|
|
(21), (22) Заявка: 2008111511/04, 25.08.2006
(24) Дата начала отсчета срока действия патента:
25.08.2006
(30) Конвенционный приоритет:
26.08.2005 JP 2005-245769
(43) Дата публикации заявки: 10.10.2009
(46) Опубликовано: 10.09.2010
(56) Список документов, цитированных в отчете о
поиске:
JP 06-071161 А, 15.03.1994. ЕР 0336501 А2, 11.10.1989. JP 2004-321952 А, 18.11.2004. JP 2004-113926 А, 15.04.2004.
(85) Дата перевода заявки PCT на национальную фазу:
26.03.2008
(86) Заявка PCT:
JP 2006/316726 20060825
(87) Публикация PCT:
WO 2007/023943 20070301
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
ИКЕГАВА Йодзиро (JP)
(73) Патентообладатель(и):
СЕНТРАЛ РИСЕРЧ ИНСТИТЬЮТ ОФ ЭЛЕКТРИК ПАУЭР ИНДАСТРИ (JP)
|
(54) СПОСОБ ПОЛУЧЕНИЯ, ЗАМЕЩЕНИЯ ИЛИ ДОБЫЧИ ГИДРАТА ГАЗА
(57) Реферат:
Изобретение относится к вариантам способа получения гидрата газа, один из которых характеризуется тем, что молекулы-гостя вводят в пустоты в слое, в котором условие температуры и давления дает возможность молекулам-гостя вызывать образование гидрата, в форме эмульсии, в которой жидкость из молекул-гостя диспергирована в воде для образования гидрата молекул-гостя в пустотах. Применение настоящего способа позволяет ускорить получение гидрата газа. 5 н. и 6 з.п. ф-лы, 19 ил., 1 табл.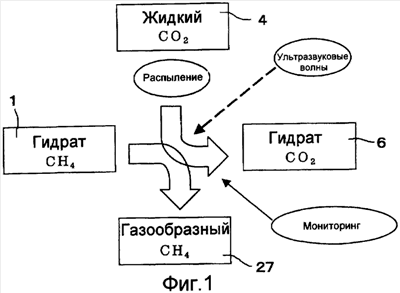
Область техники
Это изобретение относится к способам получения, замещения и добычи гидрата газа. Более конкретно, это изобретение относится к способу связывания диоксида углерода (СО2) и способу, полезному для добычи гидрата метана (CH4) посредством замещения, использующего связывание.
Уровень техники
Для того чтобы предотвратить глобальное потепление в связи с выделением огромного количества СО2, было изучено связывание СО2 в подводном слое, донном слое озер, вечной мерзлоте или тому подобном посредством гидратирования СО2. Тем временем, огромные количества гидрата CH4, лежащие под подводным слоем или тому подобным, привлекаются, как новый источник энергии, и, таким образом, добыча гидрата CH4 изучается. Далее, также изучается добыча CH4 во время связывания СО2 посредством замещения молекул CH4 в гидрате CH4 на молекулы СО2.
Например, в научно-исследовательской статье (непатентная литература 1) раскрывается замещение молекул CH4 в гидрате CH4 на молекулы СО2. В этой научно-исследовательской статье обсуждается с точки зрения термодинамики, что метан в качестве молекул-гостя в решетке гидрата замещается на диоксид углерода без разложения решетки гидрата, в состоянии смеси газообразного CH4, диоксида углерода, воды, гидрата CH4 и гидрата диоксида углерода.
Далее, был предложен способ связывания диоксида углерода, в котором диоксид углерода вводят в подземный слой гидрата CH4 для того, чтобы производить замещение метана на диоксид углерода и связывать диоксид углерода, как гидрат диоксида углерода в слое гидрата, и извлекать природный газ на поверхность земли (патентная литература 2). Поскольку условие, при котором гидрат CH4 существует стабильно, также действует, как условие, при котором гидрат диоксида углерода существует стабильно, гидрат диоксида углерода может быть получен посредством ввода газообразного или жидкого диоксида углерода в слой гидрата CH4 через проходящую нагнетательную трубу, в то время как посредством экзотермической реакции при этом получении гидрат CH4 может быть разложен. Затем газообразный метан извлекается на поверхность земли через отдельную выпускную трубу.
Между прочим, в качестве способа добычи гидрата газа был предложен выпуск струйного потока с высокой скоростью в слой гидрата газа через трубу для добычи, которая была забита в слой, имеющий слой гидрата газа, для того, чтобы разрезать и разрушать гидрат газа и извлекать его как жидкую смесь, включающую газ, на землю, в то же время заполняя пустоты в слое, которые создаются посредством извлечения гидрата газа, составом струйного потока с высокой скоростью (патентная литература 1). В качестве состава для струйного потока с высокой скоростью используется мелкозернистый материал, который включает шлам, отвердитель типа цемента и/или промышленный побочный продукт, как, например, шлак доменной печи, в пульпе, которую получают посредством замешивания воды и ила, связный грунт или тому подобное.
Патентная литература 1 – не прошедшая экспертизу публикация патента Японии 2003-214082 (JP 2003-214082 A).
Патентная литература 2 – Не прошедшая экспертизу публикация патента Японии HEI 6-71161 (JP HEI 6-71161 A).
Непатентная литература 1: Kazunari Ohgaki, Kiyomitsu Takano, Masairi Moritoki,  Utilization of CH4 hydrate and reservation of CO2 in Nankai trough Utilization of CH4 hydrate and reservation of CO2 in Nankai trough , Collection of Chemical Engineering Essay, Japan, 20 (1), 1994.01, pp.121-123. , Collection of Chemical Engineering Essay, Japan, 20 (1), 1994.01, pp.121-123.
Описание изобретения
Задачи, которые должны быть решены посредством изобретения
Способ добычи гидрата газа, раскрытый в патентной литературе 1, однако, является бесполезным для связывания СО2, потому что в способе гидрат газа просто извлекается посредством разрезания и разрушения слоя. Кроме того, большинство слоев в качестве целей для добычи гидрата газа представляет собой слой океанических отложений, где твердые фазы, как например, частицы песка, связываются друг с другом посредством присутствия гидрата CH4. Поэтому хотя пустоты, которые были созданы после добычи, заполнятся составом струйного потока с высокой скоростью, имеется опасность вызвать обрушение или оползень слоя вокруг участка, который был разрезан и разрушен посредством струйного потока с высокой скоростью, или вызвать трещины, за которыми следует хрупкость или разрушение слоя вокруг участка, который был разрезан или разрушен струйным потоком с высокой скоростью прежде, чем установится текучесть состава струйного потока с высокой скоростью, и состав будет связан. Таким образом, гидрат СН4 может выйти на поверхность и естественно раствориться, и затем может сложиться ситуация, в которой истечением газообразного СН4 на землю нельзя будет управлять. Далее, замещение гидрата газа мелкозернистым материалом, который включает шлам, отвердитель типа цемента и/или промышленный побочный продукт типа шлака доменной печи в пульпе, которая приготовляется посредством замешивания воды и ила, связного грунта или тому подобного может привести к опасности дополнительного загрязнения окружающей среды.
В соответствии со способом связывания диоксида углерода по патентной литературе 2, поскольку жидкий СО2 с концентрацией почти 100% вводится без того, чтобы смешиваться с водой, площадь поверхности раздела между жидким СО2 и водой, где происходит реакция получения гидрата, ограничена и очень мала, и таким образом имеется проблема, что реакция является медленной. Кроме того, хотя отношение воды и СО2 является важным для реакции получения гидрата СО2, едва ли возможно поддерживать отношение воды и СО2 равномерным в пустоте в слое при введении жидкой СО2 при концентрации почти 100% в слой. Поэтому очень трудно связывать большое количество СО2, как гидрат СО2, и также трудно замещать его эффективно большим количеством метана. Таким образом, способ является непрактичным, когда сразу требуется связывание большого количества СО2. Далее, поскольку слой океанических отложений, где гидрат CH4 присутствует как незатвердевший, когда большое количество жидкого СО2 вводится в него, жидкий СО2 начнет подниматься посредством плавучести в случае, когда скорость реакции является медленной, так как плотность жидкого СО2 является меньшей, чем плотность морской воды. Таким образом, имеется опасность утечки жидкого СО2 на дно океана прежде, чем будет получен гидрат СО2. Кроме того, поскольку трудно предсказать, где и как поверхность раздела между жидким СО2 и водой перемещается в пустоту в слое, становится трудно предсказать распределение повышения температуры слоя в связи с выделением тепла при получении гидрата СО2 и управлять температурой слоя так, чтобы создать эффективное разложение гидрата CH4. Таким образом, имеется проблема, состоящая в том, что управление получения гидрата газа и управление разложением гидрата газа являются трудными.
Гидрат СО2 получают при низкой температуре и высоком давлении окружающей среды, однако, гидрат СО2 может быть получен на стороне более высокой температуры и более низкого давления по сравнению с CH4, и, таким образом, именно окружающая среда, где гидрат СО2 остается стабильным, также как и гидрат CH4, может связывать гидрат СО2. Поэтому для того, чтобы довести технологию связывания СО2 посредством гидратации и технологию добычи гидрата CH4 посредством замещения гидрата CH4 на гидрат СО2 до практического использования, желательно ускорить производительность по гидрату СО2.
Задача настоящего изобретения состоит в том, чтобы обеспечить способы получения, замещения и добычи гидрата газа, которые могут ускорить получение гидрата газа.
Средства решения задач
Способ получения гидрата газа в соответствии с настоящим изобретением для достижения такой задачи отличается тем, что молекулы-гостя вводят в пустоты в слое, в котором условия температуры и давления дают возможность молекулам-гостя вызывать гидратацию, в форме эмульсии, где жидкость из молекул-гостя диспергируется, как мелкие частицы, имеющие размер, меньший, чем размер пустот в воде.
Отношение жидких мелких частиц из молекул-гостя и воды, как диспергирующей среды, которая образует эмульсию, конкретно не ограничивается определенной величиной. Хотя предпочтительно, чтобы отношение было отрегулировано до величины, подходящей для получения гидрата, возможно в некоторых случаях, чтобы отношение жидкости из молекул-гостя и воды изменялось для того, чтобы управлять величиной теплоты на единицу объема эмульсии. Далее, также является возможным, чтобы размер жидких мелких частиц из молекул-гостя в эмульсии изменялся для того, чтобы управлять получением гидрата. Эти средства управления являются полезными для предотвращения повышения температуры слоя, связанного с получением гидрата газа, от достижения температуры, когда не производится гидрат, или температуры, при которой гидрат становится нестабильным.
В настоящем изобретении эмульсия может быть введена в слой, как она есть, без получения конкретной операции. Также возможно, однако, облучать эмульсию ультразвуковыми волнами для того, чтобы активировать границы раздела молекул-гостя или чтобы облучать эмульсию ультразвуковыми волнами непрерывно для того, чтобы подавить получение гидрата. Эти средства управления используют в зависимости от обстоятельств и, таким образом, они не всегда являются необходимыми.
В качестве молекул-гостя в способе получения гидрата газа в соответствии с настоящим изобретением любые молекулы, приводящие к получению гидрата, могут быть использованы. Среди них СО2 является особенно желательным.
Способ замещения гидрата газа в соответствии с настоящим изобретением отличается тем, что в пустоты в слое, где присутствует гидрат из первых молекул-гостя, вводится эмульсия, в которой жидкость из вторых молекул-гостя диспергирована в воде, в качестве частиц, имеющих размер, меньший, чем размер пустот, в которых вторые молекулы-гостя могут образовать гидрат в условиях более высокой температурой и более низкого давления по сравнению с условием температуры и давления, в которых первые молекулы-гостя образуют гидрат; и в результате этого гидрат из первых молекул-гостя разлагается под действием тепла, которое вырабатывается, когда получается гидрат из вторых молекул-гостя.
В этом способе замещения гидрата газа, как и в случае со способом получения гидрата газа, упомянутым выше, возможно, чтобы отношение концентрации компонентов смеси жидкости из вторых молекул-гостя и воды в эмульсии изменялось для того, чтобы управлять величиной теплоты на единицу объема эмульсии. Далее, также возможно, чтобы размер мелких частиц жидкости из вторых молекул-гостя в эмульсии изменялся для того, чтобы управлять получением гидрата.
Кроме того, когда облучают эмульсию ультразвуковыми волнами на ранней стадии замещения, границы раздела между мелкими частицами из вторых частиц-гостя и водой активируются. Когда облучают эмульсию ультразвуковыми волнами, получение гидрата из вторых молекул-гостя подавляется в течение облучения.
Далее, в способе замещения гидрата газа в соответствии с настоящим изобретением прогресс разложения гидрата из первых молекул-гостя и прогресс получения гидрата из вторых молекул-гостя оцениваются посредством по меньшей мере одного или более: изменения температуры слоя, изменения скорости прохода ультразвуковых волн через слой и изменения проницаемости эмульсии в пустоты.
Кроме того, в способе замещения гидрата газа в соответствии с настоящим изобретением предпочтительно использовать CH4 в качестве первой молекулы-гостя и СО2 в качестве второй молекулы-гостя, соответственно.
Способ добычи гидрата газа в соответствии с настоящим изобретением отличается тем, что в пустоты в слое, где присутствует гидрат CH4, вводят эмульсию, в которой жидкий СО2 диспергирован в воде, как частиц, имеющих размер, меньший, чем размер пустот, в котором эмульсия используется в качестве агента для нагрева для разложения гидрата CH4, который находится в пустотах.
Далее, способ добычи гидрата газа в соответствии с настоящим изобретением отличается тем, что пустоты в слое, который покоится на слое гидрата CH4 и находится в таких условиях температуры и давления, что СО2 может образовать гидрат, эмульсия, в который жидкий СО2 диспергируется в воде, как частицы, имеющие размер, меньший, чем размер пустот, вводится для того, чтобы образовать изолирующий слой гидрата СО2; и затем эмульсия вводится в пустоты в слое гидрата CH4 так, чтобы гидрат СО2 производился во время разложения гидрата CH4, который находится в пустотах, посредством тепла реакции получения гидрата СО2, таким образом, гидрат CH4 замещается гидратом СО2 в то время, как извлекается газообразный CH4.
Альтернативно, способ добычи гидрата газа в соответствии с настоящим изобретением отличается тем, что пустоты в слое, который покоится на слое гидрата CH4 и находится в таких условиях температуры и давления, что СО2 может образовать гидрат, эмульсия, в которой жидкий СО2 диспергируется в воде, как частицы, имеющие размер, меньший, чем размер пустот, вводится для того, чтобы образовать изолирующий слой гидрата СО2; и эмульсия вводится в пустоты в слое, который покоится под слоем гидрата CH4 для того, чтобы образовывать гидрат СО2 и вызывать повышение температуры этого слоя посредством тепла реакции получения гидрата СО2, посредством повышенной температуры гидрата CH4, присутствующего в слое гидрата CH4, который покоится на этом слое, разлагается с нижней стороны; и газообразный CH4 собирается посредством изолирующего слоя для того, чтобы извлекать газообразный CH4 на землю, в то время как прочность слоя после добычи гидрата CH4 восстанавливается посредством введения эмульсии в слой так, чтобы образовать в нем гидрат CO2.
Эффект изобретения
В соответствии со способом получения гидрата газа по настоящему изобретению, поскольку жидкость из молекул-гостя, которая вводится в слой, находится в состоянии эмульсии, где жидкость из молекул-гостя диспергируется в воде, как частицы, имеющие размер, меньший, чем размер пустот в слое, подобно воде, жидкость из молекул-гостя может входить в пустоту легко без нарушения во время вытеснения воды или морской воды, заполняющей пустоту, в слой из пустоты, или может диспергироваться в воде или морской воде, и таким образом она может быть распределена равномерно в слое, в то же время поддерживая состояния эмульсии, где мелкие частицы из молекул-гостя перемешиваются с морской водой. Кроме того, поскольку жидкость из молекул-гостя готовят в состоянии эмульсии перед ее введением в слой, возможно диспергировать воду и молекулы-гостя при отношении, подходящем для получения гидрата, и, таким образом, возможно производить гидрат равномерно и эффективно.
Далее, поскольку поверхность контакта между жидкостью из молекул-гостя и водой может быть значительно увеличена посредством приготовления мелких частиц, возможно ускорить скорость реакции, и таким образом возможно ускорить получение гидрата. Кроме того, поскольку гидрат может быть получен быстро, возможно связывать большое количество молекул-гостя в слое. Кроме того, поскольку время, требуемое для получения гидрата, может быть сокращено, и гидрат может быть получен быстро, возможно подавлять перемещение и диффузию жидкости из молекул-гостя, которая вызывается потоком грунтовых вод или плавучестью жидкости.
Далее, в соответствии со способом получения гидрата газа по настоящему изобретению, возможно управлять температурой слоя до температуры, при которой гидрат газа может быть получен, когда отношение концентраций компонентов смеси жидкости из молекул-гостя и воды изменяется так, чтобы управлять величиной теплоты способностью на единицу объема эмульсии, или когда температура воды как дисперсионной среды, изменяется так, чтобы изменять температуру эмульсии саму по себе. В этом случае нет опасения, что гидрат станет нестабильным в связи с повышением температуры слоя, связанным с получением гидрата газа, и нет необходимости в подготовке любых снижающих температуру механизмов.
Далее, в соответствии со способом получения гидрата газа по настоящему изобретению, возможно управлять производительностью по гидрату, когда площадь удельной поверхности мелких частиц жидкости из молекул-гостя в эмульсии изменяется посредством изменения размера мелких частиц. Поэтому только посредством регулирования размера мелких частиц жидкости из молекул-гостя, возможно управлять производительностью по гидрату.
Далее, в способе получения гидрата газа по настоящему изобретению, также возможно ускорить скорость реакции и ускорить получение гидрата, когда поверхности раздела между мелкими частицами жидкости из частиц-гостя и воды активируются посредством облучения их ультразвуковыми волнами.
Далее, в соответствии с настоящим изобретением, поскольку получение гидрата может быть подавлено посредством непрерывного облучения эмульсии ультразвуковыми волнами, и, таким образом, приводя мелкие частицы и воду в состояние вибрации, возможно управлять синхронизацией начала получения гидрата посредством регулирования времени облучения ультразвуковыми волнами.
Кроме того, в способе получения гидрата газа по настоящему изобретению также возможно связывать большое количество СО2, которое является причиной глобального потепления, в слое, когда СО2 используется как молекулы-гостя и ее гидрат производится в пустотах слоя.
В соответствии со способом замещения гидрата газа по настоящему изобретению возможно осуществлять замещение гидрата газа без того, чтобы вызвать ослабление или разрушение слоя. Потому что только посредством введения эмульсии, где мелкие частицы вторых молекул-гостя смешиваются с морской водой, в слой, где существует гидрат первых молекул-гостя, разложение гидрата газа, в который были включены первые молекулы-гостя, может прогрессировать при быстрой скорости реакции, в то время как производится гидрат газа, в который включены вторые молекулы-гостя. Поэтому даже если подводный оползень в большом масштабе случится в связи с землетрясением или тому подобным в течение операции замещения гидрата газа, нет очень больших рисков относительно утечки газа из вторых молекул-гостя, который вводится в слой, и относительно утечки газа из первых молекул-гостя, который производится посредством разложения, в атмосферу, так же как и относительно выделения гидрата газа в атмосферу в результате поднятия гидрата газа в связи с плавучестью и затем давая ему возможность превращения в газ. Кроме того, поскольку реакционная поверхность, необходимая для ускорения химической реакции, увеличивается в результате получения вторых молекул-гостя в виде мелких частиц, и, таким образом, тепло, необходимое для разложения гидрата газа, может быть эффективно достигнутую благодаря теплу получения другого гидрата газа, возможно подавлять выработку СО2 для получения тепла.
Далее, в соответствии со способом замещения гидрата газа по настоящему изобретению, возможно управлять повышением температуры в слое для того, чтобы регулировать скорость разложения гидрата газа, который должен быть замещен, когда отношение концентрации компонентов смеси жидкости из молекул-гостя и воды в эмульсии изменяется так, чтобы управлять величиной теплоты на единицу объема эмульсии, или когда температура воды в качестве дисперсионной среды изменяется, так чтобы изменить температуру самой эмульсии.
Далее, в соответствии со способом замещения гидрата газа по настоящему изобретению возможно управлять выходом по гидрату из вторых молекул-гостя, когда площадь удельной поверхности мелких частиц жидкости из молекул-гостя в эмульсии изменяется в результате изменения размера мелких частиц.
Далее, в способе замещения гидрата газа по настоящему изобретению, также возможно ускорить скорость реакции и ускорить получение гидрата из вторых молекул-гостя, когда поверхности раздела между мелкими частицами жидкости из вторых частиц-гостя и водой активируются в результате облучения их ультразвуковыми волнами на ранней стадии замещения. Далее, поскольку получение гидрата может быть подавлено облучением эмульсии ультразвуковыми волнами непрерывно, и таким образом приводя мелкие частицы и воду в состояние вибрации, возможно управлять синхронизацией начала получения гидрата путем регулирования времени облучения ультразвуковыми волнами. В результате этих средств управления получением гидрата возможно управлять повышением температуры слоя и управлять скоростью разложения гидрата газа.
Кроме того, в способе замещения гидрата газа по настоящему изобретению, поскольку прогресс в разложении гидрата из первых молекул-гостя и прогресс в получении гидрата из вторых молекул-гостя может быть оценен на основе по меньшей мере одного или более: изменения температуры слоя, изменения в скорости прохода ультразвуковых волн через слой и изменения в проницаемости эмульсии в пустоты, возможно регулировать производительность или скорость разложения гидрата газа в соответствии с этой оценкой.
Далее, в способе замещения гидрата газа по настоящему изобретению возможно связывать на земле большие количества СО2, который является причиной глобального потепления, в форме стабильного гидрата в слое, в то же время собирая CH4 в морских отложениях, путем использования тепла реакции для получения гидрата, когда первые молекулы-гостя представляют собой CH4 и вторые молекулы-гостя представляют собой СО2.
В соответствии со способом добычи гидрата газа по настоящему изобретению возможно связывать на земле большие количества СО2, который является причиной глобального потепления, в форме стабильного гидрата в слое при высокой скорости реакции, в то же время собирая CH4 в морских отложениях, путем использования тепла реакции для получения гидрата, когда первые молекулы-гостя представляют собой CH4 и вторые молекулы-гостя представляют собой СО2. Далее, поскольку добыча гидрата CH4 прогрессирует, во время замещения гидрата CH4 на гидрат CO2, нет опасности вызывать ослабление или разрушение слоя. Кроме того, поскольку энергия для разложения гидрата CH4, причем разложение гидрата CH4 является необходимым для добычи гидрата CH4, достигается посредством использования CO2, который связывают, как отход, в слое, как вещество для нагревания, возможно придать дополнительную ценность отходу CO2 и эффективно использовать энергию.
Далее, в соответствии со способом добычи гидрата газа по настоящему изобретению, поскольку изолирующий слой гидрата CO2 образуется в слое, который покоится на слое гидрата CH4, как цели добычи способом получения гидрата газа по настоящему изобретению, твердые фазы в слое примыкают друг к другу благодаря тому факту, что пустоты в слое заполняются гидратом CO2 и становятся стабильными. Поэтому даже если подводный оползень в большом масштабе случится в связи с землетрясением или тому подобным, здесь нет очень больших рисков относительно утечки газообразного CH4, который производится посредством разложения гидрата CH4, в атмосферу, и относительно выделения гидрата CH4 в атмосферу в результате повышения плавучести гидрата CH4, причем плотность гидрата CH4 является меньшей, чем плотность морской воды, и затем давая ему возможность превращения в газ. Этот пункт является особенно полезным, поскольку слой океанических отложений, где отлагается гидрат CH4, накапливается в слое песка. Кроме того, возможно связывать CO2 как стабильный гидрат как в слое гидрата CH4, так и в изолирующем слое.
Далее, в соответствии со способом добычи гидрата газа по настоящему изобретению, поскольку изолирующий слой гидрата CO2 образуется в слое, который покоится на слое гидрата CH4, как цель добычи, и нагревающий слой гидрата CO2 образуется в слое, который покоится под слоем гидрата CH4, посредством использования способа получения гидрата газа по настоящему изобретению, возможно добывать и извлекать гидрат CH4 безопасно, не вызывая утечки газообразного метана, и также возможно связывать большое количество CO2 в виде стабильного гидрата, в трех слоях, то есть изолирующем слое, слое, который действует как источник тепла и в слое, из которого добывается гидрат CH4.
Краткое описание чертежей
Фиг.1 представляет собой схематическое изображение, которое иллюстрирует вариант осуществления способа замещения гидрата газа в соответствии с настоящим изобретением.
Фиг.2 представляет собой схему, которая иллюстрирует состояние получения гидрата CO2 и разложения гидрата CH4, когда жидкий CO2 4 вводится в пустоты при условии, что жидкий CO2 4 был разделен на мелкие частицы.
Фиг.3 представляет собой схематическое изображение, которое иллюстрирует состояние замещения гидрата CH4 на гидрат CO2.
Фиг.4 представляет собой схематическое изображение, которое иллюстрирует верхние части нагнетательной скважины.
Фиг.5 представляет собой схематическое изображение, которое иллюстрирует нижние части нагнетательной скважины.
Фиг.6 представляет собой секционное изображение подводного грунта, которое иллюстрирует состояние замещения гидрата CH4 на гидрат CO2.
Фиг.7 представляет собой карту, показывающую равновесие фаз гидрата CH4 и гидрата CO2.
Фиг.8 показывает изменения замещения гидрата CH4 на гидрат CO2 в течение времени, где (A) представляет собой карту, показывающую изменения составляющих слоя гидрата CH4, и (B) представляет собой карту, показывающую изменение температуры пустот в слое гидрата CH4, изменение в скорости ультразвуковых волн и изменение в проницаемости эмульсии.
Фиг.9 представляет собой схематическое изображение, которое иллюстрирует вариант осуществления способа получения гидрата газа в соответствии с настоящим изобретением.
Фиг.10 представляет собой схему, которая иллюстрирует состояние получения гидрата CO2 и разложения гидрата CH4, когда жидкий CO2 4 вводится в пустоты при условии, что жидкий CO2 4 не был разделен на мелкие частицы.
Фиг.11 представляет собой схематическое изображение, которое иллюстрирует вариант осуществления способа добычи гидрата газа с показом примера добычи гидрата CH4.
Фиг.12 представляет собой график, который показывает распределение по размерам частиц в слое отложений во впадине Nankai.
Фиг.13 представляет собой схематическое изображение экспериментального устройства.
Фиг.14 представляет собой микрофотографию тонко разделенного жидкого CO2 в воде.
Фиг.15 представляет собой микрофотографию для сравнения тонко разделенного жидкого CO2 в воде с песком Toyoura.
Фиг.16 представляет собой график, который показывает отношения между размером частиц и процентным содержанием прохода по весу по отношению к тонко разделенному жидкому CO2 в воде и песке Toyoura.
Фиг.17 представляет собой схематическое изображение, которое показывает позиции для измерения температуры в сосуде, работающем под давлением, для получения гидрата CO2.
Фиг.18 представляет собой график, который показывает результат эксперимента получения гидрата CO2, в котором (A) показывает изменение температуры от времени начала до времени конца эксперимента, и (B) показывает изменение температуры перед и после получения гидрата CO2 в увеличенном масштабе.
Фиг.19 представляет собой график, который показывает результат эксперимента получения гидрата CO2, как управление 1, в котором гидрат газа производится из жидкого CO2.
Описание позиций
1. Гидрат CH4 (гидрат из первых молекул-гостя).
2. Слой, где образуется гидрат CH4.
3. Пустота.
4. Жидкий CO2 (жидкость из вторых молекул-гостя).
5. Эмульсия вода – CO2.
6. Гидрат CO2 (гидрат из вторых молекул-гостя).
23 Мелкие частицы жидкого CO2 (мелкие частицы жидкости из вторых молекул-гостя).
Лучший способ выполнения изобретения
В дальнейшем, строение по настоящему изобретению будет описано подробно со ссылкой на лучшие способы, иллюстрированные на чертежах.
На фиг.1-6 иллюстрирован вариант осуществления способа замещения гидрата в слое, который использует способ получения гидрата газа в соответствии с настоящим изобретением. В описании этого варианта осуществления способ получения гидрата газа также будет объяснен. Способ замещения гидрата газа в соответствии с настоящим изобретением представляет собой способ, в котором получение гидрата газа искусственно стимулируется в слое, что приводит слой в состояние повышенной температуры, и посредством этого гидрат природного газа, который был получен в слое, разлагается, таким образом молекулы-гостя замещаются; и в котором в пустотах 3 в слое 2, где существует гидрат 1 из первых молекул-гостя, жидкость 4 из вторых молекул-гостя вводится в форме эмульсии 5, в которой жидкость 4 из вторых молекул-гостя диспергируется, как частицы, имеющие размер, меньший, чем размер пустот 3, в дисперсионной среде 24, в котором вторые молекулы-гостя могут образовать гидрат в условиях более высокой температуры и более низкого давления по сравнению с условием температуры и давления, при котором первые молекулы-гостя образуют гидрат, в результате чего гидрат 1 из первых молекул-гостя разлагается под действием тепла реакции, которое вырабатывается, когда производится гидрат 6 из вторых молекул-гостя. Позиция 25 на фиг.2 обозначает частицы песка в слое 2. Слой 2 может быть, например, подводным слоем, и в качестве дисперсионной среды 24 эмульсии используется вода или морская вода, которая может образовать кристалл для захвата молекулы-гостя. Здесь, пустоты в слое представляют собой пространства между твердыми фазами (частицы песка, гидрат CO2, гидрат CH4), и по существу обозначают участки, которые заняты жидкой фазой (жидкий CO2, вода, морская вода) и газовой фазой (газообразный метан). То есть жидкость из молекул-гостя бьет струей, как эмульсия, там где жидкость из молекул-гостя диспергируется, как частицы, имеющие размер менее, чем размер пространств между твердыми фазами в слое, где образуется гидрат газа.
Первые молекулы-гостя в способе замещения гидрата газа в соответствии с этим вариантом осуществления могут быть, например, CH4, и гидрат 1 из первых молекул-гостя может быть гидратом CH4. Далее, вторые молекулы-гостя могут быть, например, CO2, гидрат 6 из вторых молекул-гостя может быть гидратом CO2, и жидкость 4 из вторых молекул-гостя может быть жидким CO2.
Фиг.7 представляет собой карту, показывающую фазовое равновесие гидрата CH4 и гидрата CO2. Участок под кривой А представляет собой участок стабильного гидрата CO2 6, участок под кривой B представляет собой участок стабильного гидрата CH4 1, участок налево от кривой C представляет собой участок, где H2O становится твердой, и участок направо от кривой C представляет собой участок, где Н2О становится жидкостью. Как ясно из фиг.7, принимая, что давления являются теми же самыми, температура, при которой гидрат CO2 6 является стабильным, является более высокой, чем температура, при которой гидрат CH4 1 является стабильным. Далее, принимая, что температуры являются теми же самыми, давление, при котором гидрат CO2 6 является стабильным, является более низким, чем давление, при котором гидрат CH4 1 является стабильным. То есть температура и давление, при которых гидрат CO2 6 является стабильным, представляют собой более высокую температуру и более низкое давление по сравнению с температурой и давлением, при которых гидрат CH4 1 является стабильным. Участок, окруженный кривыми A, B и C, представляет собой участок, в котором условия температуры и давления дают возможность вызывать как получение гидрата CO2 6, так и разложение гидрата CH4 1 одновременно. Таким образом, в результате использования этого участка осуществляется замещение гидратом CO2 6 гидрата CH4 1. В результате замещения гидратом CO2 6 гидрата CH4 1 становится возможной добыча CH4, в то же время связывая CO2.
В подводном грунте места, где накапливается гидрат CH4, представляют собой слой песка, и таким образом, цель для добычи гидрата CH4 устанавливается в таких местах накопления. В недавних исследованиях было обнаружено, что гидрат CH4 находится в пространствах, которые образуют трехмерную сетевую структуру, занимающую приблизительно 50% слоя песка, и гидрат CH4 составляет максимально 60% пространства. Таким образом, следующее будет объяснено относительно случая, когда подводный слой 2 представляет собой целевой слой для добычи гидрата CH4 и для связывания гидрата CO2. Нижний конец нагнетательной скважины 7 и нижний конец эксплуатационной скважины 8 достигает слоя 2, где производится гидрат CH4. В море создается платформа 9 и нагнетательная скважина 7 и эксплуатационная скважина 8 продлеваются вниз от платформы 9 до дна моря. Верхний конец эксплуатационной скважины 8 соединяется с насосом, который не показан на этой фигуре, и, таким образом, он может нагнетать газообразный CH4 вместе с морской водой 24, которая наполняет пространства в слое 2. Газообразный CH4, нагнетаемый посредством эксплуатационной скважины 8, может быть использован, например, для выработки электрической энергии на тепловой электростанции 26 после отделения его от морской воды 24.
Как показано на фиг.4, нагнетательная скважина 7 составлена, как труба в трубе, где внутренняя труба 11 помещена внутрь наружной трубы 10. Верхний конец внутренней трубы 11 соединяется с резервуаром 12 жидкого СО2, и проход, через который течет жидкий СО2 4, образован во внутренней трубе 11. Жидкий СО2 4, запасаемый в резервуаре 12 жидкий СО2, получают путем сбора СО2, выделяемого на тепловой электростанции 26, сталелитейном заводе или цементном заводе, или тому подобном и сжижения собранного СО2. Далее, как показано на фиг.5, на конце внутренней трубы 11 предусматриваются распылительные сопла 13, через которые жидкий СО2 распыляется в виде мелких частиц 23, которые меньше, чем пустоты 3 в слое 2 в проходе, который окружается наружной трубой 10. В результате получения потоков с высокой скоростью в соплах 13, и таким образом, создания эффектов сдвига и соударения, жидкий СО2 может быть разделен на мелкие частицы. Хотя способ распыления жидкости за счет использования сопла, по существу, является вообще известной технологией, которая также применяется в распылителях, однако, когда перепад давления между передней и задней частью сопла 13 устанавливается в 1 МПа – несколько десятков МПа так, чтобы расход жидкого СО2 4 в сопле 13 достигал приблизительно скорости звука, возможно приготовить мелкие частицы 23 жидкого СО2 4, распыляемого из сопла 13, с размерами порядка менее мкм. Здесь, поскольку необходимо, чтобы средний размер мелких частиц 23 жидкого СО2 при распылении должен быть меньше, чем пустоты в слое, где производится гидрат газа, то есть предпочтительно, чтобы пустоты между твердыми фазами, например, были от приблизительно нескольких мкм до приблизительно 30 мкм. При удовлетворении этого условия считается, что мелкие частицы становятся меньшими, чем пустоты в слое, где производится гидрат газа. Кстати, в положении вблизи резервуара 12 жидкого СО2, внутренняя труба 11 снабжается манометром 15 для измерения давления жидкого СО2 4.
Верхний конец наружной трубы 10 соединяется с выходом насоса 14, который нагнетает морскую воду 24 из океана 31 и выпускает ее, и проходом, через который потоки морской воды 24 образуются в пространстве между наружной трубой 10 и внутренней трубой 11. Когда мелкие частицы 23 жидкого СО2 4 распыляются в поток морской воды 24, который проходит через пространство между наружной трубой 10 и внутренней трубой 11, возможно приготовить эмульсию 5 СО2 – вода, где жидкий СО2 4 диспергируется в виде мелких частиц, имеющих размер, меньший, чем пустоты 3, в морской воде 24 как раз перед тем, как эмульсия впрыскивается в слой 2. Нагнетание морской воды 24 из океана 31 может осуществляться с любых глубин до достижения морского дна посредством регулирования длины всасывающей трубы 14a. Наружная труба 10 может быть, например, буровой штангой, и она имеет много инжекционных отверстий 10a для равномерного введения приготовленной эмульсии 5 СО2 – вода в слой 2 на периферической поверхности. Инжекционное отверстие 10a размещено перед концом внутренней трубы 11, где предусмотрены распылительные сопла 13.
В результате в нагнетательной скважине 7 весовое отношение воды и СО2 в эмульсии может быть отрегулировано до предпочтительной величины в соответствии с целью получения гидрата, перед тем, как эмульсия вводится в слой 2. Например, отношение концентраций компонентов смеси воды и СО2 может быть отрегулировано в соответствии с целью получения гидрата, например, цель состоит в том, чтобы связывать молекулы-гостя стабильно, посредством получения гидрата в целевом слое 2, цель состоит в том, чтобы замещать подаваемые молекулы-гостя на другие молекулы-гостя гидрата газа, который существует в слое, цель состоит в том, чтобы использовать тепло реакции, полученное от получения гидрата, как источник тепла для добычи природных ресурсов, которые существуют в форме гидрата в слое, и так далее. Например, так как в этом варианте осуществления, в случае когда СО2 связывается в форме гидрата в слое 2, где был накоплен гидрат СН4, а гидрат СН4 разлагается на воду и СН4, для того, чтобы собрать их, гидрат СН4 добывается посредством замещения гидратом СО2 гидрата СН4 в слое, предпочтительно регулировать весовое отношение воды и СО2 до значения, подходящего для получения и стабильности гидрата СО2. Далее, когда регулируется температура морской воды или воды, используемой как дисперсионная среда в эмульсии 5, или температура жидкой СО2, возможно вводить эмульсию при заданном условии температуры, которое является выгодным, чтобы производить гидрат и поддерживать его стабильность при условии температуры слоя, где предназначается получение гидрата газа, и при условии подъема температуры слоя. Например, при изменении глубины сбора морской воды 24, возможно легко получить воду или морскую воду при желаемой температуре.
Эмульсия 5, распыляемая из нагнетательной скважины 7, входит в пустоты 3 слоя 2 гидрата СН4, в то же время вытесняя морскую воду, которой были заполнены пустоты, и таким образом, жидкий СО2 и морская вода 24 могут достичь любой части пустот 3 в равномерном соотношении. В пустотах гидрат СН4 существует стабильно. Таким образом, условие температуры и давления в пустотах 3 также является условием температуры и давления, где гидрат СО2 может существовать стабильно. Поэтому гидрат СО2 6 производится из эмульсии 5, вошедшей в пустоты.
Получение гидрата представляет собой экзотермическую реакцию, в то время как разложение гидрата представляет собой эндотермическую реакцию. Благодаря теплу, испускаемому, когда производится гидрат СО2 6, температура слоя 2, включая окружающие твердые фазы и жидкие фазы, поднимается, и гидрат СН4 разлагается. Например, принимая, что температура поднимается вверх от точки Р1 до точки P2 на фиг.7, хотя пустоты 3 принадлежат к участку стабильности СО2 на фиг.7, пустоты 3 отклоняются от участка стабильности СН4. Поэтому гидрат СН4 в пустотах 3 разлагается, тогда как гидрат СО2 6 существует стабильно. Таким образом, что касается возможности присутствия гидрата в пустотах 3, гидрат СН4 замещается на гидрат СО2. Кстати, что касается замещения в пустотах 3, хотя основной феномен его заключается в том, что гидрат СН4 1 разлагается, сопровождая прогресс получения гидрата СО2, феномен, где СН4, который представляет собой молекулы-гостя гидрата СН4 1, замещается на СО2, не вызывая разложения гидрата СН4 1, также имеет место на этом участке.
Поскольку тепло, выделяемое во время получения гидрата СО2 6, поглощается при разложении гидрата СН4 1, температура пустот 3, посредством увеличения температуры в слое 2, не повышается сверх температуры, при которой гидрат СО2 может быть получен и может существовать стабильно. Таким образом, полученный гидрат СО2 6 существует стабильно.
В результате разложения гидрата СН4 1 получается газообразный СН4 27. Газообразный СН4 27 образует пузырьки, и они всплывают в морской воде 24, которая протекает в пустоты 3. Далее, часть газообразного СН4 27 растворяется в грунтовой воде 24. С другой стороны, поскольку эмульсия 5 выпускается из нагнетательной скважины 7, и грунтовая вода 24 нагнетается посредством эксплуатационной скважины 8, поток грунтовой воды 24 из нагнетательной скважины 7 в эксплуатационную скважину 8 образуется в пустотах 3. Таким образом, как пузырьки выработанного газообразного СН4 27, так и газообразный СН4 27, растворенный в морской воде 24, собираются вместе с морской водой 24 посредством эксплуатационной скважины 8.
Как упомянуто выше, когда гидрат производится посредством введения СО2 в подводный слой, и гидрат СН4 1 в подводном слое, который является эффективным ресурсом, разлагается в связи с подъемом температуры в слое 2 в результате тепла реакции, выделяемого при образовании гидрата СО2 6, и в результате чего гидрат СН4 1 замещается гидратом СО2; возможен прогресс в связывании СО2 и добычи гидрата СН4 1 так же, как и извлечение и стабилизация прочности слоя, одновременно. Далее, также возможно использовать молекулы-гостя просто как вещество для нагревания, как например, СО2 в этом варианте осуществления, который должен быть связан путем образования гидрата.
Поскольку жидкий СО2 в эмульсии 5 подается в форме мелких частиц 23, которые являются меньшими, чем пустоты 3 в слое 2, жидкий СО2 может входить в пустоты 3 в слое 2 легко и без препятствий для его движения, подобно воде, и, таким образом, он может быть диспергирован внутри пустот с равномерным распределением. Поэтому возможно диспергировать жидкий СО2 равномерно по более широкому участку пустот 3 в слое 2, при отношении вода – СО2, которое является подходящим или почти подходящим для образования гидрата, и, таким образом, возможно получать гидрат СО2 равномерно по широкому участку.
Далее, поскольку жидкий СО2 4 подается в форме мелких частиц, поверхность контакта между жидким СО2 4 и морской водой 24 становится большой. Например, принимая, что частица жидкого СО2 представляет собой сферу, когда ее радиус становится равным одной десятой, число частиц на единицу объема, площадь поверхности каждой отдельной частицы 23 и суммарная площадь поверхности на единицу объема становится в 1000 раз, одну сотую и десять раз, соответственно. Например, принимая, что площадь поверхности мелких частиц 23, когда их радиус составляет 1 мм, является критерием, когда диаметр мелких частиц 23 установлен в 0,01 мм или 0,001 мм, общая площадь поверхности на единицу объема становится 100 раз или 1000 раз соответственно. Как описано выше, поскольку возможно повысить поверхность контакта между жидким СО2 4 и морской водой 24, становится возможным ускорить скорость реакции так, чтобы гидрат СО2 образовывался быстро.
С целью ссылки, на фиг.10 показано состояние, когда жидкий СО2 4 вводится в пустоты 3 в слое 2 при условии, что жидкий СО2 не разделяется на мелкие частицы и он находится в этом цельном состоянии при почти 100% концентрации. В этом случае, поскольку жидкий СО2 входит в пустоты, в то время как жидкий СО2 вытесняет морскую воду 24, заполняющую пустоты, наружу из пустот, жидкий СО2 входит в контакт с морской водой 24 только на границе между жидким СО2 и морской водой 24, и только один из жидкого СО2 и морской воды 24 существует внутри границы. Поэтому едва ли возможно распределить воду и жидкий СО2 равномерно при отношении, которое является подходящим для получения гидрата в пустотах 3.
Далее, в соответствии с настоящим изобретением, поскольку возможно ускорить производительность по гидрату газа, настоящее изобретение полезно не только для замещения одного гидрата на другой и добычи ресурсов гидрата, но также для связывания и хранения молекул-гостя в форме гидрата в слое. Например, настоящее изобретение является подходящим для технологии связывания СО2, который выделяется в большом количестве.
Далее, в настоящем изобретении, поскольку жидкий СО2 подается в форме мелких частиц, которые являются меньшими, чем пустоты в слое 2 заранее, и таким образом он подается в форме эмульсии, становится возможно управлять величиной теплоты на единицу объема эмульсии 5, посредством отношения концентраций компонентов смеси жидкого СО2 4 и воды 24 в эмульсии, которая вводится в пустоты 3 слоя 2 гидрата СН4 из нагнетательной скважины 7. Например, посредством регулирования расхода жидкого СО2 4 и расхода морской воды 24 в нагнетательной скважине 7, отношение концентраций компонентов смеси жидкого СО2 4 и воды 24 может быть изменено, и, таким образом, становится возможным управлять величиной теплоты на единицу объема эмульсии 5.
Отношение числа молекул-гостя и числа молекул воды для образования гидрата зависит от вида молекулы-гостя. Когда отношение концентраций компонентов смеси жидкого СО2 4 и воды 24 в эмульсии 5 приближается к отношению числа молекул СО2 и числа молекул воды для образования гидрата СО2, величина образования гидрата на единицу количества эмульсии 5 увеличивается, и величина теплоты также увеличивается. Наоборот, когда отношение концентраций компонентов смеси жидкого СО2 4 и воды 24 в эмульсии 5 далеко от отношения числа молекул СО2 и числа молекул воды для образования гидрата СО2, величина образования гидрата на единицу количества эмульсии 5 уменьшается, и величина теплоты также уменьшается. Поэтому посредством изменения отношения концентраций компонентов смеси жидкого СО2 4 и воды 24 в эмульсии 5, величиной теплоты на единицу объема эмульсии 5 при получении гидрата СО2 можно управлять. Далее, посредством управления величиной теплоты на единицу объема эмульсии 5 при получении гидрата СО2, повышение температуры слоя 2 может регулироваться. Вследствие регулирования температуры слоя 2, становится возможно сохранить температуру слоя 2 при температуре, при которой возможно создание гидрата газа, или регулировать скорость разложения гидрата, который замещается или добывается, как например, гидрат СН4 1. Конечно, в случаях замещения гидрата СН4 на гидрат СО2 в получении и добыче гидрата СН4 путем образования гидрата СО2, поскольку величина теплоты и эндотермическая величина теплоты обоих гидратов может уравновешивать друг друга, регулирования температуры не требуется.
Далее, по настоящему изобретению производительность по гидрату СО2 управляется путем изменения размера мелких частиц 23 жидкого СО2 4 в эмульсии 5, которая должна быть введена в пустоты 3 слоя 2 гидрата СН4 из нагнетательной скважины 7. Например, в результате замены распылительного сопла 13 нагнетательной скважины 3 на другое размер мелких частиц 23 жидкого СО2 в эмульсии 5 может быть изменен, и, таким образом, производительность по гидрату СО2 можно регулировать.
Когда размер мелких частиц 23 жидкого СО2 в эмульсии 5 становится меньшим, площадь поверхности жидкого СО2 на единицу объема жидкого СО2, другими словами, поверхность контакта между жидким СО2 и морской водой 24 увеличивается, и таким образом производительность по гидрату СО2 увеличивается. Наоборот, когда размер мелких частиц 23 жидкого СО2 в эмульсии 5 становится крупным, поверхность контакта между жидким СО2 и морской водой 24 уменьшается, и, таким образом, производительность по гидрату СО2 уменьшается. Таким образом, посредством изменения размера мелких частиц 23 жидкого СО2, производительность по гидрату СО2 можно регулировать.
Кроме того, согласно изобретению в результате облучения эмульсии 5 ультразвуковыми волнами на ранней стадии замещения гидрата, поверхности раздела между мелкими частицами жидкости из вторых частиц-гостя и воды активируются, и, таким образом, СО2, в качестве молекул-гостя, может быть приведен в состояние, при котором легко образуется гидрат. Что касается этого пункта, если непрерывно подвергать облучению ультразвуковыми волнами мелкие частицы жидкого СО2 вибрируют и, таким образом, они не могут образовать гидрат. Как только облучение останавливается, начинается образовываться гидрат. Таким образом, в результате управления временем облучения ультразвуковыми волнами можно управлять синхронизацией начала образования гидрата СО2. Например, хотя это не показано на чертежах, возможно включить два вида устройств 55, 56 для выработки ультразвуковых волн в конец внутренней трубы 11, в которых первые устройства 55 для выработки ультразвуковых волн используются для активирования границ раздела между СО2 и водой в эмульсии СО2 – вода, существующей в наружной трубе 10, и, таким образом, ускоряют образование гидрата, в то время как второе устройство 56 для выработки ультразвуковых волн используется для создания ультразвуковых волн непрерывно по направлению к слою 2 для непрерывной вибрации слоя 2 и подавления образования гидрата СО2. Кстати, как средство для облучения мелких частиц 23 жидкого СО2 ультразвуковыми волнами, например, также возможно использовать ультразвуковое вырабатывающее и принимающее устройство 16, которое устроено в слое 2 гидрата СН4 для измерения скорости ультразвуковых волн.
Также, в соответствии с настоящим изобретением, поскольку жидкий СО2 в качестве молекул-гостя может быть в форме эмульсии, где жидкий СО2 диспергирован в воде при равномерном отношении, необходимом для образования гидрата, для того, чтобы вводить ее в слой, жидкий СО2 и морская вода 24 могут быть распределены по всем пустотам 3, и поэтому прогресс в разложении гидрата СН4 1, и прогресс в образовании гидрата СО2 6 могут быть оценены на основе изменения температуры слоя 2, изменения скорости прохода ультразвуковых волн через слой и изменения проницаемости эмульсии 5 в пустоты 3.
Температура слоя 2, где производится гидрат СН4, изменяется благодаря экзотермическому теплу получения гидрата СО2 6 и эндотермическому теплу разложения гидрата СН4 1. Скорость прохода ультразвуковых волн через слой 2 изменяется в зависимости от вида, количества, фазы (газовая фаза, жидкая фаза или твердая фаза) и т.д., вещества, существующего в пустотах 3. Проницаемость эмульсии 5 в пустоты 3 в слое 2 также изменяется в зависимости от вида, количества, фазы (газовая фаза, жидкая фаза или твердая фаза) и т.д., вещества, присутствующего в пустотах 3. Таким образом, состояние замещения гидратом СО2 6 гидрата СН4 1 может быть оценено мониторингом изменения температуры в пустотах 3, изменения в скорости прохода ультразвуковых волн через пустоты 3 и изменения в проницаемости эмульсии 5 в пустоты 3.
Изменения в замещении гидрата СН4 1 на гидрат СО2 6 в течение времени показано на фиг.8. Фиг.8(A) показывает изменения в составляющих слоя 2 гидрата СН4, и линия T, линия U и линия E на фиг.8(B) показывают изменения температуры в слое гидрата, изменения в скорости ультразвуковых волн и изменения в проницаемости эмульсии 5 соответственно. Как показано на фиг.8(A), слой 2 на начальной стадии замещения содержит, например, слой 17 песка и ила и пустоты 3, и гидрат СН4 1 и морская вода 24 существуют в пустотах 3.
Когда эмульсия 5 вводится в пустоты 3 и, таким образом, подается жидкий СО2 4, гидрат СО2 6 начинает расти, и температура слоя, то есть температура твердой фазы и жидкой фазы начинает повышаться вместе с образованием гидрата, в результате чего гидрат СН4 1 начинает разлагаться. Газообразный СН4 27, образованный в результате разложения гидрата СН4 1, образует пузырьки, и часть газообразного СН4 27 растворяется в морской воде, которая протекает через пустоты 3, а именно, грунтовой воде 24. Пузырьки газообразного СН4 27 и газообразный СН4 27, растворенный в грунтовой воде 24, собираются вместе с грунтовой водой 24 посредством эксплуатационной скважины 8.
Как показано на фиг.8(B), температура слоя повышается в результате образования гидрата СО2. Когда повышение температуры достигает определенного уровня, начинается разложение гидрата СН4, которое представляет собой эндотермическую реакцию. Таким образом, считается, что температура в конце замещения возвращается обратно на уровень начальной стадии замещения, потому что эндотермическое тепло, благодаря разложению гидрата СН4, и экзотермическое тепло, благодаря образованию гидрата СО2, уравновешивают друг друга, и изменение температуры становится небольшим. Поэтому температура слоя отражает начало и конец образования гидрата, так же как и начало и конец разложения.
Считается, что проницаемость эмульсии 5 увеличивается или уменьшается пропорционально ширине частей, отличных от гидрата СН4 1 и гидрата СО2 6 в пустотах 3. Когда пузырьки выработанного газообразного СН4 становятся больше и они улавливаются в пустотах 3, это становится препятствием для проницаемости эмульсии. Таким образом, считается, что проницаемость эмульсии 5 будет понижена посредством степени этого препятствия. Таким образом, считается, что когда гидрат СН4 1 начинает разлагаться, проницаемость имеет тенденцию уменьшаться, и когда гидрат СН4 1 исчезает в результате завершения его разложения, проницаемость имеет тенденцию улучшаться. Поэтому проницаемость эмульсии 5 отражает состояние образования гидрата так же, как и состояние разложения гидрата.
Ультразвуковые волны имеют тенденцию сильно отражаться на границе раздела между твердым веществом и газом, когда акустическое сопротивление становится большим. С другой стороны, по отношению к слою 17 песка и ила рассматривается, что отражение, проникновение и рефракция ультразвуковых волн будут усложнены. Поскольку скорость ультразвуковых волн, распространяемых через твердое вещество, является более быстрой, чем через жидкость, скорость ультразвуковых волн изменяется в соответствии с условиями в пустотах 3. Далее, чем больше твердых гидрата СН4 и гидрата СО2 существует в пустотах 3, тем быстрее становится скорость ультразвуковых волн, в то время как чем больше газа существует в пустотах 3, тем с большей вероятностью отражаются ультразвуковые волны. Поэтому когда начинается образование гидрата СО2 6, скорость ультразвуковых волн увеличивается постепенно. Когда начинается разложение гидрата СН4 1, скорость ультразвуковых волн постепенно уменьшается. Далее, когда гидрат СН4 1 исчезает в результате завершения его разложения и, таким образом, объем газообразного СН4 27 уменьшается, скорость ультразвуковых волн снова постепенно увеличивается. Поэтому скорость ультразвуковых волн отражает состояние образования гидрата так же, как и состояние разложения гидрата.
Как упомянуто выше, поскольку температура слоя 2, скорость ультразвуковых волн, распространяемых через слой 2, и проницаемость эмульсии 5 в пустоты отражает условие в пустоте 3, возможно предполагать состояние замещения гидратом СО2 6 гидрата СН4 1 в пустотах 3 путем мониторинга таких параметров.
Измерение температуры слоя 2 может быть осуществлено, например, датчиком 18 температуры, который помещен в слой 2, где образуется гидрат СН4. Измерение ультразвуковых волн может быть осуществлено, например, ультразвуковым генератором и ультразвуковым приемником, которые помещены в слой 2, где образуется гидрат СН4. В этом варианте осуществления используется ультразвуковое вырабатывающее и принимающее устройство 16, где ультразвуковой генератор составляет единое целое с ультразвуковым приемником. А именно, ультразвуковое вырабатывающее и принимающее устройство 16, которое используется для активирования молекул СО2 и подавления получения гидрата СО2 6, также используется для измерения. Скорость ультразвуковых волн, распространяемых через пустоты 3, может быть определена посредством приема в принимающей части ультразвукового вырабатывающего и принимающего устройства 16 ультразвуковых волн для мониторинга, которые вырабатываются вырабатывающей частью устройства 16. Далее, измерение проницаемости эмульсии 5 в пустоты 3 может быть осуществлено, например, манометром 15, который предусмотрен на трубопроводе подачи жидкой СО2 нагнетательной скважины 7. В результате измерения изменения в давлении жидкой СО2 4, проходящей через нагнетательную скважину 7, проницаемость эмульсии 5 может быть определена.
Два или более датчиков 18 температуры и два или более ультразвуковых вырабатывающих и принимающих устройств 16 помещены вдоль измерительного трубопровода 28. Датчики 18 температуры и ультразвуковые вырабатывающие и принимающие устройства 16 соединяются с кабелями 19, и они подвешены на соединительных устройствах 20 управления, которые помещены на дне моря в отверстиях 21. В слое 2, в котором производится гидрат СН4, датчики 18 температуры и ультразвуковые вырабатывающие и принимающие устройства 16 поочередно располагаются, и в изолирующем слое 22, размещенном на слое 2, предусматриваются датчики 18 температуры. Отдельные соединительные устройства 20 управления соединяются с компьютером, который размещен на море, посредством соединительных и силовых кабелей 30. Кстати, на фиг.3, иллюстрация датчиков 18 температуры и ультразвуковых вырабатывающих и принимающих устройств 16 опущена.
В случае добычи гидрата газа, предпочтительно образовать на слое гидрата газа, как цели добычи, изолирующий слой из гидрата газа, который является стабильным даже при высокой температуре и низком давлении по сравнению с гидратом газа, который должен добываться, перед добычей. Например, в случае добычи гидрата СН4 в этом варианте осуществления замещение гидрата производится после того, как изолирующий слой 22 гидрата СО2 образовался на слое 2, где производится гидрат СН4. Поскольку СО2 может присутствовать стабильно в форме гидрата даже в условии более высокой температуры и более низкого давления по сравнению с СН4, СО2 является предпочтительным в качестве изолирующего слоя 22 для образования на слое 2, где образуется гидрат СН4. Во-первых, под действием нагнетательной скважины 29, которая проходит в слой, размещенный на слое 2, где образуется гидрат СН4, и в котором условия температуры и давления делают возможным образование гидрата, и введения эмульсии 5 СО2 – вода через скважину 29 для вливания в пустоты 3 между твердыми частицами в слое, в котором эмульсия 5 СО2 – вода находится в таких условиях, что жидкий СО2 диспергируется в морской воде в форме мелких частиц, меньших, чем пустоты 3, образуется изолирующий слой 22. После этого, в результате введения вышеупомянутой эмульсии 5 СО2 – вода в пустоты 3 между твердыми частицами в слое 2, где образуется гидрат СН4, в нем образуется гидрат СО2, в то время как гидрат СН4, существующий в пустотах 3, разлагается под действием тепла реакции образования гидрата СО2. Газообразный СН4 27, полученный в результате разложения гидрата СН4, улавливается посредством изолирующего слоя 22 так, чтобы его можно было собрать через эксплуатационную скважину 8 без утечки в море или в атмосферу. Таким образом, гидрат СН4, внедренный в слой, может быть извлечен как газообразный СН4, в то время как он замещается гидратом СО2.
Кстати, в случае, когда изолирующий слой 22 образуется посредством получения гидрата газа, но образуется в слое, где гидрат природного газа не внедрен, в зависимости от обстоятельств, может быть необходимо регулировать температуру так, чтобы достичь температуры, которая дает возможность образования гидрата газа, который образует изолирующий слой 22, например, в результате регулирования температуры эмульсии 5 или регулирования среднего диаметра мелких частиц жидкости из молекул-гостя, потому что эндотермическое тепло в связи с разложением гидрата газа не может ожидаться. Например, в случае, когда молекулы-гостя представляют собой СО2, в зависимости от обстоятельств может быть необходимо принять такое приспособление, чтобы объем морской воды, которая должна быть смешана с мелкими частицами 23 жидкого СО2 в эмульсии СО2 – вода повышался, или чтобы температура морской воды, которая должна быть смешана, устанавливалась на более низкой температуре. Отдельно, также возможно подавить величину теплоты на единицу объема эмульсии 5 посредством изменения отношения концентраций компонентов смеси жидкого СО2 и воды в эмульсии. Далее, также возможно регулировать производительность по гидрату СО2 посредством изменения размера мелких частиц жидкой СО2 в эмульсии 5. Кроме того, также возможно активировать молекулы СО2 посредством облучения эмульсии 5 ультразвуковыми волнами. Альтернативно, также возможно подавить образование гидрата в продолжение облучения путем облучения эмульсии 5 ультразвуковыми волнами.
Затем вариант осуществления другого способа добычи гидрата газа показан на фиг.11. В этом способе добычи гидрата газа, во-первых, куполообразный изолирующий слой 22 гидрата СО2 образуется на слое 32 гидрата СН4 как цели добычи, и слой 33 гидрата СО2, который стремится связывать гидрат СО2, образуется в слое, который покоится под слоем 32 гидрата СН4, и затем температура этого слоя 33, в который вводится эмульсия СО2, повышается посредством тепла реакции при образовании гидрата СО2, и гидрат СН4, существующий в слое 32 гидрата СН4, который покоится на слое 33, разлагается на воду и газообразный СН4 с нижней стороны под действием повышенной температуры. Газообразный СН4 27, выработанный в результате разложения слоя 32 гидрата СН4, собирается посредством куполообразного изолирующего слоя 22 временно, и затем он извлекается через эксплуатационную скважину 8 на землю. Кроме того, в слой после добычи гидрата СН4 вводится эмульсия СО2 – вода посредством операции перемещения нагнетательной скважины 7 вверх или обеспечения другой нагнетательной скважины, которая проникает в слой 32 гидрата СН4 для того, чтобы получать в нем гидрат СО2. Посредством этого, твердые фазы, как например, частицы песка, которые были принесены во взаимно неуплотненном состоянии, могут быть уплотнены посредством гидрата СО2, и таким образом прочность слоя может быть восстановлена. Поэтому возможно связывать большое количество СО2 в форме стабильного гидрата, как три слоя 22, 32 и 33, в подводном слое. Кстати, поскольку участок поверх слоя 32 гидрата СН4 стабилизируется в результате образования гидрата СО2, который образует изолирующий слой 22 и в результате которого твердые фазы в этом слое уплотняются перед добычей гидрата СН4, даже если подводный оползень в большом масштабе случится в связи с землетрясением или тому подобным, здесь нет очень больших рисков относительно утечки газообразного СН4, полученного посредством разложения гидрата СН4, в атмосферу, или относительно выделения гидрата CH4, который имеет более низкую плотность, чем морская вода, в атмосферу в результате подъема гидрата СН4 в связи с плавучестью и затем давая ему возможность превращаться в газ.
Хотя вышеупомянутые варианты осуществления представляют собой предпочтительные варианты осуществления настоящего изобретения, многие и разнообразные изменения или модификации могут быть сделаны, если они не отклоняются от сущности и диапазона настоящего изобретения. Хотя настоящее изобретение описано на основе примеров связывания СО2 в результате гидратации, замещение гидратом СО2 гидрата СН4 и добычи гидрата СН4 в вышеупомянутых вариантах осуществления, молекулы-гостя, которые являются целью, не ограничиваются этим. Необходимо ясно понять, что настоящее изобретение может быть применено ко всем молекулам-гостя, которые могут образовать гидрат газа. Что касается замещения гидрата, оно может также быть применено к любым сочетаниям двух молекул-гостя, которые отличаются друг от друга, что касается условий температуры и давления для стабильного существования в их формах гидрата. Например, поскольку молекулы-гостя гидрата природного газа, метана (СН4), этана (С2Н6), пропана (СН3СН2СН3), диоксида углерода (СО2), сероводорода (H2S), воздуха (азот N2), являются известными, будет ясно понято, что способы в соответствии с настоящим изобретением могут быть применены к получению, замещению и добыче гидрата газа этих молекул-гостя.
Далее, хотя в вышеупомянутом варианте осуществления способы получения, замещения и добычи гидрата газа в подводном слое, который содержит в основном слой песка, описываются, как само собой разумеющееся, настоящее изобретение может быть применено к слою, как например, к слою гидрата СН4 под дном озера, слою гидрата СН4 в вечной мерзлоте и т.д. Далее, поскольку в настоящем изобретении молекулы-гостя вводятся в форме эмульсии 5, которая включает воду, необходимую для получения гидрата, в пустоты слоя возможно осуществлять связывание, замещение и добычу благодаря образованию гидрата из молекул-гостя, который является целью в слое, где сама вода не присутствует в пустотах.
Кроме того, в зависимости от состояния слоя, для того чтобы регулировать отношение жидкого СО2 и воды в эмульсии 5, жидкий СО2, вода/морская вода 24 сможет получить возможность протекать через наружную трубу 10 и внутреннюю трубу 11, соответственно, и вода/морская вода 24 сможет получить возможность распыляться в жидкий СО2. Далее, хотя в вышеупомянутых вариантах осуществления эмульсию получают путем введения жидкого СО2 в воду/морскую воду перед введением эмульсии в слой, в зависимости от обстоятельств, также возможно вводить жидкий СО2 непосредственно из распылительного сопла в слой, где существует гидрат СН4, так чтобы диспергировать жидкий СО2 в виде мелких частиц, в морскую воду или тому подобное в слое и образовать эмульсию, и после этого диффундировать эмульсию в слой посредством использования энергии, создаваемой посредством введения.
ПРИМЕРЫ
<Пример 1>
Лабораторное испытание было выполнено для того, чтобы подтвердить, могут ли диаметры мелких частиц из жидкого СО2, которые суспендированы в эмульсии СО2 – вода, быть сделаны меньшими, чем размер пустот в осадочном слое (пустоты между твердыми фазами). Этот эксперимент был проведен со слоем песка во впадине Nankai, которая является многообещающей для добычи гидрата СН4. Этот слой песка во впадине Nankai включает глину (размер частиц: 0,005-0,001 мм) и ил (размер частиц: 0,075-0,005 мм) при приблизительно 20%. Процентное содержание прохода по весу в нем показано на фиг.12. Хотя образец слоя песка из впадины Nankai был получен в результате испытательного бурения вручную, проведенного под руководством Министерства Экономики, Торговли и Промышленности Японии, было трудно для изобретателя получить образец. Поэтому эксперимент был проведен при использовании песка Toyoura в диапазоне 0,1-0,6 мм, который был отрегулирован до процентного содержания прохода по весу, показанного на фиг.12, как индикатор для лабораторного испытания. Распыление жидкого СО2 было продолжено с использованием распылительного сопла, изготовленного H. Ikeuchi &, Co., Ltd. (Product Code: 1/4MKB 80 063N S303-RW) в соответствии со способом распыления. При распылении воды из этого сопла при нормальной температуре и нормальным давлении и посредством установки внутреннего давления на 1 МПа диаметр капелек воды составлял 30-40 мкм. Однако состояние распыления для жидкого СО2 было неизвестно. Таким образом, принимая, что состояние, в котором жидкий СО2 будет прилипать к жидкой воде, перепад давления между сосудом 34, работающим под давлением, который наполнялся жидким СО2, и давлением распыления в сосуде 35, работающим под давлением, на котором было предусмотрено распылительное сопло, был установлен в 1 МПа, что касается давления распыления.
Испытание осуществлялось с использованием экспериментального прибора, как показано на схематическом изображении на фиг.13. Три сосуда, работающих под давлением, то есть сосуд 34, работающий под давлением, для жидкого СО2, сосуд 35, работающий под давлением, распыляющий жидкий СО2, и сосуд 37, работающий под давлением, для наблюдения под микроскопом, которые были взаимно соединены посредством трубопроводов, образовали экспериментальный прибор. В сосуд 34, работающий под давлением, для жидкого СО2, вводился СО2 при комнатной температуре, так чтобы газообразный СО2 подавался поверх слоя жидкого СО2. В сосуд 35, работающий под давлением, для распыления жидкого СО2, вводили воду, и затем газообразный СО2 подавался поверх воды. Кстати, на этой фигуре позиции 45, 46, 51, 52, 53, 54 обозначают резервуар для воды, горячую воду, насос, вентиль и резервуар для жидкого СО2, и термометр соответственно.
Сосуд 34, работающий под давлением, для жидкого СО2, в котором диоксид углерода был сжижен при начальном условии, что температура составляла 19°С (комнатная температура) и давление составляло 5,2 МПа, был герметизирован, и затем он нагревался в горячей воде. Когда температура и давление достигали 25°C и 6,2 МПа, соответственно вентиль 44 открывался для подачи жидкого СО2 в сосуд 35, работающий под давлением, для распыления. В сосуде 35, работающем под давлением, для распыления, жидкий СО2 распыляли посредством распылительного сопла (не показанного на фигуре) по направлению к газообразному СО2, как верхнему слою в сосуде 35, работающем под давлением, для распыления, и затем мелкие частицы жидкого СО2, образованные таким образом, падали в слой воды, как в нижний слой в сосуде 35, работающем под давлением, который перемешивался посредством мешалки, таким образом получалась эмульсия СО2 – вода. Кстати, перед нагреванием в горячей воде внутреннее давление в сосуде 34, работающем под давлением, для жидкого СО2 и внутреннее давлении в сосуде 35, работающем под давлением, для распыления выравнивались посредством открытия вентиля 43.
После этого эмульсия СО2 – вода, приготовленная таким образом, вводилась в сосуд 37, работающий под давлением, для наблюдения под микроскопом, посредством открытия вентиля 47, и наблюдение под микроскопом было проведено. Эмульсия СО2 – вода в камере для отбора образцов, которая была образована между стойкими к давлению стеклами толщиной 10 мм в сосуде 37, работающем под давлением, для наблюдения под микроскопом, наблюдалась посредством использования стереоскопического микроскопа с увеличением в 60 раз (изготовленного Nikkyo Technos, Co., Ltd., under the product code: S-20L(60 X)). После наблюдения посредством использования микрофотографии (см. фиг.14) диаметры и число мелких частиц в трех точках (а, b, c) были исследованы. Отношения между диаметром и числом жидкого СО2 в трех точках были показаны в таблице. Когда отношение между размерами частиц жидкого СО2 и процентными содержаниями прохода по весу было определено, было обнаружено, что диаметры частиц жидкого СО2 находились в диапазоне 10-100 мкм, как показано на фиг.16, и, таким образом, они были достаточно меньше, чем песок Toyoura (100-600 мкм) (см. фиг.15). Кроме того, оно было подобным распределению песка Toyoura.
| D (мм) |
(a) |
(b) |
(c) |
Итого |
0,100 D D |
1 |
3 |
2 |
6 |
0,084 D<0,100 D<0,100 |
3 |
6 |
1 |
10 |
0,062 D<0,084 D<0,084 |
3 |
9 |
7 |
19 |
0,047 D<0,062 D<0,062 |
9 |
6 |
8 |
23 |
0,034 D<0,047 D<0,047 |
16 |
16 |
10 |
42 |
0,026 D<0,034 D<0,034 |
14 |
15 |
5 |
34 |
0,018 D<0,026 D<0,026 |
25 |
19 |
12 |
56 |
0,010 D<0,018 D<0,018 |
47 |
23 |
35 |
105 |
| Итого |
118 |
97 |
80 |
295 |
Судя по этим результатам, эмульсия, которая включает большой объем жидкого СО2, может входить в пустоты между твердыми фазами, как например, частицами песка, в то время как она вытесняет морскую воду или воду, заполняющую пустоты, наружу из пустот, то есть частицы СО2, которые меньше, чем пустоты в слое, где образуется гидрат газа, то есть пустоты между твердыми фазами (частицами песка), могут протекать через пустоты, как в случае с водой.
<Пример 2>
Режим получения гидрата СО2, когда эмульсия СО2 – вода, полученная в примере 1, пропитывала песок Toyoura, в сосуде 42, работающем под давлением, для получения гидрата СО2, который моделировал слой песка в слое океанических отложений, наблюдался посредством использования, как индикаторов, температуры и давления. Схематическое изображение экспериментального прибора, используемого в получении гидрата СО2, показано на фиг.13. Этот экспериментальный прибор был тем же самым, как и в примере 1, за исключением того, что сосуд 36, работающий под давлением, для получения гидрата СО2 был дополнительно соединен ниже по потоку, чем сосуд 35, работающий под давлением, для распыления жидкого СО2. Повышенное давлением во внутренней части сосуда 36, работающего под давлением, для получения гидрата СО2 осуществлялось посредством ручного насоса 39 при условии, что вода подавалась в сосуд 36, работающий под давлением, для получения гидрата СО2 из не показанного резервуара для воды. Сосуд 36, работающий под давлением, для получения гидрата СО2 наполнялся песком Toyoura и водой, что моделировало слой песка в слое океанических отложений, причем песок в слое находился в диапазоне диаметров частиц, показанном на фиг.12 так, чтобы удовлетворить пористости приблизительно 50%. Кстати, в этом эксперименте, поскольку здесь нет необходимости подтвердить условие эмульсии СО2 – вода, сосуд 36, работающий под давлением, для получения гидрата СО2 может быть соединен непосредственно с сосудом 35, работающим под давлением, для распыления жидкой СО2, ниже по потоку, чем сосуд 35, работающий под давлением. Позиция 45 представляет манометр.
Во-первых, в сосуд 36, работающий под давлением, для получения гидрата СО2, который наполнен 314,09 г песка Toyoura, насыщенным 79,47 г воды, и давление в котором было повышено до приблизительно 5 МПа посредством использования ручного насоса 39, было введено 30,78 г эмульсии СО2 – вода с верха сосуда 36, работающего под давлением, при условии, что вентиль, который был размещен на нижней стороне сосуда 36, работающего под давлением, был слегка открыт до такой степени, чтобы давление внутри сосуда 36, работающего под давлением, не было уменьшено так, чтобы вода, присутствующая в пустотах, выдавливалась из сосуда 36, работающего под давлением, посредством эмульсии, и чтобы эмульсия вводилась в сосуд, работающий под давлением. После того как эмульсия была выпущена с нижней стороны сосуда, работающего под давлением, вентиль был закрыт. При этом условии вода, содержащаяся в сосуде, работающем под давлением, составляла 48,69 г. Затем посредством использования замороженной воды 50 в резервуаре 38 для воды, сосуд, работающий под давлением, охлаждался в течение двух часов до температуры, которая является стабильным условием для гидрата СО2, для того, чтобы производить гидрат СО2. Кстати, введение эмульсии жидкий СО2 – вода было продолжено посредством открытия вентиля 48, так чтобы ввести эмульсию жидкий СО2 – вода, которая была приготовлена в сосуде 35, работающем под давлением, для распыления жидкого СО2, в сосуд 36, работающий под давлением, для получения гидрата СО2. Выпуск эмульсии может быть легко обнаружен в связи с тем фактом, что давление падает до атмосферного давления, что дает возможность мелким частицам жидкого СО2 в эмульсии испаряться.
Изменения температуры в сосуде 36 под давлением в это время, которые были измерены посредством термометров 42, размещенных в шести точках, показанных на фиг.17, показаны на фиг.18. В соответствии с результатами измерений, температуры в шести точках повысились в то же самое время и подобным образом. Рассматривается, что эти изменения температуры были связаны с феноменом, что гидрат СО2 был получен равномерно, и также рассматривается, что СО2 был диспергирован равномерно по всему образцу. Между прочим, внутреннее давление в сосуде изменялось в диапазоне 4-9 МПа.
В этом эксперименте сосуд 36, работающий под давлением, опускали в замороженную воду, и, таким образом, этот эксперимент был выполнен при граничном условии, что тепло могло быть рассеяно (теплопередача). Значения подъема температуры в соответствующих точках измерения T3-T8 составляли приблизительно 4°C. Однако в случае действительного слоя океанических отложений имеются границы, где первоначальная температура не изменяется. Таким образом, при граничном условии, что первоначальная температура не изменяется, был проведен анализ неустойчивой термодиффузии. В результате этого было обнаружено, что температура образца (смесь песка Toyoura, воды и СО2), используемая как индикатор, повысилась на приблизительно 9°C посредством тепла реакции получения гидрата СО2. Поскольку теоретически рассчитанный максимум подъема температуры слоя Toyoura (смесь песка, воды и СО2) посредством тепла реакции (абсолютное значение) для получения гидрата СО2 составляет приблизительно 9°C, результат эксперимента означает, что окружающая среда удерживалась близкой к условиям, в которых может быть получено максимальное повышение температуры. А именно, результат проясняет, что в результате распыления и эмульгирования жидкого СО2, вызывается идеальная реакция образования гидрата, другими словами, производительность по гидрату СО2 может быть ускорена, и еще далее, эмульсия жидкий СО2 – вода может быть диспергирована равномерно в слое песка. Кроме того, результат проясняет, что СО2 может быть использован, как вещество для нагревания для слоя, где присутствует гидрат СН4.
Из результатов примеров 1 и 2 можно судить, что частицы СО2, которые являются меньшими, чем пустоты, протекали в пустоты в слое или слой песка Toyoura, как имеет место в случае с водой.
<Управление 1>
В сосуд 36, работающий под давлением, который был наполнен 314,09 г песка Toyoura, насыщенным 79,47 г воды, и давление в котором было повышено до приблизительно 5 МПа посредством использования ручного насоса 39, было введено 27,14 г жидкого СО2, давление которого было повышено до приблизительно 1 МПа, посредством погружения в горячую воду, и в то же самое время приблизительно 25 куб. см воды было откачано с нижней стороны сосуда 36, работающего под давлением, посредством использования насоса с ручным приводом. После того как жидкий СО2 был выпущен с нижней стороны сосуда, работающего под давлением, вентиль был закрыт. Выпуск жидкого СО2 может быть легко обнаружен в связи с тем фактом, что давление падает до атмосферного давления, что дает возможность жидкому СО2 испаряться. При этом условии вода, содержащаяся в сосуде под давлением, составляла 50,85 г. Затем посредством использования замороженной воды 50 в резервуаре 38 для воды, сосуд, работающий под давлением, охлаждался в течение двух часов до температуры, которая является стабильным условием для гидрата СО2, для того, чтобы получить гидрат СО2.
Фактические данные измерения изменений температуры в шести точках в Toyoura в данном случае показаны на фиг.17. В соответствии с результатами измерений изменения температуры в шести точках были вызваны случайными различиями во времени. Далее, что касается величины подъема температуры, величины в отдельных точках были отличными друг о друга, и величины, даже при максимуме, не достигали 2°C. Далее, в точке измерения, которая является минимумом изменения температуры, подъем температуры едва ли наблюдался. Из этих результатов видно, что жидкий СО2 не был равномерно диспергирован в пустотах в слое песка Toyoura, и большое изменение было вызвано в дисперсии, и далее, в зависимости от мест, куда жидкий СО2 не подавался. Далее, поскольку здесь имело место изменение в величинах повышения температуры в соответствующих точках измерения, и величины повышения температуры сами по себе были низкими, было показано, что скорость реакции образования гидрата была медленной, и реакция не прогрессировала активно.
Формула изобретения
1. Способ получения гидрата газа, отличающийся тем, что молекулы-гостя вводят в пустоты в слое, в котором условие температуры и давления дает возможность молекулам-гостя вызывать образование гидрата, в форме эмульсии, в которой жидкость из молекул-гостя диспергирована в воде для образования гидрата молекул-гостя в пустотах.
2. Способ по п.1, в котором величину теплоты на единицу объема эмульсии, связанной с получением гидрата газа, регулируют путем изменения отношения жидкости из молекул-гостя и воды в эмульсии для предотвращения повышения температуры от достижения температуры, когда гидрат не образуется, или температуры, при которой гидрат становится нестабильным.
3. Способ по п.1, в котором скорость получения гидрата в пустотах регулируют путем изменения размера мелких частиц жидкости из молекул-гостя в эмульсии.
4. Способ по п.1, в котором молекулы-гостя представляют собой СО2.
5. Способ замещения гидрата газа, отличающийся тем, что в пустоты в слое, где присутствует гидрат первых молекул-гостя, вводят эмульсию, в которой жидкость из вторых молекул-гостя диспергирована в воде, причем вторые молекулы-гостя могут образовать гидрат при условии более высокой температуры и более низкого давления по сравнению с условием температуры и давления, при котором первые молекулы-гостя образуют гидрат; в результате чего гидрат первых молекул-гостя разлагается посредством тепла, которое вырабатывается во время образования гидрата вторых молекул-гостя в пустотах.
6. Способ замещения по п.5, в котором величину теплоты на единицу объема эмульсии, связанной с образованием гидрата вторых молекул-гостя, регулируют путем изменения отношения жидкости из вторых молекул-гостя и воды в эмульсии для регулирования скорости разложения гидрата первых молекул-гостя.
7. Способ замещения по п.5, в котором скорость получения гидрата вторых молекул-гостя в пустотах регулируют путем изменения размера мелких частиц жидкости из вторых молекул-гостя в эмульсии.
8. Способ замещения по п.5, в котором первые молекулы-гостя представляют собой СН4, и вторые молекулы-гостя представляют собой СО2.
9. Способ добычи газа СН4 из гидрата CH4, отличающийся тем, что в пустоты в слое гидрата СН4 в условиях температуры и давления, при которых CO2 может образовывать гидрат, вводят эмульсию, в которой жидкий CO2 диспергирован в воде, причем эмульсию используют как агент нагревания для разложения гидрата CH4, присутствующего в пустотах.
10. Способ добычи газа СН4 из гидрата СН4, отличающийся тем, что в пустоты в слое, который покоится на слое гидрата СН4, находящемся в таких условиях температуры и давления, чтобы СО2 мог образовать гидрат, и находится в таких условиях температуры и давления, чтобы СО2 мог образовать гидрат, вводят эмульсию, в которой жидкий CO2 диспергирован в воде, для того, чтобы образовать куполообразный изолирующий слой из гидрата CO2; и затем эмульсию вводят в пустоты в слое гидрата CH4, так чтобы гидрат СО2 образовывался во время разложения гидрата СН4, присутствующего в пустотах, под действием тепла реакции образования гидрата СО2, таким образом, гидрат CH4 замещается гидратом CO2, тогда как газ СН4 собирается посредством куполообразного изолирующего слоя для извлечения газа CH4 на землю.
11. Способ добычи газа СН4 из гидрата СН4, отличающийся тем, что в пустоты в слое, который покоится на слое гидрата СН4, находящемся в таких условиях температуры и давления, чтобы СО2 мог образовать гидрат, и находится в таких условиях температуры и давления, чтобы СО2 мог образовать гидрат, вводят эмульсию, в которой жидкий СО2 диспергирован в воде, для того, чтобы образовать куполообразный изолирующий слой из гидрата СО2; в пустоты в слое, который покоится под слоем гидрата СН4, и находится в условиях температуры и давления, чтобы СО2 мог образовать гидрат, эмульсию вводят для того, чтобы получить гидрат СО2 и вызвать повышение температуры слоя, который покоится под слоем гидрата СН4, под действием тепла реакции образования гидрата СО2, причем под действием повышенной температуры гидрат СН4, присутствующий в слое гидрата СН4, разлагается с нижней стороны слоя гидрата CH4; и газообразный СН4 собирается посредством куполообразного изолирующего слоя для того, чтобы извлечь газообразный CH4 на землю, в то время как прочность слоя после добычи газа СН4 восстанавливается посредством ввода эмульсии в слой для того, чтобы образовать в нем гидрат СО2.
РИСУНКИ
|
|