|
(21), (22) Заявка: 2007119376/13, 26.10.2005
(24) Дата начала отсчета срока действия патента:
26.10.2005
(30) Конвенционный приоритет:
25.10.2004 US 60/621,086
(43) Дата публикации заявки: 27.11.2008
(46) Опубликовано: 10.09.2010
(56) Список документов, цитированных в отчете о
поиске:
WO 9801557 А2, 15.01.1998. HARRIS C.A. et al. Three distinct human thymopoietins are derived from alternatively spliced mRNAs. Proc. Natl. Acad. Sci. USA, 1994, v.91, n.14, p.6283-6287. RU 2176517 C2, 10.12.2001.
(85) Дата перевода заявки PCT на национальную фазу:
25.05.2007
(86) Заявка PCT:
IL 2005/001113 20051026
(87) Публикация PCT:
WO 2006/046239 20060504
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег.  517 517
|
(72) Автор(ы):
ДЕВАРИ Йорам (IL),
САНДЛЕР Узиель (IL)
(73) Патентообладатель(и):
ИММЬЮН СИСТЕМ КИ ЛТД (IL)
|
(54) ТИМУС-СПЕЦИФИЧЕСКИЙ БЕЛОК
(57) Реферат:
Изобретение относится к области биотехнологии, конкретно к получению тимус-специфических белков, и может быть использовано в медицине. Из человеческого тимуса выделяют тимус-специфический белок Т101, состоящий из 84 аминокислот. Выделенный полноразмерный пептид Т101 включает в себя состоящий из 33 аминокислот сигнальный пептид и состоящую из 51 аминокислоты пептидную последовательность Т101, обладающую иммуномодулирующей активностью. Полноразмерный пептид Т101, а также его пептидные фрагменты и производные используют в составе фармацевтической композиции для лечения аутоиммунных и воспалительных заболеваний. Изобретение позволяет получить полипептид, способный стимулировать пролиферацию лимфоцитов периферической крови (ЛПК) человека, ингибировать рост опухоли и модулировать иммунную систему. 10 н.п. ф-лы, 15 ил., 1 табл.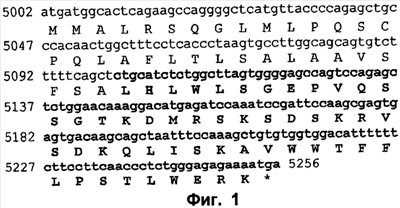
2420-144113RU/031
Область, к которой относится изобретение
Настоящее изобретение относится к новому тимус-специфическому белку.
Предшествующий уровень техники
Ниже приводятся предшествующие публикации, которые иллюстрируют предшествующий уровень техники в той области, к которой относится настоящее изобретение:
[1] Maurer, H.R., Eckert, K., Stange, R.: Einfluss der Therapie mit Thymoject auf die antitumorale Immunotoxizität der Leukozyten von Mamma-Tumorpatientinnen. Pers. Mitt. (1999).
[2] Mustacchi, G., Paves, L., Milani, S. et al.: High-dose folinic acid and fluouracil plus or minus thymostimulin for the treatment of metastatic colorectal cancer: results of a randomised multicentered trial. Anticancer Res. (1994) 14: 617-619.
[3] Schulof, R.S., Loyd, M.J., Cleary, P.A., et al.: A randomized trial to evaluate the immunorestorative properties of synthetic thymosin-alpha1 in patients with lung cancer. J. Biol. Resp. Modif. (1985) 4: 147-158.
[4] Azizi, A., Brenner, H.J., Shoham, J.: Postoperative adjuvante Behandlung von Patienten mit malignem Melanom durch den Thymusfaktor Thymostimulin. Arzneim-Forsch/Drg. Res. (1984) 34(11): 1043-1046.
[5] Massimo, F., Gobbi, P., Moretti, G., Avanzini, P., Italian Lymphoma Study Group: Effects of Thymostimulin with combination Chemotherapy in patients with aggressive non-Hogkins lymphoma. Am. J. Clin. Oncol. (CCT) (1995) 18(1): 8-14.
[6] Peretti, P., Tonelli, F., Mazzei, T., Ficari, F., Italian study group on antimicrobal prophylaxis in abdominal surgery. J. Chemotherapy (1993) 5(1): 37-42.
[7] Gonelli, S., Petrioli, R., Cepollaro, C., Palmieri, R., Aquino, A., Gennari, C.: Thymostimulin in association with chemotherapy in breast cancer patients with bone metastases. Clin. Drug Invest (1995) 9(2): 79-87.
[8] Iaffaioli, R.V., Frasci, G., Tortora, G., Ciardiello, F., Nuzzo, F., Scala, S., Pacelli, R., Bianco, A.R.: Effect of thymic extract Thymostimulin on the incidence of infections and myelotoxicity during adjuvant chemotherapy for breast cancer. Thymus (1988) 12: 69-75. Kluwer Academic Publishers.
В тексте описания изобретения эти публикации обозначены указанными выше номерами в скобках.
Предпосылки создания изобретения
В настоящее время идентифицированы многие модификаторы биологических ответов (MБО). Примерами таких модификаторов являются интерлейкины и цитокины. В целом в иммуномодуляции важную роль играет тимус. Можно сказать, что тимус является центральным органом иммунной системы. Считается, что тимус играет ключевую роль в развитии и функционировании иммунной системы и в механизмах биологической защиты от раковых и хронически инфицированных клеток.
Ткань тимуса ответственна за селективную трансформацмю клеток-предшественников в различные Т-клетки, то есть хелперные (CD4+) T-лимфоциты, которые облегчают дифференцировку других лимфоцитов; клетки-киллеры (NK-клетки); цитотоксические клетки и супрессорные (цитотоксические) (CD8+) T-лимфоциты [1-3]. Лимфоциты после их высвобождения в кровоток, а также в кишечные и периферические ткани характеризуются четко определяемыми антигенами или маркерами активации, присутствующими на их поверхности. Их активности проявляются вне тимуса.
Существуют очень тонкие взаимодействия между тимусом и активным костным мозгом. При этом существует прямая и положительная корреляция между гипофункцией тимуса и снижением уровня продуцирования колониестимулирующих факторов (CSF). Поэтому в случае недостаточного продуцирования CSF может оказаться полезным терапевтическое применение тимусных пептидов.
Хронический гепатит В (СНВ), ВИЧ-инфекция, хронический гепатит С (СНС) и малярия являются хроническими заболеваниями, которыми в настоящее время страдают примерно десять миллионов человек, не получая при этом никакого лечения. Клеточная составляющая иммунитета ответственна за иммунный  надзор надзор , направленный на предотвращение этих хронических вирусных, грибковых, дрожжевых и паразитарных инфекций, а также новообразований и симптомов старения. Тимусные экстракты находят клиническое применение в лечении различных заболеваний, включая некоторые из указанных состояний. Такие экстракты вводят перорально или путем инъекции как в чистом виде, так и в комбинации с другими терапевтическими средствами. Тимусные экстракты применяются для лечения тяжелых и хронических аллергий, включая аллергии дыхательный путей и кожи, а также для лечения тяжелых, острых и хронических инфекционных заболеваний. Было показано, что указанные экстракты уменьшают риск возникновения постхирургических инфекций и снижают степень повреждения, вызываемого химиотерапией и облучением, а также могут быть использованы в качестве вспомогательных средств в основном курсе терапии, проводимом для лечения опухолевых заболеваний. Все указанные состояния успешно подвергались лечению с использованием экстрактов, выделенных из тимуса коров. , направленный на предотвращение этих хронических вирусных, грибковых, дрожжевых и паразитарных инфекций, а также новообразований и симптомов старения. Тимусные экстракты находят клиническое применение в лечении различных заболеваний, включая некоторые из указанных состояний. Такие экстракты вводят перорально или путем инъекции как в чистом виде, так и в комбинации с другими терапевтическими средствами. Тимусные экстракты применяются для лечения тяжелых и хронических аллергий, включая аллергии дыхательный путей и кожи, а также для лечения тяжелых, острых и хронических инфекционных заболеваний. Было показано, что указанные экстракты уменьшают риск возникновения постхирургических инфекций и снижают степень повреждения, вызываемого химиотерапией и облучением, а также могут быть использованы в качестве вспомогательных средств в основном курсе терапии, проводимом для лечения опухолевых заболеваний. Все указанные состояния успешно подвергались лечению с использованием экстрактов, выделенных из тимуса коров.
В рандомизированных исследованиях пациентов со злокачественной меланомой введение тимусных пептидов приводило к увеличению периода прекращения развития опухоли, к увеличению продолжительности жизни и к повышению качества жизни [4]. В другом рандомизированном исследовании пациентов с промежуточной и высокозлокачественной неходжкинской лимфомой эти пациенты помимо стандартной химиотерапии были подвергнуты лечению тимусными пептидами. Прошедшие указанный курс лечения пациенты достаточно хорошо переносили такое лечение, и у этих пациентов наблюдался значимо более высокий показатель ответа, чем у пациентов, которым не вводили тимусные пептиды [5]. В другом рандомизированном исследовании, в котором участвовали пациенты, подвергнутые операции на ободочной кишке, было обнаружено, что у пациентов, которым помимо цефотетана вводили тимусные пептиды, наблюдалось значимое снижение уровня развития абсцессов в брюшине и инфекций в верхних дыхательных путях [6]. Рандомизированные исследования, проводимые с участием женщин с запущенным раком молочной железы, документально подтвердили, что у женщин, которым помимо курса химиотерапии вводили тимусные пептиды, наблюдалась значительно лучшая переносимость химиотерапии и снижение уровня развития вторичных инфекций [7, 8].
В соответствии с вышеуказанными данными очевидно, что тимусные пептиды могут быть использованы для усиления функции костного мозга и для защиты пациента от миелосупрессии, вызываемой химиотерапией; для стимуляции восстановления костного мозга после облучения и химиотерапии; для предупреждения развития вторичных инфекций, обусловленных иммуносупрессией, вызываемой стандартной химиотерапией и хирургическим вмешательством; для повышения показателя полного и частичного ответа на противораковую терапию; и для улучшения функции лимфоцитов и механизмов биологической защиты.
Иммунная система состоит из множества различных клеток, включая T-клетки, B-клетки, NK-клетки и т.п. Эти различные клетки варьируются по своей природе. Незрелые T-клетки образуются в костном мозге, а затем они мигрируют в тимус. В тимусе происходят различные процессы, которые приводят к продуцированию зрелых T-клеток и к секреции различных пептидов, регулирующих иммунный ответ. T-клетки могут быть подразделены на несколько подгрупп, например T-хелперные клетки, T-цитотоксические клетки, T-клетки памяти и регуляторные T-клетки. Клетки каждой такой подгруппы играют свою определенную роль в иммунном ответе. Клетки этих подгрупп характеризуются различными антигенами, присутствующими на их мембранах. Так, например, T-хелперные клетки представляют антиген CD4 на своей мембране, а T-цитотоксические клетки представляют антиген CD8 на своей мембране.
CD4+-T-клетки играют регуляторную роль и, очевидно, ассоциируются с периферической аутотолерантностью. Предположение о существовании тимусных регуляторных T-клеток было сначала высказано ранее, исходя из того факта, что аутоиммунное заболевание у мышей начинает развиваться на 3-й день после тимэктомии. При этом было обнаружено, что такие расстройства обусловлены потерей периферических CD4+-Т-клеток, конститутивно экспрессирующих IL-2R альфа (CD25), которые появляются на периферии значительно позже после рождения. Физиологически генерируемые CD4+-CD25+-клетки подавляют аутоиммунные и воспалительные расстройства широкого ряда, например колит.
Несмотря на многочисленные исследования, механизм регуляторного действия CD4+-CD25+-Т-клеток остается неясным. Некоторые исследования показали, что регуляция in vivo зависит от продуцирования цитокинов-супрессоров, таких как IL-10 и ТGF- и молекул клеточной поверхности, таких как CTLA-4. In vivo исследования показали, что супрессорный эффект опосредован не цитокинами, а клеточным взаимодействием. и молекул клеточной поверхности, таких как CTLA-4. In vivo исследования показали, что супрессорный эффект опосредован не цитокинами, а клеточным взаимодействием.
В общих чертах сообщалось, что in vivo CD8+-Т-клетки играют главную роль в предупреждении экспериментального аутоиммунного энцефаломиелита и способствуют пероральной толерантности. Регуляторные CD8+-CD28–-T-клетки могут быть генерированы и размножены in vitro путем проведения множества раундов стимуляции аллогенными АПК, но при этом не известно, существует ли такая популяция in vivo. Новое исследование выявило новую популяцию регуляторных CD8+-клеток, которые также конститутивно экспрессируют CD25 и которые обладают свойствами, очень похожими на свойства CD4+-CD25+-клеток.
Эти клетки продуцируют IL-10, Foxp3 и CTLA-4 и ингибируют CD25–-T-клеточный ответ на стимуляцию анти-CD3-антителом, опосредуемую межклеточными взаимодействиями, с эффективностью, аналогичной эффективности действия CD4+-CD25+-клеток.
Очевидно, что эти 2 субпопуляции CD4+-CD25+-клеток и CD8+-CD25+-клеток участвуют в регуляции иммунного ответа.
Описание сущности изобретения
Целью настоящего изобретения является выделение тимус-специфического белка из человеческого тимуса.
С помощью ПЦР библиотеки человеческих кДНК, выделенные из 16 различных тканей 20-летних женщин, были подвергнуты скринингу, и была идентифицирована уникальная кДНК человеческого тимуса. Пептид, кодируемый указанной кДНК, был обозначен Т101. Были подвергнуты скринингу банки человеческих, мышиных и крысиных EST, но какого-либо сходства кДНК Т101 с любым из известных генов обнаружено не было. Аналогичные результаты были получены с использованием банков белков и полноразмерных геномных ДНК. Указанная последовательность кДНК и соответствующая аминокислотная последовательность являются новыми последовательностями, которые не были описаны ранее.
Пептид, кодируемый указанной кДНК, имеет длину в 84 аминокислоты и включает в себя сигнальный пептид, состоящий из 33 аминокислот и присутствующий на N-конце (см. фиг.1). Ниже приводятся последовательность кДНК (SEQ ID NO:1) и аминокислотная последовательность (SEQ ID NO:2) Т101:
atgatggcactcagaagccaggggctcatgttaccccaga
gctgcccacaactggctttcctcaccctaagtgccttggc
agcagtgtctttttcagctctgcatctctggcttagtggg
gagccagtccagagctctggaacaaaggacatgagatcca
aatccgattccaagcgagtgagtgacaagcagctaatttc
caaagctgtgtggtggacattttttcttccttcaaccctc
tgggagagaaaatga (SEQ ID NO:1)
MMАLRSQGLMLPQSCPQLAFLTLSALAAVSFSALHLWLSG
EPVQSSGTKDMRSKSDSKRVSDKQLISKAVWWTFFLPSTL
WERK (SEQ ID NO:2)
Настоящее изобретение относится также к молекуле нуклеиновой кислоты SEQ ID NO:1 и к пептиду SEQ ID NO:2. Полипептид SEQ ID NO:2 будет далее называться  полноразмерным пептидом T101 полноразмерным пептидом T101 . .
Полноразмерный пептид Т101 также включает в себя сигнальную последовательность в 33 аминокислоты. Таким образом, настоящее изобретение относится также к пептиду, составляющему последовательность полноразмерного пептида Т101, не содержащего указанный сигнальный пептид и имеющего следующую последовательность (SEQ ID NO:4):
LHLWLSGEPVQSSGTKDMRSKSDSKRVSDKQLISKAVWWT
FFLPSTLWERK (SEQ ID NO:4)
Пептид Т101, который не содержит сигнальной последовательности (SEQ ID NO:4), будет далее называться  пептидом Т101 пептидом Т101 . .
Настоящее изобретение относится также к молекуле нуклеиновой кислоты, содержащей последовательность, кодирующую пептид Т101. Эта последовательность включает в себя нижеследующую последовательность (SEQ ID NO:3):
catctctggcttagtggggagccagtccagagctctggaacaaag
gacatgagatccaaatccgattccaagcgagtgagtgacaagcag
ctaatttccaaagctgtgtggtggacattttttcttccttcaacc
ctctgggagagaaaatga (SEQ ID NO:3)
Настоящее изобретение относится также к модифицированным молекулам нуклеиновой кислоты SEQ ID NO:1 или SEQ ID NO:3 и к модифицированным пептидам SEQ ID NO:2 или SEQ ID NO:4, в которых добавлены, делетированы или заменены один или несколько нуклеотидов или аминокислотных остатков соответственно, где указанные модификации не оказывают значительного влияния на биологические свойства указанной модифицированной молекулы по сравнению с немодифицированной молекулой.
Используемый здесь термин  пептид пептид означает пептид, полипептид или белок. Этот пептид может быть получен путем синтеза, методами генной инженерии, путем экспрессии в клетке-хозяине или любыми другими подходящими методами. означает пептид, полипептид или белок. Этот пептид может быть получен путем синтеза, методами генной инженерии, путем экспрессии в клетке-хозяине или любыми другими подходящими методами.
Термин  биологические свойства биологические свойства , относящийся к пептидной молекуле, означает, что эта молекула имеет по меньшей мере одну in vitro или in vivo активность, которой может обладать полноразмерный пептид Т101 или пептид Т101, включая, но не ограничиваясь ими, биологические активности, описанные ниже в разделе , относящийся к пептидной молекуле, означает, что эта молекула имеет по меньшей мере одну in vitro или in vivo активность, которой может обладать полноразмерный пептид Т101 или пептид Т101, включая, но не ограничиваясь ими, биологические активности, описанные ниже в разделе  Примеры Примеры . Термин . Термин  биологические свойства биологические свойства , относящийся к молекуле нуклеиновой кислоты, означает способность этой молекулы кодировать пептид, имеющий биологические свойства, аналогичные биологическим свойствам полноразмерного пептида Т101 или пептида Т101, включая, в частности, (i) молекулу нуклеиновой кислоты, имеющую последовательность, которая отличается от последовательности SEQ ID NO:1 или SEQ ID NO:3, но которая вследствие избыточности генетического кода кодирует полноразмерный пептид Т101 или пептид Т101 соответственно; и (ii) молекулу нуклеиновой кислоты, кодирующую аминокислотную последовательность, которая отличается от последовательности полноразмерного пептида Т101 или пептида Т101, но которая имеет биологические свойства, аналогичные биологическим свойствам полноразмерного пептида Т101 или пептида Т101 соответственно. , относящийся к молекуле нуклеиновой кислоты, означает способность этой молекулы кодировать пептид, имеющий биологические свойства, аналогичные биологическим свойствам полноразмерного пептида Т101 или пептида Т101, включая, в частности, (i) молекулу нуклеиновой кислоты, имеющую последовательность, которая отличается от последовательности SEQ ID NO:1 или SEQ ID NO:3, но которая вследствие избыточности генетического кода кодирует полноразмерный пептид Т101 или пептид Т101 соответственно; и (ii) молекулу нуклеиновой кислоты, кодирующую аминокислотную последовательность, которая отличается от последовательности полноразмерного пептида Т101 или пептида Т101, но которая имеет биологические свойства, аналогичные биологическим свойствам полноразмерного пептида Т101 или пептида Т101 соответственно.
Термин  не оказывает значительного влияния на биологические свойства модифицированной молекулы по сравнению с немодифицированной молекулой не оказывает значительного влияния на биологические свойства модифицированной молекулы по сравнению с немодифицированной молекулой означает, что указанная модифицированная молекула сохраняет биологическую активность, которая по своим качествам аналогична активности немодифицированной молекулы. В отношении модифицированного пептида этот термин означает, что указанный пептид сохраняет одно или несколько биологических свойств пептида SEQ ID NO:2 или SEQ ID NO:4, включая среди прочих его диагностическую и терапевтическую эффективности, описанные ниже, а также in vitro и in vivo активности, описанные ниже в разделе означает, что указанная модифицированная молекула сохраняет биологическую активность, которая по своим качествам аналогична активности немодифицированной молекулы. В отношении модифицированного пептида этот термин означает, что указанный пептид сохраняет одно или несколько биологических свойств пептида SEQ ID NO:2 или SEQ ID NO:4, включая среди прочих его диагностическую и терапевтическую эффективности, описанные ниже, а также in vitro и in vivo активности, описанные ниже в разделе  Примеры Примеры . Для того, чтобы определить, сохраняет ли данный пептид биологическую активность, которая качественно аналогична активности немодифицированной молекулы, можно провести один или несколько анализов, таких, например, как in vitro, in vivo или клинический эксперимент, в котором модифицированный пептид сравнивают с соответствующим немодифицированным пептидом (а именно с полноразмерным пептидом Т101 или пептидом Т101), которые подвергают параллельному анализу; или эксперимент, в котором указанный модифицированный пептид анализируют для того, чтобы определить, обладает ли он биологической активностью, аналогичной активности немодифицированного пептида, которая была установлена в отдельно проводимом эксперименте. Такие эксперименты могут быть проведены, например, как описано ниже в разделе . Для того, чтобы определить, сохраняет ли данный пептид биологическую активность, которая качественно аналогична активности немодифицированной молекулы, можно провести один или несколько анализов, таких, например, как in vitro, in vivo или клинический эксперимент, в котором модифицированный пептид сравнивают с соответствующим немодифицированным пептидом (а именно с полноразмерным пептидом Т101 или пептидом Т101), которые подвергают параллельному анализу; или эксперимент, в котором указанный модифицированный пептид анализируют для того, чтобы определить, обладает ли он биологической активностью, аналогичной активности немодифицированного пептида, которая была установлена в отдельно проводимом эксперименте. Такие эксперименты могут быть проведены, например, как описано ниже в разделе  Примеры Примеры . В отношении модифицированной молекулы нуклеиновой кислоты термин . В отношении модифицированной молекулы нуклеиновой кислоты термин  не оказывает значительного влияния на биологические свойства модифицированной молекулы по сравнению с немодифицированной молекулой не оказывает значительного влияния на биологические свойства модифицированной молекулы по сравнению с немодифицированной молекулой означает, что указанная молекула способна кодировать модифицированный пептид, имеющий любые из вышеупомянутых свойств. означает, что указанная молекула способна кодировать модифицированный пептид, имеющий любые из вышеупомянутых свойств.
Модифицированным пептидом может быть пептид, включающий в себя последовательность смежных аминокислот, состоящую по меньшей мере из 8, 12, 15, 20, 25, 30, 35, 40 или по меньшей мере из 45 аминокислотных остатков, которые по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, а в частности по меньшей мере на 95% идентичны соответствующей последовательности, состоящей по меньшей мере из 8, 12, 15, 20, 25, 30, 35, 40 или по меньшей мере из 45 аминокислотных остатков, присутствующих в пептиде Т101.
Настоящее изобретение относится также к пептиду, содержащему неполную последовательность из смежных аминокислот, происходящую из полноразмерного пептида Т101 и включающую в себя по меньшей мере 8 аминокислотных остатков, где указанная непрерывная последовательность представляет собой последовательность из смежных аминокислот, присутствующую в указанном полноразмерном пептиде Т101. Такой пептид будет далее называться  неполным пептидом Т101 неполным пептидом Т101 . В одном из своих вариантов настоящее изобретение относится к неполному пептиду Т101, содержащему нижеследующую непрерывную последовательность из 13 смежных аминокислотных остатков, начинающихся с N-конца пептида Т101 (аминокислоты 39-51): . В одном из своих вариантов настоящее изобретение относится к неполному пептиду Т101, содержащему нижеследующую непрерывную последовательность из 13 смежных аминокислотных остатков, начинающихся с N-конца пептида Т101 (аминокислоты 39-51):
WTFFLPSTLWERK (SEQ ID NO:5)
Настоящее изобретение относится также к белку или полипептиду, содержащему аминокислотную последовательность полноразмерного пептида Т101, пептида Т101, модифицированного пептида или неполного пептида Т101 (такой пептид или полипептид будет далее называться  Т101-содержащим белком Т101-содержащим белком ). Т101-содержащий белок может, например, представлять собой гибридный белок, включающий в себя полноразмерный пептид Т101, пептид Т101, модифицированный пептид или неполный пептид Т101; и он может представлять собой конъюгат белка или другого пептида или полипептида с полноразмерным пептидом Т101, пептидом Т101, модифицированным пептидом или неполным пептидом Т101 и т.п. ). Т101-содержащий белок может, например, представлять собой гибридный белок, включающий в себя полноразмерный пептид Т101, пептид Т101, модифицированный пептид или неполный пептид Т101; и он может представлять собой конъюгат белка или другого пептида или полипептида с полноразмерным пептидом Т101, пептидом Т101, модифицированным пептидом или неполным пептидом Т101 и т.п.
Настоящее изобретение относится также к олигонуклеотиду, состоящему по меньшей мере из 24 нуклеотидов и представляющему собой (i) олигонуклеотид, который кодирует неполную непрерывную последовательность из смежных аминокислот пептида Т101, включающую в себя по меньшей мере 8 аминокислотных остатков, и который может включать в себя непрерывную последовательность из 24 смежных нуклеиновых кислот, присутствующих в SEQ ID NO:1; (ii) нуклеотидную последовательность, которая может гибридизоваться с нуклеотидной последовательностью SEQ ID NO:1 в условиях гибридизации высокой жесткости; (iii) олигонуклеотид, имеющий последовательность, которая состоит по меньшей мере из 24 смежных нуклеотидов и которая по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, а в частности по меньшей мере на 95% идентична соответствующей непрерывной последовательности из смежных нуклеотидов, присутствующих в SEQ ID NO:1.
Настоящее изобретение относится также к молекуле нуклеиновой кислоты, например к вектору для переноса или к экспрессионному вектору, содержащему любую из вышеупомянутых молекул нуклеиновой кислоты.
В другом своем аспекте настоящее изобретение относится к нижеследующим дополнительным неполным пептидам Т101:
SGEPVQSSGTKDMRSKSDSKRVS (SEQ ID NO:6)
DKQLISKAVWWTFFLPSTLWERK (SEQ ID NO:7)
PSTLWERK (SEQ ID NO:8)
AVWWTFFLPSTLW (SEQ ID NO:9)
KREWLTSPLFFTWWVA (SEQ ID NO:10)
WTFFL (SEQ ID NO:11)
Последовательность SEQ ID NO:6 состоит из аминокислот 6-28 пептида Т101; последовательность SEQ ID NO:7 состоит из аминокислот 29-51 пептида Т101; последовательность SEQ ID NO:8 состоит из аминокислот 44-51 пептида Т101; последовательность SEQ ID NO:9 состоит из аминокислот 36-48 пептида Т101; последовательность SEQ ID NO:10 состоит из аминокислот 36-51 пептида Т101, расположенных в обратном порядке; последовательность SEQ ID NO:11 состоит из аминокислот 39-43 пептида Т101.
Настоящее изобретение относится также к модифицированным пептидам, происходящим из любого из пептидов, определяемых выше, например к модифицированным пептидам, в которых одна или несколько аминокислот заменены другими аминокислотами путем консервативной замены. Используемый здесь термин  консервативная замена консервативная замена означает замену аминокислоты одного класса аминокислотой того же класса, где класс аминокислот определяется общими физико-химическими свойствами боковых цепей аминокислот и высокой частотой замен в гомологичных белках, наблюдающихся в природе. Существует шесть общих классов боковых цепей аминокислот, и такими классами являются: класс I (Cys); класс II (Ser, Thr, Pro, Ala, Gly); класс III (Asn, Asp, Gln, Glu); класс IV (His, Arg, Lys); класс V (Ile, Leu, Val, Met) и класс VI (Phe, Tyr, Trp). Так, например, замена Asp другим остатком класса III, таким как Asn, Gln или Glu, является консервативной заменой. означает замену аминокислоты одного класса аминокислотой того же класса, где класс аминокислот определяется общими физико-химическими свойствами боковых цепей аминокислот и высокой частотой замен в гомологичных белках, наблюдающихся в природе. Существует шесть общих классов боковых цепей аминокислот, и такими классами являются: класс I (Cys); класс II (Ser, Thr, Pro, Ala, Gly); класс III (Asn, Asp, Gln, Glu); класс IV (His, Arg, Lys); класс V (Ile, Leu, Val, Met) и класс VI (Phe, Tyr, Trp). Так, например, замена Asp другим остатком класса III, таким как Asn, Gln или Glu, является консервативной заменой.
В одном из вариантов изобретения в аминокислотной последовательности имеется только одна замена. В другом варианте изобретения в аминокислотной последовательности имеются две замены. В еще одном варианте изобретения в аминокислотной последовательности имеются три замены. Максимальное число замен не должно превышать число аминокислот, которое составляет по меньшей мере 70%, желательно по меньшей мере 80%, предпочтительно по меньшей мере 90%, а наиболее предпочтительно по меньшей мере 95% от всех аминокислот в немодифицированной последовательности. В одном из предпочтительных вариантов изобретения замены, которые включают до 3, порой до 6 аминокислотных остатков, замененных другими остатками, являются консервативными заменами.
В другом варианте осуществления одна или несколько аминокислот могут быть заменены D-аминокислотами, а предпочтительно соответствующими D-аминокислотами.
В еще одном варианте настоящее изобретение также включает в себя последовательности, расположенные в обратном порядке по отношению к вышеуказанным последовательностям.
Так, например, настоящее изобретение относится также к полноразмерным пептидам Т101 SEQ ID NO:2, или предпочтительно к пептидам Т101 SEQ ID NO:4, или к неполным последовательностям Т101, модифицированным путем одной или нескольких консервативных замен.
Настоящее изобретение относится также к пептиду, включающему в себя по меньшей мере 10 или 15, или 20, или 25, или 30, или 35, или 40 аминокислотных остатков, или к полноразмернму пептиду Т101, имеющему последовательность: AA1,-AA2-…-AA51, где
AA1 выбран из лейцина, изолейцина, валина и метионина;
AA2 выбран из лизина, аргинина и гистидина;
AA3 выбран из лейцина, изолейцина, валина и метионина;
AA4 выбран из триптофана, фенилаланина и тирозина;
AA5 выбран из лейцина, изолейцина, валина и метионина;
AA6 выбран из серина, треонина, аланина, глицина и пролина;
AA7 выбран из серина, треонина, аланина, глицина и пролина;
AA8 выбран из глутамина, глутаминовой кислоты, аспарагиновой кислоты и аспарагина;
AA9 выбран из серина, треонина, аланина, глицина и пролина;
AA10 выбран из лейцина, изолейцина, валина и метионина;
AA11 выбран из глутамина, глутаминовой кислоты, аспарагиновой кислоты и аспарагина;
AA12 выбран из серина, треонина, аланина, глицина и пролина;
AA13 выбран из серина, треонина, аланина, глицина и пролина;
AA14 выбран из серина, треонина, аланина, глицина и пролина;
AA15 выбран из серина, треонина, аланина, глицина и пролина;
AA16 выбран из лизина, аргинина и гистидина;
AA17 выбран из глутамина, глутаминовой кислоты, аспарагиновой кислоты и аспарагина;
AA18 выбран из лейцина, изолейцина, валина и метионина;
AA19 выбран из лизина, аргинина и гистидина;
AA20 выбран из серина, треонина, аланина, глицина и пролина;
AA2I выбран из лизина, аргинина и гистидина;
AA22 выбран из серина, треонина, аланина, глицина и пролина;
AA23 выбран из глутамина, глутаминовой кислоты, аспарагиновой кислоты и аспарагина;
AA24 выбран из серина, треонина, аланина, глицина и пролина;
AA25 выбран из лизина, аргинина и гистидина;
AA26 выбран из лизина, аргинина и гистидина;
AA27 выбран из лейцина, изолейцина, валина и метионина;
AA28 выбран из серина, треонина, аланина, глицина и пролина;
AA29 выбран из глутамина, глутаминовой кислоты, аспарагиновой кислоты и аспарагина;
AA30 выбран из лизина, аргинина и гистидина;
AA31 выбран из глутамина, глутаминовой кислоты, аспарагиновой кислоты и аспарагина;
AA32 выбран из лейцина, изолейцина, валина и метионина;
AA33 выбран из лейцина, изолейцина, валина и метионина;
AA34 выбран из серина, треонина, аланина, глицина и пролина;
AA35 выбран из лизина, аргинина и гистидина;
AA36 выбран из серина, треонина, аланина, глицина и пролина;
AA37 выбран из лейцина, изолейцина, валина и метионина;
AA38 выбран из триптофана, фенилаланина и тирозина;
AA39 выбран из триптофана, фенилаланина и тирозина;
AA40 выбран из серина, треонина, аланина, глицина и пролина;
AA41 выбран из триптофана, фенилаланина и тирозина;
AA42 выбран из триптофана, фенилаланина и тирозина;
AA43 выбран из лейцина, изолейцина, валина и метионина;
AA44 выбран из серина, треонина, аланина, глицина и пролина;
AA45 выбран из серина, треонина, аланина, глицина и пролина;
AA46 выбран из серина, треонина, аланина, глицина и пролина;
AA47 выбран из лейцина, изолейцина, валина и метионина;
AA48 выбран из триптофана, фенилаланина и тирозина;
AA49 выбран из глутамина, глутаминовой кислоты, аспарагиновой кислоты и аспарагина;
AA50 выбран из лизина, аргинина и гистидина; и
AA51 выбран из лизина, аргинина и гистидина.
Настоящее изобретение относится также к модифицированным пептидам, полученным на основе полноразмерного пептида Т101, пептида Т101 или неполного пептида Т101, включающим в себя нижеследующие подпоследовательности (аминокислоты пронумерованы в соответствии с нумерацией пептида Т101):
AA38-AA39-AA40-AA41-AA42, где AA38 и AA39 представляют собой аминокислоты класса VI, предпочтительно триптофан; AA40 представляет собой аминокислоту класса II, предпочтительно треонин; а AA41 и AA42 представляют собой аминокислоты класса VI, предпочтительно фенилаланин;
AA38-AA39-AA40-AA41-AA42-AA43, где AA38 и AA39 представляют собой аминокислоты класса VI, предпочтительно триптофан; AA40 представляет собой аминокислоту класса II, предпочтительно треонин; AA41 и AA42 представляют собой аминокислотаы класса VI, предпочтительно фенилаланин; и AA43 представляет собой аминокислоту класса V, предпочтительно лейцин;
Ala-Val-AA38-AA39-AA40-AA41-AA42, где AA38 и AA39 представляют собой аминокислоты класса VI, предпочтительно триптофан; AA40 представляет собой аминокислоту класса II, предпочтительно треонин; и AA41 и AA42 представляют собой аминокислоты класса VI, предпочтительно фенилаланин;
Ala-Val-AA38-AA39-AA40-AA41-AA42-AA43, где AA38 и AA39 представляют собой аминокислоты класса VI, предпочтительно триптофан; AA40 представляет собой аминокислоту класса II, предпочтительно треонин; AA41 и AA42 представляют собой аминокислоты класса VI, предпочтительно фенилаланин; и AA43 представляет собой аминокислоту класса V, предпочтительно лейцин.
Подпоследовательность из 24 аминокислот SEQ ID NO:4 (аминокислоты 24-47):
SKRVSDKQLISKAVWWTFFLPSTL (SEQ ID NO:12),
имеет близкое сходство с нижеследующими последовательностями, происходящими от млекопитающих других видов, а именно:
от собак: SKQVSDKQLISKAVQRIFFFLQPS (SEQ ID NO:13); и
от крыс: SKFMSDKQLISKAVQRIFFLSSTL (SEQ ID NO:14).
При сравнении последовательностей SEQ ID NO:12-14 была выявлена нижеследующая консенсусная последовательность для млекопитающих трех видов (показана заглавными буквами):
SKrvSDKQLISKAVwwtFFLpSTL (SEQ ID NO:12)
SKqvSDKQLISKAVQRIFFflqps (SEQ ID NO:13)
SKfmSDKQLISKAVQRIFFLsSTL (SEQ ID NO:14)
Настоящее изобретение относится также к пептиду, содержащему указанную консенсусную последовательность. Такой пептид (называемый здесь  консенсусным пептидом консенсусным пептидом ) имеет одну из нижеследующих формул: ) имеет одну из нижеследующих формул:
SKx1x2SDKQLISKAVx3x4x5FFLx6STL (SEQ ID NO:15);
SKx1x2SDKQLISKAVx3х4x5FFLx6 (SEQ ID NO:16);
SKx1x2SDKQLISKAVQRIFF (SEQ ID NO:17); или
SKx1x2SDKQLISKAVQRIFFLx6STL (SEQ ID NO:18);
где
х1 представляет собой R, Q или F, или, альтернативно, как результат консервативной замены, H, K, N, D, E, Y или W;
x2 представляет собой V или M, или, альтернативно, как результат консервативной замены, I или L;
х3 представляет собой W или Q, или, альтернативно, как результат консервативной замены, F, Y, N, D или E;
х4 представляет собой W или R, или, альтернативно, как результат консервативной замены, F, Y, H или K;
х5 представляет собой T или I, или, альтернативно, как результат консервативной замены, S, P, A, G, L, V или M; и
х6 представляет собой P, L или S, или, альтернативно, как результат консервативной замены, T, A, G, I, V или M.
Настоящее изобретение относится также к белку или к полипептиду, который содержит аминокислотную последовательность указанного консенсусного пептида. Настоящее изобретение также относится к нуклеотидной последовательности, кодирующей указанные консенсусные пептиды, или белок, или полипептид, содержащий аминокислотную последовательность указанного консенсусного пептида.
Т101 является растворимым в водном растворе. Это его свойство и биологические свойства, описанные ниже, а также его тканеспецифичность и физические свойства, характерные для пептидного гормона, способствуют тому, что указанный пептид Т101, полноразмерный пептид Т101, неполный пептид Т101 или любые их модификации могут быть использованы в качестве терапевтических средств для индуцирования клеточного иммунного ответа и для лечения различных других клинических состояний, таких как ВИЧ-инфекция, гепатит В, гепатит С, рак и малярия.
Как будет также показано в нижеследующих примерах, было обнаружено, что пептид Т101 и происходящие от него различные модифицированные пептиды обладают способностью модулировать иммунную систему. Такая модуляция выражается в активации иммунной системы (на что указывает, например, увеличение уровня пролиферации лимфоцитов периферической крови (ЛПК)), а также в подавлении иммунной системы (на что указывает, например, увеличение уровня продуцирования IL-10 и снижение числа ЛПК). Таким образом, Т101 обладает как иммуноактивирующей, так и иммуноингибирующей способностью. Не претендуя на какую-либо конкретную теорию и не ограничивая объема настоящего изобретения, можно сказать, что механизм действия Т101 на иммунную систему может зависеть от его концентрации.
Настоящее изобретение относится также к способам лечения, к способам диагностики и к фармацевтическим композициям, в которых используется указанный пептид Т101, полноразмерный пептид Т101, неполный пептид Т101, модифицированный пептид Т101, или Т101-содержащий белок, или любые молекулы нуклеиновой кислоты, упомянутые выше. Пептид Т101 может иметь нижеследующие диагностические и терапевтические применения:
1. Т101 может служить в качестве средства для диагностики отсутствия иммунокомпетентности после подкожной инъекции токсинов, выделенных из различных организмов.
2. Определение уровня Т101 в крови может служить показателем повышенной или пониженной функции тимуса и показателем уровня активности иммунной системы.
3. Уровень Т101 может служить в качестве индикатора аутоиммунных заболеваний.
4. Т101 может служить стимулятором иммунной системы. Так, например, Т101 может быть использован для лечения состояния, ассоциированного с отсутствием иммунокомпетентности в отношении бактерий, паразитов и вирусных токсинов.
5. Т101 может быть использован в качестве диагностического средства для предотвращения рецидивов инфекций. Так, например, Т101 должен снижать число рецидивов инфекций в дыхательных путях.
6. Т101 может быть использован в качестве терапевтического средства для ослабления аллергических и воспалительных реакций. Так, например, Т101 может быть использован для снижения заболеваемости астмой или ослабления ее симптомов.
7. Т101 может быть использован для лечения вирусных заболеваний, таких как туберкулез, герпес, острый и хронический гепатит В, острый и хронический гепатит С, хронический холестатический гепатит, цирроз и стоматит.
8. Т101 может быть использован в качестве терапевтического средства для лечения заболеваний, ассоциированных с иммунодефицитом, таких как СПИД и комбинированный иммунодефицит.
9. Т101 может быть использован в качестве терапевтического средства для лечения кожных болезней, таких как атопическая экзема и псориаз.
10. Т101 может быть использован для лечения некоторых других заболеваний. Так, например, Т101 может быть использован в качестве ингибитора иммунной системы для лечения аутоиммунных патологий, таких как ВЗК, тяжелая миастения, рассеянный склероз, диабет типа I, ревматоидный артрит, системная красная волчанка, склеродермия, хроническая аутоиммунная гемолитическая анемия, колит, болезнь Крона и т.п.
11. Т101 может быть использован в качестве стимулятора иммунной системы для лечения таких злокачественных заболеваний, как рак легких, карцинома гортани, карцинома головы и шеи, карцинома молочной железы, болезнь Ходжкина, неходжкинская лимфома, рак молочной железы, гепатоцеллюлярный рак и меланома.
12. Т101 может быть использован для предотвращения возникновения инфекций после хирургических операций и имплантаций. Т101 может быть использован после трансплантации для ингибирования отторжения трансплантата.
13. Т101 может быть использован для усиления иммунного ответа у пожилых или более молодых людей или у людей с нарушенной иммунной системой.
14. Т101 может быть использован для лечения кожных инфекций после ожогов.
15. Т101 может быть использован в качестве терапевтического средства для лечения бесплодия у мужчин.
16. Т101 может повышать сердечную активность.
17. Т101 может быть использован в методе идентификации клеток тимуса. Т101 может служить также тимусным маркером и показателем метаболического состояния тимуса. Так, например, Т101 может быть использован в ELISA-анализах или в других анализах для измерения метаболического состояния тимуса.
18. Т101 может быть использован в качестве средства для проявления флуоресцентного красителя в целях выявления специфических субпопуляций лейкоцитов для выделения различных субпопуляций лейкоцитов из различных тканей.
19. Т101 может служить в качестве общего стимулятора или ингибитора различных иммунных реакций и может также непосредственно или опосредованно влиять на другие органы, такие как сердце, легкие и т.п.
20. Т101 может быть использован для модуляции функций нервной системы, таких как память и регенерация нервной системы, а также для ослабления боли и лечения патологических состояний нервной системы, таких как болезнь Паркинсона и болезнь Альцгеймера.
21. Т101 может служить в качестве зонда для идентификации специфических клеток иммунной системы и их использования для клеточной терапии.
Для вышеуказанных диагностических и терапевтических целей могут быть также использованы полноразмерный пептид Т101, неполный пептид Т101, Т101-содержащий белок или модифицированный пептид Т101.
Краткое описание графического материала
Для лучшего понимания настоящего изобретения и для облегчения его осуществления ниже будут описаны результаты экспериментов, проводимых в соответствии с настоящим изобретением, со ссылками на прилагаемый графический материал, где:
На фиг.1 представлена полноразмерная последовательность кДНК Т101 и кодируемый ею полноразмерный пептид Т101.  Полноразмерный Полноразмерный пептид Т101 состоит из сигнального пептида (показанного обычным шрифтом) и пептида Т101 (показанного жирным шрифтом). Аналогичным образом показана кДНК, кодирующая сигнальный пептид. пептид Т101 состоит из сигнального пептида (показанного обычным шрифтом) и пептида Т101 (показанного жирным шрифтом). Аналогичным образом показана кДНК, кодирующая сигнальный пептид.
На фиг.2 представлена фотография ПЦР-геля, иллюстрирующего пептид Т101. Этот гель содержал 12 столбцов и был подвергнут электрофорезу с двумя массивами образцов: один массив находился в верхней части геля, а другой массив находился в середине геля (показано линиями с обеих сторон геля).
На фиг.3 графически показано включение BrdU в человеческие ЛПК, которые были инкубированы с пептидом Т101, по сравнению с контролем. По оси Y отложена оптическая плотность при 450 нм, где более высокое значение OD означает более высокий уровень включения BrdU.
На фиг.4 графически показано включение BrdU в тимоциты мышей Balb/с, которые были инкубированы с пептидом Т101, по сравнению с контролем. На оси Y отложена оптическая плотность при 450 нм, где более высокое значение OD означает более высокий уровень включения BrdU.
На фиг.5 представлена флуоресцентная микрофотография лимфоцитов после инкубирования с биотинилированным пептидом Т101.
На фиг.6 представлена гистограмма, иллюстрирующая результаты эксперимента, в котором проводили мечение мышиных спленоцитов пептидом bT101 и/или CD25 с помощью антигена CD25. На оси Y даны % меченых клеток.
На фиг.7 представлена гистограмма, где указано число клеток на микролитр, относящихся к различным популяциям человеческих лейкоцитов, а именно моноцитов (MONO), лимфоцитов (LYM) и целых лейкоцитов (WBC), после инкубации этих клеток либо в физиологическом растворе, содержащем пептид Т101 (Т101), либо только в физиологическом растворе (физиологический раствор). Число моноцитов делили на 1000 для включения всех результатов в один график.
На фиг.8 представлена гистограмма, где указано число клеток на микролитр, относящихся к человеческим эритроцитам, после инкубации этих клеток либо в физиологическом растворе, содержащем пептид Т101 (Т101), либо только в физиологическом растворе (физиологический раствор).
На фиг.9 представлена гистограмма, где указано число клеток, относящихся к различным популяциям клеток крови мышей Balb/С: моноцитов (MONO), лимфоцитов (LYM), нейтрофилов (Neut), эритроцитов (RBC) и целых лейкоцитов (WBC), после обработки животных либо пептидом Т101, либо физиологическим раствором (контроль).
На фиг.10 представлена гистограмма, где указано число CD4- и CD8-клеток среди лимфоцитов селезенки мышей Balb/С, после инъекции животным либо Т101-содержащего физиологического раствора, либо только физиологического раствора. На оси Y даны % лейкоцитов.
На фиг.11 представлена гистограмма, иллюстрирующая уровни IL-10 у мышей, которым был инъецирован Т101 в физиологическом растворе, по сравнению с контрольными мышами, которым инъецировали одну дозу физиологического раствора через день. Мышам одной экспериментальной группы инъецировали пептид Т101 один раз через день (анализ  1), мышам второй группы инъецировали этот пептид один раз в день ежедневно (анализ 1), мышам второй группы инъецировали этот пептид один раз в день ежедневно (анализ  2), а мышам третьей группы инъецировали этот пептид ежедневно два раза в день (анализ 2), а мышам третьей группы инъецировали этот пептид ежедневно два раза в день (анализ  3). 3).
На фиг.12 представлена гистограмма, иллюстрирующая увеличение размера опухоли у мышей Balb/C, у которых было индуцировано развитие карциномы молочной железы и которые были обработаны либо физиологическим раствором, содержащим пептид Т101, либо только физиологическим раствором.
На фиг.13 представлен график, иллюстрирующий скорость роста (в %) опухоли, показанного на фиг.12.
На фиг.14 представлена гистограмма, где указана длина толстой кишки у мышей, которые получали DSS с питьевой водой и которые затем подвергались обработке. Были протестированы четыре группы животных: одной группе мышей не вводили DSS, и мышей этой группы не подвергали лечению (контроль); второй группе мышей вводили DSS с питьевой водой и инъецировали физиологический раствор (DSS); остальным двум группам мышей вводили DSS с питьевой водой и инъецировали физиологический раствор, содержащий 52 и 13 микрограммов/мл (DSS + BTL1 и DSS + BTL2 соответственно).
На фиг.15 представлена гистограмма, где показана масса тела мышей, описанных на фиг.14, которым в конце эксперимента вводили DSS (конец), по сравнению с массой тела мышей в начале эксперимента (начало).
ПРИМЕРЫ
Пример 1
Аминокислотная и нуклеотидная последовательности полноразмерного пептида Т101 представлены на фиг.1. Аминокислотную последовательность анализировали методом Phobius, идентифицирующим сигнальные пептиды (описанным на сайте www.phobius.cgb.ki.se) и используемым в целях предсказания трансмембранной топологии и последовательности сигнального пептида.
Методом Phobius была предсказана С-концевая последовательность полноразмерного пептида Т101, состоящая из 33 аминокислот и представляющая собой гидрофобный трансмембранный домен сигнального пептида. Этот сигнальный пептид показан на фиг.1 обычным шрифтом.
Кроме того, с использованием стандартных средств биоинформатики было обнаружено, что состоящая из 24 аминокислот подпоследовательность SEQ ID NO:4,
SKRVSDKQLISKAVWWTFFLPSTL (SEQ ID NO:12)
имеет близкое сходство с нижеследующими последовательностями, происходящими от млекопитающих других видов, а именно:
от собак: SKQVSDKQLISKAVQRIFFFLQPS (SEQ ID NO:13) и
от крыс: SKFMSDKQLISKAVQRIFFLSSTL (SEQ ID NO:14).
При сравнении последовательностей SEQ ID NO:12-14 была выявлена нижеследующая консенсусная последовательность аминокислотных остатков в этих пептидах (консенсусные аминокислоты показаны заглавными буквами):
SKrvSDKQLISKAVwwtFFLpSTL (SEQ ID NO:12)
SKqvSDKQLISKAVQRIFFflqps (SEQ ID NO:13)
SKfmSDKQLISKAVQRIFFLsSTL (SEQ ID NO:14)
Пример 2
Библиотеки кДНК, выделенные из 16 различных тканей, использовали для скрининга на пептид Т101. Эти библиотеки, закупленные у Clontech, включали библиотеки, выделенные из лейкоцитов, яичек, толстой кишки, предстательной железы, тонкой кишки, тимуса, яичника, селезенки, печени, почек, головного мозга, легких, поджелудочной железы, скелета, плаценты и сердца.
Библиотеки кДНК скринировали с помощью ПЦР с использованием специфических олигонуклеотидов для Т101. Последовательности олигонуклеотидов были выведены из последовательности Т101.
В ПЦР-эксперименте использовали 3 микролитра каждой из библиотек кДНК, 5 микролитров специфических олигонуклеотидов (всего), 20 микролитров полимеразы Readymix Taq и 17 микролитров DDW.
Процедура ПЦР была проведена следующим образом:
– 1 минута при 95°С;
– 30 циклов:
1 минута при 95°С,
1 минута при 52°С,
1 минута при 72°С.
После завершения циклов образцы выдерживали при 72°С в течение 10 минут.
Используемые олигонуклеотиды имели следующие последовательности:
(i) OLIGO  5-метка: H10(180)E1P 5-метка: H10(180)E1P
5′-atggcactcagaagccaggg-3′ (SEQ ID NO:19)
(ii) OLIGO  6-метка: H10(180)E1C 6-метка: H10(180)E1C
5′-cactcgcttggaatcggatt-3′ (SEQ ID NO:20)
Результаты ПЦР представлены на фиг.2. Агарозный гель, показанный на фиг.2, содержал 12 столбцов и был подвергнут электрофорезу с двумя массивами образцов: первый массив находился в верхней части геля, а второй массив находился в середине геля (показано линиями с обеих сторон геля). В столбцах первого массива находились следующие образцы: 1 и 12 – маркеры МW (молекулярные массы показаны с правой стороны геля); 2 – гормон роста; 3 – лейкоциты; 4 – яички; 5 – толстая кишка; 6 – предстательная железа; 7 – тонкая кишка; 8 – тимус; 9 – яичник; 10 – селезенка; 11 – печень. В столбцах второго массива находились следующие образцы: 1 – маркер МW; 2 – почки; 3 – головной мозг; 4 – легкие; 5 – поджелудочная железа; 6 – скелетная мышца; 7 – плацента; 8 – сердце.
Как можно видеть на геле, было обнаружено, что специфическая последовательность Т101 присутствует только в ткани тимуса и отсутствует во всех остальных протестированных тканях. Было также обнаружено, что гормон роста, используемый здесь в качестве позитивного контроля, давал положительный результат на Т101.
Пример 3
Пептид Т101 тестировали на его способность к активации пролиферации мышиных спленоцитов или тимоцитов (были использованы два мышиных штамма: CD1 и Balb/C), а также человеческих лимфоцитов периферической крови (ЛПК). Активность пролиферации измеряли по включению в эти клетки 5-бром-2′-дезоксиуридина (BrdU).
Метод
Мышиные спленоциты или тимоциты выделяли из селезенки или тимуса мышей Balb/C. Эти спленоциты высевали в 96-луночные планшеты при концентрации 107 клеток/лунку. При этом использовали среду RPMI 1640 + 10% FCS и Pen/Str. Эти клетки обрабатывали различными концентрациями пептида Т101 (0,1 или 0,01 мкг/лунку) или физиологическим раствором (контроль), и через 48 часов эти клетки метили BrdU в течение 6 часов, а затем тестировали на включение BrdU в их ядра.
Человеческие ЛПК выделяли на градиенте фиколла из крови, взятой у волонтеров, а затем высевали на 96-луночные планшеты также с использованием среды RPMI 1640 + 10% FCS + Pen/Str.
Полученные клетки обрабатывали различными концентрациями пептида или физиологическим раствором (как указано выше), и через 48 часов эти клетки метили BrdU в течение 6 часов, а затем тестировали на включение BrdU в их ядра.
Результаты
Как показано на фиг.3 и 4, соответственно в человеческих ЛПК и в тимоцитах Balb/c Т101 обнаруживал способность увеличивать уровни включения BrdU, что означает, что Т101 способен индуцировать увеличение скорости пролиферации клеток.
Пример 4
В следующем эксперименте были сконструированы и синтезированы несколько делеционных мутантов пептида Т101. Эти мутанты были протестированы на их способность стимулировать пролиферацию человеческих ЛПК. Правый столбец указывает на кратность увеличения уровня пролиферации по сравнению с пролиферацией необработанных клеток.
Исходя из вышеприведенных результатов, были сделаны следующие выводы:
1. Мутант  1 состоит из 13 N-концевых аминокислот пептида Т101 и является очень активным. Очевидно, что эта последовательность (или ее часть) играет важную роль в измеренной активности, стимулирующей пролиферацию. 1 состоит из 13 N-концевых аминокислот пептида Т101 и является очень активным. Очевидно, что эта последовательность (или ее часть) играет важную роль в измеренной активности, стимулирующей пролиферацию.
2. Мутант  2 состоит из 23 аминокислот, расположенных выше мутанта 2 состоит из 23 аминокислот, расположенных выше мутанта  1, и имеет относительно низкую активность. Очевидно, что эта часть пептида Т101 играет менее важную роль в указанной биологической активности. 1, и имеет относительно низкую активность. Очевидно, что эта часть пептида Т101 играет менее важную роль в указанной биологической активности.
3. Мутант  3 состоит из 23 N-концевых аминокислот пептида Т101 и по сравнению с мутантом 3 состоит из 23 N-концевых аминокислот пептида Т101 и по сравнению с мутантом  2 является очень активным. Таким образом, можно отметить, что некоторые части пептида Т101 играют более важную роль в стимулирующей активности по сравнению с другими частями. 2 является очень активным. Таким образом, можно отметить, что некоторые части пептида Т101 играют более важную роль в стимулирующей активности по сравнению с другими частями.
4. Мутант  4 состоит из 8 N-концевых аминокислот пептида Т101 и почти не обладает активностью. Это указывает на то, что в активности данного пептида решающую роль играют пять С-концевых аминокислот мутанта 4 состоит из 8 N-концевых аминокислот пептида Т101 и почти не обладает активностью. Это указывает на то, что в активности данного пептида решающую роль играют пять С-концевых аминокислот мутанта  1. 1.
5. Мутант  5 состоит из 13 аминокислот, которые частично перекрываются с аминокислотами мутанта 5 состоит из 13 аминокислот, которые частично перекрываются с аминокислотами мутанта  1. Он имеет активность, аналогичную активности пептида Т101, но его активность меньше активности мутанта 1. Он имеет активность, аналогичную активности пептида Т101, но его активность меньше активности мутанта  1. 1.
6. Мутант  6 состоит из аминокислотной последовательности мутанта 6 состоит из аминокислотной последовательности мутанта  5, расположенной в обратном порядке. Неожиданно было обнаружено, что его активность аналогична активности мутанта 5, расположенной в обратном порядке. Неожиданно было обнаружено, что его активность аналогична активности мутанта  5. 5.
Таким образом, очевидно, что для осуществления активности, стимулирующей пролиферацию, не требуется вся аминокислотная последовательность пептида Т101.
Пример 5
Был синтезирован биотинилированный пептид Т101 и был определен уровень его связывания с человеческими ЛПК под флуоресцентным микроскопом.
Метод
Биотинилированный пептид Т101 в различных концентрациях добавляли к 106 клеток/пробирку (человеческие ЛПК). Был также использован контроль, не содержащий пептида Т101. В следующей стадии добавляли флуоресцентное антитело против биотина при концентрациях насыщения, и клетки 3 раза промывали PBS. Затем эти клетки наблюдали под флуоресцентным микроскопом.
Результаты
Результаты, представленные на фиг.5, показали, что антитело против биотина связывалось с клетками, обработанными биотинилированным Т101. Было обнаружено, что увеличение концентрации биотинилированного пептида Т101 приводило к повышению интенсивности флуоресценции (результаты FACS не приводятся). Если биотинилированный пептид Т101 был сначала связан с антителом, а затем этот конъюгат был инкубирован с клетками, то флуоресценция не детектировалась. Контрольные клетки также не обнаруживали флуоресценции (на этой фигуре результаты не приводятся).
В большинстве случаев клетки, меченные биотинилированным пептидом Т101, образовывали агрегаты.
Этот эксперимент со всей очевидностью показал, что пептид Т101 может связываться с человеческими ЛПК. Поскольку антитело не может проникать в клетки, а клетки, немеченые Т101, также не были помечены антителом против биотина, то можно сделать вывод, что меченными были только клетки, внешняя поверхность которых связывалась с Т101.
Аналогичные результаты были получены с использованием мышиных спленоцитов.
Пример 6
Для того, чтобы определить, какая субпопуляция лимфоцитов связывается с пептидом Т101, был проведен FACS-анализ с использованием мышиных клеток селезенки или тимуса. В этом анализе использовали несколько антител: (1) антитело против мышиного CD3, (2) антитело против мышиного CD4, (3) антитело против мышиного CD8 и (4) антитело против мышиного CD25.
Метод
106 спленоцитов метили биотинилированным пептидом Т101, ФЭ-стрептавидином и ФИТЦ-конъюгированным антителом против мышиного CD25. Для каждого антитела в качестве контроля использовали антитело того же изотипа.
Результаты
Результаты FACS-анализа представлены на фиг.6 (на оси Y даны проценты меченых клеток). Исходя из этих результатов, могут быть сделаны следующие выводы:
(1) Добавление биотинилированного пептида Т101 приводит к появлению крупных флуоресцирующих клеток, тогда как в контрольном эксперименте такие клетки не детектировались (результаты не приводятся).
(2) Все CD25+-клетки были также помечены биотинилированным пептидом.
(3) Часть CD3+-, CD4+– и CD8+-клеток была помечена биотинилированным пептидом (результаты не приводятся).
Пептид Т101 связывается с CD25+-клетками, с CD4+-клетками и CD8+-клетками. CD25+-клетками также, вероятно, являются CD4+-клетки и CD8+-клетки. Таким образом, пептид Т101 связывается с клетками, регулирующими иммунный ответ.
Пример 7
Данный эксперимент был проведен для того, чтобы определить, каким образом пептиды Т101 влияют на иммунный ответ у мышей, и для того, чтобы определить, может ли пептид Т101 влиять на любой из компонентов иммунной системы, а именно на уровень клеток различных типов и на соотношение различных субпопуляций.
Метод
50 микрограмм/кг пептида Т101 или физиологического раствора инъецировали (два раза в день в течение 8 дней) 7-8-недельным самкам мышей Balb/C (10 мышей на группу). Затем проводили CDC-анализ крови и определяли процент различных субпопуляций лейкоцитов (WBC) (моноцитов (MONO), лимфоцитов (LYM) и общего числа лейкоцитов (WBC)). В качестве контроля использовали тромбоциты и эритроциты.
Результаты
Как показано на фиг.7, у 7-8-недельных самок мышей Balb/C наблюдалось примерно 30%-ное увеличение общего числа лейкоцитов после инъекции пептида Т101 по сравнению с общим числом лейкоцитов у мышей, которым вводили физиологический раствор. При тестировании субпопуляций лейкоцитов у экспериментальной группы наблюдалось примерно 30%-ное увеличение числа лимфоцитов и моноцитов по сравнению с контрольной группой, которой вводили физиологический раствор.
В качестве контроля также определяли уровни тромбоцитов и эритроцитов (RBC). Было обнаружено, что различие между группами, которым вводили физиологический раствор и пептид Т101, составляло менее 5%, как показано на фиг.8 (результаты для тромбоцитов не приводятся).
Анализ CD4+– и CD8+-популяций не выявил каких-либо значимых различий между группой мышей, обработанных Т101, и группой мышей, обработанных физиологическим раствором (результаты не приводятся).
Этот эксперимент повторяли для 3-4-недельных самок мышей Balb/C (7 мышей на группу). Этим мышам инъецировали 72 микрограмма/кг указанного пептида или физиологического раствора два раза в день. Результаты приводятся на фиг.9.
В этом эксперименте в отличие от описанного выше эксперимента пептид Т101 индуцировал некоторую степень супрессии иммунной системы, наблюдаемой на уровне клеток различных типов. Степень такой супрессии составляла примерно 30%.
Пример 8
Уровень различных субпопуляций лимфоцитов селезенки оценивали у 3-4-недельных самок мышей Balb/C, которым один раз в день инъецировали пептид Т101 (72 микрограмма/кг массы тела). Результаты систематизированы на фиг.10.
Как показано на фиг.10, Т101 способствовал снижению уровней CD4+– и CD8+-клеток в селезенке мышей. В клетках тимуса какого-либо различия в уровнях CD4+– и CD8+-клеток не наблюдалось (результаты не приводятся). В лимфоузлах мышей наблюдалось 35-50%-ное снижение уровней CD4+-клеток, а уровни CD8+-клеток не изменялись (результаты не приводятся).
Пример 9
IL-10 представляет собой интерлейкин, который может подавлять иммунную систему (интерлейкин TH2). Уровень IL-10 оценивали у трех групп, каждая из которых включала по 3 мыши: (1) мышам одной группы инъецировали пептид Т101 два раза в день (анализ  3); (2) мышам второй группы инъецировали такую же концентрацию Т101 один раз в день (анализ 3); (2) мышам второй группы инъецировали такую же концентрацию Т101 один раз в день (анализ  2); (3) мышам третьей группы инъецировали одну дозу указанного пептида через день (анализ 2); (3) мышам третьей группы инъецировали одну дозу указанного пептида через день (анализ  1). Все инъецируемые дозы были одинаковыми (72 микрограмма/кг массы тела). В качестве контроля использовали мышей, которым был инъецирован физиологический раствор (контроль). Результаты представлены на фиг.11. 1). Все инъецируемые дозы были одинаковыми (72 микрограмма/кг массы тела). В качестве контроля использовали мышей, которым был инъецирован физиологический раствор (контроль). Результаты представлены на фиг.11.
Как указывалось выше, у мышей всех групп после введения им пептида Т101 уровень IL-10 повышался. Наилучшая схема введения инъекций предусматривала введение одной дозы через день.
Эти результаты подтвердили эффективность пептида Т101, используемого в качестве супрессора иммунной системы для лечения аутоиммунных заболеваний.
Пример 10
У взрослых мышей Balb/C при введении им более низких концентраций Т101 наблюдалось некоторое увеличение уровней иммунных клеток. Этот эксперимент проводили для того, чтобы определить, будет ли такое увеличение уровней клеток эффективным в иммунотерапии злокачественной опухоли.
Метод
8-недельным мышам Balb/С инъецировали клетки карциномы молочной железы EMT6/CTX и после того, как размер опухоли достигал 4 мм2, мышам два раза в день в течение 8 дней инъецировали пептид Т101 (50 микрограмм/кг). Размер опухоли измеряли через день, а также по окончании эксперимента.
Результаты
Результаты измерения размера опухоли на 14-й день были систематизированы на фиг.12. У мышей, обработанных пептидом Т101, размер опухоли увеличивался в 4,3 раза по сравнению с размером исходной опухоли до инъекции. У мышей, обработанных физиологическим раствором, размер опухоли увеличивался в 6,7 раза. Таким образом, Т101 способствовал значительному снижению роста опухоли.
Скорость роста опухоли показана на фиг.13. Как можно видеть, Т101 способен значительно снижать скорость роста опухоли.
Патологические исследования этих опухолей показали, что у некоторых Т101-обработанных мышей наблюдалось значительное увеличение числа лимфоциитов и нейтрофилов в опухоли по сравнению с контролем (результаты на приводятся).
Эти результаты показали, что Т101 может быть использован в качестве терапевтического средства для лечения злокачественной опухоли.
Пример 11
Для оценки возможности применения Т101 для лечения аутоиммунных заболеваний использовали мышей с моделью колита/болезни Крона.
8-недельным самкам мышей Balb/c вводили DSS (сульфат декстрана) в питьевой воде (5%) в течение 14 дней. В этот период времени мышам инъецировали физиологический раствор или физиологический раствор, содержащий Т101, как описано ниже. Затем проводили мониторинг содержания крови в фекалиях, массы тела и состава фекалий. В конце эксперимента мышей умерщвляли, извлекали толстую кишку и измеряли ее длину.
Мышей разделяли на 4 группы, по 3 мыши на группу:
Группа  1 – контрольные мыши, которым давали обычную питьевую воду (без DSS) и которых не подвергали обработке. 1 – контрольные мыши, которым давали обычную питьевую воду (без DSS) и которых не подвергали обработке.
Группа  2 – DSS-мыши, которым давали питьевую воду, содержащую 5% DSS, и инъецировали физиологический раствор. 2 – DSS-мыши, которым давали питьевую воду, содержащую 5% DSS, и инъецировали физиологический раствор.
Группа  3 – DSS+BTL1-мыши, которым давали питьевую воду, содержащую 5% DSS, и которым один раз в каждые 3 дня инъецировали Т101 (в дозе 52 микрограмма Т101 на 1 кг массы тела). 3 – DSS+BTL1-мыши, которым давали питьевую воду, содержащую 5% DSS, и которым один раз в каждые 3 дня инъецировали Т101 (в дозе 52 микрограмма Т101 на 1 кг массы тела).
Группа  4 – DSS+BTL2-мыши, которым давали питьевую воду, содержащую 5% DSS, и которым один раз в каждые 3 дня инъецировали Т101 (в дозе 13 микрограмм Т101 на 1 кг массы тела). 4 – DSS+BTL2-мыши, которым давали питьевую воду, содержащую 5% DSS, и которым один раз в каждые 3 дня инъецировали Т101 (в дозе 13 микрограмм Т101 на 1 кг массы тела).
Результаты систематизированы на фиг.14 и 15. Очевидно, что пептид Т101 обладает сильной активностью, направленной на ослабление симптомов заболевания у этих животных, по сравнению с мышами, которым вводили DSS и только физиологический раствор.
Эти результаты показали, что пептид Т101 может служить в качестве иммуносупрессора для лечения аутоиммунных заболеваний, таких как колит/болезнь Крона.
         
Формула изобретения
1. Выделенный полипептид, способный стимулировать пролиферацию лимфоцитов периферической крови (ЛПК) человека, ингибировать рост опухоли и/или модулировать иммунную систему для лечения аутоиммунных заболеваний и/или воспалительных заболеваний, где полипептид представляет собой пептид Т101 с аминокислотной последовательностью SEQ ID NO:4.
2. Выделенный полипептид, представляющий собой фрагмент выделенного пептида Т101 по п.1, где фрагмент имеет такой же вид активности, и полипептид состоит из аминокислот 29-51 указанного пептида Т101 и имеет аминокислотную последовательность, представленную в SEQ ID NO:7.
3. Выделенный полипептид, представляющий собой фрагмент выделенного пептида Т101 по п.1, где фрагмент имеет такой же вид активности, и полипептид состоит из аминокислот 39-51 указанного пептида Т101 и имеет аминокислотную последовательность, представленную в SEQ ID NO:5.
4. Выделенный полипептид, представляющий собой фрагмент выделенного пептида Т101 по п.1, где фрагмент имеет такой же вид активности, и полипептид состоит из аминокислот 44-51 указанного пептида Т 101 и имеет аминокислотную последовательность, представленную в SEQ ID NO:8.
5. Выделенный полипептид, представляющий собой фрагмент выделенного пептида Т101 по п.1, где фрагмент имеет такой же вид активности, и полипептид состоит из аминокислот 36-48 указанного пептида Т101 и имеет аминокислотную последовательность, представленную в SEQ ID NO:9.
6. Выделенный полипептид, представляющий собой фрагмент выделенного пептида Т101 по п.1, где фрагмент имеет такой же вид активности, и полипептид состоит из аминокислот 24-47 указанного пептида Т101 и имеет аминокислотную последовательность, представленную в SEQ ID NO:12.
7. Выделенный полипептид, который представляет собой производное выделенного полипептида по любому из пп.1-6 и имеет такой же вид активности, в котором от 1 до 3 аминокислотных остатков заменены другим аминокислотным остатком путем консервативной замены.
8. Выделенный полипептид, который представляет собой производное выделенного полипептида по любому из пп.1-7 и имеет такой же вид активности, в котором одна или более аминокислот заменены соответствующей D-аминокислотой.
9. Фармацевтическая композиция, стимулирующая пролиферацию лимфоцитов периферической крови (ЛПК) человека, ингибирующая рост опухоли и/или модулирующая иммунную систему, предназначенная для лечения аутоиммунных заболеваний и/или воспалительных заболеваний, содержащая выделенный полипептид по любому из пп.1-8 в качестве активного агента.
10. Применение полипептида по любому из пп.1-8 в качестве активного агента фармацевтической композиции, стимулирующей пролиферацию лимфоцитов периферической крови (ЛПК) человека, ингибирующей рост опухоли и/или модулирующей иммунную систему, для лечения аутоиммунных заболеваний и/или воспалительных заболеваний.
РИСУНКИ
|