Патент на изобретение №2398774
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ 3′-ЙОДФОЛИЕВОЙ И 3′-БРОМФОЛИЕВОЙ КИСЛОТ, МЕЧЕННЫХ РАДИОАКТИВНЫМИ ИЗОТОПАМИ ЙОДА ИЛИ БРОМА
(57) Реферат:
Изобретение относится к новому способу получения новых 3′-иодфолиевой и 3′-бромфолиевой кислот, меченных радиоактивными изотопами йода или брома, которые могут найти применение для медицинской диагностики и радиотерапии. Способ заключается в том, что к водному раствору щелочной соли фолиевой кислоты, добавляют источник радиоактивного йода или радиоактивного брома, так чтобы pH этого раствора был около 7, с получением раствора, содержащего фолиевую кислоту и йодид-иона или бромид-иона. Затем понижают pH этого раствора до 3,5-4,9, добавляя к вышеуказанному раствору окислитель из группы N-хлорсульфамидов кислот в буферном растворе. Преимущественно в качестве окислителя используют хлорамин Т, либо хлорамин В. Отличием данной методики от ранее известных способов является то, что изотопную метку в фолиевую кислоту вводят через радикалы. 1 з.п. ф-лы.
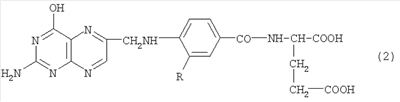
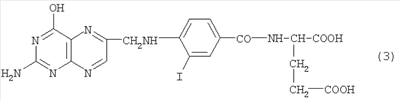
Изобретение относится к области биохимии и радиохимии. Фолиевая кислота относится к классу витаминов группы В. Фолиевая кислота и ее производные, такие как аминоптерин и метотрексат, эффективно поглощаются некоторыми типами раковых опухолей. Это делает возможным применение фолиевой кислоты и ее производных, меченных радиоактивными изотопами, для целей медицинской диагностики и радиотерапии. Поскольку фолиевая кислота в организме человека содержится в очень малых количествах (концентрация в плазме крови составляет сотые доли микромоля в литре), то приготовленные препараты должны обладать высокой удельной радиоактивностью, а метод синтеза должен быть приемлем для работы с короткоживущими изотопами, такими как йод-121 или бром-75 с периодом полураспада около 2 часов. Эти изотопы в последнее время находят все более широкое применение в позитронно-эмиссионной томографии, так как являются позитронными излучателями. В литературе описаны способы получения меченных йодом различных производных, исходя из растворов соединения, которое следует пометить, с применением радиоактивного йода в форме йодид-ионов и хлорамина. Известен способ мечения биологических соединений, описанный в работе [1.]: F.С.Greenwood & W.M.Hunter, Biochem. J. (1963) 89, 114. Реакция проводится при pH 7.5 Однако этот способ в случае применения для мечения йодом фолиевой кислоты дает очень малые выходы по радиоактивности (менее 1%). Чтобы обойти проявленную инертность фолиевой кислоты в этой реакции, патентовались способы, в которых к глютаминовому остатку фолиевой кислоты присоединялись легко йодируемые тирозин или гистидин. Известен способ получения производных фолиевой кислоты, меченных йодом, описанный в работе [2]: US Patent Способ, описанный в US Patente Недостатком является то, что при этом образуется не фолиевая кислота, меченная йодом, а производное фолиевой кислоты, меченное йодом, которое существенно отличается от фолиевой кислоты по структуре, распределению зарядов, наличием дополнительных гидрофобных групп. Это может изменить условия его транспорта в клетке по сравнению с природной фолиевой кислотой. Известно, например, что если вместо гистидина или тирозина стоит еще один остаток глютаминовой кислоты, то такое производное фолиевой кислоты в клетку не проникает несмотря на то, что молекула глютаминовой кислоты занимает меньший объем, чем молекула гистидина или тирозина. В связи со сказанным представляется перспективным метод, позволяющий метить изотопами йода и брома саму фолиевую кислоту, а не продукты ее присоединения к другим легко йодируемым молекулам, т.е. метод, позволяющий получать соединения, соответствующие формуле (2), где бром или йод занимает положение R. Причем этот метод должен быть пригоден для работы с количествами йода или брома, меньшими микрограмма. В литературе описан способ мечения изотопом I131 соединения, близкого по структуре к фолиевой кислоте, -аминоптерина [4]: D.G.Johus et al J. Nuclear Med., v.9, К раствору 10 MCi NaI131 в 0.4 мл сульфата натрия были добавлены при перемешивании следующие реагенты в указанном порядке: порошок аминоптерина (20 мг); йодная кислота – 4.5 мг; йод – 7.5 мг; диметилформамид – 0.5 мл; и четыреххлористый углерод – 0.1 мл. Сосуд закрыли и перемешивали в течение 18 часов. Затем реакционная смесь была разделена на колонке с ДЕАЕ-целлюлозой. Однако способ дает малый выход – (4÷10%), низкую удельную активность (в приведенной публикации в нескольких экспериментах был получен разброс 50-300 микрокюри на микромоль), образование большого количества загрязняющих примесей, в том числе радиоактивных, и длительность процедуры синтеза (18 часов). Этот способ близок к заявляемому по тому факту, что метят непосредственно соединение, которое близко по структурной формуле, а не его производное. Заявляемый объект относится к способу мечения изотопами йода или брома непосредственно фолиевой кислоты. В патентной и научно-технической литературе мы не обнаружили способов мечения фолиевой кислоты, поэтому прототип отсутствует. Мы заявляем способ получения 3′-йодфолиевой и 3′-бромфолиевой кислот, меченных радиоактивными изотопами йода и брома, заключающийся в том, что готовят исходный раствор, содержащий фолиевую кислоту, радиоактивный йод или радиоактивный бром в виде йодид-иона или бромид-иона при pH 7, добавляют к исходному раствору подкисленный раствор окислителя из группы хлорированных амидов кислот, доводят pH раствора до 3.5÷4.9, оптимально до 4.7, переводя фолиевую кислоту в гель. Выделение целевого продукта осуществляют методом обращено-фазной хроматографии. В качестве окислителя используют хлорамин Т, либо хлорамин В. Наши исследования показали, что причиной неудачи при попытке мечения самой фолиевой кислоты по способам [1] является медленность реакции фолиевой кислоты с йодноватистой кислотой HIO, которая в способах [1] является действующим агентом и образуется при реакции йодид-иона с хлорамином. Из-за медленности реакции HIO с фолиевой кислотой, преобладающими в системе реакциями становятся диспропорционирование HIO и ее окисление избытком хлорамина, приводящие к радикальному снижению выхода целевого продукта и росту выхода побочных продуктов. Проведение реакции в условиях, способствующих образованию катионов I+ и Br+, позволило нам разработать эффективный вариант синтеза йодфолиевой и бромфолиевой кислот, меченных изотопами йода и брома. Сущность предлагаемого нами способа состоит в том, чтобы в реакции йодирования с использованием окислителей типа хлорамина, которая во всех патентах проводится при pH выше 7, перейти к проведению реакции при pH значительно более низком. Однако если проводить реакцию в условиях, в которых проводится синтез относительно больших количеств немеченой йодфолиевой кислоты, описанных в патентах [5] – US Patent 2570391 (1951); [6] US Patent 2570392 (1951), где фолиевая кислота находится в растворе 5М HCl при низком pH, то, как показали наши эксперименты, большая часть (окислителя) хлорамина расходуется на образование 3′-хлорфолиевой и 3′,5′-дихлорфолиевой кислот. Причем последняя не может быть отделена от целевого продукта обращенно-фазной хроматографией, которая используется для разделения в предлагаемом нами способе. Нами было найдено значение pH в интервале 3,5-4,9, при котором одновременно удовлетворяются условия малого времени реакции (что важно для работы с короткоживущими изотопами), больших выходов и пренебрежимо малых выходов 3′,5′-дихлорфолиевой кислоты. Сложность состоит в том, что при таких pH фолиевая кислота очень малорастворима. Поэтому в заявляемом способе подготовительные (исходные) растворы имеют pH около 7, и только одновременно с началом рекции pH понижают до 4.7. При этом фолиевая кислота переходит в гель тогда, когда все реагенты уже добавлены. В геле некоторое время сохраняется реакционноспособность фолиевой кислоты, достаточная для прохождения целевой реакции до конца. Если pH ниже 3, 5, то резко увеличивается доля 3′,5′-дихлорфолиевой кислоты, которая загрязняет целевой продукт и практически неотделима методом обращенно-фазной хроматографии; если pH выше 4,9, значительно уменьшается выход целевого продукта. Пример 1. Раствор 0.1 М натриевой соли фолиевой кислоты готовят путем растворения 480 мг фолиевой кислоты, предварительно очищенной путем перекристаллизации, в 8 мл 0.28 М раствора едкого натра. Затем pH раствора доводят до 7 путем добавления примерно 1.2 мл 0.1 М раствора серной кислоты порциями с энергичным перемешиванием так, чтобы образующийся в месте прибавления кислоты гель тут же растворялся. Далее объем доводят до 10 мл водой и этот раствор используют для приготовления раствора необходимой концентрации. В пробирку приливают 30 мкл 5×10-2 М натриевой соли фолиевой кислоты, 10 мкл 5×10-4 М KI и 50 мкл раствора NaI, содержащего 2 mCi йода-125 без носителя в 10-3 М NaOH (раствор А)-исходный раствор. После этого отдельно готовят раствор Б. Для этого последовательно добавляют 0.3 мл воды +10 мкл 0.1 М раствора хлорамина Т (предварительно очищенного от примеси дихлорамина путем экстракции четыреххлористым углеродом) +0.4 мл ацетатного буфера (0.8 М по уксусной кислоте и 0.4 М по ацетату натрия). 30 мкл раствора Б добавляют к раствору А, быстро перемешивают. В течение нескольких секунд образуется гель. Выдержав смесь в течение 30 секунд, добавляют 100 мкл раствора 1 М по гидрофосфату калия и 7×10-3 М по сульфиту натрия для растворения геля и удаления избытка окислителя, перемешивают. Далее добавляют 1 мл воды. Полученный раствор вводят в HPLC-колонку 150×8 мм с сорбентом С-18 с размером зерен 5 микрон, предварительно уравновешенную буферным раствором: 0.05 М по NaH2PO4 и 0.05 М по Na2HPO4. После внесения раствора в колонку ее промывают 15 мл уравновешивающего буфера, затем подают элюент, состоящий из этого же буфера, к которому было добавлено 4.5% (объемных) ацетонитрила. Расход элюента 2.4 мл/мин. Измеряют оптическую плотность раствора, прошедшего через колонку на длине волны 260 нм. Время выхода пика 3′-йодфолиевой кислоты предварительно определяют с использованием немеченой 3′-йодфолиевой кислоты. В эксперименте оно составило 25 минут. Целевой продукт, вышедший в этом пике, собирают в объеме 5 мл, далее выпаривают до объема 3 мл, при этом весь ацетонитрил испаряется. Полученный раствор содержал 70% от всей введенной в реакцию радиоактивности. Удельная активность препарата составила 300 миллиСi/мкМ. В контрольном эксперименте вместо раствора KI и раствора NaI125 добавлена вода. Полученный на хроматографе пик 3′,5′-дихлорфолиевой кислоты по площади был в двести раз меньше, чем пик от 3′-йодфолиевой кислоты, полученной в примере 1. Пример 2. В пробирку приливают 30 мкл 0.05 М раствора натриевой соли фолиевой кислоты (приготовленного как в примере 1) и 60 мкл 0.0012 М раствора бромида калия, содержащего 0.04 мСi Br-82 (раствор AI – исходный раствор). После этого отдельно готовят раствор БI. Для чего последовательно добавляют 0.3 мл воды +30 мкл 0.1 М раствора хлорамина Т (предварительно очищенного от примеси дихлорамина путем экстракции четыреххлористым углеродом) + 0.4 мл ацетатного буфера (0.8 М по уксусной кислоте и 0.4 М по ацетату натрия). Затем добавляют 30 мкл раствора БI к раствору AI. Последующая обработка растворов и выделение целевого продукта производятся так же, как в примере 1. Время выхождения 3′-бромфолиевой кислоты предварительно определяют по немеченому препарату. Пик меченой 3′-бромфолиевой кислоты содержал 50% от всей исходной активности. Удельная активность препарата составила 350 микроСi/мкМ. Предложенный способ может применяться как с изотопным разбавлением, так и без него. В последнем случае в реакционную смесь вместо раствора нерадиоактивного изотопа йода или брома следует добавлять столько же воды. Если же необходимо добавить больше нерадиоактивного изотопа, чем указано в примерах, то следует соответственно увеличить и концентрацию хлорамина и сульфита натрия. Однако концентрацию хлорамина нельзя увеличивать более чем вдвое по сравнению с раствором БI, так как начнется его выпадение в осадок. Если все же необходимо еще больше хлорамина, то следует взять больший объем раствора БI, используя соответственно более разбавленный буфер. Заявляемый способ может найти применение в диагностике и терапии онкологических заболеваний, в биологических исследованиях.
Формула изобретения
1. Способ получения 3′-йодфолиевой и 3′-бромфолиевой кислот, меченных радиоактивными изотопами йода или брома, заключающийся в том, что к водному раствору щелочной соли фолиевой кислоты добавляют источник радиоактивного йода или радиоактивного брома так, чтобы pH этого раствора был около 7, с получением раствора, содержащего фолиевую кислоту и йодид-иона или бромид-иона, а затем понижают pH этого раствора до 3,5-4,9, добавляя к вышеуказанному раствору окислитель из группы N-хлорсульфамидов кислот в буферном растворе. 2. Способ по п.1, отличающийся тем, что в качестве окислителя используют хлорамин Т либо хлорамин В.
|
||||||||||||||||||||||||||

 3989812,; [3] US Patent
3989812,; [3] US Patent 
 -глютамил-тирозина в фосфатном буфере (0.05 М, pH 7.4) и 20 мкл свежеприготовленного раствора хлорамина Т в 0.05 М фосфатном буфере pH 7.4 (5 мг/мл). Через 15 секунд добавлено 20 мкл раствора метабисульфита натрия в 0.05 М фосфатном буфере pH 7.4. Реакционная смесь разделена на колонке BioGel-P2, а затем на ДЕАЕ ионообменной колонке.
-глютамил-тирозина в фосфатном буфере (0.05 М, pH 7.4) и 20 мкл свежеприготовленного раствора хлорамина Т в 0.05 М фосфатном буфере pH 7.4 (5 мг/мл). Через 15 секунд добавлено 20 мкл раствора метабисульфита натрия в 0.05 М фосфатном буфере pH 7.4. Реакционная смесь разделена на колонке BioGel-P2, а затем на ДЕАЕ ионообменной колонке.