|
|
(21), (22) Заявка: 2009104112/04, 06.03.2001
(24) Дата начала отсчета срока действия патента:
06.03.2001
(30) Конвенционный приоритет:
06.03.2000 US 60/187,289
(46) Опубликовано: 10.09.2010
(56) Список документов, цитированных в отчете о
поиске:
US 4853394 А, 01.08.1989. ЕР 0260070 А1, 16.03.1988. SU 1838299 A3, 30.08.1993.
(62) Номер и дата подачи первоначальной заявки, из которой данная заявка выделена: 2007139896 06.03.2001
Адрес для переписки:
129090, Москва, ул.Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
АНДЕРСОН Карл М. (DK),
КРОСТОН Гленн (US),
ХАНСЕН Е.Л. (DK),
УЛДАМ А.К. (DK)
(73) Патентообладатель(и):
АКАДИА ФАРМАСЬЮТИКАЛЗ, ИНК. (US)
|
(54) АЗАЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ ОПОСРЕДОВАННЫХ СЕРОТОНИНОМ ЗАБОЛЕВАНИЙ
(57) Реферат:
Изобретение относится к новым соединениям формулы (I)
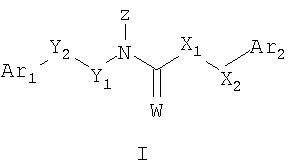
где Z означает

где R означает водород, С4-С6циклоалкильную группу, присоединенную либо через один из атомов углерода кольца, либо через присоединенную к кольцу низшую алкиленовую группу, или линейно-цепочечную или разветвленную низшую алкильную группу или низшую гидроксиалкильную группу, или низшую аминоалкильную группу, или фенил (низшую алкильную) группу, необязательно замещенную 1-2 заместителями, выбранными из низшего алкила, низшего алкокси, галогена и гидрокси, или гетероарил (низшую алкильную) группу, где гетероарил выбран из группы, состоящей из тиенила, замещенного низшей алкильной группой, имидазолила, и тиазолила, замещенного низшей алкильной группой; n означает 0 или 1; или
Z означает группу
где R означает низшую алкильную группу; X1 означает метилен или NH группу; и Х2 означает метилен; или Х1 означает метилен и Х2 означает метилен или связь; или X1 означает метилен и Х2 означает О, S или связь; Y1 означает метилен и Y2 означает метилен, винилен, этилен, или связь; Ar1 означает незамещенный или замещенный фенил; Ar2 означает незамещенный или замещенный фенил, незамещенный или замещенный тиенил, незамещенный или замещенный фурил, незамещенный или замещенный пиридил; причем когда Ar1 и Ar2 замещены, то каждый Ar1 и Ar2 независимо замещены одним или более заместителями, выбранными из низшего алкила, низшего алкокси, гидрокси, низшего гидроксиалкила, галогена, ди- и тригалоалкила, ди- и тригалоалкокси, моно- и диалкиламино, алкилтио, сложного алкилового эфира и нитро; при условии, что Ar1 и Ar2 не означают одновременно незамещенный фенил; W означает кислород или серу; или к их фармацевтически приемлемым солям; при условии, такие, как указано в п.1 формулы изобретения. Изобретение также относится к соединениям, выбранным из группы, к соединениям формулы (I), к фармацевтическим композициям, к способу ингибирования активности моноаминового рецептора, к способу ингибирования активации моноаминового рецептора, к способу лечения болезненного состояния, связанного с серотониновым рецептором, к способу лечения шизофрении, к способу лечения мигрени, а также к способу лечения психоза. Технический результат – получение новых биологически активных соединений, способных ингибировать активность моноаминового рецептора. 11 н. и 54 з.п. ф-лы, 5 табл., 4 ил.
Настоящее изобретение относится к новым соединениям, которые воздействуют на моноаминовые рецепторы, включая рецепторы серотонина. Конкретно настоящее изобретение относится к соединениям, которые активны как обратные агонисты, а в этой связи – как антагонисты в отношении подтипа 5-HT2A-рецепторов серотонина человека. Настоящее изобретение также относится к способам применения соединений согласно изобретению для модуляции явлений, опосредованных 5-HT2A-рецептором, которые могут быть полезными при лечении или облегчении течения болезненных состояний, при которых благоприятное воздействие оказывает модификация активности указанных рецепторов.
Предпосылки создания изобретения
Серотонин или 5-гидрокситриптамин (5-ГТ) играет важную роль в функционировании организма млекопитающих. В центральной нервной системе 5-ГТ является важным нейротрансмиттером и нейромодулятором, принимающим участие в столь разных поведенческих реакциях, как сон, еда, двигательная активность, ощущение боли, обучение и память, а также сексуальное влечение, регуляция температуры тела и давления крови. В позвоночнике серотонин выполняет важную роль по контролю систем афферентных периферических ноцицепторов (Moulignier, Rev. Neurol. 150:3-15, (1994)). 5-ГТ присваивают также периферические функции в сердечно-сосудистой, гематологической и желудочно-кишечной системах. Было показано, что 5-ГТ опосредует множество сократительных, секреторных и электрофизиологических явлений, включая сокращение сосудистых и несосудистых гладких мышц, а также агрегацию тромбоцитов. (Fuller, Biology of Serotonergic Transmissiоn, 1982; Boullin, Serotonin In Mental Abnormalities 1:316 (1978); Barchas, et al., Serotonin and Behavior, (1973)). Подтип рецептора 5HT2A (также называемый подклассом) характеризуется широкой экспрессией в качестве дискретного подтипа в мозге человека, включая различные кортикальные, лимбические участки и участки переднего мозга, что указывает на его участие в модуляции высших познавательных и аффективных функций. Указанный подтип рецептора также экспрессируется на зрелых тромбоцитах, где он в некоторой мере опосредует агрегацию тромбоцитов, одну из начальных стадий процесса сосудистого тромбоза.
В свете широкого распространения серотонина в организме неудивительно, что препараты, которые воздействуют на серотонинергические системы, вызывают очень большой интерес (Gershon, et al., The Peripheral Actions of 5-Hydroxytryptamine, 246 (1989); Saxena, et. al., J. Cardiovascular Pharmacol. 15:Supp.7 (1990)). Рецепторы серотонина входят в состав большого семейства генов человека, кодирующих мембраносвязанные белки, которые функционируют как преобразователи межклеточных сигналов. Они имеются на поверхности клеток разных типов, включая нейроны и тромбоциты, где при их активации под действием либо эндогенного лиганда серотонина либо экзогенно введенных лекарственных средств они меняют свою конформацию и вследствие этого взаимодействуют с медиаторами клеточного сигнала, расположенными ниже по пути передачи клеточного сигнала. Многие из указанных рецепторов, включая подкласс 5-HT2A, относятся к рецепторам, сопряженным с G-белком (GPCR), которые посылают сигнал при активации гуанин-нуклеотидсвязывающих белков (G-белков), что приводит к генерации или ингибированию второй мессенджер-молекулы, такой как циклический АМФ, инозитфосфаты и диацилглицерин. Указанные вторичные мессенджер-молекулы модулируют функцию различных внутриклеточных ферментов, включая киназы и каналы передачи ионов, которые в итоге воздействуют на возбудимость клеток и их функционирование.
Было идентифицировано по меньшей мере 15 генетически различающхся подтипов рецепторов 5ГТ, которым были присвоены названия семейств от одного до семи (5-HT1-7). Каждый подтип характеризуется уникальным распределением, предпочтением к различным лигандам и функционально соотнесен с остальными.
Серотонин может быть важным компонентом в различных типах патологических состояний, таких как некоторые психические заболевания (депрессия, агрессивность, панические атаки, обсессивно-компульсивные расстройства, психоз, шизофрения, суицидальные наклонности), некоторые нейродегенеративные заболевания (деменция типа Альцгеймера, паркинсонизм, хорея Хантингтона), анорексия, булимия, расстройства, связанные с алкоголизмом, церебрально-сосудистые явления и мигрень (Meltzer, Neuropsychopharmacology, 21:106S-115S (1999); Barnes & Sharp, Neuropharmacology, 38:1083-1152 (1999); Glennon, Neurosci. Biobehavioral Rev., 14:35 (1990)). Полученные в последнее время данные являются серьезным подтверждением того, что подтип рецептора 5-HT2 участвует в этиологии таких клинических состояний, как гипертензия, тромбоз, мигрень, сосудистый спазм, ишемия, депрессия, беспокойство, психоз, шизофрения, расстройство сна и расстройство аппетита.
Шизофрения представляет собой особенно разрушительное психоневрологическое заболевание, которое поражает примерно 1% населения. Было подсчитано, что общие финансовые затраты на диагностику, лечение и поддержание социальной активности, в связи с потерей трудоспособности индивидуумов, пораженных указанным заболеванием, превышает 2% от валового национального продукта (ВНП) США. Применяемое в настоящее время лечение прежде всего основано на фармакотерапии лекарствами из класса антипсихотических средств. Антипсихотические средства эффективны в плане ослабления позитивных симптомов (например, галлюцинации и бред), однако зачастую они не способны улучшить негативную симптоматику (например, социальную и эмоциональную обедненность, апатию и скудость речи).
В настоящее время для лечения психотических симптомов выписывают лекарства из девяти основных классов антипсихотичеких средств. Однако использование указанных соединений ограничивается профилем их побочных эффектов. Почти все такие “типичные” соединения или соединения старого поколения препаратов оказывают значительные побочные эффекты на моторную функцию человека. “Экстрапирамидные” побочные реакции, называемые так в связи с их воздействием на модулирующие механизмы моторики человека, могут быть как острыми (например, дистонические реакции; представляющий потенциальную угрозу для жизни, но достаточно редкий, нейролептический злокачественный синдром), так и хроническими (например, акатиаз, тремор и поздняя дискинезия). Усилия специалистов, разрабатывающих лекарственные средства в этом направлении, концентрировались на новых “нетипичных” агентах, свободных от указанных побочных неблагоприятных реакций.
Было показано, что антипсихотические средства взаимодействуют с множеством моноаминэргических рецепторов нейротрансмиттеров центральной нервной системы, включая допаминергические, серотонинергические, адренергические, мускариновые и гистаминергические рецепторы. Вполне вероятно, что терапевтический и побочный эффекты указанных соединений опосредованы природой различных подтипов рецепторов. Высокий уровень генетической и фармакологической гомологии, имеющейся между указанными подтипами рецепторов, затрудняет разработку подтипа селективных соединений, а также определение нормальной физиологической или патофизиологической роли каждого конкретного подтипа рецептора. В этой связи имеется потребность в разработке лекарственных средств, которые были бы селективными для индивидуальных классов и подклассов рецепторов в группе моноаминергических рецепторов трансмиттеров.
Превалирующая в настоящее время теория механизма действия антипсихотических средств основана на антагонизме допамин D2 рецепторов. К сожалению, скорее всего антагонизм допамин D2 рецепторов также опосредует экстрапирамидные побочные эффекты. Антагонизм 5-HT2A представляет собой альтернативный молекулярный механизм действия лекарственных средств с антипсихотической активностью, осуществляемый, скорее всего, через антагонизм повышенной или усиленной сигнальной трансдукции через серотонинергические системы. В этой связи антагонисты 5-HT2A можно рассматривать как вполне вероятный претендент на средство лечения психоза без сопутствующих экстрапирамидных побочных реакций.
Традиционно считалось, что указанные рецепторы находятся в спокойном состояния, если не происходит их активация при связывании агониста (лекарственного средства, которое активирует рецептор). В настоящее время признано, что многие, если не большая часть, моноаминовых рецепторов GPCR, включая рецепторы серотонина, могут существовать в частично активированном состоянии в отсутствие их эндогенных агонистов. Повышенная базовая активность (конститутивная активность) может быть подавлена соединениями, называемыми обратными агонистами. И агонисты и обратные агонисты обладают присущей им активностью в отношении рецептора, в связи с чем они сами по себе могут активировать или инактивировать указанные молекулы соответственно. В отличие от них классические или нейтральные антагонисты конкурируют с агонистами и обратными агонистами за доступ к рецептору, но не обладают присущей им способностью ингибировать повышенные базовые или конститутивные реакции рецептора.
Авторам удалось недавно прояснить важный аспект функционирования 5HT2A-рецептора при использовании методики отбора и амплификации рецептора (патент США 5 707 798, 1998; Chem. Abstr. 128;111548 (1998) и содержащиеся в них ссылки) в исследовании подкласса 5HT2A серотониновых рецепторов. R-SAT представляет собой фенотипическое тестирование рецепторных функций, которое включает в себя гетерологичную экспрессию рецепторов в фибробластах млекопитающих. При использовании указанной методики авторы смогли показать, что нативные 5HT2A-рецепторы обладают значительной конститутивной или агонист-независимой рецепторной активностью (заявка на патент США, серийный номер 60/103 317, которая включена в настоящее описание в качестве ссылки). Кроме того, при непосредственном тестировании большого числа лекарственных соединений центрального действия с известной для них клинической активностью в отношении психоневрологических заболеваний авторы обнаружили, что все соединения с антипсихотической эффективностью обладают общей молекулярной особенностью. Было показано, что почти все те соединения, которые психиатры применяют для лечения психоза, являются мощными обратными агонистами 5HT2A. Такая уникальная клинико-фармакологическая корреляция в отношении одного подтипа рецепторов является весомым доказательством того, что обратный агонизм в отношении 5HT2A рецептора представляет собой молекулярный механизм антипсихотической эффективности у человека.
Подробная фармакологическая характеристика большого числа антипсихотических соединений позволила выявить, что они обладают широкой активностью в отношении множества близких подтипов рецепторов. Большая часть указанных соединений проявляет агонистическую, конкурентную антагонистическую или обратную агонистическую активность в отношении множества подтипов моноаминергических рецепторов, включая серотонинергические, допаминергические, адренергические, мускариновые и гистаминергические рецепторы. Указанная широкая активность ответственна, скорее всего, за седативный, гипотензивный и моторный побочные эффекты указанных соединений. В этой связи было бы чрезвычайно полезно разработать соединения, которые были бы селективными обратными агонистами 5HT2A-рецептора, но которые обладали бы небольшой или вовсе бы не обладали активностью в отношении других подтипов моноаминовых рецепторов, в особенности допамин D2 рецепторов. Такие соединения могут быть полезными при лечении заболеваний человека (например, в качестве антипсихотических средств) и могут позволить избежать неблагоприятных побочных реакций, связанных с неселективным взаимодействием с рецепторами.
Краткое описание сущности изобретения
Настоящее изобретение относится к соединениям общей формулы (I), которые воздействуют на моноаминовые рецепторы, в особенности на рецепторы серотонина, и обладают общим свойством проявлять обратную агонистическую активность в отношении 5-HT2A подтипа серотониновых рецепторов человека:
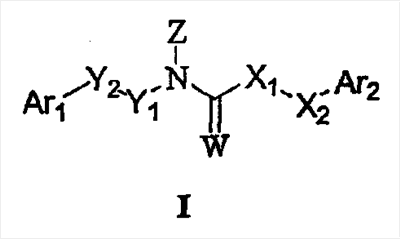
где Z означает группу, выбираемую из
R означает водород, циклическую или линейно-цепочечную, или разветвленную ациклическую органильную группу, низшую гидроксиалкильную группу, низшую аминоалкильную группу или аралкильную или гетероаралкильную группу;
n означает 0, 1 или 2;
X1 означает метиленовую, виниленовую, NH или N(низшую алкильную) группу; и
X2 означает метилен или в том случае, когда X1 означает метилен или винилен, X2 означает метилен или связь; или в том случае, когда X1 означает метилен, X2 означает O, S, NH или N (низший алкил) или связь;
Y1 означает метилен и Y2 означает метилен, винилен, этилен, пропилен или связь;
или
Y1 означает связь и Y2 означает винилен; или
Y1 означает этилен и Y2 означает O, S, NH или N (низший алкил);
Ar1 и Ar2 независимо означают незамещенные или замещенные арильные или гетероарильные группы;
W означает кислород или серу; или
к их фармацевтически приемлемым соли, сложному эфиру или пролекарству.
Настоящее изобретение также относится к фармацевтическим композициям, включающим в себя эффективное количество соединения формулы (I) или его фармацевтически приемлемые соли, сложные эфиры или пролекарства.
Настоящее изобретение также относится к способам ингибирования активности моноаминового рецептора, включая приведение в контакт моноаминового рецептора или системы, содержащей моноаминовый рецептор, с эффективным количеством соединений формулы (I), также и в составе набора, предназначенного для осуществления той же функции. Предпочтительно рецептор представляет собой серотониновый рецептор подкласса 5-HT2A. Указанный рецептор может быть расположен либо в центральной либо в периферической нервной системе, в клетках крови или тромбоцитов и может быть мутированным или модифицированным. В предпочтительном варианте реализации изобретения рецептор является конститутивно активным.
Кроме того, настоящее изобретение относится к способу ингибирования активации моноаминового рецептора, включающему в себя приведение в контакт моноаминового рецептора или системы, содержащей моноаминовый рецептор, с эффективным количеством соединений формулы (I), также и в составе набора, предназначенного для осуществления той же функции. В предпочтительном варианте осуществления изобретения соединение является селективным для 5-HT2A-рецептора серотонина. В другом предпочтительном варианте осуществления изобретения соединение обладает небольшой активностью или, по существу, не обладает антидопаминергической активностью. Рецептор может быть конститутивно активным или может активироваться эндогенным или экзогенным агонистом.
Другим объектом настоящего изобретения является способ лечения болезненного состояния, связанного с моноаминовым рецептором, включающий в себя введение млекопитающему, при необходимости такого лечения, эффективного количества соединения формулы (I), а также в виде набора для осуществления того же действия. Примеры болезненных состояний, для которых будет полезно такое лечение с использованием соединений согласно настоящему изобретению или фармацевтических композиций, включающих их, охватывают, не ограничиваясь приведенным списком, психоневрологические заболевания, такие как шизофрения и родственные идиопатические психозы, депрессия, беспокойство, расстройство сна, расстройство аппетита, аффективные расстройства, такие как депрессия, биполярное расстройство и депрессии с психотическими элементами, а также болезнь Туретта. Указанные соединения могут быть также полезны для лечения психозов, индуцированных лекарственными средствами, а также психозов, являющихся вторичными по отношению к нейродегенеративным заболеваниям, таким как болезнь Альцгеймера или Хантингтона. Соединения согласно настоящему изобретению могут быть также полезны при лечения гипертензии, мигрени, сосудистого спазма, ишемии и при первичном лечении и вторичной профилактике различных тромботический состояний, включая инфаркт миокарда, тромботический или ишемический инсульт, идиопатическую и тромботическую тромбоцитопению, а также болезнь периферических сосудов.
Изобретение также относится к способу идентификации генетического полиморфизма, определяющего предрасположенность субъекта к чувствительности в отношении соединения формулы (I), включающему в себя введение субъекту эффективного количества соединения, идентификацию чувствительности у субъекта, имеющего ослабленное болезненное состояние, связанное с моноаминовым рецептором, и идентификацию генетического полиморфизма у чувствительного субъекта в том случае, когда генетический полиморфизм определяет предрасположенность субъекта к чувствительности к данному соединению. В изобретении также предлагаются наборы для осуществления той же самой функции.
Способ идентификации субъекта, подходящего для лечения соединением формулы (I) и наборами для осуществления той же идентификации, также предлагается в настоящем изобретении. В соответствии с данным способом выявляется наличие полиморфизма, который определяет предрасположенность субъекта к чувствительности к данному соединению, при этом наличие такого полиморфизма указывает на то, что данный субъект будет подходящим для лечения.
Краткое описание фигур
На фиг.1 приведен график с данными, полученными на основе анализа по типу доза – ответ для 26HCH17 и ритансерина в качестве обратных агонистов для 5-HT2A.
На фиг.2 приведено графическое изображение фармакологических результатов, полученных in vivo на мышах с использованием гидрохлорида 2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамида. На фиг.2 проиллюстрированы эффекты указанного нового антипсихотического соединения в поведенческой модели на подергивание головой; на фиг.3 показаны результаты экспериментов по влиянию на двигательную функцию; и на фиг.4 приведены результаты исследования ингибирования при воздействии в предимпульсном режиме.
Подробное описание настоящего изобретения
Определения
В настоящем описании для определения технических терминов будут использоваться следующие определения во всей их полноте и также во всей их полноте они будут использоваться для определения широты охвата настоящих композиций, по которым будет проводиться поиск с целью защиты заявленных формул изобретения.
Термин “конститутивная активность” определяется как повышенная базовая активность рецептора, которая не зависит от присутствия агониста. Конститутивная активность рецептора может измеряться с использованием множества различных методов, включая клеточные (например, мембранные) препараты (см., например, Barr & Manning, J. Biol. Chem. 272:32979-87 (1997)), очищенные и восстановленные рецепторы вместе с ассоциированным G-белком в фосфолипидных везикулах или без него (Cerione et al., Biochemistry 23:4519-25 (1984)), и функциональные клеточные тесты (заявка на патент США, серийный номер 60/103 317).
Термин “агонист” определяется как соединение, которое при контакте с рецептором повышает его активность.
Термин “антагонист” определяется как соединение, которое конкурирует с агонистом или обратным агонистом за связывание с рецептором и тем самым блокирует действие агониста или обратного агониста на рецептор. Однако антагонист, называемый также “нейтральным антагонистом”, не оказывает воздействия на конститутивную активность рецептора.
Термин “обратный агонист” определяется как соединение, которое снижает базовую активность рецептора (например, сигнальную функцию, опосредованную рецептором). Такие соединения также известны как негативные антагонисты. Обратный агонист представляет собой лиганд для рецептора, который заставляет рецептор перейти в неактивное состояние в сравнении с его базовым состоянием, в отсутствие лиганда. Таким образом, тогда как антагонист может ингибировать активность агониста, обратный агонист является лигандом, который может менять конформацию рецептора в отсутствие агониста. Концепция обратного агониста исследовалась Бондом с соавт.(Bond et al., in Nature 374:272 (1995)). Более конкретно Бонд с соавт. предположили, что не связанный с лигандом  2-адренорецептор существует в состоянии равновесия между неактивной конформацией и спонтанно возникающей активной конформацией. Агонисты предложены для стабилизации рецептора в активной конформации. И наоборот, обратные агонисты, как полагают, будут стабилизировать неактивную конформацию рецептора. Таким образом, тогда как антагонист проявляет свою активность посредством ингибирования активности агониста, обратный агонист может дополнительно проявлять свою активность в отсутствие агониста за счет ингибирования спонтанного перехода не связанного с лигандом рецептора в активную конформацию. 2-адренорецептор существует в состоянии равновесия между неактивной конформацией и спонтанно возникающей активной конформацией. Агонисты предложены для стабилизации рецептора в активной конформации. И наоборот, обратные агонисты, как полагают, будут стабилизировать неактивную конформацию рецептора. Таким образом, тогда как антагонист проявляет свою активность посредством ингибирования активности агониста, обратный агонист может дополнительно проявлять свою активность в отсутствие агониста за счет ингибирования спонтанного перехода не связанного с лигандом рецептора в активную конформацию.
Термин “5-HT2A-рецептор” определяется как рецептор, обладающий активностью, соответствующей активности подтипа серотонинового рецептора человека, который был охарактеризован в ходе молекулярного клонирования и фармакологических исследований и детально описан Зальцманом с соавт. и Юлиусом с соавт. (Saltzman et al., Biochem. Biophys. Res. Comm. 181:1469-78; and Julius et al., Proc. Natl. Acad. Sci. USA 87: 928-932).
Термин “субъект” относится к животному, предпочтительно млекопитающему, и наиболее предпочтительно к человеку, являющемуся объектом лечения, наблюдения или эксперимента.
Термин “селективный” определяется как свойство соединения, благодаря которому то количество соединения, которого достаточно для оказания желательной реакции на конкретный тип рецептора, подтип, класс и подкласс, будет, по существу, оказывать малое воздействие или вовсе не будет оказывать воздействия на активность других типов рецептора. Термин “селективность” или “селективный” в применении к обратному агонисту следует понимать как свойство соединения согласно настоящему изобретению, благодаря которому то количество соединения, которое является эффективным в качестве обратного агониста для 5-HT2A-рецептора, снижая при этом его активность, проявляет небольшую обратную агонистическую или антагонистическую активность, или вовсе ее не проявляет в отношении других родственных или неродственных рецепторов. В частности, было обнаружено, что соединения согласно настоящему изобретению не взаимодействуют с другими серотониновыми рецепторами (5HT 1A, 1B, 1D, 1E, 1F, 2B, 2C, 4A, 6 и7) в тех концентрациях, при которых сигнальная функция 5-HT2A-рецептора уже существенно или полностью подавляется. Предпочтительно соединения согласно настоящему изобретению являются также селективными в отношении других моноамин-связывающих рецепторов, таких как допаминергические, гистаминергические, адренергические и мускариновые рецепторы. Соединения, которые обладают высокой селективностью в отношении 5-HT2A-рецепторов, могут оказывать благоприятный эффект при лечении психоза, шизофрении или близких психоневрологических расстройств, позволяя при этом избежать неблагоприятных эффектов, связанных с использованием предлагаемых для этой цели лекарственных средств.
Величина ЭК50 для агониста означает концентрацию соединения, необходимую для достижения 50% от максимального ответа, получаемого в тесте R-SAT. Для обратных агонистов ЭК50 означает концентрацию соединения, необходимую для достижения 50% ингибирования ответа в тесте R-SAT относительно базового уровня, без внесения соединения.
В контексте настоящего описания термин “совместное введение” фармакологически активных соединений относится к доставке двух или более отдельных химических групп, либо in vitro, либо in vivo. Совместное введение относится к одновременной раздельной доставке средств, к одновременной доставке смеси агентов; а также к доставке одного агента с последующей доставкой второго агента или дополнительных агентов. Во всех случаях подразумевается, что агенты, которые вводятся совместно, также и работают совместно друг с другом.
Термин “циклические органильные группы” охватывает алифатические, алициклические группы, в которых атомы углерода образуют кольцо. В предпочтительных вариантах реализации изобретения кольцо, содержащее четыре, пять, шесть или семь атомов углерода в качестве заместителя, соединяются либо непосредственно через один из атомов кольца либо через один или более присоединенных к нему атомов углерода. Конкретные примеры таких групп включают в себя циклопентильные, циклогексильные, циклогептильные, циклопентилметильные, циклогексилметильные, циклогексилэтильные группы и др.
Термин “линейно-цепочечные алициклические органильные группы” охватывает замещающие группы, состоящие из линейно расположенных атомов углерода, где каждый атом углерода связывает максимум два других атома углерода, соединенных с помощью одинарной, двойной или тройной связи. Линейно-цепочечные органильные группы могут содержать одну или несколько множественных связей или могут их не содержать, и представляют собой, например, группы, обычно называемые алкильными, алкенильными или алкинильными или алкадиенильными группами соответственно. Примеры линейно-цепочечных органильных групп включают в себя метил, этил, пропил, бутил, пентил, гексил, пропенил, бутенил, пентадиенил, пропаргил, бутинил.
Термин “разветвленные ациклические органильные группы” охватывает замещающие группы, состоящие из разветвленного объединения атомов углерода, где один или более атомов углерода могут связывать более чем два других атома углерода, соединенных с помощью одинарной, двойной или тройной связи. Разветвленные органильные группы могут содержать одну или несколько разветвленных множественных связей или могут их вовсе не содержать. Примеры разветвленных органильных групп включают в себя изопропил, изобутил, трет-бутил, метилбутил, метилбутенил, метилбутинил.
“Низшие алкоксигруппы” представляют собой С1-6 циклические или ациклические органильные группы, соединенные в качестве заместителей через атом кислорода. Примеры низших алкокси-групп включают в себя метокси, этокси, изопропокси, бутокси, трет-бутокси.
“Низшие алкильные группы” представляют собой С1-6 циклические, линейно-цепочечные или разветвленные алифатические замещающие группы, соединенные через атом углерода. Примеры их включают в себя метил, этил, пропил, бутил, метилбутил, циклопропил, циклогексил, изопропил, трет-бутил.
Термин “низшие алкиламино группы” следует понимать как низшие алкильные группы, соединенные в качестве заместителей через атом азота, который может нести одну или две низшие алкильные группы. Конкретные примеры таких групп включают в себя метиламино, диметиламино, изопропиламино. Низшие аминоалкильные группы могут необязательно состоять из 4-6-членных азотсодержащих колец, таких как пирролидино.
“Низшие аминоалкильные группы” представляют собой низшие алкильные группы, несущие в качестве заместителя дополнительную аминогруппу. Примеры таких групп включают в себя аминометил и аминоэтил.
“Низшие гидроксиалкильные группы” следует понимать как низшие алкильные группы, несущие в качестве заместителя дополнительную гидроксигруппу. Примеры таких групп включают в себя гидроксиметил, гидроксиэтил, 2-гидрокси-2-пропил, гидроксипентил.
“Ацильные группы” представляют собой водород или низшие алкильные группы, соединенные в качестве заместителей через карбонильную группу. Примеры таких групп включают в себя формил, ацетил, пропаноил.
“Галогеновые группы” следует понимать как фтор-, хлор-, бром- или йод-заместители, при этом в основном предпочтительны фтор и хлор.
“Низшие алкиленовые группы” представляют собой линейно-цепочечные связанные группы, которые образуют связи для соединения фрагментов молекул через их концевые атомы углерода. Примеры таких групп включают в себя метиленовые (-CH2-), этиленовые (-CH2CH2-), пропиленовые (-CH2CH2CH2-) или бутиленовые (-(CH2-)4-) группы.
“Виниленовые группы” представляют собой этен-1,2-диильные группы (-CHCH-), имеющие (E) или (Z) конфигурацию.
“Аралкильные группы” представляют собой арильные группы, соединенные в качестве заместителей через низшую алкиленовую группу. Арильные группы в аралкильных группах могут быть замещенными или незамещенными. Примеры таких групп включают в себя бензил, замещенный бензил, 2-фенилэтил, 3-фенилпропил, нафтилалкил.
“Гетероаралкильные группы” следует понимать как гетероарильные группы, соединенные в качестве заместителей через низшую алкиленовую группу. Гетероарильные группы в гетероаралкильных группах могут быть замещенными или незамещенными. Примеры включают в себя 2-тиенилметил, 3-тиенилметил, фурилметил, тиенилэтил, пирролилалкил, пиридилалкил, изоксазолилалкил, имидазолилалкил и их замещенные, а также слитые с бензольным кольцом аналоги.
“Арильные группы” представляют собой ароматические, предпочтительно бензоноидные или нафтоидные, группы, соединенные через образующие кольцо атомы углерода и необязательно несущие один или более заместителей, выбираемых из галогена, гидрокси, амино, циано, нитро, алкиламидо, ацила, низшего алкокси, низшего алкила, низшего гидроксиалкила, низшего аминоалкила, низшего алкиламино, алкилсульфенила, алкилсульфинила, алкилсульфонила, сульфамоила или трифторметила. Предпочтительными арильными группами являются фенильная и наиболее предпочтительно замещенная фенильная группа, несущая один или два одинаковых или разных заместителя из числа перечисленных выше. Предпочтительный вариант замещения представляет собой пара- и/или мета-замещение. Репрезентативные примеры арильных групп включают в себя, не ограничиваясь приведенным списком, фенил, 3-галогенфенил, 4-галогенфенил, 3-гидроксифенил, 4-гидроксифенил, 3-аминофенил, 4-аминофенил, 3-метилфенил, 4-метилфенил, 3-метоксифенил, 4-метоксифенил, 3-цианофенил, 4-цианофенил, диметилфенил, нафтил, гидроксинафтил, гидроксиметилфенил, трифторметилфенил.
“Гетероарильные группы” следует понимать как ароматические С2-6 циклические группы, содержащие один атом O или S или вплоть до четырех атомов N, или сочетание одного атома O или S с N, в количестве до двух атомов, и их замещенные, а также бензо- или пиридо-конденсированные производные, предпочтительно соединенные через один из атомов углерода, образующих кольцо. Гетероарильные группы могут нести один или более заместителей, выбираемых из галогена, гидрокси, амино, циано, нитро, алкиламидо, ацила, низшего алкокси, низшего алкила, низшего гидроксиалкила, низшего аминоалкила, низшего алкиламино, алкилсульфенила, алкилсульфинила, алкилсульфонила, сульфамоила или трифторметила. Предпочтительные гетероарильные группы представляют собой 5- и 6-членные ароматические гетероциклические системы, несущие 0, 1 или 2 заместителя, которые могут быть одинаковые или отличаться друг от друга и выбираются из приведенного выше списка. Репрезентативные примеры гетероарильных групп включают в себя, не ограничиваясь приведенным списком, незамещенные и одно- или двузамещенные производные фурана, бензофурана, тиофена, бензотиофена, пиррола, индола, оксазола, бензоксазола, изоксазола, бензизоксазола, тиазола, бензотиазола, изотиазола, имидазола, бензимидазола, пиразола, индазола и тетразола, все из которых относятся к предпочтительным, а также фуразан, 1,2,3-оксадиазол, 1,2,3-тиадиазол, 1,2,4-тиадиазол, триазол, бензотриазол, пиридин, хинолин, изохинолин, пиридазин, пиримидин, пурин, пиразин, птеридин и триазин. Наиболее предпочтительными заместителями являются галоген, гидрокси, циано, низший алкокси, низший алкил, низший гидроксиалкил, низший алкиламино и низший аминоалкил.
Настоящее изобретение относится к соединениям, предпочтительно демонстрирующим относительную высокую селективность в отношении серотониновых рецепторов, в частности 5-HT2A рецепторов, которые могут оказывать благотворный эффект при лечении психоневрологических заболеваний.
В соответствии с одним из вариантов реализации настоящее изобретение относится к соединениям общей формулы (I)

где Z означает

в которых R означает водород, циклическую или линейно-цепочечную или разветвленную ацикличесую органильную группу, низшую гидроксиалкильную группу, низшую аминоалкильную группу или аралкильную или гетероаралкильную группу;
n означает 0, 1 или 2;
X1 означает метиленовую, виниленовую, NH или N(низшую алкильную) группу; и
X2 означает метилен или в том случае, когда X1 означает метилен или винилен, X2 означает метилен или связь; или в том случае, когда X1 означает метилен, X2 означает O, S, NH или N(низший алкил) или связь;
Y1 означает метилен и Y2 означает метилен, винилен, этилен, пропилен или связь;
или Y1 означает связь и Y2 означает винилен; или
Y1 означает этилен и Y2 означает O, S, NH или N(низший алкил);
Ar1 и Ar2 независимо означают незамещенные или замещенные арильные или гетероарильные группы; и
W означает кислород или серу;
или к их фармакологически приемлемым соли, сложному эфиру или пролекарству.
В основном соединения формулы (I) проявляют активность в отношении моноаминовых рецепторов и конкретно серотониновых рецепторов. Предпочтительные соединения обладают общей способностью функционировать в качестве обратных агонистов для 5-HT2A рецептора. Так, в экспериментах, проведенных на клетках, временно экспрессирующих человеческий фенотип указанного рецептора, было показано, что соединения общей формулы (I) при действии на рецептор ослабляют сигнальную способность таких рецепторов в отсутствие дополнительных лигандов. Так, было показано, что указанные соединения обладают присущей им активностью в отношении указанного рецептора и способны ослаблять базовые, не стимулированные агонистом конститутивные сигнальные реакции, которые демонстрирует рецептор 5-HT2A. Данные о том, что соединения общей формулы (I) являются обратными агонистами, также указывают на то, что указанные соединения обладают способностью выступать в качестве антагонистов активации 5-HT2A-рецепторов, что опосредовано эндогенными агонистами или экзогенными синтетическими лигандами агонистов.
В предпочтительном варианте осуществления настоящее изобретение относится к соединениям, которые предпочтительно проявляют относительно высокую селективность в том, что касается 5-HT2A подтипа серотониновых рецепторов в сравнении с другими подтипами семейства серотониновых (5-ГТ) рецепторов, а также в отношении других рецепторов и особенно в отношении моноаминергических G-белок-связанных рецепторов, таких как допаминовые рецепторы. В другом предпочтительном варианте соединения согласно настоящему изобретению действуют как обратные агонисты на 5-HT2A подтип серотониновых рецепторов.
В этой связи соединения общей формулы (I) могут быть полезными для лечения или ослабления симптомов болезненных состояний, связанных с нарушением функции, в частности, с повышенным уровнем активности, особенно 5-HT2A-рецепторов, независимо от того, связано ли указанное нарушение функции с несоответствующим уровнем стимуляции рецептора или с фенотипическими аберрациями.
Ранее рядом исследователей была высказана гипотеза о том, что некоторые нейропсихологические заболевания могут быть вызваны измененным уровнем конститутивной активности моноаминовых рецепторов. Такая конститутивная активность может быть модифицирована посредством контакта релевантного рецептора с синтетическим обратным агонистом. При непосредственном тестировании большого числа клинически активных при психоневрологических заболеваниях лекарственных соединений авторы обнаружили, что все соединения, эффективные в качестве с антипсихотических средств, характеризуются общим молекулярным свойством. Почти все указанные соединения из числа применяемых психиатрами для лечения психоза, как было показано, являются мощными обратными агонистами 5-HT2A. Такая корреляция является неоспоримым подтверждением того, что обратный агонизм 5-HT2A-рецептора является молекулярным механизмом антипсихотической эффективности у людей.
Проведенная авторами изобретения в их лаборатории подробная фармакологическая характеристика большого числа антипсихотических соединений показала, что все они обладают широкой активностью в отношении многих родственных подтипов рецепторов. Большая часть указанных соединений проявляет либо агонистическую либо конкурентную антагонистическую, либо обратную агонистическую активность в отношении множества подтипов моноаминергических рецепторов, включая серотонинергические, допаминергические, адренергические, мускариновые и гистаминергические рецепторы. Такая широкая активность, скорее всего, ответственна за седативный, гипотензивный и локомоторный побочные эффекты указанных соединений. Из приведенного следует, что раскрываемые в настоящей заявке соединения будут обладать активностью в качестве, например, новых антипсихотических средств, но они будут вызывать менее слабые или менее серьезные побочные эффекты, чем имеющиеся в настоящее время соединения.
Настоящее изобретение также относится к фармацевтическим композициям, включающим в себя эффективное количество соединения общей формулы (I).
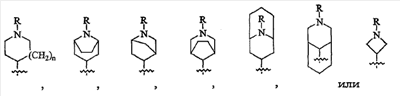
В предпочтительном варианте осуществления изобретения в соединениях формулы (I) Y1 означает метилен и Y2 означает связь, метилен, этилен или винилен, или Y1 означает этилен и Y2 означает O или S, и X1 означает метилен и X2 означает связь, метилен, O или S, или X1 означает NH или N(низший алкил).
В еще одном предпочтительном варианте осуществления изобретения в соединениях общей формулы (I) Z означает
и W означает кислород.
В более предпочтительном варианте реализации изобретения в соединениях формулы (I) n означает 1, Y1 означает метилен, Y2 означает связь, метилен, этилен или винилен, X1 означает метилен и X2 означает связь, или X1 означает NH или N(низший алкил) и X2 означает метилен. В еще одном предпочтительном варианте осуществления изобретения в соединениях формулы (I) W означает кислород и Ar1 и Ar2 означают различные арильные или гетероарильные группы, при этом особенно предпочтительными являются различные однозамещенные фенильные группы. Предпочтительно Ar1 и Ar2 не означают одновременно фенил.
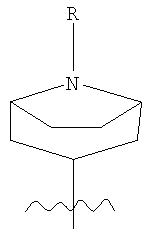
Также предпочтительными соединениями формулы (I) являются такие соединения, в которых Z означает 1-(органил или аралкил)-4-пиперидинил.
В другом варианте настоящее изобретение относится к предпочтительным соединениям формулы (II):
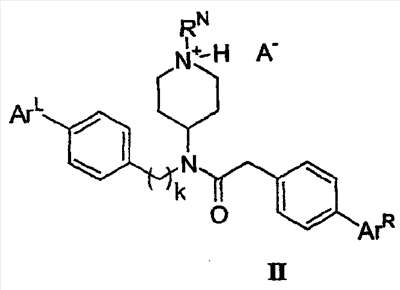
в которой RN означает водород, низший алкил, аралкил или гетероаралкил;
ArL выбирают из низшего алкила, низшего алкокси и галогена
ArR выбирают из низшего алкила, низшего алкокси и галогена;
k означает 1 или 2;
и А– означает приемлемый анион.
В соответствии с настоящим изобретением приемлемый анион может представлять любой анион, способный к образованию фармацевтически приемлемой соли соединения, что будет ниже описано более подробно.
Настоящее изобретение также относится к способу ингибирования активности моноаминового рецептора. Указанный способ подразумевает приведение в контакт моноаминового рецептора или системы, содержащей моноаминовый рецептор, с эффективным количеством соединения формулы (I). В соответствии с одним вариантом осуществления изобретения моноаминовый рецептор представляет собой серотониновый рецептор. В предпочтительном варианте осуществления изобретения соединение является селективным для 5-HT2A подкласса рецепторов. В другом предпочтительном варианте осуществления изобретение обладает небольшой активностью или, по существу, ею не обладает в отношении других типов рецепторов, включая другие серотонинергические рецепторы и наиболее предпочтительно моноаминергические G-белок-связанные рецепторы, такие как допаминергические рецепторы.
Система, содержащая моноаминовый рецептор может, например, представлять собой субъект, такой как млекопитающее, примат, отличный от человека, или человека. Рецептор может быть расположен в центральной или периферической нервной системе, в клетках крови или тромбоцитах.
Система может находиться в условиях in vivo или представлять собой экспериментальную модель in vitro, такую как модельная система клеточной культуры, которая экспрессирует моноаминовый рецептор, ее бесклеточный экстракт, который содержит моноаминовый рецептор, или очищенный рецептор. Неограничивающие примеры таких систем включают в себя культуру клеток ткани, экспрессирующих рецептор, или их экстракты или лизаты. Клетки, которые могут использоваться в процедуре настоящего способа, включают в себя любые клетки, способные опосредовать сигнальную трансдукцию через моноаминовые рецепторы, в особенности 5-HT2A-рецептор, либо через эндогенную экспрессию указанного рецептора (в частности, некоторые типы нейрональных клеточных линий, например, экспрессирующие в нативном состоянии 5-HT2A-рецептор), либо в ходе экспрессии после трансфекции клеток плазмидами, содержащими ген рецептора. В типичном случае такие клетки представляют собой клетки млекопитающих (или другие эукариотические клетки, такие как клетки насекомых или ооциты Xenopus), поскольку клетки низших организмов в основном не содержат путей сигнальной трансдукции, пригодных для целей настоящего исследования. Примеры приемлемых клеток включают в себя клеточные линии фибробластов мышей NIH 3T3 (ATCC CRL 1658), которые отвечают на трансфекцию 5-HT2A-рецепторов стимуляцией роста; RAT 1 клетки (Pace et al., Proc. Natl. Acad. Sci. USA 88:7031-35 (1991)); и клетки гипофиза (Vallar et al., Nature 330:556-58 (1987)). Другие полезные для применения в рамках настоящего способа клетки млекопитающих включают в себя HEK 293 клетки, CHO клетки и COS клетки.
Настоящее изобретение относится конкретно к способам ингибирования активности нативного, мутированного или модифицированного моноаминового рецептора. Также настоящее изобретение относится к наборам для выполнения той же функции. В предпочтительном варианте осуществления изобретения активность рецептора представляет собой сигнальную активность. В другом предпочтительном варианте осуществления изобретения активность рецептора представляет собой конститутивную базовую активность рецептора. Предпочтительное соединение является обратным агонистом, селективным для 5-HT2A-рецептора. Наиболее предпочтительно соединение обладает небольшой активностью или, по существу, вовсе не обладает активностью в отношении других серотонинергических или других моноаминергических рецепторов, таких как допаминергические рецепторы.
В одном варианте осуществления изобретения активность рецептора представляет собой реакцию, такую как сигнальный ответ на эндогенный агонист, такой как 5-ГТ, или экзогенный агонист, такой как лекарственное средство или другой синтетический лиганд. Соединения формулы (I) предпочтительно действует как обратный агонист или антагонист рецептора.
Кроме того, настоящее изобретение относится к способу ингибирования активации моноаминового рецептора, включающему в себя приведение в контакт моноаминового рецептора или системы, содержащей моноаминовый рецептор, с одним или более соединениями согласно настоящему изобретению. Активация рецептора может быть связана с экзогенным или эндогенным агентом-агонистом, или может представлять собой конститутивную активацию, ассоциированную с нативным, мутированным или модифицированным рецептором. Рецептор может быть очищен или может находиться in vitro или в системе in vivo. Рецептор может также присутствовать в центральной или периферической нервной системе, клетках крови или тромбоцитах, или в организме субъекта, отличного от человека, или у человека. В изобретении предлагаются также наборы для осуществления той же функции.
В предпочтительном варианте осуществления изобретения соединение является селективным для 5-ГТ-класса серотониновых рецепторов, более предпочтительно для 5-HT2A-подкласса серотониновых рецепторов. В другом предпочтительном варианте соединение обладает небольшой активностью или, по существу, не обладает антидопаминергической активностью.
Настоящее изобретение относится к способам лечения болезненного состояния, связанного с моноаминовым рецептором, включающим в себя введение млекопитающему, при необходимости такого лечения, эффективного количества соединения формулы (I). Изобретение конкретно относится к способам лечения или облегчения болезненных состояний, связанных с несоответствующей функцией или стимуляцией нативных, а также мутированных или любым другим образом модифицированных форм центральных серотониновых рецепторов, в особенности 5-ГТ класса таких рецепторов, включающим в себя введение, при необходимости такого лечения, эффективного количества селективного обратного агониста общей формулы (I) в организм хозяина. В изобретении также предлагаются наборы для осуществления той же самой функции.
В предпочтительном варианте осуществления изобретения рецептор относится к 5-HT2A-подклассу. В одном варианте осуществления изобретения болезненное состояние связано с дисфункцией серотонинового рецептора. В другом варианте осуществления изобретения болезненное состояние связано с активацией серотонинового рецептора, предпочтительно с неприемлемо повышенной или конститутивной активацией, повышенным серотонинергическим тонусом, а также включает в себя болезненные состояния, которые связаны с вторичными клеточными функциями, нарушенными при таких патологиях.
Примеры заболеваний, в отношении которых может быть полезно такое лечение с использованием соединений согласно настоящему изобретению или фармацевтических композиций, включающих такие соединения, включают в себя, не ограничиваясь приведенным списком, психоневрологические заболевания, такие как шизофрения и близкие идиопатические психозы, беспокойство, расстройство сна и расстройства аппетита, аффективные расстройства, такие как истинная депрессия, биполярное расстройство и депрессия с психотическим компонентом, а также болезнь Туретта, психозы, индуцированные лекарственными средствами, а также психозы, вторичные по отношению к нейродегенеративным заболеваниям, таким как болезнь Альцгеймера или Хантингтона. Ожидается, что соединения согласно настоящему изобретению, особенно селективные обратные агонисты для 5-HT2A, которые демонстрируют небольшую активность или вовсе не демонстрируют активности в отношении допаминергических рецепторов, могут быть особенно полезны для лечения шизофрении. Лечение с использованием соединений согласно настоящему изобретению может быть также полезно в случае мигрени, ангиоспазма, гипертензии, различных тромботический состояний, включая инфаркт миокарда, тромботический или ишемический инсульт, идиопатическую и тромботическую тромбоцитопению, а также заболевания периферических сосудов.
В еще одном варианте осуществления изобретения предлагаются способы лечения или облегчения болезненного состояния, связанного с несоответствующей функцией, дисфункцией или стимуляцией нативных, а также мутированных или иным способом модифицированных форм центральных или периферических серотониновых рецепторов, причем такие способы включают в себя введение эффективного количества соединения общей формулы (I) в организм хозяина при необходимости такого лечения. Предпочтительно моноаминовый рецептор представляет собой серотониновый рецептор в периферической нервной системе, крови или тромбоцитах, и более предпочтительно представляет собой 5-HT2A-подкласс рецепторов. В дополнительных вариантах осуществления изобретения болезненное состояние связано с повышенной активностью или активацией серотонинового рецептора. В изобретении также предлагаются наборы для осуществления той же функции.
Настоящее изобретение также относится к области профилактической медицины, в рамках которой используются фармакогеномные методы для прогностических (предсказательных) целей. Фармакогеномное направление рассматривает клинически значимые наследственные вариации, возникающие в ответ на лекарственные средства в связи с изменением распределения лекарственного средства в организме и аномальным воздействием на больных людей (см. например, Eichelbaum, Clin Exp Pharmacol. Physiol., 23:983-985 (1996) и Linder, Clin Chem. 43:254-66 (1997)). В целом, можно выделить два типа фармако-генетических состояний: генетическое состояние, передаваемое в виде одного фактора, изменяющего способ воздействия лекарственных средств на организм (измененное действие лекарственного средства), и генетические состояния, передаваемые в виде единичных факторов, изменяющих способ воздействия организма на лекарственные средства (измененный метаболизм лекарственного средства). Указанные фармакогенетические состояния могут существовать в виде естественного полиморфизма.
Один фармакогенетический подход к идентификации генов, который позволяет предсказать реакцию на лекарственное средство, известный как “широкая геномная ассоциация”, базируется в основном на карте человеческого генома высокого разрешения, состоящей из уже известных связанных с геном маркеров (например, “биаллельный” маркер генной карты, который состоит из 60000-100000 полиморфных или вариабельных сайтов в геноме человека, каждый из которых имеет два варианта). Такую генетическую карту высокого разрешения можно сравнивать с картой генома каждого из статистически значимого количества пациентов, принимавших участие в фазе II/III испытания лекарственных средств для идентификации маркеров, связанных с определенным наблюдаемым ответом на лекарственное средство или с возникновением побочного эффекта. Альтернативно такая карта высокого разрешения может быть получена в результате сочетания нескольких десятков миллионов известных единичных нуклеотидных полиморфизмов (SNP) в геноме человека. В контексте настоящего описания термин “SNP” относится к обычным изменениям, которые возникают в единичном нуклеотидном основании в цепи ДНК. Так, например, SNP может встречаться каждый раз на каждую тысячу оснований ДНК. SNP может принимать участие в развитии заболевания, однако большая часть их может быть не связана с заболеванием. При наличии генетической карты, основанной на встречаемости таких SNP, индивидуумы могут быть распределены по группам в соответствии с генетическими категориями, зависимыми от конкретной картины расположения SNP в их индивидуальном геноме. При таком подходе режим лечения может быть привязан к группам генетически сходных индивидуумов, при этом считается, что среди таких генетически сходных индивидуумов лечебный подход тоже может иметь общие черты.
Альтернативно способ, называемый “подходом на основе гена-кандидата”, может быть использован для идентификации генов, с помощью которых можно предсказать реакцию организма на лекарственное средство. В соответствии с его методологией, если известен тот ген, который кодирует мишень для лекарственного средства (например, белок или рецептор согласно настоящему изобретению), то все обычные варианты такого гена могут быть легко идентифицированы в популяции, и он может быть определен, если имеется одна версия гена против другой версии, которая ассоциирована с конкретной реакцией на лекарственное средство.
Альтернативно способ, называемый “профиль экспрессии гена”, может использоваться для идентификации генов, зная которые можно предсказать реакцию на лекарственные средства. Так, например, генная экспрессия у животного, которому введена доза лекарственного средства (например, молекула или модулятор согласно настоящему изобретению), может рассматриваться как индикатор того, был ли включен ген метаболического пути, связанного с токсичностью.
Информация, получаемая более чем из одного из указанных выше фармакогенетических подходов, может использоваться для определения соответствующей дозировки и режимов лечения с целью профилактики или терапевтического лечения индивидуума. Указанные знания при использовании их для подбора дозы или выбора лекарственного средства позволяют избежать неблагоприятных реакций или неудач в лечении и таким образом повысить терапевтическую и профилактическую активность в случае лечения субъекта с использованием молекулы или модулятора согласно настоящему изобретению, такого как модулятор, идентифицированный в одном из приведенных в качестве примера в скрининг-тестах в настоящем описании. Как уже указывалось ранее, данный подход может быть также использован для идентификации нового рецептора-кандидата или других генов, подходящих для дальнейшей фармакологической характеристики in vitro и in vivo.
В соответствии с вышесказанным настоящее изобретение также относится к способам и наборам для идентификации генетического полиморфизма, предрасполагающего субъекта к отзывчивости на описанное соединение. Указанный способ включает введение субъекту эффективного количества соединения, идентификацию чувствительного субъекта, имеющего ослабленное болезненное состояние, связанное с моноаминовым рецептором, и идентификацию генетического полиморфизма у такого чувствительного субъекта, в том случае, когда генетический полиморфизм обуславливает чувствительность субъекта к соединению. Ожидается, что данный способ будет полезным как для предсказания того, будут ли те или иные индивидуумы чувствительны к терапевтическому действию соединения, так и для выявления тех или иных, у которых вероятно возникновение неблагоприятных побочных реакций. Указанный подход может быть полезен для идентификации, например, полиморфизмов в серотониновом рецепторе, которые ведут к конститутивной активации и таким образом подлежат проведению терапии обратным агонистом. Кроме того, данный метод может использоваться для идентификации полиморфизмов, которые ведут к изменению метаболизма лекарственного средства, вследствие чего в организме образуются токсичные побочные продукты. Такой механизм срабатывает редко, но может привести к потенциально опасным для жизни побочным эффектам, как в случае атипичного антипсихотического средства клозапина.
В родственном варианте осуществления изобретения предлагается способ идентификации субъекта, подходящего для лечения соединением согласно настоящему изобретению. В соответствии с данным способом выявляют наличие полиморфизма, который обеспечивает предрасположенность субъекта к чувствительности к соединению, и наличие такого полиморфизма указывает на то, что субъект подходит для лечения. В изобретении также предлагаются наборы для осуществления той же самой функции.
Соединения согласно настоящему изобретению предпочтительно демонстрируют селективную активность в качестве обратных агонистов в отношении 5-HT2A-рецептора. Такая активность определяется по способности лиганда ослаблять или устранять конститутивную сигнальную активность указанного рецептора. Селективность в настоящем контексте следует понимать как способность соединения согласно настоящему изобретению, благодаря которой количество соединения, которое эффективно действует как обратный агонист в отношении 5-HT2A-рецептора, снижая при этом его активность, проявляет небольшую активность или вовсе не проявляет активности в качестве обратного агониста или антагониста на других, родственных или неродственных рецепторах. В частности, было обнаружено, что соединения согласно настоящему изобретению не вступают в сильное взаимодействие с другими серотониновыми рецепторами (5-HT 1A, 1B, 1D, 1E, 1F, 2B, 2C, 4A, 6 и 7) в тех концентрациях, при которых сигнальная функция 5HT2A-рецептора сильно или полностью подавляется. Предпочтительно соединения согласно настоящему изобретению являются также селективными в отношении других моноаминсвязывающих рецепторов, таких как допаминергические, гистаминергические, адренергические и мускариновые рецепторы.
Особенно предпочтительный вариант осуществления настоящего изобретения включает в себя
N-(1-(метилэтил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(1-(2,2-(диметилэтил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(1-пентилпиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(1-гексилпиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(1-циклогексилпиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(1-циклопентилпиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(1-циклобутилпиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(1-циклопропилпиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(1-(циклопентилметил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(1-(циклобутилметил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(1-(циклопропилметил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(1-(2-гидроксиэтил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(1-(3-гидроксипропил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-((4-метилфенил)метил)-N-(пиперидин-4-ил)-N’-фенилметилкарбамид;
N-((4-метилфенил)метил)-N-(1-(2-метилпропил)пиперидин-4-ил)-N’-фенилметилкарбамид;
N-(1-((2-бромфенил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид;
N-(1-((4-гидрокси-3-метоксифенил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид;
N-(1-((5-этилтиен-2-ил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид;
N-(1-(имидазол-2-илметил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид;
N-(1-(циклогексилметил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид;
N-(1-((4-фторфенил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид;
N-((4-метилфенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-4-метоксифенилацетамид;
N-(1-этилпиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-((4-метилфенил)метил)-N-(1-пропилпиперидин-4-ил)-4-метоксифенилацетамид;
N-(1-бутилпиперидин-4-ил)-N-((4-метилфенил)-4-метоксифенилацетамид;
N-(1-(3,3-диметилбутил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(1-(циклогексилметил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-((4-метилфенил)метил)-N-(1-(2-метилпропил)пиперидин-4-ил)-4-метоксифенилацетамид;
N-((4-метилфенил)метил)-N-(1-((4-метилфенил)метил)пиперидин-4-ил)-4-метоксифенилацетамид;
N-(1-((4-гидроксифенил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(1-((2-гидроксифенил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(3-фенилпропил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-(2-фенилэтил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((2-метоксифенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((2-хлорфенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((3,4-диметоксифенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((4-фторфенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((2,4-дихлорфенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((3-метилфенил)метил-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((3-бромфенил)метил-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-(1-(фенилметил)пиперидин-4-ил)-N-(3-фенил-2-пропен-1-ил)-4-метоксифенилацетамид;
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)фенилацетамид;
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-3-фенилпропионамид;
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-(фенилтио)ацетамид;
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)феноксиацетамид;
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-(4-хлорфенокси)ацетамид;
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-3-метоксифенилацетамид;
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-4-фторфенилацетамид;
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-2,5-диметоксифенилацетамид;
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-4-хлорфенилацетамид;
N-((4-метилфенил)метил)-N-(1-(фенилметил)пирролидин-3-ил)-N’-фенилметилкарбамид;
N-((4-метилфенил)метил)-N-(1-(фенилметил)пирролидин-3-ил)-4-метоксифенилацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-(пиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-этилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-хлорбензил)-N-(1-изопропилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-хлорбензил)-N-(пиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-хлорбензил)-N-(1-циклопентилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-хлорбензил)-N-(1-изопропилпиперидин-4-ил)ацетамид;
2-(фенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-фторфенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-трифторметилфенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил) ацетамид;
2-(4-фторфенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(фенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-трифторметилфенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-трифторметилфенил)-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-фенил-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-хлорфенил)-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-трифторметилфенил)-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-фенил-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-хлорфенил)-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-[1-(4-хлорметил-2-тиазолилметил)пиперидин-4-ил]ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-{1-[3-(1,3-дигидро-2Н-бензимидазол-2-он-1-ил)пропил]пиперидин-4-ил}ацетамид;
2-(4-метоксифенил)-N-(2-4-(фторфенил)этил)-N-(1-метилпиперидин-4-ил]ацетамид;
2-(4-метоксифенил)-N-[2-(2,5-диметоксифенил)этил]-N-(1-метилпиперидин-4-ил]ацетамид;
2-(4-метоксифенил)-N-[2-(2,4-дихлорфенил)этил]-N-(1-метилпиперидин-4-ил]ацетамид;
2-(4-метоксифенил)-N-[2-(3-хлорфенил)этил]-N-(1-метилпиперидин-4-ил]ацетамид;
2-(4-метоксифенил)-N-[2-(4-метоксифенил)этил]-N-(1-метилпиперидин-4-ил] ацетамид;
2-(4-метоксифенил)-N-[2-(3-фторфенил)этил]-N-(1-метилпиперидин-4-ил]ацетамид;
2-(4-этоксифенил)-N-[2-(4-фторфенэтил]-N-(1-метилпиперидин-4-ил]ацетамид;
2-(4-этоксифенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил]ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-{1-[2-(2-гидроксиэтокси)этил]-пиперидин-4-ил}ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-[1-((2-хлор-5-тиенил)-метил)пиперидин-4-ил]ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-[1-(2-(имидазолидинон-1-ил)этил)пиперидин-4-ил]ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-{1-[2-(2,4-(1H,3H)хиназолиндион-3-ил)этил]пиперидин-4-ил}ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-{1-[2-(1,3-диоксолан-2-ил)этил]пиперидин-4-ил}ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-{1-[2-(3-индолил)этил]пиперидин-4-ил}ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-{1-[3-(1,2,4-триазол-1-ил)пропил]пиперидин-4-ил}ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-[1-(5-бензофуразанилметил)пиперидин-4-ил}ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-[1-(5-хлорбензо[b]тиен-3-илметил)пиперидин-4-ил]ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-[1-(5-фенил-1,2,4-оксадиазол-3-илметил)пиперидин-4-ил]ацетамид;
2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-изопропилпиперидин-4-ил)ацетамид;
2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-этилпиперидин-4-ил}ацетамид;
2-фенил-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил}ацетамид;
2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-циклопентилпиперидин-4-ил)ацетамид;
2-(4-фторфенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-(2-гидроксиэтил)пиперидин-4-ил)ацетамид;
2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-циклобутилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-циклобутилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-(тропин-4-ил)ацетамид;
N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)-N’-бензилкарбамид;
N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)-N’-фенилкарбамид;
N-фенэтил-N-(1-метилпиперидин-4-ил)-N’-бензилкарбамид;
2-фенил-N-(4-метоксибензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-трифторметилфенил)-N-(4-метоксибензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-фторфенил)-N-(4-метоксибензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-метоксибензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метилфенил)-N-(4-хлорбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-гидроксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
N-фенэтил-N-(1-метилпиперидин-4-ил)-N’-фенилкарбамид;
N-(3-фенилпропил)-N-(1-метилпиперидин-4-ил)-N’-бензилкарбамид;
N-(3-фенилпропил)-N-(1-метилпиперидин-4-ил)-N’-фенилкарбамид;
2-(4-метоксифенил)-2,2-этилен-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-альфа-метилбензил-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-(3-тропен-4-ил)ацетамид;
2-фенил-2-этил-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
N-фенэтил-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)амин;
2-(4-метоксифенил)-N-(1-инданил)-N-(1-метилпиперидин-4-ил)ацетамид;
N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)-N’-(4-метоксибензил)карбамид;
2-(3,4-диметоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(3,4-метилендиоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-трет-бутилпиперидин-4-ил)ацетамид;
N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)-N’-фенэтилкарбамид;
N-фенэтил-N-(1-метилпиперидин-4-ил)-N’-фенэтилкарбамид;
N-(4-метилбензил)-N-(1-трет-бутилпиперидин-4-ил)-N’-(4-метоксибензил)карбамид;
2-(4-этоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-бутоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-изопропоксифенил)-N-(4-метилензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-трет-бутоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-бутоксифенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-пропоксифенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-изопропоксифенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид и
2-(4-трет-бутоксифенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид.
Подходящие фармацевтически приемлемые соли соединения согласно настоящему изобретению включают в себя аддитивные соли кислоты, которые могут быть, например, образованы при смешивании раствора соединения согласно настоящему изобретению с раствором фармацевтически приемлемой кислоты, такой как хлористоводородная кислота, серная кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, бензойная кислота, щавелевая кислота, лимонная кислота, винная кислота, угольная кислота или фосфорная кислота. Кроме того, в том случае, когда соединения согласно настоящему изобретению несут кислотную группировку, их подходящие фармацевтически приемлемые соли могут включать в себя соли щелочного металла, например соли натрия или калия, соли щелочноземельного металла, например соли кальция или магния, и соли, образованные с подходящими органическими лигандами, например соли четвертичного аммония. Примеры фармацевтически приемлемых солей включают ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид кальция, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, фумарат, глюконат, глутамат, гидробромид, гидрохлорид, гидроксинафтоат, иодид, изотионат, лактат, лактобионат, лаурат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, нитрат, N-метилглюкаминаммониевую соль, олеат, оксалат, фосфат/дифосфат, салицилат, стеарат, сульфат, сукцинат, таннат, тартрат, тозилат, триэтиодид и соль валериановой кислоты.
Настоящее изобретение включает в себя пролекарства соединений согласно настоящему изобретению. В целом такие пролекарства представляют собой неактивные производные соединений согласно настоящему изобретению, которые легко превращаются in vivo в нужное соединение. Традиционные процедуры отбора и получения подходящих производных пролекарств описаны, например, в руководстве по разработке пролекарств (Design of Prodrugs (ed. H. Bundgaard, Elsevier, 1985). Метаболиты указанных соединений включают в себя активные виды, которые получают при введении соединений согласно настоящему изобретению в биологическую среду.
В том случае, когда соединения согласно настоящему изобретению содержат по меньшей мере один хиральный центр, они могут существовать в виде рацемата или в виде энантиомеров. Следует отметить, что все такие изомеры и их смеси включены в объем, охватываемый настоящим изобретением. Кроме того, некоторые кристаллические формы соединений согласно настоящему изобретению могут существовать в виде полиморфов, и в качестве таковых они также включены в объем настоящего изобретения. В дополнение некоторые соединения согласно настоящему изобретению могут образовывать сольваты с водой (т.е. гидраты) или с обычными органическими растворителями. Такие сольваты также включаются в область настоящего изобретения.
В том случае, когда при получении соединений согласно настоящему изобретению могут образовываться смеси стереоизомеров, такие изомеры могут быть разделены традиционными методами, такими как препаративная хиральная хроматография. Соединения могут быть получены в рацемической форме или в виде индивидуальных энантиомеров посредством стереоселективного синтеза или при разрешении. Соединения могут быть разрешены на свои энантиомерные компоненты с использованием стандартных методик, таких как образование диастереомерных пар при солеобразовании с оптически активной кислотой, такой как (-)-ди-п-толуоил-d-винная кислота и/или (+)-ди-п-толуоил-l-винная кислота, с проведением впоследствии кристаллизации и регенерации свободного основания. Соединения также могут быть разрешены посредством образования диастереомерных сложных эфиров или амидов с последующим хроматографическим разделением и удалением хиральной добавки.
Соединения согласно настоящему изобретению могут вводиться в составе любой из указанных выше композиций и в соответствии с режимом дозирования, известным в технике в случае возникновения потребности в конкретной фармакологической модификации активности моноаминовых рецепторов.
Настоящее изобретение также относится к фармацевтическим композициям, включающим в себя одно или более соединений согласно настоящему изобретению вместе с фармацевтически приемлемым разбавителем или наполнителем. Предпочтительно такие композиции имеют вид стандартных дозированных форм, таких как таблетки, пилюли, капсулы (включая композиции длительного или задержанного высвобождения), порошки, гранулы, эликсиры, настойки, сиропы и эмульсии, стерильные парентеральные растворы или суспензии, аэрозольные или жидкие распылители, капли, ампулы, аутоинжекторные устройства или суппозитории; для перорального, парентерального (например, внутривенного, внутримышечного или подкожного), интраназального, сублингвального или ректального введения, или для введения путем ингаляции или инсуффляции, и могут быть приготовлены в виде композиции соответствующим способом и в соответствии с методиками, принятыми в практике, такими как раскрытые в руководстве Ремингтона (Remington’s Pharmaceutical Sciences (Gennaro, ed., Mack Publishing Co., Easton PA, 1990, включено в настоящее описание в качестве ссылки)). Альтернативно композиции могут быть в форме для пролонгированного высвобождения, подходящей для введения раз в неделю или один раз в месяц, например, в виде нерастворимой соли активного соединения, такой как деканоатная соль, и могут быть адаптированы для получения депо-препарата для внутримышечного введения. Настоящее изобретение также рассматривает соответствующие местные композиции для введения, например, в глаза или кожу, или в слизистые.
Так, например, для перорального введения в виде таблетки или капсулы активный лекарственный компонент может быть объединен с пероральным, нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и др. Кроме того, если желательно или необходимо, подходящие связующие вещества, замасливатели, средства, способствующие разложению, вкусовые вещества и красители также могут вводиться в состав смеси. Подходящие связующие вещества включают в себя, не ограничиваясь приведенным списком, крахмал, желатин, натуральные сахара, такие как глюкоза или бета-лактоза, натуральные и синтетические камеди, такие как аравийская камедь, трагакант или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воск и др. Замасливатели, используемые в указанных дозированных формах, включают в себя, не ограничиваясь приведенным списком, олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и др. Средства, способствующие разложению, включают в себя, не ограничиваясь приведенным списком, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и др.
Для получения твердых композиций, таких как таблетки, активный ингредиент смешивают с подходящим фармацевтическим наполнителем, таким, как указано выше, и другими фармацевтическими разбавителями, например с водой, с образованием твердой предварительной композиции, содержащей гомогенную смесь соединения согласно настоящему изобретению или его фармацевтически приемлемой соли. Термин “гомогенный” в контексте настоящего описания означает, что активный ингредиент распределен равномерно в композиции так, чтобы композицию можно было легко разделить на одинаково эффективные стандартные дозированные формы, такие как таблетки, пилюли и капсулы. Твердая предварительная композиция может быть затем разделена на стандартные дозированные формы указанного выше типа, которые содержат от 0,1 до примерно 50 мг активного ингредиента соединения согласно настоящему изобретению. Таблетки или пилюли с данной композицией могут быть покрыты оболочкой или любым иным способом так, чтобы иметь дозированную форму, обладающую преимуществом пролонгированного действия. Так, например, таблетка или пилюля может включать в себя внутреннее ядро, содержащее активное соединение, и внешний слой в качестве покрывающей оболочки, которая окружает ядро. Внешняя покрывающая оболочка может представлять собой энтеросолюбильный слой, который служит для того, чтобы противостоять разложению в желудке и позволяет внутреннему ядру проходить в интактном виде в двенадцатиперстную кишку или позволяет задерживать его высвобождение. Для получения таких энтеросолюбильных слоев или покрывающих оболочек может использоваться множество материалов, которые включают в себя различные полимерные кислоты и смеси полимерных кислот с традиционными материалами, такими как шеллак, цетиловый спирт и ацетат целлюлозы.
Жидкие формы, которые могут иметь композиции согласно настоящему изобретению для введения пероральным способом или посредством инъекций, включают в себя водные растворы, сиропы с добавкой соответствующих вкусовых веществ, водные или масляные суспензии, ароматизированные эмульсии с пищевыми маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и аналогичные фармацевтические носители. Подходящие для водных суспензий средства, способствующие диспергированию или суспендированию, включают в себя синтетические и натуральные камеди, такие как трагакант, аравийскую камедь, альгинат, декстран, натрийкарбоксиметилцеллюлозу, желатин, метилцеллюлозу или поливинилпирролидон. Другие средства, способствующие диспергированию, которые также могут использоваться, включают в себя глицерин и др. Для парентерального введения желательны стерильные суспензии и растворы. В том случае, когда желательно внутривенное введение, используются изотонические препараты, которые в основном содержат подходящие консерванты. Композиции могут быть также приготовлены в виде офтальмологического раствора или в виде суспензионного образования, например в виде глазных капель, для внутриглазного введения.
В свете вышеприведенного настоящее изобретение также относится к способу облегчения или лечения болезненного состояния, при котором модификация активности моноаминового рецептора, в частности активности серотонинергического 5-HT2A-рецептора, оказывает благоприятный эффект при введении терапевтически эффективного количества соединения согласно настоящему изобретению субъекту, нуждающемуся в таком лечении. Такие заболевания или состояния могут, например, возникать в результате несоответствующей стимуляции или активации серотонинергических рецепторов. Ожидается, что при использовании соединений, которые являются селективными для конкретного подтипа серотонинового рецептора, в частности 5-HT2A, можно в значительной мере избежать проблем, связанных с неблагоприятными побочными эффектами, наблюдаемыми с известными антипсихотическими средствами, такими как экстрапирамидные эффекты.
Термин “терапевтически эффективное количество” в контексте настоящего описания означает количество активного соединения или фармацевтического средства, которое вызывает биологическую или медицинскую реакцию в ткани, системе, организме животного или человека и которое является предметом поиска исследователей, ветеринаров, врачей или других клинических специалистов, и которое подразумевает облегчение симптомов заболевания, которое предстоит лечить.
Соединения согласно настоящему изобретению могут успешно вводиться в виде однократной дневной дозы или в режиме разделения общей дневной дозы на отдельные дозировки и вводиться, например, два, три или четыре раза в день. Кроме того, соединения согласно настоящему изобретению могут вводиться в интраназальной форме посредством местного использования подходящих интраназальных носителей, посредством чрескожных способов введения с использованием тех форм чрескожных пластырей, которые известны специалистам в данной области, например с помощью имплантируемых насосов или посредством других подходящих способов введения. В случае введения посредством чрескожной системы доставки, например, режим дозирования будет представлять собой, разумеется, непрерывный, а не перемежающийся режим дозирования.
Режим дозирования, используемый при введении соединений согласно настоящему изобретению, выбирают в соответствии с множеством факторов, включающих в себя тип, вид, возраст, вес, пол и медицинское состояние пациента, тяжесть состояния, которое предстоит лечить, способ введения, состояние почечной и печеночной функций пациента и природа конкретного используемого соединения. Врач или ветеринар со средним уровнем знаний в данной области может без труда определить и предписать эффективное количество лекарственного средства, необходимое для профилактики, противодействия или для остановки заболевания или расстройства, которое предстоит лечить.
Ежедневная доза рассматриваемых продуктов может варьировать в широком диапазоне примерно от 0,01 мг до 100 мг для взрослого человека в день. Для перорального введения композиции предпочтительно предлагаются в виде таблеток, содержащих 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0 или 50,0 мг активного ингредиента с целью симптоматического подбора дозы для пациента, которого предстоит лечить. Стандартная доза содержит в типичном случае примерно от 0,001 до 50 мг активного ингредиента, предпочтительно примерно от 1мг до 10 мг активного ингредиента. Эффективное количество лекарственного средства обычно поставляется в виде стандартной дозы примерно от 0,0001 мг/кг до 25 мг/кг веса тела в день. Предпочтительно диапазон дозировок составляет примерно от 0,001 до 10 мг/кг веса тела в день и в особенности примерно от 0,001 мг/кг до 1 мг/кг веса тела в день.
Соединения согласно настоящему изобретению могут использоваться отдельно в соответствующих дозировках, определяемых рутинным способом, позволяющих достичь оптимального фармакологического воздействия на моноаминергический рецептор, в частности 5-HT2A-подтип серотонинергического рецептора, при сопутствующей минимизации любого возможного токсического или иного нежелательного эффекта. В дополнение в некоторых случаях может быть желательно совместное введение или последовательное введение других средств, которые улучшают эффект данного соединения.
Фармакологические свойства и селективность соединений согласно настоящему изобретению в отношении конкретных подтипов серотонинергического рецептора могут быть продемонстрированы в различных методах тестирования с использованием подтипов рекомбинантных рецепторов, предпочтительно человеческих рецепторов, если они доступны, например, с использованием традиционного второго мессенджера или тестов на связывание. Особенно удобной системой для функционального тестирования является тест на отбор рецептора и амплификацию, описанный в патенте США No. 5 707 798, который описывает способ скрининга биологически активных соединений при использовании способности клеток, трансфицированных ДНК, кодирующей рецептор, например ДНК, кодирующей различные серотонинергические подтипы, амплифицироваться в присутствии лиганда рецептора. Клеточная амплификация выявляется по повышению уровня маркера, который также экспрессируется клетками.
Методы получения
Соединения согласно настоящему изобретению могут быть синтезированы с помощью описанных ниже методов или при модификации указанных методов. Способы модификации методики включают в себя в числе других варьирование температуры, растворителей, реагентов и др., очевидные для специалистов в данной области.
Так, например, соединения формулы С могут быть синтезированы из соответствующего кетона А посредством восстановительного аминирования с использованием любого первичного амина. Реакцию проводят обычно при перемешивании реагентов в инертном растворителе, таком как метанол или этанол, содержащий уксусную кислоту. В качестве восстановителя могут использоваться NaBH4, NaCNBH3, BH3-пиридин или любой аналогичный реагент, включая реагенты на твердой подложке. Реакцию в типичном случае проводят при комнатной температуре. Кетон А, примером которого может служит пиперидон, может быть выбран из приведенного для формулы (I) перечня соединений, соответствующих Z-группе. Кетоны могут быть либо получены коммерчески либо синтезированы по методике, описанной в литературе (Lowe et al., J. Med. Chem. 37:2831-40 (1994); Carroll et al., J. Med. Chem. 35:2184-91 (1992); или Rubiralta et al., Piperidine-Structure, Prеparation, Reactivity and Synthetic Applications of Piperidine and its Derivatives. (Studies in Organic Chemistry 43, Elsevier, Amsterdam, 1991)). Защитная группа P включает такие группы, которые описаны в руководстве Грина и Вутса (T. W. Greene and P. G. M. Wuts, Protective Groups in Organic Chemistry, 3.Ed. John Wiley & Sons, 1999), которые могут быть выбраны таким образом, чтобы они были стабильными в используемых условиях реакции и легко удалялись на удобных стадиях с использованием известных в технике методик. Типичные защитные группы включают в себя N-Boc, N-Cbz, N-Bn.
Альтернативно амин С может быть синтезирован из первичного амина B посредством восстановительного аминирования с помощью любого альдегида. Реакцию проводят при перемешивании реагентов в инертном растворителе, таком как метанол или этанол, содержащий уксусную кислоту. В качестве восстановителя могут использоваться NaBH4, NaCNBH3, BH3-пиридин или любой родственный реагент, включая реагенты на твердой подложке. Реакцию в типичном случае проводят при комнатной температуре. Первичный амин B, примером которого может быть 4-аминопиперидин, может быть выбран из приведенного для формулы (I) перечня соединений, соответствующих Z-группам. Амины могут быть либо получены коммерчески либо синтезированы из соответствующих кетонов. Защитная группа P может быть выбрана, как указано выше.
Альтернативно амин С может быть синтезирован из первичного амина B посредством алкилирования с помощью любого алкилирующего агента (R-L1). Удаляемая группа L1 в приемлемом варианте представляет собой атом галогена, например атом брома или йода, или сульфонат, например тозилат или мезилат, или другую удаляемую группу, подходящую для данной реакции. Реакцию обычно проводят при перемешивании реагентов в щелочных условиях в инертном растворителе, например в диизопропилэтиламине в ацетонитриле или в K2CO3 в N,N-диметилформамиде. Реакцию в типичном случае проводят при температурах от комнатной температуры до 80°С. Первичный амин B, примером которого является 4-аминопиперидин, может быть выбран из приведенного для формулы (I) перечня соединений, соответствующих Z-группам. Амины могут быть либо получены коммерчески либо синтезированы из соответствующих кетонов. Защитная группа P может быть выбрана, как указано выше.
В приведенной схеме R и R* были определены для формулы (I), P означает подходящую защитную группу и L1 означает подходящую удаляемую группу.
Вторичный амин C может быть ацилирован с использованием любого изоцианата или изотиоцианата (Q1-N=C=W) с образованием соответствующих мочевин или тиомочевин D. Реакцию проводят в типичном случае при перемешивании реагентов с использованием избытка изоцианата или изотиоционата в инертном растворителе, например в дихлорметане, при температуре от 0°С до комнатной температуры и в условиях сушки. Амин С может быть также ацилирован с использованием любого галогенида карбоновой кислоты (Q2COX), например хлорангидрида или карбонового ангидрида ((Q2C=O)2O) с образованием амидов общей структуры E. Реакцию проводят в типичном случае с использованием ацилирующего агента и подходящего основания, например триэтиламина или диизопропилэтиламина в инертном растворителе, например в дихлорметане, при температуре от 0°С до комнатной температуры и в условиях сушки. В качестве альтернативы галогенидам карбоновых кислот и ангидридам карбоновых кислот для ацилирования амина С может использоваться карбоновая кислота (Q2COOH) и соответствующий связывающий реагент, например ДЦК или ЭДКИ. Реакцию проводят в типичном случае с использованием избытка ацилирующего агента и связывающего реагента, в инертном растворителе, например в дихлорметане, при температуре от 0°С до комнатной температуры и в условиях сушки. Соединения общей структуры (E) могут превращены в соответствующие тиоамиды с использованием методики, раскрытой Варма с соавт. (Varma et al., Org. Lett. 1:697-700 (1999); Cherkasov et. al., Tetrahedron 41:2567 (1985); или Scheibye et. al., Bull.Soc. Chim. Belg. 87:229 (1978)).
В приведенной схеме R, Q1, Q2 и W были определены для формулы (I), P означает соответствующую защитную группу и X означает галогенид.
Заместитель G на атом азота в кольце может быть введен в ходе двухступенчатой процедуры. Вначале удаляют защитную группу на мочевине D или на амиде E с использованием известных методик. Так, например, N-Boc-группу удаляют при обработке защищенного основания 4M HCl в диоксане или трифторуксусной кислоте в дихлорметане. На второй стадии вторичные амины, полученные из D и Е, могут быть алкилированы посредством восстановительного аминирования с использованием любого альдегида (T-CHO). Реакцию обычно проводят при перемешивания реагентов в инертном растворителе, таком как метанол или этанол. В качестве восстановителя могут использоваться боргидрид на твердой подложке, NaBH4, NaCNBH3, BH3-пиридин или любой родственный реагент, включая реагенты на твердой подложке. Реакцию в типичном случае проводят при комнатной температуре.
Альтернативно соединения F и G могут быть синтезированы из вторичного амина, полученного из D или E, как описано выше, посредством алкилирования любым алкилирующим агентом (T-L1). Удаляемая группа L1 в приемлемом варианте представляет собой атом галогена, например атом брома или йода, или сульфонат, например тозилат или мезилат, или другую удаляемую группу, подходящую для данной реакции. Реакцию проводят при перемешивании реагентов в щелочных условиях в инертном растворителе, например в диизопропилэтиламине в ацетонитриле или в K2CO3 в N,N-диметилформамиде. Реакцию в типичном случае проводят при температурах от комнатной температуры до 80°С.
Альтернативно Т-группа может быть введена на первой стадии синтетической последовательности, что приводит к образованию соединений согласно настоящему изобретению через N-алкилирование соединения Н любым алкилирующим агентом (Т-L1). Удаляемая группа L1 представляет собой в приемлемом варианте атом галогена, например атом брома или йода, или сульфонат, например тозилат или мезилат, или любую другую удаляемую группу, подходящую для данной реакции. Реакцию обычно проводят при перемешивании реагентов в щелочных условиях в инертном растворителе, например в диизопропилэтиламине в ацетонитриле или в K2CO3 в N,N-диметилформамиде. Реакцию в типичном случае проводят при температурах от комнатной температуры до 80°С. Вторичный амин Н, примером которого является 4-пиперидон, может быть выбран из приведенного для формулы (I) перечня соединений, соответствующих Z-группам. Амины могут быть либо получены коммерчески либо синтезированы в соответствии с описанными методиками (Lowe et al., J. Med. Chem. 37:2831-40 (1994); Carroll et al., J. Med. Chem. 35:2184-91 (1992)).
Альтернативно соединения общей структуры J могут быть синтезированы, исходя из К, с использованием метода, описанного Кюнэ с соавт. (Kuehne et. al., J. Org. Chem. 56:2701 (1991) и Kuehne et. al., J. Org. Chem. (1991), 56:513).

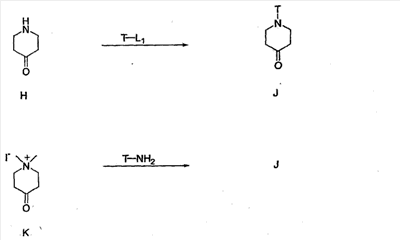
где R, Q1 Q2, W и T были определены для формулы (I), и L1 обозначает подходящую удаляемую группу.
В общем, в ходе любого из процессов получения соединений согласно настоящему изобретению может оказаться необходимой и/или желательной защита чувствительных или реакционноспособных групп на любой из участвующих молекул. Указанная защита может быть достигнута с помощью традиционных защитных групп, таких, какие описаны в соответствующем руководстве (Protective Groups in Organic Chemistry (ed. J.F.W.McOmie, Plenum Press, 1973); и Green & Wuts, Protective Groups in Organic Synthesis , John Wiley & Sons, 1991)). Защитные группы могут быть удалены на соответствующей удобной последующей стадии с использованием известных в технике методов.
Примеры
Далее настоящее изобретение раскрывается с помощью приведенных в нем примеров, которые не следует рассматривать как ограничивающие область настоящего изобретения.
Общая LC-MS процедура, используемая для примеров 1-41: все спектры получают с использованием прибора HP1100 LC/MSD. Используют установку, состоящую из двухтактного насоса, аутосэмплера, колонки с термостатом, диодного детектора и интерфейса с ионизацией методом электронапыления. Используют колонку с обратной фазой (C18 Luna размер частиц 3 мм, размер колонки 7,5 см х 4,6 мм, в.д.) с системой защиты картриджа. Колонку поддерживают при температуре 30°С. Мобильная фаза представляет собой ацетонитрил/8 мМ водный ацетат аммония. Используют 15-минутную градиентную программу, начинают градиент с 70% ацетонитрила, через 12 минут переходят на 95% ацетонитрил, через 1 минуту возвращаются к 70% ацетонитрилу, который удерживают 2 минуты. Скорость течения составляет 0,6 мл/мин. Величину tr , которая приведена в конкретных примерах ниже, получают при использовании данной процедуры.
Пример 1: N-((4-метилфенил)метил)-N-(пиперидин-4-ил)-N’-фенилметилкарбамид (26HCH65)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (1,75 г, 8,8 ммоль) и 4-метилбензиламина (970 мг, 8,0 ммоль) в метаноле (7 мл) добавляют уксусную кислоту в метаноле (1М, 6,7 мл) и затем NaCNBH3 в метаноле (0,3 М, 30 мл). Полученный раствор перемешивают при комнатной температуре. Через 20 часов добавляют воду (5 мл) и смесь перемешивают еще в течение 1 часа, после чего концентрируют. Флэш-хроматография в смеси дихлорметан:этанол (10:1) дает карбоксилат трет-бутил 4-(4-метилфенил)метил)аминопиперидина. Выход: 2,4 г, 98%. К раствору карбоксилата трет-бутил 4-(4-метилфенил)метил)аминопиперидина (800 мг, 2,63 ммоль) в сухом дихлорметане (20 мл) добавляют бензилизоцианат (0,65 мг, 5,26 ммоль) Раствор перемешивают при комнатной температуре. Через 48 часов добавляют избыток 2-диметиламиноэтиламиа. Смесь перемешивают еще в течение 24 часов, после чего концентрируют. Полученный твердый материал перерастворяют в дихлорметане (20 мл), последовательно промывают HCl (0,2 N, 3×30 мл), водой (20 мл), сушат (Na2SO4), фильтруют и концентрируют. Флэш-хроматография с использованием смеси дихлорметан:этанол (10:1) дает N-((4-метилфенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-N’-фенилметилкарбамид (760 мг, 66%), который растворяют в диэтиловом эфире (5 мл). Добавляют HCl (4 М) в диоксане (3 мл) и раствор перемешивают при комнатной температуре в течение 60 минут и затем концентрируют. Полученное масло перерастворяют в смеси дихлорметана и диэтилового эфира (4:1). Органический слой экстрагируют HCl (0,2 М, 3х20 мл). Объединенные водные слои обрабатывают NaOH (0,2 М) до щелочной реакции (pH>8) и затем экстрагируют дихлорметаном (3х20 мл). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения. Выход: 406 мг. 70%; 13С-ЯМР (CDCl3):  21,3, 31,6, 45,0, 45,9, 46,4, 53,0, 126,3, 127,2, 127,4, 128,6, 129,8, 135,3, 137,4, 139,7, 158,5. 21,3, 31,6, 45,0, 45,9, 46,4, 53,0, 126,3, 127,2, 127,4, 128,6, 129,8, 135,3, 137,4, 139,7, 158,5.
Пример 2: N-((4-метилфенил)метил)-N-(1-(2-метилпропил)пиперидин-4-ил)-N’-фенилметилкарбамид (26HCH66-02)
Продукт, полученный в примере 1 (20 мг, 0,06 ммоль), растворяют в абсолютном этаноле (2 мл). Добавляют 2-метилпропиональдегид (0,08 мл, 0,6 ммоль) и затем боргидрид на твердой подложке (150 мг, 2,5 ммоль/г смолы; Aldrich 32864-2). Cмесь встряхивают при комнатной температуре. Через 48 часов смолу отфильтровывают и к органическому раствору добавляют уксусный ангидрид (0,02 мл, 0,2 ммоль). Через 24 часа смесь концентрируют и перерастворяют в метаноле (2 мл). Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3х6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. ИК: 1640, 1185, 1110 см-1; LC-MS: (M+H)+ 394,2, tr 5,60 минут.
Пример 3: N-(1-(2-бромфенил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид (26HCH66-03)
Продукт, полученный в примере 1 (20 мг, 0,06 ммоль), растворяют в абсолютном этаноле (2 мл). Добавляют 2-бромбензальдегид (0,07 мл, 0,6 ммоль) и затем боргидрид на твердой подложке (150 мг, 2,5 ммоль/г смолы; Aldrich 32864-2). Смесь встряхивают при комнатной температуре. Через 48 часов смолу отфильтровывают и к органическому раствору добавляют уксусный ангидрид (0,02 мл, 0,2 ммоль). Через 24 часа смесь концентрируют и перерастворяют в метаноле (2 мл). Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. ИК: 1635, 1180, 1110 см-1; LC-MS: (M+H)+ 506,1, tr 8,37 минут.
Пример 4: N-(1-((4-гидрокси-3-метоксифенил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид (26HCH66-04)
Продукт, полученный в примере 1 (20 мг, 0,06 ммоль), растворяют в абсолютном этаноле (2 мл). Добавляют 4-гидрокси-3-метоксибензальдегид (91 мг, 0,6 ммоль) и затем боргидрид на твердой подложке (150 мг, 2,5 ммоль/г смолы; Aldrich 32864-2). Смесь встряхивают при комнатной температуре. Через 48 часов смолу отфильтровывают и к органическому раствору добавляют уксусный ангидрид (0,02 мл, 0,2 ммоль). Через 24 часа смесь концентрируют и перерастворяют в метаноле (2 мл). Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. 13C-ЯМР (CD3ОD, выбранный):  19,9, 55,4, 126,5, 127,0, 128,1, 129,0, 140,3, 148,0, 148,1, 158,8. 19,9, 55,4, 126,5, 127,0, 128,1, 129,0, 140,3, 148,0, 148,1, 158,8.
Пример 5: N-(1-((5-этилтиен-2-ил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид (26HCH66-05)
Продукт, полученный в примере 1 (20 мг, 0,06 ммоль), растворяют в абсолютном этаноле (2 мл). Добавляют 5-этил-2-тиофенкарбоксальдегид (84 мг, 0,6 ммоль) и затем боргидрид на твердой подложке (150 мг, 2,5 ммоль/г смолы; Aldrich 32,864-2). Смесь встряхивают при комнатной температуре. Через 48 часов смолу отфильтровывают и к органическому раствору добавляют уксусный ангидрид (0,02 мл, 0,2 ммоль). Через 24 часа смесь концентрируют и перерастворяют в метаноле (2 мл). Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. ИК: 1640, 1185, 1110, 805, 700, 620 см-1; LC-MS: (M+H)+ 462,3, tr 7,52 минут.
Пример 6: N-(1-(имидазол-2-илметил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид (26HCH66-06)
Продукт, полученный в примере 1 (20 мг, 0,06 ммоль), растворяют в абсолютном этаноле (2 мл). Добавляют имидазол-2-карбоксальдегид (58 мг, 0,6 ммоль) и затем боргидрид на твердой подложке (150 мг, 2,5 ммоль/г смолы; Aldrich 32864-2). Смесь встряхивают при комнатной температуре. Через 48 часов смолу отфильтровывают и к органическому раствору добавляют уксусный ангидрид (0,02 мл, 0,2 ммоль). Через 24 часа смесь концентрируют и перерастворяют в метаноле (2 мл). Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле, после чего концентрируют с получением указанного в заголовке соединения. ИК: 1620, 1190, 1110, 805, 700, 620 см-1; LC-MS: (M+H)+ 418, 2, tr 2,05 минут.
Пример 7: N-(1-(циклогексилметил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид (26HCH66-09)
Продукт, полученный в примере 1 (20 мг, 0,06 ммоль), растворяют в абсолютном этаноле (2 мл). Добавляют циклогексанкарбоксальдегид (67 мг, 0,6 ммоль) и затем боргидрид на твердой подложке (150 мг, 2,5 ммоль/г смолы; Aldrich 32864-2). Смесь встряхивают при комнатной температуре. Через 48 часов смолу отфильтровывают и к органическому раствору добавляют уксусный ангидрид (0,02 мл, 0,2 ммоль). Через 24 часа смесь концентрируют и перерастворяют в метаноле (2 мл). Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3х6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. ИК: 1635, 1175, 1110, 805, 695, 620 см-1; LC-MS: (M+H)+ 434,4, tr 7,44 минут.
Пример 8: N-(1-((4-фторфенил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид (26HCH66-10)
Продукт, полученный в примере 1 (20 мг, 0,06 ммоль), растворяют в абсолютном этаноле (2 мл). Добавляют 4-фторбензальдегид (0,08 мл, 0,6 ммоль) и затем боргидрид на твердой подложке (150 мг, 2,5 ммоль/г смолы; Aldrich 32864-2). Смесь встряхивают при комнатной температуре. Через 48 часов смолу отфильтровывают и к органическому раствору добавляют уксусный ангидрид (0,02 мл, 0,2 ммоль). Через 24 часа смесь концентрируют и перерастворяют в метаноле (2 мл). Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3х6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. ИК: 1640, 1175, 1110, 805, 700, 620 см-1; LC-MS: (M+H)+ 446,3, tr 5,62 минут.
Пример 9: Гидрохлорид N-((4-метилфенил)метил)-N-(1-(фенилметил)пиперидин-4-ил)-N’-фенилметилкарбамида (26HCH16D)
К раствору 1-бензил-4-пиперидона (1,74 г, 9,2 ммоль) и 4-метилбензиламина (0,97 г, 8 ммоль) в метаноле (30 мл) небольшими порциями в течение 30 минут добавляют боргидрид натрия (525 мг). Реакционную смесь перемешивают при комнатной температуре. Через 16 часов смесь концентрируют. Добавляют воду (30 мл) и смесь экстрагируют дихлорметаном (2 х 20 мл). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют с получением 4-((4-метилфенил)метил)амино-1-фенилметилпиперидина. Сырой продукт используют далее без дополнительной очистки.
4-((4-метилфенил)метил)амино-1-фенилметилпиперидин (800 мг, 2,7 ммоль) растворяют в сухом дихлорметане (30 мл). Добавляют бензилизоцианат (543 мг, 4,1 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 16 часов добавляют воду (10 мл) и затем NaOH (6 N, 2 мл). После 30 минут дополнительного перемешивания отфильтровывают белые кристаллы. Органический слой отделяют и сушат (Na2SO4), фильтруют и концентрируют. Флэш-хроматография в смеси дихлорметан/метанол (10:1) дает N-((4-метилфенил)метил)-N-(1-(фенилметил)пиперидин-4-ил)-N’-фенилметилкарбамид. Выход: 820 мг, 71%. Образец концентрируют с использованием HCl (4 М в диоксане) и затем проводят перекристаллизацию из смеси дихлорметан/диэтиловый эфир, получая указанное в заголовке соединение. 1H-ЯМР (СDСl3):  1,87 (ушд, 2 H), 2,30 (с, 3 H), 2,59 (дкв, 2 H), 2,76 (ушкв, 2 H), 3,44 (ушд, 2 H), 4,09 (д, 2 H), 4,30 (д, 2 H), 4,40 (с, 2 H), 4,64-4,76 (м, 2 H), 6,98-7,64 (ароматические протоны, 14 H). 13C-ЯМР (CDCl3): 1,87 (ушд, 2 H), 2,30 (с, 3 H), 2,59 (дкв, 2 H), 2,76 (ушкв, 2 H), 3,44 (ушд, 2 H), 4,09 (д, 2 H), 4,30 (д, 2 H), 4,40 (с, 2 H), 4,64-4,76 (м, 2 H), 6,98-7,64 (ароматические протоны, 14 H). 13C-ЯМР (CDCl3):  21,2, 26,7, 45,0, 46,0, 49,7, 52,2, 61,0, 126,2, 127,26, 126,31, 128,2, 128,6, 129,6, 129,9, 130,4, 131,6, 134,4, 137,6, 139,3, 158,5. 13C-ЯМР (CD3ОD, ротамеры): 21,2, 26,7, 45,0, 46,0, 49,7, 52,2, 61,0, 126,2, 127,26, 126,31, 128,2, 128,6, 129,6, 129,9, 130,4, 131,6, 134,4, 137,6, 139,3, 158,5. 13C-ЯМР (CD3ОD, ротамеры):  19,8, 26,4, 27,8, 40,3, 44,3, 51,6, 51,9, 54,5, 60,5, 110,0, 112,1, 114,0, 114,2, 117,5, 125,9, 126,2, 126,7, 126,8, 128,9, 129,1, 129,2, 129,4, 129,7, 130,1, 131,2, 134,5, 137,4, 159,1, 173,8, 175,0. Тпл. 109-112°С. Данные элементного анализа: Найдено (в %): С – 70,06; Н – 7,62; N – 8,60; расчет для моногидрата: С – 69,76; Н – 7,53; N – 8,72. 19,8, 26,4, 27,8, 40,3, 44,3, 51,6, 51,9, 54,5, 60,5, 110,0, 112,1, 114,0, 114,2, 117,5, 125,9, 126,2, 126,7, 126,8, 128,9, 129,1, 129,2, 129,4, 129,7, 130,1, 131,2, 134,5, 137,4, 159,1, 173,8, 175,0. Тпл. 109-112°С. Данные элементного анализа: Найдено (в %): С – 70,06; Н – 7,62; N – 8,60; расчет для моногидрата: С – 69,76; Н – 7,53; N – 8,72.
Пример 10: Оксалат N-((4-метилфенил)метил)-N-(1-(фенилметил)пиперидин-4-ил)-N’-фенилметилкарбамида (34JJ59oxal)
N-((4-метилфенил)метил)-N-(1-(фенилметил)пиперидин-4-ил)-N’-фенилметилкарбамид получают, как описано выше в примере 9. Образец осаждают в виде оксалата и перекристаллизовывают из этилацетата с получением указанного в заголовке соединения. 13C-ЯМР (CDCl3):  21,2, 27,0, 45,0, 45,9, 49,9, 52,1, 60,6, 126,1, 127,3, 127,4, 128,5, 128,7, 129,6, 130,0, 130,4, 131,2, 134,3, 137,7, 139,3, 158,4, 163,4; Тпл. 180-182°С; Данные элементного анализа: Найдено (в %): С – 69,54; Н – 6,73; N – 7,96; расчет для монооксалата: С – 69,61; Н – 6,82; N – 8,12. 21,2, 27,0, 45,0, 45,9, 49,9, 52,1, 60,6, 126,1, 127,3, 127,4, 128,5, 128,7, 129,6, 130,0, 130,4, 131,2, 134,3, 137,7, 139,3, 158,4, 163,4; Тпл. 180-182°С; Данные элементного анализа: Найдено (в %): С – 69,54; Н – 6,73; N – 7,96; расчет для монооксалата: С – 69,61; Н – 6,82; N – 8,12.
Пример 11: Гидрохлорид N-((4-метилфенил)метил)-N-(1-(фенилметил)пиперидин-4-ил)-4-метоксифенилацетамида (26 HCH17)
К раствору 1-бензил-4-пиперидона (1,74 г, 9,2 ммоль) и 4-метилбензиламина (0,97 г, 8 ммоль) в метаноле (30 мл) небольшими порциями в течение 30 минут добавляют боргидрид натрия (525 мг). Реакционную смесь перемешивают при комнатной температуре. Через 16 часов смесь концентрируют. Добавляют воду (30 мл) и смесь экстрагируют дихлорметаном (2 х 20 мл). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют с получением 4-((4-метилфенил)метил)амино-1-фенилметилпиперидина. Сырой продукт используют далее без дополнительной очистки.
К раствору 4-((4-метилфенил)метил)амино-1-фенилметилпиперидина (800 мг, 2,7 ммоль) в сухом дихлорметане (30 мл) добавляют диизопропилэтиламин (1,5 мл) и затем 4-метоксифенилацетилхлорид (997 мг, 4,5 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 16 часов реакционную смесь концентрируют, перерастворяют в диэтиловом эфире и экстрагируют HCl (0,6 N). Водный слой отделяют, обрабатывают NaOH (1 N) до щелочной реакции и экстрагируют дихлорметаном (20 мл). Отделяют органический слой, сушат его (Na2SO4), фильтруют и концентрируют, после чего перерастворяют в диэтиловом эфире. Добавляют HCl (4 М в диоксане) с образованием гидрохлорида, который повторно кристаллизуют из диэтилового эфира с получением указанного в заголовке соединения. Выход: 600 мг, 50%. 1Н-ЯМР (CDCl3):  1,75 (д, 2 H), 2,32 (с, 3 H), 2,50 (кв, 2 H), 2,70 (кв, 2 H), 3,38 (д, 2 H), 3,54 (с, 2 H), 3,78 (с, 3 H), 4,06 (д, 2 H), 4,54 (с, 2 H), 4,82 (м, 1 H), 6,78-7,60 (ароматические протоны, 13 H). 13C-ЯМР (CDCl3): 1,75 (д, 2 H), 2,32 (с, 3 H), 2,50 (кв, 2 H), 2,70 (кв, 2 H), 3,38 (д, 2 H), 3,54 (с, 2 H), 3,78 (с, 3 H), 4,06 (д, 2 H), 4,54 (с, 2 H), 4,82 (м, 1 H), 6,78-7,60 (ароматические протоны, 13 H). 13C-ЯМР (CDCl3):  21,0, 26,0, 40,3, 46,3, 49,0, 51,8, 55,3, 60,8, 114,2, 125,6, 126,6, 127,9, 129,4, 129,60, 129,62, 130,3, 131,4, 134,8, 137,1, 158,7, 172,9. Тпл. 197-200°С. Данные элементного анализа: Найдено (в %): С – 71,29; Н – 7,25; N – 5,73; расчет для гидрата: С – 71,37; Н – 7,43; N – 5,74. 21,0, 26,0, 40,3, 46,3, 49,0, 51,8, 55,3, 60,8, 114,2, 125,6, 126,6, 127,9, 129,4, 129,60, 129,62, 130,3, 131,4, 134,8, 137,1, 158,7, 172,9. Тпл. 197-200°С. Данные элементного анализа: Найдено (в %): С – 71,29; Н – 7,25; N – 5,73; расчет для гидрата: С – 71,37; Н – 7,43; N – 5,74.
Пример 12: Оксалат N-((4-метилфенил)метил)-N-(1-(фенилметил)пиперидин-4-ил)-4-метоксифенилацетамида (34JJ61oxal)
N-((4-метилфенил)метил)-N-(1-(фенилметил)пиперидин-4-ил)-4-метоксифенилацетамид получают, как описано выше в примере 11. Образец осаждают в виде оксалата и повторно кристаллизуют из тетрагидрофурана с получением указанного в заголовке соединения. 13C-ЯМР (CDCl3):  21,2, 26,4, 40,6, 52,0, 55,5, 114,4, 125,9, 126,7, 128,4, 129,6, 129,8, 129,9, 130,4, 131,2, 134,6, 137,6, 158,9, 163,3, 172,9. Тпл. 171-173°С. Данные элементного анализа: Найдено (в %): С – 69,56; Н – 6,74; N – 5,16; расчет для монооксалата: С – 69,48; Н – 6,61; N – 5,40. 21,2, 26,4, 40,6, 52,0, 55,5, 114,4, 125,9, 126,7, 128,4, 129,6, 129,8, 129,9, 130,4, 131,2, 134,6, 137,6, 158,9, 163,3, 172,9. Тпл. 171-173°С. Данные элементного анализа: Найдено (в %): С – 69,56; Н – 6,74; N – 5,16; расчет для монооксалата: С – 69,48; Н – 6,61; N – 5,40.
Пример 13: N-((4-метилфенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид (26HCH71B)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (1,75 г, 8,8 ммоль) и 4-метилбензиламина (970 мг, 8,0 ммоль) в метаноле (7 мл) добавляют уксусную кислоту в метаноле (1М, 6,7 мл) и затем NaCNBH3 в метаноле (0,3 М, 30 мл). Полученный раствор перемешивают при комнатной температуре. Через 20 часов добавляют воду (5 мл) и смесь перемешивают еще в течение 1 часа, после чего концентрируют. Флэш-хроматография в смеси дихлорметан:этанол (10:1) дает карбоксилат трет-бутил 4-(4-метилфенил)метил)аминопиперидина. Выход: 2,4 г, 98%. К раствору карбоксилата трет-бутил 4-(4-метилфенил)метил)аминопиперидина (862 мг, 2,83 ммоль) в сухом дихлорметане (10 мл) добавляют диизопропилэтиламин (1,1 мл, 6,5 ммоль) и затем 4-метоксифенилацетилхлорид (0,66 мл, 4,3 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 48 часов добавляют воду (5 мл) и смесь перемешивают еще в течение 2 часов, после чего экстрагируют NaOH (0,2 N, 2 x 15мл), HCl (0,2 N, 2 х 15 мл) и водой (15 мл). Органический слой сушат (Na2SO4) и концентрируют с получением N-((4-метилфенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамида. Сырой продукт используют далее без дополнительной очистки. N-((4-метилфенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамид растворяют в диэтиловом эфире (2 мл) и добавляют HCl (3 мл, 4 М в диоксане). Реакционную смесь перемешивают при комнатной температуре. Через 2 часа добавляют воду (5 мл) и смесь экстрагируют HCl (0,1 N, 3 х 30 мл). Объединенные водные слои обрабатывают NaOH (0,2 М) до щелочной реакции (pH>8). Водный слой экстрагируют диэтиловым эфиром (2 х 20 мл). Объединенные органические слои сушат (Na2SO4) и концентрируют, после чего растворяют в метаноле (2 мл). Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют. Дополнительная флэш-хроматография в смеси дихлорметан:этанол (1:1) и далее метанолом, содержащим 2% NH3, дает указанное в заголовке соединение. Выход: 466 мг. 47%. 13C-ЯМР (CD3ОD, ротамеры):  19,9, 27,8, 29,7, 40,2, 40,3, 44,4, 44,45, 44,50, 52,4, 54,5, 55,5, 114,0, 114,1, 126,0, 126,7, 126,9, 127,3, 128,7, 129,3, 129,6, 129,7, 135,1, 136,1, 136,2, 137,1, 159,0, 159,1, 173,1, 173,7. 19,9, 27,8, 29,7, 40,2, 40,3, 44,4, 44,45, 44,50, 52,4, 54,5, 55,5, 114,0, 114,1, 126,0, 126,7, 126,9, 127,3, 128,7, 129,3, 129,6, 129,7, 135,1, 136,1, 136,2, 137,1, 159,0, 159,1, 173,1, 173,7.
Пример 14: N-(1-(3,3-диметилбутил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид (26HCH79-5)
Продукт, полученный в приведенном выше примере 13 (20 мг, 0,06 ммоль), растворяют в абсолютном этаноле (2 мл). Добавляют 3,3-диметилбутиральдегид (0,143 мл, 1,1 ммоль) и затем боргидрид на твердой подложке (150 мг, 2,5 ммоль/г смолы; Aldrich 32864-2). Смесь встряхивают при комнатной температуре. Через 48 часов смолу отфильтровывают и к органическому раствору добавляют уксусный ангидрид (0,02 мл, 0,2 ммоль). Через 24 часа смесь концентрируют и перерастворяют в метаноле (2 мл). Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3х6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. Выход: 26 мг; 13C-ЯМР (CD3OD, ротамеры):  19,9, 27,4, 28,4, 28,8, 29,2, 29,3, 38,3, 38,4, 40,2, 40,3, 44,3, 52,0, 52,3, 52,4, 53,9, 54,6, 54,9, 114,0, 114,1, 126,0, 126,8, 127,0, 127,3, 128,8, 129,4, 129,8, 129,9, 135,0, 136,1, 136,3, 137,1, 158,96, 159,05, 173,2, 173.8. 19,9, 27,4, 28,4, 28,8, 29,2, 29,3, 38,3, 38,4, 40,2, 40,3, 44,3, 52,0, 52,3, 52,4, 53,9, 54,6, 54,9, 114,0, 114,1, 126,0, 126,8, 127,0, 127,3, 128,8, 129,4, 129,8, 129,9, 135,0, 136,1, 136,3, 137,1, 158,96, 159,05, 173,2, 173.8.
Пример 15: N-(1-(циклогексилметил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид (26HCH79-6)
Продукт, полученный в приведенном выше примере 13 (20 мг, 0,06 ммоль), растворяют в абсолютном этаноле (2 мл). Добавляют циклогексанкарбоксальдегид (0,138 мл, 1,1 ммоль) и затем боргидрид на твердой подложке (150 мг, 2,5 ммоль/г смолы; Aldrich 32864-2). Смесь встряхивают при комнатной температуре. Через 48 часов смолу отфильтровывают и к органическому раствору добавляют уксусный ангидрид (0,02 мл, 0,2 ммоль). Через 24 часа смесь концентрируют и перерастворяют в метаноле (2 мл). Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3х6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. Выход: 17 мг; HRMS (FAB+, NBA) (M+H)+ 449,3163 Для C29H41N2O2 требуется 449,3168; LC-MS: (M+H)+ 449,2, tr 7,92 минут.
Пример 16: N-((4-метилфенил)метил)-N-(1-(2-метилпропил)пиперидин-4-ил)-4-метоксифенилацетамид (26HCH79-7)
Продукт, полученный в приведенном выше примере 13 (20 мг, 0,06 ммоль), растворяют в абсолютном этаноле (2 мл). Добавляют 2-метилпропиональдегид (0,104 мл, 1,1 ммоль) и затем боргидрид на твердой подложке (150 мг, 2,5 ммоль/г смолы; Aldrich 32864-2). Смесь встряхивают при комнатной температуре. Через 48 часов смолу отфильтровывают и к органическому раствору добавляют уксусный ангидрид (0,02 мл, 0,2 ммоль). Через 24 часа смесь концентрируют и перерастворяют в метаноле (2 мл). Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. Выход: 19 мг; HRMS (FAB+, NBA) (M+H)+ 409,2858. Для C26H37N2O2 требуется 409,2855; LC-MS: (M+H)+ 409,2, tr 5,97 минут.
Пример 17: N-((4-метилфенил)метил)-N-(1-((4-метилфенил)метил)пиперидин-4-ил)-4-метоксифенилацетамид (26HCH79-8)
Продукт, полученный в приведенном выше из примере 13 (20 мг, 0,06 ммоль), растворяют в абсолютном этаноле (2 мл). Добавляют 4-метилбензальдегид (0,134 мл, 1,1 ммоль) и затем боргидрид на твердой подложке (150 мг, 2,5 ммоль/г смолы; Aldrich 32864-2). Смесь встряхивают при комнатной температуре. Через 48 часов смолу отфильтровывают и к органическому раствору добавляют уксусный ангидрид (0,02 мл, 0,2 ммоль). Через 24 часа смесь концентрируют и перерастворяют в метаноле (2 мл). Раствор вносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3х6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. Выход: 22 мг; HRMS (FAB+, NBA) (M+H)+ 457,2853. Для C30H37N2O2 требуется 457,2855; LC-MS: (M+H)+ 457,2, tr 6,97 минут.
Пример 18: N-(1-((4-гидроксифенил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид (26HCH79-9)
Продукт, полученный в приведенном выше примере 13 (20 мг, 0,06 ммоль), растворяют в абсолютном этаноле (2 мл). Добавляют 4-гидроксибензальдегид (139 мг, 1,1 ммоль) и затем боргидрид на твердой подложке (150 мг, 2,5 ммоль/г смолы; Aldrich 32864-2). Смесь встряхивают при комнатной температуре. Через 48 часов смолу отфильтровывают и к органическому раствору добавляют уксусный ангидрид (0,02 мл, 0,2 ммоль). Через 24 часа смесь концентрируют и перерастворяют в метаноле (2 мл). Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3х6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. Выход: 19 мг; HRMS (FAB+, NBA) (M+H)+ 459,2655. Для C29H35N2O3 требуется 459,2648; LC-MS: (M+H)+ 459,1, tr 2,84 минут.
Пример 19: N-(1-((2-гидроксифенил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид (26HCH79-10)
Продукт, полученный в приведенном выше примере 13 (20 мг, 0,06 ммоль), растворяют в абсолютном этаноле (2 мл). Добавляют 2-гидроксибензальдегид (0,122 мл, 1,1 ммоль) и затем боргидрид на твердой подложке (150 мг, 2,5 ммоль/г смолы; Aldrich 32864-2). Раствор встряхивают при комнатной температуре. Через 48 часов смолу отфильтровывают и к органическому раствору добавляют уксусный ангидрид (0,02 мл, 0,2 ммоль). Через 24 часа смесь концентрируют и перерастворяют в метаноле (2 мл). Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3х6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. Выход: 16 мг; HRMS (FAB+, NBA) (M+H)+ 459,2633. Для C29H35N2O3 требуется 459,2648; LC-MS: (M+H)+ 459,2, tr 5,81 минут.
Пример 20: N-((3-фенилпропил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид (26HCH80-1)
К раствору коммерчески доступного карбоксилата трет-бутила 4-оксо-1-пиперидина (400 мг, 2 ммоль) в метаноле (1 мл) и 3-фенилпропиламина (0,143 мл, 1 ммоль) в метаноле (1 мл) добавляют уксусную кислоту в метаноле (1М, 1,34 мл) и затем NaCNBH3 в метаноле (0,3 М, 4,4 мл). Полученный раствор перемешивают при комнатной температуре. Через 24 часа добавляют воду (2 мл) и смесь перемешивают в течение 1 часа, после чего концентрируют. Полученное масло перерастворяют в диэтиловом эфире (20 мл) и экстрагируют HCl (0,1 N, 1 х 15 мл). Водный слой промывают диэтиловым эфиром (10 мл) и обрабатывают 0,2 N NaOH до щелочной реакции (pH>8), после чего проводят экстракцию дихлорметаном (20 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют с получением карбоксилата трет-бутил 4-(3-фенилпропил)аминопиперидина. Выход: 110 мг. К раствору карбоксилата трет-бутил 4-(3-фенилпропил)аминопиперидина (50 мг, 0,16 ммоль) в дихлорметане (6 мл) добавляют диизопропилэтиламин (0,070 мл, 0,4 ммоль) и затем 4-метоксифенилацетилхлорид (0,055 мл, 0,35 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 18 часов добавляют воду (2 мл). Смесь перемешивают еще в течение 2 часов. Далее смесь последовательно промывают HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и водой (10 мл), сушат (Na2SO4), фильтруют и концентрируют с получением N-(3-фенилпропил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамида. Сырой продукт используют далее без дополнительной очистки. N-(3-фенилпропил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамид растворяют в диэтиловом эфире (2 мл) и добавляют HCl (1 мл, 4 М в диоксане). Реакционную смесь перемешивают при комнатной температуре. Через 2,5 часа добавляют NaOH (1 мл, 6 N) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 15 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. Выход: 61 мг; 13C–ЯМР (CD3OD, ротамеры):  27,8, 29,4, 30,8, 32,3, 32,7, 33,3, 40,2, 40,5, 42,0, 44,5, 44,6, 44,9, 52,7, 54,56, 54,57, 54,9, 114,0, 114,1, 125,7, 126,1, 127,0, 127,4, 128,2, 128,3, 128,5, 129,47, 129,55, 141,2, 141,8, 158,9, 159,0, 172,5, 172,7. 27,8, 29,4, 30,8, 32,3, 32,7, 33,3, 40,2, 40,5, 42,0, 44,5, 44,6, 44,9, 52,7, 54,56, 54,57, 54,9, 114,0, 114,1, 125,7, 126,1, 127,0, 127,4, 128,2, 128,3, 128,5, 129,47, 129,55, 141,2, 141,8, 158,9, 159,0, 172,5, 172,7.
Пример 21: N-(2-фенилэтил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид (26HCH80-2)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (400 мг, 2 ммоль) в метаноле (1 мл) и 2-фенилэтиламина (0,143 мл, 1 ммоль) в метаноле (1 мл) добавляют уксусную кислоту в метаноле (1М, 1,34 мл) и затем NaCNBH3 в метаноле (0,3 М, 4,4 мл). Полученный раствор перемешивают при комнатной температуре. Через 24 часа добавляют воду (2 мл) и смесь перемешивают в течение 1 часа, после чего концентрируют. Полученное масло перерастворяют в диэтиловом эфире (20 мл) и экстрагируют HCl (0,1 N, 1 х 15 мл). Водный слой промывают диэтиловым эфиром (10 мл) и обрабатывают 0,2 N NaOH до щелочной реакции (pH>8), после чего проводят экстракцию дихлорметаном (20 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют с получением карбоксилата трет-бутил 4-(2-фенилэтил)аминопиперидина. Выход: 221 мг. К раствору карбоксилата трет-бутил 4-(2-фенилэтил)аминопиперидина (50 мг, 0,16 ммоль) в дихлорметане (6 мл) добавляют диизопропилэтиламин (0,070 мл, 0,4 ммоль) и затем 4-метоксифенилацетилхлорид (0,055 мл, 0,35 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 18 часов добавляют воду (2 мл). Смесь перемешивают еще в течение 2 часов. Далее смесь последовательно промывают HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и водой (10 мл), сушат (Na2SO4), фильтруют и концентрируют с получением N-(2-фенилэтил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамида. Сырой продукт используют далее без дополнительной очистки. N-(2-фенилэтил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамид растворяют в диэтиловом эфире (2 мл) и добавляют HCl (1 мл, 4 М в диоксане). Реакционную смесь перемешивают при комнатной температуре. Через 2,5 часа добавляют NaOH (1 мл, 6 N) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 15 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. Выход: 52 мг; 13С-ЯМР (CD3OD, ротамеры):  27,1, 28,5, 34,9, 36,6, 40,2, 40,4, 44,1, 44,2, 44,4, 53,3, 54,2, 54,6, 114,0, 114,1, 126,2, 126,6, 127,2, 127,4, 128,3, 128,6, 128,79, 128,82, 129,7, 138,5, 139,5, 158,96, 159,0, 172,7, 173,1. 27,1, 28,5, 34,9, 36,6, 40,2, 40,4, 44,1, 44,2, 44,4, 53,3, 54,2, 54,6, 114,0, 114,1, 126,2, 126,6, 127,2, 127,4, 128,3, 128,6, 128,79, 128,82, 129,7, 138,5, 139,5, 158,96, 159,0, 172,7, 173,1.
Пример 22: N-((2-метоксифенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид (26HCH80-4)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (400 мг, 2 ммоль) в метаноле (1 мл) и 2-метоксибензиламина (0,130 мл, 1 ммоль) в метаноле (1 мл) добавляют уксусную кислоту в метаноле (1М, 1,34 мл) и затем NaCNBH3 в метаноле (0,3 М, 4,4 мл). Полученный раствор перемешивают при комнатной температуре. Через 24 часа добавляют воду (2 мл) и смесь перемешивают в течение 1 часа, после чего концентрируют. Полученное масло перерастворяют в диэтиловом эфире (20 мл) и экстрагируют HCl (0,1 N, 1 х 15 мл). Водный слой промывают диэтиловым эфиром (10 мл) и обрабатывают 0,2 N NaOH до щелочной реакции (pH>8), после чего проводят экстракцию дихлорметаном (20 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют с получением карбоксилата трет-бутил 4-((2-метоксифенил)метил)аминопиперидина. Выход: 211 мг. К раствору карбоксилата трет-бутил 4-((2-метоксифенил)метил)аминопиперидина (50 мг, 0,16 ммоль) в дихлорметане (6 мл) добавляют диизопропилэтиламин (0,070 мл, 0,4 ммоль) и затем 4-метоксифенилацетилхлорид (0,055 мл, 0,35 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 18 часов добавляют воду (2 мл). Смесь перемешивают еще в течение 2 часов. Далее смесь последовательно промывают HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и водой (10 мл), сушат (Na2SO4), фильтруют и концентрируют с получением N-((2-метоксифенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамида. Сырой продукт используют далее без дополнительной очистки. N-((2-метоксифенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамид растворяют в диэтиловом эфире (2 мл) и добавляют HCl (1 мл, 4 М в диоксане). Реакционную смесь перемешивают при комнатной температуре. Через 2,5 часа добавляют NaOH (1 мл, 6 N) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 15 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. Выход: 40 мг; 13С-ЯМР (CD3OD, ротамеры):  26,1, 27,4, 40,0, 40,1, 43,5, 43,9, 51,5, 53,4, 54,5, 54,58, 54,63, 54,78, 54,83, 110,1, 110,5, 113,76, 113,78, 113,84, 114,0, 114,1, 120,1, 120,5, 125,4, 126,0, 126,5, 126,7, 127,1, 127,3, 127,7, 128,8, 129,8, 130,0, 130,08, 130,14, 156,5, 157,0, 159,0, 159,1, 173,2, 173,8. 26,1, 27,4, 40,0, 40,1, 43,5, 43,9, 51,5, 53,4, 54,5, 54,58, 54,63, 54,78, 54,83, 110,1, 110,5, 113,76, 113,78, 113,84, 114,0, 114,1, 120,1, 120,5, 125,4, 126,0, 126,5, 126,7, 127,1, 127,3, 127,7, 128,8, 129,8, 130,0, 130,08, 130,14, 156,5, 157,0, 159,0, 159,1, 173,2, 173,8.
Пример 23: N-((2-хлорфенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид (26HCH80-5)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (400 мг, 2 ммоль) в метаноле (1 мл) и 2-хлорбензиламина (0,121 мл, 1 ммоль) в метаноле (1 мл) добавляют уксусную кислоту в метаноле (1М, 1,34 мл) и затем NaCNBH3 в метаноле (0,3 М, 4,4 мл). Полученный раствор перемешивают при комнатной температуре. Через 24 часа добавляют воду (2 мл) и смесь перемешивают в течение 1 часа, после чего концентрируют. Полученное масло перерастворяют в диэтиловом эфире (20 мл) и экстрагируют HCl (0,1 N, 1 х 15 мл). Водный слой промывают диэтиловым эфиром (10 мл) и обрабатывают 0,2 N NaOH до щелочной реакции (pH>8), после чего проводят экстракцию дихлорметаном (20 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют с получением карбоксилата трет-бутил 4-((2-хлорфенил)метил)аминопиперидина. Выход: 137 мг. К раствору карбоксилата трет-бутил 4-((2-хлорфенил)метил)аминопиперидина (50 мг, 0,15 ммоль) в дихлорметане (6 мл) добавляют диизопропилэтиламин (0,070 мл, 0,4 ммоль) и затем 4-метоксифенилацетилхлорид (0,055 мл, 0,35 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 18 часов добавляют воду (2 мл). Смесь перемешивают еще в течение 2 часов. Далее смесь последовательно промывают HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и водой (10 мл), сушат (Na2SO4), фильтруют и концентрируют с получением N-((2-хлорфенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамида. Сырой продукт используют далее без дополнительной очистки. N-((2-хлорфенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамид растворяют в диэтиловом эфире (2 мл) и добавляют HCl (1 мл, 4 М в диоксане). Реакционную смесь перемешивают при комнатной температуре. Через 2,5 часа добавляют NaOH (1 мл, 6 N) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 15 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. Выход: 45 мг; 13C-ЯМР (CD3OD, ротамеры):  25,8, 26,9, 40,0, 40,1, 42,9, 43,4, 43,7, 46,0, 51,1, 53,0, 54,6, 113,77, 113,84, 114,0, 114,1, 126,6, 126,8, 127,08, 127,13, 127,3, 127,4, 128,1, 129,0, 129,2, 129,8, 130,0, 130,2, 131,9, 132,2, 135,0, 135,3, 159,1, 173,4, 173,8. 25,8, 26,9, 40,0, 40,1, 42,9, 43,4, 43,7, 46,0, 51,1, 53,0, 54,6, 113,77, 113,84, 114,0, 114,1, 126,6, 126,8, 127,08, 127,13, 127,3, 127,4, 128,1, 129,0, 129,2, 129,8, 130,0, 130,2, 131,9, 132,2, 135,0, 135,3, 159,1, 173,4, 173,8.
Пример 24: N-((3,4-диметоксифенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид (26HCH80-6)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (400 мг, 2 ммоль) в метаноле (1 мл) и 3,4-диметоксибензиламина (0,151 мл, 1 ммоль) в метаноле (1 мл) добавляют уксусную кислоту в метаноле (1М, 1,34 мл) и затем NaCNBH3 в метаноле (0,3 М, 4,4 мл). Полученный раствор перемешивают при комнатной температуре. Через 24 часа добавляют воду (2 мл) и смесь перемешивают еще в течение 1 часа, после чего концентрируют. Полученное масло перерастворяют в диэтиловом эфире (20 мл) и экстрагируют HCl (0,1 N, 1 х 15 мл). Водный слой промывают диэтиловым эфиром (10 мл) и обрабатывают 0,2 N NaOH до щелочной реакции (pH>8), после чего проводят экстракцию дихлорметаном (20 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют с получением карбоксилата трет-бутил 4-((3,4-диметоксифенил)метил)аминопиперидина. Выход: 162 мг. К раствору карбоксилата трет-бутил 4-((3,4-диметоксифенил)метил)аминопиперидина (50 мг, 0,14 ммоль) в дихлорметане (6 мл) добавляют диизопропилэтиламин (0,070 мл, 0,4 ммоль) и затем 4-метоксифенилацетилхлорид (0,055 мл, 0,35 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 18 часов добавляют воду (2 мл). Смесь перемешивают еще в течение еще 2 часов. Далее смесь последовательно промывают HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и водой (10 мл), сушат (Na2SO4), фильтруют и концентрируют с получением N-((3,4-диметоксифенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамида. Сырой продукт используют далее без дополнительной очистки. N-((3,4-диметоксифенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамид растворяют в диэтиловом эфире (2 мл) и добавляют HCl (1 мл, 4 М в диоксане). Реакционную смесь перемешивают при комнатной температуре. Через 2,5 часа добавляют NaOH (1 мл, 6 N) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 15 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. Выход: 54 мг; 13C-ЯМР (CD3OD, ротамеры):  25,9, 27,3, 40,0, 40,1, 43,5, 43,8, 44,1, 51,4, 53,5, 54,6, 55,4, 110,2, 111,0, 111,9, 112,2, 114,0, 114,2, 118,6, 119,4, 127,1, 127,4,129,9, 130,0, 130,5, 132,1, 148,2, 148,7, 149,2, 149,7, 158,98, 159,05, 173,3, 173,6. 25,9, 27,3, 40,0, 40,1, 43,5, 43,8, 44,1, 51,4, 53,5, 54,6, 55,4, 110,2, 111,0, 111,9, 112,2, 114,0, 114,2, 118,6, 119,4, 127,1, 127,4,129,9, 130,0, 130,5, 132,1, 148,2, 148,7, 149,2, 149,7, 158,98, 159,05, 173,3, 173,6.
Пример 25: N-((4-фторфенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид (26HCH80-7)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (400 мг, 2 ммоль) в метаноле (1 мл) и 4-фторбензиламина (0,114 мл, 1 ммоль) в метаноле (1 мл) добавляют уксусную кислоту в метаноле (1М, 1,34 мл) и затем NaCNBH3 в метаноле (0,3 М, 4,4 мл). Полученный раствор перемешивают при комнатной температуре. Через 24 часа добавляют воду (2 мл) и смесь перемешивают в течение 1 часа, после чего концентрируют. Полученное масло перерастворяют в диэтиловом эфире (20 мл) и экстрагируют HCl (0,1 N, 1 х 15 мл). Водный слой промывают диэтиловым эфиром (10 мл) и обрабатывают 0,2 N NaOH до щелочной реакции (pH>8), после чего проводят экстракцию дихлорметаном (20 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют с получением карбоксилата трет-бутил 4-((4-фторфенил)метил)аминопиперидина. Выход: 130 мг. К раствору карбоксилата трет-бутил 4-((4-фторфенил)метил)аминопиперидина (50 мг, 0,16 ммоль) в дихлорметане (6 мл) добавляют диизопропилэтиламин (0,070 мл, 0,4 ммоль) и затем 4-метоксифенилацетилхлорид (0,055 мл, 0,35 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 18 часов добавляют воду (2 мл). Смесь перемешивают еще в течение 2 часов. Далее смесь последовательно промывают HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и водой (10 мл), сушат (Na2SO4), фильтруют и концентрируют с получением N-((4-фторфенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамида. Сырой продукт используют далее без дополнительной очистки. N-((4-фторфенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамид растворяют в диэтиловом эфире (2 мл) и добавляют HCl (1 мл, 4 М в диоксане). Реакционную смесь перемешивают при комнатной температуре. Через 2,5 часа добавляют NaOH (1 мл, 6 N) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 15 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. Выход: 45 мг; 13C-ЯМР (CD3OD, ротамеры):  26,1, 27,5, 40,1, 43,6, 43,8, 44,0, 51,6, 53,6, 54,6, 113,77, 113,84, 114,0, 114,1, 114,7, 114,9, 115,3, 115,6, 126,8, 127,2, 128,1, 128,6, 128,7, 129,8,130,0, 130,1, 130,6, 131,0, 133,8, 159,1, 173,3, 173,6. 26,1, 27,5, 40,1, 43,6, 43,8, 44,0, 51,6, 53,6, 54,6, 113,77, 113,84, 114,0, 114,1, 114,7, 114,9, 115,3, 115,6, 126,8, 127,2, 128,1, 128,6, 128,7, 129,8,130,0, 130,1, 130,6, 131,0, 133,8, 159,1, 173,3, 173,6.
Пример 26: N-((2,4-дихлорфенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид (26HCH80-8)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (400 мг, 2 ммоль) в метаноле (1 мл) и 2,4-дихлорбензиламина (0,135 мл, 1 ммоль) в метаноле (1 мл) добавляют уксусную кислоту в метаноле (1М, 1,34 мл) и затем NaCNBH3 в метаноле (0,3 М, 4,4 мл). Полученный раствор перемешивают при комнатной температуре. Через 24 часа добавляют воду (2 мл) и смесь перемешивают еще в течение 1 часа, после чего концентрируют. Полученное масло перерастворяют в диэтиловом эфире (20 мл) и экстрагируют HCl (0,1 N, 1 х 15 мл). Водный слой промывают диэтиловым эфиром (10 мл) и обрабатывают 0,2 N NaOH до щелочной реакции (pH>8), после чего проводят экстракцию дихлорметаном (20 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют с получением карбоксилата трет-бутил 4-((2,4-дихлорфенил)метил)аминопиперидина. Выход: 97 мг. К раствору карбоксилата трет-бутил 4-((2,4-дихлорфенил)метил)аминопиперидина (50 мг, 0,14 ммоль) в дихлорметане (6 мл) добавляют диизопропилэтиламин (0,070 мл, 0,4 ммоль) и затем 4-метоксифенилацетилхлорид (0,055 мл, 0,35 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 18 часов добавляют воду (2 мл). Смесь перемешивают еще в течение 2 часов. Далее смесь последовательно промывают HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и водой (10 мл), сушат (Na2SO4), фильтруют и концентрируют с получением N-((2,4-дихлорфенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамида. Сырой продукт используют далее без дополнительной очистки. N-((2,4-дихлорфенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамид растворяют в диэтиловом эфире (2 мл) и добавляют HCl (1 мл, 4 М в диоксане). Реакционную смесь перемешивают при комнатной температуре. Через 2,5 часа добавляют NaOH (1 мл, 6 N) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 15 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. Выход: 39 мг; 13C-ЯМР (СD3OD, ротамеры):  25,7, 26,8, 40,0, 42,6, 43,3, 43,7, 51,2, 53,0, 54,5, 54,6, 113,8, 113,8, 114,0, 114,1, 127,0, 128,4, 128,8, 129,8, 130,0, 130,1, 131,0, 132,7, 132,9, 134,5, 159,1, 173,4, 173,6. 25,7, 26,8, 40,0, 42,6, 43,3, 43,7, 51,2, 53,0, 54,5, 54,6, 113,8, 113,8, 114,0, 114,1, 127,0, 128,4, 128,8, 129,8, 130,0, 130,1, 131,0, 132,7, 132,9, 134,5, 159,1, 173,4, 173,6.
Пример 27: N-((3-метилфенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид (26HCH80-9)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (400 мг, 2 ммоль) в метаноле (1 мл) и 3-метилбензиламина (0,125 мл, 1 ммоль) в метаноле (1 мл) добавляют уксусную кислоту в метаноле (1М, 1,34 мл) и затем NaCNBH3 в метаноле (0,3 М, 4,4 мл). Полученный раствор перемешивают при комнатной температуре. Через 24 часа добавляют воду (2 мл) и смесь перемешивают в течение 1 часа, после чего концентрируют. Полученное масло перерастворяют в диэтиловом эфире (20 мл) и экстрагируют HCl (0,1 N, 1 х 15 мл). Водный слой промывают диэтиловым эфиром (10 мл) и обрабатывают 0,2 N NaOH до щелочной реакции (pH>8), после чего проводят экстракцию дихлорметаном (20 мл). Органические слои сушат (Na2SO4), фильтруют и концентрируют с получением карбоксилата трет-бутил 4-((3-метилфенил)метил)аминопиперидина. Выход: 136 мг. К раствору карбоксилата трет-бутил 4-((3-метилфенил)метил)аминопиперидина (50 мг, 0,14 ммоль) в дихлорметане (6 мл) добавляют диизопропилэтиламин (0,070 мл, 0,4 ммоль) и затем 4-метоксифенилацетилхлорид (0,055 мл, 0,35 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 18 часов добавляют воду (2 мл). Смесь перемешивают еще в течение 2 часов. Далее смесь последовательно промывают HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и водой (10 мл), сушат (Na2SO4), фильтруют и концентрируют с получением N-((3-метилфенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамида. Сырой продукт используют далее без дополнительной очистки. N-((3-метилфенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамид растворяют в диэтиловом эфире (2 мл) и добавляют HCl (1 мл, 4 М в диоксане). Реакционную смесь перемешивают при комнатной температуре. Через 2,5 часа добавляют NaOH (1 мл, 6 N) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 15 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. Выход: 48 мг; 13C-ЯМР (CD3OD, ротамеры):  20,4, 26,8, 28,3, 40,2, 43,9, 44,1, 44,5, 51,8, 54,2, 54,57, 54,61, 114,0, 114,1, 123,2, 123,7, 126,7, 127,0, 127,1, 127,3, 128,0, 128,1, 128,7, 129,8, 129,9, 137,9, 138,6, 138,9, 159,0, 159,1, 173,1, 173,7. 20,4, 26,8, 28,3, 40,2, 43,9, 44,1, 44,5, 51,8, 54,2, 54,57, 54,61, 114,0, 114,1, 123,2, 123,7, 126,7, 127,0, 127,1, 127,3, 128,0, 128,1, 128,7, 129,8, 129,9, 137,9, 138,6, 138,9, 159,0, 159,1, 173,1, 173,7.
Пример 28: N-((3-бромфенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид (26HCH80-10)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (400 мг, 2 ммоль) в метаноле (1 мл) и гидробромида 3-бромбензиламина (222 мг, 1 ммоль) в метаноле (1 мл) добавляют уксусную кислоту в метаноле (1М, 1,34 мл) и затем NaCNBH3 в метаноле (0,3 М, 4,4 мл). Полученный раствор перемешивают при комнатной температуре. Через 24 часа добавляют воду (2 мл) и смесь перемешивают еще в течение 1 часа, после чего концентрируют. Полученное масло перерастворяют в диэтиловом эфире (20 мл) и экстрагируют HCl (0,1 N, 1 х 15 мл). Водный слой промывают диэтиловым эфиром (10 мл) и обрабатывают 0,2 N NaOH до щелочной реакции (pH>8), после чего проводят экстракцию дихлорметаном (20 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют с получением карбоксилата трет-бутил 4-((3-бромфенил)метил)аминопиперидина. Выход: 142 мг. К раствору карбоксилата трет-бутил 4-((3-бромфенил)метил)аминопиперидина (50 мг, 0,14 ммоль) в дихлорметане (6 мл) добавляют диизопропилэтиламин (0,070 мл, 0,4 ммоль) и затем 4-метоксифенилацетилхлорид (0,055 мл, 0,35 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 18 часов добавляют воду (2 мл). Смесь перемешивают еще в течение 2 часов. Далее смесь последовательно промывают HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и водой (10 мл), сушат (Na2SO4), фильтруют и концентрируют с получением N-((3-бромфенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамида. Сырой продукт используют далее без дополнительной очистки. N-((3-бромфенил)метил)-N-(1-(трет-бутилоксикарбонил)пиперидин-4-ил)-4-метоксифенилацетамид растворяют в диэтиловом эфире (2 мл) и добавляют HCl (1 мл, 4 М в диоксане). Реакционную смесь перемешивают при комнатной температуре. Через 2,5 часа добавляют NaOH (1 мл, 6 N) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 15 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле и затем концентрируют с получением указанного в заголовке соединения. Выход: 49 мг; 13C-ЯМР (CD3OD, ротамеры):  26,6, 28,2, 40,2, 43,9, 44,0, 51,8, 54,1, 54,6, 113,76, 113,84, 114,1, 114,2, 122,2, 125,0, 125,5, 126,7, 127,1, 129,2, 129,5, 129,7, 129,8, 129,9, 130,0, 130,5, 130,6, 140,8, 141,8, 159,1, 173,3, 173,7. 26,6, 28,2, 40,2, 43,9, 44,0, 51,8, 54,1, 54,6, 113,76, 113,84, 114,1, 114,2, 122,2, 125,0, 125,5, 126,7, 127,1, 129,2, 129,5, 129,7, 129,8, 129,9, 130,0, 130,5, 130,6, 140,8, 141,8, 159,1, 173,3, 173,7.
Пример 29: N-((1-фенилметил)пиперидин-4-ил)-N-(3-фенил-2-пропен-1-ил)-4-метоксифенилацетамид (26HCH76B)
К раствору 4-амино-N-бензилпиперидина (200 мг, 1,05 ммоль) в метаноле (2 мл) добавляют транс-циннамальдегид (211 мг, 1,6 ммоль) и затем уксусную кислоту в метаноле (1М, 1,4 мл) и цианборгидрид натрия в метаноле (0,3 М, 4,4 мл). Реакционную смесь перемешивают при комнатной температуре. Через 48 часов добавляют воду (2 мл). Смесь перемешивают еще в течение 2 часов, после чего концентрируют и перерастворяют в диэтиловом эфире (20 мл). Органический слой экстрагируют HCl (0,1 N, 2 х 10 мл). Объединенные водные слои обрабатывают NaOH (0,2 N) до щелочной реакции (pH>8). Смесь экстрагируют дихлорметаном (2 х 10 мл). Объединенные органические слои сушат (Na2SO4) и концентрируют. Сырой продукт, который используют далее без дополнительной очистки, растворяют в дихлорметане (5 мл). Добавляют диизопропилэтиламин (284 мг, 2,1 экв.) и затем 4-метоксифенилацетилхлорид (387 мг, 2,0 экв.). Реакционную смесь перемешивают при комнатной температуре. Через 18 часов добавляют воду (2 мл). Еще через 2 часа добавляют дихлорметан (10 мл). Смесь экстрагируют NaOH (0,2 N, 3 х 15 мл) и водой (15 мл). Органический слой сушат (Na2SO4) и концентрируют. Неочищенный продукт перерастворяют в метаноле (2 мл) и наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле, после чего концентрируют с получением указанного в заголовке соединения. 13С-ЯМР (CDCl3):  28,5, 38,1, 46,6, 47,4, 50,9, 54,7, 62,9, 113,7, 125,5, 126,4, 126,6, 127,4, 127,9, 128,5, 128,6, 129,6, 130,0, 135,2, 135,3, 138,0, 158,2, 173,2. 28,5, 38,1, 46,6, 47,4, 50,9, 54,7, 62,9, 113,7, 125,5, 126,4, 126,6, 127,4, 127,9, 128,5, 128,6, 129,6, 130,0, 135,2, 135,3, 138,0, 158,2, 173,2.
Пример 30: N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-фенилацетамид (26HCH78-1)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (1,75 г, 8,8 ммоль) и 4-метилбензиламина (970 мг, 8,0 ммоль) в метаноле (7 мл) добавляют уксусную кислоту в метаноле (1М, 6,7 мл) и затем NaCNBH3 в метаноле (0,3 М, 30 мл). Полученный раствор перемешивают при комнатной температуре. Через 20 часов добавляют воду (5 мл) и смесь перемешивают в течение 1 часа, после чего концентрируют. Флэш-хроматография в дихлорметане:метаноле (10:1) дает карбоксилат трет-бутил 4-(4-метилфенил)метил)аминопиперидина. Выход: 2,4 г, 98%. К раствору карбоксилата трет-бутил 4-(4-метилфенил)метил)аминопиперидина (80 мг, 0,26 ммоль) в дихлорметане (1,8 мл) добавляют диизопропилэтиламин (0,11 мл, 2,4 экв.) и затем фенилацетилхлорид (81 мг, 0,53 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 20 часов добавляют воду (1 мл). Смесь перемешивают еще в течение 2 часов, после чего добавляют диэтиловый эфир (20 мл). Далее смесь последовательно экстрагируют HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и H2O (10 мл), сушат (Na2SO4), фильтруют и концентрируют. Сырой материал растворяют в диэтиловом эфире (2 мл) и HCl (4 М в диоксане, 1 мл). Реакционную смесь перемешивают при комнатной температуре. Через 2 часа добавляют NaOH (6 N, 1 мл) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 10 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле, после чего концентрируют с получением указанного в заголовке соединения. Выход: 38 мг; 13C-ЯМР (CD3OD, ротамеры):  19,9, 26,9, 28,4, 41,0, 41,1, 44,0, 44,1, 44,4, 51,9, 54,4, 126,1, 126,7, 126,8, 126,9, 128,5, 128,7, 128,78, 128,81, 128,9, 129,4, 129,5, 134,9, 135,2, 135,6, 136,0, 136,3, 137,2, 172,8, 173,3. 19,9, 26,9, 28,4, 41,0, 41,1, 44,0, 44,1, 44,4, 51,9, 54,4, 126,1, 126,7, 126,8, 126,9, 128,5, 128,7, 128,78, 128,81, 128,9, 129,4, 129,5, 134,9, 135,2, 135,6, 136,0, 136,3, 137,2, 172,8, 173,3.
Пример 31: N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-3-фенилпропионамид (26HCH78-2)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (1,75 г, 8,8 ммоль) и 4-метилбензиламина (970 мг, 8,0 ммоль) в метаноле (7 мл) добавляют уксусную кислоту в метаноле (1М, 6,7 мл) и затем NaCNBH3 в метаноле (0,3 М, 30 мл). Полученный раствор перемешивают при комнатной температуре. Через 20 часов добавляют воду (5 мл) и смесь перемешивают в течение 1 часа, после чего концентрируют. Флэш-хроматография в дихлорметане:метаноле (10:1) дает карбоксилат трет-бутил 4-(4-метилфенил)метил)аминопиперидина. Выход: 2,4 г, 98%. К раствору карбоксилата трет-бутил 4-(4-метилфенил)метил)аминопиперидина (80 мг, 0,26 ммоль) в дихлорметане (1,8 мл) добавляют диизопропилэтиламин (0,11 мл, 2,4 экв.) и затем 3-фенилпропионилхлорид (0,078 мл, 0,53 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 20 часов добавляют воду (1 мл). Смесь перемешивают еще в течение 2 часов, после чего добавляют диэтиловый эфир (20 мл). Далее смесь последовательно экстрагируют HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и H2O (10 мл), сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал растворяют в диэтиловом эфире (2 мл) и HCl (4 М в диоксане, 1 мл). Реакционную смесь перемешивают при комнатной температуре. Через 2 часа добавляют NaOH (6 N, 1 мл) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 10 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле, после чего концентрируют с получением указанного в заголовке соединения. Выход: 43 мг; 13С-ЯМР (CD3OD, ротамеры):  19,9, 27,4, 29,0, 31,4, 31,7, 34,7, 35,7, 44,2, 44,3, 51,6, 54,2, 125,9, 126,07, 126,15, 126,8, 128,3, 128,4, 128,7, 128,8, 129,3, 135,1, 136,1, 136,2, 137,0, 141,1, 141,2, 173,9, 174,4. 19,9, 27,4, 29,0, 31,4, 31,7, 34,7, 35,7, 44,2, 44,3, 51,6, 54,2, 125,9, 126,07, 126,15, 126,8, 128,3, 128,4, 128,7, 128,8, 129,3, 135,1, 136,1, 136,2, 137,0, 141,1, 141,2, 173,9, 174,4.
Пример 32: N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-(фенилтио)ацетамид (26HCH78-3)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (1,75 г, 8,8 ммоль) и 4-метилбензиламина (970 мг, 8,0 ммоль) в метаноле (7 мл) добавляют уксусную кислоту в метаноле (1М, 6,7 мл) и затем NaCNBH3 в метаноле (0,3 М, 30 мл). Полученный раствор перемешивают при комнатной температуре. Через 20 часов добавляют воду (5 мл) и смесь перемешивают еще в течение 1 часа, после чего концентрируют. Флэш-хроматография в дихлорметане:метаноле (10:1) дает карбоксилат трет-бутил 4-(4-метилфенил)метил)аминопиперидина. Выход: 2,4 г, 98%. К раствору карбоксилата трет-бутил 4-(4-метилфенил)метил)аминопиперидина (80 мг, 0,26 ммоль) в дихлорметане (1,8 мл) добавляют диизопропилэтиламин (0,11 мл, 2,4 экв.) и затем (фенилтио)ацетилхлорид (0,078 мл, 0,53 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 20 часов добавляют воду (1 мл). Смесь перемешивают еще в течение 2 часов, после чего добавляют диэтиловый эфир (20 мл). Далее смесь последовательно экстрагируют HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и H2O (10 мл), сушат (Na2SO4), фильтруют и концентрируют. Сырой материал растворяют в диэтиловом эфире (2 мл) и HCl (4 М в диоксане, 1 мл). Реакционную смесь перемешивают при комнатной температуре. Через 2 часа добавляют NaOH (6 N, 1 мл) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 10 мл), сушат (Na2SO4), фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле, после чего концентрируют с получением указанного в заголовке соединения. Выход: 18 мг; HRMS (FAB+, NBA) (M+H)+ 355,1841. Для C21H27N2OS требуется 355,1844; LC-MS: (M+H)+ 355, tr 2,62 минут.
Пример 33: N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-феноксицетамид (26HCH78-4)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (1,75 г, 8,8 ммоль) и 4-метилбензиламина (970 мг, 8,0 ммоль) в метаноле (7 мл) добавляют уксусную кислоту в метаноле (1М, 6,7 мл) и затем NaCNBH3 в метаноле (0,3 М, 30 мл). Полученный раствор перемешивают при комнатной температуре. Через 20 часов добавляют воду (5 мл) и смесь перемешивают в течение 1 часа, после чего концентрируют. Флэш-хроматография в дихлорметане:метаноле (10:1) дает карбоксилат трет-бутил 4-(4-метилфенил)метил)аминопиперидина. Выход: 2,4 г, 98%. К раствору карбоксилата трет-бутил 4-(4-метилфенил)метил)аминопиперидина (80 мг, 0,26 ммоль) в дихлорметане (1,8 мл) добавляют диизопропилэтиламин (0,11 мл, 2,4 экв.) и затем феноксиацетилхлорид (0,073 мл, 0,53 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 20 часов добавляют воду (1 мл). Смесь перемешивают еще в течение 2 часов, после чего добавляют диэтиловый эфир (20 мл). Далее смесь последовательно экстрагируют HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и H2O (10 мл), сушат (Na2SO4), фильтруют и концентрируют. Сырой материал растворяют в диэтиловом эфире (2 мл) и HCl (4 М в диоксане, 1 мл). Реакционную смесь перемешивают при комнатной температуре. Через 2 часа добавляют NaOH (6 N, 1 мл) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 10 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле, после чего концентрируют с получением указанного в заголовке соединения. Выход: 24 мг; 13C–ЯМР (CD3ОD, ротамеры):  19,9, 25,8, 27,4, 43,5, 43,7, 44,4, 51,9, 52,3, 66,9, 114,7, 114,8, 116,7, 117,0, 121,4, 123,6, 126,3, 126,8, 128,4, 128,9, 129,3, 129,5, 129,6, 131,0, 134,4, 136,1, 137,4, 158,3, 169,8, 170,1. 19,9, 25,8, 27,4, 43,5, 43,7, 44,4, 51,9, 52,3, 66,9, 114,7, 114,8, 116,7, 117,0, 121,4, 123,6, 126,3, 126,8, 128,4, 128,9, 129,3, 129,5, 129,6, 131,0, 134,4, 136,1, 137,4, 158,3, 169,8, 170,1.
Пример 34: N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-(4-хлорфенокси)ацетамид (26HCH78-5)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (1,75 г, 8,8 ммоль) и 4-метилбензиламина (970 мг, 8,0 ммоль) в метаноле (7 мл) добавляют уксусную кислоту в метаноле (1М, 6,7 мл) и затем NaCNBH3 в метаноле (0,3 М, 30 мл). Полученный раствор перемешивают при комнатной температуре. Через 20 часов добавляют воду (5 мл) и смесь перемешивают в течение 1 часа, после чего концентрируют. Флэш-хроматография в дихлорметане:метаноле (10:1) дает карбоксилат трет-бутил 4-(4-метилфенил)метил)аминопиперидина. Выход: 2,4 г, 98%. К раствору карбоксилата трет-бутил 4-(4-метилфенил)метил)аминопиперидина (80 мг, 0,26 ммоль) в дихлорметане (1,8 мл) добавляют диизопропилэтиламин (0,11 мл, 2,4 экв.) и затем 4-хлорфеноксиацетилхлорид (0,082 мл, 0,53 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 20 часов добавляют воду (1 мл). Смесь перемешивают еще в течение 2 часов, после чего добавляют диэтиловый эфир (20 мл). Далее смесь последовательно экстрагируют HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и H2O (10 мл), сушат (Na2SO4), фильтруют и концентрируют. Сырой материал растворяют в диэтиловом эфире (2 мл) и HCl (4 М в диоксане, 1 мл). Реакционную смесь перемешивают при комнатной температуре. Через 2 часа добавляют NaOH (6 N, 1 мл) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 10 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле, после чего концентрируют с получением указанного в заголовке соединения. Выход: 21 мг; 13C-ЯМР (CD3ОD, ротамеры):  19,9, 26,2, 27,8, 43,6, 43,9, 44,4, 52,2, 52,5, 67,0, 116,2, 116,4, 126,2, 126,3, 126,8, 128,6, 128,9, 129,1, 129,3, 129,5, 131,0, 134,4, 135,6, 136,4, 137,5, 157,1, 169,4, 169,7. 19,9, 26,2, 27,8, 43,6, 43,9, 44,4, 52,2, 52,5, 67,0, 116,2, 116,4, 126,2, 126,3, 126,8, 128,6, 128,9, 129,1, 129,3, 129,5, 131,0, 134,4, 135,6, 136,4, 137,5, 157,1, 169,4, 169,7.
Пример 35: N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-3-метоксифенилацетамид (26HCH78-6)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (1,75 г, 8,8 ммоль) и 4-метилбензиламина (970 мг, 8,0 ммоль) в метаноле (7 мл) добавляют уксусную кислоту в метаноле (1М, 6,7 мл) и затем NaCNBH3 в метаноле (0,3 М, 30 мл). Полученный раствор перемешивают при комнатной температуре. Через 20 часов добавляют воду (5 мл) и смесь перемешивают в течение 1 часа, после чего концентрируют. Флэш-хроматография в дихлорметане:метаноле (10:1) дает карбоксилат трет-бутил 4-(4-метилфенил)метил)аминопиперидина. Выход: 2,4 г, 98%. К раствору карбоксилата трет-бутил 4-(4-метилфенил)метил)аминопиперидина (80 мг, 0,26 ммоль) в дихлорметане (1,8 мл) добавляют диизопропилэтиламин (0,11 мл, 2,4 экв.) и затем 3-метоксифенилацетилхлорид (97 мг, 0,53 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 20 часов добавляют воду (1 мл). Смесь перемешивают еще в течение 2 часов, после чего добавляют диэтиловый эфир (20 мл). Далее смесь последовательно экстрагируют HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и H2O (10 мл), сушат (Na2SO4), фильтруют и концентрируют. Сырой материал растворяют в диэтиловом эфире (2 мл) и HCl (4 М в диоксане, 1 мл). Реакционную смесь перемешивают при комнатной температуре. Через 2 часа добавляют NaOH (6 N, 1 мл) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 10 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле, после чего концентрируют с получением указанного в заголовке соединения. Выход: 26 мг; 13C–ЯМР (CD3OD, ротамеры):  19,9, 26,3, 27,7, 41,0, 43,7, 43,9, 44,4, 51,5, 53,8, 54,5, 54,6, 112,2, 112,6, 114,3, 114,5, 121,0, 121,2, 126,1, 126,8, 128,8, 129,4, 129,5, 129,8, 134,8, 136,0, 136,3, 136,5, 136,9, 137,2, 160,2, 160,3, 172,8, 173,2. 19,9, 26,3, 27,7, 41,0, 43,7, 43,9, 44,4, 51,5, 53,8, 54,5, 54,6, 112,2, 112,6, 114,3, 114,5, 121,0, 121,2, 126,1, 126,8, 128,8, 129,4, 129,5, 129,8, 134,8, 136,0, 136,3, 136,5, 136,9, 137,2, 160,2, 160,3, 172,8, 173,2.
Пример 36: N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-4-фторфенилацетамид (26HCH78-7)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (1,75 г, 8,8 ммоль) и 4-метилбензиламина (970 мг, 8,0 ммоль) в метаноле (7 мл) добавляют уксусную кислоту в метаноле (1М, 6,7 мл) и затем NaCNBH3 в метаноле (0,3 М, 30 мл). Полученный раствор перемешивают при комнатной температуре. Через 20 часов добавляют воду (5 мл) и смесь перемешивают еще в течение 1 часа, после чего концентрируют. Флэш-хроматография в дихлорметане:метаноле (10:1) дает карбоксилат трет-бутил 4-(4-метилфенил)метил)аминопиперидина. Выход: 2,4 г, 98%. К раствору карбоксилата трет-бутил 4-(4-метилфенил)метил)аминопиперидина (80 мг, 0,26 ммоль) в дихлорметане (1,8 мл) добавляют диизопропилэтиламин (0,11 мл, 2,4 экв.) и затем 4-фторфенилацетилхлорид (0,072 мл, 0,53 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 20 часов добавляют воду (1 мл). Смесь перемешивают еще в течение 2 часов, после чего добавляют диэтиловый эфир (20 мл). Далее смесь последовательно экстрагируют HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и H2O (10 мл), сушат (Na2SO4), фильтруют и концентрируют. Сырой материал растворяют в диэтиловом эфире (2 мл) и HCl (4 М в диоксане, 1 мл). Реакционную смесь перемешивают при комнатной температуре. Через 2 часа добавляют NaOH (6 N, 1 мл) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 10 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле, после чего концентрируют с получением указанного в заголовке соединения. Выход: 26 мг; 13C–ЯМР (CD3ОD, ротамеры):  19,9, 26,1, 27,4, 39,7, 39,9, 43,5, 43,8, 44,4, 51,3, 53,4, 114,9, 115,1, 115,3, 126,1, 126,7, 128,5, 128,8, 129,4, 130,7, 130,8, 130,9, 131,0, 131,2, 131,6, 134,8, 136,0, 136,3, 137,2, 160,9, 163,3, 172,7, 173,2. 19,9, 26,1, 27,4, 39,7, 39,9, 43,5, 43,8, 44,4, 51,3, 53,4, 114,9, 115,1, 115,3, 126,1, 126,7, 128,5, 128,8, 129,4, 130,7, 130,8, 130,9, 131,0, 131,2, 131,6, 134,8, 136,0, 136,3, 137,2, 160,9, 163,3, 172,7, 173,2.
Пример 37: N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-2,5-диметоксифенилацетамид (26HCH78-8)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (1,75 г, 8,8 ммоль) и 4-метилбензиламина (970 мг, 8,0 ммоль) в метаноле (7 мл) добавляют уксусную кислоту в метаноле (1М, 6,7 мл) и затем NaCNBH3 в метаноле (0,3 М, 30 мл). Полученный раствор перемешивают при комнатной температуре. Через 20 часов добавляют воду (5 мл) и смесь перемешивают в течение 1 часа, после чего концентрируют. Флэш-хроматография в дихлорметане:метаноле (10:1) дает карбоксилат трет-бутил 4-(4-метилфенил)метил)аминопиперидина. Выход: 2,4 г, 98%. К раствору карбоксилата трет-бутил 4-(4-метилфенил)метил)аминопиперидина (80 мг, 0,26 ммоль) в дихлорметане (1,8 мл) добавляют диизопропилэтиламин (0,11 мл, 2,4 экв.) и затем 2,5-диметоксифенилацетилхлорид (0,092 мл, 0,53 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 20 часов добавляют воду (1 мл). Смесь перемешивают еще в течение 2 часов, после чего добавляют диэтиловый эфир (20 мл). Далее смесь последовательно экстрагируют HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и H2O (10 мл), сушат (Na2SO4), фильтруют и концентрируют. Сырой материал растворяют в диэтиловом эфире (2 мл) и HCl (4 М в диоксане, 1 мл). Реакционную смесь перемешивают при комнатной температуре. Через 2 часа добавляют NaOH (6 N, 1 мл) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 10 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле, после чего концентрируют с получением указанного в заголовке соединения. Выход: 36 мг; 13C–ЯМР (CD3ОD, ротамеры):  20,0, 26,5, 28,2, 35,1, 35,7, 44,0, 44,4, 51,6, 53,8, 54,99, 55,03, 55,2, 55,5, 111,4, 111,7, 112,4, 112,9, 116,6, 116,9, 124,98, 125,02, 126,1, 126,7, 128,8, 129,3, 135,0, 136,1, 136,3, 137,0, 151,3, 151,7, 153,9, 154,0, 173,1, 173,5. 20,0, 26,5, 28,2, 35,1, 35,7, 44,0, 44,4, 51,6, 53,8, 54,99, 55,03, 55,2, 55,5, 111,4, 111,7, 112,4, 112,9, 116,6, 116,9, 124,98, 125,02, 126,1, 126,7, 128,8, 129,3, 135,0, 136,1, 136,3, 137,0, 151,3, 151,7, 153,9, 154,0, 173,1, 173,5.
Пример 38: N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-4-хлорфенилацетамид (26HCH78-9)
К раствору коммерчески доступного карбоксилата трет-бутил 4-оксо-1-пиперидина (1,75 г, 8,8 ммоль) и 4-метилбензиламина (970 мг, 8,0 ммоль) в метаноле (7 мл) добавляют уксусную кислоту в метаноле (1М, 6,7 мл) и затем NaCNBH3 в метаноле (0,3 М, 30 мл). Полученный раствор перемешивают при комнатной температуре. Через 20 часов добавляют воду (5 мл) и смесь перемешивают в течение 1 часа, после чего концентрируют. Флэш-хроматография в дихлорметане:метаноле (10:1) дает карбоксилат трет-бутил 4-(4-метилфенил)метил)аминопиперидина. Выход: 2,4 г, 98%. К раствору карбоксилата трет-бутил 4-(4-метилфенил)метил)аминопиперидина (80 мг, 0,26 ммоль) в дихлорметане (1,8 мл) добавляют диизопропилэтиламин (0,11 мл, 2,4 экв.) и затем 4-хлорфенилацетилхлорид (99 мг, 0,53 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 20 часов добавляют воду (1 мл). Смесь перемешивают еще в течение 2 часов, после чего добавляют диэтиловый эфир (20 мл). Далее смесь последовательно экстрагируют HCl (0,2 N, 2 х 15 мл), NaOH (0,2 N, 2 х 15 мл) и H2O (10 мл), сушат (Na2SO4), фильтруют и концентрируют. Сырой материал растворяют в диэтиловом эфире (2 мл) и HCl (4 М в диоксане, 1 мл). Реакционную смесь перемешивают при комнатной температуре. Через 2 часа добавляют NaOH (6 N, 1 мл) и затем дихлорметан (10 мл). Смесь экстрагируют водой (2 х 10 мл), сушат (Na2SO4) и фильтруют с получением прозрачного раствора. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле, после чего концентрируют с получением указанного в заголовке соединения. Выход: 22 мг; 13С-ЯМР (CD3ОD, ротамеры):  19,9, 26,3, 27,7, 39,9, 40,0, 43,6, 43,9, 44,4, 51,5, 53,6, 126,1, 126,7, 128,2, 128,4, 128,6, 128,9, 129,4, 129,6, 130,7, 130,9, 131,2, 131,6, 132,5, 132,7, 133,9, 134,1, 134,4, 134,8, 135,9, 136,3, 137,2, 172,4, 172,9. 19,9, 26,3, 27,7, 39,9, 40,0, 43,6, 43,9, 44,4, 51,5, 53,6, 126,1, 126,7, 128,2, 128,4, 128,6, 128,9, 129,4, 129,6, 130,7, 130,9, 131,2, 131,6, 132,5, 132,7, 133,9, 134,1, 134,4, 134,8, 135,9, 136,3, 137,2, 172,4, 172,9.
Пример 39: N-((4-метилфенил)метил)-N-(1-(фенилметил)пирролидин-3-ил)-N’-фенилметилкарбамид (26HCH50)
К раствору 3-амино-1-фенилметилпирролидина (353 мг, 2 ммоль) и 4-метилбензальдегида (361 мг, 3 ммоль) в метаноле (20 мл) добавляют уксусную кислоту в метаноле (2М, 6,7 мл) и затем NaCNBH3 в метаноле (0,3 М, 3 мл). Смесь перемешивают при комнатной температуре. Через 24 часа добавляют воду (5 мл). Смесь перемешивают еще в течение 1 часа, после чего концентрируют. Флэш-хроматография в смеси дихлорметан/метанол (10:1) дает N-((4-метилфенил)метил)амино-1-фенилметилпирролидин.
N-((4-метилфенил)метил)амино-1-фенилметилпирролидин (35 мг, 0,125 ммоль) растворяют в дихлорметане (1,5 мл) и добавляют бензилизоцианат (0,09 мл, 0,3 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 48 часов неочищенную реакционную смесь наносят на колонку, несущую сильнокислотную катионообменную смолу (0,3 ммоль/г смолы), которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле, после чего концентрируют с получением указанного в заголовке соединения. Выход: 48 мг, 92%. 13C-ЯМР (СD3ОD):  20,0, 29,7, 44,2, 51,3, 53,4, 56,4, 57,8, 58,7, 126,8, 127,1, 127,3, 127,6, 128,3, 128,4, 128,9, 129,1, 135,9, 136,8, 140,3, 158,5. 20,0, 29,7, 44,2, 51,3, 53,4, 56,4, 57,8, 58,7, 126,8, 127,1, 127,3, 127,6, 128,3, 128,4, 128,9, 129,1, 135,9, 136,8, 140,3, 158,5.
Пример 40: N-((4-метилфенил)метил)-N-(1-(фенилметил)пирролидин-3-ил)-4-метоксифенилацетамид (26HCH52)
К раствору 3-амино-1-фенилметилпирролидина (353 мг, 2 ммоль) и 4-метилбензальдегида (361 мг, 3 ммоль) в метаноле (20 мл) добавляют уксусную кислоту в метаноле (2М, 6,7 мл) и затем NaCNBH3 в метаноле (0,3 М, 3 мл). Смесь перемешивают при комнатной температуре. Через 24 часа добавляют воду (5 мл). Смесь перемешивают еще в течение 1 часа, после чего концентрируют. Флэш-хроматография в смеси дихлорметан/метанол (10:1) дает N-((4-метилфенил)метил)амино-1-фенилметилпирролидин.
К раствору N-((4-метилфенил)метил)амино-1-фенилметилпирролидина (35 мг, 0,125 ммоль), диизопропилэтиламина (0,14 мл) в дихлорметане (1,5 мл) добавляют 4-метоксифенилацетилхлорид (0,1 мл, 0,5 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 48 часов неочищенную реакционную смесь концентрируют и перерастворяют в метаноле. Раствор наносят на колонку, несущую сильнокислотную катионообменную смолу, которую промывают метанолом (3 х 6 мл), и проводят элюцию 10% NH3 в метаноле, после чего концентрируют. Флэш-хроматография в смеси дихлорметан/метанол (10:1) дает смесь указанного в заголовке соединения. Выход: 20 мг, 38%. 13C-ЯМР (CD3ОD):  21,3, 30,2, 40,8, 47,8, 53,6, 53,9, 55,5, 57,5, 60,2, 114,4, 125,7, 127,0, 127,1, 127,3, 127,4, 128,4, 128,5, 128,7, 128,9, 129,2, 129,8, 130,0, 135,9, 137,0, 158,6. 21,3, 30,2, 40,8, 47,8, 53,6, 53,9, 55,5, 57,5, 60,2, 114,4, 125,7, 127,0, 127,1, 127,3, 127,4, 128,4, 128,5, 128,7, 128,9, 129,2, 129,8, 130,0, 135,9, 137,0, 158,6.
Пример 41: N-((4-метилфенил)метил)-N-(1-(фенилметил)пиперидин-4-ил)-4-метоксифенилтиоацетамид (RO)
Смесь N-((4-метилфенил)метил)-N-(1-(фенилметил)пиперидин-4-ил)-(4-метоксифенилметил)ацетамида (20 мг, 0,045 ммоль) и реагент Лавессона (25 мг, 0,062 ммоль) отбирают в стеклянную ампулу и тщательно перемешивают с помощью магнитной мешалки. Затем стеклянную ампулу облучают в микроволновой печи (900 Вт, Whirlpool M401) в течение 8 минут. По завершении реакции желтоокрашенный материал переносят на ионообменную колонку с помощью метанола (2 мл). Ионообменную колонку последовательно промывают CH2Cl2 (2 мл) и метанолом (2 мл) и продукт затем элюируют с ионообменной колонки (10% NH3 в метаноле, 2 мл) с получением N-((4-метилфенил)метил)-N-(1-(фенилметил)пиперидин-4-ил)-4-метоксифенилметилтиоацетамида (20 мг, 97%) в виде белого твердого вещества; LC-MS: (M+H)+ 459, tr 9,60 минут; ТСХ (CH2Cl2/метанол 20:1) Rf=0,38.
Пример 42 – Тесты по выбору рецептора и амплификации (R-SAT)
Функциональный тест на рецептор по методике выбора и амплификации рецептора (R-SAT) авторы использовали (с небольшими модификациями относительно ранее описанной в патенте США 5 707 798 методики) для скрининга соединений на эффективность в отношении 5-HT2A рецептора. В общих чертах, скрининг состоит в том, что клетки NIH3T3 растят в 96-ячеечных планшетах для культуры тканей до 70-80% слияния. Клетки трансфицируют в течение 12-16 часов с плазмидными ДНК с использованием суперфекта (Qiagen Inc.), как указано в инструкции производителя. Тесты R-SAT в основном проводят с использованием 50 нг/ячейку рецептора и 20 нг/ячейку плазмидной ДНК, кодирующей бета-галактозидазу. Все используемые конструкции рецептора и G-белка находятся в векторе экспрессии млекопитающих pSI (Prоmega Inc.), как описано в патенте США 5 707 798. Ген 5-HT2A рецептора амплифицируют методом внутригенной ПЦР из кДНК мозга с использованием олигодезоксинуклеотидов, выбранных на основе опубликованных последовательностей (см. Saltzman et. al., Biochem. Biophys. Res. Comm. 181:1469-78 (1991)). При масштабных трансфекциях клетки трансфицируются в течение 12-16 часов, после чего их обрабатывают трипсином и замораживают в ДМСО. Замороженный клетки затем оттаивают, помещают в количестве 10 000 – 40 000 клеток на ячейку в 96-ячеечном планшете, который содержит лекарственное средство. По процедуре обоих методов клетки далее растят в увлажненной атмосфере при наличии 5% CO2 в окружающей среде в течение пяти дней. Затем среды удаляют из планшетов и измеряют активность маркерного гена при добавлении субстрата бета-галактозидазы ONPG (в ФБР с добавкой 5% NP-40). Проходит колориметрическая реакция, интенсивность которой измеряют в устройстве для спектрофотометрического измерения планшетов (Titertek Inc.) при 420 нМ. Все данные анализируют при использовании компьютерной программы XLFit (IDBSm). Эффективность в процентах от максимальной репрессии сравнивают с репрессией под действием контрольного соединения (ритансерин, в случае 5-HT2A). pИК50 представляет собой отрицательный логарифм ИК50, где ИК50 представляет собой расчетную концентрацию в молях, которая вызывает 50% репрессию от максимального уровня. Результаты, полученные для шести соединений согласно настоящему изобретению, представлены в приведенной ниже таблице.
Таблица 1. Эффективность соединений в отношении
5-HT2A-рецептора
| Соединение |
Эффективность
(средняя) |
Эффективность
(СКО) |
рИК50
(средний) |
рИК50
(СКО) |
| 26HCH52 |
98 |
5,0 |
7,31 |
0,16 |
| 26HCH66-03 |
76 |
13,3 |
7,42 |
0,01 |
| 26HCH66-05 |
109 |
3,0 |
7,55 |
0,15 |
| 26HCH80-2 |
89 |
4,6 |
7,78 |
0,17 |
| 26HCH80-7 |
87 |
3,7 |
7,70 |
0,26 |
| 26HCH80-10 |
91 |
4,9 |
7,21 |
0,05 |
Пример 43 – Эффективность in vitro 26HCH17 в качестве обратного агониста в отношении 5-HT2A рецептора
График, приведенный на фиг.1, изображает данные, полученный в результате анализа доза-ответ 26HCH17 и ритансерина как обратных агонистов 5-HT2A-рецептора. Вкратце, анализ состоит в том, что 5-HT2A-рецептор и альфа-субъединицу белка Gq, связывающую гуаниннуклеотид, временно трансфицируют в NIH3T3 клетки и проводят анализ с использованием функционального теста на рецептор по методике отбора и амплификации рецептора (R-SAT) по существу, как описано в патенте США 5 707 798. Проводят скрининг каждого соединения при семи серийно разведенных концентрациях в тройном повторе. Полученные данные анализируют с использованием метода наименьших квадратов по программе GraphPad Prism (San Diego, CA) и выражают реакцию в виде процентов.
Пример 44 – Профиль селективности обратного агониста 26HCH16D
Проводят R-SAT анализ (как описано в примере 42) с использованием клеток, трансфицированных рецепторами (перечисленными ниже), для определения профиля селективности соединения 26HCH16D в отношении рецептора. Данные по обратному агонисту в отношении 5-HT2A (ИК50, нМ; % эффективности) получают из кривых доза-ответ (7 точек в тройном повторе). Все другие данные (исходная концентрация, при которой наблюдается по меньшей мере 30% эффективности; фактическая эффективность) получают по процедуре, в ходе которой соединения исследуют в двойном повторе по 4 дозам; nr = активность менее 30% во всех исследованных дозах (3, 30, 300, 3000 нм), поэтому ЭК50/ИК50 более чем 3000 нМ. Полученные результаты представлены в приведенной ниже таблице.
Таблица 2. Профиль обратного агониста 26HCH16D в
отношении 5-HT2A
Как указывалось выше, 26HCH16D представляет собой обратный агонист с высокой селективностью в отношении 5-HT2A рецептора.
Общая процедура проведения ЖХ-MС анализа при осуществлении примеров ELH01-46, MBT01-14 и AKU01-38
В приведенных ниже примерах анализы методами ВЭЖХ-МС проводят с использованием любого из двух основных методов (метод А или метод В). Приведенные ниже значения параметра tr получают с помощью указанных процедур, как указано в конкретных примерах.
Данные методы приведены ниже:
Метод А: Agilent HP1100 ВЭЖХ/МСД
Двухтактный насос G1312A, аутосэмплер G1313A, колонка G1316A, диодный детектор G1315A (190-450 нм), МСД 1946А, устройство для ионизации электронапылением.
Хроматография:
8 мМ аммонийацетат в смеси воды/ацетонитрила.
Градиент начинают от 70% орг. в течение 12 минут повышают до 100% орг., затем в течение 0,5 минут снижают до 70% орг. и выдерживают в течение 3,5 минут. Общее время разгона 16 минут. Скорость течение 1 мл/мин.
Колонка: Phenomenex Luna C18(2) 3 мкм, 75 х 4,6 мм.
Параметры при проведении МС:
Осушающий газ, 10 л/мин. Давление в распылителе 40 ф/дюйм2. Температура газа 350оС. Vcap, 4000.
Метод В: Уотерс/Микромасс (Waters/Micromass) устройство для ВЭЖХ/МС анализа
Насос 600 LC, контроллер сэмплера 2700, двухлучевой детектор абсорбции 2487 (канал А-205 нм, канал В-235 нм), ZMD-масс-спектрометр Micromass, устройство для ионизации электронапылением.
Хроматография:
0,15% ТФУ в смеси воды/ацетонитрила.
Градиент начинают от 30% орг., в течение 10 минут повышают до 100% орг., выдерживают в течение 3 минут и затем в течение 0,5 минут снижают до 30% орг. и выдерживают в течение 4,5 минут. Общее время разгона 18 минут. Скорость течение 1 мл/мин.
Колонка: Symmetry C18, 5 мкм, 4,6 х 50 мм или
10 мМ аммонийацетат в смеси воды/ацетонитрила.
Градиент начинают от 30% орг. в течение 2,5 минут, затем в течение 10 минут повышают до 100% орг., выдерживают в течение 9 минут и затем в течение 0,5 минут снижают до 30% орг. и выдерживают в течение 5 минут. Общее время разгона 27 минут. Скорость течение 1 мл/мин.
Колонка: Phenomenex Synergi C12, 4 мкм, 4,6 х 50 мм.
Параметры при проведении МС:
Газ для десольвации – 404 l/H; Капилляр – 5,3 Кв; Конус – 36 в; Экстрактор – 3 в; Температура в отсеке исходных продуктов 130о С; Температура десольвации 250о С.
Пример 45: 2-(4-метоксифенил)-N-(4-метилбензил)-N-(пиперидин-4-ил)ацетамид (50ELH87)
Реакционная стадия 1: N-трифторацетил-4-пиперидон (50ELH84)
Моногидрат гидрохлорида 4-пиперидона (4,0 г, 26 ммоль, 1,0 экв.) растворяют в 130 мл дихлорметана. После добавления триэтиламина (8,66 г, 3,3 экв.) реакционную смесь перемешивают в течение 10 минут. Затем смесь охлаждают в ледяной бане (0°С). При перемешивании добавляют по каплям трифторуксусный ангидрид (12,0 г, 2,2 экв.). Через 2 часа реакцию гасят добавлением дистиллированной воды. Водную фазу дважды экстрагируют дихлорметаном. Объединенные органические слои собирают и сушат над сульфатом натрия. Концентрирование дает N-трифторацетил-4-пиперидон.
Реакционная стадия 2: 4-(4-метилбензиламино)-1-(трифторацетил)пиперидин (50ELH85)
В колбу Эрленмейера вносят метанол (150 мл) и при перемешивании добавляют уксусную кислоту до рН 5. Затем в круглодонную колбу на 250 мл добавляют 4-метилбензиламин (3,14 г, 25,9 ммоль) и N-трифторацетил-4-пиперидон (с реакционной стадии 1) (5,065 г, 25,9 ммоль) и растворяют в предварительно приготовленной смеси метанол/уксусная кислота (150 мл). Реакционную смесь перемешивают в течение 5 минут и медленно, при перемешивании добавляют NaCNBH3 (2,46 г, 38,9 ммоль). Через 20 часов реакционную смесь концентрируют и переносят в делительную воронку, содержащую дихлорметан и дистиллированную воду. Водную фазу подщелачивают при добавлении Na2CO3. Затем водную фазу экстрагируют дважды дихлорметаном. Объединенные органические слои собирают и сушат над Na2SO4. Концентрирование дает 4-(4-метилбензиламин)-1-(трифторацетил)пиперидин. УФ/МС 60/53 (М+301), tr (A, МС) 3,267.
Реакционная стадия 3: 2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-трифторацетилпиперидин-4-ил)ацетамид (50ELH86)
Продукт с реакционной стадии 2 (7,8 г, 25,9 ммоль) растворяют в 100 мл дихлорметана и перемешивают, добавляя при этом 4-метоксифенилацетилхлорид (4,8 г, 25,9 ммоль). Через 4 часа добавляют гептан, при этом продукт осаждается в виде гидрохлоридной соли. Растворитель удаляют при выпаривании. Сырой материал очищают флэш-хроматографией, EtOAc/гептан (1:2). Выход (общий для реакционных стадий 1+2+3) 3,912 г (34%), УФ/МС 91/58 (М+449), tr (A, МС) 4,319. 1H-ЯМР (400 МГц, СDСl3)  6,80-7,15 (Аr, 4H), 4,64 (ушт, 1H), 4,4 (с, 2H), 3,95 (д, 2H), 3,72 (с, 3Н), 3,50 (с, 2H), 3,09 (т, 2H), 2,7(т, 2H), 2,32 (с, 3H), 1,75 (ушт, 2H). 13C-ЯМР 172,5; 158,8; 137,4; 134,9; 129,9; 129,9; 129,8; 127,1; 125,8; 114,3; 55,4; 52,2; 47,3; 45,3; 43,4; 40,6; 30,1; 29,2; 21,2. 6,80-7,15 (Аr, 4H), 4,64 (ушт, 1H), 4,4 (с, 2H), 3,95 (д, 2H), 3,72 (с, 3Н), 3,50 (с, 2H), 3,09 (т, 2H), 2,7(т, 2H), 2,32 (с, 3H), 1,75 (ушт, 2H). 13C-ЯМР 172,5; 158,8; 137,4; 134,9; 129,9; 129,9; 129,8; 127,1; 125,8; 114,3; 55,4; 52,2; 47,3; 45,3; 43,4; 40,6; 30,1; 29,2; 21,2.
Реакционная стадия 4: 2-(4-метоксифенил)-N-(4-метилбензил)-N-(пиперидин-4-ил)ацетамид (50ELH87)
Продукт с реакционной стадии 3 (3,9 г, 8,7 ммоль) растворяют в метаноле (12 мл). В круглодонной колбе на 250 мл готовят насыщенный раствор карбоната калия в метаноле. К указанному раствору добавляют при перемешивании раствор 2-(4-метоксифенил)-N-(4-метилбензил)-N-(N-трифторацетпиперидин-4-ил)ацетамида. Через 4 часа раствор концентрируют и оставшийся твердый материал отбирают при подщелачивании в дихлорметан. Объединенные органические слои сушат над сульфатом натрия и концентрируют. УФ/МС 91/72 (М+353), tr (A, МС) 2,210.
Получают также соответствующую гидрохлоридную соль при растворении свободного основания в дихлорметане (1 мл) и добавляют при перемешивании HCl (1 экв., 2 М HCl в эфире). Соль осаждают при добавлении дихлорметанового раствора в гептан. Концентрирование на роторном испарителе дает продукт в виде белых кристаллов.
Пример 46: 2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH27)
Реакционная стадия 1: 4-(4-метилбензиламино)-1-метилпиперидин (50ELH25)
В колбу Эрленмейера вносят метанол (50 мл) и при перемешивании добавляют уксусную кислоту до рН 5. Затем в круглодонную колбу на 100 мл добавляют метилбензиламин (1,0 г, 8,8 ммоль) и 1-метил-4-пиперидон (1,1 г, 8,8 ммоль) и растворяют в предварительно приготовленной смеси метанол/уксусная кислота (40 мл). Реакционную смесь перемешивают в течение 5 минут и медленно, при перемешивании добавляют NaCNBH3 (0,83 г, 13,2 ммоль). Через 20 часов реакционную смесь концентрируют и переносят в делительную воронку, содержащую дихлорметан и дистиллированную воду. Водную фазу подщелачивают при добавлении Na2CO3. Затем водную фазу экстрагируют дважды дихлорметаном. Объединенные органические слои собирают и сушат над Na2SO4. Концентрирование дает указанное в заголовке соединение. Выход (неочищенного продукта): 98%. УФ/МС 89/88 (М+353), tr (A, МС) 3,982.
Реакционная стадия 2: 2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH27)
Продукт с реакционной стадии 1 (1,9 г, 8,7 ммоль) растворяют в 40 мл дихлорметана и перемешивают, добавляя при этом 4-метоксифенилацетилхлорид (1,606 г, 8,7 ммоль). Через 4 часа добавляют гептан, при этом продукт осаждается в виде гидрохлоридной соли. Растворитель удаляют при выпаривании. Сырой материал очищают флэш-хроматографией, проводя элюцию вначале 10% МеОН в СН2Cl2 и затем – 0-29% МеОН в СН2Cl2 и 5% NЕt3. Выход (общий для реакционных стадий 1+2) (77%), УФ/МС 100/100 (М+367), tr (A, МС) 4,359, Rf 0,15 (2% МеОН в СН2Cl2). 1Н-ЯМР (400 МГц, СDСl3)  12,6 (c, 1H), 7,16 (д, J=7,0 Гц, 2H), 7,10 (д, J=7,0 Гц, 2H), 7,04 (д, J=8,0 Гц, 2H), 6,82 (д, J=8,0 Гц, 2H), 4,87 (тт, J=11,0, 4,0 Гц, 1H), 4,53 м.д. (с, 2H), 3,78 (с, 3Н), 3,55 (с, 2H), 3,42 (ушд, J=11,0 Гц, 2H), 2,80 (ушкв, J=11,0 Гц, 2H), 2,7 (д, J=4,0 Гц, 3Н), 2,42 (дкв, J=13,0, 3,0 Гц, 2H), 2,34 (с, 3Н), 1,78 (ушд, J=13,0 Гц, 2H). 13C-ЯМР 173,1; 158,9; 137,4; 134,8; 129,9; 126,7; 125,8; 114,4; 76,9; 55,5; 54,6; 48,8; 43,7; 40,5; 26,4; 21,2. 12,6 (c, 1H), 7,16 (д, J=7,0 Гц, 2H), 7,10 (д, J=7,0 Гц, 2H), 7,04 (д, J=8,0 Гц, 2H), 6,82 (д, J=8,0 Гц, 2H), 4,87 (тт, J=11,0, 4,0 Гц, 1H), 4,53 м.д. (с, 2H), 3,78 (с, 3Н), 3,55 (с, 2H), 3,42 (ушд, J=11,0 Гц, 2H), 2,80 (ушкв, J=11,0 Гц, 2H), 2,7 (д, J=4,0 Гц, 3Н), 2,42 (дкв, J=13,0, 3,0 Гц, 2H), 2,34 (с, 3Н), 1,78 (ушд, J=13,0 Гц, 2H). 13C-ЯМР 173,1; 158,9; 137,4; 134,8; 129,9; 126,7; 125,8; 114,4; 76,9; 55,5; 54,6; 48,8; 43,7; 40,5; 26,4; 21,2.
Пример 47: 2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-циклогексилметилпиперидин-4-ил)ацетамид (42ELH45)
50ELH87 (гидрохлоридную соль) (0,5 г, 1,29 ммоль, 1,0 экв.) растворяют в этаноле (100 мл). Добавляют циклогексанкарбоксальдегид (2,5 г, 20 экв.) и затем боргидрид натрия (0,084 г, 2,0 экв.). Реакционную смесь перемешивают в течение 36 часов, после чего добавляют уксусную кислоту (3 мл). Реакционную смесь перемешивают еще в течение 2 часов и проводят экстракцию гидрокарбонатом натрия (3 раза) и дихлорметаном. Органические слои сушат сульфатом натрия и концентрируют. Продукт очищают флэш-хроматографией (1-10% МеОН в СН2Cl2). Полученный продукт растворяют в диэтиловом эфире (20 мл) и при перемешивании добавляют МеОН (по каплям по мере растворения) и HCl (1 экв., 2 М HCl в эфире). Осаждается гидрохлоридная соль 2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-циклогексилметилпиперидин-4-ил)ацетамида, после чего отфильтровывают белые кристаллы. Выход 80 мг (16%), УФ/МС 100/100 (М+449), tr (A, МС) 7,105, Тпл. 133-135 С, Rf 0,25 (2% МеОН/СН2Cl2). 1H-ЯМР (400 МГц, CDCl3)  11,9 (ушс, 1H), 7,12 (кв, 4H), 7,02 (д, 2H), 6,80 (д, 2H), 4,87 (м, 1H), 4,58 (с, 2H), 3,77 (с, 3Н), 3,55 (с, 2H), 3,48 (м, 2H), 2,70 (м, 4H), 2,31 (с, 3Н), 1,91 (д, 2H), 1,75 (м, 3Н), 1,64 (д, 1H), 1,22 (д, 2H), 1,13 (тт, 2H), 1,02 (ушкв, 2H). 13C-ЯМР 173,1; 158,8; 137,2; 135,1; 129,9; 129,8; 126,8; 125,8; 114,4; 64,1; 55,5; 53,4; 49,2; 46,5; 40,4; 33,9; 25,9; 25,8; 25,7; 21,2. 11,9 (ушс, 1H), 7,12 (кв, 4H), 7,02 (д, 2H), 6,80 (д, 2H), 4,87 (м, 1H), 4,58 (с, 2H), 3,77 (с, 3Н), 3,55 (с, 2H), 3,48 (м, 2H), 2,70 (м, 4H), 2,31 (с, 3Н), 1,91 (д, 2H), 1,75 (м, 3Н), 1,64 (д, 1H), 1,22 (д, 2H), 1,13 (тт, 2H), 1,02 (ушкв, 2H). 13C-ЯМР 173,1; 158,8; 137,2; 135,1; 129,9; 129,8; 126,8; 125,8; 114,4; 64,1; 55,5; 53,4; 49,2; 46,5; 40,4; 33,9; 25,9; 25,8; 25,7; 21,2.
Пример 48: 2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-этилпиперидин-4-ил)ацетамид (42ELH80)
50ELH87 (0,25 г, 0,71 ммоль, 1,0 экв.) растворяют в ацетонитриле (15 мл) и добавляют при перемешивании этилбромид (0,232 г, 3,0 экв.). Через 2 часа добавляют основание Хюнингса (0,084 г, 10,0 экв.). Через 36 часов раствор экстрагируют гидрокарбонатом натрия и дихлорметаном (3 раза). Органические слои сушат сульфатом натрия и концентрируют с получением желтого масла. Далее продукт очищают флэш-хроматографией (2% МеОН в СН2Cl2). Полученный продукт растворяют в дихлорметане (1 мл) и добавляют при перемешивании HCl (1 экв. 2 М HCl в эфире). Соль осаждают при добавлении дихлорметанового раствора к гептану. Концентрирование на роторном испарителе дает продукт в виде белых кристаллов. Выход: 170 мг (63%). УФ/МС 98/95 (М+381), Тпл. 153-155 С, rt (A, МС) 3,033, Rf 0,35 (3% МеОН/СН2Cl2). 1Н-ЯМР (400 МГц, CDCl3)  12,2 (c, 1H), 7,15 (д, 2H), 7,12 (д, 2H), 7,08 (д, 2H), 6,82 (д, 2H), 4,89 (т, 1Н), 4,58 (с, 2H), 3,79 (с, 3Н), 3,58 (с, 2H), 3,50 (д, 2H), 2,90 (м, 1H), 2,7 (ушкв, 2H), 2,45 (м, 2H), 2,34 (с, ЗН), 1,80 (д, 2H), 1,44 (т, 3Н). 13С-ЯМР 173,1; 158,9; 137,3; 134,9; 129,9; 125,8; 114,4; 55,5; 52,3; 52,0; 49,2; 46,5; 40,5; 26,2; 21,2; 9,5. 12,2 (c, 1H), 7,15 (д, 2H), 7,12 (д, 2H), 7,08 (д, 2H), 6,82 (д, 2H), 4,89 (т, 1Н), 4,58 (с, 2H), 3,79 (с, 3Н), 3,58 (с, 2H), 3,50 (д, 2H), 2,90 (м, 1H), 2,7 (ушкв, 2H), 2,45 (м, 2H), 2,34 (с, ЗН), 1,80 (д, 2H), 1,44 (т, 3Н). 13С-ЯМР 173,1; 158,9; 137,3; 134,9; 129,9; 125,8; 114,4; 55,5; 52,3; 52,0; 49,2; 46,5; 40,5; 26,2; 21,2; 9,5.
Пример 49: 2-(4-метоксифенил)-N-(4-хлорбензил)-N-(1-метилпиперидин-4-ил)ацетамид (42ELH85)
Указанное соединение получают по процедуре, аналогичной процедуре получения 50ELH27.
Реакционная стадия 1: (42ELH84)
Исходные материалы: 1-метил-4-пиперидон (0,5 , 4,4 ммоль, 1,0 экв.), 4-хлорбензиламин (0,626 г, 1,0 экв.), цианборгидрид натрия (0,279 г, 1,5 экв.).
Реакционная стадия 2: (42ELH85)
Исходные материалы: 42ELH84, 4-метоксифенилацетилхлорид (0,774 г, 1,0 экв.).
Процедура получения аналогична таковой для 50ELH27, но продукт очищают ионообменной хроматографией и затем ВЭЖХ. Гидрохлоридную соль получают при растворении свободного основания в дихлорметане (1 мл) и при добавлении при перемешивании HCl (1 экв. 2М HCl). Соль осаждают посредством добавления дихлорметанового раствора к гептану с последующим концентрированием на роторном испарителе.
Продукт: белые кристаллы: УФ/МС 98/97 (М+387), rt (A, МС) 2,953. 1Н-ЯМР (400 МГц, CDCl3)  12,6 (с, 1H), 7,35 (д, 2H), 7,18 (д, 2H), 7,05 (д, 2H), 6,82 (д, 2H), 4,89 (м, 1H), 4,55 (с, 2H), 3,80 (с, 3H), 3,55 (с, 2H), 3,45 (ушс, 2H), 2,80 (ушс, 2H), 2,72 (с, 3H), 2,25 (ушс, 3H), 1,80 (ушс, 2H). 13C-ЯМР 173,0; 158,9; 136,5; 133,6; 129,8; 129,4; 127,3; 126,3; 114,5; 55,5; 54,6; 48,7; 46,3; 43,7; 40,5; 26,3. 12,6 (с, 1H), 7,35 (д, 2H), 7,18 (д, 2H), 7,05 (д, 2H), 6,82 (д, 2H), 4,89 (м, 1H), 4,55 (с, 2H), 3,80 (с, 3H), 3,55 (с, 2H), 3,45 (ушс, 2H), 2,80 (ушс, 2H), 2,72 (с, 3H), 2,25 (ушс, 3H), 1,80 (ушс, 2H). 13C-ЯМР 173,0; 158,9; 136,5; 133,6; 129,8; 129,4; 127,3; 126,3; 114,5; 55,5; 54,6; 48,7; 46,3; 43,7; 40,5; 26,3.
Пример 50: 2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-изопропилпиперидин-4-ил)ацетамид (42ELH79)
Получают по процедуре, использованной для 42ELH80.
Исходные материалы: 50ELH87 (0,25 г, 0,71 ммоль, 1,0 экв.), изопропилбромид (0,262 г, 3,0 экв.).
Продукт: выход 130 мг (46%), УФ/МС 100/100 (М+395), rt (A, МС) 3,360. 1H-ЯМР (400 МГц, CDCl3)  12,0 (c, 1H), 7,15 (д, 2H), 7,10 (д, 2H), 7,05 (д, 2H), 6,82 (д, 2H), 4,87 (м, 1H), 4,60 (с, 2H), 3,79 (с, 3H), 3,57 (с, 2H), 3,38 (ушд, 3H), 2,79 (кв, 2H), 2,63 (кв, 2H), 2,34 (с, 3H), 1,80 (д, 2H), 1,39 (д, 6H). 13C-ЯМР 173,1; 158,9; 137,3; 135,1; 129,8; 126,8; 125,8; 114,4; 57,9; 49,4; 48,2; 46,5; 40,5; 25,9; 21,2; 16,9. 12,0 (c, 1H), 7,15 (д, 2H), 7,10 (д, 2H), 7,05 (д, 2H), 6,82 (д, 2H), 4,87 (м, 1H), 4,60 (с, 2H), 3,79 (с, 3H), 3,57 (с, 2H), 3,38 (ушд, 3H), 2,79 (кв, 2H), 2,63 (кв, 2H), 2,34 (с, 3H), 1,80 (д, 2H), 1,39 (д, 6H). 13C-ЯМР 173,1; 158,9; 137,3; 135,1; 129,8; 126,8; 125,8; 114,4; 57,9; 49,4; 48,2; 46,5; 40,5; 25,9; 21,2; 16,9.
Пример 51: 2-(4-метоксифенил)-N-(4-хлорбензил)-N-(пиперидин-4-ил)ацетамид (42ELH89) (В качестве исходного материла для других реакций используют в неочищенном виде)
Следуют процедуре получения 50ELH27.
Реакционная стадия 1: N-трифторацетил-4-пиперидон (42ELH86)
Исходные материалы: моногидрат гидрохлорида 4-пиперидона (2,0 г, 13 ммоль, 1,0 экв.), трифторуксусный ангидрид (6,0 , 2,2 экв.). Результаты проведения ТСХ показывают, что достигнуто полное превращение.
Продукт: Rf 0,9 (10% MeOH/CH2Cl2).
Реакционная стадия 2: 4-(4-хлорбензиламино)-1-(трифторацетил)пиперидин (42ELH87)
Исходные материалы: 42ELH86 (2,5 г, 12,8 ммоль, 1,0 экв.), 4-хлорбензиламин (1,8 г, 1,0 экв.).
Реакционная стадия 3: 2-(4-метоксифенил)-N-(4-хлорбензил)-N-(1-трифторацетилпиперидин-4-ил)ацетамид (42ELH88)
Исходные материалы: 42ELH87 (4,0 г, 12,5 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (2,31 г, 1,0 экв.).
Реакционная стадия 4: 2-(4-метоксифенил)-N-(4-хлорбензил)-N-(пиперидин-4-ил)ацетамид (42ELH89)
Продукт: выход 2 г (57%), УФ/МС 80/82 (М+373), Rf 0,2 (50%, EtOAc/гептан).
Пример 52: 2-(4-метоксифенил)-N-(4-хлорбензил)-N-(1-циклопентилпиперидин-4-ил)ацетамид (42ELH91)
Следуют процедуре получения 42ELH80, но продукт очищают методом ВЭЖХ. Кислотный элюент подщелачивают карбонатом натрия и проводят экстракцию дихлорметаном (3 раза). Объединенные органические слои собирают и сушат сульфатом натрия и концентрируют. Оставшийся продукт растворяют в 1 мл дихлорметана и добавляют при перемешивании HCl (1 экв. 2 М HCl в эфире). Указанный раствор добавляют по каплям к большому избытку н-гептана с образованием осадка гидрохлорида. Растворитель выпаривают с получением белых кристаллов гидрохлорида 2-(4-метоксифенил)-N-(4-хлорбензил)-N-(1-циклопентилпиперидин-4-ил)ацетамида.
Исходные материалы: 42ELH89 (0,25 г, 0,67 ммоль, 1,0 экв.), циклопентилбромид (0,3 , 3,0 экв.).
Продукт: выход: 211,2 мг (76%). При очистке ионообменной хроматографией получают: УФ/МС 90/98. Очистка: ВЭЖХ: УФ/МС 100/100 (М+441), Rf 0,2 (3%МеОН/CH2Cl2), rt (A, MC) 4,067. 1Н-ЯМР (400 МГц, CDCl3)  12,2 (ушс, 1H), 7,32 (д, 2H), 7,17 (д, 2H), 7,04 (д, 2H), 6,82 (д, 2H), 4,90 (ушт, 1H), 4,58 (с, 2H), 3,79 (с, 3H), 3,58 (ушд, 2H), 3,54 (с, 2H), 3,14 (ушкв, 2H), 2,58 (ушкв, 2H), 2,04 (м, 4Н), 1,89 (м, 4Н), 1,75 (ушд, 2H). 13C-ЯМР 173,0; 158,9; 133,5; 129,8; 129,3; 127,3; 126,4; 114,5; 68,4; 55,5; 51,9; 49,1; 46,2; 40,5; 28,5; 26,0; 23,8. 12,2 (ушс, 1H), 7,32 (д, 2H), 7,17 (д, 2H), 7,04 (д, 2H), 6,82 (д, 2H), 4,90 (ушт, 1H), 4,58 (с, 2H), 3,79 (с, 3H), 3,58 (ушд, 2H), 3,54 (с, 2H), 3,14 (ушкв, 2H), 2,58 (ушкв, 2H), 2,04 (м, 4Н), 1,89 (м, 4Н), 1,75 (ушд, 2H). 13C-ЯМР 173,0; 158,9; 133,5; 129,8; 129,3; 127,3; 126,4; 114,5; 68,4; 55,5; 51,9; 49,1; 46,2; 40,5; 28,5; 26,0; 23,8.
Пример 53: 2-(4-метоксифенил)-N-(4-хлорбензил)-N-(1-изопропилпиперидин-4-ил)ацетамид (42ELH90)
42ELH89 (0,25 г, 0,67 ммоль, 1,0 экв.) переносят во флакон на 4 мл и растворяют в ацетонитриле (2 мл). Добавляют изопропилбромид (0,25 г, 3,0 экв.) вместе с основанием Хюнигса (Hunigs) (0,87 г, 10,0 экв.). Флакон плотно закрывают и встряхивают в течение 4 дней при 60о С. Затем реакционную смесь переносят в делительную воронку с дистиллированной водой и CH2Cl2. Водную фазу подщелачивают гидрокарбонатом натрия и проводят экстракцию дихлорметаном (3 раза). Органические слои собирают, сушат сульфатом натрия и концентрируют с образованием желтого масла. Продукт очищают флэш-хроматографией (3% МеОН в CH2Cl2). Полученный продукт растворяют в дихлорметане (1 мл) и добавляют при перемешивании HCl (1 экв. 2 М HCl в эфире). Соль осаждают при добавлении дихлорметанового раствора к гептану. Концентрирование на роторном испарителе дает продукт в виде белых кристаллов. Выход: 101,2 мг (63%), УФ/МС (М+415), Rf 0,25 (3%МеОН/CH2Cl2).
1H-ЯМР (400 МГц, CDCl3)  12,05 (ушс, 1H), 7,36 (д, 2H), 7,18 (д, 2H), 7,04 (д, 2H), 6,82 (д, 2H), 4,88(м, 1H), 4,60 (с, 2H), 3,79 (с, 3H), 3,55 (д, 2H), 3,36 (д, 3H), 2,80 (ушкв, 2H), 2,65 (ушкв, 2H), 1,76 (ушд, 2H), 1,39 (д, 6H). 13C-ЯМР 173,0; 159,0; 137,0; 136,0; 129,7; 129,3; 127,4; 126,4; 114,5; 57,9; 55,5; 49,2; 48,2; 46,2; 40,5; 25,8; 16,9. 12,05 (ушс, 1H), 7,36 (д, 2H), 7,18 (д, 2H), 7,04 (д, 2H), 6,82 (д, 2H), 4,88(м, 1H), 4,60 (с, 2H), 3,79 (с, 3H), 3,55 (д, 2H), 3,36 (д, 3H), 2,80 (ушкв, 2H), 2,65 (ушкв, 2H), 1,76 (ушд, 2H), 1,39 (д, 6H). 13C-ЯМР 173,0; 159,0; 137,0; 136,0; 129,7; 129,3; 127,4; 126,4; 114,5; 57,9; 55,5; 49,2; 48,2; 46,2; 40,5; 25,8; 16,9.
Пример 54: 2-(фенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH14b)
Следуют процедуре получения 50ELH27. Очистку проводят методом ВЭЖХ. Гидрохлоридную соль получают при растворении свободного основания в дихлорметане (1 мл) с последующим добавлением при перемешивании HCl (1 экв. 2 М HCl в эфире). Соль осаждают при добавлении дихлорметанового раствора к гептану с последующим концентрированием.
Реакционная стадия 1: 4-(4-трифторметилбензиламино)-1-метилпиперидин (50ELH2).
Исходные материалы: 1-метил-4-пиперидон (1,13 г, 10,0 ммоль, 1,0 экв.), 4-трифторметилбензиламин (1,75 г, 1,0 экв.).
Продукт: УФ/МС 80/92 (М+273).
Реакционная стадия 2: 2-(фенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH14b)
Исходные материалы: 50ELH2 (0,12 г, 0,44 ммоль, 1,0 экв.), фенилацетилхлорид (0,068 г, 1,0 экв.).
Продукт: УФ/МС 100/97 (М+390), rt (A, MC) 3,797, Rf 0,3 (5%МеОН/CH2Cl2). 1Н-ЯМР (400 МГц, CDCl3, ротамеры 54/46)  7,52 (д, 2H), 7,42 (д, 2H), 7,12-7,30 (м, 4H,), 4,63 и 3,74 (2м, 1H), 4,38 (ушс, 2H), 3,80 и 3,50 (2с, 3H), 3,31 и 2,78 (2д, 2H), 2,33 и 2,18 (2с, 2H), 2,24 и 1,65-1,90 (т и м, 4H), 1,60 и 1,22 (2д, 2H), 1. 13C-ЯМР 172,3; 171,8; 143,9; 135,1; 134,8; 129,1; 129,0; 128,9; 128,7; 127,4; 127,3; 127,2; 126,3; 126,1; 126,0; 56,0; 55,2; 54,9; 50,9; 46,8; 45,2; 44,9; 42,2; 41,7; 30,6; 28,4. 7,52 (д, 2H), 7,42 (д, 2H), 7,12-7,30 (м, 4H,), 4,63 и 3,74 (2м, 1H), 4,38 (ушс, 2H), 3,80 и 3,50 (2с, 3H), 3,31 и 2,78 (2д, 2H), 2,33 и 2,18 (2с, 2H), 2,24 и 1,65-1,90 (т и м, 4H), 1,60 и 1,22 (2д, 2H), 1. 13C-ЯМР 172,3; 171,8; 143,9; 135,1; 134,8; 129,1; 129,0; 128,9; 128,7; 127,4; 127,3; 127,2; 126,3; 126,1; 126,0; 56,0; 55,2; 54,9; 50,9; 46,8; 45,2; 44,9; 42,2; 41,7; 30,6; 28,4.
Пример 55: 2-(4-фторфенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH14с)
Следуют процедуре получения 50ELH14В.
Реакционная стадия 2: 2-(4-фторфенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH14с)
Исходные материалы: 50ELH2 (0,12 г, 0,44 ммоль, 1,0 экв.), 4-фторфенилацетилхлорид (0,076 г, 1,0 экв.).
Продукт: выход: 69,7 мг (36%), УФ/МС 100/98 (М+409), rt (A, MC) 3,839, Rf 0,3 (5%МеОН/CH2Cl2). 1Н-ЯМР (400 МГц, DMSO, ротамеры 65/35)  10,80 и 10,60 (2с, 1H), 7,71 и 7,62 (2д, 2H), 7,47 и 7,38 (2д, 2H), 7,00-7,36 (т и м, 4H), 4,70 и 4,50 (2с, 2H), 4,30 (м, 1H), 3,93 и 3,56 (2с, 2H), 3,34 (с, 2H), 3,00 (ушкв, 2H), 2,64 (с, 3H), 2,08 (м, 2H), 1,68 и 1,58 (2д, 2H). 13C-ЯМР 176,8; 176,4; 167,6; 165,3; 150,0; 149,0; 136,6; 132,5; 131,0; 130,5; 120,6; 120,5; 120,5; 120,4; 58,1; 58,0; 57,0; 54,5; 52,0; 49,3; 47,6; 45,0; 32,4; 31,4. 10,80 и 10,60 (2с, 1H), 7,71 и 7,62 (2д, 2H), 7,47 и 7,38 (2д, 2H), 7,00-7,36 (т и м, 4H), 4,70 и 4,50 (2с, 2H), 4,30 (м, 1H), 3,93 и 3,56 (2с, 2H), 3,34 (с, 2H), 3,00 (ушкв, 2H), 2,64 (с, 3H), 2,08 (м, 2H), 1,68 и 1,58 (2д, 2H). 13C-ЯМР 176,8; 176,4; 167,6; 165,3; 150,0; 149,0; 136,6; 132,5; 131,0; 130,5; 120,6; 120,5; 120,5; 120,4; 58,1; 58,0; 57,0; 54,5; 52,0; 49,3; 47,6; 45,0; 32,4; 31,4.
Пример 56: 2-(4-метоксифенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH14d)
Следуют процедуре получения 50ELH14В.
Реакционная стадия 2: 2-(4-метоксифенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH14d)
Исходные материалы: 50ELH2 (0,15 г, 0,55 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (0,1 г, 1,0 экв.).
Продукт: выход: 57,5 мг (29%), УФ/МС 99/100 (М+421), rt (В, MC) 6,30, Rf 0,25 (3%МеОН/CH2Cl2). 1H-ЯМР (400 МГц, CDCl3)  12,4 (уш с, 1H), 7,55 (в, 2H), 7,28 (д, 2H), 6,96 (д, 2H), 4,84 (ушт, 1H), 4,59 (с, 2H), 3,72 (с, 3H), 3,46 (с, 2H), 3,38 (д, 2H), 2,78 (кв, 2H), 2,64 (с, 3H), 2,38 (кв, 2H), 1,70 (d, 2H). 13C-ЯМР 173,0; 159,0; 142,3; 130,0; 129,8; 126,3; 126,2; 114,7; 114,5; 55,5; 54,4; 48,7; 46,5; 43,6; 40,6; 26,3. 12,4 (уш с, 1H), 7,55 (в, 2H), 7,28 (д, 2H), 6,96 (д, 2H), 4,84 (ушт, 1H), 4,59 (с, 2H), 3,72 (с, 3H), 3,46 (с, 2H), 3,38 (д, 2H), 2,78 (кв, 2H), 2,64 (с, 3H), 2,38 (кв, 2H), 1,70 (d, 2H). 13C-ЯМР 173,0; 159,0; 142,3; 130,0; 129,8; 126,3; 126,2; 114,7; 114,5; 55,5; 54,4; 48,7; 46,5; 43,6; 40,6; 26,3.
Пример 57: 2-(4-трифторметилфенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH14а)
Следуют процедуре получения 50ELH14В.
Реакционная стадия 2: 2-(4-трифторметилфенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH14а)
Исходные материалы: 50ELH2 (0,12 г, 0,44 ммоль, 1,0 экв.), 4-трифторметилфенилацетилхлорид (0,1 г, 1,0 экв.).
Продукт: выход: 92,6 мг (42%), УФ/МС 89/93 (М+458), rt (А, MC) 4,211, Rf 0,3 (5%МеОН/CH2Cl2). 1Н-ЯМР (400 МГц, СDСl3)  12,7 (ушс, 1H), 7,56 (д, 2H), 7,48 (д, 2H), 7,17 (д, 2H), 4,86 (м, 1H), 4,63 (с, 2H), 3,58 (с, 3H), 3,40 (д, 2H), 2,75 (кв, 2H), 2,65 (д, 3H), 2,46 (дкв, 2H), 1,73 (ушс, 2H). 13C-ЯМР 171,8; 141,9; 138,4; 129,4; 127,9; 126,3; 126,3; 126,2; 125,9; 125,8; 54,4; 48,8; 46,6; 43,6; 40,9; 26,2. 12,7 (ушс, 1H), 7,56 (д, 2H), 7,48 (д, 2H), 7,17 (д, 2H), 4,86 (м, 1H), 4,63 (с, 2H), 3,58 (с, 3H), 3,40 (д, 2H), 2,75 (кв, 2H), 2,65 (д, 3H), 2,46 (дкв, 2H), 1,73 (ушс, 2H). 13C-ЯМР 171,8; 141,9; 138,4; 129,4; 127,9; 126,3; 126,3; 126,2; 125,9; 125,8; 54,4; 48,8; 46,6; 43,6; 40,9; 26,2.
Пример 58: 2-(4-фторфенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH6).
Следуют процедуре получения 50ELH14В.
Реакционная стадия 1: 4-(4-фторбензиламино)-1-метилпиперидин (50ELH4)
Исходные материалы: 1-метил-4-пиперидон (1,13 г, 10,0 ммоль, 1,0 экв.), 4-фторбензиламин (1,25 г, 1,0 экв.).
Продукт: выход: 2,154 г (97%), УФ/МС 79/89 (М+223).
Реакционная стадия 2: 2-(4-фторфенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH14а)
Исходные материалы: 50ELH4 (0,12 г, 0,54 ммоль, 1,0 экв.), 4-фторфенилацетилхлорид (0,096 г, 1,0 экв.).
Продукт: выход: 57 мг (29%), УФ/МС 100/100 (М+359), rt (А, MC) 3,763, Rf 0,25 (3%МеОН/CH2Cl2). 1Н-ЯМР (400 МГц, CDCl3)  12,6 (ушс, 1H), 7,2 (дд, 2H), 7,06 (м, 4H), 6,98 (т, 2H), 4,88 (тт, 1H), 4,58 (с, 4H), 3,45 (д, 2H), 2,81 (кв, 2H), 2,72 (д, 3H), 2,48 (ушкв, 2H), 1,78 (ушс, 2H). 13C-ЯМР 172,5; 163,4; 160,8; 133,4; 130,6; 130,2; 127,5; 127,4; 116,3; 116,1; 115,9; 115,7; 54,5; 48,8; 46,2; 43,6; 40,3; 26,3. 12,6 (ушс, 1H), 7,2 (дд, 2H), 7,06 (м, 4H), 6,98 (т, 2H), 4,88 (тт, 1H), 4,58 (с, 4H), 3,45 (д, 2H), 2,81 (кв, 2H), 2,72 (д, 3H), 2,48 (ушкв, 2H), 1,78 (ушс, 2H). 13C-ЯМР 172,5; 163,4; 160,8; 133,4; 130,6; 130,2; 127,5; 127,4; 116,3; 116,1; 115,9; 115,7; 54,5; 48,8; 46,2; 43,6; 40,3; 26,3.
Пример 59: 2-(4-метоксифенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH8).
Следуют процедуре получения 50ELH14В
Реакционная стадия 2:
Исходные материалы: 50ELH4 (0,12 г, 0,54 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (0,1 г, 1,0 экв.).
Продукт: выход: 54 г (26%), УФ/МС 100/100 (М+371), rt (А, MC) 3,257, Rf 0,25 (3%МеОН/CH2Cl2). 1Н-ЯМР (400 МГц, CDCl3)  12,2 (ушс, 1H), 7,12 (м, 2H), 6,97 (м, 4H), 6,75 (д, 2H), 4,80 (ушт, 1H), 4,49 (с, 2H), 3,71 (с, 3H), 3,47 (с, 2H), 3,37 (д, 2H), 2,8 (кв, 2H), 2,64 (с, 3H), 2,35 (кв, 2H), 1,69 (д, 2H). 13C-ЯМР 173,0; 163,5; 161,1; 158,9; 133,7; 133,6; 129,8; 127,6; 127,5; 126,5; 116,2; 116,0; 114,6; 114,5; 55,5; 54,4; 48,8; 46,2; 43,6; 40,5; 26,4. 12,2 (ушс, 1H), 7,12 (м, 2H), 6,97 (м, 4H), 6,75 (д, 2H), 4,80 (ушт, 1H), 4,49 (с, 2H), 3,71 (с, 3H), 3,47 (с, 2H), 3,37 (д, 2H), 2,8 (кв, 2H), 2,64 (с, 3H), 2,35 (кв, 2H), 1,69 (д, 2H). 13C-ЯМР 173,0; 163,5; 161,1; 158,9; 133,7; 133,6; 129,8; 127,6; 127,5; 126,5; 116,2; 116,0; 114,6; 114,5; 55,5; 54,4; 48,8; 46,2; 43,6; 40,5; 26,4.
Пример 60: 2-(фенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH10).
Следуют процедуре получения 50ELH14В
Реакционная стадия 2: 2-(фенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH10)
Исходные материалы: 50ELH4 (0,13 г, 0,54 ммоль, 1,0 экв.), фенилацетилхлорид (0,091 г, 1,0 экв.).
Продукт: УФ/МС 100/94 (М+341), rt (А, MC) 3,127, Rf 0,25 (3%МеОН/CH2Cl2). 1Н-ЯМР (400 МГц, DMSO, ротамеры 54/56)  12,38 (ушс, 1H), 7,35-7,00 (м, 9H), 4,55 и 4,40 (2с, 2H), 4,50 и 4,25 (ушт, 1H), 3,91 и 3,56 (2с, 2H), 3,30 (Скрытый под сигналом воды)(2H), 2,98 (д, 2H), 2,64 (с, 3H), 2,09 (ушт, 2H), 1,66 и 1,45 (2ушд, 2H). 13C-ЯМР 171,9; 171,6; 162,8; 160,4; 136,5; 136,2; 135,4; 129,9; 129,7; 129,5; 129,2; 129,0; 128,9; 128,7; 127,2; 127,1; 116,2; 116,0; 115,6; 53,2; 52,5; 49,8; 46,9; 44,0; 42,8; 40,9; 40,6; 40,4; 40,2; 40,0; 39,8; 39,6; 27,7; 26,6. 12,38 (ушс, 1H), 7,35-7,00 (м, 9H), 4,55 и 4,40 (2с, 2H), 4,50 и 4,25 (ушт, 1H), 3,91 и 3,56 (2с, 2H), 3,30 (Скрытый под сигналом воды)(2H), 2,98 (д, 2H), 2,64 (с, 3H), 2,09 (ушт, 2H), 1,66 и 1,45 (2ушд, 2H). 13C-ЯМР 171,9; 171,6; 162,8; 160,4; 136,5; 136,2; 135,4; 129,9; 129,7; 129,5; 129,2; 129,0; 128,9; 128,7; 127,2; 127,1; 116,2; 116,0; 115,6; 53,2; 52,5; 49,8; 46,9; 44,0; 42,8; 40,9; 40,6; 40,4; 40,2; 40,0; 39,8; 39,6; 27,7; 26,6.
Пример 61: 2-(4-трифторметилфенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH122)
Следуют процедуре получения 50ELH14В
Реакционная стадия 0: 4-трифторметилфенилацетилхлорид (50ELH121)
4-трифторфенилуксусную кислоту (1,0 г) и тионилхлорид (15 мл) кипятят с обратным холодильником в течение 1 часа. Избыток тионилхлорида выпаривают. Анализ ЯМР показывает, что превращение прошло полностью.
Реакционная стадия 2: 2-(4-трифторметилфенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH122)
Исходные материалы: 50ELH4 (0,12 г, 0,55 ммоль, 1,0 экв.), 4-трифторметилфенилацетилхлорид (50ELH121) (0,11 г, 0,5 ммоль, 1,0 экв.).
Продукт: выход: 47,1 мг (24%), УФ/МС 96/96 (М+409), rt (А, MC) 4,566, Rf 0,25 (3%МеОН/CH2Cl2). 1Н-ЯМР (400 МГц, CDCl3)  7,52 (д, 2H), 7,22 (д, 2H), 7,17 (дд, 2H), 7,04 (т, 2H), 4,86 (ушт, 1H), 4,58 (с, 2H), 3,64 (с, 2H), 3,45 (ушд, 2H), 2,84 (ушкв, 2H), 2,71 (д, 3H), 2,45 (ушкв, 2H), 1,77 (ушд, 2H). 13C-ЯМР 171,8; 163,6; 161,2; 138,7; 133,3; 129,8; 129,5; 127,5; 127,4; 125,8; 125,7; 116,4; 116,2; 54,4; 48,9; 46,3; 43,6; 40,8; 26,3. 7,52 (д, 2H), 7,22 (д, 2H), 7,17 (дд, 2H), 7,04 (т, 2H), 4,86 (ушт, 1H), 4,58 (с, 2H), 3,64 (с, 2H), 3,45 (ушд, 2H), 2,84 (ушкв, 2H), 2,71 (д, 3H), 2,45 (ушкв, 2H), 1,77 (ушд, 2H). 13C-ЯМР 171,8; 163,6; 161,2; 138,7; 133,3; 129,8; 129,5; 127,5; 127,4; 125,8; 125,7; 116,4; 116,2; 54,4; 48,9; 46,3; 43,6; 40,8; 26,3.
Пример 62: 4-(4-метоксибензиламино)-1-метилпиперидин (50ELH18)
Следуют процедуре получения 50ELH27
Исходные материалы: 1-метил-4-пиперидон (1,13 г, 10,0 ммоль, 1,0 экв.), 4-метоксибензиламин (1,37 г, 1,0 экв.).
Продукт: УФ/МС 95/95 (М+235), rt (А, MC) 3,509 1Н-ЯМР (400 МГц, CDCl3)  7,3-6,8 (м, 4H), 3,77 (с, 3H), 3,73 (с, 2H), 2,86 (м, 2Н), 2,55 (м, 1H), 2,30 (с, 3H), 2,1 (т, 2H), 1,96 (дд, 2H), 1,50 (м, 2H). 7,3-6,8 (м, 4H), 3,77 (с, 3H), 3,73 (с, 2H), 2,86 (м, 2Н), 2,55 (м, 1H), 2,30 (с, 3H), 2,1 (т, 2H), 1,96 (дд, 2H), 1,50 (м, 2H).
Пример 63: 2-(4-трифторметилфенил)-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH20А)
Следуют процедуре получения 50ELH14В.
Реакционная стадия 1: Метил 4-(N-[1-метилпиперидин-4-ил]аминометил)бензоат (50ELH19)
Исходные материалы: 1-метил-4-пиперидон (1,13 г, 10,0 ммоль, 1,0 экв.), гидрохлорид метил 4-(аминометил)бензоата (2,0 г, 1,0 экв.).
Продукт: УФ/МС 81/88 (М+263), rt (А, MC) 3,060 1H-ЯМР (400 МГц, CDCl3)  8,00 (д, 2H), 7,20 (д, 2H), 3,90 (c, 3H), 3,85 (c, 2H), 2,96 (дт, 2H), 2,7 (ушс, 1H), 2,62 (м, 1H), 2,40 (c, 3H), 2,28 (т, 2H), 1,96 (м, 2H), 1,56 (м, 2H). 8,00 (д, 2H), 7,20 (д, 2H), 3,90 (c, 3H), 3,85 (c, 2H), 2,96 (дт, 2H), 2,7 (ушс, 1H), 2,62 (м, 1H), 2,40 (c, 3H), 2,28 (т, 2H), 1,96 (м, 2H), 1,56 (м, 2H).
Реакционная стадия 2: 2-(4-трифторметилфенил)-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH20А)
Исходные материалы: 50ELH19 (0,20 г, 0,76 ммоль, 1,0 экв.), 50ELH121 (0,169 г, 1,0 экв.).
Продукт: выход: 108,9 мг (32%), УФ/МС 100/100 (М+448), rt (А, MC) 3,327, Rf 0,3 (5%МеОН/CH2Cl2). 1Н-ЯМР (400 МГц, DMSO, ротамеры 56/44)  10,7 и 10,4 (2ушс, 1H), 7,96-7,28 (м, 8H), 4,70 и 4,51 (2с, 2H), 4,30 (ушт, 1H), 4,06 и 3,69 (2с, 2H), 3,83 и 3,81 (2с, 3H), 3,00 (м, 2H), 2,63 (м, 3H), 2,05 (ушт, J=12 Гц, 2H), 1,69 (ушт, J=12 Гц, 2H). 13C-ЯМР (CDCl3) 171,9; 166,7; 142,9; 138,5; 130,7; 130,1; 129,7; 126,2; 125,9; 55,2; 52,5; 49,2; 47,4; 41,2; 32,1; 26,6; 22,9; 14,3. 10,7 и 10,4 (2ушс, 1H), 7,96-7,28 (м, 8H), 4,70 и 4,51 (2с, 2H), 4,30 (ушт, 1H), 4,06 и 3,69 (2с, 2H), 3,83 и 3,81 (2с, 3H), 3,00 (м, 2H), 2,63 (м, 3H), 2,05 (ушт, J=12 Гц, 2H), 1,69 (ушт, J=12 Гц, 2H). 13C-ЯМР (CDCl3) 171,9; 166,7; 142,9; 138,5; 130,7; 130,1; 129,7; 126,2; 125,9; 55,2; 52,5; 49,2; 47,4; 41,2; 32,1; 26,6; 22,9; 14,3.
Пример 64: 2-фенил-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH20В)
Следуют процедуре получения 50ELH14В
Реакционная стадия 2: 2-фенил-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH20В)
Исходные материалы: 50ELH19 (0,2 г, 0,76 ммоль, 1,0 экв.), фенилацетилхлорид (0,117 г, 1,0 экв.).
Продукт: выход: 82,5 г (29%), УФ/МС 100/100 (М+381), rt (А, MC) 2,625, Rf 0,25 (3%МеОН/CH2Cl2). 1Н-ЯМР  (400 МГц, CDCl3) 12,2 (ушс, 1H), 8,00 (д, J=7,4, 2H), 7,4-7,2 (м, 4H), 7,08 (д, J=7,4, 2H), 4,89 (ушт, 1H), 4,62 (с, 2H), 3,90 (с, 3Н), 3,56 (с, 2H), 3,42 (д, J=11,0, 2H), 2,84 (кв, J=11,0, 2H), 2,68 (д, J=3,6, 3Н), 2,40 (кв, J=11,0, 2H), 1,77 (ушд, J=11,0, 2H). 13C-ЯМР 173,0; 168,0; 143,3; 136,7; 130,6; 129,0; 127,4; 125,9; 54,5; 52,4; 48,8; 43,6; 41,4; 26,3. (400 МГц, CDCl3) 12,2 (ушс, 1H), 8,00 (д, J=7,4, 2H), 7,4-7,2 (м, 4H), 7,08 (д, J=7,4, 2H), 4,89 (ушт, 1H), 4,62 (с, 2H), 3,90 (с, 3Н), 3,56 (с, 2H), 3,42 (д, J=11,0, 2H), 2,84 (кв, J=11,0, 2H), 2,68 (д, J=3,6, 3Н), 2,40 (кв, J=11,0, 2H), 1,77 (ушд, J=11,0, 2H). 13C-ЯМР 173,0; 168,0; 143,3; 136,7; 130,6; 129,0; 127,4; 125,9; 54,5; 52,4; 48,8; 43,6; 41,4; 26,3.
Пример 65: 2-(4-хлорфенил)-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH20С)
Следуют процедуре получения 50ELH14В
Реакционная стадия 2: 2-(4-хлорфенил)-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH20С)
Исходные материалы: 50ELH19 (0,2 г, 0,76 ммоль, 1,0 экв.), 4-хлорфенилацетилхлорид (0,131 г, 1,0 экв.).
Продукт: выход: 79,2 г (26%), УФ/МС 100/96 (М+399), rt (А, MC) 2,333 1Н-ЯМР (400 МГц, DMSO, ротамеры 62/38)  10.8 и 10.60 (2ушс, 1H), 7,95 и 7,85 (2д, J=8,6, 2H), 7,4 и 7,28 (2д, 2H), 7,35 и 7,14 (м, 4H), 4,67 и 4,50 (2с, 2H), 4,29 (м, 1H), 3,93 и 3,84 (2с, 2H), 3,81 (с, ЗН), 3,21 (д, J=11,9, 2H), 3,00 (д, J=11,9, 2H), 2,63 (с, ЗН), 2,06 (м, 2H), 1,68 и 1,56 (d, J=11,9, 2H). 13C-ЯМР (СDСl3) 172,6; 166,7; 163,4; 161,0; 143,0; 130,7; 130,6; 130,5; 126,0; 115,9; 115,7; 54,7; 52,4; 48,9; 46,9; 44,0; 40,4; 26,4. 10.8 и 10.60 (2ушс, 1H), 7,95 и 7,85 (2д, J=8,6, 2H), 7,4 и 7,28 (2д, 2H), 7,35 и 7,14 (м, 4H), 4,67 и 4,50 (2с, 2H), 4,29 (м, 1H), 3,93 и 3,84 (2с, 2H), 3,81 (с, ЗН), 3,21 (д, J=11,9, 2H), 3,00 (д, J=11,9, 2H), 2,63 (с, ЗН), 2,06 (м, 2H), 1,68 и 1,56 (d, J=11,9, 2H). 13C-ЯМР (СDСl3) 172,6; 166,7; 163,4; 161,0; 143,0; 130,7; 130,6; 130,5; 126,0; 115,9; 115,7; 54,7; 52,4; 48,9; 46,9; 44,0; 40,4; 26,4.
Пример 66: 2-(4-метоксифенил)-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH20D)
Следуют процедуре получения 50ЕLH14В.
Реакционная стадия 2: 2-(4-метоксифенил)-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH20D)
Исходные материалы: 50ELH19 (0,2 г, 0,76 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (0,140 г, 1,0 экв.).
Продукт: выход: 108,6 г (26%), УФ/МС 100/99 (М+410), rt (А, MC) 2,280 1Н-ЯМР (400 МГц, CDCl3)  12,38 (ушс, 1H), 8,00 (д, J=7,2, 2H), 7,28 (д, J=7,2, 2H), 7,00 (д, J=7,2, 2H), 6,79 (д, J=7,2, 2H), 4,88 (ушт, 1H), 4,61 (с, 2H), 3,90 (с, 3Н), 3,75 (с, 3Н), 3,42 (ушд, J=10,7, 2H), 2,84 (кв, J=10,7,2H), 2,68 (д, J=3,6, 3Н), 2,40 (ушкв, J=10,7, 2H), 1,75 (д, J=10,7, 2H). 13C-ЯМР 173,0; 166,8; 159,0; 143,3; 130,5; 129,9; 129,8; 126,3; 125,9; 114,5; 55,5; 54,7; 52,4; 48,7; 46,7; 43,6; 40,6; 12,38 (ушс, 1H), 8,00 (д, J=7,2, 2H), 7,28 (д, J=7,2, 2H), 7,00 (д, J=7,2, 2H), 6,79 (д, J=7,2, 2H), 4,88 (ушт, 1H), 4,61 (с, 2H), 3,90 (с, 3Н), 3,75 (с, 3Н), 3,42 (ушд, J=10,7, 2H), 2,84 (кв, J=10,7,2H), 2,68 (д, J=3,6, 3Н), 2,40 (ушкв, J=10,7, 2H), 1,75 (д, J=10,7, 2H). 13C-ЯМР 173,0; 166,8; 159,0; 143,3; 130,5; 129,9; 129,8; 126,3; 125,9; 114,5; 55,5; 54,7; 52,4; 48,7; 46,7; 43,6; 40,6;
32,1; 26,3; 22,9; 14,3.
Пример 67: N-(4-метилфенетил)-N-(1-метилпиперидин-4-ил)бензиламид (50ELH23)
Следуют процедуре получения 50ELH14В
Реакционная стадия 2: 1-фенил-N-[2-(4-метилфенил)этил]-N-(1-метилпиперидин-4-ил)амид (50ELH23)
Исходные материалы: 4-(2-фенилэтил)амино-1-метилпиперидин (0,20 г, 0,86 ммоль, 1,0 экв.), бензоилхлорид (0,158 г, 1,0 экв.).
Продукт: выход: 159 мг (50%), УФ/МС 100/100 (М+337), rt (А, MC) 3,289, Rf 0,55 (10%МеОН/CH2Cl2) 1Н-ЯМР (400 МГц, DMSO (80°C))  10,9 (ушс, 1H), 7,44 (с, 2H), 7,34 (д, J=3,0 Гц, 2H), 7,04 (д, J=7,0 Гц, 2H), 6,95 (ушс, 2H), 4,00 (ушс, 1H), 3,40 (д, J=4,2 Гц, 2H), 3,35 (д, J=4,2 Гц, 2H), 2,95 (ушс, 2H), 2,77 (т, J=3,2 Hz, 2H), 2,40 (кв, J=6,4 Гц, 2H), 2,24 (с, 3H) 1,83 (д, J=6,4 Гц, 2H). 13C-ЯМР (CDCl3) 171,6; 138,1; 136,3; 136,0; 129,8; 129,6; 129,1; 129,1; 126,7; 53,6; 52,4; 46,1; 42,9; 35,9; 27,3; 21,1. 10,9 (ушс, 1H), 7,44 (с, 2H), 7,34 (д, J=3,0 Гц, 2H), 7,04 (д, J=7,0 Гц, 2H), 6,95 (ушс, 2H), 4,00 (ушс, 1H), 3,40 (д, J=4,2 Гц, 2H), 3,35 (д, J=4,2 Гц, 2H), 2,95 (ушс, 2H), 2,77 (т, J=3,2 Hz, 2H), 2,40 (кв, J=6,4 Гц, 2H), 2,24 (с, 3H) 1,83 (д, J=6,4 Гц, 2H). 13C-ЯМР (CDCl3) 171,6; 138,1; 136,3; 136,0; 129,8; 129,6; 129,1; 129,1; 126,7; 53,6; 52,4; 46,1; 42,9; 35,9; 27,3; 21,1.
Пример 68: 2-(4-метоксифенил)-N-(3-фенил-1-пропил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH65)
Следуют процедуре получения 50ELH14В
Реакционная стадия 1: 4-(3-фениламинопропил)пиперидин (50ELH59)
Исходные материалы: 1-метил-4-пиперидон (1,1 мл, 7,4 ммоль, 1,0 экв.), 3-фенилпропиламин (1,35 г, 1,0 экв.).
Продукт: УФ/МС 100/94 (М+233), rt (А, MC) 3,534 1Н-ЯМР (400 МГц, CDCl3)  7,28-7,12 (м, 5H), 3,40 (ушс, 1H), 2,84 (дт, J=12,3 и 3,5 Гц, 2H), 2,64 (кв, J=7,0 Гц, 4H), 2,51 (м, 1H), 2,27 (с, 3H), 2,05 (ушт, J=12,3 Гц, 2H), 1,82 (м, 2H), 1,44 (м, 2H). 7,28-7,12 (м, 5H), 3,40 (ушс, 1H), 2,84 (дт, J=12,3 и 3,5 Гц, 2H), 2,64 (кв, J=7,0 Гц, 4H), 2,51 (м, 1H), 2,27 (с, 3H), 2,05 (ушт, J=12,3 Гц, 2H), 1,82 (м, 2H), 1,44 (м, 2H).
Реакционная стадия 2: 2-(4-метоксифенил)-N-(3-фенил-1-пропил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH65)
Исходные материалы: 50ELH59 (0,50 г, 2,2 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (0,398 г, 1,0 экв.).
Продукт: выход: 153 мг (43%), УФ/МС 100/100 (М+381), rt (А, MC) 2,938 1Н-ЯМР (400 МГц, DMSO, ротамеры 55/45)  11,0 и 10,90 (2ушс, 1H), 7,30-7,10 (м, J=7,9 Гц, 6H), 6,97 (д, J=7,9 Гц, 1H), 4,22 и 4,06 (2дт, dH), 3,70 (с, 3H), 3,35 (т, J=10,4 Гц, 2H), 3,15 (м, 2H), 3,00 (кв, J=10,4 Гц, 2H), 2,66 (д, 3H), 2,52 (кв, J=7,9 Гц, 2H), 2,17 (ушкв, J=12 Гц, 2H) 1,73 (м, 2H), 1,70 и 1,52 (2д, J=12 Гц, 2H). 13C-ЯМР (DMSO) 171,3; 171,0; 158,6; 142,2; 141,7; 130,0; 129,0; 128,0; 128,5; 128,2; 126,6; 114,5; 55,7; 55,7; 53,5; 53,3; 50,1; 44,5; 42,9; 41,9; 33,7; 33,1; 32,9; 31,4; 27,8; 26,8. 11,0 и 10,90 (2ушс, 1H), 7,30-7,10 (м, J=7,9 Гц, 6H), 6,97 (д, J=7,9 Гц, 1H), 4,22 и 4,06 (2дт, dH), 3,70 (с, 3H), 3,35 (т, J=10,4 Гц, 2H), 3,15 (м, 2H), 3,00 (кв, J=10,4 Гц, 2H), 2,66 (д, 3H), 2,52 (кв, J=7,9 Гц, 2H), 2,17 (ушкв, J=12 Гц, 2H) 1,73 (м, 2H), 1,70 и 1,52 (2д, J=12 Гц, 2H). 13C-ЯМР (DMSO) 171,3; 171,0; 158,6; 142,2; 141,7; 130,0; 129,0; 128,0; 128,5; 128,2; 126,6; 114,5; 55,7; 55,7; 53,5; 53,3; 50,1; 44,5; 42,9; 41,9; 33,7; 33,1; 32,9; 31,4; 27,8; 26,8.
Пример 69: 2-(4-метоксифенил)-N-[2-(4-метилфенил)этил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH68)
Следуют процедуре получения 50ELH14В
Реакционная стадия 1: 4-[2-(4-метилфенил)этиламино]пиперидин (50ELH58)
Исходные материалы: 1-метил-4-пиперидон (1,1 мл, 7,4 ммоль, 1,0 экв.), 2-(4-метилфенил)этиламин (1,0 г, 1,0 экв.).
Продукт: УФ/МС 100/91 (М+233), rt (А, MC) 3,933 1Н-ЯМР (400 МГц, CDCl3)  7,4 (с, 5H), 3,27 (ушс, 1H), 2,84 (d, J=7,0 Гц, 4H), 2,75 (м, 2H), 2,54 (м, 1H), 2,29 (2xс, 6H), 2,10 (ушт, J=12,3 Гц, 2H), 1,86 (ушд, 2H), 1,45 (м, 2H). 7,4 (с, 5H), 3,27 (ушс, 1H), 2,84 (d, J=7,0 Гц, 4H), 2,75 (м, 2H), 2,54 (м, 1H), 2,29 (2xс, 6H), 2,10 (ушт, J=12,3 Гц, 2H), 1,86 (ушд, 2H), 1,45 (м, 2H).
Реакционная стадия 2: 2-(4-метоксифенил)-N-[2-(4-метилфенил)этил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH68)
Исходные материалы: 50ELH58 (0,30 г, 1,3 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (0,238 г, 1,0 экв.).
Продукт: выход: 125 мг (26%), УФ/МС 100/99 (М+381), rt (А, MC) 3,156 1H-ЯМР (400 МГц, DMSO, ротамеры 50/50)  11,0 и 10,90 (2ушс, 1H), 7,25-7,04 (м, J=8,7 Гц, 6H), 6,87 и 6,84 (2д, J=8,7 Гц, 2H), 4,30 и 4,09 (2дт, J=11,5 Гц, дH), 3,73 и 3,58 (2с, 2H), 3,71 и 3,70 (2с, 3H), 3,35 (м, (нижележащий водный пик) 3H), 3,24 (м, 1H), 3,02 (м, J=11,5 Гц, 2H), 2,80-2,62 (м, 5H), 2,32 и 2,20 (2кв, J=11,5 Гц, 2H), 2,26 и 2,24 (2с, 3H) 1,78 и 1,49 (2д, J=11,5 Гц, 2H). 13C-ЯМР (DMSO) 171,5; 171,2; 158,6; 136,8; 136,2; 136,0; 135,8; 130,7; 130,5; 129,7; 129,6; 129,4; 129,2; 128,4; 128,3; 114,5; 55,8; 55,7; 53,3; 53,3; 52,2; 50,2; 46,8; 43,9; 42,9; 36,8; 35,2; 27,6; 26,8; 21,3. 11,0 и 10,90 (2ушс, 1H), 7,25-7,04 (м, J=8,7 Гц, 6H), 6,87 и 6,84 (2д, J=8,7 Гц, 2H), 4,30 и 4,09 (2дт, J=11,5 Гц, дH), 3,73 и 3,58 (2с, 2H), 3,71 и 3,70 (2с, 3H), 3,35 (м, (нижележащий водный пик) 3H), 3,24 (м, 1H), 3,02 (м, J=11,5 Гц, 2H), 2,80-2,62 (м, 5H), 2,32 и 2,20 (2кв, J=11,5 Гц, 2H), 2,26 и 2,24 (2с, 3H) 1,78 и 1,49 (2д, J=11,5 Гц, 2H). 13C-ЯМР (DMSO) 171,5; 171,2; 158,6; 136,8; 136,2; 136,0; 135,8; 130,7; 130,5; 129,7; 129,6; 129,4; 129,2; 128,4; 128,3; 114,5; 55,8; 55,7; 53,3; 53,3; 52,2; 50,2; 46,8; 43,9; 42,9; 36,8; 35,2; 27,6; 26,8; 21,3.
Пример 70: 2-(4-метоксифенил)-N-[2-(2-тиенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH71А)
Следуют процедуре получения 50ELH14В
Реакционная стадия 1: 4-[2-(2-тиенил)этиламино]пиперидин (50ELH67А)
Исходные материалы: 1-метил-4-пиперидон (0,5 г, 4,4 ммоль, 1,0 экв.), тиофен-2-этиламин (0,563 г, 1,0 экв.).
Продукт: УФ/МС 94/93 (М+225)
Реакционная стадия 2: 2-(4-метоксифенил)-N-[2-(2-тиенилэтил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH71А)
Исходные материалы: 50ELH67А (0,243 г, 1,08 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (0,2 г, 1,0 экв.).
Продукт: выход: 80,7 мг (33%), УФ/МС 100/100 (М+373), rt (А, MC) 2,613 1Н-ЯМР (400 МГц, DMSO, ротамеры 50/50)  10,8 и 10,6 (2ушс, 1H), 7,36 и 7,31 (2д, 7=4,7 Гц, 1H), 7,20 и 7,06 (2д, J=8,3 Гц, 2H), 7,00-6,92 (м, J=4,7 и 2,8 Гц, 2H), 6,87 и 6,40 (2d, J=8,3 Гц, 2H), 4,22 и 4,08 (2дт, J=12,2 Гц, 1H), 3,71 (с, 3H), 3,70 (с, 2H), 3,46-3,30 (м, 4H), 3,10-2,90 (м, 4H), 2,67 (м, 2H), 2,28 и 2,12 (2кв, J=12 Гц, 2H), 1,80 и 1,50 (2д, J=12 Гц, 2H). 13C-ЯМР (DMSO) 172,5; 158,9; 139,6; 130,0; 129,6; 126,8; 124,5; 114,5; 55,5; 54,7; 49,3; 45,8; 43,8; 41,3; 31,9; 29,9. 10,8 и 10,6 (2ушс, 1H), 7,36 и 7,31 (2д, 7=4,7 Гц, 1H), 7,20 и 7,06 (2д, J=8,3 Гц, 2H), 7,00-6,92 (м, J=4,7 и 2,8 Гц, 2H), 6,87 и 6,40 (2d, J=8,3 Гц, 2H), 4,22 и 4,08 (2дт, J=12,2 Гц, 1H), 3,71 (с, 3H), 3,70 (с, 2H), 3,46-3,30 (м, 4H), 3,10-2,90 (м, 4H), 2,67 (м, 2H), 2,28 и 2,12 (2кв, J=12 Гц, 2H), 1,80 и 1,50 (2д, J=12 Гц, 2H). 13C-ЯМР (DMSO) 172,5; 158,9; 139,6; 130,0; 129,6; 126,8; 124,5; 114,5; 55,5; 54,7; 49,3; 45,8; 43,8; 41,3; 31,9; 29,9.
Пример 71: 2-(4-метоксифенил)-N-[2-(4-нитрофенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH71С)
Следуют процедуре получения 50ELH14В
Реакционная стадия 1: 4-[2-(4-нитрофенил)этиламино]пиперидин (50ELH67С)
Исходные материалы: 1-метил-4-пиперидон (0,5 г, 4,4 ммоль, 1,0 экв.), 4-нитрофенил-2-этиламин (0,897 г, 1,0 экв.).
Продукт: УФ/МС 96/89 (М+264), rt (А, MC) 3,264
Реакционная стадия 2: 2-(4-метоксифенил)-N-[2-(4-нитрофенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH71А)
Исходные материалы: 50ELH67С (0,285 г, 1,08 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (0,2 г, 1,0 экв.).
Продукт: выход: 130,9 мг (30%), УФ/МС 100/100 (М+412), rt (А, MC) 2,219 1Н-ЯМР (400 МГц, DMSO, ротамеры 50/50)  10,8 и 10,6 (2ушс, 1H), 8,17 и 8,12 (2д, J=8,6 Гц, 2H), 7,58 и 7,48 (2д, J=8,6 Гц, 2H), 7,2 и 7,1 (2д, J=8,6 Гц, 2H), 6,87 и 6,40 (2д, 7-8,6 Гц, 2H), 4,25 и 4,10 (2дт, J=12 Гц, 1H), 3,72 (с, 3H), 3,70 (с, 2H), 3,48-3,30 (м, 4H), 3,10-2,84 (м, 4H), 2,69 и 2,67 (2д, J=4,7 Гц, 3H), 2,34 и 2,15 (2кв, J=13,2 Гц, 2H), 1,79 и 1,47 (2д, J=13,2 Гц, 2H). 10,8 и 10,6 (2ушс, 1H), 8,17 и 8,12 (2д, J=8,6 Гц, 2H), 7,58 и 7,48 (2д, J=8,6 Гц, 2H), 7,2 и 7,1 (2д, J=8,6 Гц, 2H), 6,87 и 6,40 (2д, 7-8,6 Гц, 2H), 4,25 и 4,10 (2дт, J=12 Гц, 1H), 3,72 (с, 3H), 3,70 (с, 2H), 3,48-3,30 (м, 4H), 3,10-2,84 (м, 4H), 2,69 и 2,67 (2д, J=4,7 Гц, 3H), 2,34 и 2,15 (2кв, J=13,2 Гц, 2H), 1,79 и 1,47 (2д, J=13,2 Гц, 2H).
Пример 72: 2-(4-метоксифенил)-N-(2-тиенилметил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH73А)
Следуют процедуре получения 50ELH14В
Реакционная стадия 1: 4-[(2-тиенилметил)амино]-1-метилпиперидин (50ELH66А)
Исходные материалы: 1-метил-4-пиперидон (0,5 г, 4,4 ммоль, 1,0 экв.), 2-тиенилметиламин (0,52 г, 1,0 экв.).
Продукт: УФ/МС 77/86 (М+211), rt (А, MC) 2,739
Реакционная стадия 2: 2-(4-метоксифенил)-N-(2-тиенилметил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH73А)
Исходные материалы: 50ELH66А (0,228 г, 1,08 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (0,2 г, 1,0 экв.).
Продукт: выход: 178,4 мг (50%), УФ/МС 100/98 (М+359), rt (А, MC) 3,117 1H-ЯМР (400 МГц, ДМСO)  10,9 и 10,6 (2ушс, 1H), 7,47 и 7,32 (2д, J=4,5 Гц, 1H), 7,20 и 7,03 (2д, J=8,4 Гц, 2H), 7,03 и 6,98 (2м, 1H), 6,87 (м, 3H), 4,70 и 4,57 (2с, 2H), 4,42 и 4,16 (2т, J=11,9 Гц, 1H), 3,77 и 3,60 (2с, 2H), 3,51 (с, 3H), 3,15 (м, 2H), 2,98 (м, J=11,9 Гц, 2H), 2,65 (2д, J=4,5 Гц, 3H), 2,25 и 2,17 (2кв, J=11,9 Гц, 2H), 1,69 и 1,44 (2д, J=11,9 Гц, 2H). 13C-ЯМР (ДМСO) 171,4; 158,6; 143,2; 130,7; 128,1; 126,6; 126,3; 125,9; 114,5; 55,7; 53,3; 52,6; 50,0; 42,8; 27,7; 26,8. 10,9 и 10,6 (2ушс, 1H), 7,47 и 7,32 (2д, J=4,5 Гц, 1H), 7,20 и 7,03 (2д, J=8,4 Гц, 2H), 7,03 и 6,98 (2м, 1H), 6,87 (м, 3H), 4,70 и 4,57 (2с, 2H), 4,42 и 4,16 (2т, J=11,9 Гц, 1H), 3,77 и 3,60 (2с, 2H), 3,51 (с, 3H), 3,15 (м, 2H), 2,98 (м, J=11,9 Гц, 2H), 2,65 (2д, J=4,5 Гц, 3H), 2,25 и 2,17 (2кв, J=11,9 Гц, 2H), 1,69 и 1,44 (2д, J=11,9 Гц, 2H). 13C-ЯМР (ДМСO) 171,4; 158,6; 143,2; 130,7; 128,1; 126,6; 126,3; 125,9; 114,5; 55,7; 53,3; 52,6; 50,0; 42,8; 27,7; 26,8.
Пример 73: 2-(4-метоксифенил)-N-(фурфурил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH73В)
Следуют процедуре получения 50ELH14В
Реакционная стадия 1: 4-(фурфуриламино)-1-метилпиперидин (50ELH66В)
Исходные материалы: 1-метил-4-пиперидон (0,5 г, 4,4 ммоль, 1,0 экв.), фурфуриламин (0,43 г, 1,0 экв.).
Продукт: УФ/МС 77/92 (М+195), rt (А, MC) 2,812
Реакционная стадия 2: 2-(4-метоксифенил)-N-(фурфурил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH73В)
Исходные материалы: 50ELH66В (0,21 г, 1,08 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (0,2 г, 1,0 экв.).
Продукт: выход: 134 мг (36%), УФ/МС 100/99 (М+343), rt (А, MC) 2,401 1H-ЯМР (400 МГц, ДМСO, ротамеры 57/43)  10,95 и 10,75 (2ушс, 1H), 7,63 и 7,48 (с, 1H), 7,18 и 7,06 (2д, J=7,7 Гц, 2H), 6,85 (т, J=7,7 Гц, 2H), 6,44 и 6,33 (2д, J=7,7 Гц, 1H), 6,37 и 6,11 (2с, 1H) 4,5 и 4,34 (2с, 2H), 4,42 и 4,18 (2дт, J=11 и 2 Гц, 1H), 3,75 и 3,65 (2с, 2H) 3,70 (с, 3H), 3,33 (замаскированный, 2H), 3,0 (кв, 2H), 2,64 (д, J=4,7 Гц, 3H), 2,15 (дкв, J=11 и 2 Гц, 2H), 1,65 и 1,50 (2д, J=11 Гц, 2H). 10,95 и 10,75 (2ушс, 1H), 7,63 и 7,48 (с, 1H), 7,18 и 7,06 (2д, J=7,7 Гц, 2H), 6,85 (т, J=7,7 Гц, 2H), 6,44 и 6,33 (2д, J=7,7 Гц, 1H), 6,37 и 6,11 (2с, 1H) 4,5 и 4,34 (2с, 2H), 4,42 и 4,18 (2дт, J=11 и 2 Гц, 1H), 3,75 и 3,65 (2с, 2H) 3,70 (с, 3H), 3,33 (замаскированный, 2H), 3,0 (кв, 2H), 2,64 (д, J=4,7 Гц, 3H), 2,15 (дкв, J=11 и 2 Гц, 2H), 1,65 и 1,50 (2д, J=11 Гц, 2H).
Пример 74: 2-(2-тиенил)-N-(4-метилфенилметил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH82)
Следуют процедуре получения 50ЕLН14В.
Реакционная стадия 2: 2-(2-тенилметил)-N-(4-метилфенилметил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH82)
Исходные материалы: 50ELH25 (0,30 г, 1,38 ммоль, 1,0 экв.), тиофен-2-ацетилхлорид (0,22 г, 1,0 экв.).
Продукт: выход: 235 мг (62%), УФ/МС 97/93 (М+343), rt (А, MC) 2,795 1Н ЯМР (400 МГц, ДМСO, ротамеры 54/46)  10,8 и 10,60 (2ушс, 1H), 7,4 и 7,35 (2д, 1H), 7,2-6,76 (м, 6Н), 4,55 и 4,4 (2с, 2H), 4,49 и 4,26 (2дт, J=11 и 2 Гц, 2H), 4,15 и 3,79 (2с, 2H), 3,32 (д, J=11 Гц, 2H), 2,99 (кв, 2H), 2,63 (с, 3H), 2,27 и 2,23 (2с, 3H), 2,09 (кв, J=11 Гц, 2H), 1,66 и 1,55 (2д, J=11Гц, 2H). 10,8 и 10,60 (2ушс, 1H), 7,4 и 7,35 (2д, 1H), 7,2-6,76 (м, 6Н), 4,55 и 4,4 (2с, 2H), 4,49 и 4,26 (2дт, J=11 и 2 Гц, 2H), 4,15 и 3,79 (2с, 2H), 3,32 (д, J=11 Гц, 2H), 2,99 (кв, 2H), 2,63 (с, 3H), 2,27 и 2,23 (2с, 3H), 2,09 (кв, J=11 Гц, 2H), 1,66 и 1,55 (2д, J=11Гц, 2H).
Пример 75: 2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-циклопентилпиперидин-4-ил)ацетамид (42ELH75)
Следуют процедуре получения 42ELH80, за исключением того, что реакцию проводят при температуре 60о С в течение 3 дней.
Исходные материалы: 50ELH87 (0,25 г, 0,71 ммоль, 1,0 экв.), циклопентилбромид (0,288 г, 3,0 экв.).
Продукт: выход: 91,2 мг (34%), УФ/МС 88/93 (М+421), rt (А, MC) 4,450
Пример 76: 2-(4-метоксифенил)-N-(4-метилбензил)-N-{1-[3-(1,3-дигидро-2Н-бензимидазол-2-он-1-ил)пропил]пиперидин-4-ил}ацетамид (50ELH89)
50ELH87 (0,05 г, 0,14 ммоль, 1 экв.) переносят во флакон на 4 мл и растворяют в 1 мл ацетонитрила. Затем добавляют 1-(3-хлорпропил)-1,3-дигидро-2Н-бензимидазол-2-он (0,032 г, 1,1 экв.), карбонат натрия (0,022 г, 1,1 экв.) и KI (один кристалл) и флакон плотно закрывают и встряхивают в течение 20 часов при 82о С. Далее смесь экстрагируют дистиллированной водой (рН 10, карбонат натрия) и дихлорметаном (3 раза), органические слои сушат сульфатом натрия и концентрируют. Указанное в заголовке соединение очищают ВЭЖХ и выпаривают досуха с получением соли трифторуксусной кислоты. Выход: 8,8 мг (12%). УФ/МС 100/100 (М+527), rt (А, MC) 2,851
Пример 77: 2-(4-метоксифенил)-N-(4-метилбензил)-N-[1-(2-метилтиазол-4-илметил)пиперидин-4-ил]ацетамид (63ELH1А)
50ELH87 (0,3 г, 0,852 ммоль, 1 экв.) и гидрохлорид 4-(хлорметил)-2-метилтиазола (0,235 г, 1,5 экв.) вносят во флакон на 7 мл и растворяют в ацетонитриле (3 мл). Затем добавляют карбонат натрия (141,3 г, 1,2 экв.) и один кристалл KI и флакон плотно закрывают и встряхивают в течение 20 часов при 82о С. Далее реакционную смесь экстрагируют дистиллированной водой (которую подщелачивают карбонатом калия до рН 10) и дихлорметаном. Неочищенный продукт сушат сульфатом натрия и концентрируют. После очистки методом ВЭЖХ продукт превращают в гидрохлоридную соль при растворении свободного основания в 1 мл дихлорметана и при добавлении 1 экв. HCl в эфире (2 М). Смесь добавляют по каплям к избытку гептана, в ходе чего происходит осаждение продукта. Растворитель удаляют выпариванием с получением белого порошка продукта. Выход: 83,8 мг (21%). УФ/МС 100/90 (М+463), rt (В, MC) 11,82
Пример 78: 2-(4-метоксифенил)-N-(2-4-фторфенил)этил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH93А)
Следуют процедуре получения 50ELH14В
Реакционная стадия 1: 4-[2-4-(фторфенил)этиламино]-1-метилпиперидин (50ELH92А)
Исходные материалы: 1-метил-4-пиперидон (0,3 г, 2,65 ммоль, 1,0 экв.), 4-(фторфенил)этиламин (0,369 г, 1,0 экв.).
Продукт: УФ/МС 60/92 (М+237), rt (А, MC) 3,422
Реакционная стадия 2: 2-(4-метоксифенил)-N-(2-4-фторфенил)этил)-N-(1-метилпиперидин-4-ил)ацетамид (50ELH93А)
Исходные материалы: 50ELH92А (0,625 г, 2,65 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (0,488 г, прим. 1,0 экв.).
Продукт: выход: 181 мг (18%), УФ/МС 87/97 (М+385), rt (А, MC) 2,783, Rf 0,8 (10%МеОН/CH2Cl2) 1Н-ЯМР (400 МГц, ДМСO, ротамеры 50/50)  10,9 (ушс, 1H), 7,56-6,8 (м, 8H), 4,26 и 4,02 (2ушт, 2H), 3,70 и 3,95 (2с, 3H), 3,59 и 3,57 (2с, 2H), 3,4-3,15 (м, 5H), 2,96-2,66 (м, 5H), 2,62 и 2,56 (2с, 3H), 2,29 и 2,10 (2кв, 2H), 1,73 и 1,41 (2д, 2H). 13C-ЯМР (ДМСO) 172,5; 171,4; 171,3; 162,9; 162,7; 160,5; 160,3; 158,9; 158,6; 136,1; 136,1; 135,3; 131,4; 131,3; 131,1; 131,0; 131,0; 130,6; 130,5; 128,4; 128,4; 126,9; 115,9; 115,8; 115,7; 115,6; 114,5; 55,7; 53,7; 53,5; 52,7; 52,3; 50,7; 46,7; 43,8; 43,2; 43,0; 36,3; 34,7; 27,9; 26,9. 10,9 (ушс, 1H), 7,56-6,8 (м, 8H), 4,26 и 4,02 (2ушт, 2H), 3,70 и 3,95 (2с, 3H), 3,59 и 3,57 (2с, 2H), 3,4-3,15 (м, 5H), 2,96-2,66 (м, 5H), 2,62 и 2,56 (2с, 3H), 2,29 и 2,10 (2кв, 2H), 1,73 и 1,41 (2д, 2H). 13C-ЯМР (ДМСO) 172,5; 171,4; 171,3; 162,9; 162,7; 160,5; 160,3; 158,9; 158,6; 136,1; 136,1; 135,3; 131,4; 131,3; 131,1; 131,0; 131,0; 130,6; 130,5; 128,4; 128,4; 126,9; 115,9; 115,8; 115,7; 115,6; 114,5; 55,7; 53,7; 53,5; 52,7; 52,3; 50,7; 46,7; 43,8; 43,2; 43,0; 36,3; 34,7; 27,9; 26,9.
Пример 79: 2-(4-метоксифенил)-N-[2-(2,5-диметоксифенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH93С)
Следуют процедуре получения 50ELH14В. Небольшое количество очищают методом ВЭЖХ и выпаривают досуха с образованием соли трифторуксусной кислоты.
Реакционная стадия 1: 4-[2-(2,5-диметоксифенил)этиламино]-1-метилпиперидин (50ELH92А)
Исходные материалы: метил-4-пиперидон (0,3 г, 2,65 ммоль, 1,0 экв.), 2,5-(диметоксифенил)этиламин (0,481 г, 1,0 экв.).
Продукт: УФ/МС 81/90 (М+279), rt (А, MC) 2,868
Реакционная стадия 2: 2-(4-метоксифенил)-N-[2-(2,5-диметоксифенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH93С)
Исходные материалы: 50ELH93С (0,737 г, 2,65 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (0,488 г, прим. 1,0 экв.).
Продукт: УФ/МС 82/100 (М+427), rt (В, MC) 8,44, Rf 0,8 (10%МеОН/CH2Cl2)
Пример 80: 2-(4-метоксифенил)-N-[2-(2,4-дихлорфенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH93D)
Следуют процедуре получения 50ELH14В, но проводят очистку методом ВЭЖХ и выпаривают досуха с образованием соли трифторуксусной кислоты.
Реакционная стадия 1: 4-[2-(2,4-дихлорфенил)этиламино]-1-метилпиперидин (50ELH92D)
Исходные материалы: 1-метил-4-пиперидон (0,3 г, 2,65 ммоль, 1,0 экв.), 2,5-(дихлорфенил)этиламин (0,5 г, 1,0 экв.).
Продукт: УФ/МС 82/92 (М+287), rt (А, MC) 4,875
Реакционная стадия 2: 2-(4-метоксифенил)-N-[2-(2,4-дихлорфенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH93D)
Исходные материалы: 50ELH93D (0,76 г, 2,65 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (0,488 г, прим. 1,0 экв.).
Продукт: УФ/МС 100/96 (М+435), rt (А, MC) 4,415, Rf 0,8 (10%МеОН/CH2Cl2)
Пример 81: 2-(4-метоксифенил)-N-[2-(3-хлорфенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH93Е)
Следуют процедуре получения 50ELH14В, но проводят очистку методом ВЭЖХ и выпаривают досуха с образованием соли трифторуксусной кислоты.
Реакционная стадия 1: 4-[(3-хлорфенил)этил)амино]-1-метилпиперидин (50ELH92Е)
Исходные материалы: 1-метил-4-пиперидон (0,3 г, 2,65 ммоль, 1,0 экв.), 3-(хлорфенил)этиламин (0,413 г, 1,0 экв.).
Продукт: УФ/МС 86/88 (М+253), rt (А, MC) 3,175
Реакционная стадия 2: 2-(4-метоксифенил)-N-[2-(3-хлорфенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH93Е)
Исходные материалы: 50ELH93Е (0,67 г, 2,65 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (0,488 г, прим. 1,0 экв.).
Продукт: УФ/МС 100/100 (М+401), rt (А, MC) 3,464, Rf 0,8 (10%МеОН/CH2Cl2)
Пример 82: 2-(4-метоксифенил)-N-[2-(4-метоксифенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH95В)
Следуют процедуре получения 50ELH14В. Проводят очистку методом ВЭЖХ и выпаривают досуха с образованием соли трифторуксусной кислоты.
Реакционная стадия 1: 4-[(4-метоксифенил)этил)амино]-1-метилпиперидин (50ELH94В)
Исходные материалы: 1-метил-4-пиперидон (0,3 г, 2,65 ммоль, 1,0 экв.), 4-метоксифенилэтиламин (0,40 г, 1,0 экв.).
Продукт: УФ/МС 74/87 (М+249), rt (А, MC) 2,935
Реакционная стадия 2: 2-(4-метоксифенил)-N-[2-(4-метоксифенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH95В)
Исходные материалы: 50ELH94В (0,657 г, 2,65 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (0,488 г, прим. 1,0 экв.).
Продукт: УФ/МС 100/100 (М+397), rt (А, MC) 2,389, Rf 0,8 (10%МеОН/CH2Cl2)
Пример 83: 2-(4-метоксифенил)-N-[2-(3-фторфенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH95D)
Следуют процедуре получения 50ELH14В. Проводят очистку методом ВЭЖХ и выпаривают досуха с образованием соли трифторуксусной кислоты.
Реакционная стадия 1: 4-[2-((3-фторфенил)этил)амино]-1-метилпиперидин (50ELH94D)
Исходные материалы: 1-метил-4-пиперидон (0,3 г, 2,65 ммоль, 1,0 экв.), 3-фторфенилэтиламин (0,369 г, 1,0 экв.).
Продукт: УФ/МС 74/89 (М+237), rt (А, MC) 2,946
Реакционная стадия 2: 2-(4-метоксифенил)-N-[2-(3-фторфенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид (50ELH95D)
Исходные материалы: 50ELH94D (0,625 г, 2,65 ммоль, 1,0 экв.), 4-метоксифенилацетилхлорид (0,488 г, прим. 1,0 экв.).
Продукт: УФ/МС 100/95 (М+385), rt (А, MC) 2,946, Rf 0,8 (10%МеОН/CH2Cl2)
Пример 84: 2-(4-этоксифенил)-N-[2-(4-фторфенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид (63ELH20)
Реакционная стадия 1: Хлорид 4-этоксифенилуксусной кислоты (63ELH19)
4-этоксифенилуксусную кислоту (0,5 г, 2,8 ммоль) переносят во флакон на 7 мл и растворяют в тионилхлориде (3 мл). Реакционную смесь встряхивают при 70о С в течение 2,5 часа. Тионилхлорид выпаривают и оставшийся продукт используют далее без очистки.
Реакционная стадия 2: 2-(4-этоксифенил)-N-[2-(4-фторфенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид (63ELH20)
63ELH17 (0,11 г, 0,47 ммоль) переносят во флакон на 4 мл и растворяют в дихлорметане. Затем добавляют 63ELH19 (0,084 мг, 1 экв.) и флакон плотно закрывают и реакционную смесь встряхивают в течение 20 часов. Далее продукт экстрагируют дистиллированной водой (которую подщелачивают карбонатом калия до рН 10) и дихлорметаном. Сушат сульфатом натрия и концентрируют. Очищают методом ВЭЖХ. Экстракцию, сушку и концентрирование повторяют и затем продукт перерастворяют в дихлорметане (1 мл) и добавляют HCl (1 экв., 2 М эфир). Смесь добавляют по каплям к избытку гептана, при этом происходит осаждение соли. Выход: 33,4 мг (18%). УФ/МС 92/100 (М+399), rt (В, MC) 10,38
Пример 85: 2-(4-этоксифенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид (63ELH21)
50ELH4 (0,11 г, 0,49 ммоль, 1,0 экв.) переносят во флакон на 4 мл и растворяют в дихлорметане. Затем добавляют 63ELH19 (0,089 мг, 1 экв.) и флакон плотно закрывают и реакционную смесь встряхивают в течение 20 часов. Далее продукт экстрагируют дистиллированной водой (которую подщелачивают карбонатом калия до рН 10) и дихлорметаном. Сушат сульфатом натрия и концентрируют. Очищают методом ВЭЖХ. Экстракцию, сушку и концентрирование повторяют и затем продукт перерастворяют в дихлорметане (1 мл) и добавляют HCl (1 экв., 2 М эфир). Смесь добавляют по каплям к избытку гептана, при этом происходит осаждение соли. Выход: 31,1 мг (16%). УФ/МС 94/100 (М+385), rt (А, MC) 2,573
Пример 86: N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(3-гидрокси-4-метоксифенил)ацетамид (57MBT12B)
N-((4-метилфенил)метил)-4-амино-1-метилпиперидин (50ELH25) (105 мг; 0,48 ммоль) и 3-гидрокси-4-метоксифенилуксусную кислоту (88 мг; 0,48 ммоль) растворяют в ДМФ (10 мл). Добавляют диизопропилэтиламин (ДИЭА, 250 мкл; 1,44 ммоль) и затем гексафторфосфат бром-трис-пирролидинофосфония (PyBrOP, 336 мг; 0,72 ммоль) и смесь перемешивают при комнатной температуре в течение 1 часа. Добавляют воду (50 мл) и реакционную смесь экстрагируют EtOAc (2х50 мл). Сушка с использованием Na2SO4 и концентрирование дают 514 мг неочищенного материала, который очищают флэш-хроматографией (0-30% MeOH в CH2Cl2). При этом получают 105 мг (57%) указанного в заголовке соединения в виде белого твердого вещества. Rf=0,20 (10% MeOH в CH2Cl2). Результаты ВЭЖХ-МС (метод А) дают МН+=383. УФ/МС(%)=100/92. 1Н-ЯМР (400 МГц, CD3OD, ротамеры 52:48):  7,18-6,58 (м, 7H), 4,53 (с, 2H), 4,31 и 3,97 (2м, 1H), 3,82 и 3,81 (2с, 3H), 3,80 и 3,55 (2с, 2H), 3,04 и 2,85 (2м, 2H), 2,41 и 2,32 (2с, 3H), 2,35 и 2,12 (2м, 2H), 2,29 и 2,27 (2с, 3H), 1,83 и 1,74 (2м, 2H), 1,72 и 1,33 (2м, 2H). 7,18-6,58 (м, 7H), 4,53 (с, 2H), 4,31 и 3,97 (2м, 1H), 3,82 и 3,81 (2с, 3H), 3,80 и 3,55 (2с, 2H), 3,04 и 2,85 (2м, 2H), 2,41 и 2,32 (2с, 3H), 2,35 и 2,12 (2м, 2H), 2,29 и 2,27 (2с, 3H), 1,83 и 1,74 (2м, 2H), 1,72 и 1,33 (2м, 2H).
Пример 87: N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(3,4-дигидроксифенил)ацетамид (57MBT24B)
N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(3-гидрокси-4-метоксифенил)ацетамид (57MBT12B) (52 мг; 0,136 ммоль) растворяют в CH2Cl2 (1 мл) и охлаждают до -78°С. Добавляют по каплям трибромид бора (1 М в CH2Cl2, 204 мкл; 0,204 ммоль) и убирают охлаждающую баню. После перемешивания в течение 2 часов добавляют метанол (2 мл) и смесь выпаривают. Полученное масло очищают препаративной ВЭЖХ с получением 24 мг (48%) указанного в заголовке соединения в виде белого твердого вещества. Результаты проведения ВЭЖХ-МС (метод А) дают МН+=369. УФ/МС(%)=100/97. 1H-ЯМР (400 МГц, CD3OD, ротамеры 33:67):  7,19-6,47 (м, 7H), 4,54 и 4,53 (2с, 2H), 4,23 (м, 1H), 3,83 и 3,58 (2с, 2H), 3,46 и 3,40 (2ушд, J=12 Гц, 2H), 3,02 и 2,95 (2ушт, J=12 Гц, 2H), 2,79 (с, 3H), 2,33 и 2,28 (2с, 3H), 2,17 и 1,84 (2дкв, J=4,12 Гц, 2H), 1,87 и 1,48 (2ушд, J=12 Гц, 2H). 7,19-6,47 (м, 7H), 4,54 и 4,53 (2с, 2H), 4,23 (м, 1H), 3,83 и 3,58 (2с, 2H), 3,46 и 3,40 (2ушд, J=12 Гц, 2H), 3,02 и 2,95 (2ушт, J=12 Гц, 2H), 2,79 (с, 3H), 2,33 и 2,28 (2с, 3H), 2,17 и 1,84 (2дкв, J=4,12 Гц, 2H), 1,87 и 1,48 (2ушд, J=12 Гц, 2H).
Пример 88: N-((3-гидрокси-4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-метоксифенил)ацетамид (57MBT54B)
N-((4-метоксифенил)метил)-4-амино-1-метилпиперидин (1 г; 4,27 ммоль) растворяют в 4% растворе муравьиной кислоты в метаноле (60 мл). В атмосфере аргона добавляют 10% Pd/C (1 г) и реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 24 часов. Далее смесь фильтруют через целит и фильтрат подкисляют концентрированной HCl до рН 1. Концентрирование дает желтое масло, которое очищают флэш-хроматографией (MeOH/CH2Cl2 3:7 + 3,5% NH4OH) с получением 249 мг (51%) 4-амино-1-метилпиперидина (57MBT36B) в виде белого твердого вещества. Rf=0,13 (10% MeOH в CH2Cl2 + 3,5% NH4OH). Результаты ВЭЖХ-МС (метод В) дают МН+=115. УФ/МС(%)=-/100.
4-Амино-1-метилпиперидин (57MBT36B) (26 мг; 0,231 ммоль) растворяют в метаноле (1 мл) и добавляют 3-гидрокси-4-метилбензальдегид (32 мг; 0,231 ммоль) и уксусную кислоту (33 мкл). Смесь охлаждают до 0°С. Добавляют NaBH3CN (29 мг; 0,462 ммоль) и убирают охлаждающую баню. Через 3 часа смесь выпаривают и проводят флэш-хроматографию (0-30% MeOH в CH2Cl2), в результате которой получают 27 мг (50%) N-((3-гидрокси-4-метилфенил)метил)-4-амино-1-метилпиперидина (57MBT44C) в виде белого твердого вещества. Rf=0,27 (10% MeOH в CH2Cl2 + 3,5% NH4OH). Результаты ВЭЖХ-МС (метод А) дают МН+=235. УФ/МС(%)=99/99.
N-((3-Гидрокси-4-метилфенил)метил)-4-амино-1-метилпиперидин (57MBT44C) (27 мг; 0,115 ммоль) растворяют в CH2Cl2 (2 мл). В атмосфере аргона по каплям прибавляют 4-метоксифенилацетилхлорид (17 мкл; 0,115 ммоль). Через 3 часа добавляют н-гептан (3 мл) и смесь выпаривают. Флэш-хроматография (0-20% MeOH в CH2Cl2) дает 14 мг (32%) указанного в заголовке соединения в виде белого твердого вещества. Rf=0,32 (10% MeOH в CH2Cl2 + 3,5% NH4OH). Результаты ВЭЖХ-МС (метод А) дают МН+=383. УФ/МС(%)=99/96. 1H-ЯМР (400 МГц, CD3OD, ротамеры 63:37);  7,28-6,55 (м, 7H), 4,48 (с, 2H), 4,37 и 3,95 (2м, 1H), 3,78 и 3,77 (2с, 3H), 3,06 и 2,89 (2ушд, J=12 Гц, 2H), 2,42 и 2,32 (2с, 3H), 2,40 и 2,12 (2м, 2H), 2,18 и 2,12 (2с, 3H), 1,86 и 1,83 (2м, 2H), 1,75 и 1,35 (2ушд, J=12Гц, 2H). 7,28-6,55 (м, 7H), 4,48 (с, 2H), 4,37 и 3,95 (2м, 1H), 3,78 и 3,77 (2с, 3H), 3,06 и 2,89 (2ушд, J=12 Гц, 2H), 2,42 и 2,32 (2с, 3H), 2,40 и 2,12 (2м, 2H), 2,18 и 2,12 (2с, 3H), 1,86 и 1,83 (2м, 2H), 1,75 и 1,35 (2ушд, J=12Гц, 2H).
Пример 89: N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-бромфенил)ацетамида гидрохлорид (57MBT70-1D)
4-бромфенилуксусную кислоту (54 мг; 0,252 ммоль) растворяют в CH2Cl2 (2 мл) и добавляют N-((4-метилфенил)метил)-4-амино-1-метилпиперидин (в форме раствора для хранения 292 мг/мл в CH2Cl2; 171 мкл; 0,229 ммоль) и диизопропилэтиламин на полистирольной подложке (ПС-ДИЭА с нагрузкой 3,57 ммоль/г; 192 мг; 0,687 ммоль), а затем прибавляют гексафторфосфат бром-трис-пирролидинфосфония (PyBrOP; раствор для хранения 160 мг/мл; 1 мл; 0,334 ммоль). Реакционную смесь встряхивают в течение 1 часа при комнатной температуре и затем фильтруют в предварительно промытую (метанолом) ионообменную колонку (0,88 ммоль/г; 1 г). Колонку промывают метанолом (8×4 мл) и оставшийся продукт экстрагируют с колонки с помощью 10% NH4OH в метаноле (2×4 мл) и выпаривают. Полученное масло фильтруют через силикагель (Н=4 см, D=1 см) в смеси метанол/CH2Cl2 1:9 (20 мл), выпаривают и наносят на вторую ионообменную колонку (0,88 ммоль/г; 1 г). Колонку промывают метанолом (8×4 мл) и оставшийся продукт элюируют с колонки 10% NH4OH в метаноле (2×4 мл) и выпаривают на роторном испарителе с масляным насосом. Продукт растворяют в CH2Cl2 (0,5 мл) и добавляют HCl в диэтиловом эфире (1,0 М; 0,1 мл; 0,1 ммоль). Раствор прибавляют к н-гептану (3 мл) и выпаривают с получением 29 мг (25%) указанного в заголовке соединения в виде белого твердого вещества. Rf=0,31 (10% MeOH в CH2Cl2). Результаты ВЭЖХ-МС (метод В) дают МН+=416. УФ/МС(%)=100/99.
Пример 90: N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-иодфенил)ацетамида гидрохлорид (57MBT70-2D)
Указанное в заголовке соединение получают в соответствии с примером получения MBT04. Выход: 33 мг (26%). Rf=0,31 (10% MeOH в CH2Cl2). Результаты ВЭЖХ-МС (метод В) дают МН+=463. УФ/МС(%)=100/98.
Пример 91: N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-(2-пропил)фенил)ацетамида гидрохлорид (57MBT70-3D)
Указанное в заголовке соединение получают в соответствии с примером получения MBT04. Выход: 36 мг (34%). Rf=0,31 (10% MeOH в CH2Cl2). Результаты ВЭЖХ-МС (метод В) дают МН+=379. УФ/МС(%)=100/97.
Пример 92: N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-трифторметоксифенил)ацетамида гидрохлорид (57MBT70-4D)
Указанное в заголовке соединение получают в соответствии с примером получения MBT04. Выход: 35 мг (30%). Rf=0,27 (10% MeOH в CH2Cl2). Результаты ВЭЖХ-МС (метод В) дают МН+=421. УФ/МС(%)=100/99.
Пример 93: N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-метилтиофенил)ацетамида гидрохлорид (57MBT70-5D)
Указанное в заголовке соединение получают в соответствии с примером получения MBT04. Выход: 35 мг (33%). Rf=0,30 (10% MeOH в CH2Cl2). Результаты ВЭЖХ-МС (метод В) дают МН+=383. УФ/МС(%)=100/99.
Пример 94: N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-(N,N-диметиламино)фенил)ацетамида гидрохлорид (57MBT70-6D)
Указанное в заголовке соединение получают в соответствии с примером получения MBT04. Выход: 16 мг (15%). Rf=0,25 (10% MeOH в CH2Cl2). Результаты ВЭЖХ-МС (метод А) дают МН+=380. УФ/МС(%)=100/100.
Пример 95: N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-нитрофенил)ацетамида гидрохлорид (57MBT70-7D)
Указанное в заголовке соединение получают в соответствии с примером получения MBT04. Выход: 28 мг (27%). Rf=0,27 (10% MeOH в CH2Cl2). Результаты ВЭЖХ-МС (метод В) дают МН+=382. УФ/МС(%)=100/100.
Пример 96: N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-метокси-3-метилфенил)ацетамида гидрохлорид (57MBT70-8D)
Указанное в заголовке соединение получают в соответствии с примером получения MBT04. Выход: 34 мг (32%). Rf=0,30 (10% MeOH в CH2Cl2). Результаты ВЭЖХ-МС (метод В) дают МН+=381. УФ/МС(%)=100/99.
Пример 97: N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-пиридил)ацетамида гидрохлорид (57MBT70-9F)
Указанное в заголовке соединение получают в соответствии с примером получения MBT04. Выход: 18 мг (17%). Rf=0,09 (10% MeOH в CH2Cl2). Результаты ВЭЖХ-МС (метод А) дают МН+=338. УФ/МС(%)=100/100.
Пример 98: N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-метилфенил)ацетамида гидрохлорид (57MBT62B)
Указанное в заголовке соединение получают в соответствии с примером получения MBT04. Выход: 10 мг (35%). Rf= (10% MeOH в CH2Cl2). Результаты ВЭЖХ-МС (метод А) дают МН+=351. УФ/МС(%)=100/100.
Пример 99: N-((4-(гидроксиметил)фенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-метоксифенил)ацетамида гидрохлорид (57MBT72D)
К перемешиваемой суспензии LiAlH4 (285 мг; 7,52 ммоль) в диэтиловом эфире (10 мл) при 0°С добавляют в течение 15 минут раствор 4-цианобензилового спирта (0,5 г; 3,76 ммоль) в диэтиловом эфире (5 мл). Серую реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 3 часов. После охлаждения до комнатной температуры смесь обрабатывают последовательно водой (1 мл), 2 М NaOH (2 мл) и водой (2 мл) при интенсивном перемешивании. Полученную белую взвесь фильтруют и промывают CH2Cl2 (20 мл). Экстракция дополнительным CH2Cl2 (20 мл) и н-бутанолом (20 мл) и выпаривание приводят к получению масла, которое после флэш-хроматографии (0-15% MeOH в CH2Cl2) дает 152 мг (29%) 4-(аминометил)бензилового спирта (57MBT52B) в виде белого твердого вещества. Rf=0,51 (30% MeOH в CH2Cl2 + 3,5% NH4OH).
1-Метил-4-пиперидон (84 мкл; 0,73 ммоль) растворяют в метаноле (5 мл) и добавляют 4-(аминометил)бензиловый спирт (57MBT52B) (100 мг; 0,73 ммоль) с последующим добавлением уксусной кислоты (125 мкл). Затем добавляют NaBH3CN (92 мг; 1,46 ммоль) и смесь перемешивают в течение 3 часов. Реакционную смесь выпаривают и добавляют 2М NaOH (5 мл). Экстракция CH2Cl2 (4×5 мл), сушка с помощью Na2SO4 и выпаривание дают 152 мг (87%) N-((4-(гидроксиметил)фенил)метил)-4-амино-1-метилпиперидина (57MBT56D). Анализ методом ВЭЖХ-МС (метод В) дает МН+=235. УФ/МС(%)=100/100.
N-((4-(Гидроксиметил)фенил)метил)-4-амино-1-метилпиперидин (57MBT56D) (20 мг; 0,0853 ммоль) растворяют в CH2Cl2 (2 мл) и добавляют по каплям 4-метоксифенилацетилхлорид (26 мкл; 0,171 ммоль). Реакционную смесь перемешивают в течение 1 часа и добавляют воду (500 мкл) с последующим выпариванием. Затем добавляют раствор натрия (5 мг; 0,179 ммоль) в метаноле (2 мл). После перемешивания в течение 4 часов раствор переносят в предварительно промытую (метанолом) ионообменную колонку (0,88 ммоль/г; 1 г) и промывают метанолом (4×4 мл). Оставшийся продукт элюируют с колонки 10% NH4OH в метаноле (2×4 мл) и выпаривают. Полученное масло фильтруют через силикагель (h=4 см; d=1 см) в смеси метанол/CH2Cl2 2:8 (20 мл), выпаривают и наносят на вторую ионообменную колонку (0,88 ммоль/г; 1 г). Колонку промывают метанолом (8×4 мл) и оставшийся продукт элюируют с колонки 10% NH4OH в метаноле (2×4 мл) и выпаривают на роторном испарителе с масляным насосом. Продукт растворяют в CH2Cl2 (0,5 мл) и добавляют HCl в диэтиловом эфире (1,0 М; 0,1 мл; 0,1 ммоль). Полученный раствор прибавляют к н-гептану (3 мл) и выпаривают с получением 14 мг (39%) указанного в заголовке соединения в виде белого твердого вещества. Rf=0,16 (10% MeOH в CH2Cl2). Анализ методом ВЭЖХ-МС (метод В) дает МН+=383. УФ/МС(%)=100/96.
Пример 100: 2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-изопропилпиперидин-4-ил)ацетамид (47AKU-7)
1-Трифторацетил-4-пиперидон (47AKU-2)
Моногидрат гидрохлорида 4-пиперидона (3,85 г; 25 ммоль) и триэтиламин (10,5 мл; 75 ммоль) частично растворяют в 100 мл дихлорметана и перемешивают в течение 10 минут. Затем реакционную смесь охлаждают в ледяной бане и медленно прибавляют в течение 10 минут трифторуксусный ангидрид (7,2 мл; 50 ммоль). Ледяную баню удаляют и смесь перемешивают в течение ночи. Вносят дополнительное количество трифторуксусного ангидрида (2 мл) и смесь перемешивают в течение 1 часа. Добавляют воду (200 мл). Фазы разделяют и водную фазу повторно экстрагируют дихлорметаном. Объединенные органические фазы промывают насыщенным солевым раствором, сушат над MgSO4 и концентрируют (40°С) с получением 4,97 г (100 %) 47AKU-2 в виде желтых кристаллов. ТСХ (5% метанола в дихлорметане): Rf=0,8. 1H-ЯМР (400 МГц, CDCl3):  = 3,87-3,99 (4H,м); 2,54-2,61 (4H, м). 13C-ЯМР (CDCl3): = 3,87-3,99 (4H,м); 2,54-2,61 (4H, м). 13C-ЯМР (CDCl3):  = 204,7, 118,0, 115,1, 44,2, 42,8, 41,2, 40,5. = 204,7, 118,0, 115,1, 44,2, 42,8, 41,2, 40,5.
4-(4-Метилбензиламино)-1-трифторацетилпиперидин (47AKU-3)
47AKU-2 (4,97 г; 25 ммоль) растворяют в 100 мл метанола и добавляют 4-метилбензиламин (3,2 мл; 25 ммоль). Смесь перемешивают и добавляют уксусную кислоту (~2 мл) до рН~5. Медленно прибавляют NaCNBH3 (3,15 г; 50 ммоль). После перемешивания на магнитной мешалке в течение 20 часов метанол частично удаляют на роторном испарителе (40°С). Добавляют дихлорметан, 2М NaOH и воду до рН~10. Фазы разделяют и водную фазу повторно дважды экстрагируют дихлорметаном. Объединенные органические фазы промывают насыщенным солевым раствором и сушат над MgSO4. Концентрирование (40°С) дает 6,94 г (92%) 47AKU-3. ТСХ (10% метанола в дихлорметане): Rf=0,6. Анализ методом ВЭЖХ-МС (метод А): М+=301,0 (УФ/МС(%)=94/100).
2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-трифторацетилпиперидин-4-ил)ацетамид (47AKU-4)
47AKU-3 (3,01 г; 10 ммоль) в 25 мл дихлорметана помещают в 100-миллилитровую колбу. Добавляют триэтиламин (1,4 мл; 10 ммоль) и смесь охлаждают в ледяной бане и перемешивают в течение 10 минут. 4-хлорфенилацетилхлорид (1,90 г; 10 ммоль) растворяют в 10 мл дихлорметана и медленно добавляют к охлажденной на льду реакционной смеси. Через 15 минут ледяную баню убирают и смесь оставляют на 1 час. Наблюдается выпадение осадка. Затем реакционную смесь концентрируют с отсасыванием (40°С). Сырой продукт очищают флэш-хроматографией (0-50% этилацетата в гептане) с получением 2,38 г (53%) 47AKU-4. ТСХ (100% дихлорметан): Rf=0,6. Анализ методом ВЭЖХ-МС (метод А): М+=453,0 (УФ/МС(%)=89/84).
2-(4-хлорфенил)-N-(4-метилбензил)-N-(пиперидин-4-ил)ацетамид (47AKU-6)
47AKU-4 (2,38 г; ~5 ммоль) растворяют в 50 мл метанола. Добавляют в виде одной порции K2CO3 (3,5 г; 25 ммоль). После перемешивания на магнитной мешалке в течение 20 часов вносят дополнительное количество K2CO3 (1 г). После перемешивания на магнитной мешалке в течение 4 часов метанол частично удаляют выпариванием (40°С). Добавляют этилацетат (100 мл) и воду. Фазы разделяют и водную фазу повторно экстрагируют этилацетатом. Объединенные органические фазы сушат над MgSO4 и концентрируют (40°С) с получением 1,95 г (100%) 47AKU-6. ТСХ (20% метанола в дихлорметане): Rf=0,3. Анализ методом ВЭЖХ-МС (метод А): М+=357,1 (УФ/МС(%)=84/95).
2-(4-хлорфенил)-N-(4-метилбензил)-N-(изопропилпиперидин-4-ил)ацетамид (47AKU-7)
47AKU-6 (358 мг; 1,0 ммоль) растворяют в 20 мл ацетонитрила. Добавляют триэтиламин (1,4 мл; 10 ммоль) и смесь перемешивают в течение 10 минут. Изопропилбромид (370 мг; 3,0 ммоль) растворяют в 5 мл ацетонитрила и добавляют к реакционной смеси, которую перемешивают при комнатной температуре в течение 20 часов и затем нагревают до 60°С в течение 4 часов. После охлаждения добавляют этилацетат (25 мл) и воду (25 мл). Фазы разделяют и водную фазу повторно экстрагируют этилацетатом. Объединенные органические фазы промывают насыщенным солевым раствором, сушат над MgSO4 и концентрируют (40°С) с получением 362 мг сырого продукта. Очистка флэш-хроматографией (0-10% метанола в дихлорметане) и осаждение под действием HCl из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане дают 76 мг (18%) 47AKU-7. ТСХ (10% метанол в дихлорметане): Rf=0,4. Тпл.=223-224°С. Анализ методом ВЭЖХ-МС (метод А): М+=399,1 (УФ/МС(%)=100/99). 1H-ЯМР (400 МГц, CDCl3):  = 7,03-7,29 (8H, м); 4,86 (1H, м); 4,61 (2H, м); 3,58 (2H, м); 3,37 (3H, м); 2,82 (2H, м); 2,64 (2H, м); 2,34 (3H, с); 1,80 (2H, м); 1,39 (6H, д). 13C-ЯМР (СDCl3): = 7,03-7,29 (8H, м); 4,86 (1H, м); 4,61 (2H, м); 3,58 (2H, м); 3,37 (3H, м); 2,82 (2H, м); 2,64 (2H, м); 2,34 (3H, с); 1,80 (2H, м); 1,39 (6H, д). 13C-ЯМР (СDCl3):  = 172,4, 137,4, 134,8, 133,3, 133,1, 130,4, 129,9, 129,0, 125,8, 58,0, 49,5, 48,2, 46,6, 40,4, 26,0, 21,2, 17,0. = 172,4, 137,4, 134,8, 133,3, 133,1, 130,4, 129,9, 129,0, 125,8, 58,0, 49,5, 48,2, 46,6, 40,4, 26,0, 21,2, 17,0.
Пример 101: 2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-этилпиперидин-4-ил)-2-(4-бромфенил)ацетамид (47AKU-12)
47AKU-6 (358 мг; 1,0 ммоль) растворяют в 20 мл ацетонитрила. Добавляют триэтиламин (1,4 мл; 10 ммоль) и смесь перемешивают в течение 10 минут. Добавляют этилбромид (370 мкл; 5,0 ммоль). Затем смесь нагревают до 50°С и перемешивают в течение ночи. После охлаждения добавляют воду (25 мл) и этилацетат (25 мл). Фазы разделяют и водную фазу повторно экстрагируют этилацетатом. Объединенные органические фазы промывают насыщенным насыщенным солевым раствором и сушат над MgSO4. Выпаривание (40°С) дает 406 мг сырого продукта. Очистка ионообменной хроматографией (промывка 10% водным NH4OH (25%) в метаноле) дает 166 мг (43%) 47AKU-12. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,5. Анализ методом ВЭЖХ-МС (метод А): М+=385,1 (УФ/МС(%)=100/99). 1H-ЯМР (400 МГц, CDCl3, ротамеры):  = 7,02-7,34 (8H, м); 4,62 (1H, м); 4,46 и 4,53 (2H, 2с); 3,81 (1H, с); 3,55 (2H, с); 2,92 (2H, м); 2,34 (3H, с); 2,29 (1H, с); 1,98 (2H, м); 1,52-1,84 (4H, м), 1,03(3Н, т). 13C-ЯМР (СDCl3): = 7,02-7,34 (8H, м); 4,62 (1H, м); 4,46 и 4,53 (2H, 2с); 3,81 (1H, с); 3,55 (2H, с); 2,92 (2H, м); 2,34 (3H, с); 2,29 (1H, с); 1,98 (2H, м); 1,52-1,84 (4H, м), 1,03(3Н, т). 13C-ЯМР (СDCl3):  = 171,7, 137,2, 135,4, 133,9, 132,8, 130,4, 129,7, 128,9, 125,8, 52,8, 52,4, 46,5, 40,8, 31,2, 28,8, 21,2, 12,4. = 171,7, 137,2, 135,4, 133,9, 132,8, 130,4, 129,7, 128,9, 125,8, 52,8, 52,4, 46,5, 40,8, 31,2, 28,8, 21,2, 12,4.
Пример 102: 2-фенил-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-13)
47AKU-5 (218 мг; 1,0 ммоль) растворяют в 2 мл дихлорметана в колбе на 50 мл. Добавляют фенилацетилхлорид (134 мкл; 1,0 ммоль). После 3 часов перемешивания при комнатной температуре смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают ионообменной хроматографией (промывка 10% водным NH4OH (25%) в метаноле) и флэш-хроматографией (0-10% метанола в дихлорметане) с получением 48 мг (14%) 47AKU-13. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,4. Анализ методом ВЭЖХ-МС (метод А): М+=337,1 (УФ/МС(%)=98/98). 1H-ЯМР (400 МГц, СDСl3, ротамеры):  = 7,01-7,40 (9H, м); 4,63 (1H, м); 4,53 и 4,45 (2H, 2с); 3,85 и 3,61 (2H, 2с); 2,86 и 2,77 (2H, 2м); 2,35 и 2,29 (3H, 2с); 2,25 и 2,20 (3H, 2с); 2,09 (2H, м); 1,61-1,86 (4H, м). 13C-ЯМР (CDCl3): = 7,01-7,40 (9H, м); 4,63 (1H, м); 4,53 и 4,45 (2H, 2с); 3,85 и 3,61 (2H, 2с); 2,86 и 2,77 (2H, 2м); 2,35 и 2,29 (3H, 2с); 2,25 и 2,20 (3H, 2с); 2,09 (2H, м); 1,61-1,86 (4H, м). 13C-ЯМР (CDCl3):  = 172,2, 137,1, 135,5, 129,7, 128,9, 128,8, 127,2, 126,9, 125,8, 55,3, 51,6, 46,6, 46,1, 41,6, 29,5, 21,2. = 172,2, 137,1, 135,5, 129,7, 128,9, 128,8, 127,2, 126,9, 125,8, 55,3, 51,6, 46,6, 46,1, 41,6, 29,5, 21,2.
Пример 103: 2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-8)
4-(4-Метилбензиламино)-1-метилпиперидин (47AKU-5)
1-Метил-4-пиперидон (1,13 г; 10 ммоль) растворяют в 20 мл метанола и помещают в колбу на 100 мл. Добавляют 4-метилбензиламин (1,21 г; 10 ммоль) в 10 мл метанола. Затем добавляют уксусную кислоту (~1,5 мл) до рН~5. После этого медленно прибавляют NaCNBH3 (1,26 г; 20 ммоль). После перемешивания на магнитной мешалке в течение 20 часов метанол частично выпаривают на роторном испарителе (40°С). Добавляют дихлорметан, воду и 2М NaOH до рН~10. Фазы разделяют и водную фазу дважды экстрагируют дихлорметаном. Объединенные органические фазы промывают насыщенным солевым раствором и сушат над MgSO4. Концентрирование на роторном испарителе (40°С) дает 2,06 г неочищенного (93 %) 47AKU-5. ТСХ (20% метанол в дихлорметане): Rf=0,3. Анализ методом ВЭЖХ-МС (метод А): М+=219,1 (УФ/МС(%)=89/98).
2-(4-Хлорфенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-8)
47AKU-5 (437 мг; 2,0 ммоль) растворяют в 10 мл дихлорметана в колбе на 50 мл. Добавляют триэтиламин (280 мкл; 2,0 ммоль) и смесь охлаждают до 0°С на ледяной бане, после чего перемешивают в течение 10 минут. Затем растворяют 4-хлорфенилацетилхлорид (380 мг; 2,0 ммоль) в 10 мл дихлорметана и добавляют к охлажденной смеси. После 2 часов перемешивания при комнатной температуре вносят дополнительное количество дихлорметана (10 мл) и воды (20 мл). Фазы разделяют и водную фазу повторно экстрагируют дихлорметаном. Объединенные органические фазы сушат над MgSO4 и концентрируют на роторном испарителе (40°С) с получением 755 мг сырого продукта. Очистка флэш-хроматографией (0-10% метанола в дихлорметане) дает 485 мг (65%) продукта. Дальнейшая очистка ионообменной хроматографией (промывка 10% водным NH4OH (25%) в метаноле) дает 239 мг (32%) 47AKU-8. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,4. Тпл.=217-219°С. Анализ методом ВЭЖХ-МС (метод А): М+=371,1 (УФ/МС(%)=99/99). 1H-ЯМР (400 МГц, CD3OD):  = 7,05-7,39 (8H, м); 4,80 (3Н, с); 4,62 + 4,56 (2H, 2с); 4,35 (1H, м); 4,00 (1H, с); 3,71 (1H, с); 3,46 (2H, м); 3,06 (2H, м); 2,80 (3H, с); 2,32 + 2,27 (3H, 2с); 2,19 (1H,м). 13C-ЯМР (CD3OD): = 7,05-7,39 (8H, м); 4,80 (3Н, с); 4,62 + 4,56 (2H, 2с); 4,35 (1H, м); 4,00 (1H, с); 3,71 (1H, с); 3,46 (2H, м); 3,06 (2H, м); 2,80 (3H, с); 2,32 + 2,27 (3H, 2с); 2,19 (1H,м). 13C-ЯМР (CD3OD):  = 173,0, 137,5, 134,5, 133,9, 132,6, 130,6, 129,5, 128,5, 126,2, 54,0, 51,4, 42,6, 40,2, 31,8, 26,6, 19,9. = 173,0, 137,5, 134,5, 133,9, 132,6, 130,6, 129,5, 128,5, 126,2, 54,0, 51,4, 42,6, 40,2, 31,8, 26,6, 19,9.
Пример 104: 2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-циклопентилпиперидин-4-ил)ацетамид (47AKU-11)
47AKU-6 (358 мг; 1,0 ммоль) растворяют в 20 мл ацетонитрила. Добавляют триэтиламин (1,4 мл; 10 ммоль) и смесь перемешивают в течение 10 минут. Затем добавляют циклопентилбромид (540 мкл; 5,0 ммоль) и смесь перемешивают при комнатной температуре. Через 20 часов смесь нагревают до 50°С в течение еще 24 часов. Затем реакционную смесь охлаждают и добавляют воду (25 мл) и этилацетат (25 мл). Фазы разделяют и водную фазу повторно экстрагируют этилацетатом. Объединенные органические фазы промывают насыщенным солевым раствором и сушат над MgSO4. Концентрирование на роторном испарителе (45°С) дает 426 мг сырого продукта. Очистка ионообменной хроматографией (промывка 10% водным NH4OH (25%) в метаноле) и флэш-хроматографией (0-10% метанол в дихлорметане) дают 76 мг (18%) 47AKU-11. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанола в дихлорметане): Rf=0,5. Анализ методом ВЭЖХ-МС (метод А): М+=425,1 (УФ/МС(%)=100/97). 1H-ЯМР (400 МГц, СDСl3, ротамеры):  = 7,01-7,34 (8H, м); 4,67 (1H, м); 4,49 и 4,52 (2H, 2с); 3,54 (2H, с); 3,15 и 3,02 (2H, 2м); 2,64 (1H, м); 2,27 и 2,34 (3H, 2с); 2,20 (1H, м); 1,85 (4H, м); 1,69 (4H, м); 1,53 (4H, м); 1,37 (1H, м). 13C-ЯМР (СDСl3): = 7,01-7,34 (8H, м); 4,67 (1H, м); 4,49 и 4,52 (2H, 2с); 3,54 (2H, с); 3,15 и 3,02 (2H, 2м); 2,64 (1H, м); 2,27 и 2,34 (3H, 2с); 2,20 (1H, м); 1,85 (4H, м); 1,69 (4H, м); 1,53 (4H, м); 1,37 (1H, м). 13C-ЯМР (СDСl3):  = 171,9, 137,2, 135,2, 133,8, 132,9, 130,4, 129,7, 128,9, 125,8, 67,7, 52,4, 52,1, 46,5, 40,7, 30,2, 28,8, 24,3, 21,2. = 171,9, 137,2, 135,2, 133,8, 132,9, 130,4, 129,7, 128,9, 125,8, 67,7, 52,4, 52,1, 46,5, 40,7, 30,2, 28,8, 24,3, 21,2.
Пример 105: 2-(4-фторфенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-14)
47AKU-5 (218 мг; 1,0 ммоль) растворяют в 3 мл дихлорметана в колбе на 50 мл. Добавляют 4-фторфенилацетилхлорид (150 мкл; 1,1 ммоль). После 4 часов перемешивания при комнатной температуре смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 243 мг (68%) 47AKU-14. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,5. Анализ методом ВЭЖХ-МС (метод А): М+=355,1 (УФ/МС(%)=100/100). 1H-ЯМР (400 МГц, СDСl3):  = 6,92-7,33 (8H, м); 4,73 (1H, м); 4,52 (2H, с); 3,56 (2H, 2с); 3,44 (5H, м); 3,25 (2H, м); 2,52-2,67 (4H, м); 2,33 (3H, с). 13C-ЯМР (СDСl3): = 6,92-7,33 (8H, м); 4,73 (1H, м); 4,52 (2H, с); 3,56 (2H, 2с); 3,44 (5H, м); 3,25 (2H, м); 2,52-2,67 (4H, м); 2,33 (3H, с). 13C-ЯМР (СDСl3):  = 172,5, 163,3, 160,9, 139,5, 134,8, 130,6, 129,8, 125,8, 115,8, 54,6, 50,8, 49,9, 46,7, 40,4, 27,2, 21,2. = 172,5, 163,3, 160,9, 139,5, 134,8, 130,6, 129,8, 125,8, 115,8, 54,6, 50,8, 49,9, 46,7, 40,4, 27,2, 21,2.
Пример 106: 2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-(2-гидроксиэтил)-пиперидин-4-ил)ацетамид (47AKU-18)
47AKU-6-2 (358 мг; 1,0 ммоль) растворяют в 10 мл ацетонитрила в колбе на 50 мл. Добавляют триэтиламин (1,4 мл; 10 ммоль) и смесь перемешивают в течение 10 минут.
Добавляют 2-бромэтанол (215 мкл; 3,0 ммоль). Затем реакционную смесь нагревают до 60°С и перемешивают в течение ночи. После охлаждения добавляют этилацетат (25 мл) и воду (25 мл). Фазы разделяют и водную фазу повторно экстрагируют этилацетатом. Объединенные органические фазы промывают насыщенным солевым раствором, сушат над MgSO4 и концентрируют на роторном испарителе (40°С) с получением 406 мг сырого продукта. Очистка флэш-хроматографией (0-10% метанол в дихлорметане) дает 253 мг (63%) 47AKU-18. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,4. Анализ методом ВЭЖХ-МС (метод А): М+=401,1 (УФ/МС(%)=100/100). 1Н-ЯМР (400 МГц, СDСl3, ротамеры):  = 7,04-7,34 (8H, м); 4,60 (1H, м);4,52 и 4,45 (2H, 2с); 3,55 (4H, м); 3,03 (1H, ушс); 2,92 (2H, м); 2,52 (2H, м); 2,36 и 2,31 (3H, 2с); 2,19 (2H, м); 1,66 (4H, м).). 13C-ЯМР (СDСl3): = 7,04-7,34 (8H, м); 4,60 (1H, м);4,52 и 4,45 (2H, 2с); 3,55 (4H, м); 3,03 (1H, ушс); 2,92 (2H, м); 2,52 (2H, м); 2,36 и 2,31 (3H, 2с); 2,19 (2H, м); 1,66 (4H, м).). 13C-ЯМР (СDСl3):  = 171,7, 137,3, 135,2, 133,8, 132,9, 130,4, 129,8, 128,9, 125,8, 59,4, 58,1, 53,1, 52,3, 46,8, 40,8, 29,7, 21,2. = 171,7, 137,3, 135,2, 133,8, 132,9, 130,4, 129,8, 128,9, 125,8, 59,4, 58,1, 53,1, 52,3, 46,8, 40,8, 29,7, 21,2.
Пример 107: 2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-циклобутилпиперидин-4-ил)ацетамид (47AKU-19)
1-циклобутил-4-пиперидон (47AKU-15)
Частично растворенную четвертичную соль (1,23 г; 3,7 ммоль) (полученную по процедуре, описанной для синтеза 47AKU-47) медленно добавляют в кипящий с обратным холодильником раствор циклобутиламина (178 мг; 2,5 ммоль) и карбоната калия (48 мг; 0,34 ммоль) в этаноле. Смесь кипятят с обратным холодильником в течение 1,5 часа. После охлаждения до комнатной температуры добавляют воду (10 мл) и дихлорметан (25 мл). Фазы разделяют и водную фазу повторно экстрагируют дихлорметаном. Объединенные органические фазы сушат над MgSO4 и концентрируют на роторном испарителе (40°С) с получением 419 мг неочищенного 47AKU-15. ТСХ (10% метанол в дихлорметане): Rf=0,4. Анализ методом ВЭЖХ-МС (метод А): М+=154,1 (МС(%)=75).
4-(4-метилбензиламино)-1-циклобутилпиперидин (47AKU-16)
4-метилбензиламин (215 мг; 1,8 ммоль) растворяют в 5 мл метанола и помещают в колбу на 50 мл. Добавляют раствор 47AKU-15 (270 мг; 1,8 ммоль) в 5 мл метанола. Затем добавляют уксусную кислоту (0,3 мл) до получения рН~5. После этого медленно добавляют NaCNBH3 (226 мг; 3,6 ммоль). Наблюдается выделение газа. После 24 часов перемешивания на магнитной мешалке добавляют дихлорметан, 2М NaOH и воду до достижения рН~10. Фазы разделяют и водную фазу повторно экстрагируют дихлорметаном. Объединенные органические фазы сушат над MgSO4 и концентрируют на роторном испарителе (40°С) с получением 419 мг неочищенного 47AKU-16. ТСХ (10% метанол в дихлорметане): Rf=0,3. Анализ методом ВЭЖХ-МС (метод А): М+=259,1 (УФ/МС(%)=44/87).
2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-циклобутилпиперидин-4-ил)ацетамид (47AKU-19)
47AKU-16 (209 мг; 0,8 ммоль) помещают в колбу на 50 мл и добавляют 5 мл дихлорметана. Затем добавляют 4-хлорфенилацетилхлорид (171 мг; 0,9 ммоль) в 5 мл дихлорметана. После 5 часов перемешивания на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 101 мг (31%) продукта. Дальнейшая очистка ионообменной хроматографией (промывка 10% водным NH4OH (25%) в метаноле) дает 55 мг (17%) 47AKU-19. Оксалатную соль получают из раствора щавелевой кислоты (1,1 эквивалента) в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,6. Анализ методом ВЭЖХ-МС (метод В): М+=411,2 (УФ/МС(%)=91/86). 1H-ЯМР (400 МГц, СDСl3, ротамеры):  = 7,33-7,01 (8H, м); 4,62 (1H, м); 4,52 и 4,46 (2H, 2с); 3,80 (1H, с); 3,45 и 3,54 (2H, 2с); 2,86 (2H, м); 2,66 (2H, м); 2,28 и 2,34 (3H, 2с); 1,98 (2H, м); 1,80 (2H, м); 1,70-1,52 (6H,м). 13C-ЯМР (СDСl3): = 7,33-7,01 (8H, м); 4,62 (1H, м); 4,52 и 4,46 (2H, 2с); 3,80 (1H, с); 3,45 и 3,54 (2H, 2с); 2,86 (2H, м); 2,66 (2H, м); 2,28 и 2,34 (3H, 2с); 1,98 (2H, м); 1,80 (2H, м); 1,70-1,52 (6H,м). 13C-ЯМР (СDСl3):  = 171,7, 137,2, 135,4, 133,9, 132,9, 130,4, 129,7, 128,9, 125,7, 60,4, 52,3, 49,4, 46,5, 40,7, 29,4, 27,6, 21,2, 14,2. = 171,7, 137,2, 135,4, 133,9, 132,9, 130,4, 129,7, 128,9, 125,7, 60,4, 52,3, 49,4, 46,5, 40,7, 29,4, 27,6, 21,2, 14,2.
Пример 108: 2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-циклобутилпиперидин-4-ил)ацетамид (47AKU-20)
47AKU-16 (209 мг; 0,8 ммоль) помещают в колбу на 50 мл и добавляют 5 мл дихлорметана. Затем добавляют 4-метоксифенилацетилхлорид (167 мг; 0,9 ммоль) в 5 мл дихлорметана. После перемешивания в течение 5 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 72 мг (22%) продукта. Дальнейшая очистка ионообменной хроматографией (промывка 10% водным NH4OH (25%) в метаноле) дает 67 мг (20%) 47AKU-20. Оксалатную соль получают из раствора щавелевой кислоты (1,1 эквивалента) в дихлорметане/гептане. ТСХ (10% метанола в дихлорметане): Rf=0,6. Анализ методом ВЭЖХ-МС (метод В): М+=407,3 (УФ/МС(%)=93/77). 1H-ЯМР (400 МГц, СDСl3, ротамеры):  = 7,26-6,79 (8H, м); 4,62 (1H, м); 4,52 и 4,45 (2H, 2с); 3,79 (1H, м); 3,77 (3H, с); 3,52 и 3,45 (2H, 2с); 2,84 (2H, м); 2,66 (2H, м); 2,34 и 2,28 (3H, 2с); 1,98 (2H, м); 1,81 (2H, м); 1,72-1,51 (6H,м). 13C-ЯМР (СDСl3): = 7,26-6,79 (8H, м); 4,62 (1H, м); 4,52 и 4,45 (2H, 2с); 3,79 (1H, м); 3,77 (3H, с); 3,52 и 3,45 (2H, 2с); 2,84 (2H, м); 2,66 (2H, м); 2,34 и 2,28 (3H, 2с); 1,98 (2H, м); 1,81 (2H, м); 1,72-1,51 (6H,м). 13C-ЯМР (СDСl3):  = 172,5, 158,7, 137,0, 135,7, 130,4, 129,8, 127,4, 125,8, 114,3, 60,4, 55,5, 52,1, 49,4, 46,4, 40,6, 29,4, 27,6, 21,2, 14,2. = 172,5, 158,7, 137,0, 135,7, 130,4, 129,8, 127,4, 125,8, 114,3, 60,4, 55,5, 52,1, 49,4, 46,4, 40,6, 29,4, 27,6, 21,2, 14,2.
Пример 109: 2-(4-метоксифенил)-N-(4-метилбензил)-N-(8-метил-8-азабицикло[3.2.1]окт-3-ил)-ацетамид (47AKU-21)
4-(4-метилбензиламино)тропан (47AKU-17)
4-метилбензиламин (607 мг; 5,0 ммоль) растворяют в 10 мл метанола и помещают в колбу на 100 мл. Добавляют раствор тропинона (697 мг; 5,0 ммоль) в 10 мл метанола. Затем добавляют уксусную кислоту (0,75 мл) до получения рН~5. После этого медленно добавляют NaCNBH3 (628 мг; 10 ммоль). Наблюдается выделение газа. После 20 часов перемешивания на магнитной мешалке добавляют дихлорметан, 2М NaOH и воду до достижения рН~10. Фазы разделяют и водную фазу повторно экстрагируют дихлорметаном. Объединенные органические фазы сушат над MgSO4. Концентрирование на роторном испарителе (40°С) дает 1,14 г неочищенного 47AKU-17. ТСХ (10% метанол в дихлорметане): Rf=0,4. Анализ методом ВЭЖХ-МС (метод А): М+=245,2 (УФ/МС(%)=65/96).
2-(4-метоксифенил)-N-(4-метилбензил)-N-(тропин-4-ил)ацетамид (47AKU-21)
47AKU-17 (244 мг; 1,0 ммоль) помещают в колбу на 50 мл и добавляют 5 мл дихлорметана. Затем добавляют 4-метоксифенилацетилхлорид (203 мг; 1,1 ммоль) в 10 мл дихлорметана. После перемешивания в течение 3 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают ионообменной хроматографией (промывка 10% водным NH4OH (25%) в метаноле) и флэш-хроматографией (0-10% метанол в дихлорметане) с получением 202 мг (51%) 47AKU-21. Оксалатную соль получают из раствора щавелевой кислоты (1,1 эквивалента) в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,4. Анализ методом ВЭЖХ-МС (метод В): М+=393,3 (УФ/МС(%)=94/92). 1H-ЯМР (400 МГц, СDСl3, изомеры):  = 7,02-7,17 (6H, м); 6,78-6,87 (2H, м); 4,74 (1H, с); 4,44 (1H, с); 3,78 и 3,77 (3H, 2с); 3,68 (1H, м); 3,66 и 3,55 (3H, 2с); 2,65 (2H, м); 2,56 (2H, м); 2,32 (3H, с); 2,12-2,26 (6H, м); 2,05 (2H, м). 13C-ЯМР (СDСl3): = 7,02-7,17 (6H, м); 6,78-6,87 (2H, м); 4,74 (1H, с); 4,44 (1H, с); 3,78 и 3,77 (3H, 2с); 3,68 (1H, м); 3,66 и 3,55 (3H, 2с); 2,65 (2H, м); 2,56 (2H, м); 2,32 (3H, с); 2,12-2,26 (6H, м); 2,05 (2H, м). 13C-ЯМР (СDСl3):  = 173,2, 171,4, 158,8, 137,1, 129,7, 127,6, 126,9, 126,0, 114,4, 63,4, 60,9, 55,5, 54,6, 47,5, 41,5, 40,4, 32,8, 31,1, 27,5, 24,9, 21,2. = 173,2, 171,4, 158,8, 137,1, 129,7, 127,6, 126,9, 126,0, 114,4, 63,4, 60,9, 55,5, 54,6, 47,5, 41,5, 40,4, 32,8, 31,1, 27,5, 24,9, 21,2.
Пример 110: N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)-N’-бензилкарбамид (47AKU-22)
47AKU-5 (219 мг; 1,0 ммоль) растворяют в 5 мл дихлорметана и помещают в колбу на 50 мл. Затем добавляют бензилизоцианат (160 мг; 1,2 ммоль) в 5 мл дихлорметана. После перемешивания в течение 16 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 236 мг (67%) 47AKU-22. Оксалатную соль получают из раствора щавелевой кислоты (1,1 эквивалента) в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,5. Анализ методом ВЭЖХ-МС (метод В): М+=352,3 (УФ/МС(%)=100/100). 1H-ЯМР (400 МГц, СDСl3):  = 7,26-7,02 (9H, т); 4,61 (1H, м); 4,41 (1H, м); 4,33 (4Н, м); 2,87 (2H, м); 2,32 (3H, с); 2,25 (3H, с); 2,09 (2H, м); 1,79-1,62 (4Н, м). 13C-ЯМР (СDСl3): = 7,26-7,02 (9H, т); 4,61 (1H, м); 4,41 (1H, м); 4,33 (4Н, м); 2,87 (2H, м); 2,32 (3H, с); 2,25 (3H, с); 2,09 (2H, м); 1,79-1,62 (4Н, м). 13C-ЯМР (СDСl3):  = 158,6, 139,7, 137,3, 135,4, 129,8, 128,6, 127,4, 127,2, 126,2, 55,5, 52,2, 46,2, 45,8, 45,0, 30,2, 21,2. = 158,6, 139,7, 137,3, 135,4, 129,8, 128,6, 127,4, 127,2, 126,2, 55,5, 52,2, 46,2, 45,8, 45,0, 30,2, 21,2.
Пример 111: N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)-N’-фенилкарбамид (47AKU-24)
47AKU-5 (219 мг; 1,0 ммоль) растворяют в 5 мл дихлорметана и помещают в колбу на 50 мл. Затем добавляют фенилизоцианат (143 мг; 1,2 ммоль) в 5 мл дихлорметана. После перемешивания в течение 4 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 181 мг (54%) 47AKU-24. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,4. Анализ методом ВЭЖХ-МС (метод А): М+=338,3 (УФ/МС(%)=100/100). 1H-ЯМР (400 МГц, СDСl3):  = 7,12-7,24 (8H, м); 6,93-6,98 (1H, м); 6,26 (1H, с); 4,45 (3H, с); 2,90 (2H, д); 2,36 (3H, с); 2,28 (3H, с); 2,12 (2H,м); 1,69-1,85 (4H,м). 13C-ЯМР (СDСl3): = 7,12-7,24 (8H, м); 6,93-6,98 (1H, м); 6,26 (1H, с); 4,45 (3H, с); 2,90 (2H, д); 2,36 (3H, с); 2,28 (3H, с); 2,12 (2H,м); 1,69-1,85 (4H,м). 13C-ЯМР (СDСl3):  = 156,1, 139,3, 137,8, 134,9, 130,1, 128,9, 126,3, 123,1, 119,9, 55,5, 52,3, 46,3, 46,2, 30,3, 21,3. = 156,1, 139,3, 137,8, 134,9, 130,1, 128,9, 126,3, 123,1, 119,9, 55,5, 52,3, 46,3, 46,2, 30,3, 21,3.
Пример 112: N-фенэтил-N-(1-метилпиперидин-4-ил)-N’-бензилкарбамид (47AKU-25)
4-(2-фенилэтил)амино-1-метилпиперидин (110 мг; 0,5 ммоль) растворяют в 5 мл дихлорметана и помещают в колбу на 50 мл. Затем добавляют бензилизоцианат (80 мг; 0,6 ммоль) в 5 мл дихлорметана. После перемешивания в течение 20 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 164 мг (84%) 47AKU-25. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,4. Анализ методом ВЭЖХ-МС (метод А): М+=352,3 (УФ/МС(%)=100/100). 1H-ЯМР (400 МГц, СDСl3):  = 7,34-7,09 (10Н, м); 4,52 (1H, м); 4,35 (2H, д); 4,08 (1H, м); 3,33 (2H, т); 2,92 (2H, м); 2,82 (2H, т); 2,28 (3H, с); 2,07 (2H, м); 1,84-1,66 (4H, м). 13C-ЯМР (СDСl3): = 7,34-7,09 (10Н, м); 4,52 (1H, м); 4,35 (2H, д); 4,08 (1H, м); 3,33 (2H, т); 2,92 (2H, м); 2,82 (2H, т); 2,28 (3H, с); 2,07 (2H, м); 1,84-1,66 (4H, м). 13C-ЯМР (СDСl3):  = 157,9, 139,8, 139,1, 129,0, 128,9, 128,8, 127,8, 127,4, 126,9, 55,7, 52,8, 46,2, 45,3, 44,8, 37,5, 30,6. = 157,9, 139,8, 139,1, 129,0, 128,9, 128,8, 127,8, 127,4, 126,9, 55,7, 52,8, 46,2, 45,3, 44,8, 37,5, 30,6.
Пример 113: 2-фенил–N-(4-метоксибензил)-N-(1-метилпиперидин-4-ил)-ацетамид (47AKU-26а)
50ELH-18 (118 мг; 0,5 ммоль) растворяют в 5 мл дихлорметана в колбе на 50 мл.
Добавляют 4-фторфенилацетилхлорид (104 мг; 0,6 ммоль). После перемешивания в течение 20 часов при комнатной температуре реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 87 мг (49%) 47AKU-26а. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. Анализ методом ВЭЖХ-МС (метод А): М+=353,1 (УФ/МС(%)=96/88).
Пример 114: 2-(4-трифторметилфенил)–N-(4-метоксибензил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-26b)
50ELH-18 (118 мг; 0,5 ммоль) растворяют в 5 мл дихлорметана в колбе на 50 мл.
Добавляют 4-трифторметилфенилацетилхлорид (134 мг; 0,6 ммоль). После перемешивания в течение 20 часов при комнатной температуре реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 81 мг (39%) 47AKU-26b. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. Анализ методом ВЭЖХ-МС (метод А): М+=421,1 (УФ/МС(%)=90/100).
Пример 115: 2-(4-фторфенил)–N-(4-метоксибензил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-26с)
50ELH-18 (118 мг; 0,5 ммоль) растворяют в 5 мл дихлорметана в колбе на 50 мл.
Добавляют 4-фторфенилацетилхлорид (104 мг; 0,6 ммоль). После перемешивания в течение 20 часов при комнатной температуре реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 68 мг (37%) 47AKU-26с. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. Анализ методом ВЭЖХ-МС (метод А): М+=371,1 (УФ/МС(%)=100/97).
Пример 116: 2-(4-метоксифенил)–N-(4-метоксибензил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-26d)
50ELH-18 (118 мг; 0,5 ммоль) растворяют в 5 мл дихлорметана в колбе на 50 мл.
Добавляют 4-метоксифенилацетилхлорид (111 мг; 0,6 ммоль). После перемешивания в течение 20 часов при комнатной температуре реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 77 мг (40%) 47AKU-26d. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. Анализ методом ВЭЖХ-МС (метод А): М+=383,1 (УФ/МС(%)=100/100).
Пример 117: 2-(4-метилфенил)-N-(4-хлорбензил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-28)
4-(4-хлорбензиламино)-1-метилпиперидин (47AKU-27)
1-метил-4-пиперидон (566 мг; 5,0 ммоль) растворяют в 10 мл метанола и помещают в колбу на 100 мл. Добавляют раствор 4-хлорбензиламин (708 мг; 5,0 ммоль). Смесь перемешивают и добавляют уксусную кислоту (~0,75 мл) до получения рН~5. После этого медленно добавляют NaCNBH3 (628 мг; 10 ммоль). Наблюдается выделение газа. После перемешивания на магнитной мешалке в течение 16 часов метанол частично удаляют на роторном испарителе (40°С). Добавляют дихлорметан, 2М NaOH и воду до достижения рН~10. Фазы разделяют и водную фазу повторно экстрагируют дихлорметаном. Объединенные органические фазы сушат над MgSO4. Концентрирование на роторном испарителе (40°С) дает 1,14 г неочищенного 47AKU-27. ТСХ (10% метанол в дихлорметане): Rf=0,3. Анализ методом ВЭЖХ-МС (метод А): М+=239,1 (МС(%)=96).
2-(4-метилфенил)-N-(4-хлорбензил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-28)
п-Толилуксусную кислоту (1,5 г) растворяют в 10 мл тионилхлорида и помещают в колбу на 50 мл. Смесь нагревают до температуры кипения с обратным холодильником в течение 2 часов и затем концентрируют на роторном испарителе (40°С).
К 41AKU-27 (239 мг; 1,0 ммоль) в 5 мл дихлорметана добавляют хлорангидрид п-толилуксусной кислоты (202 мг; 1,2 ммоль) в 5 мл дихлорметана. После перемешивания в течение 4 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 104 мг (28%) 47AKU-28. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,5. Анализ методом ВЭЖХ-МС (метод А): М+=371,1 (УФ/МС(%)=100/90). 1H-ЯМР (400 МГц, СDСl3, ротамеры):  = 7,34-6,99 (8Н, м); 4,57 (1H, м); 4,50 и 4,44 (2H, 2с); 3,80 (1H, с); 3,55 (2H, с); 2,96 и 2,82 (2H, 2м); 2,32 (3H, с); 2,24 и 2,15 (3H, 2с); 1,91 (1H, м); 1,81-1,59 (4H, м). 13C-ЯМР (СDСl3): = 7,34-6,99 (8Н, м); 4,57 (1H, м); 4,50 и 4,44 (2H, 2с); 3,80 (1H, с); 3,55 (2H, с); 2,96 и 2,82 (2H, 2м); 2,32 (3H, с); 2,24 и 2,15 (3H, 2с); 1,91 (1H, м); 1,81-1,59 (4H, м). 13C-ЯМР (СDСl3):  = 172,5, 13828, 136,8, 133,4, 131,8, 129,7, 129,2, 128,6, 127,4, 54,9, 51,3, 46,7, 41,3, 30,6, 28,6, 21,2. = 172,5, 13828, 136,8, 133,4, 131,8, 129,7, 129,2, 128,6, 127,4, 54,9, 51,3, 46,7, 41,3, 30,6, 28,6, 21,2.
Пример 118: 2-(4-гидроксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-29)
42ELH-77 (41 мг; 1,0 ммоль) растворяют в 1 мл сухого дихлорметана и помещают в высушенную в сушильной печи колбу на 10 мл. Смесь охлаждают до -78°С в бане со смесью сухой лед/изопропанол. Затем при -78°С медленно прибавляют трибромид бора (1,0 М в дихлорметане; 150 мкл; 0,15 ммоль). Ледяную баню удаляют и смесь оставляют при комнатной температуре на 2 часа. Добавляют воду (3 мл) и насыщенный NaCl (водный) и водную фазу экстрагируют дихлорметаном, этилацетатом и н-бутанолом. Объединенные органические фазы сушат над MgSO4 и концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-20% метанола в дихлорметане) с получением 22 мг (63%) 47AKU-29. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,3. Анализ методом ВЭЖХ-МС (метод А): М+=353,2 (УФ/МС(%)=100/100). 1Н-ЯМР (400 МГц, СDСl3, ротамеры):  = 7,07-6,60 (8H, м); 4,48 (1H, м); 4,39 (2H, с); 3,76 и 3,66 (4H, 2ушс); 3,41 (2H, с); 3,08 (2H, м); 2,49 (1H, м); 2,42 (2H, ушс); 2,22 и 2,16 (3H, 2с); 1,96-1,82 (2H, м); 1,66-1,56 (1H, м). 13C-ЯМР (СDСl3): = 7,07-6,60 (8H, м); 4,48 (1H, м); 4,39 (2H, с); 3,76 и 3,66 (4H, 2ушс); 3,41 (2H, с); 3,08 (2H, м); 2,49 (1H, м); 2,42 (2H, ушс); 2,22 и 2,16 (3H, 2с); 1,96-1,82 (2H, м); 1,66-1,56 (1H, м). 13C-ЯМР (СDСl3):  = 173,7, 156,0, 137,3, 134,6, 129,7, 129,6, 125,7, 125,4, 115,7, 54,4, 50,4, 46,8, 44,0, 40,5, 27,3, 20,9. = 173,7, 156,0, 137,3, 134,6, 129,7, 129,6, 125,7, 125,4, 115,7, 54,4, 50,4, 46,8, 44,0, 40,5, 27,3, 20,9.
Пример 119: N-фенилэтил-N-(1-метилпиперидин-4-ил)-N’-фенилкарбамид (47AKU-30)
4-(2-фенилэтил)амино-1-метилпиперидин (110 мг; 0,5 ммоль) растворяют в 5 мл дихлорметана и помещают в колбу на 50 мл. Добавляют фенилизоцианат (71 мг; 0,6 ммоль) в 5 мл дихлорметана. После перемешивания в течение 16 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают дважды флэш-хроматографией (0-10% метанол в дихлорметане) с получением 131 мг (78%) 47AKU-30. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,4 Анализ методом ВЭЖХ-МС (метод А): М+=338,1 (УФ/МС(%)=99/100). 1Н-ЯМР (400 МГц, СDСl3):  = 7,36-6,93 (10Н, м); 6,24 (1H, с); 4,31 (1H, м); 3,50 (2H, т); 3,20 (2H, д); 2,89 (2H, т); 2,57 (2H, м); 2,50 (3H, с); 2,26 (2H, м); 1,79 (2H, м). 13C-ЯМР (СDСl3): = 7,36-6,93 (10Н, м); 6,24 (1H, с); 4,31 (1H, м); 3,50 (2H, т); 3,20 (2H, д); 2,89 (2H, т); 2,57 (2H, м); 2,50 (3H, с); 2,26 (2H, м); 1,79 (2H, м). 13C-ЯМР (СDСl3):  = 155,8, 139,2, 139,0, 129,4, 129,3, 128,9, 127,3, 123,2, 120,4, 54,9, 51,3, 45,5, 44,3, 37,6, 28,3. = 155,8, 139,2, 139,0, 129,4, 129,3, 128,9, 127,3, 123,2, 120,4, 54,9, 51,3, 45,5, 44,3, 37,6, 28,3.
Пример 120: N-(3-фенилпропил)-N-(1-метилпиперидин-4-ил)-N’-бензилкарбамид (47AKU-31)
4-(3-фенилпропил)амино-1-метилпиперидин (160 мг; 0,7 ммоль) растворяют в 5 мл дихлорметана и помещают в колбу на 50 мл. Добавляют бензилизоцианат (107 мг; 0,8 ммоль) в 5 мл дихлорметана. После перемешивания в течение 2 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают дважды флэш-хроматографией (0-10% метанол в дихлорметане) с получением 156 мг (61%) 47AKU-31. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,3 Анализ методом ВЭЖХ-МС (метод А): М+=366,1 (УФ/МС(%)=100/100). 1Н-ЯМР (400 МГц, СDСl3):  = 7,34-7,07 (10Н, м); 4,33 (3H, м); 4,14 (1H, м); 3,04 (2H, м); 2,89 (2H, д); 2,57 (2H, т); 2,28 (3H, с); 2,06 (2H, м); 1,87 (2H, м); 1,75-1,62 (4Н, м). 13C-ЯМР (СDСl3): = 7,34-7,07 (10Н, м); 4,33 (3H, м); 4,14 (1H, м); 3,04 (2H, м); 2,89 (2H, д); 2,57 (2H, т); 2,28 (3H, с); 2,06 (2H, м); 1,87 (2H, м); 1,75-1,62 (4Н, м). 13C-ЯМР (СDСl3):  = 157,5, 141,0, 140,0, 129,0, 128,6, 128,3, 128,0, 127,6, 126,6, 55,6, 52,1, 46,3, 45,1, 41,6, 33,4, 32,2, 30,6. = 157,5, 141,0, 140,0, 129,0, 128,6, 128,3, 128,0, 127,6, 126,6, 55,6, 52,1, 46,3, 45,1, 41,6, 33,4, 32,2, 30,6.
Пример 121: N-(3-фенилпропил)-N-(1-метилпиперидин-4-ил)-N’-фенилкарбамид (47AKU-32)
4-(3-фенилпропил)амино-1-метилпиперидин (160 мг; 0,7 ммоль) растворяют в 5 мл дихлорметана и помещают в колбу на 50 мл. Добавляют фенилизоцианат (95 мг; 0,8 ммоль) в 5 мл дихлорметана. После перемешивания в течение 20 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 106 мг (43%) 47AKU-32. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,3 Анализ методом ВЭЖХ-МС (метод А): М+=352,1 (УФ/МС(%)=100/100). 1H-ЯМР (400 МГц, СDСl3):  = 7,35-6,95 (10Н, м); 5,99 (1H, с); 4,18 (1H, м); 3,17 (2H, т); 2,91 (2H, д); 2,65 (2H, т); 2,28 (3H, с); 2,07 (2H, м); 1,97 (2H, м); 1,81-1,66 (4H, м). 13C-ЯМР (СDСl3): = 7,35-6,95 (10Н, м); 5,99 (1H, с); 4,18 (1H, м); 3,17 (2H, т); 2,91 (2H, д); 2,65 (2H, т); 2,28 (3H, с); 2,07 (2H, м); 1,97 (2H, м); 1,81-1,66 (4H, м). 13C-ЯМР (СDСl3):  = 154,9, 141,0, 139,3, 129,2, 129,0, 129,0, 126,8, 123,1, 120,0, 55,6, 52,2, 46,2, 41,8, 33,4, 32,3, 30,6. = 154,9, 141,0, 139,3, 129,2, 129,0, 129,0, 126,8, 123,1, 120,0, 55,6, 52,2, 46,2, 41,8, 33,4, 32,3, 30,6.
Пример 122: 2-(4-метоксифенил)-2,2-этилен-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-33)
1-(4-метоксифенил)-1-циклопропанкарбоновую кислоту (230 мг; 1,2 ммоль) растворяют в 2 мл тионилхлорида и помещают в колбу на 50 мл. Смесь нагревают до температуры кипения с обратным холодильником в течение 2 часов и затем концентрируют на роторном испарителе (40°С). Хлорангидрид кислоты (250 мг; 1,2 ммоль) в 5 мл дихлорметана добавляют к 47AKU-5 (220 мг; 1,0 ммоль) в 5 мл дихлорметана. После перемешивания в течение 2 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают дважды флэш-хроматографией (0-10% метанол в дихлорметане) с получением 201 мг (51%) 47AKU-33. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,6 Анализ методом ВЭЖХ-МС (метод А): М+=393,2 (УФ/МС(%)=95/88). 1H-ЯМР (400 МГц, СDСl3, ротамеры):  = 7,22-6,70 (8H, м); 4,44 (2H, с); 4,26 (1H, м); 3,74 (3H, с); 3,12 и 2,89 (2H, 2м); 2,51 (1H, м); 2,32 (3H, м); 2,26 (3H, с); 2,08-1,52 (4H, м); 1,36 (2H, ушс); 1,15-0,95 (3H, м). 13C-ЯМР (СDСl3): = 7,22-6,70 (8H, м); 4,44 (2H, с); 4,26 (1H, м); 3,74 (3H, с); 3,12 и 2,89 (2H, 2м); 2,51 (1H, м); 2,32 (3H, м); 2,26 (3H, с); 2,08-1,52 (4H, м); 1,36 (2H, ушс); 1,15-0,95 (3H, м). 13C-ЯМР (СDСl3):  = 172,9, 158,6, 136,6, 132,7, 129,2, 128,6, 127,9, 127,4, 114,4, 55,5, 55,1, 54,4, 45,2, 45,0, 29,8, 29,2, 21,2, 13,8. = 172,9, 158,6, 136,6, 132,7, 129,2, 128,6, 127,9, 127,4, 114,4, 55,5, 55,1, 54,4, 45,2, 45,0, 29,8, 29,2, 21,2, 13,8.
Пример 123: 2-(4-метоксифенил)–N-(1-фенилэтил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-37)
4-альфа-метилбензиламино-1-метилпиперидин (47AKU-36)
DL-фенилэтиламин (606 мг; 5,0 ммоль) растворяют в 10 мл метанола и добавляют 1-метил-4-пиперидон (566 мг; 5,0 ммоль) в 10 мл метанола. Смесь перемешивают и добавляют уксусную кислоту (~0,75 мл) до получения рН~5. Затем медленно добавляют NaCNBH3 (628 г; 10 ммоль). Наблюдается выделение газа. После перемешивания на магнитной мешалке в течение 20 часов метанол частично удаляют на роторном испарителе (40°С). Добавляют этилацетат, 2М NaOH и воду до достижения рН~10. Фазы разделяют и водную фазу повторно экстрагируют этилацетатом и дихлорметаном. Объединенные органические фазы сушат над MgSO4. Концентрирование на роторном испарителе (40°С) дает 838 мг неочищенного 47AKU-36. ТСХ (10% метанол в дихлорметане): Rf=0,3. Анализ методом ВЭЖХ-МС (метод А): М+=219,1 (УФ/МС(%)=100/94).
2-(4-метоксифенил)-N–альфа-метилбензил-N-(1-метилпиперидин-4-ил)-ацетамид (47AKU-37)
47AKU-36 (218 мг; 1,0 ммоль) растворяют в 10 мл дихлорметана и помещают в колбу на 50 мл. Добавляют 4-метоксифенилацетилхлорид (185 мг; 1,2 ммоль) в 10 мл дихлорметана. После перемешивания в течение 16 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 256 мг (70%) 47AKU-37. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанола в дихлорметане): Rf=0,5. Анализ методом ВЭЖХ-МС (метод А): М+=367,3 (УФ/МС(%)=100/99). 1Н-ЯМР (400 МГц, СDСl3, ротамеры):  = 7,34-7,06 (7H, м); 6,84 (2H, д); 5,10 (1H, м); 3,77 (3H, с); 3,67 (2H, м); 3,17 (1H, м); 3,03-2,75 (3H, м); 2,64 (3H, с); 2,38 (2H, м); 1,77-1,05 (6H, м). 13C-ЯМР (СDСl3): = 7,34-7,06 (7H, м); 6,84 (2H, д); 5,10 (1H, м); 3,77 (3H, с); 3,67 (2H, м); 3,17 (1H, м); 3,03-2,75 (3H, м); 2,64 (3H, с); 2,38 (2H, м); 1,77-1,05 (6H, м). 13C-ЯМР (СDСl3):  = 172,0, 158,9, 139,9, 130,0, 129,0, 128,2, 127,1, 114,5, 55,5, 53,1, 51,4, 42,4, 41,3, 31,1, 29,5, 24,9, 18,1. = 172,0, 158,9, 139,9, 130,0, 129,0, 128,2, 127,1, 114,5, 55,5, 53,1, 51,4, 42,4, 41,3, 31,1, 29,5, 24,9, 18,1.
Пример 124: 2-(4-метоксифенил)-N-(4-метилбензил)-N-(8-метил-8-азабицикло[3.2.1]октен-3-ил)-ацетамид (47AKU-39)
4-метилбензилиминотропан (47AKU-38)
4-метилбензиламин (1,21 г; 10 ммоль) и тропинон (1,39 г; 10 ммоль) помещают в колбу на 100 мл и растворяют в 50 мл толуола. Смесь нагревают до температуры кипения с обратным холодильником в течение 3 часов и удаляют воду с использованием сепаратора воды Дина/Старка. Сырой продукт концентрируют на роторном испарителе (40°С) с получением 47AKU-38. ТСХ (10% метанол в дихлорметане): Rf=0,3. 1Н-ЯМР (400 МГц, СDСl3, изомеры): 7,20-7,09 (4H, м); 4,47 (1Н, м); 3,81 (1H, с); 3,42 (1H, м); 3,31 (1H, м); 2,77- 2,56 (2H, м); 2,47 и 2,41 (3H, 2с); 2,33 и 2,31 (3H, 2с); 2,27-1,97 (4H, м); 1,69-1,54 (2H, м).
2-(4-метоксифенил)-N-(4-метилбензил)-N-(3-тропен-4-ил)ацетамид (47AKU-39)
47AKU-38 (242 мг; 1,0 ммоль) растворяют в 5 мл дихлорметана и помещают в колбу на 50 мл. Добавляют 4-метоксифенилацетилхлорид (185 мг; 1,2 ммоль) в 10 мл дихлорметана. После перемешивания в течение 16 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 69 мг (18%) 47AKU-39. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,4. Анализ методом ВЭЖХ-МС (метод А): М+=391,2 (УФ/МС(%)=91/86). 1H-ЯМР (400 МГц, СDСl3, ротамеры):  = 7,22-6,82 (8H, м); 5,41 (1H, ушс); 4,71-4,52 (2H, м); 3,78 (3H, с); 3,68 (2H, м); 3,44-3,24 (2H, м); 2,72-2,36 (5H, м); 2,32 (3H, с); 2,25-2,00 (2H, м); 1,80-1,54 (2H, м). 13C-ЯМР (СDСl3): = 7,22-6,82 (8H, м); 5,41 (1H, ушс); 4,71-4,52 (2H, м); 3,78 (3H, с); 3,68 (2H, м); 3,44-3,24 (2H, м); 2,72-2,36 (5H, м); 2,32 (3H, с); 2,25-2,00 (2H, м); 1,80-1,54 (2H, м). 13C-ЯМР (СDСl3):  = 170,8, 158,7, 137,4, 134,9, 130,1, 129,3, 128,9, 126,9, 114,2, 59,0, 58,0, 55,5, 49,5, 46,3, 39,7, 35,9, 33,8, 29,7, 21,3. = 170,8, 158,7, 137,4, 134,9, 130,1, 129,3, 128,9, 126,9, 114,2, 59,0, 58,0, 55,5, 49,5, 46,3, 39,7, 35,9, 33,8, 29,7, 21,3.
Пример 125: 2-фенил-2-этил-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-40)
2-фенилмасляную кислоту (197 мг; 1,2 ммоль) растворяют в 2 мл тионилхлорида и помещают в колбу на 50 мл. Смесь нагревают до температуры кипения с обратным холодильником в течение 2 часов и затем концентрируют на роторном испарителе (50°С). Хлорангидрид кислоты (1,2 ммоль) в 5 мл дихлорметана добавляют к 47AKU-5 (158 мг; 0,72 ммоль) в 5 мл дихлорметана. После перемешивания в течение 20 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 196 мг (74%) 47AKU-40. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,5. Анализ методом ВЭЖХ-МС (метод А): М+=365,4 (УФ/МС(%)=99/100). 1H-ЯМР (400 МГц, СDСl3), ротамеры):  = 7,32-6,98 (8H, м); 4,77 (1H, ушс); 4,50 (1H, д); 4,29 (1H, д); 3,43 и 3,21 (3H, 2м); 2,72 (2H, м); 2,62 (3H, с); 2,43 (1H, м); 2,32 (3H, с); 2,21 (3H, м); 2,04 (2H, м); 1,67 (3H, м); 0,92-0,72 (3H, м). 13C-ЯМР (СDСl3): = 7,32-6,98 (8H, м); 4,77 (1H, ушс); 4,50 (1H, д); 4,29 (1H, д); 3,43 и 3,21 (3H, 2м); 2,72 (2H, м); 2,62 (3H, с); 2,43 (1H, м); 2,32 (3H, с); 2,21 (3H, м); 2,04 (2H, м); 1,67 (3H, м); 0,92-0,72 (3H, м). 13C-ЯМР (СDСl3):  = 174,7, 139,9, 137,3, 135,2, 129,7, 129,0, 127,8, 127,3, 125,8, 54,5, 51,6, 49,4, 46,0, 43,8, 28,9, 26,7, 26,3, 21,2, 12,7. = 174,7, 139,9, 137,3, 135,2, 129,7, 129,0, 127,8, 127,3, 125,8, 54,5, 51,6, 49,4, 46,0, 43,8, 28,9, 26,7, 26,3, 21,2, 12,7.
Пример 126: 2-(4-метоксифенил)–N-(1-инданил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-43)
4-(1-инданамино)-1-метилпиперидин (47AKU-42)
1-аминоиндан (666 мг; 5,0 ммоль) растворяют в 10 мл метанола и помещают в колбу на 100 мл. Добавляют 1-метил-4-пиперидон (566 мг; 5,0 ммоль) в 10 мл метанола. Смесь перемешивают и добавляют уксусную кислоту (~0,75 мл) до получения рН~5. Затем медленно добавляют NaCNBH3 (628 мг; 10 ммоль). Наблюдается выделение газа. После перемешивания на магнитной мешалке в течение 16 часов метанол частично удаляют на роторном испарителе (40°С). Добавляют дихлорметан, 2М NaOH и воду до достижения рН~10. Фазы разделяют и водную фазу повторно экстрагируют этилацетатом и дихлорметаном. Объединенные органические фазы сушат над MgSO4. Концентрирование на роторном испарителе (40°С) дает 1,06 г 47AKU-42. ТСХ (10% метанол в дихлорметане): Rf=0,3. Анализ методом ВЭЖХ-МС (метод А): М+=231,1 (УФ/МС(%)=72/91).
2-(4-метоксифенил)-N-(1-инданил)-N-(1-метилпиперидин-4-ил)-ацетамид (47AKU-43)
47AKU-42 (230 мг; 1,0 ммоль) растворяют в 10 мл дихлорметана и помещают в колбу на 50 мл. Добавляют 4-метоксифенилацетилхлорид (185 мг; 1,2 ммоль) в 10 мл дихлорметана. После перемешивания в течение 16 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 194 мг (51%) 47AKU-43. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,5. Анализ методом ВЭЖХ-МС (метод А): М+=379,2 (УФ/МС(%)=94/90).
Пример 127: N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)-N’-(метоксибензил)карбамид (47AKU-44)
47AKU-5 (219 мг; 1,0 ммоль) растворяют в 5 мл дихлорметана и помещают в колбу на 50 мл. Добавляют 4-метоксибензилизоцианат (196 мг; 1,2 ммоль) в 10 мл дихлорметана. После перемешивания в течение 16 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 192 мг (50%) 47AKU-44. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,3 Анализ методом ВЭЖХ-МС (метод А): М+=382,3 (УФ/МС(%)=100/94). 1Н-ЯМР (400 МГц, CDCl3):  = 7,10 (4Н, м); 6,98 (2Н, м); 6,76 (2Н, м); 4,58 (1Н, т); 4,45 (1Н, м); 4,33 (2Н, с); 4,25 (2H, д); 3,76 (3Н, с); 2,97 (2H, м); 2,34 (3Н, с); 2,32 (3Н, с); 2,24 (2H, м); 1,78 (4H, м). 13C-ЯМР (СDСl3): = 7,10 (4Н, м); 6,98 (2Н, м); 6,76 (2Н, м); 4,58 (1Н, т); 4,45 (1Н, м); 4,33 (2Н, с); 4,25 (2H, д); 3,76 (3Н, с); 2,97 (2H, м); 2,34 (3Н, с); 2,32 (3Н, с); 2,24 (2H, м); 1,78 (4H, м). 13C-ЯМР (СDСl3):  = 158,9, 158,5, 137,3, 135,2, 131,8, 129,8, 128,8, 126,2, 114,1, 55,5, 55,4, 51,7, 45,8, 45,7, 44,5, 29,7, 21,2. = 158,9, 158,5, 137,3, 135,2, 131,8, 129,8, 128,8, 126,2, 114,1, 55,5, 55,4, 51,7, 45,8, 45,7, 44,5, 29,7, 21,2.
Пример 128: 2-(3,4-диметоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-45)
3,4-диметоксифенилмасляную кислоту (235 мг; 1,2 ммоль) растворяют в 2 мл тионилхлорида и помещают в колбу на 50 мл. Смесь нагревают до температуры кипения с обратным холодильником в течение 2 часов и затем концентрируют на роторном испарителе (50°С). Хлорангидрид кислоты (1,2 ммоль) в 5 мл дихлорметана добавляют к 47AKU-5 (219 мг; 1,0 ммоль) в 10 мл дихлорметана. После перемешивания в течение 16 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 129 мг (33%) 47AKU-45. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,4. Анализ методом ВЭЖХ-МС (метод А): М+=397,4 (УФ/МС(%)=98/89). 1H-ЯМР (400 МГц, СDСl3, ротамеры):  = 7,17-6,60 (7H, м); 4,75 (1H, м); 4,51 (2H, с); 3,83 (3Н, с); 3,79 (3Н, с); 3,53 (2H, с); 3,27 (2H, д); 2,65 (2H, т); 2,58 (3Н, с); 2,32 (3Н, с); 2,24 (2H, м); 1,72 (2H, д). 13C-ЯМР (СDСl3): = 7,17-6,60 (7H, м); 4,75 (1H, м); 4,51 (2H, с); 3,83 (3Н, с); 3,79 (3Н, с); 3,53 (2H, с); 3,27 (2H, д); 2,65 (2H, т); 2,58 (3Н, с); 2,32 (3Н, с); 2,24 (2H, м); 1,72 (2H, д). 13C-ЯМР (СDСl3):  = 172,8, 149,3, 148,3, 137,4, 135,0, 129,8, 127,4, 125,8, 121,0, 112,2, 111,6, 56,2, 56,1, 54,6, 49,6, 46,7, 44,0, 40,9, 27,0, 21,2. = 172,8, 149,3, 148,3, 137,4, 135,0, 129,8, 127,4, 125,8, 121,0, 112,2, 111,6, 56,2, 56,1, 54,6, 49,6, 46,7, 44,0, 40,9, 27,0, 21,2.
Пример 129: 2-(3,4-метилендиоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (47AKU-46)
3,4-метилендиоксифенилуксусную кислоту (216 мг; 1,2 ммоль) растворяют в 2 мл тионилхлорида и помещают в колбу на 50 мл. Смесь нагревают до температуры кипения с обратным холодильником в течение 2 часов и затем концентрируют на роторном испарителе (50°С). Хлорангидрид кислоты (1,2 ммоль) в 5 мл дихлорметана добавляют к 47AKU-5 (219 мг; 1,0 ммоль) в 10 мл дихлорметана. После перемешивания в течение 2 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 188 мг (49%) продукта. Дальнейшая очистка ионообменной хроматографией (промывка 10% водным NH4OH (25%) в метаноле) дает 149 мг (39%) 47AKU-46. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,4. Анализ методом ВЭЖХ-МС (метод А): М+=381,2 (УФ/МС(%)=96/95). 1H-ЯМР (400 МГц, СDСl3;, ротамеры):  = 7,17-7,02 (4H, м); 6,77-6,51 (3H, м); 5,91 и 5,93 (2H, 2с); 4,70 (1H, м); 4,52 и 4,49 (2H, 2с); 3,51 (2H, с); 3,26 (2H, д); 2,49 (3H, с); 2,33 (3H, с); 2,14-1,66 (6H, м). 13C-ЯМР (СDСl3): = 7,17-7,02 (4H, м); 6,77-6,51 (3H, м); 5,91 и 5,93 (2H, 2с); 4,70 (1H, м); 4,52 и 4,49 (2H, 2с); 3,51 (2H, с); 3,26 (2H, д); 2,49 (3H, с); 2,33 (3H, с); 2,14-1,66 (6H, м). 13C-ЯМР (СDСl3):  = 172,5, 148,1, 146,8, 137,3, 135,1, 129,8, 128,6, 125,8, 121,9, 109,4, 108,5, 101,2, 54,8, 50,2, 46,7, 44,6, 41,1, 27,7, 21,2. = 172,5, 148,1, 146,8, 137,3, 135,1, 129,8, 128,6, 125,8, 121,9, 109,4, 108,5, 101,2, 54,8, 50,2, 46,7, 44,6, 41,1, 27,7, 21,2.
Пример 130: 2-(4-метоксифенил)–N-(4-метилбензил)-N-(1-трет-бутилпиперидин-4-ил)ацетамид (47AKU-49)
1-трет-бутил-4-пиперидон (47AKU-47)
1-бензил-4-пиперидон (1,89 г; 10 ммоль) растворяют в 15 мл ацетона. В течение 5 минут медленно добавляют метилиодид (0,90 мл; 15 ммоль). После 2 часов перемешивания на магнитной мешалке вносят дополнительное количество метилиодида (1,8 мл; 30 ммоль). После 1 часа перемешивания на магнитной мешалке добавляют 20 мл диэтилового эфира. Неочищенный продукт собирают фильтрованием и промывают смесью ацетон/диэтиловый эфир. Полученные белые кристаллы сушат в вакууме с получением 806 мг четвертичной соли. ТСХ (10% метанол в дихлорметане): Rf=0,7. Частично растворенную в 5 мл воды соль добавляют к нагретой до 50°С смеси трет-бутиламина (120 мг; 1,6 ммоль) и карбоната калия (32 мг; 0,22 ммоль) в 3 мл этанола. Полученную смесь перемешивают и нагревают до температуры кипения с обратным холодильником (~80°С) в течение 1 часа. После охлаждения добавляют воду (20 мл) и дихлорметан (20 мл). Фазы разделяют и водную фазу повторно экстрагируют дихлорметаном и этилацетатом. Объединенные органические фазы сушат над MgSO4 и концентрируют на роторном испарителе (40°С) с получением 496 мг 47AKU-47. ТСХ (10% метанол в дихлорметане): Rf=0,3. 1Н-ЯМР (400МГц, СDСl3):  = 2,82 (4H, т); 2,41 (4H, т); 1,12 (9H, с). 13C-ЯМР (СDСl3): = 2,82 (4H, т); 2,41 (4H, т); 1,12 (9H, с). 13C-ЯМР (СDСl3):  = 210,2, 54,3, 46,4, 42,4, 26,6. = 210,2, 54,3, 46,4, 42,4, 26,6.
Неочищенный продукт содержит ~25% (по данным анализа 1Н-ЯМР) исходного материала (1-бензил-4-пиперидона).
4-(4-метилбензиламино)-1-трет-бутилпиперидин (47AKU-48)
4-метилбензиламин (268 мг; 2,2 ммоль) растворяют в 5 мл метанола и помещают в колбу на 50 мл. Добавляют 47AKU-47 (305 мг; 2,0 ммоль) в 5 мл метанола. Затем добавляют уксусную кислоту (0,3 мл) до получения рН~5. После этого медленно добавляют NaCNBH3 (250 мг; 4,0 ммоль). Наблюдается выделение газа. После перемешивания на магнитной мешалке в течение 4 часов добавляют дихлорметан, 2М NaOH и воду до достижения рН~10. Фазы разделяют и водную фазу повторно экстрагируют дихлорметаном и этилацетатом. Объединенные органические фазы сушат над MgSO4. Концентрирование на роторном испарителе (40°С) дает 556 мг неочищенного 47AKU-48. ТСХ (20% метанол в дихлорметане): Rf=0,4. Анализ методом ВЭЖХ-МС (метод А): М+=261,2 (МС(%)=57).
2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-трет-бутилпиперидин-4-ил)ацетамид (47AKU-49)
47AKU-48 (556 мг; 2,1 ммоль) помещают в колбу на 50 мл и добавляют 5 мл дихлорметана. Затем добавляют 4-метоксифенилацетилхлорид (739 мг; 4,0 ммоль) в 10 мл дихлорметана. После перемешивания в течение 4 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 124 мг (15%) продукта. Дальнейшая очистка ионообменной хроматографией (промывка 10% водным NH4OH (25%) в метаноле) дает 91 мг (11%) 47AKU-49. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,5 Анализ методом ВЭЖХ-МС (метод А): М+=409,4 (УФ/МС(%)=100/90). 1H-ЯМР (400 МГц, СDСl3):  = 7,11 (4H, м); 7,03 (2H, д); 6,79 (2H, д); 4,78 (1H, м); 4,56 (2H, с); 3,76 (3H, с); 3,53 (2H, с); 3,43 (2H, м); 2,63 (2H, м); 2,47 (2H, м); 2,31 (3H, с); 1,74 (2H, д); 1,36 (9H, с). 13C-ЯМР (СDСl3): = 7,11 (4H, м); 7,03 (2H, д); 6,79 (2H, д); 4,78 (1H, м); 4,56 (2H, с); 3,76 (3H, с); 3,53 (2H, с); 3,43 (2H, м); 2,63 (2H, м); 2,47 (2H, м); 2,31 (3H, с); 1,74 (2H, д); 1,36 (9H, с). 13C-ЯМР (СDСl3):  = 173,0, 158,8, 137,1, 135,3, 129,8, 129,7, 127,0, 125,8, 114,3, 55,6, 55,5, 49,8, 46,5, 46,4, 40,5, 26,7, 25,1, 21,2. = 173,0, 158,8, 137,1, 135,3, 129,8, 129,7, 127,0, 125,8, 114,3, 55,6, 55,5, 49,8, 46,5, 46,4, 40,5, 26,7, 25,1, 21,2.
Пример 131: N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)-N’-фенилэтилкарбамид (58AKU-1)
47AKU-5-2 (219 мг; 1,0 ммоль) растворяют в 5 мл дихлорметана и помещают в колбу на 50 мл. Добавляют фенилэтилизоцианат (177 мг; 1,2 ммоль) в 5 мл дихлорметана. После 6 часов перемешивания на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-15% метанол в дихлорметане) с получением 134 мг (37%) 58AKU-1. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,5 Анализ методом ВЭЖХ-МС (метод А): М+=366,3 (УФ/МС(%)=99/96). 1Н-ЯМР (400 МГц, СDСl3):  = 7,21-6,97 (9H, м); 4,33 (1H, м); 4,26 (1H, м); 4,21 (2H, с); 3,39 (2H, кв); 2,85 (2H, м); 2,67 (2H, т); 2,31 (3H, с); 2,24 (3H, с); 2,06 (2H, м); 1,73-1,57 (4H, м). 13C-ЯМР (СDСl3): = 7,21-6,97 (9H, м); 4,33 (1H, м); 4,26 (1H, м); 4,21 (2H, с); 3,39 (2H, кв); 2,85 (2H, м); 2,67 (2H, т); 2,31 (3H, с); 2,24 (3H, с); 2,06 (2H, м); 1,73-1,57 (4H, м). 13C-ЯМР (СDСl3):  = 158,7, 139,5, 137,0, 135,4, 129,7, 128,8, 128,6, 126,3, 126,1, 55,6, 52,2, 46,2, 45,8, 42,2, 36,4, 30,2, 21,2. = 158,7, 139,5, 137,0, 135,4, 129,7, 128,8, 128,6, 126,3, 126,1, 55,6, 52,2, 46,2, 45,8, 42,2, 36,4, 30,2, 21,2.
Пример 132: N-фенилэтил-N-(1-метилпиперидин-4-ил)-N’-фенэтилкарбамид (58AKU-2)
4-(2-фенилэтил)амино-1-метилпиперидин (131 мг; 0,6 ммоль) растворяют в 5 мл дихлорметана и помещают в колбу на 50 мл. Добавляют фенэтилизоцианат (103 мг; 0,7 ммоль) в 5 мл дихлорметана. После перемешивания в течение 4 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (45°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 198 мг (90%) 58AKU-1. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,3 Анализ методом ВЭЖХ-МС (метод А): М+=366,3 (УФ/МС(%)=100/100). 1H-ЯМР (400 МГц, СDСl3):  = 7,33-7,16 (8H, м); 7,01 (2H, м); 4,23 (1H, т); 4,04 (1H, м); 3,47 (2H, кв); 3,17 (2H, т); 2,89 (2H, м); 2,78 (2H, т); 2,66 (2H, т); 2,28 (3H, с); 2,05 (2H, м); 1,79-1,59 (4H, м). 13C-ЯМР (СDСl3): = 7,33-7,16 (8H, м); 7,01 (2H, м); 4,23 (1H, т); 4,04 (1H, м); 3,47 (2H, кв); 3,17 (2H, т); 2,89 (2H, м); 2,78 (2H, т); 2,66 (2H, т); 2,28 (3H, с); 2,05 (2H, м); 1,79-1,59 (4H, м). 13C-ЯМР (СDСl3):  = 157,8, 139,6, 139,0, 129,0, 128,9, 128,8, 126,8, 126,7, 55,7, 52,5, 46,2, 44,6, 42,0, 37,3, 36,4, 30,5. = 157,8, 139,6, 139,0, 129,0, 128,9, 128,8, 126,8, 126,7, 55,7, 52,5, 46,2, 44,6, 42,0, 37,3, 36,4, 30,5.
Пример 133: N-(4-метилбензил)-N-(1-трет-бутилпиперидин-4-ил)-N’-(4-метоксибензил)карбамид (58AKU-3)
47AKU-5-2 (404 мг; 1,6 ммоль) растворяют в 5 мл дихлорметана и помещают в колбу на 50 мл. Добавляют 4-метоксибензилизоцианат (326 мг; 2,0 ммоль) в 5 мл дихлорметана. После перемешивания в течение 20 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (45°С). Сырой продукт очищают три раза флэш-хроматографией (0-20% метанол в дихлорметане и 0-30% метанол в этилацетате) с получением 155 мг (23%) 58AKU-3. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,3 Анализ методом ВЭЖХ-МС (метод А): М+=424,2 (УФ/МС(%)=92/83). 1Н-ЯМР (400 МГц, СDСl3):  = 7,10 (4H, м); 6,99 (2H, м); 6,76 (2H, м); 4,53 (1H, м); 4,35 (3H, с); 4,26 (2H, д); 3,77 (3H, с); 3,09 (2H, м); 2,32 (3H, с); 2,22 (2H, м); 1,81-1,54 (4H, м); 1,06 (9H, с). 13C-ЯМР (СDСl3): = 7,10 (4H, м); 6,99 (2H, м); 6,76 (2H, м); 4,53 (1H, м); 4,35 (3H, с); 4,26 (2H, д); 3,77 (3H, с); 3,09 (2H, м); 2,32 (3H, с); 2,22 (2H, м); 1,81-1,54 (4H, м); 1,06 (9H, с). 13C-ЯМР (СDСl3):  = 158,9, 158,6, 137,1, 135,6, 131,9, 129,7, 128,8, 126,2, 114,0, 62,6, 55,5, 53,0, 45,9, 45,7, 44,5, 31,0, 26,3, 21,2. = 158,9, 158,6, 137,1, 135,6, 131,9, 129,7, 128,8, 126,2, 114,0, 62,6, 55,5, 53,0, 45,9, 45,7, 44,5, 31,0, 26,3, 21,2.
Пример 134: 2-(4-этоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (58AKU-4)
4-этоксифенилуксусную кислоту (270 мг; 1,5 ммоль) растворяют в 2 мл тионилхлорида и помещают в колбу на 50 мл. Смесь нагревают до температуры кипения с обратным холодильником в течение 2 часов и затем концентрируют на роторном испарителе (45°С). Хлорангидрид кислоты (1,5 ммоль) в 5 мл дихлорметана добавляют к 47AKU-5-2 (262 мг; 1,2 ммоль) в 5 мл дихлорметана. После перемешивания в течение 20 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 272 мг (60%) 58AKU-4. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,4. Анализ методом ВЭЖХ-МС (метод А): М+=381,2 (УФ/МС(%)=98/91). 1Н-ЯМР (400 МГц, СDСl3):  = 7,17-6,99 (6Н, м); 6,82-6,76 (2H, м); 4,73 (1H, м); 4,48 (2H, с); 3,98 (2H, кв); 3,52 (2H, с); 3,22 (2H, д); 2,61 (2H, т); 2,54 (3Н, с); 2,32 (3Н, с); 2,14 (2H, с); 1,71 (2H, д); 1,38 (3Н, т). 13C-ЯМР (СDСl3): = 7,17-6,99 (6Н, м); 6,82-6,76 (2H, м); 4,73 (1H, м); 4,48 (2H, с); 3,98 (2H, кв); 3,52 (2H, с); 3,22 (2H, д); 2,61 (2H, т); 2,54 (3Н, с); 2,32 (3Н, с); 2,14 (2H, с); 1,71 (2H, д); 1,38 (3Н, т). 13C-ЯМР (СDСl3):  = 172,9, 158,2, 137,3, 135,0, 129,9, 129,8, 126,8, 125,8, 114,9, 63,7, 54,6, 49,8, 46,7, 44,1, 40,6, 27,2, 21,2, 15,0. = 172,9, 158,2, 137,3, 135,0, 129,9, 129,8, 126,8, 125,8, 114,9, 63,7, 54,6, 49,8, 46,7, 44,1, 40,6, 27,2, 21,2, 15,0.
Пример 135: 2-(4-бутоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (58AKU-5)
4-бутоксифенилуксусную кислоту (317 мг; 1,5 ммоль) растворяют в 2 мл тионилхлорида и помещают в колбу на 50 мл. Смесь нагревают до температуры кипения с обратным холодильником в течение 2 часов и затем концентрируют на роторном испарителе (45°С). Хлорангидрид кислоты (1,5 ммоль) в 5 мл дихлорметана добавляют к 47AKU-5-2 (262 мг; 1,2 ммоль) в 5 мл дихлорметана. После перемешивания в течение 20 часов на магнитной мешалке реакционную смесь концентрируют на роторном испарителе (40°С). Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 230 мг (47%) 58AKU-5. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,5. Анализ методом ВЭЖХ-МС (метод А): М+=409,2 (УФ/МС(%)=98/93). 1Н-ЯМР (400 МГц, СDСl3):  = 7,15-6,96 (6Н, м); 6,78 (2H, м); 4,74 (1H, м); 4,48 (2H, с); 3,91 (2H, т); 3,52 (2H, с); 3,27 (2H, д); 2,72 (2H, т); 2,58 (3Н, с); 2,32 (ЗН, с); 2,23 (2H, м); 1,72 (4H, д); 1,45 (2H, м); 0,95 (3Н, т). 13C-ЯМР (СDСl3): = 7,15-6,96 (6Н, м); 6,78 (2H, м); 4,74 (1H, м); 4,48 (2H, с); 3,91 (2H, т); 3,52 (2H, с); 3,27 (2H, д); 2,72 (2H, т); 2,58 (3Н, с); 2,32 (ЗН, с); 2,23 (2H, м); 1,72 (4H, д); 1,45 (2H, м); 0,95 (3Н, т). 13C-ЯМР (СDСl3):  = 173,0, 158,4, 137,3, 135,0, 129,8, 126,6, 125,8, 115,0, 67,9, 54,4, 49,5, 46,7, 43,8, 40,6, 31,5, 26,8, 21,2, 19,4, 14,0. = 173,0, 158,4, 137,3, 135,0, 129,8, 126,6, 125,8, 115,0, 67,9, 54,4, 49,5, 46,7, 43,8, 40,6, 31,5, 26,8, 21,2, 19,4, 14,0.
Пример 136: 2-(4-изопропоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид (58AKU-6)
47AKU-29-2 (245 мг; 0,7 ммоль) растворяют в 10 мл диметилформамида и помещают в колбу на 50 мл. Добавляют KOH (196 мг; 3,5 ммоль) и изопропилбромид (200 мкл; 2,1 ммоль). Смесь нагревают до 50°С и перемешивают в течение 24 часов. После охлаждения добавляют воду и этилацетат. Фазы разделяют и водную фазу повторно экстрагируют дихлорметаном. Объединенные органические фазы промывают насыщенным солевым раствором, сушат над MgSO4 и концентрируют на роторном испарителе (40°С) с получением 188 мг. Сырой продукт очищают флэш-хроматографией (0-10% метанол в дихлорметане) с получением 136 мг (49%) 58AKU-6. HCl-соль получают из смеси 2М HCl/диэтиловый эфир в дихлорметане/гептане. ТСХ (10% метанол в дихлорметане): Rf=0,3. Анализ методом ВЭЖХ-МС (метод В): М+=395 (УФ/МС(%)=95/91). 1Н-ЯМР (400 МГц, СDСl3, ротамеры):  = 7,23-7,01 (6H, м); 6,79 (2H, м); 4,60 (1H, м); 4,51 (1H, м); 4,44 (1H, с); 3,77 (1H, с); 3,52 (1H, с); 2,83 (2H, м); 2,76 (2H, м); 2,28 и 2,34 (3H, 2с); 2,19 и 2,22 (3H, 2с); 2,05 (1H, м); 1,86-1,55 (4H, м); 1,32 (6H, д). 13C-ЯМР (СDСl3): = 7,23-7,01 (6H, м); 6,79 (2H, м); 4,60 (1H, м); 4,51 (1H, м); 4,44 (1H, с); 3,77 (1H, с); 3,52 (1H, с); 2,83 (2H, м); 2,76 (2H, м); 2,28 и 2,34 (3H, 2с); 2,19 и 2,22 (3H, 2с); 2,05 (1H, м); 1,86-1,55 (4H, м); 1,32 (6H, д). 13C-ЯМР (СDСl3):  = 172,6, 157,0, 137,1, 135,6, 129,8, 129,7, 125,8, 116,2, 70,1, 55,3, 51,6, 46,6, 46,1, 40,8, 29,6, 22,3, 21,2. = 172,6, 157,0, 137,1, 135,6, 129,8, 129,7, 125,8, 116,2, 70,1, 55,3, 51,6, 46,6, 46,1, 40,8, 29,6, 22,3, 21,2.
Пример 137: Тест на отбор и амплификацию рецептора (R-SAT)
Функциональный тест на рецептор по методике отбора и амплификации рецептора (R-SAT) был использован (с небольшими модификациями относительно ранее описанного теста в патенте США 5707798) для скрининга соединений на их эффективность в отношении рецептора 5-HT2A. В общих чертах, тест состоит в том, что клетки NIH3T3 выращивают в 96-луночных планшетах для культуры тканей до 70-80% слияния. Затем клетки трансфицируют в течение 12-16 часов плазмидной ДНК с использованием суперфекта (Qiagen Inc.) по инструкции производителя. В основном тесты R-SAT проводят с использованием 50 нг/ячейку рецептора и 20 нг/ячейку плазмидной ДНК, кодирующей  -галактозидазу. Все использованные конструкции рецептора и G-протеина находятся в векторе экспрессии млекопитающих pSI (Promega Inc.), как описано в патенте США 5707798. Ген, кодирующий рецептор 5HT2A, амплифицируют методом внутригенной ПЦР, исходя из кДНК мозга с использованием олигодезоксинуклеотидов на основе известной последовательности (см. Saltzman et al., Biochem. Biophys. Res. Comm. 181:1469-78 (1991)). В случае крупномасштабных трансфекций клетки трансфицируют в течение 12-16 часов, затем обрабатывают трипсином и замораживают в ДМСО. Затем замороженные клетки подвергают оттаиванию, помещают в количестве 10000-40000 клеток на ячейку в 96-луночный планшет, который содержит лекарственное средство. В ходе обоих методов клетки далее растят в увлажненной атмосфере в присутствии 5% СО2 в течение пяти дней. Затем среду удаляют из планшетов и определяют активность маркерного гена при добавлении субстрата бета-галактозидазы ONPG (в ФБР с добавкой 5% NP-40). Итоговую колориметрическую реакцию измеряют на спектрофотометре для планшетов (Titertek Inc.) при длине волны 420 нм. Все полученные данные анализируют с использованием компьютерной программы XLFit (IDBSm). Эффективность представляет собой процент от максимальной репрессии в сравнении с репрессией контрольным соединением (ритансерин в случае 5HT2A). рИК50 представляет собой отрицательный логарифм ИК50, где ИК50 означает вычисленную концентрацию в молях, которая дает 50% репрессию от максимального уровня. Результаты, полученные для нескольких соединений согласно настоящему изобретению, представлены ниже в таблице 4. -галактозидазу. Все использованные конструкции рецептора и G-протеина находятся в векторе экспрессии млекопитающих pSI (Promega Inc.), как описано в патенте США 5707798. Ген, кодирующий рецептор 5HT2A, амплифицируют методом внутригенной ПЦР, исходя из кДНК мозга с использованием олигодезоксинуклеотидов на основе известной последовательности (см. Saltzman et al., Biochem. Biophys. Res. Comm. 181:1469-78 (1991)). В случае крупномасштабных трансфекций клетки трансфицируют в течение 12-16 часов, затем обрабатывают трипсином и замораживают в ДМСО. Затем замороженные клетки подвергают оттаиванию, помещают в количестве 10000-40000 клеток на ячейку в 96-луночный планшет, который содержит лекарственное средство. В ходе обоих методов клетки далее растят в увлажненной атмосфере в присутствии 5% СО2 в течение пяти дней. Затем среду удаляют из планшетов и определяют активность маркерного гена при добавлении субстрата бета-галактозидазы ONPG (в ФБР с добавкой 5% NP-40). Итоговую колориметрическую реакцию измеряют на спектрофотометре для планшетов (Titertek Inc.) при длине волны 420 нм. Все полученные данные анализируют с использованием компьютерной программы XLFit (IDBSm). Эффективность представляет собой процент от максимальной репрессии в сравнении с репрессией контрольным соединением (ритансерин в случае 5HT2A). рИК50 представляет собой отрицательный логарифм ИК50, где ИК50 означает вычисленную концентрацию в молях, которая дает 50% репрессию от максимального уровня. Результаты, полученные для нескольких соединений согласно настоящему изобретению, представлены ниже в таблице 4.
Таблица 3. Эффективность и значение рИК50 соединений в отношении 5-HT2A-рецептора в сравнении с ритансерином
| Соединение |
Эффективность в % |
рИК50 |
| 26НСН17 |
94 |
8,3 |
| 26НСН65 |
103 |
8,2 |
| 26НСН66-05 |
126 |
8,1 |
| 26НСН79-5 |
94 |
8,2 |
| 26НСН79-6 |
83 |
8,3 |
| 26НСН79-10 |
102 |
7,8 |
| 26НСН71В |
124 |
7,9 |
| 42ELH45 |
108 |
9,0 |
| 50ELH27 |
108 |
8,7 |
| 47AKU-7 |
120 |
8,1 |
| 42ELH-80 |
122 |
8,5 |
| 42ELH79 |
110 |
8,5 |
| 42ELH91 |
108 |
8,0 |
| 42ELH85 |
118 |
7,8 |
| 42ELH75 |
109 |
8,3 |
| 47AKU-12 |
112 |
8,1 |
| 47AKU-8 |
113 |
8,1 |
| 47AKU-22 |
117 |
7,9 |
| 47AKU-21 |
117 |
7,9 |
| 47AKU-20 |
120 |
8,0 |
| 50ELH8 |
129 |
7,8 |
| 50ELH68 |
96 |
8,4 |
| 50ELH65 |
92 |
7,9 |
| 47AKU-44 |
112 |
8,5 |
| 57МВТ12В |
75 |
7,7 |
| 58AKU-4 |
110 |
9,6 |
| 58AKU-3 |
111 |
8,1 |
| 58AKU-5 |
99 |
9,5 |
| 58AKU-6 |
101 |
9,8 |
| 57МВТ54В |
95 |
7,9 |
| 50ELH95В |
119 |
8,0 |
| 50ELH93Е |
72 |
8,1 |
| 50ELH93D |
58 |
7,8 |
| 50ELH93A |
106 |
8,7 |
| 63ELH1A |
104 |
8,3 |
| 50ELH89 |
111 |
9,7 |
| 63ELH20 |
95 |
9,0 |
| 57МВТ70-8D |
119 |
7,7 |
| 57МВТ70-5D |
105 |
8,4 |
| 57МВТ70-4D |
98 |
8,5 |
| 57МВТ70-3D |
87 |
8,9 |
| 57МВТ70-2D |
105 |
8,2 |
| 57МВТ70-1D |
120 |
7,9 |
| 63ELH21 |
100 |
8,5 |
| 57МВТ62B |
119 |
7,9 |
| 57МВТ70-6E |
115 |
8,0 |
Пример 138: Профиль селективности гидрохлорида 2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамида
Используют тест R-SAT (описанный выше в примере 137) для изучения селективности гидрохлорида 2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамида. Ниже, в таблице 4 представлены результаты широкого скрининга указанного соединения на множестве рецепторов. NR обозначает “нет реакции”, то есть исследованное соединение не проявляет эффекта в отношении рассматриваемого рецептора.
Таблица 4: Селективность 2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамида
Пример 139: Фармакология in vivo гидрохлорида 2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамида (АС-90179)
Методы
Животные и аппаратура
Животных, использованных в экспериментах с крысами (подробности содержатся в документации на аппаратуру и на измерения см. Malе Non-Swiss Albino mice and male Spraque-Dawley rats (Harlan Spraque-Dawley)) содержали (4 мыши/клетку; 2 крысы/клетку) в помещениях с контролируемой температурой и влажностью и со свободным доступом к пище и воде (Harlan Teklad). Мышей содержали в условиях 12-часового цикла свет:темнота, в то время как крыс содержали в условиях обратного 12-часового цикла свет:темнота. Для проведения экспериментов на двигательную активность и наблюдений за мышами камеры размером 20х20х30 см, позволяющие животным быть активными, снабжаются фотоиндикаторами (AccuScan Instruments). Камеры (San Diego Instruments) используют для экспериментов с крысами (подробности содержатся в инструкции на аппараты и методы измерения, см. Mansbach et al., (1988) Psychopharmacology 94:507-14).
Процедуры
Наблюдение за подергиванием головой
Мышам вводят в/б 2,5 мг/кг DOI. Через пять минут мышам вводят п/к АС-90179 и помещают их в камеры для активности. Через десять минут мышей обследуют с использованием методики повторного отбора образцов. Каждую мышь обследуют в течение 10 секунд и отмечают наличие (1) или отсутствие (0) подергивания головой в целом за 6 наблюдений в течение 15 минут и общий уровень подергивания головой по шкале от 0 до 6. Каждое сочетание дозы испытывают в отдельной группе животных (n=8), и эксперимент организуют как слепой в отношении лекарственного средства. Определяют среднее значение оценочного балла подергивания головой по методу анализа вариантов (ANOVA) и по т-тесту сравнения пост-хок Даннетта (post-hoc Dunnett’s).
Двигательная активность
В экспериментах на гиперактивность мышам вводят в/б 0,3 мг/кг дизоцилпина или 3,0 мг/кг д-амфетамина за 15 минут до сеанса. Через пять минут после предварительной обработки мышам вводят п/к АС-90179 и помещают их в камеру для активности. Для определения спонтанной активности вводят один только АС-90179. Данные по локомоторной активности собирают в ходе 15-минутного сеанса без помещения в освещенную комнату. Каждое сочетание дозы исследуют в отдельной группе животных (n=8). Вычисляют пройденное расстояние (см) и определяют среднее значение по методу ANOVA и при сравнении по т-тесту пост-хок Даннетта.
Тест на пугливость
Крыс обследуют и подбирают в группы (n=10) по уровню реакции на испуг и предпульсного ингибирования (ППИ; PPI, см. Mansbach et al., (1988) Psychopharmacology 94:507-14). Через два дня начинают сеанс испытаний, который включает в себя 5-минутный акклиматизационный период при постоянном фоновом шуме (65 дБ) с последующими 60 посылками звукового стимула для оценки реакции испуга в ответ на звуковое воздействие. Указанные 60 испытаний состоят из двадцати двух 40-миллисекундных (мс) посылок широкополосных импульсов с интенсивностью 120 дБ, десяти 20-мс посылок предварительных импульсов каждого уровня интенсивности (68, 71, 77 дБ) за 100 мс перед посылкой 40-мс широкополосного импульса с интенсивностью 120 дБ, и 8 NOSTIM испытаний (без стимуляции), в которых никакой стимуляции не применяют, для того чтобы оценить общую дигательную активацию у крыс. За тридцать минут до тестирования крысам вводят стерильную воду (п/к), рисперидон (1,0 мг/кг; в/б) или АС-90179 (п/к). Через пять минут крысам вводят DOI (0,5 мг/кг; п/к) или 0,9% физиологический раствор (п/к). Через одну неделю крысам вводят то же самое предварительное лекарственное средство или носитель и проводят перекрестные испытания для достижения лечения, противоположного тому, что они получали в течение предшествующей недели. Значения степени пугливости и процент ППИ для трех уровней интенсивности предварительных импульсов рассчитывают, как описано в литературе (Bakshi, et al., (1994), J. Pharmacol. Exp. Ther. 271:787-94) и проводят повторные исследования с обработкой по методу ANOVA.
Результаты
Для дальнейшей характеристики клинической применимости селективного обратного агониста рецептора 5-HT2A в качестве нового антипсихотического средства исследовали действие АС-90179 на таких поведенческих моделях, как подергивание головой, локомоторная функция и предимпульсное ингибирование. Мыши, обработанные DOI (2,5 мг/кг; в/б; 15 минут), демонстрировали средний балл подергивания головой 2,6 (±0,3; СКО). АС-90179 (0,1-30 мг/кг; п/к; 10 минут) вызывал зависимое от дозы снижение DOI-индуцированного подергивания головой с минимальной эффективной дозой 1 мг/кг и при более высоких дозах практически полностью устранял подергивание головой (фиг.2).
В локомоторных экспериментах (фиг.3) мыши проходили в среднем 794 см (±122 СКО) после введения носителя. Дизоцилпин (0,3 мг/кг; в/б; 15 минут) и д-амфетамин (3,0 мг/кг: в/б; 15 минут) вызывали повышение пройденной дистанции, в среднем она составляла 2625 см (±312) и 3367 (±532) соответственно. АС-90179 (0,3-10 мг/кг; п/к; 10 минут) ослаблял гиперактивность, вызванную дизоцилпином, но не д-амфетамином. Минимальная эффективная доза против дизоцилпина составляла 1 мг/кг, тогда как АС-90179 снижал спонтанную локомоторную активность только при высшей исследованной дозе (30 мг/кг).
Проведенные 3-направленные повторные анализы по методу ANOVA на основе данных ППИ на группах с использованием АС-90179 выявили наличие общего эффекта обработки [F(1,37) = 27,73; p = <0,01] и взаимодействия обработки и предобработки [F(3,37) = 8,22; p = <0,01] (фиг.2С). DOI значительно нарушал ППИ, а АС-90179 был эффективен при восстановлении указанного нарушения, особенно при более высоких дозах. АС-90179 не воздействовал на само ППИ, и при этом не отмечалось значительного эффекта предобработки (p > 0,05) на процент ППИ. Рисперидон использовался как позитивный контроль, поскольку предыдущие исследования в лаборатории авторов позволили предположить, что он эффективен по блокированию ППИ-нарушающего эффекта DOI. Повторные 3-направленные измерения по методу ANOVA данных по ППИ в группе рисперидона также выявили значительный эффект обработки [F(1,18) = 14,08; p < 0,01] и взаимодействие обработки и предварительной обработки [F(1,18) = 24,48; p < 0,01]. Как и предполагалось, рисперидон был также эффективен в отношении восстановления ППИ у крыс, получавших DOI. Рисперидон также не оказывал эффекта на само ППИ, что следует из отсутствия эффекта предобработки (p > 0,05). Поскольку отсутствует существенное взаимодействие с предимпульсной интенсивностью, данные представлены в суммарном виде по трем предимпульсным интенсивностям для целей построения графика.
Поскольку отмечается существенное взаимодействие обработки и предобработки, было проведено парное 2-направленное повторное измерение по методу ANOVA в группах с физиологическим раствором и введением DOI. У крыс, получавших носитель, отсутствовал эффект АС-90179 (p > 0,025) или рисперидона (p > 0,025) на ППИ. В группах, получавших DOI, отмечался значительный эффект АС-90179 [F(3,37) = 5,68; p < 0,01] и рисперидона [F(1,18) = 16,73, p < 0,01) на процент ППИ.
3-направленные повторные обработки по методу ANOVA данных по степени пугливости в группах, получавших АС-90179, выявили значительный эффект предварительной обработки [F(3,37) = 2,89; p = 0,048] и обработки [F(1,37) = 10,27; p < 0,01] на степень пугливости, но не на обработку под воздействием предобработки (p > 0,05; фиг.1, блок С внутри). Рисперидон, с другой стороны, не оказывал воздействия на степень пугливости (p > 0,05).
Пример 140 – Фармакология in vivo дополнительных соединений
Эффект различных соединений на поведенческое подергивание головой у мышей, обработанных DOI, наблюдали, как описано выше в примере 139. Результаты суммированы ниже в таблице 5.
Эффект различных соединений на подергивание головы у мышей, обработанных DOI, наблюдали, как описано в примере 139. Животным вводили подкожные инъекции 0,1-30 мг/кг указанного соединения. МЭД (MED) указывает минимальную эффективную дозу, при которой отмечается статистически значимое снижение уровня подергивания головой (описанное выше). MЭД = минимальная эффективная доза in vivo.
Таблица 5. Сравнение аналогов по их способности снижать вызванное DOI подергивание головой у мышей
МЭД = минимальная эффективная доза in vivo.
Описание и формула настоящего изобретения не ограничиваются в объеме конкретными вариантами реализации изобретения, поскольку указанные варианты рассматриваются лишь как иллюстрации некоторых аспектов изобретения. Любые эквивалентные варианты входят в область настоящего изобретения. Фактически различные модификации изобретения в дополнение к показанным и описанным в настоящем описании станут очевидными специалистам в данной области техники из приведенного выше описания. Такие модификации также входят в объем, заявленный прилагаемой формулой изобретения.
Раскрытие всех цитированных ссылок полностью включены в описание посредством ссылки.
Формула изобретения
1. Соединения формулы (I)

где Z означает

где
R означает водород, С4-С6циклоалкильную группу, присоединенную либо через один из атомов углерода кольца, либо через присоединенную к кольцу низшую алкиленовую группу, или линейно-цепочечную или разветвленную низшую алкильную группу или низшую гидроксиалкильную группу, или низшую аминоалкильную группу, или фенил(низшую алкильную)группу, необязательно замещенную 1-2 заместителями, выбранными из низшего алкила, низшего алкокси, галогена и гидрокси, или гетероарил(низшую алкильную)группу, где гетероарил выбран из группы, состоящей из тиенила, замещенного низшей алкильной группой, имидазолила, и тиазолила, замещенного низшей алкильной группой;
n означает 0 или 1; или
Z означает группу

где R означает низшую алкильную группу;
X1 означает метилен или NH группу; и
Х2 означает метилен; или
X1 означает метилен и Х2 означает метилен или связь; или
X1 означает метилен и Х2 означает О, S или связь;
Y1 означает метилен и Y2 означает метилен, винилен, этилен, или связь;
Ar1 означает незамещенный или замещенный фенил;
Ar2 означает незамещенный или замещенный фенил, незамещенный или замещенный тиенил, незамещенный или замещенный фурил, незамещенный или замещенный пиридил; причем когда Ar1 и Ar2 замещены, то каждый Ar1 и Ar2 независимо замещены одним или более заместителями, выбранными из низшего алкила, низшего алкокси, гидрокси, низшего гидроксиалкила, галогена, ди- и тригалоалкила, ди- и тригалоалкокси, моно- и диалкиламино, алкилтио, сложного алкилового эфира и нитро;
при условии, что Ar1 и Ar2 не означают одновременно незамещенный фенил;
W означает кислород или серу; или
их фармацевтически приемлемые соли;
при условии, что
когда Z означает  , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает связь, Y1 означает метилен, Y2 означает метилен, и Ar1 означает 3,4-диметоксифенил, тогда Ar2 не может быть выбран из группы, содержащей 3,4-дихлорфенил, 3-трифторметилфенил, 3,4,5-триметоксифенил, 3,5-бис(трет-бутил)-4-гидроксифенил, 4-бромфенил, бензо[b]тиофен-3-ил, 4-аминофенил, 4-трифторметилфенил и 1Н-индол-3-ил; , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает связь, Y1 означает метилен, Y2 означает метилен, и Ar1 означает 3,4-диметоксифенил, тогда Ar2 не может быть выбран из группы, содержащей 3,4-дихлорфенил, 3-трифторметилфенил, 3,4,5-триметоксифенил, 3,5-бис(трет-бутил)-4-гидроксифенил, 4-бромфенил, бензо[b]тиофен-3-ил, 4-аминофенил, 4-трифторметилфенил и 1Н-индол-3-ил;
когда Z означает  , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает связь, Y1 означает метилен, Y2 означает связь, и Ar1 означает 2,6-дифторфенил, тогда Ar2 не может быть выбран из группы, содержащей 3,4-дихлорфенил, 3-трифторметилфенил, 3,4,5-триметоксифенил, 3,5-бис(трет-бутил)-4-гидроксифенил, 4-бромфенил, бензо[b]тиофен-3-ил, 4-аминофенил, 4-трифторметилфенил и 1Н-индол-3-ил; , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает связь, Y1 означает метилен, Y2 означает связь, и Ar1 означает 2,6-дифторфенил, тогда Ar2 не может быть выбран из группы, содержащей 3,4-дихлорфенил, 3-трифторметилфенил, 3,4,5-триметоксифенил, 3,5-бис(трет-бутил)-4-гидроксифенил, 4-бромфенил, бензо[b]тиофен-3-ил, 4-аминофенил, 4-трифторметилфенил и 1Н-индол-3-ил;
когда Z  , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает метилен, Y1 означает метилен, Y2 означает метилен, и Ar1 означает 3,4-диметоксифенил, тогда Ar2 не может означать 3,4-диметоксифенил; , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает метилен, Y1 означает метилен, Y2 означает метилен, и Ar1 означает 3,4-диметоксифенил, тогда Ar2 не может означать 3,4-диметоксифенил;
когда Z означает  , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает метилен, Y1 означает метилен, Y2 означает связь, и Ar1 означает 2,6-дифтофенил, тогда Ar2 не может означать 3,4-диметоксифенил; , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает метилен, Y1 означает метилен, Y2 означает связь, и Ar1 означает 2,6-дифтофенил, тогда Ar2 не может означать 3,4-диметоксифенил;
когда Z означает  , R означает Н, n означает 1, X1 означает NH; Х2 означает метилен, Y1 означает метилен, Y2 означает метилен, Ar1 означает 3,4-диметоксифенил, и Ar2 означает фур-2-ил или нафтилен-1-ил, тогда W не может означать S; и , R означает Н, n означает 1, X1 означает NH; Х2 означает метилен, Y1 означает метилен, Y2 означает метилен, Ar1 означает 3,4-диметоксифенил, и Ar2 означает фур-2-ил или нафтилен-1-ил, тогда W не может означать S; и
когда Z означает  , R означает Н, n означает 1, X1 означает NH; Х2 означает метилен, Y1 означает метилен, Y2 означает связь, Ar1 означает 2,6-дифторфенил, и Ar2 означает нафтилен-1-ил, тогда W не может означать S. , R означает Н, n означает 1, X1 означает NH; Х2 означает метилен, Y1 означает метилен, Y2 означает связь, Ar1 означает 2,6-дифторфенил, и Ar2 означает нафтилен-1-ил, тогда W не может означать S.
2. Соединение по п.1, в котором
Z означает  , n означает 0 или 1, и , n означает 0 или 1, и
R означает водород, С4-Сбциклоалкильную группу, присоединенную либо через один из атомов углерода кольца, либо через присоединенную к кольцу низшую алкиленовую группу, или линейно-цепочечную или разветвленную низшую алкильную группу или низшую гидроксиалкильную группу.
3. Соединение по п.2, в котором
Y1 означает метилен и Y2 означает связь, метилен, этилен или винилен; и
X1 означает метилен и Х2 означает связь, метилен, О или S; или
X1 означает NH и Х2 означает метилен.
4. Соединение по п.3, в котором Z означает

и W означает кислород.
5. Соединение по п.4, в котором
Ar1 означает фенил, замещенный 1-2 заместителями, выбранными из низшего алкила, низшего алкокси, гидрокси, низшего гидроксиалкила, галогена, ди- и тригалоалкила, ди- и тригалоалкокси, моно- и диалкиламино, алкилтио, сложного алкилового эфира и нитро; и Ar2 означает фенил, замещенный 1-2 заместителями, выбранными из низшего алкила, низшего алкокси, гидрокси, низшего гидроксиалкила, галогена, ди- и тригалоалкила, ди- и тригалоалкокси, моно- и диалкиламино, алкилтио, сложного алкилового эфира и нитро.
6. Соединение по п.5, в котором
R означает водород, С4-С6циклоалкильную группу, присоединенную либо через один из атомов углерода кольца, либо через присоединенную к кольцу низшую алкиленовую группу, или линейно-цепочечную или разветвленную низшую алкильную группу или низшую гидроксиалкильную группу;
n означает 1;
Y1 означает метилен, Y2 означает связь, метилен, этилен или винилен;
X1 означает метилен и Х2 означает связь; или
X1 означает NH и Х2 означает метилен; и
Ar1 и Ar2 означают фенильные группы, независимо n-замещенные группами, выбранными из низшего алкила, низшего алкокси и галогена.
7. Соединение по п.1, имеющее формулу (II)
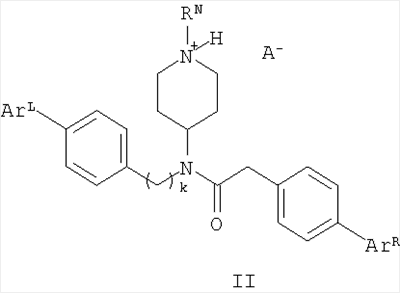
в которой
RN означает водород, С4-С6циклоалкильную группу, присоединенную либо через один из атомов углерода кольца, либо через присоединенную к кольцу низшую алкиленовую группу, или линейно-цепочечную или разветвленную низшую алкильную группу или низшую гидроксиалкильную группу, или низшую аминоалкильную группу, или фенил(низшую алкильную)группу, необязательно замещенную 1-2 заместителями, выбранными из низшего алкила, низшего алкокси, галогена и гидрокси, или гетероарил(низшую алкильную)группу, где гетероарил выбран из группы, состоящей из тиенила, замещенного низшей алкильной группой, имидазолила, и тиазолила, замещенного низшей алкильной группой;
ArL выбран из низшего алкила, низшего алкокси и галогена;
ArR выбран из низшего алкила, низшего алкокси и галогена;
k означает 1 или 2; и
А– означает анион или фармацевтически приемлемую кислоту.
8. Соединение по п.1, выбранное из группы, включающей
N-((4-метилфенил)метил)-N-(пиперидин-4-ил)-N’-фенилметилкарбамид;
N-((4-метилфенил)метил)-N-(1-(2-метилпропил)пиперидин-4-ил)-N’-фенилметилкарбамид;
N-(1-(циклогексилметил)пиперидин-4-ил)-Н-((4-метилфенил)метил)-N’-фенилметилкарбамид;
N-((4-метилфенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-(1-(3,3-диметилбутил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-(1-(циклогексилметил)пиперидин-4-ил)-N-((4-метилфенил)метил)-4-метоксифенилацетамид;
N-((4-метилфенил)метил)-N-(1-(2-метилпропил)пиперидин-4-ил)-4-метоксифенилацетамид;
N-(3-фенилпропил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-(2-фенилэтил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((2-метоксифенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((2-хлорфенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((3,4-диметоксифенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((4-фторфенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((2,4-дихлорфенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((3-метилфенил)метил-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((3-бромфенил)метил)-N-(пиперидин-4-ил)-4-метоксифенилацетамид;
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)фенилацетамид; и
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-3-фенилпропионамид.
9. Соединение по п.1, выбранное из группы, включающей
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-(фенилтио)ацетамид;
N-((4-метилфенил)метил)-N(1-пиперидин-4-ил)феноксиацетамид;
N-((4-метилфенил)метил)-N(1-пиперидин-4-ил)-(4-хлорфенокси)ацетамид;
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-3-метоксифенилацетамид;
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-4-фторфенилацетамид;
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-2,5-диметоксифенилацетамид;
N-((4-метилфенил)метил)-N-(1-пиперидин-4-ил)-4-хлорфенилацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-этилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-хлорбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-изопропилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-хлорбензил)-N-(пиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-хлорбензил)-N-(1-циклопентилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-хлорбензил)-N-(1-изопропилпиперидин-4-ил)ацетамид;
2-(фенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-фторфенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-трифторметилфенил)-N-(4-трифторметилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-фторфенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид; и
2-(фенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид.
10. Соединение по п.1, выбранное из группы, включающей
2-(4-трифторметилфенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-трифторметилфенил)-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-фенил-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-хлорфенил)-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-[4-(метоксикарбонил)бензил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(2-(4-фторфенил)этил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-[2-(2,5-диметоксифенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-[2-(2,4-дихлорфенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-[2-(3-хлорфенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-[2-(4-метоксифенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-[2-(3-фторфенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-этоксифенил)-N-[2-(4-фторфенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-этоксифенил)-N-(4-фторбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-изопропилпиперидин-4-ил)ацетамид;
2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-этилпиперидин-4-ил)ацетамид;
2-фенил-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-циклопентилпиперидин-4-ил)ацетамид; и
2-(4-фторфенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид.
11. Соединение по п.1, выбранное из группы, включающей
2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-(2-гидроксиэтил)пиперидин-4-ил)ацетамид;
2-(4-хлорфенил)-N-(4-метилбензил)-N-(1-циклобутилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-циклобутилпиперидин-4-ил)ацетамид;
N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)-N’-бензилкарбамид;
2-фенил-N-(4-метоксибензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-трифторметилфенил)-N-(4-метоксибензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-фторфенил)-N-(4-метоксибензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-метоксибензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метилфенил)-N-(4-хлорбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-гидроксифенил)-N-(1-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)-N’-(4-метоксибензил)карбамид;
2-(3,4-диметоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-трет-бутилпиперидин-4-ил)ацетамид;
N-(4-метилбензил)-N-(1-трет-бутилпиперидин-4-ил)-N’-(4-метоксибензил)карбамид;
2-(4-этоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-бутоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-изопропоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(3-фенил-1-пропил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-[2-(4-метоксифенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид; и
2-(4-метоксифенил)-N-[2-(4-нитрофенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид.
12. Соединение по п.1, выбранное из группы, включающей
2-(4-метоксифенил)-N-(4-метилбензил)-N-(1-циклопентилпиперидин-4-ил)ацетамид;
N-((4-(гидроксиметил)фенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-метоксифенил)ацетамид;
N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(3-гидроксил-4-метоксифенил)ацетамид;
N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(3,4-дигидроксифенил)ацетамид;
N-((3-гидрокси-4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-метоксифенил)ацетамид;
N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-бромфенил)ацетамид;
N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-иодфенил)ацетамид;
N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-(2-пропил)фенил)ацетамид;
N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-трифторметоксифенил)ацетамид;
N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-метилтиофенил)ацетамид;
N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-(N,N’-диметиламино)фенил)ацетамид;
N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-нитрофенил)ацетамид;
N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-метокси-3-метилфенил)ацетамид;
N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-метилфенил)ацетамид.
13. Соединение по п.1, выбранное из группы, включающей
N-(1-((2-бромфенил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид;
N-(1-((4-гидрокси-3-метоксифенил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид;
N-(1-((5-этилтиен-2-ил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид;
N-(1-(имидазол-2-илметил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид;
N-(1-((4-фторфенил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)-N’-фенилметилкарбамид;
N-((4-метилфенил)метил)-N-(1-((4-метилфенил)метил)пиперидин-4-ил)-4-метоксифенилацетамид;
N-(1-((4-гидроксифенил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)4-метоксифенилацетамид;
N-(1-((2-гидроксифенил)метил)пиперидин-4-ил)-N-((4-метилфенил)метил)4-метоксифенилацетамид;
N-(1-(фенилметил)пиперидин-4-ил)-N-(3-фенил-2-пропен-1-ил)-4-метоксифенилацетамид;
оксалат N-((4-метилфенил)метил)-N-(1-(фенилметил)пиперидин-4-ил)-N’-фенилметилкарбамида;
гидрохлорид N-((4-метилфенил)метил)-N-(1-(фенилметил)пиперидин-4-ил)-N-фенилметилкарбамида;
оксалат N-((4-метилфенил)метил)-N-(1-(фенилметил)пиперидин-4-ил)-4-метоксифенилацетамида;
гидрохлорид N-((4-метилфенил)метил)-N-(1-(фенилметил)пиперидин-4-ил)-4-метоксифенилацетамида;
N-((4-метилфенил)метил)-N-(1-(фенилметил)пиперидин-4-ил)-4-метоксифенилтиоацетамида; и
2-(4-метоксифенил)-N-(4-метилбензил)-N-[1-(2-метилтиазол-4-илметил)пиперидин-4-ил]ацетамид.
14. Соединение по п.1, выбранное из группы, включающей
2-(4-метоксифенил)-N-(4-метилбензил)-N-(8-метил-8-азабицикло[3.2.1]окт-3-ил)-ацетамид;
N-((4-метилфенил)метил)-N-(1-(фенилметил)пирролидин-3-ил)-N’-фенилметилкарбамид; и
N-((4-метилфенил)метил)-N-(1-(фенилметил)пирролидин-3-ил)-4-метоксифенилацетамид.
15. Соединение, выбранное из группы, включающей
2-(4-метоксифенил)-N-(4-метилбензил)-N-{1-[3-(1,3-дигидро-2Н-бензимидазол-2-он-1-ил)пропил]пиперидин-4-ил}ацетамид;
N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)-N’-фенилкарбамид;
N-фенэтил-N-(1-метилпиперидин-4-ил)-N’-бензилкарбамид;
N-фенилэтил-N-(1-метилпиперидин-4-ил)-N’-фенилкарбамид;
N-(3-фенилпропил)-N-(1-метилпиперидин-4-ил)-N’-бензилкарбамид;
N-(3-фенилпропил)-N-(1-метилпиперидин-4-ил)-N’-фенилкарбамид;
1-(4-метоксифенил)-N-(1-(4-метилбензил)-N-(1-метилпиперидин-4-ил)циклопропанкарбоксамид;
2-(4-метоксифенил)-N-(1-фенилэтил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(4-метилбензил)-N-(8-метил-8-азабицикло[3.2.1]октен-3-ил)-ацетамид;
2-фенил-2-этил-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(1-инданил)-N-(1-метилпиперидин-4-ил)ацетамид;
2-(3,4-метилендиоксифенил)-N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)ацетамид;
N-(4-метилбензил)-N-(1-метилпиперидин-4-ил)-N’-фенилэтилкарбамид; и
N-фенилэтил-N-(1-метилпиперидин-4-ил)-N’-фенилэтилкарбамид;
2-(4-метоксифенил)-N-[2-(2-тиенил)этил]-N-(1-метилпиперидин-4-ил)ацетамид;
2-(4-метоксифенил)-N-(2-тиенилметил)-N-(1-метилпиперидин-4-ил)ацетамид; и
2-(4-метоксифенил)-N-(фурфурил)-N-(1-метилпиперидин-4-ил)ацетамид.
16. Соединение формулы (I)

где Z означает

где
R означает водород, С4-С6циклоалкильную группу, присоединенную либо через один из атомов углерода кольца, либо через присоединенную к кольцу низшую алкиленовую группу, или линейно-цепочечную или разветвленную низшую алкильную группу или низшую гидроксиалкильную группу, или низшую аминоалкильную группу, или фенил(низшую алкильную)группу, необязательно замещенную одним или более заместителями, выбранными из низшего алкила, низшего алкокси, галогена и гидрокси, или гетероарил(низшую алкильную)группу, где гетероарил выбирают из группы, состоящей из тиенила, замещенного низшей алкильной группой, имидазолила, и тиазолила, замещенного низшей алкильной группой;
n означает 0 или 1; или
Z означает группу

где R означает низшую алкильную группу;
X1 означает метилен или NH группу; и
Х2 означает метилен; или
X1 означает метилен и Х2 означает метилен или связь; или
X1 означает метилен и Х2 означает О, S или связь;
Y1 означает метилен и Y2 означает метилен, винилен, этилен, или связь;
Ar1 означает незамещенный или замещенный фенил;
Ar2 означает незамещенный или замещенный фенил, незамещенный или замещенный тиенил, незамещенный или замещенный фурил, незамещенный или замещенный пиридил;
причем когда Ar1 и Ar2 замещены, то каждый Ar1 и Ar2 независимо замещены одним или более заместителями, выбранными из группы, состоящей из низшего алкила, низшего алкокси, гидрокси, низшего гидроксиалкила, галогена, ди- и тригалоалкила, ди- и тригалоалкокси, моно- и диалкиламино, алкилтио, сложного алкилового эфира и нитро; Ar1 и Ar2 имеют различные значения;
W означает кислород или серу; или
их фармацевтически приемлемые соли;
при условии, что
когда Z означает  , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает связь, Y1 означает метилен, Y2 означает метилен, и Ar1 означает 3,4-диметоксифенил, тогда Ar2 не может быть выбран из группы, содержащей: 3,4-дихлорфенил, 3-трифторметилфенил, 3,4,5-триметоксифенил, 3,5-бис(трет-бутил)-4-гидроксифенил, 4-бромфенил, бензо[b]тиофен-3-ил, 4-аминофенил, 4-трифторметилфенил и 1H-индол-3-ил; , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает связь, Y1 означает метилен, Y2 означает метилен, и Ar1 означает 3,4-диметоксифенил, тогда Ar2 не может быть выбран из группы, содержащей: 3,4-дихлорфенил, 3-трифторметилфенил, 3,4,5-триметоксифенил, 3,5-бис(трет-бутил)-4-гидроксифенил, 4-бромфенил, бензо[b]тиофен-3-ил, 4-аминофенил, 4-трифторметилфенил и 1H-индол-3-ил;
когда Z означает  , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает связь, Y1 означает метилен, Y2 означает связь, и Ar1 означает 2,6-дифторфенил, тогда Ar2 не может быть выбран из группы, содержащей: 3,4-дихлорфенил, 3-трифторметил фенил, 3,4,5-триметоксифенил, 3,5-бис(трет-бутил)-4-гидроксифенил, 4-бромфенил, бензо[b]тиофен-3-ил, 4-аминофенил, 4-трифторметилфенил и 1H-индол-3-ил; , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает связь, Y1 означает метилен, Y2 означает связь, и Ar1 означает 2,6-дифторфенил, тогда Ar2 не может быть выбран из группы, содержащей: 3,4-дихлорфенил, 3-трифторметил фенил, 3,4,5-триметоксифенил, 3,5-бис(трет-бутил)-4-гидроксифенил, 4-бромфенил, бензо[b]тиофен-3-ил, 4-аминофенил, 4-трифторметилфенил и 1H-индол-3-ил;
когда Z  , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает метилен, Y1 означает метилен, Y2 означает метилен, и Ar1 означает 3,4-диметоксифенил, тогда Ar2 не может означать 3,4-диметоксифенил; , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает метилен, Y1 означает метилен, Y2 означает метилен, и Ar1 означает 3,4-диметоксифенил, тогда Ar2 не может означать 3,4-диметоксифенил;
когда Z означает  , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает метилен, Y1 означает метилен, Y2 означает связь, и Ar1 означает 2,6-дифтофенил, тогда Ar2 не может означать 3,4-диметоксифенил; , R означает Н, n означает 1, W означает О, X1 означает метилен, Х2 означает метилен, Y1 означает метилен, Y2 означает связь, и Ar1 означает 2,6-дифтофенил, тогда Ar2 не может означать 3,4-диметоксифенил;
когда Z означает  , R означает Н, n означает 1, Х1 означает NH; Х2 означает метилен, Y1 означает метилен, Y2 означает метилен, Ar1 означает 3,4-диметоксифенил, и Ar2 означает фур-2-ил или нафтилен-1-ил, тогда W не может означать S; и , R означает Н, n означает 1, Х1 означает NH; Х2 означает метилен, Y1 означает метилен, Y2 означает метилен, Ar1 означает 3,4-диметоксифенил, и Ar2 означает фур-2-ил или нафтилен-1-ил, тогда W не может означать S; и
когда Z означает  , R означает Н, n означает 1, X1 означает NH; Х2 означает метилен, Y1 означает метилен, Y2 означает связь, Ar1 означает 2,6-дифторфенил, и Ar2 означает нафтилен-1-ил, тогда W не может означать S. , R означает Н, n означает 1, X1 означает NH; Х2 означает метилен, Y1 означает метилен, Y2 означает связь, Ar1 означает 2,6-дифторфенил, и Ar2 означает нафтилен-1-ил, тогда W не может означать S.
17. Соединение по п.16, в котором
Z означает  , n означает 0 или 1, и , n означает 0 или 1, и
R означает водород, С4-Сбциклоалкильную группу, присоединенную либо через один из атомов углерода кольца, либо через присоединенную к кольцу низшую алкиленовую группу, или линейно-цепочечную или разветвленную низшую алкильную группу или низшую гидроксиалкильную группу.
18. Соединение по п.17, в котором
Y1 означает метилен и Y2 означает связь, метилен, этилен или винилен; и
X1 означает метилен и Х2 означает связь, метилен, О или S; или
X1 означает NH и Х2 означает метилен.
19. Соединение по п.18 в котором
Z означает

и W означает кислород.
20. Соединение по п.19, в котором
Ar1 означает фенил, замещенный 1-2 заместителями, выбранными из низшего алкила, низшего алкокси, гидрокси, низшего гидроксиалкила, галогена, ди- и тригалоалкила, ди- и тригалоалкокси, моно- и диалкиламино, алкилтио, сложного алкилового эфира и нитро; и
Ar2 означает фенил, замещенный 1-2 заместителями, выбранными из низшего алкила, низшего алкокси, гидрокси, низшего гидроксиалкила, галогена, ди- и тригалоалкила, ди- и тригалоалкокси, моно- и диалкиламино, алкилтио, сложного алкилового эфира и нитро.
21. Соединение по п.20, в котором
R означает водород, С4-С6циклоалкильную группу, присоединенную либо через один из атомов углерода кольца, либо через присоединенную к кольцу низшую алкиленовую группу, или линейно-цепочечную или разветвленную низшую алкильную группу или низшую гидроксиалкильную группу, n означает 1;
Y1 означает метилен, Y2 означает связь, метилен, этилен или винилен;
X1 означает метилен и Х2 означает связь; или
X1 означает NH и Х2 означает метилен; и
Ar1 и Ar2 означают фенильные группы, независимо n-замещенные группами, выбранными из низшего алкила, низшего алкокси и галогена.
22. Соединение по п.16, имеющее формулу (II)
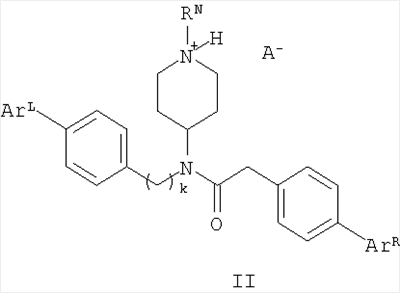
в которой
RN означает водород, С4-С6циклоалкильную группу, присоединенную либо через один из атомов углерода кольца, либо через присоединенную к кольцу низшую алкиленовую группу, или линейно-цепочечную или разветвленную низшую алкильную группу или низшую гидроксиалкильную группу, или низшую аминоалкильную группу, или фенил(низшую алкильную)группу, необязательно замещенную 1-2 заместителями, выбранными из низшего алкила, низшего алкокси, галогена и гидрокси, или гетероарил(низшую алкильную)группу, где гетероарил выбирают из группы, состоящей из тиенила, замещенного низшей алкильной группой, имидазолила, и тиазолила, замещенного низшей алкильной группой;
ArL выбран из низшего алкила, низшего алкокси и галогена;
ArR выбран из низшего алкила, низшего алкокси и галогена;
k означает 1 или 2; и
А– означает анион или фармацевтически приемлемую кислоту.
23. Фармацевтическая композиция, действующая на серотониновый рецептор, включающая эффективное количество одного или более соединений по п.1 или их фармацевтически приемлемую соль; и фармацевтически приемлемый разбавитель или наполнитель.
24. Фармацевтическая композиция для лечения болезненного состояния, ассоциированного с серотониновым рецептором, включающая эффективное количество одного или более соединений по п.2 или фармацевтически приемлемую соль указанного соединения; и фармацевтически приемлемый разбавитель или наполнитель.
25. Способ ингибирования активности моноаминового рецептора, включающий в себя приведение в контакт моноаминового рецептора или системы, содержащей моноаминовый рецептор, с эффективным для ингибирования активности моноаминового рецептора количеством одного или более соединений по п.1.
26. Способ по п.25, в котором моноаминовый рецептор представляет собой серотониновый рецептор.
27. Способ по п.26, в котором серотониновый рецептор относится к подклассу 5-НТ2А-рецепторов.
28. Способ по п.26, в котором серотониновый рецептор находится в центральной нервной системе или в периферической нервной системе.
29. Способ по п.26, в котором серотониновый рецептор находится в клетках крови или тромбоцитах.
30. Способ по п.26, в котором серотониновый рецептор мутирован или модифицирован.
31. Способ по п.25, в котором указанная активность представляет собой сигнальную активность.
32. Способ по п.25, в котором указанная активность представляет собой конститутивную активность.
33. Способ по п.25, в котором указанная активность связана с активацией серотонинового рецептора.
34. Способ ингибирования активации моноаминового рецептора, включающий в себя приведение в контакт моноаминового рецептора или системы, содержащей моноаминовый рецептор, с эффективным для ингибирования активации моноаминового рецептора количеством одного или более соединений по п.1.
35. Способ по п.34, в котором указанная активация осуществляется агонистическим агентом.
36. Способ по п.35, в котором указанный агонистический агент является экзогенным.
37. Способ по п.35, в котором указанный агонистический агент является эндогенным.
38. Способ по п.34, в котором указанная активация является конститутивной.
39. Способ по п.34, в котором моноаминовый рецептор представляет собой серотониновый рецептор.
40. Способ по п.39, в котором серотониновый рецептор относится к подклассу 5-НТ2А-рецепторов.
41. Способ по п.39, в котором серотониновый рецептор находится в центральной нервной системе или в периферической нервной системе.
42. Способ по п.39, в котором серотониновый рецептор находится в клетках крови или тромбоцитах.
43. Способ по п.39, в котором серотониновый рецептор мутирован или модифицирован.
44. Способ лечения болезненного состояния, связанного с серотониновым рецептором, включающий в себя введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества одного или более соединений по п.1.
45. Способ по п.44, в котором соединение по п.1 обеспечивает снижение побочных эффектов по сравнению с соединением, которое проявляет агонистическую, конкурентную антагонистическую, или обратную агонистическую активность в отношении множества подтипов монаминергических рецепторов.
46. Способ по п.45, в котором подтипы монаминергических рецепторов выбраны из серотонинергических, допаминергических, адренергических, мускариновых и гистаминергических рецепторов.
47. Способ по п.44, в котором болезненное состояние выбрано из группы, состоящей из шизофрении, психоза, мигрени, гипертензии, тромбоза, ангиоспазма, ишемии, депрессии, беспокойства, расстройства сна и расстройства аппетита.
48. Способ по п.44, в котором болезненное состояние связано с дисфункцией серотонинового рецептора.
49. Способ по п.44, в котором болезненное состояние связано с активацией серотонинового рецептора.
50. Способ по п.44, в котором болезненное состояние связано с повышенной активностью серотонинового рецептора.
51. Способ по п.44, в котором серотониновый рецептор относится к подклассу 5-НТ2А рецепторов.
52. Способ по п.44, в котором указанный серотониновый рецептор находится в центральной нервной системе или в периферической нервной системе.
53. Способ по п.44, в котором серотониновый рецептор находится в клетках крови или тромбоцитах.
54. Способ по п.44, в котором серотониновый рецептор мутирован или модифицирован.
55. Способ лечения шизофрении, включающий введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества одного или более соединений по п.1.
56. Способ лечения мигрени, включающий введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества одного или более соединений по п.1.
57. Способ лечения психоза, включающий введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества одного или более соединений по п.1.
58. Способ по п.57, в котором соединение по п.1 обеспечивает снижение экстрапирамидальных побочных эффектов по сравнению с антипсихотическим лекарственным средством, проявляющим антагонистическую активность в отношении допаминового D2 рецептора.
59. Соединение по п.1, в котором Z означает  , n означает 0 или 1, и R означает С4-Сбциклоалкильную группу, присоединенную либо через один из атомов углерода кольца, либо через присоединенную к кольцу низшую алкиленовую группу, или линейно-цепочечную или разветвленную низшую алкильную группу или низшую гидроксильную группу. , n означает 0 или 1, и R означает С4-Сбциклоалкильную группу, присоединенную либо через один из атомов углерода кольца, либо через присоединенную к кольцу низшую алкиленовую группу, или линейно-цепочечную или разветвленную низшую алкильную группу или низшую гидроксильную группу.
60. Соединение по п.1, в котором
Z означает

где
R означает линейно-цепочечную или разветвленную низшую алкильную группу;
n означает 1;
X1 означает NH и Х2 означает метилен;
Y1 означает метилен, Y2 означает связь, метилен, этилен или винилен;
W означает кислород; и
Ar1 и Ar2 означают незамещенные или замещенные фенильные группы.
61. Соединение по п.1, в котором
Z означает

где
R означает линейно-цепочечную или разветвленную низшую алкильную группу;
n означает 1;
X1 означает NH, и Х2 означает метилен;
Y1 означает метилен, Y2 означает связь;
W означает кислород; и
Ar1 и Ar2 означают незамещенные или замещенные фенильные группы.
62. Соединение по п.1, в котором
Z означает

где
R означает линейно-цепочечную или разветвленную низшую алкильную группу;
n означает 1;
X1 означает метилен, Х2 означает метилен; или
X1 означает метилен, Х2 означает связь;
Y1 означает метилен, Y2 означает метилен или связь;
W означает кислород; и
Ar1 и Ar2 означают незамещенные или замещенные фенильные группы.
63. Соединение по п.1, в котором
Z означает

где
R означает линейно-цепочечную или разветвленную низшую алкильную группу;
n означает 1;
X1 означает метилен, Х2 означает связь;
Y1 означает метилен, Y2 означает метилен или связь;
W означает кислород; и
Ar1 и Ar2 означают незамещенные или замещенные фенильные группы.
64. Соединение по п.1, выбранное из группы, содержащей
N-((4-метилфенил)метил)-N-(1-метилпиперидин-4-ил)-2-(4-пиридил)ацетамид; и
2-(2-тиенил)-N-(4-метилфенилметил)-N-(1-метилпиперидин-4-ил)ацетамид.
65. Соединение по п.16, в котором Z означает  , n означает 0 или 1, и R означает С4-С6циклоалкильную группу, присоединенную либо через один из атомов углерода кольца, либо через присоединенную к нему низшую алкиленовую группу, или линейно-цепочечную или разветвленную низшую алкильную группу или низшую гидроксильную группу. , n означает 0 или 1, и R означает С4-С6циклоалкильную группу, присоединенную либо через один из атомов углерода кольца, либо через присоединенную к нему низшую алкиленовую группу, или линейно-цепочечную или разветвленную низшую алкильную группу или низшую гидроксильную группу.
РИСУНКИ
|
|