|
|
(21), (22) Заявка: 2009111025/04, 27.03.2009
(24) Дата начала отсчета срока действия патента:
27.03.2009
(46) Опубликовано: 10.09.2010
(56) Список документов, цитированных в отчете о
поиске:
MARKT Patrick et al. Discovery of Novel CB2 Receptor Ligands by a Pharmacophore-Based Virtual Screening Workflow. Journal of Medicinal Chemistry, 2009, 52(2), 369-378. DEVANE William A. et al. Determination and characterization of a cannabinoid receptor in rat brain. Molecular Pharmacology, 1988, 34(5), 605-613. Lisa M. JOHANEK et al. CannabinoidAgonist, CP 55,940. Prevents Capsaicin-Induced Sensitization of Spinal Cord Dorsal Horn Neurons. J. Neurophysiol. 2005, т.93, с.989-997. Золотарев Ю.А. и др. Твердофазный изотопный обмен со спилловер-водородом в аминокислотах, пептидах и белках. Биоорганическая химия, 2005, т.31,  1, с.3-21. RU 2291147 C2, 10.01.2007. RU 98118226 A, 27.06.2000. 1, с.3-21. RU 2291147 C2, 10.01.2007. RU 98118226 A, 27.06.2000.
Адрес для переписки:
123182, Москва, пл. Акад. Курчатова, 2, ИМГ РАН, ПЛГ
|
(72) Автор(ы):
Шевченко Валерий Павлович (RU),
Мясоедов Николай Федорович (RU),
Нагаев Игорь Юлианович (RU),
Безуглов Владимир Виленович (RU)
(73) Патентообладатель(и):
Учреждение Российской академии наук Институт молекулярной генетики РАН (ИМГ РАН) (RU)
|
(54) РАВНОМЕРНО МЕЧЕННЫЙ ТРИТИЕМ 5-(1,1-ДИМЕТИЛГЕПТИЛ)-2-[5-ГИДРОКСИ-2-(3-ГИДРОКСИПРОПИЛ)ЦИКЛОГЕКСИЛ]ФЕНОЛ
(57) Реферат:
Изобретение относится к равномерномеченному тритием 5-(1,1-диметилгептил)-2-[5-гидрокси-2-(3-гидроксипропил)циклогексил]фенолу формулы I:
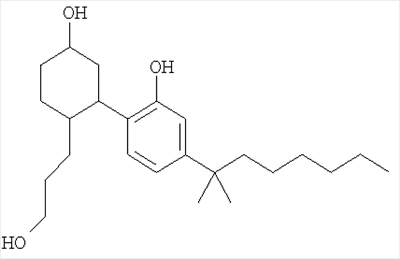
Данное соединение является аналогом 5-(1,1-диметилгептил)-2-[5-гидрокси-2-(3-гидроксипропил)циклогексил]фенола, который является селективным агонистом каннабиноидных рецепторов. 1 ил.
Изобретение относится к области органической химии и может найти применение в аналитической химии и биологических исследованиях.
При изучении физиологически активных соединений необходимы их равномерномеченые аналоги.
Известно, что замена атомов соединений на их меченые аналоги не приводит к изменению каких-либо свойств исходного соединения (Evans E.A. – Tritium and its compounds London Butterworths, 1974, р.48) [1].
Известен 5-(1,1-диметилгептил)-2-[5-гидрокси-2-(3-гидроксипропил)циклогексил]фенол формулы I:
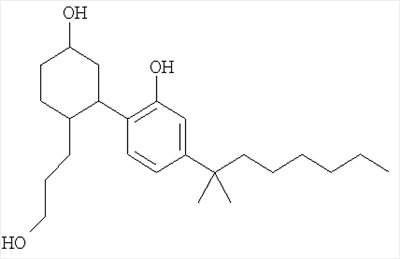
Данное соединение является одним из самых интенсивно изучаемых селективных агонистов каннабиноидных рецепторов (L.M.Johanek, D.A.Simone. Cannabinoid Agonist, CP 55,940, Prevents Capsaicin-Induced Sensitization of Spinal Cord Dorsal Horn Neurons. J Neurophysiol 93: 989-997, 2005. [2]).
Однако его равномерномеченный тритием аналог не описан.
Техническим результатом, достигаемым настоящим изобретением, является расширение ассортимента меченых аналогов физиологически активных соединений.
Достигается указанный технический результат получением равномерномеченного тритием 5-(1,1-диметилгептил)-2-[5-гидрокси-2-(3-гидроксипропил)циклогексил]фенола формулы I:
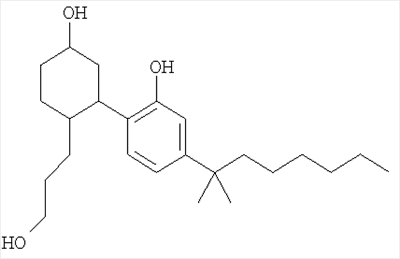
Ниже приведен пример реализации изобретения.
Пример I.
Раствор 2 мг 5-(1,1-диметилгептил)-2-[5-гидрокси-2-(3-гидроксипропил)циклогексил]-фенола в 0,2 мл диметилсульфоксида добавляли к 200 мг 5% Pd/BaSO4, диметилсульфоксид удаляли лиофилизацией. Остаток измельчали в ступке и вновь лиофилизировали. Сухую смесь переносили в реакционную ампулу. Затем ампулу вакуумировали до давления 0,1 Па, заполняли газообразным тритием до давления 400 гПа и выдерживали при температуре 180°С 15 мин. Избыток газообразного трития удаляли вакуумированием. Вещество с катализатора отделяли фильтрованием, экстракцию проводили метанолом (5×1 мл). Лабильный тритий удаляли несколько раз, растворяя вещество в метаноле (5×1 мл) и упаривая последний. Радиоактивность выделенной реакционной массы – около 1,4 Ки.
Анализ меченого препарата проводили на Милихроме А-02 колонка ProntoSIL-120-5-С18 AQ DВ-2003, 2,0×75 мм, 5 мкм, 0,2 мл/мин, 35°С, детекция – 210 нм, А – 0,2 М LiClO4 + 0,005 М HClO4 буфер, Б – метанол, градиент Б (75-100) за 12,5 мин, время удерживания – 4,33 мин. Для удаления продуктов деградации и полимеризации реакционную массу растворяли в 1 мл 70% метанола и сажали на патрон, упакованный SipC18 (SepPack). Патрон промывали последовательно 3 мл 90% метанола с уксусной кислотой (вымылось 260 мКи, где содержалось основное количество искомого соединения) и 4 мл метанола (вымылось 800 мКи), на патроне осталось около 300 мКи продуктов полимеризации. (75-100) за 12,5 мин, время удерживания – 4,33 мин. Для удаления продуктов деградации и полимеризации реакционную массу растворяли в 1 мл 70% метанола и сажали на патрон, упакованный SipC18 (SepPack). Патрон промывали последовательно 3 мл 90% метанола с уксусной кислотой (вымылось 260 мКи, где содержалось основное количество искомого соединения) и 4 мл метанола (вымылось 800 мКи), на патроне осталось около 300 мКи продуктов полимеризации.
Препаративную хроматографию проводили на колонке Kromasil 100С18, 8×150 мм, 7 мкм, система: 80% метанол-0,1% уксусная кислота, скорость потока – 2 мл/мин, время удерживания 5-(1,1-диметилгептил)-2-[5-гидрокси-2-(3-гидроксипропил)циклогексил]фенола – 8,08 мин (фиг.1).
После очистки методом ВЭЖХ радиохимическая чистота равномерномеченого препарата – 98%, выход – 20-25%, молярная радиоактивность – 70 Ки/ммоль. Таким образом, получено новое меченное тритием соединение.
Формула изобретения
Равномерно меченный тритием 5-(1,1-диметилгептил)-2-[5-гидрокси-2-(3-гидроксипропил)циклогексил]фенол формулы I
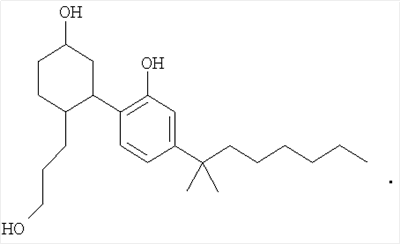
РИСУНКИ
|
|