Патент на изобретение №2397981
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ 5-(4-[4-(5-ЦИАНО-3-ИНДОЛИЛ)БУТИЛ]-1-ПИПЕРАЗИНИЛ)БЕНЗОФУРАН-2-КАРБОКСАМИДА
(57) Реферат:
Изобретение относится к способу получения 5-(4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил)бензофуран-2-карбоксамида и/или одной из его физиологически приемлемых солей, характеризующемуся тем, что соединение формулы (I)
в которой L представляет собой Cl, Br, I, SO2F, SO2CF3, SO2C2F5, вводят в реакцию с 3-(4-пиперазин-1-илбутил)индол-5-карбонитрилом путем катализируемого переходным металлом сочетания посредством комплексных соединений Pd, и/или тем, что образовавшийся 5-(4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил)бензофуран-2-карбоксамид превращают в одну из его солей присоединения кислоты при помощи обработки кислотой, и ко второму способу, характеризующемуся тем, что соединение формулы (II) как основание или соль НХ (где Х=Cl, Br) вводят в реакцию с 3-(4-оксобутил)-1Н-индол-5-карбонитрилом путем восстановительного аминирования, и/или тем, что 5-(4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил)бензофуран-2-карбоксамид превращают в одну из его солей присоединения кислоты при помощи обработки кислотой. Полученное соединение является агонистом 5-HT1A рецептора. 2 н. и 2 з.п. ф-лы.
Изобретение относится к способу получения 5-(4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил)бензофуран-2-карбоксамида и его физиологически приемлемых солей при помощи химиоселективного, катализируемого металлом сочетания предшественника 3-(4-пиперазин-1-илбутил)индол-5-карбонитрила с производными галогенированого бензофуран-2-карбоксамида. Кроме того, изобретение относится к способу получения 5-(4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил)бензофуран-2-карбоксамида и его физиологически приемлемых солей путем восстановительного аминирования 3-(4-оксобутил)-1Н-индол-5-карбонитрила с использованием 5-пиперазинилбензофуран-2-карбоксамида. До настоящего времени подход к получению основывался на сочетании активизированного 5-циано-3-бутилиндола с производными 5-пиперазинилбензофурана, как известно, например, из J. Med. Chem. (2004), 47(19), 4684-4692, Heinrich, Т.; Böettcher, H.; Gericke, R.; Bartoszyk, G.D.; Anzali, S.; Seyfried, C.A.; Greiner, H.E.; van Amsterdam, С. и J. Med. Chem. 2004, 47, 4677-4683, Heinrich, Т., Böettcher, H.Bartoszyk, G.D.Greiner, H.E.Seyfried, C.A., van Amsterdam, С. и процитированной в них литературы. Неожиданно исследования, как часть синтеза лекарств, описанные, например, в ЕР 0648767, показали, что 5-(4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил)-бензофуран-2-карбоксамид может быть получен с по крайней мере сопоставимым или более высоким общим выходом по сравнению с предыдущим уровнем техники, в которых важными преимуществами, что могут быть упомянуты, являются простота реакции, включающей меньшее количество стадий синтеза и, следовательно, более простое выделение продукта. Это, следовательно, также означает более низкие затраты растворителей и энергии. Таким образом, изобретение относится к способу получения 5-(4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил)бензофуран-2-карбоксамида и/или одной из его физиологически приемлемых солей, в котором соединение формулы I
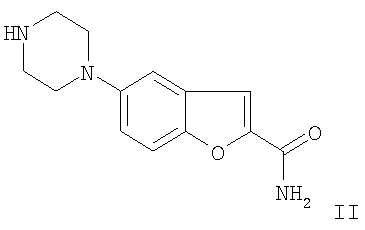
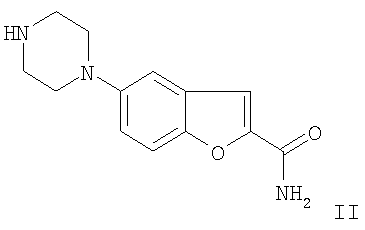
в которой L представляет собой Cl, Br, I, SO2F, SO2CF3, SO2C2F5, вводят в реакцию с 3-(4-пиперазин-1-илбутил)индол-5-карбонитрилом путем катализируемого переходным металлом сочетания посредством комплексных соединений Pd, и/или в котором образовавшийся 5-(4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил)бензофуран-2-карбоксамид превращают в одну из его солей присоединения кислоты при помощи обработки с кислотой (способ вариант а)). Предпочтительно используемый радикал L представляет собой бром. Таким образом, вышеупомянутый способ по варианту а) основан на катализируемом металлом сочетании пиперазина с производным 5-галоиндола, предпочтительно с производным 5-броминдола, в присутствии катализатора переходного металла с получением вышеупомянутого конечного продукта. По сравнению со способами, известными из предыдущего уровня техники, которые могли включать до 10 стадий, представленный вариант способа является значительно более коротким и, таким образом, также менее дорогим. Применяемыми катализаторами переходных металлов являются предпочтительно комплексные соединения Pd(0), такие как трис(дибензилиденацетон)дипалладий или аналогичные комплексные соединения в комбинации с фосфорными лигандами, такими как, например, Р(трет-Bu)3. Однако производные Pd2+, такие как, например, PdCl2 или Pd(OAc)2, также могут использоваться в качестве источника палладия. Способы получения 5-(1-пиперазинил)бензофуран-2-карбоксамида известны, например, из WO 01/40219 (Merck Patent GmbH), в которых используется катализатор переходного металла. Для катализируемого металлом сочетания, используются апротонные растворители, такие как толуол, ксилол, ТГФ или другие эфиры. Подходящие основания представляют собой алкоксиды щелочных металлов, предпочтительно трет-бутоксид натрия, или также карбонаты щелочных металлов. В зависимости от используемых условий реакции время реакции составляет от нескольких минут до 7 дней, температура реакции составляет от 0 до 150°С, предпочтительно от 20° до 120°С. Изобретение также относится к способу получения 5-(4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил)бензофуран-2-карбоксамида и/или одной из его физиологически приемлемых солей, в котором соединение формулы II
как основание или соль НХ (где Х=Cl, Br, сульфат или также органические противоионы, такие как, например, анион метансульфоновой кислоты (CH3SO3 Восстановительное аминирование (способ вариант b)) альдегидов представляет собой широко применяемый синтез аминов (см. Baxter, E.W.; Reitz, A.B. Organic Reactions 2002, 59, 1). В представленном способе сначала получают альдегид 3-(4-оксобутил)-1Н-индол-5-карбонитрил из 3-(4-гидроксибутил)-1Н-индол-5-карбонитрила. На последующей стадии альдегид сочетают с соединением формулы II с добавлением восстановителей, с получением 5-(4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил)бензофуран-2-карбоксамида в виде основания, которое может быть выделено, используя обычные лабораторные методы, или альтернативно основание преобразуют в моногидрохлорид (вилазодон) в растворе или в виде твердого вещества после обработки с кислотами, такими как, например, соляная кислота. Таким образом, становится возможной замена стадии алкилирования 3-(4-хлорбутил)индол-5-карбонитриловым реагентом, как описано в J. Med. Chem. (2004), 47 (19), 4684-4692, Heinrich, Т.; Böettcher, H.; Gericke, R.; Bartoszyk, G.D.; Anzali, S.; Seyfried, C.A.; Greiner, H.E.; van Amsterdam, С. и процитированной в ней литературе, восстановительным аминированием с использованием (3-(4-оксобутил)-1Н-индол-5-карбонитрила). Подходящие растворители представляют собой спирты, предпочтительно метанол, а также эфиры, углеводороды или другие растворители, которые растворяют исходные материалы до адекватной степени. В зависимости от используемых условий реакции время реакции составляет от нескольких минут до 7 дней, температура реакции составляет от 0 до 150°С, предпочтительно от 0 до 30°С. В следующих примерах “обычная лабораторная обработка” означает следующую процедуру: при необходимости добавляют воду, при необходимости устанавливают значение рН от 2 до 10, в зависимости от строения конечного продукта, смесь экстрагируют при помощи этилацетата или дихлорметана, фазы разделяют, органическую фазу высушивают над сульфатом натрия и упаривают, а продукт очищают с применением хроматографии на силикагеле и/или кристаллизацией. Основание 5-(4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил)бензофуран-2-карбоксамид может быть преобразовано в соль присоединения кислоты с использованием кислоты, например, путем приведения в реакцию эквивалентных количеств основания и кислоты в инертном растворителе, таком как этиловый спирт, с последующим упариванием. Подходящими кислотами для этой реакции, в частности, являются те, которые приводят к получению физиологически приемлемых солей. Таким образом, возможно использовать минеральные кислоты, например серную кислоту, азотную кислоту, галогенводородные кислоты, такие как HCl или HBr, фосфорные кислоты, такую как ортофосфорная кислота, сульфаминовую кислоту, кроме того органические кислоты, в особенности алифатические, алициклические, аралифатические, ароматические или гетероциклические моно- или полиосновные карбоновые, сульфоновые или серные кислоты. Катализируемое металлами аминирование (способ вариант а)) Пример 1. В атмосфере защитного газа 80 мг трис(дибензилиденацетон)дипалладия и 65 мг трис-трет-бутилфосфина вводят в 70 мл диметилового эфира диэтиленгликоля при 20°С с перемешиванием. Далее добавляют 1,5 г 5-бромбензофуран-2-карбоксамида и 2,5 г 3-(4-пиперазин-1-илбутил)индол-5-карбонитрила. При следующем добавлении 2,3 г трет-бутоксида натрия формируется желто-серая суспензия. Реакционную смесь нагревают при 120°С в течение 48 часов, после этого ее охлаждают до комнатной температуры (около 23°С), обрабатывают с применением обычных лабораторных методов и выделяют целевое соединение в виде основания вилазодона или в виде моногидрохлорида (вилазодон – 5-{4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил}бензофуран-2-карбоксамида гидрохлорид) после обработки растворенного основания водным раствором соляной кислоты. Идентичность целевого соединения была подтверждена при помощи хроматографического сравнения с материалом образца. Восстановительное аминирование (способ вариант b)) Пример 2. Предшественник 3-(4-оксобутил)-1Н-индол-5-карбонитрил 18 г 3-(4-гидроксибутил)-1Н-индол-5-карбонитрила и 34 мл триэтиламина растворяют в 300 мл дихлорметана и охлаждают до около 0°С на лед/метанольной бане. После этого дозировано вводят раствор 39 г комплексного соединения триоксида серы / пиридина и 140 мл диметилсульфоксида при температуре от 2 до 5°С. Смесь перемешивают при температуре от 2 до 3°С в течение еще приблизительно 20 мин, после этого реакционный раствор нагревают до 22-23°С (комнатная температура) в течение 2 часов. Реакционную смесь разбавляют добавлением еще 200 мл дихлорметана и затем экстрагируют с водой, 10%-ным раствором лимонной кислоты и 10%-ным раствором хлористого натрия. Органическую фазу концентрируют до масляного остатка в вакууме, затем хроматографируют на силикагеле с использованием смеси дихлорметана и МТВ эфира. Сравнительные Н-ЯМР и MS подтверждают идентичность. Получение 5-{4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил}бензофуран-2-карбоксамида гидрохлорида При 20°С 1,7 г 5-(1-пиперазинил)бензофуран-2-карбоксамида и 1,1 г цианоборогидрида натрия растворяют в 200 мл метанола при перемешивании. Раствор 2,4 г 3-(4-оксобутил)-1Н-индол-5-карбонитрила и 50 мл метанола добавляют в течение 15 мин при указанной температуре. Реакционную смесь перемешивают при 20°С в течение приблизительно 18 часов, затем охлаждают до 10°С в течение 6 часов. Осажденный твердый продукт отделяют, промывают метанолом и водой, высушивают в вакууме. Твердый остаток растворяют в тетрагидрофуране при 20°С с перемешиванием и отфильтровывают. Водный 1 н. HCl добавляют к фильтрату. Реакционную смесь далее перемешивают при 20°С, после этого осажденный твердый продукт отфильтровывают. Остаток на фильтре промывают при помощи ТГФ и воды и термически высушивают в вакууме. Согласно хроматографическому сравнению с материалом образца полученное целевое соединение представляет собой вилазодон (5-{4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил}бензофуран-2-карбоксамида гидрохлорид).
Формула изобретения
1. Способ получения 5-(4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил)-бензофуран-2-карбоксамида и/или одной из его физиологически приемлемых солей, отличающийся тем, что соединение формулы I 2. Способ по п.1, отличающийся тем, что L в соединении формулы I представляет собой бром. 3. Способ по п.1 и/или 2, отличающийся тем, что используемая система катализатора переходного металла представляет собой трис(дибензилиденацетон)-дипалладий или аналогичные комплексные соединения Pd (0). 4. Способ получения 5-(4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил)бензофуран-2-карбоксамида и/или одной из его физиологически приемлемых солей, отличающийся тем, что соединение формулы II
|
||||||||||||||||||||||||||

 11
11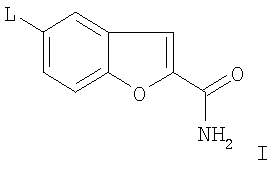
 –)), вводят в реакцию с 3-(4-оксобутил)-1Н-индол-5-карбонитрилом путем восстановительного аминирования, и/или в котором образовавшийся 5-(4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил)бензофуран-2-карбоксамид превращают в одну из его солей присоединения кислоты при помощи обработки с кислотой (способ вариант b)).
–)), вводят в реакцию с 3-(4-оксобутил)-1Н-индол-5-карбонитрилом путем восстановительного аминирования, и/или в котором образовавшийся 5-(4-[4-(5-циано-3-индолил)бутил]-1-пиперазинил)бензофуран-2-карбоксамид превращают в одну из его солей присоединения кислоты при помощи обработки с кислотой (способ вариант b)).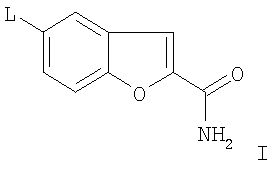 ,
,