|
|
(21), (22) Заявка: 2007128815/15, 26.12.2005
(24) Дата начала отсчета срока действия патента:
26.12.2005
(30) Конвенционный приоритет:
27.12.2004 US US60/638,388
24.03.2005 JP 2005-085968
(43) Дата публикации заявки: 10.02.2009
(46) Опубликовано: 27.08.2010
(56) Список документов, цитированных в отчете о
поиске:
JP 2004-175796 A, 24.06.2004. ЕР 1552825 А1, 13.07.2005.
(85) Дата перевода заявки PCT на национальную фазу:
27.07.2007
(86) Заявка PCT:
JP 2005/023771 20051226
(87) Публикация PCT:
WO 2006/070735 20060706
Адрес для переписки:
129090, Москва, ул.Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, А.В.Мицу
|
(72) Автор(ы):
УМЕДЗИМА Хироюки (JP),
ОХИ Хироси (JP),
САИТО Кацуми (JP),
ТАКЕТАНИ Юко (JP)
(73) Патентообладатель(и):
АСТЕЛЛАС ФАРМА ИНК. (JP)
|
(54) СТАБИЛЬНАЯ, СОСТОЯЩАЯ ИЗ ЧАСТИЦ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СОЛИФЕНАЦИН ИЛИ ЕГО СОЛЬ
(57) Реферат:
Настоящее изобретение относится к химико-фармацевтической промышленности и касается стабильной, состоящей из частиц фармацевтической композиции солифенацина или его соли, которую можно получить при использовании связующего вещества с Тпл. ниже 174°С, которая имеет сферическую форму, подходящую для нанесения покрытия, и в которой можно ингибировать разложение с течением времени, при предоставлении фармацевтического препарата солифенацина или его соли для клинического использования. Более конкретно, оно относится к состоящей из частиц фармацевтической композиции, при включении состоящей из частиц фармацевтической композиции солифенацина в состав фармацевтического препарата. Кроме того, при проведении способствующей кристаллизации обработки после получения состоящей из частиц фармацевтической композиции можно получить более стабильную, состоящую из частиц фармацевтическую композицию солифенацина или его соли. 4 н. и 14 з.п. ф-лы, 3 табл., 3 ил.
Область техники, к которой относится изобретение
Настоящее изобретение относится к стабильной, состоящей из частиц фармацевтической композиции, полученной с использованием солифенацина или его соли, и определенного связующего вещества, способу получения данной композиции, таблетке, распадающейся в щечной полости, которая содержит состоящую из частиц фармацевтическую композицию, и способу стабилизации данной состоящей из частиц фармацевтической композиции.
Предпосылки к созданию изобретения
Солифенацин изображается следующей формулой (I):
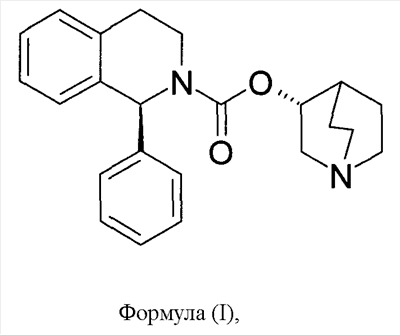
а его химическое название представляет собой (1R,3’R)-3′-хинуклидинил-1-фенил-1,2,3,4-тетрагидро-2-изохинолинкарбоксилат.
Сообщалось, что ряд производных хинуклидина, включая солифенацин и его соли, обладают высоким селективным антагонизмом по отношению к мускариновому М3 рецептору и применимы в качестве профилактического/терапевтического агента при урологических заболеваниях, таких как нервная поллакиурия, неврогенная дисфункция мочевого пузыря, никтурия, синдром гиперактивного мочевого пузыря, спазмы мочевого пузыря и хронический цистит, или респираторных заболеваниях, таких как хронические обструктивные заболевания легких, хронический бронхит, астма и ринит (смотри патентный документ 1).
В примере 8 патентного документа 1 описан способ получения гидрохлорида солифенацина и сообщается, что кристалл, выросший из смеси растворителей, состоящей из ацетонитрила и диэтилового эфира, имел температуру плавления от 212 до 214°С и проявлял удельное вращение [ ]25 ]25 D, равное 98,1 (с=1,00, EtOH). D, равное 98,1 (с=1,00, EtOH).
Однако в патентном документе 1 нет описания, или даже указания на аморфную форму солифенацина или его соли, или на то, что при получении фармацевтического препарата из сукцината солифенацина стандартным способом получения препаратов сукцинат солифенацина, являющийся активным ингредиентом, существенно разлагается с течением времени в полученной фармацевтической композиции.
В непатентном документе 1, изданном Министерством здравоохранения, труда и благосостояния в июне 2003 года, приведены стандартные правила для фармацевтических препаратов, то есть описаны концепции разложения продуктов (примесей) в фармацевтических препаратах, допустимые в тесте на стабильность. Согласно данному документу в том случае, когда количество лекарственного вещества, которое нужно вводить в день, составляет менее 10 мг, пороговая величина, для которой необходимо подтверждение безопасности продуктов разложения в фармацевтическом препарате, меньше 1% из расчета на процентную долю продуктов разложения, содержащихся в лекарственном веществе, и 50 мкг из расчета на общий прием продуктов разложения в день. В том случае, когда количество лекарственного вещества, которое нужно вводить в день, составляет 10 мг или более и 100 мг или менее, пороговая величина, для которой необходимо подтверждение безопасности продуктов разложения в фармацевтическом препарате, меньше 0,5% из расчета на процентную долю продуктов разложения, содержащихся в лекарственном веществе, и 200 мкг из расчета на общий прием продуктов разложения в день. Следовательно, в целом стандартная величина количества продуктов разложения, которую можно установить без подтверждения безопасности продуктов разложения, составляет, например, в случае фармацевтической композиции, в которой содержание лекарственного вещества составляет 5 мг, 1%, или менее, из расчета на процентное содержание продуктов разложения, содержащихся в лекарственном веществе, и, например, в случае фармацевтического препарата, в котором содержание лекарственного вещества составляет 10 мг, 0,5% или менее, из расчета на процентное содержание продуктов разложения, содержащихся в лекарственном веществе.
В настоящее время содержащие солифенацин фармацевтические препараты, которые собираются пустить в продажу на основании результатов текущих клинических испытаний, представляют собой таблетку 2,5 мг, таблетку 5 мг и таблетку 10 мг. Для того чтобы подобные фармацевтические препараты обладали стабильностью, описанной в непатентном документе 1, считается, что количество основного продукта разложения сукцината солифенацина (в дальнейшем называемого F1), по отношению к общему количеству сукцината солифенацина и продуктам разложения, должно составлять 0,5%, или менее, и более предпочтительно, необходимо контролировать его на уровне 0,4%, или менее, включая различия и ошибки в ряду большого числа продуктов и во время тестирования.
С другой стороны, известно, что солифенацин и его соль обладают очень высокой растворимостью в различных растворителях и очень сильным горьким и терпким вкусом. Поэтому для разработки фармацевтического препарата с высокой пригодностью, такого как частица, или порошок солифенацина или его соли, содержащиеся в таблетке, которая распадается в щечной полости, требуется скрыть эту горечь и терпкость. Таким образом, необходимо применять способ нанесения пленочного покрытия с использованием полимерного субстрата. Конкретнее, в случае, когда лекарственное вещество покрыто пленкой полимерного субстрата, необходимо равномерно покрыть поверхность лекарственного вещества. Таким образом, данное лекарственное вещество должно представлять собой мелкие частицы сферической формы с одинаковым размером частиц.
[Патентный документ 1] ЕР патент  801067 801067
[Непатентный документ 1] PFSB/ELD сообщение  0624001 «Пересмотр правил, касающихся примесей в продуктах медицинского использования с новыми активными ингредиентами» 0624001 «Пересмотр правил, касающихся примесей в продуктах медицинского использования с новыми активными ингредиентами»
Раскрытие изобретения
Задачи, которые предстоит решить при помощи данного изобретения
Как описано выше, имелась необходимость в стабильной, состоящей из частиц фармацевтической композиции солифенацина или его соли, которая имеет сферическую форму, подходящую для нанесения пленочного покрытия, и в которой можно замедлить разложение с течением времени при предоставлении фармацевтического препарата солифенацина или его соли для клинического использования.
Способы решения данных задач
При разработке сукцината солифенацина в качестве прекрасного терапевтического агента для лечения учащенного мочеиспускания или недержания мочи авторы настоящего изобретения наносили на лекарственные вещества покрытие из стандартного связующего вещества (поливинилпирролидона, в дальнейшем сокращенно ПВП (PVP)), или гидроксипропилметилцеллюлозы (в дальнейшем сокращенно ГПМЦ (HPMC)), что обычно проводится специалистом в данной области техники при помощи способа гранулирования в псевдоожиженном слое, или тому подобного, и проводили для полученных фармацевтических препаратов предварительный тест на стабильность в течение 2 месяцев в условиях ускоренного тестирования (условия при 40°С, 75%-ной RH (относительной влажности) и в герметически закрытом сосуде), который представляет собой один из стандартных тестов на стабильность. В результате наблюдали снижение остаточного соотношения сукцината солифенацина и было показано, что спустя 6 месяцев после начала хранения, которые являлись временем конечного определения в ускоренном тесте, соотношение количества образовавшегося F1 (окисленной формы сукцината солифенацина) и общего количества сукцината солифенацина и продуктов разложения превысило 0,4% (по поводу подробностей см. таблицу 1 ниже). Было найдено, что при помощи подобного стандартного способа составления препаратов трудно получить фармацевтический препарат, обладающий фармацевтически достаточной стабильностью.
При данном уровне техники авторы настоящего изобретения провели интенсивные исследования, направленные на стабилизацию фармацевтического препарата солифенацина, и в результате ими неожиданно было обнаружено, что основной причиной разложения активного ингредиента с течением времени является солифенацин в аморфной форме, образующийся в процессе производства фармацевтического препарата, и что использование такого стандартного связующего вещества, как ГПМЦ, в значительной степени связано с образованием данной аморфной формы солифенацина.
Для получения гранулированного вещества, в котором горечь и терпкость солифенацина скрыты, автор настоящего изобретения счел эффективным способ, в котором мелкую частицу (состоящую из частиц фармацевтическую композицию) получают путем распыления раствора лекарственного вещества на ядро частицы, состоящей, например, из кристаллической целлюлозы, и покрывают эту мелкую частицу пленкой из соответствующего полимерного вещества. Для получения подобной мелкой частицы необходимо проводить распыление сразу после растворения солифенацина или его соли, однако было найдено, что солифенацин склонен переходить при этом в аморфное состояние и, кроме того, возникает проблема, характерная для солифенацина, которая заключается в том, что при его переходе из аморфной формы в кристаллическую форму образуются продукты разложения. То есть в том случае, когда состоящую из частиц фармацевтическую композицию получают после растворения части, или всего солифенацина в растворителе, было найдено, что крайне сложно гарантировать стабильность солифенацина.
В данных обстоятельствах авторы настоящего изобретения сначала обнаружили, что при использовании в качестве связующего вещества соединения, содержащего этиленоксидную цепочку, такого как полиэтиленгликоль (другое название: макрогол, в дальнейшем иногда сокращенно ПЭГ (PEG)), неожиданно получают фармацевтический препарат, в котором можно замедлить разложение солифенацина с течением времени за счет ингибирования сохранения аморфной формы солифенацина, хотя сам по себе ПЭГ является соединением, которое обычно используют в целях перевода лекарственного вещества в аморфную форму.
Кроме того, при разработке и получении стабильной, состоящей из частиц фармацевтической композиции солифенацина или его соли, подходящей для нанесения пленочного покрытия, авторы настоящего изобретения пришли к заключению, что, например, в случае, когда растворенный солифенацин распыляют на ядро частицы вместе с полимерным веществом (связующим веществом), таким как ПЭГ, способность солифенацина сохранять или не сохранять аморфную форму после распыления может зависеть от текучести солифенацина в данном полимерном веществе (связующем веществе). Поэтому авторами были проведены интенсивные исследования и обращено внимание на физические величины (температура стеклования (в дальнейшем сокращенно Tg), или температура плавления (в дальнейшем сокращенно т.пл.)), характерные для полимера, которые могут влиять на текучесть лекарственного вещества в том, что касается связующего вещества, предназначенного для использования при распылении на частицы ядра. В результате авторами было обнаружено, что при использовании для состоящей из частиц фармацевтической композиции связующего вещества с высокой Tg, начальное значение для родственного соединения, которое становится индексом разложения, было низким, однако, что касается последующей стабильности, оно было нестабильным. С другой стороны, при использовании для состоящей из частиц фармацевтической композиции определенного связующего вещества с Тg, меньшей, чем заданное значение, авторы неожиданно обнаружили, что и начальное значение для родственного соединения, и значение для родственного соединения, полученное впоследствии, были небольшими и стабильными и, более того, частицы были одинакового размера и сферическими, что подходит для нанесения пленочного покрытия.
Кроме того, в результате интенсивных исследований авторами найдено, что при проведении обработки, способствующей кристаллизации, такой как обработка увлажнением и высушиванием, получается более стабильная, состоящая из частиц фармацевтическая композиция, таким образом, настоящее изобретение было завершено.
То есть настоящее изобретение относится к:
1. Стабильной, состоящей из частиц фармацевтической композиции, содержащей солифенацин или его соль, и связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль;
2. Фармацевтической композиции в соответствии с изложенным выше в абзаце 1, в которой связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, представляет собой связующее вещество, обладающее способностью ингибировать сохранение аморфной формы солифенацина или его соли;
3. Фармацевтической композиции в соответствии с изложенным выше в абзаце 1 или 2, характеризующейся тем, что связующее вещество представляет собой связующее вещество с температурой стеклования или температурой плавления ниже 174°С;
4. Фармацевтической композиции в соответствии с изложенным выше в абзаце 3, в которой связующее вещество представляет собой одно или более соединений, выбранных из группы, включающей в себя полиэтиленгликоль, полиэтиленоксид, блоксополимер полиоксиэтилена/полиоксипропилена, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, этилцеллюлозу, сополимер L метакриловой кислоты, сополимер LD метакриловой кислоты, сополимер S метакриловой кислоты, кукурузный крахиал, сополимер Е аминоалкилметакрилата, сополимер RS аминоалкилметакрилата и мальтозу;
5. Фармацевтической композиции в соответствии с изложенным выше в абзаце 3, в которой связующее вещество представляет собой одно или более соединений, выбранных из группы, включающей в себя полиэтиленгликоль, блоксополимер полиоксиэтилена/полиоксипропилена, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу и мальтозу;
6. Фармацевтической композиции в соответствии с изложенным выше в абзаце 3, в которой связующее вещество представляет собой одно или более соединений, выбранных из группы, включающей в себя полиэтиленгликоль, блоксополимер полиоксиэтилена/полиоксипропилена и гидроксипропилцеллюлозу;
7. Стабильной, состоящей из частиц фармацевтической композиции, содержащей солифенацин или его соль, которую можно получить при использовании смеси, в которой солифенацин или его соль, и связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, растворены и/или суспендированы вместе;
8. Фармацевтической композиции в соответствии с изложенным выше в абзаце 7, в которой связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, представляет собой связующее вещество, обладающее способностью ингибировать сохранение аморфной формы солифенацина или его соли;
9. Фармацевтической композиции в соответствии с изложенным выше в абзаце 7 или 8, характеризующейся тем, что связующее вещество представляет собой связующее вещество с температурой стеклования или температурой плавления ниже 174°С;
10. Фармацевтической композиции в соответствии с изложенным выше в абзаце 9, в которой связующее вещество представляет собой одно или более соединений, выбранных из группы, включающей в себя полиэтиленгликоль, полиэтиленоксид, блоксополимер полиоксиэтилена/полиоксипропилена, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, этилцеллюлозу, сополимер L метакриловой кислоты, сополимер LD метакриловой кислоты, сополимер S метакриловой кислоты, кукурузный крахмал, сополимер Е аминоалкилметакрилата, сополимер RS аминоалкилметакрилата и мальтозу;
11. Фармацевтической композиции в соответствии с изложенным выше в абзаце 9, в которой связующее вещество представляет собой одно или более соединений, выбранных из группы, включающей в себя полиэтиленгликоль, блоксополимер полиоксиэтилена/полиоксипропилена, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу и мальтозу;
12. Фармацевтической композиции в соответствии с изложенным выше в абзаце 9, в которой связующее вещество представляет собой одно или более соединений, выбранных из группы, включающей в себя полиэтиленгликоль, блоксополимер полиоксиэтилена/полиоксипропилена и гидроксипропилцеллюлозу;
13. Фармацевтической композиции в соответствии с изложенным выше в любом из абзацев 1-12, стабильность которой повышена посредством дополнительного проведения обработки, способствующей кристаллизации; и
14. Таблетке, распадающейся в щечной полости, которая содержит фармацевтическую композицию в соответствии с изложенным выше в любом из абзацев 1-13.
В целом, в качестве индекса текучести во многих случаях используют термодинамические параметры, характерные для вещества, такие как температура стеклования (Tg, единицы: °С), или температура размягчения (единицы: °С), основанные на аморфной области полимера, и температура плавления (т.пл., единицы: °С), основанные на кристаллической области полимера. Данные величины обозначают температуру, показывающую изменение в термодинамическом состоянии вещества, однако, поскольку молекулярное движение подавляется при температуре ниже Tg, вещество находится в состоянии, близком к кристаллическому состоянию, или стеклообразному состоянию, в результате чего пластичность должна снизиться. Однако когда температура вещества составляет Tg или выше, степень активности молекулы возрастает, вследствие чего вещество находится в резиноподобном состоянии и пластичность повышается. Кроме того, состояние, в котором при повышении температуры кристаллическая область полимера разрушается, приводя к появлению пластичности, означает плавление данного полимера. Принимая это во внимание, в случае, когда лекарственное вещество, находящееся в аморфном состоянии, существует в полимере при определенной температуре, то чем выше Tg полимера, тем сложнее самому полимеру проявлять текучесть. Следовательно, оно должно быть в аморфной форме, которая находится в первоначальном состоянии, а с другой стороны, это означает, что чем ниже Tg полимера, тем быстрее выпадет кристалл (Int. J. Pharm. 282 (2004) 151-162). С другой стороны, что касается низкомолекулярного соединения, поскольку структура соединения кристаллическая, то во многих случаях у него нет Tg, поэтому в качестве параметра, показывающего изменение в термической подвижности, для низкомолекулярного соединения в качестве индекса использовали температуру плавления. Что касается полимера, использовали Tg, которая представляет собой температуру, при которой изменение проявляется быстрее.
Кроме того, изобретение относится к:
15. Способу стабилизации солифенацина или его соли, предусматривающему осуществление обработки фармацевтической композиции, содержащей солифенацин или его соль и связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, где указанная обработка способствует кристаллизации; и
16. Способу перевода аморфной формы солифенацина или его соли в его кристаллическую форму, предусматривающему осуществление обработки стабильной, состоящей из частиц фармацевтической композиции, содержащей солифенацин или его соль и связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, где указанная обработка способствует кристаллизации.
Далее композиция настоящего изобретения будет описана подробно.
Примеры «соли солифенацина», предназначенного для использования в настоящем изобретении, включают в себя гидрохлорид солифенацина, описанный в патентном документе 1, соли присоединения кислоты с минеральными кислотами, такими как бромистоводородная кислота, йодистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота, или с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, лимонная кислота, винная кислота, угольная кислота, пикриновая кислота, метансульфокислота, этансульфоновая кислота и глутаминовая кислота, и четвертичные аммониевые соли. Из их числа предпочтителен сукцинат солифенацина, принимая во внимание то, что он поставляется в виде фармацевтического продукта.
«Солифенацин или его соль», предназначенные для использования в настоящем изобретении, можно легко получить при помощи, или в соответствии с методами, описанными в патентном документе 1, или стандартным способом.
«Кристалл», или «кристаллическая форма» солифенацина или его соли обозначает буквальную интерпретацию соединения солифенацина или его соли, имеющих кристаллографически кристаллическую структуру. Однако в настоящем изобретении это означает вещество, отличающееся от «аморфной формы», в которой проявляется значительная разложимость солифенацина с течением времени при содержании в количестве в пределах интервала, не влияющем на стабильность продукта в фармацевтическом препарате. С другой стороны, «аморфность» или «аморфная форма» солифенацина или его соли в настоящем изобретении означает вещество, имеющее кристаллографически аморфную структуру. Однако в настоящем изобретении это означает вещество, отличающееся от «кристалла», или «кристаллической формы», проявляющее крайне малую разложимость солифенацина с течением времени, которое содержится в количестве в пределах интервала, не влияющем на стабильность продукта в фармацевтическом препарате.
Количество смешения солифенацина или его соли, предназначенное для использования в настоящем изобретении, обычно выбирают подходящим образом, согласно типу лекарственного вещества или его медицинскому использованию (показанию), однако оно особенно не ограничено до тех пор, пока оно представляет собой терапевтически эффективное количество или профилактически эффективное количество. Конкретно, оно составляет от 0,01 мг до 100 мг, предпочтительно, от 0,5 мг до 50 мг, более предпочтительно, от 0,5 мг до 10 мг, и наиболее предпочтительно, от 0,5 мг до 4 мг из расчета на дневное количество солифенацина или его соли.
Кроме того, количество смешанного солифенацина или его соли с распадающейся в щечной полости таблеткой по настоящему изобретению может быть любым в пределах содержания эффективного количества на единицу введения фармацевтического препарата, однако оно предпочтительно составляет от 0,001 масс.% до 97 масс.%, более предпочтительно, от 0,05 масс.% до 50 масс.%, еще более предпочтительно, от 0,05 масс.% до 10 масс.%, и наиболее предпочтительно, от 0,05 масс.% до 4 масс.%.
«Связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль», предназначенное для использования в настоящем изобретении, означает связующее вещество, которое способно замедлять разложение солифенацина или его соли, с течением времени, а конкретно означает связующее вещество, которое способно замедлять разложение солифенацина или его соли, с течением времени за счет ингибирования сохранения аморфной формы. Кроме того, в том случае, когда связующее вещество, не обладающее стабилизирующим действием на солифенацин или его соль, само по себе, например, даже такое связующее вещество, как ГПМЦ, или ПВП, используют вместе со связующим веществом, предназначенным для использования в настоящем изобретении в целях повышения действия в качестве связующего вещества, его можно использовать в количестве, которое находится в пределах интервала, не превышающем стандартные правила стабильности фармацевтического препарата, который является предметом настоящего изобретения.
«Ингибирующее действие в отношении сохранения аморфной формы», как использовано в настоящем изобретении, относится к действию, которое затрудняет существование вещества в аморфном состоянии и/или действие, которое способно облегчить переход вещества из аморфной формы в кристаллическую форму.
Кроме того, связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, или ингибирующее действие на сохранение аморфной формы, предназначенное для использования в настоящем изобретении, представляет собой связующее вещество, способное уменьшить количество F1 в солифенацине до 0,5% или ниже, более предпочтительно, связующее вещество, способное уменьшить количество F1 до 0,4% или ниже. Конкретно, оно представляет собой связующее вещество с Tg или т.пл. ниже 174°С, предпочтительно, связующее вещество с Tg или т.пл., равной 0°С, или выше, и ниже 174°С, более предпочтительно, связующее вещество с Tg или т.пл., равной 0°С или выше, и ниже 156°С, еще более предпочтительно, связующее вещество с Tg или т.пл., равной 0°С, или выше, и ниже 137°С, и наиболее предпочтительно, связующее вещество с Tg или т.пл., равной 10°С или выше, и ниже 137°С. Конкретный тип связующего вещества особенно не ограничен до тех пор, пока оно имеет Tg в пределах указанного выше интервала, однако его предпочтительные примеры включают в себя вещество, содержащее этиленоксидную цепочку, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, этилцеллюлозу, поливиниловый спирт, сополимер метакриловой кислоты, сополимер аминоалкилметакрилата, крахмал и мальтозу. Однако с точки зрения процесса производства в ряду указанных выше связующих веществ поливиниловый спирт, сополимер метакриловой кислоты, сополимер аминоалкилметакрилата и крахмал обладают слабой связующей силой, поэтому считается, что нанесение покрытия на частицы затруднено. Соответственно, более предпочтительно вещество, содержащее этиленоксидную цепочку, такое как ПЭГ, полиэтиленоксид, или блоксополимер полиоксиэтилена/полиоксипропилена, гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза или мальтоза, еще более предпочтителен ПЭГ, блоксополимер полиоксиэтилена/полиоксипропилена или гидроксипропилцеллюлоза, особенно предпочтителен ПЭГ или гидроксипропилцеллюлоза, а наиболее предпочтителен ПЭГ. Что касается подобного связующего вещества, тип молекулярной массы, степень полимеризации или тому подобное особенно не ограничены до тех пор, пока при добавлении данного связующего вещества можно достигнуть цели настоящего изобретения, состоящей в ингибировании аморфности солифенацина или его соли. Однако, что касается типа молекулярной массы, средняя молекулярная масса предпочтительно находится в интервале от 400 до 1000000, а более предпочтительно, средняя молекулярная масса находится в интервале от 2000 до 200000. Кроме того, описанные выше связующие вещества можно использовать в виде сочетания двух или более типов.
Вещество, содержащее этиленоксидную цепь, как использовано здесь, особенно не ограничено до тех пор, пока оно содержит этиленоксидную цепь. Тип его молекулярной массы, его степень полимеризации или тому подобное особенно не ограничены до тех пор, пока при добавлении данного связующего вещества можно достигнуть цели настоящего изобретения, состоящей в ингибировании аморфности солифенацина или его соли. Однако, что касается типа молекулярной массы, средняя молекулярная масса предпочтительно находится в интервале от 400 до 1000000, а более предпочтительно, средняя молекулярная масса находится в интервале от 2000 до 200000. Вещества, содержащие этиленоксидную цепь, можно использовать сами по себе или в виде смеси двух или более типов.
В настоящем изобретении конкретные примеры вещества, содержащего этиленоксидную цепь, включают в себя ПЭГ, полиэтиленоксид, блоксополимер полиоксиэтилена/полиоксипропилена и так далее. Однако в настоящем изобретении из их числа предпочтительны ПЭГ и блоксополимер полиоксиэтилена/полиоксипропилена, а особенно предпочтителен ПЭГ. В качестве ПЭГ предпочтителен ПЭГ, находящийся в твердой форме при нормальной температуре. Конкретные примеры включают в себя макрогол 4000 (Японская Фармакопея, молекулярная масса: от 2600 до 3800, торговая марка: Macrogol 4000/Sanyo Chemical Industries, Ltd., NOF Corporation, Lion Corporation и так далее), макрогол 6000 (Японская Фармакопея, молекулярная масса: от 7300 до 9300, торговая марка: Macrogol 6000/Sanyo Chemical Industries, Ltd., NOF Corporation, Lion Corporation и так далее), макрогол 20000 (Японская Фармакопея, молекулярная масса: от 15000 до 25000, торговая марка: Macrogol 20000/Sanyo Chemical Industries, Ltd., NOF Corporation, Lion Corporation и так далее), полиэтиленгликоль 8000 (USP/NF, молекулярная масса: от 7000 до 9000, торговая марка: Polyethylene glycol 8000/The Dow Chemical Company и так далее) и так далее. Средняя молекулярная масса ПЭГ предпочтительно находится в интервале от 400 до 40000, более предпочтительно, в интервале от 2000 до 25000 и еще более предпочтительно, в интервале от 2000 до 10000.
Блоксополимер полиоксиэтилена/полиоксипропилена в соответствии с настоящим изобретением представляет собой сополимер пропиленоксида и этиленоксида и существуют различные типы в зависимости от его композиционного соотношения, однако он может иметь такое композиционное соотношение, чтобы обладать свойством ингибировать переход солифенацина или его соли в аморфное состояние. Конкретно используют полиоксиэтилен(105)полиоксипропилен(5)гликоль, полиоксиэтилен(160)полиоксипропилен(30)гликоль (другое название: Pluronic F68) или тому подобное.
«Смесь, в которой солифенацин или его соль, и связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, растворены и/или суспендированы вместе», как использовано в настоящем изобретении, означает смесь, в которой связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, растворено в растворе, полученном при растворении солифенацина или его соли, в растворителе, таком как вода.
Однако не всегда есть необходимость растворять весь солифенацин или его соль в растворителе, и пока частицу, содержащую лекарственное вещество, подходящую для нанесения на нее покрытия, такого как покрытие, скрывающее горечь, которое осуществляют впоследствии, можно получить при использовании полученной смеси, подобную смесь для данной частицы, полученную при использовании смеси в суспендированном состоянии, в которой в растворителе растворена часть солифенацина или его соли также включают в рассмотрение.
Композиция, которую «можно получить при использовании» смеси, в которой солифенацин или его соль, и связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, растворены вместе, в настоящем изобретении представляет собой частицу, содержащую лекарственное вещество, подходящую для нанесения на нее покрытия, такого как покрытие, скрывающее горечь. Ее примеры включают в себя композицию, полученную при нанесении методом распыления на ядро частицы, такое как кристаллическая целлюлоза, покрытия из лекарственного вещества в форме раствора, композицию, которую можно получить не при нанесении лекарственного вещества в жидком виде, а при соединении смеси, полученной при совместном растворении данных веществ, с нерастворимым ядром частицы, и нанесении лекарственного вещества для получения равномерного распределения лекарственного вещества по нерастворимому ядру частицы, и так далее. Кроме того, примеры продукта, полученного способом, в котором не используют ядро частицы, включают в себя собственно порошок, полученный путем распылительной сушки, или сублимационной сушки раствора лекарственного вещества и связующего вещества, и такой порошок можно использовать для частицы, содержащей лекарственное вещество, предназначенное для использования в целях маскировки горечи, или тому подобного. Однако, с точки зрения эффективности производства, предпочтительна композиция, которую можно получить путем распыления на ядро частицы смеси, в которой вместе растворены солифенацин или его соль, и связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль.
«Стабильная, состоящая из частиц композиция», как использовано в настоящем изобретении, которую можно получить при использовании солифенацина или его соли, или тому подобное, особенно не ограничена до тех пор, пока она представляет собой стабильную частицу, в которой разложение с течением времени замедлено. Термин «стабильный», использованный здесь, конкретно означает частицу, в которой количество образующегося F1 из солифенацина или его соли составляет 0,5%, или менее, более предпочтительно, 0,4%, или менее. Кроме того, в случае, когда фармацевтическая композиция представляет собой частицу, такую как гранула, размер частиц особенно не ограничен до тех пор, пока самый большой диаметр составляет 2 мм или меньше. Что касается случая, когда она входит в состав таблетки, распадающейся в щечной полости, размер частиц особенно не ограничен до тех пор, пока при ее приеме не возникает неприятного ощущения вроде песка во рту, однако ее предпочтительно изготавливают при среднем размере частиц 350 мкм, или менее. Более предпочтительный средний размер частиц составляет от 1 до 350 мкм, а особенно предпочтительный средний размер частиц составляет от 20 до 350 мкм. С точки зрения распределения частиц по размерам, оно особенно не ограничено до тех пор, пока она представляет собой частицу, подходящую для нанесения на нее покрытия, такого как покрытие для маскировки горечи, однако, предпочтительно, чтобы 80% общей массы было распределено в интервале от 1 до 350 мкм, более предпочтительно, чтобы 80% общей массы было распределено в интервале от 50 до 300 мкм, и особенно предпочтительно, чтобы 80% общей массы было распределено в интервале от 100 до 250 мкм.
Кроме того, форма состоящей из частиц фармацевтической композиции в соответствии с настоящим изобретением особенно не ограничена до тех пор, пока она находится в состоянии, в котором можно осуществить нанесение покрытия, такое как покрытие для маскировки горечи, однако, с точки зрения эффективности нанесения покрытия, она предпочтительно имеет сферическую форму, то есть ее сферичность как можно более близка к 1.
В том случае, когда состоящая из частиц фармацевтическая композиция настоящего изобретения представляет собой гранулу, количество смешанного связующего вещества в состоящей из частиц фармацевтической композиции особенно не ограничено до тех пор, пока оно представляет собой количество, которое дает возможность нанести покрытие солифенацином или его солью, и достигнуть цели настоящего изобретения. Однако оно предпочтительно составляет от 0,01 до 91 массовых %, а более предпочтительно, от 0,5 до 75% от массы всей состоящей из частиц фармацевтической композиции. Наиболее предпочтительно, смешанное количество составляет от 5 до 50 массовых %. Кроме того, рассматривая смешанное количество связующего вещества в случае, когда фармацевтическая композиция настоящего изобретения представляет собой частицу, такую как гранула, относительно 1 массовой части солифенацина или его соли, в кристаллической форме и в аморфной форме, оно предпочтительно составляет долю, находящуюся в интервале от 1 до 1000 массовых %, предпочтительно, в интервале от 5 до 500 массовых %, и еще более предпочтительно, в интервале от 10 до 100 массовых %.
Состоящую из частиц фармацевтическую композицию настоящего изобретения получают из солифенацина или его соли, в состоянии раствора. Однако, в том случае, когда на ядро частицы наносят покрытие раствором солифенацина методом распыления, примеры ядра частицы включают в себя хлорид натрия, микрокристаллическую целлюлозу, карбонат кальция, лактозу, мальтозу и маннит, а ее предпочтительные примеры включают в себя микрокристаллическую целлюлозу, лактозу, маннит и тому подобное. Более предпочтительны микрокристаллическая целлюлоза и лактоза. В настоящем изобретении из группы подобных веществ можно использовать сочетание одного типа или двух или более типов.
Кроме того, обработка, способствующая кристаллизации, особенно не ограничена до тех пор, пока она представляет собой обработку, способствующую кристаллизации, и ее примеры включают в себя обработку увлажнением, обработку микроволновым излучением, обработку ультразвуковым излучением, обработку низкочастотным излучением, обработку термоэлектронным излучением и тому подобное. Кроме того, обработка увлажнением относится к обработке, при которой, например, проводится обработка увлажнением при температуре от 20 до 30°С и при влажности от 60 до 85% RH в течение от 6 до 24 часов, а затем высушивание при температуре от 30 до 40°С и при влажности от 30 до 40% RH в течение от 2 до 6 часов. Обработку микроволновым излучением, как правило, нельзя ограничить, однако, например, можно использовать микроволну с длиной волны от 10 МГц до 25 ГГц. Кроме того, продолжительность обработки зависит от степени кристаллизации на начальной стадии и выбранного основного вещества, однако, например, данную обработку можно проводить в течение от 10 секунд до 60 минут. Само по себе облучение можно проводить непрерывно или периодически и при любом временном распределении после получения любой состоящей из частиц композиции.
Обработку ультразвуковым излучением, как правило, нельзя ограничить, однако, например, можно использовать ультразвуковую волну с частотой от 10 кГц до 600 кГц. Кроме того, продолжительность обработки зависит от степени кристаллизации на начальной стадии и выбранного основного вещества, однако, например, данную обработку можно проводить в течение от 10 секунд до 24 часов. Само по себе облучение можно проводить непрерывно или периодически и при любом временном распределении после получения любой состоящей из частиц композиции.
Что касается обработки, способствующей кристаллизации, предпочтительны обработка увлажнением, обработка микроволновым излучением и обработка ультразвуковым излучением.
В состоящей из частиц фармацевтической композиции настоящего изобретения подходящим образом используют и вводят в состав фармацевтического препарата любой из множества фармацевтических эксципиентов. Примеры подобного фармацевтического эксципиента включают в себя лактозу и тому подобное. Кроме того, можно использовать другое вспомогательное вещество в интервале, в пределах которого оно не навредит цели настоящего изобретения, пока оно является фармацевтически и фармакологически приемлемым вспомогательным веществом. Например, можно использовать разрыхляющий агент, подкисляющий агент, пенообразующий агент, искусственный подсластитель, ароматизатор, смазывающее вещество, окрашивающий агент, стабилизатор, буферизующий агент, антиоксидант, поверхностно-активное вещество или тому подобное, и для них нет особенного ограничения. Примеры разрыхляющего агента включают кукурузный крахмал, картофельный крахмал, кармеллозу кальция, кармеллозу натрия, гидроксипропилцеллюлозу с низкой степенью замещения и так далее. Примеры подкисляющего агента включают в себя лимонную кислоту, винную кислоту, яблочную кислоту и так далее. Примеры пенообразующего агента включают в себя бикарбонат натрия и так далее. Примеры искусственного подсластителя включают в себя сахаринат натрия, глицирризинат дикальция, аспартам, стевию, соматин и так далее. Примеры ароматизатора включают в себя лимон, лимон-лайм, апельсин, ментол и так далее. Примеры смазывающего вещества включают в себя стеарат магния, стеарат кальция, сложный эфир сахарозы и жирной кислоты, тальк, стеариновую кислоту и так далее. Примеры окрашивающего агента включают в себя желтую полуторную окись железа, красную полуторную окись железа, пищевой желтый  4 и 4 и  5, пищевой красный 5, пищевой красный  3 и 3 и  102, пищевой синий 102, пищевой синий  3 и так далее. Примеры буферизующего агента включают в себя лимонную кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, аскорбиновую кислоту или ее соль, глутаминовую кислоту, глутамин, глицин, аспарагиновую кислоту, аланин, аргинин или его соль, оксид магния, оксид цинка, гидроксид магния, фосфорную кислоту, борную кислоту или ее соль, и так далее. Примеры антиоксиданта включают в себя аскорбиновую кислоту, нитрит натрия, сульфит натрия, гидросульфит натрия, эдетат натрия, эриторбовую кислоту, токоферолацетат, токоферол, бутилгидроксианизол, дибутилгидрокситолуол, пропилгаллат и так далее. Примеры поверхностно-активного вещества включают в себя лаурилсульфат натрия, сложный эфир полиоксиэтиленсорбитана и жирной кислоты (полисорбат 80), полиоксиэтиленовое гидрированное касторовое масло и так далее. Что касается фармацевтического эксципиента, указанные выше вещества можно подходящим образом использовать по отдельности или в виде сочетания двух, или более типов в соответствующем количестве. 3 и так далее. Примеры буферизующего агента включают в себя лимонную кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, аскорбиновую кислоту или ее соль, глутаминовую кислоту, глутамин, глицин, аспарагиновую кислоту, аланин, аргинин или его соль, оксид магния, оксид цинка, гидроксид магния, фосфорную кислоту, борную кислоту или ее соль, и так далее. Примеры антиоксиданта включают в себя аскорбиновую кислоту, нитрит натрия, сульфит натрия, гидросульфит натрия, эдетат натрия, эриторбовую кислоту, токоферолацетат, токоферол, бутилгидроксианизол, дибутилгидрокситолуол, пропилгаллат и так далее. Примеры поверхностно-активного вещества включают в себя лаурилсульфат натрия, сложный эфир полиоксиэтиленсорбитана и жирной кислоты (полисорбат 80), полиоксиэтиленовое гидрированное касторовое масло и так далее. Что касается фармацевтического эксципиента, указанные выше вещества можно подходящим образом использовать по отдельности или в виде сочетания двух, или более типов в соответствующем количестве.
«Содержание аморфной формы», как использовано в настоящем изобретении, означает отношение относительно общего количества аморфной формы и кристаллической формы солифенацина или его соли.
Примеры фармацевтического препарата с использованием упомянутой выше частицы включают в себя порошок, гранулу, пилюлю, таблетку, капсулу, таблетку, распадающуюся в щечной полости, сухой сироп и так далее, однако предпочтительной является таблетка, распадающаяся в щечной полости.
Далее будет описана таблетка, распадающаяся в щечной полости, содержащая состоящую из частиц фармацевтическую композицию настоящего изобретения.
«Таблетка, распадающаяся в щечной полости», в настоящем изобретении означает таблетку, которая распадается в щечной полости, главным образом, за счет слюны, в течение всего лишь 2 минут, предпочтительно, в течение 1 минуты, более предпочтительно, в течение 30 секунд, в том случае, когда таблетку принимают, не запивая водой, и фармацевтический препарат, аналогичный таблетке.
Состоящую из частиц фармацевтическую композицию настоящего изобретения можно включить в состав подобной таблетки, которая распадается в щечной полости, например, таблетку, распадающуюся в щечной полости, можно изготовить, используя состоящую из частиц фармацевтическую композицию в качестве лекарственного вещества для известной таблетки, распадающейся в щечной полости, которая описана в любом документе из числа международной публикации  95-20380 (соответствует патенту США 95-20380 (соответствует патенту США  5576014), международной публикации 5576014), международной публикации  2002-92057 (соответствует публикации патентной заявки США 2002-92057 (соответствует публикации патентной заявки США  2003/099701), патента США 2003/099701), патента США  4305502, патента США 4305502, патента США  4371516, японского патента 4371516, японского патента  2807346 (соответствует патенту США 2807346 (соответствует патенту США  5466464), JP-A-5-271054 (соответствует европейскому патенту 5466464), JP-A-5-271054 (соответствует европейскому патенту  553777), JP-A-10-182436 (соответствует патенту США 553777), JP-A-10-182436 (соответствует патенту США  5958453), японского патента 5958453), японского патента  3412694 (соответствует патенту США 3412694 (соответствует патенту США  5223264) и международной публикации 5223264) и международной публикации  WO 98/02185 (соответствует патенту США WO 98/02185 (соответствует патенту США  6287596), с использованием основного вещества таблетки, разрушающейся в щечной полости, описанного в любой из данных публикаций, и следуя способу, описанному в любой из данных публикаций. Таким образом, в качестве примера таблетки, распадающейся в щечной полости, содержащей состоящую из частиц фармацевтическую композицию, можно привести таблетку, распадающуюся в щечной полости, которая описана в японском патенте 6287596), с использованием основного вещества таблетки, разрушающейся в щечной полости, описанного в любой из данных публикаций, и следуя способу, описанному в любой из данных публикаций. Таким образом, в качестве примера таблетки, распадающейся в щечной полости, содержащей состоящую из частиц фармацевтическую композицию, можно привести таблетку, распадающуюся в щечной полости, которая описана в японском патенте  3412694 (соответствует патенту США 3412694 (соответствует патенту США  5223264) и JP-A-2003-55197, и состоящую из частиц фармацевтическую композицию настоящего изобретения можно включить в подобную таблетку, распадающуюся в щечной полости. 5223264) и JP-A-2003-55197, и состоящую из частиц фармацевтическую композицию настоящего изобретения можно включить в подобную таблетку, распадающуюся в щечной полости.
В целом, описанную выше таблетку, распадающуюся в щечной полости, подразделяют на таблетку формованного типа, увлажненного типа и стандартного типа и состоящую из частиц фармацевтическую композицию настоящего изобретения можно включить в состав таблетки любого типа, распадающейся в щечной полости. Таблетку формованного типа, распадающуюся в щечной полости, изготавливают, например, путем заполнения формы раствором или суспензией эксципиента и его высушивания, такого как эксципиент, описанный в японском патенте  2807346 (соответствует патенту США 2807346 (соответствует патенту США  5466464). Таблетку формованного типа, распадающуюся в щечной полости, которая содержит состоящую из частиц фармацевтическую композицию настоящего изобретения, можно изготовить, например, заполняя блистерную упаковку раствором, или суспензией состоящей из частиц фармацевтической композицией настоящего изобретения, эксципиентом, таким как сахарид, и связующим веществом, таким как желатин или агар-агар, и удаляя влагу таким способом, как сублимационная сушка, сушка при пониженном давлении, или низкотемпературная сушка. Таблетку увлажненного типа, распадающуюся в щечной полости, изготавливают, увлажняя эксципиент, такой как сахарид, и осуществляя таблетирование при низком давлении, а затем высушивая ее, как описано в японском патенте 5466464). Таблетку формованного типа, распадающуюся в щечной полости, которая содержит состоящую из частиц фармацевтическую композицию настоящего изобретения, можно изготовить, например, заполняя блистерную упаковку раствором, или суспензией состоящей из частиц фармацевтической композицией настоящего изобретения, эксципиентом, таким как сахарид, и связующим веществом, таким как желатин или агар-агар, и удаляя влагу таким способом, как сублимационная сушка, сушка при пониженном давлении, или низкотемпературная сушка. Таблетку увлажненного типа, распадающуюся в щечной полости, изготавливают, увлажняя эксципиент, такой как сахарид, и осуществляя таблетирование при низком давлении, а затем высушивая ее, как описано в японском патенте  3069458 (соответствует патенту США 3069458 (соответствует патенту США  5501861 и патенту США 5501861 и патенту США  5720974). Следовательно, например, состоящую из частиц фармацевтическую композицию настоящего изобретения и эксципиент, такой как сахарид, увлажняют небольшим количеством воды, или смешанного раствора воды и спирта, и полученную увлаженную смесь формуют при низком давлении, а затем высушивают данную формованную смесь, в результате чего можно изготовить таблетку увлажненного типа, распадающуюся в щечной полости. 5720974). Следовательно, например, состоящую из частиц фармацевтическую композицию настоящего изобретения и эксципиент, такой как сахарид, увлажняют небольшим количеством воды, или смешанного раствора воды и спирта, и полученную увлаженную смесь формуют при низком давлении, а затем высушивают данную формованную смесь, в результате чего можно изготовить таблетку увлажненного типа, распадающуюся в щечной полости.
В случае таблетки стандартного типа ее изготавливают при помощи стадии стандартного таблетирования, которая описана в международной публикации  95-20380 (соответствует патенту США 95-20380 (соответствует патенту США  5576014), международной публикации 5576014), международной публикации  2002-92057 (соответствует публикации патентной заявки США 2002-92057 (соответствует публикации патентной заявки США  2003/099701), JP-A-10-182436 (соответствует патенту США 2003/099701), JP-A-10-182436 (соответствует патенту США  5958453), JP-A-9-48726, JP-A-8-19589 (соответствует патенту США 5958453), JP-A-9-48726, JP-A-8-19589 (соответствует патенту США  5672364), японском патенте 5672364), японском патенте  2919771 и японском патенте 2919771 и японском патенте  3069458 (соответствует патенту США 3069458 (соответствует патенту США  5501861 и патенту США 5501861 и патенту США  5720974). Для получения таблетки стандартного таблеточного типа, распадающейся в щечной полости, которая содержит состоящую из частиц фармацевтическую композицию настоящего изобретения, например, состоящую из частиц фармацевтическую композицию настоящего изобретения и эксципиент, такой как сахарид с низкой формуемостью, гранулируют с использованием раствора или суспензии сахарида с высокой формуемостью, или водорастворимого полимера, а затем полученное гранулированное вещество подвергают компрессионному формованию, получая компрессионно-формованное вещество, или затем полученное компрессионно-формованное вещество подвергают увлажнению и сушке, в результате чего можно получить таблетку, распадающуюся в щечной полости, как описано в международной публикации 5720974). Для получения таблетки стандартного таблеточного типа, распадающейся в щечной полости, которая содержит состоящую из частиц фармацевтическую композицию настоящего изобретения, например, состоящую из частиц фармацевтическую композицию настоящего изобретения и эксципиент, такой как сахарид с низкой формуемостью, гранулируют с использованием раствора или суспензии сахарида с высокой формуемостью, или водорастворимого полимера, а затем полученное гранулированное вещество подвергают компрессионному формованию, получая компрессионно-формованное вещество, или затем полученное компрессионно-формованное вещество подвергают увлажнению и сушке, в результате чего можно получить таблетку, распадающуюся в щечной полости, как описано в международной публикации  95-20380 (соответствует патенту США 95-20380 (соответствует патенту США  5576014) и японскому патенту 5576014) и японскому патенту  2919771. Кроме того, для получения таблетки стандартного таблеточного типа, распадающейся в щечной полости, которая описана в международной публикации 2919771. Кроме того, для получения таблетки стандартного таблеточного типа, распадающейся в щечной полости, которая описана в международной публикации  99-47124 (соответствует патенту США 99-47124 (соответствует патенту США  6589554), например, состоящую из частиц фармацевтическую композицию настоящего изобретения и эксципиент, такой как кристаллический сахарид, подвергают компрессионному формованию с использованием аморфного сахарида, а полученное вещество подвергают увлажнению и высушиванию, в результате чего можно получить таблетку, распадающуюся в щечной полости. 6589554), например, состоящую из частиц фармацевтическую композицию настоящего изобретения и эксципиент, такой как кристаллический сахарид, подвергают компрессионному формованию с использованием аморфного сахарида, а полученное вещество подвергают увлажнению и высушиванию, в результате чего можно получить таблетку, распадающуюся в щечной полости.
Кроме того, для получения таблетки стандартного таблеточного типа, распадающейся в щечной полости, описанной в международной публикации  2002-92057 (соответствует публикации патентной заявки 2002-92057 (соответствует публикации патентной заявки  2003/099701), например, смесь состоящей из частиц фармацевтической композиции настоящего изобретения и эксципиента с сахаридом, температура плавления которого ниже, чем температура плавления эксципиента, подвергают компрессионному формованию, а полученное вещество нагревают для образования поперечных связей за счет затвердевшего расплава продукта сахарида с более низкой температурой плавления, в результате чего можно получить таблетку, распадающуюся в щечной полости. При помощи увлажнения и высушивания, или обработки нагреванием, описанных выше, можно повысить таблеточную прочность подобной таблетки, распадающейся в щечной полости. 2003/099701), например, смесь состоящей из частиц фармацевтической композиции настоящего изобретения и эксципиента с сахаридом, температура плавления которого ниже, чем температура плавления эксципиента, подвергают компрессионному формованию, а полученное вещество нагревают для образования поперечных связей за счет затвердевшего расплава продукта сахарида с более низкой температурой плавления, в результате чего можно получить таблетку, распадающуюся в щечной полости. При помощи увлажнения и высушивания, или обработки нагреванием, описанных выше, можно повысить таблеточную прочность подобной таблетки, распадающейся в щечной полости.
В качестве эксципиента, предназначенного для использования в распадающейся в щечной полости таблетке настоящего изобретения, можно также использовать стандартный эксципиент, однако, в частности, предпочтительно используют фармацевтически приемлемый сахарид. Для способа, в котором используется формуемость сахарида, можно применять сахарид с низкой формуемостью. При использовании способа повышения таблеточной прочности за счет кристаллического/аморфного свойства сахарида, и увлажнения, и высушивания, можно использовать кристаллический сахарид. При использовании способа образования поперечных связей за счет затвердевшего расплава продукта сахарида в дополнение к стандартному эксципиенту можно использовать сахарид с высокой температурой плавления.
«Сахарид с низкой формуемостью» означает сахарид, который придает таблетке прочность от 0 до 2 кПа в случае, когда, например, 150 мг сахарида таблетируют при давлении таблетирования от 10 до 50 кг/см2 при использовании штампа диаметром 8 мм. «Сахарид с высокой формуемостью» означает сахарид, придающий таблетке прочность 2 кПа или выше при использовании аналогичного способа. Сахарид с низкой формуемостью является фармацевтически приемлемым сахаридом, и его примеры могут включать в себя лактозу, маннит, глюкозу, сахарозу, ксилит, эритрит и так далее. Такие сахариды можно использовать сами по себе, или сочетая подходящим образом два или более типа. Сахарид с высокой формуемостью является фармацевтически приемлемым сахаридом, и его примеры могут включать в себя мальтозу, мальтит, сорбит, трегалозу и так далее. Кроме того, эти сахариды можно использовать сами по себе, или сочетая подходящим образом два или более типа.
«Кристаллический сахарид» является фармацевтически приемлемым сахаридом, и его примеры могут включать в себя маннит, мальтит, эритрит, ксилит и так далее. Данные сахариды можно использовать сами по себе, или сочетая подходящим образом два или более типа.
«Аморфный сахарид» является фармацевтически приемлемым сахаридом, и его примеры могут включать в себя лактозу, сахарозу, глюкозу, сорбит, мальтозу, трегалозу и так далее. Кроме того, данные сахариды можно использовать сами по себе, или сочетая подходящим образом два или более типа.
Кроме того, «эксципиент с температурой плавления, превышающей температуру плавления сахарида с низкой температурой плавления» является фармацевтически приемлемым и может быть выбран, например, из числа ксилита, трегалозы, мальтозы, сорбита, эритрита, глюкозы, сахарозы, мальтита, маннита и так далее. Данные сахариды можно использовать сами по себе, или сочетая подходящим образом два или более типа. «Сахарид с низкой температурой плавления» является фармацевтически приемлемым и может быть выбран, например, из числа ксилита, трегалозы, мальтозы, сорбита, эритрита, глюкозы, сахарозы, мальтита, маннита и так далее. Данные сахариды также можно использовать сами по себе, или сочетая подходящим образом два или более типа. В качестве примера связующего вещества для таблетки, разрушающейся в щечной полости, можно привести мальтит, кополивидон, эритрит и так далее. Кроме того, данные сахариды можно использовать сами по себе, или сочетая подходящим образом два или более типа.
При использовании водорастворимого полимера вместо сахарида с высокой формуемостью предпочтительными являются гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, повидон, поливиниловый спирт, порошок гуммиарабика, желатин, пурулан и так далее.
Используемое количество смешения для эксципиента, предназначенного для применения в таблетке, распадающейся в щечной полости, которая содержит состоящую из частиц фармацевтическую композицию настоящего изобретения, устанавливают подходящим образом в соответствии с количеством смешения для состоящей из частиц фармацевтической композиции настоящего изобретения и/или размера таблетки и так далее, однако оно предпочтительно составляет от 20 до 1000 мг в целом, более предпочтительно, от 50 до 900 мг и особенно предпочтительно, от 100 до 800 мг на таблетку.
Кроме того, смешанные количества для сахарида с высокой формуемостью, водорастворимого полимера, аморфного сахарида или сахарида с низкой температурой плавления особенно не ограничены до тех пор, пока оно выбрано подходящим образом и используются в соответствии с соответствующими методиками, однако они предпочтительно составляют от 0,5 до 40 массовых %, более предпочтительно, от 2 до 30 массовых %, и особенно от 5 до 20 массовых % от массы эксципиента, или они предпочтительно составляют от 1 до 20 массовых % от всего фармацевтического препарата.
Что касается типа другой необязательно добавки, ее состава или количества смешанного, или тому подобного, то описание упомянутых выше патентных документов в части таблеток, разрушающихся в щечной полости, процитировано здесь в качестве составной части данного описания.
Кроме того, в том случае, когда состоящая из частиц фармацевтическая композиция настоящего изобретения входит в состав таблетки, распадающейся в щечной полости, данная состоящая из частиц фармацевтическая композиция настоящего изобретения может быть включена в количестве, которое соответствует интервалу от 0,5 до 90 массовых %, предпочтительно, от 1 до 80 массовых %, и более предпочтительно, от 5 до 60 массовых % от всей таблетки, распадающейся в щечной полости.
Далее будет описан способ получения состоящей из частиц фармацевтической композиции настоящего изобретения.
Для получения состоящей из частиц фармацевтической композиции настоящего изобретения солифенацин или его соль, и связующее вещество, оказывающее стабилизирующее действие на солифенацин или его соль, растворяют или суспендируют при перемешивании в воде, или смешанном растворе, полученном при добавлении к воде органического растворителя, такого как этанол, при помощи мешалки, в результате чего получают раствор лекарственного вещества. В этом случае можно соответственно установить количество воды, или органического растворителя, содержащееся в растворе лекарственного вещества. В качестве примера способа измельчения (гранулирования) раствора лекарственного вещества солифенацина или его соли можно привести способ сублимационной сушки, распылительной сушки, способ гранулирования при высокоинтенсивном перемешивании, способ гранулирования в псевдоожиженном слое, способ гранулирования в барабане и так далее. До тех пор, пока способ позволяет измельчать (гранулировать) солифенацин после его растворения, и устройство, и способ особенно не ограничены, однако особенно предпочтительными являются распылительная сушка и способ гранулирования в псевдоожиженном слое. Конкретно, на частицу соответствующей добавки (например, кристаллическую целлюлозу (частица), сферическую гранулу очищенной сахарозы, сферическую гранулу сахарозы и крахмала, или тому подобного), предназначенную для использования в качестве ядра, наносят методом распыления покрытие из раствора лекарственного вещества, в результате чего можно получить состоящую из частиц композицию настоящего изобретения.
В качестве примера устройства, используемого для нанесения покрытия методом распыления, можно привести, например, гранулятор с псевдоожиженным слоем (FLO-1 производства Glatt Co., Ltd.), распылительную сушилку (DL41 производства Yamato Scientific Co. Ltd.) и так далее.
Далее будет описан способ получения таблетки, распадающейся в щечной полости, которая содержит состоящую из частиц фармацевтическую композицию настоящего изобретения.
В случае таблетки, распадающейся в щечной полости, которая описана в международной публикации  95-20380 (соответствует патенту США 95-20380 (соответствует патенту США  5576014), можно применить стадии смешивания состоящей из частиц фармацевтической композиции настоящего изобретения и сахарида с низкой формуемостью; распыления полученной смеси при использовании сахарида с высокой формуемостью в качестве связующего вещества для нанесения покрытия и/или гранулирования; и подвергания полученного гранулированного вещества компрессионному формованию. Кроме того, чтобы повысить прочность формованного вещества, можно применить стадии увлажнения и высушивания. «Увлажнение» определяется кажущейся критической относительной влажностью содержащегося сахарида, но обычно его увлажняют до критической относительной влажности или более. Например, влажность составляет от 30 до 100% RH, предпочтительно, от 50 до 90% RH. В этом случае температура предпочтительно составляет от 15 до 50°С, более предпочтительно, от 20 до 40°С. Продолжительность обработки составляет от 1 до 36 часов, предпочтительно, от 12 до 24 часов. «Высушивание» особенно не ограничено до тех пор, пока оно представляет собой стадию удаления влаги, абсорбированной при увлажнении. Например, в качестве условия температуры высушивания, ее можно установить в интервале от 10 до 100°С, предпочтительно, от 20 до 60°С, более предпочтительно, от 25 до 40°С. Продолжительность обработки можно установить от 0,5 до 6 часов, предпочтительно, от 1 до 4 часов. 5576014), можно применить стадии смешивания состоящей из частиц фармацевтической композиции настоящего изобретения и сахарида с низкой формуемостью; распыления полученной смеси при использовании сахарида с высокой формуемостью в качестве связующего вещества для нанесения покрытия и/или гранулирования; и подвергания полученного гранулированного вещества компрессионному формованию. Кроме того, чтобы повысить прочность формованного вещества, можно применить стадии увлажнения и высушивания. «Увлажнение» определяется кажущейся критической относительной влажностью содержащегося сахарида, но обычно его увлажняют до критической относительной влажности или более. Например, влажность составляет от 30 до 100% RH, предпочтительно, от 50 до 90% RH. В этом случае температура предпочтительно составляет от 15 до 50°С, более предпочтительно, от 20 до 40°С. Продолжительность обработки составляет от 1 до 36 часов, предпочтительно, от 12 до 24 часов. «Высушивание» особенно не ограничено до тех пор, пока оно представляет собой стадию удаления влаги, абсорбированной при увлажнении. Например, в качестве условия температуры высушивания, ее можно установить в интервале от 10 до 100°С, предпочтительно, от 20 до 60°С, более предпочтительно, от 25 до 40°С. Продолжительность обработки можно установить от 0,5 до 6 часов, предпочтительно, от 1 до 4 часов.
В случае таблетки, распадающейся в щечной полости, которая описана в международной публикации  2002-92057 (соответствует публикации патентной заявки США 2002-92057 (соответствует публикации патентной заявки США  2003/099701), состоящую из частиц фармацевтическую композицию настоящего изобретения, эксципиент с высокой температурой плавления и сахарид с низкой температурой плавления смешивают и распыляют полученную смесь с использованием связующего вещества для таблетки, распадающейся в щечной полости, для нанесения покрытия и/или гранулирования, а затем гранулированное вещество можно подвергнуть компрессионному формованию. В качестве условия распыления, например, при использовании гранулятора с псевдоожиженным слоем (FLO-1 производства Glatt Co., Ltd.), концентрация раствора солифенацина особенно не ограничена до тех пор, пока он имеет вязкость, позволяющую подавать раствор при помощи насоса, однако она предпочтительно составляет от 0,01 до 30% (масса/масса), из расчета на концентрацию содержащегося твердого вещества. Скорость распыления особенно не ограничена до тех пор, пока можно осуществлять распылительную сушку, однако она предпочтительно составляет от 0,1 до 20 г/мин. Температура распыления особенно не ограничена до тех пор, пока ее можно установить так, чтобы температура продукта составляла от 10 до 60°С. Данные условия распыления изменяются в зависимости от масштабов производства и типа устройства, однако они особенно не ограничены до тех пор, пока позволяют получать состоящую из частиц композицию. Кроме того, в том случае, когда смешивают эксципиент с высокой температурой плавления и сахарид с низкой температурой плавления, чтобы повысить прочность полученного формованного вещества, можно применить стадию нагревания. «Нагревание» определяется температурой плавления содержащегося в нем сахарида с низкой температурой плавления. Однако его обычно нагревают до температуры не ниже, чем температура плавления сахарида с низкой температурой плавления, и ниже, чем температура плавления эксципиента с высокой температурой плавления. Продолжительность обработки можно установить в интервале от 0,5 до 120 минут, а предпочтительно, от 1 до 60 минут. 2003/099701), состоящую из частиц фармацевтическую композицию настоящего изобретения, эксципиент с высокой температурой плавления и сахарид с низкой температурой плавления смешивают и распыляют полученную смесь с использованием связующего вещества для таблетки, распадающейся в щечной полости, для нанесения покрытия и/или гранулирования, а затем гранулированное вещество можно подвергнуть компрессионному формованию. В качестве условия распыления, например, при использовании гранулятора с псевдоожиженным слоем (FLO-1 производства Glatt Co., Ltd.), концентрация раствора солифенацина особенно не ограничена до тех пор, пока он имеет вязкость, позволяющую подавать раствор при помощи насоса, однако она предпочтительно составляет от 0,01 до 30% (масса/масса), из расчета на концентрацию содержащегося твердого вещества. Скорость распыления особенно не ограничена до тех пор, пока можно осуществлять распылительную сушку, однако она предпочтительно составляет от 0,1 до 20 г/мин. Температура распыления особенно не ограничена до тех пор, пока ее можно установить так, чтобы температура продукта составляла от 10 до 60°С. Данные условия распыления изменяются в зависимости от масштабов производства и типа устройства, однако они особенно не ограничены до тех пор, пока позволяют получать состоящую из частиц композицию. Кроме того, в том случае, когда смешивают эксципиент с высокой температурой плавления и сахарид с низкой температурой плавления, чтобы повысить прочность полученного формованного вещества, можно применить стадию нагревания. «Нагревание» определяется температурой плавления содержащегося в нем сахарида с низкой температурой плавления. Однако его обычно нагревают до температуры не ниже, чем температура плавления сахарида с низкой температурой плавления, и ниже, чем температура плавления эксципиента с высокой температурой плавления. Продолжительность обработки можно установить в интервале от 0,5 до 120 минут, а предпочтительно, от 1 до 60 минут.
Кроме того, способ стабилизации состоящей из частиц композиции настоящего изобретения и способ превращения аморфной формы солифенацина или его соли в кристаллическую форму в состоящей из частиц композиции настоящего изобретения можно осуществить для состоящей из частиц композиции настоящего изобретения, полученной описанным выше способом при использовании упомянутого выше способа обработки, способствующей кристаллизации.
Краткое описание чертежей
На фиг. 1 показаны результаты дифракции рентгеновских лучей в порошке для сукцината солифенацина в кристаллической форме; ПЭГ 8000 (торговая марка: Macrogol 6000 производства Sanyo Chemical Industries, Ltd.), высушенный при помощи распыления продукт сукцината солифенацина, полученный при использовании ПЭГ 8000; высушенный при помощи распыления продукт сукцината солифенацина, полученный при использовании ГПМЦ (торговая марка: ТС-5Е производства Shinetsu Chemical Co., Ltd.), и высушенный при помощи распыления продукт сукцината солифенацина, полученный при использовании поливинилпирролидона (торговое название: PVP K90 производства BASF, в далее сокращенно ПВП), соответственно.
На фиг. 2 показаны результаты дифракции рентгеновских лучей в порошке для продукта с покрытием, полученного при покрытии кристаллической целлюлозы (торговая марка: Celphere, производства Asahi Chemical Industry Co., Ltd.), ПЭГ 8000 (торговая марка: Macrogol 6000, производства Sanyo Chemical Industries, Ltd.) в примере 3, и продукта с покрытием, полученного при использовании ГПМЦ в сравнительном примере 1.
На фиг. 3 показана взаимосвязь между количеством образующегося F1, который является основным продуктом разложения солифенацина, и Tg, или т.пл. связующего вещества, используемого в сочетании, после двухмесячного периода хранения (о: без обработки увлажнением,  : с обработкой увлажнением). : с обработкой увлажнением).
Наилучший способ осуществления изобретения
Состоящая из части фармацевтическая композиция солифенацина или его соли в настоящем изобретении будет описана подробно. Далее настоящее изобретение будет описано более подробно со ссылкой на примеры и сравнительные примеры, однако настоящее изобретение не следует истолковывать как ограниченное данными примерами.
Пример 1
Продукт с покрытием, полученный при покрытии сукцинатом солифенацина частицы ядра из кристаллической целлюлозы с использованием HPC-SL в качестве связующего вещества.
Десять частей сукцината солифенацина и 3,4 части гидроксипропилцеллюлозы (торговая марка: HPC-SL, производства Nippon Soda Co., Ltd., далее сокращенно ГПЦ (НРС)) растворяли при перемешивании в растворе смеси 26,6 частей воды и 26,6 частей метанола при использовании мешалки (MGM-66, производимой SHIBATA), в результате чего получали раствор кристаллической целлюлозы. Затем помещали 60 частей кристаллической целлюлозы (торговая марка: Celphere, производства Asahi Chemical Company Co., Ltd.) в гранулятор с псевдоожиженным слоем (FLO-1, производства Glatt Co., Ltd.) и наносили на Celphere покрытие распылением раствора лекарственного вещества при температуре всасываемого воздуха 50°С, объеме потока воздуха 1,00 м3/мин, скорости распыления раствора связующего вещества 4,0 г/мин и давлении распыляемого воздуха 3,0 кг/см3, в результате чего получали состоящую из частиц композицию настоящего изобретения.
Пример 2
Состоящую из частиц композицию, полученную в примере 1, подвергали кристаллизационной обработке увлажнением при 25°С и 75% в течение 12 часов, а затем высушиванию при 30°С и 40% в течение 3 часов, в результате чего получали состоящую из частиц композицию настоящего изобретения.
Пример 3
Продукт с покрытием, полученный при нанесении сукцината солифенацина на ядро частицы из кристаллической целлюлозы с использованием ПЭГ 6000 в качестве связующего вещества
Десять частей сукцината солифенацина и 3,4 части ПЭГ (торговая марка: Macrogol 6000, производства Sanyo Chemical Industries, Ltd.) растворяли при перемешивании в растворе смеси 26,6 частей воды и 26,6 частей метанола при использовании мешалки (MGM-66, производства SHIBATA), в результате чего получали раствор лекарственного вещества. Затем помещали 60 частей Celphere (производства Asahi Chemical Company Co., Ltd.) в гранулятор с псевдоожиженным слоем (FLO-1, производства Glatt Co., Ltd.) и наносили на Celphere покрытие распылением раствора лекарственного вещества при температуре всасываемого воздуха 50°С, объеме потока воздуха 0,97 м3/мин, скорости распыления раствора связующего вещества 10 г/мин и давлении распыляемого воздуха 3,0 кг/см3, в результате чего получали состоящую из частиц композицию настоящего изобретения.
Пример 4
Состоящую из частиц композицию, полученную в примере 3, подвергали кристаллизационной обработке увлажнением при 25°С и 75% в течение 12 часов, а затем высушиванию при 30°С и 40% в течение 3 часов, в результате чего получали состоящую из частиц композицию настоящего изобретения.
Пример 5
Продукт с покрытием, полученный при нанесении сукцината солифенацина на ядро частицы из кристаллической целлюлозы с использованием мальтозы в качестве связующего вещества
Десять частей сукцината солифенацина и 3,4 части мальтозы (торговая марка: SunMalto S, выпускаемой Sanwa Cornstarch Co., Ltd.) растворяли при перемешивании в растворе смеси 26,6 частей воды и 26,6 частей метанола при использовании мешалки (MGM-66, производимой SHIBATA), в результате чего получали раствор лекарственного вещества. Затем помещали 60 частей Celphere (производства Asahi Chemical Company Co., Ltd.) в гранулятор с псевдоожиженным слоем (FLO-1, производства Glatt Co., Ltd.) и наносили на Celphere покрытие распылением раствора лекарственного вещества при температуре всасываемого воздуха 60°С, объеме потока воздуха 0,98 м3/мин, скорости распыления раствора связующего вещества 3,0 г/мин и давлении распыляемого воздуха 3,0 кг/см3, в результате чего получали состоящую из частиц композицию настоящего изобретения.
Пример 6
Состоящую из частиц композицию, полученную в примере 5, подвергали кристаллизационной обработке увлажнением при 25°С и 75% в течение 12 часов, а затем высушиванию при 30°С и 40% в течение 3 часов, в результате чего получали состоящую из частиц композицию настоящего изобретения.
Пример 7
Продукт с покрытием, полученный при нанесении сукцината солифенацина на ядро частицы из кристаллической целлюлозы с использованием НЕС в качестве связующего вещества
Десять частей сукцината солифенацина и 3,4 части гидроксиэтилцеллюлозы (торговая марка: НЕС SЕ400, производства Daicel Chemical Industries, Ltd.) растворяли при перемешивании в растворе смеси 26,6 частей воды и 26,6 частей метанола при использовании мешалки (MGM-66, производства SHIBATA), в результате чего получали раствор лекарственного вещества. Затем помещали 60 частей Celphere (производства Asahi Chemical Company Co., Ltd.) в гранулятор с псевдоожиженным слоем (FLO-1, производства Glatt Co., Ltd.) и наносили на Celphere покрытие распылением раствора лекарственного вещества при температуре всасываемого воздуха 60°С, объеме потока воздуха 0,98 м3/мин, скорости распыления раствора связующего вещества 3,0 г/мин и давлении распыляемого воздуха 3,0 кг/см3, в результате чего получали состоящую из частиц композицию настоящего изобретения.
Пример 8
Состоящую из частиц композицию, полученную в примере 7, подвергали кристаллизационной обработке увлажнением при 25°С и 75% в течение 12 часов, а затем высушиванию при 30°С и 40% в течение 3 часов, в результате чего получали состоящую из частиц композицию настоящего изобретения.
Пример 9
Продукт с покрытием, полученный при нанесении сукцината солифенацина на ядро частицы из кристаллической целлюлозы с использованием Pluronic в качестве связующего вещества
Десять частей сукцината солифенацина и 3,4 части Pluronic F68 (торговая марка: Lutrol F68, производства BASF) растворяли при перемешивании в растворе смеси 26,6 частей воды и 26,6 частей метанола при использовании мешалки (MGM-66, производства SHIBATA), в результате чего получали раствор лекарственного вещества. Затем помещали 60 частей кристаллической целлюлозы (торговая марка: Celphere, производства Asahi Chemical Company Co., Ltd.) в гранулятор с псевдоожиженным слоем (FLO-1, производства Glatt Co., Ltd.) и наносили на кристаллическую целлюлозу покрытие распылением раствора лекарственного вещества при температуре всасываемого воздуха 54°С, объеме потока воздуха 0,94 м3/мин, скорости распыления раствора связующего вещества 3,0 г/мин и давлении распыляемого воздуха 3,0 кг/см3, в результате чего получали состоящую из частиц композицию настоящего изобретения.
Пример 10
Продукт с покрытием, полученный при нанесении на кристаллическую целлюлозу покрытия из сукцината солифенацина и ПЭГ
Десять частей сукцината солифенацина и 1 часть ПЭГ (торговая марка: Macrogol 6000, производства Sanyo Chemical Industries, Ltd.) растворяли при перемешивании в растворе смеси 16 частей воды и 16 частей метанола при использовании мешалки (MGM-66, производства SHIBATA), в результате чего получали раствор лекарственного вещества. Затем помещали 60 частей кристаллической целлюлозы (торговая марка: Celphere, производства Asahi Chemical Company Co., Ltd.) в гранулятор с псевдоожиженным слоем (FLO-1, производства Glatt Co., Ltd.) и наносили на кристаллическую целлюлозу покрытие распылением раствора лекарственного вещества при температуре всасываемого воздуха 45°С, объеме потока воздуха 1,0 м3/мин, скорости распыления раствора связующего вещества 2,0 г/мин и давлении распыляемого воздуха 2,0 кг/см3, в результате чего получали сыпучий порошок.
Пример 11
Продукт с покрытием, полученный при нанесении на кристаллическую целлюлозу покрытия из сукцината солифенацина и ПЭГ
Десять частей сукцината солифенацина и 10 частей ПЭГ (торговая марка: Macrogol 6000, производства Sanyo Chemical Industries, Ltd.) растворяли при перемешивании в растворе смеси 70 частей воды и 70 частей метанола при использовании мешалки (MGM-66, производства SHIBATA), в результате чего получали раствор лекарственного вещества. Затем помещали 60 частей кристаллической целлюлозы (торговая марка: Celphere, производства Asahi Chemical Company Co., Ltd.) в гранулятор с псевдоожиженным слоем (FLO-1, производства Glatt Co., Ltd.) и наносили на кристаллическую целлюлозу покрытие распылением раствора лекарственного вещества при температуре всасываемого воздуха 60°С, объеме потока воздуха 1 м3/мин, скорости распыления раствора связующего вещества 6,5 г/мин и давлении распыляемого воздуха 3,0 кг/см3, в результате чего получали сыпучий порошок.
Пример 12
При использовании другой композиции растворителей
Продукт с покрытием, полученный при нанесении на кристаллическую целлюлозу покрытия из сукцината солифенацина и ПЭГ
Десять частей сукцината солифенацина и 3,4 частей ПЭГ (торговая марка: Macrogol 6000, производства Sanyo Chemical Industries, Ltd.) растворяли при перемешивании в 53,2 частях воды при использовании мешалки (MGM-66, производства SHIBATA), в результате чего получали раствор лекарственного вещества. Затем помещали 60 частей кристаллической целлюлозы (торговая марка: Celphere, производства Asahi Chemical Company Co., Ltd.) в гранулятор с псевдоожиженным слоем (FLO-1, производства Glatt Co., Ltd.) и наносили на кристаллическую целлюлозу покрытие распылением раствора лекарственного вещества при температуре всасываемого воздуха 80°С, объеме потока воздуха 0,97 м3/мин, скорости распыления раствора связующего вещества 7,0 г/мин и давлении распыляемого воздуха 3,0 кг/см3, в результате чего получали сыпучий порошок.
Пример 13
Продукт с покрытием, полученный при нанесении на кристаллическую целлюлозу покрытия из сукцината солифенацина и ПЭГ (содержание лекарственного вещества: 50%)
Десять частей сукцината солифенацина и 3,4 части ПЭГ (торговая марка: Macrogol 6000, производства Sanyo Chemical Industries, Ltd.) растворяли при перемешивании в 26,6 части метанола и 26,6 части воды при использовании мешалки (MGM-66, производства SHIBATA), в результате чего получали раствор лекарственного вещества. Затем помещали 60 частей кристаллической целлюлозы (торговая марка: Celphere, производства Asahi Chemical Company Co., Ltd.) в гранулятор с псевдоожиженным слоем (FLO-1, производства Glatt Co., Ltd.) и наносили на кристаллическую целлюлозу покрытие распылением раствора лекарственного вещества при температуре всасываемого воздуха 54°С, объеме потока воздуха 0,94 м3/мин, скорости распыления раствора связующего вещества 3,0 г/мин и давлении распыляемого воздуха 3,0 кг/см3, в результате чего получали сыпучий порошок. Затем полученный порошок покрывали сверху следующим раствором лекарственного вещества, полученным при указанном выше соотношении состава с использованием того же устройства и тех же условий, в результате чего получали сыпучий порошок с более высоким содержанием лекарственного вещества (содержание лекарственного вещества: 50%).
Сравнительный пример 1
Продукт с покрытием, полученный при нанесении на ядро частицы из кристаллической целлюлозы покрытия из сукцината солифенацина с использованием ГПМЦ в качестве связующего вещества
Десять частей сукцината солифенацина и 3,4 части гидроксипропилметилцеллюлозы 2910 (торговая марка: ТС-5Е, производства Shinetsu Chemical Co., Ltd., далее сокращенно ГПМЦ) растворяли при перемешивании в растворе смеси 26,6 части воды и 26,6 части метанола при использовании мешалки (MGM-66, производства SHIBATA), в результате чего получали раствор лекарственного вещества. Затем помещали 60 частей Celphere (производства Asahi Chemical Company Co., Ltd.) в гранулятор с псевдоожиженным слоем (FLO-1, выпускаемый Glatt Co., Ltd.) и наносили на Celphere покрытие распылением раствора лекарственного вещества при температуре всасываемого воздуха 50°С, объеме потока воздуха 0,94 м3/мин, скорости распыления раствора связующего вещества 7,0 г/мин и давлении распыляемого воздуха 3,0 кг/см3, в результате чего получали состоящую из частиц композицию.
Сравнительный пример 2
Состоящую из частиц композицию, полученную в сравнительном примере 1, подвергали кристаллизационной обработке увлажнением при 25°С и 75% в течение 12 часов, а затем высушиванию при 30°С и 40% в течение 3 часов, в результате чего получали состоящую из частиц композицию.
Сравнительный пример 3
Продукт с покрытием, полученный при нанесении на ядро частицы из кристаллической целлюлозы покрытия из сукцината солифенацина с использованием ПВП в качестве связующего вещества
Десять частей сукцината солифенацина и 3,4 части поливинилпирролидона (торговая марка: PVP K90, производства BASF, далее сокращенно ПВП) растворяли при перемешивании в смешанном растворе 26,6 части воды и 26,6 части метанола при использовании мешалки (MGM-66, производства SHIBATA), в результате чего получали раствор лекарственного вещества. Затем помещали 60 частей Celphere (производства Asahi Chemical Company Co., Ltd.) в гранулятор с псевдоожиженным слоем (FLO-1, производства Glatt Co., Ltd.) и наносили на Celphere покрытие распылением раствора лекарственного вещества при температуре всасываемого воздуха 50°С, объеме потока воздуха 0,97 м3/мин, скорости распыления раствора связующего вещества 6 г/мин и давлении распыляемого воздуха 3,0 кг/см3, в результате чего получали состоящую из частиц композицию.
Сравнительный пример 4
Состоящую из частиц композицию, полученную в сравнительном примере 3, подвергали кристаллизационной обработке увлажнением при 25°С и 75% в течение 12 часов, а затем высушиванию при 30°С и 40% в течение 3 часов, в результате чего получали состоящую из частиц композицию.
Сравнительный пример 5
Продукт с покрытием, полученный при нанесении на ядро частицы из кристаллической целлюлозы покрытия из сукцината солифенацина с использованием метилцеллюлозы в качестве связующего вещества
Десять частей сукцината солифенацина и 3,4 части метилцеллюлозы (торговая марка: Metolose SM100, производства Shinetsu Chemical Co., Ltd., далее сокращенно МЦ) растворяли при перемешивании в смешанном растворе 53,2 части воды и 53,2 части метанола при использовании мешалки (MGM-66, производства SHIBATA), в результате чего получали раствор лекарственного вещества. Затем помещали 60 частей Celphere (производства Asahi Chemical Company Co., Ltd.) в гранулятор с псевдоожиженным слоем (FLO-1, производства Glatt Co., Ltd.) и наносили на Celphere покрытие распылением раствора лекарственного вещества при температуре всасываемого воздуха 55°С, объеме потока воздуха 0,97 м3/мин, скорости распыления раствора связующего вещества 5 г/мин и давлении распыляемого воздуха 3,0 кг/см3, в результате чего получали состоящую из частиц композицию.
Сравнительный пример 6
Состоящую из частиц композицию, полученную в сравнительном примере 5, подвергали кристаллизационной обработке увлажнением при 25°С и 75% в течение 12 часов, а затем высушиванию при 30°С и 40% в течение 3 часов, в результате чего получали состоящую из частиц композицию.
Экспериментальные примеры
<Результаты дифракции рентгеновских лучей в порошке>
Сначала проводили оценку взаимодействия между лекарственным веществом и полимерами.
Результаты дифракции рентгеновских лучей в порошке для высушенных методом распылительной сушки продуктов, содержащих ПЭГ и лекарственное вещество, использованное в примере, ГПМЦ или ПВП и лекарственное вещество, использованное в сравнительных примерах (в качестве прибора, с использованием RINT 1400: цилиндрическая лампа: Cu, напряжение на лампе: 40 кВ, ток в лампе: 40 мА, скорость сканирования: 3000°С/мин (Rigaku. Denki Co.)), представлены на фиг. 1. В качестве сравнения результаты для одного сукцината солифенацина в кристаллической форме и ПЭГ представлены вместе. В результате для каждого из продуктов, полученных при использовании ПЭГ, показанных в примерах, проявляются пики, происходящие от сукцината солифенацина в кристаллической форме, и было доказано, что лекарственное вещество в порошке существует в виде кристаллической формы. Напротив, для образцов, приведенных в сравнительных примерах, проявляется функция окаймления, типичная для аморфной структуры, показывающая, что лекарственное вещество существует в виде аморфной формы.
Далее на фиг. 2 приведены результаты дифракции рентгеновских лучей в порошке для продукта с покрытием, полученного при нанесении на Celphere покрытия ПЭГ, описанного на этот раз в примере (пример 3), и для продукта с покрытием, полученного при использовании ГПМЦ, описанного в сравнительном примере 1 (в качестве прибора, с использованием RINT 2000: цилиндрическая лампа: Cu, напряжение на лампе: 50 кВ, ток в лампе: 300 мА, скорость сканирования: 60000°С/мин (Rigaku. Denki Co.)). Как видно из чертежа, даже для продуктов с покрытием показано, что для образца с использованием ПЭГ проявляются кристаллические пики, происходящие от солифенацина.
<Результаты предварительного теста на стабильность>
Результаты предварительного теста на стабильность для данных состоящих из частиц композиций приведены в таблицах 1 и 2. Серийные измерения количества продуктов разложения после хранения композиций в течение определенного периода времени осуществляли методом высокоэффективной жидкостной хроматографии и приведено максимальное значение в ряду полученных относительных количеств продуктов разложения (то есть количество образовавшегося F1, который является основным продуктом разложения). В тесте при жестких условиях при 40°С и 75% RH, как в случае использования ГПМЦ, описанного в сравнительном примере 1, когда не проводили обработку увлажнением, продукт разложения наблюдали на уровне 0,34% лишь по прошествии 2-месячного периода времени, что в 8 раз превосходит концентрацию в начале хранения, составляющую 0,04%. Кроме того, что касается случая использования ПВП, описанного в сравнительном примере 3, когда не проводили обработку увлажнением, продукт разложения наблюдали на уровне 0,53% по прошествии 2-месячного периода времени, что превышает стандартное значение, составляющее 0,4%. Кроме того, что касается случая с использованием МЦ, описанного в сравнительном примере 5, когда не проводили обработку увлажнением, продукт разложения наблюдали на уровне 0,74% лишь по прошествии 2-месячного периода времени, что в 12 раз превосходит концентрацию в начале хранения, составляющую 0,06%. Даже в том случае, когда проводили обработку увлажнением для содействия кристаллизации, количество продукта разложения в любом из сравнительных примеров 2, 4 и 6 больше, чем в любом из примеров. В случае использования ГПМЦ, продукт разложения наблюдали на уровне 0,92% лишь по прошествии 2-месячного периода времени, что в 13 раз превосходит концентрацию в начале хранения, составляющую 0,07%. Кроме того, в случае использования МЦ, продукт разложения наблюдали на уровне 11,75% лишь по прошествии 2-месячного периода времени, что в 11 раз превосходит концентрацию в начале хранения, составляющую 1,09%.
С другой стороны, что касается образцов, описанных в примерах с 1 по 7, вне зависимости от того, проводили обработку увлажнением, или нет, количества продукта разложения за 2 месяца составляли 0,2%, или менее, и абсолютные значения были невелики, в 2-390 раз меньше, чем абсолютные значения для сравнительных примеров. Кроме того, было найдено, что солифенацин в любом из фармацевтических препаратов стабилен во времени, поскольку степень изменения была невелика. С другой стороны, было найдено, что в случае проведения обработки увлажнением для содействия кристаллизации имеет место тенденция к тому, что количество продуктов разложения почти не увеличивается, а солифенацин стабилен, как показано в примерах 2, 4, 6 и 8.
Значения Tg (если нет Tg, то т.пл.) связующих веществ, использованных в этот раз, приведены в таблице 3 и была изучена линейная регрессия взаимосвязи между количеством образующегося основного продукта разложения (F1 (%)) за 2 месяца и Tg (°С). В результате, как показано на фиг. 3, площади коэффициента корреляции (R2) составили 0,73 в случае, когда не проводили увлажнение и высушивание, и 0,60 в случае, когда проводили увлажнение и высушивание, что показало благоприятную положительную корреляцию.
Как описано выше, очевидно, что термодинамические параметры вспомогательного вещества, используемого в комбинации, являются преобладающими факторами в стабильности солифенацина в фармацевтическом препарате. Это явление возникает вследствие летучести, то есть Tg описанного выше связуюшего вещества, и считается, что чем выше Tg, тем легче аморфной форме непрерывно существовать в фармацевтическом препарате в аморфном состоянии, поэтому легко образуются продукты разложения.
Результаты предварительного теста на стабильность для состоящих из частиц композиций, содержащих сукцинат солифенацина
Условия хранения: 40°С, 75% RH, герметично закрыто.
Форма упаковки: упаковка в HDPE бутылки с металлической крышкой.
Объект тестирования: родственное вещество (количество образующегося основного продукта разложения, F1 (%)).
| Таблица 1 |
| Форма упаковки |
Упаковка в HDPE* бутылки с металлической крышкой |
 |
Пример 1 |
Пример 3 |
Пример 5 |
Пример 7 |
Сравни-тельный пример 1 |
Сравни-тельный пример 3 |
Сравни-тельный пример 5 |
| Начало хранения |
0,08 |
0,03 |
НО |
0,04 |
0,04 |
0,19 |
0,06 |
| 1 месяц |
0,18 |
0,04 |
0,10 |
0,05 |
0,20 |
0,46 |
0,39 |
| 2 месяца |
0,19 |
0,04 |
0,15 |
НТ |
0,34 |
0,53 |
0,74 |
| Форма упаковки |
Упаковка в HDPE* бутылки с металлической крышкой |
 |
Пример 10 |
Пример 11 |
Пример 12 |
Пример 13 |
| Начало хранения |
НО |
0,02 |
НО |
НО |
| 1 месяц |
0,09 |
0,04 |
0,03 |
0,04 |
| 2 месяца |
0,10 |
0,04 |
0,04 |
0,06 |
*HDPE: полиэтилен высокого давления
НО: не определяли, НТ: не тестировали |
Результаты предварительного теста на стабильность для состоящих из частиц композиций, содержащих сукцинат солифенацина, которые подвергались обработке увлажением
Условия хранения: 40°С, 75% RH, герметично закрыто.
Форма упаковки: упаковка в HDPE бутылки с металлической крышкой.
Объект тестирования: родственное вещество (количество образующегося основного продукта разложения, F1 (%)).
| Таблица 2 |
| Форма упаковки |
Упаковка в HDPE* бутылки с металлической крышкой |
 |
Пример 2 |
Пример 4 |
Пример 6 |
Пример 8 |
Сравни-тельный пример 2 |
Сравни-тельный пример 4 |
Сравни-тельный пример 6 |
| Начало хранения |
0,09 |
0,03 |
0,03 |
0,02 |
0,07 |
0,23 |
1,09 |
| 1 месяц |
0,10 |
0,03 |
0,09 |
0,03 |
0,70 |
0,40 |
12,16 |
| 2 месяца |
0,10 |
0,04 |
0,10 |
0,03 |
0,92 |
0,40 |
11,75 |
Температура стеклования Tg (°С) каждого связующего вещества
| Таблица 3 |
 |
Macrogol 6000*,** |
Maltose*,** |
HPC*** |
NEC*** |
EC*** |
PVP*** |
HPMC*** |
MC*,*** |
| Tg (°C) |
60 |
102 |
130 |
137
(135-140) |
157
(152-162) |
174 |
240 |
298
(290-305) |
Промышленная применимость
Технические признаки настоящего изобретения заключаются в том, что стабильную, состоящую из частиц фармацевтическую композицию можно получить, изготавливая ее при использовании определенного связующего вещества в состоящей из частиц фармацевтической композиции, содержащей солифенацин или его соль, и что можно получить более стабильную во времени, состоящую из частиц фармацевтическую композицию, проводя обработку, способствующую кристаллизации, такую как увлажнение и высушивание в случае необходимости, что оказывает значительное влияние на промышленное изготовление. Кроме того, использование состоящей из частиц фармацевтической композиции настоящего изобретения применимо в качестве способа, благодаря которому можно получить различные стабильные фармацевтические препараты солифенацина или его соли, для которых требовалась разработка в качестве прекрасного фармацевтического продукта при учащенном мочеиспускании или недержании мочи.
Формула изобретения
1. Стабильная, состоящая из частиц фармацевтическая композиция, содержащая солифенацин или его соль и связующее вещество с температурой стеклования или температурой плавления ниже 174°С, которое оказывает стабилизирующее действие на солифенацин или его соль.
2. Фармацевтическая композиция по п.1, в которой связующее вещество представляет собой одно или более веществ, выбранных из группы, включающей полиэтиленгликоль, полиэтиленоксид, блоксополимер полиоксиэтилена/полиоксипропилена, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, этилцеллюлозу, поливиниловый спирт, сополимер метакриловой кислоты, сополимер аминоалкилметакрилата, крахмал и мальтозу.
3. Фармацевтическая композиция по п.1 или 2, в которой связующее вещество представляет собой одно или более веществ, выбранных из группы, включающей полиэтиленгликоль, полиэтиленоксид, блоксополимер полиоксиэтилена/полиоксипропилена, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу и мальтозу.
4. Фармацевтическая композиция по п.1 или 2, в которой связующее вещество представляет собой одно или более веществ, выбранных из группы, включающей полиэтиленгликоль, блоксополимер полиоксиэтилена/полиоксипропилена и гидроксипропилцеллюлозу.
5. Фармацевтическая композиция по п.1 или 2, где связующее вещество представляет собой связующее вещество с температурой стеклования или температурой плавления не выше 140°С.
6. Фармацевтическая композиция по п.1 или 2, где композиция получена нанесением на ядро частицы покрытия в виде раствора и/или суспензии, содержащей солифенацин или его соль, и связующее вещество, которое характеризуется температурой стеклования или температурой плавления не выше 174°С.
7. Фармацевтическая композиция по п.1 или 2, стабильность которой повышена за счет дополнительного проведения обработки, способствующей кристаллизации.
8. Фармацевтическая композиция по п.7, где обработка, способствующая кристаллизации, включает одну или несколько обработок, выбранных из группы, состоящей из обработки увлажнением, обработки микроволновым излучением, обработку ультразвуковым излучением, обработку низкочастотным излучением и обработку термоэлектронным излучением.
9. Таблетка, распадающаяся в щечной полости, которая содержит фармацевтическую композицию по любому из пп.1-8.
10. Способ получения состоящей из частиц фармацевтической композиции, предусматривающий растворение или суспендирование солифенацина или его соли, и связующего вещества с температурой стеклования или температурой плавления ниже 174°С, с получением раствора лекарственного вещества и гранулированием указанного раствора лекарственного вещества.
11. Способ получения по п.10, в котором методика гранулирования представляет собой одну или несколько методик, выбранных из группы, включающей способ сублимационной сушки, способ распылительной сушки, способ гранулирования при высокоинтенсивном перемешивании, способ гранулирования в псевдоожиженном слое и способ гранулирования в барабане.
12. Способ получения по п.10, в котором методика гранулирования проводится посредством нанесением покрытия в виде раствора лекарственного вещества путем распыления на ядра частиц.
13. Способ получения по любому из пп.10-12, где связующее вещество представляет собой одно или более веществ, выбранных из группы, включающей полиэтиленгликоль, полиэтиленоксид, блоксополимер полиоксиэтилена/полиоксипропилена, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, этилцеллюлозу, поливиниловый спирт, сополимер метакриловой кислоты, сополимер аминоалкилметакрилата, крахмал и мальтозу.
14. Способ получения по любому из пп.10-12, где связующее вещество представляет собой одно или более веществ, выбранных из группы, включающей полиэтиленгликоль, полиэтиленоксид, блоксополимер полиоксиэтилена/полиоксипропилена, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу и мальтозу.
15. Способ получения по любому из пп.10-12, где связующее вещество представляет собой одно или более веществ, выбранных из группы, включающей полиэтиленгликоль, блоксополимер полиоксиэтилена/полиоксипропилена и гидроксипропилцеллюлозу.
16. Способ получения по любому из пп.10-12, где способ дополнительно включает этап проведения обработки, способствующей кристаллизации.
17. Способ получения по п.16, где обработка, способствующая кристаллизации, включает одну или несколько обработок, выбранных из группы, состоящей из обработки увлажнением, обработки микроволновым излучением, обработку ультразвуковым излучением, обработку низкочастотным излучением и обработку термоэлектронным излучением.
РИСУНКИ
|
|