|
(21), (22) Заявка: 2009117048/13, 04.05.2009
(24) Дата начала отсчета срока действия патента:
04.05.2009
(46) Опубликовано: 20.08.2010
(56) Список документов, цитированных в отчете о
поиске:
 2, 2008, с.29-37. ТЕМЕЖНИКОВА Н.Д. Лабораторная диагностика легионеллеза (обзор литературы). Клин. лаб. диагн. 2, 2008, с.29-37. ТЕМЕЖНИКОВА Н.Д. Лабораторная диагностика легионеллеза (обзор литературы). Клин. лаб. диагн.  11, 2008, с.34-39. 11, 2008, с.34-39.
Адрес для переписки:
410005, г.Саратов, ул. Университетская, 46, “РосНИПЧИ “Микроб”
|
(72) Автор(ы):
Портенко Светлана Анатольевна (RU),
Осина Наталья Александровна (RU),
Бугоркова Татьяна Васильевна (RU),
Кутырев Владимир Викторович (RU),
Яцышина Светлана Борисовна (RU),
Шипулин Герман Александрович (RU)
(73) Патентообладатель(и):
Федеральное государственное учреждение здравоохранения “Российский научно-исследовательский противочумный институт “Микроб” Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека” (“РосНИПЧИ “Микроб”) (RU)
|
(54) НАБОР ДЛЯ ДЕТЕКЦИИ ВОЗБУДИТЕЛЯ ЛЕГИОНЕЛЛЕЗА В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ И ОБЪЕКТАХ ОКРУЖАЮЩЕЙ СРЕДЫ
(57) Реферат:
Изобретение относится к области биотехнологии. Задачей изобретения является создание набора для детекции возбудителя легионеллеза в биологическом материале и объектах окружающей среды с возможностью использования его в ПЦР с электрофоретическим и гибридизационно-флуоресцентным учетом результатов. Набор для детекции возбудителя L. pneumophila содержит видоспецифичные праймеры Lp1 – 5′-GCTTGGTGCTGTGAAAGGTА-3′, Lp2 – 5′-CCTCCAATAAAGGAGATGCAA-3′ и зонд Lp-з – 5′-ROX-TCACCGTACGCACATCCGCA-BHQ2-3′. ДНК-мишенью для специфической амплификации L. pneumophila является фрагмент ДНК гена fisZ, расположенный в пределах с 397 по 758 нуклеотид полной последовательности локуса. Изобретение обеспечивает быстрое и высокоспецифичное выявление L. pneumophila 1-14 серогрупп в клинических образцах и пробах окружающей среды. 2 ил., 6 табл.
Изобретение относится к области биотехнологии и может быть использовано для выявления возбудителя легионеллеза в биологическом материале и объектах окружающей среды в практическом здравоохранении и службе Роспотребнадзора.
Легионеллез – одно из опасных инфекционных заболеваний, протекающих в форме тяжелых пневмоний, при которой до 15% случаев заканчиваются летальным исходом, или в форме респираторных заболеваний.
Большинство случаев легионеллеза связано с видом Legionella pneumophila, однако наибольшую опасность представляют Legionella pneumophila I серогруппы (1). Другие виды легионелл, такие как L. bozemanii, L. longbeachae, L. micdadei и др., вызывают заболевания преимущественно у лиц со сниженным иммунным статусом (2).
Легионеллы размножаются внутри макрофагов и локализуются в «неперевариваемой» фаголизосоме, поэтому для лечения используют антибактериальные препараты, способные проникать через мембраны клеток и накапливаться внутри вакуолей, что отличает лечение при пневмонии, вызванной другими возбудителями (3).
В связи с этим ранняя диагностика в клинических образцах возбудителя легионеллеза позволяет корректировать лечение больного и избежать тяжелых последствий, а своевременное и быстрое выявление его в объектах окружающей среды способствует предотвращению эпидемических вспышек.
Эффективность лечения больных и эпидемиологического надзора за Legionella spp. во многом определяется качеством лабораторной диагностики. Для диагностики легионеллеза применяют бактериологические, иммунологические, молекулярно-генетические методы исследования.
Бактериологический метод диагностики легионеллеза является «золотым стандартом», однако чувствительность его составляет в среднем не более 60%, несмотря на применение высококачественных питательных сред (4). Кроме невысокой чувствительности, недостатком культурального метода является его продолжительность. Максимальное количество видимых колоний вырастает на 5-8 сутки.
Иммунологические методы исследования обладают достаточно высокой чувствительностью, например, с помощью коммерческих ИФА тест-систем возможно обнаружение антигена Legionella pneumophila I серогруппы, чувствительность метода до 97%.
Иммунохроматографический анализ (ИХА) позволяет выявлять растворимый легионеллезный антиген в моче, и чувствительность достигает 95% (5, 6, 7). Недостатком данного метода является то, что он не может быть применен для другого клинического материала (мокрота, кровь, лаваж и др.) и проб из объектов окружающей среды.
Основной недостаток коммерческих ИФА и ИХА тест-систем состоит в том, что они не рассчитаны на диагностику инфекций, вызванных Legionella pneumophila 2-16 серогрупп и Legionella spp. (8).
В настоящее время наиболее перспективным считают молекулярно-генетические методы исследования, основанные на детекции ДНК возбудителя в исследуемом материале. Методом ПЦР возможно исследовать биологический материал – мокроту, бронхоальвеолярный лаваж, плевральную жидкость, мазки из ротоглотки, кровь, микро- и макроаутоптаты, а также пробы из объектов окружающей среды – воду, смывы, образцы биопленки, а также чистые культуры возбудителя.
Важным этапом при разработке ПЦР тест-систем является подбор мишеней для детекции возбудителя.
Известно использование в качестве мишеней для детекции Legionella spp. и L. pneumophila фрагментов генов mip, 16S рДНК, 5S рДНК, 23S-5S, dotA для ПЦР с учетом результатов методом электрофореза (ПЦР-ЭФ) (9, 10). Описанные мишени не обеспечивают достаточного уровня надежности для клинической диагностики легионеллеза при выполнении ПЦР-ЭФ (11).
При тщательном изучении нуклеотидных последовательностей генома Legionella pneumophila установлено, что вариабельность фрагмента гена 16S рДНК размером 1434 п.н. у штаммов Legionella pneumophila составила 2,0-6,0% (в среднем 31 полиморфный нуклеотид) между L. pneumophila и другими видами легионелл. При исследовании генов 23S-5S вариабельность среди штаммов L. pneumophila составила 7,4%, а между L. pneumophila и другими видами – 14,0-20,0%. Гены 23S (143 п.н.) и 5S (91 п.н.) обладали высокой гомологией, тогда как межгенный участок 23S-5S (102 п.н.) характеризовался высоким содержанием полиморфных нуклеотидов. Исходя из полученных данных, видно, что применение этих мишеней в ПЦР целесообразно только при использовании системы праймеров и зондов с учетом результатов в режиме «реального» времени (ПЦР-РВ).
Известен набор для детекции Legionella spp., содержащий праймеры для амплификации, для внутреннего контроля и зонд, позволяющий выявлять возбудителя с помощью ПЦР-РВ (12).
Известен коммерческий набор IQ-Check (BioRad) для скрининга легионелл в окружающей среде, сконструированный американскими исследователями (13). Однако описанный набор не предназначен для выявления возбудителя легионеллеза в биологическом материале (мокроте, бронхоальвеолярном лаваже, плевральной жидкости, мазках из ротоглотки, крови, микро- и макро-аутоптатов). Кроме того, высокая стоимость набора и невозможность выполнения с его помощью ПЦР с электрофоретическим учетом результатов ограничивают его применение в практических лабораториях, так как ПЦР с учетом результатов в режиме «реального времени» предусматривает использование дорогостоящего оборудования.
Проведенный поиск по патентам и научно-техническим источникам информации показал отсутствие сведений о наборах, предназначенных для выявления L. pneumophila методом ПЦР с электрофоретическим и гибридизационно-флюоресцентным учетом результатов, обеспечивающих детекцию возбудителя в биологическом материале и объектах окружающей среды, а также доступных для работы в лабораториях России. Таким образом, существует потребность в создании недорогого, чувствительного и специфичного набора, который нашел бы широкое применение в практическом здравоохранении.
Задачей изобретения является создание набора для детекции возбудителя легионеллеза в биологическом материале и объектах окружающей среды с возможностью использования его в ПЦР с электорофоретическим и гибридизационно-флуоресцентным учетом результатов.
Техническим результатом заявляемого изобретения является высокоспецифичное и быстрое выявление L. pneumophila 1-14 серогрупп в биологическом материале и объектах окружающей среды.
Технический результат достигается набором для детекции возбудителя легионеллеза. Заявляемый набор содержит видоспецифичные праймеры Lp1 – 5′-GCTTGGTGCTGTGAAAGGTА-3′, Lp2 – 5′-ССТССААТAAAGGAGATGCАА-3′ и зонд Lp-з – 5′-ROX-TCACCGTACGCACATCCGCA-BHQ2-3′, используемые при амплификации фрагмента гена ftsZ L. pneumophila в пределах с 397 по 758 нуклеотид полной последовательности локуса, имеющего нуклеотидную последовательность SEQ ID NO 1.
При конструировании набора для детекции возбудителя легионеллеза особое значение придавали выбору новых ДНК – мишеней.
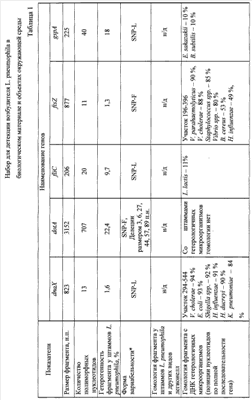
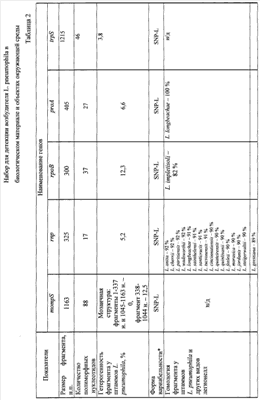
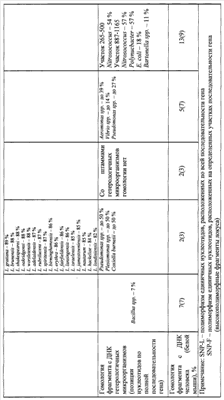
На основании анализа нуклеотидной последовательности генома возбудителя L. pneumophila проверены 10 генов, участвующих в жизнедеятельности клетки (house keeping), и отобран фрагмент гена ftsZ. Сравнительные данные нуклеотидных последовательностей 10 генов (жизнеобеспечения) L. pneumophila и других видов легионелл представлены в табл.1 и 2. Анализ нуклеотидных последовательностей указанных генов L. pneumophila и других видов легионелл представлен по генетической базе данных GenBank NCBI. Секвенирование фрагмента гена ftsZ у штаммов L. pneumophila, выделенных на территории Российской Федерации, и их сравнение с нуклеотидной последовательностью аналогичных участков у референс-штаммов L. pneumophila Philadelphia 1, Corby, Paris, Lens (GenBank NCBI: NC– 002942, CP 00675, NC– 006368, NC– 006369) показало, что наиболее перспективным для подбора праймеров при разработке ПЦР является фрагмент гена ftsZ, кодирующего синтез тубулиноподобного белка (с 397 по 758 нуклеотид). В результате тщательной проверки качества определения нуклеотидной последовательности была выведена консенсусная последовательность фрагмента гена ftsZ SEQ ID NO 1:

Обоснование выбора праймеров и зонда.
На следующей стадии конструировали набор олигонуклеотидных праймеров, специфических для детекции L. pneumophila. На основании консенсусной последовательности выбранного фрагмента гена ftsZ с помощью программы Primer Premier-V5 (Premier Bio Soft International) и алгоритма BLAST подобранны олигонуклеотидные праймеры, обеспечивающему амплификацию фрагмента данного локуса размером 185 п.н. Выбор праймеров осуществляли с учетом возможности регистрации результатов как в режиме «реального времени», так и с помощью электрофореза. Для использования праймеров в ПЦР-РВ подбирали зонд формата TaqMan (Lp-з) в онлайн-режиме на интернет-сайте www.genscript.com. Подобранные зонд Lp-з – 5′-ROX-TCACCGTACGCACATCCGCA-BHQ2-3′ к участку гена fisZ и праймеры: Lpl – 5′-GCTTGGTGCTGTGAAAGGTA-3′, Lp2 – 5′-CCTCCAATAAAGGAGATGCAA-3′ обеспечивают высокую специфичность реакции и позволяют выявлять возбудителя легионеллеза в образцах из объектов окружающей среды и биологического материала.
Специфичность праймеров оценивали методом множественного сравнения последовательностей, используя программное обеспечение, например BLAST (Lastaew для оценки полиморфизмов в сравниваемых последовательностях).
Данные праймеры не образуют вторичных структур (шпилек) и димеров, что способствует эффективному связыванию их с матричной ДНК.
Для определения аналитической чувствительности ПЦР использовали количественно охарактеризованные разведения рекомбинантных плазмид с клонированным фрагментом гена ftsZ, а также препаратов ДНК, выделенных из проб, содержащих L. pneumophila различных серогрупп в концентрации 1×103-1×105 м.к./мл. Результаты представлены на фиг.1 и 2.
Для характеристики специфичности ПЦР применяли выборку штаммов из целевой коллекции различных микроорганизмов. Специфичность ПЦР с праймерами на основе нуклеотидной последовательности ftsZ гена представлена в табл.3.
В результате проведенной оценки установлено, что выбранные праймеры и зонд для детекции L. pneumophila обладают высокой чувствительностью – 1·103 м.к./мл и специфичностью 100%.
Подобраны оптимальные параметры реакции амплификации с олигонуклеотидными праймерами и системой « праймер – зонд»:
– концентрация праймеров – от 5 до 16 пМ;
– концентрация зонда – от 1 до 5 пМ;
– концентрация MgCl – от 2 до 3 пМ;
– концентрация Tag-полимеразы – от 1 до 1,5 ед.;
– температура, при которой определяется уровень флуоресценции в пробах, – от 54 до 60°С;
– количество циклов, во время которых считывается флуоресценция, – от 30 до 40;
– температура отжига праймеров – от 50-64°С;
– время каждого шага цикла – 30-60 с;
– количество циклов: 35-40;
– время предварительной денатурации 1-5 мин;
– время завершающей элонгации 1-7 мин.
Экспериментально установлен оптимальный состав реакционной смеси для выполнения ПЦР-ЭФ. Подобранная концентрация праймеров Lp1 и Lp2, фермента Tag-полимеразы в концентрации 1,0 ед. и зонда Lp-з необходима и достаточна для обеспечения высокой специфичности и эффективности проведения реакции и позволяют получить легко детектируемые количества ампликонов. Сущность изобретения подтверждена примерами.
Пример 1. Выявление ДНК возбудителя L. pneumophila в биологическом материале (мокроте, бронхоальвеолярном лаваже, плевральной жидкости, мазках из ротоглотки, крови, микро- и макро-аутоптатов) с помощью ПЦР с электрофоретическим учетом результатов.
Для выявления возбудителя легионеллеза биологический материал обеззараживают путем добавления в подготовленные пробы 300 мкл раствора, содержащего 6 М гуанидинтиоцианата, и прогревают в течение 15 мин при температуре 64°С.
Выделение ДНК. В обеззараженные пробы добавляют 30 мкл сорбента, затем инкубируют в течение 10 мин при комнатной температуре, периодически встряхивая на вортексе 10 с, центрифугируют при 12000 об/мин в течение 20 с. Отбирают супернатант и к осадку добавляют 300 мкл раствора для отмывки сорбента от клеточного дебриса и других веществ, которые могут ингибировать реакцию амплификацию; перемешивают и центрифугируют при 12000 об/мин в течение 20 с. Супернатант удаляют, а к осадку добавляют 1 мл второго отмывочного раствора (10 мМ Трис, 50 мМ NaCl, 50% этанол), перемешивают и инкубируют при температуре 64°С. Надосадочную жидкость удаляют, проводят отмывку осадка 400 мкл ацетона, центрифугируют при 12000 об/мин в течение 20 с. Осадок высушивают в течение 10 мин при температуре 64°С, добавляют 50 мкл ТЕ-буфера и инкубируют при температуре 64°С в течение 10 мин, периодически встряхивая на вортексе, центрифугируют 12000 об/мин в течение 2 мин; супернатант используют в ПЦР.
Для проведения ПЦР в микропробирках объемом 0,5 мл готовят общую ПЦР-смесь исходя из того, что на одну пробу необходимо 10 мкл реакционной смеси и 0,2 мкл фермента Tag-полимеразы. Полученную смесь тщательно перемешивают на микроцентрифуге/встряхивателе и добавляют по 10 мкл в микропробирки, содержащие смесь праймеров и дНТФ под слоем парафина. Затем в пробирки вносят по 10 мкл ДНК, выделенных из исследуемых проб. Пробирка с отрицательным контрольным образцом содержит 10 мкл ТЕ-буфера, а пробирка с положительным контрольным образцом содержит 10 мкл ПКО ДНК L. pneumophila. Микропробирки, содержащие контрольные и опытные образцы, переносят в термоциклер, предварительно нагретый до 95°С, и проводят амплификацию по подобранной программе.
Детекцию продуктов амплификации проводят с помощью электрофореза в 1,5-2,5% агарозном геле по методике, приведенной в руководствах Л.А.Остермана и Т.Маниатиса (14,15). Результаты представлены в табл.3.
Пример 2. Выявление возбудителя L. pneumophila в объектах окружающей среды (вода, смывы, образцы биопленки).
Выявление возбудителя легионеллеза из объектов окружающей среды осуществляют аналогично примеру 1. Результаты детекции возбудителя легионеллеза в биологическом материале представлены в табл.4, а в пробах из объектов окружающей среды – в табл.5.
Параллельно с использованием заявляемого набора проводили исследования образцов другими методами. Полученные данные показали высокий процент совпадения результатов.
Пример 3. Детекция L. pneumophila в образцах, искусственно контаминированных микроорганизмом различных серогрупп.
Выделение ДНК и проведение ПЦР проводили аналогично примеру 1. Результаты представлены в табл.6.
Описанное изобретение не ограничивается указанными в таблицах объектами, которые предназначены только для иллюстрирования. Любые клинические образцы и объекты внешней среды находятся в сфере действия настоящего изобретения.
На основе выбранных праймеров и зонда сконструированы тест-системы «Ген L. pneumophila – РЭФ» и «Ген L. pneumophila – РГФ» для индикации L. pneumophila. Тест-системы прошли апробацию на базе Ставропольского НИПЧИ и ГНЦ вирусологии и биотехнологии «Вектор» и находятся на стадии внедрения в производство.
Таким образом, использование новой мишени и соответствующих наборов праймеров и зонда к ним для детекции L. pneumophila 1-14 серогрупп с помощью ПЦР с электрофоретическим и/или гибридизационно-флуоресцентным учетом результатов обеспечивает раннюю диагностику возбудителя (в течение 3-4 ч), что способствует эффективности лечения больных, повышает качество эпидемиологического надзора за объектами окружающей среды. Предлагаемый набор праймеров и зонда доступен для любой практической лаборатории здравоохранения, так как позволяет выполнять исследования при различном уровне оснащенности оборудованием и реактивами.
 
| Таблица 5 |
| Виды материала |
Кол-во исследованных проб |
ПЦР-ЭФ |
ПЦР-РГФ |
Бактериологический |
| Пробы воды из питьевого водоснабжения |
14 |
– |
– |
– |
| Смывы из систем питьевого водоснабжения |
15 |
– |
– |
– |
| Смывы из систем отопления |
10 |
– |
– |
– |
| Смывы из систем кондиционирования |
12 |
– |
– |
– |
| Пробы питьевой воды, искусственно инфицированные L. pneumophila Philadelphia 1 333151 АТСС |
3 |
+ |
+ |
+ |
| Смывы с кондиционера, искусственно инфицированные L. pneumophila Philadelphia 1 333151 АТСС |
3 |
+ |
+ |
+ |
| Всего: |
57 |
57 |
57 |
57 |
| Примечание: (-) – отрицательный результат; |
| (+) – положительный результат. |
Формула изобретения
Набор для детекции возбудителя L. pneumophila в биологическом материале и объектах окружающей среды, содержащий видоспецифичные праймеры Lp1 – 5′-GCTTGGTGCTGTGAAAGGTA-3′, Lp2 – 5′-CCTCCAATAAAGGAGATGCAA-3′ и зонд Lp-з – 5′-ROX-ТСACCGTACGCACATCCGCA-BHQ2-3′, используемые при амплификации фрагмента гена ftsZ L.pneumophila в пределах с 397 по 758 нуклеотид полной последовательности локуса, имеющего нуклеотидную последовательность SEQ ID NO 1.
РИСУНКИ
|