|
|
(21), (22) Заявка: 2007104776/13, 05.07.2005
(24) Дата начала отсчета срока действия патента:
05.07.2005
(30) Конвенционный приоритет:
08.07.2004 CU 2004-0147
(43) Дата публикации заявки: 20.08.2008
(46) Опубликовано: 10.08.2010
(56) Список документов, цитированных в отчете о
поиске:
EP 0226800 A, 01.07.1987. ОКАМОТО Т. et al., Activation of human matrix metalloproteinases by various bacterial proteinases, J. Biol. Chem., 1997, v.272, n.9, p.6059-6066. FR 2519021 A, 01.07.1983. RU 2229305, 27.05.2004.
(85) Дата перевода заявки PCT на национальную фазу:
08.02.2007
(86) Заявка PCT:
CU 2005/000003 20050705
(87) Публикация PCT:
WO 2006/005268 20060119
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег.  517 517
|
(72) Автор(ы):
АБРААНТЕС ПЕРЕС Мария дель Кармен (CU),
РЕЕС ГОНСАЛЕС Хесус (CU),
ВЕЛИС РИОС Глория (CU),
МАРТИНЕС ДИАС Эдуардо (CU),
ГАСМУРИ ГОНСАЛЕС Каридад Анаис (CU),
ГАРСИЯ СУАРЕС Хосе (CU),
БЕКЕТ РОМЕРО Моника (CU),
ГОНСАЛЕС ЛОПЕС Луис Хавьер (CU),
КАСТЕЛЬЯНОС СЕРРА Лила Роса (CU),
СЕЛЬМАН-ОУСЕЙН СОСА Мануэль (CU),
ГОМЕС РЬЕРА Рауль (CU),
ГАВИЛОНДО КАУЛИ Хорхе Виктор (CU)
(73) Патентообладатель(и):
СЕНТРО ДЕ ИНЖЕНЬЕРИА ГЕНЕТИКА И БИОТЕКНОЛОГИА (CU)
|
(54) ПРОТИВООПУХОЛЕВАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) И ЕЕ ПРИМЕНЕНИЕ
(57) Реферат:
Изобретение относится к области биотехнологии, конкретно к композициям, способным ингибировать рост опухолевых клеток разного гистологического происхождения и активированных эндотелиальных клеток, и может быть использовано в медицине. Компонентами указанных композиций являются непротеолитические полипептидные фрагменты серрализинов, выбранных из ARA1, ARA2, ARA3 и ARA4. Указанные фрагменты серрализинов также комбинируют с продигиосинами и с антителами или их антигенсвязывающими фрагментами, направленными на антигены опухолевых клеток, что усиливает противоопухолевый эффект композиции. Изобретение позволяет получить композицию с более высокой антипролиферативной активностью, по сравнению с композицией, содержащей целые молекулы серрализинов. 3 н. и 5 з.п. ф-лы, 7 табл., 16 ил.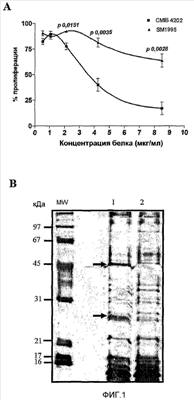
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области биотехнологии, фармацевтической промышленности и, в частности, к получению композиции, способной ингибировать рост опухолевых клеток. Данная композиция содержит полипептидные фрагменты серрализинов, полученные деградацией интактного белка, которые обладают более высокой антипролиферативной активностью, чем целые молекулы серрализина. Указанные фрагменты принадлежат C-концу серрализинов, от внутреннего метионина последовательности до конца молекулы, и их комбинация с продигиозинами усиливает противоопухолевое действие данной композиции.
УРОВЕНЬ ТЕХНИКИ
Химиотерапия рака традиционно направлена на ингибирование пролиферации раковых клеток. Тем не менее, в последние годы возрос интерес к противоопухолевым продуктам, которые индуцируют апоптоз, поскольку рак, как установили, является патологией, связанной с относительным дефектом апоптоза, а не избыточной пролиферацией.
Бактерии или их экстракты применяли для лечения рака почти 100 лет. Наиболее цитируемо сообщение врача и хирурга William B. Coley из the Memorial Hospital города New Cork, называемого Sloan-Kettering Memorial Hospital. Он заметил, что многие из его пациентов с несколькими типами рака чувствовали регрессию опухоли после инфицирования патогенными бактериями (Coley, W.B. 1991 – перепечатано из 1893-. Clin. Orthop. 262:3).
Устойчивость к опухолям инфицированных пациентов или животных приписали противоопухолевому иммунитету, опосредованному сопутствующими клетками (Paglia, P. and Guzman, С.A. 1998. Cancer immunol. Immunother. 46:88). Идею о том, что инфекция патогенными бактериями или простейшими может активировать регрессию рака посредством активации врожденного или адаптивного иммунитета, недавно обсуждали Hunter et al. (Hunter, C.A., Yu, D., Gee, M., Ngo, С.V., Sevignani, C., Goldschmidt, M., Golovkina, T.V., Evans, S., Lee, W.F. and Thomas-Tekhonenko, A. 2001. J. Immunol. 166:5878). Они продемонстрировали, что ткани, инфицированные T. Gondii, вырабатывают некоторые растворимые антиангиогенные факторы, предотвращающие формирование кровеносных сосудов в опухолях, которые могут представлять потенциальный терапевтический интерес. Данный процесс формирования новых капилляров, известный как ангиогенез, стал важным центром внимания для внедрения новых способов лечения рака и его метастазов. Поиск антиангиогенных факторов является основанием для новых противораковых терапевтических стратегий (Folkman, J. 2003. Seminars in Cancer Biology. 13:159). Недавно применение анаэробных бактерий в качестве химиотерапевтических и избирательных противососудистых средств привело к значительной регрессии подкожных (sc) опухолей у мышей. Данное лечение называют сочетанной бактериолитической терапией (COBALTO) (Dang, L.H., Bettegowda, C., Huso, D.L., Klnzler, K.W. and Vogelstein, B. 2001. Proc Natl Arad Sci USA. 98: 15155). Тем не менее, живые бактерии вызывают значительную токсичность и побочные реакции, которые ограничивают их применение против рака у человека.
За последние годы появилось несколько сообщений, указывающих на то, что анаэробные бактерии выделяют окислительно-восстановительные белки, которые индуцируют апоптоз клеток опухоли (Yamada, Т., Goto, M., Punj, V., Zaborina, O. and Chen, M.L. 2002. Proc. Natl. Acad. Sci. USA. 99: 14088; Goto, M., Yamada, Т., Kimbara, K., Homer, J., Newcomb, M., Gupta, Т.К. and Chakrabarty, A.M. 2003. Mol Microbiol. 47:549). Предположили, что окислительно-восстановительные белки можно включить в группу растворимых белков, которые секретировали предки прокариотических клеток, и их функциями могла являться элиминация предков эукариотических клеток (Punj, V. and Chakrabarty, A.M. 2003. Cellular Microbiology. 5:225). В целом мало известно относительно выработки растворимых секретируемых факторов данными прокариотическими организмами, которые могут специфическим образом действовать на раковые клетки, вызывая их смерть и, параллельно, регрессию опухоли.
Serratia marcescens является факультативной анаэробной бактерией. Из нескольких ее штаммов получили несколько препаратов с противоопухолевыми свойствами; наиболее изученными являются: [a] ImuVert® (Budagov, R.S. and Ulianova, L.P. 2001. Radiats Biol Radioecol Russian. 41:38), препарат рибосомальных мембран, которые активируют иммунную систему пациента; [b] протеаза из Serratia Mr 56000 (Wu, J., Akaike, Т., Hayashida, K., Okamoto, Т., Okuyama, A. and Maeda, H. 2001. Jpn. J. Cancer Res. 92:439), которая индуцирует смерть клеток посредством некроза в зависимости от экспрессии  -2-макроглобулина; и [с] продигиозины, семейство пигментов, которые действуют как иммуносупрессоры и антиканцерогены посредством индукции апоптоза (Montaner, В. and Perez Tomas, R. 2003. Curr Cancer Drug Targets. 3:57; Perez Tomas, R. у Montaner, B. 2003. Histol Histopathol. 18:379). Авторы настоящего изобретения получили непротеолитические фрагменты серрализинов с более высокой цитотоксической активностью, чем целые молекулы. Это позволяет сочетать данные фрагменты с низкими дозами продигиозина, снижая токсичность, сообщенную для пигмента, и повышая антипролиферативное действие на опухолевые клетки. -2-макроглобулина; и [с] продигиозины, семейство пигментов, которые действуют как иммуносупрессоры и антиканцерогены посредством индукции апоптоза (Montaner, В. and Perez Tomas, R. 2003. Curr Cancer Drug Targets. 3:57; Perez Tomas, R. у Montaner, B. 2003. Histol Histopathol. 18:379). Авторы настоящего изобретения получили непротеолитические фрагменты серрализинов с более высокой цитотоксической активностью, чем целые молекулы. Это позволяет сочетать данные фрагменты с низкими дозами продигиозина, снижая токсичность, сообщенную для пигмента, и повышая антипролиферативное действие на опухолевые клетки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Композиции по данному изобретению способны ингибировать рост опухолевых клеток и составлены из полипептидных фрагментов серрализинов с более высоким антипролиферативным действием, чем целые молекулы серрализинов, которые можно сочетать с продигиозинами, что усиливает их противоопухолевое действие.
В данном изобретении описано получение препарата MG2327, в котором совместно присутствуют как полипептиды, так и продигиозины, который обладает широким спектром цитотоксического действия на линии малигнизированных клеток, с избирательным действием на трансформированные опухолевые клетки и, в особенности, на клетки, активированные для роста. Изучение чувствительности на разных линиях клеток, опухолевых или нет, демонстрирует, что линии нормальных клеток являются только слабочувствительными к препарату MG2327, в то время как клетки, полученные из меланомы, карциномы гортани, фибросарком, карцином печени и карциномы шейки матки (положительные или нет на вирус папилломы человека) являются очень чувствительными. Карциномы гематопоэтического происхождения являются менее чувствительными. Клетки HUVEC, активированные для роста, являются более чувствительными к MG2327, чем неактивированные. Препарат MG2327 способен действовать специфично на фактор, экспрессируемый или сверхэкспрессируемый в процессе деления клетки. Данные факторы образуют терапевтические мишени против рака и других заболеваний пролиферативного происхождения. Более того, данные факторы также образуют мишени для ранней диагностики заболеваний, вызываемых избыточной пролиферацией, или неконтролируемой пролиферацией дифференцированных или недифференцированных клеток. Составы с контролированным высвобождением, содержащие данные молекулы, можно направить на данные пролиферирующие мишени, действуя специфичным способом на них, потому что нормальные клетки более устойчивы к их действию.
Чтобы продемонстрировать противоопухолевую активность препарата MG2327, мышам BALB/c вводили внутрибрюшинной инокуляцией опухолевые клетки CB Hep.1 миелоидного происхождения, способные вызывать асцитические опухоли у мышей (Fontirrochi, G., Duenas, M., Fernandez de Cossio, M.E., Fuentes, P., Perez, M., Mainet, D., Ayala, M., Gavilondo, J.V. and Duarte, C. 1993. Biotecnol Aplic. 10: 24-30). Через 10 суток мышам инъецировали внутрибрюшинно препарат MG2327 или PBS. 60% животных, обработанных из расчета 1 мг/кг, выжили, в то время как только 25% контролей оставались живыми спустя 45 суток после начала обработки (фиг.8). Полную регрессию опухоли наблюдали у обработанных выживших животных, демонстрировавших здоровое состояние, в то время как у контролей опухоли прогрессировали, формируя большие плотные образования, и мыши демонстрировали ухудшение общего состояния.
Мыши BALB/c, с опухолью миелоидного происхождения, обработанные однократной дозой препарата MG2327 из расчета 1 мг/кг массы, выжили с полной регрессией. Та же самая доза повышает выживаемость, при значительном уменьшении объема опухоли, мышей BALB/c с опухолью, произошедшей от трансформированного фибробласта E6/E7. MG2327 защищает мышей BALB/c от приживления миелоидных опухолей.
Препарат MG2327 получили в результате оптимизации условий культивирования для выработки антипролиферативных молекул, которые образуют защитное вещество от приживления и развития злокачественных опухолей, таким образом, в качестве индуктора выработки антипролиферативных, апоптотических и антиангиогенных молекул в нормальных и опухолевых клетках, что можно успешно применять в профилактике и лечении рака, более того, других заболеваний, связанных с данными явлениями. Штамм CMIB 4202 сверхэкспрессирует растворимые белки в диапазоне 45-50 и 20-30 кДа (50 и 25 кДа посредством SDS-PAGE, с коэффициентом детерминации 0,984). Для фракции 25 кДа, обозначенной как p25, показали зависимую от дозы сильную антипролиферативную активность в эксперименте, выполненном на линии клеток HEp-2, инкубированных с ЭДТА, в то время как фракция 50 кДа, обозначенная как p50, не ингибирует рост. Однако при инкубации с 5 мкМ Zn2SO4 для фракции p50 показали антипролиферативную активность, но менее сильную, чем для фракции p25. IC50 фракций p25 и p50 представляли собой 0,48 нМ и 16 нМ соответственно.
Выделенные белковые биомолекулы с антипролиферативным действием (полипептиды и продигиозин) получали согласно настоящему изобретению посредством только одной стадии хроматографии: ионного обмена с применением ступенчатого градиента NaCl. Применяли матрицу из сефарозы Fast Flow DEAE или QAE, уравновешенную 50 мМ фосфатным буфером, pH 8,00. Элюцию осуществляли ступенчатым градиентом NaCl: 50 мМ фосфатный буфер-0,1 M NaCl, pH 8,00; 50 мМ фосфатный буфер-0,2 M NaCl, pH 8,00; 50 мМ-2 M NaCl, pH 8,00, и в конце элюировали фракцию пигмента, абсорбированную на матрице, этанолом от абсолютного до 70%. Результаты подтверждают, что белковый компонент препарата 25 кДа обладает большей способностью, чем белковый компонент 50 кДа того же препарата, ингибировать рост клеточных опухолей, и оба обладают in vitro биологической активностью в индивидуальной форме.
Деградация p50 приводила к появлению фрагментов нескольких молекулярных масс, которые включали в себя фрагменты 25 кДа. Повышенную деградацию p50 получали посредством высокой температуры, и образование p25 было пропорционально данному повышению температуры, в то время как повышение температуры уменьшало p50. Поликлональные антитела к p50, полученные в овце, узнавали p25 в анализе вестерн-блоттингом; таким образом, p25 возникает как продукт деградации белка p50. Количество продуктов деградации возрастало пропорционально антипролиферативной активности продуктов деградации. Данные результаты подтверждают, что аутолиз p50 способен давать фрагменты деградации с антипролиферативной активностью более сильной, чем у исходной молекулы p50. Кроме того, белок p25 также индуцирует полную регрессию злокачественных опухолей миелоидного происхождения. Фрагменты p50 можно генетически конъюгировать посредством некоторой уже известной методологии фрагментов антител и создавать иммунотоксины, применимые для лечения заболевания пролиферативной этиологии. Также данный фрагмент сам по себе или в сочетании с другими белковыми молекулами можно применять в качестве носителя изнутри клеток или специфических рецепторов. Фрагмент p50 также может подвергаться воздействию внешней среды отрегулированной системы высвобождения для поддержания направленного контроля от специфичных мишеней.
Протеолитическую активность p50 ингибировали 7 мМ ЭДТА и продемонстрировали, что p50 является металлопротеазой, принадлежащей к семейству серрализинов, как идентифицировано масс-спектрометрией.
Основное сходство обнаружили у вида с идентификатором PRZN_SERSP и PRZN_SERMA в базе данных белков Swissprot. Белок p25, очищаемый хроматографией, не обладал ферментативной активностью, и он соответствует некаталитической карбоксиконцевой области серрализинов.
Белковые компоненты и продигиозин составили в одну и ту же композицию, которая значительно повышала (p<0,005), ингибирующий эффект по сравнению с индивидуальными компонентами данного состава. Композиции получили, поддерживая то же соотношение белков и продигиозина, которое использовали для оценки индивидуальных компонентов. В такой композиции продигиозин можно обнаружить в концентрации 0,1-100 нМ и фрагменты серрализина между 0,1-150 мкг/мл.
Получение композиции, содержащей полипептидные фрагменты, полученные из серрализинов, с повышенным антипролиферативным эффектом по сравнению с целыми молекулами серрализинов, и сочетание фрагментов серрализинов и продигиозинов, которое избирательно усиливает биологическую активность композиции.
Кроме того, данные полипептидные фрагменты обладают апоптотическим действием на раковые клетки. Данное апоптотическое действие включает в себя фрагментацию митохондрий, микротрубочек и ДНК, усиливающую сигнал программируемой клеточной гибели, с применением уменьшенных доз данной композиции. Данные события также наблюдали с сочетанной композицией полипептида и продигиозина.
Антиангиогенное действие MG2327 и антипролиферативных фрагментов полипептидов оценивали способом формирования трубчатой структуры в матригеле. Микроциркуляторные эндотелиальные клетки человека (HMEC) инкубировали с нецитоксическими концентрациями MG2327 и его фракций p25 и р50. Окончательный результат оценивали, принимая во внимание длину сформированных трубчатых структур и количество соединений между ними. Для этого применяли программу обработки изображений Pro Express 4.5. Результат подтверждает, что обработка композицией MG2327 позволяет объяснить, что обработка белком и его антипролиферативными полипептидами ингибирует в значительной степени (p<0,05, ANOVA) дифференцировку или созревание эндотелиальных клеток, демонстрируя, что MG2327, а также выделенные из него полипептиды, обладают антиангиогенной активностью.
Апоптотическая, антиангиогенная активность и избирательность являются одними из характеристик, наиболее важных для рассматриваемой композиции по данному изобретению, в качестве потенциального лекарственного и защитного средства против рака.
Продемонстрировали, что сочетание фрагментов серрализинов и продигиозинов является более сильным и избирательным, чем индивидуальные компоненты, в качестве противораковых средств. Данные полипептиды можно применять для получения рекомбинантных токсинов и иммунотоксинов для профилактики и лечения рака или других заболеваний, связанных с пролиферацией эндотелиальных и трансформированных клеток.
Данные полипептиды и их возможное сочетание с продигиозинами применимы в фармацевтической промышленности для получения вакцинных препаратов, лекарственных или диагностических средств для применения у человека или животных против рака и других патологий пролиферативного типа, которые являются высоко избирательными и обладают широким спектром действия.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1. Взаимодействием S. marcescens с опухолевыми клетками CB Hep.1 получают бактериальные штаммы с высокой антипролиферативной способностью и с модифицированной экспрессией белка. A – Выживаемость клеток. Через 72 часа выживаемость клеток подсчитывали способом MTT. Для штамма CMIB 4202 показали сильное антипролиферативное действие на опухолевые клетки человека HEp-2, в то время как действие штамма SM1995 являлось очень слабым. Данные результаты являлись усреднением трех независимых экспериментов с применением четырех повторностей на образец. B – Электрофорез SDS-PAGE (окрашивание серебром). CMIB 4202 сверхэкспрессировал растворимые белки, мигрировавшие приблизительно 25 и 50 кДа.
Фиг.2. Антипролиферативная активность фракций 25 и 50 кДа на линии клеток HEp-2. Жизнеспособность клеток определяли способом MTT и выражали в процентах относительно контрольных клеток. Фракции выделяли из гелей, содержащих SDS (окрашенных имидазол-цинком) и ренатурировали. Для фракции приблизительно 25 кДа показали сильную антипролиферативную активность (IC50 0,35 нМ/мл), в то время как p50 оказалась неспособной ингибировать рост. При добавлении 5 мкМ Zn4SO2 к p50 наблюдали возрастание антипролиферативной активности (IC50 45 нМ/мл), хотя ниже, чем у p25. Кривые построили на основе средних значений пяти независимых экспериментов и начертили с соответствующим стандартным отклонением (SD).
Фиг.3. Кинетика экспрессии белка и продигиозина штаммом CBMI 4202. Экспрессия продигиозинов в культурную среду происходит в течение переходного периода от фазы роста к стационарной фазе, где CBMI 4202 достигает более высокого времени удвоения. A – Кинетика времени удвоения клеток. B – Эффективность экспрессии продигиозина (продукт/биомасса). C – Кинетика антипролиферативного действия на клетки Hep-2, определяемая способом MTT. D – Кинетика роста клеток, определяемая по оптической плотности и биосинтезу белка.
Фиг.4. Чувствительность опухолевых и нормальных клеток человека к обработке MG2327. Нормальные клетки обладают низкой чувствительностью, и клетки гематопоэтического происхождения менее чувствительны, чем остальные из анализируемых клеточных линий. В то же время, клетки, активированные для роста (HUVEC bFGF), и клетки, полученные из опухолевых злокачественных повреждений, являются более чувствительными.
Фиг.5. Анализы выживаемости мышей BALB/c после обработки или без обработки препаратом MG2327 и введения опухоли CBHep1. A – Доза 1 мг/кг индуцировала регрессию опухоли у 60% обработанных животных, в то время как 100% необработанных животных умерли в течение 60 суток. B – Через сорок пять суток после инокуляции опухолевых клеток, необработанные животные демонстрировали крайне ослабленное состояние, с наличием твердых опухолей и асцита, в то время как животные, обработанные из расчета 1 мг/кг не демонстрировали признаков опухолей и жили дольше 300 суток.
Фиг.6. Противоопухолевое действие MG2327 на опухолевой модели 3T316. A – На графике ежесуточного среднего значения для каждой группы выявлены статистически значимые отличия между объемами опухолей обработанных и необработанных животных (p<0,003). Анализ роста опухоли в течение времени не показал значительных вариаций (p=0,109) для группы, обработанной MG2327, в то время как отрицательная контрольная группа демонстрировала значительное увеличение данного параметра (p=0,04). B – Выживаемость обработанных и необработанных животных.
Фиг.7. Выделение белковых активных фракций из MG2327. (A) Электрофорез SDS-PAGE (12,5%). Результаты окрашивания по Кумасси. На дорожке 1 показан образец, соответствующий элюции 0,2 M NaCl, pH 8,00, где белковая полоса, соответствующая 50 кДа, может заслуживать внимания. На дорожке 2 показана белковая полоса 25 кДа. Окрашивание осуществляли по способу Кумасси. (B) Антипролиферативное действие на HEp-2 белков p50 и p25 на опухолевых клетках человека. Отношение доза-эффект для p25, p50 и MG2327 выражали в виде концентрации общего белка.
Фиг.8. Антипролиферативные эффекты активных фракций, выделенных из MG2327, на клетки HEp-2. Для белков 50 и 25 кДа, содержащихся в MG2327, показана активность ингибирования роста. Сочетание данных белков с продигиозинами уменьшало дозу, способную ингибировать рост 50% опухолевых клеток при сравнении с контролем (IC50).
Фиг.9. SDS-PAGE и вестерн-блоттинг. (A) Образец белка, полученный из MG2327. Образец анализировали в геле SDS-PAGE (12%) и окрашивали серебром. (B) Белковые полосы приблизительно 50 и 25 кДа (стрелки) вырезали из сходного геля, окрашенного имидазол-цинком, ренатурировали и снова разделяли в новом SDS-PAGE. Белки переносили на нитроцеллюлозную мембрану и вестерн-блоттинга проявили с помощью антитела к p50. Поликлональные антитела, полученные в козе, являлись способными узнавать p25 и продукты деградации p50, и не узнавать полосы неродственных белков (Neg C).
Фиг.10. Аутолиз p50. A – Электрофорез SDS-PAGE: 1-24°C, 2-37°C, 3-45°C, 4-60°C, 5-4°C. B – Денситометрический анализ p50 и p25 продемонстрировал, что с увеличением температуры инкубации уменьшается интенсивность полосы p50, в то время как увеличивается интенсивность полосы p25.
Фиг.11. p50, очищенный хроматографией на сефарозе Fast Flow DEAE. p50 (элюированный 0,2 M NaCl) дает продукты деградации с более высокой антипролиферативной активностью, чем родительская молекула.
Фиг.12. Ферментативная активность p25 и p50, полученных разными хроматографиями. A – Для p25 не продемонстрирована активность, в то время как для p50 показана ферментативная активность. B – 7 мМ ЭДТА полностью ингибировала ферментативную активность p50.
Фиг.13. MG2327 индуцировал зависящую от времени фрагментацию ДНК опухолевых клеток P3X63Ag8. Спустя 6 часов инкубации можно наблюдать олигонуклеосомные фрагменты, и их количество возрастает со временем, достигая обычного апоптотического профиля с олигонуклеосомными фрагментами 180-200 пар оснований к 24 часам.
Фиг.14. Ультраструктура клеток миеломы мыши P3X63AG8, обработанных и необработанных (контрольные клетки) препаратом MG из расчета 22 мкг/мл. (A) На электронной микрофотографии контрольных клеток миеломы мыши P3X63Ag8 показаны цитоплазма и ядро данных клеток, с показанной ультраструктурой, обычной для нормальных клеток, и ультраструктура митохондрий, обычная для нормальных клеток: митохондриальный матрикс обладал более высокой плотностью, чем окружающая цитоплазма  (B) К 2 часам после обработки посредством MG в цитоплазме присутствовали вакуолизированные тельца (которые отчасти происходят из измененных митохондрий (B) К 2 часам после обработки посредством MG в цитоплазме присутствовали вакуолизированные тельца (которые отчасти происходят из измененных митохондрий  набухание митохондрий и разрушение крист набухание митохондрий и разрушение крист  нормальное ядро нормальное ядро  (C, D) Агрегацию митохондрий и индивидуальные кристы, которые становятся слившимися (C, D) Агрегацию митохондрий и индивидуальные кристы, которые становятся слившимися  также наблюдали после двух часов обработки в (В). (Е) Электронные микрофотографии с апоптотической морфологией: конденсация также наблюдали после двух часов обработки в (В). (Е) Электронные микрофотографии с апоптотической морфологией: конденсация  (маргинация и фрагментация хроматина (маргинация и фрагментация хроматина  и апоптотические тельца ( и апоптотические тельца ( ) к 6 часам после обработки посредством MG2327. (F) Апоптоз выявляли по компактизации хроматина, в ядре наблюдали периферические бляшки конденсированного хроматина. {Обратите внимание, что набухание митохондрий и разрушение крист, всех цитоплазматических мембран присутствовало во все разные моменты времени}. Увеличения: ×6000 (Е), ×10000 (A, B, D), ×15000 (C) и ×40000 (F). ) к 6 часам после обработки посредством MG2327. (F) Апоптоз выявляли по компактизации хроматина, в ядре наблюдали периферические бляшки конденсированного хроматина. {Обратите внимание, что набухание митохондрий и разрушение крист, всех цитоплазматических мембран присутствовало во все разные моменты времени}. Увеличения: ×6000 (Е), ×10000 (A, B, D), ×15000 (C) и ×40000 (F).
Фиг.15. Влияние MG2327, p25 и p50 (очищенных хроматографией) и их фракций на дифференцировку эндотелиальных клеток в матригеле. Клетки HMEC культивировали в условиях активации (10 нг/мл EGF, 1 мкг/мл гидрокортизона) в присутствии сходных концентраций MG2327 (A), p50 (B) и p25 (C), без обработки (E) и без активации (D). На диаграмме (F) сгруппированы результаты 3 независимых экспериментов, демонстрируя ингибирующую активность MG2327 и его компонентов на формирование трубчатых сетей в матригеле. Как MG2327, так и p50 полностью обращали индуцированную активацию до уровня неактивированных клеток (ANOVA MG2327, p50 и CN p>0,05. Клетки, обработанные p25, демонстрировали более низкий показатель формирования сети, чем наблюдаемый для MG2327 и p50 (непарный t p=0,0107 и p=0,0498 соответственно).
Фиг.16. Выживаемость BALB/c, иммунизированных или нет MG2327, и с введенными клетками миеломы X63. При применении 3 и 6 доз из расчета 1 мг/кг MG2327, у 100% иммунизированных животных произошло отторжение миелоидной опухоли.
ПРИМЕРЫ
Пример 1. Получение штамма CMIB 4202
Для получения штаммов бактерий, вырабатывающих противоопухолевые молекулы, дикий тип Serratia Marcescens SM1995, выделенный из брюшной поверхности мышей BALB/c, смешали с опухолевыми клетками CBHEp.1 (Aleman, M.R., Valdes, R., Perez, M., Ibarra, N., Reyes, В., Gonzalez, M., Mendoza, O., Padilla, S., Agraz, A. and Rodriguez, M.P. 2000. Biopharm 13:48-52) и инокулировали внутрибрюшинно мышам BALB/c, предварительно инокулированным 10 сутками ранее тяжелым жидким вазелином. Спустя восемь суток после инокуляции смесями клеток производили каждые 2 суток извлечения из асцитов. Анализировали кинетику роста опухоли, и осуществляли микробиологический контроль асцита каждого животного, дающего представление о регрессии опухоли.
Выделенные бактерии выращивали в различных средах и условиях культивирования. Супернатанты культуры стерилизовали фильтрованием, применяя мембранные фильтры 0,22 мкМ, и их токсичность оценивали на клетках CBHEp.1. Штамм с более высокой цитотоксичностью отдали на хранение под инвентарным номером CMIB4202 в the Collection of Microorganism with Biotechnological Importance of the Center of Genetic Engineering and Biotechnology, Habana city, Cuba. CMIB4202 и его родительский штамм SM1995 культивировали в параллели в ферментерах на 5 л в средах с пептон-глицерином при 28°C. Для стерильного фильтрата CMIB 4202 показана активность, зависимая от дозы, в то время как фильтрат SM1995 обладает только незначительной активностью на линии раковых клеток человека HEp-2 (фиг.1A) в анализе антипролиферативности с применением способа MTT (Skehan, P., Storeng, R., Scudiero, D., Monks, A., Mcmahon, J., Vistica, D., Warren, J. Т., Bokesch, H., Kenney, S. and Boyd, M.R. 1990. J. Natl. Cancer. Inst. 82:1107).
Штамм CMIB 4202 сверхэкспрессировал растворимые белки в диапазонах 45-50 и 20-30 кДа (50 и 25 кДа, как определено посредством SDS-PAGE, с коэффициентом детерминации 0,984), фиг.1B.
Для фракции p25, выделенной из полос, присутствующих в гелях с SDS, окрашенных имидазол-цинком (Hardy, E., Santana, H., Sosa, A., Hernandez, L., Fernandez-Padron, C. and Castellanos-Serra, L. 1996. Analytical Biochemistry. 240:150), показали сильную антипролиферативную активность на HEp-2, зависимую от дозы, в то время как фракция p50 не ингибирует рост клеток.
Тем не менее, для p50 при инкубации с 5 мкМ Zn2SO4 продемонстрировали антипролиферативную активность, но более низкую по сравнению с наблюдаемой для p25 (фиг.2). IC50 фракций p25 и p50 являлись 0,48 нМ и 16 нМ, соответственно.
С целью сравнить способность обоих штаммов экспрессировать белки применяли факториал ANOVA. Значение вероятности взаимодействия не являлось значимым (p=0,93). С другой стороны, вероятность обоих основных эффектов показала, что оба белка экспрессированы в существенно отличающихся количествах (р=0,01) и что это количество сильно зависит от штамма (р=0,0004). Более того, имелись существенные различия в экспрессии этих белков между обоими штаммами (р<0,001).
Пример 2. Получение антипролиферативного препарата MG2327
Для получения антипролиферативного препарата части штамма S. marcensces CMIB 4202 получили 1 л культуры микроорганизма, и культуральные среды оптимизировали для получения интересующих молекул (фиг.3). Культуру CMIB 4202 центрифугировали при 12000 g и 4°C 30 минут. Супернатант собирали и затем фильтровали через молекулярный фильтр 0,2 мкм в стерильных условиях. Объем супернатанта уменьшали в 10 раз в тех же самых стерильных условиях. Объем супернатанта уменьшали в 10 раз, применяя мембрану с пределом исключения 10 кДа и диализуя против PBS при 4°C в течение 24 часов в физиологических условиях. Диализованное вещество фильтровали в стерильных условиях и распределяли по флаконам по 5 мл. Препарат хранили при 4°C и назвали MG2327.
Увеличение загрузки ферментера до 5 л осуществляли в условиях, уже определенных в скрининге: среды пептон-глицерин при 28°C 14 часов, аэрация 1 vvm, 250 об/мин и начальная оптическая плотность 0,1. pH культуральных сред доводили до физиологического, и ферментацию осуществляли при свободном pH. Остальное осуществляли в той же форме, как в скрининге.
Пример 3. Характеристика антипролиферативной активности препарата MG2327 in vitro
Для характеристики антипролиферативной активности MG2327 in vitro оценивали панель линий клеток человека (табл.1). Всего 2000 клеток, за исключением PBMC (20000), высевали в 96-луночные культуральные планшеты и добавляли различные концентрации MG2327. Через 72 часа количество выживших клеток оценивали добавлением MTT (Skehan, P., Storeng, R., Scudiero, D., Monks, A., Mcmahon, J., Vistica, D., Warren, J.Т., Bokesch, H., Kenney, S. and Boyd, M.R. 1990. J Natl Cancer Inst. 82:1107). Растворимые продукты формазана детектировали при 540 нм в многоканальном спектрофотометре для прочтения планшетов. Для MG2327 показали широкий диапазон цитотоксической активности против анализируемых линий клеток человека. IC50 находился в диапазоне мкг/мл.
Таблица 1
Клетки и культуральные среды,применяемые при исследовании in vitro |
| FIBHUM |
ФИБРОБЛАСТЫ, ПРОИСХОДЯЩИЕ ИЗ КРАЙНЕЙ ПЛОТИ ЧЕЛОВЕКА, P 3-6 |
DMEM, 15% FBS*, ИНСУЛИН 30 мкг/мл |
| H82 |
Карцинома легкого человека |
RPMI 1640, 10% FBS |
| MDA-MB145S |
Аденокарцинома молочной железы человека |
DMEM, 10% FBS |
| Colo-205 |
Карцинома толстой кишки человека |
RPMI 1640, 10% FBS |
| HT1080 |
Фибросаркома человека |
DMEM, 10% FBS |
| Hela |
Карцинома шейки матки человека |
DMEM, 10% FBS |
| HEp-2 |
Карцинома гортани человека |
MEM, 10% FBS |
| HepG2 |
Гепатокарцинома человека |
DMEM, 10% FBS |
| A375 |
Меланома человека |
DMEM, 10% FBS |
| PBMC |
Периферические мононуклеарные клетки человека |
RPMI 1640, 10% FBS, IL-2 |
| HuT78 |
T-клеточная лимфома кожи человека |
RPMI 1640, 10% FBS |
| HL60 |
Промиелоцитарный лейкоз человека |
RPMI 1640, 10% FBS |
| K562 |
Эритролейкоз человека |
RPMI 1640, 10% FBS |
| CRL 1682 |
Аденокарцинома поджелудочной железы человека |
RPMI 1640, 10% FBS |
| A 431 |
Аденокарцинома наружных женских половых органов человека |
RPMI 1640, 10% FBS |
| SiHa |
Карцинома шейки матки человека |
RPMI 1640, 10% FBS |
| CaSki |
Карцинома шейки матки человека |
RPMI 1640, 10% FBS |
| HUVEC |
Эндотелиальные сосудистые клетки человека |
M199 30% FBS 10 нг/мл bFGF |
| *FBS: Фетальная бычья сыворотка |
Избирательность MG2327 сравнивали с коммерческим лекарственным средством доксорубицином (DXR), применяя линию клеток HT1080 (из фибросаркомы) и первичные фибробласты. Антипролиферативный анализ применяли, как описано выше. Серийные разведения DXR и препарата MG2327 применяли от 10 мкг/мл и строили кривую по пяти точкам. Показатель смертности рассчитывали для каждой точки как отношение между процентной долей смертности для HT1080 и процентной долей смертности для первичных фибробластов. Более сильные различия детектировали при более низких тестируемых концентрациях (MG2327 9:1, DXR 1,7:1). MG2327 являлся очень избирательным при концентрациях ниже 2 мкг/мл.
Клетки HEp-2, происходящие из карциномы гортани, являются очень устойчивыми к противоопухолевым средствам, применяемым в клинике, по сравнению с другими анализированными линиями клеток. По этой причине авторы настоящего изобретения применяли их как модель для изучения in vitro эффектов препарата MG2327. Сравнение кривых цитотоксичности, построенных для клеток HEp-2, обработанных известными противоопухолевыми средствами, продемонстрировало сходные результаты (40%) пролиферации при 3 мкг/мл для препарата MG2327, цисплатина (CDDP), доксорубицина (DXR), винкристина (VC), винбластина (VB) и таксола (TX) (p>0,05, критерий ANOVA). В тех же самых условиях для других противоопухолевых средств, подобных ара-C, метотрексату (MTC), блеомицину (Bleo) и циклофосфамиду (CPA), не продемонстрировали эффект. CDDP является одним из противоопухолевых средств, разрешенных FDA для лечения рака гортани, и анализ кривых выживаемости для препарата MG2327 и CDDP показал сходные значения для IC10, IC50 и IC90.
Изучение чувствительности разных канцерогенных линий клеток и неканцерогенных (фиг.4) показало, что линии нормальных клеток являются мало чувствительными, в то время как меланома, карцинома гортани, фибросаркома, гепатокарцинома и карцинома шейки матки (носитель вируса папилломы человека) являются очень чувствительными. Карциномы гематопоэтического происхождения являются менее чувствительными. Активированные для роста клетки HUVEC являются более чувствительными к препарату MG2327, чем не активированные.
Предыдущий результат продемонстрировал, что препарат MG2327 обладает широким спектром цитотоксического действия на линии злокачественных клеток, с избирательным влиянием на опухолевые/трансформированные клетки, и клетки, активированные для роста.
Пример 4. Противоопухолевая активность препарата MG2327
Для демонстрации противоопухолевой активности препарата MG2327 авторы настоящего изобретения применяли мышей BALB/c, которым прививали внутрибрюшинно (i.p.) опухолевые клетки CB Hep.1 миелоидного происхождения, способные давать начало мышиным асцитным опухолям (Fontirrochi, G., Duenas, M., Fernandez de Cossio, M.E., Fuentes, P., Perez, M., Mainet, D., Ayala, M., Gavilondo, J.V. and Duarte, C. 1993. Biotecnol Aplic. 10:24-30). Спустя 10 суток мышам инъецировали i.p. MG2327 или PBS. Шестьдесят процентов животных, обработанных из расчета 1 мг/кг массы, выжили, в то время как только 25 процентов контролей жили до 45 суток после начальной обработки (фиг.5). Полную регрессию опухоли наблюдали у всех обработанных выживших животных, которые демонстрировали здоровое состояние, в то время как у контролей опухоли прогрессировали, формируя большие плотные образования, и животные демонстрировали нездоровое общее состояние.
У мышей BALB/c, несущих опухоль из фибробластов, трансформированных E6/E7, возрастала выживаемость после обработки препаратом MG2327, демонстрируя значительное уменьшение объема опухоли.
Также для оценки противоопухолевой активности MG2327 применяли модель рака, ассоциированного с вирусом папилломы человека (HPV16), разработанную Hernandez et al. (Hernandez, P., Merina, N., Lopez-Ocejo, O. and Arana, M.J. 2000. Biochem Biophys Res Commun. 270:119-124). Две группы мышей BALB/c инокулировали подкожно (s.c.) 2·106 клеток 3Т316 в левую брюшную область. Через 48 часов дозу из расчета 0,75 мг/кг массы MG2327 или PBS вводили s.c, близко к первоначальной инокуляции клетками в контрольной группе; ежесуточные измерения производили циркулем. Объем опухоли подсчитывали с применением общепринятой формулы: V=0,52·a2·b, где a представляет собой ширину, а b представляет собой длину горизонтального периметра опухоли (Hernandez, P., Merina, N., Lopez-Ocejo, O. and Arana, M.J. 2000. Biochem Biophys Res Commun. 270:119-124). Характер изменения показан на фиг.6.
Различия во времени развития опухоли являлись статистически значимыми (p=0,0054) между обработанными и необработанными животными. Изучение отношения время:обработка посредством критерия ANOVA показало, что та же самая величина различия не сохраняется между обработанными и необработанными группами; это указывает на существование различия, связанного с примененной к животным обработкой.
При применении критерия Уилкоксона к парным данным измерений между 21 и 45 сутками для каждой группы авторы настоящего изобретения детектировали значимое увеличение объема опухоли для контрольной группы (p=0,043), что не имеет места в случае обработанной группы (фиг.6A). Для анализа существования значимых различий между группами в каждой точке оценивания, авторы настоящего изобретения применяли U-критерий Манна-Уитни, которым детектировали значимые различия, за исключением первой точки (p<0,01). Также авторы настоящего изобретения детектировали важное различие в скорости роста опухоли. Кривые роста приводили к одной линии, и наклоны вычисляли из уравнения, полученного наилучшим приближением. Сравнение наклонов показывает, что опухоль в контрольной группе росла со скоростью значительно выше наблюдаемой скорости для обработанной группы (p=0,0088).
Мыши контрольной группы умерли между 45 и 64 сутками вследствие прививания опухоли, в то время как животные в обработанной группе начали умирать на 52 сутки, с 20% выживших, которые остались со временем (170 суток), фиг.6B.
При приведении данных по выживаемости к Байесовской иерархической модели (регрессия Вейбула с 500 итерациями) авторы настоящего изобретения получили статистически значимое различие (p=0,02447), которое подтвердили, когда показали, что доверительные интервалы среднего времени выживаемости полностью не пересекались.
Пример 5. Фракционирование препарата MG2327. Выделение небелковых биомолекул
Для определения состава препарата MG2327 осуществляли его молекулярное фракционирование и оценивали его способность ингибировать in vitro рост клеток линии опухолевых клеток человека Hep-2.
Полисахаридную фракцию (tr=6,85 минут) отделяли хроматографией в геле Aminex HPX 87-N (размеры: 300×7,8 мм, элюция: 0,5 мл/мин). Применяли образцы фруктозы tr=13,15 минуты, глюкозы tr=12,12 минуты, дисахарида tr=9,40 минуты, трисахарида tr=8,24 минуты, полисахарида tr=7,01 минуты. Фракцию пигмента отделяли на колонке butyl-TSK MERCK, уравновешенной 20 мМ фосфата, pH=7, в котором остаток задерживался на матрице, с которой затем элюировали, используя абсолютный этанол. Спектр поглощения (100% этанол, pH 5,00) полученного продукта демонстрировал полосу с максимумом при 470 и 490 нм, и максимальный пик при 537 нм, которые соответствуют характерному описанию для мономеров и димера, соответственно, с опубликованной антипролиферативной активностью (Perez-Tomas, R. and Montaner, B. 2003 Histol. Histopathol. 18:379-385; Montaner, В., and Perez-Thomas, R. 2003. Curr Cancer Drug Targets. 3:57-65). Для выделенного полисахарида не показали ингибирующего эффекта, в то время как для фракции, соответствующей продигиозину, показали антипролиферативную активность, зависимую от дозы.
Пример 6. Фракционирование препарата MG2327. Выделение белковых биомолекул с антипролиферативным эффектом посредством только одного этапа хроматографии: ионного обмена в ступенчатом градиенте NaCl. Состав
Препарат MG2327 наносили на матрицу из сефарозы Fast Flow DEAE, уравновешенную 50 мМ фосфатным буфером, pH 8,00. Элюцию осуществляли ступенчатым градиентом NaCl: 50 мМ фосфатный буфер-0,1 M NaCl, pH 8,00; 50 мМ фосфатный буфер-0,2 M NaCl, pH 8,00; 50 мМ фосфатный буфер-2 M NaCl, pH 8,00, и в конце элюировали фракцию пигмента, абсорбированную на матрице, 70%-абсолютным этанолом.
Для фракции, соответствующей 0,2 M NaCl, pH 8,00, и первого элюата, собранного из фракции, которая не сорбировалась (сходила), показали антипролиферативную активность, зависимую от дозы, в уже описанном тесте. Посредством электрофореза SDS-PAGE наблюдали белковую полосу на уровне 50 кДа и максимальную полосу (чистота >90%) на уровне 25 кДа соответственно (фиг.7A). Молекулярную массу подсчитывали с помощью функции, которая связывает молекулярную массу коммерческого образца с расстоянием миграции полос; r2=0,984.
На фиг.7B показан антипролиферативный эффект p50 и р25 в сравнении с препаратом MG2327. Для p50 и p25 показали антипролиферативный эффект на HEp.2.
В табл.2 показаны сравнительные результаты между p50, p25 и препаратом MG2327, с применением статистического анализа вариантов (ANOVA). С его помощью осуществили сравнение реакций на каждую примененную дозу. С его помощью можно наблюдать, что существуют значимые отличия между активностями трех анализируемых образцов. Данные отличия зависят от примененных доз. При высокой концентрации компонентов препарата (9 и 18 мкг/мл) существуют значимые отличия между фракциями 25 и 50 кДа, где фракция 25 кДа была наиболее активной, не являясь более активной при более низких концентрациях (2,25 и 4,5 мкг/мл).
Таблица 2
Сравнительные результаты между белковыми компонентами и препаратом MG2327,
с применением статистического анализа вариантов (ANOVA) |
| Концентрация (мкг/мл) |
ANOVA |
| Между выборками |
25-50 |
25-MG2327 |
50-MG2327 |
| 2,25 |
0,0110 |
0,0649 |
0,0089 |
0,0958 |
| 4,5 |
0,0316 |
0,0685 |
0,0081 |
0,3728 |
| 9 |
0,0040 |
0,0318 |
0,0151 |
0,4271 |
| 18 |
0,0015 |
0,0243 |
0,3206 |
0,0243 |
Между белковым компонентом 50 кДа и препаратом MG2327 существовало значимое отличие для дозы 18 мкг/мл, где препарат являлся наиболее активным, давая ингибирование роста 100% опухолевых клеток, в то время как данный белковый компонент 50 кДа давал приблизительно 80% ингибирование роста. Для доз 2,25, 4,5 и 9 мкг/мл не существовало значимого отличия между реакцией, вызванной фракцией 50 кДа и препаратом MG2327.
Однако активность белкового компонента 25 кДа значительно отличалась от препарата MG2327 для доз 2,5, 4,5 и 9 мкг/мл, где для белкового компонента 25 кДа показали наибольшую биологическую активность; и для дозы 18 мкг/мл не существовало значимого отличия, поскольку оба образца давали одинаковое ингибирование 100% опухолевых клеток.
Данные результаты свидетельствуют, что белковый компонент 25 кДа обладает основной способностью ингибировать рост опухолевых клеток, чем белковый компонент 50 кДа, и что оба компонента обладали биологической активностью in vitro независимым образом.
Данные процедуры очистки повторяли еще три раза и получили однородные результаты.
Пример 7. Композиция полипептида серрализина с продигиозином
Белковые компоненты и продигиозин составлены в одну и ту же композицию, которая значительно (p<0,005) повышает ингибирующий эффект по сравнению с эффектом индивидуального компонента. На фиг.8 показан IC50 антипролиферативных биомолекул, выделенных из препарата MG2327 и их сочетаний. Препарат MG2327 обозначает суммарный белок; композицию получили, сохраняя фиксированным то же самое соотношение белка и продигиозина, которое применяли для оценки индивидуальных компонентов. В такой композиции продигиозин можно обнаружить в концентрации 0,1-100 нМ, и фрагменты серрализина в концентрации 0,1-150 мкг/мл.
Пример 8. p25 образуется из p50
Анти-p50, полученные в овце, применяли, чтобы узнать о взаимоотношении между p25 и p50. MG2327 наносили на 12% гель SDS-PAGE и окрашивали имидазол-цинком (Hardy, E., Santana, H., Sosa, A., Hernandez, L, Fernandez-Padron, С and Castellanos-Serra, L. 1996. Analytical biochemistry. 240:150-152). Белковые полосы приблизительно 50 и 25 кДа (фиг.9) вырезали, ренатурировали в геле и наносили на SDS-PAGE. Их переносили на нитроцеллюлозную мембрану и осуществляли вестерн-блоттинг. Поликлональные антитела к p50 узнавали p25; и молекулярные массы продуктов деградации p50 оценивали посредством окрашенных маркеров молекулярной массы (Bio-Rad). Вестерн-блот, приведенный здесь, является представителем трех одинаковых экспериментов.
Пример 9. Продукты температурной деградации p50 более активны, чем сам p50
p50, полученный в примере 6, инкубировали при различных температурах и тестировали его антипролиферативную активность на HEp.2, применяя способ MTT, ранее уже описанный. Профиль деградации, полученный при каждом условии (4, 37, 45 и 60°C), количественно определяли денситометрией.
Образование фрагмента, получаемого деградацией, являлось прямо пропорциональным повышению температуры, таким образом, с уменьшением количества p50 возрастало количество p25, как продукта деградации p50 (фиг.10). Для продуктов деградации p50 показали более сильную антипролиферативную активность, чем для исходного p50 (фиг.11).
Пример 10. p25 вызывает регрессию злокачественных опухолей
Белок p25, полученный хроматографией, описанной в примере 6, применяли в обращенно-фазной хроматографии (RP-HPLC), чтобы подтвердить его гомогенность и чистоту. В ней применяли градиент ацетонитрила 0-100 в течение 100 минут. Наблюдали пик белков с чистотой больше 90%, что демонстрировало гомогенность и чистоту элюата.
p25 затем инъецировали i.p. мышам BALB/c спустя 8 суток после прививания и полного развития миелоидной опухоли P3X63Ag8. Доза p25 из расчета 22 мкг/кг массы вызывала полную регрессию у 80% обработанных животных. Отрицательные контроли умирали в конце 30 суток, где уже развивались плотные опухоли.
Пример 11. p50 является металлопротеазой, в то время как p25 не обладает протеолитической активностью
Модифицированный способ Anson и Mirsky (Anson, M.L., Mirsky, A.E. 1932. J. Gen. Physiol. 16:59) с применением казеина в качестве субстрата, в лаборатории авторов настоящего изобретения приспособили для трипсина (y=1,9314x-0,682; R2=0,999). Белковые фракции, полученные хроматографией, описанной в примере 6, анализировали данным способом. Для p50 показали протеолитическую активность, которую ингибировала 7 мМ ЭДТА; таким образом, p50 является металлопротеазой. Для p25 не показали ферментативную активность, фиг.12.
Способ зимогена с применением желатина в качестве субстрата (Vacca, A., Iurlaro, M., Ribatti, D., Minischetti, M., Nico, В., Ria, R., Pellegrino, A. and Dammacco, F. 1999. Blood. 94:4143-4155) применяли для подтверждения протеолитической активности p50 и p25. Более того, анализировали ферментативную способность деградации p50. В данном анализе белок p50, полученный хроматографией, описанной в примере 6, демонстрировал ферментативную активность. Для фракции белковой полосы в геле на уровне 25 кДа (из MG2327) показали протеолитическую активность, в то время как для p25, полученного хроматографией, не показали данную активность.
Пример 12. Идентификация антипролиферативных полипептидов 25 кДа из MG2327
Для идентификации белков с антипролиферативной активностью, присутствующих в полосе 25 кДа, данную полосу вырезали из геля SDS-PAGE (как описано в примере 8) с нанесенным MG2327. Полосу инкубировали 5 минут в 1 мл буфера Tris/HCl (100 мМ, pH 8,5) до полной прозрачности. Полосу разрезали на маленькие кубики приблизительно 1 мм3, производили абсорбцию ацетонитрилом, регидратировали в наименьшем объеме бикарбоната аммония (25 мМ), содержащего трипсин или LEP в концентрации 12,5 нг/мкл. Для расщепления в геле его инкубировали при 37°C 18 часов в термостатируемом перемешивателе.
Результирующие пептиды из расщепления посредством LEP анализировали посредством MALDI-MS. Сигналы наибольшей интенсивности от моноизотопных ионов вводили в программу ProFound для идентификации интересующего белка в базе данных последовательностей. Хотя авторы настоящего изобретения не накладывали никакого таксономического ограничения на поиск в базе данных, протеазу 50 кДа из Serratia marcescens EC 3.4.24.40 выбрали за наибольшее сходство. Четыре пептида (51-57, 58-66, 67-80 и 81-90) принадлежат N-концевой области, и один (402-409) принадлежит C-концевой области белка. Молекулярная масса EC 3.4.24.40 превосходит массу присутствующих в анализируемой полосе (приблизительно 25 кДа, как оценили посредством SDS-PAGE). Данное открытие позволяет предположить, что полоса 25 кДа содержит два фрагмента, совместно мигрирующих в районе 25 кДа, обладающих сходством к белку 50 кДа EC 3.4.24.40, принадлежащему к семейству серрализинов.
Для подтверждения данной гипотезы полосу 25 кДа белка подвергли расщеплению трипсином. Полученный спектр ESI-MS пептидов подвергли деконволюции, и сигналы наибольшей интенсивности ввели в программу Profound. Данным способом обнаружили белок, такой же, как идентифицированный ранее (EC 3.4.24.40). Последовательность, покрываемая расщеплением трипсином (21%), оказалась больше, по сравнению с предыдущим расщеплением (10%). Карта покрытия последовательности основана на семи пептидах, которые очень хорошо совпадали с некоторыми фрагментами расщепления трипсином белков PRZN_SERMA/PRZN_SERSP. Пять из них (28-41, 58-66, 67-80, 81-90 и 163-171) соответствовали N-концевой области, в то время как оставшиеся два пептида (351-373 и 374-393) соответствуют C-концевой области. Данные результаты не только подтверждают предыдущую идентификацию белка, но то, что покрытие карты позволяет предположить присутствие двух совместно мигрирующих фрагментов 25 кДа идентифицированного белка, как PRZN_SERMA/PRZN_SERSP, в анализируемой полосе.
Спектр ESI-MS/MS, соответствующий пептидам N- и C-концевых областей ранее упомянутых белков, описывали вручную, и частичные последовательности выделили для идентификации, табл.3.
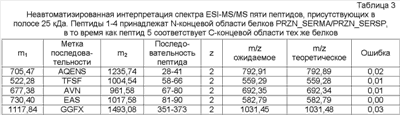
На основании примененных способов и полученных результатов авторы настоящего изобретения сделали вывод, что в анализируемой полосе 25 кДа существует смесь белков, которые обладают фрагментами со сходством с N- и C-концами белков PRZN_SERMA/PRZN_SERSP.
Пример 13. Идентификация p50
Для идентификации белка p50 с антипролиферативной активностью, белковую фракцию, соответствующую белку 50 кДа, полученную по протоколу очистки, описанному в примере 6, обрабатывали эндопротеиназой Lys-C. Идентификацию пептидов осуществляли секвенированием посредством автоматизированной деградации по Эдману и двухсекторного масс-спектрометра JMS HX-110, с пушкой FAB. Данные результаты и выравнивание, осуществленное посредством программного обеспечения Swissprot и PIR, позволяют сделать вывод, что такой белок относится к семейству серрализинов с молекулярной массой 50 кДа. Основное сходство обнаружили с видом с идентификаторами PRZN_SERSP и PRZN_SERMA в банке Swissprot. Молекулярная масса всех пептидов, анализированных масс-спектрометром, совпала с ожидаемым теоретическим количеством пептидов данного расщепления белков эндопротеиназой Lys-C.
Пример 14. Идентификация p25, очищенного хроматографией
Для идентификации белка 25 кДа с антипролиферативной, апоптотической и антиангиогенной активностью, p25, очищенный DEAE-хроматографией, описанной в примере 6, наносили на SDS-PAGE. Белковую полосу промывали пять минут 500 мкл воды, после обесцвечивания промывали 100 мМ раствором лимонной кислоты, затем вновь промывали водой MilliQ, разрезали на маленькие кубики приблизительно 1 мм3. Далее добавляли ацетонитрил до их дегидратации и избыток удаляли. Кубики геля полностью дегидратировали в испарительной центрифуге с последующей регидратацией в растворе бикарбоната аммония (50 мМ), который содержал трипсин в концентрации 12,5 нг/мкл. Далее инкубировали в перемешивателе, термостатируемом в течение 30 минут при 37°С, в течение ночи.
Пептиды пассивно отделяли добавлением 20 мкл раствора бикарбоната аммония и дополнительной инкубацией при 37°C в течение 45 минут. Пептиды выделяли с применением ZipTipC18 и затем подкисляли реакционную смесь добавлением 5 мкл свободной муравьиной кислоты, и вновь выделяли пептиды с применением ZipTipC18 и затем подкисляли реакционную смесь добавлением 5 мкл свободной муравьиной кислоты, и вновь выделяли пептиды с применением ZipTipC18 . Пептиды, связанные с ZipTipC18 . Пептиды, связанные с ZipTipC18 , непрерывно промывали 5% раствором муравьиной кислоты и затем отделяли в объеме 2-3 мкл 60% раствора ацетонитрила, содержащего 1% муравьиную кислоту. , непрерывно промывали 5% раствором муравьиной кислоты и затем отделяли в объеме 2-3 мкл 60% раствора ацетонитрила, содержащего 1% муравьиную кислоту.
Пептиды, полученные расщеплением, нагружали на боросиликатные капиллярные иглы, покрытые золотом, вводили в источник ионов ортогонального геометрического гибридного масс-спектрометра, оборудованного источником наноспрея (QTOF-2 ). ).
Масс-спектр ESI-MS получали в диапазоне 350-2000 Да в течение 1 секунды. Сигналы наибольшей интенсивности выбирали из последующей последовательности ESI-MSMS. В качестве газа для соударений применяли аргон и использовали энергию столкновений, подходящую для вызывания обширной фрагментации выбранных пептидов, которая позволит их однозначно идентифицировать в базе данных.
Спектр ESI-MS подвергали деконволюции и экспортировали в формате DTA, и импортировали в программу MASCOT для идентификации белка в базах данных SWISSPROT и NCBInr посредством стратегии масс-спектрометрических пептидных карт (PMF). Для точной идентификации белка применяли внутреннюю калибровку, чтобы использовать аутопротеолиз трипсина до пептидов, и фиксировали ошибку в 0,05 Да, для осуществления поиска пептидов, наблюдаемых в спектре, и выбирали те сигналы, которые обладали интенсивностью, превышающей на 10% интенсивность базового пика.
Четыре пептида, присутствующие в анализируемой полосе, секвенировали посредством ESI-MSMS (табл.4). Данные пептиды белков PRZN_SERMA/PRZN_SERSP, относящиеся к C-концевой области (обозначены красным в последовательности табл.6), ранее идентифицировали в предыдущих примерах.
Таблица 4
Пептиды, относящиеся к p25 S. marcescens, которые секвенировали посредством ESI-MSMS |
 |
Аминокислотная последовательность |
m/z теор. |
m/z эксп. |
Ошибка |
| 1 |
DFLSTTSNSQK |
1226,51 |
1226,58 |
0,07 |
| 2 |
SAASDSAPGASDWIR |
1489,75 |
1489,68 |
0,07 |
| 3 |
GGAGNDVLFGGGGADELWGGAGK |
2060,96 |
2060,87 |
0,11 |
| 4 |
TGDTVYGFNSNTGR |
1488,65 |
1488,60 |
0,05 |
Аналогично обнаружили другие сигналы, которые хотя не секвенировали, значения их масс очень хорошо согласуются с ожидаемыми значениями масс пептидов после расщепления трипсином, идентифицированных как C-концевая область белков PRZN_SERMA/PRZN_SERSP, табл.5 (обозначены синим в табл.6). Между данными пептидами появляется интенсивный двойной сигнал, который мог бы соответствовать C-концевому пептиду белков PRZN_SERMA/PRZN_SERSP. Не обнаружено пептидов, которые могли бы соответствовать характерным продуктам расщепления N-концевой области белков PRZN_SERMA/PRZN_SERSP.
Таблица 5
Пептиды после расщепления трипсином, принадлежащие белку PRZN_SERMA, детектированные в спектре ESI-MS |
 |
Аминокислотная последовательность |
m/z эксп. |
m/z выч. |
z |
Ошибка |
| 1 |
325SFSDVGGLK333 |
455,20 |
455,24 |
2 |
0,04 |
| 2 |
417IDLSFFNK424 |
492,24 |
492,26 |
2 |
0,02 |
| 3 |
475IVGQVDVATDFIV487 |
688,35 |
688,38 |
2 |
0,03 |
Посредством способов и результатов, показанных в данном примере, авторы настоящего изобретения способны гарантировать, что в обладающей сильным антипролиферативным эффектом полосе p25, очищенной DEAE-хроматографией, присутствует C-концевой фрагмент 25 кДа белков PRZN_SERMA/PRZN_SERSP.
Табл.6. Идентификация p50 и p25, полученных DEAE-хроматографией. В последовательности обнаружены ошибочные аминокислоты, которые не присутствуют в зрелом белке; без данных аминокислот молекулярная масса белков PRZN_SERSP и PRZN_SERMA составляет, соответственно, 50595,4 Да и 50293,4 Да. Идентификация пептидов после расщепления трипсином, которые сдвинуты между молекулами, позволяет предположить, что оба вида могут присутствовать и включать сосуществующие (зеленый (курсив): идентифицирован масс-спектрометрией, и темно-бордовый (подчеркнутый): идентифицирован деградацией по Эдману, внутри непрерывного прямоугольника). Пептиды, отмеченные ( и и  ) идентифицировали в p25, полученным хроматографией, описанной в примере 6. Пептиды, отмеченные ) идентифицировали в p25, полученным хроматографией, описанной в примере 6. Пептиды, отмеченные
( ) и подчеркнутые, идентифицировали в p50, полученном хроматографией, описанной в примере 6, и пептид (курсивом) идентифицировали из фрагмента геля. ) и подчеркнутые, идентифицировали в p50, полученном хроматографией, описанной в примере 6, и пептид (курсивом) идентифицировали из фрагмента геля.
Пример 15. Белки 25 кДа, соответствующие N- и С-концу
Для определения молекулярной массы белков-продуктов деградации PRZN_SERMA/PRZN_SER, которые могут совместно присутствовать в районе 25 кДа при проведении SDS-PAGE, их последовательности получили и ввели в программу GenRun. Фрагменты 25 кДа (±2 кДа), соответствующие N- и C-концу, показаны в табл.7.
Пример 16. Апоптоз, индуцированный MG2327
MG2327 индуцирует апоптоз клеток миеломы X63, вызывая фрагментацию ДНК, митохондрий и микротрубочек
Для определения типа смерти опухолевых клеток клетки миеломы мыши P3X63Ag8 (2·107) обрабатывали in vitro посредством MG2327 из расчета 22 мкг/мл. Обработанные и необработанные клетки подготавливали для исследований посредством ультрастуктурной просвечивающей электронной микроскопии в разные моменты времени, и геномную ДНК экстрагировали для анализа ступенчатой деградации ДНК.
Фрагментацию ДНК оценивали электрофорезом в 2% агарозном геле. Апоптоз часто вызывает ступенчатую деградацию клеточной ДНК до 180-200 п.н., что соответствует межнуклеосомным расстояниям (Soldatenkov, V.A., Prasad, S., Voloshin, Y., and Dritschilo, A. 1998. Cell Death Differ. 5:307-12). Как показано на фиг.13, наблюдали значительное увеличение количества олигонуклеосом, соответствующее морфологическим изменениям в культуре и подтверждаемое электронной микроскопией.
Межнуклеосомной фрагментации предшествовали морфологические признаки апоптоза, детектируемые оптической микроскопией. Более того, на микрофотографиях показаны измененные цитоплазматические органеллы (митохондрия, 2 часа), также предшествующие конденсации хроматина (4 часа) и межнуклеосомной фрагментации (6 часов).
MG2327 повреждает микротрубочки и ультраструктурную организацию митохондрий, усиливая апоптоз клеток P3X63Ag8
Необработанные клетки обладают обычной ультраструктурой митохондрий: отчетливо видимые митохондриальные кристы и митохондриальный матрикс повышенной плотности; митохондрии равномерно распределены по всей цитоплазме (фиг.14A).
Клетки, обработанные MG2327, обладают увеличенным размером митохондрий, пониженной плотностью матрикса и сильно поврежденной морфологией крист (фиг.14B-E). Данные ультраструктурные изменения преимущественно указывают на органеллы с нарушенными функциями.
Более того, авторы настоящего изобретения наблюдали крупные цитоплазматические вакуоли, также рассматривая эндоплазматический ретикулум как митохондрии и ядерную структуру, 2 часа после обработки (фиг.14B).
Разные морфологические изменения наблюдали в ядрах к 6 часам после обработки (конденсация, слияние и ступенчатая фрагментация хроматина). На микрофотографии поздней стадии апоптоза (8 часов) клеток P3X63Ag8, обработанных MG2327, хроматин выглядит компактным (фиг.14F). Почкование не детектировали во все моменты времени.
Интересно, что митохондрии клеток P3X63Ag8, обработанных 2 часа, образовывали скопления на периферии цитоплазматической мембраны (фиг.14B-E), в результате разрушения микротрубочек и нарушения транспорта митохондрий вдоль этой органеллы (Schatten, H., and Lewis, M.L. 2001 Acta Astronaut. 49:399-418).
На фиг.14C и D показаны более крупные митохондрии, также обладающие конденсированными структурами, прикрепленными к внутренним митохондриальным мембранам. Данные структуры могли быть вызваны последовательным слиянием крист. MG2327 мог вызывать апоптоз посредством высвобождения в цитозоль цитохрома c, после набухания внешней мембраны митохондрий наряду с увеличением в размере, с последующей активацией каспаз и апоптозом (Green, D.R. and Reed, J.C. 1998. Science. 28:1309-1312. Обзор).
Без увеличения в размере цитохром cмог также полностью и быстро высвободиться из поврежденных крист митохондрии в цитозоль через контакты между межмембранным пространством и кристами после слияния (Scorrano, L., Ashiya, M., Buttle, K., Weiler, S., Oakes, S.A., Mannella, C.A. and Korsmeyer, S.J. 2002. Dev Cell. 2:55-67). Описанный процесс значительно усиливает сигналы апоптоза, вызываемые MG2327 в клетках.
Пример 17. p25 и p50 вызывают апоптоз
Чтобы различить роль p25 и p50 в событиях апоптоза, вызванных MG2327, их индивидуально вводили клеткам P3X63Ag8 в разных концентрациях и анализировали электронной микроскопией. Во всех случаях детектировали конденсацию хроматина, повреждение митохондриальных крист и агрегацию митохондрий. Действительно, индукция апоптоза посредством MG2327 связана с действием этих двух белков.
Пример 18. Антиангиогенное действие MG2327 и антипролиферативных полипептидов
Развитие трубчатых структур в матригеле
Эндотелиальные клетки человека, полученные из микроциркуляторного русла человека (HMEC) оценивали по формированию эндотелиального тяжа в матригеле (Crum R., Szabo S., Folkman J. 1985. Science. 230:1375-8; Vacca, A., Ribatti, D., Presta, M., Minischettti, M., Iurlaro, M., Ria, R., Albini, A., Bussolino, F. and Dammaacco, F. 1999. Blood 93:3064) после культивирования с нецитотоксичными концентрациями MG2327, p25 и p50 (Sanz, L., Pascual, M., Munoz, A., Gonzalez, M.A., Salvador C.H., Alvarez-Vallina L. 2002. Microvascular Research 63:335-339). Результатами считали длину трубчатых структур и количество соединений между ними, при подсчете с использованием программного пакета Image-Pro Express 4.5. Показали значительное ингибирование (p<0,05, ANOVA) дифференцировки или созревания эндотелиальных клеток (фиг.15) после обработки препаратом MG2327 и его фракциями p25 и p50.
Пример 19. Непрямое действие MG2327 на пролиферирующие клетки
MG2327 защищает мышей Balb/c от приживления миелоидных опухолей
Для анализа защитной активности MG2327 против прививаемых опухолей мышам Balb/c инокулировали (i.p.) из расчета 1 мг/мл данного противоопухолевого препарата посредством разных схем иммунизации. Вводили три дозы, одна доза каждую неделю и две дозы каждую неделю в течение трех недель, по меньшей мере, с тремя сутками между дозами. Группу отрицательного контроля инокулировали 1× PBS. Два миллиона клеток миеломы P3X63Ag8 инокулировали i.p. экспериментальным группам (обработанная и контрольная) 150 суток после первой дозы (после 5 месяцев). Все мыши из группы отрицательного контроля умерли в течение первых 25 суток, в то время как 100% обработанных животных выжили без опухолей (фиг.16).
Пример 20. C-концевой домен других серрализинов также обладает цитотоксическим эффектом без протеолитической активности
Штамм ATCC14756 культивировали в сходных условиях со штаммом CMIB4202 согласно примеру 2, и супернатанты его культуры обрабатывали, как описано в примере 6. В обоих препаратах авторы настоящего изобретения наблюдали белки в районе 50 кДа, которые элюировали 50 мМ фосфатом-0,2 M NaCl, pH 8,00. Данные белки обладали ферментативной активностью, которую ингибировали 10 мМ ЭДТА и восстанавливали 5 мкМ Zn2SO4. Оба белка химически расщепляли посредством CNBr, и характер расщепления являлся одинаковым, давая сходные фрагменты приблизительно 25 кДа, соответствующие C-концу p50, от внутреннего метионина в последовательности до конца молекулы.
Фрагменты, полученные из расщепления, ренатурировали изменением буфера посредством диализа в течение 48 часов. Биологическую активность данных фрагментов тестировали в анализе цитотоксичности, описанном здесь, используя клетки HEp.2, которые инкубировали 72 часа в их присутствии. Фрагменты, полученные расщеплением и лишенные протеолитической активности в присутствии 5 мМ ЭДТА, обладали более высокой цитотоксической активностью, которая была зависимой от дозы, приблизительно в 2,5 раза больше по сравнению с полной молекулой p50. Данные фрагменты, если их последовательности известны, можно также получать химическим синтезом или рекомбинантными способами.
Пример 21. Сочетание фрагментов серрализинов с антителами или фрагментами антител
Полипептидные фрагменты, полученные в примерах 6 и 20, химически конъюгировали с моноклональным антителом CB/ior-CEA.1 (Tormo В. et al. APMIS 97:1073-1080, 1989), с его вариабельными областями и с фрагментом антитела, полученным посредством технологии рекомбинантной ДНК на основе его последовательности (димерное антитело) (патент WO 03/093315). Конъюгированные биомолекулы анализировали на опухолевых линиях клеток человека LoVo (ATCC CCL-229), AsPC-1 (ATCC CRL-1682) и LS 174T (ATCC CL-188), которые все экспрессируют CEA в культуре, посредством антипролиферативных анализов, сходных с описанным в примере 3. Конъюгированные фрагменты использовали в цитотоксических концентрациях, эквивалентных концентрациям неконъюгированных фрагментов, вызывая реакцию, зависимую от дозы, в то время как для неконъюгированных молекул не наблюдали антипролиферативную реакцию. Показано с применением способов, таких как клеточный ELISA и непрямая иммунофлуоресценция (патент WO 03/093315), что конъюгированные фрагменты связывают CEA на клетках. Данные результаты показывают, что конъюгаты, описанные здесь, можно применять для терапии и диагностики рака.
         
Формула изобретения
1. Противоопухолевая профилактическая или терапевтическая фармацевтическая композиция, содержащая один или несколько непротеолитических полипептидных фрагментов серрализина, выбранных из ARA1, ARA2, ARA3 и ARA4, характеризующихся аминокислотной последовательностью, представленной в SEQ ID NO: 1, 2, 3 или 4 соответственно, и необязательно содержащая продигиосины, при этом композиция обладает более высокой антипролиферативной активностью по сравнению с композицией, содержащей целые молекулы серрализинов.
2. Противоопухолевая профилактическая или терапевтическая фармацевтическая композиция по п.1, где указанные фрагменты серрализина получены из супернатанта клеточной культуры рекомбинантным путем или химическим синтезом.
3. Противоопухолевая профилактическая или терапевтическая фармацевтическая композиция по п.1, где указанные фрагменты присутствуют в композиции по отдельности, конъюгированными или в смеси.
4. Противоопухолевая профилактическая или терапевтическая фармацевтическая композиция по п.3, где указанные фрагменты серрализина получены из супернатанта клеточной культуры рекомбинантным путем или химическим синтезом.
5. Противоопухолевая профилактическая или терапевтическая фармацевтическая композиция по п.1, где композиция содержит продигиосины, усиливающие ее противоопухолевую активность.
6. Противоопухолевая профилактическая или терапевтическая фармацевтическая композиция, содержащая один или несколько непротеолитических полипептидных фрагментов серрализина, выбранных из ARA1, ARA2, ARA3 и ARA4, характеризующихся аминокислотной последовательностью, представленной в SEQ ID NO: 1, 2, 3 или 4 соответственно, в сочетании с антителами или их антигенсвязывающими фрагментами, направленными на антигены опухолевых клеток, при этом композиция обладает более высокой антипролиферативной активностью по сравнению с композицией, содержащей целые молекулы серрализинов.
7. Противоопухолевая профилактическая или терапевтическая фармацевтическая композиция по п.6, где указанные компоненты присутствуют в композиции конъюгированными или в смеси.
8. Применение композиции по п.1 в качестве антиангиогенной, апоптотической, антипролиферативной и в качестве индуктора антипролиферативных, апоптотических, антиангиогенных или регулирующих дифференцировку факторов.
РИСУНКИ
|
|