|
|
(21), (22) Заявка: 2007124545/04, 28.12.2005
(24) Дата начала отсчета срока действия патента:
28.12.2005
(30) Конвенционный приоритет:
07.01.2005 EP 05100077.6
(43) Дата публикации заявки: 20.02.2009
(46) Опубликовано: 10.08.2010
(56) Список документов, цитированных в отчете о
поиске:
Petigara R.B. et al. “Synthesis and Central Nervous System Depressant Activity of New Piperazine Derivatives. I” JOURNAL OF MEDICINAL CHEMISTRY, Vol.11,  2, 332-336, 1968. RU 2199534 C2, 27.02.2003. EA 000669 В1, 28.02.2000. WO 2004037800 A1, 06.05.2004. 2, 332-336, 1968. RU 2199534 C2, 27.02.2003. EA 000669 В1, 28.02.2000. WO 2004037800 A1, 06.05.2004.
(85) Дата перевода заявки PCT на национальную фазу:
07.08.2007
(86) Заявка PCT:
EP 2005/014082 20051228
(87) Публикация PCT:
WO 2006/072436 20060713
Адрес для переписки:
191186, Санкт-Петербург, а/я 230, “АРС-ПАТЕНТ”, пат.пов. И.И.Липатовой, рег. 554 554
|
(72) Автор(ы):
ЙОЛИДОН Синиз (CH),
НАРКИЗЬЯН Робер (FR),
НОРКРОСС Роджер Дэвид (CH),
ПИНАР Эмманюэль (FR)
(73) Патентообладатель(и):
Ф.ХОФФМАНН-ЛЯ РОШ АГ (CH)
|
(54) ПРОИЗВОДНЫЕ [4-(ГЕТЕРОАРИЛ)ПИПЕРАЗИН-1-ИЛ]-(2,5-ЗАМЕЩЕННЫЙ ФЕНИЛ)МЕТАНОНА В КАЧЕСТВЕ ИНГИБИТОРОВ ПЕРЕНОСЧИКА ГЛИЦИНА-1 (GLYT-1) ДЛЯ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ И ПСИХОНЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ
(57) Реферат:
Настоящее изобретение относится к соединениям общей формулы I и их фармацевтически приемлемым солям присоединения кислот. Соединения настоящего изобретения обладают свойствами ингибиторов глицинового переносчика 1 (GlyT-1). В формуле I
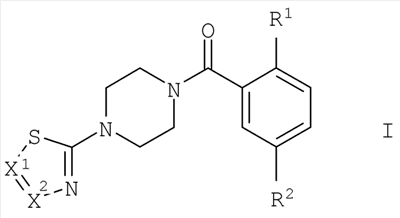
R1 представляет собой -OR1 , -SR1 , -SR1 или морфолинил; R1 или морфолинил; R1 представляет собой низший алкил, низший алкил, замещенный галогеном, или представляет собой -(СН2)n-низший циклоалкил; R2 представляет собой -S(O)2-низший алкил, -S(O)2NH-низший алкил, NO2 или CN; X1 представляет собой CR3 представляет собой низший алкил, низший алкил, замещенный галогеном, или представляет собой -(СН2)n-низший циклоалкил; R2 представляет собой -S(O)2-низший алкил, -S(O)2NH-низший алкил, NO2 или CN; X1 представляет собой CR3 или N; X2 представляет собой CR3 или N; R3/R3 или N; X2 представляет собой CR3 или N; R3/R3 независимо друг от друга представляют собой водород, галоген, низший алкил, CN, NO2, -S(O)2-фенил, -S(O)2-низший алкил, -S(O)2-пиридин-2, 3 или 4-ил, фенил, возможно замещенный одним или двумя заместителями, выбранными из группы, состоящей из NO2 или галогена, или представляют собой низший алкил, замещенный галогеном, или представляют собой -С(O)-низший алкил; n имеет значение 0, 1 или 2. Изобретение также относится к лекарственному средству, содержащему одно или более чем одно соединение изобретения и фармацевтически подходящие эксципиенты. 2 н. 18 з.п. ф-лы, 1 табл. независимо друг от друга представляют собой водород, галоген, низший алкил, CN, NO2, -S(O)2-фенил, -S(O)2-низший алкил, -S(O)2-пиридин-2, 3 или 4-ил, фенил, возможно замещенный одним или двумя заместителями, выбранными из группы, состоящей из NO2 или галогена, или представляют собой низший алкил, замещенный галогеном, или представляют собой -С(O)-низший алкил; n имеет значение 0, 1 или 2. Изобретение также относится к лекарственному средству, содержащему одно или более чем одно соединение изобретения и фармацевтически подходящие эксципиенты. 2 н. 18 з.п. ф-лы, 1 табл.
Настоящее изобретение относится к соединениям общей формулы
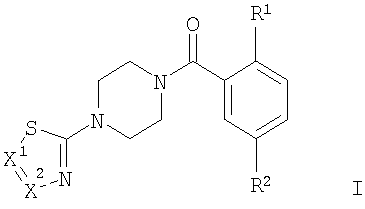 , ,
где
R1 представляет собой -OR1′, -SR1′ или представляет собой гетероциклоалкильную группу;
R1′ представляет собой низший алкил, низший алкил, замещенный галогеном, или представляет собой -(CH2)n-циклоалкил;
R2 представляет собой -S(O)2-низший алкил, -S(O)2NH-низший алкил, NO2 или CN;
X1 представляет собой CR3 или N;
X2 представляет собой CR3′ или N;
R3/R3′ независимо друг от друга представляют собой водород, галоген, низший алкил, CN, NO2, -S(O)2-фенил, -S(O)2-низший алкил, -S(O)2-пиридин-2, 3 или 4-ил, фенил, возможно замещенный одним или двумя заместителями, выбранными из группы, состоящей из NO2 или галогена, или представляют собой низший алкил, замещенный галогеном, или представляют собой -С(O)-низший алкил;
n имеет значение 0, 1 или 2;
и к их фармацевтически приемлемым солям присоединения кислот.
Настоящее изобретение относится к соединениям общей формулы I, к фармацевтическим композициям, содержащим эти соединения, и их применению в лечении неврологических и психоневрологических расстройств. Неожиданно было найдено, что соединения общей формулы I являются хорошими ингибиторами глицинового переносчика 1 (GlyT-1) и что они обладают хорошей селективностью в отношении ингибиторов глицинового переносчика 2 (GlyT-2).
Шизофрения представляет собой прогрессирующее и изнуряющее неврологическое заболевание, характеризующееся эпизодическими позитивными симптомами, такими как бред, галлюцинации, расстройства мышления и психоз, и стойкими негативными симптомами, такими как притупленный аффект, нарушение внимания и социальная самоизоляция, и когнитивными нарушениями (Lewis D.A. and Lieberman J.A., Neuron, 28: 325-33, 2000). В течение нескольких десятилетий исследование было сконцентрировано на гипотезе “дофаминергической гиперактивности”, что привело к терапевтическим вмешательствам, включающим блокаду дофаминергической системы (Vandenberg R.J. and Aubrey K.R., Exp. Opin. Ther. Targets, 5 (4): 507-518, 2001; Nakazato A. and Okuyama S., et al., Exp. Opin. Ther. Patents, 10 (1): 75-98, 2000). Этот фармакологический подход плохо соответствует лечению негативных и когнитивных симптомов, которые являются лучшими показателями функционального результата (Sharma Т., Br. J. Psychiatry, 174 (suppl. 28): 44-51, 1999).
В середине 1960-х годов была предложена дополнительная модель шизофрении, основанная на психотомиметическом действии, вызываемом блокадой глутаматной системы соединениями, подобными фенциклидину (РСР) и родственным агентам (кетамину), которые являются неконкурентными антагонистами NMDA-рецептора. Интересно, что у здоровых волонтеров РСР-индуцированное психотомиметическое действие включает позитивные и негативные симптомы, а также когнитивную дисфункцию и, таким образом, сильно напоминает шизофрению у пациентов (Javitt D.C. et al., Biol. Psychiatry, 45: 668-679, 1999). Кроме того, трансгенные мыши, экспрессирующие пониженные уровни NMDAR1-субъединицы, проявляют аномалии в поведении, подобные тем, которые наблюдают в фармакологически индуцированных моделях шизофрении, что подтверждает модель, в которой уменьшение активности NMDA-рецептора приводит к шизофреническому поведению (Mohn A.R. et al., Cell, 98: 427-236, 1999).
Глутаматная нейротрансмиссия, в частности активность NMDA-рецептора, играет ключевую роль в синаптической пластичности, обучении и памяти, а именно NMDA-рецепторы, по-видимому, служат в качестве дифференцированного переключателя для синхронизации порогового значения синаптической пластичности и формирования памяти (Wiley N.Y.; Bliss T.V and Collingridge G.L., Nature, 361: 31-39, 1993). Трансгенные мыши, сверхэкспрессирующие NR2B-субъединицу NMDA, проявляют повышенную синаптическую пластичность, лучшие способности к обучению и лучшую память (Tang J.P. et al., Nature, 401: 63-69, 1999).
Таким образом, если патофизиология шизофрении включает дефицит глутамата, можно ожидать, что увеличение глутаматной трансмиссии, в частности посредством активации NMDA-рецептора, будет вызывать как антипсихотические эффекты, так и эффекты повышения когнитивной функции.
Известно, что в ЦНС аминокислота глицин имеет по меньшей мере две важные функции. Связываясь со стрихнин-чувствительными глициновыми рецепторами, она действует как тормозная аминокислота, а, действуя в качестве основного коагониста глутамата на функцию рецептора N-метил-D-аспартата (NMDA), эта аминокислота также оказывает влияние на возбудительную активность. В то время как глутамат высвобождается из синаптических окончаний в зависимости от активности, глицин присутствует предположительно на более постоянном уровне и, по-видимому, модулирует/контролирует рецептор для его ответа на глутамат.
Один из наиболее эффективных путей контроля синаптических концентраций нейромедиатора состоит в том, чтобы воздействовать на его обратный захват в синапсах. Переносчики нейромедиаторов действуют путем удаления нейромедиаторов из внеклеточного пространства и могут контролировать их внеклеточное время жизни и тем самым модулировать параметры синаптической передачи (Gainetdinov R.R. et al., Trends in Pharm. Sci., 23 (8): 367-373, 2002).
Глициновые переносчики, которые принадлежат натрий- и хлоридзависимому семейству переносчиков нейромедиаторов, играют важную роль в терминации постсинаптических глицинергических воздействий и поддержании низкой внеклеточной концентрации глицина путем обратного захвата глицина в пресинаптических нервных окончаниях и в близлежащих тонких глиальных отростках.
Из головного мозга млекопитающих были клонированы два разных гена глициновых переносчиков (GlyT-1 и GlyT-2), которые дают начало двум переносчикам примерно с 50% гомологией аминокислотной последовательности. GlyT-1 представлен четырьмя изоформами, являющимися результатом альтернативного сплайсинга и альтернативного использования промоторов (1а, 1b, 1с и 1d). Только две из этих изоформ были найдены в головном мозге грызунов (GlyT-1а и GlyT-1b). GlyT-2 также показывает некоторую степень гетерогенности. В головном мозге грызунов были идентифицированы две изоформы GlyT-2 (2а и 2b). Известно, что GlyT-1 локализуется в ЦНС и в периферических тканях, тогда как GlyT-2 является специфичным для ЦНС. GlyT-1 имеет преимущественно глиальное распределение, и его находят не только в областях, соответствующих стрихнинчувствительным глициновым рецепторам, но также за пределами этих областей, где, как предполагается, он участвует в модуляции функции NMDA-рецептора (Lopez-Corcuera В et al., Mol. Mem. Biol., 18: 13-20, 2001). Соответственно, один из способов повышения активности NMDA-рецептора состоит в увеличении концентрации глицина в локальном микроокружении синаптических NMDA-рецепторов путем ингибирования переносчика GlyT-1 (Bergereon R. et al., Proc. Natl. Acad. Sci. USA, 95: 15730-15734, 1998; Chen L. et al., J. Neurophysiol., 89 (2): 691-703, 2003).
Ингибиторы глициновых переносчиков подходят для лечения неврологических и психоневрологических расстройств. Большинство связанных с ними болезненных состояний представляют собой психозы, шизофрению (Armer RE and Miller DJ, Exp. Opin. Ther. Patents, 11 (4): 563-572, 2001), психотические расстройства настроения, такие как большое депрессивное расстройство тяжелого типа, расстройства настроения, связанные с психотическими расстройствами, такие как острый маниакальный синдром или депрессия, связанная с биполярными расстройствами, и расстройства настроения, связанные с шизофренией (Pralong ET et al., Prog. Neurobiol., 67: 173-202, 2002), аутистические расстройства (Carlsson M.L., J. Neural Trans. 105: 525-535, 1998), когнитивные расстройства, такие как деменции, включая возрастную деменцию и сенильную деменцию Аьцгеймеровского типа, нарушения памяти у млекопитающих, включая человека, синдромы дефицита внимания, и боль (Armer R.E. and Miller D.J., Exp. Opin. Ther. Patents, 11 (4): 563-572, 2001).
Соответственно, увеличение активации NMDA-рецепторов посредством ингибирования GlyT-1 может привести к агентам, которые лечат психоз, шизофрению, деменцию и другие заболевания, при которых нарушены когнитивные процессы, такие как синдромы дефицита внимания или болезнь Альцгеймера.
Предметом настоящего изобретения являются соединения формулы I per se, применение соединений формулы I и их фармацевтически приемлемых солей в изготовлении лекарств для лечения заболеваний, связанных с активацией NMDA-рецепторов посредством ингибирования GlyT-1, их получение, лекарства на основе соединения согласно изобретению и их изготовление, а также применение соединений формулы I в лечении или предупреждении таких заболеваний, как психозы, дисфункция памяти и обучения, шизофрения, деменция и другие заболевания, при которых нарушены когнитивные процессы, такие как синдромы дефицита внимания или болезнь Альцгеймера.
Предпочтительными показаниями для применения соединений по настоящему изобретению является шизофрения, когнитивное нарушение и болезнь Альцгеймера.
Кроме того, изобретение включает все рацемические смеси, все соответствующие энантиомеры и/или оптические изомеры.
В контексте данного описания термин “низший алкил” означает насыщенную группу с нормальной или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и тому подобное. Предпочтительными алкильными группами являются группы с 1-4 атомами углерода.
В контексте данного описания термин “циклоалкил” означает насыщенное углеродное кольцо, содержащее от 3 до 7 атомов углерода, например циклопропил, циклопентил или циклогептил.
Термин “низший алкил, замещенный галогеном”, означает насыщенную группу с нормальной или разветвленной цепью, содержащую от 1 до 7 атомов углерода, такую, как определено выше, где один или более чем один атом водорода замещен галогеном, например -CF3, -CH2CF3, -CH2CF2CF3, -СН(СН3)CF3, -С(СН3)2CF3 или -СН(CF3)СН2СН3.
Термин “галоген” означает хлор, иод, фтор и бром.
Термин “гетероциклоалкил” означает неароматический углеводородный радикал, например оксетанил, тетрагидрофуранил, тетрагидропиранил, азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил или тиоморфолинил. Предпочтительно морфолинил.
Термин “фармацевтически приемлемые соли присоединения кислот” включает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота и тому подобное.
Настоящее изобретение включает соединения следующих структур:
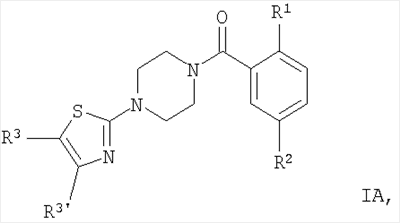
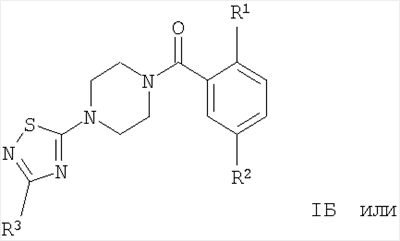
где заместители являются такими, как описано выше.
Предпочтительными соединениями по настоящей заявке являются соединения формулы IA.
Особенно предпочтительными соединениями формулы IA являются соединения, в которых R1 представляет собой OR1′ и R1′ представляет собой низший алкил, например следующие соединения:
[4-(5-бензолсульфонил-тиазол-2-ил)-пиперазин-1-ил]-(2-изопропокси-5-метансульфонил-фенил)-метанон,
2-[4-(2-изобутокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил,
2-{4-[2-(2,2-диметил-пропокси)-5-метансульфонил-бензоил]-пиперазин-1-ил}-тиазол-5-карбонитрил,
[4-(5-бензолсульфонил-тиазол-2-ил)-пиперазин-1-ил]-[2-(2,2-диметил-пропокси)-5-метансульфонил-фенил]-метанон,
[4-(5-бензолсульфонил-тиазол-2-ил)-пиперазин-1-ил]-(2-изобутокси-5-метансульфонил-фенил)-метанон,
{4-[5-(бутан-1-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-[2-(2,2-диметил-пропокси)-5-метансульфонил-фенил]-метанон,
(2-((R)-втор-бутокси)-5-метансульфонил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
(2-((S)-втор-бутокси)-5-метансульфонил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон или
(2-изопропокси-5-метансульфонил-фенил)-[4-(4-метил-5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон.
Другими предпочтительными соединениями формулы IA являются соединения, в которых R1 представляет собой OR1′ и R1′ представляет собой низший алкил, замещенный галогеном, например следующие соединения:
2-{4-[5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензоил]-пиперазин-1-ил}-тиазол-5-карбонитрил,
{4-[5-(бутан-1-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-[5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-метанон,
[5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-метил-4-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
[5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
[5-метансульфонил-2-(2,2,2-трифтор-1,1-диметил-этокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
[5-метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
[5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-{4-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-ил}-метанон,
[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-{4-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-ил}-метанон,
[5-метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-фенил]-{4-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-ил}-метанон,
[5-этансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(4-метил-5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
[5-метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(4-метил-5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон или
[5-метансульфонил-2-(2,2,3,3,3-пентафтор-пропокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон.
Другими предпочтительными соединениями формулы IA являются соединения, в которых R1 представляет собой OR1′ и R1′ представляет собой -(CH2)n-циклоалкил, например следующие соединения:
2-[4-(2-циклобутилметокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил,
[4-(5-бензолсульфонил-тиазол-2-ил)-пиперазин-1-ил]-(2-циклопентилокси-5-метансульфонил-фенил)-метанон,
{4-[5-(бутан-1-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-(2-циклопентилокси-5-метансульфонил-фенил)-метанон,
3-[4-(5-циано-тиазол-2-ил)-пиперазин-1-карбонил]-4-цикпопентилокси-N-метил-бензолсульфонамид или
4-циклопентилокси-N-метил-3-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-карбонил]-бензолсульфонамид.
Другими предпочтительными соединениями формулы IA являются соединения, в которых R1 представляет собой SR1′, например следующее соединение:
(2-изопропилсульфанил-5-метансульфонил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон.
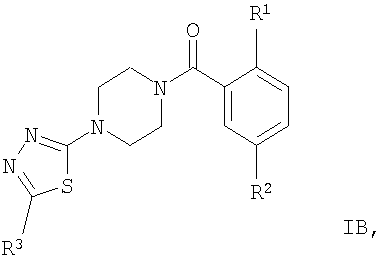
Соединением формулы IБ, где R1 представляет собой OR1′ и R1 представляет собой низший алкил, является
(2-изопропокси-5-метансульфонил-фенил)-[4-(3-фенил-[1,2,4]тиадиазол-5-ил)-пиперазин-1-ил]-метанон.
Соединением формулы IБ, где R1 представляет собой OR1′ и R1′ представляет собой (CH2)n-циклоалкил, является
4-циклопентилокси-N-метил-3-[4-(3-фенил-[1,2,4]тиадиазол-5-ил)-пиперазин-1-карбонил]-бензолсульфонамид.
Соединениями формулы IB, где R1 представляет собой OR1′, являются, например, следующие соединения:
(2-изопропокси-5-метансульфонил-фенил)-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон,
(2-циклопропилметокси-5-метансульфонил-фенил)-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон,
(2-изобутокси-5-метансульфонил-фенил)-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон,
(5-метансульфонил-2-морфолин-4-ил-фенил)-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон или
[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон.
Настоящие соединения формулы I и их фармацевтически приемлемые соли могут быть получены в соответствии с методиками, известными в данной области техники, например в соответствии с методиками, описанными ниже, которые включают
взаимодействие соединения формулы
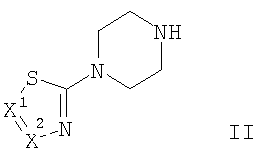
с соединением формулы
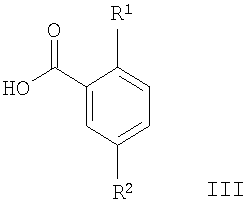
в присутствии активирующего агента, такого как TBTU (2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуронийтетрафторборат),
с образованием соединения формулы
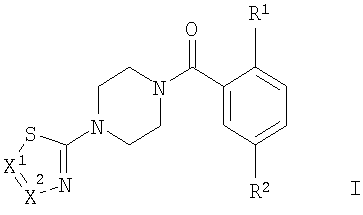 , ,
где X1 и X2 и заместители R1 и R2 являются такими, как определено выше,
и, при желании, превращение полученных соединений в фармацевтически приемлемые соли присоединения кислот.
Соединения формулы I могут быть получены в соответствии с одной из вышеописанных методик и в соответствии с приведенными ниже схемами 1-7. Исходные вещества либо имеются в продаже, либо известны из химической литературы или могут быть получены в соответствии с методиками, хорошо известными в данной области техники.
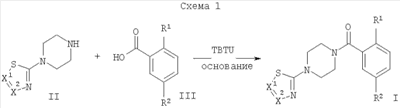
Соединения общей формулы I могут быть получены путем взаимодействия производных пиперазина формулы II с подходящей замещенной кислотой формулы III в присутствии активирующего агента, подобного TBTU (2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуронийтетрафторборату), и основания, такого как N-этилдиизопропиламин (Схема 1).
Кислоты формулы III могут быть получены различными путями, приведенными на Схемах 2-5.
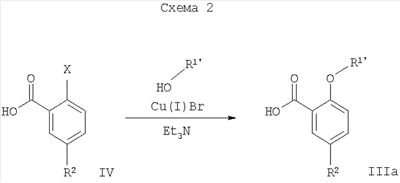 , ,
где Х = галоген.
Например, соединения формулы IIIa, где R1′ представляет собой низший алкил, низший алкил, замещенный галогеном, или -(СН2)n-циклоалкил, могут быть получены при повышенной температуре путем взаимодействия галогенного соединения формулы IV со спиртом формулы R1′OH, возможно в присутствии медной соли, такой как Cu(I)Br, и основания, такого как триэтиламин (Схема 2).
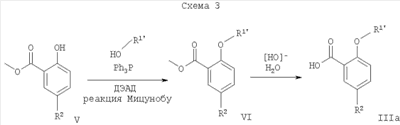
Альтернативно, соединения формулы IIIa, где R1′ представляет собой низший алкил, низший алкил, замещенный галогеном, или -(СН2)n-циклоалкил, могут быть получены путем взаимодействия гидроксисоединения формулы V со спиртом формулы R1′OH, в условиях реакции Мицунобу в присутствии фосфина, такого как трифенилфосфин или дифенил-2-пиридилфосфин, и диалкилазадикарбоксилата, такого как диэтилазадикарбоксилат (ДЭАД) или ди-трет-бутилазодикарбоксилат, с образованием промежуточных соединений формулы VI и последующего гидролиза в присутствии водного основания, такого как гидроксид калия, гидроксид натрия или гидроксид лития (Схема 3).
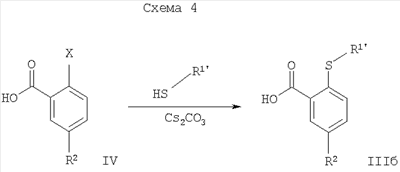 , ,
где Х = галоген.
Соединения формулы IIIб, где R1′ представляет собой низший алкил, низший алкил, замещенный галогеном, или -(CH2)n-циклоалкил, могут быть получены при повышенной температуре путем взаимодействия галогенного соединения формулы IV с тиолом формулы R1′SH, возможно в присутствии основания, такого как карбонат цезия, карбонат калия или карбонат натрия (Схема 4).
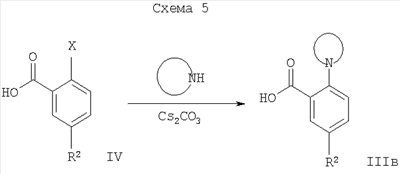
где X = галоген.
Соединения формулы IIIв, где R1 представляет собой гетероциклоалкильную группу, содержащую N атом, могут быть получены при повышенной температуре путем взаимодействия галогенного соединения формулы IV с амином формулы 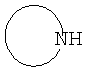 , возможно в присутствии основания, такого как карбонат цезия, карбонат калия или карбонат натрия (Схема 5). , возможно в присутствии основания, такого как карбонат цезия, карбонат калия или карбонат натрия (Схема 5).
Галогенозамещенные и гидроксилзамещенные исходные вещества формулы IV и V (приведенные на Схемах 2-5) либо имеются в продаже, либо известны из химической литературы или могут быть получены с использованием ряда методик, хорошо известных в данной области техники.
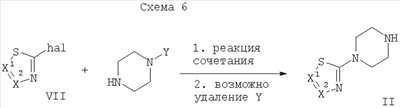
hal = галоген
Y=Н или защитная группа (например Boc)
Производные пиперазина формулы II могут быть получены путем нагревания пиперазина с соответствующим галогенозамещенным гетероциклическим соединением формулы VII, возможно в присутствии палладийорганического катализатора (Схема 6). Альтернативно, производные пиперазина формулы II также могут быть получены путем нагревания N-защищенного пиперазина с соответствующим галогенозамещенным гетероциклическим соединением формулы VII, возможно в присутствии палладийорганического катализатора, и последующего отщепления защитной группы (Схема 6). Обычно защитная группа представляет собой трет-бутоксикарбонил (Boc).
Галогенозамещенные гетероциклические соединения формулы VII либо имеются в продаже, либо известны из химической литературы или могут быть получены с использованием ряда методик, хорошо известных в данной области техники.
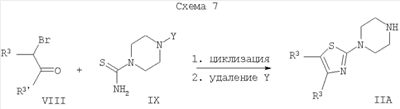
Y = защитная группа (например Boc)
В том случае, когда гетероциклическое соединение формулы II представляет собой производное тиазола, данные соединения могут быть получены альтернативным путем, приведенным на Схеме 7. Подходящий замещенный альфа-бром-кетон, соединение формулы VIII, конденсируют с амидом N-защищенной пиперазин-1-тиокарбоновой кислоты, соединением формулы IX. Затем удаляют защитную группу (например Boc) с азота и получают тиазолзамещенный пиперазин, соединение формулы II.
В том случае, когда соединения формулы II содержат реакционноспособную функциональную группу (например галоидные заместители, гидроксильные заместители или карбонильные заместители) или скрытую реакционноспособную функциональную группу (например скрытую карбонильную группу или скрытую гидроксильную группу) в R3, с целью модификации заместителя R3 могут быть проведены дополнительные реакции либо с соединениями формулы II, либо с соединениями формулы I. Примеры таких реакций включают взаимные превращения функциональных групп (например изменение окислительного состояния в R3, например при превращении гидроксильного заместителя в карбонильный заместитель или тиоэфирного заместителя в сульфоновый заместитель), реакции нуклеофильного замещения (например, в том случае, когда в R3 имеется реакционноспособный галоидный заместитель), реакции сочетания, опосредованные металлоорганическими катализаторами (например реакции сочетания Стилле или Сузуки, в том случае, когда в R3 имеется реакционноспособный галоидный заместитель), или реакции сочетания, опосредованные стехиометрическими реагентами (например реакцию Виттига, в том случае, когда в R3 имеется реакционноспособный карбонильный заместитель, или реакцию обмена галоген-металл с последующей реакцией с электрофилом, в том случае, когда в R3 имеется реакционноспособный галоидный заместитель). Такие реакции могут быть выполнены с использованием ряда методик, хорошо известных в данной области техники, и конкретные примеры могут быть даны посредством ссылки на Примеры, приведенные в данном описании ниже.
Выделение и очистка соединений
Выделение и очистку соединений и промежуточных соединений, приведенных в данном описании, можно осуществить, при желании, с помощью любой подходящей методики разделения или очистки, такой как, например, фильтрация, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, хроматография в толстом слое, препаративная жидкостная хроматография низкого или высокого давления, или путем комбинации этих методик. Конкретные иллюстрации подходящих методик разделения и выделения могут быть даны посредством ссылки на подготовительные примеры и примеры, приведенные в данном описании ниже. Однако также могут быть использованы, конечно, и другие равноценные методики разделения или выделения. Рацемические смеси хиральных соединений формулы I могут быть разделены с использованием хиральной ЖХВД (жидкостной хроматографии высокого давления).
Соли соединений формулы I
Соединения формулы I могут являться основаниями, например, в тех случаях, когда остаток R1 или R3/R3′ содержит основную группу, такую как алифатическая или ароматическая аминная группировка. В таких случаях соединения формулы I могут быть превращены в соответствующую соль присоединения кислоты.
Данное превращение выполняют путем обработки по меньшей мере стехиометрическим количеством подходящей кислоты, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, и органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, пара-толуолсульфоновая кислота, салициловая кислота и тому подобное. Обычно свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и тому подобное, и в сходном растворителе добавляют кислоту. Температуру поддерживают в диапазоне от 0°С до 50°С. Полученная соль выпадает в осадок спонтанно или может быть осаждена из раствора менее полярным растворителем.
Соли присоединения кислот основных соединений формулы I могут быть превращены в соответствующее свободные основания путем обработки по меньшей мере стехиометрическим эквивалентом подходящего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и тому подобное.
Соединения формулы I и их фармацевтически приемлемые соли присоединения обладают полезными фармакологическими свойствами. Конкретно, найдено, что соединения по настоящему изобретению являются хорошими ингибиторами глицинового переносчика I (GlyT-1).
Данные соединения были исследованы в соответствии с тестами, приведенными в настоящем описании ниже.
Растворы и вещества
Полная среда DMEM: питательная смесь F-12 (Gibco Life-technologies), эмбриональная телячья сыворотка (FBS) 5%, (Gibco life technologies), пенициллин/стрептомицин 1% (Gibco life technologies), гигромицин 0,6 мг/мл (Gibco life technologies), глутамин 1 мМ (Gibco life technologies).
Буфер для захвата (UB): 150 мМ NaCl; 10 мМ Hepes (N-2-гидроксиэтилпиперазин-N’-2-этансульфоновая кислота)-Tris, рН 7,4; 1 мМ CaCl2; 2,5 мМ KCl; 2,5 мМ MgSO4; 10 мМ (+)D-глюкоза.
Клетки Flp -in-CHO (Invitrogen, Кат. -in-CHO (Invitrogen, Кат.  R758-07), стабильно трансфицированные mGlyT1b кДНК. R758-07), стабильно трансфицированные mGlyT1b кДНК.
Анализ ингибирования захвата глицина (mGlyT-1b)
В первый день клетки млекопитающего (Flp-in -CHO), трансфицированные mGlyT-1b кДНК, засевали с плотностью 40000 клеток/лунку в полную среду F-12 без гигромицина в 96-луночные культуральные планшеты. На второй день среду отсасывали и клетки дважды промывали буфером для захвата (UB). Затем клетки инкубировали в течение 20 мин при 22°С либо без потенциального конкурирующего соединения (1), либо с 10 мМ нерадиоактивного глицина (2), либо с потенциальным ингибитором в какой-либо концентрации (3). Для того чтобы получить данные для вычисления концентрации ингибитора, приводящей к 50%-ному ингибированию (например ИК50, концентрации конкурирующего соединения, обеспечивающей 50%-ное ингибирование захвата глицина), использовали диапазон концентраций потенциального ингибитора. Сразу после этого добавляли раствор, содержащий 60 nM [3H]-глицин (11-16 Ки/ммоль) и 25 мкМ нерадиоактивный глицин. Планшеты инкубировали при мягком покачивании, и реакцию останавливали путем отсасывания смеси и промывания (три раза) охлажденным до 0°С UB. Клетки лизировали сцинтилляционной жидкостью, покачивали в течение 3 часов, и радиоактивность клеток подсчитывали с использованием сцинтилляционного счетчика. -CHO), трансфицированные mGlyT-1b кДНК, засевали с плотностью 40000 клеток/лунку в полную среду F-12 без гигромицина в 96-луночные культуральные планшеты. На второй день среду отсасывали и клетки дважды промывали буфером для захвата (UB). Затем клетки инкубировали в течение 20 мин при 22°С либо без потенциального конкурирующего соединения (1), либо с 10 мМ нерадиоактивного глицина (2), либо с потенциальным ингибитором в какой-либо концентрации (3). Для того чтобы получить данные для вычисления концентрации ингибитора, приводящей к 50%-ному ингибированию (например ИК50, концентрации конкурирующего соединения, обеспечивающей 50%-ное ингибирование захвата глицина), использовали диапазон концентраций потенциального ингибитора. Сразу после этого добавляли раствор, содержащий 60 nM [3H]-глицин (11-16 Ки/ммоль) и 25 мкМ нерадиоактивный глицин. Планшеты инкубировали при мягком покачивании, и реакцию останавливали путем отсасывания смеси и промывания (три раза) охлажденным до 0°С UB. Клетки лизировали сцинтилляционной жидкостью, покачивали в течение 3 часов, и радиоактивность клеток подсчитывали с использованием сцинтилляционного счетчика.
Предпочтительные соединения показывают для GlyT-1 ИК50 (мкМ) в диапазоне от 0,006-0,100, как приведено в таблице ниже.
Пример  |
ИК50 (мкМ) |
Пример  |
ИК50 (мкМ) |
Пример  |
ИК50 (мкМ) |
| 4 |
0,061 |
55 |
0,073 |
79 |
0,067 |
| 10 |
0,082 |
59 |
0,098 |
80 |
0,046 |
| 14 |
0,083 |
66 |
0,061 |
81 |
0,044 |
| 16 |
0,065 |
67 |
0,046 |
84 |
0,076 |
| 19 |
0,043 |
68 |
0,082 |
93 |
0,075 |
| 29 |
0,017 |
69 |
0,056 |
99 |
0,021 |
| 30 |
0,023 |
70 |
0,057 |
100 |
0,055 |
| 31 |
0,024 |
71 |
0,069 |
101 |
0,026 |
| 39 |
0,070 |
74 |
0,031 |
103 |
0,006 |
| 41 |
0,018 |
77 |
0,100 |
 |
 |
| 42 |
0,046 |
78 |
0,089 |
 |
 |
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I можно применять в качестве лекарств, например, в форме фармацевтических препаратов. Данные фармацевтические препараты могут быть введены перорально, например, в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако также может быть сделано ректальное введение, например, в форме суппозиториев, или парентеральное введение, например в форме растворов для инъекций.
Для изготовления фармацевтических препаратов соединения формулы I могут быть использованы вместе с фармацевтически инертными неорганическими или органическими носителями. Например, в качестве таких носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул может быть использована лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и тому подобное. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и тому подобное. Однако в зависимости от природы активного вещества в случае мягких желатиновых капсул носители обычно не требуются. Подходящими носителями для изготовления растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и тому подобное. Подходящими носителями для суппозиториев являются, например, натуральные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и тому подобное.
Более того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизирующие агенты, увлажняющие агенты, эмульгаторы, подсластители, красящие вещества, корригенты, соли для регулирования осмотического давления, буферные агенты, маскирующие агенты или антиоксиданты. Они также могут содержать еще и другие терапевтически полезные вещества.
Лекарства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также являются предметом настоящего изобретения, как и способ их изготовления, который включает доведение одного или более чем одного соединения формулы I и/или фармацевтически приемлемых солей присоединения кислот и, при желании, одного или более чем одного другого терапевтически полезного вещества до формы галенова препарата вместе с одним или более чем одним терапевтически инертным носителем.
Наиболее предпочтительными показаниями согласно настоящему изобретению являются те, которые включают расстройства центральной нервной системы, например лечение или предупреждение шизофрении, когнитивного нарушения и болезни Альцгеймера.
Конечно, дозировку можно варьировать в широких пределах, и обычно в каждом конкретном случае она должна быть подобрана в соответствии с индивидуальными потребностями. В случае перорального введения доза для взрослых может меняться от приблизительно 0,01 мг до приблизительно 1000 мг в сутки соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Суточная доза может быть введена в виде однократной дозы или в виде дробных доз, и, кроме того, также может быть превышен верхний предел, когда для этого имеются показания.
| Препарат таблеток (влажная грануляция) |
| Пункт |
Ингредиенты |
мг/таблетку |
 |
 |
5 мг |
25 мг |
100 мг |
500 мг |
| 1. |
Соединение формулы I |
5 |
25 |
100 |
500 |
| 2. |
Лактоза безводная DTG |
125 |
105 |
30 |
150 |
| 3. |
Sta-Rx 1500 |
6 |
6 |
6 |
30 |
| 4. |
Микрокристаллическая целлюлоза |
30 |
30 |
30 |
150 |
| 5. |
Стеарат магния |
1 |
1 |
1 |
1 |
| 6. |
Всего |
167 |
167 |
167 |
831 |
Методика изготовления
1. Вещества 1, 2, 3 и 4 смешивают и гранулируют с очищенной водой.
2. Гранулы сушат при 50°С.
3. Гранулы пропускают через подходящее помольное оборудование.
4. Добавляют вещество 5, и перемешивают в течение трех минут; прессуют на подходящем прессе.
| Препарат капсул |
| Пункт |
Ингредиенты |
мг/таблетку |
 |
 |
5 мг |
25 мг |
100 мг |
500 мг |
| 1. |
Соединение формулы I |
5 |
25 |
100 |
500 |
| 2. |
Лактоза водная |
159 |
123 |
148 |
– |
| 3. |
Кукурузный крахмал |
25 |
35 |
40 |
70 |
| 4. |
Тальк |
10 |
15 |
10 |
25 |
| 5. |
Стеарат магния |
1 |
2 |
2 |
5 |
| 6. |
Всего |
200 |
200 |
300 |
600 |
Методика изготовления
1. Вещества 1, 2 и 3 смешивают в подходящем смесителе в течение 30 минут.
2. Добавляют вещества 4 и 5, и смешивают в течение 3 минут.
3. Заполняют подходящую капсулу.
Следующие примеры иллюстрируют изобретение, но предполагается, что они не ограничивают его объем.
В примерах использованы следующие аббревиатуры:
н-Вос-пиперазин: трет-бутил 1-пиперазинкарбоксилат,
Oxone®: (моноперсульфат калия) 2KHSO5 KHSO4 KHSO4 K2SO4, K2SO4,
TBTU: 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуронийтетрафторборат.
Синтез промежуточных соединений формулы III
Пример А1
2-Изопропокси-5-метансульфонил-бензойная кислота
(а) 2-Хлор-5-метансульфонил-бензойная кислота
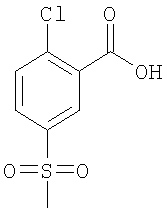
К 99 ммоль 2-хлор-5-(метилтио)бензойной кислоты (приобретенной у Alcfrich) в 400 мл метанола при 0°С добавляли 296 ммоль Oxone®, и данную смесь оставляли перемешиваться при комнатной температуре в течение 3,5 ч. Осадок отфильтровывали, и фильтрат концентрировали при пониженном давлении. Остаток экстрагировали 3 раза 400 мл этилацетата, и объединенные органические фазы дважды промывали 300 мл 1 н. HCl и 300 мл насыщенного водного раствора NaCl и сушили с использованием MgSO4. В результате упаривания при пониженном давлении получали указанное в заголовке соединение, которое использовали на следующей стадии без дополнительной очистки.
(б) 2-Изопропокси-5-метансульфонил-бензойная кислота
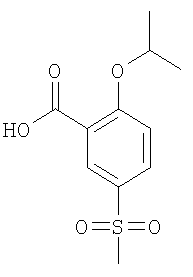
Смесь 2,13 ммоль 2-хлор-6-метансульфонил-бензойной кислоты, 0,64 ммоль Cu(I)Br в 5 мл триэтиламина и 25 мл изопропанола нагревали до 120°С в течение 16 ч в герметически закрытой пробирке. Летучие компоненты удаляли под вакуумом и остаток переносили в 70 мл 1 н. HCl. В результате экстракции этилацетатом, сушки объединенных органических фракций и упаривания получали остаток, который очищали путем обратнофазовой препаративной ЖХВД с элюцией градиентом ацетонитрил/вода. В результате упаривания фракций, содержащих продукт реакции, получали указанное в заголовке соединение. МС (масса/заряд): 257,0 ([М-Н]–, 100%).
Пример А2
рац-5-Метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойная кислота
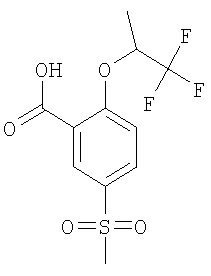
Получали по аналогии с Примером А1 (б) из 2-хлор-5-метансульфонил-бензойной кислоты (Пример А1 (а)) и рац-1,1,1-трифтор-пропан-2-ола. Неочищенное вещество очищали путем препаративной ЖХВД с получением указанного в заголовке соединения в виде белого твердого вещества. МС (масса/заряд): 311,3 ([М-Н]–, 100%).
Пример A3
5-Метансульфонил-2-(2,2,2-трифтор-этокси)-бензойная кислота
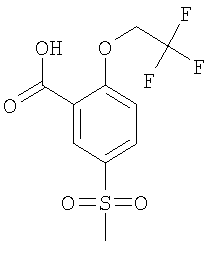
Получали по аналогии с Примером А1 (б) из 2-хлор-6-метансульфонил-бензойной кислоты (Пример А1 (а)) и 2,2,2-трифтор-этанола. Неочищенное вещество очищали путем препаративной ЖХВД с получением указанного в заголовке соединения в виде белого твердого вещества. МС (масса/заряд): 297,0 ([М-Н]–, 100%).
Пример А4
2-Циклопентилокси-5-метансульфонил-бензойная кислота
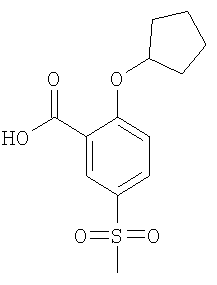
Получали по аналогии с Примером А1 (б) из 2-хлор-5-метансульфонил-бензойной кислоты (Пример А1 (а)) и циклопентанола. Неочищенное вещество очищали путем флэш-хроматографии с получением указанного в заголовке соединения в виде желтого твердого вещества. МС (масса/заряд): 282,9 ([М-Н]–, 100%).
Пример А5
2-Циклопропилметокси-5-метансульфонил-бензойная кислота
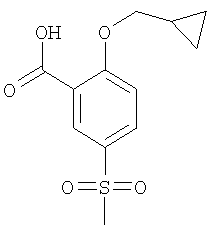
Получали по аналогии с Примером А1 (б) из 2-хлор-5-метансульфонил-бензойной кислоты (Пример А1 (а)) и циклопропилметанола. Неочищенное вещество очищали путем флэш-хроматографии с получением указанного в заголовке соединения в виде белого твердого вещества. МС (масса/заряд): 269,1 ([М-Н]–, 100%).
Пример А6
2-Циклобутилметокси-5-метансульфонил-бензойная кислота
(а) 2-Циклобутилметокси-5-метансульфонил-бензойной кислоты метиловый эфир
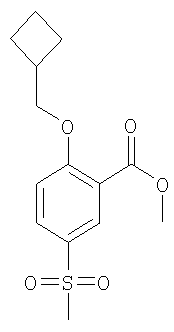
Раствор 6,51 ммоль 2-гидрокси-5-метансульфонил-бензойной кислоты метилового эфира (WO 2002074774), 9,77 ммоль трифенилфосфина, 7,17 ммоль циклобутилметанола и 7,17 ммоль ди-трет-бутилазодикарбоксилата в 20 мл ТГФ (тетрагидрофурана) перемешивали при 60°С в течение 2 часов. Затем данную реакционную смесь концентрировали под вакуумом и очищали путем колоночной хроматографии (SiO2) с получением указанного в заголовке соединения в виде светло-желтого масла.
(б) 2-Цикпобутилметокси-5-метансульфонил-бензойная кислота
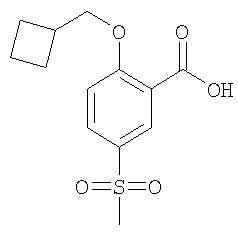
К 6,51 ммоль 2-циклобутилметокси-5-метансульфонил-бензойной кислоты метилового эфира в 20 мл тетрагидрофурана добавляли 40 ммоль 2 н. водного раствора NaOH, и данную реакционную смесь перемешивали при 60°С в течение 2 часов. По истечении этого времени реакционную смесь подкисляли путем добавления концентрированной HCl и дважды экстрагировали дихлорметаном. Объединенные органические фазы сушили над сульфатом натрия и концентрировали под вакуумом. Остаток растирали в диэтиловом эфире с получением указанного в заголовке соединения в виде белого твердого вещества (40% после двух стадий). МС (масса/заряд): 283,3 ([М-Н]–, 100%).
Пример А7
2-Циклогексилокси-5-метансульфонил-бензойная кислота
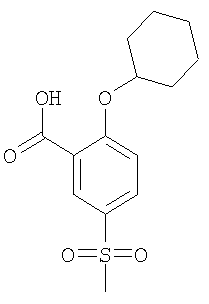
Получали по аналогии с Примером А1 (б) из 2-хлор-5-метансульфонил-бензойной кислоты (Пример А1 (а)) и циклогексанола. Неочищенное вещество очищали путем препаративной ЖХВД с получением указанного в заголовке соединения в виде белого твердого вещества. МС (масса/заряд): 297,3 ([М-Н]–, 100%).
Пример А8
2-Изобутокси-5-метансульфонил-бензойная кислота
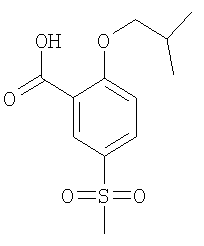
Получали по аналогии с Примером А1 (б) из 2-хлор-5-метансульфонил-бензойной кислоты (Пример А1 (а)) и изобутанола. Неочищенное вещество очищали путем флэш-хроматографии с получением указанного в заголовке соединения в виде белого твердого вещества. МС (масса/заряд): 271,1 ([М-Н]–, 100%).
Пример А9
2-Циклобутокси-5-метансульфонил-бензойная кислота
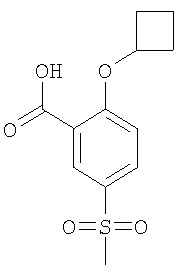
Получали по аналогии с Примером А1 (б) из 2-хлор-5-метансульфонил-бензойной кислоты (Пример А1 (а)) и циклобутанола. Неочищенное вещество очищали путем препаративной ЖХВД с получением указанного в заголовке соединения в виде белого твердого вещества. МС (масса/заряд): 269,3 ([М-Н]–, 100%).
Пример А10
Рац-2-втор-Бутокси-5-метансульфонил-бензойная кислота
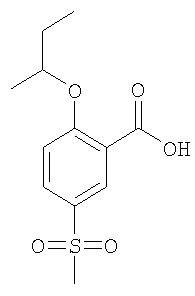
Получали по аналогии с Примером А1 (б) из 2-хлор-5-метансульфонил-бензойной кислоты (Пример А1 (а)) и рац-бутан-2-ола. Неочищенное вещество очищали путем препаративной ЖХВД с получением указанного в заголовке соединения в виде белого твердого вещества. МС (масса/заряд): 271,4 ([М-Н]–, 100%).
Пример А11
2-(2,2-Диметил-пропокси)-5-метансульфонил-бензойная кислота
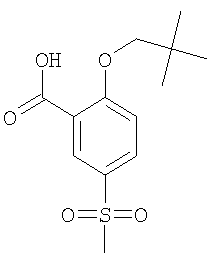
Получали по аналогии с Примером А1 (б) из 2-хлор-5-метансульфонил-бензойной кислоты (Пример А1 (а)) и 2,2-диметил-пропан-1-ола. Неочищенное вещество очищали путем препаративной ЖХВД с получением указанного в заголовке соединения в виде белого твердого вещества. МС (масса/заряд): 285,1 ([М-Н]–, 100%).
Пример А12
2-трет-Бутокси-5-метансульфонил-бензойная кислота
(а) 2-трет-Бутокси-5-метансульфонил-бензойной кислоты метиловый эфир
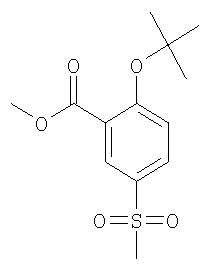
К раствору 2,17 ммоль метил 5-(метансульфонил)-салицилата (WO 2002074774) в 5 мл толуола добавляли 4,78 ммоль N,N-диметилформамид-ди-трет-бутилацеталя, и данную реакционную смесь перемешивали при 80°С в течение 1 часа. По истечении этого времени реакционную смесь концентрировали под вакуумом и очищали путем колоночной хроматографии с получением указанного в заголовке соединения в виде бесцветного масла. МС (масса/заряд): 304,4 (M+NH4 +, 100%). +, 100%).
(б) 2-трет-Бутокси-5-метансульфонил-бензойная кислота
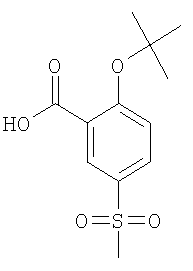
К 5,52 ммоль 2-трет-бутокси-5-метансульфонил-бензойной кислоты метилового эфира в 25 мл ТГФ добавляли раствор 8,34 ммоль моногидрата гидроксида лития в 25 мл воды, и данную реакционную смесь перемешивали при комнатной температуре в течение 4 часов. По истечении этого времени ТГФ удаляли под вакуумом, и к оставшемуся водному раствору добавляли 8 мл 1 н. водной HCl, что приводило к осаждению соединения. Осадок отфильтровывали и промывали несколько раз водой с получением указанного в заголовке соединения (67%) в виде белого твердого вещества. МС (масса/заряд): 289,9 (M+NH4 +). +).
Пример А13
5-Метансульфонил-2-морфолин-4-ил-бензойная кислота
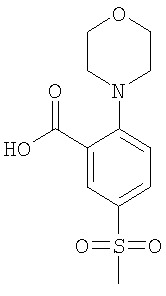
Смесь 4,26 ммоль 2-хлор-5-метансульфонил-бензойной кислоты (Пример А1 (а)) в 8 мл морфолина нагревали при 110°С в течение 15 ч. После выпаривания всех летучих компонентов остаток подкисляли путем добавления 1 н. HCl и экстрагировали три раза этилацетатом. Объединенные органические экстракты промывали последовательно 1 н. HCl и насыщенным рассолом, сушили над сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения в виде светло-желтого аморфного твердого вещества (58%). МС (масса/заряд): 284,1 ([М-Н]–, 100%).
Пример А14
5-Метансульфонил-2-(2,2,2-трифтор-1,1-диметил-этокси)-бензойная кислота
а) 2-Фтор-5-метилсульфанил-бензойная кислота
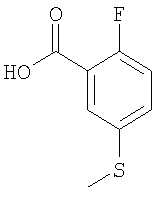
Указанное в заголовке соединение получали в соответствии с методикой, описанной в Journal of Organometallic Chemistry 1991, 419 (1-2), 1-8.
б) 2-Фтор-5-метансульфонил-бензойная кислота
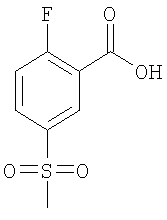
К 2,68 ммоль 2-фтор-5-метансульфанил-бензойной кислоты в 5 мл метанола при 0°С добавляли 8,05 ммоль Oxone®, и данную смесь оставляли перемешиваться при комнатной температуре в течение 72 ч. Осадок отфильтровывали, и фильтрат концентрировали при пониженном давлении. Остаток обрабатывали водой и экстрагировали 3 раза 400 мл дихлорметана. Объединенные органические фазы сушили над сульфатом натрия. В результате упаривания при пониженном давлении получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 79%). МС (масса/заряд): 217,2 (M-H+, 100%).
в) 5-Метансульфонил-2-(2,2,2-трифтор-1,1-диметил-этокси)-бензойная кислота
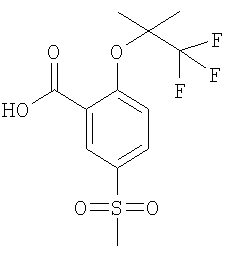
К раствору 2,75 ммоль 2-фтор-5-метансульфонил-бензойной кислоты в 10 мл N,N-диметилацетамида добавляли 14,7 ммоль 1,1,1-трифтор-2-метил-пропан-2-ола и 8,29 ммоль карбоната цезия, и данную смесь перемешивали при 170°С в течение 72 часов. Затем реакционную смесь охлаждали до комнатной температуры, подкисляли путем добавления муравьиной кислоты и затем концентрировали под вакуумом. Остаток очищали путем препаративной ЖХВД с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (выход 99%). МС (масса/заряд): 325,3. ([М-Н]–, 100%)
Пример А15
5-Метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-бензойная кислота
(а) рац-5-Метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойной кислоты метиловый эфир
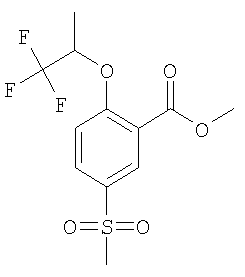
Смесь 21,7 ммоль 2-гидрокси-5-метансульфонил-бензойной кислоты метилового эфира (WO 2002074774), 32,5 ммоль рац-трифтор-метансульфоновой кислоты 2,2,2-трифтор-1-метил-этилового эфира [212556-43-9] и 43,4 ммоль карбоната калия в 87 мл ДМФА (N,N-диметилформамида) перемешивали при 80°С в течение 48 часов. После охлаждения до комнатной температуры смесь концентрировали под вакуумом, ресуспендировали в воде и перемешивали в течение 1 часа. В результате фильтрации получали указанное в заголовке соединение.
(б) 5-Метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-бензойной кислоты метиловый эфир
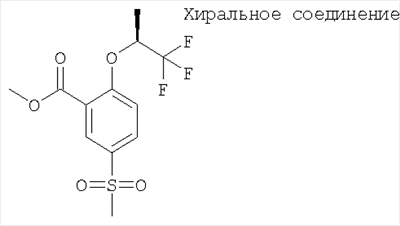
Указанное в заголовке соединение получали путем разделения рац-5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойной кислоты метилового эфира с помощью хиральной ЖХВД (Chiralcel OD; 15% этанол/гептан; скорость потока: 35 мл·мин-1; 220 нм; время удерживания: 86 мин).
(в) 5-Метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-бензойная кислота
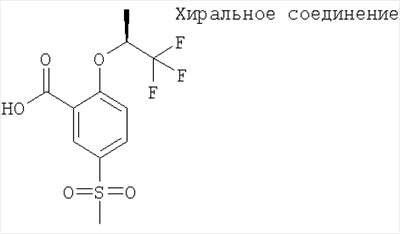
Получали по аналогии с Примером А6 (б) из 5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-бензойной кислоты метилового эфира. МС (масса/заряд): 311,0 ([М-Н]–, 100%).
Пример А16
5-Метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-бензойная кислота
(а) 5-Метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-бензойной кислоты метиловый эфир
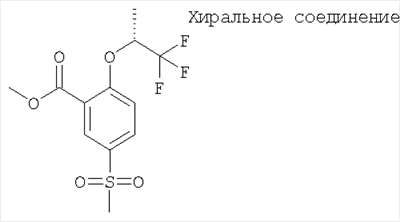
Указанное в заголовке соединение получали путем разделения рац-5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойной кислоты метилового эфира (Пример А15(а)) с помощью хиральной ЖХВД (Chiralcel OD; 15% этанол/гептан, скорость потока: 35 мл·мин-1, 220 нм, время удерживания: 74 мин).
(б) 5-Метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-бензойная кислота
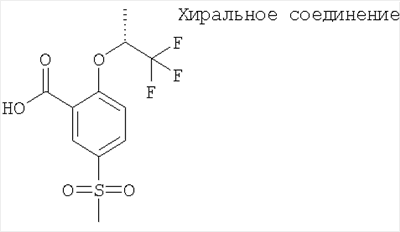
Получали по аналогии с Примером А6 (б) из 5-метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-бензойной кислоты метилового эфира. МС (масса/заряд): 311,0 ([М-Н]–, 100%).
Пример А17
Рац-5-Этансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойная кислота
(а) 5-Этансульфонил-2-фтор-бензойной кислоты этиловый эфир
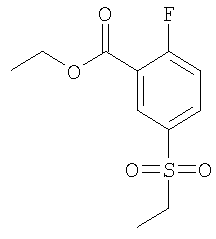
К раствору 1,98 моль сульфита натрия в 1 л воды добавляли порциями в течение 20 мин 0,264 моль 5-хлорсульфонил-2-фтор-бензойной кислоты (CAS: 37098-75-2). Данную реакционную смесь перемешивали при комнатной температуре в течение 2,5 часа, затем охлаждали до 0°С и подкисляли 230 мл серной кислоты (20%) до рН 2. Воду выпаривали, и остаток переносили в 200 мл ДМФА. Добавляли 73 ммоль карбоната калия и 86 ммоль иодэтана, и реакционную смесь перемешивали при комнатной температуре в течение 50 часов. Растворитель удаляли под вакуумом. Белое твердое вещество растворяли в 100 мл воды. Водную фазу экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом натрия. В результате упаривания при пониженном давлении и флэш-хроматографии (SiO2, гептан/этилацетат 1/1) получали указанное в заголовке соединение в виде бесцветного масла (выход 37%). МС (масса/заряд): 261,1 (М+Н+, 100%).
(б) 5-Этансульфонил-2-фтор-бензойная кислота
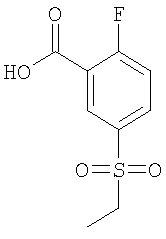
К 10,8 ммоль 5-этансульфонил-2-фтор-бензойной кислоты этилового эфира в 26 мл тетрагидрофурана добавляли 26 мл воды и 16,1 ммоль моногидрата гидроксида лития, и данную реакционную смесь перемешивали при комнатной температуре в течение 45 минут. По истечении этого времени реакционную смесь подкисляли 1 н. HCl, тетрагидрофуран выпаривали, и водную фазу дважды экстрагировали дихлорметаном. Объединенные органические фазы сушили над сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения в виде белого твердого вещества (96%). МС (масса/заряд): 232,1 ([М+, 100%).
(в) рац-5-Этансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойная кислота
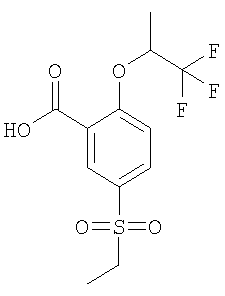
Получали по аналогии с Примером А14 (в) из 5-этансульфонил-2-фтор-бензойной кислоты и рац-1,1,1-трифтор-пропан-2-ола. МС (масса/заряд): 325,1 ([М-Н]–, 100%).
Пример А18
5-Этансульфонил-2-изопропокси-бензойная кислота
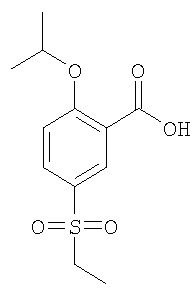
Получали по аналогии с Примером А14 (в) из 5-этансульфонил-2-фтор-бензойной кислоты (Пример А17 (б)) и изопропанола. МС (масса/заряд): 271,1 ([М-Н]–, 100%).
Пример А19
Рац-5-Метансульфонил-2-(1-трифторметил-пропокси)-бензойная кислота
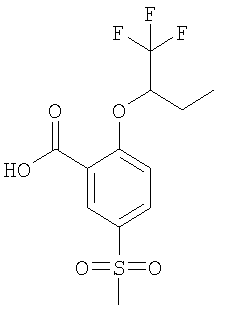
Получали по аналогии с Примером А14 (в) из 2-фтор-5-метансульфонил-бензойной кислоты (Пример А14 (б)) и рац-1,1,1-трифтор-бутан-2-ола. МС (масса/заряд): 325,0 ([М-Н]–, 100%).
Пример А20
2-((R)-втор-Бутокси)-5-метансульфонил-бензойная кислота
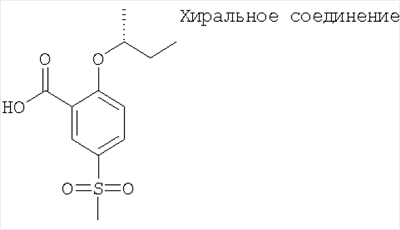
Получали по аналогии с Примером А14 (в) из 2-фтор-5-метансульфонил-бензойной кислоты (Пример А14 (б)) и (R)-бутан-2-ола. МС (масса/заряд): 271,1 ([М-Н]–, 100%).
Пример А21
2-((S)-втор-Бутокси)-5-метансульфонил-бензойная кислота
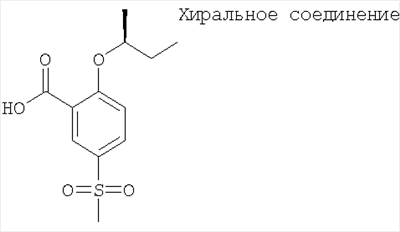
Получали по аналогии с Примером А14 (в) из 2-фтор-5-метансульфонил-бензойной кислоты (Пример А14 (б)) и (S)-бутан-2-ола. МС (масса/заряд): 271,1 ([М-Н]–, 100%).
Пример А22
2-Изопропилсульфанил-5-метансульфонил-бензойная кислота
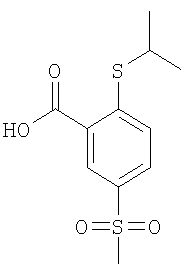
К раствору 4,58 ммоль 2-фтор-5-метансульфонил-бензойной кислоты (Пример А14 (б)) в 6 мл N,N-диметилацетамида добавляли 15,2 моль карбоната цезия и 10,1 ммоль 2-пропантиола, и данную смесь перемешивали при 90°С в течение 3 ч. Затем реакционную смесь охлаждали до комнатной температуры и подкисляли до рН 1 путем добавления соляной кислоты, перед тем как ее экстрагировали три раза этилацетатом. Объединенные органические фазы сушили над сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения в виде светло-желтой жидкости, которую использовали на следующей стадии без дополнительной очистки (выход 99%). ЭИ-МС (масс-спектрометрия с ионизацией электронами) (масса/заряд): 274,1 (M+, 35%), 232,1 ([М-С3Н6]+, 30%), 214,1 (M-C3H6-H2O)+, 100%).
Пример А23
2-Этилсульфанил-5-метансульфонил-бензойная кислота
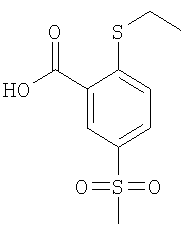
К раствору 4,58 ммоль 2-фтор-5-метансульфонил-бензойной кислоты (Пример А14(б)) в 6 мл N,N-диметилформамида добавляли 13,8 моль карбоната цезия и 9,25 ммоль этантиола, и данную смесь перемешивали при 90°С в течение 30 мин. Затем реакционную смесь охлаждали до комнатной температуры и подкисляли до рН 1 путем добавления соляной кислоты, перед тем как ее экстрагировали три раза этилацетатом. Объединенные органические фазы сушили над сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки (выход 99%). МС (масса/заряд): 259,0 ([М-Н]–, 100%).
Пример А24
5-Метансульфонил-2-(2,2,2-трифтор-этилсульфанил)-бензойная кислота
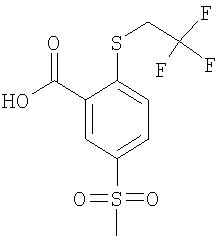
К раствору 4,58 ммоль 2-фтор-5-метансульфонил-бензойной кислоты (Пример А14 (б)) в 6 мл N,N-диметилформамида добавляли 13,8 моль карбоната цезия и 9,16 ммоль 2,2,2-трифтор-этантиола, и данную смесь перемешивали при 90°С в течение 30 мин. Затем реакционную смесь охлаждали до комнатной температуры и подкисляли до рН 1 путем добавления соляной кислоты, перед тем как ее экстрагировали три раза этилацетатом. Объединенные органические фазы сушили над сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения в виде красно-коричневого твердого вещества, которое использовали на следующей стадии без дополнительной очистки (выход 99%). МС (масса/заряд): 312,9 ([М-Н]–, 100%).
Пример А25
2-Изобутилсульфанил-5-метансульфонил-бензойная кислота
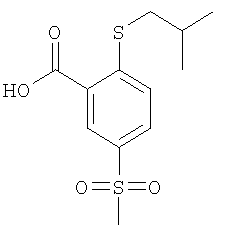
К раствору 4,58 ммоль 2-фтор-5-метансульфонил-бензойной кислоты (Пример А14 (б)) в 6 мл N,N-диметилформамида добавляли 13,8 моль карбоната цезия и 9,97 ммоль 2-метил-1-пропантиола, и данную смесь перемешивали при 90°С в течение 30 мин. Затем реакционную смесь охлаждали до комнатной температуры и подкисляли до рН 1 путем добавления соляной кислоты, перед тем как ее экстрагировали три раза этилацетатом. Объединенные органические фазы сушили над сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки (выход 99%). МС (масса/заряд): 287,0 ([М-Н]–, 100%).
Пример А26
5-Метансульфонил-2-метилсульфанил-бензойная кислота
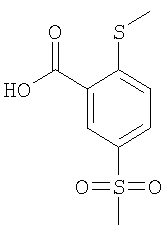
К раствору 4,58 ммоль 2-фтор-5-метансульфонил-бензойной кислоты (Пример А14 (б)) в 6 мл N,N-диметилформамида добавляли 13,8 моль карбоната цезия и 10,0 ммоль метантиолата натрия, и данную смесь перемешивали при 90°С в течение 30 мин. Затем реакционную смесь охлаждали до комнатной температуры и подкисляли до рН 1 путем добавления соляной кислоты, перед тем как ее экстрагировали три раза этилацетатом. Объединенные органические фазы сушили над сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения в виде бесцветного масла, которое использовали на следующей стадии без дополнительной очистки (выход 99%). МС (масса/заряд): 244,9 ([М-Н]–, 100%).
Пример А27
5 2-Морфолин-4-ил-5-нитро-бензойная кислота
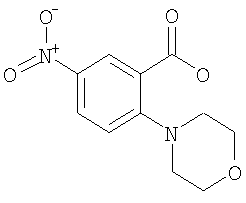
К раствору 12,2 ммоль 2-фтор-5-нитробензойной кислоты (CAS 7304-32-7; имеется в продаже, например, от Fluorochem) в 40 мл ТГФ добавляли 18,2 ммоль морфолина, и данную смесь перемешивали при комнатной температуре в течение 16 ч. Летучие компоненты удаляли под вакуумом, и остаток ресуспендировали в 25 мл воды и подкисляли до рН 4 путем добавления по каплям водной HCl. Полученную смесь перемешивали при комнатной температуре в течение 30 мин, и полученные кристаллы затем собирали путем фильтрации и сушили под вакуумом при 50°С с получением указанного в заголовке соединения в виде желтого твердого вещества (выход 32%). МС (масса/заряд): 251,0 ([М-Н]–, 100%).
Пример А28
5-Циано-2-изопропокси-бензойная кислота
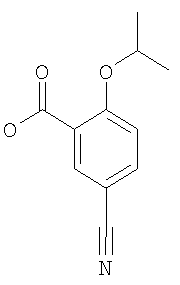
К 198 ммоль изопропанола добавляли 19,8 ммоль натрия, и затем данную смесь нагревали при 100°С до тех пор, пока не растворялся весь натрий (30 мин). Затем добавляли 6,59 ммоль 5-циано-2-иод-бензойной кислоты [CAS: 219841-92-6; WO 9901455] и 1,32 ммоль бромида меди (I), и данную реакционную смесь нагревали при 120°С в течение 2 ч. Затем реакционную смесь охлаждали до комнатной температуры и концентрировали под вакуумом. Остаток суспендировали в 50 мл 1 М водной HCl и экстрагировали 3х этилацетатом. Объединенные органические экстракты промывали рассолом, сушили над Na2SO4 и концентрировали под вакуумом. В результате флэш-хроматографии на силикагеле (элюент: гептан/этилацетат) получали указанное в заголовке соединение в виде белого твердого вещества (выход 55%). МС (масса/заряд): 204,1 ([М-Н]–, 100%).
Пример А29
2-Циклопентилокси-5-метилсульфамоил-бензойная кислота
(а) 5-Хлорсульфонил-2-гидрокси-бензойная кислота
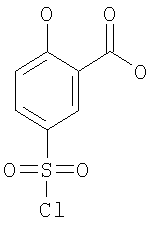
К 3,26 моль хлорсульфоновой кислоты при 0°С маленькими порциями добавляли 652 ммоль салициловой кислоты, и затем данную смесь оставляли перемешиваться при комнатной температуре в течение 1 ч, затем при 50°С в течение 1 ч и, наконец, при 70°С в течение 1 ч. Затем смесь добавляли по каплям к 1000 мл ледяной воды при перемешивании, и перемешивание продолжали в течение еще 30 мин. Получившиеся белые кристаллы собирали путем фильтрации, промывали три раза водой и затем сушили под вакуумом при 45°С в течение 16 ч с получением указанного в заголовке соединения. МС (масса/заряд): 236,8 ([{37Cl}М-Н]–, 33%), 235,0 ([{37Cl}М-Н]–, 100%).
(б) 2-Гидрокси-5-метилсульфамоил-бензойная кислота
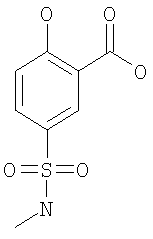
К 63 ммоль 5-хлорсульфонил-2-гидрокси-бензойной кислоты в 120 мл дихлорметана при комнатной температуре добавляли по каплям 317 ммоль метиламина (8 М раствор в этаноле), и данную смесь оставляли перемешиваться при комнатной температуре в течение 1 ч. Затем смесь концентрировали под вакуумом. Остаток суспендировали в 1 М водном растворе NaOH и дважды экстрагировали диэтиловым эфиром. Водную фазу подкисляли 5 М водной HCl, насыщенной NaCl, и экстрагировали 3 раза ТГФ. Объединенные ТГФ-экстракты дважды промывали насыщенным водным раствором NaCl и сушили Na2SO4. В результате упаривания под вакуумом получали указанное в заголовке соединение. МС (масса/заряд): 249,0 (M+NH4 +, 100%), 231,9 (M+H+, 63%). +, 100%), 231,9 (M+H+, 63%).
(в) 2-Гидрокси-5-метилсульфамоил-бензойной кислоты метиловый эфир
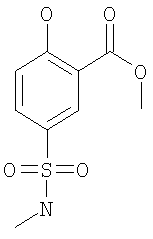
К 77 ммоль 2-гидрокси-5-метилсульфамоил-бензойной кислоты в 300 мл ТГФ добавляли 85 ммоль CDI (1,1′-карбонилдиимидазола), и данную смесь нагревали при 70°С в течение 1 ч. Затем добавляли 770 ммоль метанола, и смесь нагревали при 70°С в течение 16 ч. Затем смесь охлаждали до комнатной температуры и концентрировали под вакуумом. Остаток хроматографировали на силикагеле (элюент: этилацетат/гептан/дихлорметан 45:45:10) с получением указанного в заголовке соединения. МС (масса/заряд): 244,1 ([М-Н]–, 100%).
(г) 2-Циклопентилокси-5-метилсульфамоил-бензойной кислоты метиловый эфир
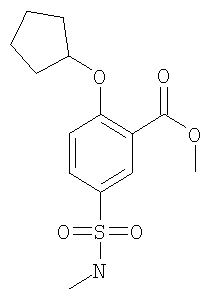
К 2,85 ммоль 2-гидрокси-5-метилсульфамоил-бензойной кислоты метилового эфира, 3,14 ммоль циклопентанола и 3,28 ммоль трифенилфосфина в 10 мл ТГФ добавляли 3,14 ммоль ди-трет-бутилазодикарбоксилата, и данную смесь перемешивали при комнатной температуре в течение 2 ч. Затем смесь концентрировали под вакуумом. Остаток хроматографировали на силикагеле (элюент: этилацетат/гептан 2:3) с получением указанного в заголовке соединения в виде бесцветного масла. МС (масса/заряд): 312,1 ([М-Н]–, 100%).
(д) 2-Циклопентилокси-5-метилсульфамоил-бензойная кислота
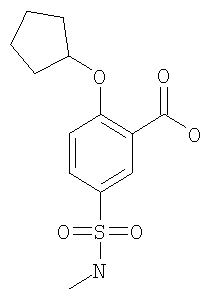
К 2,68 ммоль 2-циклопентилокси-5-метилсульфамоил-бензойной кислоты метилового эфира в 10 мл ТГФ добавляли 20 ммоль 2 М водного NaOH, и данную смесь перемешивали при комнатной температуре в течение 2 ч. Затем смесь дважды экстрагировали диэтиловым эфиром. Водную фазу подкисляли 10% водной лимонной кислотой и экстрагировали 3 раза этилацетатом. Объединенные органические фазы сушили Na2SO4. В результате упаривания под вакуумом и последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого твердого вещества. МС (масса/заряд): 298,3 ([М-Н]–, 100%).
Пример А30
5-Метансульфонил-2-(2,2,3,3,3-пентафтор-пропокси)-бензойная кислота
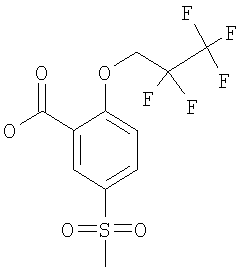
Получали по аналогии с Примером А14 (в) из 2-фтор-5-метансульфонил-бензойной кислоты (Пример А14 (б)) и 2,2,3,3,3-пентафтор-1-пропанола. МС (масса/заряд): 346,9 ([М-Н]–, 100%).
Синтез соединений формулы I по изобретению
Пример 1
[4-(5-Бром-тиазол-2-ил)-пиперазин-1-ил]-(2-изопропокси-5-метансульфонил-фенил)-метанон
а) 1-(5-Бром-тиазол-2-ил)-пиперазин
Смесь 2,06 ммоль 2,5-дибромтиазола, 6,17 ммоль пиперазина и 6,17 ммоль триэтиламина в 6 мл тетрагидрофурана в герметически закрытой пробирке нагревали при 160°С в течение 10 мин с использованием микроволнового излучения. Реакционную смесь концентрировали, и остаток очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 94%). МС (масса/заряд): 250,0 ({81Br}M+H+, 100%), 248,0 ({79Br}M+H+, 76%).
б) [4-(5-Бром-тиазол-2-ил)-пиперазин-1-ил]-(2-изопропокси-5-метансульфонил-фенил)-метанон
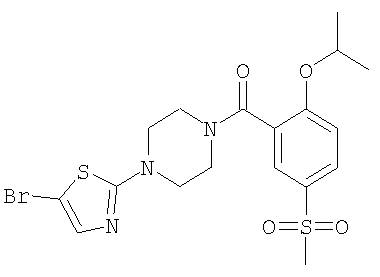
К раствору 0,31 ммоль 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) в 7 мл тетрагидрофурана добавляли последовательно 0,46 ммоль TBTU, 1,24 ммоль N-этилдиизопропиламина и 0,34 ммоль 1-(5-бром-тиазол-2-ил)-пиперазина. Данную реакционную смесь перемешивали при комнатной температуре в течение 16 ч и затем концентрировали под вакуумом. В результате хроматографии (SiO2, этилацетат/гептан) получали указанное в заголовке соединение в виде белой пены (выход 87%). МС (масса/заряд): 490,3 ({81Br}M+H+, 100%), 488,3 ({79Br}M+H+, 84%).
Пример 2
(2-Изопропокси-5-метансульфонил-фенил)-[4-(4-метил-тиазол-2-ил)-пиперазин-1-ил]-метанон
а) 2-Иод-4-метил-тиазол
К раствору 21,7 ммоль диизопропиламина в 50 мл тетрагидрофурана добавляли по каплям 19,7 ммоль раствора хлористого бутилмагния (2 М в тетрагидрофуране), и данную смесь перемешивали при комнатной температуре в течение ночи. Затем добавляли 10,1 ммоль 4-метилтиазола, и перемешивание продолжали в течение 1 часа при комнатной температуре. В конце добавляли по каплям раствор 25,7 моль иода в 50 мл тетрагидрофурана, и перемешивание продолжали в течение еще 1 ч. Затем реакционную смесь гасили путем добавления 20% водного раствора тиосульфата натрия, и смесь экстрагировали три раза этилацетатом. Объединенные органические фазы сушили над сульфатом натрия и концентрировали под вакуумом. В результате хроматографии (SiO2, диэтиловый эфир/гептан) получали указанное в заголовке соединение в виде коричневого твердого вещества (выход 83%). МС (масса/заряд): 226,1 (М+Н+, 100%).
б) 1-(4-Метил-тиазол-2-ил)-пиперазин
Смесь 1,33 ммоль 2-иод-4-метил-тиазола, 4,00 ммоль пиперазина и 4,00 ммоль триэтиламина в 4 мл тетрагидрофурана в герметически закрытой пробирке нагревали при 160°С в течение 2 ч с использованием микроволнового излучения. Данную реакционную смесь концентрировали, и остаток очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде желтого масла (выход 65%). МС (масса/заряд): 184,3 (М+Н+, 100%).
в) (2-Изопропокси-5-метансульфонил-фенил)-[4-(4-метил-тиазол-2-ил)-пиперазин-1-ил]-метанон
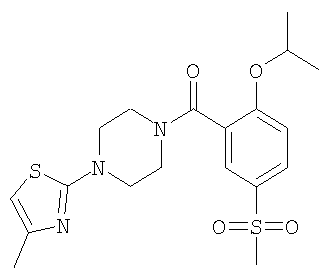
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-(4-метил-тиазол-2-ил)-пиперазина. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде аморфного желтого твердого вещества (выход 87%). МС (масса/заряд): 424,1 (M+H+], 100%).
Пример 3
(2-Изопропокси-5-метансульфонил-фенил)-[4-(5-метил-тиазол-2-ил)-пиперазин-1-ил]-метанон
а) 2-Иод-5-метил-тиазол
Получали по аналогии с примером 2 (а) из 5-метилтиазола. Неочищенное вещество очищали путем хроматографии (SiO2, диэтиловый эфир/гептан) с получением указанного в заголовке соединения в виде коричневого масла (выход 69%). МС (масса/заряд): 226,3 (М+Н+, 100%).
б) 1-(5-Метил-тиазол-2-ил)-пиперазин
Получали по аналогии с примером 2 (б) из 2-иод-6-метил-тиазола и пиперазина. Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде желтого масла (выход 32%). МС (масса/заряд): 184,3 (М+Н+, 100%).
в) (2-Изопропокси-5-метансульфонил-фенил)-[4-(5-метил-тиазол-2-ил)-пиперазин-1-ил]-метанон

Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-(5-метил-тиазол-2-ил)-пиперазина. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде желтоватой пены (выход 75%). МС (масса/заряд): 424,3 (M+H+, 100%).
Пример 4
[4-(5-Бензолсульфонил-тиазол-2-ил)-пиперазин-1-ил]-(2-изопропокси-5-метансульфонил-фенил)-метанон
а) 4-(5-Бром-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Смесь 24,7 ммоль 2,5-дибромтиазола, 49,4 ммоль трет-бутил 1-пиперазинкарбоксилата и 74,1 ммоль триэтиламина в 24 мл тетрагидрофурана в герметически закрытой пробирке нагревали при 160°С в течение 30 мин с использованием микроволнового излучения. Данную реакционную смесь концентрировали, и остаток очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 68%). МС (масса/заряд): 350,2 ({81Br}М+H+, 100%), 348,2 ({79Br}M+H+, 98%).
б) 4-(5-Фенилсульфанил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
К раствору 1,44 ммоль 4-(5-бром-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира в 6 мл тетрагидрофурана при -78°С добавляли по каплям раствор 1,44 ммоль н-бутиллития (1,6 М в гексане), и данную смесь перемешивали при -78°С в течение 10 мин. Затем добавляли по каплям в течение 15 мин раствор 1,58 ммоль дифенилдисульфида в 1 мл тетрагидрофурана, и затем реакционной смеси давали нагреваться до комнатной температуры. Затем реакционную смесь вливали в насыщенный рассол, и эту смесь экстрагировали три раза смесью этилацетат/тетрагидрофуран (1:1). Объединенные органические фазы сушили над сульфатом натрия и концентрировали под вакуумом. В результате хроматографии (SiO2, этилацетат/гептан) получали указанное в заголовке соединение в виде желтого кристаллического твердого вещества (выход 76%). МС (масса/заряд): 378,3 (M+H+, 100%).
в) 4-(5-Бензолсульфонил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
К раствору 1,06 ммоль 4-(5-фенилсульфанил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира в 10 мл дихлорэтана добавляли 2,65 ммоль мета-хлорпербензойной кислоты, и данную смесь перемешивали при комнатной температуре в течение 16 ч. Затем реакционную смесь разбавляли дихлорметаном и промывали насыщенным водным раствором бикарбоната натрия и затем водой. Органическую фазу сушили над сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения в виде желтого кристаллического твердого вещества (выход 77%). МС (масса/заряд): 410,3 (M+H+, 100%).
г) 1-(5-Бензолсульфонил-тиазол-2-ил)-пиперазин гидрохлорид
К раствору 0,73 ммоль 4-(5-бензолсульфонил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира в 10 мл диоксана добавляли по каплям раствор 7,32 ммоль хлористого водорода (4 М в диоксане), и данную смесь перемешивали при 80°С в течение 2,5 ч. Затем реакционную смесь охлаждали до 0°С и разбавляли диэтиловым эфиром. Получившиеся кристаллы собирали путем фильтрации и промывали диэтиловым эфиром с получением указанного в заголовке соединения в виде светло-коричневого кристаллического твердого вещества (выход 81%). МС (масса/заряд): 309,9 (M+H+, 100%).
д) [4-(5-Бензолсульфонил-тиазол-2-ил)-пиперазин-1-ил]-(2-изопропокси-5-метансульфонил-фенил)-метанон
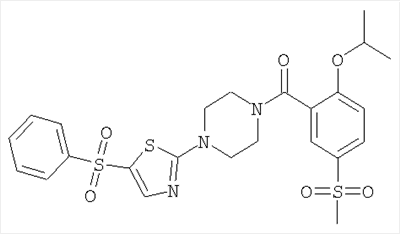
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-(5-бензолсульфонил-тиазол-2-ил)-пиперазина гидрохлорида. Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 47%). МС (масса/заряд): 550,2 (M+H+, 100%), 567,2 (M+NH4 +, 100%). +, 100%).
Пример 5
(2-Изопропокси-5-метансульфонил-фенил)-{4-[4-(2-нитро-фенил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
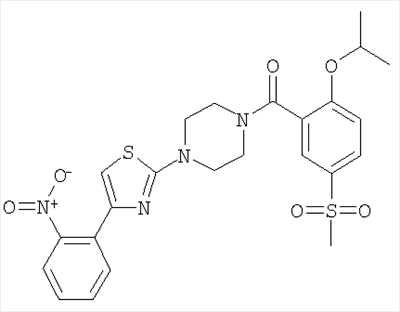
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-[4-(2-нитро-фенил)-тиазол-2-ил]-пиперазина дигидрохлорида. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтого кристаллического твердого вещества (выход 61%). МС (масса/заряд): 531,3 (М+Н+, 100%).
Пример 6
2-[4-(2-Изопропокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил
а) 2-пиперазин-1-ил-тиазол-5-карбонитрил
Получали по аналогии с примером 2 (б) из 2-хлор-1,3-тиазол-5-карбонитрила и пиперазина. Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 86%). МС (масса/заряд): 194,9 (М+Н+, 100%).
б) 2-[4-(2-Изопропокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил
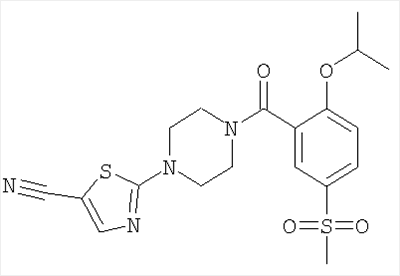
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 2-пиперазин-1-ил-тиазол-5-карбонитрила. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 69%). МС (масса/заряд): 435,4 (М+Н+, 100%).
Пример 7
{4-[4-(2,4-Дихлор-фенил)-тиазол-2-ил]-пиперазин-1-ил}-(2-изопропокси-5-метансульфонил-фенил)-метанон
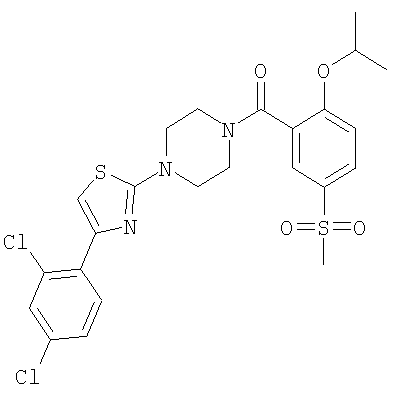
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-[4-(2,4-дихлор-фенил)-тиазол-2-ил]-пиперазина дигидрохлорида. Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) (выход 17%). МС (масса/заряд): 558,1 ({37Cl}M+H+, 19%), 555,9 ({37Cl35Cl}M+H+, 58%), 554,1 ({35Cl}M+H+, 100%).
Пример 8
(2-Изопропокси-5-метансульфонил-фенил)-[4-(5-нитро-тиазол-2-ил)-пиперазин-1-ил]-метанон
Получали по аналогии с примером 2 (б) из 2-бром-5-нитротиазола и пиперазина. Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде светло-желтого кристаллического твердого вещества (выход 50%). МС (масса/заряд): 215,3 (М+Н+, 100%).
б) (2-Изопропокси-5-метансульфонил-фенил)-[4-(5-нитро-тиазол-2-ил)-пиперазин-1-ил]-метанон
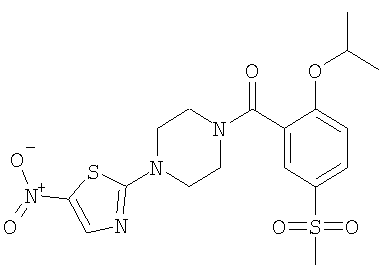
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-(5-нитро-тиазол-2-ил)-пиперазина. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтого кристаллического твердого вещества (выход 67%). МС (масса/заряд): 455,4 (М+H+, 100%), 472,0 (M+NH4 +, 100%). +, 100%).
Пример 9
(2-Изопропокси-5-метансульфонил-фенил)-[4-(3-фенил-[1,2,4]тиадиазол-5-ил)-5 пиперазин-1-ил]-метанон
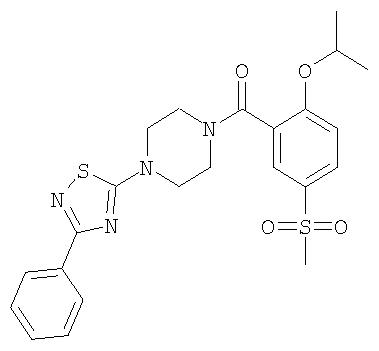
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 3-фенил-5-пиперазино-1,2,4-тиадиазола. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 69%). МС (масса/заряд): 487,3 (M+H+, 100%).
Пример 10
2-{4-[5-Метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензоил]-пиперазин-1-ил}-тиазол-5-карбонитрил
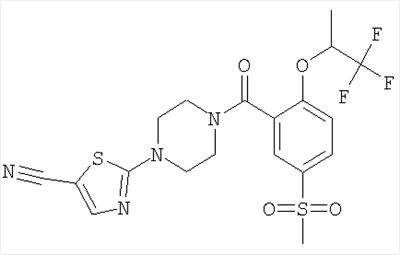
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А2) и 2-пиперазин-1-ил-тиазол-5-карбонитрила (Пример 6 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 59%). МС (масса/заряд): 489,1 (М+Н+, 100%), 506,1 (M+NH4 +, 78%). +, 78%).
Пример 11
2-{4-[5-Метансульфонил-2-(2,2,2-трифтор-этокси)-бензоил]-пиперазин-1-ил}-тиазол-5-карбонитрил
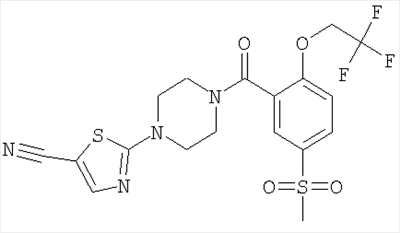
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-этокси)-бензойной кислоты (Пример A3) и 2-пиперазин-1-ил-тиазол-5-карбонитрила (Пример 6 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде светло-коричневого кристаллического твердого вещества (выход 57%). МС (масса/заряд): 475,0 (M+H+, 100%), 492,3 (M+NH4 +, 90%). +, 90%).
Пример 12
2-[4-(2-Циклопентилокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил
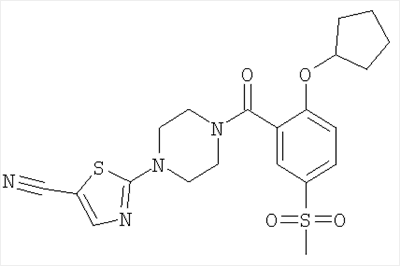
Получали по аналогии с примером 1 (б) из 2-циклопентилокси-5-метансульфонил-бензойной кислоты (Пример А4) и 2-пиперазин-1-ил-тиазол-5-карбонитрила (Пример 6 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 64%). МС (масса/заряд): 461,3 (M+H+, 100%).
Пример 13
2-[4-(2-Циклопропилметокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил
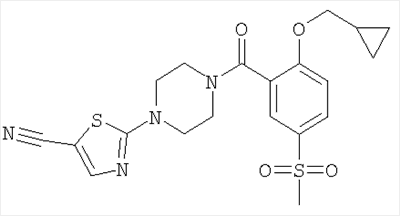
Получали по аналогии с примером 1 (б) из 2-циклопропилметокси-5-метансульфонил-бензойной кислоты (Пример А5) и 2-пиперазин-1-ил-тиазол-5-карбонитрила (Пример 6 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 75%). МС (масса/заряд): 447,3 (М+H+, 100%).
Пример 14
2-[4-(2-Циклобутилметокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил
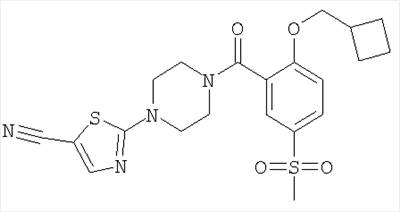
Получали по аналогии с примером 1 (б) из 2-цикпобутилметокси-5-метансульфонил-бензойной кислоты (Пример А6) и 2-пиперазин-1-ил-тиазол-5-карбонитрила (Пример 6 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 61%). МС (масса/заряд): 461,3 (M+H+, 100%).
Пример 15
2-[4-(2-Циклогексилокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил
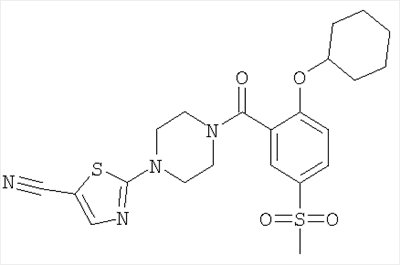
Получали по аналогии с примером 1 (б) из 2-циклогексилокси-5-метансульфонил-бензойной кислоты (Пример А7) и 2-пиперазин-1-ил-тиазол-5-карбонитрила (Пример 6 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 49%). МС (масса/заряд): 475,4 (М+Н+, 100%).
Пример 16
2-[4-(2-Изобутокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил
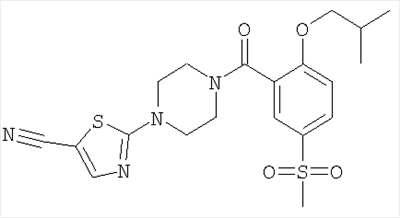
Получали по аналогии с примером 1 (б) из 2-изобутокси-5-метансульфонил-бензойной кислоты (Пример А8) и 2-пиперазин-1-ил-тиазол-5-карбонитрила (Пример 6 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 61%). МС (масса/заряд): 449,4 (M+H+, 100%).
Пример 17
2-[4-(2-Циклобутокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил
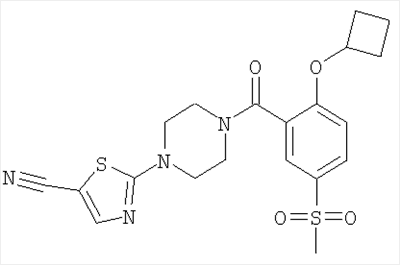
Получали по аналогии с примером 1 (б) из 2-циклобутокси-5-метансульфонил-бензойной кислоты (Пример А9) и 2-пиперазин-1-ил-тиазол-5-карбонитрила (Пример 6 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 54%). МС (масса/заряд): 447,2 (M+H+, 100%).
Пример 18
2-[4-(2-втор-Бутокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил
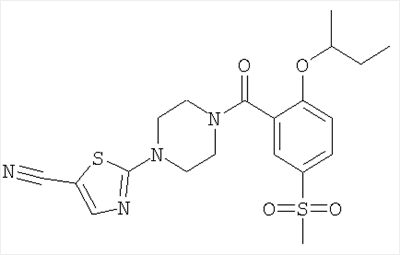
Получали по аналогии с примером 1 (б) из 2-втор-бутокси-5-метансульфонил-бензойной кислоты (Пример А10) и 2-пиперазин-1-ил-тиазол-5-карбонитрила (Пример 6 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 34%). МС (масса/заряд): 449,4 (М+H+, 100%).
Пример 19
2-{4-[2-(2,2-Диметил-пропокси)-5-метансульфонил-бензоил]-пиперазин-1-ил}-тиазол-5-карбонитрил
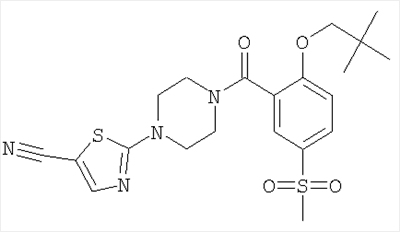
Получали по аналогии с примером 1 (б) из 2-(2,2-диметил-пропокси)-5-метансульфонил-бензойной кислоты (Пример А11) и 2-пиперазин-1-ил-тиазол-5-карбонитрила (Пример 6 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 68%). МС (масса/заряд): 463,3 (M+H+, 100%).
Пример 20
2-[4-(2-трет-Бутокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил
Получали по аналогии с примером 1 (б) из 2-трет-бутокси-5-метансульфонил-бензойной кислоты (Пример А12) и 2-пиперазин-1-ил-тиазол-5-карбонитрила (Пример 6 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 52%). МС (масса/заряд): 449,3 (М+Н+, 50%), 466,4 (M+NH4 +, 100%). +, 100%).
Пример 21
(2-Изопропокси-5-метансульфонил-фенил)-[4-(5-метансульфонил-тиазол-2-ил)-пиперазин-1-ил]-метанон
а) 4-(5-Метилсульфанил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Получали по аналогии с примером 4 (б) из 4-(5-бром-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира (Пример 4(а)) и диметилдисульфида. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде желтого кристаллического твердого вещества (выход 78%). МС (масса/заряд): 316,3 (М+H+, 100%).
б) 4-(5-Метансульфонил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Получали по аналогии с примером 4 (в) из 4-(5-метилсульфанил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира и мета-хлорпербензойной кислоты. Указанное в заголовке соединение получали в виде желтого кристаллического твердого вещества (выход 86%). МС (масса/заряд): 348,3 (М+Н+, 100%).
в) 1-(5-Метансульфонил-тиазол-2-ил)-пиперазина гидрохлорид
Получали по аналогии с примером 4 (г) из 4-(5-метансульфонил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира и раствора хлористого водорода. Неочищенное вещество очищали путем перекристаллизации из диэтилового эфира с получением указанного в заголовке соединения в виде светло-коричневого кристаллического твердого вещества (выход 99%). МС (масса/заряд): 248,1 (М+Н+, 100%).
г) (2-Изопропокси-5-метансульфонил-фенил)-[4-(5-метансульфонил-тиазол-2-ил)-пиперазин-1-ил]-метанон
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-(5-метансульфонил-тиазол-2-ил)-пиперазина гидрохлорида. Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 43%). МС (масса/заряд): 488,1 (М+Н+, 100%), 505,0 (M+NH4 +, 75%). +, 75%).
Пример 22
[4-(5-Метансульфонил-тиазол-2-ил)-пиперазин-1-ил]-[5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-метанон
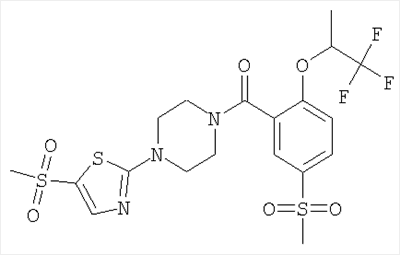
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А2) и 1-(5-метансульфонил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 21 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 29%). МС (масса/заряд): 542,2 (М+Н+, 100%), 559,2 (M+NH4 +, 65%). +, 65%).
Пример 23
(2-Циклопропилметокси-5-метансульфонил-фенил)-[4-(5-метансульфонил-тиазол-2-ил)-пиперазин-1-ил]-метанон
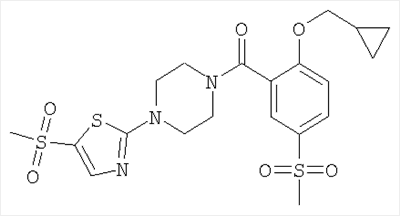
Получали по аналогии с примером 1 (б) из 2-циклопропилметокси-5-метансульфонил-бензойной кислоты (Пример А5) и 1-(5-метансульфонил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 21 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтого кристаллического твердого вещества (выход 36%). МС (масса/заряд): 500,1 (М+Н+, 100%), 517,2 (М+NH4 +, 69%). +, 69%).
Пример 24
(2-Изобутокси-5-метансульфонил-фенил)-[4-(5-метансульфонил-тиазол-2-ил)-пиперазин-1-ил]-метанон
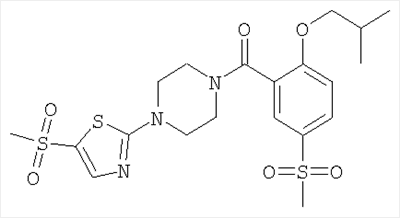
Получали по аналогии с примером 1 (б) из 2-изобутокси-5-метансульфонил-бензойной кислоты (Пример А8) и 1-(5-метансульфонил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 21 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 40%), МС (масса/заряд): 502,0 (M+H+, 100%).
Пример 25
Рац-(2-втор-Бутокси-5-метансульфонил-фенил)-[4-(5-метансульфонил-тиазол-2-ил)-пиперазин-1-ил]-метанон
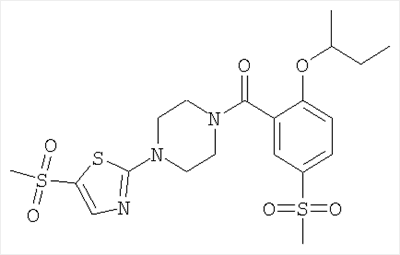
Получали по аналогии с примером 1 (б) из рац-2-втор-бутокси-6-метансульфонил-бензойной кислоты (Пример А10) и 1-(5-метансульфонил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 21 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 44%). МС (масса/заряд): 502,1 (М+Н+, 99%), 519,3 (M+NH4 +, 100%). +, 100%).
Пример 26
[2-(2,2-Диметил-пропокси)-5-метансульфонил-фенил]-[4-(5-метансульфонил-тиазол-2-ил)-пиперазин-1-ил]-метанон
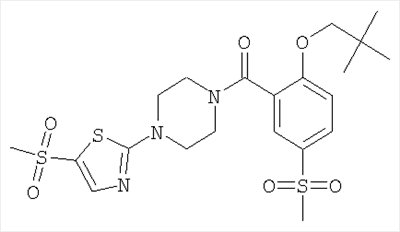
Получали по аналогии с примером 1 (б) из 2-(2,2-диметил-пропокси)-5-метансульфонил-бензойной кислоты (Пример А11) и 1-(5-метансульфонил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 21 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 36%). МС (масса/заряд): 516,2 (М+H+, 100%).
Пример 27
(2-Циклогексилокси-5-метансульфонил-фенил)-[4-(5-метансульфонил-тиазол-2-ил)-пиперазин-1-ил]-метанон
Получали по аналогии с примером 1 (б) из 2-циклогексилокси-5-метансульфонил-бензойной кислоты (Пример А7) и 1-(5-метансульфонил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 21 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде светло-красного кристаллического твердого вещества (выход 38%). МС (масса/заряд): 528,3 (M+H+, 100%).
Пример 28
(2-Циклопентилокси-5-метансульфонил-фенил)-[4-(5-метансульфонил-тиазол-2-ил)-пиперазин-1-ил]-метанон
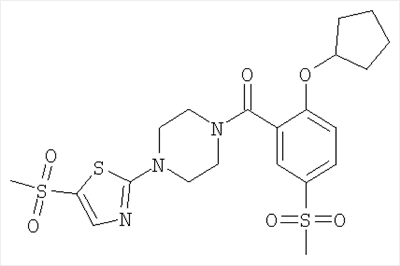
Получали по аналогии с примером 1 (б) из 2-циклопентилокси-5-метансульфонил-бензойной кислоты (Пример А4) и 1-(5-метансульфонил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 21 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 38%). МС (масса/заряд): 514,3 (М+Н+, 100%).
Пример 29
[4-(5-Бензолсульфонил-тиазол-2-ил)-пиперазин-1-ил]-[2-(2,2-диметил-пропокси)-5-метансульфонил-фенил]-метанон
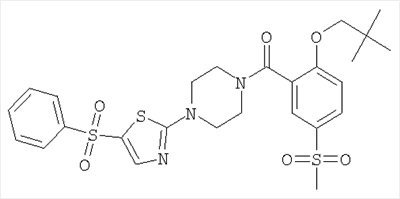
Получали по аналогии с примером 1 (б) из 2-(2,2-диметил-пропокси)-5-метансульфонил-бензойной кислоты (Пример А11) и 1-(5-бензолсульфонил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 4 (г)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 57%). МС (масса/заряд): 578,2 (M+H+, 100%), 595,3 (M+NH4 +, 92%). +, 92%).
Пример 30
[4-(5-Бензолсульфонил-тиазол-2-ил)-пиперазин-1-ил]-(2-циклопентилокси-5-метансульфонил-фенил)-метанон
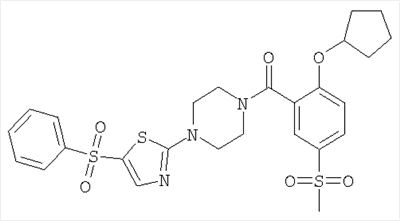
Получали по аналогии с примером 1 (б) из 2-цикпопентилокси-5-метансульфонил-бензойной кислоты (Пример А4) и 1-(5-бензолсульфонил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 4 (г)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 57%). МС (масса/заряд): 576,0 (М+Н+, 100%), 593,3 (M+NH4 +, 94%). +, 94%).
Пример 31
[4-(5-Бензолсульфонил-тиазол-2-ил)-пиперазин-1-ил]-(2-изобутокси-5-метансульфон ил-фенил)-метанон
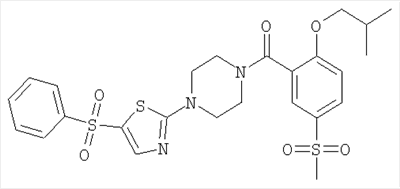
Получали по аналогии с примером 1 (б) из 2-изобутокси-5-метансульфонил-бензойной кислоты (Пример А8) и 1-(5-бензолсульфонил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 4 (г)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 45%). МС (масса/заряд): 564,3 (M+H+, 100%), 581,3 (M+NH4 +, 94%). +, 94%).
Пример 32
[2-(2,2-Диметил-пропокси)-5-метансульфонил-фенил]-[4-(5-этансульфонил-тиазол-2-ил)-пиперазин-1-ил]-метанон
а) 4-(5-Этилсульфанил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Получали по аналогии с примером 4 (б) из 4-(5-бром-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира (Пример 4(а)) и диэтилдисульфида. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 86%). МС (масса/заряд): 330,3 (М+Н+, 100%).
б) 4-(5-Этансульфонил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Получали по аналогии с примером 4 (в) из 4-(5-этилсульфанил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира и мета-хлорпербензойной кислоты. Указанное в заголовке соединение получали в виде желтого кристаллического твердого вещества (выход 99%). МС (масса/заряд): 362,3 (M+H+, 100%), 362,3 (M+NH4 +, 70%). +, 70%).
в) 1-(5-Этансульфонил-тиазол-2-ил)-пиперазина гидрохлорид
Получали по аналогии с примером 4 (г) из 4-(5-этансульфонил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира и раствора хлористого водорода. Неочищенное вещество очищали путем перекристаллизации из диэтилового эфира с получением указанного в заголовке соединения в виде светло-коричневого кристаллического твердого вещества (выход 86%). МС (масса/заряд): 262,0 (М+Н+, 100%).
г) [2-(2,2-Диметил-пропокси)-5-метансульфонил-фенил]-[4-(5-этансульфонил-тиазол-2-ил)-пиперазин-1-ил]-метанон
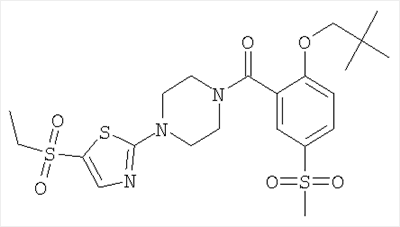
Получали по аналогии с примером 1 (б) из 2-(2,2-диметил-пропокси)-5-метансульфонил-бензойной кислоты (Пример А11) и 1-(5-этансульфонил-тиазол-2-ил)-пиперазина гидрохлорида. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 63%). МС (масса/заряд): 530,2 (M+H+, 64%), 547,2 (M+NH4 +, 100%). +, 100%).
Пример 33
[4-(5-Этансульфонил-тиазол-2-ил)-пиперазин-1-ил]-(2-изопропокси-5-метансульфонил-фенил)-метанон
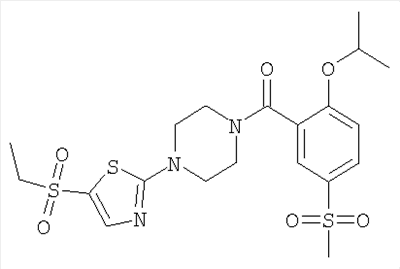
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-(5-этансульфонил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 32 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 71%). МС (масса/заряд): 502,3 (М+Н+, 100%), 519,3 (M+NH4 +, 82%). +, 82%).
Пример 34
[4-(4,5-Диметил-тиазол-2-ил)-пиперазин-1-ил]-(2-изопропокси-5-метансульфонил-фенил)-метанон
а) 2-Иод-4,5-диметил-тиазол
Получали по аналогии с примером 2 (а) из 4,5-диметилтиазола. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде светло-коричневого кристаллического твердого вещества (выход 66%). МС (масса/заряд): 240,1 (М+Н+, 100%).
б) 1-(4,5-Диметил-тиазол-2-ил)-пиперазин
Получали по аналогии с примером 2 (б) из 2-иод-4,5-диметил-тиазола и пиперазина. Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде желтого кристаллического твердого вещества (выход 25%). МС (масса/заряд): 198,3 (М+H+, 100%).
в) [4-(4,5-Диметил-тиазол-2-ил)-пиперазин-1-ил]-(2-изопропокси-5-метансульфонил-фенил)-метанон
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-(4,5-диметил-тиазол-2-ил)-пиперазина. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 65%). МС (масса/заряд): 584,3 (M+H+, 100%), 601,4 (M+NH4 +, 60%). +, 60%).
Пример 35
(2-Циклопентилокси-5-метансульфонил-фенил)-[4-(5-этансульфонил-тиазол-2-ил)-пиперазин-1-ил]-метанон
Получали по аналогии с примером 1 (б) из 2-циклопентилокси-5-метансульфонил-бензойной кислоты (Пример А4) и 1-(5-этансульфонил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 32 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 77%). МС (масса/заряд): 528,3 (М+Н+, 35%), 545,4 (M+NH4 +, 100%). +, 100%).
Пример 36
[4-(5-Этансульфонил-тиазол-2-ил)-пиперазин-1-ил]-[5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-метанон
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А2) и 1-(5-этансульфонил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 32 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 61%). МС (масса/заряд): 556,3 (M+H+, 100%), 573,3 (M+NH4 +, 55%). +, 55%).
Пример 37
[4-(5-Этансульфонил-тиазол-2-ил)-пиперазин-1-ил]-[5-метансульфонил-2-(2,2,2-трифтор-этокси)-фенил]-метанон
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-этокси)-бензойной кислоты (Пример A3) и 1-(5-этансульфонил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 32 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 72%). МС (масса/заряд): 542,2 (М+Н+, 100%), 559,3 (M+NH4 +, 60%). +, 60%).
Пример 38
{4-[5-(Бутан-1-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-(2-изопропокси-5-метансульфонил-фенил)-метанон
а) 4-(5-Бутилсульфанил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Получали по аналогии с примером 4 (б) из 4-(5-бром-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира (Пример 4(а)) и дибутилдисульфида. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде бесцветного масла (выход 93%). МС (масса/заряд): 358,3 (М+Н+, 100%).
б) 4-[5-(Бутан-1-сульфонил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Получали по аналогии с примером 4 (в) из 4-(5-бутилсульфанил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира и мета-хлорпербензойной кислоы. Указанное в заголовке соединение получали в виде желтого кристаллического твердого вещества (выход 82%). МС (масса/заряд): 390,3 (M+H+, 100%), 407,3 (M+
NH4 +, 80%). +, 80%).
в) 1-[5-(Бутан-1-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорид
Получали по аналогии с примером 4 (г) из 4-[5-(бутан-1-сульфонил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутилового эфира и раствора хлористого водорода. Неочищенное вещество очищали путем перекристаллизации из диэтилового эфира с получением указанного в заголовке соединения в виде желтоватого кристаллического твердого вещества (выход 92%). МС (масса/заряд): 290,0 (М+H+, 100%).
г) {4-[5-(Бутан-1-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-(2-изопропокси-5-метансульфонил-фенил)-метанон
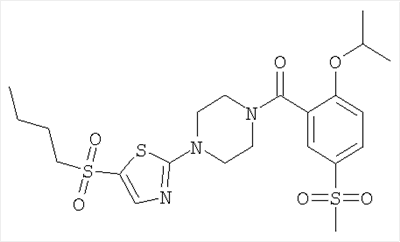
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-[5-(бутан-1-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорида. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 54%). МС (масса/заряд): 530,3 (М+Н+, 35%), 547,5 (M+NH4 +, 100%). +, 100%).
Пример 39
{4-[5-(Бутан-1-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-[5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-метанон
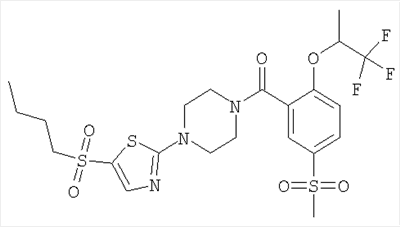
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А2) и 1-[5-(бутан-1-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорида (Пример 38(в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 65%). МС (масса/заряд): 584,3 (M+H+, 100%), 601,4 (М+NH4 +, 60%). +, 60%).
Пример 40
{4-[5-(Бутан-1-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-[5-метансульфонил-2-(2,2,2-трифтор-этокси)-фенил]-метанон
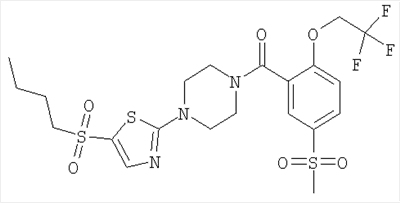
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-этокси)-бензойной кислоты (Пример A3) и 1-[5-(бутан-1-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорида (Пример 38 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 63%). МС (масса/заряд): 570,4 (М+Н+, 15%), 587,3 (M+NH4 +, 100%). +, 100%).
Пример 41
{4-[5-(Бутан-1-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-(2-циклопентилокси-5-метансульфонил-фенил)-метанон
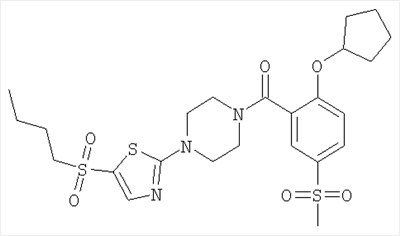
Получали по аналогии с примером 1 (б) из 2-цикпопентилокси-5-метансульфонил-бензойной кислоты (Пример А4) и 1-[5-(бутан-1-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорида (Пример 38 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 71%). МС (масса/заряд): 556,3 (М+H+, 35%), 573,5 (M+NH4 +, 100%). +, 100%).
Пример 42
{4-[5-(Бутан-1-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-[2-(2,2-диметил-пропокси)-5-метансульфонил-фенил]-метанон
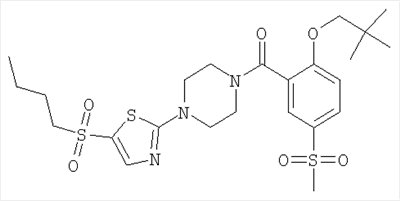
Получали по аналогии с примером 1 (б) из 2-(2,2-диметил-пропокси)-5-метансульфонил-бензойной кислоты (Пример АН) и 1-[5-(бутан-1-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорида (Пример 38 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 69%). МС (масса/заряд): 558,4 (М+Н+, 20%), 575,4 (M+NH4 +, 100%). +, 100%).
Пример 43
{4-[5-(Бутан-1-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-(5-метансульфонил-2-морфолин-4-ил-фенил)-метанон
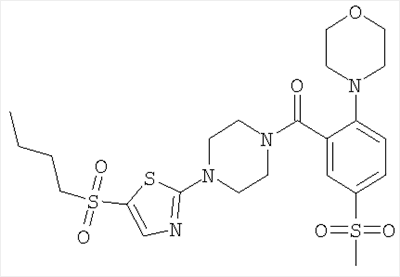
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-морфолин-4-ил-бензойной кислоты (Пример А13) и 1-[5-(бутан-1-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорида (Пример 38 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде светло-красного кристаллического твердого вещества (выход 60%). МС (масса/заряд): 557,2 (М+H+, 65%), 574,4 (M+NH4 +, 100%). +, 100%).
Пример 44
(2-Изопропокси-5-метансульфонил-фенил)-{4-[5-(пропан-2-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
а) 4-[5-(Пропан-2-сульфонил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
К раствору 0,83 ммоль 4-(5-этансульфонил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира (Пример 32(б)) в 3 мл тетрагидрофурана при -78°С добавляли по каплям раствор 1,08 ммоль бис(триметилсилиламид) калия (0,91 М в тетрагидрофуране). Через 3 мин добавляли по каплям раствор 1,24 ммоль иодметана в 2 мл тетрагидрофурана, и перемешивание продолжали в течение 10 мин при -78°С. Затем реакционную смесь оставляли нагреваться до комнатной температуры и вливали в смесь тетрагидрофуран/этилацетат (1:1). Данную смесь промывали рассолом, и органическую фазу сушили над сульфатом натрия и концентрировали под вакуумом. В результате хроматографии (SiO2, этилацетат/гептан) получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 30%). МС (масса/заряд): 376,1 (М+H+, 100%).
б) 1-[5-(Пропан-2-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорид
Получали по аналогии с примером 4 (г) из 4-[5-(пропан-2-сульфонил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутилового эфира и раствора хлористого водорода. Неочищенное вещество очищали путем перекристаллизации из диэтилового эфира с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 97%). МС (масса/заряд): 276,4 (M+H+, 100%).
в) (2-Изопропокси-5-метансульфонил-фенил)-{4-[5-(пропан-2-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
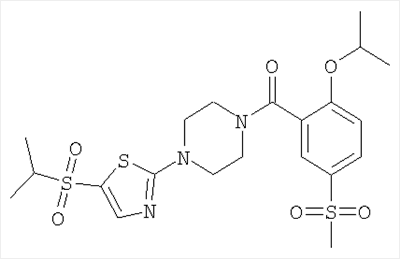
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-[5-(пропан-2-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорида. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 67%). МС (масса/заряд): 516,3 (M+H+, 100%), 533,3 (M+NH4 +, 85%). +, 85%).
Пример 45
(2-Изопропокси-5-метансульфонил-фенил)-{4-[5-(пиридин-2-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
а) 4-[5-(Пиридин-2-илсульфанил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Получали по аналогии с примером 4 (б) из 4-(5-бром-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира (Пример 4(а)) и 2,2′-дитиодипиридина. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде желтого кристаллического твердого вещества (выход 94%). МС (масса/заряд): 379,1 (М+Н+, 100%).
б) 4-[5-(Пиридин-2-сульфонил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Получали по аналогии с примером 4 (в) из 4-[5-(пиридин-2-илсульфанил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутилового эфира и мета-хлорпербензойной кислоты. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 54%). МС (масса/заряд): 411,3 (М+Н+, 100%).
в) 1-[5-(Пиридин-2-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорид
Получали по аналогии с примером 4 (г) из 4-[5-(пиридин-2-сульфонил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутилового эфира и раствора хлористого водорода. Неочищенное вещество очищали путем перекристаллизации из диэтилового эфира с получением указанного в заголовке соединения в виде желтоватого кристаллического твердого вещества (выход 99%). МС (масса/заряд): 311,0 [М+Н+, 100%).
г) (2-Изопропокси-5-метансульфонил-фенил)-{4-[5-(пиридин-2-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-[5-(пиридин-2-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорида. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 90%). МС (масса/заряд): 551,2 (M+H+, 100%).
Пример 46
(2-Изопропокси-5-метансульфонил-фенил)-{4-[5-(пиридин-3-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
a) 4-[5-(Пиридин-3-илсульфанил)-тиазол-2-ил]-пилеразин-1-карбоновой кислоты трет-бутиловый эфир
Получали по аналогии с примером 4 (б) из 4-(5-бром-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира (Пример 4 (а)) и 3,3′-дитиодипиридина. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде оранжевого масла (выход 55%). МС (масса/заряд): 379,1 (М+Н+, 100%).
б) 4-[5-(Пиридин-3-сульфонил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Получали по аналогии с примером 4 (в) из 4-[5-(пиридин-3-илсульфанил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутилового эфира и мета-хлорпербензойной кислоты. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 41%). МС (масса/заряд): 411,1 (М+Н+, 100%).
в) 1-[5-(Пиридин-3-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорид
Получали по аналогии с примером 4 (г) из 4-[5-(пиридин-3-сульфонил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутилового эфира и раствора хлористого водорода. Неочищенное вещество очищали путем перекристаллизации из диэтилового эфира с получением указанного в заголовке соединения в виде желтоватого кристаллического твердого вещества (выход 99%). МС (масса/заряд): 311,0 [М+Н+, 100%).
г) (2-Изопропокси-5-метансульфонил-фенил)-{4-[5-(пиридин-3-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
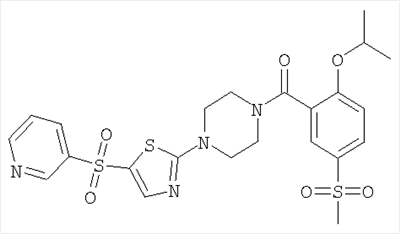
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-[5-(пиридин-3-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорида. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 87%). МС (масса/заряд): 551,3 (M+H+, 100%).
Пример 47
[5-Метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-{4-[5-(пиридин-2-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
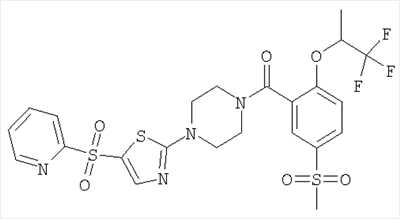
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А2) и 1-[5-(пиридин-2-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорида (Пример 45 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 68%). МС (масса/заряд): 605,0 (М+Н+, 100%).
Пример 48
[5-Метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-{4-[5-(пиридин-3-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
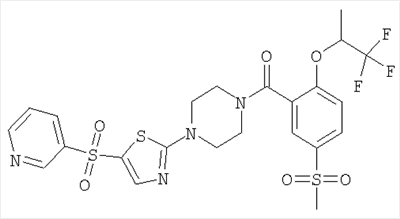
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-1-метил-зтокси)-бензойной кислоты (Пример А2) и 1-[5-(пиридин-3-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорида (Пример 46 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде светло-коричневого кристаллического твердого вещества (выход 49%). МС (масса/заряд): 605,2 (M+H+, 100%).
Пример 49
(2-Изопропокси-5-метансульфонил-фенил)-[4-(4-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
а) 1-(4-Трифторметил-тиазол-2-ил)-пилеразин
К раствору 6,89 ммоль 1-пиперазинкарботиоамида в 10 мл этанола добавляли 8,26 ммоль 3-бром-1,1,1-трифторацетона, и данную смесь нагревали при 70°С в течение 2 ч. Затем смесь концентрировали под вакуумом, и остаток ресуспендировали в дихлорметане. Нерастворимое вещество удаляли путем фильтрации, и фильтрат концентрировали под вакуумом. В результате хроматографии (SiO2, метанол/дихлорметан) получали указанное в заголовке соединение в виде желтого кристаллического твердого вещества (выход 41%). МС (масса/заряд): 238,1 (М+Н+, 100%).
б) (2-Изопропокси-5-метансульфонил-фенил)-[4-(4-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
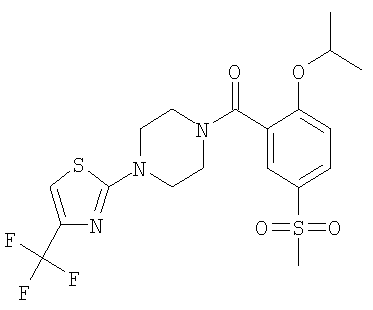
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-(4-трифторметил-тиазол-2-ил)-пиперазина. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в пентане получали указанное в заголовке соединение в виде кристаллического белого твердого вещества (выход 55%). МС (масса/заряд): 478,0 (М+H+, 100%).
Пример 50
[5-Метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(4-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
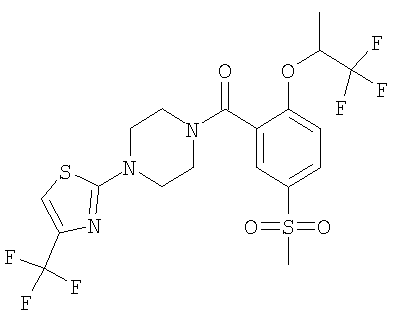
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А2) и 1-(4-трифторметил-тиазол-2-ил)-пиперазина (Пример 49 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в пентане получали указанное в заголовке соединение в виде кристаллического белого твердого вещества (выход 48%). МС (масса/заряд): 531,8 (М+Н+, 100%).
Пример 51
(2-Циклопентилокси-5-метансульфонил-фенил)-[4-(4-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
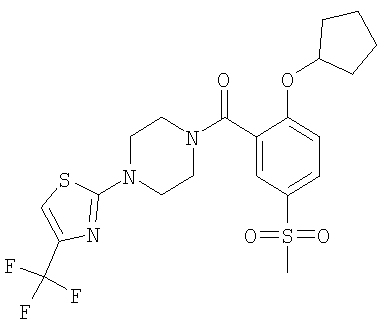
Получали по аналогии с примером 1 (б) из 2-циклопентилокси-5-метансульфонил-бензойной кислоты (Пример А4) и 1 -(4-трифторметил-тиазол-2-ил)-пиперазина (Пример 49 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в пентане получали указанное в заголовке соединение в виде кристаллического белого твердого вещества (выход 71%). МС (масса/заряд): 504,0 (М+Н+, 100%).
Пример 52
(2-Изопропокси-5-метансульфонил-фенил)-{4-[5-(пиридин-4-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
а) 4-[5-(Пиридин-4-илсульфанил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Получали по аналогии с примером 4 (б) из 4-(5-бром-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира (Пример 4(а)) и 4,4′-дитиодипиридина. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде желтого масла (выход 79%). МС (масса/заряд): 379,3 (M+H+, 100%).
б) 4-[5-(Пиридин-4-сульфонил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Получали по аналогии с примером 4 (в) из 4-[5-(пиридин-4-илсульфанил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутилового эфира и мета-хлорпербензойной кислоты. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде желтого кристаллического твердого вещества (выход 37%). МС (масса/заряд): 411,3 (М+Н+, 100%).
в) 1-[5-(Пиридин-4-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорид
Получали по аналогии с примером 4 (г) из 4-[5-(пиридин-4-сульфонил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутилового эфира и раствора хлористого водорода. Неочищенное вещество очищали путем перекристаллизации из диэтилового эфира с получением указанного в заголовке соединения в виде светло-желтого кристаллического твердого вещества (выход 99%). МС (масса/заряд): 311,0 (М+Н+, 100%).
г) (2-Изопропокси-5-метансульфонил-фенил)-{4-[5-(пиридин-4-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-[5-(пиридин-4-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорида. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде светло-красного кристаллического твердого вещества (выход 32%). МС (масса/заряд): 551,2 (М+H+, 100%).
Пример 53
[5-Метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-{4-[5-(пиридин-4-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А2) и 1-[5-(пиридин-4-сульфонил)-тиазол-2-ил]-пиперазина гидрохлорида (Пример 52 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде светло-желтого кристаллического твердого вещества д (выход 32%). МС (масса/заряд): 551,2 (М+Н+, 100%).
Пример 54
(2-Изопропокси-5-метансульфонил-фенил)-[4-(5-метил-4-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
а) 1-(5-Метил-4-трифторметил-тиазол-2-ил)-пиперазин
Получали по аналогии с примером 49 (а) из 1-пиперазинкарботиоамида и 3-бром-1,1,1-трифтор-2-бутанона. Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 25%). МС (масса/заряд): 252,1 (М+Н+, 100%).
б) (2-Изопропокси-5-метансульфонил-фенил)-[4-(5-метил-4-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
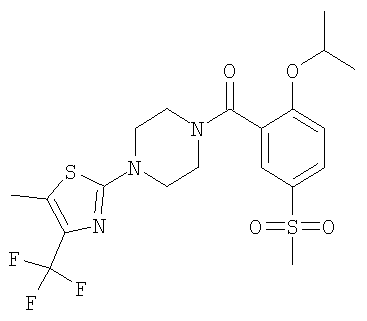
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-(5-метил-4-трифторметил-тиазол-2-ил)-пиперазина. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 60%). МС (масса/заряд): 492,3 (М+H+, 100%).
Пример 55
[5-Метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-метил-4-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
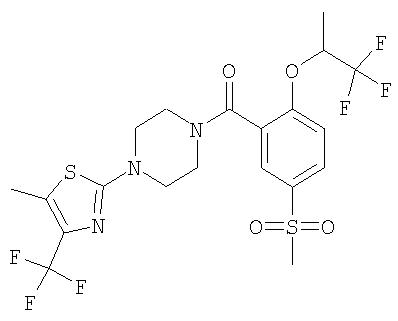
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А2) и 1-(5-метил-4-трифторметил-тиазол-2-ил)-пиперазина (Пример 54 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в пентане получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 61%). МС (масса/заряд): 546,3 (М+Н+, 100%).
Пример 56
(2-Изопропокси-5-метансульфонил-фенил)-{4-[4-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
а) 1-[4-(2,2,2-Трифтор-этил)-тиазол-2-ил]-пиперазин
Получали по аналогии с примером 49 (а) из 1-пиперазинкарботиоамида и 1-бром-4,4,4-трифтор-бутан-2-она. Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде коричневого масла (выход 24%). МС (масса/заряд): 252,3 (М+Н+, 100%).
б) (2-Изопропокси-5-метансульфонил-фенил)-{4-[4-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
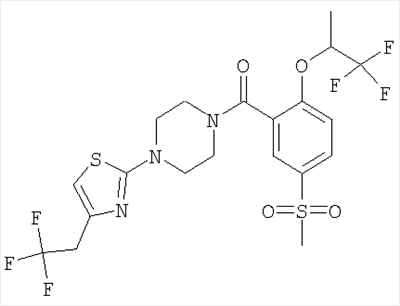
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-[4-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазина. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в пентане получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 28%). МС (масса/заряд): 492,1 (M+H+, 100%).
Пример 57
[5-Метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-{4-[4-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
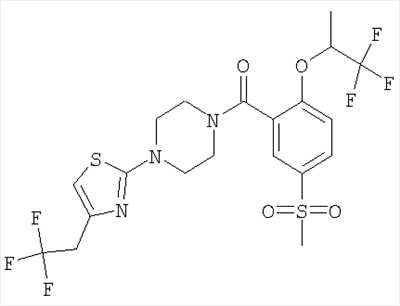
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А2) и 1-[4-(2,2,2-трифторэтил)-тиазол-2-ил]-пиперазина (Пример 56 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в пентане получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 29%). МС (масса/заряд): 546,3 (М+Н+, 100%).
Пример 58
(2-Изопропокси-5-метансульфонил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
а) 2-Бензолсульфонил-3-трифторметил-этиленоксид
К раствору 25,4 ммоль 3,3,3-трифтор-1-(фенилсульфонил)проп-1-ена в 80 мл ацетонитрила добавляли 30,5 ммоль перуксусной кислоты (39% раствор в уксусной кислоте) и 101 ммоль карбоната калия. Данную смесь нагревали при 60°С в течение 4 ч. Затем реакционную смесь разбавляли смесью этилацетат/тетрагидрофуран (1:1) и промывали рассолом. Органическую фазу сушили над сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения в виде светло-желтого кристаллического твердого вещества (выход 90%). ЭИ-МС (масса/заряд): 252,0 (М+, 15%), 125,1 (PhSO+, 100%), 77,2 (Ph+, 37%).
б) 4-(5-Трифторметил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
К раствору 17,5 ммоль 2-бензолсульфонил-3-трифторметил-этиленоксида в 20 мл N,N-диметилформамида добавляли 15,9 ммоль 4-тиокарбамоил-пиперазин-1-карбоновой кислоты трет-бутилового эфира (полученного из трет-бутил 1-пиперазинкарбоксилата, 1,1′-тиокарбонилдиимидазола и аммиака согласно методике, описанной в J. Med. Chem. 1998, 41, 5037-5054). Данную смесь нагревали при 90°С в течение 10 ч. Затем реакционную смесь концентрировали под вакуумом, и остаток очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде оранжевого кристаллического твердого вещества (выход 26%). МС (масса/заряд): 338,1 (M+H+, 100%).
в) 1-(5-Трифторметил-тиазол-2-ил)-пиперазина гидрохлорид
К раствору 3,59 ммоль 4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира в 20 мл диоксана добавляли по каплям 53,8 ммоль раствора хлористого водорода (4 М в диоксане), и данную смесь перемешивали при 90°С в течение 4 ч. Затем реакционную смесь охлаждали до 0°С и разбавляли диэтиловым эфиром. Получившиеся кристаллы собирали путем фильтрации и промывали диэтиловым эфиром с получением указанного в заголовке соединения в виде желтоватого кристаллического твердого вещества (выход 99%). МС (масса/заряд): 238,1 (М+Н+, 100%).
г) (2-Изопропокси-5-метансульфонил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
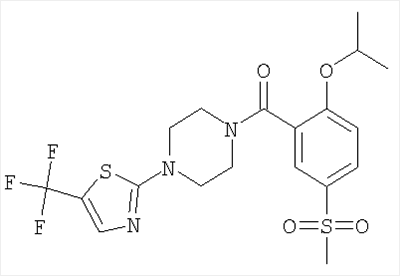
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в пентане получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 28%). МС (масса/заряд): 478,3 (М+H+, 100%).
Пример 59
[5-Метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
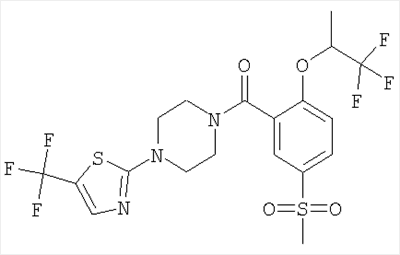
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А2) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в пентане получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 64%). МС (масса/заряд): 532,0 (М+Н+, 100%).
Пример 60
(5-Метансульфонил-2-морфолин-4-ил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
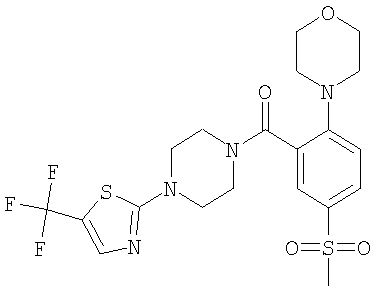
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-морфолин-4-ил-бензойной кислоты (Пример А13) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в пентане получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 71%). МС (масса/заряд): 505,3 (М+Н+, 100%).
Пример 61
(2-Циклопропилметокси-5-метансульфонил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
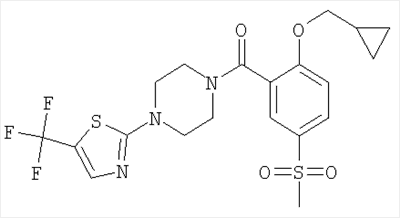
Получали по аналогии с примером 1 (б) из 2-циклопропилметокси-5-метансульфонил-бензойной кислоты (Пример А5) и 1-(б-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в пентане получали указанное в заголовке соединение в виде белого кристаллического твердого вещества (выход 22%). МС (масса/заряд): 490,3 (M+H+, 100%).
Пример 62
(2-Изопропокси-5-метансульфонил-фенил)-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон
а) 4-(5-Трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Смесь 2,2 ммоль 2-бром-5-трифторметил-[1,3,4]тиадиазола (СА 37461-6-3; полученного согласно DE 2533605), 2,3 ммоль пиперазин-1-карбоновой кислоты трет-бутилового эфира и 4,3 ммоль карбоната калия в 10 мл ацетонитрила подвергали дефлегмации в течение 4 часов. Реакционную смесь охлаждали, вливали в воду и экстрагировали 3 раза этилацетатом. В результате концентрации и перекристаллизации неочищенного вещества из диэтилового эфира получали указанное в заголовке соединение в виде бесцветного твердого вещества. МС (масса/заряд): 397,2 ([М+СН3СОО]–, 100%).
б) 1-(5-Трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазина трифторацетат
0,83 ммоль 4-(5-Трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира в 10 мл дихлорметана обрабатывали 6,6 ммоль трифторуксусной кислоты и перемешивали в течение 2 часов при комнатной температуре. Данную реакционную смесь концентрируют с получением указанного в заголовке соединения в виде желтоватой камеди. МС (масса/заряд): 239,1 (M+H+, 100%).
в) (2-Изопропокси-5-метансульфонил-фенил)-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон
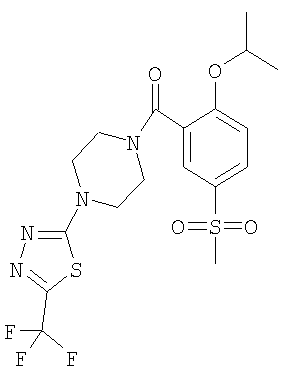
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1 -(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазина трифторацетата. Неочищенное вещество очищали путем хроматографии (SiO2, дихлорметан/метанол 99:1) с получением указанного в заголовке соединения в виде бесцветного твердого вещества. МС (масса/заряд): 479,2 (M+H+, 100%).
Пример 63
(2-Циклопропилметокси-5-метансульфонил-фенил)-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон
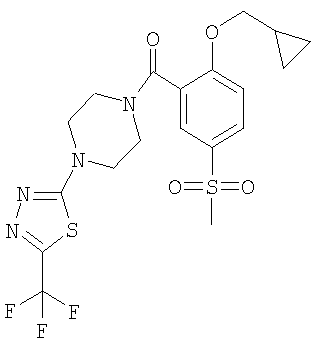
Получали по аналогии с примером 1 (б) из 2-циклопропилметокси-5-метансульфонил-бензойной кислоты (Пример А5) и 1 -(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазина трифторацетата (Пример 62 (б)). Неочищенное вещество очищали путем хроматографии (SiO2, дихлорметан/метанол 98:2) с получением указанного в заголовке соединения в виде бесцветного твердого вещества. МС (масса/заряд): 491,2 (М+Н+, 100%).
Пример 64
(2-Изобутокси-5-метансульфонил-фенил)-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон
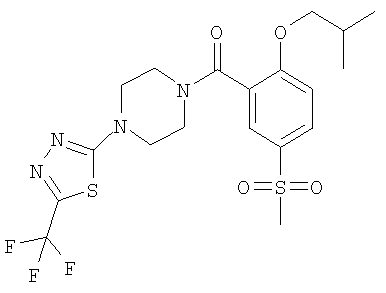
Получали по аналогии с примером 1 (б) из 2-изобутокси-5-метансульфонил-бензойной кислоты (Пример А8) и 1-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазина трифторацетата (Пример 62 (б)). Неочищенное вещество очищали путем хроматографии (SiO2, дихлорметан/метанол 98:2) с получением указанного в заголовке соединения в виде бесцветного твердого вещества. МС (масса/заряд): 493,4 (M+H+, 100%).
Пример 65
(5-Метансульфонил-2-морфолин-4-ил-фенил)-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон
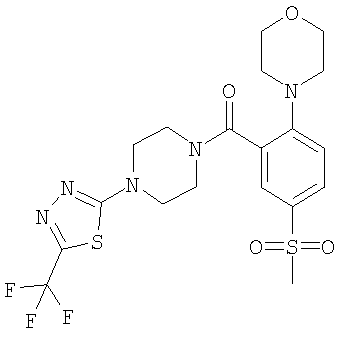
Получали по аналогии с примером 1 (б) из 6-метансульфонил-2-морфолин-4-ил-бензойной кислоты (Пример А13) и 1-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазина трифторацетата (Пример 62 (б)). Неочищенное вещество очищали путем хроматографии (SiO2, дихлорметан/метанол 99:1) с получением указанного в заголовке соединения в виде бесцветного твердого вещества, МС (масса/заряд): 506,3 (М+Н+, 100%).
Пример 66
[5-Метансульфонил-2-(2,2,2-трифтор-1,1-диметил-этокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
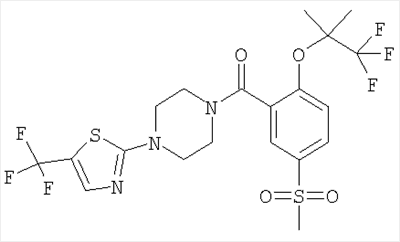
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-1,1-диметил-этокси)-бензойной кислоты (Пример А14) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем хроматографии (этилацетат/гептан) с получением указанного в заголовке соединения в виде белого твердого вещества (выход 52%). МС (масса/заряд): 546,3 (М+H+, 100%). Т.кип.=182-183°С.
Пример 67
[5-Метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
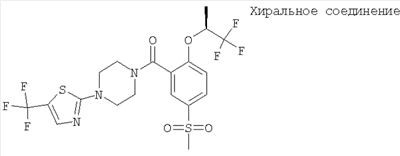
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А15) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в пентане получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 52%). МС (масса/заряд): 532,3 (М+Н+, 100%).
Пример 68
[5-Метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
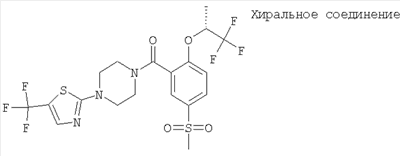
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А16) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в пентане получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 57%). МС (масса/заряд): 532,0 (М+Н+, 100%).
Пример 69
[5-Метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-{4-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
а) 4-(5-Гидроксиметил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
К раствору 179 ммоль 30% водной перекиси водорода в 60 мл воды добавляли 1 н. водный раствор гидроксида натрия, пока значение рН не стало равным 9. Затем реакционную смесь охлаждали до 10°С, и добавляли по каплям 163 ммоль акролеина. Во время этого добавления вводили дополнительное количество 1 н. водного раствора гидроксида натрия, чтобы поддерживать рН реакционной смеси в диапазоне рН от 8 до 9. Смесь перемешивали в течение 30 мин при 0°С, и затем добавляли 40,8 ммоль тиокарбамоил-пиперазин-1-карбоновой кислоты трет-бутилового эфира (полученного из трет-бутил 1-пиперазинкарбоксилата, 1,1′-тиокарбонилдиимидазола и аммиака согласно методике, описанной в J. Med. Chem. 1998, 41, 5037-5054). К полученной суспензии добавляли 25 мл этанола, и данную смесь нагревали при 80°С в течение 30 мин. Полученный раствор разбавляли смесью этилацетат/тетрагидрофуран (1:1), и данную смесь дважды промывали рассолом. Органическую фазу сушили над сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения в виде желтого масла (выход 99%). МС (масса/заряд): 300,3 (M+H+, 100%).
б) 4-(5-Формил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
К раствору 40,0 ммоль 4-(5-гидроксиметил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира в 300 мл дихлорметана добавляли 289 ммоль оксида марганца (IV), и данную смесь нагревали при температуре дефлегмации в течение 3 ч. Затем смесь фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде светло-коричневого кристаллического твердого вещества (выход 40%). МС (масса/заряд): 298,3 (M+H+, 100%).
в) 4-[5-(2,2-Дифтор-винил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
К раствору 6,73 ммоль трифенилфосфина в 13 мл N,N-диметилформамида добавляли 6,73 ммоль дибромдифторметана, и данную смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли 3,36 ммоль 4-(5-формил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира, и затем смесь охлаждали до 0°С. Добавляли маленькими порциями 6,73 ммоль цинковой пыли, и перемешивание продолжали в течение 10 мин при 0°С. Затем смесь оставляли нагреваться до комнатной температуры, и перемешивание продолжали в течение еще 2 ч. Затем реакционную смесь фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 19%). МС (масса/заряд): 332,3 (М+Н+, 10%), 276,0 ([M+2H-tBu]+, 100%).
г) 4-[5-(2,2,2-Трифтор-этил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
К раствору 1,03 ммоль 4-[5-(2,2-дифтор-винил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутилового эфира в 7,5 диметилсульфоксида и 0,3 мл воды добавляли 7,18 ммоль фторида калия, и данную смесь нагревали при 120°С в течение 2 ч. Затем смесь разбавляли этилацетатом и промывали последовательно водой и рассолом. Органическую фазу сушили над сульфатом натрия и концентрировали под вакуумом. Остаток очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде желтого кристаллического твердого вещества (выход 90%). МС (масса/заряд): 352,3 (М+Н+, 100%).
д) 1-[5-(2,2,2-Трифтор-этил)-тиазол-2-ил]-пиперазина гидрохлорид
К раствору 0,91 ммоль 4-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутилового эфира в 30 мл диоксана добавляли по каплям 18,2 ммоль раствора хлористого водорода (4 М в диоксане), и данную смесь перемешивали при 90°С в течение 90 мин. Затем реакционную смесь охлаждали до 0°С и разбавляли диэтиловым эфиром. Получившиеся кристаллы собирали путем фильтрации и промывали диэтиловым эфиром с получением указанного в заголовке соединения в виде светло-коричневого кристаллического твердого вещества (выход 73%). МС (масса/заряд): 252,3 (M+H+, 100%).
е) [5-Метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-{4-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
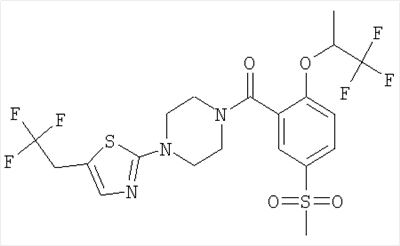
Получали по аналогии с примером 1 (б) из 5-метансульсронил-2-(2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А2) и 1-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазина гидрохлорида. Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 32%). МС (масса/заряд): 546,3 (M+H+, 100%).
Пример 70
[5-Метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-{4-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
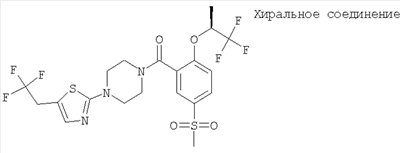
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-((5)-2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А15) и 1-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазина гидрохлорида (Пример 69 (д)). Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 54%). МС (масса/заряд): 546,3 (М+Н+, 100%).
Пример 71
[5-Метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-фенил]-{4-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
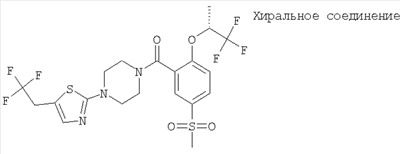
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А16) и 1-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазина гидрохлорида (Пример 69 (д)). Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 41%). МС (масса/заряд): 546,3 (М+Н+, 100%).
Пример 72
(2-Изопропокси-5-метансульфонил-фенил)-{4-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
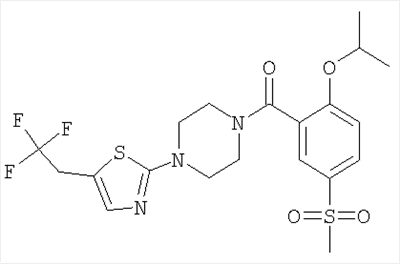
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазина гидрохлорида (Пример 69 (д)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 36%). МС (масса/заряд): 492,4 (M+H+, 100%).
Пример 73
[5-Метансульфонил-2-(2,2,2-трифтор-1,1-диметил-этокси)-фенил]-{4-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-ил}-метанон
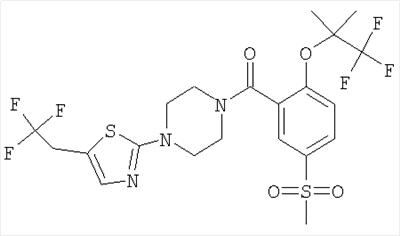
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-1,1-диметил-этокси)-бензойной кислоты (Пример А14) и 1-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазина гидрохлорида (Пример 69 (д)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 27%). МС (масса/заряд): 560,3 (М+Н+, 100%).
Пример 74
[5-Этансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
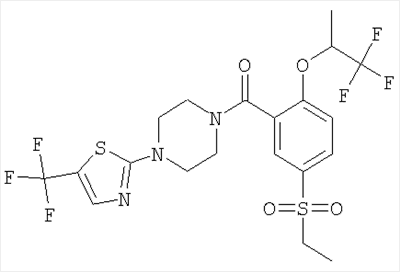
Получали по аналогии с примером 1 (б) из 5-этансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А17) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем обратнофазовой ЖХВД (ацетонитрил/вода), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 82%). МС (масса/заряд): 546,4 (M+H+, 100%).
Пример 75
(5-Этансульфонил-2-изопропокси-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
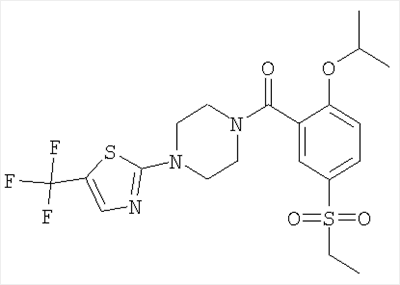
Получали по аналогии с примером 1 (б) из 5-этансульфонил-2-изопропокси-бензойной кислоты (Пример А18) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем обратнофазовой ЖХВД (ацетонитрил/вода), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 21%). МС (масса/заряд): 492,1 (М+Н+, 100%).
Пример 76
[5-Метансульфонил-2-(1-трифторметил-пропокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
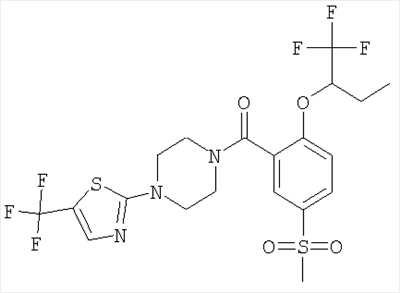
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(1-трифторметил-пропокси)-бензойной кислоты (Пример А19) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем обратнофазовой ЖХВД (ацетонитрил/вода), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 11%). МС (масса/заряд): 546,3 (M+H+, 100%).
Пример 77
(2-((R)-втор-Бутокси)-5-метансульфонил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
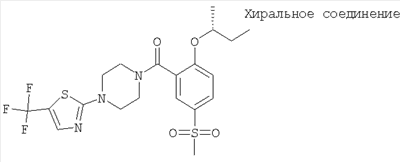
Получали по аналогии с примером 1 (б) из 2-((R)-втор-бутокси)-5-метансульфонил-бензойной кислоты (Пример А20) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем обратнофазовой ЖХВД (ацетонитрил/вода), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 10%). МС (масса/заряд): 492,4 (М+Н+, 100%).
Пример 78
(2-((S)-втор-Бутокси)-5-метансульфонил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
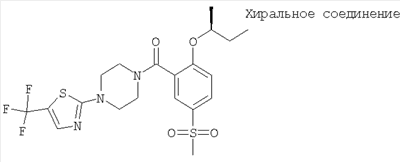
Получали по аналогии с примером 1 (б) из 2-((S)-втор-бутокси)-5-метансульфонил-бензойной кислоты (Пример А21) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем обратнофазовой ЖХВД (ацетонитрил/вода), в результате последующего растирания в диэтиловом эфире получали указанное в заголовке соединение в виде желтоватого кристаллического твердого вещества (выход 13%). МС (масса/заряд): 492,4 (М+Н+, 100%).
Пример 79
(2-Изопропокси-5-метансульфонил-фенил)-[4-(4-метил-5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
а) Рац-(3,3,3-Трифтор-1-метил-пропилсульфанил)-бензол
К раствору 54,9 ммоль 3-иод-1,1,1-трифторбутана в 50 мл N,N-диметилформамида добавляли 49,9 ммоль тиофенола и 74,9 ммоль карбоната калия. Данную смесь обрабатывали ультразвуком при комнатной температуре в течение 90 мин. Затем реакционную смесь разбавляли диэтиловым эфиром и промывали три раза водой. Органическую фазу сушили над сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения в виде бесцветного масла (выход 79%). МС (масса/заряд): 221,3 (M+, 15%).
б) Рац-(4,4,4-Трифтор-бутан-2-сульфонил)-бензол
К раствору 39,5 ммоль рац-(3,3,3-трифтор-1-метил-пропилсульфанил)-бензола в 80 мл дихлорметана добавляли 178 ммоль трифторуксусной кислоты. Затем добавляли маленькими порциями 148 ммоль пероксида мочевины, и затем данную смесь нагревали при температуре дефлегмации в течение 4 ч. Затем реакционную смесь разбавляли дихлорметаном и промывали последовательно водой, 1 н. водным гидроксидом натрия и снова водой. Затем органическую фазу сушили над сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения в виде бесцветного масла (выход 80%). ЭИ-МС (масса/заряд): 252,1 (M+, 3%), 142,1 (PhSO2H+, 100%), 91,1 (H3CCH=CHCF3 +, 20%); 78,2 (PhH+, 74%), 77,2 (Ph+, 45%). +, 20%); 78,2 (PhH+, 74%), 77,2 (Ph+, 45%).
в) Рац-(4,4,4-Трифтор-2-иод-бутан-2-сульфонил)-бензол
К раствору 28,5 ммоль диизопропиламина в 18 мл тетрагидрофурана при -78°С добавляли по каплям раствор 28,5 ммоль н-бутиллития (1,6 М в гексане), и затем данную смесь нагревали до комнатной температуры. Затем полученный раствор добавляли по каплям в течение 50 мин к раствору 19,0 ммоль рац-(4,4,4-трифтор-бутан-2-сульфонил)-бензола в 30 мл тетрагидрофурана при -78°С, и перемешивание продолжали в течение еще 15 мин при -78°С. В конце добавляли по каплям в течение 15 мин раствор 20,9 моль иода в 15 мл тетрагидрофурана, и перемешивание продолжали в течение еще 15 мин при -78°С, и затем реакционной смеси давали нагреваться до -20°С. Реакционную смесь гасили путем добавления 1 М соляной кислоты, и смесь экстрагировали три раза этилацетатом. Объединенные органические фазы промывали последовательно водным раствором тиосульфита натрия и рассолом и затем сушили над сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения в виде желтого масла (выход 87%). ЭИ-МС (масса/заряд): 377,9 (M+, 4%), 237,0 ([М-PhSO2]+, 40%), 142,0 (PhSO2H+, 100%), 125,1 (PhSO+, 93%), 78,2 (PhH+, 40%), 77,2 (Ph+, 31%).
г) ((Е)-4,4,4-Трифтор-бут-2-ен-2-сульфонил)-бензол
К раствору 14,0 ммоль рац-(4,4,4-трифтор-2-иод-бутан-2-сульфонил)-бензола в 25 мл тетрагидрофурана и 2,5 мл воды добавляли 42,1 ммоль триэтиламина и 42,1 ммоль карбоната калия. Данную месь нагревали при 70°С в течение 6 ч. Затем реакционную смесь разбавляли этилацетатом и промывали последовательно 1 н. соляной кислотой и рассолом. Органическую фазу сушили над сульфатом натрия и концентрировали под вакуумом. Остаток очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде желтого масла (выход 72%). ЭИ-МС (масса/заряд): 250,1 (М+, 15%), 186,1 ([M-SO2 +, 38%), 125,0 (PhSO+, 100%), 77,1 (Ph+, 38%). +, 38%), 125,0 (PhSO+, 100%), 77,1 (Ph+, 38%).
д) Рац-2-Бензолсульфонил-2-метил-3-трифторметил-этиленоксид
К раствору 15,2 ммоль н-бутиллития (1,6 М в гексане), растворенному в 20 мл тетрагидрофурана, при -78°С добавляли по каплям раствор 15,2 ммоль трет-бутилгидропероксида (5,5 М в нонане), и данную смесь перемешивали при -78°С в течение 10 мин, затем нагревали до -50°С и снова охлаждали до -78°С. Затем добавляли по каплям раствор 10,1 ммоль ((Е)-4,4,4-трифтор-бут-2-ен-2-сульфонил)-бензола в 6 мл тетрагидрофурана, и перемешивание продолжали в течение еще 30 мин при -78°С, и затем реакционной смеси давали нагреваться до комнатной температуры. Реакционную смесь разбавляли этилацетатом и промывали последовательно 1 М соляной кислой и рассолом. Затем органическую фазу сушили над сульфатом натрия и концентрировали под вакуумом. Остаток очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде бесцветного масла (выход 49%). ЭИ-МС (масса/заряд): 251,1 ([М-СН3]+, 6%), 250,1 ([M-O]+, 20%), 126,1 (PhSOH+, 61%), 125,0 ([M-PhSO2]+, 100%), 78,2 (PhH+, 21%), 77,2 (Ph+, 44%), 43,3 (СН3СНСН3 +, 73%). +, 73%).
е) 4-(4-Метил-5-трифторметил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Смесь 4,92 ммоль рац-2-бензолсульфонил-2-метил-3-трифторметил-этиленоксида и 5,41 ммоль 4-тиокарбамоил-пиперазин-1-карбоновой кислоты трет-бутилового эфира (полученного из трет-бутил 1-пиперазинкарбоксилата, 1,1′-тиокарбонилдиимидазола и аммиака согласно методике, описанной в J. Med. Chem. 1998, 41, 5037-5054) в 15 мл N,N-диметилформамида нагревали при 100°С в течение 4,5 ч. Затем реакционную смесь концентрировали под вакуумом, и остаток очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде желтого кристаллического твердого вещества (выход 30%). МС (масса/заряд): 352,3 (M+H+, 100%).
ж) 1-(4-Метил-5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорид
К раствору 1,45 ммоль 4-(4-метил-5-трифторметил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира в 10 мл диоксана добавляли по каплям раствор 21,8 ммоль хлористого водорода (4 М в диоксане), и данную смесь перемешивали при 90°С в течение 2 ч. Затем реакционную смесь охлаждали до 0°С и разбавляли диэтиловым эфиром. Получившиеся кристаллы собирали путем фильтрации и промывали диэтиловым эфиром с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 68%). МС (масса/заряд): 252,3 (M+H+, 100%).
з) (2-Изопропокси-5-метансульфонил-фенил)-[4-(4-метил-5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
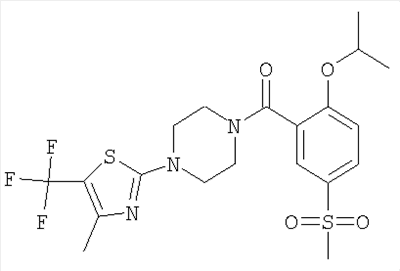
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-(4-метил-5-трифторметил-20 тиазол-2-ил)-пиперазина гидрохлорида. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белой пены (выход 52%). МС (масса/заряд): 492,0 (М+Н+а, 100%).
Пример 80
25 [5-Метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(4-метил-5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
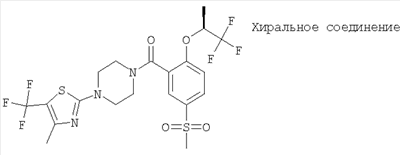
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А15) и 1-(4-метил-5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 79 (ж)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 56%). МС (масса/заряд): 546,0 (M+H+, 100%).
Пример 81
[5-Метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(4-метил-5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
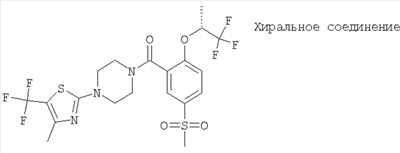
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А16) и 1-(4-метил-5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 79 (ж)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 57%). МС (масса/заряд): 546,0 (М+Н+, 100%).
Пример 82
1-{2-[4-(2-Изопропокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-ил}-пропан-1-он
а) 4-(Диметиламинометилен-тиокарбамоил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Смесь 122 ммоль N,N-диметилформамид-диметилацеталя и 6,11 ммоль 4-тиокарбамоил-пиперазин-1-карбоновой кислоты трет-бутилового эфира (полученного из трет-бутил 1-пиперазинкарбоксилата, 1,1′-тиокарбонилдиимидазола и аммиака согласно методике, описанной в J. Med. Chem. 1998, 41, 5037-5054) нагревали при 110°С в течение 3 ч. Затем реакционную смесь концентрировали под вакуумом, и остаток ресуспендировали в смеси этилацетат/тетрагидрофуран (1:1) и промывали рассолом. Органическую фазу сушили над сульфатом натрия и концентрировали под вакуумом с получением указанного в заголовке соединения в виде светло-желтого кристаллического твердого вещества (выход 95%). МС (масса/заряд): 301,4 (М+H+, 100%).
б) 4-(5-Пропионил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
К раствору 0,83 ммоль 4-(диметиламинометилен-тиокарбамоил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира в 6 мл этанола добавляли 2,50 ммоль триэтиламина и 1,00 ммоль 1-бром-2-бутанона. Данную смесь нагревали при 90°С в течение 16 ч. Затем реакционную смесь концентрировали под вакуумом, и остаток очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 72%). МС (масса/заряд): 326,1 (М+H+, 100%).
в) 1-(2-Пиперазин-1-ил-тиазол-5-ил)-пропан-1-она гидрохлорид
К раствору 0,58 ммоль 4-(5-пропионил-тиазол-2-ил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира в 6 мл диоксана добавляли по каплям раствор 8,76 ммоль хлористого водорода (4 М в диоксане), и данную смесь перемешивали при 90°С в течение 90 мин. Затем реакционную смесь охлаждали до 0°С и разбавляли диэтиловым эфиром. Получившиеся кристаллы собирали путем фильтрации и промывали диэтиловым эфиром с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 99%). МС (масса/заряд): 226,4 (М+Н+, 100%).
г) 1-{2-[4-(2-Изопропокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-ил}-пропан-1-он
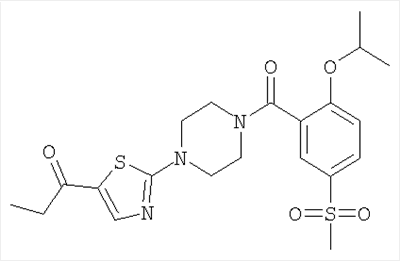
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 1-(2-пиперазин-1-ил-тиазол-5-ил)-пропан-1-она гидрохлорида. Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде светло-коричневого кристаллического твердого вещества (выход 24%), МС (масса/заряд): 466,0 (M+H+, 100%).
Пример 83
1-{2-[4-(2-Изопропокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-ил}-2,2-диметил-пропан-1-он
а) 4-[5-(2,2-Диметил-пропионил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутиловый эфир
Получали по аналогии с примером 82 (б) из 4-(диметиламинометилен-тиокарбамоил)-пиперазин-1-карбоновой кислоты трет-бутилового эфира (Пример 82 (а)) и 1-бром-пинаколина. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 87%). МС (масса/заряд): 354,3 (М+Н+, 100%).
б) 2,2-Диметил-1-(2-пиперазин-1-ил-тиазол-5-ил)-пропан-1-она гидрохлорид
Получали по аналогии с примером 82 (в) из 4-[5-(2,2-диметил-пропионил)-тиазол-2-ил]-пиперазин-1-карбоновой кислоты трет-бутилового эфира. Неочищенное вещество очищали путем перекристаллизации из диэтилового эфира с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества (выход 93%). МС (масса/заряд): 254,4 (М+Н+, 100%).
в) 1-{2-[4-(2-Изопропокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-ил}-2,2-диметил-пропан-1-он
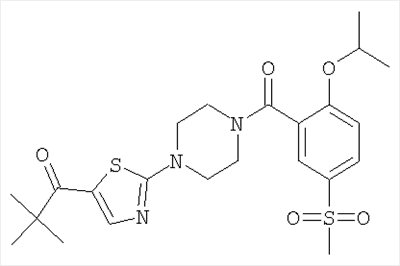
Получали по аналогии с примером 1 (б) из 2-изопропокси-5-метансульфонил-бензойной кислоты (Пример А1) и 2,2-диметил-1-(2-пиперазин-1-ил-тиазол-5-ил)-пропан-1-она гидрохлорида. Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде светло-коричневого кристаллического твердого вещества (выход 28%). МС (масса/заряд): 494,1 (М+Н+, 100%).
Пример 84
(2-Изопропилсульфанил-5-метансульфонил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
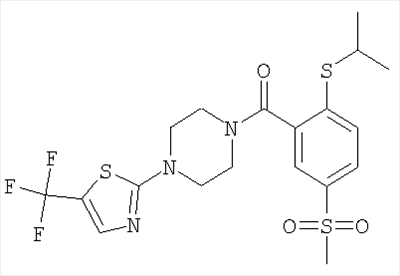
Получали по аналогии с примером 1 (б) из 2-изопропилсульфанил-5-метансульфонил-бензойной кислоты (Пример А22) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан), в результате последующего растирания в пентане получали указанное в заголовке соединение в виде белой пены (выход 50%). МС (масса/заряд): 494,4 (M+H+, 100%).
Пример 85
(2-Этилсульфанил-5-метансульфонил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
Получали по аналогии с примером 1 (б) из 2-этилсульфанил-5-метансульфонил-бензойной кислоты (Пример А23) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белой пены (выход 41%). МС (масса/заряд): 479,8 (М+Н+, 100%).
Пример 86
[5-Метансульфонил-2-(2,2,2-трифтор-этилсульфанил)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
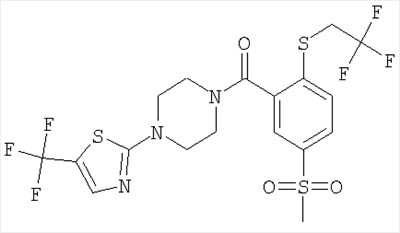
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,2-трифтор-этилсульфанил)-бензойной кислоты (Пример А24) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде светло-желтого твердого вещества (выход 49%). МС (масса/заряд): 534,0 (M+H+, 100%).
Пример 87
(2-Изобутилсульфанил-5-метансульфонил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
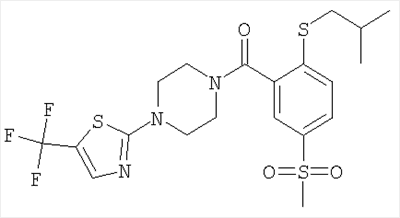
Получали по аналогии с примером 1 (б) из 2-изобутилсульфанил-5-метансульфонил-бензойной кислоты (Пример А25) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде светло-желтого твердого вещества (выход 88%). МС (масса/заряд): 508,3 (M+H+, 100%).
Пример 88
(5-Метансульфонил-2-метилсульфанил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
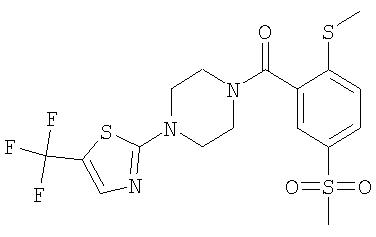
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-метилсульфанил-бензойной кислоты (Пример А26) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (выход 18%). МС (масса/заряд): 466,0 (М+Н+, 100%).
Пример 89
(2-Морфолин-4-ил-5-нитро-фенил)-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон
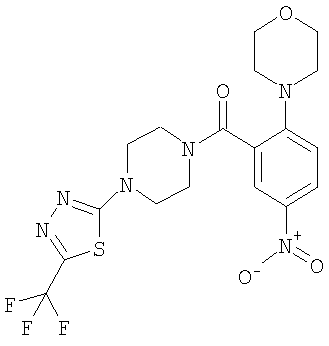
Получали по аналогии с примером 1 (б) из 2-морфолин-4-ил-5-нитро-бензойной кислоты (Пример А27) и 1-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазина трифторацетата (Пример 62 (б)). Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде коричневого твердого вещества (выход 34%). МС (масса/заряд): 473,4 (M+H+, 100%).
Пример 90
(2-Изопропилсульфанил-5-метансульфонил-фенил)-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон
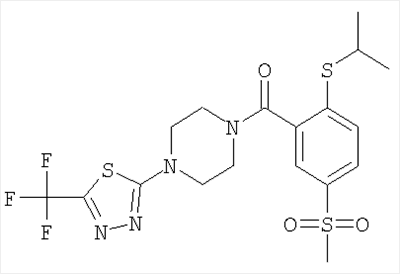
Получали по аналогии с примером 1 (б) из 2-изопропилсульфанил-5-метансульфонил-бензойной кислоты (Пример А22) и 1-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазина трифторацетата (Пример 62 (б)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого твердого вещества (выход 34%). МС (масса/заряд): 495,0 (М+Н+, 100%).
Пример 91
(2-Изопропилсульфанил-5-метансульфонил-фенил)-[4-(3-фенил-[1,2,4]тиадиазол-5-ил)-пиперазин-1-ил]-метанон
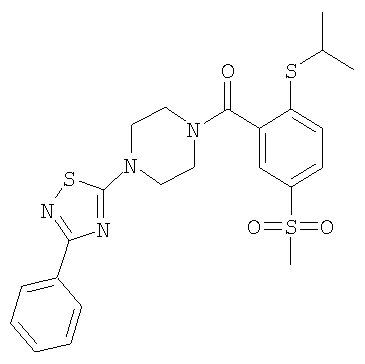
Получали по аналогии с примером 1 (б) из 2-изопропилсульфанил-5-метансульфонил-бензойной кислоты (Пример А22) и 3-фенил-5-пиперазино-1,2,4-тиадиазола. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде желтоватого твердого вещества (выход 83%). МС (масса/заряд): 503,1 (M+H+, 100%).
Пример 92
[5-Метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(3-фенил-[1,2,4]тиадиазол-5-ил)-пиперазин-1-ил]-метанон
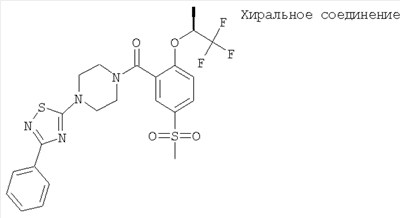
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А15) и 3-фенил-5-пиперазино-1,2,4-тиадиазола. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (выход 60%). МС (масса/заряд): 541,3 (М+Н+, 100%).
Пример 93
[5-Метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон
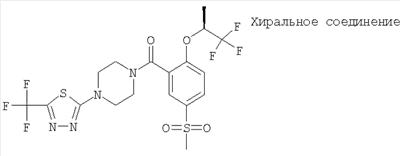
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-бензойной кислоты (Пример А15) и 1-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазина трифторацетата (Пример 62 (б)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде желтоватого твердого вещества (выход 52%). МС (масса/заряд): 533,0 (М+Н+, 100%).
Пример 94
4-Изопропокси-3-[4-(3-фенил-[1,2,4]тиадиазол-5-ил)-пиперазин-1-карбонил]-бензонитрил
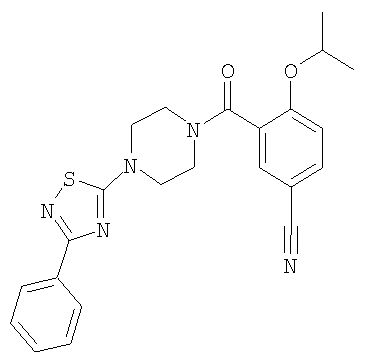
Получали по аналогии с примером 1 (б) из 5-циано-2-изопропокси-бензойной кислоты (Пример А28) и 3-фенил-5-пиперазино-1,2,4-тиадиазола. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого твердого вещества (выход 74%). МС (масса/заряд): 434,1 (M+H+, 100%).
Пример 95
4-Изопропокси-3-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-карбонил]-бензонитрил
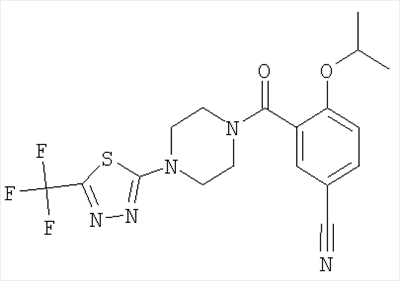
Получали по аналогии с примером 1 (б) из 5-циано-2-изопропокси-бензойной кислоты (Пример А28) и 1-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазина трифторацетата (Пример 62 (б)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого твердого вещества (выход 80%). МС (масса/заряд): 426,0 (М+Н+, 100%).
Пример 96
2-[4-(5-Циано-2-изопропокси-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил
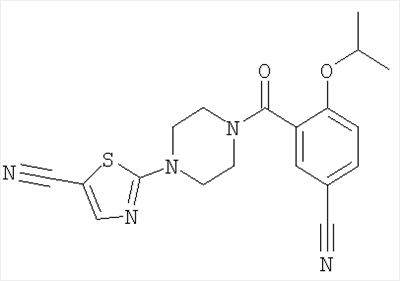
Получали по аналогии с примером 1 (б) из 5-циано-2-изопропокси-бензойной кислоты (Пример А28) и 2-пиперазин-1-ил-тиазол-5-карбонитрила (Пример 6 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого твердого вещества (выход 70%). МС (масса/заряд): 382,3 (M+H+, 100%).
Пример 97
2-[4-(2-Морфолин-4-ил-5-нитро-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил
Получали по аналогии с примером 1 (б) из 2-морфолин-4-ил-5-нитро-бензойной кислоты (Пример А27) и 2-пиперазин-1-ил-тиазол-5-карбонитрила (Пример 6 (а)). Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде желтого твердого вещества (выход 24%). МС (масса/заряд): 429,5 (М+Н+, 100%).
Пример 98
(2-Морфолин-4-ил-5-нитро-фенил)-[4-(3-фенил-[1,2,4]тиадиазол-5-ил)-пиперазин-1-ил]-метанон
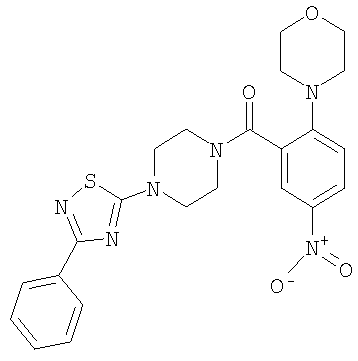
Получали по аналогии с примером 1 (б) из 2-морфолин-4-ил-5-нитро-бензойной кислоты (Пример А27) и 3-фенил-5-пиперазино-1,2,4-тиадиазола. Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде желтого твердого вещества (выход 18%). МС (масса/заряд): 481,0 (М+Н+, 100%).
Пример 99
3-[4-(5-Циано-тиазол-2-ил)-пиперазин-1-карбонил]-4-циклопентилокси-N-метил-бензолсульфонамид
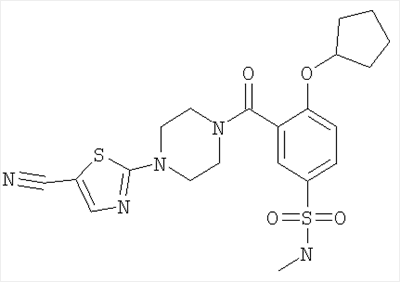
Получали по аналогии с примером 1 (б) из 2-циклопентилокси-5-метилсульфамоил-бензойной кислоты (Пример А29) и 1 -(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде белого твердого вещества (выход 48%). МС (масса/заряд): 476,3 (M+H+, 100%).
Пример 100
4-Циклопентилокси-N-метил-3-[4-(3-фенил-[1,2,4]тиадиазол-5-ил)-пиперазин-1-карбонил]-бензолсульфонамид
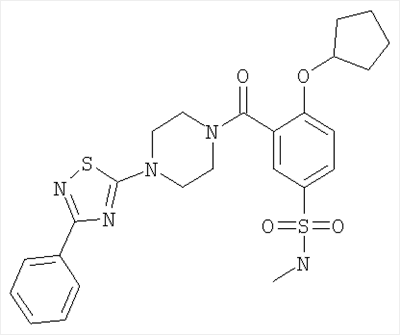
Получали по аналогии с примером 1 (б) из 2-циклопентилокси-5-метилсульфамоил-бензойной кислоты (Пример А29) и 3-фенил-5-пиперазино-1,2,4-тиадиазола. Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде желтоватого твердого вещества (выход 72%). МС (масса/заряд): 528,5 (М+Н+, 100%).
Пример 101
4-Циклопентилокси-N-метил-3-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-карбонил]-бензолсульфонамид
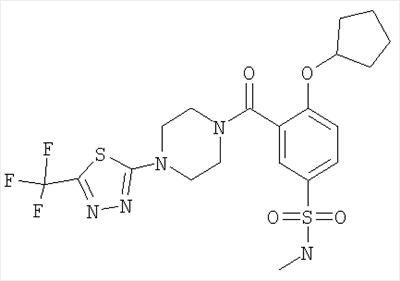
Получали по аналогии с примером 1 (б) из 2-циклопентилокси-5-метилсульфамоил-бензойной кислоты (Пример А29) и 1-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазина трифторацетата (Пример 62 (б)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде белого твердого вещества (выход 46%). МС (масса/заряд): 520,3 (M+H+, 100%).
Пример 102
[5-Метансульфонил-2-(2,2,3,3,3-пентафтор-пропокси)-фенил]-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон
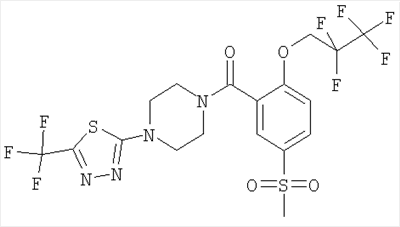
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,3,3,3-пентафтор-пропокси)-бензойной кислоты (Пример А30) и 1 -(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазина трифторацетата (Пример 62 (б)). Неочищенное вещество очищали путем хроматографии (SiO2, метанол/дихлорметан) с получением указанного в заголовке соединения в виде желтоватого твердого вещества (выход 56%). МС (масса/заряд): 569,3 (М+Н+, 100%).
Пример 103
[5-Метансульфонил-2-(2,2,3,3,3-пентафтор-пропокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон
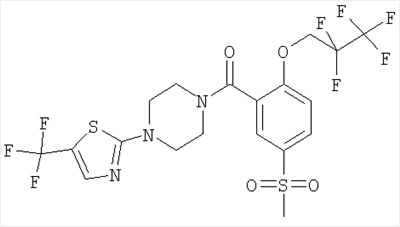
Получали по аналогии с примером 1 (б) из 5-метансульфонил-2-(2,2,3,3,3-пентафтор-пропокси)-бензойной кислоты (Пример А30) и 1-(5-трифторметил-тиазол-2-ил)-пиперазина гидрохлорида (Пример 58 (в)). Неочищенное вещество очищали путем хроматографии (SiO2, этилацетат/гептан) с получением указанного в заголовке соединения в виде коричневого твердого вещества (выход 68%). МС (масса/заряд): 568,2 (М+Н+, 100%).
Формула изобретения
1. Соединения общей формулы
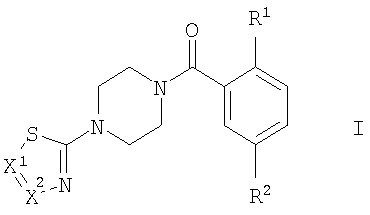
где R1 представляет собой -OR1 , -SR1 , -SR1 или морфолинил; или морфолинил;
R1 представляет собой низший алкил, низший алкил, замещенный галогеном, или представляет собой -(СН2)n-низший циклоалкил; представляет собой низший алкил, низший алкил, замещенный галогеном, или представляет собой -(СН2)n-низший циклоалкил;
R2 представляет собой -S(O)2-низший алкил, -S(O)2NH-низший алкил, NO2 или CN;
X1 представляет собой CR3 или N;
X2 представляет собой CR3 или N; или N;
R3/R3 независимо друг от друга представляют собой водород, галоген, низший алкил, CN, NO2, -S(O)2-фенил, -S(O)2-низший алкил, -S(O)2-пиридин-2, 3 или 4-ил, фенил, возможно замещенный одним или двумя заместителями, выбранными из группы, состоящей из NO2 или галогена, или представляют собой низший алкил, замещенный галогеном, или представляют собой -С(O)-низший алкил; независимо друг от друга представляют собой водород, галоген, низший алкил, CN, NO2, -S(O)2-фенил, -S(O)2-низший алкил, -S(O)2-пиридин-2, 3 или 4-ил, фенил, возможно замещенный одним или двумя заместителями, выбранными из группы, состоящей из NO2 или галогена, или представляют собой низший алкил, замещенный галогеном, или представляют собой -С(O)-низший алкил;
n имеет значение 0, 1 или 2;
и их фармацевтически приемлемые соли присоединения кислот.
2. Соединения по п.1 формулы IA
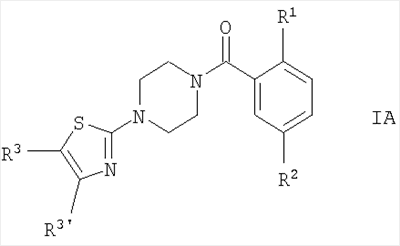
где R1 представляет собой -OR1 , -SR1 , -SR1 или морфолинил; или морфолинил;
R1 представляет собой низший алкил, низший алкил, замещенный галогеном, или представляет собой -(СН2)n-низший циклоалкил; представляет собой низший алкил, низший алкил, замещенный галогеном, или представляет собой -(СН2)n-низший циклоалкил;
R2 представляет собой -S(O)2-низший алкил, -S(O)2NH-низший алкил, NO2 или CN;
R3/R3 независимо друг от друга представляют собой водород, галоген, низший алкил, CN, NO2, -S(O)2-фенил, -S(O)2-низший алкил, -S(O)2-пиридин-2, 3 или 4-ил, фенил, возможно замещенный одним или двумя заместителями, выбранными из группы, состоящей из NO2 или галогена, или представляют собой низший алкил, замещенный галогеном, или представляют собой -С(O)-низший алкил; независимо друг от друга представляют собой водород, галоген, низший алкил, CN, NO2, -S(O)2-фенил, -S(O)2-низший алкил, -S(O)2-пиридин-2, 3 или 4-ил, фенил, возможно замещенный одним или двумя заместителями, выбранными из группы, состоящей из NO2 или галогена, или представляют собой низший алкил, замещенный галогеном, или представляют собой -С(O)-низший алкил;
n имеет значение 0, 1 или 2;
и их фармацевтически приемлемые соли присоединения кислот.
3. Соединения по п.1 формулы IБ
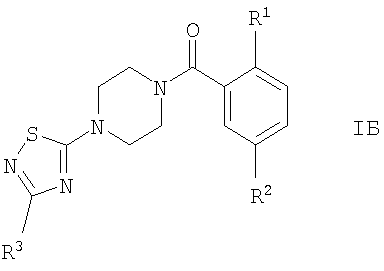
где R1 представляет собой -OR1 , -SR1 , -SR1 или морфолинил; или морфолинил;
R1 представляет собой низший алкил, низший алкил, замещенный галогеном, или представляет собой -(СН2)n-низший циклоалкил; представляет собой низший алкил, низший алкил, замещенный галогеном, или представляет собой -(СН2)n-низший циклоалкил;
R2 представляет собой -S(O)2-низший алкил, -S(O)2NH-низший алкил, NO2 или CN;
R3 представляет собой водород, галоген, низший алкил, CN, NO2, -S(O)2-фенил, -S(O)2-низший алкил, -S(O)2-пиридин-2, 3 или 4-ил, фенил, возможно замещенный одним или двумя заместителями, выбранными из группы, состоящей из NO2 или галогена, или представляет собой низший алкил, замещенный галогеном, или представляет собой -С(O)-низший алкил;
n имеет значение 0, 1 или 2;
и их фармацевтически приемлемые соли присоединения кислот.
4. Соединения по п.1 формулы IB
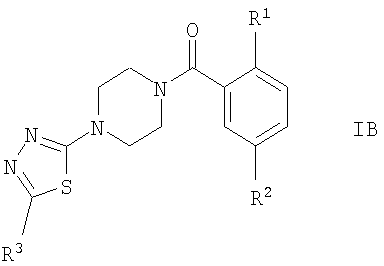
где R1 представляет собой -OR1 , -SR1 , -SR1 или морфолинил; или морфолинил;
R1 представляет собой низший алкил, низший алкил, замещенный галогеном, или представляет собой -(CH2)n-низший циклоалкил; представляет собой низший алкил, низший алкил, замещенный галогеном, или представляет собой -(CH2)n-низший циклоалкил;
R2 представляет собой -S(O)2-низший алкил, -S(O)2NH-низший алкил, NO2 или CN;
R3 представляет собой водород, галоген, низший алкил, CN, NO2, -S(O)2-фенил, -S(O)2-низший алкил, -S(O)2-пиридин-2, 3 или 4-ил, фенил, возможно замещенный одним или двумя заместителями, выбранными из группы, состоящей из NO2 или галогена, или представляет собой низший алкил, замещенный галогеном, или представляет собой -С(O)-низший алкил;
n имеет значение 0, 1 или 2;
и их фармацевтически приемлемые соли присоединения кислот.
5. Соединения формулы IA по п.2, где R1 представляет собой OR1 и R1 и R1 представляет собой низший алкил. представляет собой низший алкил.
6. Соединения формулы IA по п.5, которые представляют собой
[4-(5-бензолсульфонил-тиазол-2-ил)-пиперазин-1-ил]-(2-изопропокси-5-метансульфонил-фенил)-метанон,
2-[4-(2-изобутокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил,
2-{4-[2-(2,2-диметил-пропокси)-5-метансульфонил-бензоил]-пиперазин-1-ил}-тиазол-5-карбонитрил,
[4-(5-бензолсульфонил-тиазол-2-ил)-пиперазин-1-ил]-[2-(2,2-диметил-пропокси)-5-метансульфонил-фенил]-метанон,
[4-(5-бензолсульфонил-тиазол-2-ил)-пиперазин-1-ил]-(2-изобутокси-5-метансульфонил-фенил)-метанон,
{4-[5-(бутан-1-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-[2-(2,2-диметил-пропокси)-5-метансульфонил-фенил]-метанон,
(2-((R)-втор-бутокси)-5-метансульфонил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
(2-((S)-втор-бутокси)-5-метансульфонил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон или
(2-изопропокси-5-метансульфонил-фенил)-[4-(4-метил-5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон.
7. Соединения формулы IA по п.2, где R1 представляет собой OR1 и R1 и R1 представляет собой низший алкил, замещенный галогеном. представляет собой низший алкил, замещенный галогеном.
8. Соединения формулы IA по п.7, которые представляют собой
2-{4-[5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-бензоил]-пиперазин-1-ил}-тиазол-5-карбонитрил,
{4-[5-(бутан-1-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-[5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-метанон,
[5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-метил-4-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
[5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
[5-метансульфонил-2-(2,2,2-трифтор-1,1-диметил-этокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
[5-метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
[5-метансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-{4-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-ил}-метанон,
[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-{4-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-ил}-метанон,
[5-метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-фенил]-{4-[5-(2,2,2-трифтор-этил)-тиазол-2-ил]-пиперазин-1-ил}-метанон,
[5-этансульфонил-2-(2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(4-метил-5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон,
[5-метансульфонил-2-((R)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(4-метил-5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон или
[5-метансульфонил-2-(2,2,3,3,3-пентафтор-пропокси)-фенил]-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон.
9. Соединения формулы IA по п.2, где R1 представляет собой OR1 и R1 и R1 представляет -(CH2)n-низший циклоалкил. представляет -(CH2)n-низший циклоалкил.
10. Соединения формулы IA по п.9, которые представляют собой
2-[4-(2-циклобутилметокси-5-метансульфонил-бензоил)-пиперазин-1-ил]-тиазол-5-карбонитрил,
[4-(5-бензолсульфонил-тиазол-2-ил)-пиперазин-1-ил]-(2-циклопентилокси-5-метансульфонил-фенил)-метанон,
{4-[5-(бутан-1-сульфонил)-тиазол-2-ил]-пиперазин-1-ил}-(2-циклопентилокси-5-метансульфонил-фенил)-метанон,
3-[4-(5-циано-тиазол-2-ил)-пиперазин-1-карбонил]-4-циклопентилокси-N-метил-бензолсульфонамид или
4-циклопентилокси-N-метил-3-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-карбонил]-бензолсульфонамид.
11. Соединения формулы IA по п.2, где R1 представляет собой SR1 . .
12. Соединение формулы IA по п.11, которое представляет собой
(2-изопропилсульфанил-5-метансульфонил-фенил)-[4-(5-трифторметил-тиазол-2-ил)-пиперазин-1-ил]-метанон.
13. Соединение формулы IБ по п.3, где R1 представляет собой OR1 и R1 и R1 представляет собой низший алкил. представляет собой низший алкил.
14. Соединение формулы IБ по п.13, которое представляет собой (2-изопропокси-5-метансульфонил-фенил)-[4-(3-фенил-[1,2,4]тиадиазол-5-ил)-пиперазин-1-ил]-метанон.
15. Соединение формулы IБ по п.3, где R1 представляет собой OR1 и R1 и R1 представляет собой (CH2)n-низший циклоалкил. представляет собой (CH2)n-низший циклоалкил.
16. Соединение формулы IБ по п.15, которое представляет собой
4-циклопентилокси-N-метил-3-[4-(3-фенил-[1,2,4]тиадиазол-5-ил)-пиперазин-1-карбонил]-бензолсульфонамид.
17. Соединения формулы IB по п.4, где R1 представляет собой OR1 . .
18. Соединения формулы IB по п.17, которые представляют собой
(2-изопропокси-5-метансульфонил-фенил)-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон,
(2-циклопропилметокси-5-метансульфонил-фенил)-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон,
(2-изобутокси-5-метансульфонил-фенил)-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон или
[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон.
19. Соединение по п.4, которое представляет собой
(5-метансульфонил-2-морфолин-4-ил-фенил)-[4-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-пиперазин-1-ил]-метанон.
20. Лекарственное средство, обладающее свойствами ингибиторов глицинового переносчика 1 (GlyT-1), содержащее одно или более чем одно соединение по любому из пп.1-19 и фармацевтически подходящие эксципиенты.
|
|