Патент на изобретение №2396267
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) 4-ЗАМЕЩЕННЫЕ-3-(1-АЛКИЛ-2-ХЛОР-1Н-ИНДОЛ-3-ИЛ)ФУРАН-2,5-ДИОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ДЛЯ ФОТОХИМИЧЕСКОГО ГЕНЕРИРОВАНИЯ СТАБИЛЬНЫХ ФЛУОРЕСЦИРУЮЩИХ СОЕДИНЕНИЙ И (4,5-ЗАМЕЩЕННЫЕ-6-АЛКИЛ-1Н-ФУРО[3,4-c]КАРБАЗОЛ-1,3(6Н)-ДИОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФЛУОРОФОРОВ
(57) Реферат:
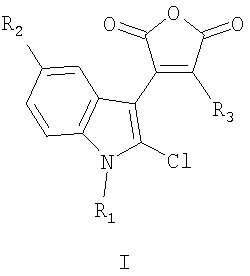
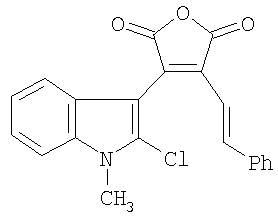
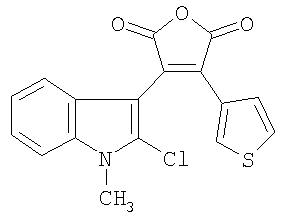
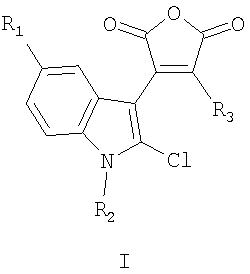
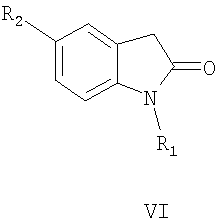
Изобретение относится к новым соединениям, а именно к 4-замещенным-3-(1-алкил-2-хлор-1Н-индол-3-ил)фуран-2,5-дионам общей формулы I
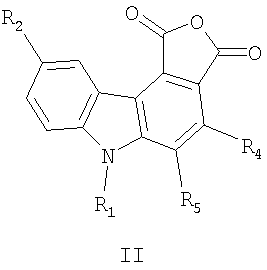
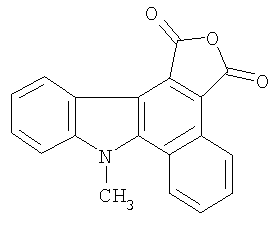
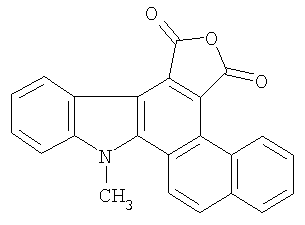
где R1=H, C1-С6 алкил; R2=H, C1-С6 алкил, C1-С6 алкокси; R3 = фенил, нафтил, 2-фенил-1-этенил, тиенил, фурил, пирролил, бензотиофенил, бензофуранил, индолил, их способу получения и применению в качестве соединений, способных к фотохимическому генерированию стабильных флуорофоров формулы II, что может быть использовано, например, в системах хранения информации, в частности, в качестве светочувствительной компоненты материала для трехмерной записи и хранения информации. Изобретение относится также к новым 4,5-замещенным-6-алкил-1Н-фуро[3,4-с]карбазол-1,3(6Н)-дионам общей формулы II где R1=H, C1-С6 алкил; R2=H, C1-С6 алкил, C1-С6 алкокси; R4=H, R5 = фенил, R4,R5 = бензо, нафто, тиено, фуро, пирроло, бензотиено, бензофуро, индоло, способу их получения и применению в качестве флуорофоров. 6 н. и 8 з.п. ф-лы, 2 табл.
Изобретение относится к новым соединениям, а именно к 4-замещенным-3-(1-алкил-2-хлор-1Н-индол-3-ил)фуран-2,5-дионам общей формулы I
где R1=H, C1-С6 алкил; R2=Н, C1-С6 алкил, C1-С6 алкокси; R3=фенил, нафтил, фенилэтенил, тиенил, фурил, пирролил, бензотиофенил, бензофуранил, индолил. Соединения I при облучении видимым светом генерируют стабильные флуоресцирующие вещества (4,5-замещенные-6-алкил-1Н-фуро[3,4-с]карбазол-1,3(6Н)-дионы (II). Изобретение относится также к новому способу получения 4-замещенных 3-(1-алкил-2-хлор-1Н-индол-3-ил)фуран-2,5-дионов общей формулы I. Изобретение относится также к применению 4-замещенных-3-(1-алкил-2-хлор-1Н-индол-3-ил)фуран-2,5-дионов выше приведенной общей формулы I в качестве соединений, способных к фотохимическому генерированию стабильных флуорофоров, что может быть использовано, например, в системах хранения информации, в частности, в качестве светочувствительной компоненты материала для трехмерной записи и хранения информации. Изобретение относится также к новым соединениям, а именно к (4,5-замещенным-6-алкил-1Н-фуро[3,4-с]карбазол-1,3(6Н)-дионам общей формулы II
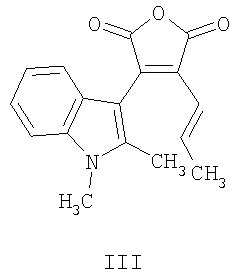
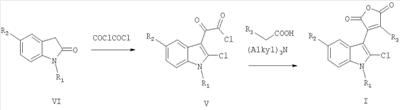
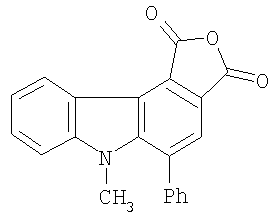
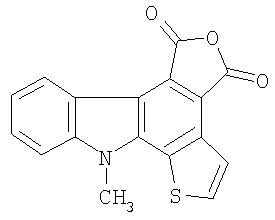
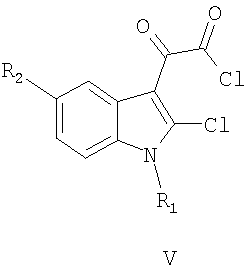
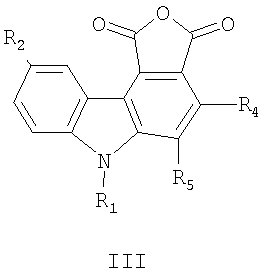
где R1=Н, С1-С6 алкил; R2=Н, С1-С6 алкил, C1-С6 алкокси; R4=Н, R5 = фенил, R4,R5 = бензо, нафто, тиено, фуро, пирроло, бензотиено, бензофуро, индоло. Изобретение относится также к новому способу получения (4,5-замещенных-6-алкил-1Н-фуро[3,4-с]карбазол-1,3(6Н)-дионов общей формулы II. Изобретение относится также к применению (4,5-замещенных-6-алкил-1Н-фуро[3,4-с]карбазол-1,3(6Н)-дионов выше приведенной общей формулы II, в качестве соединений, обладающих флуоресценцией. Наиболее близким по структуре к соединениям общей формулы I является (1,2-диметил-1Н-индол-3-ил)-4-[(1Е)-проп-1-енил]фуран-2,5-дион формулы III
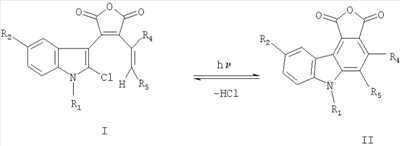
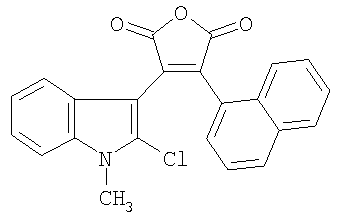
Соединение III проявляет фотохромные свойства (полоса поглощения исходной формы Наиболее близким по структуре к соединениям общей формулы II является 4-(2-хлорфенил)-8-(4-гидроксибутил)-9-метокси-6-метил-1Н-фуро[3,4-с]карбазол-1,3(6Н)-дион, формулы IV, полученный гидролизом 4-(2-хлорфенил)-8-(4-гидроксибутил)-9-метокси-6-метилпирроло[3,4-с]карбазол-1,3(2Н.6Н)-диона, который исследовали как ингибитор киназы /Jeff В. Smaill, Но Н. Lee, Brian D. Palmer, Andrew M. Thompson, Christopher J. Squire, Edward N. Baker, R. John Booth, Alan Kraker, Ken Hook and William A. Dennya, Bioorganic & Medicinal Chemistry Letters 18 (2008) 929-933/. Техническим результатом изобретения являются новые соединения в ряду 3-(1Н-индол-3-ил)фуран-2,5-дионов, проявляющие новые для данного ряда соединений свойства генерировать при действии света стабильные флуоресцирующие вещества. Техническим результатом изобретения являются также новые соединения в ряду 1Н-фуро[3,4-с]карбазол-1,3(6Н)-дионов, проявляющие новые для данного ряда соединений флуоресцентные свойства. Технический результат достигается соединениями общей формулы I, их способом получения и их применением в качестве веществ, образующих при действии света стабильные флуоресцирующие соединения II. Технический результат достигается также соединениями общей формулы II, их способом получения и их применением в качестве флуоресцирующих веществ. Изобретение удовлетворяет критерию изобретательского уровня, так предлагаемые новые соединения проявляют новые свойства в ряду структурных аналогов. Способ получения соединений I заключается во взаимодействии замещенных уксусных кислот общей формулы R3CH2COOH в присутствии триалкиламина с (2-хлор-1Н-индол-3-ил)(оксо)ацетилхлоридом общей формулы V, который получают обработкой оксалилхлоридом замещенного оксииндола общей формулы VI, где R1=Н, C1-С6 алкил; R2=Н, C1-С6 алкил, C1-С6 алкокси; R3 = фенил, нафтил, фенилэтенил, тиенил, фурил, пирролил, бензотиофенил, бензофуранил, индолил. Способ получения соединений II заключается в циклизации под действием видимого света 4-замещенных-3-(1-алкил-2-хлор-1Н-индол-3-ил)фуран-2,5-дионов общей формулы I, где R имеют вышеприведенные значения, сопровождающейся выделением хлористого водорода. Ниже приведены примеры получения соединений I и II. Пример 1. 3-(2-Хлор-1-метил-1Н-индол-3-ил)-4-фенил-фуран-2,5-дион (R1=CH3, R2=H, R3 = фенил) (Ia). К раствору 0,73 г (5 ммоль) 1-метилоксиндола в 10 мл сухого 1,2-дихлорэтана прикалывают 0,86 мл (10 ммоль) оксалилхлорида и оставляют при комнатной температуре на 2 часа. Затем растворитель отгоняют и к сухому остатку приливают раствор 0,5 мл (5 ммоль) фенилуксусной кислоты и 2,1 мл (15 ммоль) триэтиламина в 15 мл сухого 1,2-дихлорэтана, смесь кипятят 2 часа, охлаждают, осадок отфильтровывают и из маточного раствора отгоняют растворитель. Полученный продукт промывают метанолом, выпавший осадок перекристаллизовывают из метанола. Продукт перекристаллизовывают из бутанола. Выход 0.35 г (20.7%). Красные кристаллы, т.пл. 213-214°С. Найдено, %: С 67.45, Н 3.51, N 4.02. Для C19H12ClNO3 вычислено, %: С 67.57, Н 3.58, N 4.15. ИК-спектр, см-1: 720 (С-С1), 1760, 1820 (C=O). Спектр ЯМР 1Н, COCl3, Соединения Ib-d в примерах 2-4 получены аналогично примеру 1 с использованием 1-нафтил-, (Е)-2-фенил-1-этенил и 3-тиенилуксусной кислот соответственно. Пример 2. 3-(2-Хлор-1-метил-1Н-индол-3-ил)-4-(1-нафтил)-фуран-2,5-дион (R1=CH3, R2=H, R3=1-нафтил) (Ib). Продукт перекристаллизовывают из бутанола. Выход 0.42 г (21.7%). Красные кристаллы, т.пл. 206-207°С. Найдено, %: С 71.18, Н 3.55, N 3.59. Для C23H14ClNO3 вычислено, %: С 71.23, Н 3.64, N 3.61. ИК-спектр, см-1: 720 (С-С1), 1760, 1820 (CO). Спектр ЯМР 1Н, CDC13, Пример 3. 3-(2-Хлор-1-метил-1Н-индол-3-ил)-4-[(Е)-2-фенил-1-этенил]-фуран-2,5-дион (R3=СН3, R2=H, R3=(Е)-2-фенил-1-этенил) (Ic). Продукт перекристаллизовывают из бутанола. Выход 0,3 г (16,7%). Оранжевые кристаллы, т.пл. 187-189°С. Найдено, %: С 69.25, Н 3.68, N 3.74. Для C21H14ClNO3 вычислено, %: С 69.33, Н 3.88, N 3.85. ИК-спектр, см-1: 720 (С-С1), 1760, 1820 (C=O). Спектр ЯМР 1H, CDC13, Пример 4. 3-(2-Хлор-1-метил-1Н-индол-3-ил)-4-(3-тиенил)фуран-2,5-дион (R1=CH3, R2=H, R3=3-тиенил) (Id). Продукт перекристаллизовывают из бутанола. Выход 0.23 г (14.7%). Оранжевые кристаллы, т.пл. 205-206°С. Найдено, %: С 59.31, Н 2.85, N 4.02. Для C17H10ClNO3S вычислено, %: С 59.39, Н 2.93, N 4.07. ИК-спектр, см-1: 720 (С-С1), 1760, 1820 (C=O). Спектр ЯМР 1Н, CDC13, Пример 5. Фотопродукт (8-Метил-1H-бензо[a]фуро[3,4-с]карбазол-1,3(8H)-дион) (R1=CH3, R2=H, R4,R5=бензо) (IIa). Получен облучением в течение 1 часа гептанового раствора соединения 1а [0.5 ммоль (168.88 мг)] в кварцевом фотореакторе объемом 0.5 л суммарным светом ртутной лампы ДРТ-230. Ход реакции контролируют методом УФ-спектроскопии. Фотопродукт IIа активно выпадает из раствора в процессе облучения в виде взвеси. По окончании облучения растворитель упаривают на роторном испарителе до объема 20 мл, выпавший осадок отфильтровывают, промывают гептаном, высушивают и взвешивают. Получают 147.2 мг фотопродукта IIа (выход 97.7%). Продукт перекристаллизовывают из бутанола. Желтые кристаллы, т.пл. 265-266°С. Найдено, %: С 68.15, Н 4.19, N 6.85. Для C19H11NO3 вычислено, %: С 68.24, Н 4.23, N 6.92. ИК-спектр, Спектр ЯМР 1Н, ДМСО-d6, Фотопродукты IIb-с в примерах 6-8 получены аналогично примеру 5 при облучении нафто-, фенилэтенил- и тиенилфурандионов I. Пример 6. Фотопродукт (12-Метил-5H-фуро[3,4-с]нафто[2,1-a]карбазол-5,7(12H)-дион) (R1=СН3, R2=H, R4,R5=2,1-нафто) (IIb). Получен из 3-(2-хлор-1-метил-1Н-индол-3-ил)-4-(1-нафтил)-фуран-2,5-диона (Ib). Выход 98.27%. Желтые кристаллы, т.пл. 270-271°С. Найдено, %: С 78.55, Н 3.68, N 3.87. Для C23H13NO3 вычислено, %: С 78.62, Н 3.73, N 3.99. ИК-спектр. Спектр ЯМР 1Н, ДМСО-d6, Пример 7. Фотопродукт (6-Метил-5-фенил-1H-фуро[3,4-с]карбазол-1,3(6Н)-дион) (R1=CH3, R2=H, R4=H, R5=фенил) (IIc). Получен из 3-(2-хлор-1-метил-lH-индол-3-ил)-4-[(Е)-2-фенилэтенил]фуран-2,5-диона (Ic) в гексане. Выход 99.2%. Желтые кристаллы, т.пл. 285-286°С. Найдено, %: С 68.15, Н 4.19, N 6.85. Для C19H1NO3 вычислено, %: С 68.24, Н 4.23, N 6.92. ИК-спектр, Спектр ЯМР 1Н, ДМСО-d6, Пример 8. Фотопродукт (11-Метил-4H-фуро[3,4-с]тиено[2,3-a]карбазол-4,6(11H)-дион) (R1=СН3, R2=H, R4,R5=2,3 тиено) (IId). Получен из 3-(2-хлор-1-метил-1H-индол-3-ил)-4-(3-тиенил)-фуран-2,5-диона (Id). Выход 98.2%. Желтые кристаллы, т.пл. 215-216°С. Найдено, %: С 66.35, Н 2.90, N 4.45. Для C17H9NO3S вычислено, %: С 66.44, Н 2.95, N 4.5. ИК-спектр. Спектр ЯМР 1H ДМСО-d6, У полученных соединений исследованы по стандартным методикам спектрально-абсорбционные и спектрально-флуресцентные характеристики в гептане при 293 К. Электронные спектры поглощения регистрировали на спектрофотометре «Cary 100» (Varian). Облучение растворов соединений I проводили в кварцевой кювете (l=1 см) монохроматическим светом, полученным после прохождения интерференционного светофильтра для выделения линии 436 нм ртутного спектра лампы ДРШ-250. Интенсивность падающего света, измеренная с помощью ферриоксалата калия, составляла 4.24·1015 квант·с-1. Значения квантовых выходов фотореакций определяли по методике, описанной ранее / Экспериментальные методы химической кинетики, под редакцией Н.М.Эммануэля, М.Г.Кузьмина, Изд-во МГУ, Москва, 1985, 384 с./. Флуоресцентные измерения проведены на спектрофлуориметре «Сагу Eclipse» (Varian). Значения квантовых выходов флуоресценции определяли методом Паркера – Риса /С.Паркер, Фотолюминесценция растворов, Мир, Москва, 1972, с.247/с использованием 3-метоксибензантрона в толуоле ( В таблицах 1 и 2 приведены результаты исследований соединений Ia-d /по примерам 1-4/ и их фотопродуктов IIa-d.
Формула изобретения
1. 4-Замещенные-3-(1-алкил-2-хлор-1Н-индол-3-ил)фуран-2,5-дионы общей формулы I 2. 4-Замещенные-3-(1-алкил-2-хлор-1Н-индол-3-ил)фуран-2,5-дионы по п.1, где R1 = СН3, R2 = H, R3 = фенил -3-(1-метил-2-хлор-1Н-индол-3-ил)-4-фенил-фуран-2,5-дион. 3. 4-Замещенные-3-(1-алкил-2-хлор-1Н-индол-3-ил)фуран-2,5-дионы по п.1, где R1 = СН3, R2 = H, R3 = 1-нафтил -3-(1-метил-2-хлор-1Н-индол-3-ил)-4-(1-нафтил)-фуран-2,5-дион. 4. 4-Замещенные-3-(1-алкил-2-хлор-1Н-индол-3-ил)фуран-2,5-дионы по п.1, где R1 = СН3, R2 = H, R3 = (Е)-2-фенил-1-этенил-3-(1-метил-2-хлор-1Н-индол-3-ил)-4-[(Е)-2-фенил-1-этенил]-фуран-2,5-дион. 5. 4-Замещенные-3-(1-метил-2-хлор-1Н-индол-3-ил)фуран-2,5-дионы по п.1, где R1 = СН3, R2 = H, R3 = 3-тиенил-3-(1-метил-2-хлор-1Н-индол-3-ил)-4-(3-тиенил)фуран-2,5-дион. 6. Способ получения 4-замещенных-3-(1-алкил-2-хлор-1Н-индол-3-ил)фуран-2,5-дионов общей формулы I по п.1, заключающийся в том, что замещенные уксусные кислоты общей формулы R3CH2COOH, где R3 = фенил, нафтил, фенилэтенил, тиенил, фурил, пирролил, бензотиофенил, бензофуранил, индолил, вводят во взаимодействие в присутствии триалкиламина с (2-хлор-1Н-индол-3-ил)(оксо)ацетилхлоридом общей формулы V, 7. Применение 4-замещенных-3-(1-алкил-2-хлор-1Н-индол-3-ил)фуран-2,5-дионов общей формулы I по п.1 в качестве веществ, образующих под действием видимого света флуоресцирующие вещества. 8. (4,5-Замещенные-6-алкил-1Н-фуро[3,4-с]карбазол-1,3(6Н)-дионы общей формулы II 9. (4,5-Замещенные-6-алкил-1Н-фуро[3,4-с]карбазол-1,3(6Н)-дионы по п.8, где R1 = метил, R2 = H, R4R5 = бензо-8-метил-1Н-бензо[а]фуро[3,4-с] карбазол-1,3 (8Н)-дион. 10. (4,5-Замещенные-6-алкил-1Н-фуро[3,4-с]карбазол-1,3(6Н)-дионы по п.8, где R1 = метил, R2 = H, R4R5 = нафто[2,1]-12-метил-5Н-фуро[3,4-с]нафто[2,1-а]карбазол-5,7(12Н)-дион. 11. (4,5-Замещенные-6-алкил-1Н-фуро[3,4-с]карбазол-1,3(6Н)-дионы по п.8, где R1=метил, R2=H, R4=H, R5 = фенил-6-метил-5-фенил-1Н-фуро[3,4-с]карбазол-1,3(6Н)-дион. 12. (4,5-Замещенные-6-алкил-1Н-фуро[3,4-с]карбазол-1,3(6Н)-дионы по п.8, где R1 = метил, R2 = H, R4R5 = тиено[2,3]-11-метил-4Н-фуро[3,4-с]тиено[2,3-а]карбазол-4,6(11Н)-дион. 13. Способ получения (4,5-замещенных-6-алкил-1Н-фуро[3,4-с]карбазол-1,3(6Н)-дионов общей формулы II по п.8, заключающийся в действии видимого света на 4-замещенные-3-(1-алкил-2-хлор-1Н-индол-3-ил)фуран-2,5-дионы общей формулы I по п.1, где R имеют вышеприведенные значения. 14. Применение (4,5-замещенных-6-алкил-1Н-фуро[3,4-с]карбазол-1,3(6Н)-дионов общей формулы II по п.8 в качестве флуорофоров.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 ,
, ,
,
 макс=436 нм, полоса поглощения циклической формы
макс=436 нм, полоса поглощения циклической формы 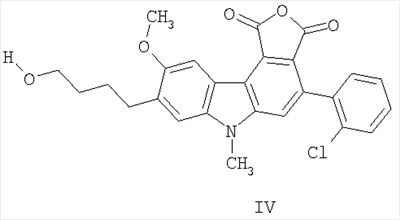
 , м.д.: 3.82 (с, 3Н, СН3), 7.02-7.10 (м, 2Н, аром), 7.22-7.42 (м, 5Н, аром), 7.60-7.65 (м, 2Н, аром).
, м.д.: 3.82 (с, 3Н, СН3), 7.02-7.10 (м, 2Н, аром), 7.22-7.42 (м, 5Н, аром), 7.60-7.65 (м, 2Н, аром). /см-1: 1760, 1820 (C=O).
/см-1: 1760, 1820 (C=O). =0.1,
=0.1, 
 ·103, л·моль-1·см-1)
·103, л·моль-1·см-1)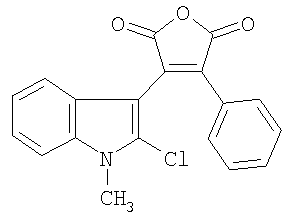
 ,
,