|
|
(21), (22) Заявка: 2008139359/04, 02.10.2008
(24) Дата начала отсчета срока действия патента:
02.10.2008
(43) Дата публикации заявки: 10.04.2010
(46) Опубликовано: 10.08.2010
(56) Список документов, цитированных в отчете о
поиске:
Boteva, A.A. et al. “Synthesis and antimicrobial activity of methyl esters of 2-(het)arylamino-4-oxo-Z-2-butenoic acids, their structural analogs and conversion products”, PHARMACEUTICAL CHEMISTRY JOURNAL, vol.42,  8, 2008, p.452-455. ТИТОВА Е.И. и др. Синтез ацетиленовых 8, 2008, p.452-455. ТИТОВА Е.И. и др. Синтез ацетиленовых  -дикетонов и взаимодействие их с алифатическими и ароматическимиаминами. Журнал органической химии, 1969, t.v, в. 126 с.2113-2119. КОЗЬМИНЫХ Е.Н. и др. Синтез, противомикробная и анальгетическая активность N-замещенных 2-амино-4-арил-4-оксо-2-бутеновых кислот. Химико-фармацевтический журнал, т.36, -дикетонов и взаимодействие их с алифатическими и ароматическимиаминами. Журнал органической химии, 1969, t.v, в. 126 с.2113-2119. КОЗЬМИНЫХ Е.Н. и др. Синтез, противомикробная и анальгетическая активность N-замещенных 2-амино-4-арил-4-оксо-2-бутеновых кислот. Химико-фармацевтический журнал, т.36,  l1, 2002, с.28-30. КОЛОТОВА Н.В. и др. Реакции ароилпировиноградных кислот и их производных с орто-аминофенилдифенилметанолом в синтезе фармакологически активных соединений. Химико-фармацевтический журнал, т.32, l1, 2002, с.28-30. КОЛОТОВА Н.В. и др. Реакции ароилпировиноградных кислот и их производных с орто-аминофенилдифенилметанолом в синтезе фармакологически активных соединений. Химико-фармацевтический журнал, т.32,  9, 1998, с.32-35. Яковлев С.В. Клиническая фармакология цефалоспоринов IV поколения. Русский медицинский журнал, 1998, т.6, 9, 1998, с.32-35. Яковлев С.В. Клиническая фармакология цефалоспоринов IV поколения. Русский медицинский журнал, 1998, т.6,  22, с.1449-1457. 22, с.1449-1457.
Адрес для переписки:
614081, г.Пермь, ул.Полевая,2, ГОУ ВПО ПГФА Росздрава, патентный отдел
|
(72) Автор(ы):
Дубровина Светлана Сергеевна (RU),
Одегова Татьяна Федоровна (RU),
Ботева Анастасия Андреевна (RU),
Красных Ольга Петровна (RU),
Рудакова Ирина Павловна (RU)
(73) Патентообладатель(и):
Государственное образовательное учреждение высшего профессионального образования “Пермская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию” (ГОУ ВПО ПГФА Росздрава) (RU)
|
(54) 2-(2,4-ДИХЛОРАНИЛИНО)-1,4-БИС(4-МЕТИЛФЕНИЛ)-2-БУТЕН-1,4-ДИОН, ОБЛАДАЮЩИЙ ПРОТИВОМИКРОБНОЙ АКТИВНОСТЬЮ
(57) Реферат:
Изобретение относится к области органической химии, к производным 1,4-дикетонов, а именно к новому биологически активному веществу – 2-(2,4-дихлоранилино)-1,4-бис(4-метилфенил)-2-бутен-1,4-диону формулы 1, которое обладает противомикробной активностью и может найти применение в медицине. 1 табл.
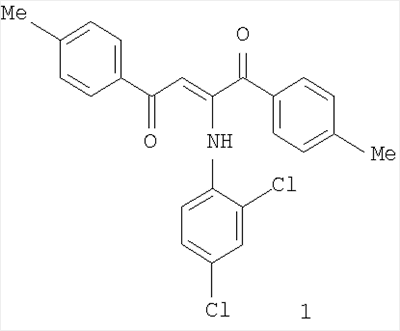
Изобретение относится к области органической химии, к производным 1,4-дикетонов, а именно к неизвестному ранее новому биологически активному веществу – 2-(2,4-дихлоранилино)-1,4-бис(4-метилфенил)-2-бутен-1,4-диону формулы 1:

которое может найти применение в медицине в качестве лекарственного противомикробного препарата.
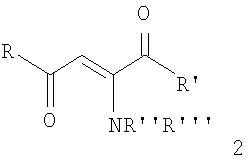
Ближайшими структурными аналогами заявляемого соединения являются аминовинилдикетоны 2, которые имеют с заявляемыми соединениями 1 одинаковый аминовинилдикетоновый фрагмент [Е.И.Титова, Л.Д.Гаврилова, Р.Л.Болынедворская, Л.И.Верещагин. Журнал органической химии, 1969, том 5, вып.12, с.2113-2119].
Структурными аналогами соединений 1 так же можно считать замещенные 2-амино-4-арил-4-оксо-2-бутеновые кислоты и их эфиры 3, проявляющие противомикробную и анальгетическую активность [Е.Н.Козьминых, А.О.Беляев, В.О.Козьминых, P.P.Махмудов, Т.Ф.Одегова. Химико-фармацевтический журнал, 2002, т.36,  11, с.28-30. Н.В.Колотова, В.О.Козьминых, Э.В.Долбилкина, Е.Н.Козьминых, В.Э.Колла, С.А.Шеленкова. Химико-фармацевтический журнал, 1998, т.32, 11, с.28-30. Н.В.Колотова, В.О.Козьминых, Э.В.Долбилкина, Е.Н.Козьминых, В.Э.Колла, С.А.Шеленкова. Химико-фармацевтический журнал, 1998, т.32,  9, с.32-35]. 9, с.32-35].
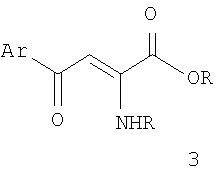
Все приведенные аналоги 2, 3 содержат общий с заявляемыми соединениями 1 аминовинилкетоновый фрагмент. Отличия состоят в том, что в качестве заместителей R и R’ в заявляемых соединениях находится n-толлильный заместитель, R”=Н, в качестве R”’ – 2,4-дихлораминофенильный заместитель.
В качестве эталона сравнения нами взяты противомикробные препараты – цефепим [Яковлев С.В., Рус. мед. журнал, 1998, т.6,  22, с.1449-1457] и хлоргексидина биглюконат [Падейская Е.Н., Инф. и антимикроб. терап., 2001, 22, с.1449-1457] и хлоргексидина биглюконат [Падейская Е.Н., Инф. и антимикроб. терап., 2001,  5, с.105-155], широко применяемые в лечебной практике антибиотик и дезинфектант. 5, с.105-155], широко применяемые в лечебной практике антибиотик и дезинфектант.
Цель данного изобретения – синтез неописанного ранее 2-(2,4-дихлоранилино)-1,4-бис(4-метилфенил)-2-бутен-1,4-диона, обладающего противомикробным действием.
Поставленная цель достигается получением 2-(2,4-дихлоранилино)-1,4-бис(4-метилфенил)-2-бутен-1,4-диона и изучением его противомикробного действия.
Пример получения заявляемого соединения 1:
Смесь эквимолярных количеств дитолуоилацетилена и 2,4-дихлоранилина кипятили в бензоле в течение 5 мин. Растворитель упаривали. Образовавшийся осадок перекристаллизовывали из четыреххлористого углерода. Выход 75%. Т.пл. 147-148°С. ИК спектр, см-1: 1668 (С(1)=0), 1605 (С(4)=0, С=С). Спектр ЯМР 1Н, м.д.: 2.36 (с, 6Н, 2Ме); 6.13 (с, 1Н, СН); 6.97 (м, 7Н, Ar); 7.76 (д, 4Н, Н(2), Н(6), 3J=8.4); 12.35 (с, 1Н, NH). Найдено, %: С 66.72; Н 3.80; Cl 17.85; N 3.50. C22H15Cl2NO2. Вычислено, %: С 66.68; Н 3.82; Cl 17.89; N 3.53.
Полученное соединение 1 представляет собой желтое кристаллическое вещество, растворимое в спиртах, хлороформе, толуоле, диметилсульфоксиде и диметилформамиде, нерастворимое в алканах и воде.
Заявленное соединение было исследовано на наличие у него противомикробной активности.
Определение бактериостатической активности проводили методом двукратных серийных разведений в жидкой питательной среде [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ – М., 2000., с.264-273]. Для всех исследуемых соединений были определены МПК в отношении фармакопейных штаммов: S. aureus АТСС 6538-Р, E. coli АТСС 25922, С. albicans АТСС 885-653, P. aerugenosa АТСС 9027, В. cereus АТСС 8035, В. subtilis АТСС 6633, S. epidermidis АТСС 14990. Посевы производили в мясопептонный бульон, рН 7,0 с различной концентрацией испытуемых соединений. Культуры выращивали в пробирках на скошенной агаризированной среде (мясопептонный агар). Для определения противомикробной активности использовалась 18-20-часовая культура. Для приготовления рабочей взвеси микробов производили смыв выросшей культуры изотоническим раствором натрия хлорида и устанавливали плотность микробной взвеси по стандарту мутности 5 единиц. Далее из полученной микробной взвеси (500 млн. м. т./мл. готовили рабочий раствор бактерий с концентрацией 5 млн. м. т./мл. Данную взвесь микробов вносили в количестве 0,1 мл в пробирки с серийными разведениями изучаемого препарата. Таким образом, микробная нагрузка при определении ПМА составила 250000 м. т./мл. Изучаемое соединение в количестве 0,05 г растворяли в 5 мл диметилсульфоксида, 1 мл полученного разведения 1:100 соединяли с 4 мл мясопептонного бульона (1:500). Далее готовили ряд серийных разведений соединения с двукратно уменьшающей концентрацией.
Учет результатов производили через 18-20 часов выдержки контрольных и опытных пробирок в термостате при температуре 37°С. Минимальную подавляющую концентрацию (МПК) устанавливали по отсутствию признаков роста на питательной среде: последняя пробирка с задержкой роста (прозрачный бульон) соответствует МПК препарата в отношении данного штамма. Бактериостатический эффект исследуемых соединений сравнивали с действием цефепима [Яковлев СВ., Рус. мед. журнал, 1998, т.6,  22, с.1449-1457], хлоргексидина биглюконата [Падейская Е.Н., Инф. и антимикроб, терап., 2001, 22, с.1449-1457], хлоргексидина биглюконата [Падейская Е.Н., Инф. и антимикроб, терап., 2001,  5, с.105-155]. 5, с.105-155].
Острую токсичность (ЛД50) заявленного соединения изучали на белых лабораторных мышах обоего пола массой 19-20 г. Исследуемое соединение вводили однократно в желудок в виде крахмальной слизи в объеме 1480, 2960, 4440, 5920, 7400 мг/кг, соответственно, наблюдение за животными проводили в течение 10 суток. Статистическую обработку результатов проводили по Прозоровскому В.В. сравнением средней смертельной дозы (ЛД50) при Р=0,05 [Прозоровский В.В., Прозоровская М.П., Демченко В.М. Фармакол. и токсикол., 1978,  4, с.497-502]. Результаты исследований представлены в таблице 1. 4, с.497-502]. Результаты исследований представлены в таблице 1.
Как видно из таблицы 1, соединение 1 по противомикробной активности сопоставимо с активностью хлоргексидина биглюконата по отношению к S.aureus и E.coli. Соединение 1 по отношению к С.albicans, спорообразующим палочкам, S.epidermidis уступает препаратам сравнения. По отношению к P.aerugenosa активностью не обладает. Соединение 1 по классификации Измерова Н.Ф. [Измеров Н.Ф. Параметры токсикометрии промышленных ядов при однократном введении, М., Медицина, 1977, с.197] относится к классу практически нетоксичных препаратов.
Таким образом, 2-(2,4-дихлоранилино)-1,4-бис(4-метилфенил)-2-бутен-1,4-дион 1 проявляет выраженную противомикробную активность и является практически нетоксичным. Следовательно, заявляемое соединение 1 может найти применение в медицине в качестве противомикробного лекарственного средства.
| Таблица 1 |
| Противомикробная активность (мкг/мл) и острая токсичность соединения 1 |
| Соединение |
S.aureus |
Е.coli |
Р.aerug. |
С.albic. |
S.epid. |
В.cereus |
В.subt. |
LD50, мг/кг |
| 1 |
2,0-1,0 |
2,0-1,0 |
– |
31-62 |
125 |
31 |
250 |
2700-3800 |
| Цефепим |
0,125-16 |
0,015-2,0 |
0,03-16 |
– |
0,5-62 |
– |
– |
– |
| Хлоргексидина бигл-т |
1-2 |
1-5 |
10-500 |
7-15 |
– |
1-2 |
1-3 |
– |
Источники информации
1. Измеров Н.Ф. Параметры токсикометрии промышленных ядов при однократном введении, М., Медицина, 1977, с.197.
2. Козьминых Е.Н., Беляев А.О., Козьминых В.О., Махмудов P.P., Одегова Т.Ф. Химико-фармацевтический журнал, 2002, т.36,  11, с.28-30. 11, с.28-30.
3. Колотова Н.В., Козьминых В.О., Долбилкина Э.В., Козьминых Е.Н., Колла В.Э., Шеленкова С.А. Химико-фармацевтический журнал, 1998, т.32,  9, с.32-35. 9, с.32-35.
4. Падейская Е.Н., Инф. и антимикроб, терап., 2001,  5, с.105-155. 5, с.105-155.
5. Прозоровский В.В., Прозоровская М. П., Демченко В.М. Фармакол. и токсикол., 1978,  4, с.497-502. 4, с.497-502.
6. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ – М., 2000, с.264-273.
7. Титова Е.И., Гаврилова Л.Д., Болыдедворская Р.Л., Верещагин Л.И. Журнал органической химии, 1969, том 5, вып.12, с.2113-2119.
8. Яковлев С.В. Русский медицинский журнал – 1998. – т.6,  22. – с.1449-1457. 22. – с.1449-1457.
Формула изобретения
2-(2,4-дихлоранилино)-1,4-бис(4-метилфенил)-2-бутен-1,4-дион формулы 1:

обладающий противомикробной активностью.
|
|