|
|
(21), (22) Заявка: 2007133103/13, 03.02.2006
(24) Дата начала отсчета срока действия патента:
03.02.2006
(30) Конвенционный приоритет:
04.02.2005 DK PA200500173
07.02.2005 US 60/650,751
(43) Дата публикации заявки: 10.03.2009
(46) Опубликовано: 10.08.2010
(56) Список документов, цитированных в отчете о
поиске:
WO 2004067023 А2, 12.08.2004. TSURUMA Т. at al: “Phase I clinical study of anti-apoptosis protein, survivin-derived peptide vaccine therapy for patients with advanced or recurrent colorectal cancer”. J Transl Med. 2004 Jun 13;2(1):19.
(85) Дата перевода заявки PCT на национальную фазу:
04.09.2007
(86) Заявка PCT:
DK 2006/000061 20060203
(87) Публикация PCT:
WO 2006/081826 20060810
Адрес для переписки:
129090, Москва, ул.Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. А.В.Миц, рег. 364 364
|
(72) Автор(ы):
АНДЕРСЕН Мадс Хальд (DK)
(73) Патентообладатель(и):
СУРВАК АпС (DK)
|
(54) ВАКЦИНА НА ОСНОВЕ ПЕПТИДОВ СУРВИВИНА
(57) Реферат:
Изобретение относится к биотехнологии. Описана вакцинная композиция, пригодная для лечения рака, содержащая: один или несколько вариантов пептидных фрагментов, полученных из белка сурвивина, где указанный пептидный фрагмент выбран из группы, состоящей из: FTELTLGEF (SEQ ID NO: 16), LMLGEFLKL (SEQ ID NO: 5), EPDLAQCFY (SEQ ID NO: 9), APPAWQPFL (SEQ ID NO: 13) и RPPAWQPFL (SEQ ID NO: 14), и адъювант, составленный как эмульсия «вода в масле», содержащая минеральное масло и поверхностно-активное вещество, где адъювант содержит до 14,5% по объему указанного поверхностно-активного вещества. Предложен способ стимулирования сильного специфического Т-клеточного ответа к сурвивину у субъекта, включающий введение описанной вакцины. А также способ лечения или профилактики рака у субъекта, включающий введение описанной вакцины. Вакцина может применяться для профилактического, облегчающего и/или лекарственного лечения, например, онкологических заболеваний. 4 н. и 10 з.п. ф-лы, 3 ил., 3 табл.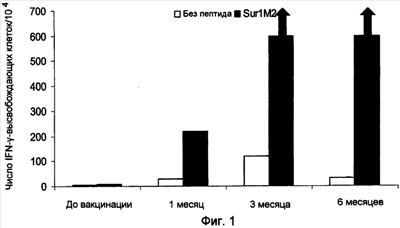
Все ссылки на патенты и другие источники, цитированные в этой патентной заявке, приведены настоящим в качестве ссылки в их полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к терапевтической вакцине, содержащей один или несколько фрагментов полипептида сурвивина. Вакцина может применяться для профилактического, облегчающего и/или лекарственного лечения, например, онкологических заболеваний. Изобретение также относится к способам комбинированного лечения.
УРОВЕНЬ ТЕХНИКИ
Иммунная система млекопитающих распознает и реагирует на чужеродные или посторонние вещества. Важной гранью системы является Т-клеточный ответ. Этот ответ состоит в том, что Т-клетки узнают и взаимодействуют с комплексами молекул клеточной поверхности, называемыми лейкоцитарными антигенами человека (HLA), составляющими главный комплекс гистосовместимости человека (MHC), и пептидами. Пептиды образуются из более крупных молекул, процессируемых клетками, которые также представляют молекулы HLA/MHC. Взаимодействие Т-клеток и комплексов HLA/пептид ограничено, для этого необходимы T-клетки, которые являются специфическими для определенной комбинации молекулы HLA и пептида. Если специфическая T-клетка не присутствует, то даже в присутствии ее комплекса партнеров Т-клеточного ответа не происходит. Аналогично, ответа не происходит, когда при наличии Т-клеток отсутствует специфический комплекс.
Хорошо известно, что пептидные эпитопы, полученные из ассоциированных с опухолью антигенов (TAA) человека, могут узнаваться цитотоксическими T-лимфоцитами (CTL) в контексте молекул MHC и что большинство, если не все, опухоли экспрессируют такие антигены. Соответственно, предпринимаются многообещающие клинические попытки нацеливания на такие TAA с использованием подходов, таких как вакцинация и адоптивная T-клеточная терапия, для того чтобы вызвать эффективные противоопухолевые CTL ответы у пациентов.
Однако иммуноселекция утративших антиген вариантов может быть серьезным препятствием для лечебного потенциала большинства известных CTL эпитопов в клинической онкологии, и отбор лишенных антигена мутантных опухолей представляет собой хорошо осознаваемое ограничение в терапевтических подходах, когда мишенями становятся антигены, которые не играют никакой роли в злокачественном росте. Дело в том, что большинство охарактеризованных пептидов являются производными полипептидов, которые не являются существенными для выживания опухолевой клетки. Следовательно, если сильные CTL ответы индуцируются по отношению к таким пептидным антигенам при помощи терапевтических мер, таких как вакцинации, то опухолевые клетки, утратившие экспрессию антигенов-мишеней, весьма вероятно, избегнут усиленных иммунных ответов.
Существует необходимость в более эффективных терапевтических вакцинах и в усовершенствованных способах лечения онкологических заболеваний.
Механизм, при помощи которого Т-клетки узнают клеточные аномалии, также органически связан с раком. В W092/20356 было обнаружено семейство генов, которые процессируются в пептиды, а те, в свою очередь, экспрессируются на поверхности клетки, и могут приводить к лизису опухолевых клеток специфическими CTL. Эти гены названы MAGE семейством и, как полагают, кодируют «предшественников антигенов отторжения опухоли» или молекулы «TRAP», а образуемые из них пептиды названы «антигенами отторжения опухоли» или «TRA».
Тем не менее, хотя является общепринятым, что большинство, если не все опухоли являются антигенными, только некоторые действительно являются иммуногенными в смысле, что развитие опухоли полностью контролируется иммунной системой.
Для преодоления этого было предпринято несколько иммунотерапевтических исследований с использованием вакцинаций пептидами, полученными из TAA. Для меланомы, опухоли, для которой было охарактеризовано наибольшее число CTL-распознаваемых TAA, при помощи вакцинации были индуцированы мощные CTL ответы против антигенов и некоторые больные получили полную ремиссию своих заболеваний. Однако, большинство пептидных эпитопов, использованных в этих испытаниях по вакцинации, являются меланоцит-специфическими, и эти пептиды не могут применяться в случае опухолей немеланоцидной природы. Более того, экспрессия этих TAA гетерогенна среди опухолей различных пациентов и даже может варьировать среди метастазов, полученных от одного пациента. Тем не менее, в течение последних нескольких лет был идентифицирован ряд специфических для опухолей пептидных антигенов, которые экспрессируются в ряде различных раков, а именно HER-2, Muc-1 и теломераза.
Было также показано, что при правильном обращении присутствующие в опухоли опухолевые антигены могут быть экспонированы для иммунной системы. Исследования показали, что CD8+ CTL ветвь иммунного ответа, сама по себе или в сочетании с CD4+ Th-клетками, составляет первичную противоопухолевую эффекторную ветвь адаптивного иммунного ответа. До последнего времени основное внимание было обращено на CTL ветвь иммунного ответа. Становится понятным, тем не менее, что CD4 T-клеточный ответ играет существенную роль в отторжении опухоли, особенно в фазе индукции или при развитии CTL ответа in vivo. Следовательно, включение расщепленных классом 1 опухолевых антигенов в схемы эффективной противоопухолевой вакцинации может усилить эффективность вакцин.
Апоптоз представляет собой генетическую программу самоубийства клетки, и ингибирование апоптоза, как предполагают, является важным механизмом, вовлеченным в формирование злокачественной опухоли путем удлинения продолжительности жизни клеток, способствующего накоплению трансформирующих мутаций. Сурвивин является недавно идентифицированным членом семейства белков-ингибиторов апоптоза (IAP). В глобальном анализе генной экспрессии 4 миллионов транскриптов сурвивин был идентифицирован как один из основных генов, неизменно активированных во многих типах раковых, но не нормальных тканей. Солидные злокачественные опухоли, сверхэкспрессирующие сурвивин, включают рак легких, толстой кишки, молочной железы, поджелудочной и предстательной желез, а также рак крови. Кроме того, сообщалось, что ряд меланомных и немеланомных раков кожи неизменно являются сурвивин-позитивными. Сверхэкспрессия сурвивина в большинстве злокачественных опухолей человека позволяет сделать предположение о главной роли ингибирования апоптоза в развитии опухоли, точка зрения, основанная на наблюдении, что в случае колоректального рака и рака мочевого пузыря, а также нейробластомы, экспрессия сурвивина ассоциировалась с неблагоприятным прогнозом. Сурвивин, как и другие ингибиторы апоптоза, экспрессируется в эндотелиальных клетках во время ангиогенеза опухоли, и подавление экспрессии сурвивина при помощи антисмысловых РНК во время ангиогенеза вызывает апоптоз эндотелиальных клеток, который вызывает быстрый коллапс капилляроподобных кровеносных сосудов in vitro. В отличие от эндотелиальных сурвивин не детектируется в нормальных зрелых тканях. Поскольку сурвивин сверхэкспрессируется в большинстве злокачественных опухолей человека и подавление его функции приводит к усилению апоптоза, этот белок может быть мишенью для терапевтических CTL ответов. О белке сурвивине и его потенциальном диагностическом и терапевтическом применении сообщается в US 6245523, который приведен в настоящем описании в качестве ссылки. Сурвивин представляет собой цитоплазматический белок массой 16,5 кДа, содержащий один BIR и сильно заряженный С-концевой скрученный участок вместо RING пальца, который ингибирует апоптоз, индуцированный удалением фактора роста (IL-3) при передаче в предшественники B-клеток. Кодирующий сурвивин ген почти идентичен последовательности рецептора-1 протеазы клеток-эффекторов (EPR-1), но имеет противоположную направленность, что предполагает существование двух отдельных генов, дуплицированных в конфигурации голова-к-голове. Соответственно, сурвивин может быть охарактеризован как антисмысловой EPR-1-продукт. Благодаря противоположной ориентации двух генов аминокислотные последовательности кодируемых белков различны.
Функционально, ингибирование экспрессии сурвивина при активации его природного антисмыслового EPR-1-транскрипта приводит к массовому апоптозу и ослаблению клеточного роста.
US 6245523 сообщает о выделении очищенного сурвивина и предоставляет молекулы нуклеиновых кислот, кодирующих белок сурвивин, и антитела и другие молекулы, которые связываются с сурвивином. US 6245523 также сообщает о противоапоптотически активных фрагментах белка сурвивина и его вариантах, где аминокислотный остаток был вставлен с N- или C-конца, или внутрь предоставленной последовательности сурвивина. В частности, показано, что такие пептиды должны содержать ключевые функциональные остатки, необходимые для апоптоза, а именно Trp в положении 67, Pro в положении 73 и Cys в положении 84.
Ранее сообщалось, что слабый Т-клеточный ответ может быть усилен при использовании вакцинации с дендритными клетками, наполненными пептидами сурвивина, что было определено при помощи тестов ELISPOT (WO2004/067023 и Otto, K. et al., J. Vaccine (2004)). Ответ составил менее 30 на 104 клеток, и последующая оценка клинических результатов показала прогрессирование заболевания. Следовательно, эта вакцина имеет только весьма ограниченное применение. Таким образом, представляет большой интерес разработка вакцин, способных индуцировать очень сильный специфический Т-клеточный ответ и, в частности, способных индуцировать клинический ответ, при котором ингибируется прогрессирование заболевания.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основывается на открытии того, что MHC Класса I-расщепленные пептиды, полученные из белка сурвивина, способны связываться с молекулами HLA MHC Класса I и, таким образом, вызывать CTL иммунные ответы как ex vivo, так и in situ у больных, страдающих от широкого круга онкологических заболеваний. Перед применением для лечения важно проанализировать иммунные ответы в сочетании с клиническими результатами для оценки пригодности вакцинной композиции для лечения рака. Специфический Т-клеточный ответ после иммунизации может быть полезным тестом на потенциальные антигены, используемые в вакцинах, предпочтительно, чтобы вакцинная композиция была способна вызывать очень сильный Т-клеточный ответ, такой как более 50 IFN- -высвобождающих клеток на 104 PBMC, так как это может усилить успех вакцинной композиции для применения при лечении рака. Настоящее изобретение раскрывает особенно эффективные вакцинные композиции, способные индуцировать частичную или полную регрессию опухоли. Очевидно, эти данные открывают путь для новых терапевтических подходов, которые, вследствие того что сурвивин, по-видимому, экспрессируется во всех опухолевых клетках, имеют общее применение при контроле онкологических заболеваний. -высвобождающих клеток на 104 PBMC, так как это может усилить успех вакцинной композиции для применения при лечении рака. Настоящее изобретение раскрывает особенно эффективные вакцинные композиции, способные индуцировать частичную или полную регрессию опухоли. Очевидно, эти данные открывают путь для новых терапевтических подходов, которые, вследствие того что сурвивин, по-видимому, экспрессируется во всех опухолевых клетках, имеют общее применение при контроле онкологических заболеваний.
Вакцинная композиция или иммуногенная композиция, как описывается в настоящем описании, квалифицируется как фармацевтическая композиция, поскольку пептиды вызывают CTL ответ, способный противодействовать неоплазии. Следовательно, вакцинная композиция квалифицируется как терапевтическая вакцина или как терапевтическая или фармацевтическая композиция.
В аспекте изобретение относится к вакцинной композиции, включающей один или несколько пептидов сурвивина или вариантов пептидов сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23, и адъювант, составленный как эмульсия «вода в масле», содержащая минеральное масло и поверхностно-активное вещество, где адъювант содержит до 14,5% по объему указанного поверхностно-активного вещества, для применения в качестве лекарственного средства.
Аспект изобретения относится к варианту пептида сурвивина, состоящему из максимально 50 аминокислотных остатков, способному связываться с HLA-B7, содержащему пептид, выбранный из группы: APPAWQPFL (SEQ ID NO: 13) и RPPAWQPFL (SEQ ID NO: 14).
Дополнительные аспекты относятся к вакцинным композициям, содержащим один или несколько пептидов сурвивина или вариантов пептидов, где последовательность варианта пептида по всей длине, по меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23 и где композиция содержит:
i) HLA-B7-связывающий пептид, и/или
HLA-A1- и HLA-A2-расщепленный, пептид, и/или
HLA-A1- и HLA-B35-расщепленный пептид,
ii) и адъювант.
Аспект относится к вакцинной композиции, содержащей три или более пептидов сурвивина или вариантов пептидов сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23 и где
i) по меньшей мере, один пептид или вариант пептида выбран из группы HLA-A1-связывающих пептидов, и где
ii) по меньшей мере, один пептид или вариант пептида выбран из группы HLA-A2-связывающих пептидов, и где
iii) по меньшей мере, один пептид или вариант пептида выбран из группы of HLA-B35-связывающих пептидов,
и адъювант.
Другой аспект настоящего изобретения относится к вакцинной композиции, содержащей семь или более пептидов сурвивина или вариантов пептидов сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23,
i) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A1-связывающих пептидов,
ii) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A2-связывающих пептидов,
iii) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A3-связывающих пептидов,
iv) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A24-связывающих пептидов,
v) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A11-связывающих пептидов,
vi) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-B35-связывающих пептидов,
vii) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-B7-связывающих пептидов,
и адъювант.
Развитие солидных опухолей зависит от образования кровеносных сосудов. Подавление ангиогенеза в связи с этим может предотвращать развитие солидных опухолей. Экспрессия сурвивина, bcl-2 и McI-1 в эндотелиальных клетках во время ангиогенеза опухоли позволяет предположить, что вакцинации с использованием описанных в настоящем описании пептидов могут иметь противоангиогенный эффект.
Аспект изобретения относится к вакцине, содержащей один или несколько пептидов или вариантов пептидов сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23, и адъювант, способной индуцировать проникновение антиген-специфических t-клеток в строму опухоли у субъекта для применения в качестве лекарственного средства.
В одном дополнительном аспекте изобретение относится к вакцинной композиции, содержащей:
i) нуклеиновую кислоту, кодирующую:
a) полипептид сурвивина (SEQ ID NO: 23),
b) пептид сурвивина или
c) вариант пептида сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23, и
ii) адъювант.
Аспект изобретения относится к применению вакцинной композиции, содержащей один или несколько пептидов сурвивина или вариантов пептидов сурвивина и адъювант, способной вызывать очень сильный специфический ответ цитотоксических T-клеток у субъекта, для производства лекарственного средства. Это рассматривается как очень сильный специфический T-клеточный ответ, который может коррелировать с более высокими показателями хороших клинических ответов. В этом отношении очень сильный специфический Т-клеточный ответ приравнивается к ответу более чем 50 пептид-специфических пятен на 104 PBMC клеток, определенному при помощи ELISPOT теста, до и после введения вакцинной композиции.
Аспект изобретения относится к набору, включающему:
i) вакцинную композицию, содержащую:
a) один или несколько пептидов сурвивина или вариантов пептидов сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23,
b) и адъювант, и
ii) вспомогательное лекарственное средство.
Аспект изобретения описывает способ стимуляции сильного специфического Т-клеточного ответа к сурвивину у субъекта, включающий:
a) получение вакцинной композиции согласно изобретению,
b) введение указанной вакцинной композиции субъекту, где указанная вакцинная композиция может быть введена более одного раза; и
c) стимулирование посредством этого сильного специфического Т-клеточного ответа у субъекта, где сильный специфический Т-клеточный ответ, определенный при помощи теста ELISPOT, до и после введения вакцинной композиции, составляет более чем 50 пептид-специфических пятен на 104 PBMC клеток,
d) получение сильного специфического Т-клеточного ответа у субъекта.
Дополнительный аспект изобретения относится к способу лечения или профилактики заболевания, включающему:
a) получение вакцинной композиции согласно изобретению,
b) введение указанной вакцинной композиции субъекту, где указанная вакцинная композиция вводится более одного раза.
В дополнительном аспекте изобретение относится к способу лечения или профилактики заболевания, включающему:
a) получение вакцинной композиции согласно изобретению,
b) введение указанной вакцинной композиции субъекту, где указанная вакцинная композиция вводится более одного раза,
c) стимулирование посредством этого сильного специфического Т-клеточного ответа у субъекта, где сильный специфический Т-клеточный ответ, определенный при помощи теста ELISPOT, до и после введения вакцинной композиции, составляет более чем 50 пептид-специфических пятен на 104 PBMC клеток,
d) получение клнического ответа у субъекта.
В определенных аспектах изобретение относится к способам индуцирования проникновения антиген-специфических T-клеток в строму опухоли у субъекта или ингибирования ангиогенеза у субъекта, включающим:
a) получение вакцины согласно изобретению,
b) введение указанной вакцинной композиции субъекту,
c) получение проникновения антиген-специфических T-клеток в строму опухоли или ингибирования ангиогенеза.
Способ комбинированного лечения, включающий одновременное, последовательное или раздельное введение в любом порядке:
a) вакцинной композиции согласно изобретению и
b) вспомогательного лекарственного средства.
Определения:
AA: Смотрите «Аминокислота».
Адъювант: Вакцинный адъювант представляет собой компонент, который усиливает специфический иммунный ответ на антиген.
Аминокислота: Вещество, содержащее аминоконцевую часть (NH2) и карбоксиконцевую часть (COOH), разделенные центральной частью, включающей атом углерода или цепочку атомов углерода, содержащих по меньшей мере одну боковую цепь или функциональную группу. NH2 относится к аминогруппе, расположенной на аминотерминальном конце аминокислоты или пептида, и COOH относится к карбоксильной группе, расположенной на карбокситерминальном конце аминокислоты или пептида. Генетический термин аминокислота включает как природные, так и неприродные аминокислоты. Природные аминокислоты стандартной номенклатуры, перечисленные в J. Biol. Chem., 243: 3552-59 (1969) и утвержденные в 37 C.F.R., раздел 1,822(b)(2), относятся к группе аминокислот, перечисленных в настоящем описании в нижеприведенной таблице 1. Неприродными являются те аминокислоты, которые не представлены в таблице 1. Примерами неприродных аминокислот являются те, которые перечислены, например, в 37 C.F.R. раздел 1,822(b) (4), каждый из которых приведен в настоящем описании в качестве ссылки. Описанные в настоящем описании аминокислотные остатки могут быть в «D» или «L» изомерной форме.
| Таблица 1 |
| Природные аминокислоты и соответствующие им коды |
| Символы |
Аминокислота |
| 1-буквенный |
3-буквенный |
| Y |
Tyr |
тирозин |
| G |
Gly |
глицин |
| F |
Phe |
фенилаланин |
| M |
Met |
метионин |
| A |
Ala |
аланин |
| S |
Ser |
Серин |
| I |
Ile |
изолейцин |
| L |
Leu |
лейцин |
| T |
Thr |
треонин |
| V |
Val |
Валин |
| P |
Pro |
пролин |
| K |
Lys |
Лизин |
| H |
His |
гистидин |
| Q |
Gln |
глутамин |
| E |
Glu |
глутаминовая кислота |
| W |
Trp |
триптофан |
| R |
Arg |
аргинин |
| D |
Asp |
аспарагиновая кислота |
| N |
Asn |
аспарагин |
| C |
Cys |
цистеин |
Аминокислотный остаток: термин «аминокислотный остаток» охватывает аминокислоты, или стандартные аминокислоты, нестандартные аминокислоты, или псевдоаминокислоты, вступающие в реакцию с не менее чем одним другим видом, например с 2, например с 3, более чем 3 другими видами. В частности, аминокислотные остатки могут содержать ацильную связь вместо свободной карбоксильной группы и/или аминную связь и/или амидную связь вместо свободной аминогруппы. Более того, вступающие во взаимодействие аминокислотные остатки могут содержать сложную эфирную или сложную тиоэфирную связь вместо амидной связи.
Антитела: представляют собой молекулы иммуноглобулинов или активных участков молекул иммуноглобулинов. Например, антителами являются неповрежденные молекулы иммуноглобулинов или их фрагменты, сохранившие иммунологическую активность.
Антиген: Молекула, которая узнается антителами. Как правило, пептид, полипептид или мультимерный полипептид. Антигены преимущественно способны вызывать иммунный ответ.
A.P.I. плотность: Термин, используемый в нефтяной промышленности для выражения относительной плотности нефтепродуктов на основании значений, установленных API (American Petroleum Institute). API плотность измеряется при помощи гидрометрического прибора по шкале, градуированной в единицах API.
CTL: Цитотоксические T лимфоциты. Подгруппа T-клеток, экспрессирующих CD8 вместе с рецептором T-клеток и поэтому способных отвечать на антигены, представленные молекулами Класса I.
Эмульсия: Суспензия маленьких капель одной жидкости во второй жидкости, с которой первая не смешивается.
Эмульгатор: поверхностно-активное вещество, которое способствует образованию эмульсии.
HLA: Лейкоцитарный антиген человека, также называемый MHC. У человека синтезируется три различных типа молекул MHC Класса I, HLA-A, HLA-B и HLA-C. Молекулы MHC Класса II человека обозначены как HLA-D.
Иммуноглобулин: Антитела сыворотки, включающие IgG, IgM, IgA, IgE и IgD.
Выделенный: используется для описания любого из различных стимуляторов секреции, полипептидов и нуклеотидов, описанных в настоящем описании, которые были идентифицированы и отделены и/или извлечены из компонента их природного окружения. Загрязняющие компоненты их природного окружения представляют собой вещества, которые, как правило, являются помехой диагностическому или терапевтическому использованию полипептида, и могут включать ферменты, гормоны и другие белковые и небелковые растворы. В предпочтительных вариантах осуществления полипептид следует очистить.
Лиганд: Молекула, например, пептид, способная специфически связываться с одним или несколькими узнающими рецепторами. Например, антиген является лигандом для своих узнающих антител.
MHC: Главный комплекс гистосовместимости, также называемый HLA. Существует два основных подкласса MHC, Класс I и Класс II.
Минеральное масло: Масло, получаемое из минерального источника, такого как нефть, в противоположность маслам, получаемым из растений и животных. Смеси углеводородов разнообразных композиций.
Montanide ISA (Montanide Incomplete Seppic Adjuvant): Масляный адъювант, составленный как эмульсия «вода в масле». Адъюванты Montanide ISA представляют собой группу адъювантов на основе масла/поверхностно-активного вещества, у которых неметаболизируемое и/или метаболизируемое масло комбинируется с поверхностно-активными веществами (поставляемыми Seppic, Belgium).
PBMC: Мононуклеарные клетки периферической крови.
PBL: Лейкоциты периферической крови.
Пептид: Множество ковалентно связанных аминокислотных остатков, составляющих последовательность и соединенных амидными связями. Термин используется аналогично терминам олигопептид и полипептид. Природные и/или неприродные аминокислоты могут быть соединены пептидными связями или непептидными связями. Термин пептид также включает посттрансляционные модификации, образуемые в результате химических или катализируемых ферментами реакций, известных в данной области.
Поверхностное натяжение: Поверхностное натяжение представляет собой энергию, необходимую для увеличения размера поверхности. Силы связывания между молекулами жидкости ответственны за поверхностное натяжение, и молекулы на поверхности жидкости сильно сцеплены друг с другом.
Поверхностно-активное вещество: Поверхностно-активное вещество, обладающее способностью ослаблять поверхностное натяжение жидкости, в которой растворено. Поверхностно-активное вещество представляет собой соединение, содержащее полярную группу, которая гидрофильна, и неполярную группу, которая гидрофобна и часто составляет алифатическую цепь.
TAA: Антиген, ассоциированный с опухолью.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к вакцинной композиции, содержащей пептиды сурвивина и варианты пептидов сурвивина, как описано в настоящем описании ниже.
Вакцинные композиции
Согласно изобретению вакцинная композиция может быть составлена на основании известных способов, например при смешивании одного или нескольких фармацевтически приемлемых наполнителей или носителей с активным веществом, предпочтительно подходящих для введения человеку. Примеры таких наполнителей, носителей и способов составления можно найти, например, в Remington’s Pharmaceutical Sciences (Maack Publishing Co, Easton, PA). Для составления фармацевтически приемлемой композиции, пригодной для эффективного введения, такие композиции согласно изобретению должны содержать эффективное количество полипептида сурвивина, пептида сурвивина или варианта пептида сурвивина, как описано в настоящем описании.
Согласно изобретению вакцинная композиция может вводиться индивидууму в терапевтически эффективных количествах. Эффективное количество может меняться в зависимости от ряда факторов, таких как состояние индивидуума, вес, пол и возраст. Другие факторы включают способ введения.
В дальнейшем вакцинные композиции подразумевают включение композиций, пригодных для терапевтического использования, включая стимулирование иммунного ответа у больного, такого как сильный специфический ответ цитотоксических T-клеток на введение указанной композиции, в особенности вакцинной композиции, способной индуцировать клинический ответ в повреждении-мишени. Кроме того, предполагается, что вакцинная композиция по изобретению не индуцирует никаких системных или локальных токсических реакций или любые другие побочные эффекты.
Для получения вакцин или иммуногенных композиций может потребоваться комбинирование сравнительно небольших молекул пептида сурвивина и вариантов пептида сурвивина, описанных в настоящем описании, с различными веществами, такими как адъюванты, иммуностимулирующие компоненты и/или носители. Адъюванты включаются в вакцинную композицию для усиления специфического иммунного ответа. Поэтому особенно важно идентифицировать адъювант, который при комбинировании с антигеном(ами) образует вакцинную композицию, способную индуцировать сильный специфический ответ цитотоксических T-клеток и, что наиболее важно, клинический ответ в повреждении-мишени.
Адъювант
Было описано большое количество адъювантов и их использование для выработки антител у лабораторных животных, таких как мышь, крыса и кролик. В такой постановке допустимость побочных эффектов весьма велика, поскольку основной целью является получение сильного ответа антител.
Для применения и для утверждения применения в фармацевтике, и особенно для применения у людей, необходимо, чтобы компоненты вакцинной композиции, включая адъювант, были хорошо охарактеризованы. Необходимо также, чтобы при применении композиции был бы минимален риск возникновения неблагоприятных реакций, таких как гранулема, абсцесс или лихорадка.
В предпочтительном варианте осуществления вакцинная композиция является пригодной для введения человеку, поэтому предпочтительные адъюванты пригодны для введения человеческому субъекту.
Выбор адъюванта может также быть отобран по способности к стимуляции иммунного ответа желаемого типа, активации B-клеток или/и T-клеток, и вакцинная композиция может быть составлена таким образом, чтобы оптимизировать распределение и представление соответствующих лимфатических тканей.
Недавно в качестве очень эффективного направления для усиления иммунного ответа, направленного в отношении онкологических заболеваний, был предложен способ, включающий наполнение соответствующих антиген-представляющих клеток антигенными пептидами. Этот способ включает выделение из больного APC (PBL) или клеток-предшественников АРС и наполнение их антигенными пептидами, альтернативно могут быть использованы дендритные клетки, которые дифференцируются in vitro в APC и наполняются антигенными пептидами перед инъекцией больному. Этот способ очень сложный и требующий времени. Использование клеточных культур делает его очень негибкой вакцинной композицией, требующей специальной подготовки и приспособлений для хранения. Настоящее изобретение имеет целью выявление вакцинной композиции, которая легко изготовляется и/или хранится.
Адъюванты, используемые в терапевтической вакцине, могут быть минеральными солями, такими как гели гидроксида алюминия и фосфата алюминия или кальция, масляные эмульсии и составы на основе поверхностно-активных веществ, такие как MF59 (микрофлюидизированная детергентная стабилизирующая эмульсия типа масло в воде), QS21 (очищенный сапонин), AS02 (SBAS2, эмульсия типа масло в воде + монофосфориллипид A (MPL) + QS21), Montanide ISA 51 и ISA-720 (стабилизированная эмульсия «вода в масле»), Адъювант 65 (содержащий арахисовое масло, маннид моноолеат и моностеарат алюминия), RIBI ImmunoChem Research Inc., (Hamilton, Utah), адъюванты в виде микрочастиц, таких как виросомы (однослойные липосомальные пузырьки, включающие гемагглютинин гриппа), AS04 (соль алюминия с MPL), ISCOMS (структурированный комплекс сапонинов и липидов (такой как холестерин), полиактидсогликолид (PLG), микробные производные (натуральные и синтетические), такие как монофосфориллипид A (MPL), Detox (MPL + скелет клеточной стенки M. Phlei), AGP (RC-529 (синтетические ацилированный моносахарид)), DC_chol (липоидные иммуностимуляторы, способные самоорганизовываться в липосомы), OM-174 (производное липида А), CpG мотивы (синтетический олигонуклеотиды, содержащие иммуностимулирующие CpG мотивы), модифицированные бактериальные токсины, LT и CT, с нетоксическими адъювантными эффектами, эндогенные иммуномодуляторы человека, например hGM-CSF или hIL-12 или иммудаптин (тандемное расположение C3d), инертные носители, такие как частицы золота.
Адъюванты QS-21 и Montanide ISA-51 могут поставляться в стерильных одноразовых пробирках.
В одном из вариантов осуществления вакцинная композиция содержит адъювант и пептиды сурвивина или вариант пептидов сурвивина, как описано в настоящем описании ниже. В предпочтительном варианте осуществления адъювантом может быть Montanide Incomplete Seppic Адъювант (ISA) (Seppic, Belgium), который включает Montanide ISA-51, Montanide ISA 50, Montanide ISA 70, Montanide ISA 206, Montanide ISA 708, Montanide ISA-720, Montanide ISA 763A, Montanide ISA 207, Montanide ISA 264, Montanide ISA 27, Montanide ISA 35, Montanide ISA 740, Montanide ISA 773, Montanide ISA 266, Montanide ISA 267, Montanide ISA 28, Montanide ISA 51F, Montanide ISA 016D и Montanide IMS. Три последних из приведенных пока еще не утверждены для применения у людей, но потенциально пригодны для вакцинной композиции согласно изобретению.
Montanide ISA-51 и Montanide ISA-720 применяются, главным образом, у людей и, следовательно, предпочтительны и представляют собой адъюванты на основе масла, которые должны вводиться как эмульсиии (смотрите ниже).
В некоторых вариантах осуществления вакцинная композиция может также содержать один или несколько дополнительных иммуностимулирующих компонентов. Они включают, без ограничения, мурамилдипептид (MDP); например N-ацетил-мурамил-L-аланил-D-изоглутамин (ala-MDP), N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нор-мурамил-L-аланил-D-изоглутамин (CGP 11637, nor-MDP) и N-ацетил-мурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1′-2′-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)- этиламин (CGP 19835A, MTP-PE), диметилглицин, тафтсин, и димиколат трегалозы, монофосфорил-липид A (MPL) и формилметионин-содержащие трипептиды, такие как N-формил-Met-Leu-Phe. Такие соединения коммерчески доступны, например, от Sigma Chemical Co. (St. Louis, MO) и RIBI ImmunoChem Research, Inc. (Hamilton, MT).
Носитель может быть представлен независимо от адъюванта. Функцией носителя может, например, быть увеличение молекулярной массы, в частности фрагментов сурвивина для усиления их активности или иммуногенности, придания стабильности, увеличения биологической активности или увеличения времени полужизни в плазме. Носителем может быть любой подходящий носитель, известный специалисту в данной области. Белком-носителем могут быть, без ограничения, гемоцианин лимфы улитки, белки плазмы, такие как трансферрин, бычий сывороточный альбумин, сывороточный альбумин человека, тироглобулин или овальбумин, иммуноглобулины или гормоны, такие как инсулин или пальмитиновая кислота. Для иммунизации людей носитель должен быть физиологически приемлемым носителем, пригодным для людей и безопасным. Впрочем, столбнячный токсоид и/или дифтерийный токсоид являются подходящими носителями в одном варианте осуществления изобретения. Альтернативно, носитель может представлять собой декстраны, например, сефарозу.
Вакцины на основе масляных эмульсий и поверхностно-активных веществ могут быть сгруппированы по составу на типы: вода в масле, масло в воде и вода в масле в воде.
Адъювант, составленный по типу масло в воде, может являться минеральным или/и неминеральным маслом и поверхностно-активным веществом/эмульгатором. Адъювант смешивается с водной антигенной композицией, предоставляя технологию приготовления вакцины.
Согласно изобретению масло может быть метаболизируемым или неметаболизируемым или смесью метаболизируемого и неметаболизируемого масел. Неминеральные масла быстро метаболизируются и выводятся из области инъекции, поэтому они вызывают очень слабый побочный эффект, однако развивающийся иммунный ответ является столь же слабым, тогда как минеральные масла только частично метаболизируются и обладают повышенным риском индуцировать нежелательные эффекты наряду с хорошим иммунным ответом.
Предпочтительно, чтобы масло было предварительно смешано с эмульгирующим веществом, таким как маннид моноолеат, перед добавлением водной фазы вакцины, и эмульгировано с использованием коллоидной мельницы или безостановочного механического или проточного ультразвукового эмульгаторов.
Более сложная двойная эмульсия (вода/масло/вода) может быть получена при повторном эмульгировании в водной фазе, содержащей небольшое количество Tween 80.
За последние несколько лет был достигнут значительный прогресс в результате применения «готовых к использованию» масляных адъювантов. Масла, содержащие, к примеру, эфиры октадециленовой кислоты и ангидроманнит, быстро образуют двойные или смешанные эмульсии (Вода/Масло/Вода), которые стабильны и при этом обладают низкой плотностью, и не требуют усложненного оборудования для эмульгирования.
В варианте осуществления предпочтительным адъювантом является адьювант для вакцины с составом типа вода в масле.
В варианте осуществления предпочтительным масляным компонентом может быть неминеральное масло. В предпочтительном варианте осуществления адъювант выбирается из группы на основе неминеральных масел Montanide ISA (неполные адъюванты производства Seppic), таких как Montanide ISA 708, Montanide ISA-720, Montanide ISA 763A, Montanide ISA 207, Montanide ISA 264, Montanide ISA 27 и Montanide ISA 35.
Альтернативно, адъювант может содержать неминеральное масло или/и минеральное масло. Так, в предпочтительном варианте осуществления адъювант выбран из группы на основе неминеральных масел или/и минеральных масел Montanide ISA (неполные адъюванты производства Seppic), такие как Montanide ISA 740, Montanide ISA 773, Montanide ISA 266, Montanide ISA 267, Montanide ISA 28, и Montanide IMS, из которых последний еще не утвержден для применения у людей.
В наиболее предпочтительном варианте осуществления масляным компонентом является минеральное масло. В предпочтительном варианте осуществления адъювант выбран из группы на основе минеральных масел Montanide ISA (неполные адъюванты производства Seppic, Belgium), такие как Montanide ISA 50, Montanide ISA-51, Montanide ISA 70, Montanide ISA 206 и Montanide ISA 51F и Montanide ISA 016D, из которых последние два еще не утверждены для применения у людей.
Структура минерального масла, например длина углеродных цепей, оказывает влияние на эффективность адъюванта, короткие цепочки вызывают сильный иммунный ответ, однако дают локальный побочный эффект, в то время как ответ с использованием длинных цепей слабее, но без значительных побочных эффектов, поэтому минеральное масло должно быть хорошо охарактеризовано и представлять сбалансированную композицию из масел с короткими и длинными углеродными цепями. Предпочтительно, чтобы минеральное масло содержало менее чем 8%, или менее чем 7%, или менее чем 6% и, что наиболее предпочтительно, менее чем 5% углеводородов с длиной цепи менее чем C14.
Предпочтительно, чтобы минеральное масло содержало ненасыщенные или ароматические углеводороды. Предпочтительно, чтобы масляный компонент имел A.P.I. плотность 32-40 или такую как 35-37 и особенно такую как 36,2-36,8.
Кроме того, предпочтительно, чтобы при 25°C минеральное масло имело относительную плотность 0,82-0,84 или 0,83-0,84. Более предпочтительно, чтобы минеральное масло при 25°C имело относительную плотность 0,834-0,838.
Предпочтительно минеральное масло с вязкостью 55-65 SSU при 37,8°C (100 F), более предпочтительно минеральное масло с вязкостью 27-61 и особенно предпочтительно, чтобы минеральное масло при 37,8°C (100 F) имело вязкость 59-61 SSU.
Предпочтительно, чтобы минеральное масло имело при 25°C коэффициент преломления 1,2-1,6, или такой как 1,3-1,6, или такой как 1,4-1,5 и наиболее предпочтительно 1,458-1,463,
Также предпочтительно, чтобы минеральное масло обладало одним или несколькими из следующих свойств:
a) лучше чем минимум в кислотном тесте,
b) является негативным для флюоресценции при 360 нм,
c) является негативным на наличие визуализированных смесей,
d) имеет минимальную ASTM точку возгорания в 295 F,
e) соответствует всем RN требованиям для светлого минерального масла и поглощения ультрафиолета.
Минеральное масло должно быть фармацевтического качества.
Drakeol 6 VR (Penreco, Texas) является минеральным маслом фармацевтического качества. Drakeol 6 VR не содержит ненасыщенных или ароматических углеводородов, и имеет A.P.I. плотность 36,2-36,8, относительную плотность при 25°C 0,834-0,838, вязкость при 37,8°C (100 F) 59-61 SSU или 10,0-10,6 сантистоксов, коэффициент преломления при 25°C 1,458-1,463, лучше чем минимум в кислотном тесте, является негативным для флюоресценции при 360 нм, является негативным на наличие визуализированных смесей, имеет ASTM температуру застывания в 0-15 F, имеет минимальную ASTM точку возгорания в 295 F и соответствовует всем RN требованиям для светлого минерального масла и поглощения ультрофиолета. Менее чем 5% минерального масла состоит из углеводородов с короткой цепью.
В наиболее предпочтительном варианте осуществления минеральным маслом является Drakeol 6 VR.
Поверхностно-активное вещество
Поверхностное напряжение адъюванта может регулироваться поверхностно-активным веществом, которое тем самым оказывает влияние на вязкость адъюванта и состав вакцины. Токсический эффект поверхностно-активного вещества коррелирует с остаточным уровнем жирных кислот, то есть необходимо поверхностно-активное вещество с низким уровнем жирных кислот. Поверхностно-активное вещество должно быть фармацевтического качества.
Адъювант согласно изобретению может содержать поверхностно-активное вещество.
В варианте осуществления адъювант составляется как водно-масляная эмульсия, содержащая минеральное масло и поверхностно-активное вещество, где адъювант содержит до 14,5% по объему указанного поверхностно-активного вещества.
Аспект по изобретению относится к вакцинной композиции, содержащей:
i. один или несколько пептидов сурвивина или вариантов пептидов сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере на 85% идентична последовательной аминокислотной последовательности SEQ ID NO:23, и
ii. адъювант, составленный как эмульсия «вода в масле», содержащая минеральное масло и поверхностно-активное вещество, где адъювант содержит до 14,5% по объему указанного поверхностно-активного вещества,
для применения в качестве лекарственного средства.
В следующем варианте осуществления адъювант содержит от 2 до 14% по объему указанного поверхностно-активного вещества, например от 5 до 14% по объему указанного поверхностно-активного вещества, например от 6 до 13% по объему указанного поверхностно-активного вещества, например от 7 до 12% по объему указанного поверхностно-активное вещество или, например от 8 до 12% по объему указанного поверхностно-активного вещества.
Предпочтительно, чтобы C18′ являлся преобладающим типом жирной кислоты в поверхностно-активном веществе, составляя от 65 до 88% композиции.
Также предпочтительно, чтобы поверхностно-активное вещество являлось маслом, таким как липидная жидкость, с максимальным кислотным числом 1.
Более того, предпочтительно, чтобы поверхностно-активное вещество имело число омыления 150-190, или такое как 160-170, или такое как 162-175, и наиболее предпочтительное число омыления 164-172.
Более того, предпочтительно, чтобы поверхностно-активное вещество имело гидроксильное число 70-120, или такое как 80-110, или такие как 80-110, 85-105, и наиболее предпочтительное гидроксильное число 89-100.
Более того, предпочтительно, чтобы поверхностно-активное вещество имело иодное число 40-100, или такое как 50-90, или такое как 60-80, или такое как 65-78, и наиболее предпочтительное иодное число 67-75.
Более того, предпочтительно, чтобы поверхностно-активное вещество имело число тяжелых металлов менее чем 40 ч/млн, или такое как 30 ч/млн, или такое как 25 ч/млн, или такое как 22 ч/млн, и наиболее предпочтительное число тяжелых металлов менее 20 ч/млн.
Более того, предпочтительно, чтобы максимальное содержание воды в поверхностно-активном веществе составляло 50%, или такое как 45%, или такое как 40%, или такое как 37%, и наиболее предпочтительное максимальное содержание воды 0,35%.
Более того, предпочтительно, чтобы поверхностно-активное вещество имело вязкость при 25°C, такую как 200-400 мПа·с, или такую как 225-375 мПа·с, или такую как 250-350 мПа·с или такую как 275-325 мПа·с, и наиболее предпочтительную вязкость при 25°C около 300 мПа·с.
В предпочтительном варианте осуществления поверхностно-активным веществом является олеат маннида, известный также как ангидроманнит октадеценоат.
Montanide 80 основывается на олеиновой кислоте (распределение различных жирных кислот), где преобладающим видом жирной кислоты является C18′, составляющий от 65 до 88% композиции. Масло представляет собой липидную жидкость с максимальным кислотным числом 1, числом омыления 164-172, гидроксильным числом 89-100, иодным числом 67-75, максимальным пероксидным числом 2, числом тяжелых металлов менее чем 20 ч/млн, максимальным содержанием воды 0,35%, максимальным числом цвета 9 и вязкостью при 25°C около 300 мПа·с.
В наиболее предпочтительном варианте осуществления адъювант содержит поверхностно-активное вещество маннид олеат, Montanide 80 (Seppic, Belgium).
В следующем предпочтительном варианте осуществления адъювант содержит минеральное масло Drakeol 6VR и поверхностно-активное вещество маннид олеат (Montanide 80).
В предпочтительном варианте осуществления адъювант содержит минеральное масло Drakeol 6VR и поверхностно-активное вещество маннид олеат, где адъювант содержит до 14,5% поверхностно-активного вещества ангидроманнит октадеценоата (Montanide 80).
В более предпочтительном варианте осуществления адъювант содержит от 2 до 14% по объему указанного поверхностно-активного вещества ангидроманнит октадеценоата, например от 5 до 14% по объему указанного поверхностно-активного вещества ангидроманнит октадеценоата, например от 6 до 13% по объему указанного поверхностно-активного вещества ангидроманнит октадеценоата, например от 7 до 12% по объему указанного поверхностно-активного вещества ангидроманнит октадеценоат или, например, от 8 до 12% по объему указанного поверхностно-активного вещества ангидроманнит октадеценоата.
В варианте осуществления адъюванты представляют собой прозрачную желтую жидкость с плотностью при 20°C около 0,7-1,0 или 0,8-0,9 или предпочтительно, 0,85.
В варианте осуществления адъювант имеет вязкость при 20°C меньше чем 500 мПа·с, например меньше чем 250 мПа·с или, например, 25-150 мПа·с или предпочтительно около 150 мПа·с.
В варианте осуществления адъювант имеет максимальное кислотное число 0,5.
В варианте осуществления адъювант имеет число омыления 10-40, такое как 12-30, такое как 14-25 или предпочтительно 16-20.
В варианте осуществления адъювант имеет гидроксильное число 5-20, или такое как 6-18, или такое как 7-15, или предпочтительно 9-13.
В варианте осуществления адъювант имеет максимальное пероксидное число 5, или 4, или 3, или предпочтительно 2.
В варианте осуществления адъювант имеет иодное число 1-20, такое как 2-15, такое как 3-12 или предпочтительно такое как 5-9.
В варианте осуществления адъювант имеет максимальное содержание воды 2%, такое как 1,5%, такое как 1% или такое как предпочтительно, 0,5%.
В варианте осуществления адъювант имеет коэффициент преломления при 25°C между 1,450 и 1,470, или между 1,455 и 1,465, или предпочтительно между 1,461-1,463.
В варианте осуществления удельная электрическая проводимость 50:50 смеси адъюванта и солевого раствора составляет меньше чем 20 мкс·см-1, 15 мкс·см-1, 12 мкс·см-1 или предпочтительно меньше чем 10 мкс·см-1.
Montanide ISA 51 содержит маннид олеат (Montanide 80) в растворе минерального масла (Drakeol 6 VR). Montanide ISA 51 содержит от 8 до 12% ангидроманнит октадеценоата и от 88 до 92% минерального масла. Montanide ISA 51 представляет собой прозрачную желтую жидкость с плотностью при 20°C около 0,85 и вязкостью при 20°C около 50 мПа·с. Montanide ISA 51 характеризуется максимальным кислотным числом 0,5, числом омыления 16-20, гидроксильным числом 9-13, максимальным пероксидным числом 2, иодным числом 5-9, максимальным содержанием воды 0,5 процента, коэффициентом преломления при 25°C между 1,455 и 1,465 или предпочтительно между 1,461-1,463. Удельная электрическая проводимость 50:50 смеси адъюванта и солевого раствора составляет меньше чем 10 мкс·см-1.
В более предпочтительном варианте осуществления адъювантом является неполный адъювант Montanide производства Seppic.
В наиболее предпочтительном варианте осуществления вакцинная композиция содержит:
i) один или несколько пептидов сурвивина или вариантов пептидов сурвивина, где последовательность варианта пептида, по всей длине, по меньшей мере на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23, и
ii) адъювант, составленный как эмульсия «вода в масле», содержащая минеральное масло и поверхностно-активное вещество, где адъювант содержит до 14,5% по объему указанного поверхностно-активного вещества, где адъювантом является Montanide ISA 51.
Пептиды или варианты пептидов сурвивина
Идеальными мишенями для иммунотерапии являются продукты генов, молчащих в нормальных тканях, сверхэкспрессирующихся в раковых клетках и от которых непосредственно зависит выживание и развитие клеток опухоли. Сурвивин потенциально соответствует этим параметрам, поскольку он вовлечен в регуляцию клеточного деления и, помимо этого, супрессирует апоптоз. Следовательно, сурвивин предохраняет клетки от физиологической смерти и, таким образом, удлиняет продолжительность жизни клетки.
Сурвивин представляет собой белок цитоплазмы массой 16,5 кДа, содержащий единственный BIR и сильнозаряженный С-концевой скрученный участок на месте RING пальца. Длина кодирующей области составляет 429 нуклеотидов (SEQ ID NO: 22), включая стоп-кодон, и длина кодируемого белка сурвивина составляет 142 аминокислоты (SEQ ID NO: 23).
Настоящее изобретение относится к вакцинной композиции, содержащей один или несколько пептидов сурвивина или вариантов пептидов сурвивина.
В варианте осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина включает полипептид сурвивина (SEQ ID NO: 23), состоящий из 142 аминокислотных остатков.
Предпочтительно один или несколько пептидов сурвивина или вариантов пептидов сурвивина содержат, по меньшей мере, 5 аминокислотных остатков, и, более предпочтительно он содержит по меньшей мере 7 аминокислотных остатков, по меньшей мере 8 аминокислотных остатков, по меньшей мере 9 аминокислотных остатков, по меньшей мере 10 аминокислотных остатков, по меньшей мере 11 аминокислотных остатков, по меньшей мере 12 аминокислотных остатков, по меньшей мере 14 аминокислотных остатков, по меньшей мере 16 аминокислотных остатков, по меньшей мере 18 аминокислотных остатков или по меньшей мере 20 аминокислотных остатков.
В варианте осуществления также предпочтительно, чтобы один или несколько пептидов сурвивина или вариантов пептидов сурвивина состояли из максимально 142 аминокислотных остатков, или, например, из максимально 120 аминокислотных остатков, или, например, из максимально 100 аминокислотных остатков и предпочтительно из максимально 80 аминокислотных остатков, или, например, из максимально 50 аминокислотных остатков и более предпочтительно состояли из максимально 20 аминокислотных остатков, например из максимально 18, например из максимально 16, например из максимально 14, например из максимально 12, например из максимально 11, например из максимально 10 аминокислотных остатков.
В варианте осуществления вакцинная композиция содержит один или несколько пептидов или пептидных вариантов, состоящих из не менее 5 аминокислотных остатков и из максимально 20 последовательных аминокислотных остатков SEQ ID NO: 23.
В варианте осуществления также предпочтительно, чтобы один или несколько пептидов сурвивина или вариантов пептидов сурвивина состояли из максимально 142 последовательных аминокислотных остатков SEQ ID NO 23 или, например, из максимально 120 последовательных аминокислотных остатков, или, например, из максимально 100 последовательных аминокислотных остатков и предпочтительно из максимально 80 последовательных аминокислотных остатков или, например, из максимально 50 последовательных аминокислотных остатков и более предпочтительно состояли из максимально 20 последовательных аминокислотных остатков, например из максимально 18 последовательных аминокислот, например из максимально 16 последовательных аминокислот, например из максимально 14 последовательных аминокислот, например, из максимально 12 последовательных аминокислот, например из максимально 11 последовательных аминокислот, например из максимально 10 последовательных аминокислотных остатков SEQ ID NO 23.
В конкретном варианте осуществления пептид содержит гептапептид, октопептид, нонапептид, декапептид или ундекапептид, состоящий, соответственно из 7, 8, 9, 10, 11 последующих аминокислотных остатков SEQ ID NO: 23.
Настоящее изобретение также охватывает варианты и функциональные эквиваленты пептидов сурвивина, как показано в настоящем описании. Термин «функциональные эквиваленты», который используется в представленном контексте, установлен посредством ссылки на соответствующую функциональность заданного фрагмента рассматриваемой последовательности. Функциональная эквивалентность может быть установлена, например, на основании сходства аффинностей связывания с молекулами HLA Класса I, или по сходству эффективностей, обнаруженных в тесте ELISPOT.
Под функциональными эквивалентами или вариантами пептидных производных сурвивина, как описано в настоящем описании, следует представление аминокислотных последовательностей, немного отличающихся от предпочтительных заданных последовательностей числом и границами вставок, делеций и замен, включая консервативные замены. Это различие может быть оценено как уменьшение идентичности между предпочтительной заданной последовательностью и вариантом производного сурвивина или функциональным эквивалентом производного сурвивина.
Идентичность между аминокислотными последовательностями может быть вычислена с использованием алгоритмов, хорошо известных в данной области. Фрагменты, имеющие гомологию с фрагментами, содержащими или состоящими из последующих полученных из сурвивина аминокислотных остатков, подлежат рассмотрению как попадающие в рамки настоящего изобретения, если они предпочтительно по всей длине, например, минимум на 75% идентичны, например минимум на 80% идентичны, например минимум 85% идентичны, например минимум на 88% идентичны, минимум на 90% идентичны, например, минимум на 94% идентичны, включая 95%, 96%, 97%, 98% или 99% идентичных с заданным полученным из сурвивина пептидом.
Вакцинная композиция согласно изобретению содержит один или несколько пептидов сурвивина или вариантов пептидов сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23.
Примером варианта пептида согласно изобретению является пептид LLLGEFLKL (сурвивин96-104L2,) (SEQ ID NO: 4), где пептидный вариант на 8/9 *100% (89%) идентичен последовательности сурвивина «LTLGEFLKL».
Использованное выше обозначение для описания пептидных вариантов применяется повсюду в настоящей заявке: Буква, за которой следует номер, например L2, указывает на вариант аминокислоты (L), которая заменяет аминокислоту, расположенную в положении 2 данного пептида. Данный пептид обозначается либо одним номером, означающим номер первой аминокислоты пептида по отношению к последовательности полноразмерного сурвивина (сурвивин96 или Sur96 начинается с остатка номер 96 сурвивина), либо двумя номерами, где второй номер дает положение концевого остатка пептида по отношению к сурвивину.
Пептидные варианты могут быть производными от известной последовательности сурвивина, например последовательность, сообщенная в US 6245523 (в настоящем описании SEQ ID NO: 23). Выбор пептидов, потенциально обладающих способностью связываться с конкретной молекулой HLA, может проводиться с использованием совмещения известной последовательности, которая связывается с данной конкретной молекулой HLA, для выявления преобладания нескольких аминокислот в определенных положениях в пептидах. Такие предоминантные аминокислотные остатки также именуются в настоящем описании как «якорные остатки» или «мотивы якорных остатков». Следуя такой относительно простой процедуре, основанной на информации об известной последовательности, которая может быть получена из доступных баз данных, из молекулы белка сурвивина можно получить пептиды, которые, возможно, связываются с конкретной молекулой HLA. Характерные примеры таких анализов для ряда молекул HLA представлены ниже в таблице 2:
| Таблица 2 |
| Использованные первичные мотивы якорных остатков |
| HLA-аллель |
Положение 1 |
Положение 2 |
Положение 3 |
Положение 5 |
Положение 6 |
Положение 7 |
C-концевой |
| HLA-A1 |
 |
T, S |
D, E |
 |
 |
L |
Y |
| HLA-A2 |
 |
L, M |
 |
 |
V |
 |
L, V |
| HLA-A3 |
 |
L, V, M |
F, Y |
 |
 |
 |
K, Y, F |
| HLA-A11 |
 |
V, I, F, Y |
M, L, F, Y |
 |
 |
 |
K, R |
| HLA-A23 |
 |
I, Y |
 |
 |
 |
 |
W, I |
| HLA-A24 |
 |
Y |
 |
I, V |
F |
 |
I, L, F |
| HLA-A25 |
 |
M, A, T |
I |
 |
 |
 |
W |
| HLA-A26 |
E, D |
V, T, I, L, F |
 |
 |
I, L, V |
 |
Y, F |
| HLA-A28 |
E, D |
V, A, L |
 |
 |
 |
 |
A, R |
| HLA-A29 |
 |
E |
 |
 |
 |
 |
Y, L |
| HLA-A30 |
 |
Y, L, F, V |
 |
 |
 |
 |
Y |
| HLA-A31 |
 |
 |
L, M, F, Y |
 |
 |
 |
R |
| HLA-A32 |
 |
I, L |
 |
 |
 |
 |
W |
| HLA-A33 |
 |
Y, I, L, V |
 |
 |
 |
 |
R |
| HLA-A34 |
 |
V, L |
 |
 |
 |
 |
R |
| HLA-A66 |
E, D |
T, V |
 |
 |
 |
 |
R, K |
| HLA-A68 |
E, D |
T, V |
 |
 |
 |
 |
R, K |
| HLA-A69 |
 |
V, T, A |
 |
 |
 |
 |
V, L |
| HLA-A74 |
 |
T |
 |
 |
 |
 |
V, L |
| HLA-B5 |
 |
A, P |
F, Y |
 |
 |
 |
I, L |
| HLA-B7 |
 |
P |
 |
 |
 |
 |
L, F |
| HLA-B8 |
 |
 |
K |
K, R |
 |
 |
L |
| HLA-B14 |
 |
R, K |
 |
 |
 |
 |
L, V |
| HLA-B15 (B62) |
 |
Q, L, K, P, H, V, I, M, S, T |
 |
 |
 |
 |
F, Y, W |
| HLA-B17 |
 |
 |
 |
 |
 |
 |
L, V |
| HLA-B27 |
 |
R |
 |
 |
 |
 |
Y, K, F, L |
| HLA-B35 |
 |
P |
 |
 |
 |
 |
I, L, M, Y |
| HLA-B37 |
 |
D, E |
 |
 |
 |
 |
I, L, M |
| HLA-B38 |
 |
H |
D, E |
 |
 |
 |
F, L |
| HLA-B39 |
 |
R, H |
 |
 |
 |
 |
L, F |
| HLA-B40 (B60, 61) |
 |
E |
F, I, V |
 |
 |
 |
L, V, A, W, M, T, R |
| HLA-B42 |
 |
L, P |
 |
 |
 |
 |
Y, L |
| HLA-B44 |
 |
E |
 |
 |
 |
 |
F, Y, W |
| HLA-B46 |
 |
M, I, L, V |
 |
 |
 |
 |
Y, F |
| HLA-B48 |
 |
Q, K |
 |
 |
 |
 |
L |
| HLA-B51 |
 |
A, P, G |
 |
 |
 |
 |
F, Y, I, V |
| HLA-B52 |
 |
Q |
F, Y |
 |
 |
 |
I, V |
| HLA-B53 |
 |
P |
 |
 |
 |
 |
W, F, L |
| HLA-B54 |
 |
P |
 |
 |
 |
 |
 |
| HLA-B55 |
 |
P |
 |
 |
 |
 |
A, V |
| HLA-B56 |
 |
P |
 |
 |
 |
 |
A, V |
| HLA-B57 |
 |
A, T, S |
 |
 |
 |
 |
F, W, Y |
| HLA-B58 |
 |
A, T, S |
 |
 |
 |
 |
F, W, Y |
| HLA-B67 |
 |
P |
 |
 |
 |
 |
L |
| HLA-B73 |
 |
R |
 |
 |
 |
 |
P |
| HLA-Cw1 |
 |
A, L |
 |
 |
 |
 |
L |
| HLA-Cw2 |
 |
A, L |
 |
 |
 |
 |
F, Y |
| HLA-Cw3 |
 |
A, L |
 |
 |
 |
 |
L, M |
| HLA-Cw4 |
 |
Y, P, F |
 |
 |
 |
 |
L, M, F, Y |
| HLA-Cw6 |
 |
 |
 |
 |
 |
 |
L, I, V, Y |
| HLA-Cw6 |
 |
Y |
 |
 |
 |
 |
L, Y, F |
| HLA-Cw8 |
 |
Y |
 |
 |
 |
 |
L, I |
| HLA-Cw16 |
 |
A, L |
 |
 |
 |
 |
L, V |
Таким образом, в качестве примера нонапептиды, потенциально обладающие способностью связываться с HLA-A1, должны иметь одну из следующих последовательностей: Xaa-T-D-Xaa-Xaa-Xaa-L-Xaa-Y, Xaa-T-E-Xaa-Xaa-Xaa-L-Xaa-Y, Xaa-S-D-Xaa-Xaa-Xaa-L-Xaa-Y или Xaa-S-E-Xaa-Xaa-Xaa-L-Xaa-Y (Xaa означает любой аминокислотный остаток). Аналогичным образом могут быть обозначены последовательности, обладающие способностью связываться с любыми другими молекулами HLA.
Следует принять во внимание, что любой специалист в данной области сможет идентифицировать дополнительные «мотивы якорных остатков» для данной молекулы HLA.
Таким образом, согласно изобретению пептидные варианты включают пептиды, содержащие последовательность, включающую любые аминокислотные остатки, перечисленные в таблице 2 для каждой конкретной HLA.
Альтернативно, различия могут быть измерены непосредственно путем сравнения числа замен в пептиде по сравнению с последовательной аминокислотной последовательностью сурвивина. Таким образом, в варианте осуществления, вакцина включает вариант пептида сурвивина, состоящий из 7-20 последовательных аминокислот, содержащий одну или две аминокислотные замены по сравнению с последовательной аминокислотной последовательностью SEQ ID NO: 23. В более предпочтительном варианте осуществления вакцинная композиция содержит вариант пептида сурвивина, состоящий из 7-12 последовательных аминокислот, содержащий одну аминокислотную замену по сравнению с последовательной аминокислотной последовательностью SEQ ID NO: 23.
Расщелина связывания молекул MHC Класса 1 точно соответствует пептидам, состоящим из 9 или 10 аминокислот. В более предпочтительном варианте осуществления вакцинная композиция содержит один или несколько пептидов сурвивина или вариантов пептидов сурвивина, состоящих из 9 или 10 аминокислотных остатков.
На основании последовательности выбранного белка сурвивина можно получить один или несколько пептидов сурвивина или вариантов пептидов сурвивина, используя соответствующие химическую или ферментативную обработки исходного вещества сурвинина, или он может быть синтезирован с использованием стандартной технологии пептидного синтеза, с которой хорошо знаком любой специалист в данной области.
Пептид по изобретению может иметь последовательность, которая представляет собой нативную последовательность белка сурвивина, из которого он получен. При этом пептиды, обладающие повышенной аффинностью к любой данной HLA, могут быть получены из такой нативной последовательности при помощи модификации последовательности замещением, делетированием или добавлением, по меньшей мере, одного аминокислотного остатка, например, с использованием описанных выше методик, в результате чего идентифицируются мотивы якорных остатков в отношении данной молекулы HLA (смотрите таблицу 2).
Таким образом, в варианте осуществления вакцинная композиция содержит один или несколько пептидов или вариантов пептидов сурвивина, где последовательность варианта пептида(ов) сурвивина может быть получена из нативной последовательности замещением, делетированием или добавлением, по меньшей мере, одного аминокислотного остатка, в результате чего образуется пептид с мотивами якорных остатков для данной молекулы HLA.
Следовательно, для увеличения иммуногенности полученных из сурвивина пептидов можно проводить аминокислотные замены в якорных участках, но не среди остатков в области TCR контакта, с целью усиления пептидного связывания с молекулой HLA Класса I. Это приводит к получению более иммуногенных эпитопов, например, с увеличенной способностью индуцировать активируемые раком CTL и которые оказываются более подходящими для индукции клинически значимых CTL ответы. При этом важно, что раковые клетки-мишени только экспрессируют и представляют на поверхности клетки пептиды, образованные из нативного сурвивина. В этом отношении принципиально важно, что индуцируемые при терапии CTL, специфичные для модифицированных пептидов-производных сурвивина, дают перекрестную реакцию с нативными аналогами.
В варианте осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются рестриктированным(ми), по меньшей мере, одной из молекул MHC Класса I, выбранной из группы: HLA-A1, HLA-A2, HLA-A3, HLA-A11, HLA-A23, HLA-A24, HLA-A25, HLA-A26, HLA-A28, HLA-A29, HLA-A30, HLA-A31, HLA-A32, HLA-A33, HLA-A34, HLA-A66, HLA-A68, HLA-A69, HLA-A74, HLA-B5, HLA-B7, HLA-B8, HLA-B14, HLA-B15 B62), HLA- B17, HLA-B27, HLA-B35, HLA-B37, HLA-B38, HLA-B39, HLA-B40 (B60,61), HLA-B42, HLA-B44, HLA-B46, HLA-B48, HLA-B51, HLA-B52, HLA-B53, HLA-B54, HLA-B55, HLA-B56, HLA-B57, HLA-B58, HLA-B67, HLA-B73, HLA-Cw1 HLA-Cw2, HLA-Cw3, HLA-CW4, HLA-Cw6, HLA-Cw6.
Так, в сходном следующем варианте осуществления один или несколько пептид(ов) является/являются рестриктированным(ми), по меньшей мере, одной из молекул MHC Класса I, выбранной из группы: HLA-A1, HLA-A2, HLA-A3, HLA-A11, HLA-A24, HLA-B7, HLA-B35, HLA-B44, HLA-B8, HLA-B15, HLA-B27 и HLA-B51, HLA-Cw1, HLA-Cw2, HLA-Cw3, HLA-Cw4, HLA-Cw5, HLA-Cw6, HLA-Cw7 и HLA-Cw16.
В конкретном предпочтительном варианте осуществления один или несколько пептид(ов) является/являются рестриктированным(ми), по меньшей мере, одной из молекул MHC Класса I, выбранной из группы: HLA-A1, HLA-A2, HLA-B7 и HLA-B35.
Вакцина согласно изобретению может содержать два или более пептидов с той же тканевой специфичностью, равно как и эффективность индивидуальных пептидов может варьировать у разных индивидуумов. Так, в варианте осуществления два или более пептидов сурвивина или вариантов пептидов сурвивина являются рестриктированными HLA молекулой MHC Класса I, выбранной из группы: HLA-A1, HLA-A2, HLA-A3, HLA-A11, HLA-A23, HLA-A24, HLA-A25, HLA-A26, HLA-A28, HLA-A29, HLA-A30, HLA-A31, HLA-A32, HLA-A33, HLA-A34, HLA-A66, HLA-A68, HLA-A69, HLA-A74, HLA-B5, HLA-B7, HLA-B8, HLA-B14, HLA-B15 (B62), HLA-B17, HLA-B27, HLA-B35, HLA-B37, HLA-B38, HLA-B39, HLA-B40 (B60,61), HLA-B42, HLA-B44, HLA-B46, HLA-B48, HLA-B51, HLA-B52, HLA-B53, HLA-B54, HLA-B55, HLA-B56, HLA-B57, HLA-B58, HLA-B67, HLA-B73, HLA-Cw1 HLA-Cw2, HLA-Cw3, HLA-Cw4, HLA-Cw6, HLA-Cw6.
В следующем вариант осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются рестриктированным(ми), по меньшей мере, одной из молекул HLA-A MHC Класса I, выбранной из группы: HLA-A1, HLA-A2, HLA-A3, HLA-A9, HLA-A 10, HLA-A 11, HLR-Aw 19, HLA-A23 (9), HLA-A24 (9), HLA-A25 (10), HLA-A26(10), HLA-A28, HLA-A29(w19),HLA-A30 (w19), HLA-A31 (w19), HLA-A32 (wl9), HLA-Aw33(w19), HLA-Aw34(10), HLA-Aw36, HLA-Aw43, HLA-Aw66 (10), HLA-Aw68(28), HLA-A69 (28). Повсеместно в литературе также используются более простые определения, где применяются только первоначальные цифровые обозначения, например HLA-A19 или HLA-A24 вместо HLA-Awl9 и HLA-A24 (9) соответственно. В конкретном варианте осуществления, один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются рестриктированным(ми) видами HLA MHC Класса I, выбранными из группы, состоящей из: HLA-A1, HLA-A2, HLA-A3, HLA-A11 и HLA-A24.
В конкретном варианте осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются рестриктированным(ми) HLA-A1.
В конкретных вариантах осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются HLA-A1-рестриктированным(ми) пептидом(ами), имеющим(ими) последовательность, выбранную из следующей группы: MAEAGFIHY (SEQ ID NO: 17) (сурвивин38-46Y9; сурвивин38-46 с «Y» вместо «C» в положении 9), PTENEPDLAY (SEQ ID NO: 18) (сурвивин47-56Y10; сурвивин47-56 с «Y» вместо «Q» в положении 10), QFEELTLGEF (SEQ ID NO: 15) (сурвивин92-101) и FTELTLGEF (SEQ ID NO: 16) (сурвивин93-101T2; сурвивин93-101 с «T» вместо «E» в положении 2). Обозначения в скобках показывают положения остатков в белке сурвивине, как сообщено в US 6245523, и аминокислотную замену в пептиде.
В конкретном варианте осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются рестриктированным(ми) HLA-A2.
В следующих конкретных вариантах осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются HLA-A2-рестриктированным(ми) пептидом-производным сурвивина, имеющим последовательность, выбранную из следующих: FLKLDRERA (сурвивин101-109) (SEQ ID NO: 1), TLPPAWQPFL(сурвивин5-14) (SEQ ID NO: 2), ELTLGEFLKL(сурвивин95-104) (SEQ ID NO: 3), LLLGEFLKL (сурвивин96-104L2; сурвивин96-104 с заменой «T» на «L» в положении 2) (SEQ ID NO: 4) и LMLGEFLKL сурвивин96-104M2 (сурвивин96-104 с заменой «T» на «M» в положении 2 (SEQ ID NO: 5).
Один или несколько пептидов сурвивина или вариантов пептидов сурвивина может также быть HLA-A3-рестриктированным пептидом, таким как RISTFKNWPK (Sur18K10) Сурвивин18-27 с заменой «F» на «K» в положении 10, (SEQ ID NO: 20) и/или HLA-A11-рестриктированными пептидами, такими как DLAQCFFCFK (сурвивин53-62) (SEQ ID NO: 19), DVAQCFFCFK (Sur53/V2) (SEQ ID NO: 45), DFAQCFFCFK (Sur53/F2) (SEQ ID NO: 46), DIAQCFFCFK (Sur53/I2) (SEQ ID NO: 47), и/или HLA-A2-рестриктированным пептидом, таким как RISTFKNWPFL (сурвивин 18-28) (SEQ ID NO: 21), и/или HLA-A24-рестриктированными пептидами, такими как STFKNWPFL (Sur20-28) (SEQ ID NO: 41), или с заменой «T» на «Y» в положении 2: SYFKNWPFL (Sur20-28/Y2) (SEQ ID NO: 48).
В сходных следующих вариантах осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются рестриктированным(ми) молекулой HLA-B MHC Класса I, включающей любые из следующих: HLA-B5, HLA-B7, HLA-B8, HLA-B12, HLA-B13, HLA-B14, HLA-B15, HLA-B16, HLA-B17, HLA-B118, HLA-B21, HLA-Bw22, HLA-B27, HLA-B35, HLA-B37, HLA-B38, HLA-B39, HLA-B40, HLA-Bw41, HLA-Bw42, HLA-B44, HLA-B45, HLA-Bw46 и HLA-Bw47. В конкретных вариантах осуществления виды HLA-B MHC Класса I, с которыми один или несколько пептидов сурвивина или вариантов пептидов сурвивина способен/способны связываться, выбраны из группы: HLA-B7, HLA-B8, HLA-B15, HLA-B27, HLA-B35, HLA-B44, HLA-B51 и HLA-B58.
В более предпочтительном варианте осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются рестриктированным(ми) HLA-B7 или HLA-B35.
В конкретном варианте осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются рестриктированным(ми) HLA-B7.
В следующих конкретных вариантах осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются HLA-B7-связывающим(ми) пептидом(ами)-производным(ми) сурвивина, имеющим(ми) последовательность, выбранную из следующих: LPPAWQPFL (сурвивин6-14) (SEQ ID NO: 10), QPFLKDHRI (сурвивин11-19) (SEQ ID NO: 11), CPTENEPDL (сурвивин51-59) (SEQ ID NO: 6), TPERMAEAGF (сурвивин34-43) (SEQ ID NO: 12), APPAWQPFL (сурвивин6-14А1) (SEQ ID NO: 13), RPPAWQPFL (сурвивин6-14R1) (SEQ ID NO: 14), RAIEQLAAM (Sur133-141) (SEQ ID NO: 44), TAKKVRRAI (Sur127-135) (SEQ ID NO: 49), RPIEQLAAM (Sur133P2) (SEQ ID NO: 50) или TPKKVRRAI (Sur127P2) (SEQ ID NO: 51). APPAWQPFL (SEQ ID NO: 13) является последовательностью, полученной из сурвивина6-14 заменой «L» в положение 1 пептида на «А», и RPPAWQPFL (SEQ ID NO: 14) получена из сурвивина6-14 заменой «L» в положение 1 пептида на «R».
В конкретном варианте осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются рестриктированным(ми) HLA-B35.
В следующих конкретных вариантах осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются HLA-B35-рестриктированным(ми) пептидом(ами)-производным(ми) сурвивина, имеющим(ми) последовательность, выбранную из следующих: CPTENEPDL (сурвивин46-54) (SEQ ID NO: 6), EPDLAQCFF(сурвивин51-59) (SEQ ID NO: 7), CPTENEPDY (сурвивин46-54Y9) (SEQ ID NO: 8) и EPDLAQCFY (сурвивин51-59Y9) (SEQ ID NO: 9). Обозначения в скобках показывают положения остатков в белке сурвивине, как сообщено в US 6245523. CPTENEPDY (SEQ ID NO: 8) является последовательностью, полученной из сурвивина46-54 заменой «L» в С-конце пептида на «Y», и EPDLAQCFY (SEQ ID NO: 9) получена из сурвивина51-59 заменой остатка «F» в С-конце пептида на «Y».
В конкретном варианте осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются рестриктированным(ми) HLA-B51. В частности, пептид сурвивина является HLA-B51-рестриктированным пептидом-производным сурвивина, имеющим последовательность: RAIEQLAAM (Sur133-141) (SEQ ID NO: 44). Этот пептид является также HLA-B7-рестриктированным.
В конкретном варианте осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются рестриктированным(ми) HLA-B27.
В следующих конкретных вариантах осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются HLA-B27-рестриктированным(ми) пептидом(ами)-производным(ми) сурвивина, имеющим(ми) последовательность, выбранную из следующих: ERMAEAGFI (Sur36-44) (SEQ ID NO: 43), ERAKNKIAK (Sur107-115) (SEQ ID NO: 52), DRERAKNKI (Sur105-113) (SEQ ID NO: 53), KEFEETAKK (Sur122-130) (SEQ ID NO: 54), ERMAEAGFL (Sur36/L9) (SEQ ID NO: 55), ERMAEAGFF (Sur36/F9) (SEQ ID NO: 56), ERMAEAGFR (Sur36/R9) (SEQ ID NO: 57), ERMAEAGFK (Sur36/K9) (SEQ ID NO: 58) или KRFEETAKK (Sur122/R2) (SEQ ID NO: 59).
В конкретном варианте осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются рестриктированным(ми) HLA-B44.
В следующих конкретных вариантах осуществления, один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются HLA-B44-рестриктированным(ми) пептидом(ами)-производным(ми) сурвивина, имеющим(ми) последовательность, выбранную из следующих: KETNNKKKEY (Sur115Y10) (SEQ ID NO: 42), KETNNKKKEF (Sur115-124) (SEQ ID NO: 60), EELTLGEFL (Sur94-102) (SEQ ID NO: 61) или EELTLGEFY (Sur94Y9) (SEQ ID NO: 62).
В конкретном варианте осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются рестриктированным(ми) HLA-B8.
В следующих конкретных вариантах осуществления, один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются HLA-B8-рестриктированным(ми) пептидом(ими)-производным(ми) сурвивина, имеющим(ми) последовательность, выбранную из следующих: ISTFKNWPFL (Sur19-28) (SEQ ID NO: 63), ISKFKNWPFL (Sur19/K3) (SEQ ID NO: 64), LSVKKQFEEL (Sur87-96) (SEQ ID NO: 65), LSKKKQFEEL (Sur87/K3) (SEQ ID NO: 66), RAKNKIAKET (Sur108-117) (SEQ ID NO: 67), RAKNKIAKEL (Sur108/L10) (SEQ ID NO: 68), NNKKKEFEET (Sur118) (SEQ ID NO: 69), NNKKKEFEEL (Sur118/L10) (SEQ ID NO: 70), QPKLKDHRI (Sur11/K3) (SEQ ID NO: 71), FLKDHRIST (Sur13) (SEQ ID NO: 72), FLKDKRIST (Sur13/K5) (SEQ ID NO: 73), FLKDHRISL (Sur13/L9) (SEQ ID NO: 74), AFLSVKKQF (Sur85) (SEQ ID NO: 75), AFLSVKKQF (Sur85/K3) (SEQ ID NO: 76), AFLSKKKQF (Sur85/K5) (SEQ ID NO: 77), AFLSVKKQL (Sur85/L9) (SEQ ID NO: 78), FLSVKKQFE (Sur86) (SEQ ID NO: 79), FLSVKKQFL (Sur86/L9) (SEQ ID NO: 80), FLKVKKQFE (Sur86/K3) (SEQ ID NO: 81), SVKKQFEEL (Sur88) (SEQ ID NO: 82), SVKKKFEEL (Sur88/K5) (SEQ ID NO: 83), FLKLKRERA (Sur101/K5) (SEQ ID NO: 84), FLKLDRERL (Sur101/L9) (SEQ ID NO: 85), TAKKKRRAI (Sur127/K5) (SEQ ID NO: 86) или TAKKVRRAL (Sur127/L9) (SEQ ID NO: 87), или TAKKVRRAI (Sur127) (SEQ ID NO: 49), FLKLDRERA (Sur101) (SEQ ID NO: 1) или QPFLKDHRI (Sur11) (SEQ ID NO: 11).
В конкретном варианте осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются рестриктированным(ми) HLA-B15.
В следующих конкретных вариантах осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются HLA-B15-рестриктированным(ми) пептидом(ами)-производным(ми) сурвивина, имеющим последовательность, выбранную из следующих: TLPPAWQPF (Sur5) (SEQ ID NO: 88), TLPPAWQPY (Sur5/Y9) (SEQ ID NO: 89), WQPFLKDHRI (Sur10) (SEQ ID NO: 90), WQPFLKDHRY (Sur10/Y9) (SEQ ID NO: 91), FLKDHRISTF (Sur13) (SEQ ID NO: 92), FLKDHRISTY (Sur13/Y9) (SEQ ID NO: 93), RISTFKNWPF (Sur18) (SEQ ID NO: 94), RLSTFKNWPF (Sur18/L2) (SEQ ID NO: 95), DLAQCFFCF (Sur53) (SEQ ID NO: 96), DLAQCFFCY (Sur53/Y9) (SEQ ID NO: 97), ISTFKNWPF (Sur19) (SEQ ID NO: 98), IQTFKNWPF (Su19/Q2) (SEQ ID NO: 99), ILTFKNWPF (Sur19/L2) (SEQ ID NO: 100), RMAEAGFIY (Sur37/Y9) (SEQ ID NO: 101), RMAEAGFIF (Sur37/F9) (SEQ ID NO: 102), RLAEAGFIY (Sur37/L2Y9) (SEQ ID NO: 103), KKHSSGCAF (Sur78) (SEQ ID NO: 104), KQHSSGCAF (Sur78/Q2) (SEQ ID NO: 105), KLHSSGCAF (Sur78/L2) (SEQ ID NO: 106), RAIEQLAAY (Sur133/Y9) (SEQ ID NO: 107) или RLIEQLAAM (Sur133/L2) (SEQ ID NO: 108) или RAIEQLAAM (Sur133) (SEQ ID NO: 44).
В конкретном варианте осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются рестриктированным(ми) HLA-B58.
В следующих конкретных вариантах осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются HLA-B58-рестриктированным(ми) пептидом(ами)-производным(ми) сурвивина, имеющим(ми) последовательность, выбранную из: PTLPPAWQPF Sur5 (SEQ ID NO: 109), CTPERMAEAGF (Sur33) (SEQ ID NO: 110), ETNNKKKEF (Sur116) (SEQ ID NO: 111), ISTFKNWPF (Sur19) (SEQ ID NO: 98), GAPTLPPAW (Sur2) (SEQ ID NO: 112) или CAFLSVKKQF (Sur84) (SEQ ID NO: 113).
В следующих полезных вариантах осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются пептидом(ами), рестриктированным(ми) молекулами HLA-C MHC Класса I, выбранными из группы: HLA-Cw1, HLA-Cw2, HLA-Cw3, HLA-Cw4, HLA-Cw5, HLA-Cw6, HLA-Cw7 и HLA-Cw16.
Более того, это может быть полезным для проведения посттрансляционных модификаций пептидов по изобретению.
Так, в варианте осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина является/являются пептидом(ами), содержащим(ми) один или несколько посттрансляционных модификаций.
Пептиды могут заключать в себе любые типы модификаций. К настоящему времени было идентифицированно около 200 структурно различных ковалентных модификаций, различающихся по размеру и сложности, от преобразования амидов и карбоновых кислот, до присоединения множественных сложных олигосахаридов. Такие модификации включают фосфорилирование, ацетилирование, убиквитинирование, липидацию (ацетилирование, пренилирование, фарнезилирование, геранилирование, пальмитилирование, миристилирование), метилирование, карбоксилирование, сульфатирование и O- или N-гликозилирование.
Было показано, что выдерживание клеток карциномы молочной железы MCF-7 или цевикальной карциномы HeLa с антираковыми агентами, включая Адриамицин, Таксол или UVB, приводит к 4-5-кратному возрастанию экспрессии сурвивина. Изменение уровня сурвивина после противоракового лечения не было связано с регуляцией экспрессии мРНК сурвивина и не зависело от транскрипции гена de novo. Напротив, ингибирование фосфорилирования Thr34 сурвивина ингибитором циклин-зависимой киназы флавопиридолом приводило к потере экспрессии сурвивина, и нефосфорилируемый мутант сурвивина (замена Thr34 на Ala) быстрее деградировал по сравнению с сурвивином дикого типа. Последующее нарушение фосфорилирования сурвивина по Thr34 приводило к апоптозу опухолевых клеток, который индуцировался антираковыми агентами независимо от p53, и супрессировало рост опухоли без токсичности на модели ксенотрансплантанта рака молочной железы in vivo. Эти результаты позволяют предположить, что фосфорилирование Thr34 существенно для регуляции уровня сурвивина в клетках опухоли и что последующее нарушение активности p34 киназы может сместить связанную с сурвивином контрольную точку жизнеспособности и усилить апоптоз у опухолевых клеток.
Таким образом, предполагается, что сурвивин и пептиды-производные сурвивина по изобретению включают фосфорилированные пептиды. Антигены фосфопептида нативного сурвивина могут быть идентифицированы в результате сканирования на присутствие MHC пептидсвязывающих мотивов в районе сайта фосфорилирования Thr34. Таким образом, возможная последовательность фосфопептида, полученного из сурвивина, включает TPERMAEAGF (SEQ ID NO: 114), предполагаемый HLA-B35-, и/или HLA-B7- и/или HLA-B51-рестриктированный пептидный антиген. Дополнительные нативные фосфопептиды, охваченные в настоящем описании, включают: HLA-A2: CACTPERMA (SEQ ID NO: 115), и CTPERMAEA (SEQ ID NO: 116); HLA-A3: FLEGCACTP (SEQ ID NO: 117); HLA-B7/HLA-B35/HLA-B51: WPFLEGCACT (SEQ ID NO: 118), (фосфорилированный остаток Thr выделен жирным шрифтом).
Хорошо известно, что различные молекулы HLA по-разному представлены в основных человеческих популяциях. Следовательно, для расширения группы больных, которых можно лечить, исходя из способов по настоящему изобретению, необходимо идентифицировать пептидные эпитопы, рестриктированные некоторыми молекулами HLA Класса I. Описание многочисленных эпитопов сурвивина с различными рестриктирующими HLA элементами расширяет клинический потенциал этого антигена-мишени в двух важных направлениях: (i) Это увеличивает число больных, пригодных для иммунотерапии на основе пептидов-производных сурвивина. HLA-A2 антиген экспрессируется у примерно 50% европейской и азиатской популяции, как HLA-A1, так и HLA-A3 антигены экспрессируются у примерно 25% европейцев и 5% азиатов, в то время как HLA-A11 антиген экспрессируется примерно у 15% европейцев и 30% азиатов. Даже если эти значения не могут быть суммированы из-за коэкспрессии, комбинация пептидов, ограниченная их разнообразием, по всей видимости, заведомо включает большинство раковых больных. (ii) Совместное намечение нескольких рестриктирующих элементов у каждого больного, возможно, уменьшает иммунное избежание, обусловленное утратой HLA-аллели. Потеря единичной HLA аллели является значительным элементом изменения MHC, описанным для раковых клеток, в то время как потеря экспрессии Класса I встречается крайне редко. Таким образом, с идентификацией эпитопов сурвивина, рестриктированных различными HLA аллелями, становится возможным намечать более чем один тип молекул HLA одновременно у больных с перекрытием аллелей.
Хотя многие потенциальные пептиды для использования в вакцинной композиции могут быть предсказаны, действительная идентификация пептидов и вакцинная композиция, обладающая способностью вызывать подходящий ответ, требует исследования многих параметров. Изобретение описывает вакцинную композицию, которая особенно эффективна. Вакцинная композиция согласно изобретению включает пептиды сурвивина и варианты пептидов сурвивина.
Пример предпочтительных в настоящее время мультиэпитопных вакцин включает «сшитые» комбинации полученных из сурвивина пептидных эпитопов, зависящие от типа ткани данного больного, например, субъект, обладающий фенотипами HLA-1, HLA-A2, HLA-A3, и HLA-B35, может быть привит вакциной, содержащей следующие пептиды ELTLGEFLKL(сурвивин95-104) (SEQ ID NO: 3), LMLGEFLKL сурвивин96-104M2 (SEQ ID NO: 5), CPTENEPDY (сурвивин46-54Y9) (SEQ ID NO: 8) и EPDLAQCFY (сурвивин51-59Y9) (SEQ ID NO: 9) и/или RISTFKNWPK (Sur18K10) (SEQ ID NO: 20).
Альтернативно, эпитоп может быть выбран на основе уровня распространения различных фенотипов HLA в данной популяции. В качестве примера HLA-A2 является наиболее распространенным фенотипом в европейской популяции, следовательно, пептид, связывающийся с HLA-A2, будет активен в большой части этой популяции.
При этом вакцинная композиция, согласно изобретению, может также включать комбинацию из двух или более пептидов сурвивина или вариантов пептидов сурвивина, каждый из которых специфически взаимодействует с различными молекулами HLA, так что перекрывает большую часть молекул заданной популяции. Так, в качестве примеров вакцинная композиция может содержать комбинацию пептида, рестриктированного молекулой HLA-A, и пептида, рестриктированного молекулой HLA-B, например, включая те молекулы HLA-A и HLA-B, которые соответствуют распространенности HLA фенотипов в заданной популяции, таких как, например, HLA-A2 и HLA-B35. Кроме того, вакцинная композиция, содержать пептид, рестриктированный молекулой HLA-C. Другие комбинации согласно изобретению включают пептид, рестриктированный HLA-A1 и HLA-A2, или пептид, рестриктированный HLA-A1 и HLA-B35. При этом могут быть использованы все три пептида с различной специфичностью, и такая комбинация пептидов рестриктирована HLA-A1, HLA-A2 и HLA-B35.
Может быть полезным включить один HLA-B7-рестриктированный пептид или два пептида, такие как HLA-A1- и HLA-A2-связывающие пептиды или такие как HLA-A1 и HLA-B35-связывающие пептиды, в вакцинную композицию.
Аспект изобретения относится к HLA-B7-рестриктированному пептиду, такому как LPPAWQPFL (сурвивин6-14) (SEQ ID NO: 10), QPFLKDHRI (сурвивин11-19) (SEQ ID NO: 11), CPTENEPDL (сурвивин51-59) (SEQ ID NO: 6), TPERMAEAGF (сурвивин34-43) (SEQ ID NO: 12), APPAWQPFL (сурвивин6-14A1) (SEQ ID NO: 13) или RPPAWQPFL (сурвивин6-14R1) (SEQ ID NO: 14).
В варианте осуществления HLA-B7-рестриктированным пептидом является APPAWQPFL (сурвивин6-14A1) (SEQ ID NO: 13) или RPPAWQPFL (сурвивин6-14R1) (SEQ ID NO: 14). В конкретном варианте осуществления, HLA-B7-рестриктированным пептидом является APPAWQPFL (сурвивин6-14A1) (SEQ ID NO: 13), в другом конкретном варианте осуществления HLA-B7-рестриктированным пептидом является RPPAWQPFL (сурвивин6-14R1) (SEQ ID NO: 14).
Аспект изобретения относится к вакцинной композиции, содержащей один или несколько пептидов или вариантов пептидов сурвивина, где последовательность варианта пептида по всей длине, меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23, и где композиция содержит:
i) HLA-B7-связывающий пептид, и/или
HLA-A1- и HLA-A2-рестриктированный пептид, и/или
HLA-A1 и HLA-B35-рестриктированный пептид,
ii) и любой из упомянутых выше адьювантов, такой как Montanide ISA 51.
В конкретных предпочтительных вариантах осуществления, вакцинная композиция содержит:
i) пептид, содержащий APPAWQPFL (SEQ ID NO: 13) и состоящий из максимально 15, предпочтительно из 10, аминокислот,
и/или
пептид, содержащий RPPAWQPFL (SEQ ID NO: 14) и состоящий из максимально 15, предпочтительно из 10, аминокислот,
и/или
пептид, содержащий FTELTLGEF (SEQ ID NO: 16) и состоящий из максимально 15, предпочтительно из 10, аминокислот, и пептид, содержащий LMLGEFLKL (SEQ ID NO: 5) и состоящий из максимально 15, предпочтительно из 10, аминокислот,
и/или
пептид, содержащий FTELTLGEF (SEQ ID NO: 16) и состоящий из максимально 15, предпочтительно из 10, аминокислот, и пептид, содержащий EPDLAQCFY (SEQ ID NO: 9) и состоящий из максимально 15, предпочтительно из 10, аминокислот,
и/или
пептид, содержащий LMLGEFLKL (SEQ ID NO: 5) и состоящий из максимально 15, предпочтительно из 10, аминокислот, и пептид, содержащий EPDLAQCFY (SEQ ID NO: 9) и состоящий из максимально 15, предпочтительно из 10, аминокислот,
ii) и любой из упомянутых выше адьювантов, такой как Montanide ISA 51.
Можно дополнительно увеличить эффективность вакцинной композиции за счет включения трех или более пептидов сурвивина или вариантов пептидов сурвивина, в частности, если пептиды рестриктированы различными молекулами HLA.
В варианте осуществления вакцинная композиция содержит
a) три или более пептидов сурвивина или вариантов пептидов сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23,
i) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A1-связывающих пептидов,
ii) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A2-связывающих пептидов,
iii) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-B35-связывающих пептидов
b) и любой из упомянутых выше адьювантов, такой как Montanide ISA 51.
В варианте осуществления HLA-A1-связывающий пептид, HLA-A2-связывающий пептид и/или HLA-B35-связывающий пептид предпочтительно состоят из максимум 15, например из максимум 14, 13, 12, 11, и наиболее предпочтительно из максимум 10 аминокислот.
В конкретном варианте осуществления вакцинная композиция содержит HLA-A1-рестриктированный пептид FTELTLGEF (SEQ ID NO: 16). Во втором конкретном варианте осуществления вакцинная композиция содержит HLA-A2-связывающий пептид LMLGEFLKL (SEQ ID NO: 5), и в третьем конкретном варианте осуществления вакцинная композиция содержит HLA-B35-связывающий пептид EPDLAQCFY (SEQ ID NO: 9).
В большинстве конкретных вариантов осуществления вакцинная композиция содержит HLA-A1-рестриктированный пептид FTELTLGEF (SEQ ID NO: 16), HLA-A2-связывающий пептид LMLGEFLKL (SEQ ID NO: 5) и HLA-B35-связывающий пептид EPDLAQCFY (SEQ ID NO: 9).
В варианте осуществления HLA-A1-связывающий пептид, HLA-A2-связывающий пептид и/или HLA-B35-связывающий пептид, как отмечено в настоящем описании выше, предпочтительно состоят из максимум 15, например из максимум 14, 13, 12, 11, и наиболее предпочтительно, из максимум 10 аминокислот.
Можно дополнительно увеличить эффективность вакцинной композиции за счет включения семи или более пептидов сурвивина или вариантов пептидов сурвивина, в частности, если пептиды рестриктированы различными молекулами HLA.
В варианте осуществления, вакцинная композиция содержит:
a) семь или более пептидов сурвивина или вариантов пептидов сурвивина, где последовательность варианта пептида, по всей длине, по меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23,
viii) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A1-связывающих пептидов,
ix) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A2-связывающих пептидов,
x) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A3-связывающих пептидов,
xi) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A24-связывающих пептидов,
xii) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-A11-связывающих пептидов)
xiii) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-B35-связывающих пептидов,
xiv) и где по меньшей мере один пептид или вариант пептида выбран из группы HLA-B7-связывающих пептидов,
b) и любой из упомянутых выше адьювантов, такой как Montanide ISA 51.
В варианте осуществления HLA-A1-, HLA-A2-, HLA-A3-, HLA-A24-, HLA-A11-, HLA-B35- и/или HLA-B7-связывающий пептид, как отмечено в настоящем описании выше, предпочтительно состоят из максимум 15, например из максимум 14, 13, 12, 11, и наиболее предпочтительно из максимум 10 аминокислот.
В предпочтительном варианте осуществления вакцинная композиция содержит HLA-A1-связывающий пептид FTELTLGEF (SEQ ID NO: 16), HLA-A2-связывающий пептид LMLGEFLKL (SEQ ID NO: 5), HLA-A3-связывающий пептид RISTFKNWPK (SEQ ID NO: 20), HLA-A24-связывающий пептид STFKNWPFL (SEQ ID NO: 41), HLA-A11-связывающий пептид DLAQCFFCFK (SEQ ID NO: 19), HLA-B35-связывающий пептид EPDLAQCFY (SEQ ID NO: 9) и HLA-B7-связывающий пептид LPPAWQPFL (SEQ ID NO: 10) и адъювант, такой как Montanide ISA 51.
В следующем предпочтительном варианте осуществления вакцинная композиция дополнительно содержит
i) по меньшей мере один пептид или вариант пептида, выбранный из группы HLA-B44-связывающих пептидов, и/или
ii) по меньшей мере один пептид или вариант пептида, выбранный из группы HLA-B27-связывающих пептидов, и/или
iii) по меньшей мере один пептид или вариант пептида, выбранный из группы HLA-B51-связывающих пептидов.
В конкретном предпочтительном варианте осуществления вакцинная композиция содержит HLA-A1-связывающий пептид FTELTLGEF (SEQ ID NO: 16), HLA-A2-связывающий пептид LMLGEFLKL (SEQ ID NO: 5), HLA-A3-связывающий пептид RISTFKNWPK (SEQ ID NO: 20), HLA-A24-связывающий пептид STFKNWPFL (SEQ ID NO: 41), HLA-A11-связывающий пептид DLAQCFFCFK (SEQ ID NO: 19), HLA-B35-связывающий пептид EPDLAQCFY (SEQ ID NO: 9) и HLA-B7-связывающий пептид LPPAWQPFL (SEQ ID NO: 10) и любой один или более из KETNNKKKEY (SEQ ID NO: 42), являющегося HLA-B44-связывающим пептидом, ERMAEAGFI (SEQ ID NO: 43), являющегося HLA-B27-связывающим пептидом, RAIEQLAAM (SEQ ID NO: 44), являющегося HLA-B51-связывающим пептидом, и адъювант, такой как Montanide ISA 51.
В любом из вышеизложенных вариантов осуществления HLA-A11-связывающий пептид может быть выбранный из группы DLAQCFFCFK (SEQ ID NO: 19), DVAQCFFCFK (SEQ ID NO: 45), DFAQCFFCFK (SEQ ID NO: 46) или DIAQCFFCFK (SEQ ID NO: 47).
В любом из вышеизложенных вариантов осуществления предпочтительно, чтобы число пептидов, умноженное на максимально 13, например на 12, например на 11 или предпочтительно на 10 или 9, представляло собой максимальное число аминокислот, из которых вакцина состоит. Например, если вакцина содержит 5 пептидов, то предпочтительно, чтобы вакцина состояла из максимально 65, например из 60, например из 55, например из 50 или 45 аминокислот.
Для того чтобы выбрать пептид сурвивина или вариант пептида сурвивина для использования в вакцинной композиции, согласно изобретению можно оценить способность пептидов сурвивина и пептидных вариантов связывать молекулы HLA Класса I. Более того, можно оценить способность пептидов сурвивина или вариантов пептидов сурвивина выявлять IFN- -продуцирующие клетки в PBL популяции раковых больных. -продуцирующие клетки в PBL популяции раковых больных.
Эти измерения могут дать указание о пригодности пептида сурвивина или варианта пептида сурвивина для использования в вакцинной композиции, однако предпочтительно, чтобы вакцинная композиция, содержащая пептиды сурвивина или варианты пептидов сурвивина, была способной индуцировать сильный специфический Т-клеточный ответ при введении раковым больным. Более того, предпочтительно, чтобы введение вакцинной композиции индуцировало клинический ответ со свойствами, описанными в разделе, касающемся оценки повреждения-мишени. Клинический ответ может быть охарактеризован как, по меньшей мере, стабилизация заболевания (увеличение в сумме максимально на 20% наибольшего диаметра повреждений-мишеней), более предпочтительно уменьшение наибольшего размера выбранных повреждений, например частичный ответ или наиболее предпочтительно полная регрессия.
Вакцинная композиция содержит один или несколько пептид(ов) сурвивина или пептидный(х) вариант(ов), где один или несколько пептид(ов) сурвивина или пептидного(ых) варианта(ов) является/являются рестриктированной молекулой HLA Класса I, где рестриктированный пептид или пептидные варианты характеризуются, по меньшей мере, одним из следующих свойств:
(i) способностью связываться с молекулой HLA Класса I с аффинностью, определенной как количество пептида, которое составляет половину от максимального высвобождения молекулами HLA Класса I (значение C50), которая составляет максимально 50 мкМ, что определялось в тестах по комплексному связыванию, как описано в WO 2004/067023,
(ii) способностью выявлять IFN- -продуцирующие клетки в PBL популяции больного раком с частотой не менее чем 1 на 104 PBL, определенной в тестах ELISPOT (как описано в WO 2004/067023). -продуцирующие клетки в PBL популяции больного раком с частотой не менее чем 1 на 104 PBL, определенной в тестах ELISPOT (как описано в WO 2004/067023).
Тест на связывание комплекса дает простые способы скрининга подходящих пептидов по их способности связывать молекулу данной HLA аллели с аффинностью, описанной выше. В предпочтительных вариантах осуществления один или несколько пептидов сурвивина или вариантов пептидов сурвивина имеют значение C50, которое составляет максимально 30 мкМ, включая такое как максимально 20 мкМ, такое как максимально 10 мкМ, максимально 5 мкМ и максимально 2 мкМ или максимально 1 мкМ. Значения C50 выбранных пептидов представлены в таблице 4 в WO 2004/067023.
Свойством одного или нескольких пептидов сурвивина или вариантов пептидов сурвивина для использования в вакцинной композиции согласно изобретению является способность узнавать или выявлять IFN- -продуцирующие реагирующие Т-клетки, т.е. цитотоксические Т-клетки (CTL), которые специфически опознают конкретный пептид в PBL популяции или клетках опухоли больного раком (клетки-мишени). Эта активность легко определяется подверанием PBL или клеток опухоли больного тесту ELISPOT, как описано в WO 2004/067023 и ссылках в нем. Перед тестированием может быть полезно стимулирование популяции PBL или опухолевых клеток, подлежащих тестированию, посредством контактирования клеток с тестируемым пептидом. Предпочтительно пептид способен выявлять или распознавать IFN- -продуцирующие реагирующие Т-клетки, т.е. цитотоксические Т-клетки (CTL), которые специфически опознают конкретный пептид в PBL популяции или клетках опухоли больного раком (клетки-мишени). Эта активность легко определяется подверанием PBL или клеток опухоли больного тесту ELISPOT, как описано в WO 2004/067023 и ссылках в нем. Перед тестированием может быть полезно стимулирование популяции PBL или опухолевых клеток, подлежащих тестированию, посредством контактирования клеток с тестируемым пептидом. Предпочтительно пептид способен выявлять или распознавать IFN- -продуцирующие реагирующие Т-клетки с частотой не менее 1 на 104 PBL, определенной в тестах ELISPOT, как использовано в настоящем описании. Более предпочтительно частота составляет не менее 5 на 104 PBL, наиболее предпочтительно, не менее 10 на 104 PBL, например, 50 или 100 на 104 PBL. В конкретных предпочтительных вариантах осуществления частота составляет не менее 200 на 104 PBL или, например, 250 на 104 PBL. -продуцирующие реагирующие Т-клетки с частотой не менее 1 на 104 PBL, определенной в тестах ELISPOT, как использовано в настоящем описании. Более предпочтительно частота составляет не менее 5 на 104 PBL, наиболее предпочтительно, не менее 10 на 104 PBL, например, 50 или 100 на 104 PBL. В конкретных предпочтительных вариантах осуществления частота составляет не менее 200 на 104 PBL или, например, 250 на 104 PBL.
IFN- продукция в ответ на меланома-специфические антигены, такие как пептиды MART-1 и gp100, была показана при вакцинации указанными пептидами больных раком. Однако никакой значительной взаимосвязи с клиническими ответами не наблюдалось (Hersey, P. et al., Canser Immunol. Immunother. 2004, Sep. 21). продукция в ответ на меланома-специфические антигены, такие как пептиды MART-1 и gp100, была показана при вакцинации указанными пептидами больных раком. Однако никакой значительной взаимосвязи с клиническими ответами не наблюдалось (Hersey, P. et al., Canser Immunol. Immunother. 2004, Sep. 21).
Так, следующая идентификация оценки функции предполагаемых иммуногенов in vivo является предпочтительной. В высшей степени предпочтительно, чтобы вакцинная композиция содержала один или несколько пептид(ов) сурвивина или пептидный(х) вариант(ов), способный(х) вызывать очень сильный иммунологический ответ, такой как индукция очень сильного специфического ответа цитотоксических T-клеток, как определено в тестах ELISPOT для IFN- до и после вакцинации. Такие тесты предусматривают определение ответа цитотоксических T-клеток у больных при помощи анализа PBMC, проведенного до и после введения вакцинной композиции, на реакционную способность к иммуногену, использованному в вакцинной композиции, например, при помощи теста ELISPOT, как описано в примере 1. до и после вакцинации. Такие тесты предусматривают определение ответа цитотоксических T-клеток у больных при помощи анализа PBMC, проведенного до и после введения вакцинной композиции, на реакционную способность к иммуногену, использованному в вакцинной композиции, например, при помощи теста ELISPOT, как описано в примере 1.
Использование дендритных клеток в вакцинной композиции давало в прототипе более высокую эффективность по сравнению с адъювантами на основе масла (Schreurs MW et all, Cancer. Res. 2000 Dec 15;60(24):6995-7001). Таким образом, в настоящее время дендритные клетки являются более предпочтительными, чем адъювант.
Удивительные результаты проведения клинических испытаний, описанные в примере 1, показали, что введение вакцинной композиции согласно настоящему изобретению было способно индуцировать удивительно высокое количество специфических IFN- -высвобождающих клеток. -высвобождающих клеток.
Предпочтительно, что введение вакцинной композиции согласно изобретению способно индуцировать сильный специфический ответ T-клеток у субъекта, что определено по числу IFN- -высвобождающих клеток, которое больше чем 50 на 104 PBMC клеток, или, например, больше чем 100 на 104 PBMC клеток, или, например, больше чем 150 на 104 PBMC, или например, больше, чем 200 на 104 PBMC клеток. Наиболее предпочтительно, чтобы ответ специфических T-клеток, определенный по числу IFN- -высвобождающих клеток, которое больше чем 50 на 104 PBMC клеток, или, например, больше чем 100 на 104 PBMC клеток, или, например, больше чем 150 на 104 PBMC, или например, больше, чем 200 на 104 PBMC клеток. Наиболее предпочтительно, чтобы ответ специфических T-клеток, определенный по числу IFN- -высвобождающих клеток, составлял больше чем 250 на 104 PBMC. -высвобождающих клеток, составлял больше чем 250 на 104 PBMC.
Специфический T-клеточный ответ, определенный при помощи ELISPOT, может зависеть от применяемой схемы введения, например, от числа вакцинаций и времени введения вакцинной композиции (смотрите описание, относящееся к лечению). В варианте осуществления сильный специфический ответ цитотоксических Т-клеток может быть обнаружен после 12 месяцев, или, например, после 10 месяцев, или, например, после 8 месяцев. В предпочтительном варианте осуществления, специфический ответ цитотоксических Т-клеток может быть обнаружен после 6 месяцев. В следующем наиболее предпочтительном варианте осуществления специфический ответ цитотоксических Т-клеток может быть обнаружен после 4 или 3 месяцев.
Может быть также важно оценить противоангиогенный эффект пептидов, поскольку ингибирование ангиогенеза имеет сильный эффект на развитие плотных опухолей.
Индикатором потенциального противоангиогенного эффекта является проникновение в строму опухоли антиген-специфических T-клеток. Присутствие антиген-специфических T-клеток в строме опухоли может быть определено методом тканевого окрашивания, как описано в примере 2, при котором антиген-специфические T-клетки in situ в опухолевых повреждениях онкологических больных определяются с использованием мультимерных пептид/HLA комплексов. Антиген-специфические T-клетки могут узнавать пептид сурвивина или вариант пептида сурвивина, согласно изобретению, предпочтительно в комплексе с молекулой HLA Класса 1.
Предпочтительно, что введение вакцинной композиции согласно изобретению способно индуцировать проникновение антиген-специфических T-клеток в строму опухоли, таких как сурвивин-специфических T-клеток в строму опухоли.
Оценка вакцинной композиции дополнительно включает исследование способности вакцинной композиции вызывать клинический ответ при введении. В отношении лечения рака клинический ответ может быть определен с использованием Response Evaluation Criteria in Solid Tumors (RECIST), как описано в приведенном ниже разделе, касающемся оценки повреждений-мишеней.
В варианте осуществления, вакцинная композиция согласно изобретению способна вызывать клинический ответ, названный стабильным заболеванием, частичным ответом или полной регрессией, характеризующийся увеличением в сумме на не более чем 20% наибольшего диаметра повреждений-мишеней.
Таким образом, простой подход для идентификации пептидных вариантов, потенциальных для использования в вакцинной композиции, согласно изобретению включает следующие этапы: выбор конкретной молекулы HLA, например, имеющей высокую представленность в данной популяции; проведение сравнительного анализа первичной структуры, как описано выше, для идентификации «мотивов якорных остатков» в белке сурвивине; выделение или конструирование пептидов подходящего размера, содержащих один или несколько идентифицированных якорных остатков; и проверка окончательных пептидов на (i) способность связываться с конкретной молекулой HLA с использованием теста на повреждение комплекса, как описано в настоящем описании, и/или на (ii) способность выявлять IFN- -продуцирующие клетки в PBL популяции, взятой от больного раком, с частотой не менее чем 1 на 104 PBL, определенной в тесте ELISPOT, как описано в WO2004/067023. -продуцирующие клетки в PBL популяции, взятой от больного раком, с частотой не менее чем 1 на 104 PBL, определенной в тесте ELISPOT, как описано в WO2004/067023.
Для того чтобы установить пригодность идентифицированных пептидов или пептидных вариантов для вакцинной композиции, согласно изобретению способность пептид-содержащей вакцинной композиции вызывать иммунологический ответ, такой как индукция сильного специфического ответа цитотоксических T-клеток, может быть определена при помощи теста ELISPOT для IFN- до и после вакцинации (как описано в настоящем описании в примере 1). до и после вакцинации (как описано в настоящем описании в примере 1).
В WO2004/067023 было показано, что сурвивин-реагирующие клетки, выделенные при помощи HLA/пептид комплексов, обладают функциональной способностью лизировать клетки-мишени. Кроме того, было дополнительно показано, что вакцина с дендритными клетками, в которой использовались пептиды сурвивина и варианты пептидов сурвивина, способна вызывать слабые иммунные ответы в раковых линиях клеток и PBL популяциях, полученных от онкологических больных, однако сообщалось, что клинические ответы у онкологических больных были незначительными, поскольку заболевание прогрессировало.
Специфический иммунный ответ можно оценить относительно общего количества PBMC или количества CD8+-клеток в популяции. Последний вариант относительной оценки был использованы в WO 2004/067023, тогда как в приведенных в настоящем описании результатах используется отношение общего количества PBM клеток. Если в результатах, приведенных в фигуре 17 в WO 2004/067023, использовалось бы то же отношение, число реактивных клеток должно было составлять 8-30 на 104 PBMC клеток.
Поскольку сила иммунного ответа является критическим параметром при оценке потенциального иммуногена, этот анализ является сильным инструментом при оценке вакцинной композиции.
Согласно изобретению важным свойством является способность стимулировать сильный специфический Т-клеточный ответ при введении онкологическому больному. Ответ может быть оценен по числу IFN- -продуцирующих клеток в популяции PBMC до и после иммунизации вакцинной композицией. В варианте осуществления изобретения вакцинная композиция способна стимулировать сильный специфический Т-клеточный ответ у онкологического больного, где сильный Т-клеточный ответ, оцененный при помощи теста ELISPOT после введения, составляет более чем 50, например более чем 100, например более чем 150, например более чем 200, например более чем 225 или например более чем 250 пептид-специфических пятен на 104 PBL клеток. -продуцирующих клеток в популяции PBMC до и после иммунизации вакцинной композицией. В варианте осуществления изобретения вакцинная композиция способна стимулировать сильный специфический Т-клеточный ответ у онкологического больного, где сильный Т-клеточный ответ, оцененный при помощи теста ELISPOT после введения, составляет более чем 50, например более чем 100, например более чем 150, например более чем 200, например более чем 225 или например более чем 250 пептид-специфических пятен на 104 PBL клеток.
Оценка противоангиогенного эффекта может быть использована при выборе подходящих пептидов, поскольку предполагается, без связи с теорией, что вакцинная композиция, обладающая способностью вызывать противоангиогенный эффект, окажется эффективной при ингибировании роста опухоли. Ожидается, что при комбинировании с пептидом(ами), способным(ми) вызывать сильный специфический Т-клеточный ответ по отношению к сурвивину, вакцинная композиция, содержащая такой(ие) пептид(ы), будет с очень высокой вероятностью индуцировать хороший клинический ответ.
Аспект изобретения относится к вакцинной композиции, содержащей один или несколько пептидов сурвивина или пептидный(х) вариант(ов), где последовательность варианта пептида по всей длине, по меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23, и адъювант, способный индуцировать проникновение антиген-специфических T-клеток в строму опухоли у субъекта.
В предпочтительном варианте осуществления вакцинная композиция способна ингибировать ангиогенез у субъекта.
Также весьма важно оценить эффект на повреждения-мишени, поэтому клинический ответ после введения вакцинной композиции должен оцениваться, как описывается ниже в разделе, касающемся оценки повреждения-мишени. Предпочтительно, чтобы вакцинная композиция обладала способностью вызывать клинический ответ, названный стабильным заболеванием, частичным ответом или полной регрессией, характеризующийся увеличением в сумме не более чем на 20% наибольшего диаметра повреждений-мишеней, как видно из примера 1. Уменьшение в сумме наибольшего диаметра повреждений-мишеней является более предпочтительным (частичный ответ), а наиболее предпочтительным ответом является полная ремиссия.
Предполагается, что пептиды сурвивина или варианты пептидов сурвивина в дополнение к их способности связываться с молекулой HLA способны образовывать комплексы HLA и пептидов на поверхности клетки, и эти комплексы, в свою очередь, действуют как эпитопы или мишени для цитолитических Т-клеток. Возможно, что пептиды сурвивина или варианты пептидов сурвивина могут вызывать другие типы иммунных ответов, например B-клеточные ответы, приводящие к повреждению антител к комплексам и/или к реакции гиперчувствительности замедленного типа (DTH).
Последний тип иммунного ответа определяется как покраснение и прощупываемое уплотнение в области введения вакцинной композиции по изобретению.
Возможным побочным эффектом иммунизации может быть системная или локальная токсичность. Сосудистые изменения, такие как васкулит или ослабленное заживление ран, являются возможными побочными эффектами. Изменения в данных по гемоглобину, лейкоцитам и тромбоцитам, а также по лактат дегидрогеназе, креатинину и холинэстеразе являются другими нежелательными эффектами.
В варианте осуществления изобретения введение вакцинной композиции не вызывает сосудистых изменений. В другом варианте осуществления введение вакцинной композиции не вызывает ослабления заживления ран.
Таким образом, в наиболее предпочтительном варианте осуществления изобретения введение вакцинной композиции не имеет существенных побочных эффектов. В частности, значимость побочных эффектов следует оценивать в зависимости от тяжести заболевания.
Более того, как описывалось ранее, следует сконцентрировать внимание на вызывании иммунностета опухоль-специфических T-хэлперных клеток, т.е. на вакцинации MHC Класса II-рестриктированными эпитопами, несмотря на факт, что опухоли, как правило, не экспрессируют MHC Класса II. Это основывается на недавних данных, что индукция и эффективность вакцино-индуцированного антиопухолевого ответа во многих случаях требует взаимодействия опухоль-специфических CD4 позитивных Th-клеток.
Таким образом, важным фактором, направляющим разработку вакцин, обладающих более сложной композицией, является стремление выявить несколько опухолевых антигенов, например, за счет разработки вакцины, содержащей или кодирующей коллекцию тщательно отобранных эпитопов CTL и Th-клеток.
Мультиэпитопные вакцины
Очевидно, мультиэпитопные вакцины представляют эффективный путь для увеличения иммунности по отношению к эпитопам, полученным из нескольких различных антигенов, без необходимости введения (генов, кодирующих) потенциально опасных белков, таких как онкобелки. Такие вакцины также позволяют селективно индуцировать иммунитет по отношению к субдоминантным и криптическим T-клеточным эпитопам, которые могут быть особенно важными в случае связанных с опухолью аутоантигенов, для которых толерантность может существовать для эпитопов, которые заметно представлены в нормальных тканях.
Некоторые проблемы, связанные с эпитопными вакцинами, включают недостаток антиген-представляющих клеток для представления определенных эпитопов. В частности, антигены, экспрессирующиеся на опухолевых клетках, могут быть по-разному представлены благодаря функциональным различиям между иммунопротеасомами антиген-представляющих клеток и «конститутивными» протеасомами, представленными в большинстве опухолевых клеток.
Таким образом, идентификация пептидов, подходящих для вакцинной композиции, предусматривает тестирование и селекцию, основанные на экспериментальных исследованиях, для оценки эффективности различных соединений, которые могут быть включены в вакцинную композицию, включая как антигенный, так и адъювантный компонент вакцинной композиции.
В связи с этим в следующем аспекте настоящее изобретение предоставляет вакцинную композицию, содержащую один или несколько пептидов сурвивина или вариантов пептидов сурвивина, по отдельности или в подходящей комбинации с другими белками или пептидными фрагментами. В конкретном варианте осуществления такие другие белки или пептидные фрагменты включают, но без ограничения, белки, вовлеченные в регуляцию клеточного апоптоза, или их пептидные фрагменты. Соответствующие примеры таких белков могут быть выбраны из семейства белков Bcl-2, например белок Bcl-2, белок Bcl-XL, белок Bcl-w, белок Mcl-1, белок TRAG-3 и пептидные фрагменты, полученные из любого из этих белков. Другие известные ингибиторы апоптоза включают членов семейства белков-ингибиторов апоптоза (IAP), таких как X-IAP, C-IAP1 и C-IAP2, все эти белки экспрессируются относительно повсеместно, в то время как ингибитор апоптоза полипептид ML-IAP имеет довольно избирательную экспрессию и обнаруживается преимущественно в меланомах. Таким образом, фрагменты ML-IAP, способные вызывать специфический Т-клеточный ответ, то есть ответ цитотоксических Т-клеток или ответ хэлперных Т-клеток, могут при желании быть включены в вакцинную композицию по настоящему изобретению.
Пригодные пептидные фрагменты ML-IAP включают ML-IAP245 (RLQEERTCKV) (SEQ ID NO: 24), ML-IAP280 (QLCPICRAPV) (SEQ ID NO: 25), ML-IAP90 (RLASFYDWPL) (SEQ ID NO: 26), ML-IAP154 (LLRSKGRDFV) (SEQ ID NO: 27), ML-IAP230 (VLEPPGARDV) (SEQ ID NO: 28), ML-IAP98 (PLTAEVPPEL) (SEQ ID NO: 29), ML-IAP34 (SLGSPVLGL) (SEQ ID NO: 30), ML-IAP54 (QILGQLRPL) (SEQ ID NO: 31), ML-IAP99 (LTAEVPPEL) (SEQ ID NO: 32), ML-IAP83 (GMGSEELRL) (SEQ ID NO: 33) и ML-IAP200 (ELPTPRREV) (SEQ ID NO: 34).
Кроме того, фармацевтическая композиция по изобретению может с успехом содержать по меньшей мере один дополнительный иммуногенный белок или его пептидный фрагмент, выбранный из белка или пептидного фрагмента, не относящегося к или не полученного из белка сурвивина. В конкретном варианте осуществления иммуногенный белок или его пептидный фрагмент получен из семейства белков Bcl-2, как описано выше и в PCT/DK2004/000799. Следующим иммуногенным Bcl-2-производным пептидом является HLA-A2-рестриктированный пептид, имеющий последовательность, выбранную из следующих: Bcl172 (NIALWMTEYL) (SEQ ID NO: 35), Bcl180 (YLNRHLHTWI) (SEQ ID NO: 36), Bcl208 (PLFDFSWLSL) (SEQ ID NO: 37) и Bcl214 (WLSLKTLLSL) (SEQ ID NO: 38), Bcl218 (KTLLSLALV) (SEQ ID NO: 39) и Bcl80 (AAAGPALSPV) (SEQ ID NO: 40).
Вариант осуществления изобретения относится к вакцинной композиции, согласно изобретению дополнительно содержащей один или несколько пептидов или пептидных вариантов, выбранных из группы пептидов, полученных из ML-IAP, BCL-2, BCL-X, MCL-1 или TRAG-3 (как описано в PCT/DK2004/000798), или их пептидных вариантов, способных связывать молекулы HLA Класса 1.
Кроме того, композиция согласно настоящему изобретению может быть предоставлена как мультиэпитопная вакцина, содержащая Класс I – рестриктированный эпитоп и/или Класса II – рестриктированные эпитопы, как определено выше в данном документе.
Доза
Предполагается, что пригодная вакцинная композиция по изобретению содержит иммунологически эффективное количество пептида сурвивина или вариантов пептидов сурвивина.
Количество пептидов сурвивина или вариантов пептидов сурвивина в вакцинной композиции может варьировать в зависимости от конкретного применения. Однако единичная доза иммуногена составляет предпочтительно всюду от приблизительно 10 мкг до приблизительно 5000 мкг, более предпочтительно, от приблизительно 25 мкг до приблизительно 2500 мкг, или, например, от приблизительно 50 мкг до приблизительно 1000 мкг, или, например, от приблизительно 50 мкг до приблизительно 500 мкг, или, например, от приблизительно 50 мкг до приблизительно 250 мкг, или, например, от приблизительно 50 мкг до приблизительно 200 мкг, или, например, от приблизительно 75 мкг до приблизительно 150 мкг. В предпочтительном варианте осуществления доза иммуногена составляет от приблизительно 75 мкг до приблизительно 150 мкг. В наиболее предпочтительном варианте осуществления доза составляет приблизительно 100 мкг.
Введение
Способ введения включает внутрикожное, подкожное и внутривенное введение, вживление в форме препарата с повременным высвобождением и т.д. Любые и все формы введения, известные в данной области, охвачены в настоящем описании. Предпочтительно подкожное введение и, в частности, глубокое подкожное введение. Также предпочтительно, что вакцинная композиция согласно изобретению вводится в конечности с их чередованием в непосредственной близости от отводящего лимфотического узла.
Кроме того, охвачены любые и все общепринятые лекарственные формы, известные в данной области и предназначенные для составленной инъецируемой иммуногенной пептидной композиции, такие как лиофилизированные формы и растворы, суспензии или эмульсионные формы, содержащие, если требуется, общепринятые фармацевтически приемлемые носители, разбавители, консерванты, адъюванты, буферные компоненты и т.д.
Иммунологический эффект композиции по изобретению может быть определен с использованием нескольких подходов, известных специалистам в данной области и описанных в примерах в WO 2004067023. Пример того, как определить CTL ответ, вызванный вакцинной композицией, предоставлен в WO97/28816. Успешный иммунный ответ также может быть определен по наличию реакций гиперчувствительности замедленного типа (DTH) после иммунизации и/или обнаружению антител, специфически распознающих пептид(ы) вакцинной композиции.
В предпочтительных вариантах осуществления фармацевтическая композиция по изобретению представляет собой иммуногенную композицию или вакцину, способную вызывать иммунный ответ на онкологическое заболевание.
Как применяется в настоящем описании, экспрессия «иммуногенной композиции или вакцины» относится к композиции, вызывающей не менее одного типа иммунного ответа, направленного в отношении раковых клеток. Таким образом, такой иммунный ответ может быть любым из описанных выше типов: CTL ответ, при котором вырабатываются CTL, способные распознавать представленный на клеточной поверхности HLA/пептидный комплекс, вызывающие клеточный лизис, т.е. вакцина вызывает у вакцинированного субъекта повреждение эффектoрных T-клеток, оказывающих цитотоксический эффект по отношению к раковым клеткам; B-клеточный ответ, приводящий к увеличению продукции антираковых антител; и/или иммунный ответ DTH типа.
Вакцины на основе нуклеиновой кислоты
Вакцинная композиция согласно настоящему изобретению может включать нуклеиновую кислоту, кодирующую полипептид сурвивина (SEQ ID NO: 23), его пептидный фрагмент или вариант пептида сурвивина. Указанная нуклеиновая кислота может, таким образом, кодировать любой вышеупомянутый белок и пептидные фрагменты. Нуклеиновая кислота может представлять собой, например, ДНК, РНК, LNA, HNA, PNA, предпочтительно нуклеиновая кислота представляет собой ДНК или РНК.
В варианте осуществления изобретение относится к вакцинной композиции, содержащей:
i) нуклеиновую кислоту, кодирующую:
a) полипептид сурвивина (SEQ ID NO: 23),
b) пептид сурвивина или
c) вариант пептида сурвивина, и
ii) любой отмеченный выше адъювант.
Нуклеиновые кислоты по изобретению могут входить в состав любого подходящего вектора, такого как экспрессионный вектор. Имеются в распоряжении множество векторов, и специалист может выбрать вектор, подходящий для конкретной цели. Вектор может быть, например, в форме плазмиды, космиды, вирусной частицы или искусственной хромосомы. Соответствующая последовательность нуклеиновой кислоты может быть вставлена в вектор при помощи множества методов, например, ДНК может быть вставлена в предназначенный участок(ки) эндонуклеазы рестрикции с использованием хорошо известных в данной области методов. Помимо последовательности нуклеиновой кислоты согласно изобретению вектор может дополнительно содержать одну или несколько сигнальных последовательностей, точку начала репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции. Вектор может также содержать дополнительные последовательности. Конструирование подходящего вектора, содержащего один или несколько таких компонентов, осуществляется при помощи стандартной процедуры лигирования, которая хорошо известна специалисту в данной области. Вектор представляет собой предпочтительно экспрессионный вектор, содержащий нуклеиновую кислоту, функционально связанную с регуляторной последовательностью нуклеиновой кислоты, контролирующей ее экспрессию в подходящей клетке. В пределах объема настоящего изобретения указанная регуляторная последовательность нуклеиновой кислоты, как правило, должна быть способна контролировать экспрессию в клетках млекопитающих, предпочтительно в клетках человека, более предпочтительно, в клетках, представляющих антиген.
В одном предпочтительном варианте осуществления вектор представляет собой вирусный вектор. Указанный вирусный вектор в дополнение к нуклеиновой кислоте, кодирующей сурвивин или его пептидный фрагмент, может содержать вторую последовательность нуклеиновой кислоты, кодирующую стимулирующий T-клетки полипептид. Стимулирующий T-клетки полипептид предпочтительно выбран из группы, состоящей из B7.1, ICAM-1 и LFA-3.
Вектор может также представлять собой бактериальный вектор, такой как ослабленный бактериальный вектор. Ослабленные бактериальные векторы могут быть использованы для того, чтобы индуцировать длительные иммунные ответы слизистой в участках инфекции и персистенции. Различные рекомбинантные бактерии могут быть использованы в качестве векторов, например, бактериальный вектор может быть выбран из группы, состоящей из Salmonella, Lactococcus и Listeria. В большинстве случаев у мышей можно получить индукцию иммунитета к гетерологичным антигенам HPV16 L1 или E7 с сильной CTL-индукцией и регрессией опухоли.
Фармацевтические лекарственные средства
Аспект по изобретению относится к вакцинной композиции, согласно изобретению, для применения при изготовлении лекарственного средства. В конкретном варианте осуществления лекарственное средство предназначено для лечения онкологических заболеваний.
В варианте осуществления лекарственное средство согласно изобретению, предназначено для подкожного введения, соответственно, лекарственное средство может быть составлено как раствор или суспензия или, альтернативно, как лиофилизированный препарат для суспендирования перед введением.
Изобретение дополнительно относится к лекарственному средству для лечения рака, включающему вакцинную композицию, содержащую один или несколько пептидов сурвивина или вариантов пептидов сурвивина и адъювант в качестве активного ингредиента.
Лечение
Молекула сурвивина, как было обнаружено, обладает нарушенной регуляцией при большом количестве онкологических заболеваний. Вакцинная композиция, содержащая пептиды сурвивина или варианты пептидов сурвивина, может быть применена для лечения клинических состояний, таких как онкологические заболевания. Согласно изобретению лечение включает ослабление симптомов и ингибирование прогрессирования заболевания, тем самым вызывая клинический ответ, как описано в настоящем описании ниже.
Вакцинная композиция согласно изобретению может быть введена более одного раза, например дважды, три раза, четыре раза, пять раз, или, например более чем пять раз, например более чем 7 раз, например более чем 10 раз, например более чем 15 раз. Заболевание, подвергнутое лечению с использованием вакцинной композиции по изобретению, может быть рецидирующим или хроническим, следовательно, для того чтобы минимизировать симптомы и ингибировать прогрессирование или повторное возникновение заболевания, лечение может быть продолжено с регулярными интервалами в течение длительного периода. Например, подвергнутое лечению заболевание может быть онкологическим заболеванием, и лечение может продолжаться до того момента или пока полная регрессия или стабилизация заболевания не станут клиническим ответом, или для жизни больного.
Вакцинная композиция может вводиться, например, один раз каждые 14 дней в течение как минимум месяца, например в течение как минимум двух месяцев, например в течение как минимум 3 месяцев, например, в течение как минимум 5 месяцев, например в течение как минимум 8 месяцев, например, в течение как минимум 12 месяцев, например в течение как минимум 20 месяцев. Вакцинная композиция может вводиться с равномерными интервалами для жизни субъекта. Вакцинная композиция может вводиться, когда заболевание случается повторно или когда отмечается прогрессирование заболевания.
В варианте осуществления изобретение относится к способу стимулирования сильного специфического T-клеточного ответа по отношению к сурвивину у субъекта
Указанный способ включает:
a) предоставление вакцинной композиции согласно изобретению,
b) введение указанной вакцинной композиции субъекту, где указанная вакцинная композиция может вводится более одного раза; и
c) стимулирование посредством этого сильного специфического Т-клеточного ответа у субъекта, где специфический Т-клеточный ответ, определенный в тесте ELISPOT до и после введения вакцинной композиции, составляет более чем 50 пептид-специфических пятен на 104 PBMC клеток.
В конкретном варианте осуществления сильный специфический Т-клеточный ответ, определенный в тесте ELISPOT до и после введения вакцинной композиции, составляет более чем 200 пептид-специфических пятен на 104 PBMC клеток.
В следующем конкретном варианте осуществления способ согласно изобретению может включать введение указанной вакцинной композиции один раз каждый месяц.
В другом предпочтительном варианте осуществления, вакцинная композиция вводится один раз каждый второй месяц.
В варианте осуществления изобретение относится к способу лечения или профилактики заболевания, включающего:
a) предоставление вакцинной композиции, содержащей любой из вышеупомянутых пептидов и, по желанию, любой из вышеупомянутых адъювантов,
b) введение указанной вакцинной композиции субъекту, где указанная вакцинная композиция может вводится более одного раза; и
c) стимулирование посредством этого сильного специфического Т-клеточного ответа у субъекта, где специфический Т-клеточный ответ, определенный в тесте ELISPOT до и после введения вакцинной композиции, составляет более чем 50 пептид-специфических пятен на 104 PBMC клеток;
d) получение клинического ответа у субъекта.
Клинический ответ оценивается, как описано ниже в разделе, относящемся к оценке повреждений-мишеней.
В предпочтительном варианте осуществления вакцинная композиция представляет собой композицию для лечения клинического состояния.
В предпочтительном варианте осуществления по изобретению клиническое состояние представляет собой рак. Термин «рак», как применяется в настоящем описании, подразумевает включение любых онкологических, неопластических и предраковых заболеваний. Указанный рак, например, может быть выбран из группы, состоящей из: карциномы толстой кишки, рака молочной железы, рака поджелудочной железы, рака яичника, рак предстательной железы, фибросаркомы, миксосаркомы, липосаркомы, хондросаркомы, остеогенной саркомы, хордомы, ангиосаркомы, эндотелиосаркомы, лимфангиосаркомы, лимфангиоэндотелиальной саркомы, синовиомы, мезотелиомы, саркомы Юинга, лейомиосаркомы, рабдомиосаркомы, карциномы плоских клеток, карциномы базальных клеток, аденокарциномы, карциномы потовых желез, карциномы сальных желез, папиллярной карциномы, папиллярных аденокарцином, цистандеокарциномы, медуллярной карциномы, бронхогенной карциномы, карциномы ренальных клеток, гепатомы, карциномы желчных протоков, хориокарциномы, семиномы, эмбриональной карциномы, опухоли Уилмса, рака шейки матки, тестикулярной опухоли, карциномы легкого, карциномы мелких клеток легкого, карциномы мочевого пузыря, карциномы эпителия, глиобластом, нейронoм, краниофарингиом, неврином, глиомы, астроцитомы, гранулобластомы, краниофарингиомы, эпендиомы, пинеаломы, гемангиобластомы, слуховой невромы, олигодендроглиомы, менингиомы, меланомы, нейробластомы, ретинобластомы, лейкемий и лимфом, острого лимфоцитарного лейкоза и истинной острой миелоцитарной полицитемии, множественной миеломы, макроглобулинемии Вальденстрема и заболевание тяжелых цепей, острых нелимфоцитарных лейкозов, хронического лимфоцитарного лейкоза, хронической миелогенной лейкемии, болезни Ходжкина, неходжскинских лимфом, рака прямой кишки, раков мочеполового тракта, раков тела матки, раков полости рта, раков кожи, рак желудка, опухолей мозга, рака печени, рака гортани, рака пищевода, опухолей молочной железы, острой лимфоидной лейкемии (ALL) младенцев, тимусной ALL, ALL B-клеток, острой миелоидной лейкемии, миеломоноцитоидной лейкемии, острой мегакариоцитоидной лейкемии, лимфомы Буркитта, острой миелоидной лейкемии, хронической миелоидной лейкемии, и T-клеточной лейкемии, карциномы мелких и больших немелких клеток легкого, острой гранулоцитной лейкемии, опухолей половых клеток, рака эндометрия, рака желудка, рака головы и шеи, хронической лимфоидной лейкемии, волосатоклеточного лейкоза и рака щитовидной железы.
В варианте осуществления вакцинная композиция согласно изобретению представляет собой композицию для лечения рака, выбранного из группы: злокачественная меланома, рак поджелудочной железы, рака шеи или рака толстой кишки.
В предпочтительном варианте осуществления вакцинная композиция согласно изобретению представляет собой композицию лечения злокачественной меланомы и рака поджелудочной железы.
Аспект изобретения относится к способу ингибирования ангиогенеза, включающего:
a) предоставление вакцинной композиции согласно изобретению;
b) введение указанной вакцинной композиции субъекту.
Индивидуум, нуждающийся в лечении, может быть любым индивидуумом, предпочтительно человеческим существом. Пептиды, как правило, должны обладать различными аффинностями к разным молекулам HLA. Следовательно, в вариантах осуществления по настоящему изобретению, где вакцинная композиция или фармацевтическая композиция содержит пептиды сурвивина, предпочтительно, чтобы вакцинная композиция или фармацевтическая композиция, вводимая данному индивидууму, содержала, по меньшей мере, один пептид, способный к ассоциации с молекулами HLA этого конкретного индивидуума.
Комбинированное лечение
Настоящее изобретение, кроме того, относится к фармацевтической композиции и набору компонентов для применения в комбинированном лечении.
Комбинированное лечение, как применяют в настоящем описании, означает лечение субъекта, нуждающегося в таковом, при помощи более чем одного различного лекарственного средства. Поэтому комбинированное лечение в одном аспекте предусматривает введение фармацевтической композиции или набора компонентов, содержащих вакцинную композицию, как описано в настоящем описании выше, и вспомогательное лекарственное средство. Вспомогательные лекарственные средства могут быть любыми лекарственными средствами, описанными в настоящем описании ниже, например химиотерапевтическим средством или ингибиторами ангиогенеза.
В частности, комбинированное лечение может предусматривать введение индивидууму химиотерапевтического средства и/или иммунотерапевтического средства в сочетании с одним или несколькими i) пептидами сурвивина или вариантами пептидов сурвивина, согласно изобретению, ii) вакцинной композицией согласно изобретению. Впрочем, комбинированное лечение может также предусматривать радиотерапию, генотерапию и/или хирургическое вмешательство.
Аспект изобретения относится к способу комбинированного лечения, включающему одновременное, последовательное или раздельное введение, в любом порядке:
i) вакцинной композиции согласно изобретению
ii) и вспомогательного лекарственного средства.
В предпочтительном варианте осуществления вспомогательным лекарственным средством является химиотерапевтическое средство. Химиотерапевтическое средство может представлять собой, например, метотрексат, винкристин, адриамицин, цисплатин, не содержащие сахара хлорэтилнитрозомочевины, 5-фторурацил, митомицин C, блеомицин, доксорубицин, дакарбазин, таксол, фрагилин, Meglamine GLA, валрубицин, кармустаин и полиферпозан, MM1270, BAY 12-9566, ингибитор RAS-фамезилтрансферазы, ингибитор фамезилтрансферазы, MMP, MTA/LY231514, LY264618/Лометексол, Гламолек, CI-994, TNP-470, Хикамтин/Топотекан, PKC412, Валсподар/PSC833, Новантрон/Митроксантрон, Метарет/Сурамин, Батимастат, E7070, BCH-4556, CS-682, 9-AC, AG3340, AG3433, Инцел/VX-710, VX-853, ZD0101, ISI641, ODN 698, TA 2516/Мармистат, BB2516/Мармистат, CDP 845, D2163, PD183805, DX8951f, Лемонал DP 2202, FK 317, Пицибанил/OK-432, AD 32/Валрубицин, Метастрон/производное стронция, Темодал/Темозоломид, Евацет/липосомальный доксорубицин, Евтаксан/Плаклитаксел, Таксол/Паклитаксел, Кселоад/Капецитабин, Фартулон/Доксифлуридин, Циклопакс/Паклитаксел для орального использования, Таксоид для орального применения, SPU-077/Цисплатин, HMR 1275/Флавопиридол, CP-358 (774)/EGFR, CP-609 (754)/ингибитор RAS онкогена, BMS-182751/платина для орального использования, UFT(Тегафур/Урацил), Эргамизол/Левамизол, Энилурацил/776C85/5FU-энхансер, Кампто/Левамизол, Камптосар/Иринотекан, Тумодекс/Ралитрексед, Лейстатин/Кладрибин, Паксекс/Паклитаксел, Доксил/липосомный доксорубицин, Каеликс/липосомный доксорубицин, Флудара/Флударабин, Фармарубицин/Эпирубицин, ДепоЦит, ZD1839, LU 79553/Бис-нафталимид, LU 103793/Доластаин, Каетикс/Липосомный доксорубицин, Гемзар/Гемцитабин, ZD 0473/Анормед, YM 116, источник йода, CDK4- и CDK2-ингибиторы, PARP-ингибиторы, D4809/Дексифосфамид, Ифес/Меснекс/Ифосамид, Вумон/Тенипозид, Параплатин/Карбоплатин, Платинол/Цисплатин, Вепезид/Этопозид, ZD 9331, Таксотер/Доцетаксел, пролекарство арабинозида гуанина, Аналог Таксана, нитрозомочевины, алкилирующие средства, такие как мелфелан и циклофосфамид, Аминоглютетимид, Аспарагиназа, Бусульфан, Карбоплатин, Хлоромбуцил, Цитарабин HCl, Дактиномицин, Даунорубицин HCl, Эстрамустина фосфат натрия, Этопозид (VP16-213), Флоксуридин, Фторурацил (5-FU), Флутамид, Гидроксимочевина (Гидроксикарбамид), Ифосфамид, Интерферон  -2a, Интерферон -2a, Интерферон  -2b, Лейпролида ацетат (аналог LHRH-релизинг фактора), Ломустин (CCNU), Мехлорэтамин HCl (азотистый иприт), Меркаптопурин, Месна, Митотан (o.p’-DDD), Митоксантрон HCl, Октреотид, Пликамицин, Прокарбазин HCl, Стрептозоцин, Тамоксифена цитрат, Тиогуанин, Тиотепа, Винбластина сульфат, Амсакрин (м-AMSA), Азацитидин, Эритропоэтин, Гексаметилмеламин (HMM), Интерлейкин-2, Митогуазон (метил-GAG; метил глиоксал бис-гуанилгидразон; MGBG), Пентостатин (2′-дезоксикоформицин), Семустин (метил-CCNU), Тенипозид (VM-26) и Виндезин сульфат. Более того, химиотерапевтическим средством может быть любое химиотерапевтическое средство из перечисленных в таблице 3 в US 6482843, в столбцах с 13 по 18. -2b, Лейпролида ацетат (аналог LHRH-релизинг фактора), Ломустин (CCNU), Мехлорэтамин HCl (азотистый иприт), Меркаптопурин, Месна, Митотан (o.p’-DDD), Митоксантрон HCl, Октреотид, Пликамицин, Прокарбазин HCl, Стрептозоцин, Тамоксифена цитрат, Тиогуанин, Тиотепа, Винбластина сульфат, Амсакрин (м-AMSA), Азацитидин, Эритропоэтин, Гексаметилмеламин (HMM), Интерлейкин-2, Митогуазон (метил-GAG; метил глиоксал бис-гуанилгидразон; MGBG), Пентостатин (2′-дезоксикоформицин), Семустин (метил-CCNU), Тенипозид (VM-26) и Виндезин сульфат. Более того, химиотерапевтическим средством может быть любое химиотерапевтическое средство из перечисленных в таблице 3 в US 6482843, в столбцах с 13 по 18.
Терапевтические композиции или вакцинные композиции по изобретению могут также применяться в сочетании с другими противораковыми подходами, и такие комбинированные лечения эффективны для ингибирования и/или элиминации опухолевого роста и метастазов. Способы по настоящему изобретению могут успешно применяться с другими лечебными методиками, включая, без ограничения, облучение, хирургическое вмешательство, генотерапию и химиотерапию.
Сурвивин сильно экспрессируется в эндотелиальных клетках при ангиогенезе и может быть вовлечен в цитопротекторное действие васкулярно-эндотелиального фактора роста (VEGF), поэтому сурвивин-экспрессирующие клетки-мишени могут непосредственно метить раковые клетки и далее предотвращать опухолевый рост путем ингибирования ангиогенеза.
Противоангиогенный эффект может быть усилен посредством комбинирования лечения вакциной согласно изобретению с лечением ингибиторами ангиогенеза. Противоангиогенная терапия выявляет сосудистую сеть опухоли и препятствует росту опухоли сверх определенного размера, поэтому в другом предпочтительном варианте осуществления вспомогательным лекарственным средством является ингибитор ангиогенеза.
Ингибиторами ангиогенеза могут являться, но не ограничены этими, например, BMS-275291, Далтепарин (Фрагмин®), Сурамин, 2-метоксиэстрадиол (2-ME), Талидомид, CC-5013 (аналог талидомида), Комбретастатина A4 фосфат, LY317615 (Ингибитор протеинкиназы C  ), Изофлавон Сои (Genistein; изолят соевого белка), AE-941 (НеовастатTM); GW786034), Aнти-VEGF Антитела (Бевацизумаб; АвастинTM), Интерферон- ), Изофлавон Сои (Genistein; изолят соевого белка), AE-941 (НеовастатTM); GW786034), Aнти-VEGF Антитела (Бевацизумаб; АвастинTM), Интерферон- , PTK787/ZK 222584, VEGF-Trap, ZD6474, EMD 121974, Карбоксиамидотриазол (CAI), Целекоксиб (Целебрекс®), галофугинона гидробромид (ТемпостатинTM), AdPEDF, Макуген, триптофанил-тРНК синтетаза (TrpRS), руфаб V2 (он же луцентис), скваламин, Retaane 15 мг (анекортава ацетат с базовой суспензией) и интерлейкин-12. , PTK787/ZK 222584, VEGF-Trap, ZD6474, EMD 121974, Карбоксиамидотриазол (CAI), Целекоксиб (Целебрекс®), галофугинона гидробромид (ТемпостатинTM), AdPEDF, Макуген, триптофанил-тРНК синтетаза (TrpRS), руфаб V2 (он же луцентис), скваламин, Retaane 15 мг (анекортава ацетат с базовой суспензией) и интерлейкин-12.
«Комбинированное лечение» может включать введение гетерологичных нуклеиновых кислот в подходящие клетки, общеизвестное как генотерапия. Например, генотерапия может включать введение генов, супрессирующих опухоль, или генов, активизирующих апоптоз в опухолевых клетках. Альтернативно, последовательности нуклеиновых кислот, ингибирующие экспрессию онкогенов или генов, ингибирующих апоптоз, могут быть введены в опухолевые клетки. Более того, могут вводиться гены, которые кодируют ферменты, способные придавать опухолевым клеткам чувствительность к химиотерапевтическим средствам. Соответственно, настоящее изобретение в одном варианте осуществления предоставляет способ, включающий стадию лечения рака посредством введения генного вектора, кодирующего белок, способный к ферментативной конверсии пролекарства, т.е. нетоксичного соединения в токсичное соединение. В способе по настоящему изобретению терапевтической последовательностью нуклеиновой кислоты является нуклеиновая кислота, кодирующая продукт, где продукт вызывает клеточную гибель сам по себе или в присутствии других лекарственных средств. Показательным примером такой терапевтической нуклеиновой кислоты является та, которая кодирует тимидин киназу вируса простого герпеса. Дополнительными примерами являются тимидин киназа вируса ветряной оспы и бактериальный ген цитозин дезаминазы, которая может преобразовывать 5-фторцитозин в высокотоксичное соединение 5-фторурацил.
Оценка повреждения-мишени
Ответ лечения определяется с использованием критерия RECIST (Response Evaluation Criteria in Solid Tumors), описанного в оригинальной WHO Handbook для описания результатов онкологического лечения (World Health Organization Offset Publication No 48; 1979) с учетом измерения наибольшего диаметра повреждений-мишеней (Therasse P et al. J. Natl. Cancer Inst. 2000 Feb 2;92(3): 205-16). Ответ подразделяется на полный ответ, частичный ответ, прогрессирующее заболевание и неизменяемое заболевание. Полный ответ представляет собой исчезновение всех повреждений-мишеней, тогда как к частичному ответу относится уменьшение не менее чем на 30% в сумме наибольшего диаметра повреждений-мишеней. Прогрессирующее заболевание представляет собой увеличение не менее чем на 20% в сумме наибольшего диаметра повреждений-мишеней. Неизменяемое заболевание относится к состоянию, для которого не применимо ни одно из вышеприведенных. Продолжительность полного ответа или частичного ответа должна измеряться от момента времени, когда оценочный критерий впервые встречается, до первой даты, которой рецидивное или прогрессирующее заболевание документируется. Эффект предпочтительно наблюдается не менее чем на одном больном.
Частичный ответ относится к ответу, при котором наблюдается уменьшение не менее чем на 30% в сумме наибольшего диаметра повреждений-мишеней. Ответ может быть дополнительно разделен на подгруппы с частичным ответом в 40%, или частичным ответом в 50%, или частичным ответом в 60%, или частичным ответом в 70%, или частичным ответом в 80%, или частичным ответом в 90%, в отношении лечения, при котором наблюдалось уменьшение в сумме наибольшего диаметра повреждений-мишеней, по меньшей мере, на 40%, 50%, 60%, 70%, 80% или 90% соответственно.
В варианте осуществления вакцинная композиция согласно изобретению представляет собой композицию для лечения рака, при котором частичный ответ составляет не менее 30%.
В варианте осуществления способ, включающий введение вакцинной композиции, согласно изобретению представляет собой способ для лечения рака и при котором частичный ответ составляет, по меньшей мере, 40%, например, по меньшей мере, 50%, например, по меньшей мере, 60%, например, по меньшей мере, 70%, например, по меньшей мере, 80% или например, по меньшей мере, 90%.
Неизменяемое заболевание относится к ответам, при которых сумма наибольшего диаметра повреждений-мишеней уменьшена на 30% или менее, и, кроме того, включает ответы, при которых сумма наибольшего диаметра повреждений-мишеней увеличена на 20% или менее. Этот тип ответов можно подразделить на ответы, при которых сумма наибольшего диаметра повреждений-мишеней уменьшена на 30% или менее, например на 25% или менее, например на 20% или менее, например на 15% или менее, например на 10% или, например на 5% или менее, и на подгруппы, в которых сумма наибольшего диаметра повреждений-мишеней увеличена на 20% или менее, например на 15% или менее, например на 10% или, например на 5% или менее. Далее включены подгруппы, где сумма наибольшего диаметра повреждений-мишеней либо уменьшена, либо увеличена на максимум 1%, например на 3% или, например, на максимум 5%.
Прогрессирующее заболевание характеризуется, по меньшей мере, 20% увеличением в сумме наибольшего диаметра повреждений-мишеней. Этот тип ответа может быть подразделен на ответы, при которых сумма наибольшего диаметра повреждений-мишеней увеличена на максимум 25%, например, на максимум 30%, например, на максимум 35%, например на максимум 40%, например на максимум 45% или, например, на максимум 50%. Согласно изобретению лечение, приводящее к прогрессирующему заболеванию в качестве ответа, при котором сумма наибольшего диаметра повреждений-мишеней увеличена на максимум 30%, может рассматриваться как положительный результат, если диагностика предсказывает увеличение на 50%. Таким образом, конкретные варианты осуществления включают лечения, при которых ответ характеризуется как ответы в виде прогрессирующего заболевания и при которых сумма наибольшего диаметра повреждений-мишеней увеличена на максимум 25%, например на максимум 30%, например на максимум 35%, например на максимум 40%, например, на максимум 45% или, например, на максимум 50%.
Вариант осуществления по изобретению относится к способу лечения или профилактики заболевания, включающему:
a) предоставление вакцинной композиции, согласно изобретению,
b) введение указанной вакцинной композиции субъекту,
c) для лечения рака и
d) где введение указанной вакцинной композиции приводит к неизменяемому заболеванию, частичному ответу или полной регрессии, характеризующимися увеличением не более чем на 20% в сумме наибольшего диаметра повреждений-мишеней.
Результаты, приведенные в примере 1, показывают, что даже у подвергнутых интенсивному предварительному лечению больных с застарелыми заболеваниями у всех исследованных больных были установлены чрезвычайно сильные сурвивин-специфические T-клеточные ответы внутри пула циркулирующих лимфоцитов. Как видно в примере 1, таблице 3, два субъекта, JUSC и OTSC испытали полную регрессию, в то время как неизменяемое заболевание наблюдалось в некоторых случаях и частичный ответ наблюдался у одного субъекта.
Набор компонентов
Комбинационное лечение предусматривает раздельное, последовательное или одновременное введение двух или более активных ингредиентов, составленных в одно или несколько лекарственных средств. Для удобства использования указанные лекарственные средства могут быть включены в отдельные комбинированные препараты или набор компонентов.
Аспект по изобретению относится к набору компонентов, включающему:
a) вакцинную композицию, содержащую
(i) один или несколько пептидов сурвивина или вариантов пептидов сурвивина, где последовательность варианта пептида по всей длине, по меньшей мере, на 85% идентична последовательной аминокислотной последовательности SEQ ID NO: 23,
(ii) и адъювант, как описано в настоящем описании,
b) и вспомогательное лекарственное средство.
Для лечения онкологического заболевания набором компонентов согласно изобретению лекарственное средство может представлять собой химиотерапевтическое средство. В отношении лечения иммунного заболевания лекарственное средство может представлять собой иммунотерапевтическое средство.
В варианте осуществления набором компонентов согласно изобретению лекарственное средство содержит химиотерапевтическое средство или иммунотерапевтическое средство. В предпочтительном варианте осуществления, лекарственное средство содержит химиотерапевтическое средство. Согласно изобретению вакцинная композиция и лекарственное средство, составленное из набора компонентов, предназначены для раздельного, последовательного или одновременного введения. Набор компонентов может дополнительно содержать и аннотацию, включающую информацию о предназначенных применении/введении/дозировке составляющего лекарственного средства и вакцинной композиции.
ОПИСАНИЕ ФИГУР
Фиг.1. Кинетический анализ иммунитета в PBL от больного раком поджелудочной железы к пептиду сурвивина Sur1M2, определенного в тесте IFN- ELISPOT. PBMC от больного OTSC были взяты до первой sur1M2/Montanide-вакцинации и через один, три и шесть месяцев после нее. T-лимфоциты были стимулированы один раз пептидом до высева по 105 клеток на чашку в трех повторностях, как без пептида, так и с пептидом. Среднее число пептид-специфических пятен (после вычитания числа пятен без добавления пептида) было подсчитано для каждого больного с использованием ImmunoSpot® Series 2,0 Analyzer (CTL Analyzers, LLC, Cleveland, US). ELISPOT. PBMC от больного OTSC были взяты до первой sur1M2/Montanide-вакцинации и через один, три и шесть месяцев после нее. T-лимфоциты были стимулированы один раз пептидом до высева по 105 клеток на чашку в трех повторностях, как без пептида, так и с пептидом. Среднее число пептид-специфических пятен (после вычитания числа пятен без добавления пептида) было подсчитано для каждого больного с использованием ImmunoSpot® Series 2,0 Analyzer (CTL Analyzers, LLC, Cleveland, US).
Фиг.2. Кинетический анализ иммунитета в PBL от больного меланомой к пептиду сурвивина Sur1M2, определенного в тесте IFN- ELISPOT. PBMC от больного JUSC были взяты до первой sur1M2/Montanide-вакцинации и через один, три и шесть месяцев после нее. T-лимфоциты были стимулированы один раз пептидом до высева по 105 клеток на чашку в трех повторностях, как без пептида, так и с пептидом. Среднее число пептид-специфических пятен (после вычитания числа пятен без добавления пептида) было подсчитано для каждого больного с использованием ImmunoSpot® Series 2,0 Analyzer (CTL Analyzers, LLC, Cleveland, US). ELISPOT. PBMC от больного JUSC были взяты до первой sur1M2/Montanide-вакцинации и через один, три и шесть месяцев после нее. T-лимфоциты были стимулированы один раз пептидом до высева по 105 клеток на чашку в трех повторностях, как без пептида, так и с пептидом. Среднее число пептид-специфических пятен (после вычитания числа пятен без добавления пептида) было подсчитано для каждого больного с использованием ImmunoSpot® Series 2,0 Analyzer (CTL Analyzers, LLC, Cleveland, US).
Фиг.3. Кинетический анализ иммунитета в PBL от больного меланомой к пептиду сурвивина Sur1M2, определенного в тесте IFN- ELISPOT. PBMC от больного SIST были взяты до первой sur1M2/Montanide-вакцинации и через один, три и шесть месяцев после нее. T-лимфоциты были стимулированы один раз пептидом до высева по 105 клеток на чашку в трех повторностях, как без пептида, так и с пептидом. Среднее число пептид-специфических пятен (после вычитания числа пятен без добавления пептида) было подсчитано для каждого больного с использованием ImmunoSpot® Series 2,0 Analyzer (CTL Analyzers, LLC, Cleveland, US). ELISPOT. PBMC от больного SIST были взяты до первой sur1M2/Montanide-вакцинации и через один, три и шесть месяцев после нее. T-лимфоциты были стимулированы один раз пептидом до высева по 105 клеток на чашку в трех повторностях, как без пептида, так и с пептидом. Среднее число пептид-специфических пятен (после вычитания числа пятен без добавления пептида) было подсчитано для каждого больного с использованием ImmunoSpot® Series 2,0 Analyzer (CTL Analyzers, LLC, Cleveland, US).
ПРИМЕРЫ
Пример 1
Клинические результаты с использованием вакцинной композиции, содержащей полученные из сурвивина эпитопы и montanide ISA 51 в качестве адъюванта. Лечения были выполнены в группах онкологических больных, находящихся на последних стадиях, как описано в настоящем описании ниже.
Все клинические методики проводились в соответствии с Хельсинкской Декларацией, и все проинформированные больные давали согласие перед лечением. Клиническое исследование было одобрено Ethical review Boards of the University of Würzburg, Germany (Studien-Nr. 7/03) и the Paul-Ehrlich-lnstitute, Langen, Germany (Vorlagen-Nr 0899/01).
Больные
Для того чтобы иметь право участвовать в данных исследованиях, больные должны были соответствовать следующим критериям:
– измеряемые метастазирующие меланома, рак поджелудочной железы, толстой кишки или рак шейки матки,
– подтвержденное прогрессирующее заболевание,
– отсутствие успеха при проведении не менее одного стандартного лечения,
– ожидаемая продолжительность жизни не менее 3 месяцев,
– отсутствие лечения в течение последних 4 недель,
– отсутствие тяжких повреждений органов,
– тип ткани HLA-A1, -A2 или -B35 Класса I.
Пептиды
Все пептиды, включенные в данное исследование, представляли собой варианты пептидов сурвивина, полученные модификацией пептидов сурвивина при помощи одной аминокислотной замены. Вследствие этого, были получены улучшенные якорные остатки и увеличена аффинность связывания данного пептида с молекулой MHC. Использованные пептиды включают:
– HLA-A1-рестриктированный эпитоп FTELTLGEF (SEQ ID NO: 16)(сурвивин93-1012T, в котором нативный глутамин в положении 2 заменен на треонин).
– HLA-A2-рестриктированный эпитоп LMLGEFLKL (SEQ ID NO: 5)(сурвивин96-1042M, в котором нативный треонин в положении 2 заменен на метионин).
– HLA-B35-рестриктированный эпитоп EPDLAQCFY (SEQ ID NO: 9)(сурвивин51-599Y, в котором лейцин в положении 9 заменен на тирозин).
Сто мкг HLA-A1-, HLA-A2- или HLA-B35-рестриктированных пептидов сурвивина были смешаны с 1 мл Montanide ISA51 согласно инструкциям изготовителя (Seppic, Brussels, Belgium). Смесь вводилась глубокой подкожной инъекцией попеременно в конечности в непосредственной близости от отводящего лимфотического узла. Больные вакцинировались с 7-дневным интервалом между первыми двумя вакцинациями, с последующим 28-дневным интервалом при дальнейших вакцинациях.
Определение токсичности, клинического эффекта и иммунологических ответов
Токсичность определялась на основании врачебного осмотра/истории болезни, гематологических тестов и биохимического анализа крови. Такие осмотры проводились перед каждой вакцинацией.
Клинический эффект определялся на основании врачебного осмотра и результатов соответствующих диагностических исследований (таких как КТ-томография, МР-томография, рентгенограмма грудной клетки, ультразвуковая сцинтиграфия или сцинтиграфия скелета) перед началом лечения и каждые 3 месяца после него.
Иммунологические ответы отслеживались при помощи теста ELISPOT, с использованием PBMC для определения сурвивин96-104-специфических высвобождений IFN- . Для увеличения чувствительности теста ELISPOT PBMC были стимулированы один раз in vitro при концентрации 1·106 клеток в мл в 24-луночных плашках (Nunc, Denmark) в среде X-vivo (Bio Whittaker, Walkersville, Maryland) с добавлением 5% инактивированной теплом сыворотки крови человека и 2 мМ L-глутамина в присутствии 10 мкМ пептида. Через два дня было добавлено 40 IU/мл рекомбинантного интерлейкина-2 (IL-2) (Chiron, Ratingen, Germany). После 10 дней клетки были тестированы на реакционную способность. Вкратце, 96-луночные планшеты с расположенной на дне нитроцеллюлозой (MultiScreen MAIP N45, Millipore, Hedehusene, Denmark) были покрыты антителами к IFN- . Для увеличения чувствительности теста ELISPOT PBMC были стимулированы один раз in vitro при концентрации 1·106 клеток в мл в 24-луночных плашках (Nunc, Denmark) в среде X-vivo (Bio Whittaker, Walkersville, Maryland) с добавлением 5% инактивированной теплом сыворотки крови человека и 2 мМ L-глутамина в присутствии 10 мкМ пептида. Через два дня было добавлено 40 IU/мл рекомбинантного интерлейкина-2 (IL-2) (Chiron, Ratingen, Germany). После 10 дней клетки были тестированы на реакционную способность. Вкратце, 96-луночные планшеты с расположенной на дне нитроцеллюлозой (MultiScreen MAIP N45, Millipore, Hedehusene, Denmark) были покрыты антителами к IFN- (1-D1K, Mabtech, Nacka, Sweden). Лунки были промыты, забиты средой X-vivo перед добавлением 104 стимулирующих T2-клеток (с или без 10 мкМ пептида) и эффекторных клеток в различных концентрациях. Плашки инкубировались в течение ночи. На следующий день среда удалялась и лунки промывались, затем добавлялись биотинилированные вторые антитела (7-B6-1-Biotin, Mabtech). Плашки инкубировались в течение 2 часов, промывались, и в каждую лунку добавляли авидин-ферментный конъюгат (AP-Avidin, Calbiochem, Life Technologies). Плашки инкубировались при комнатной температуре в течение 1 часа, затем к каждой лунке добавляли ферментный субстрат NBT/BCIP (Gibco, Life Technologies) и инкубировали при комнатной температуре 5-10 минут. Реакция была остановлена промывкой водопроводной водой до появления темно-фиолетовых пятен. Пятна были обсчитаны с использованием ImmunoSpot® Series 2,0 Analyzer (CTL Analyzers, LLC, Cleveland, US), и пептид-специфические CTL частоты можно было определить по числу образующих пятна клеток. Все тесты проводились в трех повторностях для каждого пептидного антигена. (1-D1K, Mabtech, Nacka, Sweden). Лунки были промыты, забиты средой X-vivo перед добавлением 104 стимулирующих T2-клеток (с или без 10 мкМ пептида) и эффекторных клеток в различных концентрациях. Плашки инкубировались в течение ночи. На следующий день среда удалялась и лунки промывались, затем добавлялись биотинилированные вторые антитела (7-B6-1-Biotin, Mabtech). Плашки инкубировались в течение 2 часов, промывались, и в каждую лунку добавляли авидин-ферментный конъюгат (AP-Avidin, Calbiochem, Life Technologies). Плашки инкубировались при комнатной температуре в течение 1 часа, затем к каждой лунке добавляли ферментный субстрат NBT/BCIP (Gibco, Life Technologies) и инкубировали при комнатной температуре 5-10 минут. Реакция была остановлена промывкой водопроводной водой до появления темно-фиолетовых пятен. Пятна были обсчитаны с использованием ImmunoSpot® Series 2,0 Analyzer (CTL Analyzers, LLC, Cleveland, US), и пептид-специфические CTL частоты можно было определить по числу образующих пятна клеток. Все тесты проводились в трех повторностях для каждого пептидного антигена.
Результаты
Обзор клинических результатов, полученных с использованием пептидов сурвивина, включая: аббревиатуры больных, число вакцинаций и клинический ответ, приведен в таблице 3.
Токсичность: Никаких вызванных лечением побочных эффектов не наблюдалось. Никаких признаков системной или локальной токсичности в области инъекции не наблюдалось. Особое внимание обращалось на признаки сосудистых изменений, например васкулит или ослабленное заживление ран. Данные по гемоглобину, лейкоцитам и тромбоцитам, а также по лактат дегидрогеназе, креатинину и холинэстеразе не изменялись под воздействием вакцинационного лечения (результаты не представлены). Таким образом, не было обнаружено ни клинических, ни гистологических признаков сосудистых изменений. Более того, не было признаков ослабления заживления ран, геморрагических расстройств, дисфункции сердца, васкулита или воспалительного заболевания кишечника. Таким образом, вакцинация сурвивином является как переносимой, так и безопасной для онкологических больных, у которых сохранилось нормальное кроветворение.
Клинический эффект: Объективные клинические ответы были представлены в данной группе больных с довольно неблагоприятными прогнозами. Ответы включали полную регрессию опухоли с висцелярными метастазами у нескольких больных, однако в большинстве случаев имела место стабилизация заболевания. Удивительно, у двух больных с диагнозами кожная меланома (JuSc) и аденокарцинома поджелудочной железы (OtSc), соответственно, имела место полная регрессия опухоли (таблица 3), несмотря на факт, что предварительная химиотерапия для этих больных не имела успеха (Темодал® или Гемзар® соответственно). Таким образом, клинические результаты демонстрируют весьма успешное полное лечение с необычайно высокими степенью ответа и клиническим эффектом.
Сурвивин-специфические CD8+ T-клеточные ответы
У больных была отслежена кинетика ответов цитотоксических T-клеток. PBMC, полученные до и после вакцинации, были тестированы на реакционную способность по отношению к модифицированному эпитопу сурвивин96-104 при помощи теста ELISPOT для IFN- . У всех протестированных больных была выраженная индукция реагирующих на сурвивин Т-клеток. Для двух больных с полными ответами, OtSc (страдающего раком поджелудочной железы) и JuSc (страдающего меланомой), PBL были анализированы до вакцинации и через один, три и шесть месяцев после начала вакцинаций. У больного OtSc сильный ответ был выявлен уже через один месяц после начала процесса вакцинации. Этот ответ даже усилился после трех и шести месяцев. Так, можно было зарегистрировать более чем 600 сурвивин-специфических клеток на 104 (фиг.1). У больного JuSc ответ не выявлялся до шести месяцев (фиг.2), однако в шесть месяцев он был таким же сильным, как и у больного OtSc. Кроме того, авторы настоящего изобретения анализировали PBL из меланомы больного SiSt до вакцинации и через один и четыре месяца после начала процесса вакцинации. У больного SiSt сильный ответ был выявлен после четырех месяцев вакцинаций (фиг.3). Наконец, были проанализированы PBL из двух больных с меланомой в очень поздней стадии (AIKa и ErEi), при которой больные были способны получить только четыре вакцинации до того, как они умрут от их заболевания. У обоих этих больных был установлен ответ по отношению к пептидам сурвивина (данные не представлены). Результаты показывают, что даже у подвергнутых интенсивному предварительному лечению больных с застарелым заболеванием чрезвычайно сильные сурвивин-специфические T-клеточные ответы были установлены в пуле циркулиующих лимфоцитов у всех обследованных больных. Таким образом, после одной in vitro стимуляции PBL, полученных из вакцинированных больных, было зафиксировано более чем 250 IFN- . У всех протестированных больных была выраженная индукция реагирующих на сурвивин Т-клеток. Для двух больных с полными ответами, OtSc (страдающего раком поджелудочной железы) и JuSc (страдающего меланомой), PBL были анализированы до вакцинации и через один, три и шесть месяцев после начала вакцинаций. У больного OtSc сильный ответ был выявлен уже через один месяц после начала процесса вакцинации. Этот ответ даже усилился после трех и шести месяцев. Так, можно было зарегистрировать более чем 600 сурвивин-специфических клеток на 104 (фиг.1). У больного JuSc ответ не выявлялся до шести месяцев (фиг.2), однако в шесть месяцев он был таким же сильным, как и у больного OtSc. Кроме того, авторы настоящего изобретения анализировали PBL из меланомы больного SiSt до вакцинации и через один и четыре месяца после начала процесса вакцинации. У больного SiSt сильный ответ был выявлен после четырех месяцев вакцинаций (фиг.3). Наконец, были проанализированы PBL из двух больных с меланомой в очень поздней стадии (AIKa и ErEi), при которой больные были способны получить только четыре вакцинации до того, как они умрут от их заболевания. У обоих этих больных был установлен ответ по отношению к пептидам сурвивина (данные не представлены). Результаты показывают, что даже у подвергнутых интенсивному предварительному лечению больных с застарелым заболеванием чрезвычайно сильные сурвивин-специфические T-клеточные ответы были установлены в пуле циркулиующих лимфоцитов у всех обследованных больных. Таким образом, после одной in vitro стимуляции PBL, полученных из вакцинированных больных, было зафиксировано более чем 250 IFN- -высвобождающих клеток и в конкретных примерах более чем 600 IFN- -высвобождающих клеток и в конкретных примерах более чем 600 IFN- -высвобождающих клеток на 104 клеток. -высвобождающих клеток на 104 клеток.
Пример 2
Иммуногистохимическое окрашивание
Биотинилированные пептид/HLA комплексы мультимеризуются при помощи стрептавидин-FITC-конъюгированных молекул декстрана (DAKO, Glostrup, Denmark) с образованием мультивалентного соединения HLA-декстран для иммуногистохимического окрашивания. Срезы ткани высушивались в течение ночи и затем фиксировались в охлажденном ацетоне в течение 5 минут. Все стадии инкубации проводились в темноте при комнатной температуре: (a) 45 минут с первыми антителами (разведение 1:100), (b) с Cy 3-конъюгированными антителами козла против мыши (разбавлен 1:500; код 115-165-100; Jackson ImmunoResearch, получен от Dianova, Hamburg, Germany) в течение 45 минут; и, наконец, (c) с мультимером в течение 75 минут. Между каждой стадией стекла промывались два раза по 10 минут в PBS/BSA 0,1%. Образцы помещались в среду Vectashield и хранились в холодильнике до исследования при помощи конфокального микроскопа (Leica).
Формула изобретения
1. Вакцинная композиция, пригодная для лечения рака, содержащая:
(i) один или несколько вариантов пептидных фрагментов, полученных из белка сурвивина, имеющего аминокислотную последовательность SEQ ID NO:23, где указанный пептидный фрагмент выбран из группы, состоящей из:
FTELTLGEF (SEQ ID NO:16),
LMLGEFLKL (SEQ ID NO:5),
EPDLAQCFY (SEQ ID NO:9),
APPAWQPFL (SEQ ID NO:13) и
RPPAWQPFL (SEQ ID NO:14), и
(ii) адъювант, составленный как эмульсия «вода в масле», содержащая минеральное масло и поверхностно-активное вещество, где адъювант содержит до 14,5% по объему указанного поверхностно-активного вещества.
2. Вакцинная композиция по п.1, содержащая пептиды
FTELTLGEF (SEQ ID NO:16),
LMLGEFLKL (SEQ ID NO:5),
EPDLAQCFY (SEQ ID NO:9).
3. Вакцинная композиция по п.1, где адъювант содержит от 5 до 14% по объему указанного поверхностно-активного вещества.
4. Вакцинная композиция по п.1, где вязкость указанного поверхностно-активного вещества составляет 200-400 мПа·с.
5. Вакцинная композиция по п.1, где адъювант содержит поверхностно-активное вещество маннидолеат.
6. Вакцинная композиция по п.1, где адъювантом является адвювант Montanide ISA.
7. Вакцинная композиция по п.6, где адъювантом является Montanide ISA 51 или Montanide ISA 720.
8. Вакцинная композиция по п.7, где адъювантом является Montanide ISA 51.
9. Применение вакцинной композиции по п.1 для производства лекарственного средства для лечения рака.
10. Применение по п.9, где раком является злокачественная меланома, рак поджелудочной железы, рак шейки матки или рак толстой кишки.
11. Способ стимулирования сильного специфического Т-клеточного ответа к сурвивину у субъекта, включающий:
a) получение вакцинной композиции по п.1,
b) введение указанной вакцинной композиции субъекту, где указанная вакцинная композиция может вводиться более одного раза; и
c) определение Т-клеточного ответа посредством теста ELISPOT, где сильный специфический Т-клеточный ответ стимулируется, когда получены более 50 пептидспецифических пятен на 104 РВМС клеток после введения вакцинной композиции.
12. Способ лечения или профилактики рака у субъекта, включающий:
a) получение вакцинной композиции по п.1 и
b) введение указанной вакцинной композиции указанному субъекту, где указанная вакцинная композиция может вводиться более одного раза;
c) определение Т-клеточного ответа посредством теста ELISPOT, где сильный специфический Т-клеточный ответ стимулируется, когда получены более 50 пептидспецифических пятен на 104 РВМС клеток после введения вакцинной композиции;
d) получение клинического ответа у субъекта.
13. Способ по п.11 или 12, где сильный специфический Т-клеточный ответ стимулируется, когда указанным тестом ELISPOT получены по меньшей мере 250 пептидспецифических пятен на 104 РВМС клеток.
14. Способ по п.12, где рак выбран из группы злокачественная меланома, рак поджелудочной железы, рак шейки матки и рак толстой кишки.
РИСУНКИ
|
|