|
|
(21), (22) Заявка: 2006137575/15, 17.03.2005
(24) Дата начала отсчета срока действия патента:
17.03.2005
(30) Конвенционный приоритет:
25.03.2004 EP 04007177.1
(43) Дата публикации заявки: 27.04.2008
(46) Опубликовано: 10.08.2010
(56) Список документов, цитированных в отчете о
поиске:
BRACKEN M.B. “A randomized, controlled trial of methylprednisolone or naloxone in the treatment of acute spinal-cord injury. Results of the Second National Acute Spinal Cord Injury Study.” The New England journal of medicine, 1990 May 17; 322(20): 1405-1411, реферат [Найдено 03.03.2009] Medline [он-лайн] РМID: 2278545. WO 0024710 A1, 04.05.2000. WO02062330 A2, 15.08.2002. LI J.J. “Small molecule interieukin-8 modulators” Expert Opin. Ther. Patents, 2001 11(12):1905-1910. ISAKSSON J. “Expression of ICAM-1 and CD11b after experimental spinal cord injury in rats” Journal of neurotrauma 1999 Feb; 16(2):165-73. XU J. “Polymorphonuclear (PMN) cell infiltration in experimental spinal cord injury” Society for neuroscience abstracts, 1987, 13(3):1500. US 2001016195 A1, 23.08.2001. KUNIHARAT. “Proinflammatory cytokines in cerebrospinal fluid in repair of thoracoabdominal aorta” The Annals of thoracic surgery 2001 Mar; 71(3):801-806.
(85) Дата перевода заявки PCT на национальную фазу:
25.10.2006
(86) Заявка PCT:
EP 2005/002822 20050317
(87) Публикация PCT:
WO 2005/092315 20051006
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег.  517 517
|
(72) Автор(ы):
БЕРТИНИ Риккардо (IT),
КОЛОТТА Франческо (IT)
(73) Патентообладатель(и):
ДОМПЕ ФА.Р.МА С.п.А. (IT)
|
(54) ПРИМЕНЕНИЕ N-(2-АРИЛПРОПИОНИЛ)СУЛЬФОНАМИДОВ ДЛЯ ЛЕЧЕНИЯ ПОВРЕЖДЕНИЯ СПИННОГО МОЗГА
(57) Реферат:
Изобретение относится к лекарственным средствам и касается применения N-(2-арилпропионил)сульфонамидов общей формулы (I)
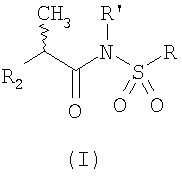
где R’, R2 и R имеют указанные в формуле значения, для получения лекарственного средства, предназначенного для лечения повреждения спинного мозга. Предложенные N-(2-арилпропионил)сульфонамиды общей формулы (I) обеспечивают блокирование апоптоза олигодендроцитов и сохраняют глиальную ткань спинного мозга. 2 з.п. ф-лы, 3 табл.,4 ил.
Настоящее изобретение касается применения N-(2-арилпропионил)сульфонамидов общей формулы (I)

в которой R2 представляет собой арилгруппу,
R представляет собой прямолинейный или разветвленный C1-C6-алкил, трифторметил, циклогексил, о-толил, 3-пиридил, 2-пиридил-этил, п-цианофенилметил, п-аминофенилметил, 3-циано-1-пропил, 4-аминобутилгруппу, алкоксиэтилен СН3-(СН2)ni-(OCH2CH2)mi-группу, в которой ni равно нулю или 1, a mi равно целому числу от 1 до 3, или P1P2N-CH2-CH2-группу, в которой P1 и Р2 независимо представляют собой Н, C1-С3-алкил, бензилоксикарбонил,  -, -,  – или – или  -пиридокарбонил, карбоксикарбонил или карбалкоксикарбонил, либо P1 и Р2, будучи присоединенными к атому N, с которым они связаны, образуют фталимидо-, пиперидино-, морфолиноостаток; -пиридокарбонил, карбоксикарбонил или карбалкоксикарбонил, либо P1 и Р2, будучи присоединенными к атому N, с которым они связаны, образуют фталимидо-, пиперидино-, морфолиноостаток;
R’ представляет собой Н либо прямолинейный или разветвленный C1-С3-алкил, предпочтительно – водород, для получения лекарственного препарата, предназначенного для лечения повреждения спинного мозга.
Уровень техники
Повреждение спинного мозга (SCI) является одним из самых тяжелых состояний в неврологии и медицине. Преобладающее количество пациентов с SCI являются молодыми, при этом перспективой большинства людей, перенесших серьезную травму, является ограниченное восстановление и постоянная инвалидность. Количество новых случаев SCI велико и превышает 12000 новых случаев в год параплегии или тетраплегии в Соединенных Штатах (Sekhon L. et al. Spine 26, S2-S12, 2001). Тем не менее, благодаря более высокому качеству лечения, уровень смертности от SCI неуклонно падает. Поэтому количество пациентов, являющихся инвалидами в результате SCI, в настоящее время только в Соединенных Штатах приближается к 200000. Сильно ощущается необходимость эффективного острого вмешательства как для снижения числа постоянных инвалидов, так и для лечения новых больных.
Лечение SCI в настоящее время ограничено введением больших доз глюкокортикоидов, которое является целесообразным в течение нескольких часов после повреждения (Bracken M.B. et al. The New England Journal of Medicine 322, 1405-1411, 1990). Механизмы, в результате которых стероиды оказывают свое умеренное терапевтическое действие, остаются непонятными, несмотря на то, что обычно их объясняют защитным действием на перекисное окисление липидов. В самом деле метилпреднизолон подавляет разрыв мембраны и нейрофиламента, ингибируя перекисное окисление липидов в поврежденном спинном мозге (Braughler J.M. et al. J. Neurosurg. 67, 102-105, 1987). Тем не менее, несмотря на неадекватность в своей основе, лечение большими дозами глюкокортикоидов остается единственным возможным способом лечения SCI.
В настоящее время известно, что патогенез SCI включает цитокины, особенно фактор некроза опухоли (ФНО), экспрессирование которого способствует отмиранию нейронов после SCI (Beattie M.S. et al. Progress in Brain Research 137, 37-47, 2002) и инфильтрацию лейкоцитов. В самом деле SCI приводит как к первичному повреждению, характеризующемуся разрывом нервной и сосудистой структуры, так и к каскаду вторичных процессов, совместно приводящих к дополнительной потере ткани. Предполагается, что посттравматическое воспаление, характеризующееся накоплением микроглии и лейкоцитов, способствует вторичному патогенезу (Mautes А.Е.М. et al. Physical Therapy 80, 673-687, 2000). Способы, целью которых является блокирование притока нейтрофилов или макрофагов и ингибирование фагоцитарной и секреторной активности макрофагов в поврежденном спинном мозге, обеспечивают нейрозащиту и улучшение двигательной функции (Giulian D. et al. Ann. Neurol. 27, 33-42, 1990; Taoka Y. et al. Neuroscience 79, 1177-1182, 1997).
В самом деле, в соответствии с современным уровнем знаний, селективное ингибирование индуцированного интерлейкином-8 (CXCL-8) хемотаксиса не является достаточным условием для защиты SCI. Действительно, в научной литературе описано множество факторов этиологии SCI, среди которых CXCL8, безусловно, не является одним из самых важных факторов: например, Taoka Y. et al. (Journal of Neurokrauma 18, 533-543, 2001) описывают, что лейкопения и ингибирование восстановления лейкоцитов путем введения моноклонального антитела анти-Р-селектина существенно снижает моторные проблемы, наблюдаемые после SCI. Кроме того, последние исследования выявили повышенный уровень медиаторов воспаления в плазме, включая интерлейкин-2, интерлейкин-6, рецептор растворимого интерлейкина-2 и молекулу-1 межклеточной адгезии (ICAM-1) у пациентов, длительное время страдающих от SCI, в качестве возможных патогенных факторов задержки функционального восстановления (Segal J.L. et al. Arch. Phys. Med. Rehabil. 78, 44-47, 1997). В US 2001/0016195 описано лечение ряда различных патологий, включая SCI, при помощи антагонистов, например антител, различных цитокинов, включая IL-1, IL-6 и IL-8. Согласно данному документу SCI никак не связана с ингибированием IL-8. Из описанных данных следует, что для ингибирования SCI необходим аспецифический ингибитор воспалительного ответа или, по меньшей мере, восстановления лейкоцитов.
N-(2-арилпропионил)сульфонамиды вышеприведенной общей формулы (I) описаны в ЕР 1123276 и в заявке на Европейский патент ЕР 04101202.2. Указано, что описанные сульфонамиды могут быть использованы, например, для предотвращения и лечения повреждений ткани, вызванных усиленным рекрутментом полиморфонуклеарных нейтрофилов (PMN лейкоциты) в местах воспаления.
Раскрытие изобретения
К удивлению, было обнаружено, что упомянутые сульфонамиды формулы (I) и, в частности, сульфонамиды формулы (Ia)
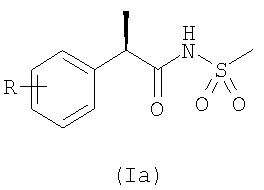
в которой R представляет собой от одного до трех заместителей, одинаковых или различных, и выбранных из водорода, атомов галогена, С1-С4-алкила, С1-С4-алкокси, гидрокси, С1-С7-ацилокси, циано, нитро, амино, С1-С3-ациламино, галоС1-С4-алкила, галоС1-С3-алкокси, бензоила, 4-(2-метилпропил)фенила, 3-феноксифенила, 2-[4-(1-оксо-2-изоиндолинил)фенила], 5-бензоил-тиен-2-ила, 4-тиеноилфенила, С1-С2-галогеналкилсульфонилокси, являются эффективными при защите от функционального повреждения в результате SCI.
В соединениях формулы (Ia) R предпочтительно представляет собой водород, 4-изобутил, 3-бензоил, 4-трифторметансульфонилокси.
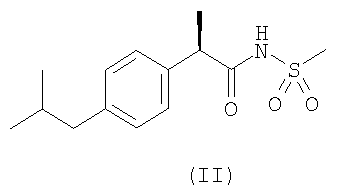
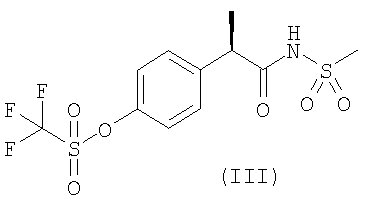
Защита от функционального повреждения в результате SCI была продемонстрирована на экспериментальной модели на крысах, подробно описанной ниже, с использованием двух характерных соединений формулы (I), а именно соединения формулы (II) и его лизиновой соли (L-лизин или DL-лизин) и соединения формулы (III). Было установлено, что на такой модели in vivo оба соединения являются очень активными.
 |
 |
| (R)-ибупрофена метансульфонамид |
R-2-[(4′-трифторметансульфонилокси)-фенил]-N-метансульфонила пропионамид |
Соединение формулы (II) и соединение формулы (III) также уменьшают степень повреждения тканей, оцениваемую как размер посттравматической полости, апоптоза олигодендроцитного и лейкоцитарной инфильтрации.
Изобретение проиллюстрировано следующим примером.
ПРИМЕР
Взрослых крыс Sprague-Dawley (самки) весом 240-260 г содержат в специальных клетках в обычных условиях (22±2°С, влажность 65%, искусственный свет от 06.00 до 20.00 ч). Стандартная сухая диета и вода присутствуют ad libitum.
SCI у крыс осуществляют в соответствии с описанием Gorio A. et al. Proc. Natl. Acad. Sci. USA 99, 9450-9455, 2002). Устройство для травмирования контролируется компьютером и свободно от влияния силы тяжести. Прикладываемое усилие составляет 1N в секунду.
Восстановление дееспособности задней конечности оценивают при помощи “теста на свободную локомоцию”, проводимого через 24 часа, 4, 7, 11, 15, 19 и 27 дней после SCI. Качество функционального восстановления выражают количественно в соответствии со “шкалой ВВВ”, разработанной в университете Огайо. Такой тест позволяет количественно определить дефицит свободной локомоции задней конечности крысы путем наблюдения за ее движением на открытом пространстве, свободном от препятствий:
0 – травмированная крыса не может двигать ни одной из конечностей;
1 – небольшое движение сустава (бедро или колено);
от 2 до 6 – движение по постепенному выпрямлению 3 суставов;
7 – хорошее движение 3 суставов;
8 – животные ходят без плантарной поддержки своей массы
от 9 до 11 – животные все чаще ходят с плантарной поддержкой своей массы;
12 – редкая координация задних и передних конечностей во время ходьбы;
от 13 до 14 – улучшающаяся координация с передними конечностями;
15 – последовательная плантарная поддержка массы и координация во время ходьбы; редкое движение пальцев во время продвижения;
от 16 до 18 – прогрессирующая тенденция к движению пальцев; во время ходьбы стопа в основном параллельна телу;
19 – положение стопы строго параллельно телу, а хвост немного поднят во время ходьбы;
20 – шатание в стороны и неустойчивая локомоция;
21 – нормальное состояние.
Апоптоз олигодендроцитов определяют на уровне тонкого и клиновидного пучков (3 мм в ростральном направлении от места контузионного повреждения) через 28 дней после SCI при помощи терминального ДУТФ, опосредованного дезоксинуклеотидилтрансферазой и методики мечения (TUNEL).
Инфильтрацию лейкоцитов определяют количественно по CD68 положительным клеткам через 1 и 7 дней после SCI.
Определение протяженности посттравматической полости осуществляют при помощи обычной гистологической методики через 28 дней после SCI.
Были исследованы следующие экспериментальные группы животных:
группа 1 (n=28): крысы, которым после SCI вводили физиологический раствор;
группа 2 (n=28): крысы, которым после SCI вводили соединение формулы (II);
группа 3 (n=28): крысы, которым после SCI вводили соединение формулы (III).
Животным вводили физиологический раствор или соединение формулы (II) (15 мг/кг) путем внутривенной инъекции в течение 30 минут после SCI, затем подкожно каждые 2 часа в течение следующих 6 часов. В последующие дни животным делали подкожные инъекции в 8 часов утра и в 17 часов до 7-го дня после SCI. Животным вводили соединение формулы (III) (8 мг/кг) путем внутривенной инъекции в течение 30 минут после SCI, затем подкожно через 24 часа после SCI. В последующие дни животным делали подкожные инъекции каждые 36 часов до 7-го дня после SCI.
Кроме того, оценивают действие соединения формулы (II) на восстановление дееспособности задней конечности после непрерывного подкожного вливания. Крысе подкожно имплантируют насос. Делают небольшой разрез кожи между лопатками и при помощи гемостата образуют карман, раздвигая подкожные соединительные ткани. Насос вставляют в карман, при этом замедлитель потока направлен в другую сторону от разреза. Разрез кожи закрывают зажимом для ран. Качество функционального восстановления оценивают через 24 часа, 4, 7, 11, 14 и 27 дней после SCI. Были исследованы следующие экспериментальные группы животных:
группа 1 (n=8): крысы, которым вводили физиологический раствор путем подкожного вливания через 30 минут после SCI;
группа 2 (n=8): крысы, которым вводили соединение формулы (II) со скоростью вливания 2,5 мг/кг/ч через 30 минут после SCI;
группа 3 (n=8): крысы, которым вводили соединение формулы (II) со скоростью вливания 5 мг/кг/ч через 30 минут после SCI;
группа 4 (n=8): крысы, которым вводили соединение формулы (II) со скоростью вливания 10 мг/кг/ч через 30 минут после SCI;
группа 5 (n=8): крысы, которым вводили соединение формулы (II) со скоростью вливания 10 мг/кг/ч через 24 часа после SCI.
Животным вводили физиологический раствор или соединение формулы (II) путем подкожного вливания вплоть до 7-го дня после SCI.
Данные анализируют при помощи ANOVA с последующим тестом Dunnet t. Статистическую значимость принимают на уровне Р<0,05.
Результаты
Действие соединения формулы (II) и соединения формулы (III) на функциональное восстановление (двигательная балльная оценка), выражаемое количественно в соответствии со “шкалой ВВВ”, оценивают в различное время после SCI. На фиг.1 показано действие (R)-ибупрофена метансульфонамида, а на фиг.2 – действие R-2-[(4′-трифторметансульфонилокси)фенил]-N-метансульфонила пропионамида. У всех животных, подвергнутых SCI, наблюдалось значительное повреждение в результате травмы (двигательная оценка равна 0 для всех групп), при этом существенное восстановление было незаметно в группе, получавшей наполнитель (физиологический раствор), вплоть до 7-го дня после SCI. Лечение соединением формулы (II) и соединением формулы (III) существенно ускоряет функциональное восстановление задней конечности после SCI. Восстановление имеет прогрессирующий характер, при этом наиболее эффективным периодом является период между 4-м и 11-м днем после SCI.
Иммуногистологическую оценку инфильтрации лейкоцитарной производят через 1 день и 7 дней после SCI. Как показано в таблице 1, соединение формулы (II) существенно снижает инфильтрацию лейкоцитарную (80% ингибирования) через 24 часа и 7 дней после SCI.
Подобное ингибирование рекрутмента лейкоцитов также наблюдается у крыс, получавших соединение формулы (III) (данные не представлены).
Хорошо известно, что апоптоз олигодендроцитов является основным событием, происходящим на ранних стадиях после травматического повреждения спинного мозга, и что объем неврологического восстановления также зависит от того, как такой процесс может быть нейтрализован или ослаблен. Отмирание олигодендроцитов вызывает демиелинизацию аксонов, уцелевших после травмы, вызывая в результате потерю способности проводить электрический импульс через поврежденный участок. Таким образом, фармакологическое ослабление апоптоза олигодендроцитов является первичной задачей любого фармакологического лечения, целью которого является ускорение восстановления после SCI. Как следует из таблицы 2, лечение соединением формулы (II) и соединением формулы (III) блокирует апоптоз олигодендроцитов, определяемый через 28 дней после SCI [85% и 65% ингибирования после лечения крыс (R)-ибупрофена метансульфонамидом и R-2-[(4′-трифторметансульфонилокси)фенил]-N-метансульфонила пропионамидом соответственно].
Наконец, было исследовано влияние соединения формулы (II) и соединения формулы (III) на повреждение тканей, индуцированное SCI. Как следует из таблицы 3, лечение вышеописанными соединениями существенно снижает уровень повреждения тканей в месте поражения и размер посттравматической полости через 28 дней после SCI.
Затем оценивали эффективность соединения формулы (II) для функционального восстановления после его непрерывного подкожного вливания. Как показано на фиг.3, лечение соединением формулы (II) со скоростью вливания 5 мг/кг/ч или 10 мг/кг/ч существенно ускоряет функциональное восстановление задней конечности после SCI, оцениваемого вплоть до 14 дней после SCI. Кроме того, соединение формулы (II), вводимое путем подкожного вливания со скоростью вливания 10 мг/кг/ч, существенно ускоряет функциональное восстановление задней конечности даже в том случае, если соединение начали вводить через 24 часа после SCI. Как показано на фиг.4, восстановление носит прогрессирующий характер, при этом наиболее эффективным периодом является период между 7-м и 24-м днем после SCI.
В заключение, приведенные выше данные ясно показывают, как соединение формулы (II) и соединение формулы (III) могут быть целесообразно использованы в медицинской практике для ускорения функционального восстановления после SCI.
| Таблица 1 |
| Количество инфильтрирующих лейкоцитов (среднее ±SE; n=8) |
| Время после SCI |
1 день |
7 дней |
 |
Физиологический раствор |
Формула (II) |
Физиологический раствор |
Формула (II) |
| Эпицентр |
125±36 |
24±3*** |
235±54 |
19±3*** |
| Периферия |
56±13 |
3±1*** |
99±2 |
4±2*** |
| ***Р<0,001 – животные, получавшие (R)-ибупрофена метансульфонамид, в сравнении с животными, получавшими физиологический раствор |
| Таблица 2 |
| Количество апоптозных ядер олигодендроцитов (среднее ±SE; n=12) |
| Лечение |
| Физиологический раствор |
14,9±2 |
| (R)-ибупрофена метансульфонамид |
2,1±1,2* |
| R-2-[(4′-трифторметансульфонилокси)фенил]-N-метансульфонила пропионамид |
5,2±3,8* |
| *Р<0,05 и ***Р<0,001 – животные, получавшие лекарственные препараты, в сравнении с животными, получавшими физиологический раствор |
| Таблица 3 |
| Процент сохраненной ткани в месте поражения (среднее ±SE; n=12) |
| Лечение |
Эпицентр поражения |
Объем полости |
| Физиологический раствор |
39,8±3,9 |
46,6±3,1 |
| (R)-ибупрофена метансульфонамид |
48,9±3,0** |
58,2±2,9** |
| R-2-[(4′-трифторметансульфонилокси)-фенил]-N-метансульфонила пропионамид |
49,7±4,2** |
60,4±4,3** |
| **Р<0,001 – животные, получавшие лекарственные препараты, в сравнении с животными, получавшими физиологический раствор |
Подходящие фармацевтические композиции для указанных терапевтических целей могут быть получены при помощи способов и эксципиентов, например, описанных в “Remington’s Pharmaceutical Sciences Handbook”, Mack Publishing Co., New York, 18th Ed., 1990.
Композиции согласно данному изобретению предпочтительно вводят внутримышечно, внутривенно, в виде болюсов ввиду срочного характера подвергаемой лечению патологии, даже в тех случаях, когда могут быть использованы другие способы введения, например пероральный способ.
Средняя суточная доза зависит от различных факторов, таких как тяжесть заболевания и состояний пациента (возраст, пол и масса). Доза обычно варьируется от 1 или нескольких мг до 1500 мг соединения ежесуточно, необязательно разделенная на несколько частей. Введение более высоких доз также возможно благодаря низкой токсичности соединений согласно данному изобретению, даже при длительном лечении.
Формула изобретения
1. Применение N-(2-арилпропионил)сульфонамидов общей формулы (I)
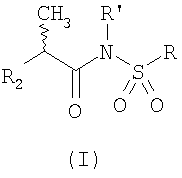
в которой R’ представляет собой Н,
R2 представляет собой арилгруппу, выбранную из 4-изобутилфенила, 3-бензоилфенила, 4-трифторметансульфонилоксифенила,
R представляет собой прямолинейный или разветвленный C1-С6-алкил,
для получения лекарственного средства, предназначенного для лечения повреждения спинного мозга.
2. Применение по п.1 соединений формул (II) и (III)
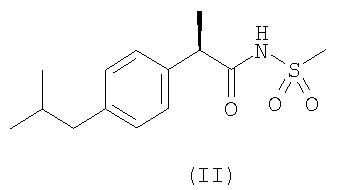 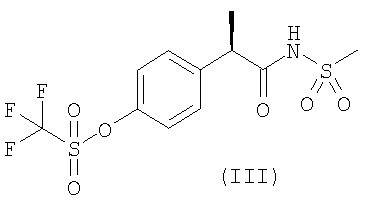
3. Применение по п.1 или 2 для блокирования апоптоза олигодендритов, уменьшения повреждения ткани и ускорения функционального восстановления после повреждения спинного мозга.
РИСУНКИ
|
|