|
|
(21), (22) Заявка: 2007106076/14, 19.07.2005
(24) Дата начала отсчета срока действия патента:
19.07.2005
(30) Конвенционный приоритет:
20.07.2004 US 60/589,782
(43) Дата публикации заявки: 27.08.2008
(46) Опубликовано: 27.06.2010
(56) Список документов, цитированных в отчете о
поиске:
(85) Дата перевода заявки PCT на национальную фазу:
20.02.2007
(86) Заявка PCT:
US 2005/025734 20050719
(87) Публикация PCT:
WO 2006/014729 20060209
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
ФЕРРАРА Наполеоне (US),
ГЕРБЕР Ханс-Петер (US),
ЛЯН Сяо Хуан (US)
(73) Патентообладатель(и):
ДЖЕНЕНТЕК, ИНК. (US)
|
(54) ИНГИБИТОРЫ АНГИОПОЭТИНПОДОБНОГО БЕЛКА 4, ИХ КОМБИНАЦИИ И ПРИМЕНЕНИЕ
(57) Реферат:
Группа изобретений относится к медицине, а именно к онкологии, и может быть использована для лечения опухолей. Изобретения включают способы, композицию и набор для блокирования или уменьшения роста опухоли или роста злокачественной клетки. Согласно изобретениям лечение включает введение антагониста ангиопоэтинподобного белка 4 (ANGPTL4) как одного, так и с антиангиогенными средствами, в частности с антагонистом фактора роста эндотелиальных клеток сосудов (VEGF). Использование изобретений позволяет повысить эффективность подавления опухолевого роста за счет уменьшения активности ANGPTL4 под действием антагониста. 8 н. и 32 з.п. ф-лы, 13 ил., 4 табл.
Настоящая заявка притязает на приоритет согласно статье 119(e) на основании предварительной заявки на выдачу патента США с регистрационным  60/589782, поданной 20 июля 2004, описание которой включено в данную заявку в полном объеме. 60/589782, поданной 20 июля 2004, описание которой включено в данную заявку в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в общем относится к лечению заболеваний и патологических состояний человека, таких как злокачественная опухоль. Изобретение относится к ингибиторам ангиопоэтинподобного белка 4 (ANGPTL4) и комбинациям ингибиторов ANGPTL4 с другими терапевтическими средствами и к способам применения таких композиций для диагностики и лечения заболеваний или патологических состояний.
УРОВЕНЬ ТЕХНИКИ
Злокачественная опухоль является лидирующей причиной смерти в Соединенных Штатах Америки. Для лечения злокачественной опухоли использовали различные типы терапии. Например, используют хирургические способы удаления злокачественной или отмершей ткани. В качестве терапии злокачественной опухоли использовали лучевую терапию, которая действует посредством уменьшения злокачественных опухолей, и химиотерапию, которая убивает быстро делящиеся клетки.
В 1971 году Folkman предположил, что антиангиогенез может быть эффективной противоопухолевой методикой. Folkman, N. Engl. J. Med. 285, 1182-1186 (1971). Ангиогенез представляет собой развитие новой сосудистой сети из уже существующих кровеносных сосудов и/или циркулирующих эндотелиальных стволовых клеток (см., например, Ferrara & Alitalo, Nature Medicine 5 (12): 1359-1364 (1999)). Ангиогенез представляет собой каскад процессов, состоящий из 1) разрушения внеклеточного матрикса в локальном месте после высвобождения протеазы, 2) пролиферации эндотелиальных клеток капилляров и 3) миграции капиллярных трубочек по направлению к ангиогенному стимулу. Ferrara et al. Endocrine Rev. 13: 18-32 (1992).
Рост новых кровеносных сосудов во время нормальных физиологических процессов является необходимым условием эмбрионального и постнатального развития, например, эмбриогенеза, заживления ран и менструации. См., например, Folkman and Klagsbrun Science 235: 442-447 (1987). Такая пролиферация новых кровеносных сосудов из предсуществующих капилляров, кроме того, играет ключевую роль в патологическом развитии различных заболеваний, включая, без ограничения, например, злокачественные опухоли, пролиферативные ретинопатии, возрастную дегенерацию желтого пятна, псориаз, воспаление, диабет и ревматоидный артрит (RA). См., например, Ferrara, Recent Prog. Horm. Res. 55: 15-35 (2000), discussion 35-6.
Принимая во внимание исключительную важность ангиогенеза с точки зрения физиологии и патологии, много работ было посвящено выяснению факторов, способных регулировать данный процесс. Высказывалось предположение, что процесс ангиогенеза регулируется посредством баланса между про- и антиангиогенными молекулами, и его срыв происходит при различных заболеваниях, в частности при злокачественной опухоли. См., например, Carmeliet and Jain, Nature 407: 249-257 (2000).
Например, ангиогенез зависит от секретируемых факторов, подобных фактору роста эндотелиальных клеток сосудов A (VEGF, также известному как фактор проницаемости сосудов (VPF)) и фактору роста фибробластов (FGF). См., например, Ferrara and Davis-Smyth Endocrine Rev. 18: 4-25 (1997); и Ferrara J. Mol. Med. 77: 527-543 (1999). В дополнение к тому, что он является ангиогенным фактором в ангиогенезе и васкулогенезе, VEGF в качестве плейотропного фактора роста оказывает множество биологических эффектов в случае других физиологических процессов, таких как обеспечение жизнеспособности эндотелиальных клеток, проницаемость и вазодилатация сосудов, хемотаксис моноцитов и приток кальция. Ferrara and Davis-Smyth (1997), выше. Кроме того, сообщалось об исследованиях митогенного действия VEGF на некоторые типы неэндотелиальных клеток, таких как пигментированные эпителиальные клетки сетчатки глаза, клетки протока поджелудочной железы и шванновские клетки. См., например, Guerrin et al. J. Cell Physiol. 164: 385-394 (1995); Oberg-Welsh et al. Mol. Cell. Endocrinol. 126: 125-132 (1997); и Sondell et al. J. Neurosci. 19: 5731-5740 (1999).
VEGF относится к семейству генов, которое включает в себя плацентарный фактор роста (PlGF), VEGF-B, VEGF-C, VEGF-D и VEGF-E. Указанные лиганды связываются с тирозинкиназными рецепторами, экспрессированными на эндотелиальных клетках. Например, семейство тирозинкиназных рецепторов VEGF включает Flt1 (VEGF-R1) (который связывает лиганды VEGF, VEGF-B и PlGF), Flk1/KDR (VEGF-R2) (который связывает VEGF, VEGF-C, VEGF-D и VEGF-E) и Flt4 (VEGF-R3) (который связывает VEGF-C и VEGF-D). См., например, Ferrara et al., Nature Medicine 9 (6): 669-676 (2003); и Robinson & Stringer, Journal of Cell Science, 114 (5): 853-65 (2001).
Ангиопоэтины представляют собой другую группу факторов роста эндотелия сосудов. См., например, Davis et al., Cell, 87: 1161-1169 (1996); Suri et al., Cell, 87: 1171-1180 (1996); Maisonpierre et al. Science 277: 55-60 (1997) и Valenzuela et al., Proc. Natl. Acad. Sci. USA 96: 1904-1909 (1999). По-видимому, ангиопоэтины работают комплементарным и координированным с VEGF образом, при этом VEGF действует в процессе развития сосудов, тогда как ангиопоэтины, наиболее вероятно, действуют посредством модулирования ремоделирования, созревания и стабилизации сосудистой сети. См., например, Holash et al., Oncogene 18: 5356-5362 (1999). Ангиопоэтин 1, ангиопоэтин 2, ангиопоэтин 3 и ангиопоэтин 4 связываются с тирозинкиназными рецепторами Tie2 (также известными как Tek), которые являются рецепторами, встречающимися на эндотелиальных клетках. См., например, Ward & Dumont, Seminars in Cell & Developmental Biology, 13: 19-27 (2002). Также существует сиротский рецептор Tie1.
Ангиогенез зависит не только от факторов роста, но также подвержен влиянию молекул клеточной адгезии (CAM), включая интегрины, связывающиеся со своими лигандами, присутствующими во внеклеточном матриксе. См., например, Ferrara & Alitalo, Nature Medicine 5 (12): 1359-1364 (1999) и Carmeliet, Nature Medicine, 6 (3): 389-395 (2000). Интегрины способствуют клеточной адгезии и миграции по белкам внеклеточного матрикса, обнаруженным в межклеточных пространствах и базальных мембранах. Интегриновое семейство белков клеточной адгезии состоит, по меньшей мере, из 18  – и 8 – и 8  -субъединиц, которые экспрессируются, по меньшей мере, в 22 комбинациях гетеродимеров -субъединиц, которые экспрессируются, по меньшей мере, в 22 комбинациях гетеродимеров   . См., например, Byzova et al., Mol. Cell., 6 (4): 851-860 (2000) и Hood and Cheresh, Nature Reviews, 2: 91-99 (2002). Из них, по меньшей мере, шесть комбинаций ( . См., например, Byzova et al., Mol. Cell., 6 (4): 851-860 (2000) и Hood and Cheresh, Nature Reviews, 2: 91-99 (2002). Из них, по меньшей мере, шесть комбинаций ( V V 3, 3,  V V 5, 5,  5 5 1, 1,  2 2 1, 1,  V V 1 и 1 и  1 1 1) вовлечены в ангиогенез (см., например, Hynes and Bader, Thromb. Haemost., 78 (1): 83-87 (1997) и Hynes et al., Braz. J. Med. Biol. Res., 32 (5): 501-510 (1999)). Инактивация различных генов, кодирующих специфичные для адгезии рецепторы, или введение блокирующих антител в животных моделях оказывает сильное воздействие на ангиогенный ответ эндотелиальных клеток. См., например, Elicieri and Cheresh, Mol. Med., 4: 741-750 (1998). 1) вовлечены в ангиогенез (см., например, Hynes and Bader, Thromb. Haemost., 78 (1): 83-87 (1997) и Hynes et al., Braz. J. Med. Biol. Res., 32 (5): 501-510 (1999)). Инактивация различных генов, кодирующих специфичные для адгезии рецепторы, или введение блокирующих антител в животных моделях оказывает сильное воздействие на ангиогенный ответ эндотелиальных клеток. См., например, Elicieri and Cheresh, Mol. Med., 4: 741-750 (1998).
Указанные молекулы были сделаны мишенями для терапии злокачественных опухолей. Например, выяснение того, что VEGF является первичным регулятором ангиогенеза при патологических состояниях, привело к многочисленным попыткам блокировать активности VEGF. Ингибирующие антитело против рецептора VEGF растворимые конструкции рецепторов, антисмысловые подходы, аптамеры РНК против VEGF и низкомолекулярные ингибиторы тирозинкиназного рецептора (RTK) VEGF были предложены для применения с целью препятствовать передаче сигнала VEGF. См., например, Siemeister et al. Cancer Metastasis Rev. 17: 241-248 (1998). Было показано, что нейтрализующие антитела против VEGF подавляют рост различных линий опухолевых клеток человека у мышей nude (Kim et al. Nature 362: 841-844 (1993); Warren et al. J. Clin. Invest. 95: 1789-1797 (1995); Borgström et al. Cancer Res. 56: 4032-4039 (1996) и Melnyk et al. Cancer Res. 56: 921-924 (1996)), а также ингибируют внутриглазной ангиогенез в моделях ишемических заболеваний сетчатки глаза (Adamis et al. Arch. Ophthalmol. 114: 66-71 (1996)). Действительно, гуманизированное анти-VEGF-антитело, бевацизумаб (Avastin®, Genentech), было одобрено FDA США в качестве терапии первой линии метастатического рака прямой и ободочной кишки. См., например, Ferrara et al., Nature Reviews Drug Discovery, 3: 391-400 (2004).
Однако современные способы лечения злокачественных опухолей не всегда являются оптимальными. Часто один тип терапии не может полностью подавить патологическое состояние. Например, хирургические способы часто не могут исключить весь злокачественный рост. Другие способы лечения злокачественных опухолей, такие как химиотерапия, имеют многочисленные побочные эффекты и/или терапия становится неэффективной, например, в результате развития резистентности злокачественной опухоли к лекарственному средству или способу лечения. Ингибирование VEGF или рецептора VEGR или системы рецепторов Tie2 иногда не полностью подавляет рост опухоли. См., например, Gerber et al., Cancer Research, 60: 6253-6258 (2000); Ferrara et al., Nature Reviews: Drug Discovery, 3: 391-400 (2004); Millauer et al., Nature 367, 576-579 (1994); Kim et al., Nature 362: 841-844 (1993); Millauer et al., Cancer Res. 56: 1615-1620 (1996); Goldman et al., Proc. Natl. Acad. Sci. USA 95: 8795-8800 (1998); Asano et al., Cancer Research, 55: 5296-5301 (1995); Warren et al., J. Clin. Invest., 95: 1789-1797 (1995); Pong et al., Cancer Res. 59: 99-106 (1999); Wedge et al., Cancer Res. 60: 970-975 (2000); Wood et al. Cancer Res. 60: 2178-2189 (2000); Siemeister et al., Cancer Res. 59: 3185-3191 (1999); Lin et al., J. Clin. Invest. 103: 159-165 (1999); Lin et al. Proc. Natl. Acad. Sci. USA 95: 8829-8834 (1998); and Siemeister et al., Cancer Res. 59, 3185-3191 (1999).
Таким образом, существует крайняя необходимость в новых и более эффективных способах терапии для борьбы со злокачественными опухолями. Изобретение относится к указанным и другим потребностям, которые будут понятны при рассмотрении следующего описания.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к ингибиторам ангиопоэтинподобного белка 4 (ANGPTL4) и способам применения таких ингибиторов для лечения заболеваний и патологических состояний, например для блокирования или уменьшения роста опухоли или роста злокачественных клеток, для блокирования или уменьшения рецидивирующего опухолевого роста и т.д. Изобретение относится к комбинациям ингибиторов ANGPTL4 и противоопухолевых средств и к способам применения таких комбинаций для ингибирования опухолевого роста. Изобретение также относится к комбинациям ингибиторов ANGPTL4 и ингибиторов ангиогенеза и к способам применения таких комбинаций для ингибирования злокачественного роста и/или расстройств, в которые вовлечен ангиогенез, например неопластических (например, опухолевого роста) и не неопластических расстройств.
Предлагаются модуляторы ANGPTL4, например антагонисты или агонисты ANGPTL4. Антагонистами ANGPTL4 согласно изобретению являются молекулы, которые ингибируют или уменьшают активность ANGPTL4. Ингибитор ANGPTL4 может включать вещество с низкой молекулярной массой, полинуклеотид, антисмысловые молекулы, аптамеры РНК, рибозимы против ANGPTL4 или полипептидов его рецептора, полипептид, антагонистические варианты ANGPTL4, изолированный белок, рекомбинантный белок, антитело или его конъюгаты или слитые белки, которые ингибируют активность ANGPTL4 прямо или опосредованно. В некоторых вариантах осуществления изобретения антагонист ANGPTL4 включает антитело, которое связывает ANGPTL4. В некоторых вариантах осуществления изобретения антагонистическим анти-ANGPTL4-антителом является антитело, которое ингибирует или уменьшает активность ANGPTL4 в результате связывания со специфичной подпоследовательностью или областью белка ANGPTL4, например N-концом, N-концевым биспиральным доменом, C-концом, C-концевым фибриногенподобным доменом или аминокислотной подпоследовательностью ANGPTL4 (1-183), ANGPTL4 (23-183), ANGPTL4 (от 1 до примерно 162), ANGPTL4 (примерно 162-406), ANGPTL4 (23-406) или ANGPTL4 (184-406) человеческого ANGPTL4 и/или аминокислотной подпоследовательностью mANGPTL4 (1-183), mANGPTL4 (23-183), mANGPTL4 (от 1 до примерно 165), mANGPTL4 (от 23 до примерно 165), mANGPTL4 (23-410) или mANGPTL4 (184-410) мышиного ANGPTL4. Другие подпоследовательности также включают без ограничения, например, 40-183, 60-183, 80-183, 100-183, 120-183, 140-183, 40-406, 60-406, 80-406, 100-406, 120-406, 140-406 и 160-406 hANGPTL4 и, например, 40-183, 60-183, 80-183, 100-183, 120-183, 140-183, 40-410, 60-410, 80-410, 100-410, 120-410, 140-410 и 160-410 mANGPTL4. В некоторых вариантах осуществления изобретения антагонист ANGPTL4 включает анти- v v 5-антитело, например антагонистическое анти- 5-антитело, например антагонистическое анти- v v 5-антитело. В некоторых вариантах антитела согласно изобретению являются гуманизированными антителами. В некоторых вариантах осуществления изобретения антагонистом ANGPTL4 является молекула миРНК. В одном варианте молекулой миРНК является молекула ANGPTL4-миРНК, при этом мишенью молекулы является последовательность ДНК (например, GTGGCCAAGCCTGCCCGAAGA) (SEQ ID NO: 3) нуклеиновой кислоты, кодирующей ANGPTL4. 5-антитело. В некоторых вариантах антитела согласно изобретению являются гуманизированными антителами. В некоторых вариантах осуществления изобретения антагонистом ANGPTL4 является молекула миРНК. В одном варианте молекулой миРНК является молекула ANGPTL4-миРНК, при этом мишенью молекулы является последовательность ДНК (например, GTGGCCAAGCCTGCCCGAAGA) (SEQ ID NO: 3) нуклеиновой кислоты, кодирующей ANGPTL4.
Предлагаются способы блокирования или уменьшения опухолевого роста или роста злокачественной клетки. В некоторых вариантах способы заключаются во введении в опухоль или злокачественную клетку эффективного количества антагониста ангиопоэтинподобного белка 4 (ANGPTL4). В другом варианте антагонистом ANGPTL4 является антагонистическое анти- v v 5-антитело. Эффективное количество блокирует или уменьшает опухолевый рост или рост злокачественной клетки. Также предлагаются способы ингибирования миграции опухолевых клеток. Например, способ заключается во введении эффективного количества антагониста ANGPTL4 в опухолевые клетки, таким образом блокируя их миграцию. В одном варианте осуществления изобретения введение антагониста ANGPTL4 ингибирует метастазы. 5-антитело. Эффективное количество блокирует или уменьшает опухолевый рост или рост злокачественной клетки. Также предлагаются способы ингибирования миграции опухолевых клеток. Например, способ заключается во введении эффективного количества антагониста ANGPTL4 в опухолевые клетки, таким образом блокируя их миграцию. В одном варианте осуществления изобретения введение антагониста ANGPTL4 ингибирует метастазы.
Дополнительные терапевтические средства, например одно или несколько противоопухолевых средств, множество антител к одним и тем же или разным антигенам, одно или несколько средств или ингибиторов против ангиогенеза, препаратов против боли и т.д., можно комбинировать и/или вводить вместе с антагонистом ANGPTL4. Также можно осуществлять или проводить дополнительные терапевтические процедуры, например хирургические процедуры, облучение и т.д. по отношению к опухоли и/или злокачественным клеткам, в способах или вместе с композициями согласно изобретению. Изобретение также относится к комбинированным композициям, например композиции, которая содержит противоопухолевое средство (например, средство против ангиогенеза и т.д.), антагонист ANGPTL4 и носитель (например, фармацевтически приемлемый носитель).
Противоопухолевые средства включают без ограничения, например, противоопухолевые средства, известные в данной области, и средства, описанные в данной публикации. В некоторых вариантах противоопухолевое средство включает в себя одно или несколько средств против ангиогенеза, например антагонист или ингибитор VEGF и т.д. В одном варианте антагонист VEGF содержит анти-VEGF-антитело или его активный фрагмент (например, гуманизированное A4.6.1, Avastin® и т.д.). В некоторых вариантах противоопухолевое средство содержит одно или несколько химиотерапевтических средств.
Предлагаются комбинированные способы блокирования или уменьшения опухолевого роста или роста злокачественной клетки. В некоторых вариантах способы включают в себя введение в опухоль или злокачественную клетку эффективного количества противоопухолевого средства и введение в опухоль или злокачественную клетку эффективного количества антагониста ANGPTL4. Альтернативно или дополнительно можно вводить комбинированную композицию, содержащую эффективное количество противоопухолевого средства (например, средства против ангиогенеза и т.д.) и эффективное количество антагониста ANGPTL4. Объединенные эффективные количества блокируют или уменьшают опухолевый рост или рост злокачественной клетки.
Также предлагаются способы блокирования или уменьшения рецидивирующего опухолевого роста или рецидивирующего роста злокачественных клеток. В некоторых вариантах осуществления изобретения субъекта подвергали или одновременно подвергают терапии по поводу злокачественной опухоли, по меньшей мере, одним противоопухолевым средством и субъекту вводят эффективное количество антагониста ANGPTL4. Введение эффективного количества антагониста ANGPTL4 блокирует или уменьшает рецидивирующий опухолевый рост или рецидивирующий рост злокачественных клеток. В некоторых вариантах субъекта подвергали или одновременно подвергают терапии антагонистом ANGPTL4 и субъекту вводят эффективное количество противоопухолевого средства (например, средства против ангиогенеза), при этом введение эффективного количества противоопухолевого средства блокирует или уменьшает рецидивирующий опухолевый рост или рецидивирующий рост злокачественных клеток.
Обычно опухоль или злокачественная клетка находится в организме субъекта. В некоторых вариантах субъекта подвергали, одновременно подвергают или будут подвергать терапии по поводу злокачественной опухоли, по меньшей мере, одним противоопухолевым средством. Обычно субъектом является млекопитающее (например, человек). В некоторых вариантах средства согласно изобретению вводят субъекту. Стадии введения или способа могут быть осуществлены в любом порядке. В одном варианте их осуществляют последовательно. В другом варианте их осуществляют одновременно. Альтернативно или дополнительно стадии могут быть осуществлены в виде комбинации последовательных и одновременных стадий в любом порядке.
Также предлагаются наборы модуляторов ANGPTL4. В некоторых вариантах набор содержит антагонист ANGPTL4, фармацевтически приемлемый носитель, наполнитель или разбавитель и упаковку. В одном варианте набор содержит первое количество противоопухолевого средства (например, средства против ангиогенеза и т.д.), второе количество антагониста ANGPTL4 и фармацевтически приемлемый носитель, наполнитель или разбавитель и упаковку. В другом варианте набор содержит определенное количество противоопухолевого средства (например, средства против ангиогенеза и т.д.) и фармацевтически приемлемый носитель, наполнитель или разбавитель в первой единичной дозированной форме; определенное количество антагониста ANGPTL4 и фармацевтически приемлемый носитель, наполнитель или разбавитель во второй единичной дозированной форме и упаковку. Также могут быть включены инструкции по их применению.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг.1 иллюстрирует последовательность нуклеиновой кислоты ANGPTL4 человека (SEQ ID  1). 1).
Фиг.2 иллюстрирует аминокислотную последовательность ANGPTL4 человека (SEQ ID  2). 2).
На фиг.3 панель A иллюстрирует очищенный рекомбинантный мышиный ANGPTL4 (23-410) после разделения с помощью электрофореза в SDS-полиакриламидном геле (SDS-ПААГ) (4-20%) в присутствии (10 мМ) или в отсутствие дитиотреитола (DTT). На фиг.3 панель B иллюстрирует hANGPTL4 дикого типа (дорожка 1) и вариант hANGPTL4 (дорожка 2) после разделения в SDS-геле и регистрации с использованием Вестерн-блоттинга, при этом вариант hANGPTL4 имеет замену R162G и R164E.
На фиг.4 панели A, B и C схематично показывают, что ANGPTL4 стимулирует пролиферацию опухолевых клеток A673 (панель A и B) и опухолевых клеток U87MG (панель B) при трансдукции опухолевых клеток конструкцией, экспрессирующей ANGPTL4, и под действием кондиционированных сред от клеток COS (C), трансдуцированных конструкцией, экспрессирующей ANGPTL4 (2) (панель C). На панели B опухолевые клетки трансдуцированы конструкцией либо (1), которая является контрольной конструкцией, экспрессирующей AdLacZ, либо (2), которая является конструкцией, экспрессирующей Ad-ANGPTL4, либо (3), которая является конструкцией Ad-миРНК ANGPTL4. На панели C пролиферация опухолевых клеток A673 осуществляется под влиянием кондиционированных сред от клеток Hepa (A), HMVEC (B) или COS (C), трансдуцированных либо (1) конструкцией, экспрессирующей LacZ, либо (2) конструкцией, экспрессирующей ANGPTL4, либо (3) конструкцией, экспрессирующей ANGPTL3.
Фиг.5 схематично показывает, что mANGPTL4 стимулирует пролиферацию A673 в случае покрытия им чашек для культивирования.
На фиг.6 панели A и B схематично иллюстрируют различные формы (панель A) связывания ANGPTL4 с опухолевыми клетками A673 и связывание в разных условиях (панель B).
На фиг.7 панели A и B схематично иллюстрируют пролиферацию A673 под влиянием сред, содержащих ANGPTL4, при выращивании в течение 7 дней (панель A) или 4 дней (панель B). На панели A (1) означает контрольную конструкцию, экспрессирующую AdLacZ, (2) означает конструкцию, экспрессирующую Ad-hANGPTL4, и (3) означает конструкцию, экспрессирующую AdLacZ и rmANGPTL4. На панели B (1) означает отсутствие добавок, (2) означает контрольный буфер, (3) mANGPTL4 (2,5 мкг/мл), (4) hANGPTL4 (2,5 мкг/мл), (5) hIgG-hANGPTL4 (2,5 мкг/мл) и (6) hIgG-mANGPTL4 (2,5 мкг/мл).
На фиг.8 панели A, B и C схематично иллюстрируют, что ANGPTL4 стимулирует опухолевый рост in vivo (панель A и панель B) и его действие имеет тенденцию уходить от противоопухолевого лечения, например, анти-VEGF-антителом (Avastin® (Genentech, South San Francisco)) в опухолях, в которые вводили конструкции аденовирус-Angptl4 (панель C). Панели A и C иллюстрируют размер опухолей в см3 по дням после имплантации опухоли. Панель B иллюстрирует массу ксенотрансплантированных опухолей A673 через 20 дней после имплантации.
На фиг.9 показано, что ANGPTL4 индуцирует клеточную миграцию опухолевых клеток A673 и 4T-1, где (1) означает отсутствие добавления сыворотки, (2) означает 10% фетальную сыворотку теленка (FCS), (3) означает PDGF-BB и (4) означает ANGPTL4.
На фиг.10, панели A и B, показано, что анти-hANGPTL4-антитела ингибируют рост опухолевых клеток, например, на панели A (клетки HeLa-S3 и Caki) и на панели B (клетки U87MG, 293 и A673), где (1) означает анти-hANGPTL4-антитела, (2) означает контрольное антитело против белка критической для синдрома Дауна области 1 (Dscr) и (3) означает отсутствие добавок, при этом числа под гистограммой показывают концентрацию антител в (мкг/мл).
Фиг.11 иллюстрирует адгезию клеток 293-1953 ( v v 5) к планшету, покрытому либо ANGPTL4, либо витронектином в концентрации, указанной снизу в (мкг/мл), где БСА используют в качестве контроля. 5) к планшету, покрытому либо ANGPTL4, либо витронектином в концентрации, указанной снизу в (мкг/мл), где БСА используют в качестве контроля.
На фиг.12 показано, что анти- v v 5-антитела и анти-hANGPTL4-антитела отменяют активность ANGPTL4 в клеточной адгезии, где (1) означает БСА, (2) означает витронектин и (3) означает ANGPTL4. 5-антитела и анти-hANGPTL4-антитела отменяют активность ANGPTL4 в клеточной адгезии, где (1) означает БСА, (2) означает витронектин и (3) означает ANGPTL4.
Фиг.13, панели A, B и C, иллюстрирует связывание ANGPTL4 с интегрином  v v 5. Панель A иллюстрирует связывание белка (mANGPTL4, hANGPTL4-Nконец или hANGPTL4-Cконец) с использованием указанного количества с планшетами, покрытыми 5. Панель A иллюстрирует связывание белка (mANGPTL4, hANGPTL4-Nконец или hANGPTL4-Cконец) с использованием указанного количества с планшетами, покрытыми  v v 5. Панель B иллюстрирует ингибирование связывания белка (mANGPTL4, hANGPTL4-Nконец или hANGPTL4-Cконец) с планшетами, покрытыми 5. Панель B иллюстрирует ингибирование связывания белка (mANGPTL4, hANGPTL4-Nконец или hANGPTL4-Cконец) с планшетами, покрытыми  v v 5, анти-hANGPTL4-антителами. Панель C иллюстрирует связывание ANGPTL4 и 5, анти-hANGPTL4-антителами. Панель C иллюстрирует связывание ANGPTL4 и  v v 5, где (1) означает планшет, покрытый hANGPTL4-Cконец, (2) означает планшет, покрытый hANGPTL4-Cконец и инкубированный с анти-hANGPTL4, (3) означает планшет, покрытый hANGPTL4-Cконец и инкубированный с анти-Dscr, (4) означает планшет, покрытый витронектином, и (5) означает планшет, покрытый БСА перед добавлением 5, где (1) означает планшет, покрытый hANGPTL4-Cконец, (2) означает планшет, покрытый hANGPTL4-Cконец и инкубированный с анти-hANGPTL4, (3) означает планшет, покрытый hANGPTL4-Cконец и инкубированный с анти-Dscr, (4) означает планшет, покрытый витронектином, и (5) означает планшет, покрытый БСА перед добавлением  v v 5. 5.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
Перед подробным описанием изобретения следует понять, что данное изобретение не ограничено конкретными композициями или биологическими системами, которые, конечно, могут варьировать. Также следует понимать, что терминология, используемая в данном описании, предназначена только для целей описания конкретных вариантов и не предназначена для ограничения. В используемом в данном описании и в прилагаемой формуле изобретения смысле формы единственного числа включают множественные объекты, если содержание ясно не диктует иное. Таким образом, например, ссылка на “молекулу” необязательно включает комбинацию двух или более таких молекул, и тому подобное. Если не оговорено особо, подразумевается, что все научные и технические термины имеют такое же значение, которое обычно используют в области, к которой они относятся. В целях изобретения ниже определены следующие термины.
Термин “ANGPTL4” или “Angptl4” относится к ангиопоэтинподобному полипептиду или белку 4 вместе с его встречающимися в природе аллельными, секретируемыми и процессированными формами. Например, ANGPTL4 человека является белком из 406 аминокислот, тогда как мышиный ANGPTL4 является белком, состоящим из 410 аминокислот. Термин “ANGPTL4” также используют для указания фрагментов (например, подпоследовательностей, укороченных форм и т.д.) полипептида, содержащих, например, N-концевой фрагмент, биспиральный домен, C-концевой фрагмент, фибриногенподобный домен, аминокислоты 1-183, 23-183, от 1 до примерно 162, от 23 до примерно 162, 23-406, 184-406, примерно 162-406 или 23-184 ангиопоэтинподобного белка 4 человека и аминокислоты 1-183, 23-183, от 1 до примерно 165, от 23 до примерно 165, 23-410 или 184-410 мышиного ангиопоэтинподобного белка 4. Другие фрагменты включают без ограничения, например, 40-183, 60-183, 80-183, 100-183, 120-183, 140-183, 40-406, 60-406, 80-406, 100-406, 120-406, 140-406 и 160-406 hANGPTL4 и, например, 40-183, 60-183, 80-183, 100-183, 120-183, 140-183, 40-410, 60-410, 80-410, 100-410, 120-410, 140-410 и 160-410 mANGPTL4. Ссылка на любые такие формы ANGPTL4 также может быть указана в заявке, например, в виде “ANGPTL4 (23-406)”, “ANGPTL4 (184-406)”, “ANGPTL4 (23-183)”, “mANGPTL4 (23-410)”, “mANGPTL4 (184-410)” и т.д., где m указывает мышиную последовательность. Положения аминокислот для фрагмента нативного ANGPTL4 пронумерованы, как указано в нативной последовательности ANGPTL4. Например, положение аминокислоты 22(Ser) во фрагменте ANGPTL4 также является положением 22(Ser) в нативном ANGPTL4 человека, например, см. фиг.2. Как правило, фрагмент нативного ANGPTL4 обладает биологической активностью.
Термин “модулятор ANGPTL4” относится к молекуле, которая может активировать ANGPTL4 или его экспрессию, например к агонисту, или которая может ингибировать активность ANGPTL4 или его экспрессию, например к антагонисту (или ингибитору). Агонисты ANGPTL4 включают антитела и активные фрагменты. Антагонист ANGPTL4 относится к молекуле, способной нейтрализовать, блокировать, ингибировать, отменять, уменьшать или служить препятствием для активностей ANGPTL4, например пролиферации или роста клеток, миграции, адгезии или модулирования метаболизма, например, липидов, или его экспрессии, включая его связывание с рецептором ANGPTL4, например  V V 5. Антагонисты ANGPTL4 включают, например, анти-ANGPTL4-антитела и их антигенсвязывающие фрагменты, молекулы рецепторов и производные, которые специфично связываются с ANGPTL4, таким образом предотвращая его связывание с одним или несколькими рецепторами, антитела против рецептора ANGPTL4 и антагонисты рецептора ANGPTL4, такие как низкомолекулярные ингибиторы рецептора. Другие антагонисты ANGPTL4 также включают варианты антагонистов ANGPTL4, антисмысловые молекулы (например, ANGPTL4-миРНК), РНК-аптамеры и рибозимы против ANGPTL4 или его рецептора. В некоторых вариантах антагонистическими ANGPTL4-антителами являются антитела, которые ингибируют или уменьшают активность ANGPTL4 посредством связывания со специфичной подпоследовательностью или областью ANGPTL4, например N-концевым фрагментом, биспиральным доменом, C-концевым фрагментом, фибриногенподобным доменом, аминокислотами 1-183, 23-183, от 1 до примерно 162, от 23 до примерно 162, 23-406, 184-406, или 23-184 ангиопоэтинподобного белка 4 человека и аминокислотами 1-183, 23-183, от 1 до примерно 165, от 23 до примерно 165, 23-410 или 184-410 ангиопоэтинподобного белка 4 мыши. Другие фрагменты включают, без ограничения, например, 40-183, 60-183, 80-183, 100-183, 120-183, 140-183, 40-406, 60-406, 80-406, 100-406, 120-406, 140-406 и 160-406 hANGPTL4 и, например, 40-183, 60-183, 80-183, 100-183, 120-183, 140-183, 40-410, 60-410, 80-410, 100-410, 120-410, 140-410 и 160-410 mANGPTL4. 5. Антагонисты ANGPTL4 включают, например, анти-ANGPTL4-антитела и их антигенсвязывающие фрагменты, молекулы рецепторов и производные, которые специфично связываются с ANGPTL4, таким образом предотвращая его связывание с одним или несколькими рецепторами, антитела против рецептора ANGPTL4 и антагонисты рецептора ANGPTL4, такие как низкомолекулярные ингибиторы рецептора. Другие антагонисты ANGPTL4 также включают варианты антагонистов ANGPTL4, антисмысловые молекулы (например, ANGPTL4-миРНК), РНК-аптамеры и рибозимы против ANGPTL4 или его рецептора. В некоторых вариантах антагонистическими ANGPTL4-антителами являются антитела, которые ингибируют или уменьшают активность ANGPTL4 посредством связывания со специфичной подпоследовательностью или областью ANGPTL4, например N-концевым фрагментом, биспиральным доменом, C-концевым фрагментом, фибриногенподобным доменом, аминокислотами 1-183, 23-183, от 1 до примерно 162, от 23 до примерно 162, 23-406, 184-406, или 23-184 ангиопоэтинподобного белка 4 человека и аминокислотами 1-183, 23-183, от 1 до примерно 165, от 23 до примерно 165, 23-410 или 184-410 ангиопоэтинподобного белка 4 мыши. Другие фрагменты включают, без ограничения, например, 40-183, 60-183, 80-183, 100-183, 120-183, 140-183, 40-406, 60-406, 80-406, 100-406, 120-406, 140-406 и 160-406 hANGPTL4 и, например, 40-183, 60-183, 80-183, 100-183, 120-183, 140-183, 40-410, 60-410, 80-410, 100-410, 120-410, 140-410 и 160-410 mANGPTL4.
Термин “анти-ANGPTL4-антитело” означает антитело, которое связывается с ANGPTL4 с достаточной аффинностью и специфичностью. Анти-ANGPTL4-антитело согласно изобретению можно применять в качестве терапевтического средства для целенаправленного воздействия и вмешательства в заболевания или состояния, в которые вовлечена активность ANGPTL4. В общем анти-ANGPTL4-антитело, как правило, не будет связываться с другими гомологами ANGPTL4, например ANGPTL3.
Термины “VEGF” и “VEGF-A” используют взаимозаменяемо по отношению к состоящему из 165 аминокислот фактору роста эндотелиальных клеток сосудов и родственным, состоящим из 121, 145, 183, 189 и 206 аминокислот фактора роста эндотелиальных клеток сосудов, которые описаны Leung et al. Science, 246: 1306 (1989), Houck et al. Mol. Endocrin., 5: 1806 (1991) и Robinson & Stringer, Journal of Cell Science, 144 (5): 853-865 (2001), вместе с их встречающимися в природе аллельными и процессированными формами. Термин “VEGF” также используют по отношению к фрагментам полипептида, например, содержащим аминокислоты 8-109 или 1-109 165-аминокислотного фактора роста эндотелиальных клеток сосудов. Ссылка на любую из таких форм VEGF может быть указана в настоящей заявке, например, в виде “VEGF (8-109)”, “VEGF (1-109)” или “VEGF165”. Положения аминокислот для “фрагмента” нативного VEGF пронумерованы, как указано в нативной последовательности VEGF. Например, положение аминокислоты 17 (метионин) в нативном фрагменте VEGF также является положением 17 (метионин) в нативном VEGF. Фрагмент нативного VEGF может обладать аффинностью связывания по отношению к рецепторам KDR и/или Flt-1, сравнимой с нативным VEGF.
“Анти-VEGF-антитело” означает антитело, которое связывается с VEGF с достаточной аффинностью и специфичностью. Анти-VEGF-антитело согласно изобретению можно применять в качестве терапевтического средства для целенаправленного воздействия и вмешательства в заболевания или состояния, в которые вовлечена активность VEGF. Анти-VEGF-антитело, как правило, не будет связываться ни с другими гомологами VEGF, такими как VEGF-B или VEGF-C, ни с другими факторами роста, такими как PlGF, PDGF или bFGF. См., например, патенты США 6582959, 6703020; WO 98/45332; WO 96/30046; WO 94/10202; EP 0666868B1; заявки на выдачу патента США 2003/0206899, 2003/0190317, 2003/0203409 и 2005/0112126; Popkov et al., Journal of Immunological Methods 288: 149-164 (2004) и документ с номером в реестре поверенного P2072R1. Анти-VEGF-антитело “бевацизумаб” (BV)”, также известное как “rhuMAb VEGF” или “AvastinTM“, является рекомбинантным гуманизированным моноклональным анти-VEGF-антителом, получаемым согласно Presta et al. Cancer Res. 57: 4593-4599 (1997). Оно содержит мутантные каркасные области IgG1 человека и антигенсвязывающие определяющие комплементарность области из мышиного моноклонального анти-hVEGF-антитела A.4.6.1, которое блокирует связывание VEGF человека с его рецепторами. Примерно 93% аминокислотной последовательности бевацизумаба, включая большую часть каркасных областей, получают из IgG1 человека и примерно 7% последовательности получают из мышиного антитела A4.6.1. Бевацизумаб имеет молекулярную массу примерно 149000 Дальтон и является гликозилированным. Бевацизумаб и другие гуманизированные анти-VEGF-антитела дополнительно описаны в патенте США  6884879, опубликованном 26 февраля 2005. 6884879, опубликованном 26 февраля 2005.
“Антагонист VEGF” относится к молекуле, способной нейтрализовать, блокировать, ингибировать, отменять, уменьшать или служить препятствием для активностей VEGF, включая его связывание с одним или несколькими рецепторами VEGF. Антагонисты VEGF включают анти-VEGF-антитела и их антигенсвязывающие фрагменты, молекулы рецепторов и производные, которые специфично связываются с VEGF, таким образом предотвращая его связывание с одним или несколькими рецепторами, антитела против рецептора VEGF и антагонисты рецептора VEGF, такие как низкомолекулярные ингибиторы VEGFR-тирозинкиназ, и слитые белки, например VEGF-Trap (регенерон), VEGF121-гелонин (перегин). Антагонисты VEGF также включают антагонистические варианты VEGF, антисмысловые молекулы, направленные к VEGF, аптамеры РНК и рибозимы против VEGF или рецепторов VEGF.
Полипептид с “нативной последовательностью” включает полипептид, имеющий такую же аминокислотную последовательность, как и полипептид, полученный из природного источника. Таким образом, полипептид с нативной последовательностью может иметь аминокислотную последовательность встречающегося в природе полипептида любого млекопитающего. Такой полипептид с нативной последовательностью можно выделить из природного источника и можно получить способами рекомбинации или синтеза. Термин полипептид с “нативной последовательностью” специально охватывает встречающиеся в природе укороченные или секретируемые формы полипептида (например, последовательность внеклеточного домена), встречающиеся в природе вариантные формы (например, альтернативно сплайсируемые формы) и встречающиеся в природе аллельные варианты полипептида.
“Полипептидная цепь” означает полипептид, в котором каждый из его доменов связан с другим доменом(ами) пептидной связью (связями), в отличие от нековалентных взаимодействий или дисульфидных связей.
“Вариант” полипептида означает биологически активный полипептид, имеющий, по меньшей мере, примерно 80% идентичность аминокислотной последовательности с соответствующим полипептидом с нативной последовательностью. Такие варианты включают, например, полипептиды, в которых один или несколько остатков аминокислот (встречающихся в природе аминокислот и/или не встречающихся в природе аминокислот) добавлены или делетированы на N- и/или C-конце полипептида. Обычно вариант будет обладать, по меньшей мере, примерно 80% идентичностью аминокислотной последовательности или, по меньшей мере, примерно 90% идентичностью аминокислотной последовательности, или, по меньшей мере, примерно 95% или большей идентичностью аминокислотной последовательности с полипептидом с нативной последовательностью. Варианты также включают полипептидные фрагменты (например, подпоследовательности, укороченные формы и т.д.) нативной последовательности, обычно биологически активные.
“Идентичность аминокислотных последовательностей в процентах (%)” в данном описании определяют как процентное содержание аминокислотных остатков в исследуемой последовательности, которые идентичны аминокислотным остаткам в выбранной последовательности после выравнивания последовательностей и введения при необходимости пробелов, чтобы достичь максимального процента идентичности последовательностей, и без учета каких-либо консервативных замен в качестве части идентичности последовательностей. Выравнивание в целях определения идентичности аминокислотных последовательностей в процентах можно осуществить различными способами, которые возможны в данной области, например, используя общедоступную компьютерную программу, такую как компьютерная программа BLAST, BLAST-2, ALIGN, ALIGN-2 или Megalign (DNASTAR). Специалисты в данной области могут определить соответствующие параметры для измерения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания на протяжении полной длины сравниваемых последовательностей. Однако в целях данного изобретения значения идентичности аминокислотных последовательностей в % получают, как описано ниже, с использованием компьютерной программы сравнения последовательностей ALIGN-2. Компьютерная программа сравнения последовательностей ALIGN-2 разработана Genentech, Inc. и подана с документацией для пользователей в Бюро регистрации авторских прав США, Washington D.C., 20559, где зарегистрирована с регистрационным  авторского права США TXU510087, и общедоступна из Genentech, Inc., South San Francisco, California. Программа ALIGN-2 должна быть компилирована для применения с операционной системой UNIX, например цифровой UNIX V4.0D. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и не изменяются. авторского права США TXU510087, и общедоступна из Genentech, Inc., South San Francisco, California. Программа ALIGN-2 должна быть компилирована для применения с операционной системой UNIX, например цифровой UNIX V4.0D. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и не изменяются.
В целях данного изобретения идентичность аминокислотной последовательности в % для данной аминокислотной последовательности A по сравнению или по отношению к данной аминокислотной последовательности B (что альтернативно может быть выражено как данная аминокислотная последовательность A, которая имеет или содержит определенную идентичность аминокислотных последовательностей в % по сравнению или по отношению к данной аминокислотной последовательности B) рассчитывают следующим образом:
100 × дробь X/Y
где X означает количество аминокислотных остатков, оцененных как идентичные совпадения программой выравнивания последовательностей ALIGN-2 при выравнивании указанной программой A и B, и где Y означает общее количество аминокислотных остатков в B. Будет понятно, что в том случае, когда длина аминокислотной последовательности A не равна длине аминокислотной последовательности B, идентичность аминокислотной последовательности A по сравнению с B в % не будет равна идентичности аминокислотной последовательности B по сравнению с A в %.
Термин “вариант ANGPTL4” в используемом в данном описании смысле относится к варианту, который описан выше, и/или ANGPTL4, который содержит одну или несколько аминокислотных мутаций в нативной последовательности ANGPTL4. Необязательно, одна или несколько аминокислотных мутаций включают аминокислотную замену(ы). ANGPTL4 и его варианты для применения в изобретении могут быть получены множеством способов, хорошо известных в данной области. Варианты аминокислотной последовательности ANGPTL4 могут быть получены в результате мутаций в ДНК ANGPTL4. Такие варианты включают, например, делеции, инсерции или замены остатков в аминокислотной последовательности ANGPTL4, например в аминокислотной последовательности человека, кодируемой нуклеиновой кислотой, депонированной в ATCC под номером депозита 209284 или показанной на фиг.2. Может быть осуществлена любая комбинация делеции, инсерции и замены, чтобы добиться конечной конструкции, обладающей требуемой активностью. Мутации, которые будут получены в ДНК, кодирующей вариант, не должны выводить последовательность из рамки считывания и предпочтительно не будут создавать комплементарные области, которые могут создавать вторичную структуру мРНК. EP 75444A.
Варианты ANGPTL4 необязательно получают сайт-специфичным мутагенезом нуклеотидов в ДНК, кодирующей нативный ANGPTL4, или способами фагового дисплея, получая таким образом ДНК, кодирующую вариант, и после этого экспрессируя ДНК в культуре рекомбинантных клеток.
В то время как сайт введения изменения аминокислотной последовательности определяют предварительно, мутация как таковая необязательно должна быть определена предварительно. Например, чтобы оптимизировать эффективность мутации в данном сайте, может быть проведен случайный мутагенез в кодоне-мишени или области-мишени и экспрессированные варианты ANGPTL4 подвергнуты скринингу в отношении оптимальной комбинации требуемой активности. Способы получения мутаций в виде замен в предварительно определяемых сайтах ДНК, имеющей известную последовательность, хорошо известны, например, такие как сайт-специфичный мутагенез. Получение вариантов ANGPTL4, описанных в данной публикации, можно осуществить с помощью способов фагового дисплея, таких как способы, описанные в публикации PCT WO 00/63380.
После отбора такого клона область мутантного белка может быть извлечена и помещена в соответствующий вектор для продукции белка, как правило, экспрессирующий вектор такого типа, который может быть использован для трансформации подходящего хозяина.
Делеции аминокислотной последовательности обычно находятся в пределах от примерно 1 до 30 остатков, необязательно, от 1 до 10 остатков, необязательно, от 1 до 5 или менее и обычно являются непрерывными.
Инсерции аминокислотной последовательности включают слияния на амино- и/или карбоксильном конце от одного остатка до полипептидов по существу неограниченной длины, а также инсерции внутри последовательности одного или множества аминокислотных остатков. Инсерции внутри последовательности (т.е. инсерции в нативной последовательности ANGPTL4) могут быть в пределах, как правило, примерно от 1 до 10 остатков, необязательно, от 1 до 5, или, необязательно, от 1 до 3. Пример концевой инсерции включает слияние сигнальной последовательности, либо гетерологичной, либо гомологичной по отношению к клетке-хозяину, с N-концом, чтобы облегчить секрецию из рекомбинантных хозяев.
Дополнительными вариантами ANGPTL4 являются такие варианты, в которых, по меньшей мере, один аминокислотный остаток в нативном ANGPTL4 был удален, а другой остаток встроен на его место. В одном варианте осуществления изобретения вариант ANGPTL4 содержит замену в положении 162 и/или 164 ANGPTL4 или замену в положении 169 mANGPTL4. Такие замены могут быть осуществлены в соответствии с заменами, показанными в таблице 1. Варианты ANGPTL4 также могут содержать неприродные аминокислоты, которые описаны в данной публикации.
Аминокислоты могут быть сгруппированы в соответствии со сходствами в свойствах их боковых цепей (в A. L. Lehninger, Biochemistry, second ed., pp.73-75, Worth Publishers, New York (1975)):
(1) неполярные: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M)
(2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q)
(3) кислотные: Asp (D), Glu (E)
(4) основные: Lys (K), Arg (R), His (H)
Альтернативно встречающиеся в природе остатки могут быть разделены на группы на основе общих свойств боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
| Таблица 1 |
| Исходный остаток |
Примерные замены |
Предпочтительные замены |
| Ala (A) |
Val; Leu; Ile |
Val |
| Arg (R) |
Lys; Gin; Asn |
Lys |
| Asn (N) |
Gln; His; Asp; Lys; Arg |
Gln |
| Asp (D) |
Glu; Asn |
Glu |
| Cys (C) |
Ser; Ala |
Ser |
| Gln (Q) |
Asn; Glu |
Asn |
| Glu (E) |
Asp; Gln |
Asp |
| Gly (G) |
Ala |
Ala |
| His (H) |
Asn; Gln; Lys; Arg |
Arg |
| Ile (I) |
Leu; Val; Met; Ala; Phe; норлейцин |
Leu |
| Leu (L) |
Норлейцин; Ile; Val; Met; Ala; Phe |
Ile |
| Lys (K) |
Arg; Gln; Asn |
Arg |
| Met (M) |
Leu; Phe; Ile |
Leu |
| Phe (F) |
Trp; Leu; Val; Ile; Ala; Tyr |
Tyr |
| Pro (P) |
Ala |
Ala |
| Ser (S) |
Thr |
Thr |
| Thr (T) |
Val; Ser |
Ser |
| Trp (W) |
Tyr; Phe |
Tyr |
| Tyr (Y) |
Trp; Phe; Thr; Ser |
Phe |
| Val (V) |
Ile; Leu; Met; Phe; Ala; норлейцин |
Leu |
“Встречающиеся в природе аминокислотные остатки” (т.е. аминокислотные остатки, кодируемые генетическим кодом) могут быть выбраны из группы, состоящей из аланина (Ala); аргинина (Arg); аспарагина (Asn); аспарагиновой кислоты (Asp); цистеина (Cys); глутамина (Gln); глутаминовой кислоты (Glu); глицина (Gly); гистидина (His); изолейцина (Ile); лейцина (Leu); лизина (Lys); метионина (Met); фенилаланина (Phe); пролина (Pro); серина (Ser); треонина (Thr); триптофана (Trp); тирозина (Tyr) и валина (Val). “Не встречающийся в природе аминокислотный остаток” относится к другому остатку, отличному от встречающихся в природе аминокислотных остатков, перечисленных выше, который способен ковалентно связывать соседний аминокислотный остаток(ки) в полипептидной цепи. Примеры не встречающихся в природе аминокислотных остатков включают, например, норлейцин, орнитин, норвалин, гомосерин и другие аналоги аминокислотных остатков, такие как остатки, описанные в Ellman et al. Meth. Enzym. 202: 301-336 (1991) и публикации заявок на выдачу патентов США 2003/0108885 и 2003/0082575. Коротко, указанные способы включают активацию супрессорной тРНК не встречающимся в природе аминокислотным остатком с последующей транскрипцией и трансляцией РНК in vitro или in vivo. См., например, публикации заявок на выдачу патентов США 2003/0108885 и 2003/0082575; Noren et al. Science 244: 182 (1989) и Ellman et al., выше.
“Изолированным” полипептидом является полипептид, который был идентифицирован и отделен и/или извлечен из компонента его природной среды. Загрязняющие компоненты его природной среды представляют собой вещества, которые могут мешать диагностическим или терапевтическим применениям полипептида и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В некоторых вариантах полипептид будет очищен (1) более чем на 95 мас.% полипептида, который определяют способом Лоури, или более чем на 99 мас.%, (2) в такой степени, которая достаточна для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающимся цилиндром или (3) до гомогенности с помощью SDS-ПААГ в восстанавливающих или невосстанавливающих условиях с использованием окраски Кумасси синим или серебром. Изолированный полипептид включает полипептид, находящийся in situ в рекомбинантных клетках, так как, по меньшей мере, один компонент из природной среды полипептида не будет присутствовать. Однако обычно изолированный полипептид будет получен, по меньшей мере, с помощью одной стадии очистки.
Термин “антитело” используют в самом широком смысле, и термин охватывает моноклональные антитела (включая полноразмерные или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела, полиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител (см. ниже), при условии, что они проявляют требуемую биологическую активность.
Если не оговорено особо, то выражение “поливалентное антитело” используют на протяжении данного описания, чтобы указать антитело, содержащее три или более антигенсвязывающих участков. Поливалентное антитело обычно конструируют так, чтобы оно имело три или более антигенсвязывающих участков, и, как правило, оно не является нативной последовательностью IgM- или IgA-антитела.
“Фрагменты антитела” содержат только часть интактного антитела, обычно включая антигенсвязывающий участок интактного антитела и поэтому сохраняя способность связывать антиген. Примеры фрагментов антитела, охватываемых приведенным определением, включают (i) Fab-фрагмент, имеющий домены VL, CL, VH и CH1; (ii) Fab’-фрагмент, который представляет собой Fab-фрагмент, имеющий один или несколько остатков цистеина на C-конце домена CH1; (iii) Fd-фрагмент, имеющий домены VH и CH1; (iv) Fd’-фрагмент, имеющий домены VH и CH1 и один или несколько остатков цистеина на C-конце домена CH1; (v) Fv-фрагмент, имеющий домены VL и VH одного плеча антитела; (vi) dAb-фрагмент (Ward et al., Nature 341, 544-546 (1989)), который состоит из домена VH; (vii) изолированные CDR-области; (viii) F(ab’)2-фрагменты, бивалентные фрагменты, содержащие два фрагмента Fab’, связанные дисульфидным мостиком в шарнирной области; (ix) молекулы одноцепочечных антител (например, одноцепочечный Fv; scFv) (Bird et al., Science 242: 423-426 (1988) и Huston et al., PNAS (USA) 85: 5879-5883 (1988)); (x) “диантитела” с двумя антигенсвязывающими участками, содержащие вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одной полипептидной цепи (см., например, EP 404097, WO 93/11161 и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993)); (xi) “линейные антитела”, содержащие пару тандемных участков Fd (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют пару антигенсвязывающих областей (Zapata et al. Protein Eng. 8 (10): 1057-1062 (1995) и патент США  5641870). 5641870).
Термин “моноклональное антитело” в используемом в данном описании смысле относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифичными, направленными против одного антигена. Кроме того, в отличие от препаратов поликлональных антител, которые обычно содержат разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Определение “моноклональное” не следует рассматривать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, применяемые согласно изобретению, могут быть получены способом на основе гибридом, впервые описанным Kohler et al., Nature 256: 495 (1975), или могут быть получены способами на основе рекомбинантной ДНК (см., например, патент США  4816567). “Моноклональные антитела” также могут быть выделены из фаговых библиотек антител с использованием способов, описанных, например, в Clackson et al., Nature 352: 624-628 (1991) или Marks et al., J. Mol. Biol. 222: 581-597 (1991). 4816567). “Моноклональные антитела” также могут быть выделены из фаговых библиотек антител с использованием способов, описанных, например, в Clackson et al., Nature 352: 624-628 (1991) или Marks et al., J. Mol. Biol. 222: 581-597 (1991).
Моноклональные антитела в данном описании специально включают “химерные” антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных от конкретного вида, или относящимся к конкретному классу или подклассу антител, тогда как остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, полученных от другого вида, или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность (патент США  4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984)). 4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984)).
“Гуманизированные” формы антител животных, отличных от человека (например мышей), представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина животного, отличного от человека. Главным образом гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области вида, отличного от человека (донорное антитело), такого как мышь, крыса, кролик или примат, отличный от человека, обладающей требуемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки каркасной области (FR) иммуноглобулина человека заменяют соответствующими остатками животного, отличного от человека. Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются ни в реципиентном антителе, ни в донорном антителе. Такие модификации осуществляют для того, чтобы дополнительно улучшить эффективность антитела. В общем, гуманизированное антитело будет содержать в основном целиком, по меньшей мере, один и, обычно, два вариабельных домена, в которых все или в основном все гипервариабельные петли соответствуют петлям иммуноглобулина животного, отличного от человека, и все или в основном все FR являются FR из последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно константной области иммуноглобулина человека. Более подробное описание см. в Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988) и Presta, Curr. Op.Struct. Biol. 2: 593-596 (1992).
“Человеческим антителом” является антитело, которое имеет аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, образуемого в организме человека, и/или которое получено с использованием любого способа получения человеческих антител, который описан в данной публикации. Такое определение человеческого антитела специально включает гуманизированное антитело, содержащее антигенсвязывающие остатки животного, отличного от человека. Человеческие антитела могут быть получены с использованием различных способов, известных в данной области. В одном варианте человеческое антитело выбрано из фаговой библиотеки, при этом такая фаговая библиотека экспрессирует человеческие антитела (Vaughan et al. Nature Biotechnology 14: 309-314 (1996): Sheets et al. PNAS (USA) 95: 6157-6162 (1998)); Hoogenboom and Winter, J. Mol. Biol., 227: 381 (1991); Marks et al., J. Mol. Biol., 222: 581 (1991)). Человеческие антитела также могут быть получены введением локусов иммуноглобулинов человека в трансгенных животных, например мышей, у которых эндогенные гены иммуноглобулинов были частично или полностью инактивированы. При стимуляции наблюдают продукцию антител человека, которая очень похожа на продукцию антител, наблюдаемую у людей во всех отношениях, включая реаранжировку генов, сборку и репертуар антител. Такой способ описан, например, в патентах США  5545807, 5545806, 5569825, 5625126, 5633425, 5661016 и в следующих научных публикациях: Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-13 (1994); Fishwild et al., Nature Biotechnology 14: 845-51 (1996); Neuberger, Nature Biotechnology 14: 826 (1996); Lonberg and Huszar, Intern. Rev. Immunol. 13: 65-93 (1995). Альтернативно человеческое антитело может быть получено посредством иммортализации B-лимфоцитов человека, продуцирующих антитело, направленное против антигена-мишени (такие B-лимфоциты могут быть извлечены из организма человека или могут быть иммунизированы in vitro). См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77 (1985); Boerner et al., J. Immunol., 147 (1): 86-95 (1991); и патент США 5545807, 5545806, 5569825, 5625126, 5633425, 5661016 и в следующих научных публикациях: Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-13 (1994); Fishwild et al., Nature Biotechnology 14: 845-51 (1996); Neuberger, Nature Biotechnology 14: 826 (1996); Lonberg and Huszar, Intern. Rev. Immunol. 13: 65-93 (1995). Альтернативно человеческое антитело может быть получено посредством иммортализации B-лимфоцитов человека, продуцирующих антитело, направленное против антигена-мишени (такие B-лимфоциты могут быть извлечены из организма человека или могут быть иммунизированы in vitro). См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77 (1985); Boerner et al., J. Immunol., 147 (1): 86-95 (1991); и патент США  5750373. 5750373.
Термин “вариабельный” относится к тому факту, что некоторые части вариабельных доменов в значительной степени отличаются по последовательности среди антител и используются в связывании и обеспечении специфичности каждого конкретного антитела по отношению к его конкретному антигену. Однако вариабельность неравномерно распределена на протяжении вариабельных доменов антител. Она сконцентрирована в трех участках, называемых гипервариабельными областями, в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высококонсервативные части вариабельных доменов называют каркасными областями (FR). Каждый из вариабельных доменов нативных тяжелой и легкой цепей содержит четыре FR, в основном принимающих конфигурацию бета-складок, соединенных тремя гипервариабельными областями, которые образуют петли, связывающие и в некоторых случаях образующие часть бета-складчатой структуры. Гипервариабельные области в каждой цепи удерживаются вместе в непосредственной близости посредством FR и с гипервариабельными областями из другой цепи вносят вклад в образование антигенсвязывающего участка антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены непосредственно не вовлечены в связывание антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в зависимой от антител опосредованной клетками цитотоксичности (ADCC).
Термин “гипервариабельная область” при использовании в данном описании относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельная область обычно содержит аминокислотные остатки из “области, определяющей комплементарность” или “CDR” (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или остатки из “гипервариабельной петли” (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia and Lesk J. Mol. Biol. 196: 901-917 (1987)). Остатки “каркасной области” или “FR” представляют собой другие остатки вариабельного домена, отличные от остатков гипервариабельной области, которые определены в данном описании.
В зависимости от аминокислотной последовательности константного домена своих тяжелых цепей интактные антитела могут быть отнесены к разным “классам”. Существует пять основных классов интактных антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на “подклассы” (изотипы), например IgG1 (включая не-A- и A-аллотипы), IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют разным классам антител, названы  , ,  , ,  , ,  и µ, соответственно. Субъединичные структуры и трехмерные конфигурации разных классов иммуноглобулинов хорошо известны. и µ, соответственно. Субъединичные структуры и трехмерные конфигурации разных классов иммуноглобулинов хорошо известны.
Легкие цепи антител из любого вида позвоночных могут быть отнесены к одному из двух явно отличающихся типов, названных каппа ( ) и лямбда ( ) и лямбда ( ), на основании аминокислотных последовательностей их константных доменов. ), на основании аминокислотных последовательностей их константных доменов.
Термин “Fc-область” используют для определения C-концевой области тяжелой цепи иммуноглобулина, которая может быть создана при расщеплении интактного антитела папаином. Fc-область может представлять собой Fc-область с нативной последовательностью или вариант Fc-области. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут варьировать, Fc-область тяжелой цепи IgG человека обычно определяют в промежутке от аминокислотного остатка примерно в положении Cys226 или примерно от положения Pro230 до карбоксильного конца Fc-области. Fc-область иммуноглобулина обычно содержит два константных домена, домен CH2 и домен CH3, и необязательно содержит домен CH4.
Под “цепью Fc-области” в данном описании подразумевают одну из двух полипептидных цепей Fc-области.
“Домен CH2” Fc-области IgG человека (также называемый доменом “Cg2”) обычно простирается от аминокислотного остатка примерно в положении 231 до аминокислотного остатка примерно в положении 340. Домен CH2 является уникальным в том, что он не спарен непосредственно с другим доменом. Вернее, две N-связанных разветвленных углеводных цепи размещены между двумя доменами CH2 интактной нативной молекулы IgG. Было выдвинуто предположение, что углевод может обеспечивать замену спариванию домен-домен и помогать стабилизировать домен CH2. Burton, Molec. Immunol. 22: 161-206 (1985). Домен CH2 согласно настоящему изобретению может представлять собой домен CH2 с нативной последовательностью или вариант домена CH2.
“Домен CH3” содержит участок из остатков, расположенных на C-конце по отношению к домену CH2 в Fc-области (т.е. от аминокислотного остатка примерно в положении 341 до аминокислотного остатка примерно в положении 447 IgG). Область CH3 согласно настоящему изобретению может представлять собой домен CH3 с нативной последовательностью или вариант домена CH3 (например, домен CH3 с введенным “выступом” в его одной цепи и соответствующей введенной “впадиной” в его другой цепи; см. патент США  5821333, специально включенный в данное описание в виде ссылки). Такие варианты домена CH3 могут быть использованы для получения полиспецифичных (например, биспецифичных) антител, которые рассмотрены в данном описании. 5821333, специально включенный в данное описание в виде ссылки). Такие варианты домена CH3 могут быть использованы для получения полиспецифичных (например, биспецифичных) антител, которые рассмотрены в данном описании.
“Шарнирную область”, как правило, определяют как участок примерно от Glu216 или от примерно Cys226 до примерно Pro230 IgG1 человека (Burton, Molec. Immunol. 22: 161-206 (1985)). Шарнирные области других изотипов IgG могут быть выравнены с последовательностью IgG1 при размещении первого и последнего остатков цистеина, образующих S-S-связи между тяжелыми цепями, в одних и тех же положениях. Шарнирная область согласно настоящему изобретению может представлять собой шарнирную область с нативной последовательностью или вариант шарнирной области. Две полипептидных цепи варианта шарнирной области обычно сохраняют, по меньшей мере, один остаток цистеина на полипептидную цепь, так что две полипептидные цепи варианта шарнирной области могут образовывать дисульфидную связь между двумя цепями. Предпочтительной шарнирной областью в настоящем изобретении является шарнирная область человека с нативной последовательностью, например шарнирная область IgG1 человека с нативной последовательностью.
“Функциональная Fc-область” обладает, по меньшей мере, одной “эффекторной функцией” Fc-области с нативной последовательностью. Примеры “эффекторных функций” включают связывание C1q; комплементзависимую цитотоксичность (CDC); связывание рецептора Fc; зависимую от антител опосредованную клетками цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, B-клеточного рецептора, BCR) и т.д. Такие эффекторные функции обычно требуют комбинирования Fc-области со связывающим доменом (например, вариабельным доменом антитела) и могут быть оценены с использованием различных анализов, известных в данной области для оценки таких эффекторных функций антитела.
“Fc-область с нативной последовательностью” содержит аминокислотную последовательность, идентичную аминокислотной последовательности Fc-области, встречающейся в природе.
“Вариант Fc-области” содержит аминокислотную последовательность, которая отличается от аминокислотной последовательности Fc-области с нативной последовательностью вследствие, по меньшей мере, одной аминокислотной модификации. В некоторых вариантах Fc-области имеет, по меньшей мере одну, аминокислотную замену по сравнению с Fc-областью с нативной последовательностью или с Fc-областью исходного полипептида, например от примерно одной до примерно десяти аминокислотных замен и предпочтительно от примерно одной до примерно пяти аминокислотных замен в Fc-области с нативной последовательностью или в Fc-области исходного полипептида. Вариант Fc-области согласно настоящему изобретению обычно будет, например, по меньшей мере, примерно на 80% идентичен по последовательности Fc-области с нативной последовательностью и/или Fc-области исходного полипептида, или, по меньшей мере, примерно на 90% идентичен им по последовательности, или, по меньшей мере, примерно на 95% или более идентичен им по последовательности.
“Зависимая от антител опосредованная клетками цитотоксичность” и “ADCC” относятся к опосредованному клетками ответу, при котором неспецифичные цитотоксические клетки, которые экспрессируют рецепторы Fc (FcR) (например, природные клетки-киллеры (NK), нейтрофилы и макрофаги), узнают связанное антитело на клетке-мишени и затем вызывают лизис клетки-мишени. Первичные клетки для опосредования ADCC, NK-клетки, экспрессируют только Fc RIII, тогда как моноциты экспрессируют Fc RIII, тогда как моноциты экспрессируют Fc RI, Fc RI, Fc RII и Fc RII и Fc RIII. Экспрессия FcR на гематопоэтических клетках суммирована в таблице 3 на странице 464 в Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-92 (1991). Чтобы оценить активность в ADCC представляющей интерес молекулы, можно осуществить анализы ADCC in vitro, такие как анализы, описанные в патентах США RIII. Экспрессия FcR на гематопоэтических клетках суммирована в таблице 3 на странице 464 в Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-92 (1991). Чтобы оценить активность в ADCC представляющей интерес молекулы, можно осуществить анализы ADCC in vitro, такие как анализы, описанные в патентах США  5500362 или 5821337. Применимые эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и природные клетки-киллеры (NK). Альтернативно или дополнительно ADCC-активность представляющей интерес молекулы можно оценить in vivo, например, в животной модели, такой как модель, описанная в Clynes et al. PNAS (USA) 95: 652-656 (1998). 5500362 или 5821337. Применимые эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и природные клетки-киллеры (NK). Альтернативно или дополнительно ADCC-активность представляющей интерес молекулы можно оценить in vivo, например, в животной модели, такой как модель, описанная в Clynes et al. PNAS (USA) 95: 652-656 (1998).
“Эффекторными клетками человека” являются лейкоциты, которые экспрессируют один или несколько FcR и осуществляют эффекторные функции. Обычно клетки экспрессируют, по меньшей мере, Fc RIII и осуществляют ADCC-эффекторную функцию. Примеры лейкоцитов человека, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (PBMC), природные клетки-киллеры (NK), моноциты, цитотоксические T-клетки и нейтрофилы; при этом обычно предпочтительны PBMC и NK-клетки. Эффекторные клетки могут быть выделены из их природного источника, например из крови или PBMC, как описано в данной публикации. RIII и осуществляют ADCC-эффекторную функцию. Примеры лейкоцитов человека, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (PBMC), природные клетки-киллеры (NK), моноциты, цитотоксические T-клетки и нейтрофилы; при этом обычно предпочтительны PBMC и NK-клетки. Эффекторные клетки могут быть выделены из их природного источника, например из крови или PBMC, как описано в данной публикации.
Термины “Fc-рецептор” и “FcR” используют для описания рецептора, который связывается с Fc-областью антитела. Предпочтительным FcR является FcR человека с нативной последовательностью. Кроме того, предпочтительным FcR является FcR, который связывает IgG-антитело (гамма-рецептор), и к предпочтительным рецепторам относятся рецепторы подклассов Fc RI, Fc RI, Fc RII и Fc RII и Fc RIII, включая аллельные варианты и альтернативно сплайсируемые формы указанных рецепторов. Рецепторы Fc RIII, включая аллельные варианты и альтернативно сплайсируемые формы указанных рецепторов. Рецепторы Fc RII включают Fc RII включают Fc RIIA (“активирующий рецептор”) и Fc RIIA (“активирующий рецептор”) и Fc RIIB (“ингибирующий рецептор”), которые имеют сходные аминокислотные последовательности, которые отличаются главным образом своими цитоплазматическими доменами. Активирующий рецептор Fc RIIB (“ингибирующий рецептор”), которые имеют сходные аминокислотные последовательности, которые отличаются главным образом своими цитоплазматическими доменами. Активирующий рецептор Fc RIIA содержит в своем цитоплазматическом домене основанный на тирозине мотив активации иммунорецептора (ITAM). Ингибирующий рецептор Fc RIIA содержит в своем цитоплазматическом домене основанный на тирозине мотив активации иммунорецептора (ITAM). Ингибирующий рецептор Fc RIIB содержит в своем цитоплазматическом домене основанный на тирозине мотив ингибирования иммунорецептора (ITIM) (обзор в Daëron, Annu. Rev. Immunol. 15: 203-234 (1997)). Обзор, посвященный FcR, представлен в Ravetch and Kinet, Annu. Rev. Immunol 9: 457-92 (1991); Capel et al., Immunomethods 4: 25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126: 330-41 (1995). Другие FcR, включая FcR, идентифицируемые в природе, включены в данном описании в термин “FcR”. Термин также включает неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG в плод (Guyer et al., J. Immunol. 117: 587 (1976) и Kim et al., J. Immunol. 24: 249 (1994)). RIIB содержит в своем цитоплазматическом домене основанный на тирозине мотив ингибирования иммунорецептора (ITIM) (обзор в Daëron, Annu. Rev. Immunol. 15: 203-234 (1997)). Обзор, посвященный FcR, представлен в Ravetch and Kinet, Annu. Rev. Immunol 9: 457-92 (1991); Capel et al., Immunomethods 4: 25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126: 330-41 (1995). Другие FcR, включая FcR, идентифицируемые в природе, включены в данном описании в термин “FcR”. Термин также включает неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG в плод (Guyer et al., J. Immunol. 117: 587 (1976) и Kim et al., J. Immunol. 24: 249 (1994)).
“Комплементзависимая цитотоксичность” и “CDC” относятся к лизису мишени в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например, антителом) в комплексе со своим антигеном. Чтобы оценить активацию комплемента, можно осуществить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996).
Антитело со “зрелой аффинностью” представляет собой антитело с одним или несколькими изменениями в одной или нескольких CDR, которые приводят к улучшению аффинности антитела по отношению к антигену по сравнению с исходным антителом, в котором нет указанного изменения(ий). Предпочтительные антитела со зрелой аффинностью будут иметь наномолярные или даже пикомолярные аффинности по отношению к антигену-мишени. Антитела со зрелой аффинностью получают способами, известными в данной области. В Marks et al. Bio/Technology 10: 779-783 (1992) описано созревание аффинности в результате перетасовки доменов VH и VL. Случайный мутагенез остатков CDR и/или каркаса описан в Barbas et al. Proc. Nat. Acad. Sci., USA 91: 3809-3813 (1994); Schier et al. Gene 169: 147-155 (1995); Yelton et al. J. Immunol. 155: 1994-2004 (1995); Jackson et al., J. Immunol. 154(7): 3310-9 (1995) и Hawkins et al, J. Mol. Biol. 226: 889-896 (1992).
“Гибкий линкер” в данном описании относится к пептиду, содержащему два или более аминокислотных остатков, связанных пептидной связью(ями), и он обеспечивает больше свободы вращения для двух соединенных им полипептидов (таких как две Fd-области). Такая свобода вращения позволяет двум или более антигенсвязывающим участкам, соединенным гибким линкером, более эффективно достигать антигена-мишени. Примеры подходящих последовательностей гибких линкерных пептидов включают gly-ser, gly-ser-gly-ser, ala-ser и gly-gly-gly-ser.
“Домен димеризации” образован в результате связывания, по меньшей мере, двух аминокислотных остатков (как правило, остатков цистеина) или, по меньшей мере, двух пептидов или полипептидов (которые могут иметь одну и ту же или разные аминокислотные последовательности). Пептиды или полипептиды могут взаимодействовать друг с другом посредством ковалентной и/или нековалентной связи(связей). Примеры доменов димеризации включают Fc-область; шарнирную область; домен CH3; домен CH4; пару CH1-CL; “область контакта”, имеющую сконструированное “выпячивание” и/или “выступ”, которая описана в патенте США  5821333, специально включенном в данное описание в виде ссылки; лейциновую молнию (например, лейциновую молнию jun/fos, см. Kostelney et al., J. Immunol., 148: 1547-1553 (1992); или лейциновую молнию GCN4 дрожжей); изолейциновую молнию; димерную пару рецепторов (например, рецептора интерлейкина-8 (IL-8R) и гетеродимеры интегрина, такие как LFA-1 и GPIIIb/IIIa) или область(и) их димеризации; димерные полипептиды лигандов (например, фактора роста нервов (NGF), нейтротрофина-3 (NT-3), интерлейкина-8 (IL-8), фактора роста эндотелиальных клеток сосудов (VEGF), VEGF-C, VEGF-D, представителей PDGF и полученного из головного мозга нейротрофического фактора (BDNF); см. Arakawa et al. J. Biol. Chem. 269(45): 27833-27839 (1994) и Radziejewski et al. Biochem. 32(48): 1350 (1993)), или область(и) их димеризации; пару остатков цистеина, способных образовывать дисульфидную связь; пару пептидов или полипептидов, каждый из которых содержит, по меньшей мере, один остаток цистеина (например, от примерно одного, двух или трех до примерно десяти остатков цистеина), так чтобы могла образоваться дисульфидная связь (связи) между пептидами или полипептидами (в дальнейшем “синтетический шарнир”); и вариабельные домены антител. Наиболее предпочтительным доменом димеризации согласно изобретению является Fc-область или шарнирная область. 5821333, специально включенном в данное описание в виде ссылки; лейциновую молнию (например, лейциновую молнию jun/fos, см. Kostelney et al., J. Immunol., 148: 1547-1553 (1992); или лейциновую молнию GCN4 дрожжей); изолейциновую молнию; димерную пару рецепторов (например, рецептора интерлейкина-8 (IL-8R) и гетеродимеры интегрина, такие как LFA-1 и GPIIIb/IIIa) или область(и) их димеризации; димерные полипептиды лигандов (например, фактора роста нервов (NGF), нейтротрофина-3 (NT-3), интерлейкина-8 (IL-8), фактора роста эндотелиальных клеток сосудов (VEGF), VEGF-C, VEGF-D, представителей PDGF и полученного из головного мозга нейротрофического фактора (BDNF); см. Arakawa et al. J. Biol. Chem. 269(45): 27833-27839 (1994) и Radziejewski et al. Biochem. 32(48): 1350 (1993)), или область(и) их димеризации; пару остатков цистеина, способных образовывать дисульфидную связь; пару пептидов или полипептидов, каждый из которых содержит, по меньшей мере, один остаток цистеина (например, от примерно одного, двух или трех до примерно десяти остатков цистеина), так чтобы могла образоваться дисульфидная связь (связи) между пептидами или полипептидами (в дальнейшем “синтетический шарнир”); и вариабельные домены антител. Наиболее предпочтительным доменом димеризации согласно изобретению является Fc-область или шарнирная область.
“Функциональный антигенсвязывающий участок” антитела представляет собой участок, который способен связывать антиген-мишень. Аффинность связывания антигена антигенсвязывающего участка необязательно такая же высокая, как у исходного антитела, из которого антигенсвязывающий участок получают, но способность связывать антиген должна быть измеримой с использованием любого из множества способов, известных для оценки связывания антитела с антигеном. Кроме того, аффинность связывания антигена каждого из антигенсвязывающих участков поливалентного антитела согласно настоящему изобретению необязательно должна быть одинаковой количественно. В случае мультимерных антител согласно изобретению количество функциональных антигенсвязывающих участков можно оценить с использованием анализа на основе ультрацентрифугирования. Согласно указанному способу анализа в разных соотношениях объединяют антиген-мишень и мультимерное антитело и рассчитывают среднюю молекулярную массу комплексов, допуская разные количества функциональных участков связывания. Полученные теоретические значения сравнивают с полученными реальными экспериментальными значениями, чтобы оценить количество функциональных участков связывания.
Антитело, обладающее “биологическим свойством” указанного антитела, представляет собой антитело, которое имеет одно или несколько биологических свойств указанного антитела, которые отличают его от других антител, которые связываются с тем же самым антигеном.
Чтобы провести скрининг антител, которые связываются с эпитопом на антигене, связываемом представляющим интерес антителом, можно осуществить обычный анализ перекрестного блокирования, такой как анализ, описанный в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988).
Введение “в комбинации с” одним или несколькими дополнительными терапевтическими средствами включает в себя совместное (одновременное) и/или последовательное введение в любом порядке.
“Млекопитающее” в целях лечения относится к любому животному, классифицируемому как млекопитающее, включая человека, домашних и сельскохозяйственных животных и животных в зоопарках, спортивных животных или комнатных животных, таких как собаки, лошади, кошки, коровы, овцы, свиньи и т.д. Обычно млекопитающим является человек.
“Расстройство” означает любое состояние, при котором может быть полезно лечение с использованием молекулы согласно изобретению. Такое состояние включает хронические и острые расстройства или заболевания, включая такие патологические состояния, которые обусловливают предрасположенность субъекта к рассматриваемому расстройству. Не ограничивающие примеры расстройств, подвергаемых лечению согласно настоящему изобретению, включают любую форму опухоли, доброкачественные и злокачественные опухоли; васкуляризированные опухоли; гипертрофию; лейкозы и лимфоидные злокачественные новообразования; нейронные, глиальные, астроглиальные, гипоталамические и другие расстройства, затрагивающие железы, макрофаги, эпителий, строму и бластоцель; и воспалительные, ангиогенные и иммунологические расстройства, сосудистые расстройства, которые возникают в результате неподходящей, аномальной, чрезмерной и/или патологической васкуляризации и/или проницаемости сосудов.
Термин “эффективное количество” или “терапевтически эффективное количество” относится к количеству лекарственного средства, эффективному при лечении заболевания или расстройства у млекопитающего. В случае злокачественной опухоли эффективное количество лекарственного средства может уменьшать количество злокачественных клеток; уменьшать размер опухоли; ингибировать (т.е. в определенной степени замедлять и обычно останавливать) инфильтрацию злокачественных клеток в периферические органы; ингибировать (т.е. в определенной степени замедлять и обычно останавливать) опухолевые метастазы; в определенной степени ингибировать рост опухоли; и/или в определенной степени ослаблять один или несколько симптомов, связанных с расстройством. В зависимости от степени, в которой лекарственное средство может предотвращать рост и/или убивать существующие злокачественные клетки, оно может быть цитостатическим и/или цитотоксическим. В случае терапии злокачественной опухоли эффективность in vivo можно, например, измерить, оценивая продолжительность выживания, время до прогрессирования заболевания (TTP), коэффициент ответа (RR), продолжительность ответа и/или качество жизни.
“Лечение” относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам. К субъектам, нуждающимся в лечении, относятся субъекты, уже имеющие расстройство, а также субъекты, у которых необходимо предотвратить расстройство.
Термин “биологическая активность” и “биологически активный” по отношению к молекулам ANGPTL4 согласно настоящему изобретению относится к способности молекулы специфично связываться и регулировать ответы клеток, например пролиферацию, адгезию, миграцию, модулирование липидов и т.д. Клеточные ответы также включают ответы, опосредованные рецептором ANGPTL4, например интегриновым рецептором  V V 5, включая, без ограничения, адгезию, миграцию и/или пролиферацию. В данном контексте термин “модулировать” включает как стимуляцию, так и ингибирование. Молекулы согласно изобретению также включают агонисты и антагонисты рецептора ANGPTL4, например интегринового рецептора 5, включая, без ограничения, адгезию, миграцию и/или пролиферацию. В данном контексте термин “модулировать” включает как стимуляцию, так и ингибирование. Молекулы согласно изобретению также включают агонисты и антагонисты рецептора ANGPTL4, например интегринового рецептора  V V 5. 5.
“Гипертрофию” в используемом в данном описании смысле определяют как увеличение массы органа или структуры, независимое от природного роста, в которое не вовлечено образование опухоли. Гипертрофия органа или ткани является следствием либо увеличения массы отдельных клеток (истинная гипертрофия), либо следствием увеличения количества клеток, составляющих ткань (гиперплазия), либо и того и другого.
Термин “злокачественная опухоль” и “злокачественный” относится или описывает физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым клеточным ростом. Примеры злокачественной опухоли включают без ограничения карциному, лимфому, бластому, саркому и лейкоз или лимфоидные злокачественные новообразования. Более конкретные примеры таких злокачественных опухолей включают рак почки или почечный рак, рак молочной железы, рак ободочной кишки, рак прямой кишки, рак прямой и ободочной кишки, рак легкого, включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и сквамозную карциному легкого, рак сквамозных клеток (например, рак эпителиальных сквамозных клеток), рак шейки матки, рак яичника, рак простаты, рак печени, рак мочевого пузыря, рак брюшины, гепатоклеточный рак, желудочный рак или рак желудка, включая рак желудочно-кишечного тракта, рак поджелудочной железы, рак головы и шеи, глиобластому, ретинобластому, астроцитому, текомы, арренобластомы, гепатому, гематологические злокачественные заболевания, включая неходжкинскую лимфому (NHL), множественную миелому и острые гематологические злокачественные заболевания, карциному эндометрия или матки, эндометриоз, фибросаркомы, хориокарциному, карциному слюнных желез, рак вульвы, рак щитовидной железы, карциномы пищевода, карциному печени, карциному заднего прохода, карциному пениса, носоглоточную карциному, карциномы гортани, саркому Капоши, меланому, карциномы кожи, шванномы, олигодендроглиому, нейробластомы, рабдомиосаркому, остеобластосаркому, лейомиосаркомы, карциномы мочевыводящих путей, карциномы щитовидной железы, опухоль Вильма, а также B-клеточную лимфому (включая фолликулярную неходжкинскую лимфому (NHL) низкой степени злокачественности; мелкоклеточную лимфоцитарную (SL) NHL; фолликулярную NHL средней степени злокачественности; диффузную NHL средней степени злокачественности; иммунобластную NHL высокой степени злокачественности; лимфобластную NHL высокой степени злокачественности; мелкоклеточную NHL с нерасщепленными ядрами высокой степени злокачественности; NHL с массивной опухолевой массой; лимфому из клеток мантийной зоны; связанную со СПИД лимфому и макроглобулинемию Вальденстрома); хронический лимфоцитарный лейкоз (CLL); острый лимфобластный лейкоз (ALL); лейкоз ворсистых клеток; хронический миелобластный лейкоз и посттрансплантационное лимфопролиферативное заболевание (PTLD), а также аномальную пролиферацию сосудов, связанную с факоматозом, эдемой (такой как эдема, связанная с опухолями головного мозга) и синдромом Мейгса.
Термин “антинеопластическая композиция” относится к композиции, применимой для лечения злокачественной опухоли, содержащей, по меньшей мере, одно активное терапевтическое средство, например “противоопухолевое средство”. Примеры терапевтических средств (противоопухолевых средств) включают, без ограничения, например, химиотерапевтические средства, ингибирующие рост средства, цитотоксические средства, средства, используемые в лучевой терапии, средства против ангиогенеза, апоптозные средства, средства против тубулина, токсины и другие средства для лечения злокачественной опухоли, например нейтрализующее анти-VEGF-антитело, антагонист VEGF, анти-HER-2, анти-CD20, антагонист рецептора эпидермального фактора роста (EGFR) (например, ингибитор тирозинкиназы), ингибитор HER1/EGFR, эрлотиниб, ингибитор COX-2 (например, целекоксиб), интерфероны, цитокины, антагонисты (например, нейтрализующие антитела), которые связываются с одним или несколькими рецепторами ErbB2, ErbB3, ErbB4 или VEGF, ингибиторы рецепторных тирозинкиназ для полученного из тромбоцитов фактора роста (PDGF) и/или фактора стволовых клеток (SCF) (например, мезилат иматиниба (Gleevec® Novartis)), TRAIL/Apo2 и другие биоактивные и органические химические агенты и т.д. Комбинации указанных средств также включены в изобретение.
Термин “цитотоксическое средство” в используемом в данном описании смысле относится к веществу, которое ингибирует или предотвращает функцию клеток и/или вызывает разрушение клеток. Подразумевается, что термин включает радиоактивные изотопы (например, 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P и радиоактивные изотопы Lu), химиотерапевтические средства и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины, имеющие происхождение из бактерий, грибов, растений или животных, включая их фрагменты и/или варианты.
“Ингибирующее рост средство” при использовании в данном описании относится к соединению или композиции, которая ингибирует рост клетки in vitro и/или in vivo. Таким образом, ингибирующим рост средством может быть средство, которое в значительной степени уменьшает процентное содержание клеток в S-фазе. Примеры ингибирующих рост средств включают средства, которые блокируют прохождение клеточного цикла (в другом месте, отличном от S-фазы), такие как средства, которые индуцируют задержку в G1-фазе и задержку в M-фазе. Классические блокаторы M-фазы включают алкалоиды барвинка (винкристин и винбластин), TAXOL® и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Средства, которые задерживают в G1, также распространяют свое действие на задержку в S-фазе, например ДНК-алкилирующе агенты, такие как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., в главе 1, озаглавленной “Cell cycle regulation, oncogenes, and antineoplastic drugs” by Murakami et al. (WB Saunders: Philadelphia, 1995), особенно на стр.13.
“Химиотерапевтическим средством” является химическое соединение, применимое для лечения злокачественной опухоли. Примеры химиотерапевтических средств включают алкилирующие агенты, такие как тиотепа и CYTOXAN® циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбохинон, метуредопа и уредопа; этиленимины и метилмеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогенины (в частности, буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урацилмустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности калихеамицин-гамма II и калихеамицин-омега II (см., например, Agnew, Chem. Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; эсперамицин; а также хромофор неокарциностатина и родственные хромофоры хромопротеинов – энедииновые антибиотики), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицин, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая ADRIAMYCIN®, морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин, доксорубицин·HCl в инъецируемых липосомах (DOXIL®) и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (GEMZAR®), тегафур (UFTORAL®), капецитабин (XELODA®), эпотилон и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; средства, подавляющие функции надпочечников, такие как аминоглютетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фолиновая кислота; ацеглатон; гликозид альдофосфамид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазинон; элфорнитин; ацетат эллиптиния; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; мейтанзиноиды, такие как мейтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2′,2 -трихлортриэтиламин; трихотецены (в частности, токсин T-2, верракурин A, роридин A и ангуидин); уретан; виндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (“Ara-C”); тиотепа; таксоиды, например паклитаксел (TAXOL®), препарат паклитаксела на основе сконструированных связанных с альбумином наночастиц (ABRAXANETM) и доксетаксел (TAXOTERE®); хлорамбуцил; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; лейковорин; винорелбин (NAVELBINE®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; фармацевтически приемлемые соли, кислоты и производные любого агента, указанного выше; а также комбинации двух или более указанных выше средств, такие как CHOP, сокращенное название комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, сокращенное название схемы лечения оксалиплатином (ELOXATINTM) в сочетании с 5-FU и лейковорином. -трихлортриэтиламин; трихотецены (в частности, токсин T-2, верракурин A, роридин A и ангуидин); уретан; виндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (“Ara-C”); тиотепа; таксоиды, например паклитаксел (TAXOL®), препарат паклитаксела на основе сконструированных связанных с альбумином наночастиц (ABRAXANETM) и доксетаксел (TAXOTERE®); хлорамбуцил; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; лейковорин; винорелбин (NAVELBINE®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; фармацевтически приемлемые соли, кислоты и производные любого агента, указанного выше; а также комбинации двух или более указанных выше средств, такие как CHOP, сокращенное название комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, сокращенное название схемы лечения оксалиплатином (ELOXATINTM) в сочетании с 5-FU и лейковорином.
Также в указанное определение включены противогормональные средства, которые действуют, регулируя, уменьшая, блокируя или ингибируя эффекты гормонов, которые могут стимулировать рост злокачественной опухоли, и часто их используют в форме системного лечения или лечения на уровне целого организма. Они сами могут являться гормонами. Примеры включают антиэстрогены и избирательные модуляторы рецепторов эстрогена (SERM), включая, например, тамоксифен (включая тамоксифен NOLVADEX®), ралоксифен (EVISTA®), дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (FARESTON®); антипрогестероны; понижающие регуляторы рецептора эстрогена (ERD); средства, которые функционируют, подавляя или прекращая работу яичников, например агонисты рилизинг-гормона лютеинизирующего гормона (LHRH), такие как ацетат лейпролида (LUPRON® и ELIGARD®), ацетат гозерелина, ацетат бузерелина и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, которая регулирует продукцию эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола (MEGASE®), эксеместан (AROMASIN®), форместан, фадрозол, ворозол (RIVISOR®), летрозол (FEMARA®) и анастрозол (ARIMIDEX®). Кроме того, такое определение химиотерапевтических средств включает бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат (DIDROCAL®), NE-58095, золедроновая кислота/золедронат (ZOMETA®), алендронат (FOSAMAX®), памидронат (AREDIA®), тилудронат (SKELID®) или ризедронат (ACTONEL®); а также троксацитабин (1,3-диоксолановый нуклеозидный аналог цитозина); антисмысловые олигонуклеотиды, в частности олигонуклеотиды, которые ингибируют экспрессию генов в путях передачи сигналов, вовлеченных в пролиферацию аберрантных клеток, таких как, например, PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и вакцины для генной терапии, например вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 (например, LURTOTECAN®); rmRH (например, ABARELIX®); дитозилат лапатиниба (низкомолекулярный двойной ингибитор тирозинкиназ ErbB-2 и EGFR, также известный как GW572016); ингибиторы COX-2, такие как целекоксиб (CELEBREX®; 4-(5-(4-метилфенил)-3-(трифторметил)-1H-пиразол-1-ил)бензолсульфонамид; и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше средств.
Термин “цитокин” является родовым названием белков, высвобождаемых одной популяцией клеток, которые действуют на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. К цитокинам относится гормон роста, такой как гормон роста человека, N-метионил-гормон роста человека и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреотропин (ТSH) и лютеинизирующий гормон (LH); фактор роста гепатоцитов; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухолей-альфа и -бета; мюллерова ингибирующая субстанция; мышиный ассоциированный с гонадотропином пептид; ингибин; активин; факторы роста эндотелиальных клеток сосудов (например, VEGF, VEGF-B, VEGF-C, VEGF-D, VEGF-E); полученный из плаценты фактор роста (PlGF); полученные из тромбоцитов факторы роста (PDGF, например PDGFA, PDGFB, PDGFC, PDGFD); интегрин; тромбопоэтин (TPO); факторы роста нервов, такие как NGF-альфа; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-альфа и TGF-бета; инсулиноподобный фактор роста-I и -II; эритропоэтин (EPO); остеоиндуктивные факторы; интерфероны, такие как интерферон-альфа, -бета и -гамма, колониестимулирующие факторы (CSF), такие как CSF макрофагов (M-CSF), CSF гранулоцитов и макрофагов (GM-CSF) и CSF гранулоцитов (G-CSF); интерлейкины (IL), такие как IL-1, IL-1-альфа, IL-1-бета, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-30; секретоглобин/утероглобин; онкостатин M (OSM); фактор некроза опухолей, такой как TNF-альфа или TNF-бета; и другие полипептидные факторы, включая LIF и лиганд kit (KL). В используемом в данном описании смысле термин “цитокин” включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты цитокинов с нативной последовательностью.
Термин “пролекарство”, используемый в данной заявке, относится к форме предшественника или производного фармацевтически активного вещества, которая является менее цитотоксичной по отношению к опухолевым клеткам по сравнению с исходным лекарственным средством и способна подвергаться ферментативной активации или превращению в более активную исходную форму. См., например, Wilman, “Prodrugs in Cancer Chemotherapy” Biochemical Society Transactions, 14, pp.375-382, 615th Meeting Belfast (1986) и Stella et al., “Prodrugs: A Chemical Approach to Targeted Drug Delivery”, Directed Drug Delivery, Borchardt et al., (ed.), pp.247-267, Humana Press (1985). Пролекарства согласно изобретению включают без ограничения пролекарства, содержащие фосфат, пролекарства, содержащие тиофосфат, пролекарства, содержащие сульфат, пролекарства, содержащие пептид, пролекарства, модифицированные D-аминокислотами, гликозилированные пролекарства, пролекарства, содержащие бета-лактам, пролекарства, содержащие необязательно замещенный феноксиацетамид, или пролекарства, содержащие необязательно замещенный фенилацетамид, 5-фторцитозинсодержащие и другие 5-фторуридинсодержащие пролекарства, которые могут быть превращены в более активное цитотоксическое свободное пролекарство. Примеры цитотоксических лекарственных средств, которые могут быть дериватизованы в пролекарственную форму для применения в настоящем изобретении, включают без ограничения химиотерапевтические средства, описанные выше.
“Ангиогенным фактором или средством” является фактор роста, который стимулирует развитие кровеносных сосудов, например стимулирует ангиогенез, рост эндотелиальных клеток, стабильность кровеносных сосудов и/или васкулогенез и т.д. Например, ангиогенные факторы включают, без ограничения, например, VEGF и представителей семейства VEGF, PlGF, семейства PDGF, семейства факторов роста фибробластов (FGF), лиганды TIE (ангиопоэтины), эфрины, ANGPTL3, ANGPTL4 и т.д. К ним также относятся факторы, которые ускоряют заживление ран, такие как гормон роста, инсулиноподобный фактор роста-I (IGF-I), VIGF, эпидермальный фактор роста (EGF), CTGF и представители его семейства, и TGF- и TGF- и TGF- . См., например, Klagsbrun and D’Amore, Annu. Rev. Physiol., 53: 217-39 (1991); Streit and Detmar, Oncogene, 22: 3172-3179 (2003); Ferrara and Alitalo, Nature Medicine 5(12): 1359-1364 (1999); Tonini et al., Oncogene, 22: 6549-6556 (2003) (например, таблицу 1, в которой перечислены известные ангиогенные факторы); и Sato Int. J. Clin. Oncol., 8: 200-206 (2003). . См., например, Klagsbrun and D’Amore, Annu. Rev. Physiol., 53: 217-39 (1991); Streit and Detmar, Oncogene, 22: 3172-3179 (2003); Ferrara and Alitalo, Nature Medicine 5(12): 1359-1364 (1999); Tonini et al., Oncogene, 22: 6549-6556 (2003) (например, таблицу 1, в которой перечислены известные ангиогенные факторы); и Sato Int. J. Clin. Oncol., 8: 200-206 (2003).
“Средство против ангиогенеза” или “ингибитор ангиогенеза” относится к низкомолекулярному веществу, полинуклеотиду, полипептиду, изолированному белку, рекомбинантному белку, антителу или их конъюгатам или слитым белкам, которые ингибируют ангиогенез, васкулогенез или нежелательную проницаемость сосудов либо прямо, либо опосредованно. Например, средством против ангиогенеза является антитело или другой антагонист ангиогенного средства, которое описано выше, например антитела к VEGF, антитела к рецепторам VEGF, малые молекулы, которые блокируют передачу сигнала рецептора VEGF (например, PTK787/ZK2284, SU 6668). Средства против ангиогенеза также включают нативные ингибиторы ангиогенеза, например ангиостатин, эндостатин и т.д. См., например, Klagsbrun and D’Amore, Annu. Rev. Physiol., 53: 217-39 (1991); Streit and Detmar, Oncogene, 22: 3172-3179 (2003) (например, таблицу 3, в которой перечислены антиангиогенные терапевтические средства в случае злокачественной меланомы); Ferrara & Alitalo, Nature Medicine 5(12): 1359-1364 (1999); Tonini et al., Oncogene, 22: 6549-6556 (2003) (например, таблицу 2, в которой перечислены антиангиогенные факторы) и Sato Int. J. Clin. Oncol., 8: 200-206 (2003) (например, таблицу 1, в которой перечислены антиангиогенные средства, применяемые в клинических испытаниях).
Слово “метка” при использовании в данном описании относится к регистрируемому соединению или композиции, которые конъюгированы прямо или опосредованно с полипептидом. Метку можно регистрировать как таковую (например, радиоизотопные метки или флуоресцентные метки), или, как в случае ферментной метки, она может катализировать химическое изменение субстратного соединения или композиции, которое регистрируется.
“Изолированной” молекулой нуклеиновой кислоты является молекула нуклеиновой кислоты, которую идентифицируют и отделяют, по меньшей мере, от одной примесной молекулы нуклеиновой кислоты, с которой она обычно ассоциирована в природном источнике нуклеиновой кислоты полипептида. Изолированная молекула нуклеиновой кислоты имеет другую форму или окружение, отличные от той формы и окружения, в которых она встречается в природе. Поэтому изолированные молекулы нуклеиновой кислоты отличаются от молекулы нуклеиновой кислоты, в виде которой они существуют в природных клетках. Однако изолированная молекула нуклеиновой кислоты включает в себя молекулу нуклеиновой кислоты, которая содержится в клетках, которые обычно экспрессируют полипептид, в которых молекула нуклеиновой кислоты находится, например, в положении хромосомы, отличном от положения в хромосоме природных клеток.
Выражение “регуляторные последовательности” относится к последовательностям ДНК, необходимым для экспрессии оперативно связанной кодирующей последовательности в организме конкретного хозяина. Регуляторные последовательности, которые подходят для прокариот, например, включают в себя промотор, необязательно последовательность оператора и участок связывания рибосомы. Эукариотические клетки, как известно, используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота является “оперативно связанной”, когда она размещена в функциональной взаимосвязи с другой последовательностью нуклеиновой кислоты. Например, ДНК для препоследовательности или лидера секреции является оперативно связанной с ДНК для полипептида, если она экспрессируется в виде пребелка, который принимает участие в секреции полипептида; промотор или энхансер является оперативно связанным с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или участок связывания рибосом является оперативно связанным с кодирующей последовательностью, если он расположен так, чтобы способствовать трансляции. Обычно “оперативно связанные” означает, что последовательности ДНК, которые связаны, являются соседними и, в случае лидера секреции, являются соседними и находятся в рамке считывания. Однако энхансеры не должны быть соседними. Связывание осуществляют лигированием в подходящих сайтах рестрикции. Если таких сайтов не существует, то используют синтетические олигонуклеотидные адаптеры или линкеры согласно обычной практике.
В используемом в данном описании смысле выражения “клетка”, “линия клеток” и “культура клеток” используют взаимозаменяемо, и все такие определения включают потомство. Таким образом, слова “трансформанты” и “трансформированные клетки” включают первичную клетку субъекта и полученные из нее культуры, независимо от количества переносов. Также понятно, что все потомство может быть не строго идентичным по содержанию ДНК вследствие преднамеренных или случайных мутаций. В изобретение включено мутантное потомство, которое имеет такую же функцию или биологическую активность, которые выявлены в исходно трансформированной клетке. Случаи, когда имеют в виду особые отличительные признаки, будут понятны из контекста.
ANGPTL4
Ангиопоэтинподобный белок 4 (ANGPTL4) является секретируемым белком и является членом семейства ангиопоэтина. Он также известен как фибриноген печени/ангиопоэтинродственный белок (HFARP) (Kim et al., Biochem. J. 346: 603-610 (2000)), PGAR (PPAR -ангиопоэтинродственный белок) (Yoon, et al., Mol. Cell Biol., 20: 5343-5349 (2000)), индуцируемый голоданием адипозный фактор (FIAF) (Kerten et al., J. Biol. Chem., 275: 28488-28493 (2000)); ангиопоэтинродственный белок (ARP-4); NL2 (см. патенты США -ангиопоэтинродственный белок) (Yoon, et al., Mol. Cell Biol., 20: 5343-5349 (2000)), индуцируемый голоданием адипозный фактор (FIAF) (Kerten et al., J. Biol. Chem., 275: 28488-28493 (2000)); ангиопоэтинродственный белок (ARP-4); NL2 (см. патенты США  6348350, 6372491 и 6455496) и Ang6. 6348350, 6372491 и 6455496) и Ang6.
Белок ANGPTL4 человека является белком из 406 аминокислот (например, патенты США 6348350, 6372491 и 6455496), тогда как мышиный ANGPTL4 является белком из 410 аминокислот (Kim et al., Biochem. J. 346: 603-610 (2000)). Белки мыши и человека обладают примерно 75% идентичностью на уровне аминокислот. Kim et al., Biochem. J. 346: 603-610 (2000). ANGPTL4 имеет сигнальный пептид, три потенциальных сайта N-гликозилирования и четыре остатка цистеина, которые могут быть вовлечены в образование внутримолекулярных дисульфидных связей. Например, ANGPTL4 образует более высокомолекулярные структуры, например, как показано на фиг.3, панель A. См. также, например, Ge et al., J. Biol. Chem., 279 (3): 2038-2045 (2004); Ge et al., J. Lipid Res. 45: 2071-2079 (2004) и Mandard et al., J. of Biol. Chem., 279 (33): 34411-34420 (2004). ANGPTL4 также может протеолитически процессироваться. См. также, например, Ge et al., J. Biol. Chem., 279 (3): 2038-2045 (2004) и Mandard et al., J. of Biol. Chem., 279 (33): 34411-34420 (2004). Как описано в данной публикации, замена R162G и R164E в ANGPTL4 приводит к варианту ANGPTL4, разгоняемому на уровне более высокой молекулярной массы в SDS-геле, чем белок дикого типа (или нативный белок) (см. фиг.3, панель B).
Консервативные области семейства ангиопоэтина включают биспиральный домен и C-концевой фибриноген (FBN)-подобный домен. См., например, Kim et al., Biochem. J. 346: 603-610 (2000). Предполагается, что ANGPTL4 протеолитически процессируется регулируемым образом с высвобождением C-концевого фибриногенподобного домена. См., например, Ge et al., J. Biol. Chem., 279 (3): 2038-2045 (2004). Другие представители семейства ангиопоэтинов включают ангиопоэтин 1, ангиопоэтин 2 и ангиопоэтин 3/ангиопоэтин 4, которые связываются с рецептором Tie2. См., например, Davis et al., Cell 87, 1161-1169 (1996); Maisonpierre et al., Science 277, 55-60 (1997); Valenzuela et al., Proc. Natl. Acad. Sci. USA 96, 1904-1909 (1999) и патенты США  5521073, 5650490 и 5814464. Ангиопоэтин 1 и 4, по-видимому, являются агонистами рецептора Tie2, тогда как ангиопоэтин 2 и 3, по-видимому, являются антагонистами (и, возможно, агонистами) рецептора Tie2. См., например, Folkman and D’Amore, Cell, 87: 1153-1155 (1996); Suri et al., Cell, 87: 1171-1180 (1996); Masionpierre et al., Science 277: 55-60 (1997) и Ward & Dumont, Seminars in Cell & Developmental Biology, 13: 19-27 (2002). 5521073, 5650490 и 5814464. Ангиопоэтин 1 и 4, по-видимому, являются агонистами рецептора Tie2, тогда как ангиопоэтин 2 и 3, по-видимому, являются антагонистами (и, возможно, агонистами) рецептора Tie2. См., например, Folkman and D’Amore, Cell, 87: 1153-1155 (1996); Suri et al., Cell, 87: 1171-1180 (1996); Masionpierre et al., Science 277: 55-60 (1997) и Ward & Dumont, Seminars in Cell & Developmental Biology, 13: 19-27 (2002).
Другой представитель семейства, ангиопоэтинподобный белок 3 (ANGPTL3), является ангиогенным фактором, который связывается с интегрином  V V 3. См., например, заявку на выдачу патента США 2003/0215451, опубликованную 20 ноября 2003, и Camenisch et al., J. Biol. Chem., 277(19): 17281-17290 (2002). ANGPTL3, по-видимому, не связывается с рецептором Tie2. Camenish et al., Journal of Biol. Chem. 277(19): 17281-17290 (2002). ANGPTL3 также является регулятором уровней липидов в плазме. См., например, Koishi et al., Nat. Genetics 30: 151-157 (2002). 3. См., например, заявку на выдачу патента США 2003/0215451, опубликованную 20 ноября 2003, и Camenisch et al., J. Biol. Chem., 277(19): 17281-17290 (2002). ANGPTL3, по-видимому, не связывается с рецептором Tie2. Camenish et al., Journal of Biol. Chem. 277(19): 17281-17290 (2002). ANGPTL3 также является регулятором уровней липидов в плазме. См., например, Koishi et al., Nat. Genetics 30: 151-157 (2002).
ANGPTL4 связывается с интегрином  V V 5. См., например, фиг.11, 12 и 13. Интегрин 5. См., например, фиг.11, 12 и 13. Интегрин  V V 5 является рецептором белков внеклеточного матрикса, включая витронектин и Del-1 (см., например, Stupack and Cheresh, Journal of Cell Science 115: 3729-3738 (2002)). Альфа-v-интегрины вовлечены в прогрессирование опухолей и метастазы. См., например, Marshall, J. F. and Hart, I. R. Semin. Cancer Biol. 7(3): 129-38 (1996). Кроме того, также была показана роль альфа-v-интегринов в ходе ангиогенеза. См., например, Eliceiri, B.P. and Cheresh, D.A. Molecular Medicine 4: 741-750 (1998). Например, было показано, что моноклональное антитело к 5 является рецептором белков внеклеточного матрикса, включая витронектин и Del-1 (см., например, Stupack and Cheresh, Journal of Cell Science 115: 3729-3738 (2002)). Альфа-v-интегрины вовлечены в прогрессирование опухолей и метастазы. См., например, Marshall, J. F. and Hart, I. R. Semin. Cancer Biol. 7(3): 129-38 (1996). Кроме того, также была показана роль альфа-v-интегринов в ходе ангиогенеза. См., например, Eliceiri, B.P. and Cheresh, D.A. Molecular Medicine 4: 741-750 (1998). Например, было показано, что моноклональное антитело к  V V 5 ингибирует VEGF-индуцированный ангиогенез в роговице кроликов и в модели на основе хориоаллантоисной оболочки цыпленка. См., например, M.C. Friedlander, et al., Science 270: 1500-1502 (1995). Также показано, что антагонисты 5 ингибирует VEGF-индуцированный ангиогенез в роговице кроликов и в модели на основе хориоаллантоисной оболочки цыпленка. См., например, M.C. Friedlander, et al., Science 270: 1500-1502 (1995). Также показано, что антагонисты  V V 3 и 3 и  V V 5 ингибируют ангиогенез, индуцированный фактором роста и опухолью. См., например, Eliceiri and Cheresh, Current Opinion in Cell Biology, 13: 563-568 (2001). 5 ингибируют ангиогенез, индуцированный фактором роста и опухолью. См., например, Eliceiri and Cheresh, Current Opinion in Cell Biology, 13: 563-568 (2001).
Изобретение относится к композициям модуляторов, например агонистов или антагонистов, ангиопоэтинподобного белка 4 (ANGPTL4) и комбинациям указанных модуляторов с другими терапевтическими средствами. Например, предлагаются комбинации антагонистов ANGPTL4 с противоопухолевыми средствами и способы их применения для блокирования или снижения опухолевого роста или роста злокачественных клеток. Изобретение также относится к способам блокирования или снижения рецидивирующего опухолевого роста или рецидивирующего роста злокачественных клеток с использованием антагонистов ANGPTL4 и/или других противоопухолевых средств. Также предлагаются композиции антагонистов ANGPL4 и комбинации средств против ангиогенеза и способы их применения для блокирования или снижения неоваскуляризации в случае неопластических или ненеопластических расстройств.
Модуляторы ANGPTL4 и их применения
Модуляторами ANGPTL4 являются молекулы, которые модулируют активность ANGPTL4, например агонисты и антагонисты. Термин “агонист” используют по отношению к пептидным и непептидным аналогам ANGPTL4 и к антителам, специфично связывающим такие молекулы ANGPTL4, при условии, что они обладают способностью передавать сигнал через нативный рецептор ANGPTL4 (например, интегрин  V V 5). Термин “агонист” определяют в контексте биологической роли рецептора ANGPTL4 (например, 5). Термин “агонист” определяют в контексте биологической роли рецептора ANGPTL4 (например,  V V 5). В некоторых вариантах агонисты обладают биологическими активностями нативного ANGPTL4, которые описаны выше, такими как стимуляция пролиферации, миграции и/или адгезии клеток и/или модулирование гомеостаза липидов. 5). В некоторых вариантах агонисты обладают биологическими активностями нативного ANGPTL4, которые описаны выше, такими как стимуляция пролиферации, миграции и/или адгезии клеток и/или модулирование гомеостаза липидов.
Термин “антагонист” используют по отношению к молекулам, которые обладают способностью ингибировать биологическую активность ANGPTL4, независимо от того, обладают ли они способностью связывать ANGPTL4 или его рецептор, например  V V 5. Соответственно антагонисты, которые обладают способностью связывать ANGPTL4 или его рецептор, включают анти-ANGPTL4-антитела и анти- 5. Соответственно антагонисты, которые обладают способностью связывать ANGPTL4 или его рецептор, включают анти-ANGPTL4-антитела и анти- V V 5-антитела. Антагонист ANGPTL4 можно оценить, например, по ингибированию активности ANGPTL4, например активности ANGPTL4 в адгезии, миграции, пролиферации и/или модулировании гомеостаза липидов. Что касается активности рецептора интегрина 5-антитела. Антагонист ANGPTL4 можно оценить, например, по ингибированию активности ANGPTL4, например активности ANGPTL4 в адгезии, миграции, пролиферации и/или модулировании гомеостаза липидов. Что касается активности рецептора интегрина  V V 5, то модулятор рецептора интегрина 5, то модулятор рецептора интегрина  V V 5 можно определить способами, известными в данной области. Например, можно использовать способ, описанный J.W.Smith et al. в J. Biol. Chem. 265: 12267-12271 (1990). 5 можно определить способами, известными в данной области. Например, можно использовать способ, описанный J.W.Smith et al. в J. Biol. Chem. 265: 12267-12271 (1990).
Терапевтические применения
ANGPTL4 рассматривается в качестве мишени в случае злокачественной опухоли. ANGPTL4 при экспрессии в некоторых опухолевых клетках вызывает пролиферацию опухолевых клеток in vitro и in vivo (см., например, фиг.4, фиг.5, фиг.7 и фиг.8, панель A и панель B). В том случае, когда ANGPTL4 экспрессируется в опухолях, подвергаемых лечению антиангиогенным фактором, например анти-VEGF-антителом, опухоль может сохранять способность расти (см., например, фиг.8 панель C). ANGPTL4 также вызывает миграцию опухолевых клеток (см., например, фиг.9). Также было показано, что он подвергается повышающей регуляции в злокачественных опухолях почек. См., например, документ под номером в реестре поверенного P5032R1, WO 02/07941 и Le Jan et al., American Journal of Pathology, 162 (5): 1521-1528 (2003). Кроме того, ANGPTL4 является проангиогенным фактором (см., например, S. Le Jan et al., Am. J. Pathol., 162 (5): 1521-1528 (2003)), который является мишенью для терапии злокачественных опухолей. Подобно VEGF (Shweiki et al., Proc. Natl. Acad. Sci., USA 92: 768-772 (1995) экспрессия ANGPTL4 возрастает в ответ на гипоксию. См., например, Le Jan et al., American Journal of Pathology, 162 (5): 1521-1528 (2003).
ANGPTL4 связывается с опухолевыми клетками, например клетками A673, в различных условиях (например, фиг.6, панели A и B). Как видно, например, на фиг.4, на панели A и панели B, ANGPTL4 стимулирует рост некоторых опухолевых клеток in vitro в том случае, когда клетки трансдуцированы конструкцией, экспрессирующей ANGPTL4. Панель C на фиг.4 также иллюстрирует, что добавление кондиционированной среды от клеток COS7, трансдуцированных ANGPTL4, индуцирует пролиферацию клеток A673. См. также фиг.7, панели A и B. ANGPTL4 индуцирует пролиферацию клеток A673 в том случае, когда ANGPTL4 покрывают чашки для культивирования (см. фиг.5), но не индуцирует клеточную пролиферацию эпителиальных клеток почки, мезангиальных клеток почки или HUVEC. ANGPTL4 также индуцирует клеточную миграцию опухолевых клеток. См., например, фиг.9.
ANGPTL4 преимущественно экспрессируется в жировой ткани, плаценте, печени и почках и также подвергается повышающей регуляции у мышей ob/ob (нокаутированных по лептину) и db/db (нокаутированных по рецептору лептина). См., например, Yoon et al., Mol. Cell. Biol. 20: 5343-5349 (2000); Kim et al., Biochem. J., 346: 603-610 (2000); Kersten et al., J. Biol. Chem., 275: 28488-28493 (2000) и Le Jan et al., American Journal of Pathology 162 (5): 1521-1528 (2003). Также сообщалось, что ANGPTL4 является модулятором липидов и ингибитором липопротеинлипазы. См., например, Yu et al., PNAS USA 102 (5): 1767-1772 (2005); Yoshida et al., J. Lipid Res. 43: 1770-1772 (2002) и Wiesner et al., J. Endocrinology 180: R1-R6 (2004). Экспрессия ANGPTL4 также индуцируется PPAR-гамма и -альфа в жировой ткани и индуцируется голоданием. ANGPTL4 также модулирует пролиферацию преадипоцитов и гепатоцитов и/или клеточную миграцию преадипоцитов наряду с модулированием уровней триглицеридов и холестерина в сыворотке. См. предварительную заявку на выдачу патента США 60/589875 и номером в реестре поверенного P2156R1, поданную одновременно, которая включена в виде ссылки для всех целей. Исследователи сообщали о связях между ангиогенезом и адипогенезом. См., например, Sierra-Honigmann et al., “Biological Action of Leptin as an Angiogenic Factor” Science 281: 1683-1686; (1998); Rupnick et al., “Adipose tissue mass can be regulated through the vasculature” Proc. Nat. Acad. Sci. USA, 99(16): 10730-10735 (2002); and Fukumura et al., “Paracrine Regulation of Angiogenesis and Adipocyte Differentiation During In Vivo Adipogenesis.” Circ. Res. 93: e88-e97 (2003).
Согласно изобретению предполагается, что модуляторы ANGPTL4 и/или комбинации модуляторов ANGPTL4 и других терапевтических средств можно применять для лечения различных неоплазм или ненеопластических состояний. В одном варианте модуляторы ANGPTL4, например антагонисты ANGPTL4, применяют для ингибирования роста злокачественных клеток или роста опухоли. Например, как видно на фиг.10, панели A и B, поликлональные анти-ANGPTL4-антитела ингибировали рост опухолевых клеток зависимым от дозы образом. ANGPTL4 может вызывать миграцию опухолевых клеток (см., например, фиг.9). Согласно изобретению предполагается, что антагонисты ANGPTL4 также можно применять для ингибирования метастазов опухоли. ANGPTL4 также индуцирует миграцию преадипоцитов. См. предварительную заявку на выдачу патента США 60/589875 и под номером в реестре поверенного P2156R1, поданную одновременно. В некоторых вариантах одно или несколько противоопухолевых средств можно вводить вместе с антагонистами ANGPTL4, чтобы ингибировать рост злокачественных клеток или рост опухоли. См. раздел, озаглавленный “Комбинированная терапия”, в данном описании.
Примеры неопластических расстройств, подвергаемых лечению, включают, без ограничения, расстройства, описанные в данной публикации под терминами “злокачественная опухоль” и “злокачественный”. Ненеопластические состояния, которые поддаются лечению антагонистами согласно изобретению, включают, без ограничения, например, нежелательную или отклоняющуюся от нормы гипертрофию, артрит, ревматоидный артрит (RA), псориаз, псориазные бляшки, саркоидоз, атеросклероз, атеросклеротические бляшки, отек в результате инфаркта миокарда, диабетические и другие пролиферативные ретинопатии, включая синдром Терри, ретролентальную фиброплазию, неоваскулярную глаукому, связанную с возрастом дегенерацию желтого пятна, диабетический отек желтого пятна, неоваскуляризацию роговицы, неоваскуляризацию трансплантата роговицы, отторжение трансплантата роговицы, неоваскуляризацию сетчатки/хориоида, неоваскуляризацию уголка глаза (покраснение радужки), неоваскулярное заболевание глаза, рестеноз сосудов, артериовенозные мальформации (AVM), менингиому, гемангиому, ангиофиброму, гиперплазии щитовидной железы (включая диффузный токсический зоб), трансплантацию роговицы и других тканей, хроническое воспаление, воспаление легких, острое легочное повреждение/ARDS, сепсис, первичную легочную гипертонию, злокачественные легочные выпоты, отек головного мозга (например, связанный с острым инсультом/закрытой травмой черепа/травмой), синовиальное воспаление, образование паннуса при RA, оссифицирующий миозит, гипертрофическое образование костей, остеоартрит (OA), рефрактерные асциты, поликистоз яичника, эндометриоз, заболевания, связанные с потерей жидкости в 3-е пространство (панкреатит, синдром межфасциального пространства, ожоги, заболевание кишечника), фиброиды матки, преждевременные роды, хроническое воспаление, такое как IBD (болезнь Крона и язвенный колит), отторжение аллотрансплантата почки, воспалительное заболевание кишечника, нефротический синдром, нежелательный или отклоняющийся от нормы роста массы ткани (не злокачественный), ожирение, рост массы жировой ткани, гемофилические гемартрозы, гипертрофические рубцы, ингибирование роста волос, синдром Ослера-Вебера, пиогенную гранулему, ретролентальные фиброплазии, склеродерму, трахому, спайки сосудов, синовит, дерматит, предэклампсию, асциты, перикардиальный выпот (такой как перикардиальный выпот, связанный с перикардитом) и плевральный выпот.
Модуляторы ANGPTL4, например агонисты или активаторы ANGPTL4, можно использовать для лечения патологических расстройств. Модуляторы ANGPTL4, например агонисты ANGPTL4, можно использовать для лечения патологических расстройств, при которых требуется ангиогенез или неоваскуляризация и/или гипертрофия, которые включают, без ограничения, например, травму сосудов, раны, разрывы, разрезы, ожоги, язвы (например, диабетические язвы, пролежневые язвы, гемофилические язвы, варикозные язвы), рост тканей, прибавление массы, болезнь периферических артерий, возбуждение родовой деятельности, рост волос, буллезный эпидермолиз, почечную атрофию, переломы костей, срастания позвонков, разрывы менисков и т.д. См. также предварительную заявку на выдачу патента США 60/589875 и номером в реестре поверенного P2156R1, поданную одновременно.
Комбинированная терапия
Как указано выше, изобретение относится к комбинированной терапии, при которой антагонист ANGPTL4 вводят с другими средствами терапии. Например, антагонисты ANGPTL4 применяют в комбинациях с противоопухолевыми терапевтическим средствами или терапевтическими средствами против неоваскуляризации для лечения различных неопластических состояний или состояний, не являющихся неопластическими. В одном варианте неопластическое состояние или состояние, не являющееся неопластическим, характеризуется патологическим расстройством, связанным отклоняющимся от нормы или нежелательным ангиогенезом. Антагонист ANGPTL4 можно вводить последовательно или совместно с другим средством, которое является эффективным для таких целей, либо в виде одной композиции, либо в виде отдельных композиций. Альтернативно или дополнительно можно вводить несколько ингибиторов ANGPTL4.
Введение антагониста и/или средств согласно изобретению можно осуществлять одновременно, например, в виде одной композиции или в виде двух или более отдельных композиций, используя один и тот же или разные пути введения. Альтернативно или дополнительно введение можно осуществлять последовательно в любом порядке. В некоторых вариантах интервалы между введениями двух или более композиций могут составлять от минут до дней, недель, месяцев. Например, противоопухолевое средство можно ввести сначала, а затем ввести ингибитор ANGPTL4. Однако также предусмотрено одновременное введение или введение антагониста ANGPTL4 в первую очередь.
Эффективные количества терапевтических средств, вводимых в комбинации с антагонистом ANGPTL4, будут представлены на усмотрение лечащего врача или ветеринара. Введение доз и корректировку осуществляют так, чтобы максимально справиться с состояниями, подвергаемыми лечению. Дополнительно доза будет зависеть от таких факторов, как тип применяемого терапевтического средства и конкретный пациент, подвергаемый лечению. Подходящими дозами для противоопухолевого средства являются используемые в настоящее время дозы, и они могут быть снижены благодаря комбинированному действию (синергии) противоопухолевого средства и антагониста ANGPTL4. В некоторых вариантах комбинация ингибиторов усиливает эффективность одного ингибитора. Термин “усиливать” относится к повышению эффективности терапевтического средства в его общепринятой или одобренной дозе. См. также раздел, озаглавленный “Фармацевтические композиции”, в данном описании.
Обычно антагонисты ANGPTL4 и противоопухолевые средства являются подходящими для одного и того же или сходных заболеваний, чтобы блокировать или уменьшить патологическое расстройство, такое как опухолевый рост или рост злокачественных клеток. В одном варианте противоопухолевое средство представляет собой средство против ангиогенеза.
Антиангиогенная терапия в связи со злокачественной опухолью представляет собой методику лечения злокачественной опухоли, нацеленную на ингибирование развития кровеносных сосудов в опухоли, требуемых для доставки питательных веществ для поддержания роста опухоли. Поскольку ангиогенез вовлечен как в рост первичной опухоли, так и метастазы, то антиангиогенное лечение, предлагаемое в изобретении, способно ингибировать неопластический рост опухоли в первичном месте, а также предотвращать метастазы опухоли во вторичных местах, таким образом позволяя бороться с опухолями с помощью других терапевтических средств.
В данной области идентифицировано и известно множество антиангиогенных средств, включая средства, перечисленные в данном описании, например перечисленные в разделе “Определения” и, например, в Carmeliet and Jain, Nature 407: 249-257 (2000); Ferrara et al., Nature Reviews: Drug Discovery, 3: 391-400 (2004); и Sato Int. J. Clin. Oncol., 8: 200-206 (2003). См. также заявку на выдачу патента США US 2003/0055006. В одном варианте антагонист ANGPTL4 используют в комбинации с нейтрализующим анти-VEGF-антителом (или фрагментом) и/или другим антагонистом VEGF или антагонистом рецептора VEGF, включая, без ограничения, например, растворимые фрагменты рецептора VEGF (например, VEGFR-1, VEGFR-2, VEGFR-3, нейтропиллины (например, NRP1, NRP2)), аптамеры, способные блокировать VEGF или VEGFR, нейтрализующие анти-VEGFR-антитела, низкомолекулярные ингибиторы тирозинкиназ VEGFR (RTK), антисмысловые методики в отношении VEGF, рибозимы против VEGF или рецепторов VEGF, антагонистические варианты VEGF и любые их комбинации. Альтернативно или дополнительно пациенту можно вводить два или более ингибиторов ангиогенеза. В некоторых вариантах одно или несколько дополнительных терапевтических средств, например противоопухолевых средств, можно вводить в комбинации с антагонистом ANGPTL4 и средством против ангиогенеза.
В некоторых аспектах изобретения другие терапевтические средства, применимые для комбинированной терапии опухолей с антагонистом согласно изобретению, включают другие методы терапии злокачественной опухоли (например, хирургическую операцию, радиологическое лечение (например, включающее в себя облучение или введение радиоактивных веществ), химиотерапию, лечение противоопухолевыми средствами, перечисленными в данном описании и известными в данной области, или комбинации указанного). Альтернативно или дополнительно пациенту можно совместно вводить два или более антител, связывающих один и тот же или два или более разных антигенов, описанных в данной публикации. Иногда также может быть полезным введение пациенту одного или нескольких цитокинов.
Химиотерапевтические средства
В некоторых аспектах изобретение относится к способу блокирования или уменьшения опухолевого роста или роста злокачественных клеток посредством введения эффективных количеств антагониста ANGPTL4 и/или ингибитора(ов) ангиогенеза и одного или нескольких химиотерапевтических средств пациенту, восприимчивому к злокачественной опухоли, или пациенту, у которого диагностирована злокачественная опухоль. Множество химиотерапевтических средств можно использовать в способах комбинированной терапии согласно изобретению. Примерный и не ограничивающий список рассматриваемых химиотерапевтических средств представлен в данном описании в разделе “Определения”.
Специалистам в данной области будет понятно, что подходящие дозы химиотерапевтических средств будут, как правило, близки дозам, уже применяемым в клинической терапии, при которой химиотерапевтические средства вводят отдельно или в комбинации с другими химиотерапевтическими средствами. Вероятно, будет иметь место варьирование доз в зависимости от состояния, подвергаемого лечению. Врач, который проводит лечение, сможет определить подходящую дозу для конкретного субъекта.
Рецидивирующий рост опухоли
Изобретение также относится к способам и композициям для ингибирования или предотвращения рецидивирующего опухолевого роста или рецидивирующего роста злокачественных клеток. Например, панель C на фиг.8 схематично иллюстрирует способность опухоли, подвергаемой лечению анти-VEGF-антителом (авастин), ускользать от лечения (например, один тип рецидива) в том случае, когда опухоль экспрессирует ANGPTL4.
Рецидивирующий опухолевый рост или рецидивирующий рост злокачественных клеток используют для описания состояния, при котором пациенты, претерпевающие или подвергаемые лечению одним или несколькими имеющимися в настоящее время способами терапии (например, терапии злокачественной опухоли, такой как химиотерапия, лучевая терапия, хирургия, гормональная терапия и/или биологическая терапия/иммунотерапия, в частности стандартная терапевтическая схема для конкретной злокачественной опухоли), клинически не реагируют адекватно на лечение пациентов, или когда пациенты больше не получают какого-либо полезного эффекта от терапии, так что такие пациенты нуждаются в дополнительной эффективной терапии. В используемом в данном описании смысле фраза также может относиться к состоянию “не отвечающего/трудноизлечимого” пациента, например, описывает пациентов, которые отвечают на терапию, страдая при этом от побочных эффектов, у которых развивается резистентность, которые не отвечают на терапию, которые неудовлетворительно отвечают на терапию и т.д. В различных вариантах злокачественная опухоль представляет собой рецидивирующий опухолевый рост или рецидивирующий рост злокачественных клеток, когда количество злокачественных клеток существенно не уменьшилось или увеличилось, или размер опухоли существенно не уменьшился или увеличился, или не удалось какое-либо дальнейшее уменьшение размера или количества злокачественных клеток. Определение того, представляют ли собой злокачественные клетки результат рецидивирующего опухолевого роста или рецидивирующего роста злокачественных клеток, можно осуществить либо in vivo, либо in vitro любым способом, известным в данной области для анализа эффективности обработки злокачественных клеток, используя в таком контексте принятые в данной области значения терминов “рецидивирующий” или “рефрактерный” или “не отвечающий”.
Изобретение относится к способам блокирования или снижения рецидивирующего опухолевого роста или рецидивирующего роста злокачественных клеток у субъекта посредством введения одного или нескольких антагонистов ANGPTL4 согласно изобретению, чтобы блокировать или уменьшить рецидивирующий опухолевый рост или рецидивирующий рост злокачественных клеток у субъекта. В некоторых вариантах антагонист ANGPTL4 можно вводить после терапевтического средства против злокачественной опухоли. В некоторых вариантах ANGPTL4 вводят одновременно с противоопухолевой терапией. Альтернативно или дополнительно терапию антагонистом ANGPTL4 чередуют с другой противоопухолевой терапией, которые можно осуществлять в любом порядке. Изобретение также охватывает способы введения одного или нескольких ингибирующих ANGPTL4 антител, чтобы предотвратить появление или рецидив злокачественной опухоли у пациентов, предрасположенных к наличию злокачественной опухоли. В общем, субъект подвергался или одновременно подвергается терапии, направленной против злокачественной опухоли. В одном варианте терапия злокачественной опухоли представляет собой лечение средством против ангиогенеза. Средства против ангиогенеза включают средства, известные в данной области, и средства, указанные в данном описании в разделе “Определения”. В одном варианте средством против ангиогенеза является нейтрализующее анти-VEGF-антитело или фрагмент (например, гуманизированное антитело A4.6.1, AVASTIN® (Genentech, South San Francisco, CA), Y0317, M4, G6, B20, 2C3 и т.д.). См., например, патенты США 6582959, 6884879, 6703020, WO 98/45332, WO 96/30046, WO 94/10202, EP 0666868B1, заявки на выдачу патентов США 2003/0206899, 2003/0190317, 2003/0203409 и 2005/0112126; Popkov et al., Journal of Immunological Methods 288: 149-164 (2004) и документ под номером в реестре поверенного PR2072-4. Могут быть введены дополнительные средства в комбинации с антагонистами ANGPTL4 для блокирования или уменьшения рецидивирующего опухолевого роста или рецидивирующего роста злокачественных клеток, например, см. раздел, озаглавленный “Комбинированная терапия”, в данном описании.
В одном варианте антагонисты ANGPTL4 согласно изобретению или другие терапевтические средства, которые уменьшают экспрессию ANGPTL4, вводят для того, чтобы снять резистентность или пониженную чувствительность злокачественных клеток к некоторым биологическим, гормональным, лучевым и химиотерапевтическим средствам, таким образом повторно сенсибилизируя злокачественные клетки к одному или нескольким из указанных средств, которые затем можно вводить (или продолжать вводить) для лечения или борьбы со злокачественной опухолью, включая предотвращение метастазов.
Антитела
Антитела согласно изобретению включают анти-ANGPTL4-антитела и антитела против фрагментов ANGPTL4, антитела, которые являются антиангиогенными средствами или ингибиторами ангиогенеза, антитела, которые являются противоопухолевыми средствами, антитела к рецептору ANGPTL4, например анти- V V 5-антитела или другие антитела, описанные в данной публикации. Примеры антител включают, например, поликлональные, моноклональное, гуманизированные антитела, фрагменты антител, полиспецифичные, гетероконъюгированные, поливалентные, обладающие эффекторной функцией и т.д. антитела. 5-антитела или другие антитела, описанные в данной публикации. Примеры антител включают, например, поликлональные, моноклональное, гуманизированные антитела, фрагменты антител, полиспецифичные, гетероконъюгированные, поливалентные, обладающие эффекторной функцией и т.д. антитела.
Поликлональные антитела
К антителам согласно изобретению могут относиться поликлональные антитела. Способы получения поликлональных антител известны специалисту в данной области. Например, поликлональные антитела против антитела согласно изобретению вырабатываются у животных при одной или нескольких подкожных (п/к) или внутрибрюшинных (в/б) инъекциях соответствующего антигена и адъюванта. Может быть полезным конъюгирование соответствующего антигена с белком, который является иммуногенным для иммунизируемого вида, например с гемоцианином лимфы улитки, сывороточным альбумином, бычьим тиреоглобулином или ингибитором трипсина сои, с использованием бифункционального или дериватизирующего агента, например сложного эфира малеимидобензоилсульфосукцинимида (конъюгирование через остатки цистеина), N-гидроксисукцинимида (через остатки лизина), глутаральдегида, янтарного ангидрида, SOCl2 или R1N=C=NR, где R и R1 означают разные алкильные группы.
Животных иммунизируют против вещества согласно изобретению в виде иммуногенных конъюгатов или производных, комбинируя, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда и инъецируя раствор внутрикожно в нескольких местах. Спустя месяц животных подвергают бустер-иммунизации, используя от 1/5 до 1/10 исходного количества пептида или конъюгата в полном адъюванте Фрейнда посредством подкожной инъекции в нескольких местах. Через 7-14 дней у животных берут кровь и анализируют сыворотку в отношении титра антител. Животных подвергают бустер-иммунизации вплоть до выхода титра на плато. Обычно животное подвергают бустер-иммунизации конъюгатом того же самого антигена, но конъюгированного с другим белком, и/или с помощью другого поперечно сшивающего реагента. Конъюгаты также могут быть получены в культуре рекомбинантных клеток в виде слияний белков. Также соответствующим образом используют агрегирующие агенты, такие как квасцы, для усиления иммунного ответа.
Моноклональные антитела
Моноклональные антитела могут быть получены с использованием способа на основе гибридом, впервые описанного Kohler et al., Nature, 256: 495 (1975), или могут быть получены способами на основе рекомбинантной ДНК (патент США  4816567). 4816567).
В способе на основе гибридом мышь или другое подходящее животное-хозяин, такое как хомячок или макака, иммунизируют, как описано выше, чтобы вызвать появление лимфоцитов, которые продуцируют или способны продуцировать антитела, которые будут специфично связываться с белком, используемым для иммунизации. Альтернативно лимфоциты можно иммунизировать in vitro. Затем лимфоциты сливают с клетками миеломы, используя подходящий агент для слияния, такой как полиэтиленгликоль, чтобы образовать гибридомную клетку (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Полученные таким образом клетки гибридомы высевают и выращивают в подходящей культуральной среде, которая обычно содержит одно или несколько веществ, которые ингибируют рост или жизнеспособность неслитых исходных клеток миеломы. Например, если в исходных клетках миеломы отсутствует фермент гипоксантингуанинфосфорибозилтрансфераза (HGPRT или HPRT), то в культуральную среду для гибридом обычно будут включать гипоксантин, аминоптерин и тимидин (среда HAT), и такие вещества предотвращают рост HGPRT-дефицитных клеток.
Обычные клетки миеломы представляют собой клетки, которые эффективно сливаются, поддерживают на стабильно высоком уровне продукцию антител отобранными продуцирующими антитела клетками и чувствительны к такой среде, как среда HAT. Среди них предпочтительными линиями клеток миеломы являются линии клеток миеломы мышей, такие как линии, полученные из опухолей мышей MOPC-21 и MPC-11, доступные из Salk Institute Cell Distribution Center, San Diego, California USA, и клетки SP-2 или X63-Ag8-653, доступные из Американской коллекции типов культур, Rockville, Maryland USA. Линии клеток миеломы человека и гетеромиеломы мыши-человека также были описаны для получения моноклональных антител человека (Kozbor, J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой выращивают клетки гибридомы, анализируют в отношении продукции моноклональных антител, направленных, например, против ANGPTL4,  V V 5 или ангиогенной молекулы. Специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, можно определить с помощью иммунопреципитации или анализом связывания in vitro, таким как радиоиммуноанализ (РИА) или твердофазный иммуноферментный анализ (ELISA). Такие способы и анализы известны в данной области. Аффинность связывания моноклонального антитела, например, можно определить анализом по Скэтчарду, как описано в Munson and Pollard, Anal. Biochem., 107: 220 (1980). 5 или ангиогенной молекулы. Специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, можно определить с помощью иммунопреципитации или анализом связывания in vitro, таким как радиоиммуноанализ (РИА) или твердофазный иммуноферментный анализ (ELISA). Такие способы и анализы известны в данной области. Аффинность связывания моноклонального антитела, например, можно определить анализом по Скэтчарду, как описано в Munson and Pollard, Anal. Biochem., 107: 220 (1980).
После того как идентифицировано, что клетки гибридомы продуцируют антитела требуемой специфичности, аффинности и/или активности, клоны могут быть субклонированы способами лимитирующего разведения и выращены стандартными способами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Подходящие культуральные среды для указанной цели включают, например, среду D-MEM или RPMI-1640. Кроме того, клетки гибридомы могут быть выращены in vivo в виде асцитных опухолей у животного.
Моноклональные антитела, секретируемые подклонами, соответствующим образом отделяют от культуральной среды, асцитной жидкости или сыворотки обычными способами очистки иммуноглобулинов, такими как, например, хроматография с использованием белка A-сефарозы, гидроксилапатита, гель-электрофорез, диализ или аффинная хроматография.
Моноклональные антитела также могут быть получены способами на основе рекомбинантной ДНК, такими как способы, описанные в патенте США  4816567. ДНК, кодирующую моноклональные антитела, легко выделяют и секвенируют, используя обычные способы (например, используя олигонуклеотидные зонды, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи моноклональных антител). Клетки гибридомы служат в качестве источника такой ДНК. После выделения ДНК может быть помещена в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E.coli, клетки COS обезьян, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые в ином случае не продуцируют белок иммуноглобулина, чтобы получить синтез моноклональных антител в рекомбинантных клетках-хозяевах. Рекомбинантная продукция антител будет более подробно описана ниже. 4816567. ДНК, кодирующую моноклональные антитела, легко выделяют и секвенируют, используя обычные способы (например, используя олигонуклеотидные зонды, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи моноклональных антител). Клетки гибридомы служат в качестве источника такой ДНК. После выделения ДНК может быть помещена в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E.coli, клетки COS обезьян, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые в ином случае не продуцируют белок иммуноглобулина, чтобы получить синтез моноклональных антител в рекомбинантных клетках-хозяевах. Рекомбинантная продукция антител будет более подробно описана ниже.
В другом варианте антитела или фрагменты антител могут быть выделены из фаговых библиотек антител, созданных с использованием способа, описанного в McCafferty et al., Nature, 348: 552-554 (1990). В Clackson et al., Nature, 352: 624-628 (1991) и Marks et al., J. Mol. Biol., 222: 581-597 (1991) описано выделение мышиных и человеческих антител, соответственно, с использованием фаговых библиотек. В последующих публикациях описано получение высокоаффинных (нМ-диапазон) антител человека с помощью перетасовки цепей (Marks et al., Bio/Technology, 10: 779-783 (1992)), а также комбинаторной инфекции и рекомбинации in vivo в качестве методики конструирования очень больших фаговых библиотек (Waterhouse et al., Nuc. Acids. Res., 21: 2265-2266 (1993)). Таким образом, указанные способы являются приемлемой альтернативой традиционным способам на основе продуцирующих моноклональные антитела гибридом для выделения моноклональных антител.
ДНК также может быть модифицирована, например, подстановкой кодирующей последовательности константных доменов тяжелой и легкой цепей человека вместо гомологичных мышиных последовательностей (патент США  4816567; Morrison, et al., Proc. Natl. Acad. Sci. USA, 81: 6851 (1984)) или ковалентным связыванием с кодирующей иммуноглобулин последовательностью всей или части последовательности, кодирующей неиммуноглобулиновый полипептид. 4816567; Morrison, et al., Proc. Natl. Acad. Sci. USA, 81: 6851 (1984)) или ковалентным связыванием с кодирующей иммуноглобулин последовательностью всей или части последовательности, кодирующей неиммуноглобулиновый полипептид.
Обычно такими неиммуноглобулиновыми полипептидами заменяют константные домены антитела или ими заменяют вариабельные домены одного антигенсвязывающего участка антитела, чтобы создать химерное бивалентное антитело, содержащее один антигенсвязывающий участок, имеющий специфичность по отношению к антигену, и другой антигенсвязывающий участок, имеющий специфичность по отношению к другому антигену.
Гуманизированные и человеческие антитела
Антитела согласно изобретению могут включать гуманизированные антитела или человеческие антитела. Гуманизированное антитело имеет один или несколько аминокислотных остатков, введенных в него из источника, который отличен от человека. Указанные аминокислотные остатки животного, отличного от человека, часто называют “импортируемыми” остатками, которые обычно берут из “импортируемого” вариабельного домена. Гуманизацию можно, по существу, выполнить, следуя способу Винтера и соавторов (Jones et al., Nature, 321: 522-525 (1986); Riechmann et al., Nature, 332: 323-327 (1988); Verhoeyen et al., Science, 239: 1534-1536 (1988)), заменой CDR или последовательностями CDR грызунов соответствующих последовательностей антитела человека. Соответственно, такие “гуманизированные” антитела являются химерными антителами (патент США  4816567), в которых значительно меньшая часть, чем интактный вариабельный домен человека, была заменена соответствующей последовательностью вида, отличного от человека. На практике гуманизированные антитела обычно представляют собой антитела человека, в которых некоторые остатки CDR и, возможно, некоторые остатки FR заменены остатками из аналогичных участков антител грызунов. 4816567), в которых значительно меньшая часть, чем интактный вариабельный домен человека, была заменена соответствующей последовательностью вида, отличного от человека. На практике гуманизированные антитела обычно представляют собой антитела человека, в которых некоторые остатки CDR и, возможно, некоторые остатки FR заменены остатками из аналогичных участков антител грызунов.
Выбор вариабельных доменов человека как легкой, так и тяжелой цепи, используемых для получения гуманизированных антител, очень важен для снижения антигенности. Согласно так называемому способу “оптимальной подгонки” последовательность вариабельного домена антитела грызуна подвергают скринингу по сравнению с полной библиотекой известных последовательностей вариабельных доменов человека. Последовательность человека, которая наиболее близка последовательности грызуна, затем берут в качестве каркаса (FR) человека для гуманизированного антитела (Sims et al., J. Immunol., 151: 2296 (1993); Chothia et al., J. Mol. Biol., 196: 901 (1987)). В другом способе используют конкретный каркас, полученный из консенсусной последовательности всех антител человека конкретной подгруппы легких или тяжелых цепей. Один и тот же каркас можно использовать для нескольких разных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89: 4285 (1992); Presta et al., J. Immunol., 151: 2623 (1993)).
Кроме того, важно, чтобы антитела были гуманизированы с сохранением высокой аффинности по отношению к антигену и других благоприятных биологических свойств. Для достижения указанной цели согласно обычному способу гуманизированные антитела получают, проводя анализ исходных последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов общедоступны и известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и показывают возможные трехмерные конформационные структуры выбранных для исследования последовательностей иммуноглобулина. Исследование таких изображений позволяет проанализировать вероятную роль остатков в функционировании выбранной для исследования последовательности иммуноглобулина, т.е. анализировать остатки, которые влияют на способность выбранного для исследования иммуноглобулина связывать соответствующий ему антиген. Таким образом могут быть выбраны и объединены остатки FR из реципиентных и импортируемых последовательностей так, чтобы достичь требуемых характеристик антитела, таких как повышенная аффинность по отношению к антигену-мишени. В общем, остатки CDR непосредственно и в наибольшей степени влияют на связывание антигена.
Альтернативно в настоящее время можно получать трансгенных животных (например, мышей), которые способны после иммунизации продуцировать полный репертуар антител человека в отсутствие продукции эндогенных иммуноглобулинов. Например, описано, что гомозиготная делеция гена соединяющей области тяжелой цепи (JH) антитела у химерных и мутантных по зародышевой линии мышей приводит к полному ингибированию продукции эндогенных антител. Перенос ряда генов иммуноглобулина зародышевой линии человека в таких мутантных по зародышевой линии мышей будет приводить к продукции антител человека при антигенной стимуляции. См., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90: 2551 (1993); Jakobovits et al., Nature, 362: 255-258 (1993); Bruggermann et al., Year in Immuno., 7: 33 (1993); и Duchosal et al. Nature 355: 258 (1992). Антитела человека также могут быть получены из библиотек в фаговом дисплее (Hoogenboom et al., J. Mol. Biol., 227: 381 (1991); Marks et al., J. Mol. Biol., 222: 581-597 (1991); Vaughan et al. Nature Biotech 14: 309 (1996)).
Антитела человека также могут быть получены с использованием различных способов, известных в данной области, включая библиотеки в фаговом дисплее (Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222: 581 (1991)). Согласно указанному способу гены V-доменов антител клонируют в рамке с геном либо основного, либо минорного белка оболочки нитчатого бактериофага, такого как M13 или fd, и выводят в виде функциональных фрагментов антител на поверхность фаговой частицы. Поскольку нитчатая частица содержит однонитевую копию ДНК фагового генома, то селекция на основе функциональных свойств антитела также приводит к селекции гена, кодирующего антитело, проявляющее такие свойства. Таким образом, фаг имитирует некоторые свойства B-клетки. Фаговый дисплей может быть выполнен в разных формах, обзор которых приведен, например, в Johnson, K. S. and Chiswell, D J., Cur. Opin. in Struct. Biol. 3: 564-571 (1993). Для фагового дисплея можно использовать несколько источников участков V-генов. Например, Clackson et al., Nature, 352: 624-628 (1991) выделили ряд разнообразных антител против оксазолона из небольшой случайной комбинаторной библиотеки V-генов, полученной из селезенок иммунизированных мышей. Можно сконструировать репертуар V-генов неиммунизированных людей-доноров и можно выделить антитела к ряду разнообразных антигенов (включая аутоантигены), по существу следуя, например, способу, описанному Marks et al., J. Mol. Biol. 222: 581-597 (1991) или Griffith et al., EMBO J. 12: 725-734 (1993). См. также патенты США  5565332 и 5573905. Способы Cole et al. и Boerner et al. также доступны для получения человеческих моноклональных антител (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77 (1985) и Boerner et al., J. Immunol., 147(1): 86-95 (1991)). Антитела человека также могут быть образованы активированными in vitro B-клетками (см. патенты США 5567610 и 5229275). 5565332 и 5573905. Способы Cole et al. и Boerner et al. также доступны для получения человеческих моноклональных антител (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77 (1985) и Boerner et al., J. Immunol., 147(1): 86-95 (1991)). Антитела человека также могут быть образованы активированными in vitro B-клетками (см. патенты США 5567610 и 5229275).
Фрагменты антител
Фрагменты антител также включены в объем изобретения. Разработаны различные способы получения фрагментов антител. Традиционно такие фрагменты получали в результате протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24: 107-117 (1992) и Brennan et al., Science, 229: 81 (1985)). Однако в настоящее время такие фрагменты могут непосредственно продуцироваться рекомбинантными клетками-хозяевами. Например, фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых выше. Альтернативно Fab’-SH-фрагменты могут быть непосредственно извлечены из клеток E.coli и химически связаны с образованием F(ab’)2-фрагментов (Carter et al., Bio/Technology 10: 163-167 (1992)). Согласно другому способу F(ab’)2-фрагменты могут быть выделены непосредственно из культуры рекомбинантных клеток-хозяев. Другие способы получения фрагментов антител будут известны специалистам в данной области. В других вариантах предпочтительное антитело представляет собой одноцепочечный Fv-фрагмент (scFv). См. WO 93/16185, патент США  5571894 и патент США 5571894 и патент США  5587458. Fv и sFv являются единственными видами с интактными связывающими участками, которые лишены константных областей; таким образом, они являются подходящими с точки зрения пониженного неспецифичного связывания в ходе применения in vivo. Могут быть сконструированы слитые белки SFv, чтобы получить слияние эффекторного белка либо с амино-, либо с карбоксильным концом sFv. См. Antibody Engineering, ed. Borrebaeck, выше. Фрагмент антитела также может представлять собой “линейное антитело”, например, такое, как описано в патенте США 5641870. Такие линейные фрагменты антител могут быть моноспецифичными или биспецифичными. 5587458. Fv и sFv являются единственными видами с интактными связывающими участками, которые лишены константных областей; таким образом, они являются подходящими с точки зрения пониженного неспецифичного связывания в ходе применения in vivo. Могут быть сконструированы слитые белки SFv, чтобы получить слияние эффекторного белка либо с амино-, либо с карбоксильным концом sFv. См. Antibody Engineering, ed. Borrebaeck, выше. Фрагмент антитела также может представлять собой “линейное антитело”, например, такое, как описано в патенте США 5641870. Такие линейные фрагменты антител могут быть моноспецифичными или биспецифичными.
Полиспецифичные антитела (например, биспецифичные)
Антитела согласно изобретению также включают, например, полиспецифичные антитела, которые обладают специфичностями связывания, по меньшей мере, по отношению к двум разным антигенам. Несмотря на то что такие молекулы, как правило, будут связывать только два антигена (т.е. биспецифичные антитела, BsAb), антитела с дополнительными специфичностями, такие как триспецифичные антитела, входят в указанное выражение при его использовании в данном описании. Примеры BsAb включают антитела с одним плечом, направленным против клеточного антигена, и другим плечом, направленным против запускающей цитотоксической молекулы, такие как анти-Fc RI/анти-CD15, анти-p185HER2/Fc RI/анти-CD15, анти-p185HER2/Fc RIII (CD16), анти-CD3/антитело против злокачественной B-клетки (1D10), анти-CD3/анти-p185HER2, анти-CD3/анти-p97, анти-CD3/антитело против почечно-клеточной карциномы, анти-CD3/анти-OVCAR-3, анти-CD3/L-D1 (антитело против карциномы ободочной кишки), анти-CD3/антитело против аналога меланоцитостимулирующего гормона, антитело против рецептора EGF/анти-CD3, анти-CD3/анти-CAMA1, анти-CD3/анти-CD19, анти-CD3/MoV18, антитело против молекулы адгезии нервных клеток (NCAM)/анти-CD3, антитело против связывающего фолат белка (FBP)/анти-CD3, антитело против пан-антигена, связанного с карциномой (AMOC-31)/анти-CD3; BsAb с одним плечом, которое специфично связывается с опухолевым антигеном на клетке, и одним плечом, которое связывается с токсином, такие как антисапорин/анти-Id-1, анти-CD22/антисапорин, анти-CD7/антисапорин, анти-CD38/антисапорин, анти-CEA/антитело против цепи A рицина, антиинтерферон- RIII (CD16), анти-CD3/антитело против злокачественной B-клетки (1D10), анти-CD3/анти-p185HER2, анти-CD3/анти-p97, анти-CD3/антитело против почечно-клеточной карциномы, анти-CD3/анти-OVCAR-3, анти-CD3/L-D1 (антитело против карциномы ободочной кишки), анти-CD3/антитело против аналога меланоцитостимулирующего гормона, антитело против рецептора EGF/анти-CD3, анти-CD3/анти-CAMA1, анти-CD3/анти-CD19, анти-CD3/MoV18, антитело против молекулы адгезии нервных клеток (NCAM)/анти-CD3, антитело против связывающего фолат белка (FBP)/анти-CD3, антитело против пан-антигена, связанного с карциномой (AMOC-31)/анти-CD3; BsAb с одним плечом, которое специфично связывается с опухолевым антигеном на клетке, и одним плечом, которое связывается с токсином, такие как антисапорин/анти-Id-1, анти-CD22/антисапорин, анти-CD7/антисапорин, анти-CD38/антисапорин, анти-CEA/антитело против цепи A рицина, антиинтерферон- (IFN- (IFN- )/антигибридомный идиотип, анти-CEA/антитело против алкалоида барвинка; BsAb, относящиеся к превращению активируемых ферментами пролекарств, такие как анти-CD30/антищелочная фосфатаза (которая катализирует превращение пролекарства фосфата митомицина в спирт митомицина); BsAb, которые могут быть использованы в качестве фибринолитических средств, такие как антифибрин/антитело против тканевого активатора плазминогена (tPA), антифибрин/антитело против активатора плазминогена урокиназного типа (uPA); BsAb для направления иммунных комплексов к рецепторам клеточной поверхности, такие как антитело против липопротеинов низкой плотности (LDL)/анти-Fc-рецептор (например, Fc )/антигибридомный идиотип, анти-CEA/антитело против алкалоида барвинка; BsAb, относящиеся к превращению активируемых ферментами пролекарств, такие как анти-CD30/антищелочная фосфатаза (которая катализирует превращение пролекарства фосфата митомицина в спирт митомицина); BsAb, которые могут быть использованы в качестве фибринолитических средств, такие как антифибрин/антитело против тканевого активатора плазминогена (tPA), антифибрин/антитело против активатора плазминогена урокиназного типа (uPA); BsAb для направления иммунных комплексов к рецепторам клеточной поверхности, такие как антитело против липопротеинов низкой плотности (LDL)/анти-Fc-рецептор (например, Fc RI, Fc RI, Fc RII или Fc RII или Fc RIII); BsAb для применения в терапии инфекционных заболеваний, такие как анти-CD3/антитело против простого вируса герпеса (HSV), антитело против комплекса T-клеточный рецептор:CD3/антитело против вируса гриппа, анти-Fc RIII); BsAb для применения в терапии инфекционных заболеваний, такие как анти-CD3/антитело против простого вируса герпеса (HSV), антитело против комплекса T-клеточный рецептор:CD3/антитело против вируса гриппа, анти-Fc R/анти-ВИЧ; BsAb для выявления опухолей in vitro или in vivo, такие как анти-CEA/анти-EOTUBE, анти-CEA/анти-DPTA, анти-p185HER2/антигаптен; BsAb в качестве адъювантов вакцин; и BsAb в качестве диагностических средств, такие как антитело против IgG кролика/антиферритин, антитело против пероксидазы хрена (HRP)/антигормон, антисоматостатин/антитело против вещества P, анти-HRP/анти-FITC, анти-CEA/анти- R/анти-ВИЧ; BsAb для выявления опухолей in vitro или in vivo, такие как анти-CEA/анти-EOTUBE, анти-CEA/анти-DPTA, анти-p185HER2/антигаптен; BsAb в качестве адъювантов вакцин; и BsAb в качестве диагностических средств, такие как антитело против IgG кролика/антиферритин, антитело против пероксидазы хрена (HRP)/антигормон, антисоматостатин/антитело против вещества P, анти-HRP/анти-FITC, анти-CEA/анти- -галактозидаза. Примеры триспецифичных антител включают анти-CD3/анти-CD4/анти-CD37, анти-CD3/анти-CD5/анти-CD37 и анти-CD3/анти-CD8/анти-CD37. Биспецифичные антитела могут быть получены в виде полноразмерных антител или фрагментов антител (например, биспецифичные F(ab’)2-антитела). -галактозидаза. Примеры триспецифичных антител включают анти-CD3/анти-CD4/анти-CD37, анти-CD3/анти-CD5/анти-CD37 и анти-CD3/анти-CD8/анти-CD37. Биспецифичные антитела могут быть получены в виде полноразмерных антител или фрагментов антител (например, биспецифичные F(ab’)2-антитела).
Способы получения биспецифичных антител известны в данной области. Традиционное получение полноразмерных биспецифичных антител основано на коэкспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулина, при этом две цепи имеют разные специфичности (Millstein et al., Nature, 305: 537-539 (1983)). Вследствие случайного выбора тяжелых и легких цепей иммуноглобулина такие гибридомы (квадромы) продуцируют возможную смесь 10 разных молекул антител, из которых только одна имеет правильную биспецифичную структуру. Очистка правильной молекулы, которую обычно осуществляют, используя стадии аффинной хроматографии, является довольно громоздкой, а выходы продукта низкими. Сходные способы описаны в WO 93/08829 и в Traunecker et al., EMBO J., 10: 3655-3659 (1991).
Согласно другому способу вариабельные домены антител с требуемыми специфичностями связывания (участки связывания антитело-антиген) сливают с последовательностями константных доменов иммуноглобулина. Слияние предпочтительно осуществляют с константным доменом тяжелой цепи иммуноглобулина, содержащим, по меньшей мере, часть шарнирной области, областей CH2 и CH3. Предпочтительно иметь первую константную область тяжелой цепи (CH1), содержащую сайт, необходимый для связывания легкой цепи, присутствующий, по меньшей мере, в одном из слияний. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и, в случае необходимости, легкой цепи иммуноглобулина, встраивают в отдельные экспрессирующие векторы и котрансфицируют в подходящий организм-хозяин. Это дает большую гибкость при корректировке взаимных соотношений трех полипептидных фрагментов в таких вариантах, когда неравные соотношения трех полипептидных цепей, используемых в конструкции, дают оптимальные выходы. Однако можно встраивать кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессирующий вектор в том случае, когда экспрессия, по меньшей мере, двух полипептидных цепей в равных соотношениях дает высокие выходы или когда соотношения не имеют особого значения.
В одном варианте указанного способа биспецифичные антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания в одном плече и гибридной пары тяжелой цепи-легкой цепи иммуноглобулина (обеспечивающей вторую специфичность связывания) в другом плече. Обнаружено, что такая асимметричная структура облегчает отделение требуемого биспецифичного соединения от нежелательных комбинаций цепей иммуноглобулина, так как наличие легкой цепи иммуноглобулина только в одной половине биспецифичных молекул обеспечивает простой способ разделения. Такой способ описан в WO 94/04690. Более подробное описание создания биспецифичных антител см., например, в Suresh et al., Methods in Enzymology, 121: 210 (1986).
Согласно другому способу, описанному в WО 96/27011, область контакта между парой молекул антител может быть сконструирована так, чтобы максимизировать процент гетеродимеров, которые извлекают из культуры рекомбинантных клеток. Предпочтительная область контакта содержит, по меньшей мере, часть домена CH3 константного домена антитела. В указанном способе одну или несколько небольших боковых цепей аминокислот из области контакта первой молекулы антитела заменяют более крупными боковыми цепями (например, тирозин или триптофан). Создают компенсирующие “впадины”, имеющие размер, идентичный или сходный с размером большой боковой цепи(цепей), на области контакта второй молекулы антитела, заменяя большие боковые цепи аминокислот меньшими боковыми цепями (например, аланин или треонин). Это обеспечивает механизм увеличения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Способы создания биспецифичных антител из фрагментов антител также описаны в литературе. Например, биспецифичные антитела могут быть получены с использованием химического связывания. В Brennan et al., Science, 229: 81 (1985) описан способ, при котором интактные антитела протеолитически расщепляют, чтобы создать F(ab’)2-фрагменты. Полученные фрагменты восстанавливают в присутствии агента, образующего комплексы дитиола, арсенита натрия, чтобы стабилизировать соседние дитиолы и предотвратить образование межмолекулярного дисульфида. Затем созданные Fab’-фрагменты превращают в производные тионитробензоата (TNB). Один из Fab’-TNB-производных затем снова превращают в Fab’-тиол восстановлением с использованием меркаптоэтиламина и смешивают с эквимолярным количеством другого Fab’-TNB-производного с образованием биспецифичного антитела. Полученные биспецифичные антитела можно использовать в качестве агентов для избирательной иммобилизации ферментов.
Недавние достижения облегчили прямое извлечение Fab’-SH-фрагментов из E.coli, которые могут быть химически связаны с образованием биспецифичных антител. В Shalaby et al., J. Exp.Med., 175: 217-225 (1992) описано получение полностью гуманизированной молекулы биспецифичного антитела на основе F(ab’)2. Каждый Fab’-фрагмент отдельно секретировался из клеток E.coli, и его подвергали химическому связыванию in vitro с образованием биспецифичного антитела. Образованное таким образом биспецифичное антитело способно связываться с клетками, сверхэкспрессирующими рецептор VEGF, и нормальными T-клетками человека, а также запускать литическую активность цитотоксических лимфоцитов человека против опухолевых мишеней молочной железы человека.
Также описаны различные способы получения и выделения фрагментов биспецифичных антител непосредственно из культуры рекомбинантных клеток. Например, были получены биспецифичные антитела с использованием лейциновых молний. Kostelny et al., J. Immunol., 148 (5): 1547-1553 (1992). Пептиды лейциновой молнии из белков Fos и Jun связывали с Fab’-частями двух разных антител посредством слияния генов. Гомодимеры антител восстанавливали в шарнирной области, чтобы образовать мономеры, и затем снова окисляли с образованием гетеродимеров антител. Такой способ также можно использовать для получения гомодимеров антител. Способ “диантител”, описанный Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993), дал альтернативный механизм получения фрагментов биспецифичных антител. Фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) линкером, который слишком короткий, чтобы обеспечить возможность спаривания между двумя доменами на одной и той же цепи. Соответственно, домены VH и VL одного фрагмента вынуждены спариваться с комплементарными доменами VL и VH другого фрагмента, образуя при этом два антигенсвязывающих участка. Также сообщалось о другой методике получения фрагментов биспецифичных антител с использованием димеров одноцепочечного Fv (sFv). См. Gruber et al., J. Immunol., 152: 5368 (1994).
Предполагаются антитела с более чем двумя валентностями. Например, могут быть получены триспецифичные антитела. Tutt et al. J. Immunol. 147: 60 (1991).
Гетероконъюгаты антител
Биспецифичные антитела включают поперечно сшитые или “гетероконъюгированные” антитела, которые являются антителами согласно изобретению. Например, одно из антител в гетероконъюгате может быть связано с авидином, а другое с биотином. Такие антитела, например, были предложены для того, чтобы направить клетки иммунной системы к нежелательным клеткам-мишеням (патент США  4676980) и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373 и EP 03089). Гетероконъюгаты антител могут быть получены с использованием любых способов образования поперечных сшивок. Подходящие поперечно сшивающие агенты хорошо известны в данной области и описаны в патенте США 4676980) и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373 и EP 03089). Гетероконъюгаты антител могут быть получены с использованием любых способов образования поперечных сшивок. Подходящие поперечно сшивающие агенты хорошо известны в данной области и описаны в патенте США  4676980 вместе с рядом способов образования поперечных сшивок. 4676980 вместе с рядом способов образования поперечных сшивок.
Поливалентные антитела
Антитела согласно изобретению включают поливалентное антитело. Поливалентное антитело может быть быстрее интернализовано (и/или подвергнуто катаболизму) клеткой, экспрессирующей антиген, с которым связываются антитела, чем бивалентное антитело. Антитела согласно изобретению могут представлять собой поливалентные антитела (которые не относятся к классу IgM) с тремя или более антигенсвязывающими участками (т.е. тетравалентные антитела), которые могут быть легко получены посредством рекомбинантной экспрессии нуклеиновой кислоты, кодирующей полипептидные цепи антитела. Поливалентное антитело может содержать домен димеризации и три или более антигенсвязывающих участка. Предпочтительный домен димеризации содержит (или состоит из) Fc-области или шарнирной области. По такому плану антитело будет содержать Fc-область и три или более антигенсвязывающих участка, аминоконцевых по отношению к Fc-области. Предпочтительное поливалентное антитело согласно изобретению содержит (или состоит из) от трех до примерно восьми, но предпочтительно четыре антигенсвязывающих участка. Поливалентное антитело содержит, по меньшей мере, одну полипептидную цепь (и предпочтительно две полипептидных цепи), при этом полипептидная цепь(и) содержит два или более вариабельных домена. Например, полипептидная цепь(и) может содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 означает первый вариабельный домен, VD2 означает второй вариабельный домен, Fc означает одну полипептидную цепь Fc-области, X1 и X2 означают аминокислоту или полипептид, и n равно 0 или 1. Например, полипептидная цепь(и) может содержать цепь VH-CH1-гибкий линкер-VH-CH1-Fc-область или цепь VH-CH1-VH-CH1-Fc-область. Поливалентное антитело согласно изобретению предпочтительно дополнительно содержит, по меньшей мере, два (и предпочтительно четыре) полипептида вариабельного домена легкой цепи. Поливалентное антитело согласно изобретению может, например, содержать от примерно двух до примерно восьми полипептидов вариабельного домена легкой цепи. Полипептиды вариабельного домена легкой цепи, предусмотренные в настоящем изобретении, содержат вариабельный домен легкой цепи и необязательно дополнительно содержат домен CL.
Конструирование эффекторных функций
Может быть желательной модификация антитела согласно изобретению в отношении эффекторной функции так, чтобы, например, повысить эффективность антитела для лечения злокачественной опухоли. Например, остаток(ки) цистеина могут быть введены в Fc-область, таким образом обеспечивая возможность образования межцепочечного дисульфида в данной области. Созданное таким образом гомодимерное антитело может иметь улучшенную способность к интернализации и/или повышенному опосредованному комплементом цитолизу клеток и антителозависимой клеточной цитотоксичности (ADCC). См. Caron et al., J. Exp. Med. 176: 1191-1195 (1992) и Shopes, B. J. Immunol. 148: 2918-2922 (1992). Гомодимерные антитела с повышенной противоопухолевой активностью также могут быть получены с использованием гетеробифункциональных поперечно сшивающих агентов, которые описаны в Wolff et al. Cancer Research 53: 2560-2565 (1993). Альтернативно может быть сконструировано антитело, которое имеет двойные Fc-области и в связи с этим обладает повышенной способностью к зависимому от комплемента лизису и ADCC. См. Stevenson et al. Anti-Cancer Drug Design 3: 219-230 (1989). Чтобы увеличить время полужизни, антитела в сыворотке можно включить в антитело (в частности, во фрагмент антитела) эпитоп связывания рецептора спасения, как описано, например, в патенте США 5739277. В используемом в данном описании смысле термин “эпитоп связывания рецептора спасения” относится к эпитопу Fc-области молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), который ответственен за увеличение времени полужизни молекулы IgG в сыворотке in vivo.
Иммуноконъюгаты
Изобретение также относится к иммуноконъюгатам, содержащим антитело, описанное в данной публикации, конъюгированное с цитотоксическим средством, таким как химиотерапевтическое средство, токсин (например, ферментативно активный токсин, происходящий из клеток бактерий, грибов, растений или животных, или его фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат). Имеется множество радионуклидов для получения радиоконъюгатов антител. Примеры включают, без ограничения, например, 212Bi, 131I, 131In, 90Y и 186Re.
Химиотерапевтические средства, применимые для создания таких иммуноконъюгатов, были описаны выше. Например, BCNU, стрептозоицин, винкристин, 5-фторурацил, семейство агентов, вместе известных как комплекс LL-E33288, описанных в патентах США 5053394, 5770710, эсперамицины (патент США 5877296) и т.д. (см. также определение химиотерапевтических средств в данном описании) могут быть конъюгированы с анти-ANGPTL4-антителами, анти-альфаVбета5-антителами или антителами против ангиогенеза или их фрагментами.
Для избирательного разрушения опухоли антитело может содержать высокорадиоактивный атом. Множество радиоактивных изотопов доступно для получения радиоконъюгированных анти-ANGPTL4-антител или антител против ангиогенеза или их фрагментов. Примеры включают, без ограничения, например, 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P, 212Pb, 111In, радиоактивные изотопы Lu и т.д. В том случае, когда конъюгат используют для диагностики, он может содержать радиоактивный атом для сцинтиографических исследований, например 99mTc или 123I, или спиновую метку для ядерной магнитно-резонансной (ЯМР) визуализации (также известной как магнитно-резонансная визуализация, MRI), такую как йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки могут быть включены в конъюгат известными способами. Например, пептид может быть биологически синтезирован или может быть синтезирован посредством химического синтеза из аминокислот с использованием подходящих предшественников аминокислот, содержащий, например, фтор-19 вместо водорода. Такие метки, как 99mTc или 123I, 186Re, 188Re и 111In, могут быть связаны с пептидом через остаток цистеина. Иттрий-90 может быть связан через остаток лизина. Способ IODOGEN (Fraker et al. Biochem. Biophys. Res. Commun. 80: 49-57 (1978)) можно использовать для включения йода-123. См., например, Monoclonal Antibodies in Immunoscintigraphy (Chatal, CRC Press, 1989), где подробно описаны другие способы.
Ферментативно активные токсины и их фрагменты, которые могут быть использованы, включают цепь A дифтерийного токсина, не связывающиеся активные фрагменты дифтерийного токсина, цепь A экзотоксина (из Pseudomonas aeruginosa), цепь A рицина, цепь A абрина, цепь A модекцина, альфа-сарцин, белки Aleurites fordii, белки диантины, белки Phytolacca americana (PAPI, PAPII и PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, неомицин и трикотецены. См., например, WO 93/21232, опубликованную 28 октября 1993.
Конъюгаты антитела и цитотоксического средства получают, используя множество бифункциональных связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат·HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидосоединения (такие как бис(пара-азидобензоил)гександиамин), производные бис-диазония (такие как бис(пара-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta et al. Science 238: 1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является примером хелатирующего агента для конъюгирования радионуклида с антителом. См. WO 94/11026. Линкер может представлять собой “расщепляемый линкер”, облегчающий высвобождение цитотоксического лекарственного средства в клетке. Например, можно использовать кислотолабильный линкер, чувствительный к пептидазе линкер, фотолабильный линкер, линкер на основе диметила или линкер, содержащий дисульфид (Chari et al., Cancer Research 52: 127-131 (1992); патент США  5208020). 5208020).
Альтернативно можно получить слитый белок, содержащий анти-ANGPTL4-антитело, анти- V V 5-антитело или антитело против ангиогенеза и цитотоксическое средство, например, способами на основе рекомбинации или пептидным синтезом. В длину ДНК могут быть включены соответствующие области, кодирующие две части конъюгата, либо расположенные рядом друг с другом, либо разделенные областью, кодирующей линкерный пептид, который не нарушает требуемые свойства конъюгата. 5-антитело или антитело против ангиогенеза и цитотоксическое средство, например, способами на основе рекомбинации или пептидным синтезом. В длину ДНК могут быть включены соответствующие области, кодирующие две части конъюгата, либо расположенные рядом друг с другом, либо разделенные областью, кодирующей линкерный пептид, который не нарушает требуемые свойства конъюгата.
В некоторых вариантах антитело конъюгируют с “рецептором” (например, стрептавидином) в случае применения для предварительного направления к клетке-мишени, когда конъюгат антитело-рецептор вводят пациенту с последующим удалением несвязанного конъюгата из кровообращения с использованием хелатирующего агента и затем введением “лиганда” (например, авидина), который конъюгируют с цитотоксическим средством (например, радионуклидом). В некоторых вариантах иммуноконъюгат образуют между антителом и соединением с нуклеолитической активностью (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКаза).
Мейтанзин и мейтанзиноиды
Изобретение относится к антителу согласно изобретению, которое конъюгировано с одной или несколькими молекулами мейтанзиноидов. Мейтанзиноиды являются ингибиторами митоза, которые действуют, ингибируя полимеризацию тубулина. Мейтанзин впервые был выделен из восточно-африканского кустарника Maytenus serrata (патент США  3896111). Затем было обнаружено, что некоторые микроорганизмы также продуцируют мейтанзиноиды, такие как мейтанзинол и сложные C-3-мейтанзиноловые эфиры (патент США 3896111). Затем было обнаружено, что некоторые микроорганизмы также продуцируют мейтанзиноиды, такие как мейтанзинол и сложные C-3-мейтанзиноловые эфиры (патент США  4151042). Синтетический мейтанзинол и его производные и аналоги описаны, например, в патентах США 4151042). Синтетический мейтанзинол и его производные и аналоги описаны, например, в патентах США  4137230, 4248870, 4256746, 4260608, 4265814, 4294757, 4307016, 4308268, 4308269, 4309428, 4313946, 4315929, 4317821, 4322348, 4331598, 4361650, 4364866, 4424219, 4450254, 4362663 и 4371533. 4137230, 4248870, 4256746, 4260608, 4265814, 4294757, 4307016, 4308268, 4308269, 4309428, 4313946, 4315929, 4317821, 4322348, 4331598, 4361650, 4364866, 4424219, 4450254, 4362663 и 4371533.
Анти-ANGPTL4-антитело, анти- V V 5-антитело или антитело против ангиогенеза конъюгируют с молекулой мейтанзиноида без существенного снижения биологической активности антитела или молекулы мейтанзиноида. Показано, что в среднем 3-4 молекулы мейтанзиноида, конъюгированных на молекулу антитела, эффективны для усиления цитотоксичности для клеток-мишеней без негативного влияния на функцию или растворимость антитела, хотя можно ожидать, что даже одна молекула токсин/антитело усиливает цитотоксичность по сравнению с применением “голого” антитела. Мейтанзиноиды хорошо известны в данной области и могут быть синтезированы известными способами или выделены из природных источников. Подходящие мейтанзиноиды описаны, например, в патенте США 5-антитело или антитело против ангиогенеза конъюгируют с молекулой мейтанзиноида без существенного снижения биологической активности антитела или молекулы мейтанзиноида. Показано, что в среднем 3-4 молекулы мейтанзиноида, конъюгированных на молекулу антитела, эффективны для усиления цитотоксичности для клеток-мишеней без негативного влияния на функцию или растворимость антитела, хотя можно ожидать, что даже одна молекула токсин/антитело усиливает цитотоксичность по сравнению с применением “голого” антитела. Мейтанзиноиды хорошо известны в данной области и могут быть синтезированы известными способами или выделены из природных источников. Подходящие мейтанзиноиды описаны, например, в патенте США  5208020 и в других патентах и непатентных публикациях, ссылки на которые указаны выше. В одном варианте мейтанзиноиды представляют собой мейтанзинол и аналоги мейтанзинола, модифицированные в ароматическом цикле или в других положениях молекулы мейтанзинола, такие как различные сложные мейтанзиноловые эфиры. 5208020 и в других патентах и непатентных публикациях, ссылки на которые указаны выше. В одном варианте мейтанзиноиды представляют собой мейтанзинол и аналоги мейтанзинола, модифицированные в ароматическом цикле или в других положениях молекулы мейтанзинола, такие как различные сложные мейтанзиноловые эфиры.
Существует много связывающих групп, известных в данной области, для получения конъюгатов антитело-мейтанзиноид, включая, например, группы, описанные в патенте США  5208020 или патенте EP 0425235 B1 и в Chari et al., Cancer Research 52: 127-131 (1992). Связывающие группы включают дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, неустойчивые к действию пептидазы группы или неустойчивые к действию эстеразы группы, которые описаны в указанных выше патентах, при этом предпочтительны дисульфидные и тиоэфирные группы. 5208020 или патенте EP 0425235 B1 и в Chari et al., Cancer Research 52: 127-131 (1992). Связывающие группы включают дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, неустойчивые к действию пептидазы группы или неустойчивые к действию эстеразы группы, которые описаны в указанных выше патентах, при этом предпочтительны дисульфидные и тиоэфирные группы.
Конъюгаты антитела и мейтанзиноида могут быть получены с использованием множества бифункциональных, связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат·HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидосоединения (такие как бис(пара-азидобензоил)гександиамин), производные бис-диазония (такие как бис(пара-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Обычные связывающие агенты включают N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173: 723-737 [1978]) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP) для образования дисульфидной связи.
Линкер может быть связан с молекулой мейтанзиноида в разных положениях, в зависимости от типа связи. Например, сложноэфирная связь может быть образована при взаимодействии с гидроксильной группой с использованием обычных способов связывания. Реакция может осуществляться в положении C-3, имеющем гидроксильную группу, в положении C-14, модифицированном гидроксиметилом, в положении C-15, модифицированном гидроксильной группой, и в положении C-20, имеющем гидроксильную группу. Связь образуется в положении C-3 мейтанзинола или аналога мейтанзинола.
Калихеамицин
Другой представляющий интерес иммуноконъюгат содержит антитело согласно изобретению, конъюгированное с одной или несколькими молекулами калихеамицина. Калихеамициновое семейство антибиотиков способно образовывать двунитевые разрывы ДНК в субпикомолярных концентрациях. Получение конъюгатов семейства калихеамицина см. в патентах США 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все American Cyanamid Company). Структурные аналоги калихеамицина, которые могут быть использованы, включают без ограничения  1 1 I, I,  2 2 I, I,  3 3 I, N-ацетил- I, N-ацетил- 1 1 I, PSAG и I, PSAG и 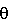 I I 1 (Hinman et al., Cancer Research 53: 3336-3342 (1993), Lode et al., Cancer Research 58: 2925-2928 (1998) и указанные выше патенты США, принадлежащие American Cyanamid). Другим противоопухолевым лекарственным средством, с которым может быть конъюгировано антитело, является QFA, который является антифолатом. Как калихеамицин, так и QFA имеют внутриклеточные места действия и с трудом проходят через плазматическую мембрану. Поэтому поглощение клетками указанных средств посредством опосредованной антителами интернализации значительно усиливает их цитотоксическое действие. 1 (Hinman et al., Cancer Research 53: 3336-3342 (1993), Lode et al., Cancer Research 58: 2925-2928 (1998) и указанные выше патенты США, принадлежащие American Cyanamid). Другим противоопухолевым лекарственным средством, с которым может быть конъюгировано антитело, является QFA, который является антифолатом. Как калихеамицин, так и QFA имеют внутриклеточные места действия и с трудом проходят через плазматическую мембрану. Поэтому поглощение клетками указанных средств посредством опосредованной антителами интернализации значительно усиливает их цитотоксическое действие.
Другие модификации антител
В данном изобретении предполагаются другие модификации антитела. Например, антитело может быть связано с одним из множества небелковых полимеров, например полиэтиленгликолем, полипропиленгликолем, полиоксиалкиленами или сополимерами полиэтиленгликоля и полипропиленгликоля. Антитело также можно заключать в микрокапсулы, полученные, например, способами коацервации или полимеризацией на границе фаз (например, микрокапсулы из гидроксиметилцеллюлозы или желатиновые микрокапсулы и микрокапсулы из поли(метилметакрилата), соответственно), в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в Remington’s Pharmaceutical Sciences, 16th edition, Oslo, A., Ed., (1980).
Липосомы и наночастицы
Полипептиды согласно изобретению могут быть приготовлены в липосомах. Например, антитела согласно изобретению также могут быть приготовлены в виде иммунолипосом. Липосомы, содержащие антитело, получают способами, известными в данной области, такими как способы, описанные в Epstein et al., Proc. Natl. Acad. Sci. USA, 82: 3688 (1985); Hwang et al., Proc. Natl Acad. Sci. USA, 77: 4030 (1980) и патентах США  4485045 и 4544545. Липосомы с повышенным периодом циркуляции описаны в патенте США 4485045 и 4544545. Липосомы с повышенным периодом циркуляции описаны в патенте США  5013556. В общем, создание и применение липосом известно специалистам в данной области. 5013556. В общем, создание и применение липосом известно специалистам в данной области.
Особенно применимые липосомы могут быть созданы способом обращенно-фазового выпаривания с использованием композиции липидов, содержащей фосфатидилхолин, холестерин и ПЭГ-дериватизованный фосфатидилэтаноламин (PEG-PE). Липосомы подвергают экструзии через фильтры с определенным размером пор, чтобы получить липосомы требуемого диаметра. Fab’-фрагменты антитела согласно изобретению можно конъюгировать с липосомами, как описано в Martin et al. J. Biol. Chem. 257: 286-288 (1982), посредством реакции дисульфидного обмена. В липосоме необязательно содержится химиотерапевтическое средство (такое как доксорубицин). См. Gabizon et al. J. National Cancer Inst. 81 (19): 1484 (1989).
Другие применения
Антитела согласно изобретению имеют разнообразные применения. Например, анти-ANGPTL4-антитела можно использовать в диагностических анализах в отношении ANGPTL4, например, для выявления его экспрессии в конкретных клетках, тканях или сыворотке, для выявления злокачественной опухоли (например, выявление злокачественной опухоли в почках) и т.д. В одном варианте антитела к ANGPTL4 используют для отбора популяции пациентов для лечения способами, предлагаемыми в настоящем изобретении, например пациентов с экспрессией ANGPTL4, повышенными уровнями ANGPTL4 или злокачественными опухолями, чувствительными к уровням ANGPTL4. Могут быть использованы различные способы диагностического анализа, известные в данной области, такие как анализы конкурентного связывания, прямые или непрямые анализы типа “сэндвич” и анализы иммунопреципитации, проводимые либо в гетерогенных, либо в гомогенных фазах (Zola, Monoclonal Antibodies: A Manual of Techniques, CRC Press, Inc. (1987) pp.147-158). Антитела, используемые в диагностических анализах, можно метить регистрируемым компонентом. Регистрируемый компонент должен обладать способностью прямо или косвенно производить регистрируемый сигнал. Например, регистрируемым компонентом может быть радиоизотоп, такой как 3H, 14C, 32P, 35S или 125I, флуоресцирующее или хемилюминесцентное соединение, такое как изотиоцианат флуоресцеина, родамин или люциферин, или фермент, такой как щелочная фосфатаза, бета-галактозидаза или пероксидаза хрена. Можно использовать любой способ, известный в данной области для конъюгирования антитела с регистрируемым компонентом, включая способы, описанные в Hunter et al., Nature, 144: 945 (1962); David et al., Biochemistry, 13: 1014 (1974); Pain et al., J. Immunol. Meth., 40: 219 (1981) и Nygren, J. Histochem. and Cytochem., 30: 407 (1982).
Анти-ANGPTL4-антитела также применимы для аффинной очистки ANGPTL4 или фрагментов ANGPTL4 из культуры рекомбинантных клеток или природных источников. В таком способе антитела против ANGPTL4 иммобилизуют на подходящей подложке, такой как смола сефадекс или фильтровальная бумага, используя способы, хорошо известные в данной области. Иммобилизованное антитело затем подвергают контакту с образцом, содержащим ANGPTL4, который необходимо очистить, и затем положку промывают подходящим растворителем, который будет удалять в основном все вещества в образце, кроме ANGPTL4, который связан с иммобилизованным антителом. Наконец, подложку промывают другим подходящим растворителем, который будет высвобождать ANGPTL4 из антитела.
Ковалентные модификации полипептидов согласно изобретению
Ковалентные модификации полипептида согласно изобретению, например, фрагмента полипептидного антагониста, слитой молекулы (например, молекулы иммунослияния), антитела согласно изобретению входят в объем настоящего изобретения. Модификации могут быть осуществлены с помощью химического синтеза или, при необходимости, ферментативным или химическим расщеплением полипептида. Другие типы ковалентных модификаций полипептида вводят в молекулу посредством взаимодействия целевых аминокислотных остатков полипептида с органическим дериватизирующим агентом, который способен взаимодействовать с выбранными боковыми цепями или N- или C-концевыми остатками, или посредством включения модифицированной аминокислоты или неприродной аминокислоты в растущую полипептидную цепь, например, Ellman et al. Meth. Enzym. 202: 301-336 (1991); Noren et al. Science 244: 182 (1989); и заявки на выдачу патента США 2003/0108885 и 2003/0082575.
Остатки цистеинила в большинстве случаев взаимодействуют с  -галогенацетатами (и соответствующими аминами), такими как хлоруксусная кислота или хлорацетамид, давая карбоксиметильные или карбоксиамилометильные производные. Остатки цистеинила также подвергают дериватизации в результате взаимодействия с бромтрифторацетоном, -галогенацетатами (и соответствующими аминами), такими как хлоруксусная кислота или хлорацетамид, давая карбоксиметильные или карбоксиамилометильные производные. Остатки цистеинила также подвергают дериватизации в результате взаимодействия с бромтрифторацетоном,  -бром- -бром- -(5-имидозоил)пропионовой кислотой, хлорацетилфосфатом, N-алкилмалеимидами, 3-нитро-2-пиридилдисульфидом, метил-2-пиридилдисульфидом, пара-хлормеркурибензоатом, 2-хлормеркури-4-нитрофенолом или хлор-7-нитробензо-2-окса-1,3-диазолом. -(5-имидозоил)пропионовой кислотой, хлорацетилфосфатом, N-алкилмалеимидами, 3-нитро-2-пиридилдисульфидом, метил-2-пиридилдисульфидом, пара-хлормеркурибензоатом, 2-хлормеркури-4-нитрофенолом или хлор-7-нитробензо-2-окса-1,3-диазолом.
Остатки гистидила подвергают дериватизации посредством взаимодействия с диэтилпирокарбонатом при pH 5,5-7,0, так как указанный агент является сравнительно специфичным по отношению к боковой цепи гистидила. Также применим пара-бромфенацилбромид; реакцию обычно осуществляют в 0,1 М какодилате натрия при pH 6,0.
Лизинил и аминоконцевые остатки взаимодействуют с янтарным ангидридом или ангидридами других карбоновых кислот. Дериватизация указанными агентами оказывает влияние в виде изменения заряда остатков лизинила. Другие подходящие реагенты для дериватизации  -аминосодержащих остатков включают сложные имидоэфиры, такие как метилпиколинимидат, пиридоксальфосфат, пиридоксаль, хлорборогидрид, тринитробензолсульфоновую кислоту, O-метилизомочевину, 2,4-пентандион и катализируемую трансаминазой реакцию с глиоксилатом. -аминосодержащих остатков включают сложные имидоэфиры, такие как метилпиколинимидат, пиридоксальфосфат, пиридоксаль, хлорборогидрид, тринитробензолсульфоновую кислоту, O-метилизомочевину, 2,4-пентандион и катализируемую трансаминазой реакцию с глиоксилатом.
Остатки аргинила модифицируют посредством взаимодействия с одним или несколькими обычными реагентами, среди которых фенилглиоксаль, 2,3-бутандион, 1,2-циклогександион и нингидрин. Дериватизация остатков аргинина требует, чтобы реакция проходила в щелочных условиях из-за высокого значения pKa функциональной группы гуанидина. Кроме того, указанные реагенты могут взаимодействовать с группами лизина, а также эпсилон-аминогруппой аргинина.
Специфичная модификация остатков тирозила может быть осуществлена в случае особого интереса во введении спектральных меток в остатки тирозила посредством взаимодействия с ароматическими соединениями диазония или тетранитрометаном. В большинстве случаев используют N-ацетилимидазол и тетранитрометан для образования O-ацетилтирозила и 3-нитропроизводных, соответственно. Остатки тирозила подвергают йодированию с использованием 125I или 131I, чтобы получить меченые белки для применения в радиоиммуноанализе.
Карбоксильные боковые группы (аспартил или глутамил) избирательно модифицируют посредством взаимодействия с карбодиимидами (R-N=C=N-R’), где R и R’ означают разные алкильные группы, такими как 1-циклогексил-3-(2-морфолинил-4-этил)карбодиимид или 1-этил-3-(4-азониа-4,4-диметилпентил)карбодиимид. Кроме того, остатки аспартила и глутамила превращают в остатки аспарагинила и глутаминила в результате взаимодействия с ионами аммония.
Остатки глутаминила и аспарагинила часто деамидируют до соответствующих остатков глутамила и аспартила, соответственно. Указанные остатки деамидируют в нейтральных или основных условиях. Деамидированная форма указанных остатков входит в объем настоящего изобретения.
Другие модификации включают гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп остатков серила или треонила, метилирование  -аминогрупп боковых цепей лизина, аргинина и гистидина (T.E.Creighton, Proteins: Structure and Molecular Properties, W.H.Freeman and Co., San Francisco, pp.79-86 (1983)), ацетилирование N-концевого амина и амидирование любой C-концевой карбоксильной группы. -аминогрупп боковых цепей лизина, аргинина и гистидина (T.E.Creighton, Proteins: Structure and Molecular Properties, W.H.Freeman and Co., San Francisco, pp.79-86 (1983)), ацетилирование N-концевого амина и амидирование любой C-концевой карбоксильной группы.
Другой тип ковалентной модификации заключается в химическом или ферментативном связывании гликозидов с полипептидом согласно изобретению. Такие способы имеют преимущества, так как они не требуют получения полипептида в клетке-хозяине, которая обладает способностью к гликозилированию, в частности к N- или O-связанному гликозилированию. В зависимости от используемого способа связывания сахар(а) может быть связан с (a) аргинином и гистидином, (b) свободными карбоксильными группами, (c) свободными сульфгидрильными группами, такими как сульфгидрильные группы цистеина, (d) свободными гидроксильными группами, такими как гидроксильные группы серина, треонина или гидроксипролина, (e) ароматическими остатками, такими как ароматические остатки фенилаланина, тирозина или триптофана, или (f) амидной группой глутамина. Такие способы описаны в WO 87/05330, опубликованной 11 сентября 1987, и в Aplin and Wriston, CRC Crit. Rev. Biochem., pp.259-306 (1981).
Удаление любых углеводных остатков, присутствующих на полипептиде согласно изобретению, можно осуществить химически или ферментативно. Химическое дегликозилирование требует воздействия на полипептид трифторметансульфоновой кислотой или эквивалентным соединением. Такая обработка приводит к отщеплению большинства или всех сахаров, за исключением связывающего сахара (N-ацетилглюкозамин или N-ацетилгалактозамин), оставляя при этом полипептид интактным. Химическое дегликозилирование описано в Hakimuddin, et al. Arch. Biochem. Biophys. 259: 52 (1987) и в Edge et al. Anal. Biochem., 118: 131 (1981). Ферментативное отщепление углеводных остатков, например, от антител можно осуществить с использованием множества эндо- и экзогликозидаз, которые описаны в Thotakura et al. Meth. Enzymol. 138: 350 (1987).
Другой тип ковалентной модификации полипептида согласно изобретению включает в себя связывание полипептида с одним или несколькими небелковыми полимерами, например полиэтиленгликолем, полипропиленгликолем или полиоксиалкиленами, таким образом, как указано в патентах США  4640835, 4496689, 4301144, 4670417, 4791192 или 4179337. 4640835, 4496689, 4301144, 4670417, 4791192 или 4179337.
Векторы, клетки-хозяева и способы рекомбинации
Полипептиды согласно изобретению могут быть получены рекомбинантно с использованием способов и веществ, которые могут быть легко получены.
Для рекомбинантного получения полипептида согласно изобретению, например ANGPTL4 или анти-ANGPTL4-антитела, анти- V V 5-антитела или антитела против ангиогенеза, например, анти-VEGF-антитела, кодирующую его нуклеиновую кислоту выделяют и встраивают в реплицируемый вектор для дальнейшего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующую полипептид согласно изобретению, легко выделяют и секвенируют, используя обычные способы. Например, ДНК, кодирующую моноклональное антитело, выделяют и секвенируют, например, используя олигонуклеотидные зонды, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи антитела. Имеется множество векторов. Компоненты вектора обычно включают без ограничения один или несколько из указанных ниже компонентов: сигнальную последовательность, начало репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции. 5-антитела или антитела против ангиогенеза, например, анти-VEGF-антитела, кодирующую его нуклеиновую кислоту выделяют и встраивают в реплицируемый вектор для дальнейшего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующую полипептид согласно изобретению, легко выделяют и секвенируют, используя обычные способы. Например, ДНК, кодирующую моноклональное антитело, выделяют и секвенируют, например, используя олигонуклеотидные зонды, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи антитела. Имеется множество векторов. Компоненты вектора обычно включают без ограничения один или несколько из указанных ниже компонентов: сигнальную последовательность, начало репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
Компонент – сигнальная последовательность
Полипептиды согласно изобретению могут быть получены рекомбинантно не только непосредственно, но также в виде слитого полипептида с гетерологичным полипептидом, который обычно представляет собой сигнальную последовательность или другой полипептид, имеющий специфичный сайт расщепления на N-конце зрелого белка или полипептида. Выбранная гетерологичная сигнальная последовательность обычно представляет собой последовательность, которая узнается и процессируется (т.е. отщепляется сигнальной пептидазой) клеткой-хозяином. В случае прокариотических клеток-хозяев, которые не узнают и не процессируют сигнальную последовательность нативного полипептида, сигнальную последовательность заменяют прокариотической сигнальной последовательностью, выбранной, например, из группы лидеров щелочной фосфатазы, пенициллиназы, lpp или термостабильного энтеротоксина II. Для секреции дрожжами нативная сигнальная последовательность может быть заменена, например, лидером инвертазы дрожжей, лидером  -фактора (включая лидеры -фактора (включая лидеры  -факторов Saccharomyces и Kluyveromyces) или лидером кислой фосфатазы, лидером глюкоамилазы C. albicans или сигналом, описанным в WO 90/13646. Для экспрессии в клетках млекопитающих имеются сигнальные последовательности млекопитающих, а также вирусные лидеры секреции, например сигнал простого герпеса gD. -факторов Saccharomyces и Kluyveromyces) или лидером кислой фосфатазы, лидером глюкоамилазы C. albicans или сигналом, описанным в WO 90/13646. Для экспрессии в клетках млекопитающих имеются сигнальные последовательности млекопитающих, а также вирусные лидеры секреции, например сигнал простого герпеса gD.
ДНК для такой области предшественника лигируют в рамке считывания с ДНК, кодирующей полипептид согласно изобретению.
Компонент – начало репликации
И экспрессирующие, и клонирующие векторы содержат последовательность нуклеиновой кислоты, которая делает возможной репликацию вектора в одной или нескольких выбранных клетках-хозяевах. В общем, в клонирующих векторах такая последовательность представляет собой последовательность, которая обеспечивает возможность репликации вектора независимо от хромосомной ДНК хозяина, и включает в себя начала репликации или автономно реплицирующиеся последовательности. Такие последовательности хорошо известны для многих бактерий, дрожжей и вирусов. Начало репликации из плазмиды pBR322 подходит для большинства грамотрицательных бактерий, начало из 2-мкм-плазмиды подходит для дрожжей и различные вирусные начала репликации (SV40, полиомы, аденовируса, VSV или BPV) подходят для клонирующих векторов в клетках млекопитающих. В общем, компонент, представленный началом репликации, не является необходимым для экспрессирующих вектором млекопитающих (начало SV40 обычно можно использовать только потому, что оно содержит ранний промотор).
Компонент – ген для селекции
Экспрессирующие и клонирующие векторы могут содержать ген для селекции, также называемый маркером селекции. Обычно гены селекции кодируют белки, которые (a) придают резистентность к антибиотикам или другим токсинам, например к ампициллину, неомицину, метотрексату или тетрациклину, (b) комплементируют ауксотрофные дефициты или (c) снабжают необходимыми питательными веществами, недоступными из сложных сред, например ген, кодирующий D-аланинрацемазу для Bacilli.
В одном примере схемы селекции используют лекарственное средство для задержки роста клетки-хозяина. Те клетки, которые успешно трансформированы гетерологичным геном, продуцируют белок, придающий резистентность к лекарственному средству, и таким образом выживают в режиме селекции. В примерах такой доминантной селекции используют лекарственные средства: неомицин, микофеноловую кислоту и гигромицин.
Другим примером подходящих маркеров селекции для клеток млекопитающих являются маркеры, которые обеспечивают возможность идентификации клеток, компетентных в отношении поглощения нуклеиновой кислоты антитела, такие как гены DHFR, тимидинкиназы, металлотионеина-I и -II, обычно гены металлотионеинов приматов, аденозиндезаминазы, орнитиндекарбоксилазы и т.д.
Например, клетки, трансформированные геном селекции DHFR, сначала идентифицируют культивированием всех трансформантов в культуральной среде, которая содержит метотрексат (Mtx), конкурентный антагонист DHFR. Подходящей клеткой-хозяином при использовании DHFR дикого типа является линия клеток яичника китайского хомячка (CHO), дефицитных по активности DHFR.
Альтернативно, клетки-хозяева (особенно хозяева дикого типа, которые содержат эндогенную DHFR), трансформированные или котрансформированные последовательностями ДНК, кодирующими полипептид согласно изобретению, белок DHFR дикого типа и другой маркер селекции, такой как аминогликозид-3′-фосфотрансфераза (APH), можно отбирать по росту клеток в среде, содержащей агент для селекции, соответствующий маркеру селекции, такой как аминогликозидный антибиотик, например канамицин, неомицин или G418. См. патент США  4965199. 4965199.
Подходящим геном селекции для применения у дрожжей является ген trp1, присутствующий в дрожжевой плазмиде Yrp7 (Stinchcomb et al., Nature, 282: 39 (1979)). Ген trp1 обеспечивает маркер селекции для мутантного штамма дрожжей, у которого отсутствует способность расти на триптофане, например ATCC No. 44076 или PEP4-1. Jones, Genetics, 85: 12 (1977). В таком случае наличие повреждения trp1 в геноме дрожжевой клетки-хозяина создает эффективные условия для регистрации трансформации по росту в отсутствие триптофана. Подобным образом, штаммы дрожжей, дефицитные по Leu2 (ATCC 20622 или 38626), комплементируются известными плазмидами, несущими ген Leu2.
Кроме того, векторы, полученные на основе кольцевой 1,6-мкм-плазмиды pKD1, могут быть использованы для трансформации дрожжей Kluyveromyces. Альтернативно, сообщалось о системе экспрессии для крупномасштабного производства рекомбинантного химозина теленка для K. lactis. Van den Berg, Bio/Technology, 8: 135 (1990). Также описаны стабильные мультикопийные экспрессирующие векторы для секреции зрелого рекомбинантного сывороточного альбумина человека промышленными штаммами Kluyveromyces. Fleer et al., Bio/Technology, 9: 968-975 (1991).
Промоторный компонент
Экспрессирующие и клонирующие векторы обычно содержат промотор, который распознается организмом-хозяином и оперативно связан с нуклеиновой кислотой, кодирующей полипептид согласно изобретению. Промоторы, подходящие для применения при использовании прокариотических хозяев, включают промотор phoA, промоторные системы  -лактамазы и лактозы, промотор щелочной фосфатазы, промоторную систему триптофана (trp) и гибридные промоторы, такие как промотор tac. Однако подходящими являются и другие известные бактериальные промоторы. Промоторы для применения в бактериальных системах также будут содержать последовательность Шайна-Далгарно (S.D.), оперативно связанную с ДНК, кодирующей полипептид согласно изобретению. -лактамазы и лактозы, промотор щелочной фосфатазы, промоторную систему триптофана (trp) и гибридные промоторы, такие как промотор tac. Однако подходящими являются и другие известные бактериальные промоторы. Промоторы для применения в бактериальных системах также будут содержать последовательность Шайна-Далгарно (S.D.), оперативно связанную с ДНК, кодирующей полипептид согласно изобретению.
Известны промоторные последовательности для эукариот. Практически все эукариотические гены имеют AT-богатую область, расположенную примерно на 25-30 оснований выше сайта инициации транскрипции. Другой последовательностью, обнаруживаемой на 70-80 оснований выше старта транскрипции многих генов, является область CNCAAT, где N может быть любым нуклеотидом. На 3′-конце большинства эукариотических генов находится последовательность AATAAA, которая может быть сигналом для добавления поли-A-хвоста к 3′-концу кодирующей последовательности. Все такие последовательности соответствующим образом встраивают в эукариотические экспрессирующие векторы.
Примеры подходящих промоторных последовательностей для применения в дрожжевых хозяевах включают промоторы 3-фосфоглицераткиназы или других гликолитических ферментов, таких как енолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкозоизомераза и глюкокиназа.
Другими дрожжевыми промоторами, которые являются индуцируемыми промоторами, имеющими дополнительное преимущество, связанное с транскрипцией, регулируемой условиями роста, являются области промотора алкогольдегидрогеназы 2, изоцитохрома C, кислой фосфатазы, разрушающих ферментов, связанных с метаболизмом азота, металлотионеина, глицеральдегид-3-фосфатдегидрогеназы и ферментов, ответственных за утилизацию мальтозы и галактозы. Подходящие векторы и промоторы для применения для экспрессии у дрожжей дополнительно описаны в EP 73657. С дрожжевыми промоторами также предпочтительно используют дрожжевые энхансеры.
Транскрипция полипептидов согласно изобретению с векторов в клетках-хозяевах млекопитающих регулируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, поксвирус птиц, аденовирус (такой как аденовирус 2), вирус бычьей папилломы, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита-B и обычно вирус 40 обезьян (SV40), гетерологичными промоторами млекопитающих, например промотором актина или промотором иммуноглобулина, промоторами теплового шока, при условии, что такие промоторы совместимы с системами клеток-хозяев.
Ранний и поздний промоторы вируса SV40 легко получают в виде рестрикционного фрагмента SV40, который также содержит начало репликации вируса SV40. Немедленный ранний промотор цитомегаловируса человека легко получают в виде фрагмента рестрикции HindIII E. Система для экспрессии ДНК в хозяевах-млекопитающих с использованием вируса бычьей папилломы в качестве вектора описана в патенте США  4419446. Модификация такой системы описана в патенте США 4419446. Модификация такой системы описана в патенте США  4601978. См. также Reyes et al., Nature 297: 598-601 (1982) в отношении экспрессии кДНК 4601978. См. также Reyes et al., Nature 297: 598-601 (1982) в отношении экспрессии кДНК  -интерферона человека в мышиных клетках под контролем промотора тимидинкиназы из вируса простого герпеса. Альтернативно в качестве промотора можно использовать длинный концевой повтор вируса саркомы Рауса. -интерферона человека в мышиных клетках под контролем промотора тимидинкиназы из вируса простого герпеса. Альтернативно в качестве промотора можно использовать длинный концевой повтор вируса саркомы Рауса.
Компонент – энхансерный элемент
Транскрипцию ДНК, кодирующей полипептид согласно настоящему изобретению, высшими эукариотами часто увеличивают встраиванием последовательности энхансера в вектор. В настоящее время известно много энхансерных последовательностей генов млекопитающих (глобина, эластазы, альбумина,  -фетопротеина и инсулина). Как правило, используют энхансер из вируса эукариотических клеток. Примеры включают энхансер SV40, расположенный после начала репликации (100-270 п.н.), энхансер раннего промотора цитомегаловируса, энхансер вируса полиомы, расположенный после начала репликации, и аденовирусные энхансеры. См. также Yaniv, Nature 297: 17-18 (1982) в отношении усиливающих элементов для активации эукариотических промоторов. Энхансер может быть сплайсирован в вектор в положении 5′- или 3′- по отношению к последовательности, кодирующей полипептид, но обычно расположен в сайте с 5′-стороны от промотора. -фетопротеина и инсулина). Как правило, используют энхансер из вируса эукариотических клеток. Примеры включают энхансер SV40, расположенный после начала репликации (100-270 п.н.), энхансер раннего промотора цитомегаловируса, энхансер вируса полиомы, расположенный после начала репликации, и аденовирусные энхансеры. См. также Yaniv, Nature 297: 17-18 (1982) в отношении усиливающих элементов для активации эукариотических промоторов. Энхансер может быть сплайсирован в вектор в положении 5′- или 3′- по отношению к последовательности, кодирующей полипептид, но обычно расположен в сайте с 5′-стороны от промотора.
Компонент для терминации транскрипции
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах (дрожжей, грибов, насекомых, растений, животных, человека или нуклеированных клетках из других многоклеточных организмов), также будут содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны из 5′- и иногда 3′-нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Указанные области содержат нуклеотидные участки, транскрибируемые в виде полиаденилированных фрагментов в нетранслируемой части мРНК, кодирующей полипептид согласно изобретению. Одним из применимых компонентов для терминации транскрипции является область полиаденилирования бычьего гормона роста. См. WO 94/11026 и описанные в заявке экспрессирующие векторы.
Селекция и трансформация клеток-хозяев
Подходящими клетками-хозяевами для клонирования или экспрессии ДНК, кодирующей полипептиды согласно изобретению, в векторах согласно изобретению являются прокариотические, дрожжевые клетки или клетки высших эукариот, описанные выше. Подходящие прокариоты для указанной цели включают эубактерии, такие как грамотрицательные или грамположительные организмы, например Enterobacteriaceae, такие как Escherichia, например, E.coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например Salmonella typhimurium, Serratia, например Serratia marcescans, и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, описанная в DD 266710, опубликованном 12 апреля 1989), Pseudomonas, такие как P. aeruginosa, и Streptomyces. Обычно клонирующим хозяином в случае E.coli является E.coli 294 (ATCC 31446), хотя подходящими являются и другие штаммы, такие как E.coli B, E.coli X1776 (ATCC 31537) и E.coli W3110 (ATCC 27325). Указанные примеры являются иллюстративными, а не ограничивающими.
Кроме прокариот подходящими клонирующими или экспрессирующими хозяевами для векторов, кодирующих полипептид согласно изобретению, являются эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи. Saccharomyces cerevisiae или обычные пекарские дрожжи являются наиболее широко используемыми из низших эукариотических микроорганизмов-хозяев. Однако ряд других родов, видов и штаммов являются общедоступными и применимыми в настоящем изобретении, такие как Schizosaccharomyces pombe; хозяева Kluyveromyces, такие, например, как K. lactis, K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906), K. thermotolerans и K. marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070); Candida; Trichoderma reesia (EP 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и нитчатые грибы, такие как, например, Neurospora, Penicillium, Tolypocladium, и хозяева Aspergillus, такие как A. nidulans и A. niger.
Подходящие клетки-хозяева для экспрессии гликозилированных полипептидов согласно изобретению получают из многоклеточных организмов. Примерами клеток беспозвоночных являются клетки растений и насекомых. Идентифицированы многочисленные бакуловирусные штаммы и варианты и соответствующие пермиссивные клетки-хозяева насекомых из таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Общедоступно множество вирусных штаммов для трансфекции, например вариант L-1 NPV Autographa californica и штамм Bm-5 NPV Bombyx mori, и такие вирусы могут быть использованы в качестве вируса согласно изобретению, в частности для трансфекции клеток Spodoptera frugiperda. Культуры растительных клеток хлопка, кукурузы, картофеля, сои, петунии, томатов и табака также можно использовать в качестве хозяев.
Однако наибольший интерес представляли клетки позвоночных, и размножение клеток позвоночных в культуре (культуре ткани) стало рутинной процедурой. Примерами применимых линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны CV1, трансформированных SV40 (COS-7, ATCC CRL 1651); линия клеток эмбриональной почки человека (клетки 293 или 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36: 59 (1977)); клетки почки сирийского хомячка (BHK, ATCC CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77: 4216 (1980)); клетки сертоли мышей (TM4, Mather, Biol. Reprod. 23: 243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой обезьяны (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крыс Buffalo (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383: 44-68 (1982)); клетки MRC 5; клетки FS4 и линия клеток гепатомы человека (Hep G2).
Клетки-хозяева трансформируют описанными выше экспрессирующими или клонирующими векторами для продукции полипептида согласно изобретению и культивируют в обычных питательных средах, соответствующим образом модифицированных для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих требуемые последовательности.
Культивирование клеток-хозяев
Клетки-хозяева, используемые для получения полипептидов согласно изобретению, можно культивировать во многих средах. Коммерчески доступные среды, такие как среда Хама F10 (Sigma), минимальная питательная среда ((MEM), (Sigma), RPMI-1640 (Sigma) и модифицированная Дульбекко среда Игла ((DMEM), Sigma), подходят для культивирования клеток-хозяев. Кроме того, любую из сред, описанных в Ham et al., Meth. Enz. 58: 44 (1979), Barnes et al., Anal. Biochem. 102: 255 (1980), патентах США  4767704, 4657866, 4927762, 4560655 или 5122469, WO 90/03430, WO 87/00195 или в патенте США Re. 30985, можно использовать в качестве культуральной среды для клеток-хозяев. Любая из указанных сред может быть дополнена при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальций, магний и фосфат), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство GENTAMYCINTM), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки также могут быть включены в соответствующих концентрациях, которые могут быть известны специалистам в данной области. Условия культивирования, такие как температура, pH и тому подобное, представляют собой условия, используемые ранее в случае клеток-хозяев, отобранных для экспрессии, и условия будут известны специалисту в данной области. 4767704, 4657866, 4927762, 4560655 или 5122469, WO 90/03430, WO 87/00195 или в патенте США Re. 30985, можно использовать в качестве культуральной среды для клеток-хозяев. Любая из указанных сред может быть дополнена при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальций, магний и фосфат), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство GENTAMYCINTM), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки также могут быть включены в соответствующих концентрациях, которые могут быть известны специалистам в данной области. Условия культивирования, такие как температура, pH и тому подобное, представляют собой условия, используемые ранее в случае клеток-хозяев, отобранных для экспрессии, и условия будут известны специалисту в данной области.
Очистка полипептидов
При использовании рекомбинантных способов полипептид согласно изобретению, например ANGPTL4, антитела согласно изобретению, например анти-ANGPTL4-антитело, анти- V V 5-антитело или антитело против ангиогенеза, может быть получен внутриклеточно, в периплазматическом пространстве или непосредственно секретирован в среду. Полипептиды согласно изобретению могут быть извлечены из культуральной среды или из лизатов клеток-хозяев. Если полипептид связан с мембраной, то его можно высвобождать из мембраны с использованием раствора подходящего детергента (например, тритона-X 100) или ферментативным расщеплением. Клетки, используемые для экспрессии полипептида согласно изобретению, могут быть разрушены различными физическими или химическими способами, такими как циклы замораживания-оттаивания, обработка ультразвуком, механическое разрушение или с использованием агентов, лизирующих клетки. 5-антитело или антитело против ангиогенеза, может быть получен внутриклеточно, в периплазматическом пространстве или непосредственно секретирован в среду. Полипептиды согласно изобретению могут быть извлечены из культуральной среды или из лизатов клеток-хозяев. Если полипептид связан с мембраной, то его можно высвобождать из мембраны с использованием раствора подходящего детергента (например, тритона-X 100) или ферментативным расщеплением. Клетки, используемые для экспрессии полипептида согласно изобретению, могут быть разрушены различными физическими или химическими способами, такими как циклы замораживания-оттаивания, обработка ультразвуком, механическое разрушение или с использованием агентов, лизирующих клетки.
Может требоваться очистка полипептида согласно изобретению от белков или полипептидов рекомбинантной клетки. Следующие способы являются примером подходящих способов очистки: фракционирование на ионообменной колонке; преципитация этанолом; обращенно-фазовая ВЭЖХ; хроматография на диоксиде кремния, хроматография на гепарин-SepharoseTM, хроматография на анионообменной или катионообменной смоле (например, на колонке с полиаспарагиновой кислотой, DEAE и т.д.); хроматофокусировка; SDS-ПААГ; преципитация сульфатом аммония; гель-фильтрация с использованием, например, сефадекса G-75; колонки с белком A-сефарозой, чтобы удалить такие примеси, как IgG; и металл-хелатных колонок, чтобы связать меченные эпитопом формы полипептидов согласно изобретению. Могут быть использованы различные способы очистки белка, и такие способы известны в данной области и описаны, например, в Deutscher, Methods in Enzymology, 182 (1990); Scopes, Protein Purification: Principles and Practice, Springer-Verlag, New York (1982). Выбранная стадия(и) очистки будет зависеть, например, от природы применяемого способа получения и конкретного полученного полипептида согласно изобретению.
Например, композиция антител, полученных из клеток, может быть очищена с использованием, например, хроматографии на гидроксилапатите, гель-электрофореза, диализа и аффинной хроматографии, при этом аффинная хроматография является типичным способом очистки. Пригодность белка A в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, который присутствует в антителе. Белок A можно использовать для очистки антител, которые основаны на тяжелых цепях  1, 1,  2 или 2 или  4 человека (Lindmark et al., J. Immunol. Meth. 62: 1-13 (1983)). Белок G рекомендуется для всех мышиных изотипов и для 4 человека (Lindmark et al., J. Immunol. Meth. 62: 1-13 (1983)). Белок G рекомендуется для всех мышиных изотипов и для  3 человека (Guss et al., EMBO J. 5: 1567-1575 (1986)). Матрицей, с которой связывают аффинный лиганд, наиболее часто является агароза, но имеются и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, обеспечивают возможность более высоких скоростей потока и более коротких периодов времени обработки, чем можно достичь в случае агарозы. В том случае, когда антитело содержит домен CH3, для очистки применима смола Bakerbond ABXTM (J.T.Baker, Phillipsburg, NJ). Также доступны другие способы очистки белка, например указанные выше способы, в зависимости от антитела, которое необходимо извлечь. См. также Carter et al., Bio/Technology 10: 163-167 (1992), где описан способ выделения антител, которые секретируются в периплазматическое пространство E.coli. 3 человека (Guss et al., EMBO J. 5: 1567-1575 (1986)). Матрицей, с которой связывают аффинный лиганд, наиболее часто является агароза, но имеются и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, обеспечивают возможность более высоких скоростей потока и более коротких периодов времени обработки, чем можно достичь в случае агарозы. В том случае, когда антитело содержит домен CH3, для очистки применима смола Bakerbond ABXTM (J.T.Baker, Phillipsburg, NJ). Также доступны другие способы очистки белка, например указанные выше способы, в зависимости от антитела, которое необходимо извлечь. См. также Carter et al., Bio/Technology 10: 163-167 (1992), где описан способ выделения антител, которые секретируются в периплазматическое пространство E.coli.
Фармацевтические композиции
Терапевтические препараты полипептидов согласно изобретению, молекул согласно изобретению и их комбинаций, описанных в данной публикации, применяемые согласно изобретению, готовят для хранения смешиванием полипептида(ов), имеющего требуемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington’s Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в форме лиофилизованных препаратов или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях и включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол и м-крезол); полипептиды с низкой молекулярной массой (примерно меньше 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как TweenTM, PluronicsTM или полиэтиленгликоль (ПЭГ).
Активные ингредиенты также могут быть заключены в микрокапсулы, приготовленные, например, способами коацервации или полимеризации на границе фаз, например микрокапсулы из гидроксиметилцеллюлозы или желатиновые микрокапсулы и микрокапсулы из поли(метилметакрилата), соответственно, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в Remington’s Pharmaceutical Sciences, 16th edition, Osol, A., Ed. (1980).
Препараты, используемые для введения in vivo, должны быть стерильными. Это легко осуществить фильтрованием через стерильные фильтрующие мембраны.
Могут быть приготовлены препараты длительного высвобождения. Подходящие примеры препаратов длительного высвобождения включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие полипептид согласно изобретению, и такие матрицы имеют определенную форму, например пленки или микрокапсулы. Примеры матриц для длительного высвобождения включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США  3773919), сополимеры L-глутаминовой кислоты и 3773919), сополимеры L-глутаминовой кислоты и  -этил-L-глутамата, не разрушаемый этилен-винилацетат, разрушаемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOTTM (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и ацетата лейпролида) и поли-D-(-)-3-гидроксимасляная кислота. В то время как такие полимеры, как этилен-винилацетат и молочная кислота-гликолевая кислота, способны высвобождать молекулы в течение около 100 дней, некоторые гидрогели высвобождают белки в течение более коротких периодов времени. В том случае, когда инкапсулированные антитела остаются в организме в течение длительного времени, они могут денатурировать или агрегировать в результате воздействия влаги при 37°C, что приводит к потере биологической активности и возможным изменениям в иммуногенности. Могут быть разработаны стандартные методики для стабилизации, в зависимости от вовлекаемого механизма. Например, если обнаружено, что механизмом агрегации является образование межмолекулярной S-S-связи в результате тиодисульфидного обмена, то стабилизация может быть достигнута посредством модификации сульфгидрильных остатков, лиофилизацией из кислых растворов, регуляцией влагосодержания, использованием соответствующих добавок и разработкой специальных композиций на основе полимерной матрицы. См. также, например, патент США -этил-L-глутамата, не разрушаемый этилен-винилацетат, разрушаемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOTTM (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и ацетата лейпролида) и поли-D-(-)-3-гидроксимасляная кислота. В то время как такие полимеры, как этилен-винилацетат и молочная кислота-гликолевая кислота, способны высвобождать молекулы в течение около 100 дней, некоторые гидрогели высвобождают белки в течение более коротких периодов времени. В том случае, когда инкапсулированные антитела остаются в организме в течение длительного времени, они могут денатурировать или агрегировать в результате воздействия влаги при 37°C, что приводит к потере биологической активности и возможным изменениям в иммуногенности. Могут быть разработаны стандартные методики для стабилизации, в зависимости от вовлекаемого механизма. Например, если обнаружено, что механизмом агрегации является образование межмолекулярной S-S-связи в результате тиодисульфидного обмена, то стабилизация может быть достигнута посредством модификации сульфгидрильных остатков, лиофилизацией из кислых растворов, регуляцией влагосодержания, использованием соответствующих добавок и разработкой специальных композиций на основе полимерной матрицы. См. также, например, патент США  6699501, в котором описаны капсулы с полиэлектролитным покрытием. 6699501, в котором описаны капсулы с полиэлектролитным покрытием.
Кроме того, предполагается, что средство согласно изобретению (ANGPTL4, агонист ANGPTL4 или антагонист ANGPTL4) может быть введено субъекту способом генной терапии. Генная терапия относится к терапии, осуществляемой введением пациенту нуклеиновой кислоты. В случае применений генной терапии гены вводят в клетки, чтобы добиться синтеза in vivo терапевтически эффективного генетического продукта, например, для замены дефектного гена. “Генная терапия” включает в себя как традиционную генную терапию, когда длительный эффект достигается однократной обработкой, и введение генных терапевтических средств, которое заключается в однократном или многократном введении терапевтически эффективной ДНК или мРНК. Антисмысловые РНК и ДНК можно использовать в качестве терапевтических средств для блокирования экспрессии некоторых генов in vivo. См., например, Ad-ANGPTL4-миРНК, описанные в данной публикации. Уже было показано, что короткие антисмысловые олигонуклеотиды могут быть импортированы в клетки, где они действуют в качестве ингибиторов, несмотря на их низкие внутриклеточные концентрации, вызванные их ограниченным поглощением через клеточную мембрану (Zamecnik et al., Proc. Natl. Acad. Sci. USA 83: 4143-4146 (1986)). Олигонуклеотиды могут быть модифицированы для усиления их поглощения, например, заменой их отрицательно заряженных фосфодиэфирных групп незаряженными группами. Общий обзор способов генной терапии см., например, в Goldspiel et al. Clinical Pharmacy 12: 488-505 (1993); Wu and Wu Biotherapy 3: 87-95 (1991); Tolstoshev Ann. Rev. Pharmacol. Toxicol. 32: 573-596 (1993); Mulligan Science 260: 926-932 (1993); Morgan and Anderson Ann. Rev. Biochem. 62: 191-217 (1993) и May TIBTECH 11: 155-215 (1993). Способы, общеизвестные в области технологии рекомбинантной ДНК, которые можно использовать, описаны в Ausubel et al. eds. (1993) Current Protocols in Molecular Biology, John Wiley & Sons, NY; и Kriegler (1990) Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY.
Существует множество способов, доступных для введения нуклеиновых кислот в жизнеспособные клетки. Способы варьируют в зависимости от того, переносят ли нуклеиновую кислоту в культивируемые клетки in vitro или in vivo в клетки предполагаемого хозяина. Способы, подходящие для переноса нуклеиновой кислоты в клетки млекопитающих in vitro, включают применение липосом, электропорации, микроинъекции, слияния клеток, DEAE-декстрана, способа преципитации фосфатом кальция и т.д. Предпочтительные в настоящее время способы переноса генов in vivo включают трансфекцию вирусных (обычно ретровирусных) векторов и трансфекцию, опосредованную липосомами, содержащими белок вирусного капсида (Dzau et al., Trends in Biotechnology 11, 205-210 (1993)). Например, способы переноса нуклеиновой кислоты in vivo включают трансфекцию с помощью вирусных векторов (таких как аденовирус, вирус простого герпеса I, лентивирус, ретровирус или аденоассоциированный вирус) и основанные на липидах системы (применимыми липидами для опосредованного липидами переноса гена являются, например, DOTMA, DOPE и DC-Chol). Примеры применимых вирусных векторов в генной терапии можно найти в Clowes et al. J. Clin. Invest. 93: 644-651 (1994); Kiem et al. Blood 83: 1467-1473 (1994); Salmons and Gunzberg Human Gene Therapy 4: 129-141 (1993); Grossman and Wilson Curr. Opin. in Genetics and Devel. 3: 110-114 (1993); Bout et al. Human Gene Therapy 5: 3-10 (1994); Rosenfeld et al. Science 252: 431-434 (1991); Rosenfeld et al. Cell 68: 143-155 (1992); Mastrangeli et al. J. Clin. Invest. 91: 225-234 (1993); и Walsh et al. Proc. Soc. Exp.Biol. Med. 204: 289-300 (1993).
В некоторых случаях желательно доставлять источник нуклеиновой кислоты с использованием агента, который направлен к клеткам-мишеням, такого как антитело, специфичное для мембранного белка клеточной поверхности или для клетки-мишени, лиганд рецептора на клетке-мишени и т.д. В случае использования липосом могут быть использованы белки, которые связываются с мембранным белком клеточной поверхности, связанным с эндоцитозом, для направления к мишени и/или облегчения поглощения, например белки капсида или их фрагменты, тропные к конкретному типу клеток, антитела к белкам, которые подвергаются интернализации при прохождении цикла, белки, которые направляют внутрь клеток и повышают время полужизни в клетках. Способ опосредованного рецепторами эндоцитоза описан, например, Wu et al., J. Biol. Chem. 262, 4429-4432 (1987); и Wagner et al., Proc. Natl. Acad. Sci. USA 87, 3410-3414 (1990). Обзор протоколов мечения генов и генной терапии см. в Anderson et al., Science 256, 808-813 (1992).
Дозировка и введение
Молекулы (вещества) согласно изобретению вводят человеку в соответствии с известными способами, такими как внутривенное введение в виде болюса или посредством непрерывной инфузии в течение определенного периода времени, внутримышечным, внутрибрюшинным, интроцереброспинальным, подкожным, внутрисуставным, интрасиновиальным, интратекальным, пероральным, местным путем или путем ингаляции и/или подкожным введением.
В некоторых вариантах лечение согласно изобретению заключается в комбинированном введении антагониста ANGPTL4 и одного или нескольких противоопухолевых средств, например средств против ангиогенеза. В одном варианте присутствуют дополнительные противоопухолевые средства, например одно или несколько разных средств против ангиогенеза, одно или несколько химиотерапевтических средств и т.д. Изобретение также охватывает введение множества ингибиторов, например нескольких антител к одному и тому же антигену или нескольких антител к разным активным молекулам злокачественной опухоли. В одном варианте вводят смесь разных химиотерапевтических средств вместе с антагонистом ANGPTL4 и/или одним или несколькими средствами против ангиогенеза. Комбинированное введение включает совместное введение с использованием отдельных препаратов или одного фармацевтического препарата и последовательное введение в любом порядке. Например, антагонист ANGPTL4 может предшествовать, следовать за, чередоваться с введением противоопухолевых средств или может быть введен одновременно с ними. В одном варианте существует период времени, в течение которого оба (или все) активные средства одновременно проявляют свои биологические активности.
Для профилактики или лечения заболевания подходящая доза антагониста ANGPTL4 будет зависеть от типа заболеваний, подвергаемых лечению, которые описаны выше, тяжести и течения заболевания, от того, вводят ли ингибитор для профилактических или терапевтических целей, предыдущей терапии, истории болезни пациента и ответа на ингибитор и решения лечащего врача. Ингибитор соответствующим образом вводят пациенту одновременно или в виде серии обработок. В схеме комбинированной терапии композиции согласно изобретению вводят в терапевтически эффективном количестве или терапевтически синергическом количестве. В используемом в данном описании смысле терапевтически эффективное количество является таким, что введение композиции согласно изобретению и/или совместное антагониста ANGPTL4 и одного или нескольких других терапевтических средств приводит к снижению или ингибированию целевого заболевания или состояния. Эффект введения комбинации средств может быть аддитивным. В одном варианте результатом введения является синергетический эффект. Терапевтически синергетическое количество представляет собой такое количество антагониста ANGPTL4 и одного или нескольких других терапевтических средств, например ингибитора ангиогенеза, которое необходимо для того, чтобы синергетически или существенно уменьшить, или исключить состояния или симптомы, связанные с конкретным заболеванием.
В зависимости от типа и тяжести заболевания от примерно 1 мкг/кг до 50 мг/кг (например, 0,1-20 мг/кг) антагониста ANGPTL4 или ингибитора ангиогенеза является исходной пригодной дозой для введения пациенту, независимо от того, является ли введение однократным или представляет собой несколько отдельных введений или непрерывную инфузию. Типичная суточная доза может варьировать от примерно 1 мкг/кг до примерно 100 мг/кг или более в зависимости от факторов, указанных выше. В случае многократных введений в течение нескольких дней или более в зависимости от состояния лечение продолжают вплоть до того, как происходит требуемое подавление симптомов заболевания. Однако могут быть применимы другие схемы дозирования. Обычно врач будет вводить молекулу(ы) согласно изобретению до достижения дозы(доз), которая обеспечивает требуемый биологический эффект. Ход лечения согласно изобретению легко контролируют, используя обычные способы и анализы.
Например, получение и схемы дозирования ингибиторов ангиогенеза, например анти-VEGF-антител, таких как AVASTIN® (Genentech), могут быть использованы согласно инструкциям производителя или определены эмпирически специалистом в данной области. В другом примере получение и схемы дозирования химиотерапевтических средств могут быть использованы согласно инструкциям производителя или так, как определено эмпирически специалистом в данной области. Получение и схемы дозирования в случае химиотерапии также описаны в Chemotherapy Service Ed., M.C. Perry, Williams and Wilkins, Baltimore, MD (1992).
Эффективность лечения
Эффективность лечения согласно изобретению можно измерить на основе разных конечных точек, обычно используемых для оценки неопластических или не неопластических расстройств. Например, лечение злокачественной опухоли можно оценить, например, без ограничения, по регрессии опухоли, уменьшению массы или размера опухоли, времени до прогрессирования, продолжительности выживания, выживанию в отсутствие прогрессирования заболевания, общего коэффициента ответа, продолжительности ответа и качеству жизни. Поскольку мишенью антиангиогенных средств, описанных в данной публикации, является сосудистая система опухоли и, необязательно, сами неопластические клетки, то они представляют собой уникальный класс противоопухолевых лекарственных средств и поэтому могут требовать специфических измерений и определений клинических ответов на лекарственные средства. Например, сокращение опухоли более чем на 50% в 2-мерном анализе является стандартным предельным значением для утверждения о наличии ответа. Однако ингибиторы согласно изобретению могут вызывать ингибирование распространения метастазов без сокращения первичной опухоли или могут просто проявлять статическое действие на опухоль. Соответственно, можно использовать способы определения эффективности терапии, включающие в себя, например, измерение маркеров ангиогенеза в плазме или моче и измерение ответа посредством радиологической визуализации.
В одном варианте изобретение может быть применено для увеличения продолжительности выживания человека, который чувствителен или у которого диагностировано не неопластическое или неопластическое расстройство, например злокачественная опухоль. Продолжительность выживания определяют как время от первого введения лекарственного средства до смерти. В одном аспекте антагонист ANGPTL4 согласно изобретению вводят больному человеку в комбинации с одним или несколькими противоопухолевыми средствами, в результате чего эффективно увеличивают продолжительность выживания по сравнению только с одним типом терапии, применяемым отдельно, например увеличивают примерно на 5% или увеличивают примерно на 10%, или увеличивают примерно на 20%, или увеличивают примерно на 30%, или увеличивают примерно на 40%, или увеличивают примерно на 50% или более по сравнению с одним типом терапии.
В другом варианте изобретение относится к способам увеличения продолжительности выживания в отсутствие прогрессирования заболевания у человека, который является чувствительным или у которого диагностировано не неопластическое или неопластическое расстройство, например злокачественная опухоль. Время до прогрессирования заболевания определяют как время от введения лекарственного средства вплоть до прогрессирования заболевания. В одном варианте комбированное лечение согласно изобретению с использованием антагониста ANGPTL4 и одного или нескольких противоопухолевых средств значимо увеличивает продолжительность выживания в отсутствие прогрессирования заболевания, по меньшей мере, примерно на 2 месяца, по меньшей мере, примерно на 4 месяца, по меньшей мере, примерно на 6 месяцев, по меньшей мере, примерно на 8 месяцев, на год или более по сравнению только с противоопухолевым лечением, используемым отдельно.
В еще одном варианте лечение согласно изобретению значимо увеличивает коэффициент ответа в группе пациентов, которые являются чувствительными или у которых диагностирована злокачественная опухоль, которых лечат различными терапевтическими средствами. Коэффициент ответа определяют как процент пациентов, подвергаемых лечению, которые отвечают на лечение. В одном варианте осуществления изобретения комбинированное лечение согласно изобретению с использованием антагониста ANGPTL4 и одного или нескольких противоопухолевых средств значимо увеличивает коэффициент ответа в группе пациентов, подвергаемых лечению, по сравнению с группой, подвергаемой лечению одним типом терапии злокачественной опухоли (например, только химиотерапией), при этом указанное увеличение имеет значение p при анализе с использованием критерия хи-квадрат, составляющее, например, менее 0,010 или менее 0,005, или менее 0,001.
В одном аспекте изобретение относится к способам увеличения продолжительности ответа у пациента или в группе пациентов, которые являются чувствительными или у которых диагностирована злокачественная опухоль. Продолжительность ответа определяют как время от начального ответа до прогрессирования заболевания. В некоторых вариантах осуществления изобретения при комбинированном лечении согласно изобретению с использованием антагониста ANGPTL4 и одного или нескольких противоопухолевых средств может быть получено статистически значимое увеличение, например по меньшей мере, на 2 месяца, по меньшей мере, на 4 месяца, по меньшей мере, на 6 месяцев, продолжительности ответа.
Изделия
В другом варианте осуществления изобретения предлагается промышленное изделие, содержащее вещества, применимые для лечения расстройств, описанных выше. Промышленное изделие содержит емкость, этикетку и вкладыш в упаковку. Подходящие емкости включают, например, бутылки, флаконы, шприцы и т.д. Емкости могут быть сделаны из множества материалов, таких как стекло или пластмасса. В емкости находится композиция, которая является эффективной для лечения состояния, и может иметь стерильное входное отверстие (например, емкость может представлять собой мешок с внутривенным раствором или флакон, имеющий пробку, прокалываемую иглой для подкожной инъекции). По меньшей мере, одним активным средством в композиции является модулятор ANGPTL4. Ярлык на емкости или прикрепленный к упаковке указывает, что композиция применима для лечения выбранного состояния. Изделие может дополнительно содержать вторую емкость, содержащую фармацевтически приемлемый буфер, такой как фосфатно-солевой буфер, раствор Рингера и раствор декстрозы. Изделие может дополнительно содержать другие материалы, желательные с коммерческой точки зрения и точки зрения пользователя, включая дополнительные активные средства, другие буферы, разбавители, наполнители, иглы и шприцы.
Депозит материалов
Следующий материал был депонирован в Американской коллекции типов культур, 10801 University Boulevard, Manassas, VA. 20110-2209, USA (ATCC):
| Материал |
 депозита ATCC депозита ATCC |
Дата депозита |
| ANGPTL4 (NL2-DN A 22780-1078) |
209284 |
9/18/97 |
| Линия клеток гибридомы, продуцирующая антитело A4.6.1 |
ATCC HB-10709 |
3/29/91 |
Депонирование осуществляли по условиям Будапештского договора о международном признании депонирования микроорганизмов для целей патентной процедуры и инструкций к нему (Будапештский договор). Он гарантирует сохранение жизнеспособной культуры депозита в течение 30 лет от даты депозита. Депозиты могут стать доступными из ATCC по условиям Будапештского договора и по условиям соглашения между Genentech, Inc. и ATCC, которое гарантирует постоянную и неограниченную доступность потомства культуры депозита для общественности после опубликования соответствующего патента США или после выкладки для общего доступа любой заявки на выдачу патента США или иностранного патента, какой бы ни поступил первым, и гарантирует доступность потомства лицу, определяемому комиссаром по патентам и торговым маркам США как имеющему на это право согласно 35 USC §122 и соответствующим правилам для комиссара (включая 37 CFR §1.14 с конкретной ссылкой на 886 OG 638).
Правопреемник настоящей заявки согласен, что если культура материалов на депонировании погибнет, или потеряется, или нарушится при культивировании в подходящих условиях, то материалы при уведомлении будут быстро заменены другими такими же материалами. Доступность депонированного материала не следует толковать как разрешение на практическое осуществление изобретения в нарушение прав, гарантированных полномочиями любого правительства в соответствии с его патентным законодательством.
ПРИМЕРЫ
Следует понимать, что депозиты, примеры и варианты, описанные в данной публикации, приведены только в иллюстративных целях и что различные модификации или изменения в свете приведенного описания будут очевидны для специалистов в данной области и включены в сущность и сферу применения данной заявки и объем прилагаемой формулы изобретения. Коммерчески доступные реагенты, указанные в примерах, применяли согласно инструкциям производителей, если не оговорено особо.
Пример 1: ANGPTL4 стимулирует пролиферацию клеток и миграцию клеток опухоли
Получение аденовирусных векторов и трансдукция: Аденовирусные конструкции были сконструированы посредством клонирования Not1-Not1-вставки кДНК в полилинкерном сайте с использованием наборов для конструирования вектора Ad-easy из Stratagene (LaJolla, CA), по существу, как описано производителем. См., например, Hesser et al., Blood, 104(1): 149-158 (2004).
Получение меченного одной flag-меткой белка hAngptl4(23-406) (PUR9384), mAngptl4(184-410)-IgG (PUR9388) и mAngptl4(23-410) (PUR9452): Собранную жидкость из культур клеток пропускали в течение ночи через смолу анти-flag M2 (Sigma  A-2220). Колонку промывали до базовой линии PBS, затем элюировали 50 мМ цитратом Na pH 3,0. Полученный объем концентрировали на Amicon-15 с пределом отсечки по молекулярной массе 10000 (Millipore A-2220). Колонку промывали до базовой линии PBS, затем элюировали 50 мМ цитратом Na pH 3,0. Полученный объем концентрировали на Amicon-15 с пределом отсечки по молекулярной массе 10000 (Millipore  UFC901024). Конечная стадия представляла собой диализ в 1 мМ HCl/H2O Super Q и фильтрование через 0,2 мкм-фильтры. SDS-ПААГ-гель в 4-20% трис/глицине (Invitrogen # EC6028box)+/- 10 мМ DTT использовали для определения чистоты. Правильные белки идентифицировали, либо получая масс-спектры, либо N-концевым секвенированием по Эдману. UFC901024). Конечная стадия представляла собой диализ в 1 мМ HCl/H2O Super Q и фильтрование через 0,2 мкм-фильтры. SDS-ПААГ-гель в 4-20% трис/глицине (Invitrogen # EC6028box)+/- 10 мМ DTT использовали для определения чистоты. Правильные белки идентифицировали, либо получая масс-спектры, либо N-концевым секвенированием по Эдману.
Получение hAngptl4(184-406)-IgG (PUR 9441) с N-концевой flag-меткой, за которой последовательно располагается N-концевая hu-Fc-метка: Собранную жидкость из культуры клеток пропускали в течение ночи через ProSep A (Amersham  113111835). Колонку промывали до базовой линии PBS. Затем осуществляли стадию промывки четырьмя объемами колонки 0,5 М TMAC/PBS pH 7,5 с последующей промывкой PBS до базовой линии. Стадию элюирования осуществляли в 50 мМ цитрате Na pH 3,0. Полученный объем концентрировали на Amicon-15 с пределом отсечки по молекулярной массе 10000 (Millipore 113111835). Колонку промывали до базовой линии PBS. Затем осуществляли стадию промывки четырьмя объемами колонки 0,5 М TMAC/PBS pH 7,5 с последующей промывкой PBS до базовой линии. Стадию элюирования осуществляли в 50 мМ цитрате Na pH 3,0. Полученный объем концентрировали на Amicon-15 с пределом отсечки по молекулярной массе 10000 (Millipore  UFC901024). Конечная стадия представляла собой диализ в 1 мМ HCl/H2O Super Q и фильтрование через 0,2 мкм-фильтры. SDS-ПААГ-гель в 4-20% трис/глицине (Invitrogen # EC6028box)+/- 10 мМ DTT использовали для определения чистоты. Правильные белки идентифицировали, либо получая масс-спектры, либо N-концевым секвенированием по Эдману. Рекомбинантные белки также можно получить, используя стандартные способы, известные в данной области. UFC901024). Конечная стадия представляла собой диализ в 1 мМ HCl/H2O Super Q и фильтрование через 0,2 мкм-фильтры. SDS-ПААГ-гель в 4-20% трис/глицине (Invitrogen # EC6028box)+/- 10 мМ DTT использовали для определения чистоты. Правильные белки идентифицировали, либо получая масс-спектры, либо N-концевым секвенированием по Эдману. Рекомбинантные белки также можно получить, используя стандартные способы, известные в данной области.
Создание Ad-ANGPTL4-миРНК: 4 возможных молекулы ANGPTL4-миРНК (Qiagen) создавали на основе полноразмерной последовательности hANGPTL4. Одну ANGPTL4-миРНК отбирали на основе способности миРНК ингибировать экспрессию hANGPTL4. Она была направлена к следующей последовательности ДНК-мишени GTGGCCAAGCCTGCCCGAAGA (SEQ ID NO: 3) ANGPTL4, например r(GGCCAAGCCUGCCCGAAGAUU) (SEQ ID NO: 4) и/или r(UCUUCGGGCAGGCUUGGCCAC) (SEQ ID NO: 5). МиРНК клонировали в векторе для переноса CMVpShuttle-H1.1 с РНК-промотором, например промотором H1 (GenScript). Затем клонировали кассету экспрессии миРНК, чтобы создать аденовирусную конструкцию AdhANGPTL4-миРНК. Например, аденовирусные конструкции получали клонированием Not1-Not1-вставки кДНК в полилинкерном сайте, используя наборы для конструирования вектора Ad-easy от Stratagene (LaJolla, CA), по существу, как описано производителем. См., например, Hesser et al., Blood, 104(1): 149-158 (2004).
Экспрессию ANGPTL4 подтверждали Вестерн-блот-анализом, используя анти-FLAG-антитело. Отбирали один клон с высокой экспрессией и титры увеличивали согласно инструкции производителя. Вирусные препараты очищали центрифугированием в CsCl и тестировали в отношении ревертантов с помощью ПЦР. Титры вирусов определяли в экспериментах по лизированию клеток в 96-луночных планшетах согласно инструкциям производителя. Указанные векторы наряду с поставляемым pShuttleCMV-lacZ рекомбинировали в электрокомпетентных бактериях BJ5183 с вектором AdEasy, содержащим геном Ad5, делетированный в областях E1 и E3. Первичные вирусные штаммы получали, используя временную трансфекцию рекомбинантных плазмид AdEasy в клетки-хозяева HEK293. Аденовирусные штаммы дополнительно амплифицировали в клетках HEK293 и очищали, используя способ очистки в градиенте CsCl, как описано производителем. Рабочие титры аденовируса получали в анализе ELISA.
Получение mANGPTL4: Клетки 293 временно трансфицировали конструкцией, которая содержала нуклеиновую кислоту, кодирующую полноразмерный mANGPTL4 (1-410). mANGPTL4 очищали из надосадка и использовали для экспериментов.
Пролиферация опухолевых клеток in vitro: ANGPTL4 стимулировал пролиферацию опухолевых клеток рабдомиосаркомы человека A673 (HTB 1598) in vitro. См. фиг.4, панель A. Аденовирусные конструкции Ad-Angptl4, Ad-LacZ, Ad-Angptl13 получали, как описано ранее (Hesser et al., Blood, 104(1): 149-158 (2004)). Клетки A673 трансдуцировали либо конструкцией, содержащей конструкцию аденовирус-ANGPTL4 (Ad-Angptl4), конструкцию аденовирус-LacZ (Ad-LacZ) в качестве контроля, либо конструкцию аденовирус-ANGPTL3 (Ad-Angptl3) при значении множественности инфекции (MOI) 100. После 3 дней выращивания клеток A673 в среде DMEM с высоким содержанием глюкозы и 5% FCS клетки подсчитывали. Как показано на фиг.4, панель A, Ad-Angptl4 стимулировал пролиферацию опухолевых клеток. Более чем примерно в 2 раза увеличение количества клеток наблюдали в случае клеток, обработанных Ad-Angptl4, по сравнению с контролем Ad-LacZ. Ad-Angptl4 также стимулировал пролиферацию клеток MCF7 (аденокарциномы молочной железы человека) примерно в 3 раза, клеток TK10 (линия почечноклеточного рака) примерно в 2 раза и клеток A549 (карциномы легкого человека) примерно в 1,5 раза по сравнению с контролем. Ad-Angptl4 также стимулировал пролиферацию клеток U87MG. См. фиг.4, панель B, где клетки (A673, U87MG, 4T-1 или Caki) трансдуцированы либо конструкцией, содержащей конструкцию аденовирус-ANGPTL4 (Ad-Angptl4 (2)), конструкцию аденовирус-LacZ (Ad-LacZ (1)) в качестве контроля или конструкцию аденовирус ANGPTL4-миРНК (3) при значении множественности инфекции (MOI) 500. После 2-3 дней выращивания клеток A673 в среде DMEM с высоким содержанием глюкозы и 5% FCS клетки подсчитывали.
Кондиционированная среда от клеток COS, трансдуцированных ANGPTL4, также индуцировала пролиферацию клеток A673. См. фиг.4, панель C. Кондиционированные среды (надосадок) от гепатоцитов (Hepa) (A), эндотелиальных клеток капилляров человека (HMEC) (B) или клеток COS7 (C), которые трансдуцировали аденовирусными конструкциями (Ad-Angptl4 (2), Ad-LacZ (1) или Ad-Angptl3(3)), добавляли к клеткам A673. После 4 дней выращивания клеток A673 в среде DMEM с высоким содержанием глюкозы и 5% FCS клетки подсчитывали. Как показано на фиг.4, панель C, надосадок от клеток COS+Ad-Angptl4 стимулировал пролиферацию опухолевых клеток по сравнению с контролями и другими надосадками от других типов клеток, которые были использованы, например клеток Hepa и клеток HMVEC.
Активность Angptl4 при покрывании им чашек для культивирования: Пролиферацию клеток A673 под влиянием Angptl4 также исследовали, покрывая белком чашки для культивирования. Планшеты покрывали мышиным Angptl4, LZ-hANgptl4, фибронектином, контрольным белком NL4, IgG-hAngptl4 (184-406), mAngptl3, hAngptl3, mAngptl4 (23-410), Lz-hAngptl4 (184-406), Fc-hAngptl4 (184-406) или БСА в разных концентрациях, например без покрытия, 0,3 мкг/мл, 3,0 мкг/мл или 30 мкг/мл. 96-луночные планшеты с плоским дном (MaxiSorp, Nunc, Denmark) покрывали в течение ночи при 4°C. Опухолевые клетки человека A673 собирали и разбавляли до 105 клеток/мл в среде HG-DMEM, содержащей 5% FCS. Суспензии клеток (104 клеток/лунку) в 200 мкл добавляли в покрытые лунки и планшеты инкубировали при 37°C в течение выбранного времени. Неприкрепленные клетки удаляли промывками в PBS и прикрепление клеток измеряли, используя либо способ на основе кристаллического фиолетового, либо способ PNAG согласно Landegren. См. Landegren, U. (1984) J. Immunol. Methods 67: 379-388. Результаты выражены в виде средних значений OD550 или OD405 для лунок в трех повторах, соответственно.
Подобным образом первичные эндотелиальные клетки пупочной вены человека (HUVEC), эпителиальные (epi) и мезангиальные (mesa) клетки, выделенные либо из пуповины человека, либо из почек человека (Cambrex), собирали и тестировали, используя идентичные условия. Для анализа пролиферации использовали среду, поставляемую для каждого типа клеток, от производителя (Cambrex). По-видимому, ANGPTL4 не индуцировал пролиферацию эпителиальных клеток почки, мезангиальных клеток почки или эндотелиальных клеток пупочной вены человека (HUVEC), но индуцировал пролиферацию A673 (фиг.5).
FACS-анализ связывания ANGPTL4 с клетками A673: Связывание ANGPTL4 с клетками человека A673 исследовали с помощью анализа FACS. Клетки A673 высевали в чашки для культивирования диаметром 10 см в количестве от 500000 до 1×106 клеток/лунку с образцом. Клетки разделяли за день до FACS. Клетки один раз промывали PBS и затем добавляли 10 мл 20 мМ EDTA в PBS и инкубировали в течение 10-20 минут. Через 20 минут клетки соскабливали из планшета. Добавляли 10 мл 5% FCS в PBS и клетки переносили в пробирку Falcon объемом 50 мл. Клетки осаждали центрифугированием при 1,8 тыс. об/мин в течение 5 минут при 4°C. Надосадок удаляли и клетки ресуспендировали в 1 мл 5% FCS в PBS. По 100 мкл суспензии клеток распределяли в пробирки для FACS объемом 5 мл, содержащие 1 мкг белка, и инкубировали в течение 30 минут или больше на льду. Использовали следующие белки: mAngptl4 (23-410), PUR 9452, 0,428 мг/мл (2 мкл/образец); hAngptl4 (23-406), PUR 9384, +/- 90 мкг/мл (10 мкл/образец); hAngptl4 (184-406)-IgG, PUR 9441, 1,5 мг/мл (1 мкл/образец) и контрольный FLAG-BAP (Sigma) 0,1 мг/мл (2 мкл/образец). После инкубации пробирки заполняли 5 мл 5% FCS в PBS на льду. Клетки осаждали центрифугированием в течение 5 минут при 2 тыс. об/мин. Надосадок удаляли. Добавляли анти-FLAG-FITC-антитело (Sigma) (2 мкл антитела (100 мкг/мл исходного раствора) и инкубировали на льду в течение 5 минут или больше. Конечная концентрация антитела составляла 1 мкг/мл. Добавляли 5 мл 5% FCS в PBS и клетки осаждали центрифугированием в течение 5 минут при 1,8 тыс. об/мин при 4°C. Надосадок удаляли и клетки ресуспендировали в 0,25 мл PBS с 5% FCS на льду. Также может присутствовать 0,05% азид натрия, чтобы предотвратить интернализацию рецептора. Добавляли 1 мкл разбавленного 1:50 исходного раствора йодида пропидия (PI) на образец. Затем клетки подвергали FACS-анализу. Различные формы ANGPTL4 как человеческого, так и мышиного ANGPTL4 связывались с клетками A673 (фиг.6, панель A) в разных условиях (фиг.6, панель B), при нормальном содержании кислорода, в условиях гипоксии (0% O2, в течение 24 часов) или в присутствии PMA (200 нМ в течение 24 часов). Для экспериментов в условиях гипоксии клетки инкубировали в течение 24 часов при 37°C в инкубаторе с 5% CO2, 95% N2 в течение 24 часов. Альтернативно клетки активировали в присутствии 200 нМ форболового эфира (PMA) при 37°C в инкубаторе с 5% CO2 и в условиях нормального содержания кислорода.
Кондиционированные среды от клеток, экспрессирующих ANGPTL4: Исследовали пролиферацию клеток A673 при использовании кондиционированных сред от клеток, экспрессирующих Angptl4, или при добавлении рекомбинантного Angptl4. 500 мкл кондиционированной среды (надосадка) от клеток COS7, которые были трансдуцированы аденовирусными конструкциями (Ad-Angptl4 (2), Ad-LacZ (1) или Ad-LacZ+rmAngptl4 (23-410) (3) (5 мкг/мл)), добавляли к клеткам A673. После выращивания клеток в течение 7 дней (фиг.7, панель A) в среде DMEM с высоким содержанием глюкозы, содержащей 5% FCS, клетки подсчитывали. Пролиферацию A673 также исследовали при добавлении рекомбинантного Angptl4 к среде с 5% FCS и выращивании клеток в течение 4 дней. Добавки либо отсутствовали (1), либо в среду добавляли контрольный буфер (2), mAngptl4 (23-410) (2,5 мкг/мл) (3), hAngptl4 (23-406) (2,5 мкг/мл) (4), hIgG-hAngptl4 (184-406) (2,5 мкг/мл)(5), либо hIgG-mAngptl4 (184-410) (2,5 мкг/мл) (6) в указанных концентрациях. После выращивания клеток в течение 4 дней (фиг.7, панель B) в среде DMEM с высоким содержанием глюкозы, содержащей 5% FCS, клетки подсчитывали. Пролиферация клеток A673 при действии кондиционированных сред от клеток, экспрессирующих ANGPTL4, или рекомбинантного белка, добавляемых к средам, может быть зависимой от плотности клеток. См. фиг.7, панель A (пролиферация клеток при выращивании в течение 7 дней в стандартных условиях) и панель B (пролиферацию клеток при выращивании в течение 4 дней в стандартных условиях).
Angptl4 индуцирует миграцию клеток: Авторы исследовали способность Angptl4 индуцировать клеточную миграцию мышиных опухолевых клеток 4T-1. Подвижность клеток измеряли, как описано ранее (см., например, Camenisch et al., J. Biol. Chem., 277 (19): 17281-17290 (2002)), используя многолуночные вкладыши для культуры ткани HTS с размером пор 3 мкм (Becton Dickinson, NJ). hANGPTL4 (1-406) разбавляли в 50/50/0,1% БСА до 5, 1 и 0,2 мкг/мл. В качестве позитивного контроля мембраны инкубировали либо со средой, содержащей 10% фетальной сыворотки теленка (FCS), либо 0,1 мкг/мл рекомбинантного PDGF-BB человека (R & D Systems). В качестве негативного контроля использовали 50/50/0,1% БСА. Мышиные опухолевые клетки 4T1 три раза промывали PBS, собирали и суспендировали в концентрации примерно 105 клеток/мл в 50/50/0,1% БСА. Тестировали следующие препараты клеток, где ANGPTL4 указан как NL2.
| 4T-1 |
| 50/50/0,1% БСА |
NL2 5 мкг |
| +10% FBS |
NL2 0,5 мкг |
| +10% FBS |
NL2 0,2 мкг |
| 50/50/0,1% БСА |
PDGF-BB 0,1 мкг |
Препараты добавляли в нижнюю камеру и препараты инкубировали при 37°C в течение 19 часов.
Суспензию клеток (250 мкл) добавляли в верхнюю камеру и клеткам давали возможность мигрировать в течение ночи при 37°C в инкубаторе во влажной атмосфере с 5% CO2. После инкубации среду отсасывали как из верхней, так и из нижней камер и клетки, которые мигрировали к нижней поверхности мембраны, фиксировали метанолом (400 мкл MeOH в течение 30 минут при 4°C, удаляли MeOH и сушили на воздухе в течение 40 минут) и красили YO-PRO-1-йодидом (Molecular Probes, OR) (400 мкл YO-PRO-1-йодида в концентрации 10 мкМ (1:100 из 1 мМ исходного раствора)). Результаты миграции количественно оценивали в виде среднего количества клеток/поле микроскопа при 20-кратном увеличении, используя компьютерную программу Openlab (Improvision, MA).
В другом эксперименте обнаружено, что Angptl4 индуцирует миграцию клеток A673 наряду с миграцией опухолевых клеток 4T-1. mANGPTL4 разбавляли в 50/50/0,1% БСА до 6, 1,5 и 0,375 мкг/мл. В качестве позитивного контроля мембраны инкубировали либо со средой, содержащей 10% фетальной сыворотки теленка (FCS), либо с 0,1 мкг/мл рекомбинантного PDGF-BB человека (R & D Systems). В качестве негативного контроля использовали 50/50/0,1% БСА. Клетки 4T-1 и A673 собирали и ресуспендировали в 50/50/0,1% БСА (2×105 клеток/мл). Тестировали следующие препараты клеток, где mANGPTL4 указан как NL2.
| 4T-1 |
A673 |
| 50/50/0,1% БСА |
NL2 6 мкг |
50/50/0,1% БСА |
NL2 6 мкг |
| +10% FBS |
NL2 1,5 мкг |
+10% FBS |
NL2 1,5 мкг |
| +10% FBS |
NL2 0,375 мкг |
+10% FBS |
NL2 0,375 мкг |
| 50/50/0,1% БСА |
PDGF-BB 0,1 мкг |
50/50/0,1% БСА |
NL2 0,375 мкг |
Препараты добавляли в нижнюю камеру в объеме 750 мкл и препараты инкубировали при 37°C в течение 19 часов.
Суспензию клеток (250 мкл) (5×104) добавляли в верхнюю камеру и клеткам давали возможность мигрировать в течение 7 часов при 37°C в инкубаторе во влажной атмосфере с 5% CO2. После инкубации среду отсасывали как из верхней, так и из нижней камер и клетки, которые мигрировали к нижней поверхности мембраны, фиксировали метанолом (400 мкл MeOH в течение 30 минут при 4°C, удаляли MeOH и сушили на воздухе в течение 40 минут) и красили YO-PRO-1-йодидом (Molecular Probes, OR) (400 мкл YO-PRO-1-йодида в концентрации 10 мкМ (1:100 из 1 мМ исходного раствора)). Результаты миграции количественно оценивали в виде среднего количества клеток/поле микроскопа при 20-кратном увеличении, используя компьютерную программу Openlab (Improvision, MA). См. Фиг.9, где (1) означает без добавления сыворотки, (2) означает 10% фетальную сыворотку теленка (FCS), (3) означает PDGF-BB и (4) означает ANGPTL4. При использовании и ANGPTL4 и 10% FCS клетки A673 и 4T-1 мигрировали. Следовательно, антагонисты Angptl4 могут быть использованы для ингибирования метастазов, при этом, не будучи связанными с одной теорией, например, предполагают, что в результате предотвращения миграции опухолевых клеток.
ANGPTL4 увеличивает размер опухоли in vivo: Клетки рабдомиосаркомы человека A673 (HTB 1598) культивировали, как описано ранее (Kim et al., Nature 362: 841-844 (1993) и Gerber et al., Cancer Research, 60: 6253-6258 (2000)). 5×106 клеток A673 в 0,1 мл Matrigel инъецировали п/к в боковую область спины мышей beige (с врожденным отсутствием клеток-киллеров)/nude (Harlan Sprague Dawley), чтобы получить ксенотрансплантаты. Аденовирусную конструкцию инъецировали в количестве 1×108 бляшкообразующих единиц (БОЕ) внутрь опухоли (в/о) q7d в 1, 7 и 14 дни. Инъекции осуществляли непосредственно в опухолевую массу сбоку и снизу, используя иглу 28 калибра и шприц для введения туберкулина объемом 0,5 мл. Аденовирусные конструкции представляли собой либо конструкцию аденовирус-ANGPTL4 (Ad-Angptl4), конструкцию аденовирус-LacZ (Ad-LacZ) в качестве контроля, либо конструкцию аденовирус-ANGPTL3 (Ad-Angptl3). Размер опухолей определяли в разные дни после имплантации опухоли. Измерения размера опухолей осуществляли через день и объем опухоли рассчитывали, используя формулы объема эллипсоидных опухолей ( /6×L×W×H, где L=длина, W=ширина и H=высота; Tomayko & Reynolds, Cancer Chemother. Pharmacol., 24: 148-154 (1989)). Как видно на фиг.8, размер (панель A) и масса (панель B) опухоли статистически увеличивались (P<0,0001) у мышей, которым инъецировали клетки A673 и конструкцию аденовирус-ANGPTL4 (Ad-Angptl4), по сравнению с использованием конструкций Ad-LacZ или Ad-Angptl3. /6×L×W×H, где L=длина, W=ширина и H=высота; Tomayko & Reynolds, Cancer Chemother. Pharmacol., 24: 148-154 (1989)). Как видно на фиг.8, размер (панель A) и масса (панель B) опухоли статистически увеличивались (P<0,0001) у мышей, которым инъецировали клетки A673 и конструкцию аденовирус-ANGPTL4 (Ad-Angptl4), по сравнению с использованием конструкций Ad-LacZ или Ad-Angptl3.
Пример 2: Тенденция к ускользанию от анти-VEGF-лечения опухолей, обработанных ANGPTL4
ANGPTL4 стимулировал пролиферацию опухолевых клеток в опухолях, обрабатываемых антиангиогенным средством, например анти-VEGF (таким как AVASTIN® (Genentech, South San Francisco). См. фиг.8, панель C. Клетки рабдомиосаркомы человека A673 (HTB 1598) культивировали, как описано ранее (Kim et al., Nature 362: 841-844 (1993) и Gerber et al., Cancer Research, 60: 6253-6258 (2000)). 5×106 клеток A673 в 0,1 мл Matrigel инъецировали п/к в боковую область спины мышей beige/nude (Harlan Sprague Dawley), чтобы получить ксенотрансплантаты. Аденовирусную конструкцию инъецировали в количестве 1×108 бляшкообразующих единиц (БОЕ) внутрь опухоли (в/о) q7d в 1, 7, 14, 21 и 28 день. Аденовирусные конструкции представляли собой либо конструкцию аденовирус-ANGPTL4 (Ad-Angptl4), конструкцию аденовирус-LacZ (Ad-LacZ) в качестве контроля, либо конструкцию аденовирус-ANGPTL3 (Ad-Angptl3). Мышей также обрабатывали Avastin® (Genentech) в дозе 5 мг/кг в/б дважды в неделю. Инъекции осуществляли непосредственно в опухолевую массу сбоку и снизу, используя иглу 28 калибра и шприц для инъекции туберкулина объемом 0,5 мл. Измерения размера опухолей осуществляли через день и объем опухоли рассчитывали, используя формулы объема эллипсоидных опухолей ( /6×L×W×H, где L=длина, W=ширина и H=высота; Tomayko & Reynolds, Cancer Chemother. Pharmacol., 24: 148-154 (1989)). Как видно на фиг.8, панель C, размер опухолей увеличивался у мышей, которым инъецировали конструкцию аденовирус-ANGPTL4 (Ad-Angptl4), несмотря на то что их подвергали лечению Avastin®, по сравнению с мышами, которым инъецировали клетки, содержащие конструкцию Ad-LacZ или Ad-Angptl3, в комбинации с лечением Avastin®. /6×L×W×H, где L=длина, W=ширина и H=высота; Tomayko & Reynolds, Cancer Chemother. Pharmacol., 24: 148-154 (1989)). Как видно на фиг.8, панель C, размер опухолей увеличивался у мышей, которым инъецировали конструкцию аденовирус-ANGPTL4 (Ad-Angptl4), несмотря на то что их подвергали лечению Avastin®, по сравнению с мышами, которым инъецировали клетки, содержащие конструкцию Ad-LacZ или Ad-Angptl3, в комбинации с лечением Avastin®.
Пример 3: Антитела, которые связываются с Angptl4, ингибируют рост опухолевых клеток
Тестировали способность анти-ANGPTL4-антител ингибировать биологическую активность ANGPTL4, например пролиферацию опухолевых клеток. 1×104 опухолевых клеток (например, HeLa-S3, Caki, U87MG, 293, A673, HM7 и Calu 6)/лунку высевали в 12-луночные планшеты в среду с 10% FCS. Клеткам давали возможность проходить инкубацию в течение ночи при 37°C в инкубаторе во влажной атмосфере с 5% CO2. Среду заменяли на среду с 5% FCS (за исключением клеток Calu 6, которые были в 10% FCS) и в лунки добавляли 1, 2,5, 5 или 10 мкг/мл анти-hANGPTL4-антитела или анти-Dscr-антитела или антитело не добавляли. Планшеты помещали при 37°C в инкубаторе во влажной атмосфере с 5% CO2. Клетки подсчитывали на 2 или 3 день после добавления анти-hANGPTL4-антитела. Анти-ANGPTL4-антитело ингибировало рост клеток HeLa-S3, Caki U87MG, 293, A673 и Calu 6, но не клеток HM7 клетки. См. фиг.10, панели A и B.
Пример 4: Получение антител, которые связываются с Angptl4
Способы получения поликлональных антител и моноклональных антител известны в данной области и описаны в данной публикации. Антигены (или иммуногены), которые могут быть использованы, включают очищенный белок согласно изобретению, фрагменты белка, слитые белки, содержащие такой белок, и клетки, экспрессирующие рекомбинантный белок и/или фрагменты белка на клеточной поверхности. Выбор антигена может сделать специалист в данной области без чрезмерного экспериментирования.
Мышей, таких как Balb/c, иммунизируют антигеном, эмульгированным в полном адъюванте Фрейнда и инъецированным подкожно или внутрибрюшинно в количестве 1-100 мкг. Альтернативно антиген эмульгируют в адъюванте MPL-TDM (Ribi Immunochemical Research, Hamilton, Mont.) и инъецируют в подушечки задней лапы животного. Затем иммунизированных мышей подвергают бустер-иммунизации через 10-12 дней дополнительным количеством антигена, эмульгированного в выбранном адъюванте. Затем в течение нескольких недель мыши также могут подвергаться бустер-иммунизациям с помощью дополнительных инъекций. Периодически от мышей можно получать образцы сыворотки, отбирая кровь ретроорбитально, для тестирования в анализах ELISA, чтобы выявить антитела.
После того как выявлен подходящий титр антител, животным, “позитивным” в отношении антител, можно инъецировать конечную внутривенную инъекцию данного лиганда. Через три-четыре дня мышей умерщвляют и собирают клетки селезенки. Затем клетки селезенки сливают (используя 35% полиэтиленгликоль) с выбранной линией клеток миеломы мышей, такой как P3X63AgU.1, доступной из ATCC, No. CRL 1597. Слияния дают клетки гибридомы, которые затем можно высевать в 96-луночные планшеты для культуры ткани, содержащие среду HAT (гипоксантин, аминоптерин и тимидин), чтобы ингибировать пролиферацию неслитых клеток, гибридов клеток миеломы и гибридов клеток селезенки.
Клетки гибридомы могут быть подвергнуты скринингу в ELISA в отношении реактивности против антигена. Определение “позитивных” клеток гибридомы, секретирующих требуемые моноклональные антитела против ANGPTL4 согласно изобретению, хорошо известно в данной области.
Позитивные клетки гибридомы могут быть инъецированы внутрибрюшинно сингенным мышам Balb/c, чтобы получить асциты, содержащие моноклональные анти-ANGPTL4-антитела. Альтернативно клетки гибридомы можно выращивать во флаконах для культуры ткани или вращающихся флаконах. Очистку моноклональных антител, полученных в асцитах, можно осуществить, используя преципитацию сульфатом аммония с последующей гель-эксклюзионной хроматографией. Альтернативно можно использовать аффинную хроматографию, основанную на связывании антитела с белком A или белком G.
Например, поликлональные кроличьи антитела получали при иммунизации кролика 500 мкг рекомбинантного белка ANGPTL4 человека (23-406), полученного в E.coli, в 1, 40 и 70 дни. Сыворотку собирали на 80 и 120 день после иммунизации и антитела очищали на колонках, содержащих белок-A-сефадекс.
Пример 5: Блокирующие или нейтрализующие антитела
Антитела против антигенов, описанных в данной публикации, могут быть идентифицированы различными способами, известными в данной области, например ELISA. Например, планшеты могут быть покрыты представляющим интерес полипептидом, например ANGPTL4 или его фрагментом, и инкубированы с антителами, созданными против такого полипептида, например ANGPTL4 (см., например, описание в патентах США 6348350, 6372491 и 6455496). Связанное антитело может быть выявлено разными способами.
Антагонистические (например, блокирующие или нейтрализующие) антитела могут быть идентифицированы в конкурентных анализах и/или анализах активности. Например, экспрессия ANGPTL4 стимулирует пролиферацию, миграцию, адгезию или связывание опухолевых клеток с  V V 5. Регистрацию блокирующего или нейтрализующего антитела к ANGPTL4 можно показать по способности антитела блокировать пролиферацию опухолевых клеток (см., например, фиг.10, панели A и B), миграцию, адгезию (см., например, фиг.12) или связывание с 5. Регистрацию блокирующего или нейтрализующего антитела к ANGPTL4 можно показать по способности антитела блокировать пролиферацию опухолевых клеток (см., например, фиг.10, панели A и B), миграцию, адгезию (см., например, фиг.12) или связывание с  V V 5 (USBiological, 37K, Swampscott, Massachusetts) (см., например, фиг.13, панели B и C). Например, клетки рабдомиосаркомы A673 можно высевать и инкубировать с надосадком клеток COS7, трансдуцированных Ad-hAngptl4, вместе с анти-ANGPTL4-антителом или контрольным антителом или PBS. Через несколько дней клетки можно обработать трипсином и подсчитать. Антитела, которые уменьшают количества клеток, идентифицируют как блокирующие или нейтрализующие антитела. Также показано, что ANGPTL4 индуцирует миграцию опухолевых клеток и является проангиогенным фактором. См., например, Le Jan et al., American Journal of Pathology, 164(5): 1521-1528 (2003). Таким образом, блокирующие или нейтрализующие антитела к ANGPTL4 могут быть идентифицированы с использованием антител в комбинации с ANGPTL4 в анализах миграции опухолевых клеток и/или анализах ангиогенеза, например в анализе CAM. 5 (USBiological, 37K, Swampscott, Massachusetts) (см., например, фиг.13, панели B и C). Например, клетки рабдомиосаркомы A673 можно высевать и инкубировать с надосадком клеток COS7, трансдуцированных Ad-hAngptl4, вместе с анти-ANGPTL4-антителом или контрольным антителом или PBS. Через несколько дней клетки можно обработать трипсином и подсчитать. Антитела, которые уменьшают количества клеток, идентифицируют как блокирующие или нейтрализующие антитела. Также показано, что ANGPTL4 индуцирует миграцию опухолевых клеток и является проангиогенным фактором. См., например, Le Jan et al., American Journal of Pathology, 164(5): 1521-1528 (2003). Таким образом, блокирующие или нейтрализующие антитела к ANGPTL4 могут быть идентифицированы с использованием антител в комбинации с ANGPTL4 в анализах миграции опухолевых клеток и/или анализах ангиогенеза, например в анализе CAM.
Блокирующие или нейтрализующие антитела против ANGPTL4, которые могут быть использованы для блокирования или уменьшения роста опухоли или блокирования или уменьшения роста злокачественных клеток, также могут быть идентифицированы при использовании опухолевых клеток в культуре, как описано выше, и/или в исследованиях на мышах Beige/nude. Например, мышам nude можно инъецировать опухолевые клетки. В разные периоды времени после начала опухолевого роста мышам можно внутрибрюшинно инъецировать один или два раза в неделю различные дозы блокирующего или нейтрализующего антитела против ANGPTL4, контрольного антитела или PBS. Размер опухоли можно измерять каждую неделю и в заключение исследования опухоль можно вырезать и взвесить. В качестве блокирующих или нейтрализующих антител к ANGPTL4 идентифицируют антитела, которые блокируют или уменьшают рост опухолей у мышей.
Комбинации ANGPTL4-антител и антиангиогенного средства для блокирования или снижения роста опухоли или блокирования или снижения роста злокачественных клеток могут быть идентифицированы с использованием опухолевых клеток в культуре, как описано выше, и/или с помощью исследований на мышах Beige/nude. Как указано выше, мышам nude можно инъецировать опухолевые клетки. В разные периоды времени после начала опухолевого роста мышам можно внутрибрюшинно инъецировать один или два раза в неделю различные дозы комбинации антагониста ANGPTL4 и противоопухолевого средства, например антиангиогенного средства, такого как анти-VEGF-антитело, или антагониста ANGPTL4, или противоопухолевого средства, или контрольного антитела или PBS. Размер опухоли можно измерять каждую неделю и в заключение исследования опухоль можно вырезать и взвесить. Идентифицируют комбинированную терапию антагонистами ANGPTL4 и противоопухолевыми средствами, которая блокирует или уменьшает рост опухоли у мышей или которая сильнее блокирует или уменьшает рост опухоли по сравнению с контролем или по сравнению с одним средством, используемым отдельно.
Пример 6: Вариант ANGPTL4
Вариант ANGPTL4 получали, используя стандартный набор для мутагенеза (например, набор для сайт-специфичного мутагенеза QuikChange XL (Invitrogen, Carlsbad, California)), следуя протоколу производителя. Осуществляли две аминокислотных замены в последовательности ANGPTL4 человека (см., например, фиг.2). Получали замены в положении 162 и 164 (R162G и R164E), приводящие к замене RKR на GKE. Белок ANGPTL4 (L280-плазмида, а/к 1-406) или вариант ANGPTL4 выделяли из надосадка временно трансфицированных клеток COS-7. Для очистки надосадок наносили на колонку с никелем. Белок выявляли Вестерн-блот-анализом с помощью анти-FLAG-HRP-антитела. См. фиг.3 панель B. В том случае, когда получали замены и вариант ANGPTL4 сравнивали с нативным белком или белком ANGPTL4 дикого типа, обнаружили, что вариант ANGPTL4 имеет более высокую молекулярную массу, чем нативный ANGPTL4 при Вестерн-блоттинге. Замена RKR на GKE в положении 162 и 164 нативного белка предотвращала протеолитическое разрушение ANGPTL4.
Пример 7: ANGPTL4 связывает интегрин  V V 5 5
Ангиопоэтины являются секретируемыми факторами, которые регулируют ангиогенез в результате связывания со специфичным для эндотелиальных клеток тирозинкиназным рецептором Tie2 посредством фибриноген (FBN)-подобного домена. Обнаружено, что биспиральный домен, присутствующий в семействе секретируемых лигандов, необходим для олигомеризации лиганда (см., например, Procopio et al., J. Biol. Chem., 274: 30196-201 (1999)).
Подобно ангиопоэтинам, ANGPTL3 и ANGPTL4 являются секретируемыми гликопротеинами, каждый из которых состоит из N-концевого сигнального пептида, за которым следует биспиральный домен и C-концевой FBN-подобный домен. Было определено, что ANGPTL3 связывается с  V V 3 посредством FBN-подобного домена. Авторы определили, что ANGPTL4 связывается с 3 посредством FBN-подобного домена. Авторы определили, что ANGPTL4 связывается с  V V 5. Тестировали линию клеток 293-1953, которые стабильно трансфицированы интегрином 5. Тестировали линию клеток 293-1953, которые стабильно трансфицированы интегрином  V V 5, в отношение способности связываться или прилипать к планшетам, покрытым ANGPTL4. Клетки собирали и разбавляли до 105 клеток/мл в бессывороточной среде, содержащей PBS, 1% БСА, 1 мМ CaCl2 и 1 мМ MgCl2. Клетки предварительно инкубировали в присутствии или в отсутствие антител против интегрина 5, в отношение способности связываться или прилипать к планшетам, покрытым ANGPTL4. Клетки собирали и разбавляли до 105 клеток/мл в бессывороточной среде, содержащей PBS, 1% БСА, 1 мМ CaCl2 и 1 мМ MgCl2. Клетки предварительно инкубировали в присутствии или в отсутствие антител против интегрина  V V 5 (MAB1961 (Chemicon, Temecula, CA)) или пептидов в течение 15 минут при 37°C. Рекомбинантным mANGPTL4, БСА или витронектином (1 мкг, 3 мкг, 10 мкг или 30 мкг/мл) покрывали 96-луночные планшеты для микротитрования с плоским дном Nunc Maxisorp в течение ночи при 4°C и блокировали 200 мкл 3% БСА в фосфатно-солевом буфере (PBS), pH 7,4, в течение 1,5 часов при 37°C. Суспензии клеток (5×104 клеток/100 мкл/лунку (5×105/мл)) добавляли в покрытые лунки и планшеты инкубировали при 37°C в течение 5,5 часов. Неприкрепленные клетки удаляли промывками PBS и прикрепление клеток измеряли, добавляя 200 мкл красителя CyQuant GD (молекулярные зонды (Invitrogen detection Technologies (Carlsbad, California)) (1:400)/в буфере для лизиса клеток и инкубировали в течение 2-5 минут. Флуоресценцию образцов измеряли, используя возбуждение при 480 нм и максимум эмиссии при 520 нм. Можно использовать способ PNAG согласно Lanndegren (см., например, Landegren, J. Immunol. Methods, 67: 379-388 (1984)). Наблюдали прилипание клеток, экспрессирующих 5 (MAB1961 (Chemicon, Temecula, CA)) или пептидов в течение 15 минут при 37°C. Рекомбинантным mANGPTL4, БСА или витронектином (1 мкг, 3 мкг, 10 мкг или 30 мкг/мл) покрывали 96-луночные планшеты для микротитрования с плоским дном Nunc Maxisorp в течение ночи при 4°C и блокировали 200 мкл 3% БСА в фосфатно-солевом буфере (PBS), pH 7,4, в течение 1,5 часов при 37°C. Суспензии клеток (5×104 клеток/100 мкл/лунку (5×105/мл)) добавляли в покрытые лунки и планшеты инкубировали при 37°C в течение 5,5 часов. Неприкрепленные клетки удаляли промывками PBS и прикрепление клеток измеряли, добавляя 200 мкл красителя CyQuant GD (молекулярные зонды (Invitrogen detection Technologies (Carlsbad, California)) (1:400)/в буфере для лизиса клеток и инкубировали в течение 2-5 минут. Флуоресценцию образцов измеряли, используя возбуждение при 480 нм и максимум эмиссии при 520 нм. Можно использовать способ PNAG согласно Lanndegren (см., например, Landegren, J. Immunol. Methods, 67: 379-388 (1984)). Наблюдали прилипание клеток, экспрессирующих  V V 5, к ANGPTL4 и витронектину (USBiological, Swampscott, Massachusetts), позитивному контролю, по сравнению с БСА, негативным контролем. См. фиг.11. 5, к ANGPTL4 и витронектину (USBiological, Swampscott, Massachusetts), позитивному контролю, по сравнению с БСА, негативным контролем. См. фиг.11.
Чтобы определить является ли интегрин  V V 5 достаточным для того, чтобы опосредовать адгезию клеток к ANGPTL4, тестировали блокирующие антитела по их способности ингибировать адгезию в анализе адгезии клеток. Функциональные блокирующие антитела (анти- 5 достаточным для того, чтобы опосредовать адгезию клеток к ANGPTL4, тестировали блокирующие антитела по их способности ингибировать адгезию в анализе адгезии клеток. Функциональные блокирующие антитела (анти- V V 5-антитело (MAB1961 (Chemicon, Temecula, CA)) или анти-hANGPTL4-антитела) добавляли к клеткам 293-1953 перед инкубацией с покрытыми белком лунками (БСА (1), витронектин (2) или ANGPTL4(3)). См. фиг.12. Анти- 5-антитело (MAB1961 (Chemicon, Temecula, CA)) или анти-hANGPTL4-антитела) добавляли к клеткам 293-1953 перед инкубацией с покрытыми белком лунками (БСА (1), витронектин (2) или ANGPTL4(3)). См. фиг.12. Анти- V V 5-антитела и анти-ANGPTL4-антитела отменяли адгезионную активность клеток по отношению к ANGPTL4. 5-антитела и анти-ANGPTL4-антитела отменяли адгезионную активность клеток по отношению к ANGPTL4.
Осуществляли дополнительные эксперименты, чтобы подтвердить, что ANGPTL4 связывает  V V 5. Осуществляли эксперименты ELISA, чтобы выявить, связывается ли mANGPTL4, IgG-hANGPTL4-N-конец (1-183) и/или IgG-hANGPTL4-C-конец (184-406) с планшетами, покрытыми 5. Осуществляли эксперименты ELISA, чтобы выявить, связывается ли mANGPTL4, IgG-hANGPTL4-N-конец (1-183) и/или IgG-hANGPTL4-C-конец (184-406) с планшетами, покрытыми  V V 5 (USBiological, 37K, Swampscott, Massachusetts). 100 мкл/лунку интегрина 5 (USBiological, 37K, Swampscott, Massachusetts). 100 мкл/лунку интегрина  V V 5, разбавленного буфером для покрывания (1 мкг/мл буфера для покрывания (50 мМ карбонат/бикарбонат, pH 9,6)), инкубировали в течение ночи при 4°C. Планшеты три раза промывали буфером для промывки (PBS, pH 7,4, 0,05% твин-20) и добавляли 100 мкл/лунку блокирующего буфера (PBS, pH 7,4, 0,5% БСА) на 1 час при комнатной температуре и осторожном встряхивании. Различные количества (0, 0,070 мкг, 0,22 мкг, 0,66 мкг, 2 мкг или 6 мкг) образцов mANGPTL4, IgG-hANGPTL4-N-конец (1-183) и/или IgG-hANGPTL4-C-конец (184-406) готовили в буфере для образцов (0,5% БСА, 50 мМ трис, pH 7,4, 0,05% твин-20, 1 мМ MnCl2, 50 мкМ CaCl2, 50 мкМ MgCl2, 100 мМ NaCl) и инкубировали в течение 30 минут. В планшеты добавляли образцы (100 мкл/лунку в количествах, указанных выше) и инкубировали в течение 2 часов при комнатной температуре и осторожном встряхивании. Планшеты промывали буфером и добавляли 100 мкл/лунку конъюгата антитело против Flag-пероксидаза хрена (HRP) (100 нг/мл) (Jackson 5, разбавленного буфером для покрывания (1 мкг/мл буфера для покрывания (50 мМ карбонат/бикарбонат, pH 9,6)), инкубировали в течение ночи при 4°C. Планшеты три раза промывали буфером для промывки (PBS, pH 7,4, 0,05% твин-20) и добавляли 100 мкл/лунку блокирующего буфера (PBS, pH 7,4, 0,5% БСА) на 1 час при комнатной температуре и осторожном встряхивании. Различные количества (0, 0,070 мкг, 0,22 мкг, 0,66 мкг, 2 мкг или 6 мкг) образцов mANGPTL4, IgG-hANGPTL4-N-конец (1-183) и/или IgG-hANGPTL4-C-конец (184-406) готовили в буфере для образцов (0,5% БСА, 50 мМ трис, pH 7,4, 0,05% твин-20, 1 мМ MnCl2, 50 мкМ CaCl2, 50 мкМ MgCl2, 100 мМ NaCl) и инкубировали в течение 30 минут. В планшеты добавляли образцы (100 мкл/лунку в количествах, указанных выше) и инкубировали в течение 2 часов при комнатной температуре и осторожном встряхивании. Планшеты промывали буфером и добавляли 100 мкл/лунку конъюгата антитело против Flag-пероксидаза хрена (HRP) (100 нг/мл) (Jackson  109-036-098) в буфере для анализа (PBS, pH 7,4, 0,5% БСА, 0,05% твин-20) и инкубировали в течение 1 часа при комнатной температуре и осторожном встряхивании. Планшеты промывали. Добавляли 100 мкл/лунку тетраметилбензидина (TMB) (Moss, Inc.) и инкубировали в планшетах до развития хорошей окраски при комнатной температуре. Добавляли 100 мкл/лунку стоп-раствора (1 М H3PO4), чтобы остановить реакцию. Планшеты регистрировали при 630 нм. mANGPTL4, IgG-hANGPTL4-N-конец и IgG-hANGPTL4-C-конец связывались с покрытыми 109-036-098) в буфере для анализа (PBS, pH 7,4, 0,5% БСА, 0,05% твин-20) и инкубировали в течение 1 часа при комнатной температуре и осторожном встряхивании. Планшеты промывали. Добавляли 100 мкл/лунку тетраметилбензидина (TMB) (Moss, Inc.) и инкубировали в планшетах до развития хорошей окраски при комнатной температуре. Добавляли 100 мкл/лунку стоп-раствора (1 М H3PO4), чтобы остановить реакцию. Планшеты регистрировали при 630 нм. mANGPTL4, IgG-hANGPTL4-N-конец и IgG-hANGPTL4-C-конец связывались с покрытыми  V V 5 планшетами, при этом немного больше белка IgG-hANGPTL4-C-конец было связано с планшетами. См. фиг.13, панель A. 5 планшетами, при этом немного больше белка IgG-hANGPTL4-C-конец было связано с планшетами. См. фиг.13, панель A.
Анти-ANGPTL4-антитела ингибируют связывание ANGPTL4 с покрытыми  V V 5 планшетами. Осуществляли эксперименты ELISA. 100 мкл/лунку интегрина 5 планшетами. Осуществляли эксперименты ELISA. 100 мкл/лунку интегрина  V V 5, разбавленного буфером для покрывания (1 мкг/мл буфера для покрывания (50 мМ карбонат/бикарбонат, pH 9,6)), инкубировали в течение ночи при 4°C. Планшеты три раза промывали буфером для промывки (PBS, pH 7,4, 0,05% твин-20) и добавляли 100 мкл/лунку блокирующего буфера (PBS, pH 7,4, 0,5% БСА) на 1 час при комнатной температуре и осторожном встряхивании. От 0,6 мкг до 6,0 мкг образцов, mANGPTL4, IgG-hANGPTL4-N-конец (1-183) и/или IgG-hANGPTL4-C-конец (183-406) в буфере для образцов (0,5% БСА, 50 мМ трис, pH 7,4, 0,05% твин-20, 1 мМ MnCl2, 50 мкМ CaCl2, 50 мкМ MgCl2, 100 мМ NaCl) инкубировали с анти-ANGPTL4-антителами (1,5 мкг) или анти-Dscr (1,5 мкг) в течение 30 минут. После инкубации 100 мкл/лунку образца +/- антитело инкубировали в планшетах в течение 2 часов при комнатной температуре и осторожном встряхивании. Планшеты промывали буфером и добавляли 100 мкл/лунку анти-Flag-HRP (100 нг/мл) в буфере для анализа (PBS, pH 7,4, 0,5% БСА, 0,05% Твин-20) и инкубировали в течение 1 часа при комнатной температуре и осторожном встряхивании. Планшеты промывали и добавляли 100 мкл/лунку TMB и инкубировали в планшетах вплоть до развития хорошей окраски при комнатной температуре. Добавляли 100 мкл/лунку стоп-раствора (1 М H3PO4), чтобы остановить реакцию. Планшеты регистрировали при 630 нм. Анти-ANGPTL4-антитела уменьшали количество mANGPTL4, IgG-hANGPTL4-N-конец и IgG-hANGPTL4-C-конец, связывающегося с покрытыми 5, разбавленного буфером для покрывания (1 мкг/мл буфера для покрывания (50 мМ карбонат/бикарбонат, pH 9,6)), инкубировали в течение ночи при 4°C. Планшеты три раза промывали буфером для промывки (PBS, pH 7,4, 0,05% твин-20) и добавляли 100 мкл/лунку блокирующего буфера (PBS, pH 7,4, 0,5% БСА) на 1 час при комнатной температуре и осторожном встряхивании. От 0,6 мкг до 6,0 мкг образцов, mANGPTL4, IgG-hANGPTL4-N-конец (1-183) и/или IgG-hANGPTL4-C-конец (183-406) в буфере для образцов (0,5% БСА, 50 мМ трис, pH 7,4, 0,05% твин-20, 1 мМ MnCl2, 50 мкМ CaCl2, 50 мкМ MgCl2, 100 мМ NaCl) инкубировали с анти-ANGPTL4-антителами (1,5 мкг) или анти-Dscr (1,5 мкг) в течение 30 минут. После инкубации 100 мкл/лунку образца +/- антитело инкубировали в планшетах в течение 2 часов при комнатной температуре и осторожном встряхивании. Планшеты промывали буфером и добавляли 100 мкл/лунку анти-Flag-HRP (100 нг/мл) в буфере для анализа (PBS, pH 7,4, 0,5% БСА, 0,05% Твин-20) и инкубировали в течение 1 часа при комнатной температуре и осторожном встряхивании. Планшеты промывали и добавляли 100 мкл/лунку TMB и инкубировали в планшетах вплоть до развития хорошей окраски при комнатной температуре. Добавляли 100 мкл/лунку стоп-раствора (1 М H3PO4), чтобы остановить реакцию. Планшеты регистрировали при 630 нм. Анти-ANGPTL4-антитела уменьшали количество mANGPTL4, IgG-hANGPTL4-N-конец и IgG-hANGPTL4-C-конец, связывающегося с покрытыми  V V 5 планшетами, по сравнению с анти-Dscr-антителом, моноклональным антителом 5G7 или средой. См. фиг.13, панель B. 5 планшетами, по сравнению с анти-Dscr-антителом, моноклональным антителом 5G7 или средой. См. фиг.13, панель B.
В другом эксперименте связывание ANGPTL4 и интегрина  V V 5 было показано с помощью ELISA. В таком эксперименте в планшеты добавляли 80 мкл/лунку C-концевого hANGPTL4, витронектина или БСА (5 мкг/мл) в буфере для покрывания (50 мМ карбонат/бикарбонат, pH 9,6) и инкубировали в течение ночи при 4°C. Планшеты промывали (буфер для промывки: PBS, pH 7,4, 0,05% твин-20) и добавляли 100 мкл/лунку блокирующего буфера (PBS, pH 7,4, 0,5% БСА) либо со средой, либо с анти-hANGPTL4-антителами (15 мкг/100 мкл), либо с анти-Dscr-антителами (15 мкг/100 мкл) и инкубировали в течение 1 часа при комнатной температуре и осторожном встряхивании. Планшеты промывали и добавляли 100 мкл (3-9 мкг/мл) 5 было показано с помощью ELISA. В таком эксперименте в планшеты добавляли 80 мкл/лунку C-концевого hANGPTL4, витронектина или БСА (5 мкг/мл) в буфере для покрывания (50 мМ карбонат/бикарбонат, pH 9,6) и инкубировали в течение ночи при 4°C. Планшеты промывали (буфер для промывки: PBS, pH 7,4, 0,05% твин-20) и добавляли 100 мкл/лунку блокирующего буфера (PBS, pH 7,4, 0,5% БСА) либо со средой, либо с анти-hANGPTL4-антителами (15 мкг/100 мкл), либо с анти-Dscr-антителами (15 мкг/100 мкл) и инкубировали в течение 1 часа при комнатной температуре и осторожном встряхивании. Планшеты промывали и добавляли 100 мкл (3-9 мкг/мл)  V V 5 и инкубировали в течение 2 часов при комнатной температуре и осторожном встряхивании. Планшеты промывали и добавляли 1 мкг/мл (1:1000) анти- 5 и инкубировали в течение 2 часов при комнатной температуре и осторожном встряхивании. Планшеты промывали и добавляли 1 мкг/мл (1:1000) анти- V V 5-антитела (Chemicon) (5 мкг/100 мкл) в буфере для анализа (PBS, pH7,4, 0,5% БСА, 0,05% твин-20) и инкубировали в течение 1 часа при комнатной температуре и осторожном встряхивании. После инкубации планшеты промывали и добавляли 100 мкл/лунку конъюгированного с пероксидазой хрена (HRP) антимышиного антитела (1:5000) в буфере для анализа. Планшеты промывали и добавляли 100 мкл/лунку тетраметилбензидина (TMB) и инкубировали при комнатной температуре вплоть до развития хорошей окраски. Реакцию останавливали добавлением 100 мкл/лунку 1 М H3PO4 и планшеты регистрировали при 630 нм. 5-антитела (Chemicon) (5 мкг/100 мкл) в буфере для анализа (PBS, pH7,4, 0,5% БСА, 0,05% твин-20) и инкубировали в течение 1 часа при комнатной температуре и осторожном встряхивании. После инкубации планшеты промывали и добавляли 100 мкл/лунку конъюгированного с пероксидазой хрена (HRP) антимышиного антитела (1:5000) в буфере для анализа. Планшеты промывали и добавляли 100 мкл/лунку тетраметилбензидина (TMB) и инкубировали при комнатной температуре вплоть до развития хорошей окраски. Реакцию останавливали добавлением 100 мкл/лунку 1 М H3PO4 и планшеты регистрировали при 630 нм.  V V 5 связывается с планшетами, покрытыми ANGPTL4 (дорожка 1) и витронектином (дорожка 4). Связывание блокируется анти-ANGPTL4-антителами (дорожка 2), но не блокируется при использовании контрольного анти-Dscr-антитела (дорожка 3) или в том случае, когда планшеты покрывают контрольным белком (дорожка 5). См. фиг.13, панель C. 5 связывается с планшетами, покрытыми ANGPTL4 (дорожка 1) и витронектином (дорожка 4). Связывание блокируется анти-ANGPTL4-антителами (дорожка 2), но не блокируется при использовании контрольного анти-Dscr-антитела (дорожка 3) или в том случае, когда планшеты покрывают контрольным белком (дорожка 5). См. фиг.13, панель C.
Следовательно, полученные данные свидетельствуют, что рекомбинантный ANGPTL4 специфично связывается с интегрином  V V 5. 5.
Предполагается, что описание является достаточным, чтобы дать возможность специалисту в данной области практически осуществить изобретение. Понятно, что примеры и варианты осуществления изобретения, описанные в данной публикации, предназначены только для иллюстративных целей. Объем изобретения не ограничен депонированной конструкцией, так как депонированный вариант рассматривается в качестве одной иллюстрации некоторых аспектов изобретения, и любые конструкции, которые являются функционально эквивалентными, входят в объем изобретения. Депозит материала согласно изобретению не является признанием того, что описание является неадекватным, чтобы обеспечить возможность практического осуществления какого-либо аспекта изобретения, включая его наилучший способ, и не рассматривается как ограничивающий объем формулы изобретения конкретными иллюстрациями, которые он представляет. Действительно, различные модификации изобретения в дополнение к модификациям, показанным и описанным в данной публикации, будут очевидны для специалистов в данной области на основании приведенного выше описания, и они входят в объем прилагаемой формулы изобретения. Все публикации, патенты и заявки на выдачу патента, цитированные в данном описании, включены в данное описание в виде ссылки в полном объеме для всех целей.
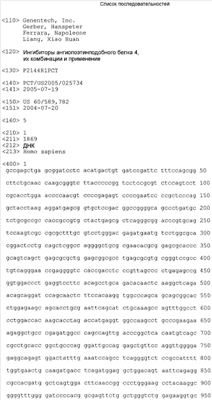   
Формула изобретения
1. Способ блокирования или уменьшения роста опухоли или роста злокачественной клетки, где указанный способ включает
a) введение в опухоль или злокачественную клетку эффективного количества антагониста фактора роста эндотелиальных клеток сосудов (VEGF) и
b) введение в опухоль или злокачественную клетку эффективного количества антагониста ангиопоэтинподобного белка 4 (ANGPTL4).
2. Способ по п.1, в котором антагонист VEGF представляет собой анти-VEGF-антитело.
3. Способ по п.2, в котором анти-VEGF-антитело является гуманизированным антителом А4.6.1.
4. Способ по п.1, в котором антагонистом ANGPTL4 является анти-ANGPTL4-антитело.
5. Способ по п.4, в котором анти-ANGPTL4-антитело связывается с аминокислотными остатками 184-406 SEQ ID NO: 2.
6. Способ по п.1, в котором антагонистом ANGPTL4 является анти- v v 5-антитело. 5-антитело.
7. Способ по п.2, 4 или 6, в котором антитело является гуманизированным антителом.
8. Способ по п.1, в котором антагонист ANGPTL4 содержит молекулу миРНК.
9. Способ по п.8, в котором молекула миРНК представляет собой молекулу ANGPTL4-миРНК.
10. Способ по п.9, в котором мишенью молекулы ANGPTL4-миРНК является последовательность ДНК нуклеиновой кислоты, кодирующей ANGPTL4, при этом последовательность ДНК содержит, по меньшей мере, GTGGCCAAGCCTGCCCGAAGA (SEQ ID NO: 3).
11. Способ по п.1, дополнительно включающий в себя введение в опухоль или злокачественную клетку третьего противоопухолевого средства.
12. Способ по п.11, в котором третьим противоопухолевым средством является химиотерапевтическое средство.
13. Способ по п.11, в котором третьим противоопухолевым средством является другой ингибитор ангиогенеза.
14. Способ по п.1, в котором стадии введения (а) и (b) осуществляют последовательно.
15. Способ по п.1, в котором стадии введения (а) и (b) осуществляют одновременно.
16. Способ по п.1, в котором стадии введения (а) и (b) осуществляют и последовательно и одновременно.
17. Способ по п.1, в котором стадии введения осуществляют в любом порядке.
18. Способ по п.1, в котором опухоль или злокачественная клетка находятся в организме субъекта.
19. Способ по п.18, в котором субъектом является человек.
20. Способ по п.18, в котором у субъекта имеется рецидивирующий опухолевый рост или рецидивирующий рост злокачественных клеток.
21. Способ блокирования или уменьшения роста опухоли или роста злокачественной клетки у субъекта, где указанный способ включает введение субъекту комбинированной композиции, содержащей эффективное количество антиангиогенного средства и эффективное количество антагониста ангиопоэтинподобного белка 4 (ANGPTL4).
22. Способ по п.21, дополнительно включающий введение дополнительного средства, где дополнительное средство представляет собой противоопухолевое средство.
23. Способ блокирования или уменьшения рецидивирующего опухолевого роста или рецидивирующего роста злокачественных клеток у субъекта, где способ включает введение субъекту эффективного количества антагониста ангиопоэтинподобного белка 4 (ANGPTL4), при этом указанного субъекта подвергали или он одновременно подвергается терапии по поводу злокачественной опухоли противоопухолевым средством.
24. Способ по п.23, в котором противоопухолевое средство представляет собой одно или несколько химиотерапевтических средств.
25. Способ по п.23, в котором противоопухолевое средство содержит антиангиогенное средство.
26. Способ по п.25, в котором антиангиогенное средство содержит анти-VEGF-ингибитор.
27. Способ по п.26, в котором анти-VEGF-ингибитор представляет собой анти-VEGF-антитело.
28. Способ по п.27, в котором анти-VEGF-антителом является гуманизированное антитело А4.6.1.
29. Способ по п.23, в котором антагонистом ANGPTL4 является анти-ANGPTL4-антитело.
30. Способ по п.23, в котором антагонистом ANGPTL4 является анти- v v 5-антитело. 5-антитело.
31. Способ по п.27, 29 или 30, в котором антитело является гуманизированным антителом.
32. Способ по п.23, в котором антагонист ANGPTL4 содержит молекулу миРНК.
33. Способ по п.32, в котором молекула миРНК представляет собой молекулу ANGPTL4-миРНК.
34. Способ по п.33, в котором мишенью молекулы ANGPTL4-миРНК является последовательность ДНК нуклеиновой кислоты, кодирующей ANGPTL4, при этом последовательность ДНК содержит, по меньшей мере, последовательность GTGGCCAAGCCTGCCCGAAGA (SEQ ID NO: 3).
35. Способ по п.23, дополнительно включающий введение дополнительного средства, где дополнительным средством является противоопухолевое средство.
36. Способ блокирования или уменьшения роста опухоли или роста злокачественной клетки, где способ включает введение в опухоль или злокачественную клетку эффективного количества антагониста ангиопоэтинподобного белка 4 (ANGPTL4), при этом антагонистом ANGPTL4 является антитело, которое связывается с аминокислотными остатками 184-406 SEQ ID NO: 2.
37. Композиция для блокирования или уменьшения роста опухоли или роста злокачественной клетки, содержащая антитело, которое связывается с аминокислотными остатками 184-406 SEQ ID NO: 2, и антагонист VEGF.
38. Композиция для блокирования или уменьшения роста опухоли или роста злокачественной клетки, содержащая молекулу ANGPTL4-миРНК, где мишенью молекулы ANGPTL4-миРНК является последовательность ДНК нуклеиновой кислоты, кодирующей ANGPTL4, и указанная последовательность ДНК содержит, по меньшей мере, последовательность GTGGCCAAGCCTGCCCGAAGA (SEQ ID NO: 3).
39. Набор для блокирования или уменьшения роста опухоли или роста злокачественной клетки, содержащий первое количество антиангиогенного средства, второе количество антагониста ангиопоэтинподобного белка 4 (ANGPTL4) и фармацевтически приемлемый носитель, наполнитель или разбавитель и упаковку.
40. Набор для блокирования или уменьшения роста опухоли или роста злокачественной клетки, содержащий некоторое количество антиангиогенного средства и фармацевтически приемлемый носитель, наполнитель или разбавитель в первой единичной дозированной форме; некоторое количество антагониста ангиопоэтинподобного белка 4 (ANGPTL4) и фармацевтически приемлемый носитель, наполнитель или разбавитель во второй единичной дозированной форме; и упаковку.
РИСУНКИ
|
|