|
|
(21), (22) Заявка: 2008129203/15, 15.01.2007
(24) Дата начала отсчета срока действия патента:
15.01.2007
(30) Конвенционный приоритет:
26.01.2006 US 60/762,279
20.06.2006 US 60/814,984
(43) Дата публикации заявки: 10.03.2010
(46) Опубликовано: 27.06.2010
(56) Список документов, цитированных в отчете о
поиске:
US 6,290,971 B1, 18.09.2001. WO 98/48836 (A1), 05.11.1998. Химическая энциклопедия./Под ред. Н.С.Зефирова, т.4. – М.: Большая российская энциклопедия, 1995.
(85) Дата перевода заявки PCT на национальную фазу:
26.08.2008
(86) Заявка PCT:
IB 2007/000258 20070115
(87) Публикация PCT:
WO 2007/085962 20070802
Адрес для переписки:
191036, Санкт-Петербург, а/я 24, “НЕВИНПАТ”, А.В.Поликарпову
|
(72) Автор(ы):
ДОМИНОУСКИ Пол Джосеф (US),
МЭННАН Рамасами Мэннар (US),
МЕДИРАТТА Санджита (US)
(73) Патентообладатель(и):
Пфайзер Продактс Инк. (US)
|
(54) НОВЫЕ ГЛИКОЛИПИДНЫЕ АДЪЮВАНТНЫЕ КОМПОЗИЦИИ
(57) Реферат:
Изобретение относится к медицине и касается композиции и способа изготовления стабильных исходных адъювантных растворов, содержащих гликолипиды, слабые кислоты, спирты, неионные поверхностно-активные вещества и буферы. Изобретение обеспечивает улучшенную стабильность адъювантной гликолипидной композиции. 5 н. и 10 з.п. ф-лы, 16 табл.
Настоящее изобретение относится к новым композициям гликолипидных адъювантов, способам их применения и их приготовлению. Новые композиции по настоящему изобретению стабильны в течение длительного периода времени без флокуляции. Они особенно полезны при доставке различных лекарственных средств, включая вакцины.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Обычно вакцины используют для защиты людей и домашних животных от инфекционных заболеваний, вызываемых бактериями, вирусами и микроорганизмами-паразитами. Применяемые в вакцинах антигены могут представлять собой любую разновидность агентов, но обычно состоят из убитых патогенных микроорганизмов, патогенных микроорганизмов, остающихся живыми, но которые модифицированы или аттенуированы, белков, рекомбинантных белков или их фрагментов. Каков бы ни был источник антигена, зачастую необходимо добавить адъювант, чтобы усилить иммунный ответ реципиента на антиген.
Адъюванты используют для достижения двух целей: они замедляют высвобождение антигенов из места инъекции и стимулируют иммунную систему.
Первым адъювантом, о котором сообщалось в литературе, был полный адъювант Фрейнда (FCA). FCA содержит эмульсию типа вода-в-масле и экстракты микобактерии. Микобактериальные экстракты являются источником иммуностимулирующих молекул в неочищенной форме. Эмульсия типа вода – в – масле действует, создавая эффект депо, из которого антигены медленно высвобождаются. К сожалению, FCA обладает плохой переносимостью и может вызывать неконтролируемое воспаление. С момента открытия FCA, свыше 80 лет назад, предпринимаются попытки уменьшения нежелательных побочных эффектов адъювантов.
В настоящее время известны гликолипидные аналоги, включающие новый класс соединений, имеющих адъювантные свойства. В патенте США  4855283 (далее 4855283 (далее  283) раскрыт синтез гликолипидных аналогов, включая N-гликозиламиды, N-гликозилмочевины, N-гликозилкарбаматы и, конкретно, ацетат N-(2-дезокси-2-L-лейциламино- 283) раскрыт синтез гликолипидных аналогов, включая N-гликозиламиды, N-гликозилмочевины, N-гликозилкарбаматы и, конкретно, ацетат N-(2-дезокси-2-L-лейциламино- -D-глюкопиранозил)-N-октадецил- додеканамида (известный как Bay R1005, О Lockhoff, Angew. Chem. Int. Ed. Engl. (1991) 30: 1611-1620). Соединения, описанные в патенте 283, особенно подходят для применения в качестве адъювантов. -D-глюкопиранозил)-N-октадецил- додеканамида (известный как Bay R1005, О Lockhoff, Angew. Chem. Int. Ed. Engl. (1991) 30: 1611-1620). Соединения, описанные в патенте 283, особенно подходят для применения в качестве адъювантов.
Необходимо, чтобы приготовление гликолипидных адъювантных композиций не вызывало затруднения и чтобы они были стабильны при хранении в течение продолжительных периодов времени без флокуляции липидного компонента. Неацетатные формы гликолипидамидов или гликозиламидов в значительной мере нерастворимы и обычно флокулируют из раствора при хранении их как при комнатной температуре, так и при более низких температурах.
Растворы и адъюванты, содержащие гликозиламиды, предложенные в данном описании, демонстрируют низкую степень флокуляции и совершенно стабильны. Их приготовление не вызывает затруднения, и они могут быть получены в промышленном масштабе. Жидкие гликолипидные адъювантные композиции можно использовать в качестве разбавителя для повторного гидратирования лиофилизированного антигенного препарата. Также предложены способы тестирования стабильности этих композиций в реальном времени с использованием протоколов ускоренного тестирования стабильности.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Данное изобретение включает композицию и способ получения или приготовления как исходного раствора гликозиламида, так и раствора гликолипидного адъюванта. Исходный раствор гликозиламида приготавливают путем растворения гликолипида формулы I в спирте и комбинирования его с соответствующим количеством слабой кислоты и “неионным” поверхностно-активным веществом. Слабую кислоту добавляют к спиртовому раствору гликолипида в молярном избытке слабой кислоты по отношению к гликолипиду. В одном воплощении гликолипид представляет собой гидроацетат N-(2-дезокси-2-L-лейциламино- -D-глюкопиранозил)-N-октадецилдодеканоиламида. В одном воплощении спиртом является этанол. В одном воплощении слабой кислотой является уксусная кислота. В одном воплощении неионные поверхностно-активные вещества представляют собой различные сорбитаны (Span®) или полиоксиэтиленсорбитаны (Tween®), в частности монолауратсорбитаны (Span 20®) и монолауратполиоксиэтиленсорбитаны (Tween 20®). Раствор гликолипидного адъюванта приготавливают путем введения соответствующего количества исходного раствора гликозиламида в “подходящий буфер”. pH описанных в данном изобретении конечных стабильных растворов гликолипидного адъюванта должен составлять от приблизительно 6 до приблизительно 8. Предпочтительно, когда конечный pH составляет от приблизительно 6 до приблизительно 7. Описан конечный pH от приблизительно 6, 3 до приблизительно 6, 4. В растворе гликолипидного адъюванта следует избегать высоких концентраций солей, превышающих 30 мМ NaCI. -D-глюкопиранозил)-N-октадецилдодеканоиламида. В одном воплощении спиртом является этанол. В одном воплощении слабой кислотой является уксусная кислота. В одном воплощении неионные поверхностно-активные вещества представляют собой различные сорбитаны (Span®) или полиоксиэтиленсорбитаны (Tween®), в частности монолауратсорбитаны (Span 20®) и монолауратполиоксиэтиленсорбитаны (Tween 20®). Раствор гликолипидного адъюванта приготавливают путем введения соответствующего количества исходного раствора гликозиламида в “подходящий буфер”. pH описанных в данном изобретении конечных стабильных растворов гликолипидного адъюванта должен составлять от приблизительно 6 до приблизительно 8. Предпочтительно, когда конечный pH составляет от приблизительно 6 до приблизительно 7. Описан конечный pH от приблизительно 6, 3 до приблизительно 6, 4. В растворе гликолипидного адъюванта следует избегать высоких концентраций солей, превышающих 30 мМ NaCI.
Более подробное описание этих двух растворов проиллюстрировано ниже.
Исходный раствор гликозиламида представляет собой композицию, содержащую
а) гликолипид формулы I:
где формула I представляет собой
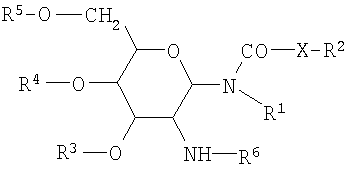
где R1 представляет собой водород или насыщенный алкильный радикал, имеющий до 20 атомов углерода включительно;
X представляет собой -СН2-, -О- или -NH-;
R2 представляет собой водород или насыщенный алкильный радикал, имеющий до 20 атомов углерода включительно;
R3, R4 и R5 независимо представляют собой водород, -SO4 2-, -РО4 2-, -РО4 2-, -СОС1-10алкил; 2-, -СОС1-10алкил;
R6 представляет собой L-аланил, L-альфа-аминобутил, L-аргинил, L-аспарагинил, L-аспартил, L-цистеинил, L-глутамил, L-глицил, L-гистидил, L-гидроксипропил, L-изолейцил, L-лейцил, L-лизил, L-метионил, L-орнитинил, L-фенилаланил, L-пролил, L-серил, L-треонил, L-тирозил, L-триптофанил и L-валил или их D-изомеры;
в форме соли, которая образована со слабой кислотой;
б) спирт, который представляет собой HO-C1-3алкил;
в) слабую кислоту, которая 1) присутствует в молярном избытке по отношению к содержанию гликолипида и 2) представляет собой любую кислоту, имеющую величину рКа от приблизительно 1,0 до приблизительно 9,5 согласно стандартным таблицам или величинам; и
г) неионное поверхностно-активное вещество, которое представляет собой агент, уменьшающий поверхностное натяжение вещества, в котором он растворен, и содержащий один компонент, который является гидрофобным, и другой компонент, который является гидрофильным.
Раствор гликолипидного адъюванта представляет собой композицию, содержащую:
а) исходный раствор гликозиламида; и
б) подходящий буфер, который представляет собой буфер, приемлемый для применения в ветеринарии или медицине, и может поддерживать относительно постоянный pH в водном растворе от приблизительно 6,0 до приблизительно 8,0.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если не установлено иное, следующие далее термины, используемые в описании и формуле изобретения, имеют значения, приведенные ниже.
Термин “спирт” относится к соединению формулы: HO-C1-3алкил. Им может быть метанол, этанол или пропанол в любой форме, например н-пропанол или изопропанол. Этанол предпочтителен.
Термин “алкил” относится как к прямым, так и разветвленным насыщенным углеводородным группировкам.
Термин “гликолипиды” относится к приведенным ниже соединениям формулы I. Эти соединения описаны в патенте США 6290971 и патенте США  4855283, опубликованном 8 августа 1989 года. И патент США 6290971, и патент США 4855283, опубликованном 8 августа 1989 года. И патент США 6290971, и патент США  4855283 тем самым включены во всей своей полноте посредством ссылки. Гликолипид, в частности описанный в данном изобретении, когда он находится в своей ацетатной форме, имеет торговое название Bay R1005® и химическое название “ацетат N-(2-дезокси-2-L-лейциламино- 4855283 тем самым включены во всей своей полноте посредством ссылки. Гликолипид, в частности описанный в данном изобретении, когда он находится в своей ацетатной форме, имеет торговое название Bay R1005® и химическое название “ацетат N-(2-дезокси-2-L-лейциламино- -D-глюкопиранозил)-N-октадецилдодеканамида”. Амидная форма этого соединения имеет торговое название Bay 15-1583® и химическое название “N-(2-дезокси-2-1-лейциламино- -D-глюкопиранозил)-N-октадецилдодеканамида”. Амидная форма этого соединения имеет торговое название Bay 15-1583® и химическое название “N-(2-дезокси-2-1-лейциламино- -D-глюкопиранозил)-N-октадецилдодеканамид”. -D-глюкопиранозил)-N-октадецилдодеканамид”.
Гликолипиды формулы I представляют собой:

где R1 представляет собой водород или насыщенный алкильный радикал, имеющий до 20 атомов углерода включительно;
X представляет собой -СН2-, -О- или -NH-;
R2 представляет собой водород или насыщенный алкильный радикал, имеющий до 20 атомов углерода включительно;
R3, R4 и R5 независимо представляют собой водород, -SO4 2-, -PO4 2-, -PO4 2- или -СОС1-10алкил; 2- или -СОС1-10алкил;
R6 представляет собой L-аланил, L-альфа-аминобутил, L-аргинил, L-аспарагинил, L-аспартил, L-цистеинил, L-глутамил, L-глицил, L-гистидил, L-гидроксипропил, L-изолейцил, L-лейцил, L-лизил, L-метионил, L-орнитинил, L-фенилаланил, L-пролил, L-серил, L-треонил, L-тирозил, L-триптофанил и L-валил или их D-изомеры;
или их фармацевтически приемлемую соль.
Другое конкретное воплощение описывает гликолипиды формулы I,
где R1 представляет собой водород или насыщенный С12-18алкил;
R2 представляет собой водород или насыщенный С7-11алкил;
X представляет собой -СН2-;
R4 и R5 независимо представляют собой водород;
R6 выбран из L-лейцила.
Переменные для формулы I являются индивидуальными и независимыми, и в данном изобретении описаны и заявлены все комбинации переменных.
В другом воплощении гликолипидами являются гликолипиды, описанные формулой II(a):
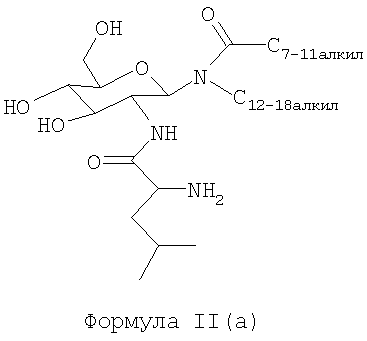
В другом воплощении гликолипидами являются гликолипиды, описанные формулой II(b):
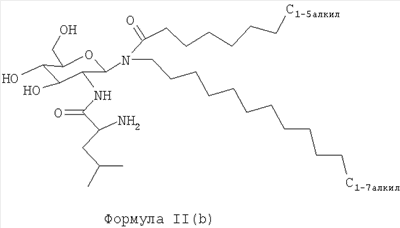
В другом воплощении гликолипиды имеют структуру формулы III:
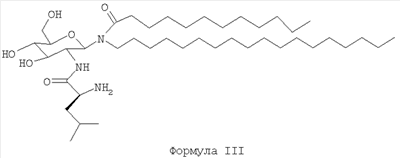
Соединение формулы III может существовать либо в амидной форме, либо в ацетатной форме. Амидная форма этого соединения имеет торговое название Bay 15-1583®. Ацетатная форма имеет торговое название Bay R1005®.
Гликолипиды формулы I могут быть приготовлены с использованием следующих далее методик, взятых из патента США  4855283. 4855283.
Как можно видеть из формулы I, основой соединений по изобретению является замещенная 2-амино-2-дезоксигексоза. Эти сахара всегда соединены N-гликозидной связью через С-1, аномерный атом углерода, с группой ациламидо, карбамида или алкоксикарбониламидо,

имеющей упомянутые выше значения для R1, R2 и X.
2-Аминогруппа аминосахаров в соединениях формулы I по изобретению соединена амидной связью с  -аминокислотой или производным -аминокислотой или производным  -аминокислоты. -аминокислоты.
Аминокислоты представляют собой природные L-аминокислоты, такие как глицин, саркозин, гиппуровая кислота, аланин, валин, лейцин, изолейцин, серии, треонин, цистеин, метионин, орнитин, цитруллин, аргинин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, фенилаланин, тирозин, пролин, триптофан и гистидин. Также описаны D-аминокислоты, такие как D-аланин, или аминокарбоновые кислоты, такие как альфа-аминомасляная кислота,  -аминовалериановая кислота, -аминовалериановая кислота,  -аминокапроновая кислота или -аминокапроновая кислота или  -аминогептановая кислота как в D-, так и в L-форме, чтобы действовать в качестве заместителя на аминосахаре. -аминогептановая кислота как в D-, так и в L-форме, чтобы действовать в качестве заместителя на аминосахаре.
Также предложены способы получения соединений, соответствующих формуле I. Порядок их осуществления начинается с производного 2-амино-2-дезоксигликопиранозы (формула IV), защищенного по аминогруппе,

в котором R10 представляет собой защитную группу для защиты аминогрупп, известную из синтеза пептидов, и которая может, если это целесообразно, быть избирательно удалена.
Примерами подходящих защитных групп являются ацильные группы, такие как трифторацетильная или трихлорацетильная, о-нитрофенилсульфенильные, 2,4-динитрофенилсульфенильные или возможно замещенные низшие алкоксикарбонильные группы, такие как метоксикарбонильные, трет-бутилоксикарбонильные, бензилоксикарбонильные, п-метоксибензилоксикарбонильные или 2,2,2-трихлорэтоксикарбонильные группы. Известны подходящие N-защищенные аминогексозные производные. Например, M.Bergmann and L.Zervas, Ber. 64, 975 (1931); D.Horton, J. Org. Chem. 29, 1776 (1964); P.H.Gross and R.W.Jeanloz, J. Org. Chem. 32, 2759 (1967); M.L.Wolfram and H.B.Bhat, J. Org. Chem. 32, 1821 (1967); в общем случае: J.F.W.McOmie (Editor). Prot. groups. Org. Chem., Plenum Press (1973); Geiger в “The Peptides” Vol.3, p.1-99 (1981) Academic Press; и приведенная там литература). Предпочтительными аминозащитными группами для получения соединений, соответствующих формуле I, являются группа ВОС (трет-бутилоксикарбонил) или группа Z (бензилоксикарбонил).
Блокированные производные аминосахаров (IV) приводят на первой стадии реакции во взаимодействие с аминами (формула V),

где R1 имеет вышеупомянутое значение с получением гликозиламинов (формула VI)
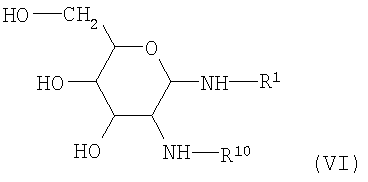 . .
Препараты гликозиламинов этого типа в принципе известны (ELLIS, Advances in Carbohydrate Chemistry 10, 95 (1955)) и, в частности, описаны в DE-OS (German Published Specification)  3213650. 3213650.
На второй стадии реакции гликозиламины (VI) приводят во взаимодействие с подходящими производными карбоновой кислоты (формула VII), такими как галогенангидриды карбоновых кислот или ангидриды карбоновых кислот,
 , ,
где R2 имеет вышеупомянутое значение, a R11 представляет собой галоген, такой, например, как хлор, или представляет собой -О-CO-R2 с упомянутым выше значением для R2, или представляет собой группировку -O-СО-О-низший алкил. Таким способом получают гликозиламиды (формула VIII),
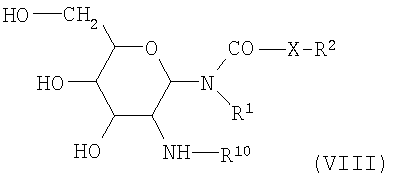
в которых R1 и R2 имеют вышеупомянутые значения, R10 такой же, как R6, а X представляет собой -СН2-. Условия N-ацилирований этого типа указаны в DE-OS (German Published Specification)  3213650. 3213650.
В предпочтительном воплощении гликозиламины формулы VI приводят во взаимодействие с одним-двумя эквивалентами карбонилхлорида (формула VII) или с одним-двумя эквивалентами смешанного ангидрида, который получен из релевантной карбоновой кислоты R2–CH2–CO2H и этилхлорформиата или изобутилхлорформиата в присутствии вспомогательного органического основания известными из литературы способами с получением гликозиламида формулы VIII, в котором X представляет собой -СН2-.
Это взаимодействие осуществляют в органических или водно-органических растворителях при 0°С – 50°С в присутствии, если целесообразно, неорганического или органического основания. Подходящими разбавителями являются спирты, такие как метанол, этанол, 1-пропанол или 2-пропанол, или простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или 1,4-диоксан, или галогенированные углеводороды, такие как дихлорметан, трихлорметан или 1,2-дихлорэтан, или N,N-диметилформамид.
Когда гликозиламины (VI), полученные на первой стадии, приводят во взаимодействие с эфирами галогеномуравьиной кислоты (IX),

где R12 представляет собой галоген, такой как, например, хлор или бром, a R2 имеет вышеупомянутое значение, тогда получают гликозилкарбаматы (VIII), где X в формуле VIII представляет собой кислород.
В одном воплощении гликозиламины формулы VIII приводят во взаимодействие с одним-двумя эквивалентами эфира хлоругольной кислоты IX с получением гликозилкарбамата. Это взаимодействие предпочтительно осуществляют в органических или водно-органических растворителях при температурах между 0°С и 50°С, но особенно предпочтительно при комнатной температуре. Подходящими растворителями являются спирты, простые эфиры, галогенированные углеводороды или диметилформамид, которые упомянуты выше.
Когда гликозиламины (VI), полученные на первой стадии, приводят во взаимодействие с одним-двумя эквивалентами органического изоцианата (формула X),

где R2 имеет вышеупомянутое значение, тогда получают гликозилмочевины формулы VIII, и X представляет собой -NH-. Подобно вышеупомянутым реакциям, эту реакцию ацилирования предпочтительно осуществляют в органических растворителях при температурах реакции, составляющих от -20°С до 60°С, предпочтительно между 0°С и 25°С. Подходящими растворителями являются вышеупомянутые спирты, простые эфиры, галогенированные углеводороды или диметилформамид.
Гликозиламиды (формула VIII, X представляет собой -СН2-), гликозилкарбаматы (формула VIII, X представляет собой -О-) или гликозилмочевины (формула VIII, X представляет собой -NH-), полученные этим способом, выделяют в форме кристаллических или аморфных твердых веществ известными способами и при необходимости очищают с использованием стандартных методик, таких как перекристаллизация, хроматография, экстракция и т.д.
Кроме того, во многих случаях параллельно с упомянутыми выше стадиями очистки или вместо них выгодно осуществлять получение химических производных (химическую дериватизацию), в результате чего получают производное гликозил-амидов, -карбаматов и -мочевин формулы VIII, обладающее хорошей способностью к кристаллизации. Химическими дериватизациями этого типа являются, в случае гликозиламидов, гликозилкарбаматов и гликозилмочевин по изобретению, например реакции этерификации гидроксильных групп остатков сахара. Примерами подходящих сложноэфирных групп являются ацетильная, бензоильная или п-нитробензоильная группы.
Для получения три-О-ацил-производных гликозиламидов, гликозилмочевин или гликозилкарбаматов соответствующие триолы (формула VIII) приводят во взаимодействие с ацилирующими агентами в присутствии неорганических или органических вспомогательных оснований. Подходящими ацилирующими агентами являются хлорангидриды кислот, такие как ацетилхлорид, бензоилхлорид или п-нитробензилхлорид, либо ангидриды, как например, уксусный ангидрид. Результатом этого является образование сложных эфиров, соответствующих формуле XI,
 , ,
где R1, R2, R10 и X имеют вышеупомянутые значения, и
R13 представляет собой ацетил, бензоил или п-нитробензоил.
Реакции О-ацилирования предпочтительно осуществляют в инертных органических растворителях. Растворителями, которые могут быть использованы, являются галогенированные углеводороды, такие как дихлорметан, трихлорметан или 1,2-дихлорэтан, простые эфиры, такие как тетрагидрофуран или 1,4-диоксан, сложные эфиры, такие как этилацетат, и амиды, такие как диметилформамид.
В качестве подходящих растворителей также можно указать сами органические основания, такие как триэтиламин или пиридин. Все основания, которые могут быть использованы, представляют собой основания, применяемые в органической химии для О-ацилирования. Предпочтительно используют триэтиламин, пиридин или смесь пиридин/4-диметиламинопиридин. Тройные сложные эфиры (формула XI) могут легко кристаллизоваться из органических растворителей. Особенно предпочтительными для кристаллизации являются полярные растворители, такие как спирты с короткой цепью, то есть метанол, этанол, н-пропанол или изопропанол. Другие растворители, подходящие для кристаллизации тройных сложных эфиров (формула XI), представляют собой смеси органических растворителей с полярными неорганическими или органическими растворителями, например тетрагидрофуран – метанол, тетрагидрофуран – вода, этанол – вода и изопропанол – вода. Тройные сложные эфиры (формула XI), очищенные в результате однократной или, где целесообразно, многократной перекристаллизации, переводят обратно в триолы (формула VIII) посредством гидролиза или трансэтерификации трех О-ацетильных групп. В органической химии известно множество способов расщепления эфиров. Для получения триолов (формула VIII) из тройных сложных эфиров (формула XI) можно отметить трансэтерификацию ацильных групп в присутствии метанола и каталитических количеств метанолята натрия, известную в органической химии как гидролиз по Земплену.
Третья стадия реакции получения соединений формулы I по изобретению включает избирательное отщепление защитной группы с 2-аминогруппы сахара в соединениях формулы VIII. В этой реакции необходима особенная осторожность, чтобы не происходило одновременного удаления группы 1-амидо, или 1-карбамидо, или 1-(алкоксикарбониламидо) на сахаре соединений формулы VIII.
Бензилоксикарбонильная группа, предпочтительно используемая по положению С-2 аминогексанов, может быть количественно и избирательно отщеплена с сохранением группы 1-амидо, или 1-карбамидо, или 1-алкокси-карбониламидо в условиях гидрогенолиза. В результате такого гидрогенолиза получаются гликозиламиды, гликозилмочевины или гликозилкарбаматы со свободной 2-аминогруппой сахара, имеющие следующую структурную формулу (XII)

с упомянутыми выше значениями для R1, R2 и X.
Примерами подходящих катализаторов для гидрогенолиза являются благородные металлы, такие как платина или палладий, которые адсорбированы на активированном угле. Предпочтительно используют палладий/уголь (5%-ный или 10%-ный). Гидрогенолиз может быть осуществлен при атмосферном давлении или повышенном давлении в подходящем сосуде под давлением. Для гидрирования подходят инертные растворители, как например спирты, такие как метанол, этанол или пропанол, простые эфиры, такие как тетрагидрофуран или 1,4-диоксан, либо карбоновые кислоты, такие как уксусная кислота, либо их смеси. Там, где это целесообразно, растворитель смешивают с водой или разбавленными кислотами, такими как соляная кислота или серная кислота. Несомненно, когда добавляют такие кислоты, 2-амино-2-дезокси-гликозиламиды, -карбаматы и -мочевины формулы XII получают в виде аммониевых солей этих кислот. трет-Бутилоксикарбонильная защитная группа, которая также предпочтительно используется в соединениях формулы VIII, может быть отщеплена способами, известными из литературы, с использованием минеральных кислот, таких как соляная кислота или серная кислота. В этом случае 2-амино-2-дезокси-гликозиламиды,-карбаматы и -мочевины формулы XII также избирательно получаются в виде аммониевых солей кислот, использованных для отщепления.
Четвертая стадия реакции синтеза соединений формулы I по изобретению включает связывание аминогликозиламидов, амидов, -карбаматов или -мочевин, соответствующих формуле XII, или их солей с подходящим производным аминокислот. Подходящие производные аминокислот представляют собой N-блокированные аминокислоты (формула XIII),

где R7 имеет упомянутое выше значение,
R8 представляет собой водород или метил, и
R14 представляет собой защитную группу, которая обычно используется в пептидном синтезе и может быть избирательно удалена с сохранением пептидной связи.
Предпочтительно используемыми защитными группами для аминогруппы в формуле XIII являются вышеупомянутые группы, а бензилоксикарбонильные или трет-бутилоксикарбонильные группы являются особенно предпочтительными. Сочетание 2-амино-2-дезокси-гликозиламида-карбамата или -мочевины формулы XII с аминокислотным производным формулы XIII может быть осуществлено традиционными способами пептидного синтеза (E.Wunsch et al.: Synthese von Peptiden (Synthesis of peptides) in: Methoden der Org. Chemie (Methods of org. chemistry) (Houben-Weyl) (E.Muller, Editor), Vol.XV/I и XV/2, 4-е издание, опубликовано Thieme, Stuttgart (1974).
Примерами традиционных способов являются конденсация аминогруппы в соединении формулы XII с аминокислотным производным формулы XIII в присутствии удаляющих воду агентов, например дициклогексилкарбодиимида или диизопропилкарбодиимида.
Конденсацию соединений формулы XII с соединениями формулы XIII также можно осуществлять, когда карбоксильная группа активирована. Возможная активированная карбоксильная группа представляет собой, например, ангидрид карбоновой кислоты, предпочтительно смешанный ангидрид, такой как ацетат кислоты, либо амид кислоты, такой как имидазолид, либо активированный сложный эфир. Примерами активированных сложных эфиров являются цианометиловые эфиры, пентахлорфениловые эфиры и N-гидроксифталимидные эфиры. Активированные сложные эфиры также могут быть получены из кислоты (формула XIII) и N-гидроксисукцинимида или 1-гидроксибензотиазола в присутствии удаляющего воду агента, такого как карбодиимид. Производные аминокислот известны и могут быть получены известным способом. В результате конденсации аминосоединения формулы XII с возможно активированными карбоксильными соединениями формулы XIII получают пептидогликолипиды формулы XIV:
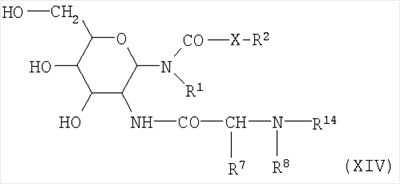
с упомянутыми выше значениями для R1, R2, R7, R8, R14 и X.
На заключительной стадии способа получения соединений формулы I защитную группу R14 в соединениях формулы XIV удаляют. Эта стадия должна быть проведена с осторожностью, так чтобы другие амидные, уретановые группы или группы мочевины, имеющиеся в соединениях формулы XIV, не отщеплялись. Защитные группы R14, которые предпочтительно используются в соединениях формулы XIV, N-карбобензоксигруппа и N-трет-бутилоксикарбонильная группа, могут быть удалены с сохранением амидной группы, уретановой группы или группы мочевины. Карбобензоксигруппа может быть избирательно удалена гидрогенолизом в присутствии благородного металла, такого, например, как палладий на угле, в подходящем растворителе, таком как этанол, метанол, ледяная уксусная кислота или тетрагидрофуран. Растворители могут быть использованы в виде чистого растворителя или скомбинированы с другим растворителем или с водой. Реакция может быть осуществлена либо при атмосферном давлении, либо при повышенном давлении. трет-Бутилоксикарбонильная группа R14 в соединениях формулы XIV может быть удалена в результате ацидолитических процессов. Примерами подходящих условий являются использование хлористого водорода в подходящих растворителях, таких как, например, ледяная уксусная кислота, диэтиловый эфир, диоксан или этилацетат, при комнатной температуре. Способы этого типа для расщепления трет-бутилкарбаматов в принципе известны. Пептидогликозиламиды, -карбаматы и -мочевины формулы I, полученные этим способом, выделяют в форме кристаллических или аморфных твердых веществ известными способами и при необходимости очищают стандартными методами, такими как перекристаллизация, хроматография, экстракция и т.д.
Соединения по изобретению формулы I также могут быть получены в соответствии со вторым способом синтеза с аналогичными хорошими результатами. Этот второй способ синтеза отличается от описанного выше первого способа тем, что у него другая последовательность связывания синтонов аминосахар-аминокислота, амин R1-NH2 и карбоновая кислота R2-CH2-СО2-Н или производное карбоновой кислоты R2-O-CO-галоген либо R2-NCO, где значения R1 и R2 упомянуты выше. В этом втором способе в качестве исходного компонента используют подходящие 2-Т-(аминоацил)аминосахара формулы XV
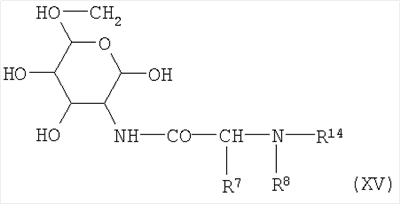
с упомянутыми выше значениями для R7 и R8, и в которых R14 представляет собой известную в пептидной химии защитную группу для аминогруппы, предпочтительно бензилоксикарбонильную или трет-бутилоксикарбонильную группу. Получаемые таким образом соединения формулы XV далее конденсируют с аминосоединениями формулы III с получением гликозиламинов общей формулы XVI
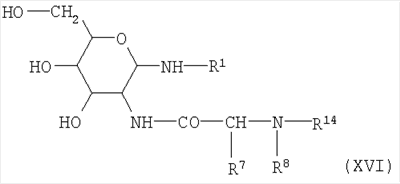
с R1, R7, R8 и R14, имеющими значения, согласующиеся с формулой I и определением R6.
Все описанные выше способы получения соединений общей формулы VI можно использовать для получения соединений общей формулы XVI. Соединения формулы XVI далее приводят во взаимодействие либо с вышеупомянутыми производными карбоновой кислоты (формула VII), либо с эфирами галогеноугольной кислоты (формула IX), либо с органическими изоцианатами (формула X) с получением 2-(аминоацил)-аминогликозиламидов формулы XIV (с X, представляющим собой -СН2–), или -карбаматов формулы XIV (с X, представляющим собой -О-), или -мочевин формулы XIV (с X, представляющим собой -NH-). Эти реакции ацилирования в общем случае могут быть осуществлены с использованием описанных выше способов взаимодействия гликозиламинов с карбоновыми кислотами или производными карбоновых кислот.
Промежуточные соединения (формула XIV), которые получают этим способом, могут быть очищены с использованием вышеупомянутого физического способа очистки. Однако предпочтительным является превращение соединений формулы XIV описанными выше способами О-ацилирования в три-О-ацетаты или три-О-бензоаты общей формулы XVII

со значениями переменных, согласующимися с формулой I.
Эти соединения могут легко кристаллизоваться, предпочтительно из полярных растворителей, таких как метанол или этанол, и таким образом очищены. Очищенные кристаллические производные формулы XVII затем превращают в триолы формулы XIV вышеупомянутыми способами гидролиза сложных эфиров, которые особенно широко используются в химии сахаров. Окончательное удаление защитных групп в аминокислоте в соединениях формулы XIV уже было описано выше для получения соединений формулы I. Изобретение также относится к солям соединений формулы I. Они представляют собой главным образом нетоксичные соли, которые обычно можно использовать в фармации, например хлориды, ацетаты и лактаты, или инертные соли соединений формулы I.
Термин “слабая кислота” означает любую кислоту, имеющую величину рКа (-log Ка) от приблизительно 1,0 до приблизительно 9,5 по стандартным таблицам или величинам. Следующие далее примеры слабых кислот, без ограничения данного изобретения, описаны путем указания названия, формулы и приблизительного значения рКа. Уксусная кислота H(C2H3O2) (рКа 4,76); аскорбиновая кислота(1), H2(C6H6O6) (рКа 4,10); ацетилсалициловая кислота H8(C9O4) (рКа 3,5); бутановая кислота H(C4H7O2) (рКа 4,83); угольная кислота H2CO3 (рКа 4,83; форма 1); хромовая кислота HCrO4 – (рКа 6,49; форма 2); лимонная кислота H3(C6H5O7) (рКа 3,14; форма 1); лимонная кислота H2C6H5O7 – (рКа 6,49; форма 2); лимонная кислота H3(C6H5O7) (рКа 3,14; форма 1); лимонная кислота H2C6H5O7 – (рКа 4,77; форма 2); лимонная кислота (HC6H5O7)2- (рКа 6,39; форма 3); муравьиная кислота H(CHO2) (рКа 3,75); фумаровая кислота H4(C4O4) (рКа 3,03); гептановая кислота H(C7H13O2) (рКа 4,89); гексановая кислота H(C6H11O2) (рКа 4,84); фтористоводородная кислота HF (рКа 3,20); изолимонная кислота H8(C6O7) (рКа 3,29); молочная кислота H(C3H5O3) (рКа 3,08); малеиновая кислота H4(C4O4) (рКа 1,83); никотиновая кислота H5(C6NO2) (рКа 3,39); щавелевая кислота H2(C2O4) (рКа 1,23; форма 1); щавелевая кислота (HC2O4)– (рКа 4,19; форма 2); пентановая кислота H(C5H9O2) (рКа 4,84); фосфорная кислота H3PO4 (рКа 2,16; форма 1); пропановая кислота H(C3H5O2) (рКа 4,86); пировиноградная кислота H4(C3O3) (рКа 2,39); янтарная кислота H6(C4O4) (рКа 4,19) и трихлоруксусная кислота H(C2Cl3O2) (рКа 0,70). Любые комбинации этих кислот также являются примерами. – (рКа 4,77; форма 2); лимонная кислота (HC6H5O7)2- (рКа 6,39; форма 3); муравьиная кислота H(CHO2) (рКа 3,75); фумаровая кислота H4(C4O4) (рКа 3,03); гептановая кислота H(C7H13O2) (рКа 4,89); гексановая кислота H(C6H11O2) (рКа 4,84); фтористоводородная кислота HF (рКа 3,20); изолимонная кислота H8(C6O7) (рКа 3,29); молочная кислота H(C3H5O3) (рКа 3,08); малеиновая кислота H4(C4O4) (рКа 1,83); никотиновая кислота H5(C6NO2) (рКа 3,39); щавелевая кислота H2(C2O4) (рКа 1,23; форма 1); щавелевая кислота (HC2O4)– (рКа 4,19; форма 2); пентановая кислота H(C5H9O2) (рКа 4,84); фосфорная кислота H3PO4 (рКа 2,16; форма 1); пропановая кислота H(C3H5O2) (рКа 4,86); пировиноградная кислота H4(C3O3) (рКа 2,39); янтарная кислота H6(C4O4) (рКа 4,19) и трихлоруксусная кислота H(C2Cl3O2) (рКа 0,70). Любые комбинации этих кислот также являются примерами.
Уксусная кислота является предпочтительной. Ацетилсалициловая кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, фтористоводородная кислота, изолимонная кислота, малеиновая кислота, никотиновая кислота, фосфорная кислота, пировиноградная кислота, янтарная кислота и трихлоруксусная кислота являются наиболее общеупотребительными слабыми кислотами, которые реализованы в воплощениях по отдельности, в комбинации и в виде набора.
Термин “неионное поверхностно-активное вещество” означает поверхностно-активное вещество, уменьшающее поверхностное натяжение вещества, в котором оно растворено, а “неионное” означает, что оно имеет полярную, электрически незаряженную группу. Термин “амфифильное поверхностно-активное вещество” означает поверхностно-активное вещество, в котором часть молекулы поверхностно-активного вещества является гидрофобной, а часть гидрофильной. Подходящие поверхностно-активные вещества будут одновременно неионными и амфифильными и приемлемыми для использования в ветеринарии и медицине. Будет или не будет конкретное неионное поверхностно-активное вещество приемлемым для использования в медицине или ветеринарии, легко может быть определено специалистом обычной квалификации в данной области техники. Имеется много подходящих неионных поверхностно-активных веществ, которые могут быть использованы в данном изобретении, и ниже предложены многочисленные примеры.
В воплощениях данного изобретения реализованы два хорошо известных типа неионных поверхностно-активных веществ. Они известны как сорбитаны, обычно продающиеся под товарным знаком Span®, и полиоксиэтиленсорбитаны, обычно продающиеся под товарным знаком Tween®. Конкретными воплощениями в данном описании являются следующие: сорбитанмонолаурат (Span 20®), сорбитанмонопальмиат (Span 40®), сорбитанмоностеарат (Span 60®), сорбитантристеарат (Span 65®), сорбитанмоноолеат (Span 80®), сорбитантриолеат (Span 85®), полиоксиэтиленсорбитанмонолаурат (Tween 20®), полиоксиэтиленсорбитанмонопальмиат (Tween 40®), полиоксиэтиленсорбитанмоностеарат (Tween 60®), полиоксиэтиленсорбитамоноолеат (Tween 80) и полиоксиэтиленсорбитантриолеат (Tween 85). Эти описания понимаются как включающие ингредиенты указанных торговых названий или эквивалентные ингредиенты, которые приведены в поставляемых каталогах для таких поверхностно-активных веществ. Поверхностно-активные вещества могут быть использованы по отдельности или в комбинации.
Конкретно описаны сорбитанмонолаурат (Span 20®), полиоксиэтиленсорбитанмонолаурат (Tween 20®), сорбитанмоноолеат (Span 80®), сорбитантриолеат (Span 85®), полиоксиэтиленсорбитанмоноолеат (Tween 80), полиоксиэтиленсорбитантриолеат (Tween 85).
Термин “подходящий буфер” означает буфер, подходящий для использования в ветеринарии или медицине, и который может поддерживать относительно постоянный pH в водном растворе от приблизительно 6 до приблизительно 8. Одним из воплощений, описанным в данном изобретении, являются фосфатные буферы. Фосфатные буферы могут быть приготовлены для получения конкретного pH в широком диапазоне посредством смешивания в разных соотношениях одноосновной и двухосновной солей фосфата натрия и/или фосфата калия. Приготовление и использование различных буферов на основе (солей) натрия и калия хорошо известно специалистам в данной области техники.
Другими примерами буферов являются следующие:
2-(N-морфолино)этансульфоновая кислота (также известная как MES);
3-(N-морфолино)пропансульфоновая кислота (также известная как MOPS);
н-[трис(гидроксиметил)]-2-аминоэтансульфоновая кислота (также известная как TES);
4-(2-гидроксиэтил)пиперазин-1-этансульфоновая кислота (также известная как HEPES);
[трис(гидроксиметил)метил]глицин (также известный как TRIS).
Часть I. Приготовление растворов
Описанные в данном изобретении новые композиции представляют собой 1) исходные растворы гликозиламида и 2) растворы гликолипидного адъюванта.
1) Исходный раствор гликозиламида приготавливают путем растворения гликолипида в спирте и комбинирования его с соответствующими количествами слабой кислоты. Слабую кислоту добавляют к спиртовому раствору гликолипида в молярном избытке слабой кислоты по отношению к гликолипиду. Для получения исходного раствора гликозиламида к смеси гликолипида, спирта и кислоты добавляют неионное поверхностно-активное вещество. Примером гликолипида является N-(2-дезокси-2-L-лейциламино- -D-глюкопиранозил)-N-октадецилдодеканоиламид. Примером спирта является этанол, примером слабой кислоты является уксусная кислота. Неионные поверхностно – активные вещества описаны выше. -D-глюкопиранозил)-N-октадецилдодеканоиламид. Примером спирта является этанол, примером слабой кислоты является уксусная кислота. Неионные поверхностно – активные вещества описаны выше.
Приготовление исходных растворов гликозиламида. К спиртовому раствору, содержащему гликолипид, добавляют слабую кислоту. Слабую кислоту добавляют в молярном избытке по отношению к содержанию гликолипида. Компонент слабой кислоты должен быть добавлен в количестве молярных эквивалентов, в 1,25-5 раз превышающем количество гликолипида. В некоторых воплощениях рекомендуются следующие далее относительные количества кислоты. Количество молей слабой кислоты должно быть в 2,0 раза; 2,5 раза; 2,7 раза; 3,0 раза и 5,0 раза и наиболее предпочтительно в 2,7 раза больше количества молей гликолипида.
Для получения конечного исходного раствора гликозиламида к приведенной выше спиртовой смеси гликолипида добавляют неионное поверхностно-активное вещество либо до, либо после добавления слабой кислоты.
В присутствии слабой кислоты гликозиламид превращается в ацетатную форму гликолипида. Гликолипиды формулы I не являются полностью растворимыми, когда просто вводятся непосредственно в буферные водные растворы. Обычно раствор, получаемый в результате растворения гликолипида формулы I в буферном водном растворе, представляет собой молокообразную смесь. Ранее исследователи предпринимали попытки сделать такие растворы смесей гомогенными посредством обработки молокообразного раствора ультразвуком. Однако обработка ультразвуком не гарантирует того, что раствор будет оставаться гомогенным в процессе хранения. Химический подход к суспендированию этих соединений приводит к достижению полного растворения, получению практически оптически прозрачного водного буферного раствора гликолипида с соответствующим pH. Когда добавляется избыток слабой кислоты по сравнению с количеством гликолипида, это гарантирует, что весь гликолипид будет переведен в растворимую форму и его возвращение обратно в нерастворимую форму предотвращено.
Слабая кислота переводит гликолипид в фармацевтически приемлемую соль. Предпочтительными солями являются нетоксичные соли, которые обычно используются в фармацевтических и биологических препаратах. Например, хлориды, ацетаты, лактаты и инертные соли соединений формулы I получают с описанными в данном изобретении слабыми кислотами.
Спиртами, используемыми для растворения гликолипида, могут быть метанол, этанол, любая изомерная форма пропанола или любая их комбинация. Полученный спиртовой раствор гликолипида будет оптически прозрачным. Любая химическая реакция, которая может переводить ацетную форму гликолипида обратно в неацетатную форму, будет вызывать флокуляцию гликолипидов в водном растворе. Когда происходит флокуляция гликолипида, молекулы гликолипида выпадают из раствора в виде тонких хлопьев, оседая на дне контейнера. Исходная концентрация слабой кислоты в концентрированном растворе гликозиламида и спирта определяет, будет ли происходить какая-либо флокуляция гликолипида. Для того чтобы избежать флокуляции, слабая кислота должна быть в молярном избытке по отношению к гликолипиду.
2) Растворы гликолипидного адъюванта приготавливают путем введения соответствующего количества исходного раствора гликозиламида в “подходящий буфер”. pH описанных в данном изобретении конечных стабильных растворов гликолипидного адъюванта должен составлять от приблизительно 6 до приблизительно 8. Предпочтительно, когда конечный pH составляет от приблизительно 6 до приблизительно 7. Описан конечный pH от приблизительно 6,3 до приблизительно 6,4.
Исходный раствор гликозиламида содержит избыток кислоты, поэтому он должен быть забуферен для применения в качестве адъюванта. Например, можно приготовить фосфатный буфер с конкретным pH в широком диапазоне путем смешивания одноосновной и двухосновной солей фосфата натрия или фосфата калия в разных соотношениях. Если используется фосфатный буфер, его можно приготовить в концентрации приблизительно 20 мМ, и он будет иметь pH приблизительно 7,8. Когда к этому буферу добавляют исходный раствор гликозиламида, pH буфера понижается. Применение фосфатного буферного раствора с pH 7,8 приводит к получению конечного раствора гликолипидного адъюванта с pH приблизительно 6,4. Может быть осуществлено окончательное подведение pH, но обычно в этом нет необходимости.
Исходнный раствор гликозиламина, содержащий слабую кислоту и гликолипид, имеет очень низкий pH. Может оказаться необходимым увеличить pH до приемлемого уровня. Следует избегать использования сильного основания для достижения этой цели, поскольку добавление сильного основания может переводить солевую форму гликолипида обратно в несолевую форму, приводя к осаждению (флокуляции) несолевой формы в водном окружении. Тем не менее, если желательно применение сильного основания, следует использовать только небольшие его количества. Например, рекомендуется использовать не более чем 100 мМ NaOH, хотя оптимальной является концентрация 4,0 мМ или меньше.
Буферный раствор возможно может включать некоторое количество NaCl, но это не обязательно. Концентрация NaCl может меняться в диапазоне от приблизительно 1 до приблизительно 50 мМ. Меньшие количества NaCl предпочтительны по сравнению с более высокими количествами. В приведенных в данном описании Примерах либо вообще не содержится NaCl, либо содержится 15 мМ NaCl. 100 мМ NaCl не подходит ввиду наличия флокуляции. Ожидается, что флокуляция будет отсутствовать при концентрациях NaCl 15 мМ или меньше. Ожидается, что флокуляция будет отсутствовать при концентрациях NaCl 30 мМ или меньше. Ожидается, что флокуляция будет отсутствовать при концентрациях NaCl 50 мМ или меньше.
Часть II. Характеристика гликолипидного адъювантного раствора
Стабильность раствора гликолипидного адъюванта в процессе хранения можно контролировать простым визуальным наблюдением или с использованием соответствующих аналитических приборов. Молекулы гликолипида в водном растворе образуют мицеллы, и размер мицелл можно точно определить с помощью лазерного дифрактометра. Подобного рода измерение можно использовать для определения наличия флокуляции молекул гликолипида.
Альтернативным подходом определения стабильности в режиме реального времени является проведение ускоренного тестирования стабильности. При ускоренном тестировании стабильности раствор адъюванта подвергают воздействию температуры приблизительно 37°С в течение приблизительно семи суток с последующей инкубацией при приблизительно 4°С в течение приблизительно двух суток при постоянном встряхивании. Инкубация при приблизительно 37°С в течение приблизительно семи суток соответствует хранению при приблизительно 4°С в течение периода времени, равного приблизительно одному году. Инкубация при приблизительно 4°С в течение приблизительно двух суток с постоянным встряхиванием соответствует стрессовому условию, с которым можно столкнуться при транспортировке раствора гликолипидного адъюванта.
Для определения изотоничности раствора гликолипидного адъюванта по отношению к цитоплазме может быть определена осмолярность. Можно добавлять хлорид натрия в разных концентрациях и определять осмолярность полученного раствора, используя осмометр. Повышенные концентрации хлорида натрия помимо увеличения осмолярности также вызывают тенденцию к помутнению раствора. Считается, что мутность обуславливается агрегацией мицелл в большие частицы. Растворы, которые трудно или невозможно отфильтровать с использованием фильтра 0,2 мкм, обычно не приемлемы для промышленного использования, поскольку для обеспечения стерильности растворов адъюванта, приготавливаемых в промышленном масштабе, часто используют заключительное фильтрование. Для определения наличия агрегации мицелл как результата слишком высокой концентрации соли можно использовать анализ с применение электронного микроскопа.
В растворе гликолипидного адъюванта могут быть использованы дополнительные негликолипидные адъюванты в комбинации с описанными выше. В другом воплощении изобретения к раствору гликолипидного адъюванта добавляют дополнительные иммуностимулирующие молекулы. Иммуностимулирующие молекулы хорошо известны в данной области, и они включают сапонины, Quil А, бромид диметилдиоктадециламмония (DDA) и карбопол (Carbopol).
Quil А представляет собой очищенный экстракт коры южноамериканского дерева Quillaja saponaria. Quil А индуцирует как гуморальный, так и клеточноопосредованный ответы. Quil А часто используют с холестерином, поскольку холестерин устраняет нежелательные побочные эффекты при введении в соответствующих соотношениях. Холестерин образует нерастворимые комплексы с Quil А, которые образуют спиралеподобные структуры, когда холестерин связывается с Quil А, экспонируя таким образом сахарные звенья молекулы, которые помогают стимулированию иммунного ответа.
Бромид диметилдиоктадециламмония (DDA) представляет собой катионное поверхностно-активное вещество с алкильными цепями из 18 атомов углерода. Он является амфифильным четвертичным амином. Для получения оптимального иммунного ответа необходимо прямое взаимодействие DDA и антигена, поскольку DDA функционирует как носитель антигена через прямое связывание антигена на границе раздела фаз масло/вода. Он стимулирует как гуморальный, так и клеточноопосредованный иммунные ответы.
Карбопол представляет собой другую полезную иммуностимулирующую молекулу, которая может быть использована в данном изобретении. Он является гомополимером акриловой кислоты, поперечно-сшитым с использованием полиалкенилового простого эфира.
Часть III. Применения раствора гликолипидного адъюванта
Раствор гликолипидного адъюванта в фармацевтически приемлемой солевой форме можно смешивать с антигеном. Удобные антигены включают: белки микробных патогенов, гликопротеины, липопротеины, пептиды, гликопептиды, липопептиды, анатоксины, углеводы и опухолеспецифические антигены. Антигены могут происходить из разнообразных источников. Антигены из микробных патогенов включают вызывающие заболевания бактерии, вирусы и микроорганизмы – паразиты. Можно использовать смеси двух или более антигенов. Антиген может быть убитым, естественным образом аттенуированным, модифицированным живым или представлять собой белковый экстракт, рекомбинантно продуцируемый белок, химически синтезированный пептид или что-либо еще, что стимулирует иммунный ответ. Пептидный антиген может существовать в виде свободного пептида или в виде пептида, конъюгированного с гликолипидом или конъюгированного с другими известными В-клеточными или Т-клеточными эпитопами.
Стабильный раствор гликолипидного адъюванта может быть комбинирован с дополнительными адъювантами или компонентами, известными как имеющие адъювантные свойства. Дополнительные адъюванты, которые можно комбинировать с раствором гликолипидного адъюванта, включают полимеры, существующие в природе терпеноидные соединения в неочищенной или частично очищенной форме, амфифильный четвертичный амин, производные веществ бактериальной клеточной стенки и синтетические аналоги компонентов бактериальной клеточной стенки или компонентов ДНК. Раствор гликолипидного адъюванта может быть использован или комбинирован с одним или более агентами, такими как антибиотики или другие антигены. Бактериальные или вирусные антигены могут быть или убитыми, или модифицированными живыми. Убитые вирусные антигены получают, выращивая вирусы в тканевой культуре и инактивируя вирусы путем химической обработки. Некоторые вирусы могут быть выращены в яйцах с зародышами. Убитый вирусный антиген можно добавлять к раствору, содержащему раствор гликолипидного адъюванта, и полученный раствор можно использовать для вакцинации животных с целью достижения защиты против вирусных инфекций.
В одном воплощении данного изобретения раствор гликолипидного адъюванта может быть использован в качестве разбавителя для модифицированных живых вирусных антигенов. Вирусные патогены могут быть аттенуированы в своей вирулентности либо посредством их пассирования в тканевой культуре в течение нескольких генераций, либо посредством специфических манипуляций с вирусным геномом. Такие аттенуированные штаммы вирусов могут быть выращены до очень высоких титров в тканевой культуре и могут быть использованы в качестве вакцинных антигенов. Аттенуированные вирусные штаммы обозначаются как модифицированные живые вирусные антигены. Несмотря на то, что эти штаммы являются менее вирулентными, они, по-прежнему, остаются высоко иммуногенными, когда используются в качестве антигена в вакцине, и обуславливают защиту против инфекции вирулентными штаммами. Если раствор гликолипидного адъюванта планируется использовать в качестве разбавителя модифицированных живых вирусных антигенов, то он должен быть протестирован, чтобы убедиться, что он не обладает каким-либо вирулицидным действием в отношении конкретного представляющего интерес вируса.
Вирулицидные свойства раствора гликолипидного адъюванта в отношении модифицированных живых вирусных антигенов может быть определено в эксперименте in vitro. Лиофилизированные вирусные антигены повторно гидратируют, используя раствор гликолипидного адъюванта или воду. Полученные “вирусные растворы” высевают на монослой пермиссивных клеток. Титр вирусного антигена определяют посредством подсчета количества бляшек, образованных на монослое. Разницу в титрах вирусов, полученных для образцов, повторно гидратированных с использованием воды и с использованием раствора гликолипидного адъюванта, можно использовать для определения вирулицидного действия, если оно имеет место, которое оказывает раствор гликолипидного адъюванта на любой живой вирус.
Модифицированные живые вирусные антигены могут быть лиофилизированы и представлены в виде лиофилизированных брикетов в коммерческом вакцинном препарате. Обычно эти лиофилизированные брикеты модифицированных живых вирусных антигенов повторно гидратируют с использованием раствора-разбавителя и используют для парентеральной вакцинации. Примеры разбавителей включают водный раствор, содержащий забуференный фосфатом физиологический раствор. Если раствор-разбавитель содержит известную иммуностимулирующую молекулу, эффективность вакцинации модифицированными живыми вирусными антигенами может быть улучшена. В одном воплощении настоящего изобретения раствор гликолипидного адъюванта используют в качестве раствора-разбавителя.
ПРИМЕРЫ
Пример 1. Получение нерастворимой гликозиламидной композиции с идентичной концентрацией Bay 15-5831® и уксусной кислоты
| Таблица 1. |
| Композиция, не подходящая для промышленного применения |
| Реагент |
Количество (200 мл) |
| Этанол (100%-ный) |
176,1 мл |
| Tween 20 |
4,0 мл |
| Ледяная уксусная кислота |
1,5 мл |
| Bay 15-5831® |
18,4 г |
Bay 15-5831®, зарегистрированный компанией Байер (Bayer Company), является торговым названием для N-(2-дезокси-2-L-лейциламино- -D-глюкопиранозил)-N-октадецилдодеканоиламида. Когда это соединение применяют для приготовления раствора адъюванта, используя композицию, описанную выше в Таблице 1, где уксусная кислота используется в равной молярной концентрации по отношению к гликолипиду, и гликолипид находится в форме своего свободного основания, тогда данный гликолипид оказывается нерастворимым и флокулирует. -D-глюкопиранозил)-N-октадецилдодеканоиламида. Когда это соединение применяют для приготовления раствора адъюванта, используя композицию, описанную выше в Таблице 1, где уксусная кислота используется в равной молярной концентрации по отношению к гликолипиду, и гликолипид находится в форме своего свободного основания, тогда данный гликолипид оказывается нерастворимым и флокулирует.
Пример 2. Растворимый исходный раствор гликозиламида, в котором использованы те же компоненты, что и в Примере 1, но с увеличенной концентрацией уксусной кислоты по отношению к концентрации гликолипида, что приводит к получению исходного раствора растворимого гликозиламида.
| Таблица 2. |
| Композиция исходного раствора гликозиламида |
| Реагент |
Количество (50 мл) |
| Этанол (60%-ный об./об.) |
44,64 мл |
| Tween 20 |
1,12 мл |
| Ледяная уксусная кислота |
0,68 мл |
| Bay 15-5831® |
3,49 г |
Здесь использовали 60%-ный этанол (об./об.), а молярное соотношение уксусной кислоты и гликолипида составляет 2,0. Этанол крепости 200 из Примера 1 заменен на 60%-ный этанол в воде. Полученный исходный раствор гликозиламида был оптически прозрачным и не наблюдалось никакого осаждения на дне контейнера. Этот исходный раствор гликозиламида добавляют к различным буферам для приготовления раствора гликолипидного адъюванта в Примере 3.
Пример 3. Приготовление растворов гликолипидного адъюванта Приготавливали фосфатные буферные растворы с разными значениями pH. 2 М исходный раствор одноосновного фосфата натрия приготавливали путем растворения 138 граммов соли NaH2PO4·H2O в 250 мл DI (деионизованной) воды в химическом стакане и подведения конечного объема до 500 мл. Аналогично, 2 М исходный раствор двухосновного фосфата натрия приготавливали путем растворения 142 грамм Na2HPO4 в 300 мл DI воды в химическом стакане и подведения конечного объема до 500 мл. Оба исходных раствора подвергали стерилизации фильтрованием, используя фильтр 0,2 микрона.
| Таблица 3. |
| Композиции 1 М исходного раствора натрий-фосфатного буфера при разных pH |
Рассчитан.
pH |
Раствор Na2HPO4
(мл) |
Раствор NaH2PO4H2O
(мл) |
Общий объем 2 М исх. раствора
(мл) |
Добавленная стерильная DI вода (мл) |
Общий объем 1 М исх. раствора
(мл) |
| 6,0 |
87,7 |
12,3 |
100 |
100 |
200 |
| 6,5 |
68,5 |
31,5 |
100 |
100 |
200 |
| 7,0 |
39,0 |
61,0 |
100 |
100 |
200 |
| 7,5 |
16,0 |
84,0 |
100 |
100 |
200 |
| 7,8 |
8,5 |
91,5 |
100 |
100 |
200 |
Подготавливали разные объемы 2 М исходных растворов одноосновного фосфата натрия и двухосновного фосфата натрия, как показано в Таблице 3, затем получали 1 М исходный раствор натрий-фосфатных буферов с разными уровнями pH. 1 М фосфатные буферные растворы далее разбавляли в 50 раз (50Х), получая 20 мМ фосфатные буферы.
Растворы гликолипидного адъюванта приготавливали, используя эти исходные буферы и исходные растворы гликозиламида из Примера 2.
К 96 мл каждого из этих 20 мМ фосфатных растворов добавляли по 5 мл исходного раствора гликозиламида, приготовленного в Примере 2. Полученный раствор гликолипидного адъюванта содержал 12,5 мМ уксусную кислоту и 6,33 мМ гликолипид. Теперь гликолипид находится в ацетатной форме.
Пример 4. Важность конечного pH раствора гликолипидного адъюванта
В другой серии экспериментов анализировали важность конечного pH различных растворов с целью оценки влияния pH на флокуляцию. Приготавливали 20 мМ фосфатный буфер с начальным pH 7,8. В Таблице 4 показан гликолипидный адъювант, приготовленный с использованием гликозиламида, полученного как в Примере 1, где гликолипид и уксусную кислоту использовали в равных молярных концентрациях. Отметим, что конечный pH не очень сильно уменьшился (Таблица 4), что указывает на эффективность буфера. Варьировали концентрации NaCl. Показания оптической плотности (O.D.) при 600 нм, приведенные в Таблице 4, сравнивали с аналогичными показаниями в Таблице 5, где растворы гликолипидного адъюванта приготавливали из исходных растворов гликозиламида, содержащих двухкратное молярное соотношение уксусной кислоты и гликолипида, как было приготовлено в Примере 2. Использование более высокой концентрации или большего количества уксусной кислоты приводит к минимальной флокуляции. Более существенная флокуляция отмечалась в нефильтрованном образце по сравнению с фильтрованными образцами. Кроме того, при увеличении концентрации NaCl происходит усиление флокуляции и даже выпадение осадка. Приготавливали раствор гликолипидного адъюванта, описанный в Таблице 5, с фосфатным буфером, имеющим начальный pH 8,0; конечный pH раствора гликолипидного адъюванта составлял 6,8-7,0. Дальнейшее уменьшение конечного pH раствора гликолипидного адъюванта может приводить к получению раствора гликолипидного адъюванта с меньшей мутностью и без какой-либо флокуляции.
| Таблица 4. |
Приготовление гликозиламидных композиций, содержащих эквимолярные количества уксусной кислоты и гликолипидов
(см. Пример 1) |
| Концентрация NaCl (мМ) |
Объем буфера (мл) |
Объем гликолипидных исходных композиций (мл) |
Конечный pH |
O.D. при 600 нм |
| 0 |
480 |
25 |
7,42 |
1,693 |
| 15 |
480 |
25 |
7,39 |
1,873 |
| 100 |
480 |
25 |
7,33 |
2,742 |
| Таблица 5. |
Приготовление раствора гликолипидного адъюванта с использованием исходного раствора гликозиламида, содержащего двухкратное молярное количество уксусной кислоты по отношению к гликолипиду
(см. Пример 2) |
| Концентрация NaCl (мМ) |
Объем буфера (мл) |
Объем исходного раствора гликозиламида (мл) |
Конечный pH |
O.D. при 600 нм |
| 0 |
480 |
25 |
6,93 |
0,146 |
| 15 |
480 |
25 |
6,88 |
0,487 |
| 100 |
480 |
25 |
6,84 |
2,826 |
Оптическая плотность (O.D.) менее 0,1 соответствует полупрозрачному раствору. Оптическая плотность 0,1-0,5 соответствует гомогенному раствору с незначительной мутностью, оптическая плотность 0,5-1,0 соответствует раствору с некоторой мутностью, раствор с оптической плотностью 1,0-1,5 считается мутным. Раствор с оптической плотностью выше 1,5 является мутным и, вероятно, нефильтруемым через фильтр 0,2 микрона. Как правило, последний будет считаться неподходящим для промышленного применения.
Пример 5. Титрование гликолипидного адъюванта уксусной кислотой с целью демонстрации обратимости флокуляции
Для определения влияния добавления возрастающих количеств уксусной кислоты к гликолипидному адъюванту, демонстрирующему флокуляцию, на обращение флокуляции приготавливали гликолипидный адъювант, как описано в Примере 1. Этот гликолипидный адъювант демонстрировал флокуляцию даже в отсутствие какого-либо количества NaCl. К этой флокулирующей гликолипидной адъювантной смеси добавляли уксусную кислоту в возрастающей концентрации. Уксусную кислоту разбавляли в 16,6 раза водой с получением одномолярной концентрации рабочего раствора. Затем 15 мкл этого 1 М раствора добавляли к 15 мл гликолипидной адъювантной смеси для увеличения концентрации уксусной кислоты до 1 мМ. С увеличением концентрации уксусной кислоты pH гликолипидного адъюванта уменьшался и флокуляты растворялись. Однако гликолипидный адъювант оставался до некоторой степени мутным. Это наблюдение подтверждает, что увеличение концентрации уксусной кислоты переводит свободное основание Bay 15-5381 в ацетатную форму, которая является более растворимой в водном растворе.
| Таблица 7. |
| Титрование гликолипидного адъюванта уксусной кислотой |
| Объем гликолипидного адъюванта |
Объем добавленной 1 н. уксусной кислоты |
pH раствора |
| 15 мл |
0 |
7,25 |
| 15 мл |
15 мкл (1 мМ) |
7,21 |
| 15 мл |
30 мкл (2 мМ) |
7,10 |
| 15 мл |
60 мкл (4 мМ) |
6,97 |
| 15 мл |
150 мкл (10 мМ) |
6,44 |
| 15 мл |
750 мкл (50 мМ) |
4,57 |
Пример 6. Получение второго стабильного раствора гликолипидного адъюванта с NaCl и без него.
После установления важности увеличения количества уксусной кислоты для поддержания стабильности растворов гликолипида было решено использовать композицию, приведенную в Таблице 8, чтобы сначала приготовить исходный раствор гликозиламида, а затем использовать его для получения другого раствора гликолипидного адъюванта как с NaCl, так и без него. Этот исходный раствор гликозиламида аналогичен раствору в Примере 2, имеет увеличенный в 4 раза общий объем и относительно большие количества уксусной кислоты и Tween 20.
| Таблица 8. |
| Композиция исходного раствора гликозиламида |
| Реагент |
Количество (200 мл) |
| 60%-ный этанол (об./об.) |
179 мл |
| Tween 20 |
4,0 мл |
| Уксусная кислота |
3,0 мл |
| Bay 15-5381 |
13,96 грамм |
Приготавливали три разных раствора гликолипидного адъюванта с изменяющимися концентрациями NaCl, используя фосфатный буфер из Примера 3 и исходный раствор гликозиламида, приготовленный как в Таблице 8.
Аналогично композиции из Примера 4 (Таблица 5) приготавливали раствор гликолипидного адъюванта, содержащий 0 мМ, 15 мМ и 100 мМ NaCl. Растворы 0 мМ и 15 мМ NaCl было возможно профильтровать через фильтр 0,2 микрона. Раствор гликолипидного адъюванта, содержащий 100 мМ NaCl, профильтровать через фильтр 0,2 микрона оказалось невозможно.
| Таблица 9. |
| Приготовление стабильного раствора гликолипидного адъюванта с NaCl и без него |
| Концентрация хлорида натрия (мМ) |
Объем буфера (мл) |
Объем исходного раствора гликозиламида (мл) |
Конечный pH |
O.D. на 600 нм |
| 0 |
465 |
35 |
6,39 |
0,039 |
| 15 |
465 |
35 |
6,37 |
0,073 |
| 100 |
465 |
35 |
6,29 |
0,439 |
По 20 мл каждого из растворов гликолипидного адъюванта помещали в стеклянные флаконы емкостью 30 мл и инкубировали при комнатной температуре и 4°С. С регулярными интервалами времени проводили визуальное наблюдение. Первоначально раствор гликолипидного адъюванта с 0 мМ NaCl был оптически прозрачным. Раствор гликолипидного адъюванта, содержащий 15 мМ NaCl, был слегка мутным и имел O.D. при 600 нм, равную 0,073. Раствор гликолипидного адъюванта, содержащий 100 мМ NaCl, был мутным и имел O.D. при 600 нм, равную 0,439 (Таблица 9). Ни один из этих растворов гликолипидного адъюванта не демонстрировал никаких признаков флокуляции как при комнатной температуре, так и при 4°С. Наблюдение за этими растворами гликолипидного адъюванта проводили в течение периода времени один год, причем изменений во внешнем виде не было отмечено.
Пример 7. Титрование стабильного раствора гликолипидного адъюванта с использованием NaOH
Первоначально оптически прозрачный и стабильный раствор гликолипидного адъюванта был получен без NaOH. С целью установления, что удаление NaOH или использование минимального количества NaOH было существенно для предотвращения флокуляции, необходимо показать, что постепенное добавление NaOH будет индуцировать флокуляцию в приготовленной стабильной гликолипидной смеси. К 15 мл раствора гликолипидного адъюванта без какого-либо добавленного количества NaCl, полученного в соответствии с Таблицей 10, ниже, добавляли соответствующие объемы 1 н. NaOH. Концентрацию NaOH постепенно увеличивали от 1 мМ до 12 мМ (Таблица 10). Раствор гликолипидного адъюванта, использованный в этом эксперименте, был приготовлен с применением исходного раствора гликозиламида, описанного в Примере 6. С увеличением концентрации NaOH в растворе гликолипидного адъюванта pH композиции постепенно повышался с одновременным появлением флокуляции.
| Таблица 10. |
| Титрование стабильного раствора гликолипидного адъюванта с использованием NaOH |
| Объем гликолипидного адъюванта |
Объем добавленного 1 н. NaOH (мМ) |
pH раствора |
| 15 мл |
0 |
6,21 |
| 15 мл |
15 мкл (1 мМ) |
6,38 |
| 15 мл |
30 мкл (2 мМ) |
6,48 |
| 15 мл |
60 мкл (4 мМ) |
6,68 |
| 15 мл |
150 мкл (10 мМ) |
7,11 |
| 15 мл |
750 мкл (50 мМ) |
12,17 |
Пример 8. Количественное определение гликолипидного компонента с использованием HPLC (высокоэффективная жидкостная хроматография)
При проведении HPLC-анализа Bay 15-5831® использовали следующую методологию. Использовали параметры HPLC, описанные в Таблице 11.

| Таблица 12. |
| Стандарты Bay 15-5831® |
| Стандарт |
Концентрация |
| 1 |
0,103 мМ |
| 2 |
0,206 мМ |
| 3 |
0,412 мМ |
| 4 |
0,618 мМ |
| 5 |
0,824 мМ |
| 6 |
1,03 мМ |
Приготавливали стандарты в диапазоне 0,10-1,03 мМ и вводили в колонку для HPLC. Сводка данных по стандартам приведена в Таблице 12. Образцы нагревали до комнатной температуры и переворачивали 5 раз перед использованием. Один мл образца добавляли к 6 мл метанола в мерной колбе на 10 мл. Потом образцы обрабатывали ультразвуком в течение 10 минут, затем разбавляли до (мерного) объема и перемешивали. Для построения графика зависимости площадей пиков от концентрации стандартов применяли метод линейной регрессии. Затем, используя данную кривую, рассчитывали концентрацию в образцах.
Пример 9. Приготовление в масштабе тридцати (30) литров
Приготавливали 30-литровую партию раствора гликолипидного адъюванта с составом, описанным в Примере 6. Эта партия содержала 15 мМ NaCl.
Используя эту 30-литровую партию, приготавливали пять разных субрастворов с возрастающей концентрацией NaOH. Концентрацию NaOH увеличивали от 0 мМ до 1 мМ, 2 мМ, 4 мМ, 8 мМ и 12 мМ. Из образца с каждой концентрацией NaOH отбирали аликвоту для измерения pH и визуального наблюдения. По мере увеличения количеств NaOH pH гликолипидного адъюванта увеличивался одновременно с усилением флокуляции. Флокуляция начинала проявляться при 2 мМ концентрации NaOH при комнатной температуре, а при 4°С флокуляция начинала проявляться при 4 мМ NaOH.
| Таблица 13. |
| Характеристики 30-литровой партии гликолипидного адъюванта при увеличении концентрации NaOH |
 образца образца |
Описание |
Измеренная концентрация (мМ) |
O.D. при 600 нм |
pH |
| 30-л Образец 1 |
15 мМ NaCl, ОмМ NaOH |
6,21 |
0,218 |
6,42 |
| 30-л Образец 2 |
15 мМ NaCl, 1 мМ NaOH |
6,3 |
0,137 |
6,52 |
| 30-л Образец 3 |
15 мМ NaCl, 2 мМ NaOH |
6,24 |
0,137 |
6,59 |
| 30-л Образец 4 |
15 мМ NaCl, 4 мМ NaOH |
6,17 |
0,15 |
6,80 |
| 30-л Образец 5 |
15 мМ NaCl, 8 мМ NaOH |
6,26 |
0,129 |
7,06 |
| 30-л Образец 6 |
15 мМ NaCl, 12 мМ NaOH |
6,15 |
0,062 |
7,54 |
Количество Bay 15-5381 во всех шести образцах, показанных в Таблице 13, определяли, используя метод HPLC, описанный в Примере 8. В образцах с разными pH обнаружена одна и та же концентрация Bay 15-5381, что является подтверждением того, что адъювантный компонент не разлагался в процессе увеличения pH, вызванного добавлением NaOH, и сопровождающей этот процесс флокуляции.
Пример 10. Оценка стабильности с использованием ускоренного тестирования в стрессовых условиях
В этом примере описаны способы и результаты ускоренного тестирования в стрессовых условиях на растворе гликолипидного адъюванта. Три партии растворов гликолипидного адъюванта, которые описаны в Примере 6, приготавливали в масштабе 500 л. Все три партии содержали 15 мМ NaCl и не содержали никакого количества NaOH. Для изучения стабильности гликолипида с применением ускоренного тестирования стабильности использовали растворы гликолипидного адъюванта из этих трех партий объемом по 500 л.
Для ускоренного тестирования в стрессовых условиях раствор гликолипидного адъюванта подвергали встряхиванию в течение семи суток при 37°С с последующим встряхиванием при 4°С в течение двух суток. Встряхивание в течение семи суток при 37°С соответствует старению при 4°С в течение года. Встряхивание при 4°С в течение двух суток соответствует стрессовому условию в процессе транспортировки.
Один набор раствора гликолипидного адъюванта хранили в неподвижном положении при 37°С в течение 7 суток, затем встряхивали при 100 об./мин при 4°С в течение дополнительных 2 суток. Для четырех временных точек, т.е. Т равно 0, 3, 7 и 9 суток, производили наблюдение и фотографирование. Для 2 временных точек, т.е. Т равно 0 и 9 суток, осуществляли измерение показателя преломления и анализ размеров частиц.
Второй набор раствора гликолипидного адъюванта встряхивали при 100 об./мин при 37°С в течение 7 суток; затем встряхивали при 100 об./мин при 4°С в течение дополнительных 2 суток. Для четырех временных точек, т.е. Т равно 0, 3, 7 и 9 суток, производили наблюдение и фотографирование. Для 2 временных точек, т.е. Т равно 0 и 9 суток, осуществляли измерение показателя преломления и анализ размеров частиц.
Третий набор раствора гликолипидного адъюванта хранили в неподвижном состоянии при 4°С в течение 9 суток в качестве контроля. Для четырех временных точек, т.е. Т равно 0, 3, 7 и 9 суток, производили наблюдение и фотографирование. Для 2 временных точек, т.е. Т равно 0 и 9 суток, осуществляли измерение показателя преломления и анализ размеров частиц.
В результате тестирования в стрессовых условиях не обнаружено никаких изменений в размере частиц. Во всех образцах сохранялся субмикронный размер частиц, который наблюдали в образцах сразу же после их приготовления. Кроме того, измерение с использованием HPLC компонента Bay 15-5831® в образцах, выдержанных при 4°С или подвергнутых стрессовым условим при 37°С в течение семи суток, не показало какого-либо изменения в количестве Bay 15-5831®.
| Таблица 15. |
| Количественное определение Bay 15-5831® после тестирования в стрессовых условиях |
| Номер партии раствора гликолипидного адъюванта и обработка |
Измеренная концентрация (мМ) |
| Партия 1 – 4°С |
6,23 |
| Партия 1 – 37°С, встряхивание |
6,29 |
| Партия 2 – 4°С |
6,32 |
| Партия 2 – 37°С, встряхивание |
6,30 |
| Партия 3 – 4°С |
6,28 |
| Партия 3 – 37°С, встряхивание |
6,29 |
В Таблице 15: контрольные образцы хранили при 4°С в течение семи суток, в то время как тестируемые образцы встряхивали при 37°С в течение семи суток. Образцы, встряхиваемые при 37°С в течение семи суток, имели концентрации, аналогичные таковым в образцах, которые хранили при 4°С.
Пример 11. Тестирование противовирусного эффекта раствора гликолипидного адъюванта
Тестирование вирулицидного эффекта проводили на растворе гликолипидного адъюванта, приготовленном в масштабе 30 л, как описано выше в Примере 9. Этот раствор гликолипидного адъюванта содержал 15 мМ NaCl и не содержал никакого количества NaOH.
Гликолипидный адъювант тестировали на его пригодность для использования его в качестве разбавителя с модифицированными живыми вирусами. Модифицированные живые вирусные антигены приготавливают в виде высушенных сублимационной сушкой “таблеток”. После повторного гидратирования этих таблеток с использованием подходящего раствора гликолипидного адъюванта было получено подтверждение, что использованный раствор гликолипидного адъюванта не убивает модифицированные живые вирусы. Раствор гликолипидного адъюванта тестировали против трех бычьих вирусных антигенов: бычьего респираторно – синцитиального вируса (BRSV), вируса парагриппа 3 (PI3) и вируса инфекционного бычьего ринотрахеита (IBR).
Вирусные таблетки повторно гидратировали, используя раствор гликолипидного адъюванта. После инкубации при комнатной температуре (КТ) в течение 1 часа образцы высевали на монослой пермиссивной клеточной линии с серийными разведениями. Посредством подсчета количества вирусных бляшек, которые появляются на монослое, для каждого вирусного антигена, повторно гидратированного с использованием стерильной воды или раствора гликолипидного адъюванта, определяли величину средней цитопатогенной дозы на мл (дозы, инфицирующей 50% клеток тканевой культуры) (TCID50/мл). В этом анализе уменьшение в титре на 0,7 после повторного гидратирования с использованием тестируемого раствора гликолипидного адъюванта трактовали как противовирусный эффект.
Результаты представлены в Таблице 16. Раствор гликолипидного адъюванта не показал какого-либо противовирусного эффекта по отношению к трем бычьим вирусам.
| Таблица 16. |
| Анализ противовирусного эффекта раствора гликолипидного адъюванта |
| Вирус |
Начальный титр |
Конечный титр с гликолипидным адъювантом |
Конечный титр со стерильной водой |
Потеря титра |
| tsIBR 051404 |
7,3±0,5 |
7,08 |
7,49 |
0,42 |
| tsPI3 052604 |
7,6±0,5 |
7,74 |
7,49 |
-0,25 |
| BRSV 081103 |
6,4±0,5 |
6,57 |
6,82 |
0,25 |
В этом примере показано, что раствор гликолипидного адъюванта может быть использован в промышленном препарате вакцины для лечения животных (Animal Health vaccine). Rispoval® действует против заболеваний, вызываемых тремя разными бычьими вирусами, путем применения 3 модифицированных живых вирусных антигенов. Эти бычьи вирусные антигены представляют собой модифицированный живой вирус бычьего герпеса, модифицированный живой бычий респираторно-синцитиальный вирус и модифицированный живой вирус парагриппа 3. Эти вирусные антигены выпускаются в виде лиофилизированных брикетов, и в качестве раствора-разбавителя для этих антигенов может быть использован раствор гликолипидного адъюванта, приготовленный в соответствии с данным изобретением. Используемым гликолипидом был ацетат N-(2-дезокси-2-L-лейциламино- -D-глюкопиранозил)-N-октадецилдодеканамида. -D-глюкопиранозил)-N-октадецилдодеканамида.
Данные примеры приведены для иллюстрации изобретения. Их не следует считать ограничивающими объем изобретения. Специалистам в данной области техники будут очевидны многие изменения, вариации, модификации и другие применения и приложения данного изобретения.
Формула изобретения
1. Адъювантная композиция, содержащая:
а) гликолипид формулы I:
где формула I представляет собой
 , ,
где R1 и R2 независимо представляют собой водород или насыщенный алкильный радикал, имеющий до 20 атомов углерода включительно;
Х представляет собой -CH2-, -O- или -NH-;
R3, R4 и R5 независимо представляют собой водород, -SO4 2-, -PO4 2-, -PO4 2-, -COC1-10алкил; 2-, -COC1-10алкил;
R6 представляет собой L-аланил, L-альфа-аминобутил, L-аргинил, L-аспарагинил, L-аспартил, L-цистеинил, L-глутамил, L-глицил, L-гистидил, L-гидроксипролил, L-изолейцил, L-лейцил, L-лизил, L-метионил, L-орнитинил, L-фенилаланил, L-пролил, L-серил, L-треонил, L-тирозил, L-триптофанил и L-валил или их D-изомеры;
в форме соли, которая образована со слабой кислотой;
б) спирт, который представляет собой HO-C1-3алкил;
в) слабую кислоту, которая 1) присутствует в молярном избытке по отношению к содержанию гликолипида и 2) представляет собой любую кислоту, имеющую величину рКа (-log Ка) от приблизительно 1,0 до приблизительно 9,5 согласно стандартным таблицам или величинам;
г) неионное поверхностно-активное вещество, которое представляет собой агент, уменьшающий поверхностное натяжение вещества, в котором он растворен, и содержащий компонент, который является гидрофобным, и другой компонент, который является гидрофильным.
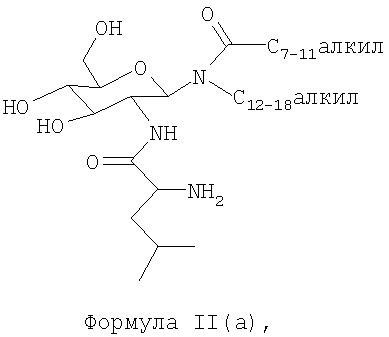
2. Композиция по п.1, где гликолипид представляет собой соединение формулы II(а)
 , ,
а слабая кислота выбрана из следующих слабых кислот: уксусной кислоты, H(C2H3O2) (рКа 4,76); аскорбиновой кислоты (1), H2(C6H6O6) (рКа 4,10); ацетилсалициловой кислоты, H8(C9O4) (рКа 3,5); бутановой кислоты, H(C4H7O2) (рКа 4,83); угольной кислоты, формы 1, H2CO3 (рКа 4,83); хромовой кислоты, формы 2, HCrO4 – (рКа 6,49); формы 1 лимонной кислоты, H3(C6H5O7) (рКа 3,14); формы 2 лимонной кислоты, (H2C6H5O7)– (рКа 4,77); формы 3 лимонной кислоты, (HC6H5O7)2- (рКа 6,39); муравьиной кислоты, H(CHO2) (рКа 3,75); фумаровой кислоты, H4(C4O4) (рКа 3,03); гептановой кислоты, H(C7H13O2) (рКа 4,89); гексановой кислоты, H(C6H11O2) (рКа 4,84); фтористоводородной кислоты, HF (рКа 3,20); изолимонной кислоты, H8(C6O7) (рКа 3,29); молочной кислоты, H(C3H5O3) (рКа 3,08); малеиновой кислоты, H4(C4O4) (рКа 1,83); никотиновой кислоты, H5(C6NO2) (рКа 3,39); формы 1 щавелевой кислоты, H2(C2O4) (рКа 1,23); формы 2 щавелевой кислоты, (HC2O4)– (рКа 4,19); пентановой кислоты, H(C5H9O2) (рКа 4,84); формы 1 фосфорной кислоты, H3PO4 (рКа 2,16); пропановой кислоты, H(C3H5O2) (рКа 4,86); пировиноградной кислоты, H4(C3O3) (рКа 2,39); янтарной кислоты, H6(C4O4) (рКа 4,19) и трихлоруксусной кислоты, H(C2C13O2) (рКа 0,70) или любых их комбинаций. – (рКа 6,49); формы 1 лимонной кислоты, H3(C6H5O7) (рКа 3,14); формы 2 лимонной кислоты, (H2C6H5O7)– (рКа 4,77); формы 3 лимонной кислоты, (HC6H5O7)2- (рКа 6,39); муравьиной кислоты, H(CHO2) (рКа 3,75); фумаровой кислоты, H4(C4O4) (рКа 3,03); гептановой кислоты, H(C7H13O2) (рКа 4,89); гексановой кислоты, H(C6H11O2) (рКа 4,84); фтористоводородной кислоты, HF (рКа 3,20); изолимонной кислоты, H8(C6O7) (рКа 3,29); молочной кислоты, H(C3H5O3) (рКа 3,08); малеиновой кислоты, H4(C4O4) (рКа 1,83); никотиновой кислоты, H5(C6NO2) (рКа 3,39); формы 1 щавелевой кислоты, H2(C2O4) (рКа 1,23); формы 2 щавелевой кислоты, (HC2O4)– (рКа 4,19); пентановой кислоты, H(C5H9O2) (рКа 4,84); формы 1 фосфорной кислоты, H3PO4 (рКа 2,16); пропановой кислоты, H(C3H5O2) (рКа 4,86); пировиноградной кислоты, H4(C3O3) (рКа 2,39); янтарной кислоты, H6(C4O4) (рКа 4,19) и трихлоруксусной кислоты, H(C2C13O2) (рКа 0,70) или любых их комбинаций.
3. Композиция по п.2, где гликолипид представляет собой соединение формулы II(b):

а слабая кислота выбрана из следующих слабых кислот: уксусной кислоты, ацетилсалициловой кислоты; лимонной кислоты; муравьиной кислоты; фумаровой кислоты; фтористоводородной кислоты; изолимонной кислоты; малеиновой кислоты; никотиновой кислоты; фосфорной кислоты; пировиноградной кислоты; янтарной кислоты и трихлоруксусной кислоты или любых их комбинаций.
4. Композиция по п.3, где гликолипид представляет собой ацетат N-(2-дезокси-2-L-лейциламино- -D-глюкопиранозил)-N-октадецилдодеканамида, имеющего структуру формулы III: -D-глюкопиранозил)-N-октадецилдодеканамида, имеющего структуру формулы III:

а слабая кислота представляет собой уксусную кислоту.
5. Композиция по п.2, где слабая кислота выбрана из группы, состоящей из уксусной кислоты; ацетилсалициловой кислоты; формы 1 лимонной кислоты; формы 2 лимонной кислоты; формы 3 лимонной кислоты; муравьиной кислоты; фумаровой кислоты; фтористоводородной кислоты; изолимонной кислоты; малеиновой кислоты; никотиновой кислоты; формы 1 фосфорной кислоты; пировиноградной кислоты; янтарной кислоты и трихлоруксусной кислоты.
6. Композиция по п.1, где указанная слабая кислота присутствует в количестве, превышающем молярный эквивалент гликолипида, или присутствует в количестве, превышающем молярный эквивалент гликолипида в следующее количество раз:
а) в 1,25 раза,
б) в 2,0 раза,
в) в 2,5 раза,
г) в 2,7 раза,
д) в 3,0 раза,
е) в 5,0 раз.
7. Композиция по п.1, где спирт является этиловым спиртом.
8. Композиция по п.1, где указанное неионное поверхностно-активное вещество выбрано из любого вещества из группы, состоящей из: сорбитанмонолаурата, сорбитанмонопальмиата, сорбитанмоностеарата, сорбитантристеарата, сорбитанмоноолеата, сорбитантриолеата, полиоксиэтиленсорбитанмонолаурата, полиоксиэтиленсорбитан-монопальмиата, полиоксиэтиленсорбитанмоностеарата, полиоксиэтиленсорбитанмоноолеата, полиоксиэтиленсорбитантриолеата и других сорбитанов и полиоксиэтиленсорбитанов, обычно используемых в вакцинах, или любых их комбинаций.
9. Адъювантная композиция, содержащая:
а) гликолипид формулы I:
где формула I представляет собой

где R1 и R2 независимо представляют собой водород или насыщенный алкильный радикал, имеющий до 20 атомов углерода включительно; X представляет собой -CH2-, -O- или -NH-;
R3, R4, и R5 независимо представляют собой водород, -SO4 2-, -PO4 2-, -PO4 2-, -COC1-10алкил; 2-, -COC1-10алкил;
R6 представляет собой L-аланил, L-альфа-аминобутил, L-аргинил, L-аспарагинил, L-аспартил, L-цистеинил, L-глутамил, L-глицил, L-гистидил, L-гидроксипролил, L-изолейцил, L-лейцил, L-лизил, L-метионил, L-орнитинил, L-фенилаланил, L-пролил, L-серил, L-треонил, L-тирозил, L-триптофанил и L-валил или их D-изомеры;
в форме соли, которая образована со слабой кислотой,
б) спирт, который представляет собой HO-C1-3алкил;
в) слабую кислоту, которая 1) присутствует в молярном избытке по отношению к содержанию гликолипида и 2) представляет собой любую кислоту, имеющую величину рКа (-log Ка) от приблизительно 1,0 до приблизительно 9,5 согласно стандартным таблицам или величинам;
г) неионное поверхностно-активное вещество, которое представляет собой агент, уменьшающий поверхностное натяжение вещества, в котором он растворен, и содержащий компонент, который является гидрофобным, и другой компонент, который является гидрофильным; и
д) водный буфер, причем подходящим буфером является буфер, пригодный для применения в вакцинах и способный поддерживать pH других ингредиентов в диапазоне pH от приблизительно 6 до приблизительно 8,
при условии, что использовано не более 50 мМ NaCl.
10. Композиция по п.9, где pH раствора доведен до относительно постоянного pH в водном растворе от приблизительно 6 до приблизительно 7, а буфер выбран из группы, состоящей из фосфатных буферов, содержащих одну или обе одноосновную и двухосновную соли фосфат натрия и/или фосфат калия в одинаковых или разных соотношениях.
11. Композиция по п.9, где указанный буфер выбран из группы, состоящей из:
а) 2-(N-морфолино)этансульфоновой кислоты (также известной как МЕS);
б) 3-(N-морфолино)пропансульфоновой кислоты (также известной как MOPS);
в) н-[трис(гидроксиметил)]-2-аминоэтансульфоновой кислоты (также известной как TES);
г) 4-(2-гидроксиэтил)пиперазин-1-этансульфоновой кислоты (также известной как HEPES) и
д) [трис(гидроксиметил)метил] глицина (также TRIS) или любой их комбинации.
12. Композиция по любому из пп.1-11, дополнительно содержащая антиген, выбранный из группы, состоящей из модифицированного живого бычьего вируса герпеса, модифицированного живого бычьего респираторно-синцитиального вируса и модифицированного живого вируса парагриппа 3 или любой их комбинации.
13. Адъювантная композиция, содержащая:
а) ацетат N-(2-дезокси-2-L-лейциламино- -D-глюкопиранозил)-N-октадецилдодеканамида, имеющего структуру формулы III: -D-глюкопиранозил)-N-октадецилдодеканамида, имеющего структуру формулы III:

б) этанол;
в) уксусную кислоту, которая присутствует в молярном избытке по отношению к содержанию гликолипида;
г) неионное поверхностно-активное вещество, выбранное из: сорбитанмонолаурата, сорбитанмонопальмиата, сорбитанмоностеарата, сорбитантристеарата, сорбитанмоноолеата, сорбитантриолеата, полиоксиэтиленсорбитанмонолаурата, полиоксиэтиленсорбитан-монопальмиата, полиоксиэтиленсорбитанмоностеарата, полиоксиэтилен-сорбитанмоноолеата, полиоксиэтиленсорбитантриолеата,
д) водный буфер, где pH раствора доведен до относительно постоянного pH в водном буферном растворе от приблизительно 6 до приблизительно 7, а буфер выбран из группы, состоящей из:
1) 2-(N-морфолино)этансульфоновой кислоты (также известной как МЕS);
2) 3-(N-морфолино)пропансульфоновой кислоты (также известной как MOPS);
3) н-[трис(гидроксиметил)]-2-аминоэтансульфоновой кислоты (также известной как TES);
4) 4-(2-гидроксиэтил)пиперазин-1-этансульфоновой кислоты (также известной как HEPES) и
5) [трис(гидроксиметил)метил]глицина (также TRIS) или любой их комбинации,
при условии, что использовано не более 15 мМ NaCl, и
е) антиген, состоящий, по существу, из модифицированного живого бычьего вируса герпеса, модифицированного живого бычьего респираторно-синцитиального вируса и модифицированного живого вируса парагриппа 3.
14. Способ изготовления композиции, включающий совместное смешивание следующего:
А) гликолипида формулы I;
Б) спирта, который представляет собой HO-C1-3алкил;
В) слабой кислоты, где количество слабой кислоты находится в молярном избытке по отношению к содержанию гликолипида; и
Г) неионного поверхностно-активного вещества.
15. Способ изготовления композиции, включающий совместное смешивание следующего:
А) гликолипида формулы I;
Б) спирта, который представляет собой HO-C1-3алкил;
В) слабой кислоты, где количество слабой кислоты находится в молярном избытке по отношению к содержанию гликолипида;
Г) неионного поверхностно-активного вещества и затем добавление Д) подходящего буфера.
|
|