Патент на изобретение №2392947
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ КЛЕТОЧНОГО МАТЕРИАЛА ДЛЯ ТРАНСПЛАНТАЦИИ ПРИ МИЕЛОСУПРЕССИИ
(57) Реферат:
Изобретение относится к экспериментальной медицине и касается получения клеточного материала для трансплантации при миелосупрессии. Для этого лабораторному животному подкожно вводят рекомбинантный гранулоцитарный колониестимулирующий фактор (Г-КСФ) в дозе 125 мкг/кг 1 раз в сутки в течение 3 дней. Одновременно внутрибрюшинно вводят гиалуронидазу в дозе 1000 УЕ/кг 1 раз в сутки в течение 2 дней. Затем получают фракцию мононуклеаров периферической крови и помещают ее в сбалансированную питательную среду, содержащую 10-8 моль/мл D-глюкуроновой кислоты, с последующей инкубацией в течение 2 часов. Введение Г-КСФ и гиалуронидазы в разработанных дозах и режиме, в сочетании с инкубацией с D-глюкуроновой кислотой обеспечивает повышение терапевтической активности трансплантата за счет увеличения мононуклеаров в периферической крови и повышения их способности к энграфтингу. 4 табл.
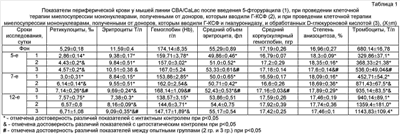
Изобретение относится к медицине, конкретно, к экспериментальной гематологии и клеточным технологиям, и касается способа получения клеточного материала для трансплантации. Одним из самых распространенных способов получения клеточного материала, содержащего стволовые клетки (СК), для трансплантации при экспериментальной терапии различных заболеваний [1], а также для клинического использования в онкологии (при лечении осложнений, связанных с нарушением кроветворения при проведении химио- и лучевой терапии), является способ получения фракции мононуклеаров периферической крови после назначения гранулоцитарного колониестимулирующего фактора (Г-КСФ) [2, 3, 4]. Данный способ является наиболее близким к заявляемому по механизму действия и техническому результату и выбран в качестве прототипа. Недостатком способа является недостаточная терапевтическая активность получаемого клеточного материала. Задачей, решаемой данным изобретением, является увеличение терапевтической активности получаемого клеточного материала. Поставленная задача достигается техническим решением, представляющим собой способ получения клеточного материала для терапии миелосупрессий, заключающийся в получении фракции мононуклеаров периферической крови после подкожного введения препарата гранулоцитарного колониестимулирующего фактора в дозе 125 мкг/кг 1 раз в сут в течение 3 дней и внутрибрюшинного введения препарата гиалуронидазы в дозе 1000 УЕ/кг 1 раз в сут в течение 2 дней, с последующей инкубацией фракции мононуклеаров в сбалансированной питательной среде, содержащей 10-8 моль/мл D-глюкуроновой кислоты, в течение 2 часов. Новым в предлагаемом изобретении является дополнительное введение гиалуронидазы в дозе 1000 УЕ/кг 1 раз в сут в течение 2 дней и инкубация фракции мононуклеаров в среде, содержащей 5 мкг/мл D-глюкуроновой кислоты, в течение 2 часов. В настоящее время весьма перспективными для лечения различных заболеваний выглядят способы клеточной терапии [1]. В онкологической практике при получении трансплантанта, для лечения гематологических осложнений после проведения лучевой – и химиотерапии широко используют способ-прототип – получение фракции мононуклеаров периферической крови, обогащенной прогенеторными элементами за счет способности Г-КСФ вызывать выход СК, в том числе гемопоэтических, в циркуляцию [2, 3, 4]. Известна возможность увеличения доли содержания прогениторных элементов в клеточном материале из периферической крови, получаемом с помощью Г-КСФ, путем дополнительного назначения гиалуронидазы [5] – фермента, участвующего в метаболизме гиалуроновой кислоты (ГК). Однако, согласно данных литературы [6], а также собственных наблюдений применение данного фермента приводит к нарушению способности прогениторных клеток, полученных из периферической крови доноров, к их энграфтингу («оседанию» и «приживлению»). Данный феномен, очевидно, связан с тем, что ГК является не только одним из основных компонентов межклеточного матрикса тканей организма, в том числе и гемопоэтической ткани [7, 8], но и входит в состав гликокаликса клеток, их рецепторов к биологически активным веществам [7, 9], а также содержится во внуткиклеточных структурах (цитоплазме, ядре, ядрышках) [7]. Указанные обстоятельства определяют модифицирующее влияние данного фермента на структуру клеточной стенки, в том числе прогениторных элементов, уровни экспрессии рецепторов, а также активности их взаимодействия с лигандами, что в целом нарушает реализацию ростового потенциала СК материала, обработанного гиалуронидазой, при его трансплантации. В то же время известно, что одним из составных компонентов мономера ГК является D-глюкуроновая кислота, а также высокая скорость метаболизма данного гликозаминогликана [7]. В частности, период полураспада ГК в сыворотки крови составляет 2-5 минут [7]. Тем не менее, на сегодняшний день не известна возможность восстановления функциональной полноценности прогениторных клеток, подверженных воздействию гиалуронидазы, путем их инкубации перед трансплантацией в среде, содержащей D-глюкуроновую кислоту. Факт дополнительного использования гиалуронидазы с дальнейшей инкубацией клеточного материала в среде, содержащей D-глюкуроновую кислоту, с целью повышения терапевтической активности получаемого трансплантанта для терапии миелосупрессии для специалиста не является очевидным и не вытекает явным образом из уровня техники в данной области. Новые признаки позволяют повысить терапевтическую активность трансплантанта. Предлагаемое изобретение может быть использовано в экспериментальной биологии и медицине с выходом в практическое здравоохранение для создания новых эффективных способов клеточной терапии. Идентичной совокупности признаков при исследовании уровня техники по патентной и научно-медицинской литературе не обнаружено. Исходя из вышеизложенного, следует считать заявляемое техническое решение соответствующим критериям: «Новизна», «Изобретательский уровень», «Промышленная применимость». Способ осуществляют следующим образом: Лабораторному интактному животному-донору (мыши) начинают одновременно вводить внутрибрюшинно препарат гиалуронидазы в дозе 1000 УЕ/кг 1 раз в сутки в течение 2-х дней и подкожно препарат гранулоцитарного колониестимулирующего фактора в дозе 125 мкг/кг 1 раз в сут в течение 3 дней. На 3-и сут после начала введения препаратов в стерильных условиях периферическую кровь животных собирают, гепаринизируют до конечной концентрации гепарина 40 Ед/мл. Затем с помощью специального раствора с плотностью 1077 кг/м3 путем центрифугирования и разделения клеток крови на разные фракции собирают фракцию мононуклеаров периферической крови. Клеточный материал разводят сбалансированной питательной средой, содержащей 10-8 моль/мл D-глюкуроновой кислоты, до концентрации 10-30 млн. клеток/мл и инкубируют в течение 2 часов. Заявляемая доза и режим введения гиалуронидазы и Г-КСФ подобраны опытным путем и являются оптимальными для получения заявленного технического результата. Повышение дозы и кратности введения гиалуронидазы отменяют получение заявленного технического результата. Уменьшение дозы гиалуронидазы и/или однократное введение препарата значительно снижают эффективность способа. Повышение дозы и кратности введения Г-КСФ (сопровождаемое увеличением ксенобиотической нагрузки на организм и развитием ряда побочных эффектов и осложнений) не приводит к возрастанию эффективности способа, а снижение указанных показателей режима введения Г-КСФ снижает его эффективность. Концентрация D-глюкуроновой кислоты в питательной среде и длительность инкубации также определены опытным путем и являются оптимальными. Опытным путем также показано, что инкубация трансплантанта, полученного с помощью только Г-КСФ, до использования в растворе, содержащем D-глюкуроновую кислоту, не влияет на его терапевтическую активность. Предлагаемый способ был изучен в экспериментах на мышах линии CBA/CaLac в количестве 250 штук, массой 18-20 г. Мыши 1 категории (конвенциональные линейные мыши) получены из питомника отдела экспериментального биомедицинского моделирования НИИ фармакологии ТНЦ СО РАМН (сертификат имеется). Оценку эффективности предлагаемого способа осуществляли по сравнению терапевтической активности трансплантантируемого материала, полученного по заявляемому способу и способу прототипу, при моделировании миелосупрессии. Миелосупресссию у животных-реципиентов моделировали путем однократного внутрибрюшинного введения 5-фторурацила в дозе 1/2 от максимально переносимой дозы (МПД). Через сутки после введения цитостатика опытным животным однократно внутривенно вводили по 1,5 млн мононуклеаров. В одном случае, мононуклеары были получены по заявленному способу, в другом – по способу-прототипу. Контрольным животным в эквивалентном объеме вводили питательную среду. На 5, 7 и 12-е сут после введения цитостатика с помощью автоматического гематологического анализатора ABACUS (Diatron, Австрия) и стандартных гематологических методов определяли количество эритроцитов, тромбоцитов, ретикулоцитов, общее количество лейкоцитов и их различных морфологических форм в периферической крови и показатели костномозгового кроветворения [10]. Кроме того, изучали число эритроидных (КОЕ-Э), грануломоноцитарных (КОЕ-ГМ) и фибробластных (КОЕ-Ф) клеток-предшественников в костном мозге, а также пролиферативную активность и скорость дифференцировки кроветворных прекурсоров [11]. Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента и непараметрического U-критерия Вилкоксона-Манна-Уитни. Пример 1. Опытным мышам вводили внутрибрюшинно препарат гиалуронидазы («Лидаза», ФГУП «НПО Микроген» МЗ РФ) в дозе 1000 УЕ/кг 1 раз в сутки в течение 2-х дней и подкожно препарат гранулоцитарного колониестимулирующего фактора («Нейпоген», «Hoffman-la Roche», Швейцария) в дозе 125 мкг/кг 1 раз в сут в течение 3 дней. Контрольным животным по соответствующей схеме (по способу-прототипу) подкожно вводили препарат гранулоцитарного колониестимулирующего фактора («Нейпоген», «Hoffman-la Roche», Швейцария). На 3-и сут после начала введения препаратов периферическую кровь животных обеих групп брали в стерильных условиях из шейных сосудов после частичной декапитации животного с помощью ножниц. Шерсть на шеи мышей предварительно выстригалась, и область будущего разреза обрабатывалась 70% спиртом. Кровь собирали в центрифужную пробирку с воронкой, гепариназировали (до 40 ЕД/мл гепарина (“Biochemie”, Австрия)) и использовали для получения лейкоконцентрата (фракции мононуклеаров). Для этого гепаринизированную кровь наслаивали на 3 мл раствора «Histo-paque-1077» (“Sigma”, США) и центрифугировали в течение 15 мин при 3000 об/мин. При необходимости процедуру повторяли. После центрифугирования в пробирке над фракцией эритроцитов образовывалось «опалисцирующее кольцо», состоящее из мононуклеаров периферической крови, которые с помощью микропипетки собирали и переносили в препаровочную среду (95% RPMI-1640, 5% эмбриональной телячьей сыворотки (ЭТС) (“Sigma”, США)). Полученный материал дважды отмывали центрифугированием при 1500 об/мин в течение 5-10 мин. Затем клетки помещали в среду следующего состава: 90% RPMI-1640 (“Sigma”, США), 10% инактивированной ЭТС (“Sigma”, США), 280 мг/л L-глутамина (“Sigma”, США), 50 мг/л гентамицина (“Serva”, ФРГ), 40 Ед/мл гепарина (“Biochemie”, Австрия), суспендировали, с помощью раствора трипанового синего подсчитывали количество жизнеспособных клеток. Клеточный материал разводили до концентрации 15 млн. клеток/мл в среде, содержащей 10-8 моль/мл D-глюкуроновой кислоты. После чего клеточную взвесь инкубировали в CO2 инкубаторе (“Jouan”, Франция) при 37°C, 5% CO2 и 100% влажности воздуха, в течение 2-х часов. Изучение эффективности предлагаемого способа осуществляли по сравнению с терапевтической активностью трансплантанта, полученного по заявляемому способу и способу-прототипу при моделировании миелосупрессии. Миелосупресссию у животных-реципиентов моделировали путем однократного внутрибрюшинного введения «5-фторурацил-Эбеве» (Эбеве Фарма ГмбХ, (Австрия)) в дозе 1/2 МПД (114 мг/кг). Через сутки после введения цитостатика животным внутривенно однократно вводили 1,5 млн мононуклеаров. Контрольным мышам вводили клеточный материал, полученный по способу-прототипу, а опытным животным – по заявленному способу. Мышам цитостатического контроля в эквивалентном объеме (0,1 мл) внутривенно вводили культуральную среду (90% RPMI-1640 (“Sigma”, США), 10% инактивированной ЭТС (“Sigma”, США), 280 мкг/мл L-глутамина (“Sigma”, США), 40 Ед/мл гепарина (“Biochemie”, Австрия), 10-8 моль/мл D-глюкуроновой кислоты (“Sigma”, США). Введение мононуклеаров периферической крови животным после моделирования миелосупрессии приводило к значительному ускорению регенерации кроветворной ткани. В обеих опытных группах наблюдалось значительное увеличение количества ретикулоцитов, эритроцитов, тромбоцитов, а также общего количества лейкоцитов, палочко- и сегментоядерных нейтрофилов в периферической крови. При этом существенно более выраженными изменения были в группе мышей, которым вводили клеточный материал, полученный после совместного использования Г-КСФ и гиалуронидазы (табл.1, 2). Указанные изменения явились закономерным отражением костномозгового кроветворения. Клеточная терапия сопровождалась значительным возрастанием количества незрелых (ННГ) и зрелых (ЗНГ) нейтрофильных гранулоцитов, а также эритрокариоцитов в костном мозге мышей с подавленным цитостатиком кроветворением (табл.3). При этом число данных клеточных элементов в опытной группе достоверно превышало аналогичные показатели у контрольных животных. Максимальная разница регистрировалась: в отношении количества ННГ на 44,2% на 7-е сут, ЗНГ на 50,0% на 5-е сут, и содержания эритрокариоцитов на 45,3% на 7-е сут опыта. Изучение механизмов ускорения регенерации кроветворной ткани выявило определяющую роль повышения содержания эритроидных и грануломоноцитарных клеток-предшественников в костном мозге, их пролиферативной активности и скорости созревания. Причем во всех случаях существенно более значимыми изменения были у животных опытной группы (табл.4). В частности, количество КОЕ-Э и КОЕ-ГМ на 7-е сут в опытной группе было выше, чем в контроле, на 90,9% и 61,5% соответственно. Кроме того, трансплантация мононуклеаров, содержащих СК [3, 4, 5], приводила к увеличению КОЕ-Ф в гемопоэтической ткани. Причем наиболее значительными данные изменения имели место при введении клеточных элементов животных, получавших оба препарата. Учитывая важную роль гемопоэзиндуцирующего микроокружения (ГИМ) [1], указанные изменения позволяют говорить о значительном участии стромальных клеточных элементов в восстановлении подавленного цитостатиком кроветворения. Особенно существенным представляется роль данного механизма компенсации при введении антиметаболита (5-фторурацила), который значительно нарушает функционирование элементов ГИМ и их кооперацию с кроветворными клетками, тем самым замедляя регенерацию гемопоэтической ткани при цитостатическом воздействии [12]. Таким образом, полученные результаты свидетельствуют о существенном повышении эффективности проведения клеточной терапии миелосупрессии трансплантатом, полученным из периферической крови при совместном использовании гиалуронидазы и Г-КСФ и обработанным D-глюкуроновой кислотой, чем при применении клеточного материала только после Г-КСФ. Предлагаемый способ позволяет значительно повысить терапевтическую активность клеточного материала. Литература 1. Гольдберг Е.Д., Дыгай A.M., Зюзьков Г.Н. Гипоксия и система крови. – Томск: Изд-во Том. ун-та, 2006. – С.79-105. 4. Borota R., Borota J., Beli
10. Лабораторные методы исследования в клинике: Справочник / Под ред. В.В.Меньшикова, М. – 1987. – 152 с. 11. Гольдберг Е.Д., Дыгай A.M., Шахов В.П. Методы культуры ткани в гематологии. – Томск: Изд-во ТГУ, 1992. – С.130-145. 12. Гольдберг Е.Д., Дыгай A.M., Жданов В.В. Роль гемопоэзиндуцирующего микроокружения при цитостатических миелосупрессиях. – Томск, 1999. – 114 с.
Формула изобретения
Способ получения клеточного материала для трансплантации при миелосупрессии, заключающийся в получении фракции мононуклеаров периферической крови после введения препарата рекомбинантного гранулоцитарного колониестимулирующего фактора подкожно в дозе 125 мкг/кг 1 раз в сутки в течение 3 дней, отличающийся тем, что дополнительно внутрибрюшинно вводят препарат гиалуронидазы в дозе 1000 УЕ/кг 1 раз в сутки в течение 2 дней, а затем фракцию мононуклеаров помещают в сбалансированную питательную среду, содержащую 10-8 моль/мл D-глюкуроновой кислоты, и инкубируют в течение 2 ч.
|
||||||||||||||||||||||||||

 2, с.115-119. KUSMINSKY G. et al. “Allogenic hematopoietic transplantation with stem cells extracted from peripheral blood”. Medicina 2000; 60(2): 179-87, реферат, найдено 25.06.2009 из PubMed PMID: 10962806.
2, с.115-119. KUSMINSKY G. et al. “Allogenic hematopoietic transplantation with stem cells extracted from peripheral blood”. Medicina 2000; 60(2): 179-87, реферат, найдено 25.06.2009 из PubMed PMID: 10962806. A., Gebauer E., Stefanovi
A., Gebauer E., Stefanovi