|
|
(21), (22) Заявка: 2008118409/15, 12.05.2008
(24) Дата начала отсчета срока действия патента:
12.05.2008
(43) Дата публикации заявки: 20.11.2009
(46) Опубликовано: 20.06.2010
(56) Список документов, цитированных в отчете о
поиске:
RU 2238939, C2, 27.10.2004. МУРАВЬЕВ И.А. Технология лекарств. – М.: Медицина, 1980, с.343-435. RU 2281096 C2, 10.08.2006. RU 2340341 C2, 10.02.2008.
Адрес для переписки:
344090, г.Ростов-на-Дону, пр. Стачки, 194/2, НИИФОХ, патентная служба, М.И.Румянцевой
|
(72) Автор(ы):
Анисимова Вера Алексеевна (RU),
Косолапов Вадим Анатольевич (RU),
Минкин Владимир Исаакович (RU),
Петров Владимир Иванович (RU),
Спасов Александр Алексеевич (RU)
(73) Патентообладатель(и):
Федеральное государственное образовательное учреждение высшего профессионального образования “Южный федеральный университет”(ФГОУ ВПО ЮФУ) (RU),
Государственное образовательное учреждение высшего профессионального образования “Волгоградский государственный медицинский университет” (ГОУ ВПО ВолГМУ) (RU)
|
(54) ДИГИДРОБРОМИД 2-(3,4-ДИГИДРОКСИФЕНИЛ)-9-ДИЭТИЛАМИНОЭТИЛИМИДАЗО[1,2-a] БЕНЗИМИДАЗОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ
(57) Реферат:
Изобретение относится к области медицины, в частности к фармации, и касается применения дигидробромид 2-(3,4-дигидроксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола при производстве лекарственного средства, обладающего противоишемическими, гемореологическими и антирадикальными свойствами, а также фармацевтической композиции, содержащей указанный активный компонент и обладающей указанными выше свойствами. Средство обладает высокой и не обладает выраженными побочными эффектами. 2 н. и 8 з.п. ф-лы, 18 табл., 1 ил.
Предлагаемое изобретение относится к медицине, а именно к фармацевтической химии, фармакологии и технологии лекарственных форм, и направлено на создание лекарственного препарата с противоишемическими, гемореологическими и антирадикальными свойствами.
 1. – P.59-66). 1. – P.59-66).
 4. – 429-443). 4. – 429-443).
  9. – С.265-267). 9. – С.265-267).
Техническим результатом изобретения является создание средства, обладающего более высокой противоишемической, гемореологической и антирадикальной активностью.
Технический результат достигается дигидробромидом 2-(3,4-диоксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола формулы I
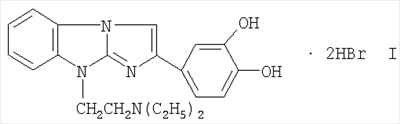
Известно, что дигидробромид 2-(3,4-диоксифенил)-9-диэтил-аминоэтилимидазо[1,2-а]бензимидазола оказывает церебропротекторное действие при радиационных поражениях (Патент РФ  2238938, C07D 235/04, 2004 г.). 2238938, C07D 235/04, 2004 г.).
Способ получения дигидробромида 2-(3,4-дигидроксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола заключается в конденсации 1-диэтиламиноэтил-2-аминобензимидазола с 3,4-диметоксифенацилбромидом, последующей циклизации образующегося в результате конденсации бромида 1-диэтиламиноэтил-3-(3,4-диметоксифенацил)-2-аминобензимидазолия в 48%-ной бромистоводородной кислоте (т.кип. 127°С), сопровождающейся деметилированием метоксигрупп и образованием искомого дигидробромида 2-(3,4-дигидроксифенил)замещенного имидазо[1,2-а]бензимидазола (аналогию см. Хим.-фарм. журнал, 2006 г., т.40,  10, с.3-10). 10, с.3-10).
Ниже приведен пример получения соединения I.
Пример. Дигидробромид 2-(3,4-диоксифенил)-9-этиламиноэтилимидазо[1,2-а]бензимидазола (I).
В раствор 2,32 г (10 ммоль) 2-амино-1-диэтиламиноэтилбензимидазола в 25 мл ацетона вносят 2,6 г (10 ммоль) 3,4-диметоксифенацилбромида. Выпавший осадок бромида 2-амино-1-(2-диэтиламиноэтил)-3-(3,4-диметоксифенацил)бензимидазолия отфильтровывают, промывают ацетоном. Выход 4,6 г (93,5%). Т.пл. 182°С (разложение, из спирта). Найдено, %: C 56,2; H 6,4; Br 16,4; N 11,3. C23H30N4O3·HBr. Вычислено, %: C 56,2; H 6,4; Br 16,3; N 11,4. ИК-спектр (вазелиновое масло): 1685 см-1 (C=O).
Кипятят 4 г (~8 ммоль) полученного бромида в 160 мл конц. HBr (т.кип.127°С) до полного протекания реакции (контроль – ТСХ: исчезновение пятна исходного имина и промежуточно образующегося 2-(3,4-диметоксифенил)замещенного имидазо[1,2-а]бензимидазола). По охлаждении осадок искомого дигидробромида отфильтровывают, промывают ацетоном. Выход 4,1 г (96%). Кристаллизуется соль из 80%-ного водного спирта в виде белоснежных волокнистых кристаллов, которые после высушивания при 110-120°С имеют т.пл. 289-290°С (разложение). Кристаллогидрат с 1 молекулой воды плавится при 180°С. В ИК-спектре полученного дигидробромида отсутствует полоса поглощения карбонильной группы, присутствующая в ИК-спектре четвертичной соли. Найдено, %: C 47,6; H 5,3; Br 30,0; N 10,7. C21H24N4O2·2HBr. Вычислено, %: C 47,9; H 5,0; Br 30,4; N 10,7.
Фармакологические свойства заявленного соединения I.
Данное соединение (I) проявляет противоишемические и гемореологические свойства, обладает широким спектром антирадикальной активности.
Исследование противоишемической активности соединения I in vivo (модель 4-сосудистой перевязки артерий мозга с реперфузией у крыс)
Материалы и методы
Опыты выполнены на 40 неинбредных крысах обоего пола массой 180-230 г, которых содержали в условиях вивария с естественным световым режимом на стандартной диете лабораторных животных (ГОСТ Р50258-92) с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997), а также правил лабораторной практики при проведении доклинических исследований в РФ. Забой животных проводили согласно требованиям, изложенным в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1989).
Соединение I (5 мг/кг) и препарат сравнения кавинтон (5 мг/кг) вводили однократно внутрибрюшинно за 10 мин перед окклюзией каротидных артерий. Для исследования было сформировано 3 группы: 1) контроль – ложнооперированные крысы; 2) ишемия; 3) животные с ишемией, которым за 10 мин до окклюзии вводили исследуемое вещество.
 7. – P.918-924). Первоначально производили термокоагуляцию вертебробазилярных артерий. Через 4 сут после восстановления животных на каротидные артерии накладывали окклюзоры без пережатия. Все этапы операции проводили под наркозом (калипсол 80-100 мг/кг, в/бр). На следующие сутки после второй операции моделировали тотальную ишемию головного мозга пережатием каротидных артерий окклюзорами в течение 30 мин. Реперфузия достигалась снятием окллюзоров, восстановление кровотока контролировали визуально. 7. – P.918-924). Первоначально производили термокоагуляцию вертебробазилярных артерий. Через 4 сут после восстановления животных на каротидные артерии накладывали окклюзоры без пережатия. Все этапы операции проводили под наркозом (калипсол 80-100 мг/кг, в/бр). На следующие сутки после второй операции моделировали тотальную ишемию головного мозга пережатием каротидных артерий окклюзорами в течение 30 мин. Реперфузия достигалась снятием окллюзоров, восстановление кровотока контролировали визуально.
 10. – С.475-477.). Неврологический статус оценивали по 3-х балльной шкале с учетом нормальных (2 балла), сниженных (1 балл) или отсутствующих (0 баллов) рефлексов (роговичного, отдергивания хвоста, задней лапы, переворачивания, хватания передними лапами и вздрагивания на звуковой раздражитель). На 7-е сут реперфузии исследовали запоминание аверсивного стимула в тесте условной реакции пассивного избегания (УРПИ), обучение проводили предварительно за 1 час до начала ишемии. При наблюдении за животными позже 7 сут динамики отмечено не было. 10. – С.475-477.). Неврологический статус оценивали по 3-х балльной шкале с учетом нормальных (2 балла), сниженных (1 балл) или отсутствующих (0 баллов) рефлексов (роговичного, отдергивания хвоста, задней лапы, переворачивания, хватания передними лапами и вздрагивания на звуковой раздражитель). На 7-е сут реперфузии исследовали запоминание аверсивного стимула в тесте условной реакции пассивного избегания (УРПИ), обучение проводили предварительно за 1 час до начала ишемии. При наблюдении за животными позже 7 сут динамики отмечено не было.
Смертность в ходе эксперимента колебалась между 25 и 35%. Гибель после термокоагуляции вертебробазилярных артерий составляла не более 10%. После 2-го этапа – наложения окклюзора на каротидные артерии гибели животных не наблюдали.
Статистическую обработку данных проводили в пакете Statistica 6.0. па (StatSoft, США) с использованием дисперсионного анализа множественных сравнений и критерия Шеффе (p 0,05 или p 0,05 или p 0,01). 0,01).
Результаты.
При изучении влияния соединения I на восстановление крыс в реперфузионном периоде после ишемии было установлено, что соединение I превосходило препарат сравнения кавинтон по активности, более выражено восстанавливая нарушенную двигательную активность в 1-е и 2-е сут реперфузии (Таблица 1). Соединение I достоверно улучшало неврологический статус и вызывало его полную нормализацию на 7-е сут наблюдений (Таблица 2), а также практически полное восстановление мышечной силы (Таблица 3). Кавинтон не приводил к полной нормализации неврологического статуса и динамометрии – на 7-е сут дефицит составлял 34% и 23,5% соответственно. Соединение I нормализовало запоминание обучающего задания в тесте УРПИ у животных, перенесших тотальную ишемию мозга, сокращая дефицит памяти до 15,3% (p<0,01) (Таблица 4). Препарат сравнения также оказывал некоторое корректирующее влияние на памятный след, однако дефицит памяти под влиянием кавинтона составлял 50,3%.
Таким образом, соединение I превосходит препараты сравнения дибунол и кавинтон по противоишемической активности.
Исследование антирадикальной активности соединения I in vitro
Материалы и методы
В качестве препарата сравнения использовали мексидол (НИИ фармакологии РАМН, Россия). Исследование процессов хемилюминесценции проводили на хемилюминометре «Хемилюминомер-03» (Уфа, Россия), связанном интерфейсом с компьютером.
Способность веществ взаимодействовать с липидными радикалами LOO исследовали на модели Fe2+4 (чда, Украина) в конечной концентрации 2,5 мМ при интенсивном перемешивании и t 37°C, после чего в течение 10 мин измеряли кинетику хемилюминесценции. исследовали на модели Fe2+4 (чда, Украина) в конечной концентрации 2,5 мМ при интенсивном перемешивании и t 37°C, после чего в течение 10 мин измеряли кинетику хемилюминесценции.
 24. – С.33-34), в кювету хемилюминометра добавляли фосфатный буфер pH 7,45, содержащий 1 мкМ люминола (Serva, Германия) и 5 мМ цитрата натрия (ЧД, Россия) в конечном объеме 20 мл. Инициирование ХЛ осуществляли FeSO4 в конечной концентрации 2,5 мМ при интенсивном перемешивании и в течение 5 мин измеряли кинетику ХЛ. 24. – С.33-34), в кювету хемилюминометра добавляли фосфатный буфер pH 7,45, содержащий 1 мкМ люминола (Serva, Германия) и 5 мМ цитрата натрия (ЧД, Россия) в конечном объеме 20 мл. Инициирование ХЛ осуществляли FeSO4 в конечной концентрации 2,5 мМ при интенсивном перемешивании и в течение 5 мин измеряли кинетику ХЛ.
 2. – С.88-91) с применением кверцетина (Sigma, США). Ингибиторную активность соединений регистрировал по торможению падения оптической плотности на спектрофотометре СФ-46 (Ломо, Россия) при 2. – С.88-91) с применением кверцетина (Sigma, США). Ингибиторную активность соединений регистрировал по торможению падения оптической плотности на спектрофотометре СФ-46 (Ломо, Россия) при  406 нм в кювете с длиной оптического пути 10 мм. Степень ингибирования реакции рассчитавали: % инг=100-( 406 нм в кювете с длиной оптического пути 10 мм. Степень ингибирования реакции рассчитавали: % инг=100-( Dвещ/ Dвещ/ Dкверц×100), где Dкверц×100), где  Dвещ – изменение оптической плотности за 10 мин в опытной пробе, содержащей вещество; Dвещ – изменение оптической плотности за 10 мин в опытной пробе, содержащей вещество;   12 – P.816-822). Генерацию супероксидного радикала вызывали внесением 0,25 мл ксантиноксидазы (Sigma, США) (0,25 U/ml) в пробу, содержащую 10 мл фосфатного буфера pH 7,45, содержащего 5 мкМ люцигенина (Fluka, Швейцария) и 0,5 мл 1 мМ ксантина (Sigma, США). Кинетику хемилюминисценции оценивали в течение 5 мин при интенсивном перемешивании и t 37°C. 12 – P.816-822). Генерацию супероксидного радикала вызывали внесением 0,25 мл ксантиноксидазы (Sigma, США) (0,25 U/ml) в пробу, содержащую 10 мл фосфатного буфера pH 7,45, содержащего 5 мкМ люцигенина (Fluka, Швейцария) и 0,5 мл 1 мМ ксантина (Sigma, США). Кинетику хемилюминисценции оценивали в течение 5 мин при интенсивном перемешивании и t 37°C.
Способность веществ к перехвату и инактивации пероксильного радикала (ROO
Изучаемые вещества вводили в среду инкубации за 1 мин перед инициированием реакции в широком диапазоне концентраций.
Результаты оценивали статистически в программе Statistica 6.0 с использованием t-критерия Стьюдента с поправкой Бонферони (t). Отличия от контроля во всех группах считали статистически значимыми при Р 0,05. Для сравнительной оценки эффективности веществ рассчитывали величины ИК50 (концентрация вещества, ингибирующая реакцию на 50%). Расчет ИК50 проводили с помощью простого линейного регрессионного анализа, реализованного во встроенном пакете анализа программы Microsoft Excel 2000 с расчетом парного коэффициента корреляции R2. Достоверность регрессии оценивали с помощью двухфакторного дисперсионного анализа в программе «Statistica 6.0» (Stat Soft, США). 0,05. Для сравнительной оценки эффективности веществ рассчитывали величины ИК50 (концентрация вещества, ингибирующая реакцию на 50%). Расчет ИК50 проводили с помощью простого линейного регрессионного анализа, реализованного во встроенном пакете анализа программы Microsoft Excel 2000 с расчетом парного коэффициента корреляции R2. Достоверность регрессии оценивали с помощью двухфакторного дисперсионного анализа в программе «Statistica 6.0» (Stat Soft, США).
Результаты
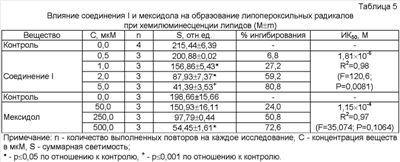
Исследуемое вещество I дозозависимо подавляло образование липопероксильных радикалов (Таблица 5) и по величине ИК50 почти на два порядка превосходило мексидол по активности. Соединение I почти в 15 раз превосходило мексидол по способности инактивировать активные формы кислорода в реакции Fe2+-индуцированной хемилюминесценции в присутствии люминола (Таблица 6). У соединения I отмечалась выраженная ингибирующая активность в отношении супероксидного радикала как в реакции с кверцетином (Таблица 7), так и при исследовании хемилюминесценции в системе ксантин-ксантиноксидаза в присутствии люцигенина (Таблица 8). Мексидол по способности к перехвату супероксида уступал соединению I более чем на порядок. Исследуемое соединение I дозозависимо угнетало образование пероксильных радикалов (Таблица 9), регистрируемых с помощью хемилюминесценции, сопровождающей термическое разложение АБАП, почти в десять раз превосходя мексидол по величине ИК50.
Таким образом, соединение I превосходило мексидол более чем в десять раз по способности перехватывать липопероксильный, супероксидный и другие активные формы кислорода и АБАП-радикалы.
Исследование гемореологических свойств соединения I in vitro и in vivo
Материалы и методы
  8. – С.459-461). Количество тромбоцитов регистрировали с помощью счетчика тромбоцитов. В качестве индуктора использовали 5 мкМ динатриевую соль АДФ (Reanal, Венгрия). Антиагрегантную активность соединений изучали в диапазоне концентраций от 1×10-4 до 1×10-6 М. Уровень агрегации оценивали по величине максимальной амплитуды агрегатограммы. Расчет антиагрегационого действия изучаемых веществ проводили по формуле (А-В)×100/А, где А -уровень агрегации тромбоцитов нативной плазмы, В – уровень агрегации тромбоцитов плазмы после инкубации с исследуемым веществом. Препаратом сравнения служили мексидол и ацетилсалициловая кислота. 8. – С.459-461). Количество тромбоцитов регистрировали с помощью счетчика тромбоцитов. В качестве индуктора использовали 5 мкМ динатриевую соль АДФ (Reanal, Венгрия). Антиагрегантную активность соединений изучали в диапазоне концентраций от 1×10-4 до 1×10-6 М. Уровень агрегации оценивали по величине максимальной амплитуды агрегатограммы. Расчет антиагрегационого действия изучаемых веществ проводили по формуле (А-В)×100/А, где А -уровень агрегации тромбоцитов нативной плазмы, В – уровень агрегации тромбоцитов плазмы после инкубации с исследуемым веществом. Препаратом сравнения служили мексидол и ацетилсалициловая кислота.
Исследование влияния соединения I и препарата сравнения мексидола на агрегацию тромбоцитов “in vivo” проводили в опытах на 30 интактных нелинейных крысах массой 220-260 г.
Соединение I вводили в дозах 30 мг/кг внутрижелудочно в течение 3-х дней, мексидол вводили в эквимолярной дозе. Контрольные животные получали растворитель (дистиллированная вода). Забор крови из брюшной аорты осуществляли под нембуталовым (40 мг/кг) наркозом через 2 часа после введения соединений. Агрегацию тромбоцитов изучали по описанной выше методике с расчетом степени максимальной агрегации и степени дезагрегации (как разность между максимальной агрегацией тромбоцитов и агрегацией на 5-й мин), и скорость агрегации тромбоцитов (по величине максимального наклона кривой), выраженные в процентах к контролю, при этом степень агрегации тромбоцитов в контроле принимали за 100%. Подсчет количества тромбоцитов проводили на счетчике модели 220LA (НПФ “Биола”, Москва) (З.А.Габбасов и др., 1989).
-1), моделирующих различную интенсивность кровотока в сосудах. При этом вязкость в области малых скоростей сдвига служит характеристикой агрегации эритроцитов, а в области более высоких скоростей сдвига – показателем их деформируемости. Все исследуемые образцы приводились к единому гематокриту 45 у.е., измеряемому на микрогемоцентрифуге МГЦ-8 (8000 об/мин, 2 мин). Исследования изучаемых соединений in vitro проводили в концентрациях от 1×10-4 до 1×10-6 М. Соединение I и препарат сравнения пентоксифиллин растворяли в физиологическом растворе, непосредственно перед исследованием, и 20 мкл раствора добавляли к исследуемой пробе перед термостатированием. В контрольные образцы вносили эквивалентное количество физиологического раствора (37°С). Кровь забирали из локтевой вены здоровых доноров и стабилизировали 3,8% раствором цитрата натрия в соотношении 1:9.
Изучение влияния соединения I на реологические свойства крови при реперфузионном поражении головного мозга проводили на 40 нелинейных крысах-самцах массой 240-280 г, наркотизированных хлоралгидратом в дозе 400 мг/кг. Измерение вязкости крови проводили как описано выше. Глобальную ишемию головного мозга воспроизводили билатеральной окклюзией общих сонной артерий в сочетании с контролируемой гипотензией (Методические указания по экспериментальному изучению перпаратов для лечения нарушений мозгового кровообращения и мигрени: Метод, рекомендации. / Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ; Сост.: Р.С.Мирзоян, А.С.Саратиков, М.Б.Плотников и др. – М., 2000. – 398 с.). Предварительно артериальное давление снижалось под влиянием забора крови из яремных вен до 50 мм рт.ст. (полученные образцы использовались для оценки исходных реологических показателей). Соединение I в дозе 10 мг/кг и пентоксифиллин в дозе 8 мг/кг вводили перорально за 30 мин до ишемии. Контрольным группам (ишемия – контроль и ложнооперированные животные) вводили физиологический раствор в аналогичном объеме. В качестве нормального контроля использовалась группа ложнооперированных животных. Через 1 час ишемии производили снятие лигатур с сонных артерий, что обеспечивало реперфузию головного мозга. Спустя час после реперфузии кровь забирали из нижней полой вены. Кровь стабилизировали 3,8% раствором цитрата натрия в соотношении 1:9.
Для изучения влияния веществ на оксидативный гемолиз эритроцитов забор крови производили из ушной вены кролика в пробирки с 3,8% раствором натрия цитрата в соотношении 1:9. Эритроциты трехкратно отмывали трис-NaCl-буфером pH 7,4, Суспензия эритроцитов в буфере приводилась к единому гематокриту 45 у.е. Соединение I и препарат сравнения мексидол вводили в эритроцитарную суспензию непосредственно перед термостатированием в дозах 10-4, 10-5 и 10-6
Статистическую обработку результатов экспериментов производили в пакете прикладных программ «Statistika 6.0» с использованием парного критерия Стьюдента при предварительной проверке выборки на нормальность распределения или критерия Манна-Уитни.
Результаты.
При изучении влияния соединения I и препаратов сравнения мексидола и ацетилсалициловой кислоты на агрегацию тромбоцитов in vitro, индуцированную 5 мкМ АДФ, было установлено (Таблица 10), что соединение I, ЭК50 которого составила 3,30×10-4 М, превосходило препараты сравнения по активности.
Было установлено, что соединение I обладает способностью дозозависимо ингибировать АДФ-индуцированную агрегацию тромбоцитов и в условиях целого организма (Таблица 11). Оно уменьшало как степень максимальной агрегации тромбоцитов, так и скорость образования агрегатов, а также проявляло дезагрегирующие свойства, практически не меняя количество тромбоцитов, что свидетельствует о том, что изменение способности тромбоцитов к агрегации связано не с изменением их числа, а с возникшей под действием соединения I гипореактивностью кровяных пластинок. Мексидол уступал соединению I как по влиянию на степень максимальной агрегации тромбоцитов и скорость образования агрегатов, так и по влиянию на дезагрегацию.
Соединение I дозозависимо снижало вязкость крови доноров при всех скоростях сдвига (Таблица 12). Так при скорости сдвига 200 сПз соединение I снижало вязкость крови на 4,24%, а пентоксифиллин – на 3,15%, что свидетельствует о влиянии соединений на пластичность мембраны эритроцитов. При снижении концентрации веществ в пробе при указанной скорости сдвига эффективность соединения I снижается и составляет 1,32%, а пентоксифиллин практически не оказывает влияния на вязкость крови. Со снижением скорости сдвига влияние соединения I на данный параметр увеличивается, являясь достоверным в концентрациях вещества 1×10-4 и
1×10-5 М. Препарат сравнения, в указанных концентрациях, оказывается практически не эффективным.
Таким образом, наибольший эффект соединения I на вязкость крови доноров проявляется при низких скоростях сдвига, что подтверждается статистически достоверными изменениями индекса агрегации.
Соединение I также достоверно снижало вязкость крови у крыс с экспериментальной ишемией головного мозга особенно при низких скоростях сдвига (Таблица 13) (на 30% по сравнению с ишемизированной группой животных), и его эффект был сравним с пентоксифиллином.
При инкубировании в течение 2 ч в присутствии гидрофильного радикального инициатора АБАП можно было наблюдать существенный гемолиз эритроцитов по сравнению с контролем, который составил 81% (Таблица 14) (p<0,05) по сравнению с 29% в контроле с буфером. Соединение I в максимальной дозе 100 мкМ в суспензию эритроцитов приводило к дозозависимому достоверному снижению гемолиза до 39,3%. Мексидол оказался менее эффективен, чем соединение I в соответствующих концентрациях.
| Таблица 1 |
| Влияние соединения I (5 мг/кг) и кавинтона (5 мг/кг) на спонтанную двигательную активность крыс в раннем восстановительном периоде после четырехсосудистой перевязки артерий мозга (M±m) |
| Группы животных |
n |
Первые сутки, у.е. |
% от контроля |
Вторые сутки, у.е. |
% от контроля |
| Контроль (Ложнооперированные) |
9 |
121,3±9,32 |
– |
107,2±8,54 |
– |
| Ишемия |
9 |
16,1±3,01* |
-86,7 |
18,7±3,95* |
-82,6 |
| Ишемия + соединение I |
9 |
75,8±7,72*+ |
-37,5 |
58,5±3,58*+ |
-45,4 |
| Контроль (Ложнооперированные) |
9 |
111,9±44,80 |
– |
75,7±25,99 |
– |
| Ишемия |
9 |
44,0±27,00 |
-60.7 |
25,2±13,63 |
-66,7 |
| Ишемия + Кавинтон |
9 |
45,6±13,00 |
-59,2 |
21,5±15,72 |
-71,6 |
| n – число животных в эксперименте |
| * – данные статистически значимы по отношению к Контролю (p<0,01) |
| + – данные статистически значимы по отношению к Ишемии (p<0,01) |
| Таблица 2 |
| Влияние соединения I (5 мг/кг) и кавинтона (5 мг/кг) на неврологический статус (баллы) крыс в раннем восстановительном периоде после четырехсосудистой перевязки артерий мозга (М±m) |
| Группы |
Сутки после ишемии |
| 1 |
2 |
3 |
5 |
7 |
| Контроль (Ложнооперированные) |
12,0±0,00 |
12,0±0,00 |
12,0±0,00 |
12,0±0,00 |
12,0±0,00 |
| Ишемия |
5,3±0,37* |
5,0±0,24* |
4,6±0,48* |
6,5±0,22* |
7,4±0,24* |
| Ишемия + соединение I |
9,5±0,22*+ |
10,0±0,37*+# |
9,7±0,49*+ |
11,4±0,24+# |
11,6±0,24+ |
| Контроль (Ложнооперированные) |
12,0±0,00 |
12,0±0,00 |
12,0±0,00 |
12,0±0,00 |
12,0±0,00 |
| Ишемия |
5,6±0,50* |
5,8±0,40* |
5,6±0,50* |
5,8±1,33* |
6,5±1,32* |
| Ишемия + Кавинтон |
6,5±0,82* |
6,5±0,52* |
6,6±0,89* |
6,8±0,83* |
7,9±0,83* |
* – данные статистически значимы по отношению к контролю при p 0,01 0,01 |
+ – данные статистически значимы по отношению к ишемии при p 0,01 0,01 |
# – данные статистически значимы по отношению к кавинтону при p 0,05 0,05 |
| Таблица 3 |
| Влияние соединения I (5 мг/кг) и кавинтона (5 мг/кг) на мышечную силу передних лап (граммсилы) крыс в раннем восстановительном периоде после четырехсосудистой перевязки артерий мозга (М±m) |
| Группы |
Сутки после ишемии |
| 1 |
2 |
3 |
5 |
7 |
| Контроль (Ложно-оперированные) |
391,0±3,32 |
390,8±3,74 |
394,0±2,92 |
392,0±3,39 |
392,0±2,54 |
| Ишемия |
131,1±22,13* |
117,7±16,81* |
98,6±24,73* |
193,3±8,03* |
248,0±13,56* |
| Ишемия + соединение I |
343,3±7,60*+# |
337,5±8,70*+ |
344,1±9,86*+# |
386,0±4,00+# |
386,0±5,10+# |
| Контроль (Ложнооперированные) |
392,5±4,23 |
393,5±8,34 |
391,2±6,42 |
390,4±14,2 3 |
392,5±9,52 |
| Ишемия |
218,2±20,88* |
221,8±20,49* |
170,1±33,32* |
160,2±30,5* |
211,7±44,23 |
| Ишемия + Кавинтон |
275,5±8,9+ |
279,1±11,4 |
250,3±12,25+ |
244,0±14,35 |
272,1±43,29 |
* – данные статистически значимы по отношению к контролю при p 0,05 0,05 |
+ данные статистически значимы по отношению к ишемии при p 0,05 0,05 |
# – данные статистически значимы по отношению к кавинтону при p 0,05 0,05 |
| Таблица 4 |
| Влияние соединения I (5 мг/кг) и кавинтона (5 мг/кг) на запоминание аверсивного стимула крысами в условной реакции пассивного избегания на седьмой день после четырехсосудистой перевязки артерий мозга (М±m) |
| Группа животных |
n |
Латентное время, с |
% от контроля |
| Контроль (Ложнооперированные) |
5 |
176,0±4,00 |
– |
| Ишемия |
5 |
15,6±5,08* |
-91,1 |
| Ишемия + соединение I |
5 |
149,0±13,27+ |
-15,3 |
| Контроль (Ложнооперированные) |
9 |
180,0±0,00 |
– |
| Ишемия |
9 |
19,1±5,48* |
-89,44 |
| Кавинтон |
9 |
89,4±27,2* |
-50,33 |
| n – число животных в эксперименте |
* – данные статистически значимы по отношению к контролю при p 0,01 0,01 |
+ – данные статистически значимы по отношению к ишемии при p 0,01 0,01 |
| Таблица 6 |
| Влияние соединения I и мексидола на образование активных форм кислорода при люминолзависимой хемилюминесценции (М±m) |
| Вещество |
С, мкМ |
n |
S, отн.ед. |
% ингибирования |
ИК50, М |
| Контроль |
0,0 |
4 |
76,83±1,21 |
– |
– |
| Соединение I |
1,0 |
3 |
62,93±2,12* |
18,1 |
4,44×10-6 |
 |
5,0 |
3 |
37,03±0,77+ |
51,8 |
R2=0,99 |
 |
10,0 |
3 |
24,59±1,47+ |
67,9 |
(F=1503,3; P=0,0164) |
| Контроль |
0,0 |
3 |
77,06±4,21 |
– |
– |
 |
10,0 |
3 |
76,70±0,00 |
0,5 |
1,70×10-4 |
| Мексидол |
50,0 |
3 |
61,52±0,87* |
20,2 |
R2=0,93 |
 |
100,0 |
3 |
43,82±1,08+ |
43,1 |
(F=13,05; Р=0,1719) |
Примечание: n – количество выполненных повторов на каждое исследование, С – концентрация веществ в мкМ, S – суммарная светимость; * – p 0,05 по отношению к контролю, + – p 0,05 по отношению к контролю, + – p 0,001 по отношению к контролю. 0,001 по отношению к контролю. |
| Таблица 7 |
| Влияние соединения I и мексидола веществ на генерацию супероксидного радикала в реакции окисления кверцетина |
| Вещество |
С, мкМ |
% ингибирования |
ИК50, М |
| Соединение I |
1,0 |
3,0 |
2,48×10-5 |
 |
5,0 |
34,2 |
R2=0,96 |
 |
10,0 |
72,1 |
 |
| Мексидол |
1,0 |
25,8 |
6,91×10-4 |
 |
10,0 |
26,6 |
R2=0,96 |
 |
100,0 |
41,7 |
 |
| Таблица 8 |
| Влияние соединения I и мексидола на генерацию супероксидного радикала в системе ксантин-ксантиноксидаза при люцигенин-зависимой хемилюминесценции (М±m) |
| Вещество |
С, мкМ |
S, отн.ед. |
% инг. |
ИК50, М |
| Контроль |
0,0 |
61,62±3,80 |
– |
– |
| Соединение I |
0,5 |
42,15±9,20 |
31,6 |
9,60×10-7 |
 |
1,0 |
26,79±2,98+ |
56,5 |
R2=0,97 |
 |
5,0 |
8,44±0,40+ |
86,3 |
(F=32,13; P=0,1111) |
| Контроль |
0,0 |
80,81±7,33 |
– |
– |
 |
10,0 |
93,32±0,00 |
-15,5 |
1,67×10-4 |
| Мексидол |
50,0 |
57,72±1,93 |
28,6 |
R2=0,99 |
 |
500,0 |
22,99±1,56* |
71,5 |
(F=88,37; P=0,0694) |
| Примечание: С, мкМ – концентрация веществ, S – суммарная светимость, * – p<0,05 по отношениею к контролю, + – p<0,001 по отношению к контролю |
| Таблица 9 |
| Влияние соединения I и мексидола на образование пероксильного радикала при АБАП-индуцированной хемилюминесценции (М±m) |
| Вещество |
С, мкМ |
n |
S, отн.ед. |
% ингибирования |
ИК50, М |
| Контроль |
0,0 |
4 |
612,09±23,96 |
– |
– |
 |
0,1 |
3 |
457,37±4,45* |
25,2 |
2,00×10-7 |
| Соединение I |
0,25 |
3 |
295,02±2,39* |
51,8 |
R2=0,96 |
 |
0,5 |
3 |
58,67±10,92 |
90,4 |
(F=28,04;
Р=0,1188) |
| Контроль |
0,0 |
3 |
698,28±42,64 |
– |
– |
 |
1,0 |
3 |
396,37±16,78* |
43,2 |
1,38×10-6 |
| Мексидол |
5,0 |
3 |
158,64±68,18* |
77,3 |
R2=0,98 |
 |
10,0 |
3 |
105,19±15,93* |
84,9 |
(F=63,88; Р=0,0792) |
Примечание: n – количество выполненных повторов на каждое исследование, С – концентрация веществ в мкМ, S – суммарная светимость; * – p 0,05 по отношению к контролю. 0,05 по отношению к контролю. |
| Таблица 10 |
| Влияние соединения I, мексидола и ацетилсалициловой кислоты на агрегацию тромбоцитов in vitro, индуцированную 5 мкМ АДФ |
 |
Вещества |
Антиагрегантная активность, ЭК50 (М) |
| 1. |
Соединение I |
3,30×10-4 |
| 2. |
Мексидол |
1,40×10-3 |
| 3. |
Ацетилсалициловая кислота |
7,27×10-4 |
| Таблица 11 |
| Влияние соединения I и мексидола (3-дневное пероральное введение в дозе 60 мМ) на агрегацию тромбоцитов (индуцированную 5 мкМ АДФ) и количество тромбоцитов (М±m) |
 |
Изучаемые вещества |
Степень агрегации, отн.ед |
Скорость агрегации, отн.ед. |
Степень дезагрегации, % |
Количество тромбоцитов, 109/л |
| 1. |
Контроль |
84,05±8,14 |
67,25±11,00 |
0,95±0,95 |
359,0±26,70 |
| 2. |
Соединение I |
10,44±2,11*# |
13,07±2,64*# |
15,59±6,56* |
342,5±17,50 |
| 3. |
Мексидол |
56,10±4,05* |
28,65±3,06* |
14,85±12,00 |
330,0±36,00 |
| Примечание: n – количество исследований |
| * – данные статистически значимы по отношению к контролю (p<0,05) |
| # – данные статистически значимы по отношению к мексидолу (p<0,05) |
| Таблица 12 |
| Влияние соединения I и пентоксифиллина (%) на вязкость крови доноров в экспериментах in vitro (M±m). |
| Соединение I |
С, М |
Скорость сдвига |
Индекс агрегации |
| 200 с-1 |
40 с-1 |
10 с-1 |
| Соединение I |
1×10-4 |
-4,24±1,53 |
-9,72±1,74* |
-10,93±1,33* |
-6,69±1,65* |
| 1×10-5 |
-1,32±0,62 |
-10,17±1,52* |
-11,54±1,05* |
-7,37±1,94* |
| 1×10-6 |
0,00±0,00 |
-1,54±0,78 |
-1,75±0,74 |
-0,48±0,54 |
| Пентоксифиллин |
1×10-4 |
-3,15±0,92 |
-10,30±0,93* |
-10,47±1,07* |
-7,56±0,63* |
| 1×10-5 |
0,00±0,00 |
-0,01±1,17 |
-0,52±0,52 |
-0,46±1,32 |
| 1×10-6 |
0,00±0,00 |
-1,17±3,50 |
0,24±0,57 |
-0,24±0,57 |
| * – данные статистически значимы (t) по отношению к контролю (p<0,05) |
| Таблица 13 |
| Влияние соединения I (10 мг/кг)и пентоксифиллина (8 мг/кг) (при пероральном введении) на вязкость крови (сПз) крыс с ишемией головного мозга при различных скоростях сдвига (М±m) |
| Группы животных |
Скорость сдвига |
| 200 с-1 |
100 с-1 |
20 с-1 |
5 с-1 |
| Контроль (Ложнооперированные) |
3,44±0,09 |
3,62±0,09 |
4,72±0,15 |
6,62±0,4 |
| Ишемия |
4,09±0,22* |
4,54±0,24* |
6,31±0,33* |
10,27±0,63* |
| Ишемия + соединение I |
4,08±0,28 |
4,23±0,27 |
5,13±0,39 |
6,45±0,57 |
| Ишемия + пентоксифиллин |
3,76±0,14 |
3,96±0,17 |
4,84±0,28 |
6,28±0,62 |
| * – данные статистически значимы (критерий Манна-Уитни) по отношению к контролю (p<0,05); |
 – данные статистически значимы (критерий Манна-Уитни) по отношению к ишемии (p<0,05) – данные статистически значимы (критерий Манна-Уитни) по отношению к ишемии (p<0,05) |
| Таблица 14 |
| Влияние соединения I и мексидола на АБАП-индуцированный окислительный гемолиз эритроцитов кролика in vitro (M±m). |
| Вещества |
С, М |
Гемолиз, % |
Статистическая значимость, Р |
| Контроль (физ. раствор) |
– |
29,78±0,65 |
– |
| АБАП |
– |
81,87±5,70 |
0,01 |
| АБАП + соединение I |
1·10-4 |
39,29±4,03 |
0,01 |
| 1·10-5 |
46,61±5,38 |
0,02 |
| 1·10-6 |
60,81±3,44 |
0,05 |
| АБАП + Мексидол |
1·10-4 |
55,28±0,60 |
0,04 |
| 1·10-5 |
54,08±2,99 |
0,03 |
| 1·10-6 |
74,55±13,60 |
0,68 |
Создание фармацевтической композиции для получения таблеток
Разработана фармацевтическая композиция, содержащая в качестве действующего вещества – дигидробромид 2-(3,4-диоксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола и в качестве вспомогательных веществ коллидон, лактозу, поливинилпирролидон, тальк, кальция стеарат и натрия метабисульфит. Исследованы композиции при следующем соотношении ингредиентов, вес (г):
| 1. Дигидробромид 2-(3,4-диоксифенил)-9-диэтиламиноэтилимидазо [1,2-а]бензимидазола |
– или 0,05 г, или 0,20 г, или 1,0 г |
| 2. Коллидона |
– 0,05 г |
| 3. Лактозы |
– 0,062 г |
| 4. Поливинилпирролидона |
– 0,02 г |
| 5. Талька |
– 0,01 г |
| 6. Кальция стеарата |
– 0,004 г |
| 7. Натрия метабисульфита |
– 0,004 г |
Для получения фармацевтической композиции используют метод прямого прессования смеси лекарственного вещества и вспомогательных веществ. Для этого отвешивают все ингредиенты из расчета на 100 кг таблеточной массы и просеивают через сито с диаметром отверстий 0,25 мм, после чего смешивают в смесителе в следующей последовательности: лактоза, натрия метабисульфит, соединение I, поливинилпирролидон низкомолекулярный медицинский, коллидон, тальк и кальция стеарат. Полученную смесь проверяют на однородность смешения: действующего вещества в таблеточной массе должно быть не менее 58,5% и не более 59,0%. При получении положительного результата таблеточную массу прессуют на таблеточном прессе типа РТМ-24М при давлении прессования 120 МПа.
С целью стандартизации таблеток согласно ОСТ 91500.05.001-00 выбраны следующие критерии: описание, подлинность, средняя масса и однородность по массе, тальк, распадаемость, посторонние примеси, микробиологическая чистота и количественное определение соединения I (Таблица 15).
| Таблица 15 |
| Результаты анализа таблеток на основе дигидробромида 2-(3,4-диоксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола |
| Описание |
Подлинность |
Средняя масса, г |
Тальк, % |
Распадаемость, мин |
Посторонние примеси |
Количественное определение, г |
| Таблетки белого цвета диаметром 10±0,3 мм и высотой 4±0,3 мм |
УФ-спектр должен совпадать со спектром раствора РСО РУ-185, Х,=268 нм |
0,35±5% |
не более3% |
не более 15 мин |
не более 1% |
отсутствуют |
0,19-0,21 |
Был разработан состав защитного пленочного покрытия, обеспечивающего стабильность при хранении и растворимость в желудке. Из пленкообразователей, обеспечивающих желудочно-растворимые покрытия, нами апробированы следующие: коллидон-30, плаздон S-630, метилцеллюлоза МЦ-16, а также их комбинации. В качестве фотозащитных добавок использованы: тартразин, метиловый оранжевый, двуокись титана и их комбинации. Нанесение покрытия проводили в дражировочном котле путем распыления растворов пленкообразователей с последующей сушкой при t не больше 60°С до увеличения средней массы таблеток в сухом виде на 5%. Состав покрытий приведен ниже (Таблица 16).
| Таблица 16 |
| Состав покрытия таблеток на основе дигидробромида 2-(3,4-диоксифенил)-9-диэтиламиноэтилимидазо [1,2-а] бензимидазола. |
 |
Компоненты |
Кол. |
| 1. |
Коллидон-30 |
10,0 |
| Титана диоксид |
5,0 |
| Краситель (тартразин) |
0,1 |
| Вода очищенная до |
100,0 |
| 2. |
Плаздон S-630 |
10,0 |
| Метилцеллюлоза МЦ-16 |
1,0 |
| Краситель (метиловый оранжевый) |
0,1 |
| Вода очищенная до |
100,0 |
| 3. |
Коллидон-30 |
5,0 |
| Метилцеллюлоза МЦ-16 |
2,0 |
| Титана диоксид |
5,0 |
| Краситель (метиловый оранжевый) |
0,05 |
| Вода очищенная до |
100,0 |
| 4. |
Метилцеллюлоза МЦ-16 |
2,0 |
| Титана диоксид |
5,0 |
| Краситель (метиловый оранжевый) |
0,05 |
| Вода очищенная до |
100,0 |
| 5. |
Плаздон S-630 |
10,0 |
| Титана диоксид |
5,0 |
| Краситель (тартразин) |
0,1 |
| Вода очищенная до |
100,0 |
Качество нанесенных покрытий оценивали по следующим показателям:
1. Внешний вид (равномерность покрытия, качество).
2. Распадаемость (мин, вода 37°С).
3. Фотозащитные свойства (отсутствие изменения цвета после снятия покрытия у таблеток, хранившихся при облучении лампой дневного света 10 Вт в течение 10 суток).
4. Отклонение от средней массы (не более 5%).
Таблица 17 содержит результаты оценки качества покрытий.
Как следует из таблицы, оптимальными качествами обладает состав  4. Он экономически выгоден, прост в исполнении. 4. Он экономически выгоден, прост в исполнении.
Предлагаемое соотношение действующих, вспомогательных веществ и покрытия является оптимальным, обеспечивает получение качественных таблетированных лекарственных препаратов соединения I и достижение необходимого терапевтического эффекта.
Создание фармацевтической композиции для получения лиофилизированного порошка для инъекций
Разработана фармацевтическая композиция, содержащая в качестве действующего вещества дигидробромида 2-(3,4-диоксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола и в качестве вспомогательных веществ поливинилпирролидон и лимонную кислоту. Исследованы композиции при следующем соотношении ингредиентов, вес (г):
| 1. Дигидробромида 2-(3,4-диоксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола |
– или 0,01 г, или 0,1 г, или 2,0 г |
| 2. Поливинилпирролидона |
– 0,100 г |
| 3. Лимонной кислоты |
– 0,005 г |
Изучение биодоступности фармацевтической композиции
Эксперименты по изучению фармакокинетики субстанции соединения I и ее фармацевтической композиции проводилось на 10 кроликах-самцах породы шиншилла массой 2,7-3,7 кг, содержавшихся в условиях вивария на стандартной диете. Накануне эксперимента кролики голодали в течение 12 часов без ограничения доступа к воде. Таблетки и субстанцию вводили животным внутрижелудочно через резиновый зонд. Субстанцию вводили в аналогичной дозе, содержащейся в таблетированных лекарственных формах. Кровь забирали из ушной вены самотеком перед введением препарата и затем через определенные временные интервалы после введения. Между экспериментами делали двухнедельный перерыв. В качестве стандарта использовали субстанцию в дозе 54 мг/кг. Забор проб крови производили через 0,5; 1; 1,5; 3; 6; 9 и 12 часов после введения.
Содержание соединения I определяли методом ВЭЖХ на жидкостном хроматографе «Gilson» серии 6000 (Франция) с флуоресцентным детектором на колонке С18 4,6×250 мм, 5 µм. Подвижная фаза составляет смесь ацетонитрила (60%) и ацетатного буфера с pH 5,0 (40%). Длина волны возбуждения 270 нм, длина волны эмиссии 330 и 410 нм. Чувствительность метода составляет для эноксифола 1 µг/мл и для продуктов его окисления 100 nг/мл. Идентификацию исследуемых веществ и расчет их концентрации проводили по методу абсолютных стандартов. Время удерживания для соединения I составило 4,4-4,8 мин, для продукта окисления – 5,8-6,0 мин.
 5. – т.49. – c.118-127). 5. – т.49. – c.118-127).
Содержание соединения I в крови кроликов при введении субстанции и таблетки с фотозащитным покрытием в дозе 50 мг приведены на чертеже, где по оси абсцисс приведено время (час), по оси ординат – концентрация мкг/мл. Как видно из чертежа, при введении таблетки с фотозащитным покрытием фармакокинетическая кривая практически не отличается от таковой при введении субстанции.
Фармакокинетические параметры субстанции и таблетированной лекарственной формы эноксифола представлены в Таблица 18.
Относительная биодоступность (f отн.) таблетки с фотозащитным покрытием составляет 95%.
| Таблица 18 |
| Фармакокинетические параметры субстанции Соединения I и таблеток с фотозащитным покрытием при пероральном введении кроликам |
| Параметр |
Субстанция |
Таблетка с фотозащитным покрытием |
| AUC, µg/ml/час |
62,76 |
59,43 |
| Cmax, ng/ml |
14,5 |
13,9 |
| Тmax, мин |
180 |
180 |
| f отн. |
 |
0,95 |
Таким образом, при проведении биофармацевтического анализа установлено, что таблетированная лекарственная форма является биоэквивалентной по отношению к субстанции и не препятствует высвобождению и всасыванию лекарственных веществ в желудочно-кишечном тракте. Таблетки соединения I с фотозащитным пленочным покрытием обладают высокой биологической доступностью (выше 90%). Фармакокинетические параметры при введении лекарственной формы практически не отличаются от таковых при введении субстанции.
Формула изобретения
1. Применение дигидробромида 2-(3,4-дигидроксифенил)-9-диэтиламино-этилимидазо[1,2-а]бензимидазола формулы
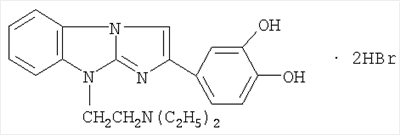
при производстве лекарственного средства, обладающего противоишемическими, гемореологическими и антирадикальными свойствами.
2. Фармацевтическая композиция, обладающая противоишемическими, гемореологическими и антирадикальными свойствами, содержащая дигидробромид 2-(3,4-дигидроксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола в эффективном количестве и фармацевтически приемлемый носитель.
3. Фармацевтическая композиция по п.2, отличающаяся тем, что носитель представляет собой вещество, выбранное из группы коллидон, лактоза, поливинилпирролидон, тальк, кальция стеарат, натрия метабисульфит и их комбинации.
4. Фармацевтическая композиция по любому из пп.2 или 3, отличающаяся тем, что содержит дигидробромид 2-(3,4-дигидроксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола в количестве 0,05-1,0 г на единичную дозу.
5. Фармацевтическая композиция по п.3, отличающаяся тем, что содержит следующее количественное соотношение компонентов, г:
| Дигидробромид 2-(3,4-дигидроксифенил)- |
 |
| 9-диэтиламиноэтилимидазо[1,2-а]бензимидазола |
0,20 |
| Коллидон |
0,05 |
| Лактоза |
0,062 |
| Поливинилпирролидон |
0,02 |
| Тальк |
0,01 |
| Кальция стеарат |
0,004 |
| Натрия метабисульфит |
0,004 |
6. Фармацевтическая композиция по п.2, отличающаяся тем, что она выполнена в виде лиофилизированного порошка для инъекций.
7. Фармацевтическая композиция по п.6, отличающаяся тем, что в качестве носителя она содержит поливинилпирролидон и лимонную кислоту.
8. Фармацевтическая композиция по любому из пп.6 или 7, отличающаяся тем, что содержит дигидробромид 2-(3,4-дигидроксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола в количестве 0,01-2,0 г на единичную дозу.
9. Фармацевтическая композиция по п.7, отличающаяся тем, что содержит следующее количественное соотношение компонентов, г:
| Дигидробромид 2-(3,4-дигидроксифенил)- |
 |
| 9-диэтиламиноэтилимидазо[1,2-а]бензимидазола |
0,100 |
| Поливинилпирролидон |
0,100 |
| Лимонная кислота |
0,005 |
10. Фармацевтическая композиция по п.5, отличающаяся тем, что она выполнена в виде твердой лекарственной формы и покрыта защитным пленочным покрытием, содержащим следующее количественное соотношение компонентов, г:
| Метилцеллюлоза МЦ-16 |
2,0 |
| Титана диоксид |
5,0 |
| Краситель (метиловый оранжевый) |
0,05 |
| Вода очищенная |
до 100 |
РИСУНКИ
|
|