Патент на изобретение №2391973
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ПРИМЕНЕНИЕ (ГАЛОБЕНЗИЛОКСИ)БЕНЗИЛАМИНО-ПРОПАНАМИДОВ ДЛЯ ПРОИЗВОДСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ, ДЕЙСТВУЮЩИХ КАК СЕЛЕКТИВНЫЕ МОДУЛЯТОРЫ НАТРИЕВЫХ И/ИЛИ КАЛЬЦИЕВЫХ КАНАЛОВ
(57) Реферат:
Изобретение относится к (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамиду в виде отдельного изомера и его фармацевтически приемлемой соли, к применению его или (R)-2-[4-(2-хлорбензилокси)бензиламино]-N-метилпропанамида в виде отдельных изомеров или их фармацевтически приемлемой соли (предпочтительно соли метансульфоновой кислоты) для производства лекарственного средства, селективно действующего как модулятор натриевых и/или кальциевых каналов и поэтому эффективного в профилактике, облегчении и лечении патологических процессов, включая боль, мигрень, периферические заболевания, сердечно-сосудистые заболевания, воспалительные процессы, поражающие все системы организма, расстройства, поражающие кожу и смежные ткани, расстройства дыхательной системы, расстройства иммунной и эндокринной систем, желудочно-кишечных и мочеполовых, метаболических и пароксизмальных расстройств, при которых вышеупомянутые механизмы были описаны как играющие патологическую роль. Изобретение отличает отсутствие побочного эффекта ингибирования МАО, что снижает гепатотоксичность, гипертензивный криз и т.д. при лечении указанных заболеваний. 6 н. и 19 з.п. ф-лы, 2 табл.
Настоящее изобретение относится к применению (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамида или (R)-2-[4-(2-хлорбензилокси)бензиламино]-N-метилпропамида в виде отдельных изомеров или их фармацевтически приемлемых солей для производства лекарственного средства, селективно действующего как модулятор натриевых и/или кальциевых каналов, полезного в профилактике, облегчении и лечении широкого круга заболеваний, при которых указанный механизм(ы) играет(ют) патологическую роль, включая боль, мигрень, воспалительные, урогенитальные и желудочно-кишечные заболевания, характеризующегося тем, что указанное лекарственное средство в основном не оказывает никакого эффекта ингибирования MAO или проявляет значительно меньший эффект ингибирования MAO в дозах, которые являются терапевтически эффективными в профилактике, облегчении и/или лечении указанных заболеваний. Следующий аспект изобретения относится к способу селективного лечения вышеуказанных заболеваний, который включает назначение пациенту при необходимости терапевтически эффективного количества вышеперечисленных (R)-(галобензилокси)бензиламино-пропанамидов, при котором терапевтическая активность указанных соединений в основном лишена какого-либо побочного эффекта ингибирования MAO или проявляет значительно меньший побочный эффект ингибирования MAO. Уровень техники Химический уровень техники Замещенные производные бензиламинопропионамида, действующие на центральную нервную систему и эффективные в качестве противоэпилептических, противопаркинсонических, нейропротективных, антидепрессивных и антиспастических снотворных средств, раскрыты в международных заявках на патенты, опубликованных под В WO03/020273 раскрыты фармацевтические композиции, включающие выбранные производные В WO 04/062655 раскрыто применение некоторых производных В WO 05/018627 раскрыты производные В WO 04/066987 раскрыт способ лечения расстройств желудочно-кишечного тракта с применением модуляторов натриевых каналов. В WO 04/066990 раскрыт способ лечения расстройств нижних отделов мочевыводящих путей с применением модуляторов натриевых каналов. В PCT/EP/2005/000514 раскрыты производные Биологический уровень техники Известно, что натриевые каналы играют важную роль в нейрональной сети посредством быстрой передачи электрических импульсов по клеткам и клеточным сетям, таким образом координируя высшие процессы от локомоции до познания. Эти каналы являются большими трансмембранными белками, которые способны переключаться в различные состояния для возможности селективной проницаемости для ионов натрия. В этом процессе для деполяризации мембраны необходим потенциал действия, и, таким образом, эти каналы являются потенциалозависимыми. В последние несколько лет было раскрыто намного лучшее понимание натриевых каналов и взаимодействия препаратов с ними. Выяснилось, что ряд препаратов, имеющих неизвестный механизм действия, фактически действуют посредством модуляции проводимости натриевых каналов, включая местные анестетики, антиаритмики I класса и противосудорожные средства. Блокаторы нейронных натриевых каналов нашли применение в лечении эпилепсии (фенитоин и карбамазепин), биполярного расстройства (карбамазепин, ламотриджин), профилактике нейродегенерации и в уменьшении нейропатической боли. Различные противоэпилептические препараты, стабилизирующие возбудимость нейронов, эффективны в лечении нейропатической боли (габапентин, прегабалин). Кроме того, повышение экспрессии или активности натриевых каналов наблюдалось в нескольких моделях воспалительной боли, наводя на мысль о роли натриевых каналов в воспалительной боли. Кальциевые каналы являются перекрывающими мембрану белками, состоящими из нескольких субъединиц, которые позволяют ионам кальция из внеклеточной жидкости поступать в клетки. В основном кальциевые каналы являются потенциалозависимыми и называются потенциалчувствительными кальциевыми каналами (VSCC). VSCCs найдены во всех отделах нервной системы млекопитающих, где они регулируют такие различные виды активности, как клеточная возбудимость, высвобождение медиаторов, внутриклеточный метаболизм, нейросекреторная активность и экспрессия генов. Все “возбудимые” клетки животных, такие как нейроны центральной нервной системы (CNS), периферические нервные клетки и мышечные клетки, включая клетки скелетных мышц, сердечной мышцы и гладкомышечные клетки вен и артерий, имеют потенциалозависимые кальциевые каналы. Кальциевые каналы играют центральную роль в регулировании внутриклеточного уровня ионов кальция, которые важны для поддержания жизнеспособности и функции клетки. Внутриклеточные концентрации ионов кальция вовлечены у животных в множество витальных процессов, таких как высвобождение нейромедиатора, активация вторичных мессенджеров и систем сигнальной трансдукции, мышечное сокращение, активность пейсмейкеров и секреция гормонов. Считается, что кальциевые каналы играют важную роль при некоторых болезненных состояниях. Полагается, что ряд соединений, эффективных в лечении различных сердечно-сосудистых заболеваний у млекопитающих, включая людей, оказывают их положительные эффекты посредством модулирования функции потенциалозависимых кальциевых каналов в миокарде и/или гладких мышцах сосудов. Соединения, обладающие активностью в отношении кальциевых каналов, также применялись для лечения боли. В частности, как показано в нескольких фармакологических исследованиях, считается, что кальциевые каналы N-типа (Cav2:2), ответственные за регуляцию нейромедиаторов, играют значимую роль в ноцицептивной передаче. Эта гипотеза была подтверждена клинически с помощью Ziconotide – пептида, полученного из яда морской улитки, Conus Magus. Ограничение терапевтического применения этого пептида состоит в том, что его необходимо вводить человеку внутриоболочечно (Bowersox S. S. and Luther R. Toxicon, 1998, 36, 11, 1651-1658). Все эти открытия указывают на то, что соединения, блокирующие натриевые и/или кальциевые каналы, имеют высокий терапевтический потенциал в профилактике, облегчении и лечении широкого круга патологий, включая боль, мигрень, сердечно-сосудистые, мочеполовые, метаболические и желудочно-кишечные заболевания, при которых, как описано, вышеупомянутые механизмы играют патологическую роль. Во многих публикациях и патентах описаны модуляторы или антагонисты натриевых и/или кальциевых каналов для лечения и/или модулирования множества расстройств. Эти каналы способны модулировать некоторые местные анестетики, антиаритмики, противорвотные средства, антигипертензивные средства, стабилизаторы настроения, агенты для лечения униполярной депрессии, сердечно-сосудистых заболеваний, недержания мочи, диареи, воспаления, инсульта, эпилепсии, нейродегенеративных состояний, отмирания нервных клеток, противосудорожные средства, средства для лечения нейропатической боли, мигрени, острой гипералгезии и воспаления, почечной недостаточности, аллергии, астмы, бронхоспазма, дисменореи, спазма пищевода, глаукомы, расстройств мочевыводящих путей, расстройств моторики желудочно-кишечного тракта, преждевременных родов, ожирения. Ниже приведены использованные ссылки: В «C. Alzheimer Adv. Exp. Med. Biol. 2002, 513, 161-181» рассмотрены натриевые и кальциевые каналы как мишени нейропротективных субстанций. В «Vanegas, Schaible (Pain 2000, 85, 9-18)» рассмотрено влияние антагонистов кальциевых каналов на спинальные механизмы боли, гипералгезии и аллодинии. Патент США 5051403 относится к способу уменьшения повреждения нейронов, связанного с ишемическим состоянием, таким как инсульт, с помощью применения пептида, связывающего/ингибирующего омега-конотоксин, где пептид характеризуется специфическим ингибированием проходимости потенциалозависимых кальциевых каналов выборочно в тканях нервной системы. Патент США 5587454 относится к композициям и способам создания аналгезии, особенно при лечении боли и нейропатической боли. Патент США 5863952 относится к антагонистам кальциевых каналов для лечения ишемического инсульта. Патент США 6011035 относится к блокаторам кальциевых каналов, эффективным в лечении состояний, таких как инсульт и боль. Патент США 6117841 относится к блокаторам кальциевых каналов и их применению в лечении инсульта, ишемии головного мозга, боли, травмы головы или эпилепсии. Патент США 6362174 относится к применению блокаторов кальциевых каналов N-типа в терапии инсульта, ишемии головного мозга, боли, эпилепсии и травмы головы. Патент США 6380198 касается применения блокатора кальциевых каналов флунаризина для местного лечения глаукомы. Патент США 6420383 и патент США 6472530 относятся к новым блокаторам кальциевых каналов, эффективным для лечения и профилактики ряда расстройств, таких как гиперчувствительность, аллергия, астма, бронхоспазм, дисменорея, спазм пищевода, глаукома, преждевременные роды, расстройства мочевыводящих путей, расстройства моторики желудочно-кишечного тракта и сердечно-сосудистые расстройства. Патент США 6458781 относится к соединениям, которые действуют как блокаторы кальциевых каналов, и их применению для лечения инсульта, ишемии головного мозга, боли, травмы головы или эпилепсии. Патент США 6521647 относится к применению блокаторов кальциевых каналов в лечении почечной недостаточности у животных, особенно хронической почечной недостаточности. WO 97/10210 относится к трициклическим гетероциклическим производным и их применению в терапии, в частности в качестве антагонистов кальциевых каналов, например, для лечения ишемии, в частности ишемического инсульта. WO 03/018561 относится к соединениям хинолина, действующим как антагонисты кальциевых каналов N-типа, и способам применения подобных соединений для лечения или профилактики боли или ноцицепции. WO 03/057219 относится к блокаторам натриевых каналов, эффективным в качестве агентов для лечения или модулирования расстройств центральной нервной системы, таких как нейропатическая боль, воспалительная боль, боль, связанная с воспалением, или эпилепсия. Моноаминоксидаза (MAO) является ферментом, присутствующим в наружной митохондриальной мембране нейронных и не нейронных клеток. Существуют две изоформы MAO: MAO-A и MAO-B. Ферменты MAO ответственны за окислительное дезаминирование эндогенных и ксенобиотических аминов и имеют различную тропность к субстратам, специфичность к ингибиторам и распределение в тканях. Предпочтительными субстратами для MAO-A являются серотонин, норадреналин и адреналин, а хлоргилин является селективным ингибитором MAO-A; тогда как MAO-B обладает тропностью к Ингибирование MAO позволяет накапливаться эндогенным и экзогенным субстратам, и, таким образом, при почти полном ингибировании (>90%), может изменять динамику обычных моноаминных медиаторов. MAO регулирует концентрации в мозге наиболее важных нейромедиаторов, таких как норадреналин, серотонин и допамин, которые связаны с эмоциями, тревожностью и движениями. Таким образом, полагается, что активность MAO тесно связана с различными психиатрическими и неврологическими расстройствами, такими как депрессия, тревожность и болезнь Паркинсона (PD), и старения в общем смысле. Ингибиторы MAO-A применяются главным образом в психиатрии для лечения большой, рефрактерной и атипичной депрессии, вследствие их способности повышать сниженный уровень серотонина и норадреналина в мозге. Совсем недавно, ингибиторы MAO-A были применены для лечения пациентов с тревожными расстройствами, такими как социофобия, панические расстройства, посттравматические стрессовые расстройства и обсессивно-компульсивные расстройства. Ингибиторы MAO-B применяются главным образом в неврологии для лечения PD. Также существуют новые данные и интерес в изучении роли MAO-B в других патологических состояниях, таких как болезнь Альцгеймера (AD). До настоящего времени, не сообщалось ни о каких доказательствах относительно участия MAO-B в метаболизме ко-медиаторов, таких как холецистокинин, субстанция P, соматостатин и нейротензин, которые вовлечены в модуляцию ощущения боли. По этой причине нет никакого научного объяснения применению ингибиторов MAO-B при болевых синдромах. Сообщалось о неблагоприятных реакциях на лекарственные средства при клиническом применении ингибиторов MAO. Первое поколение неселективных и необратимых ингибиторов MAO, таких как транилципромид и фенелзин, имеют серьезные побочные эффекты, включая гепатотоксичность, ортостатическую гипотензию и, наиболее важно, гипертензивный криз, который развивается после приема внутрь пищевых продуктов, содержащих тирамин (Cooper AJ. – Tyramine and irreversible monoamine oxidase inhibitors in clinical pratice. – Br J Psych Suppl 1989:38-45). При применении этих неселективных и необратимых ингибиторов MAO необходимо строго соблюдать диету с пониженным содержанием тирамина. Чувствительность артериального давления к тирамину нормализуется через 4 недели после прекращения терапии транилципромидом и через более чем 11 недель после прекращения терапии фенелзином. Селегилин, селективный и необратимый ингибитор MAO-B, особенно при применении в комбинации с леводопой у больных с PD, может вызвать анорексию/тошноту, ксеростомию, дискинезию и ортостатическую гипотензию, последнее осложнение является самым проблематичным (Volz H. P. and Gleiter C.H. – Monoamine oxidase inhibitors. A perspective on their use in the elderly. – Drugs Aging 13 (1998), pp. 341-355). В сравнении с пациентами, получающими плацебо, у пациентов, получающих селегилин в режиме монотерапии, чаще встречались анорексия/тошнота, повреждение скелетных мышц и сердечные аритмии. Кроме этих неблагоприятных эффектов было отмечено повышение уровней АЛТ и АСТ в сыворотке крови. Наиболее часто описываемым неблагоприятным эффектом моклобемида, селективного и обратимого ингибитора MAO-A, является нарушение сна, повышенная тревожность, беспокойство и головная боль. Комбинация селективных ингибиторов обратного захвата серотонина (SSRIs) и моклобемида весьма эффективна в случаях рефрактерной депрессии, но тот факт, что токсические побочные эффекты, такие как серотонинэргический синдром, являются следствием применения этой комбинации, оспаривается (Baumann P. – Pharmacokinetic-pharmacodynamic relationship of the selective serotonin reuptake inhibitors. Clin Pharmacokinet 31 (1996), pp. 444-469). Вследствие развития сердечных аритмий и повышения уровней ферментов печени необходимо регулярно проверять электрокардиограмму и лабораторные показатели. Многие виды физиологических изменений, происходящих при старении, влияют на фармакодинамику и фармакокинетику ингибиторов MAO. В действительности, фармакокинетические показатели у пожилых заметно отличаются от таковых для более молодых пациентов. Эти показатели, включая абсорбцию, распределение, метаболизм и экскрецию, должны приниматься во внимание для избежания или сведения к минимуму некоторых неблагоприятных эффектов и взаимодействий лекарственных средств. Пожилые пациенты в основном более склонны к развитию побочных эффектов, включая неблагоприятные реакции на лекарственное средство. У пожилых может чаще встречаться гипертензивный криз, так как сердечно-сосудистая система пожилых скомпрометирована возрастом. Применение симпатомиметических препаратов в комбинации с ингибиторами MAO может также повышать кровяное давление. Кроме того, в сравнении с плацебо, фенелзин был связан со значительно более высокой частотой развития сонливости, тремора, дискинезии, диареи, затруднения мочеиспускания, ортостатических эффектов и неблагоприятных дерматологических эффектов. Интересно отметить, что в пожилом возрасте головная боль отмечается чаще при лечении моклобемидом (Volz H. P. and Gleiter C.H. – Monoamine oxidase inhibitors. A perspective on their use in the elderly. Drugs Aging 13 (1998), pp. 341-355). Ингибиторы MAO иногда назначаются для лечения депрессии. Вследствие потенциального риска совершения суицида неблагоприятные реакции на лекарственное средство и токсичность, вследствие передозировки, являются важными факторами, которые необходимо принимать во внимание при выборе антидепрессанта. Кроме того, полагается, что при применении ингибиторов MAO в высоких дозах значительно возрастает частота развития неблагоприятных эффектов со стороны сердечно-сосудистой системы и, вследствие того, что при таких больших дозировках наиболее доступных препаратов селективность действия MAO теряется, тирамин может вызывать потенциально опасные гипертензивные реакции. Острая передозировка ингибиторами MAO вызывает развитие состояния повышенной тревожности, галлюцинаций, гипертермии, гиперрефлексии и конвульсий. Патологическое кровяное давление также является симптомом интоксикации, так что может потребоваться промывание желудка и поддержание функции легких и сердца. Передозировка традиционных неселективных и необратимых ингибиторов MAO является весьма опасной и иногда фатальной (Yamada and Richelson, 1996. Pharmacology of antidepressants in the elderly. In: David JR, Snyder L., editors. Handbook of pharmacology of aging. Boca Raton: CRC Press 1996). При лечении заболеваний, при которых механизмы натриевых и кальциевых каналов играют патологическую роль, и в частности болевых синдромов (либо нейропатического, либо воспалительного типа), подавление ферментов MAO не приносит никакой пользы. Наиболее клинически активные антиноцицептивные препараты не обладают ингибирующей MAO активностью. Напротив, побочные эффекты в виде ингибирования MAO могут требовать, по крайней мере, двух типов негативных ограничений. 1.Диетических: потребление пищи с высоким содержанием тирамина может вызывать тяжелое, даже угрожающее жизни повышение системного кровяного давления (так называемый “сырный эффект”). 2.Фармакологических: боль часто купируется с помощью комбинации препаратов, таких как производные опиоидов и трициклические антидепрессанты. Подобная комбинация становится опасной при применении ингибиторов MAO, поскольку она может вызывать серотонинэргический синдром (тревожность, тремор, галлюцинации, гипертермия и аритмии). Таким образом, устранение или значительное уменьшение ингибирующей MAO активности лекарственных средств, действующих как модуляторы натриевых и/или кальциевых каналов, эффективных в профилактике, облегчении и лечении широкого круга патологических процессов, при которых указанный(е) механизм(ы) играет(ют) патологическую роль (таких как боль, мигрень, сердечно-сосудистые, воспалительные, мочеполовые, метаболические и желудочно-кишечные заболевания), является неожиданным и существенным терапевтическим улучшением, в сравнении с соединениями с подобной эффективностью, но с вышеупомянутыми побочными эффектами. Указанное улучшение является особенно желательным для лекарственных средств, действующих как эффективные модуляторы натриевых и/или кальциевых каналов, в частности для лечения болевых синдромов. Принимая во внимание эти открытия относительно ингибиторов MAO и, в частности, испытывая недостаток в каких-либо доказательствах роли MAO-B в таких патологических процессах, как боль, мигрень, сердечно-сосудистые, воспалительные, мочеполовые, метаболические и желудочно-кишечные заболевания, соединения, показанные при вышеуказанных состояниях, не должны обладать ингибирующей MAO-B активностью, наличие которой может усиливать нежелательные неблагоприятные явления. Предпочтительными должны считаться лекарственные средства, “селективно действующие как модуляторы натрия и/или кальция” или эффективные в “селективном лечении” патологических процессов, расстройств или заболеваний, при которых механизм натриевых и/или кальциевых каналов играет(ют) патологическую роль. Под этим выражением подразумеваются лекарственные средства, которые при назначении нуждающемуся в них пациенту в количествах, эффективных в лечении вышеуказанных заболеваний, при которых вышеупомянутый механизм(ы) играет(ют) патологическую роль, не проявляют никакой ингибирующей MAO активности или проявляют значительно меньшую ингибирующую MAO активность, таким образом приводя к профилактике развития побочных эффектов, возникающих вследствие накопления эндогенных и экзогенных моноаминных медиаторов. Первым объектом этого изобретения является применение выбранных (галобензилокси)бензиламино-пропанамидов для производства лекарственных средств, действующих как модуляторы натриевых и/или кальциевых каналов, для лечения патологий, где вышеупомянутый механизм(ы) играет(ют) патологическую роль, указанные лекарственные средства в основном лишены какой-либо ингибирующей MAO-B активности или имеют значительно меньшую ингибирующую MAO активность и, следовательно, имеют меньший потенциал к развитию нежелательных побочных эффектов. Указанное применение обеспечивает улучшенный селективный способ профилактики, облегчения и/или лечения вышеуказанных патологических процессов. Описание изобретения Объект настоящего изобретения относится к применению (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамида или (R)-2-[4-(2-хлорбензилокси)бензиламино]-N-метилпропанамида в виде отдельного изомера или в виде его фармацевтически приемлемых солей для производства лекарственного средства, селективно действующего как модулятор натриевых и/или кальциевых каналов, эффективного в профилактике, облегчении и/или лечении заболеваний, где указанный механизм(ы) играет(ют) патологическую роль, характеризующемуся тем, что указанное лекарственное средство в основном лишено какого-либо эффекта ингибирования МАО или проявляет значительно меньший эффект ингибирования MAO в дозировках, терапевтически эффективных для профилактики, облегчения и/или лечения указанных заболеваний. К указанным заболеваниям относятся, без ограничения перечисленными, боль, мигрень, воспалительные, мочеполовые и желудочно-кишечные заболевания. Согласно следующему аспекту этого изобретения, процессы, профилактика, облегчение или лечение которых может осуществляться с помощью вышеупомянутых соединений и их фармацевтически приемлемых солей, предпочтительно включают болевой синдром (как нейропатического так и/или воспалительного типа), и/или мигрень, и/или мочеполовые, и/или желудочно-кишечные заболевания. Эти соединения обладают модулирующей натриевые и/или кальциевые каналы активностью с неожиданным профилем селективности, в сравнении с другими производными того же химического класса, действующими как модуляторы натриевых и/или кальциевых каналов и, в частности, в сравнении с соответствующими S-изомерами. В действительности, с помощью прогностических фармакологических тестов было показано, что соотношение между дозами соединений по изобретению, действующих как модуляторы натриевых и/или кальциевых каналов, и дозами тех же продуктов, действующих как ингибиторы фермента MAO-B, уменьшается неожиданным и значительным образом. В этом описании и формуле изобретения выражение “модулятор(ы) натриевых и/или кальциевых каналов” означает соединения, способные блокировать ток натрия и/или кальция потенциалозависимым образом. Соединение (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамид упомянуто как отдельный изомер или смесь рацематов в EP 1045830 B1 (и WO 99/35125) без какой-либо определенной информации о его изготовлении и исследовании. Соединение (R)-2-[4-(2-хлорбензилокси)бензиламино]-N-метилпропанамид раскрыто в форме соответствующей соли метансульфоновой кислоты в EP 0400495 B1 (и WO 90/14334). Еще одним объектом этого изобретения является способ селективной профилактики, облегчения и/или лечения патологических процессов, при которых механизм(ы) натриевых и/или кальциевых каналов играет(ют) патологическую роль, который включает введение нуждающемуся в этом пациенту терапевтически эффективного количества (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамида или (R)-2-[4-(2-хлорбензилокси)бензиламино]-N-метилпропанамида в виде отдельного изомера или их фармацевтически приемлемых солей, где терапевтическая активность указанного соединения в основном лишена какого-либо эффекта ингибирования MAO или соединение проявляет значительно меньший побочный эффект ингибирования MAO. Согласно следующему аспекту вышеуказанного способа этого изобретения, патологические процессы, в которых механизм(ы) натриевых или кальциевых каналов играет(ют) патологическую роль, включают боль, мигрень, воспалительные, мочеполовые и желудочно-кишечные заболевания; предпочтительно, указанные патологические процессы включают болевой синдром либо нейропатического, либо воспалительного типа. Соединения по изобретению и их соли могут быть получены с помощью процесса, включающего взаимодействие соединений общей формулы I
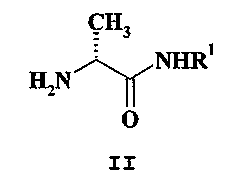
в которой R обозначает 2-фтор или 2-хлор заместитель, с соединением формулы II
в которой R1 обозначает водород, когда R в соединении формулы II обозначает 2-фтор заместитель, или метильную группу, когда R в соединении формулы II обозначает 2-хлор заместитель. Соединения I и II являются коммерчески доступными соединениями. Взаимодействие соединения формулы I с соединением формулы II для получения соответственно (R)-2-[(галобензилокси)бензиламино]-пропанамида является реакцией восстановительного аминирования, которая может быть осуществлена согласно известным способам. Согласно предпочтительному варианту осуществления изобретения, она может быть выполнена в атмосфере азота, в подходящем органическом растворителе, таком как спирт, например, в низшем алканоле, в частности метаноле, или в ацетонитриле, или в тетрагидрофуране при температуре от приблизительно 0°C до приблизительно 80°C, в присутствии восстанавливающего агента, наиболее подходящим из которых является борогидрид натрия или цианоборогидрид натрия. Для облегчения реакции в реакционную смесь иногда может добавляться изопропилат титана IV и молекулярные сита. Фармакология Соединения по изобретению являются потенциалозависимыми блокаторами кальциевых и/или натриевых каналов, что демонстрируется с помощью флюоресцентного анализа поступления кальция и электрофизиологических исследований. Активность селективных (R)-2-[(галобензилокси)бензиламино]-пропанамидов по модулированию натриевых каналов определялась с помощью электрофизиологических анализов с применением технологии двухэлектродной фиксации потенциала (TEVC) в изолированных овоцитах Xenopus, экспрессирующих Na канал Nav 1.3. Активность (R)-2-[(галобензилокси)бензиламино]-пропанамидов по модулированию кальциевых каналов N-типа определялась с помощью анализа поступления кальция, основанного на флюоресценции. Активность вышеупомянутых соединений по блокированию MAO-B определялась с помощью анализа определения активности фермента in vitro. Активность вышеупомянутых соединений как анальгетиков in vivo оценивалась с помощью формалинового теста на мышах. Селективность соединений этого изобретения оцененивалась в сравнении с другими производными 2-[(галобензилокси)бензиламино]-пропанамида, которые, как известно, действуют как анальгетики, согласно EP 1045830 B1, в частности, в сравнении с соответствующими (S)-изомерами, и как с (R), так и с (S) изомерами 2-[4-(3-хлорбензилокси)бензиламино]пропанамида. Эти сравнительные тесты показывают, что одновременно с тем, что (R)-изомеры этого изобретения имеют в основном такую же степень анальгетической активности, как и соединения контрольной группы, их активность как блокаторов MAO-B по крайней мере в 40-90 раз ниже, чем та же активность у соединений контрольной группы. Кроме того, соотношение между дозами R-изомеров по данному изобретению, действующих как модуляторы Na+ и/или Ca+, и дозами тех же продуктов, действующих как ингибиторы фермента MAO-B, намного ниже, чем то же соотношение для соединений контрольной группы, таким образом предоставляя дальнейшее подтверждение их селективного профиля. Подобные субстанции также проявляют “зависимость от применения”, когда натриевые каналы блокированы, то есть максимальная блокада натриевых каналов достигается после повторной стимуляции натриевых каналов. Таким образом, субстанции предпочтительно связываются с натриевыми каналами, которые активизированы многократно. В результате субстанции способны проявлять свою активность избирательно в тех областях тела, которые патологически избыточно стимулированы, как проиллюстрировано с помощью экспериментов фиксации потенциала, которые показывают, что соединения согласно изобретению блокируют электрически стимулированный натриевый канал “зависимым от применения” образом. В результате этих механизмов, соединения по изобретению проявляют активность in vivo при пероральном введении в диапазоне от 0,1 до 100 мг/кг, в формалиновой модели постоянной боли на животных. Ввиду вышеописанных механизмов действия, соединения настоящего изобретения особенно эффективны в селективном лечении или профилактике нейропатической боли. К синдромам нейропатической боли относятся, но не ограничиваясь ими: диабетическая невропатия; ишиалгия; неспецифичная боль в нижнем отделе спины; боль при рассеянном склерозе; фибромиалгия; ВИЧ-ассоциированная нейропатия; невралгия, такая как постгерпетическая невралгия и невралгия тройничного нерва; и боль в результате физической травмы, ампутации, рака, действия токсинов или состояний хронического воспаления; компрессия спинного мозга, нервных корешков, периферических нервов и центральных проводящих путей боли. Соединения по изобретению также эффективны в селективном лечении хронической боли. Хроническая боль включает, но не ограничиваясь ими, хроническую боль, вызванную воспалением или связанным с воспалением состоянием, остеоартритом, ревматоидным артритом или являющуюся осложнением заболевания, острого повреждения или травмы, и включает боль в верхнем отделе спины или боль в нижнем отделе спины (вследствие системного, регионального или первичного заболевания позвоночного столба (например, радикулопатии), боль костного происхождения (вследствие остеоартрита, остеопороза, костного метастаза или неизвестных причин), тазовую боль, боль, связанную с повреждением спинного мозга, кардиальную боль в грудной клетке, экстракардиальную боль в грудной клетке, центральную постинсультную боль, миофасциальную боль, раковую боль, боль при СПИДе, боль при серповидноклеточной анемии, гериатрическую боль или боль, вызванную головной болью, синдромом височно-нижнечелюстного сустава, подагрой, фиброзом или компрессионными синдромами верхней апертуры грудной клетки, боль, связанную с хирургическим лечением и являющуюся осложнением хирургического лечения. Соединения по изобретению также эффективны в селективном лечении острой боли (вызванной острой травмой, заболеванием, травмами в спортивной медицине, туннельным синдромом запястья, ожогами, растяжениями связок и деформациями скелетных мышц, сухожильно-мышечной деформацией, синдромами шейно-плечевой боли, язвой желудка, язвой двенадцатиперстной кишки, дисменореей, эндометриозом или хирургическим лечением, таким как операции на открытом сердце или операции в условиях искусственного кровообращения), послеоперационной боли, боли, вызываемой камнями почек, боли, вызываемой камнями желчного пузыря, акушерской боли или зубной боли. Соединения по изобретению также эффективны в селективном лечении мигрени и других головных болей, видоизмененной мигрени или развивающейся головной боли, кластерной головной боли, тензионной головной боли, а также вторичной головной боли вследствие различных расстройств, например, инфекций, нарушений обмена веществ или других системных заболеваний, и других острых головных болей, пароксизмальной гемикрании и т.п., развивающихся вследствие ухудшения вышеупомянутых первичных и вторичных головных болей. Соединения по изобретению подавляют воспалительные процессы, влияющие на все системы организма. Поэтому они эффективны в селективном лечении воспалительных процессов мышечно-скелетной системы, примеры которых перечислены ниже, но не охватывают все намеченные расстройства: артритические заболевания, такие как анкилозирующий спондилит, цервикальный артрит, фибромиалгия, подагра, ювенильный ревматоидный артрит, пояснично-крестцовый артрит, остеоартрит, остеопороз, псориатический артрит, ревматизм; расстройства с поражением кожи и смежных тканей: экзема, псориаз, дерматит и воспалительные состояния, такие как солнечный ожог; расстройства дыхательной системы: астма, аллергический ринит и респираторный дистресс-синдром, легочные расстройства, которые включают процесс воспаления, такие как бронхит; хронические обструктивные заболевания легких; расстройства иммунной и эндокринной систем: узелковый периартериит, тиреоидит, рассеянный склероз, саркоидоз, синдром Бехчета, полимиозит, гингивит. Соединения по изобретению также эффективны в селективном лечении расстройств желудочно-кишечного (GI) тракта, таких как воспалительные расстройства кишечника, включая, но не ограничиваясь ими, неспецифический язвенный колит, болезнь Крона, илеит, проктит, глютеновую болезнь, энтеропатии, микроскопический или коллагеновый колит, эозинофильный гастроэнтерит или воспаление резервуара, сформированного после проктоколэктомии или подвздошно-анального анастомоза, и синдром раздраженной кишки, включающий любые расстройства, связанные с болью в животе и/или дискомфортом в животе, такие как пилороспазм, нервная диспепсия, спастическая толстая кишка, спастический колит, спастическая дискинезия кишечника, кишечный невроз, функциональный колит, слизистый колит и колит вследствие приема слабительных; а также для лечения атрофического гастрита, gastritis varialoforme, пептических язв, изжоги и других поражений GI тракта, например, поражения Helicobacter pylori, гастроэзофагеальной рефлюксной болезни, гастропареза, такого как диабетический гастропарез; и других функциональных кишечных расстройств, таких как неязвенная диспепсия (NUD); рвота, диарея, и висцеральное воспаление. Соединения по изобретению также эффективны в селективном лечении расстройств мочеполового тракта, таких как гиперреактивный мочевой пузырь, простатит (хронический бактериальный и хронический небактериальный простатит), простатодиния, интерстициальный цистит, недержание мочи и аднексит, тазовый перитонит, бартолинит и вагинит. Соединения по изобретению также эффективны для селективного лечения всех других состояний, опосредованных ингибированием потенциалозависимых натриевых каналов, и/или потенциалозависимых кальциевых каналов. Следует учитывать, что соединения по изобретению могут преимущественно применяться совместно с одним или большим числом других терапевтических средств. Примеры подходящих средств для добавочной терапии включают агонист 5HT1B/1D, такой как триптан (например, суматриптан или наратриптан); агонист аденозина А1; лиганд ЕР; модулятор NMDA, такой как антагонист глицина; антагонист субстанции P (например, антагонист NK1); каннабиноид; ацетаминофен или фенацетин; ингибитор 5-липоксигеназы; антагонист лейкотриеновых рецепторов; DMARD (например, метотрексат); габапентин и родственные соединения; трициклический антидепрессант (например, амитриптилин); противоэпилептическое средство, стабилизирующее нейроны; ингибитор матриксной металлопротеиназы; ингибитор синтазы окиси азота (NOS), такой как ингибитор iNOS или nNOS; ингибитор высвобождения, или активности фактора некроза опухоли альфа; терапия антителами, например, терапия моноклональными антителами; противовирусный агент, такой как нуклеозидный ингибитор (например, ламивудин) или модулятор иммунной системы (например, интерферон); аналгетик, такой как ингибитор циклооксигеназы-2; местный анестетик; стимулятор, включая кофеин; H2-антагонист (например, ранитидин); ингибитор протонной помпы (например, омепразол); антацид (например, гидроокись алюминия или магния); ветрогонное средство (например, симетикон); деконгестант (например, фенилэфрин, фенилпропаноламин, псевдоэфедрин, оксиметазолин, адреналин, нафазолин, ксилометазолин, пропилгекседрин или лево-дезоксиэфедрин, нафазолин, ксилометазолин, пропилгекседирин или лево-дезоксиэфедрин); противокашлевое средство (например, кодеин, гидрокодон, кармифен, карбетапентан или декстраметорфан); диуретик; антигистаминное средство с седативным эффектом или без седативного эффекта. Необходимо понимать, что настоящее изобретение включает применение соединений согласно этому изобретению или их фармацевтически приемлемой соли в комбинации с одним или большим числом терапевтических агентов. Соединения по настоящему изобретению эффективны для человека и в ветеринарии. Необходимо понимать, что применяемые здесь термины “лечение” или “лечить” всякий раз, когда особым образом не определено иначе, включают профилактику, облегчение и лечение патологического процесса, в частности, они включают как лечение установленных симптомов, так и профилактическое лечение. Соответственно, выражение “терапевтически эффективный”, применяемое по отношению к “количеству”, “дозе” или “дозировке” (R)-2-[(галобензилокси)бензиламино]-пропанамидов по данному изобретению, подразумевает “количество”, “дозу” или “дозировку” любых указанных соединений, достаточную для применения как для лечения установленных симптомов, так и для профилактического лечения вышеуказанных патологических процессов. Согласно применению этого изобретения, вышеупомянутое селективно действующие производные R-2-[(галобензилокси)бензиламино]-пропанамидов и их фармацевтически приемлемые соли могут применяться как “действующие компоненты” фармацевтически приемлемой композиции, которая может быть изготовлена с помощью обычных процедур, например, с помощью смешивания действующего компонента с фармацевтически приемлемыми, терапевтически инертными органическими и/или неорганическими материалами-носителями. Композиция, включающая вышеуказанные производные 2-[(галобензилокси)бензиламино]-пропанамидов, может применяться в различных формах, например, орально, в форме таблеток, пастилок, капсул, таблеток, покрытых сахаром или оболочкой, жидких растворов, эмульсий или суспензий; ректально или интравагинально, в форме суппозиториев; парентерально, например, с помощью внутримышечных, подкожных или внутривенных инъекций или инфузий, локально и трансдермально в форме пластыря и геля, и крема. К подходящим фармацевтически приемлемым, терапевтически инертным органическим и/или неорганическим материалам-носителям, полезным в изготовлении подобной композиции, относятся, например, вода, желатин, аравийская камедь, лактоза, крахмал, целлюлоза, магния стеарат, тальк, растительные масла, циклодекстрины, полиалкиленгликоли и т.п. Композиция, содержащая упомянутая выше (R)-2-[(галобензилокси)бензиламино]-пропанамиды, может быть простерилизована и может, кроме того, содержать широко известные компоненты, такие как, например, консерванты, стабилизаторы, увлажняющие или эмульгирующие агенты, например, парафиновое масло, моноолеат маннида, соли для регуляции осмотического давления, буферы и т.п. К примеру, твердые оральные формы могут вместе с действующим компонентом содержать растворители, например, лактозу, декстрозу, сахарозу, целлюлозу, кукурузный крахмал или картофельный крахмал; лубриканты, например, двуокись кремния, тальк, стеариновую кислоту, стеарат магния или кальция, и/или полиэтиленгликоли; связующие агенты, например, крахмалы, гуммиарабики, желатин, метилцеллюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; дезагрегирующие агенты, например, крахмал, альгиновую кислоту, альгинаты или натрия крахмал гликолят; выделяющие газ смеси; красители; подсластители; увлажняющие агенты, такие как лецитин, полисорбаты, лаурилсульфаты; и в основном нетоксичные и фармакологически неактивные субстанции, применяемые в фармацевтических композициях. Указанные фармацевтические препараты могут производиться известным образом, например, с помощью процессов смешивания, гранулирования, таблетирования, покрытия сахаром или покрытия пленкой. Композиции для орального применения включают композиции с замедленным высвобождением, которые могут изготавливаться обычным образом, например, с помощью нанесения на таблетки и гранулы кишечнорастворимого покрытия. Жидкая дисперсия для орального приема может быть представлена, например, сиропами, эмульсиями и суспензиями. Сиропы могут содержать в качестве носителя, например, сахарозу или сахарозу с глицерином и/или маннитолом, и/или сорбитолом. Суспензии и эмульсии могут содержать в качестве носителя, например, природную камедь, агар, альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций вместе с действующим соединением могут содержать фармацевтически приемлемый носитель, например, стерильную воду, оливковое масло, этилолеат, гликоли, например, пропиленгликоль, и, если желательно, подходящее количество лидокаина. Растворы для внутривенных инъекций или инфузий могут содержать в качестве носителя, например, стерильную воду, или, предпочтительно, они могут быть в форме стерильных водных, изотонических солевых растворов. Суппозитории могут вместе с действующим компонентом содержать фармацевтически приемлемый носитель, например, масло какао, полиэтиленгликоль, поверхностно-активные вещества на основе эфира жирной кислоты и полиоксиэтиленсорбитана, или лецитин. В зависимости от скорости клиренса, подходящее лечение проводится 1, 2 или 3 раза в сутки. Соответственно, желательная доза может быть представлена в виде однократной дозы или в виде дробных доз, которые вводятся через подходящие интервалы, например, от двух до четырех или более неполных доз в сутки. Фармацевтические композиции, включающие вышеупомянутые селективно действующие (R)-2-[(галобензилокси)бензиламино]-пропанамиды, будут содержать в единице дозировки, например, в капсуле, таблетке, порошке для инъекций, чайной ложке, суппозитории и т.п., от приблизительно 1 до приблизительно 2500 мг действующего компонента, предпочтительно от 5 до 1000 мг, наиболее предпочтительно от 10 до 200 мг действующего компонента. Оптимальные назначаемые терапевтически эффективные дозы могут быть легко определены специалистами и будут варьировать, в основном, в зависимости от устойчивости препарата, способа введения и улучшения состояния, или разновидности заболевания, лечение которого проводится. Кроме того, факторы, связанные с конкретным субъектом, лечение которого проводится, включающие возраст субъекта, вес, диету и время введения, приводят к необходимости регулировки дозы до подходящего терапевтически эффективного уровня. В основном терапевтически эффективные суточные дозы соединений изобретения для пациента, нуждающегося в селективном лечении вышеупомянутых патологических процессов, в которых механизм(ы) натриевых и/или кальциевых каналов играет(ют) патологическую роль, находятся в диапазоне от 0,05 до 100 мг/кг, предпочтительно от 0,1 до 50 мг/кг, наиболее предпочтительно от 0,5 до 10 мг/кг веса тела. Изобретение далее иллюстрируют следующие примеры. Пример 1 (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамид К 50 мл сухого метанола с образованием пузырьков газа в (R)аланинамида гидрохлориде (1,37 г, 11 ммоль) был добавлен 4-(2-фторбензилокси)бензальдегид (2,3 г, 10 ммоль), триэтиламин (1,12 г, 11 ммоль) и 1 г молекулярных сит 3- Пример 2 (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамида метансульфонат К раствору (R)-2-[4-(2-фторбензилокси)бензиламино]-пропанамида (2,5 г, 8,3 ммоль) в 40 мл этилацетата было добавлено стехиометрическое количество метансульфоновой кислоты (0,80 г), растворенной при перемешивании в 10 мл этилацетата при комнатной температуре. Через 1 час белые кристаллы были отфильтрованы, промыты 5 мл этилацетата и высушивались в вакуумной печи до получения 3,26 г (98,8% выход продукта) названного соединения: точка плавления 240-241°C. 1H-ЯМР (ДМСО-d6) Вычислено (C17H19FN2O2-CH3SO3H) C, H, F, N, S. Аналогично были изготовлены: (R)-2-[4-(2-хлорбензилокси)бензиламино]-N-метилпропанамида метансульфонат 1H-ЯМР (ДМСО-d6) Вычислено (C18H21ClN2O2-CH3SO3H) C, H, Cl, N, S. (R)-2-[4-(3-хлорбензилокси)бензиламино]пропанамида метансульфонат 1H-ЯМР (ДМСО-d6) Вычислено (C17H19ClN2O2-CH3SO3H) C, H, Cl, N, S. Пример 3 Анализ активности фермента MAO-B in vitro Изготовление мембран (нативная митохондриальная фракция): самцы крыс Wistar (Harlan, Италия – 175-200 г) умерщвлялись под легкой анестезией, и головной мозг быстро извлекался и гомогенизировался в 8 объемах охлажденного до 0°С 0,32М сахарозного буфера, содержащего 0,1М EDTA, pH 7,4. Нативный гомогенат центрифугировался со скоростью 2220 об/мин в течение 10 минут, и супернатант был извлечен. Осадок был гомогенизирован и снова центрифугировался, и два супернатанта были объединены и центрифугировались со скоростью 9250 об/мин в течение 10 минут при +4°C. Осадок был повторно растворен в свежем буфере и центрифугировался со скоростью 11250 об/мин в течение 10 минут при +4°C. Образующийся в результате осадок до применения хранился при -80°C. Анализ активности ферментов in vitro: активности фермента оценивались с помощью радиоферментного анализа с применением селективного субстрата 14C-фенилэтиламина (PEA) для MAO-B. Митохондриальный осадок (500 мкг белка) был повторно растворен в 0,1М фосфорнокислом буфере, pH 7,4, и 500 мкл были добавлены к 50 мкл тестируемого соединения или буфера на 30 минут при 37°C (предварительная инкубация), затем был добавлен субстрат (50 мкл). Инкубация осуществлялась в течение 10 минут при 37°C (14C-PEA, 0,5 мкМ). Реакция была остановлена с помощью добавления 0,2 мл HCl или перхлорной кислоты. После центрифугирования, дезаминированные метаболиты были экстрагированы 3 мл толуола и радиоактивной органической фазы, определенной с помощью жидкостной сцинтилляционной спектрометрии с 90% эффективностью. Радиоактивность в элюате указывает на продукцию нейтральных и кислых метаболитов, которые образуются в результате активности MAO-B. Ферментативная активность была выражена в нмоль преобразованного субстрата/мг белка/минуту. Активность MAO-B в образце была выражена как процент от контрольной активности в отсутствии ингибиторов после вычета подходящих пустых значений. Кривые ингибирования лекарственного средства были получены по крайней мере от восьми различных концентраций, каждой в двойном экземпляре (10-10 до 10-5 M) и значений IC90 (концентрация лекарственного средства, подавляющая 90% активности фермента) с доверительными интервалами, определенными с применением анализа линейной регрессии (полуавтоматическая компьютерная программа). Для достижения значительного повышения уровня нейромедиатора, активность фермента MAO-B должна быть блокирована по крайней мере на 90%. Значения IC90 как для (R)-изомеров этого изобретения, так и для сравнительных соединений приведены в Таблице 1. Пример 4 Анализ поступления кальция Клетки нейробластомы человека IMR32 по своей природе содержат каналы как L, так и N типа. В дифференцирующих условиях IMR32 избирательно экспрессируют на поверхности мембраны кальциевые каналы N-типа. Оставшиеся кальциевые каналы L-типа были заблокированы, применяя селективный блокатор L-типа, нифедипин. В этих экспериментальных условиях могут быть обнаружены только каналы N-типа. Клетки IMR32 были дифференцированы, применяя 1мМ дибутирил-цАМФ и 2,5 мкМ бромодезоксиуридина в течение 8 дней (4 раза) в колбах объемом 225 см2, затем отделены, высеяны в количестве 200000 клеток/стенку на 96 покрытых полилизином чашек и далее инкубировались в течение 18-24 часов в присутствии дифференцирующего буфера перед применением. Применялся набор для анализа Ca2+ (Molecular Devices), основанный на флуоресцентном индикаторе кальция с длиной волны 485-535 нм. Дифференцированные клетки инкубировались с загрузкой красителя в течение 30 минут при 37°C, затем, на дальнейшие 15 минут был добавлен нифедипин в отдельности (1 мкМ) или в присутствии Флюоресценция (485-535 нм) определялась до и после (30-40 секунд) автоматизированной инъекции деполяризующего раствора 100 мМ KCl, применяя спектрофотометр для прочтения планшетов Victor (Perkin Elmer). Построение кривых ингибирования осуществлялось от 5 концентраций, каждой в трех экземплярах, а IC50 была определена с применением анализа линейной регрессии. Активность кальциевого канала N-типа, выраженная в виде IC50, для (R)-изомера этого изобретения и соединений контрольной группы показана в Таблице 1. Пример 5 Электрофизиологический анализ Эксперименты для определения тонической блокады проводились на изолированных овоцитах Xenopus, экспрессирующих Na каналы Nav 1.3. Потенциалы регистрировались с применением технологии двухэлектродной фиксации потенциала (TEVC). Приготовление овоцитов С помощью раствора этилового эфира 3-аминобензойной кислоты (1 г/л) производилась анестезия лягушки (Xenopus Laevis), и через 25 минут она помещалась на спину на охлажденную до 0°С подложку. Кожа и другие ткани рассекались, доли яичников извлекались и сохранялись в ND96 После удаления овоцитов, мышца и кожа зашивались отдельно. Доли яичников были разделены на кластеры по 10/20 овоцитов, помещены в трубки с раствором коллагеназы (1 мг/мл) и сохранялись в термостате приблизительно 1 час в движении. В конце этого шага, когда овоциты хорошо разделились друг от друга, они промывались три раза ND96 Полученные овоциты находились на различных стадиях развития. Для инъекции РНК и последующих экспериментов отбирались только клетки в стадиях V или VI. Через день после изготовления в овоциты были введены (Drummond Nanoject) 20 нг Navl.3 кРНК, и клетки выдерживались в NDE. Начиная с 48 часов после инъекции мРНК регистрировались потенциалы целых клеток, применяя автоматизированное рабочее место с фиксацией напряжения двумя микроэлектродами. Типичные микроэлектроды имеют сопротивление от 0,5 до 1 мОм и заполнены 3M KCl. Контрольный раствор в термостате содержит (мМ): NaCl 98, MgCl2 1, CaCl2 1,8, HEPES 5 (pH 7,6). Из соединений были изготовлены исходные растворы (20 мМ), которые были растворены до конечных концентраций в наружном растворе термостата. Регистрация потенциалов Для определения мембранного потенциала, вызывающего максимальную активацию, первоначально определялось соотношение потенциал/напряжение (I/V) для потенциалов Nav1.3, экспрессируемых в овоцитах. Navl.3 показал максимальную активацию при 0 мВ, что мы использовали в качестве тестового потенциала (Vtest) для исследований тонической блокады. Затем были изучены свойства инактивации потенциалов Nav1.3 в стационарном состоянии, для определения мембранных потенциалов в состоянии покоя (Vrest), при которых доступность канала является максимальной (Imax), и мембранного потенциала при инактивации на половину от максимальной (V1/2), предоставляя соответственно половину от максимальной доступности потенциала (I1/2). Эти два состояния напряжения затем применялись для оценки зависимости тонического блока от потенциала. В заключении применялся двухступенчатый протокол для определения зависимости блокады Navl.3 от потенциала: овоциты были зафиксированы при -80 мВ, потенциалы были активизированы с помощью пошаговых импульсов длительностью 100 мс до 0 мВ (Vtest) от 3000 мс предварительного потенциала -80 мВ (покой, состояние Imax) и -40 мВ (деполяризация, состояние I1/2) соответственно. Были зарегистрированы амплитуды потенциалов в двух состояниях, в отсутствие и в присутствии различных концентраций соединения (между исследованиями осуществлялось промывание) для построения кривых концентрация-ингибирование и определения значений IC50 для тонической блокады в состоянии деполяризации (половина от максимальной доступности потенциала). Активность натриевых каналов Nav 1.3, выраженная в виде IC50 для (R)-изомеров этого изобретения и соединений контрольной группы, приведена в Таблице 1. Пример 6 Формалиновый тест на мышах Согласно модифицированному протоколу от Rosland et al., (1990) 20 мкл 2,7% раствора формалина вводились подкожно (s.c) мышам в подошвенную поверхность левой лапы, и мыши немедленно помещались в чистые камеры из ПХВ для наблюдения (23×12×13 см). Тестируемое соединение (20 мг/кг) вводилось перорально за 15 минут до инъекции формалина в объеме 10 мл/кг веса тела в группах из 10 мышей на дозу. Контрольная группа лечилась носителем. Реакция на боль определялась количественно с помощью подсчета суммарного времени (в секундах) облизывания лапы, в которую был введен формалин. Результаты измерения были получены во время последней фазы, через 30-40 минут после инъекции формалина (Tjolsen 1992 et al.). Анальгетический эффект соединений вычислялся в виде % ингибирования суммарного времени облизывания по отношению к контрольной группой. Как показано в Таблице 2, оба (R)-изомера этого изобретения проявляют сходную (статистически не различимую) или лучшую анальгетическую активность, чем соединения контрольной группы. Результаты
Согласно терминам и критериям, применяемым в этой заявке и формуле изобретения, считается, что лекарственное средство, действующее как модулятор натриевых и/или кальциевых каналов, в основном, лишено какого-либо эффекта ингибирования MAO-B в дозировках, терапевтически эффективных для профилактики, облегчения и/или лечения патологических процессов, в которых указанный механизм(ы) играет(ют) патологическую роль, когда соотношение между значениями IC50 Nav 1.3 и IC90 MAO-B и соотношение между значениями IC50 Ca2+N-типа и IC90 MAO-B составляет менее 0,1. Подобным образом, лекарственное средство, действующее как модулятор натриевых и/или кальциевых каналов, рассматривается как средство со значительно меньшим эффектом ингибирования MAO-B в дозировках, терапевтически эффективных для профилактики, облегчения, и/или лечения патологических процессов, в которых указанный механизм(ы) играет(ют) патологическую роль, когда соотношение между значениями IC50 Nav 1.3 и IC90 MAO-B и соотношение между значениями IC50 Ca2+ и IC90 MAO-B составляет менее 0,5, но по крайней мере одно из них составляет не менее 0,1.
Формула изобретения
1. Применение (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамида или (R)-2-[4-(2-хлорбензилокси)бензиламино]-N-метилпропанамида в виде отдельных изомеров или их фармацевтически приемлемых солей для производства лекарственного средства, селективно действующего как модулятор натриевых и/или кальциевых каналов, для профилактики, облегчения и/или лечения патологических процессов, выбранных из боли, мигрени, воспалительных процессов, поражающих все системы организма, расстройств, поражающих кожу и смежные ткани, расстройств дыхательной системы, расстройств иммунной и эндокринной систем, желудочно-кишечных и мочеполовых расстройств, характеризующееся тем, что указанное лекарственное средство в основном лишено какого-либо эффекта ингибирования МАО или проявляет значительно меньший эффект ингибирования МАО в дозировках, терапевтически эффективных в профилактике, облегчении и/или лечении указанного патологического процесса. 2. Применение по п.1, в котором патологический процесс выбран из боли, мигрени, воспалительного, мочеполового и желудочно-кишечного расстройств. 3. Применение по п.2, в котором патологический процесс является болевым синдромом или мигренью. 4. Применение по п.3, в котором патологический процесс является болевым синдромом. 5. Применение по п.4, в котором болевой синдром относится либо к нейропатическому, либо к воспалительному типу. 6. Применение по п.4, в котором болевой синдром является острой или хронической болью. 7. Применение по п.3, в котором патологический процесс является мигренью. 8. Применение по любому из пп.1-7 (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамида в виде отдельного изомера или в виде его фармацевтически приемлемой соли, предпочтительно соли метансульфоновой кислоты. 9. Применение по любому из пп.1-7 отдельного изомера (R)-2-[4-(2-хлорбензилокси)бензиламино]N-метилпропанамида или его фармацевтически приемлемой соли, предпочтительно соли метансульфоновой кислоты. 10. Применение по п.1, в котором фермент МАО является изоформой МАО-В. 11. Применение (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамида или (R)-2-[4-(2-хлорбензилокси)бензиламино]-N-метилпропанамида в виде отдельных изомеров или их фармацевтически приемлемой соли, предпочтительно соли метансульфоновой кислоты, для изготовления лекарственного средства для профилактики, облегчения и/или лечения болевого синдрома, которое в дозировках, терапевтически эффективных для лечения указанного болевого синдрома, в основном лишено какого-либо эффекта ингибирования МАО-В или проявляет значительно меньший эффект ингибирования МАО-В. 12. Применение по любому из пп.1-7, которое включает как лечение установленных симптомов, так и профилактическое лечение. 13. (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамид в виде отдельного изомера и его фармацевтически приемлемая соль. 14. Соединение по п.13, которое является солью метансульфоновой кислоты отдельного изомера (R)-2-[4-(2-фторбензилокси) бензиламино]пропанамида. 15. Фармацевтическая композиция для селективного лечения болевого синдрома или мигрени, содержащая фармацевтически приемлемый носитель или разбавитель и, в качестве активного средства, соединение по любому из пп.13 или 14. 16. Фармацевтическая композиция по п.15, где болевой синдром относится либо к нейропатическому, либо к воспалительному типу. 17. Фармацевтическая композиция для селективного лечения болевого синдрома или мигрени, содержащая фармацевтически приемлемый носитель или растворитель и, в качестве активного средства, (R)-2-[4-(2-хлорбензилокси)бензиламино]-N-метилпропанамид в виде отдельного изомера или в виде его фармацевтически приемлемой соли, предпочтительно его метансульфоната. 18. Фармацевтическая композиция по п.17, где болевой синдром относится либо к нейропатическому, либо к воспалительному типу. 19. Соединение, выбранное из (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамида и (R)-2-[4-(2-хлорбензилокси)бензиламино]-N-метилпропанамида в виде отдельных изомеров или их фармацевтически приемлемых солей для производства лекарственного средства, селективно действующего как модулятор натриевых и/или кальциевых каналов, для профилактики, облегчения и/или лечения патологических процессов, выбранных из боли, мигрени, воспалительных процессов, поражающих все системы организма, расстройств, поражающих кожу и смежные ткани, расстройств дыхательной системы, расстройств иммунной и эндокринной систем, желудочно-кишечных и мочеполовых расстройств, характеризующееся тем, что указанное лекарственное средство в основном лишено какого-либо эффекта ингибирования МАО или проявляет значительно меньший эффект ингибирования МАО в дозировках, терапевтически эффективных в профилактике, облегчении и/или лечении указанного патологического процесса. 20. Соединение по п.19 для применения в соответствии с данным пунктом, в котором патологический процесс выбран из боли, мигрени, воспалительного, мочеполового и желудочно-кишечного расстройств. 21. Соединение по п.19 для применения в соответствии с данным пунктом, в котором патологический процесс является болевым синдромом или мигренью. 22. Соединение по п.19 для применения в соответствии с данным пунктом, в котором патологический процесс является болевым синдромом. 23. Соединение по п.22 для применения в соответствии с данным пунктом, в котором болевой синдром относится либо к нейропатическому, либо к воспалительному типу. 24. Соединение по п.19 для применения в соответствии с данным пунктом, в котором патологический процесс является мигренью. 25. Соединение по любому из пп.19-24 для применения в соответствии с любым из данных пунктов, представляющее собой (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамид в виде отдельного изомера или в виде его фармацевтически приемлемой соли, предпочтительно соли метансульфоновой кислоты.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||


 -аминоамидов и габапентин, прегабалин или тиагабин.
-аминоамидов и габапентин, прегабалин или тиагабин. -фенилэтиламину в качестве субстрата и селективно ингибируется селегилином. Допамин, тирамин и триптамин окисляются как MAO-A, так и MAO-B, в частности в мозге человека 80% допамина дезаминируется с помощью MAO-B.
-фенилэтиламину в качестве субстрата и селективно ингибируется селегилином. Допамин, тирамин и триптамин окисляются как MAO-A, так и MAO-B, в частности в мозге человека 80% допамина дезаминируется с помощью MAO-B.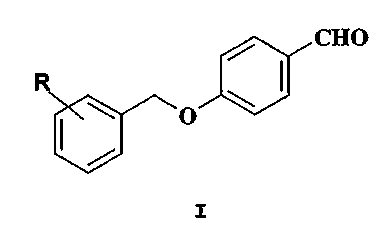
 , и смесь перемешивалась в течение 4 часов при 40°C. Затем температура была снижена до 10°C, и через 15′ был добавлен натрия борогидрид (0,19 г, 5 ммоль). Реакционная смесь перемешивалась в течение 6 часов при комнатной температуре, затем она была отфильтрована и выпаривалась до сухого состояния в вакууме. Остаток был поглощен водой и толуолом при 60°C, и органическая фаза была промыта дважды теплой водой и высушивалась при той же температуре с безводным натрия сульфатом. Раствор был отфильтрован и постепенно был охлажден до 10°C. Осадок был отфильтрован, промыт небольшим количеством охлажденного толуола и высушивался в вакууме до получения 2,69 г (89,0% выход продукта) белых кристаллов.
, и смесь перемешивалась в течение 4 часов при 40°C. Затем температура была снижена до 10°C, и через 15′ был добавлен натрия борогидрид (0,19 г, 5 ммоль). Реакционная смесь перемешивалась в течение 6 часов при комнатной температуре, затем она была отфильтрована и выпаривалась до сухого состояния в вакууме. Остаток был поглощен водой и толуолом при 60°C, и органическая фаза была промыта дважды теплой водой и высушивалась при той же температуре с безводным натрия сульфатом. Раствор был отфильтрован и постепенно был охлажден до 10°C. Осадок был отфильтрован, промыт небольшим количеством охлажденного толуола и высушивался в вакууме до получения 2,69 г (89,0% выход продукта) белых кристаллов. : 1,39 (д, J=6,9 Гц, 3H, CH3CH), 2,30 (с, 3H, CH3SO3
: 1,39 (д, J=6,9 Гц, 3H, CH3CH), 2,30 (с, 3H, CH3SO3 –), 3,71 (кв, J=6,9 Гц, 1H, CH3CH), 4,01 (м, 2H, ArCH2-NH), 5,15 (с, 2H, ArCH2O), 7,08 (м, 2H, H3, H5), 7,1-7,6 (м, 6H, H3′, H4′, H5′, H6′, H2, H6), 7,63, 7,89 (2с, 2H, CONH2), 9,0 (шир. с, 2H, NH2
–), 3,71 (кв, J=6,9 Гц, 1H, CH3CH), 4,01 (м, 2H, ArCH2-NH), 5,15 (с, 2H, ArCH2O), 7,08 (м, 2H, H3, H5), 7,1-7,6 (м, 6H, H3′, H4′, H5′, H6′, H2, H6), 7,63, 7,89 (2с, 2H, CONH2), 9,0 (шир. с, 2H, NH2 -конотоксина, или тестируемые соединения.
-конотоксина, или тестируемые соединения. Ca2+ (NaCl 96мМ, KCl 2мМ, MgCl2 1 мМ, Hepes 10 мМ, pH 7,85 с NaOH).
Ca2+ (NaCl 96мМ, KCl 2мМ, MgCl2 1 мМ, Hepes 10 мМ, pH 7,85 с NaOH).