|
|
(21), (22) Заявка: 2008149477/13, 15.12.2008
(24) Дата начала отсчета срока действия патента:
15.12.2008
(46) Опубликовано: 10.06.2010
(56) Список документов, цитированных в отчете о
поиске:
RU 2083221 C1, 10.07.1997. RU 2172631 C2, 27.08.2001.
Адрес для переписки:
630117, г.Новосибирск, а/я 5, Л.Я. Кучумовой
|
(72) Автор(ы):
Кабилова Татьяна Олеговна (RU),
Черноловская Елена Леонидовна (RU),
Зенкова Марина Аркадьевна (RU),
Власов Валентин Викторович (RU)
(73) Патентообладатель(и):
Учреждение Российской академии наук Институт химической биологии и фундаментальной медицины Сибирского отделения РАН (ИХБФМ СО РАН) (RU),
Федеральное агентство по науке и инновациям (RU)
|
(54) ФРАГМЕНТЫ ДВУЦЕПОЧЕЧНОЙ РНК, ОБЛАДАЮЩИЕ АНТИПРОЛИФЕРАТИВНОЙ И ИНТЕРФЕРОН-ИНДУЦИРУЮЩЕЙ АКТИВНОСТЯМИ
(57) Реферат:
Изобретение относится к области молекулярной биологии и биотехнологии. Предложены фрагменты двуцепочечной РНК длиной 22-нуклеотида, содержащие тринуклеотидные выступающие 3′-концы, состоящие из нуклеотидных цепей следующей последовательности:
5′-AAAN1N2N3N4N5N6N7GCCUGACACUUU/A-3′
5′-GUGUCAGGCN14N13N12N11N10N9N8UUUUUU/A-3′,
где N1-N7 комплементарны N8-N14, соответственно, обладающие антипролиферативной и интерферон-индуцирующей активностями. Изобретение может найти применение в медицине для разработки лекарственных форм препаратов, используемых для лечения вирусных заболеваний. 5 ил., 2 табл.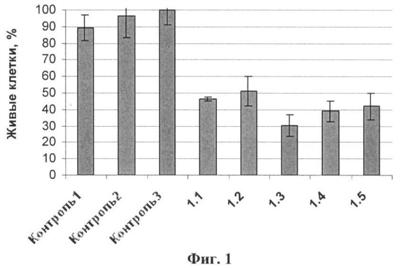
Изобретение относится к области молекулярной биологии и биотехнологии и может быть использовано в медицине и фармацевтической промышленности.
Онкологические заболевания являются одной из основных проблем современной медицины. Существующие на данный момент схемы лечения злокачественных опухолей используют хирургические методы в комплексе с высокодозной агрессивной химиотерапией, серьезным недостатком которой является высокая токсичность современных противоопухолевых препаратов в отношении жизненно важных органов и систем организма. Сопутствующие побочные эффекты снижают эффективность, а в ряде случаев, ограничивают применение противоопухолевых средств. Другой проблемой в лечении онкологических заболеваний является проблема остаточного опухолевого клона. Опухолевые клетки, пережившие химиотерапию, обычно проявляют лекарственную устойчивость к широкому кругу препаратов и вызывают рецидив заболевания в более тяжелой форме. В связи со всем вышесказанным, актуальной задачей является поиск новых противоопухолевых препаратов, обеспечивающих высокую избирательность и эффективность лечения.
Наиболее ближайшим к заявляемому изобретению – прототипом, является двуцепочечная РНК из киллерных штаммов дрожжей, обладающая интерферон-индуцирующей активностью. На основе данной дцРНК создан препарат («Ридостин»), представляющий собой липосомальную композицию на основе водно-солевого раствора дцРНК дрожжей Saccharomyces cerevisiae с pH 6,5-7,5 или лиофилизат, проявляющие выраженную противовирусную активность в отношении различных форм герпесной и хламидиозной инфекций (Патент РФ 2083221, кл. А61К 38/20, 1997 г.).
Недостатками активного агента и фармацевтической композиции являются довольно высокое содержание дцРНК (5-15%), что является причиной повышенной токсичности композиции и проявления мутагенного эффекта; быстрое выведение активного компонента из организма (в течение 24 ч), что требует частого его приема для поддержания терапевтической дозы. Поскольку препараты нуклеиновых кислот относятся к классу нестабильных высокотоксичных соединений, то увеличение дозировок ведет к усилению побочных эффектов.
Технической задачей изобретения является создание новых эффективных, низкотоксичных соединений на основе дцРНК, обладающих антипролиферативной и интерферон-индуцирующей активностями.
Поставленная техническая задача решается предлагаемыми фрагментами двуцепочечной РНК длиной 22-нуклеотида, содержащими тринуклеотидные выступающие 3′-концы, со следующей оригинальной нуклеотидной последовательностью (1):
5′-AAAN1N2N3N4N5N6N7GCCUGACACUUU/A-3′
3′-A/UUUUUUN8N9N10N11N12N13N14CGGACUGUG-5′,
где N1-N7 комплементарны N8-N14, соответственно, обладающими антипролиферативной и интерферон-индуцирующей активностями.
Предлагаемые фрагменты представляют собой двуцепочечные молекулы РНК длиной 22 нуклеотида, имеющие на 3′-концах выступы из 3 нуклеотидов. Данные фрагменты получают объединением двух цепей определенной последовательности (1), где N1-7 любой рибонуклеотид,
a N8-14=А, G, U, С, если Nn-7=U, С, A, G, соответственно.
Было исследовано влияние заявляемых фрагментов дцРНК (1) на пролиферацию клеток карциномы, нейробластомы и опухолевых клеток почки эмбриона человека. Исследована динамика изменения экспрессии генов-маркеров интерферонового ответа, а также интерферон-чувствительных генов под действием заявляемых фрагментов дцРНК (1).
В результате было установлено, что заявляемые фрагменты дцРНК (1) проявляют высокую антипролиферативную активность по отношению ко всем исследованным опухолевым клеточным культурам. При исследовании цитотоксичности соединений (1) по отношению к использованным опухолевым клеткам были получены значения IC50, концентрации соединения, при котором наблюдается гибель 50% клеток. Показано, что значения IC50 для соединений (1) имеют сходный порядок величины для всех опухолевых клеток и лежат в диапазоне 45-200 нМ. Полученные данные по антипролиферативной активности соединений (1) позволяют рассматривать их как перспективные противоопухолевые агенты.
Под действием как контрольного индуктора интерферона poly(I:C), так и заявляемых фрагментов дцРНК (1) происходит активация экспрессии гена-маркера интерферонового ответа PKR и подавление экспрессии интерферон-чувствительных генов с-mус и  -актина. Полученные данные свидетельствуют об интерферон-индуцирующей активности исследуемых фрагментов дцРНК (1). -актина. Полученные данные свидетельствуют об интерферон-индуцирующей активности исследуемых фрагментов дцРНК (1).
На основе предлагаемых соединений могут быть созданы фармацевтические композиции, содержащие в своем составе в качестве активного агента по меньшей мере один фрагмент дцРНК, описанный выше (1), и фармацевтически приемлимый носитель. В качестве фармацевтически пригодного носителя могут быть использованы катионные липиды и катионные полимеры, облегчающие проникновение заявляемого фрагмента дцРНК в клетку. Для терапевтического применения данные композиции могут быть выполнены в форме раствора, например инъекционного, крема, мази, таблетки, суспензии и т.п. Композицию можно вводить любым подходящим способом, например инъекцией, пероральным, местным, назальным, ректальным введением.
Сущность изобретения иллюстрируется следующими фигурами и примерами.
Пример 1. Синтез фрагментов двуцепочечной РНК.
Для сравнительного исследования влияния заявляемых фрагментов дцРНК (1) на пролиферацию клеток карциномы человека КВ-3-1 были синтезированы пять фрагментов дцРНК (1.1-1.5), последовательность которых соответствует общей формуле заявляемых фрагментов дцРНК (1), и три контрольных фрагмента (контроль 1 – контроль 3), последовательности которых не соответствуют общей формуле заявляемых фрагментов дцРНК (1).
Пример 2. Влияние фрагментов двуцепочечной РНК 1.1-1.5 на пролиферацию клеток карциномы человека КВ-3-1.
Клетки линии КВ-3-1 (эпидермоидная карцинома ротовой полости) культивировали в среде DMEM, содержащей 10%-ную эмбриональную телячью сыворотку, антибиотики (100 ед./мл пенициллина и 0.1 мг/мл стрептомицина) и антимикотик амфотерицин (0.25 мкг/мл), в атмосфере 5%-ного CO2 при 37°С.
Количество живых клеток после инкубации с фрагментами 1.1-1.5 и Контроль 1 – Контроль 3 (Табл.1) определяли с помощью МТТ теста, который основан на способности митохондриальных дегидрогеназ живых клеток превращать водорастворимые соли тетразолия в ярко окрашенные кристаллы формазана, что позволяет спектрофотометрически оценивать количество живых клеток в препарате. Для этого клетки КВ-3-1 высаживали в 96-луночные планшеты (1000 клеток на лунку). Через 24 ч в лунках меняли среду на свежую среду DMEM без сыворотки и антибиотиков и клетки трансфицировали с помощью препарата из группы катионных липидов Липофектамина2000 (согласно протоколу производителя) фрагментами 1.1-1.5 и Контроль 1 – Контроль 3 (конечная концентрация фрагментов в среде варьировала от 25 до 200 нМ). Клетки инкубировали с комплексами фрагментов с катионным липидом в среде без сыворотки и антибиотиков в атмосфере 5%-ного СО2 при 37°С в течение 4 ч, после чего добавляли эмбриональную телячью сыворотку до концентрации 10% и инкубировали в тех же условиях в течение еще 72 ч. По окончании инкубации, без смены среды, к клеткам добавляли раствор МТТ (5 мг/мл) в фосфатно-солевом буфере до концентрации 0.5 мг/мл и инкубировали в течение 3 ч в тех же условиях. Среду удаляли, к клеткам добавляли по 100 мкл ДМСО, в котором происходит растворение образовавшихся в клетках кристаллов формазана, и измеряли оптическую плотность на многоканальном спектрофотометре Multiscan RC (Labsystems) на длинах волн 570 и 620 нм, где А570 – поглощение формазана, а А620 – фон клеток.
Данные представляли в виде количества живых клеток в пробе относительно контроля. За 100% принимали количество клеток в контроле, где клетки инкубировали в течение 72 ч в отсутствие соединения, но в присутствии Липофектамина2000 (фиг.1).
Из данных, приведенных на фиг.1 видно, что при трансфекции клеток КВ-3-1 фрагментами дцРНК 1.1-1.5 в концентрации 200 нМ наблюдается эффективное снижение количества живых клеток до 30-50% относительно контроля. Наиболее эффективным ингибитором пролиферации является фрагмент дцРНК (1.3), значение IC50 для которого составило 46 нМ. Значения IC50 – концентрация соединения, при которой количество клеток сокращается на 50% – приведены в таблице 2. Из данных, приведенных на фиг.1, видно, что внесение замен в структуру фрагмента двуцепочечной РНК 1.3 в позиции 10-16 (соединения 1.4 и 1.5) не значительно снижает антипролиферативную активность соединений, в то время как замены 3′-концевых нуклеотидов A/U на G/C (Контроль 2, Контроль 3) или удаление этих нуклеотидов (Контроль 1) приводит к полному исчезновению антипролиферативного действия исследуемых фрагментов дцРНК. Далее проводили исследование фрагмента дцРНК 1.3, проявляющего наибольшую антипролиферативную и интерферон-индуцирующую активность.
Пример 3. Влияние фрагмента дцРНК 1.3 на пролиферацию клеток нейробластомы человека SK-N-MC.
Клетки линии SK-N-MC (нейробластома) культивировали в среде DMEM, содержащей 10%-ную эмбриональную телячью сыворотку, антибиотики (100 ед./мл пенициллина и 0.1 мг/мл стрептомицина) и антимикотик амфотерицин (0.25 мкг/мл), в атмосфере 5%-ного СО2 при 37°С.
Жизнеспособность клеток после инкубации с фрагментом дцРНК 1.3 в комплексе с олигофектамином определяли с помощью МТТ теста, как описано в примере 2, за исключением того, что для трансфекции использовали другой препарат из группы катионных липидов (олигофектамин) и клетки высаживали в 96-луночные планшеты в количестве 10000 клеток на лунку.
Данные представляли в виде количества живых клеток относительно контроля. За 100% принимали количество клеток в контроле, где клетки инкубировали в течение 72 ч в отсутствие соединения, но в присутствии олигофектамина (фиг.2). Из данных, приведенных на фиг.2 видно, что при трансфекции клеток SK-N-MC фрагментом дцРНК 1.3 наблюдается эффективное снижение количества клеток уже при концентрации фрагмента 75-150 нМ, что подтверждает его высокий антипролиферативный потенциал. Значение IC50, полученное для данной клеточной линии, составило 88 нМ.
Пример 4. Влияние фрагмента дцРНК 1.3 на пролиферацию клеток почки эмбриона человека 293.
Клетки линии 293 культивировали в среде DMEM, содержащей 10%-ную эмбриональную телячью сыворотку, антибиотики (100 ед./мл пенициллина и 0.1 мг/мл стрептомицина) и антимикотик амфотерицин (0.25 мкг/мл), в атмосфере 5%-ного СО2 при 37°С.
Количество живых клеток после инкубации с фрагментом дцРНК 1.3 определяли с помощью МТТ теста, как описано в примере 2. Для этого клетки высаживали в 96-луночные планшеты (3000 клеток на лунку). Далее как в примере 2.
Данные представляли в виде количества живых клеток относительно контроля. За 100% принимали количество клеток в контроле, где клетки инкубировали в течение 72 ч в отсутствие фрагментов РНК, но в присутствии Липофектамина2000 (Фиг.3). Из данных, приведенных на фиг.3 видно, что при трансфекции клеток SK-N-MC фрагментом дцРНК 1.3 наблюдается эффективное снижение количества живых клеток уже при концентрации фрагмента 100-200 нМ, что подтверждает его высокий антипролиферативный потенциал. Значение IC50, полученное для данной клеточной линии, составило 165 нМ.
Пример 5. Активация экспрессии гена-маркера интерферонового ответа PKR под действием фрагмента дцРНК 1.3.
Клетки КВ-3-1 культивировали, высаживали в 24-луночные планшеты (10000 клеток на лунку) и трансфицировали с помощью Липофектамина2000 фрагментом дцРНК 1.3 (150 нМ) и poly(I:C) (0,05 мкг/мл), как описано в примере 2.
5-106) осаждали центрифугированием при 1000 об/мин в течение 10 мин при 4°С (центрифуга “Contron”). Супернатант удаляли, клетки промывали PBS и лизировали в 200 мкл 1%-ного SDS. К смеси добавляли 1/10 объема 2 М ацетата натрия, рН 4.5 и 2 объема (400 мкл) фенола, уравновешенного водой, тщательно перемешивали. Водную фазу отделяли центрифугированием (12000 об/мин, 10 мин, центрифуга “Eppendorf”) и экстрагировали равным объемом фенол/хлороформ (1:1). РНК осаждали из раствора этанолом (2.5-3 объема) в присутствии 0.3 М ацетата натрия (рН 4.5) и инкубировали для формирования осадка в течение 12 ч при -20°С. Осадок РНК отделяли центрифугированием (13000 об/мин, 4°С, 15 мин, центрифуга “Contron”), промывали 75%-ным этанолом, высушивали и растворяли в автоклавированной воде, хранили при -20°С. Концентрацию РНК определяли спектрофотометрически из расчета, что 1 мг/мл РНК=25 OE260/мл. Чистоту препарата определяли по соотношению оптических плотностей при 260 нм и 280 нм.
кДНК получали методом обратной транскрипции в реакционной смеси, содержащей ОТ-буфер (50 мМ Трис-HCl, pH 8.3, 3 мМ MgCl2, 5 мМ DTT, 75 мМ KCl), 0.05 мкг/мкл суммарной РНК, 5 мкМ праймер d(T)15, 0.5 мМ dNTP и 0.5 е.а./мкл РНК-зависимой ДНК-полимеразы M-MuLV. Реакцию синтеза кДНК проводили при 42°С в течение 1 ч.
Полимеразную цепную реакцию проводили в реакционной смеси объемом 20 мкл, содержащей 250 мкМ каждого из dNTP, 0.25 мкМ прямого и обратного праймера, кДНК, полученную с 25 нг суммарной клеточной РНК, фирменный раствор SYBR Green I в разведении 1:20000 и 2 е.а. Taq-ДНК-полимеразы в буфере ПЦР (10 мМ Трис-HCl, рН 8.3, 50 мМ KCl, 1.5 мМ MgCl2, 0.01%-ный Твин-20). ПЦР в реальном времени проводили на амплификаторе с оптическим модулем iCycler (Bio-Rad, США). Количество образующегося продукта оценивали по интенсивности флуоресценции, связанной с интеркаляцией SYBR Green I в двуцепочечную ДНК. Эффективность амплификации каждого ПЦР-продукта определяли по калибровочным кривым, построенным по серии разведений образцов контрольной кДНК. Эффективности амплификации ПЦР-продуктов были близки и лежали в диапазоне 1.75<Е<2. Для каждого экспериментального образца кДНК выполняли 3 повтора, определяя количество образующегося продукта как среднее арифметическое для каждого из них. Образование специфического продукта подтверждалось кривыми плавления и электрофорезом в 1.5%-ном агарозном геле.
Проводили 40 циклов амплификации по следующей программе: 95°С – 30 с, 58°С – 30 с, 72°С – 30 с, температура плавления ПЦР-продукта Tm-3°С – 15 с (измерение флуоресценции). Tm предварительно определялась путем анализа кривой плавления ПЦР-продукта в диапазоне 55°С-95°С с шагом в 0.5°С.
Количество специфического ПЦР-продукта гена PKR определяли относительно ПЦР-продукта  2 2
Из данных, приведенных на фиг.4, видно, что при трансфекции клеток КВ-3-1 фрагментом дцРНК 1.3 (150 нМ) и poly(I:C) (0,05 мкг/мл) наблюдается 10- и 25-кратное повышение уровня PKR мРНК, соответственно. Полученные данные по активации экспрессии PKR свидетельствуют об интерферон-индуцирующей активности исследуемого фрагмента дцРНК 1.3.
Пример 6. Ингибирование экспрессии интерферон-чувствительных генов – с-mус и  -актина под действием фрагмента дцРНК 1.3. -актина под действием фрагмента дцРНК 1.3.
Для исследования интерферон-индуцирующей активности фрагмента дцРНК 1.3 в клетках линии КВ-3-1 оценивали уровни экспрессии генов  -актина и с-mус с помощью ОТ-ПЦР в реальном времени, в качестве контрольного индуктора эндогенного интерферона использовали коммерчески доступный препарат poly(I:C). -актина и с-mус с помощью ОТ-ПЦР в реальном времени, в качестве контрольного индуктора эндогенного интерферона использовали коммерчески доступный препарат poly(I:C).
Клетки КВ-3-1 культивировали, высаживали в 24-луночные планшеты (10000 клеток на лунку) и трансфицировали с помощью Липофектамина2000 фрагмент дцРНК 1.3 (150 нМ) и poly(I:C) (0,05 мкг/мл), как описано в примере 2.
Количество специфических ПЦР-продуктов генов с-mус и  -актина определяли относительно ПЦР-продукта -актина определяли относительно ПЦР-продукта  2 2 -актина в контроле, где клетки инкубировали в течение 72 ч в отсутствие соединений, но в присутствии олигофектамина (фиг.5). Из данных, приведенных на фиг.5 видно, что при трансфекции клеток КВ-3-1 как контрольным индуктором интерферона poly(I:C), так и исследуемым фрагментом дцРНК 1.3 наблюдается концентрационно-зависимое снижение уровней мРНК исследуемых генов. Так, через 72 ч после трансфекции клеток КВ-3-1 фрагментом дцРНК 1.3 (150 нМ, что соответствует примерно 2,2 мкг/мл) и poly(I:С) (0,25 мкг/мл) наблюдается снижение уровня мРНК -актина в контроле, где клетки инкубировали в течение 72 ч в отсутствие соединений, но в присутствии олигофектамина (фиг.5). Из данных, приведенных на фиг.5 видно, что при трансфекции клеток КВ-3-1 как контрольным индуктором интерферона poly(I:C), так и исследуемым фрагментом дцРНК 1.3 наблюдается концентрационно-зависимое снижение уровней мРНК исследуемых генов. Так, через 72 ч после трансфекции клеток КВ-3-1 фрагментом дцРНК 1.3 (150 нМ, что соответствует примерно 2,2 мкг/мл) и poly(I:С) (0,25 мкг/мл) наблюдается снижение уровня мРНК  -актина на 80 и 85%, а также уровня мРНК с-mус на 80 и 70%, соответственно. Полученные данные по снижению уровней экспрессии интерферон-чувствительных генов с-mус и -актина на 80 и 85%, а также уровня мРНК с-mус на 80 и 70%, соответственно. Полученные данные по снижению уровней экспрессии интерферон-чувствительных генов с-mус и  -актина подтверждают потенциал фрагмента дцРНК 1.3 как индуктора интерферонового ответа. -актина подтверждают потенциал фрагмента дцРНК 1.3 как индуктора интерферонового ответа.
Таким образом, приведенные примеры однозначно указывают на высокую антипролиферативную и интерферон-индуцирующую активность фрагментов дцРНК (1), что позволяет использовать их в качестве активных компонентов для разработки лекарственных форм препаратов, предназначенных для лечения вирусных заболеваний.

| Таблица 2 |
| Фрагмент двуцепочечной РНК |
IC50 для клеток КВ-3-1 через 72 ч после трансфекции |
| 1.1 |
80 нМ |
| 1.2 |
200 нМ |
| 1.3 |
46 нМ |
| 1.4 |
74 нМ |
| 1.5 |
81 нМ |
Формула изобретения
Фрагменты двуцепочечной РНК длиной 22-нуклеотида, содержащие тринуклеотидные выступающие 3′-концы, состоящие из нуклеотидных цепей следующей последовательности:
5′-AAAN1N2N3N4N5N6N7GCCUGACACUUU/A-3′
5′-GUGUCAGGCN14N13N12N11N10N9N8UUUUUU/A-3′,
где N1-N7 комплементарны N8-N14 соответственно, обладающие антипролиферативной и интерферон-индуцирующей активностями.
РИСУНКИ
|
|