Патент на изобретение №2391345
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ДИГИДРОХЛОРИД 1-(3-МОРФОЛИНОПРОПИЛ)-2-ФЕНИЛИМИДАЗО[1,2-a]-БЕНЗИМИДАЗОЛА, ПРОЯВЛЯЮЩИЙ СВОЙСТВА АНТАГОНИСТА ПУРИНОВЫХ P2Y1-РЕЦЕПТОРОВ, АНТИАГРЕГАНТНУЮ И АНТИТРОМБОТИЧЕСКУЮ АКТИВНОСТЬ
(57) Реферат:
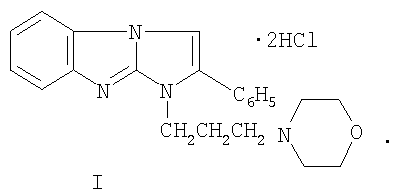
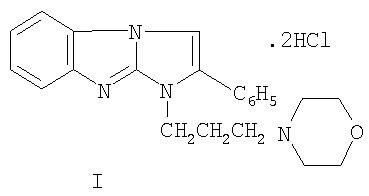
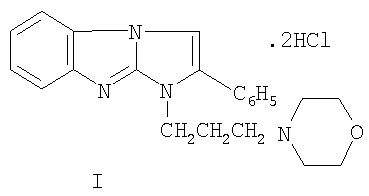
Изобретение относится к дигидрохлориду 1-(3-морфолинопропил)-2-фенилимидазо[1,2-а]бензимидазола формулы I:
проявляющему свойства антагониста пуриновых P2Y1-рецепторов, антиагрегантную и антитромботическую активность. Технический результат – получение нового соединения, которое может найти применение в медицине для создания лекарственного препарата для терапии заболеваний, сопровождающихся увеличением тромбогенного потенциала крови: атеросклероза, ишемической болезни сердца, диабетической ангиопатии. 5 табл.
Изобретение относится к новому 1,2-дизамещенному имидазо[1,2-а]бензимидазола, а именно к водорастворимому дигидрохлориду 1-(3-морфолинонопропил)-2-фенилимидазо[1,2-а]бензимидазола формулы I:
проявляющему P2Y1-антагонистические, антиагрегантные и антитромботические свойства, который может стать основой для создания лекарственного препарата для терапии заболеваний, сопровождающихся увеличением тромбогенного потенциала крови: атеросклероза, ишемической болезни сердца, диабетической ангиопатии.
В настоящий момент установлено, что на мембране тромбоцитов имеются три подтипа пуринорецепторов: P2X1, P2Y1 и P2Y12. P2Y112-рецепторов: тиклопидин и клопидогрель (Регистр лекарственных средств России. РЛС Энциклопедия лекарств. Выпуск 15. – Издательство: РЛС-2007. – 2006. – С.1488).
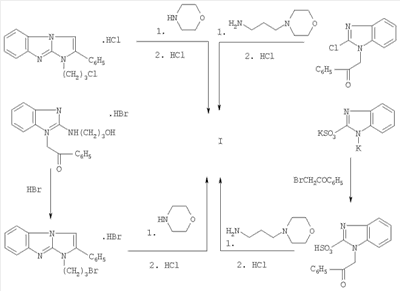
Таким образом, поиск новых безопасных и высокоэффективных ингибиторов агрегации тромбоцитов являются актуальными для современной медицины. Наиболее близким по структуре является дигидрохлорид 1-(2-морфолиноэтил)-2-трет-бутилимидазо[1,2-а]бензимидазола, проявляющий в том числе антиагрегантную активность (патент США В ряду 1,2-дизамещенных имидазо[1,2-а]бензимидазола неизвестны соединения, проявляющие одновременно свойства антагонистов пуриновых P2Y1-рецепторов, антитромботическую и антиагрегантную активность. Техническим результатом изобретения является новое соединение в ряду 1,2-дизамещенных имидазо[1,2-а]бензимидазола, проявляющее наряду с антиагрегантной активностью новые для данного ряда свойства, а именно P2Y1-антагонистическую и антитромботическую активность. Технический результат изобретения достигается дигидрохлоридом 1-(3-морфолинопропил)-2-фенилимидазо[1,2-а]бензимидазола формулы I. Синтез соединения заключается во взаимодействии гидрохлорида 1-(3-хлорпропил) – (способ А) или гидробромида 1-(3-бромпропил)-2-фенилимидазо[1,2-а]бензимидазола (способ Б) с морфолином. Можно также получить это соединение в результате реакций 1-фенацил-2-хлорбензимидазола (способ В) или 1-фенацилбензимидазол-2-сульфокислоты (способ Г) с 3-морфолинопропиламином. Полученное одним из этих способов основание затем переводят в водорастворимый дигидрохлорид I обычными методами, используя концентрированную HCl или ее растворы в изопропиловом спирте или эфире. Ниже приведены методики синтезов предлагаемого соединения: Пример. Дигидрохлорид 1-(3-морфолинопропил)-2-фенилимидазо[1,2-а]бензимидазола (I). А. Смесь 3,46 г (10 ммоль) гидрохлорида 2-фенил-1-(3-хлорпропил)-имидазо[1,2-а]бензимидазола (Анисимова В.А., Спасов А.А., Левченко М.В., Александрова Е.А.. Хим.-фарм. ж., 1995, Найдено, %: С 56,7; Н 6,5; Cl 15,2; N 12,1. C22H24N4O·2 HCl·2 H2O. Вычислено, %: С 56,3; Н 6,4; Cl 15,1; N 11,9. Спектр ПМР (DMSO-d6+CCl4), ИК-спектр (вазел. масло), см-1: 1660 (C=N+<), 2500-2730 (N+H, широкая полоса), 3200-3470 (N+Н, широкая полоса). Б. Кипятят 2,93 г (7,5 ммоль) гидробромида 2-(3-гидроксипропиламино)-1-фенацилбензимидазола (Анисимова В.А., Спасов А.А., Левченко М.В., Александрова Е.А. Хим.-фарм. ж., 1995, Найдено, %: С 49,5; Н 3,8; Br 36,8; N 9,9. C18H16BrN3·HBr. Вычислено, %: С 49,7; Н 3,9; Br 36,7; N 9,7. Спектр 1Н ЯМР (DMSO-d6 – CCl4), ИК-спектр (вазелин, масло), см-1: 1500, 1595, 1605 (С=С), 1665 (С=N+<). Смесь 1,3 г (3 ммоль) полученного гидробромида 1-бромпропил-замещенного и 5 мл морфолина кипятят 1-1,5 ч. Морфолин испаряют, остаток обрабатывают водой, осадок отфильтровывают, промывают водой и сушат на воздухе, получая 0,86-0,92 г (79,9-85,4%) основания 1-(3-морфолинопропил)-2-фенилимидазо[1,2-а]бензимидазола. После кристаллизации из изооктана и высушивании при 75-80°С т.пл. его 107-108°С. Найдено, %: С 73,4; Н 6,7; N 15,7. C22H24N4O. Вычислено, %: С 73,3; Н 6,7; N 15,5. Дигидрохлорид, идентичный описанному в методе А, получен подкислением ацетонового раствора вышеописанного основания конц. HCl. В. Смесь 4,05 г (15 ммоль) 1-фенацил-2-хлорбензимидазола [Кочергин П.М., Пономарь B.C. Способ получения производных имидазо[1,2-а]бензимидазола. Авт. свид. Г. Смесь 10 ммоль бензимидазол-2-сульфокислоты и 20 ммоль КОН в 5 мл воды нагревают до образования раствора. После охлаждения к полученному раствору приливают 30 мл ацетона, выпавший белый осадок дикалиевой соли бензимидазол-2-сульфокислоты отфильтровывают, промывают ацетоном и высушивают на воздухе. Выход 80-85%. Суспензию 4,11 г (15 ммоль) полученной дикалиевой соли и 2,98 г (15 ммоль) фенацилбромида в 15 мл диметилформамида перемешивали при 90-100°С 3 ч. Смесь охлаждали, разбавляли водой и подкисляли конц. HCl до рН 1. Выпавший осадок отфильтровывали, промывали холодной водой и ацетоном. Выход 4,0 г (85%). Смесь 1,58 г (5 ммоль) 1-фенацилбензимидазол-2-сульфокислоты и 2,16 г (15 ммоль) 1-(3-аминопропил)морфолина нагревают при перемешивании при 140-150°С 1 ч. По охлаждении реакционную массу обрабатывают водой и экстрагируют 1-(3-морфолинопропил)-2-фенилимидазо[1,2-а]бензимидазол хлороформом. Далее поступают так, как описано в методике В. Выход 1,85-1,90 г (79-81%). Фармакологические свойства соединения I. А. P2Y1-антагонистическая активность соединения I на тромбоцитах in vitro
Эксперименты проводили на лазерном анализаторе малоуглового светорассеяния «Лайт-скан» («Люмекс ЛТД», Россия) в солевой среде, содержащей 140 мМ NaCl; 10 мМ трис-HCl буфера; 5 мМ ЭДТА (рН 7,8), с разбавлением плазмы, обогащенной тромбоцитами (концентрация тромбоцитов не превышала 107 клеток/мл). Для экспериментов использована плазма 6 кроликов породы «Шиншилла» массой 4-4,5 кг. В качестве индукторов активации тромбоцитов использовались динатриевая соль аденозин-5-дифосфорной кислоты (АДФ) («Реанал», Венгрия) и селективный агонист P2Y1-рецепторов 2-метилтио-АТФ («Sigma», США). В качестве препарата сравнения взят тиклопидин (Тиклид, “Sanofi-syntelabo”, Франция). Статистическую обработку результатов экспериментов производили в пакете прикладных программ «Statistika 6.0» с использованием парного критерия Стьюдента при предварительной проверке выборки на нормальность распределения. Соединение I в концентрации 10-6 М достоверно подавляло АДФ-индуцированную активацию тромбоцитов в бескальциевой среде на – 22,1±2,1%, в то время как тиклопидин не проявил ингибирующей активности. При использовании в качестве индуктора активации тромбоцитов селективного P2Y1-агониста 2-метилтио-АТФ, соединение I в концентрациях 10-4-10-5 М выраженно подавляло активацию тромбоцитов (табл.1), в отличие от тиклопидина, показавшего статистически незначимый эффект. Б. Влияние соединения I на агрегацию тромбоцитов в условиях ex vivo
Статистическую обработку результатов экспериментов производили в пакете прикладных программ «Statistika 6.0» с использованием критерия Манна-Уитни. При исследовании влияния на АДФ-индуцированную агрегацию тромбоцитов обнаружено, что по угнетению степени агрегации соединение I превосходит тиклопидин в 2,4 раза, а по влиянию на скорость агрегации – в 1,9 раз (табл.2). Исследование влияния на коллаген-индуцированную агрегацию тромбоцитов обнаружило, что по угнетению степени агрегации соединение I незначительно превосходит тиклопидин (табл.3). В. Антитромботические свойства соединения I Исследуемое соединение I и препарат сравнения тиклопидин (Тиклид, “Sanofi-syntelabo”, Франция) вводили перорально в дозе, эквимолярной 6 мг/кг тиклопидина, за 2 часа до моделирования тромбоза. Воспроизведение моделей артериальных тромбозов проводили под нембуталовым (35 мг/кг) наркозом с регистрацией уровня кровотока с помощью ультразвукового допплерографа «Минимакс-Допплер-К» («СП Минимакс», С.-Петербург, Россия). Антитромботическую активность изучали на 38 половозрелых нелинейных белых крысах-самцах массой 330-440 г. Для моделирования генерализованного тромбоза использовали 35 белых нелинейных мышей – самцов массой 20-26 г. Статистическую обработку результатов экспериментов производили в пакете прикладных программ «Statistika 6.0» с использованием критерия Манна-Уитни, ANOVA (Newman-Keuls test) и точного критерия Фишера. На модели артериального тромбоза, индуцированного хлоридом железа, у крыс, получивших однократно соединение I, снижение уровня кровотока на 50% по сравнению с параметрами в неповрежденном сосуде отмечается примерно через 1,5 часа после нанесения повреждающего агента, что в 4,5 раза превышает аналогичный параметр в контрольной группе. В течение 2,5 часов не удается зарегистрировать момент полной окклюзии сонной артерии (табл.4). В группе крыс, получивших тиклопидин, время достижения 50%-ного уровня кровотока составляет 29 мин (табл.4), что в 1,5 раза превышает аналогичный показатель в контрольной группе, но в 3,1 раза уступает по данному параметру соединения I. С этого момента снижение уровня кровотока происходит более интенсивно, и к 42 минуте после начала воздействия повреждающего фактора наблюдается полная окклюзия. На модели артериального тромбоза, индуцированного электрическим током, однократное пероральное введение соединения I в дозе эквимолярной 6 мг/кг тиклопидина, приводит к достоверному увеличению времени кровотока в 2,4 раза по сравнению с контролем (табл.5). Время полной окклюзии сонной артерии в группе крыс, получивших соединение I, превышает аналогичный показатель на 85,7% по сравнению с группой крыс, которым был введен тиклопидин (р В группе животных, получивших тиклопидин в дозе 6 мг/кг (per os, однократно), время регистрации полного артериального тромбоза превышает данный параметр в контрольной группе в среднем на 5,8 минут, что составляет 101,7% по отношению к контролю, однако различия статистически незначимы. При изучении генерализованного коллаген-адреналинового тромбоза соединение I и тиклопидин, введенные перорально за 2 часа до моделирования генерализованного тромбоза, в разной степени уменьшали гибель животных. При введении раствора, содержащего 0,5 мг коллагена и 0,06 мг адреналина из расчета на килограмм массы тела, в хвостовую вену животным контрольной группы, в течение 1-3 минут после введения индукторов тромбоза наблюдали гибель животных. Выживаемость в контрольной группе составила 6,3%. Соединение I достоверно уменьшало гибель мышей при моделировании системного коллаген-адреналинового тромбоза по сравнению с контролем. Выживаемость составила 55,6%. В экспериментальной группе у животных, получивших тиклопидин, выживаемость достоверно не отличалась от контрольной группы и составила 30,0%. Таким образом, выживаемость животных в группе, получавших соединение I, в 8,9 раза превышала таковую в контрольной группе и в 1,9 раза – в группе у животных, получавших тиклопидин. Г.Острая токсичность соединения I Исследование острой токсичности проводили на белых нелинейных мышах-самцах массой 20-22 г при внутрибрюшинном введении. Гибель животных регистрировали в течение двух недель. (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под общей редакцией члена-корреспондента РАМН, профессора Р.У.Хабриева. – 2-изд., перераб. и доп. – М.: ОАО «Издательство «Медицина», 2005. – с.170-204). Величину токсикологического показателя – LD50 рассчитывали по методу Личфилда-Вилкоксона. По результатам изучения острой токсичности показатель ЛД50 при внутрибрюшинном введении для соединения I составил 130,0 мг/кг, таким образом, оно является умеренно токсичным.
Формула изобретения
Дигидрохлорид 1-(3-морфолинопропил)-2-фенилимидазо[1,2-а]бензимидазола формулы I:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 ,
, ,
,
 , м.д.: 2,94 (2Н, кв., СН2СН2СН2); 3,17 (4Н, т., O(СН2)2); 3,26 (2Н, т., NCH2); 3,95 (4Н, т., N(CH2)2); 4,40 (2Н, т., NArCH2); 7,30-7,75 (8Н, м., HAr); 7,90 (1Н, д., 6-Н); 8,04 (1Н, д., 7-Н); 8,28 (1Н, с., 3-Н); N+H в обмене.
, м.д.: 2,94 (2Н, кв., СН2СН2СН2); 3,17 (4Н, т., O(СН2)2); 3,26 (2Н, т., NCH2); 3,95 (4Н, т., N(CH2)2); 4,40 (2Н, т., NArCH2); 7,30-7,75 (8Н, м., HAr); 7,90 (1Н, д., 6-Н); 8,04 (1Н, д., 7-Н); 8,28 (1Н, с., 3-Н); N+H в обмене. 0,01).
0,01). % (М±m)
% (М±m)