Патент на изобретение №2391101
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ ЭКТЕИНАСЦИДИНА-743 И СОДЕРЖАЩИХ ПЛАТИНУ ПРОТИВООПУХОЛЕВЫХ СОЕДИНЕНИЙ
(57) Реферат:
Изобретение относится к способу лечения больного раком пациента, являющегося человеком, посредством комбинированной терапии с использованием ЕТ-743 в дозировках менее 1200 мкг/м2 в день и платинового противоопухолевого агента – карбоплатина в дозировках от 200 до 400 мг/м2 в день. Применение ЕТ-743 в комбинации с карбоплатином в том же диапазоне доз, что и тот, который используется в случае индивидуального введения карбоплатина, приводит к преодолению устойчивости к платиновому противоопухолевому соединению без увеличения токсичности каждого лекарственного средства. Изобретение относится также к медицинскому набору, включающему комбинацию ЕТ-743 и карбоплатина в указанных дозировках, фармацевтически приемлемый носитель и инструкции по схеме лечения. 3 н. и 26 з.п. ф-лы, 10 табл.
Изобретение относится к лечению, более направленному и усовершенствованному применению противоопухолевых препаратов в терапии онкологических заболеваний. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ Настоящее изобретение относится к применению эктеинасцидина-743 и содержащих его препаратов в терапии онкологических заболеваний, в частности к применению эктеинасцидина-743 в комбинации с противоопухолевыми координационными комплексами платины при лечении рака. УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ Онкологические заболевания представляют собой группу злокачественных опухолей, которые можно подразделить на две категории: карцинома, чаще всего наблюдаемая в клинике, и другие не так часто наблюдаемые виды рака, включая лейкемию, лимфому, опухоли центральной нервной системы и саркому. Карциномы встречаются в эпителиальных тканях, в то время как саркомы развиваются в соединительных тканях и в таких структурах, которые связаны с мезодермными тканями. Саркома может поражать, например, мышечную или костную ткань и встречаться на кости, в мочевом пузыре, в почках, в печени, в легких, околоушной железе, селезенке и т.д. Рак агрессивен и имеет тенденцию к метастазированию в новые места. Он распространяется на окружающие ткани, а также может распространяться через лимфатическую и кровеносную системы. Для лечения рака возможно использование многих способов, включая хирургическое вмешательство и лучевую терапию для локализованных очагов заболевания, а также лекарственную терапию. Однако эффективность доступных методов лечения многих видов рака невелика, и необходимы новые, улучшенные способы лечения, полезные для клинической практики. Это особенно необходимо для пациентов с запущенными заболеваниями и/или метастазами. Также это актуально для пациентов с рецидивами, выраженными в прогрессировании заболевания после предпринятой общепризнанной терапии, дальнейшее повторение которой нецелесообразно из-за приобретенной устойчивости к препаратам или из-за сопутствующей токсичности. Роль химиотерапии в лечении онкологических заболеваний весьма существенна, особенно когда требуется лечить рак на стадии со значительно распространившимися метастазами, а также химиотерапия часто способствует уменьшению опухоли до хирургического вмешательства. Разработано множество противораковых лекарственных препаратов с различными механизмами действия. Наиболее часто используются следующие противораковые лекарственные средства: ДНК-алкилирующие средства (например, циклофосфамид, ифосфамид), антиметаболиты (структурные аналоги) (например, метотрексат – антагонист фолиевой кислоты и 5-фторурацил – антагонист пиримидина), деполимеризаторы микротрубочек (останавливают митоз в метафазе, нарушают нормальное образование митотического веретена деления) (например, винкристин, винбластин, паклитаксел), связывающиеся с ДНК средства (посредством встраивания между нуклеиновыми основаниями или разделяющие цепочки ДНК) (например, доксорубицин, дауномицин, цисплатин), гормональные средства (например, тамоксифен, флутамид). Идеальное противоопухолевое лекарственное средство должно селективно уничтожать раковые клетки, иметь широкий диапазон и высокие значения терапевтического индекса, не обладать токсичностью в отношении незлокачественных клеток. Оно также должно сохранять свою эффективность против злокачественных клеток даже после продолжительного воздействия лекарства. К сожалению, ни одна из современных химиотерапевтических схем лечения не идеальна. Большинство средств имеют очень узкий диапазон и низкие значения терапевтического индекса, и практически в каждом случае у раковых клеток развивается устойчивость к химиотерапевтическому средству, применяемому в сублетальных дозах, и довольно часто возникает перекрестная резистентность – препятствующая лечению устойчивость к другим противоопухолевым средствам. Комбинированная терапия, при которой используются лекарственные средства с различными механизмами действия, – распространенный терапевтический прием, способствующий предотвращению развития устойчивости опухоли в процессе лечения. Эктеинасцидины (сокращенно ET) являются перспективными противоопухолевыми средствами, выделенными из морских оболочников Ecteinascidia turbinata. Некоторые представители Ecteinascidia упоминались ранее в патентной и научной литературе. Например, в патенте США No. 5089273 описаны новые соединения, которые получают методом экстракции из тропических морских беспозвоночных Ecteinascidia turbinata и которые названы эктеинасцидинами 729, 743, 745, 759A, 759B и 770. Эти соединения представляют интерес в качестве антибактериальных и/или противоопухолевых средств для млекопитающих. В патенте США No. 5478932 описаны эктеинасцидины, выделенные из карибских оболочников Ecteinascidia turbinata, и способные обеспечить in vivo защиту (на модели ксенотрансплантатов) от лимфомы P388, меланомы B16, саркомы яичников M5076, легочной карциномы Льюиса, а также человеческой карциномы легкого LX-1 и человеческой карциномы молочной железы MX-1. Одно из этих веществ, эктеинасцидин-743 (ET-743), является новым тетрагидроизохинолиновым алкалоидом, выделенным из морских асцидий Ecteinascidia turbinata, проявляет в случае опухолей человека и крысы in vitro и in vivo противоопухолевую активность и в настоящее время проходит клинические испытания. Потенциальная противоопухолевая активность была продемонстрирована на большом количестве моделей опухолей in vivo, включая человеческий опухолевый ксенотрансплантат у бестимусных мышей. ET-743 имеет новый комплексный механизм действия на уровне транскрипции генов. ET-743 связывается с малой канавкой в области гуанин-цитозин богатых последовательностей ДНК и осуществляет алкилирование остатков гуанина в положении В испытаниях in vitro на примере клеток костного мозга человека, крысы, собаки была продемонстрирована примерно одинаковая чувствительность к ET-743 эритроидных и миелоидных клеток. Пролонгированное или повторное воздействие лекарственного средства приводило к токсичности по отношению к кроветворным клеткам-предшественникам в большей степени, чем однократное часовое воздействие. Терапевтические показатели ET-743 оказались предпочтительными при пролонгированном использовании. Программа клинических исследований воздействия ET-743 на онкологических больных началась с фазы I, в которой осуществлялось внутривенное введение препарата в течение 1 часа, 3 часов, 24 часов и 72 часов, а также в течение 5 дней, по часу в день. В фазе I и в фазе II клинических испытаний ET-743 показал существенную противоопухолевую активность в отношении нескольких видов злокачественных опухолей человека, включая саркомы мягких тканей, карциномы яичников. Дополнительные подробности об использовании ET-743 при лечении человека при злокачественных опухолях приведены в WO 0069441 и представлены здесь на конкретном примере. Соединения платины являются хорошо известными и часто используемыми противоопухолевыми средствами. Цисплатин (цис-диаминодихлороплатинум (II)) представляет собой координационный комплекс платины, впервые описанный в 1965 году как цитотоксическое средство. Он имеет широкий спектр противоопухолевой активности и особенно эффективен при лечении эпителиальных злокачественных опухолей. Другими платиновыми координационными комплексами, прошедшими клинические испытания, являются карбоплатин, тетраплатин, ормиплатин, ипроплатин и оксалиплатин. Лечение онкологических больных такими противоопухолевыми средствами, относящимися к координационным комплексам платины, как цисплатин или карбоплатин, проводится особенно активно в последнее десятилетие. Цисплатин оказался эффективен в лечении множества злокачественных опухолей, включая рак семенников, рак яичников и мелкоклеточный рак легкого, в то время как карбоплатин эффективен в лечении опухолей головного мозга, рака эндометрия, геноцитом, а также рака головы и шеи. Механизм действия на сегодняшний день не известен, но может быть связан со способностью этих соединений связываться с ДНК с образованием различных типов внутри- и межцепочечных связей, что в итоге может препятствовать как синтезу ДНК, так и синтезу РНК. Онкологические пациенты со временем становятся нечувствительными к лечению координационными комплексами платины, такими как цисплатин и карбоплатин. Механизм резистентности к этим соединениям неясен, но может быть связан с ослаблением накопления лекарственных средств, повышением внутриклеточных концентраций металлотионеина или глутатиона, которые связывают и инактивируют лекарственные средства, или связан с ослаблением формирования аддуктов лекарство-ДНК, или с угнетением репарации. Таким образом, необходимо разрабатывать эффективные методы лечения, преодолевающие эту резистентность. Для раковых клеточных линий, выращенных in vitro, комбинированное воздействие ET-743 и цисплатина имело аддитивный эффект или эффект синергизма, количественное определение которого проводили методом анализа изоболограмм. Эффект синергизма подтвердился также и в исследованиях in vivo: Erba E. et al. “ET-743 and cisplatm (DDP) show in vitro and in vivo synergy against human sarcoma and ovarian carcinoma cell lines”, Proceed. AACR-NCI-EORTC Nov. 2001, abstract 406; Faircloth, Glynn Thomas, Jr., et al. “In vivo combinations of chemotherapeutic agents with Ecteinascidin 743 (Et743) against solid tumors”, proceed. AACR-NCI-EORTC Nov. 2001, abstract 387; Dincalci M. et al. “The combination of ET-743 and cisplatin (DDP): From a molecular pharmacology study to a phase I clinical trial”, proceed. AACR March 2002, abstract 404; Dincalci, M. et al. “In Human tumor xenografts the resistance to ET-743 or to cisplatm can be overcome by giving the two drugs in combination”, proceed. AACR-NCI-EORTC, Nov. 2002, abstract 97. Комбинированная терапия с использованием ET-743 описана в международной заявке WO 0236135, во всей полноте, включенной в настоящее описание путем цитирования. Целью изобретения является предоставление эффективных методов и продуктов для предотвращения невосприимчивости или преодоления приобретенной устойчивости у человека к координационным комплексам платины как противоопухолевым средствам. Другой целью изобретения является обеспечение эффективных способов и продуктов для усиления цитотоксического действия координационных комплексов платины как противоопухолевых средств в клинической практике. СУЩНОСТЬ ИЗОБРЕТЕНИЯ Авторы изобретения обнаружили, что при комбинированном использовании максимальная доза ET-743 и платинового соединения, в частности цисплатина или карбоплатина, не приводит к повышению или появлению дополнительной токсичности. Это подтверждено клиническими испытаниями, в которых полную дозу цисплатина и карбоплатина успешно использовали наряду с возрастающими дозами ЕТ-743. Таким образом, предмет изобретения связан с новым способом лечения онкологических пациентов, при котором соединения платины вводят в сочетании с ЕТ-743. Изобретение дополнительно связано также со способом лечения больного раком пациента, предусматривающим использование соединения платины и ЕТ-743 в таких количествах, что процентное содержание платинового соединения составляет не менее 50%, не менее 75%, не менее 85%, не менее 90%, не менее 95%, не менее 100% от рекомендуемой дозы соединения платины в отсутствие ЕТ-743, а также количество ЕТ-743 составляет не менее 50%, не менее 75%, не менее 85%, не менее 90%, не менее 100% от рекомендуемой дозы для ЕТ-743 в отсутствие соединения платины. Величины рекомендуемых доз основаны на исследованиях доз минимальной токсичности. Предпочтительные количества как соединения платины, так и ЕТ-743 в итоге составляют не менее 85%, не менее 90%, не менее 95% или не менее 100% от соответствующих рекомендуемых доз. С другой точки зрения настоящее изобретение направлено на использование ЕТ-743 в приготовлении медицинских препаратов для эффективного лечения больных раком людей путем комбинированной терапии, с использованием ЕТ-743 с соединениями платины, в процессе которой преодолевается устойчивость к платиновым противоопухолевым соединениям без увеличения токсичности каждого лекарственного средства. В этом же аспекте, в изобретении предложен способ лечения больного раком человека с помощью соединений платины, при котором ET-743 вводится для комбинированной терапии без компенсационного уменьшения дозы платинового соединения. В другом осуществлении настоящего изобретения предложен способ снижения устойчивости к платиновым антинеопластическим соединениям у индивидуума с неопластическим заболеванием, включающий в себя введение индивидууму ET-743 и соединения платины в интервале доз, аналогичных тем, которые были бы введены, если бы каждое из соединений – ET-743 или соединение платины – назначалось бы отдельно. В настоящем изобретении предложена также фармацевтическая композиция с содержанием рекомендованных доз ET-743 для еженедельного применения в комбинации с соединением платины и с фармацевтически приемлемым носителем. В дополнительном аспекте настоящего изобретения предложен набор медицинских инструментов для введения ET-743 в комбинации с антинеопластическим соединением платины, снабженный напечатанными инструкциями по применению ET-743 на основании приведенных ниже режимов дозирования, и указано обеспечение ET-743 в дозах, достаточных не менее чем на один курс лечения, при этом каждая единица дозы содержит соответствующее количество ET-743 для лечения, как определено выше, и фармацевтически приемлемый носитель. ПОДРОБНОЕ ОПИСАНИЕ ET-743 является соединением природного происхождения, его структура может быть представлена следующей формулой: Термин «ET-743» также предназначен здесь для обозначения любого рода фармацевтически допустимой соли, эфира, сольвата, гидрата или какого-либо другого соединения, которое при назначении приема реципиенту способно обеспечивать его (направленно или опосредованно) соединением, которое описано в этом документе. Однако следует принять во внимание, что фармацевтически неприемлемые соли также попадают в сферу настоящего изобретения, поскольку они могут быть использованы в получении фармацевтически приемлемых солей. Получение солей и пролекарств и их производных может быть осуществлено известными в данной области способами. ET-743 поставляется и хранится в виде стерильного лиофилизованного продукта, содержащего ET-743 и наполнитель в составе композиции, пригодной для терапевтического использования. Комбинации лекарственных средств в настоящем изобретении включают в себя ET-743 и антинеопластическое платиновое соединение, желательно координационный комплекс. Предпочтительными комплексами являются цисплатин, карбоплатин, тетраплатин, ормиплатин, ипроплатин, оксалиплатин и т.п. Наиболее предпочтительны такие координационные комплексы платины как цисплатин и карбоплатин, лучше всего – цисплатин. Два лекарства можно давать одновременно или одно за другим в любой последовательности, желательно – последовательно. Как было уже сказано, в изобретении предложен способ лечения человека, больного раком. Предпочтительны пациенты с рецидивами или резистентные к предшествовавшей химиотерапии. Наиболее предпочтительно, если пациенты имеют рак яичников, рак головы и шеи, карциному NSCL или меланому. В особо предпочтительном осуществлении пациенты имеют рак яичников, и предшествующая терапия у них включала в себя соединения платины. Кроме того, в настоящем изобретении предложен способ лечения рака у человека, включающий в себя внутривенную инфузию композиции, содержащей ET-743 человеку, имеющему злокачественное заболевание, постоянными дозами (в течение периода вплоть до 4 часов), до или после непрерывной внутривенной инфузии композиции, содержащей антинеопластическое соединение платины, причем введение лекарств повторяется еженедельно и производится периодически. Инъекции обычно периодически повторяют. Периодически чередуются две фазы: фаза еженедельной инфузии и фаза без инфузий, называемая фазой отдыха. В течение фазы отдыха для пациентов предусматривается восстановление. Обычно фазы цикла длятся по неделе, но возможно, что фаза инфузий займет одну или более недель, и фаза отдыха – одну или более недель. Период отдыха может быть длиннее или короче фазы инфузий. Предпочтительная продолжительность каждого цикла лечения составляет от 2 до 4 недель; многократность циклов обеспечивается по мере необходимости. Наиболее предпочтительны на 3- или 4-недельные циклы с одно- или 2-недельной продолжительностью инфузий. В том случае, если ЕТ-743 вводят в комбинации с цисплатином, рекомендуемая доза ЕТ-743 предпочтительно не превышает 700 мкг/м2/в день, в 1 и 8 дни каждые 3 или 4 недели лечения, предпочтительно от 400 до 650 мкг/м2/в день или даже более предпочтительно от 500 до 650 мкг/м2/в день и еще более предпочтительно от 550 до 650 мкг/м2/в день. В этом случае целесообразно применение обоих соединений ежедневно в 1 и 8 дни лечения каждые 4 недели. С другой стороны, когда ЕТ-743 вводят в комбинации с карбоплатином, рекомендуемая доза ЕТ-743 предпочтительно не должна превышать 1200 мкг/м2/в день, на день 1-й каждого 3-недельного цикла лечения, предпочтительно от 650 до 1200 мкг/м2/в день или даже более предпочтительно от 800 до 1000 мкг/м2/в день и еще более предпочтительно от 800 до 900 мкг/м2/в день. Что касается величины дозы цисплатина, используют весь интервал доз в зависимости от схемы лечения. Предпочтительными дозами являются 30-60 мг/м2/в день, более предпочтительно 40-50 мг/м2/в день, еще более предпочтительно – 40 мг/м2/в день. Величина дозы карбоплатина может быть любой в интервале используемых доз и зависит от схемы лечения. Предпочтительные дозы составляют около 200-400 мг/м2/в день, более предпочтительными являются дозы 250-300 мг/м2/в день. В особом воплощении, время инфузий ET-743 составляет от 1 до 3 часов, предпочтительно от 2 до 3 часов. Особенно предпочтительное время составляет около 3 часов. Приведенные выше схемы лечения и дозы предусматривают эффективную комбинированную терапию раковых заболеваний у человека, в то же время позволяя избежать токсичности. Авторы изобретения установили, что ET-743 в комбинации с цисплатином или карбоплатином эффективен в лечении нескольких видов рака, включая стадии прогрессии или метастазирования. Предпочтительно применение комбинации ET-743 с соединениями платины согласно вышеприведенным схемам лечения и дозам для лечения саркомы, остеосаркомы, рака яичников, рака молочной железы, меланомы, рака головы и шеи, рака ободочной и прямой кишки, мезотелиомы, рака почек, эндометриального (внутриматочного) рака и рака легких. В зависимости от вида опухоли и стадии ее развития, способы лечения, описанные в изобретении, эффективны в предотвращении риска развития опухоли, способствуют уменьшению опухоли, останавливают рост опухоли и/или предотвращают метастазирование. Хотя выше и были приведены рекомендации по дозам, но уточненные дозы соединения будут отличаться в соответствии с индивидуальными технологиями приготовления лекарственных средств, со способом применения, зависят от места расположения опухоли, от хозяина и от вида опухоли, подлежащей лечению. Другие факторы, такие как возраст, масса тела, пол, диета, время введения, скорость выведения вещества из организма, состояние организма, комбинация лекарств, реакция чувствительности и тяжесть заболевания должны приниматься во внимание. Введение лекарственного средства может осуществляться непрерывно или периодически в пределах максимально переносимой дозы. ПРИМЕРЫ Пример 1 Для того чтобы оценить воздействие комбинации ET-743 и цисплатина (DDP) in vivo, авторы изобретения выбрали ксенотрансплантаты, которые сравнительно устойчивы к дозе DDP и умеренно устойчивы к однократной дозе ET-743. Для введения лекарств использовали подходящие для инъекций носители, используя схему и способ применения инъекции, как принято в фармакотерапии. ET-743 и DDP вводили в течение 1 часа, по отдельности последовательно и одновременно. В ксенотрансплантатах контролировали рост подкожно (s.c.) трансплантированной опухоли в стандартных условиях, массу опухоли (TW) определяли следующим образом: проводили измерение диаметра опухоли штангенциркулем каждые 2-4 дня, массу вычисляли по формуле TW=d2 x D/2 (где d и D – наименьший и наибольший диаметры опухоли, соответственно). Максимальная однократная внутривенная (i.v.) доза DDP и ET-743, не приводящая к токсической смерти, составляла 12 мг/кг и 0,2 мг/кг, соответственно. Такие же дозы каждого лекарства допустимо вводить в том случае, когда два лекарства применяются в комбинации, при таких дозах отмечается толерантная токсичность, максимальная потеря массы в пределах от 10% до 26% в различных экспериментах (n=14), средняя величина потери массы 15%. Неожиданно было обнаружено, что лечение комбинацией лекарств вызывало только несколько большую потерю массы, чем лечение каждым лекарственным средством в отдельности. В токсичности не было отмечено различий для случаев одновременного или последовательного введения лекарств с интервалом в 1 час, как в той, так и в другой последовательности. Во всех моделях противоопухолевая активность комбинации лекарственных средств была больше, чем в случае их индивидуального применения. В случае рабдомиосаркомы TE-671 и нейробластомы SK-N-DZ все три варианта введения лекарства (т.е. ET-743 вводили за 1 час до введения DDP, или их вводили одновременно, или ET-743 вводили через 1 час после введения DDP) сравнивали и не наблюдали заметных отличий в противоопухолевой активности. Также в случае H & N FADU, NSCLC LX-1, меланомы H-187, SKOV яичников не наблюдали заметных отличий при сравнении двух вариантов введения лекарств. Подводя итог вышесказанному, можно отметить, что противоопухолевая активность комбинации лекарств была выше, чем каждого лекарства в отдельности, и последовательность введения не влияет на лечебный эффект, и величины токсичности при разном введении сопоставимы. Пример 2 То, что токсичность при использовании комбинации лекарственных средств проявлялась очень умеренно, побудило авторов исследовать воздействие комбинации ET-743 и DDP при разбиении дозы каждого лекарства на три введения с интервалом в 4 дня. Ксенотрансплантаты карциномы яичников 1А9 были относительно устойчивы к этим двум лекарственным средствам в случае монотерапии. В противоположность этому, DDP в дозе 4 мг/кг (Q4x3), в суммарной дозе 12 мг/кг, при его одновременном введении с ET-743 в дозе 0,1 мг/кг (Q4x3), в суммарной дозе 0,3 мг/кг, вызывал существенный уровень TWI, оставляющий 73%. И опять в случае комбинированного использования лекарственных средств не наблюдали случаи токсической смерти или тяжелых проявлений токсичности (средняя потеря массы тела составляла 16%) по сравнению с использованием одного лекарства (средняя потеря массы тела 14% и 12% при использовании ET-743 и DDP, соответственно). Таким образом, комбинированная терапия допускает применение высоких доз лекарств, и даже для тех опухолей, в лечении которых каждое из указанных двух лекарственных средств не проявляет заметной активности при индивидуальном использовании, была доказана терапевтическая активность при использовании комбинации этих средств. Пример 3 У пациентов с карциномой яичников опухоль распространяется в брюшную полость. Поэтому для создания клинической модели заболевания авторы выбрали ксенотрансплантат яичников человека HOC 8, который трансплантировали в брюшную полость из асцитов и который диссеминировался в брюшную полость. Эта опухоль отчасти чувствительна к DDP (ILS = 139%) и не чувствительна к ET-743 (ILS=21% и 23% в случае доз 0,05 мг/кг и 0,15 мг/кг, Q4x3). В случае комбинирования двух этих лекарственных средств эффект был гораздо большим, со значительным возрастанием продолжительности выживаемости, чем в случае индивидуального применения каждого лекарства. Как низкая (ILS=258% в сравнении контролем (носитель)), так и высокая (ILS=322% в сравнении с носителем) дозы ET-743, используемого в комбинации с DDP, повышали время выживаемости мышей с HOC8, что является заметным улучшением результата по сравнению с монотерапией DDP ( ILS=49% и 76% при сравнении DDP с низкими и высокими дозами ET-743, соответственно). Трое животных оставались живы спустя 12 месяцев, двое из них принадлежали к группе, получавшей высокие дозы ET-743. Они были забиты и был проведен детальный анализ макро- и микропатологических изменений. У мышей, относящихся к группе, получавшей низкие дозы ET-743, проводили микроскопический анализ печени, селезенки, поджелудочной железы, костного мозга, диаграммы яичников, матки, сальника, лимфатических узлов были негативными. В противоположность этому случаю, другие долго живущие мыши имели остаточные опухоли сальника, и у одной из мышей были обнаружены метастазы в матке, в то время как в других органах метастазы не были обнаружены. В этом примере показаны возможности комбинированной терапии в случае рака яичников, даже при наличии метастазов. Пример 4 Авторы организовали мультицентровые испытания действия введения доз в 1 и 8 дни каждые 3 недели графика лечения, с увеличением доз ET, вводимых путем 3-х часовых инфузий со стероидами и противорвотными профилактическими средствами, введение которых осуществлялось на 30 минут позже, путем 1-часовой инфузии цисплатина в фиксированной дозе 40 мг/м2, с 2 л физиологического раствора. В исследовании участвовали 36 пациентов (15 – с раком яичников, 6 – с раком матки, 14 – с саркомой мягких тканей и 1 – с другим типом опухоли). Предшествовавшее лечение пациентов было следующим:
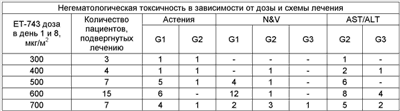
Дозы ET-743 достигали следующих уровней: 300, 400, 500, 600 и 700 мкг/м2/в день, 3-6 пациентов лечили дозами, близкими к уровню токсичности. Повышение дозы ET-743 до уровня 500 мкг/м2 проходило без особых осложнений, при 600 мкг/м2 пациентов разделили на две группы риска, в зависимости от продолжительности предшествовавшего химиотерапевтического лечения: группа низкого риска = 1 (LR) и группа высокого риска Приведенная ниже таблица отражает полученные данные о гематологической токсичности:
* 7 дней продолжалась нейтропения у G4 ° 1 пациент при 500 и 1 пациент при 600 не выздоровели от нейтропении за 35 дней # Для 1 пациента первоначальная доза была записана 500, но он принимал 400 в 1 цикле. Приведенная ниже таблица отражает обнаруженную негематологическую токсичность: Приведенная ниже таблица отражает другие полученные данные о негематологической токсичности:
Предельные токсические дозы (DLT): – 500: 1/7 лечившихся пациентов не выздоравливали за 35 дней – 600: 3/15 лечившихся пациентов –1 не выздоравливал из-за гематологической токсичности за 35 дней –1 стадия G3 ALT, выздоровления не было B/L –1 не выздоравливал за 8 дней, билирубин стадии G1, стадия G3 ALT -700: 2/7 лечившихся пациентов ANS стадии G4, ухудшения не было >7 дней (у 1 пациента была сопутствующая G4 тромбоцитопения, и выздоровления не было из-за гематологической токсичности на 35 день). В нижеприведенной таблице показана наблюдаемая эффективность:
(PR: частичная чувствительность; PD: прогрессирующее заболевание; CR: полная чувствительность; NC: нет изменений; AD: адъювант (стимулятор, синергист); NE: не поддающийся оценке; TTP: время прогрессирования заболевания). По результатам этого исследования авторы сделали следующие выводы: – из исследованных значений MTD составляет 700 мкг/м2 для излечения ранее лечившихся пациентов в 1 и 8 дни каждые 4 недели; – рекомендуемая доза (RD) для излечения ранее лечившихся пациентов составляет 500 мкг/м2 в 1 и 8 дни каждые 4 недели; – DLT вызывается миелосупрессия, особенно нейтропения; – при дозах – большинство негематологических токсичностей являются дозозависимыми, сопровождаются тошнотой и рвотой (N&V), астенией и печеночной токсичностью (всегда обратимыми и проявляются умеренно до дозы 600 мкг/м2/в день); – большинство негематологических токсичностей сопровождалось зависимыми от дозы тошнотой и рвотой (N&V), и астенией; – оптимальный интервал между лечениями составляет 28 дней. Пример 5 Авторы организовали многоцентровые испытания дозировок, вводимых с 1-го дня каждые 3 недели графика лечения с использованием карбоплатина в постоянной дозе 300 мг/м2, инфузия в течение 1 часа, и с сопутствующим увеличением доз ET, вводимых в виде 3-х часовых инфузий со стероидами и противорвотными профилактическими средствами. В исследовании участвовали 11 пациентов (6 – с раком яичников, 1 – с раком легких, 4 – с саркомой мягких тканей). Предшествовавшее лечение пациентов было следующим:
Дозы ET-743 достигали следующих уровней: 500, 650 и 800 мкг/м2/в день, 3-6 пациентов лечили дозами, близкими к уровню токсичности. Максимальная переносимая доза (MTD) определялась как наибольшее значение дозы, найденное для комбинации лекарств, при котором не менее 2 пациентов испытывали DLT в цикле 1. Если у одного пациента обнаруживалась вызванная лекарствами DLT в циклах 1 или 2, до 6 пациентов могут лечиться при этом уровне дозы лекарств. Если DLT не наблюдали у дополнительных пациентов, новые пациенты могут подвергаться лечению следующей высокой дозой. В нижеприведенной таблице представлены результаты цикла 1 по гематологической токсичности для тромбоцитов и по абсолютному количеству нейтрофильных лейкоцитов (ANC):
У двух пациентов проявлялась DLT в течение первого курса лечения при G3 тромбоцитопении в дозе уровня 3. Оба пациента имели карциному яичников, предварительно лечение которой проводили карбоплатином. В нижеприведенной таблице представлены результаты по гематологической токсичности для тромбоцитов и ANT для всех проведенных курсов лечения, а также и количество циклов без возвращения к гематологической норме на 21 и 28 дни:
*- все после сокращения дозы;
*- все после сокращения дозы; И в нижеприведенной таблице указано количество пациентов с переносимой дозой (и облегченной) в цикле 2 с указанием причин запаздывания для каждого уровня доз:
На основании данных о лечении 11 пациентов в цикле 1 можно сделать выводы: – по полученным данным количественная величина MTD для ET-743 составляет 800 мкг/м2 при его использовании с карбоплатином в фиксированной дозе (300 мг/м2); – DLT сопровождаются тромбоцитопенией 3-ей степени (G3); – у наблюдаемых пациентов при втором уровне дозирования у всех 100% испытуемых введение дозы откладывали и снижали дозу во втором цикле лечения из-за гематологической токсичности; – при третьем уровне доз 50% пациентов переносили дозу и понижение дозы во втором цикле лечения из-за гематологической токсичности. С учетом указанного гематологически безопасного профиля, с продолжительной, хоть и умеренной, нейтропенией, которую можно предотвращать дозами адекватной интенсивности ET-743, и с 2DLT, совместимыми с тромбопенией 3-й степени (G3) у двух пациентов с карциномой яичников, предварительно лечившихся карбоплатином, можно предложить следующую схему: – для пациентов, предварительно лечившихся карбоплатином: введение карбоплатина в постоянной дозе (250 мг/м2) с инфузированием в течение часа, с последующей внутривенной инфузией ET-743 в течение 3 часов в 1 день, каждые 3 недели. – для пациентов, предварительно не лечившихся карбоплатином: введение карбоплатина в постоянной дозе (300 мг/м2) с инфузией в течение часа, с последующей инфузией ET-743 в течение 3 часов в 1 день, каждые 3 недели.
Формула изобретения
1. Способ эффективного лечения больного раком пациента, являющегося человеком, посредством комбинированной терапии с использованием ЕТ-743 и карбоплатина, где дозировка карбоплатина составляет примерно от 200 до 400 мг/м2/в день, и дозировка ЕТ-743 составляет менее 1200 мг/м2/в день. 2. Способ по п.1, в котором дозировка карбоплатина составляет примерно от 250 до 300 мг/м2/в день. 3. Способ по п.2, в котором дозировка карбоплатина составляет 250 мг/м2/в день. 4. Способ по п.2, в котором дозировка карбоплатина составляет 300 мг/м2/в день. 5. Способ по любому из пп.2-4, в котором ЕТ-743 вводят в день 1-й каждого 3-недельного цикла в сочетании с карбоплатином. 6. Способ по п.5, в котором дозировка ЕТ-743 составляет примерно от 650 до 1200 мг/м2/в день. 7. Способ по п.6, в котором дозировка ЕТ-743 составляет примерно от 800 до 1000 мг/м2/в день. 8. Способ по п.6, в котором дозировка ЕТ-743 составляет примерно от 800 до 900 мг/м2/в день. 9. Способ по п.6, в котором дозировка ЕТ-743 составляет примерно 800 мг/м2/в день. 10. Способ по п.7, в котором карбоплатин вводят каждые 3 или 4 недели. 11. Способ по п.9, в котором карбоплатин вводят каждые 3 или 4 недели. 12. Способ по п.10, в котором ЕТ-743 и карбоплатин вводят в день 1-й каждого 3-недельного цикла. 13. Способ по п.11, в котором ЕТ-743 и карбоплатин вводят в день 1-й каждого 3-недельного цикла. 14. Способ по любому из пп.12 или 13, в котором введение осуществляют посредством внутривенной инфузии. 15. Способ по п.14, в котором время инфузии ЕТ-743 составляет от 1 до 3 ч. 16. Способ по п.15, в котором время инфузии ЕТ-743 составляет приблизительно 3 ч. 17. Способ по п.16, в котором время инфузии ЕТ-743 составляет 3 ч, и время инфузии карбоплатина составляет 1 ч. 18. Способ по п.1, в котором карбоплатин и ЕТ-743 вводят последовательно. 19. Способ по п.1, в котором у пациента наблюдается рецидив или резистентность к предшествовавшей химиотерапии. 20. Способ по п.1, в котором пациент имеет злокачественное заболевание, выбранное из саркомы, остеосаркомы, рака яичников, рака молочной железы, карциномы NSCL, меланомы, рака головы и шеи, рака ободочной и прямой кишки, мезотелиомы, рака почек, рака эндометрия и рака легких. 21. Способ по п.20, в котором пациент имеет злокачественное заболевание, выбранное из рака яичников, карциномы NSCL, меланомы и рака головы и шеи. 22. Способ по п.21, в котором пациент имеет рак яичников. 23. Способ по п.22, в котором пациент имеет метастазирующий рак яичников. 24. Способ по п.17, в котором пациент имеет злокачественное заболевание, выбранное из саркомы, остеосаркомы, рака яичников, рака молочной железы, карциномы NSCL, меланомы, рака головы и шеи, рака ободочной и прямой кишки, мезотелиомы, рака почек, рака эндометрия и рака легких. 25. Способ по п.24, в котором пациент имеет злокачественное заболевание, выбранное из рака яичников, карциномы NSCL, меланомы и рака головы и шеи. 26. Способ по п.25, в котором пациент имеет рак яичников. 27. Способ по п.26, в котором пациент имеет метастазирующий рак яичников. 28. Комбинация для лечения рака, включающая ЕТ-743 и карбоплатин, где дозировка карбоплатина составляет примерно от 200 до 400 мг/м2/в день, и дозировка ЕТ-743 составляет менее 1200 мг/м2/в день. 29. Медицинский набор для введения ЕТ-743 в сочетании с карбоплатином, включающий в себя ЕТ-743 в дозированных единицах по меньшей мере для одного цикла лечения, где каждая дозированная единица содержит соответствующее количество ЕТ-743 для лечения, определяемого в п.1, и фармацевтически приемлемый носитель, и напечатанные инструкции по введению ЕТ-743 в сочетании с карбоплатином, согласно схеме лечения, определяемой в п.1.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 12, 12.2002, p.3893-3903. RU 2104032 C1, 10.02.1998. RU 2185858 C1, 27.07.2002. «Справочник Видаль. Лекарственные препараты в России». 1997. МАШКОВСКИЙ М.Д. «Лекарственные средства» часть 2, 1988.
12, 12.2002, p.3893-3903. RU 2104032 C1, 10.02.1998. RU 2185858 C1, 27.07.2002. «Справочник Видаль. Лекарственные препараты в России». 1997. МАШКОВСКИЙ М.Д. «Лекарственные средства» часть 2, 1988.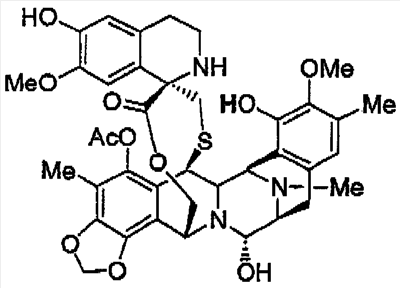
 2 (HR).
2 (HR). DLT
DLT