Патент на изобретение №2391098
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ 3-АРИЛТИОИНДОЛ-2-КАРБОКСАМИДОВ И ИХ АНАЛОГИ КАК ИНГИБИТОРЫ КАЗЕИНКИНАЗЫ I
(57) Реферат:
Изобретение относится к медицине, а именно к производству лекарственных средств, и касается применения производных 3-арилтиоиндол-2-карбоксамидов и их аналогов для производства лекарственного средства, ингибирующего активность казеинкиназы I
Предпосылки изобретения Область изобретения Данное изобретение относится к способам использования 3-арилтиоиндол-2-карбоксамидов, 5-замещенных-3-арилтиоиндол-2-карбоксамидов и их аналогов в качестве ингибиторов фосфорилирования казеинкиназой I Описание прототипа Ритмические изменения в поведении характерны для многих живых организмов, от простейших до человека. Если ритм при постоянных условиях сохраняется и имеет период около суток, при этом слабо зависит от температуры, такой ритм называют “циркадным” (суточным) (Konopka, R.J. and Benzer, S. (1971) Proc. Nat. Acad. Sci. USA 68, 2112-2116). Циркадные ритмы вызываются эндогенными биологическими водителями ритма (циркадными часами), которые существуют у большинства живых организмов, включая человека, грибы, насекомых и бактерии (Dunlap, J.C. (1999) Cell 96, 271-290; Hastings, J.W. et al. Circadian Rhythms, The Physiology of Biological Timing. In: Prosser, C.L. ed. Neural and Integrative Animal Physiology, New York: Wiley-Liss (1991) 435-546; Allada, R. et al. (1998) Cell 93, 791-804; Kondo et al. (1994) Science 266, 1233-1236; Crosthwaite, S.K. et al. (1997) Science 276, 763-769; Shearman, L.P. et al. (1997) Neuron, 19, 1261-1269). Циркадные ритмы являются самоподдерживающимися и остаются постоянными даже в условиях полной темноты, но могут синхронизироваться при смене день/ночь (подстраиваться под них) по сигналам внешней среды, таким как световые и температурные (Pittendrigh, C.S. (1993) Annu. Rev. Physiol., 55, 16-54; Takahashi, J.S. (1995) Annu. Rev. Neurosci. 18, 531-553; Albrecht, U. et al. (1997) Cell, 91, 1055-1064). Циркадные часы играют ключевую роль в поддержании многих биологических ритмов и регулируют множество таких циркадных проявлений как дневные флуктуации поведения, прием пищи, циклы сна и бодрствования, а также такие физиологические изменения как выработка гормонов и колебания температуры тела (Hastings, M. (1997) Trends Neurosci. 20, 459-464; Reppert, S.M. and Weaver, D.R. (1997) Cell 89, 487-490). Генетические и молекулярные исследования плодовой мушки Drosophila melanogaster прояснили роль некоторых генов, участвующих в циркадной ритмичности. Такие исследования привели к выявлению пути, который жестко саморегулируется и включает транскрипционную/трансляционную обратную связь (Dunlap, J.C. (1999) Cell, 96, 271-290; Dunlap, J.C. (1996) Annu. Rev. Genet. 30, 579-601; Hall, J.C. (1996) Neuron, 17, 799-802). Основными элементами циркадного осциллятора в Drosophila являются два стимулирующих белка dCLOCK/dBMAL (CYCLE) и два ингибирующих белка dPERIOD (dPER) и dTIMELESS (dTIM). dCLOCK и dBMAL гетеродимеризуются с образованием транскрипционного фактора dCLOCK/dBMAL, который промотирует экспрессию двух генов, называемых Drosophila Period (dper) и Drosophila Timeless (dtim). В конечном счете происходит считывание мРНК этих генов для обеспечения синтеза белков dPER и dTIM соответственно. В течение нескольких часов происходит синтез и фосфорилирование белковых производных dPER и dTIM в цитоплазме, затем их уровень достигает критического, они образуют гетеродимеры и перемещаются в ядро. Попав в ядро, dPER и dTIM функционируют как отрицательные регуляторы собственной транскрипции, накопление dPER и dTIM тормозится, и вновь начинается активация dper и dtim за счет присутствия dCLOCK/dBMAL (Zylka, M.J. et al. (1998) Neuron 20, 1103-1110; Lowrey, P.L. et al. (2000) 288, 483-491). Было показано, что ген dper является необходимым элементом контроля циркадных ритмов вылупления взрослой особи (появление взрослой мухи из куколки), поведения и локомоторной деятельности (Konopka, R.J., & Benzer, S. (1971) Proc. Natl. Acad. Sci. USA, 68, 2112-2116). Миссенс-мутации гена per могут либо укоротить (perS), либо удлинить (perL) период циркадного ритма, тогда как нонсенс-мутации (pero) порождают аритмичность в их поведении (Hall, J.C. (1995) Trends Neurosci. 18, 230-240). У млекопитающих супрахиазматическое ядро (СХЯ) переднего гипоталамуса является местом главных биологических часов (см. обзор Panda et al. (2002) Nature 417, 329-335; Reppert, S.M. and Weaver, D.R. (1997) Cell, 89, 487-490). Часы СХЯ включены в 24-часовой дневной цикл за счет ежедневного цикла день-ночь, причем свет действует через прямые и непрямые пути: сетчатка-СХЯ (Klein, D.C. et al. (1991) Suprachiasmatic Nuclei: The Mind’s Clock, Oxford University Press, New York). В СХЯ грызунов выявлены и клонированы три гена Per, которые обозначаются как мышиные гены Per1 (mPer1), mPer2 и mPer3. Белки, соответствующие таким генам млекопитающих (mPER1, mPER2, mPER3), имеют несколько общих областей гомологии друг с другом, и каждый ген млекопитающих Per кодирует белок с доменом димеризации белка, который обозначается как PAS (PAS является акронимом первых трех белков PER, ARNT и SIM, которые, как было установлено, обладают таким функционально важным доменом димеризации), который высоко гомологичен домену PAS PER насекомых. Уровни матричных РНК Per (мРНК) и белка колеблются в течение циркадных суток и непосредственно участвуют в положительном и отрицательном регулировании биологических часов, но только mPER1 и mPER2 осциллируют в ответ на воздействие света (Zylka, M.J. et al. (1998) Neuron 20, 1103-1110.; Albrecht, U. et al. (1997) Cell 91, 1055-1064; Shearman, L.P. et al. (1997) Neuron, 19, 1261-1269). Гомолог гена Drosophila tim у млекопитающих был клонирован и обозначен как mTim. Тем не менее, не наблюдалось никаких доказательств взаимодействий mPER-mTIM, аналогичных регистрируемым у Drosophila, и было высказано предположение о том, что взаимодействия PER-PER могут быть заменены функцией димеров PER-TIM при молекулярном действии циркадных часов млекопитающих (Zylka, M.J. et al. (1998) Neuron 21, 1115-1122). Другая возможность заключается в том, что ритмы в PER1 и PER2 образуют отрицательные обратные связи, которые регулируют транскрипционную активность белка Clock (через их домены PAS), что в свою очередь приводит в действие экспрессию любого одного или обоих генов Per (Shearman, L.P. et al. (1997) Neuron, 19, 1261-1269). Представления о роли трех генов mPer в действии часового механизма млекопитающих были предметом множества исследований. Структурная гомология белков mPER по отношению к dPER позволила надеяться на то, что белки mPER будут функционировать в качестве отрицательных элементов в цепи обратной связи млекопитающих. Предполагается, что PER1 участвует в отрицательном регулировании собственной транскрипции в цепи обратной связи, но недавно полученные данные указывают на то, что он участвует во входном канале (Hastings, M.H. et al. (1999) Proc. Natl. Acad. Sci. USA 26, 15211-15216). PER2 является наиболее хорошо изученным белком, и мутантный белок мыши mPER2 (mPer2Brdm1), не имеющий 87 остатков в карбоксильной части домена димеризации PAS, обладает укороченным циркадным циклом в нормальных условиях день-ночь, но проявляет аритмичность в полной темноте. Мутация также уменьшает осциллирующую экспрессию обоих mPer1 и mPer2 в СХЯ, показывая, что mPer2 может регулировать mPer1 in vivo (Zheng, B. et al. (1999) Nature 400, 169-173). Было показано, что PER2 обладает двойной функцией в регулировании «колесиков» в центральных часах (Shearman, L.P. et al. (2000) Science 288, 1013-1018). В этом исследовании было продемонстрировано, что PER2 связывается с криптохромными (CRY) белками и перемещается в ядро, в котором отрицательно регулируемая транскрипция CRY приводится в действие позитивными транскрипционными комплексами CLOCK и BMAL1. После проникновения в ядро PER2 инициирует положительный рычаг часов за счет положительного регулирования транскрипции BMAL1 по еще неизвестному механизму. Функция PER3 известна плохо, однако, в mPer3 нокаутных мышей наблюдается слабое воздействие на циркадную активность, и поэтому предполагалось, что PER3 участвует в циркадно регулируемых выходных каналах (Shearman, L.P. et al. (2000) Mol. Cell. Biol. 17, 6269-6275). Сообщалось, что белки mPER взаимодействуют друг с другом и что mPER3 может служить носителем mPER1 и mPER2 для доставки их в ядро, что имеет важнейшее значение для генерации циркадных сигналов в СХЯ (Kume, K. et al. (1999) Cell 98, 193-205; Takano, A. et al. (2000), FEBS Letters, 477, 106-112). Было установлено, что фосфорилирование компонентов циркадных часов регулирует продолжительность цикла. Первым генетическим свидетельством того, что специфическая протеинкиназа регулирует циркадный ритм Drosophila, было открытие нового гена doubletime (dbt), кодирующего протеин серин-треонин киназу (DBT) (Price J.L. et al. (1998) Cell 94, 83-95; Kloss B. et al. (1998) Cell 94, 97-107). Миссенс-мутации в dbt приводят к измененному циркадному ритму. Нулевые аллели dbt вызывают гипофосфорилирование dPER и аритмию. К киназам млекопитающих, наиболее близкородственным DBT, относятся казеинкиназа I Не было никаких биохимических причин выбирать между CKI В патенте США 6555328 B1 раскрываются методы скрининга клеток для выявления соединений, которые изменяют циркадные ритмы, основанные на тестовом соединении, меняющем способность человеческой казеинкиназы 1 Нарушения сна подразделялись на четыре основные категории, которые включают первичные нарушения сна (диссомнии и парасомнии), расстройства сна, связанные с медицинскими/психическими нарушениями, и категорию предполагаемых расстройств сна для тех нарушений сна, которые невозможно классифицировать из-за недостатка данных. Считается, что первичные нарушения сна возникают из-за отклонений непосредственно в системах, ответственных за генерацию сна-пробуждения (гомеостатическая система), или регистрации времени (циркадная система). Диссомнии относятся к нарушениям формирования или поддержания сна и включают первичную бессонницу, гиперсомнию (чрезмерную сонливость), нарколепсию, нарушения сна, связанные с дыханием, нарушения сна, связанные с циркадным ритмом, и диссомнии, не вошедшие в указанные категории. Первичная бессонница характеризуется сохраняющимися (>1 месяца) проблемами инициации и поддержания сна или невосстановительного сна. Проблемы сна, связанные с первичной бессонницей, приводят к значительным нарушениям или расстройствам, включая раздражительность в дневное время, потерю внимания и концентрации, усталость и недомогание и ухудшение настроения и мотивации. Нарушения сна, связанные с циркадным ритмом, включают синдром десинхроноза при перелетах, синдром нарушения сна при посменной работе, синдром преждевременной фазы сна и синдром задержки фазы сна (J. Wagner, M.L. Wagner and W.A. Hening, Annals of Pharmacotherapy (1998) 32, 680-691). Лица в режиме вынужденного сна демонстрируют более высокий уровень бодрствования в процентах от времени сна в определенные периоды циркадных суток (Dijk and Lockley, J. Appl. Physiol. (2002) 92, 852-862). Принято считать, что с возрастом происходит смещение циркадного ритма сна, которое часто приводит к менее качественному сну (Am. J. Physiol. Endocrinol. Metab. (2002) 282, E297-E303). Таким образом, сон, возникающий вне циркадной фазы, может быть ущербным с точки зрения качества и количества, что подкрепляется дополнительными примерами изменений сна при посменной работе и десинхронозе при перелетах. Изменение циркадных часов человека может вызывать нарушения сна, и агенты, которые модулируют циркадную ритмичность, например ингибитор CKI Нарушения настроения подразделяются на депрессивные расстройства («монополярные депрессии»), биполярные расстройства и два вида расстройств, основанных на этиологии, которые включают нарушения настроения, вызванные общим состоянием здоровья, и нарушение настроения под воздействием наркотических веществ. Депрессивные расстройства дополнительно подразделяются на большие депрессивные расстройства, дистимические расстройства и депрессивные расстройства, не отнесенные к другим категориям. Биполярные расстройства дополнительно подразделяются на биполярные расстройства I и II типа. Отмечалось, что термин «сезонный характер» может применяться в отношении больших депрессивных расстройств, которые носят периодический характер, а также в отношении проявления приступов больших депрессивных расстройств в биполярных расстройствах I и II типа. Заметная анергия, гиперсомния, переедание, набор веса и потребность в углеводах часто характеризуют приступы больших депрессивных расстройств, которые носят сезонный характер. Неясно, проявляется ли сезонный характер с большей вероятностью в серьезных депрессивных расстройствах, которые носят периодический характер, или в биполярных расстройствах. Тем не менее в рамках биполярных расстройств сезонный характер представляется более вероятным при биполярных расстройствах II типа, чем при биполярных расстройствах I типа. У некоторых лиц начало вспышки маний или гипоманий может быть также связано с определенным временем года. Сезонность зимнего типа, как правило, различается в зависимости от географической широты, возраста и пола. Распространенность заболевания увеличивается в более высоких широтах, подверженность риску зимних приступов депрессии уменьшается с возрастом, а женщины составляют от 60% до 90% от общего количества сезонно зависимых людей. Сезонные аффективные расстройства (SAD) – термин, широко используемый в литературе, являются подтипом расстройств настроения, которые в Руководстве по диагностике и статистике психических расстройств (DSM-IV) (American Psychiatric Association: Пациенты, страдающие большими депрессивными расстройствами, в том числе SAD, которые характеризуются периодическими приступами депрессии, обычно зимой, продемонстрировали позитивную ответную реакцию на световую терапию (Kripke, Journal of Affective Disorders (1998) 49 (2), 109-117). Успех применения терапии, основанной на использовании яркого света, для пациентов, страдающих SAD и большой депрессией, позволил предложить несколько гипотез для объяснения фундаментального механизма действия терапевтического эффекта света. К таким гипотезам относится «гипотеза циркадного ритма», которая предполагает, что антидепрессивный эффект яркого света может быть связан с фазовым сдвигом циркадного водителя ритма по отношению к сну (E.M. Tam et al., Can. J. Psychiatry (1995) 40, 457-466). Подтверждением связи между световой терапией и циркадным ритмом стал тот факт, что клинически эффективная световая терапия при больших депрессивных расстройствах вызывает сопутствующий сдвиг в циркадной фазе, и клиническая эффективность световой терапии очевидно зависит от способности световой терапии обеспечивать световой сдвиг (Czeisler et al., The Journal of Physiology (2000) 526 (Part 3), 683-694; Terman et al., Arch. Gen. Psychiatry (2001) 58, 69-75). Кроме того, было показано, что световая терапия ускоряет и усиливает эффективность фармакологического лечения больших депрессивных расстройств (Benedetti et al., J. Clin. Psychiatry (2003) 64, 648-653). Поэтому можно ожидать, что ингибирование казеинкиназы I Следует отметить, что нарушение сна является критическим симптомом для многих психиатрических расстройств (W.V.McCall, J.Clin. Psychiatry (2001) 62 (suppl 10), 27-32). Нарушения сна представляют собой общую особенность депрессивных нарушений, и бессонница является нарушением сна, которое часто встречается при депрессии, присутствуя у более чем 90% пациентов, страдающих депрессией (M.E. Thase, J. Clin. Psychiatry (1999) 60 (suppl 17), 28-31). Накопленные данные подтверждают общий патогенез для первичной бессонницы и больших депрессивных расстройств. Высказывалась гипотеза о том, что гиперактивность рилизинг-фактора кортикотропина (CRF) (в связи с генетической предрасположенностью или, возможно, из-за раннего стресса) вызывает процесс, приводящий к повышенным и протяженным нарушениям сна и в конечном счете к первичной бессоннице. Циркадная ритмичность при секреции CRF в отсутствие стресса может играть роль обычной экспрессии сон-пробуждение (G.S.Richardson and T.Roth, J.Clin. Psychiatry (2001) 62 (suppl 10), 39-45). Поэтому вещества, которые модулируют циркадную ритмичность, например, посредством ингибирования казеинкиназы I Все ссылки, упомянутые выше в настоящем документе, в силу ссылки на них полностью включаются в настоящий документ. Таким образом, предметом данного изобретения являются способы использования 3-арилтиоиндол-2-карбоксамидов, 5-замещенных-3-арилтиоиндол-2-карбоксамидов и аналогичных веществ в качестве ингибиторов фосфорилирования казеинкиназой человека I Краткое описание изобретения Таким образом, в соответствии с практикой данного изобретения предлагаются способы ингибирования активности казеинкиназы человека I Соответственно, одно из общих осуществлений изобретения относится к способу лечения пациентов, страдающих расстройствами или нарушениями, состояние которых улучшается при ингибировании активности казеинкиназы I
где X-H, Cl, F, Br, NO2, CN, OR2, NR2R2, HNSO2-C1-3алкил или NHCO-C1-3алкил; Y – -S(O)n– или -O-, где n равно 0, 1 или 2; R1: 1) арил, незамещенный или имеющий один или несколько следующих заместителей: a) C1-5алкокси, b) OH, c) галоген, d) NR2R2 или e) C1-5алкил, незамещенный или имеющий один или несколько следующих заместителей: i) OH или ii) C1-5алкокси; 2) гетероцикл, незамещенный или имеющий один или несколько следующих заместителей: a) C1-5алкил, незамещенный или имеющий один или несколько следующих заместителей: i) OH или ii) C1-5алкокси, b) C1-5алкокси, c) OH, d) галоген или e) NR2R2; 3) C1-5алкил, незамещенный или имеющий один или несколько следующих заместителей: a) C1-5алкил, b) C1-5алкокси, c) OH, или d) арил, незамещенный или имеющий один или несколько следующих заместителей: i) C1-5алкил, ii) C1-5алкокси, iii) OH, iv) галоген или v) NR2R2; Z: 1) C(=O)NR2R3 или 2) C(=O)R4; R2 – водород или C1-3алкил; R3 – водород, C1-5алкил или C3-6циклоалкил; R4 – 1-пиперидинил, 1-пирролидинил, 1-пиперазинил или 4-морфолинил, незамещенный или имеющий один или несколько следующих заместителей: 1) C1-5алкил, 2) C1-5алкокси, 3) OH, 4) галоген или 5) NR2R2; или стереоизомер, энантиомер, рацемат или таутомер упомянутого соединения или его фармацевтически приемлемой соли. Другое воплощение настоящего изобретения относится к способу ингибирования активности казеинкиназы I Подробное описание изобретения Используемое в настоящем документе выражение «стереоизомеры» является общим термином, применяемым для всех изомеров индивидуальных молекул, которые отличаются только пространственной ориентацией своих атомов. Термин «стереоизомер» включает зеркальные изомеры (энантиомеры), смеси зеркальных изомеров (рацематы, рацемические смеси), геометрические (цис/транс или E/Z) изомеры и изомеры соединений с несколькими хиральными центрами, не являющиеся зеркальными отображениями друг друга (диастереоизомеры). Соединения настоящего изобретения могут иметь асимметрические центры и существовать в виде рацематов, рацемических смесей, индивидуальных диастереоизомеров или энантиомеров, или же могут существовать в форме геометрических изомеров, причем все изомерные формы упомянутых соединений включены в настоящее изобретение. Используемые в настоящем документе обозначения «R» и «S» применяются как повсеместно используемые в органической химии для указания специфической конфигурации хирального центра. Обозначение «R» (rectus, правый) относится к конфигурации хирального центра с расположением старших по рангу групп по часовой стрелке (от группы с наибольшим рангом к группе со вторым наименьшим), если смотреть вдоль связи в направлении группы, наименьшей по старшинству. Обозначение «S» (sinister, левый) относится к конфигурации хирального центра с расположением старших по рангу групп против часовой стрелки (от группы с наибольшим рангом к группе со вторым наименьшим), если смотреть вдоль связи в направлении группы, наименьшей по старшинству. Старшинство групп определяется правилами последовательности, причем приоритет в первую очередь основан на атомном номере (в порядке убывания атомных номеров). Перечень и обсуждение старшинства групп приводится в книге Stereochemistry of Organic Compounds, Ernest L. Eliel, Samuel H. Wilen and Lewis N. Mander, editors, Wiley-Interscience, John Wiley & Sons, Inc., New York, 1994. Кроме системы (R)-(S), в настоящем документе может также применяться более старая система D-L для обозначения абсолютной конфигурации, особенно в отношении аминокислот. В данной системе формула проекции Фишера ориентируется таким образом, чтобы первый атом углерода основной цепи находился в верхней части. Префикс «D» используется для описания абсолютной конфигурации изомера, в которой функциональная (определяющая) группа находится справа от углерода хирального центра, а «L» – для изомера, в котором она расположена слева. Используемые в настоящем документе термины «таутомер» или «таутомерия» описывают одновременное существование двух (или более) соединений, которые отличаются друг от друга только положением одного (или нескольких) подвижных атомов, а также распределением электронов, например кето-енольные таутомеры или таутомерия. Применяемый в настоящем документе термин «алкил» относится к насыщенной углеводородной группе с линейной или разветвленной цепочкой, имеющей от одного до шести атомов углерода, и включает метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил и подобные им группы. Употребляемый в настоящем документе термин «алкокси» относится к моновалентному заместителю, который включает линейную или разветвленную алкильную цепочку, содержащую от одного до пяти атомов углерода, связанных через эфирный атом кислорода, и имеет свободную валентную связь от эфирного кислорода. Данное понятие объединяет метокси, этокси, пропокси, изопропокси, бутокси, втор-бутокси, трет-бутокси и подобные им группы. Используемый в настоящем документе термин «C3-6циклоалкил» относится к насыщенной моноциклической углеводородной кольцевой структуре, содержащей от трех до шести атомов углерода, и включает циклопропил, циклобутил, циклопентил, циклогексил и им подобные. Применяемый в настоящем документе термин «арил» или «Ar» означает стабильную моноциклическую, бициклическую или трициклическую кольцевую систему (до семи атомов углерода в каждом кольце), в которой по крайней мере одно из колец ароматическое и не обязательно имеет от одного до трех заместителей, которые выбираются из группы, включающей гидрокси, C1-5алкокси, галоген, -NH2, -NH(C1-3алкил), -N(C1-3алкил)2 и C1-5алкил, незамещенные или с одним или несколькими заместителями, которыми могут быть OH или C1-5алкокси. Примерами «арилов», или «Ar», являются фенил, нафтил, тетрагидронафтил и бифенил. Термин «арил-(C1-5алкил)» может обозначать 4-метилфенил, 2-метилфенил, фенилметил (бензил), фенилэтил, п-метоксибензил, п-фторбензил и п-хлорбензил. Используемый в настоящем документе термин «ацил» означает линейную или разветвленную насыщенную алифатическую углеводородную группу, имеющую от одного до шести атомов углерода, соединенную с карбонильной группой (C=O) и имеющую свободную валентность при карбонильной группе. К «ацилам» относятся ацетил, пропионил, бутирил, изобутирил и подобные им группы. Употребляемый в настоящем документе термин «гетероцикл» или «гетероциклический» применяется для описания стабильного 5-7-членного моноциклического или стабильного 8-11-членного бициклического гетероциклического кольца, которое является насыщенным или ненасыщенным и состоит из атомов углерода и от одного до трех гетероатомов, выбираемых из группы, состоящей из N, O и S, и в котором гетероатомы азота и серы могут быть окислены, а гетероатом азота может быть кватернизирован, также включает любую бициклическую группу, в которой любое из определенных выше гетероциклических колец конденсировано с бензольным кольцом. Гетероциклическое кольцо может быть связано с любым гетероатомом или атомом углерода, что приводит к образованию стабильной структуры. Примеры таких гетероциклических элементов включают пиперидинил, пиперазинил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, 2-оксоазепинил, азепинил, пирролил, пирролидинил, пиразолил, пиразолидинил, имидазолил, имидазолинил, имидазолидинил, пиридил, пиразинил, пиримидинил, пиридазинил, оксазолил, оксазолидинил, изоксазолил, изоксазолидинил, морфолинил, тиазолил, тиазолидинил, изотиазолил, хинуклидинил, изотиазолидинил, индолил, хинолинил, изохинолинил, бензимидазолил, тиадиазолил, бензопиранил, бензотиазолил, бензоксазолил, фурил, тетрагидрофурил, бензофуранил, тетрагидропиранил, тиенил, бензотиенил, тиаморфолинил тиаморфолинил сульфоксид, тиаморфолинил сульфон и оксадиазолил. Используемый в настоящем документе термин «галоген» относится к представителям группы фтора, хлора, брома или йода. Если какая-либо из функций (например, арил, гетероцикл, R1, R2, R3, R4, X, Y, Z и т.п.) встречается в одной из составляющих частей или в соединении формулы I настоящего изобретения более одного раза, в каждом случае ее определение не зависит от определения в каждом ином случае. Кроме того, сочетание заместителей и/или функций допускается, только если такие сочетания приводят к стабильным соединениям. Используемый в настоящем документе термин «лечить», «проводить лечение» или «лечение» означает: (i) профилактику заболевания, расстройства или состояния у пациента, который может быть предрасположен к заболеванию, расстройству и/или состоянию, однако, его наличие еще не было диагностировано; подавление заболевания, расстройства или состояния, т.е. замедление его развития; или (iii) устранение заболевания, расстройства или состояния, т.е. регрессия заболевания, расстройства и/или состояния. Применяемый в настоящем документе термин «пациент» относится к теплокровному животному, например млекопитающему, которое страдает конкретным заболеванием, расстройством или состоянием. Изначально предполагается, что морские свинки, собаки, кошки, крысы, мыши, лошади, крупный рогатый скот, овцы и люди являются примерами животных, объединенных данным термином. Используемый в настоящем документе термин «заболевание» относится к болезни, недомоганию или прекращению, прерыванию или нарушению функций организма, систем или органов. Употребляемый в настоящем документе термин «расстройство» обозначает нарушение функции, структуры или и того, и другого, возникающее в результате генетического или эмбриологического нарушения развития или в связи с экзогенными факторами, например ядом, травмой или заболеванием. Используемый в настоящем документе термин «состояние» обозначает общее состояние, здоровье или физическую форму. Применяемый в настоящем документе термин «профилактика» означает предупреждение заболевания. Используемый в настоящем документе термин «нарушение сна», «нарушения сна» или «расстройство сна» означает бессонницу. Употребляемый в настоящем документе термин «бессонница» означает невозможность сна в отсутствии внешних препятствий, например шума, яркого света и т.п., в тот период суток, когда обычно наступает сон, и подобная невозможность может различаться по степени от возбужденного состояния или тревожной дремоты до ограничения нормальной продолжительности сна или абсолютного бодрствования. Термин «бессонница» включает первичную бессонницу, бессонницу, связанную с психическим расстройством, бессонницу, вызванную приемом препаратов, и бессонницу циркадного ритма, связанную с изменением нормального режима сон-пробуждение (изменение рабочей смены, расстройство сна при посменной работе, десинхроноз при перелетах или синдром десинхроноза при перелетах и т.п.). Используемый в настоящем документе термин «первичная бессонница» означает затруднения при засыпании, при поддержании сна или при восстановительном сне, которые не вызваны психическим расстройством или не связаны с физиологическими последствиями приема определенных препаратов или отказа от них (бессонница, вызванная приемом препаратов). Применяемый в настоящем документе термин «расстройство сна, связанное с циркадным ритмом» включает десинхроноз при перелетах или синдром десинхроноза при перелетах, нарушение сна при посменной работе, синдром преждевременной фазы сна и синдром задержки фазы сна. Используемый в настоящем документе термин «эффективное ингибирующее количество соединения» или «эффективное количество соединения, ингибирующее казеинкиназу I Применяемый в настоящем документе термин «терапевтически эффективное количество» означает количество соединения, которое эффективно для лечения данного заболевания, расстройства или состояния. Используемое в настоящем документе выражение «удлинение периода циркадного ритма» относится к увеличению интервала между основополагающими событиями в процессе, который происходит регулярно с периодичностью примерно в 24 час. Употребляемое в настоящем документе выражение «сокращение периода циркадного ритма» относится к уменьшению интервала между основополагающими событиями в процессе, который происходит регулярно с периодичностью примерно в 24 час. Используемый в настоящем документе термин «фармацевтически приемлемая соль» предназначается для применения в отношении любой соли, как ранее известной, так и той, которая будет обнаружена в будущем, которая используется специалистом в данной области и является нетоксичной органической или неорганической солью, получающейся при добавлении кислоты или основания, и пригодна для использования в качестве фармацевтического препарата. Примеры оснований, которые образуют пригодные соли, включают гидроксиды щелочных или щелочноземельных металлов, например гидроксиды натрия, калия, кальция или магния; аммиак и алифатические, циклические или ароматические амины, например метиламин, диметиламин, триэтиламин, диэтиламин, изопропилдиэтиламин, пиридин и пиколин. Примеры кислот, которые образуют пригодные соли, включают неорганические кислоты, например соляную, бромистоводородную, серную, фосфорную и подобные им кислоты, и органические карбоновые кислоты, например уксусную, пропионовую, гликолевую, молочную, пировиноградную, малоновую, янтарную, фумаровую, яблочную, винную, лимонную, аскорбиновую, малеиновую, гидроксималеиновую и дигидроксималеиновую, бензойную, фенилуксусную, 4-аминобензойную, 4-гидроксибензойную, антраниловую, коричную, салициловую, 4-аминосалициловую, 2-феноксибензойную, 2-ацетоксибензойную, миндальную и подобные им кислоты, а также органические сульфоновые кислоты, например метансульфоновую, п-толуолсульфоновую, 1-нафталинсульфоновую, 2-нафталинсульфоновую и подобные им кислоты. Используемый в настоящем документе термин «фармацевтический носитель» или «фармацевтически приемлемый носитель» относится к известным фармацевтическим наполнителям, эффективным при приготовлении терапевтически активных составов для введения, которые в значительной степени нетоксичны и не обладают сенсибилизирующим воздействием в условиях применения. Точная пропорция таких наполнителей определяется растворимостью и химическими свойствами активного соединения, избранного пути введения, а также стандартной фармацевтической практикой. При практическом применении методов настоящего изобретения активный ингредиент предпочтительно включается в состав, содержащий фармацевтический носитель, хотя соединения сами по себе являются эффективными и могут вводиться отдельно. При этом пропорция активного ингредиента может меняться от примерно 5 вес.% до 90 вес.%. В настоящей заявке могут также использоваться следующие сокращения: Me (метил), Et (этил), Ph (фенил), Et3N (триэтиламин), p-TsOH (пара-толуолсульфоновая кислота), TsCl (пара-толуолсульфонилхлорид), hept (гептан), DMF (диметилформамид), NMP (1-метил-2-пирролидинон или N-метил-2-пирролидинон), IPA (изопропанол, или изопропиловый спирт), TFA (трифторуксусная кислота), DBU (1,8-диазабицикло[5.4.0]ундец-7-ен), DBN (1,5-диазабицикло[4.3.0]нон-5-ен), rt или r.t. (комнатная температура или температура окружающей среды), мин или мин (минуты), час (час или часы), УФ (ультрафиолетовый), ЖХМС (жидкостная хроматомасс-спектрометрия), t-Boc или Boc (трет-бутоксикарбонил), Bn (бензил), t-Bu (третичный бутил), i-Pr (изопропил), TFA (трифторуксусная кислота), HOAc (уксусная кислота), EtOAc (этилацетат), Et2O (диэтиловый эфир), EtOH (этанол), г (грамм), мг (миллиграмм), мкг (микрограмм), нг (нанограмм), мл (миллилитр), мкл (микролитр), л (литр), ВЭЖХ (высокоэффективная жидкостная хроматография), ТСХ, тсх или Тсх (тонкослойная хроматография), г/л (грамм на литр), SiO2 (силикагель), л/мин (литр в минуту), мл/мин (миллилитр в минуту), ммоль (миллимоль), M (моль на литр), mМ (миллимоль на литр), Соответственно, общее осуществление настоящего изобретения относится к способу лечения пациента, страдающего от расстройств или нарушений, состояние которого улучшается при ингибировании активности казеинкиназы I
где X-H, Cl, F, Br, NO2, CN, OR2, NR2R2, HNSO2-C1-3алкил или NHCO-C1-3алкил; Y–S(O)n– или -O-, где n равно 0, 1 или 2; R1: 1) арил, незамещенный или имеющий один или несколько заместителей, которыми могут быть C1-5алкокси, OH, галоген, NR2R2, или C1-5алкил, незамещенный или имеющий один или несколько заместителей, которыми могут быть OH или C1-5алкокси; 2) гетероцикл, незамещенный или имеющий один или несколько C1-5алкильных заместителей, незамещенных или имеющих один или несколько заместителей, которыми могут быть OH или C1-5алкокси, OH, галоген или NR2R2; 3) C1-5алкил, незамещенный или имеющий один или несколько заместителей, которыми могут быть C1-5алкил, C1-5алкокси, OH или арил, незамещенный или имеющий один или несколько заместителей, которыми могут быть C1-5алкил, C1-5алкокси, OH, галоген или NR2R2; Z-C(=O)NR2R3 или C(=O)R4; R2 – водород или C1-3алкил; R3 – водород, C1-5алкил или C3-6циклоалкил; R4 – 1-пиперидинил, 1-пирролидинил, 1-пиперазинил или 4-морфолинил, незамещенный или имеющий один или несколько заместителей, которыми могут быть C1-5алкил, C1-5алкокси, OH, галоген или NR2R2. Второе осуществление настоящего изобретения относится к способу лечения пациента, страдающего заболеванием или расстройством, состояние которого улучшается при ингибировании активности казеинкиназы I Третье осуществление настоящего изобретения относится к способу лечения пациента, страдающего заболеванием или расстройством, состояние которого улучшается при ингибировании казеинкиназы I Четвертое осуществление настоящего изобретения относится к способу лечения пациента, страдающего заболеванием или расстройством, состояние которого улучшается при ингибировании казеинкиназы I Пятое осуществление настоящего изобретения относится к способу лечения пациента, страдающего заболеванием или расстройством, состояние которого улучшается при ингибировании казеинкиназы I Шестое осуществление настоящего изобретения относится к способу лечения пациента, страдающего депрессивным расстройством, в случае, когда упомянутым депрессивным расстройством является большое депрессивное расстройство. Седьмое осуществление настоящего изобретения относится к способу лечения пациента, страдающего заболеванием или расстройством, состояние которого улучшается при ингибировании казеинкиназы I Восьмое осуществление изобретения относится к способу лечения пациента, страдающего заболеванием или расстройством, состояние которого улучшается при ингибировании казеинкиназы I Девятое осуществление изобретения относится к способу лечения пациента, страдающего нарушением сна, в случае, когда упомянутым нарушением сна является нарушение сна, связанное с циркадным ритмом. Десятое осуществление изобретения относится к способу лечения пациента, страдающего заболеванием или расстройством, состояние которого улучшается при ингибировании казеинкиназы I Одиннадцатое осуществление изобретения относится к способу лечения пациента, страдающего заболеванием или расстройством, состояние которого улучшается при ингибировании активности казеинкиназы I Один из классов соединений, относящийся к одиннадцатому осуществлению, дополнительно ограничивается соединениями формулы I, где Y – S(O)2, Z – C(=O)NH2, а R1 – фенил. Следующие соединения являются характерными примерами, входящими в сферу охвата данного осуществления: амид 3-бензолсульфонил-5-хлор-1H-индол-2-карбоновой кислоты и амид 3-бензолсульфонил-1H-индол-2-карбоновой кислоты. Второй класс соединений, относящихся к одиннадцатому осуществлению, дополнительно ограничивается соединениями формулы I, где Y-S, Z-C(=O)NHCH3, а R1 – фенил или пиридинил. Следующие соединения являются характерными примерами, входящими в объем притязаний данного осуществления: метиламид 3-фенилсульфанил-1H-индол-2-карбоновой кислоты и метиламид 3-(пиридин-2-илсульфанил)-1H-индол-2-карбоновой кислоты. Двенадцатое осуществление изобретения относится к способу лечения пациента, страдающего заболеванием или расстройством, состояние которого улучшается при ингибировании активности казеинкиназы I амид 3-фенокси-1H-индол-2-карбоновой кислоты, амид 3-(4-метоксифенокси)-1H-индол-2-карбоновой кислоты, амид 3-(4-фторфенокси)-1H-индол-2-карбоновой кислоты, амид 3-(2-фторфенокси)-1H-индол-2-карбоновой кислоты, амид 3-(4-хлорфенокси)-1H-индол-2-карбоновой кислоты, амид 3-метокси-1H-индол-2-карбоновой кислоты, амид 3-этокси-1H-индол-2-карбоновой кислоты, амид 3-изопропокси-1H-индол-2-карбоновой кислоты, амид 3-трет-бутокси-1H-индол-2-карбоновой кислоты и амид 3-бензилокси-1H-индол-2-карбоновой кислоты. Тринадцатое осуществление изобретения относится к способу лечения пациента, страдающего заболеванием или расстройством, состояние которого улучшается при ингибировании активности казеинкиназы I (3-бензолсульфонил-5-хлор-1H-индол-2-ил)морфолин-4-илметанон, (5-фтор-3-п-толилсульфанил-1H-индол-2-ил)пирролидин-1-илметанон, (3-фенилсульфанил-1H-индол-2-ил)пиперидин-1-илметанон, (5-фтор-3-фенилсульфанил-1H-индол-2-ил)пирролидин-1-илметанон, [3-(2-аминофенилсульфанил)-1H-индол-2-ил]пирролидин-1-илметанон, [3-(2-аминофенилсульфанил)-1H-индол-2-ил]пиперидин-1-илметанон, [3-(2-аминофенилсульфанил)-5-фтор-1H-индол-2-ил]пиперидин-1-илметанон, [5-фтор-3-(п-толуол-4-сульфинил)-1H-индол-2-ил]пирролидин-1-илметанон, гидрохлорид (3-фенилсульфанил-1H-индол-2-ил)пиперазин-1-илметанона, [5-фтор-3-(пиридин-2-илсульфанил)-1H-индол-2-ил]пирролидин-1-илметанон, [3-(пиридин-2-илсульфанил)-1H-индол-2-ил]пирролидин-1-илметанон, пиперидин-1-ил-[3-(пиридин-2-илсульфанил)-1H-индол-2-ил]метанон и [5-фтор-3-(пиридин-2-илсульфанил)-1H-индол-2-ил]пиперидин-1-илметанон. Четырнадцатое осуществление изобретения относится к способу лечения пациента, страдающего заболеванием или расстройством, состояние которого улучшается при ингибировании активности казеинкиназы I амид 3-(пиридин-2-илсульфанил)-1H-индол-2-карбоновой кислоты. Пятнадцатое осуществление изобретения относится к способу лечения пациента, страдающего заболеванием или расстройством, состояние которого улучшается при ингибировании активности казеинкиназы I амид 3-фенилсульфанил-1H-индол-2-карбоновой кислоты, амид 5-бром-3-фенилсульфанил-1H-индол-2-карбоновой кислоты, амид 3-(2-аминофенилсульфанил)-5-метокси-1H-индол-2-карбоновой кислоты, амид 3-(3-фторфенилсульфанил)-1H-индол-2-карбоновой кислоты, амид 3-(2-аминофенилсульфанил)-5-бром-1H-индол-2-карбоновой кислоты и амид 3-(2-аминофенилсульфанил)-1H-индол-2-карбоновой кислоты. Шестнадцатое осуществление настоящего изобретения относится к способу ингибирования активности казеинкиназы I Все различные варианты осуществления настоящего изобретения, которые приведены в настоящем документе, могут использоваться в качестве способа лечения различных заболеваний и нарушений, описанных в настоящем документе. Как отмечается в данном документе, соединения, использованные в способе настоящего изобретения, в состоянии ингибировать эффекты казеинкиназы I ХИМИЧЕСКИЙ СИНТЕЗ Соединения, составляющие предмет данного изобретения, получают с использованием методов, известных специалистам в данной области. В частности, соединения, составляющие предмет данного изобретения, описаны в патенте США 5527819 и могут быть получены в соответствии с указанными в нем методами, которые в силу ссылки на них полностью включаются в настоящий документ. Точнее, различные виды синтеза, которые могут использоваться для получения соединений, составляющих предмет данного изобретения, приводятся на схемах 1, 2 и 3, а их методология подробно описана в последующих примерах. ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ Фармацевтические композиции, составляющие предмет данного изобретения, получают хорошо известными в фармакологии методами. Носитель или наполнитель могут быть твердыми, полужидкими или жидкими материалами, способными служить носителем или средой для активного ингредиента. Подходящие носители или наполнители хорошо знакомы специалистам в данной области. Фармацевтическую композицию можно адаптировать для перорального, ингаляционного, парентерального или местного применения, а также вводить пациенту в форме таблеток, капсул, суспензий, сиропов, аэрозолей, форм для ингаляции, суппозиториев, мазей, порошков, растворов и т.п. Используемые в настоящем документе термины «фармацевтический носитель» или «фармацевтически приемлемый носитель» означает один или несколько наполнителей. В процессе приготовления фармацевтических композиций или составов соединений настоящего изобретения следует учитывать необходимость обеспечения биодоступности эффективного терапевтического количества активного соединения или соединений, выбирая способ введения (в том числе пероральный, парентеральный и подкожный). Например, эффективные способы введения могут включать подкожный, внутривенный, чрескожный, интраназальный, ректальный, вагинальный и подобные им способы, в том числе высвобождение из имплантов, а также инъекцию активного ингредиента и/или состава непосредственно в ткань. При пероральном введении соединения настоящего изобретения могут включаться в состав твердых или жидких препаратов, с инертными разбавителями или съедобными носителями или без них, например капсулы, пилюли, таблетки, пастилки, порошки, растворы, суспензии или эмульсии. Капсулы, пилюли, таблетки, пастилки и т.п. могут также содержать одно или несколько следующих вспомогательных веществ: связывающее вещество, например микрокристаллическую целлюлозу, трагакантовую камедь; наполнитель, например крахмал или лактозу, измельчитель, например альгиновую кислоту, кукурузный крахмал и т.п.; скользящее вещество, например стеариновую кислоту, стеарат магния или Sterotex® (Stokely-Van Camp Inc., Indi[ana]polis, Indiana), вещество, облегчающее скольжение, в частности коллоидный диоксид кремния; подсластитель, например сахарозу или сахарин; и ароматизатор, например перечную мяту, метилсалицилат или фруктовый ароматизатор. Если единицей дозируемой формы является капсула, она также может содержать жидкий носитель, например полиэтиленгликоль или жирное масло. Используемые вещества должны быть фармацевтически чистыми и нетоксичными в применяемых количествах. При парентеральном введении соединения настоящего изобретения могут вводиться в инъекционных формах раствора или суспензии соединения в физиологически приемлемом разбавителе с фармацевтическим носителем, в качестве которого может выступать стерильная жидкость, например водно-масляная смесь, или без добавления поверхностно-активного вещества и других фармацевтически приемлемых наполнителей. Примерами масел, применяемых в препаратах, являются масла нефтяного, животного, растительного или синтетического происхождения, например арахисовое масло, соевое масло и минеральное масло. В общем случае, вода, физиологический раствор, водная декстроза и растворы подобных сахаров, этанол и гликоли, например пропиленгликоль, являются предпочтительными жидкими носителями, особенно для инъекционных растворов. Препарат для парентерального применения может быть расфасован в ампулы, одноразовые шприцы, а также дозирующие флаконы из инертного пластика или стекла. Растворы или суспензии, описанные выше, могут также включать одно или несколько следующих вспомогательных веществ: стерильные разбавители, например воду для инъекций, физиологический раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, например аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, например этилендиаминтетрауксусная кислота; буферы, например ацетаты, цитраты или фосфаты, а также агенты для регулирования изотоничности, например хлорид натрия или декстроза. Соединения настоящего изобретения могут предлагаться в форме кожных пластырей, инъекций с замедленным всасыванием или имплантируемого препарата, приготовляемого таким образом, чтобы обеспечить постоянное высвобождение активного ингредиента. Возможно прессование активного ингредиента в гранулы или небольшие цилиндры и подкожная или внутримышечная имплантация в форме инъекции с замедленным всасыванием или импланта. Для имплантов могут использоваться инертные материалы, например биоразрушаемые полимеры и синтетические силиконы. Подходящие фармацевтические носители и методы приготовления составов приводятся в стандартных пособиях, например Remington: The Science and Practice of Pharmacy, 19th edition, Volumes 1 and 2, 1995, Mack Publishing Co., Easton, Pennsylvania, U.S.A., которое в силу ссылки на него включается в настоящий документ. Для лечения различных заболеваний, расстройств и состояний, описанных в данном документе, подходящие дозы составляют от примерно 0,01 до примерно 250 мг/кг в день, предпочтительно от примерно 0,05 до примерно 100 мг/кг в день, а в особенности от примерно 0,05 до примерно 40 мг/кг в день. Соединения настоящего изобретения могут вводиться по схеме от 1 до 4 раз в день, что определяется характером заболевания, расстройства или состояния, лечение которого проводится. Ниже представлены схемы 1-3, иллюстрирующие получение соединений, составляющих предмет данного изобретения. В таблицах 1 и 2 приводятся соединения, которые могут быть синтезированы по схемам 1-3, а также биологические данные по ингибированию in vitro казеинкиназы I ПРИМЕРЫ Приведенные ниже примеры приводятся для более подробной иллюстрации изобретения, никоим образом не ограничивая масштабы изобретения. Общие методы синтеза Если не указано иначе, материалы были получены от коммерческих поставщиков и использовались без дополнительной очистки. Все реакции проводились в инертной атмосфере, например в азоте или аргоне, с безводными реагентами или растворителями. Во флэш-хроматографии использовался силикагель EM Science 60 (40-63 мм) с указанными в описании растворителями. Тонкослойная хроматография проводилась с использованием покрытых силикагелем 0,25-мм пластинок 60F-254 (EM) с проявлением в парах йода, под УФ-излучением или с помощью окрашивающего реагента, например раствора KMnO4. Инфракрасные (ИК) спектры записывались на спектрометре Nexus 670 FTIR (Nicolet); образцы были приготовлены в соответствии с описанием; измеренные значения приведены в виде волновых чисел (см-1). Спектры 1H ЯМР записывались на 500 МГц спектрометрах Varian Gemini и/или mercury 300, Unity 400, или Unity plus и/или Inova; химические сдвиги ( 3-Арилтиоиндолы и их аналоги Схема 1 а) K2CO3, MeOH; b) NH4OH/LiCl или NH3/MeOH/LiCl, или Me2NH/MeOH, или Me2NH/H2O; c) MeOH/H2O/NaOH, затем HCl; d) карбонилдиимидазол и NH4OH или карбонилдиимидазол и первичный или вторичный амин; e) NaH, DMF, R1-S-S-R1 Общий метод синтеза I (транс-этерификация; схема I, стадия а) Смешивают этилиндол-2-карбоксилат 1 (42,3 ммоль) в MeOH (50 мл), K2CO3 (1,20 экв., 50,7 ммоль) и перемешивают суспензию при температуре 55°C в течение 1 час. Реакцию контролируют по тсх (эфир/гептан) и по завершении реакционную смесь концентрируют в вакууме, разбавляют H2O и перемешивают в течение 15 мин. Твердое вещество отделяют фильтрацией, сушат при 65°C в течение 3 час, чтобы получить метилиндол-2-карбоксилат 2. Общий метод синтеза II (амидирование при помощи NH4OH; схема I, стадия b) Суспензию 1 или 2 (40,0 ммоль) в NH4OH (100 мл) и LiCl (1,0 экв.) перемешивают при комнатной температуре в течение 16 час. Твердое вещество отделяют от реакционной смеси, промывают H2O и сушат на воздухе, получая соответствующий первичный амид 4. Общий метод синтеза III (амидирование при помощи NH3/MeOH; схема I, стадия b) Перемешивают этилиндол-2-карбоксилат 1 (X=H, 4,67 ммоль) в 7N NH3/MeOH (20 мл) и добавляют LiCl (1,0 экв., 4,67 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 дней, контролируя реакцию по тсх (10% MeOH/CH2Cl2). Смесь концентрируют до минимального объема и разбавляют H2O, после чего твердое вещество отделяют фильтрацией. Осадок на фильтре промывают H2O и сушат в вакууме при 60°C, получая первичный амид 4 (X=R2=R3=H), тсх Rf (силикагель, 10% MeOH/CH2Cl2): 1 (X=H) 0,95, 2 (X=H) 0,93, 4 (X=R2=R3=H) 0,40. Общий метод синтеза IV (гидролиз метилового эфира 2 до карбоновой кислоты 3; схема I, стадия с) Добавляют NaOH (82,0 ммоль) в метилиндол-2-карбоксилат 2 (27,0 ммоль) в виде суспензии в MeOH/H2O (3:1, 160 мл). Перемешивают при комнатной температуре в течение 16 час, концентрируют и подкисляют HCl. Осадок отделяют фильтрацией, промывают H2O и сушат в вакууме, получая индол-2-карбоновую кислоту 3. Общий метод синтеза V (амидирование 2-индолкарбоновой кислоты 3; схема I, стадия d) К раствору индол-2-карбоновой кислоты 3 (31,0 ммоль) и безводного THF (50 мл) добавляют карбонилдиимидазол (1,10 экв., 5,5 г, 34,0 ммоль). Перемешивают в течение 1 час и в густую суспензию добавляют концентрированный NH4OH (50 мл) одной порцией. Перемешивают при комнатной температуре и через 16 час фильтрованием отделяют твердое вещество, промывают H2O и сушат в вакууме при 40°C, чтобы получить индол-2-карбоксамид 4 (R2=R3=H). Общий метод синтеза VIa (амидирование 2-индолкарбоновой кислоты 3 первичными или вторичными аминами; схема I, стадия d) В раствор индол-2-карбоновой кислоты 3 (12,4 ммоль) и безводного THF (30 мл) добавляют карбонилдиимидазол (1,5 экв., 18,6 ммоль) и перемешивают в течение 1 час. Затем добавляют амин (например, метиламин, пирролидин, пиперидин, пиперазин, бензиламин или морфолин (3,0 экв., 37,2 ммоль)) одной порцией и перемешивают реакционную смесь при комнатной температуре. Через 16 час гасят реакцию водой, фильтрацией собирают осадок, сушат в вакууме и получают N-замещенный-индол-2-карбоксамид 4. Общий метод синтеза VIb (амидирование этил- или метилиндол-2-карбоксилата первичными или вторичными аминами; схема I, стадия b) Этилиндол-2-карбоксилат 1 (X=H, 4,67 ммоль) или метилиндол-2-карбоксилат 2 (X=H, 4,67 ммоль) перемешивают в Me2NH/H2O (50 мл, 40%). Реакционную смесь перемешивают при комнатной температуре в течение 16 час, контролируя реакцию по тсх (10% MeOH/CH2Cl2). Смесь концентрируют до минимального объема, разбавляют H2O и твердое вещество отделяют фильтрованием. Осадок на фильтре промывают H2O, сушат в вакууме при 60°C и получают диметиламид 4 (X=H, R2=R3=Me), ТСХ Rf=0,65 (силикагель, 10% MeOH/CH2Cl2). Общий метод синтеза VIIa (3-арилтиоиндолы с использованием NaH; схема I, стадия e) В перемешиваемую суспензию NaH (60% дисперсии в масле, 1,2 экв., 9,8 ммоль) в DMF (75 мл) под N2 при комнатной температуре добавляют раствор индол-2-карбоксамида 4 (8,18 ммоль) в DMF (5 мл). Через 5 мин добавляют диарилдисульфид (1,0 экв., 8,18 ммоль) одной порцией и перемешивают реакцию при 95°C в течение 16 час. За реакцией наблюдают, разделяя на фракции между EtОAc/H2O и анализируя органическую фазу тонкослойной хроматографией на силикагеле с 10% MeOH/CH2Cl2. Концентрируют в вакууме, разбавляют H2O и перемешивают в течение 30 мин, фильтруют и сушат на воздухе. Неочищенное твердое вещество хроматографируют на силикагеле с элюированием смесью 9:1 CH2Cl2/MeOH и получают 3-арилтио-замещенный индол I. Общий метод синтеза VIIb (3-арилтиоиндолы с использованием Cs2CO3; схема I, стадия е) В раствор индол-2-карбоксамида (0,418 ммоль) и DMF (10 мл) добавляют Cs2CO3 (0,31 ммоль), а затем добавляют диарилдисульфид (0,65 ммоль). Реакционную смесь нагревают в атмосфере азота до 100°C примерно 2,5 час (наблюдая завершение реакции при помощи ТСХ/ЖХМС). Охлаждают до комнатной температуры, концентрируют до минимального объема и делят между солевым раствором и EtOAc (3 мл). Еще раз экстрагируют EtOAc, объединенные экстракты сушат (MgSO4), фильтруют, фильтрат концентрируют и получают неочищенный 3-арилтиоиндол-2-карбоксамид. Неочищенный продукт очищают на колонке ISCO (4,0 г SiO2) и получают 3-арилтиоиндол-2-карбоксамид I. Общий метод синтеза VIIc (схема 1, дополнительная стадия f) Раствор 3-арилтиондол-2-карбоксамида (1 ммоль) обрабатывают H2O2 (30% по весу, 2,5 ммоль) и Na2CO3 (2,0 ммоль). Перемешивают при комнатной температуре в течение 16 час, гасят водой, экстрагируют EtOAc, промывают соляным раствором, сушат (MgSO4), фильтруют, концентрируют и получают амид 3-арилсульфонил-1H-индол-2-карбоновой кислоты I. Амид 1H-индол-2-карбоновой кислоты 4 (X=H)(из этилового эфира) Этилиндол-2-карбоксилат 1 (X=H, 2,0 г, 10,57 ммоль) обрабатывают, как описано в общем методе синтеза II, и получают искомое соединение (1,3 г, 76,9%) в виде белого порошка цвета слоновой кости: т.пл. 233-234,5°C; 1H ЯМР (DMSO-d6) Амид 1H-индол-2-карбоновой кислоты 4 (X=H)(из индол-2-карбоновой кислоты) 1H-Индол-2-карбоновую кислоту 3 (X=H, 1,0 г, 6,2 ммоль) обрабатывают, как описано в общем методе синтеза V, и получают искомое соединение (854 мг, 86,0%) в виде порошка желтого цвета: т.пл. 233-234,5°C; 1H ЯМР (DMSO-d6) Аналитический расчет для C9H8N2O: C, 67,50; H, 5,03; N, 17,50. Найдено: C, 67,20; H, 4,95; N, 17,25. Амид 3-бензолсульфонил-5-хлор-1H-индол-2-карбоновой кислоты (Ia) Амид 3-фенилсульфанил-5-хлор-1H-индол-2-карбоновой кислоты (303 мг, 1,0 ммоль) обрабатывают H2O2, как описано в общем методе синтеза VIIc, и получают Ia (таблица 1) в виде твердого вещества белого цвета; МС набл. 336 (M+1). Амид 3-бензолсульфонил-1H-индол-2-карбоновой кислоты (Ib) Амид 3-фенилсульфанил-1H-индол-2-карбоновой кислоты (Ic, 268 мг, 1,0 ммоль) обрабатывают H2O2, как описано в общем методе синтеза VIIc, и получают Ib в виде твердого вещества белого цвета: т.пл. 204°C (разл.); 1H ЯМР (DMSO-d6) ЖХ/МС: m/z=301 (M+H). Амид 3-фенилсульфанил-1H-индол-2-карбоновой кислоты (Ic) Амид 1H-индол-2-карбоновой кислоты 4 (X=H, 320 мг, 2,0 ммоль) обрабатывают фенилдисульфидом (1,0 экв., 436 мг), как описано в общем методе синтеза VIIa, и получают искомое соединение (500 мг, 93,3%) в виде твердого вещества цвета слоновой кости, т.пл. 197-197,5°C. Аналитический расчет для C15H12N2SO: C, 67,15; H, 4,51; N, 10,44. Найдено: C, 66,03; H, 4,42; N, 10,18. Амид 5-бром-3-фенилсульфанил-1H-индол-2-карбоновой кислоты (Id) Этиловый эфир 5-бром-1H-индол-2-карбоновой кислоты 1 (X=Br, 4,67 ммоль) обрабатывают 7 N NH3/MeOH, как описано в общем методе синтеза III, и получают амид 5-бром-1H-индол-2-карбоновой кислоты 4 (X=Br, R2=R3=H) в виде твердого вещества цвета слоновой кости. Амид 5-бром-1H-индол-2-карбоновой кислоты (100 мг, 0,41 ммоль) обрабатывают дифенилдисульфидом (1,50 экв., 141 мг, 0,65 ммоль), как описано в общем методе синтеза VIIb, и получают искомое соединение Id (85 мг) в виде твердого вещества цвета слоновой кости. 1H ЯМР (DMSO-d6) ЖХ/МС: m/z набл.=347 (M+1). Амид 3-(2-аминофенилсульфанил)-5-метокси-1H-индол-2-карбоновой кислоты (Ie) 5-Метокси-1H-индол-2-карбоновую кислоту 1 (X=OCH3, 1,09 г, 5,71 ммоль) обрабатывают, как описано в общем методе синтеза V, и получают амид 5-метокси-1H-индол-2-карбоновой кислоты 4 (X=OCH3, R2=R3=H; 536 мг, 49%) в виде твердого вещества желтого цвета, т.пл. 204-205°C; 1H ЯМР (DMSO-d6) ЖХ/МС: m/z набл.=191 (M+1). Амид 5-метокси-1H-индол-2-карбоновой кислоты (300 мг, 1,6 ммоль) обрабатывают 2-аминофенилдисульфидом (1,4 экв., 546 мг, 2,2 ммоль), как описано в общем методе синтеза VIIa, и получают искомое соединение Ie (321 мг, 65%) в виде твердого вещества светло-зеленого цвета, т.пл. 203°C (разл.); 1H ЯМР (DMSO-d6) ЖХ/МС: m/z набл.=314 (M+1). Амид 3-(3-фторфенилсульфанил)-1H-индол-2-карбоновой кислоты (If) Амид 1H-индол-2-карбоновой кислоты 4 (X=R2=R3=H; 225 мг, 1,4 ммоль) обрабатывают бис-3-фторфенилдисульфидом (1,5 экв., 534 мг, 2,1 ммоль), как описано в общем методе синтеза VIIa, и получают искомое соединение If (322 мг, 80%) в виде твердого вещества белого цвета: тсх (силикагель) Rf=0,1 (40% EtOAc/гептан). Амид 3-(2-аминофенилсульфанил)-5-бром-1H-индол-2-карбоновой кислоты (Ig) Амид 5-бром-1H-индол-2-карбоновой кислоты 4 (X=Br, R2=R3=H; 100 мг, 0,418 ммоль) обрабатывают 2-аминофенилдисульфидом (1,5 экв., 161 мг, 0,65 ммоль), как описано в общем методе синтеза VIIb, и получают искомое соединение Ig (113 мг) в виде твердого вещества цвета слоновой кости. 1H ЯМР (DMSO-d6) ЖХ/МС: m/z набл.=361,99 (M+1). Амид 3-(2-аминофенилсульфанил)-1H-индол-2-карбоновой кислоты (Ih) Амид 1H-индол-2-карбоновой кислоты 4 (X=R2=R3=H; 160 мг, 1,0 ммоль) обрабатывают 2-аминофенилдисульфидом (1,4 экв., 347 мг, 1,4 ммоль), как описано в общем методе синтеза VIIa, и получают искомое соединение Ih (135 мг, 37%) в виде твердого вещества светло-зеленого цвета: 1H ЯМР (DMSO-d6) m/z набл.=284 (M+1). Амид 3-(пиридин-2-илсульфанил)-1H-индол-2-карбоновой кислоты (Ii) Амид 1H-индол-2-карбоновой кислоты 4 (X=R2=R3=H; 80,0 мг, 0,5 ммоль) обрабатывают 2,2′-дитиопиридином (1,0 экв., 0,5 ммоль), как описано в общем методе синтеза VIIa, и получают искомое соединение Ii (71,0 мг, 53%) в виде твердого вещества желто-коричневого цвета; МС набл. 270,2 (M+1). Метиламид 3-фенилсульфанил-1H-индол-2-карбоновой кислоты (Ij) К раствору 1H-индол-2-карбоновой кислоты 3 (X=H, 1,0 г, 6,21 ммоль) и безводного THF (50 мл) добавляют карбонилдиимидазол (1,10 экв., 1,1 г, 6,83 ммоль). Перемешивают в течение 30 мин при комнатной температуре, а затем добавляют MeNH2·HCl (1,30 экв., 541 мг, 8,07 ммоль) одной порцией. В реакционную смесь добавляют DMF (10 мл) и перемешивают при комнатной температуре. Через 2 час выливают чистый реакционный раствор желтого цвета в H2O. Осадок собирают фильтрованием, сушат в вакууме при 40°C и получают метиламид 1H-индол-2-карбоновой кислоты 4 (X=R2=H, R3=CH3; 860 мг, 80%) в виде твердого вещества желтого цвета, т.пл. 222-223°C; 1H ЯМР (DMSO-d6) m/z набл.=175 (M+1). Метиламид 1H-индол-2-карбоновой кислоты (174 мг, 1,0 ммоль) обрабатывают фенилдисульфидом (1,1 экв., 240 мг, 1,1 ммоль), как описано в общем методе синтеза VIIa, и получают искомое соединение Ij (140 мг, 50%) в виде твердого вещества цвета слоновой кости, т.пл. 201-204°C; 1H ЯМР (DMSO-d6) Метиламид 3-(пиридин-2-илсульфанил)-1H-индол-2-карбоновой кислоты (Ik) Метиламид 1H-индол-2-карбоновой кислоты 4 (X=R2=H, R3=CH3; 87 мг, 0,5 ммоль) обрабатывают 2,2′-дитиопиридином (1,3 экв., 143 мг), как описано в общем методе синтеза VIIa, и получают искомое соединение Ik (93,0 мг, 66%) в виде твердого вещества белого цвета: 1H ЯМР (DMSO-d6) МС набл. 362 (M+1). Синтез кислородных изостеров индола (Il-Iu) Схема 2 а) NaNO2, HOAc, СH2Cl2, комнатная температура, b) R1OH, Rh2(OАc)4, ClCH2CH2Cl, с) KOH, EtOH/H2O, d) Im2CO, THF, NH4OH. Этиловый эфир 3-диазо-3H-индол-2-карбоновой кислоты (5) (схема 2, стадия а) К раствору этилового эфира индол-2-карбоновой кислоты (1, X=H, 2,0 г, 10,6 ммоль) добавляют по каплям при перемешивании при комнатной температуре ледяную уксусную кислоту (6 мл) и нитрит натрия (7,3 г, 106 ммоль, 10 экв.) под N2 в CH2Cl2 (20 мл). Приблизительно через 10 мин добавляют CH2Cl2 (100 мл), чтобы облегчить перемешивание образовавшейся суспензии. Через 1,5 час реакцию гасят H2O, удаляют органический слой и экстрагируют водную фазу CH2Cl2. Объединенные органические фазы последовательно промывают насыщенным NaHCO3 и соляным раствором, сушат (MgSO4), фильтруют, концентрируют и после очистки получают 5 (1,62 г, 71%) в виде твердого вещества желтого цвета. (Kettle et al. Tetrahedron Lett. 2000, 6905-6907). Общий метод синтеза VIII (для реакции диазосоединения 5 со спиртами с образованием этиловых эфиров индолов 6; схема 2, стадия b) Проводят реакцию этилового эфира 3-диазо-3H-индол-2-карбоновой кислоты 5 (0,9 ммоль) с нужным ариловым или алкиловым спиртом (1,5 ммоль) в 1,2-дихлорэтане (10 мл) с каталитическим количеством Rh2(OAc)4 (0,08 экв., 0,072 ммоль, 32 мг) и нагревают при 85°C в течение 3 час. Реакционную смесь разбавляют CH2Cl2, фильтруют через Celite® (диатомовая земля), концентрируют и получают неочищенный продукт. Полученное вещество очищают флэш-хроматографией и получают искомые кислородные изостеры индола 6 в виде этиловых эфиров. Общий метод синтеза IX (гидролиз этиловых 2-индолкарбоксилатов 6l-u в карбоновые кислоты 7l-u; схема II, стадия с) К суспензии этилового эфира индол-2-карбоновой кислоты 6 (0,50 ммоль) в EtOH (10 мл) добавляют раствор KOH (5,0 экв., 2,5 ммоль, 140 мг) и H2O (2,0 мл). Перемешивают при комнатной температуре в течение 16 час, подкисляют (HCl) до pH 1, отделяют осадок фильтрацией и получают соответствующую карбоновую кислоту 7. Амид 3-фенокси-1H-индол-2-карбоновой кислоты (I1) Проводят реакцию этилового эфира 3-диазо-3H-индол-2-карбоновой кислоты 5 (300 мг, 1,38 ммоль) с фенолом (5,0 экв., 650 мг, 6,90 ммоль), как описано в общем методе синтеза VIII. Продукт очищают флэш-хроматографией и получают этиловый эфир 3-фенокси-1H-индол-2-карбоновой кислоты 6 (R1=фенил, 303 мг, 78%) в виде твердого вещества желтого цвета. Эфир карбоновой кислоты 7 (R1=фенил) гидролизуют согласно общему методу синтеза IX, а затем превращают карбоновую кислоту в соответствующий первичный амид, как описано в общем методе синтеза V, и получают искомое соединение I1 в виде твердого вещества светло-пурпурного цвета, ТСХ (силикагель) Rf=0,15. Амид 3-(4-метоксифенокси-1H-индол-2-карбоновой кислоты (Im) Проводят реакцию этилового эфира 3-диазо-3H-индол-2-карбоновой кислоты 5 (231 мг, 1,10 ммоль) с 4-метоксифенолом (1,4 экв., 186 мг, 1,5 ммоль), как описано в общем методе синтеза VIII, и получают этиловый эфир 3-(4-метоксифенокси-1H-индол-2-карбоновой кислоты 6 (R1=4-метоксифенил, 169 мг, 51%) в виде твердого вещества цвета слоновой кости. Эфир карбоновой кислоты 7 (R1=метоксифенил) гидролизуют согласно общему методу синтеза IX, а затем превращают карбоновую кислоту в соответствующий первичный амид, как описано в общем методе синтеза V, и получают искомое соединение Im в виде бесцветного маслянистого вещества, ТСХ (силикагель) Rf=0,10. Амид 3-(4-фторфенокси-1H-индол-2-карбоновой кислоты (In) Проводят реакцию этилового эфира 3-диазо-3H-индол-2-карбоновой кислоты 5 (220 мг, 1,0 ммоль) с 4-фторфенолом (10,0 экв., 1,1 мг, 10,0 ммоль), как описано в общем методе синтеза VIII, и получают этиловый эфир 3-(4-фторфенокси-1H-индол-2-карбоновой кислоты 6 (R1=4-фторфенил, 184 мг) в виде твердого вещества белого цвета. Эфир карбоновой кислоты 7 (R1=фторфенил) гидролизуют согласно общему методу синтеза IX, а затем превращают карбоновую кислоту в соответствующий первичный амид, как описано в общем методе синтеза V, и получают искомое соединение In в виде твердого вещества белого цвета (109 мг), ТСХ (силикагель) Rf=0,40. Амид 3-(2-фторфенокси-1H-индол-2-карбоновой кислоты (Io) Проводят реакцию этилового эфира 3-диазо-3H-индол-2-карбоновой кислоты 5 (220 мг, 1,0 ммоль) с 2-фторфенолом (10,0 экв., 1,1 мг, 10,0 ммоль), как описано в общем методе синтеза VIII, и получают этиловый эфир 3-(2-фторфенокси-1H-индол-2-карбоновой кислоты 6 (R1=2-фторфенил, 100 мг) в виде твердого вещества цвета слоновой кости. Эфир карбоновой кислоты 7 (R1=2-фторфенил) гидролизуют согласно общему методу синтеза IX, а затем превращают карбоновую кислоту в соответствующий первичный амид, как описано в общем методе синтеза V, и получают искомое соединение Io в виде твердого вещества белого цвета (59 мг), ТСХ (силикагель) Rf=0,07. Амид 3-(4-хлорфенокси)-1H-индол-2-карбоновой кислоты (Ip) Проводят реакцию этилового эфира 3-диазо-3H-индол-2-карбоновой кислоты 5 (220 мг, 1,0 ммоль) с 4-хлорфенолом (10,0 экв., 1,3 мг, 10,0 ммоль), как описано в общем методе синтеза VIII, и получают этиловый эфир 3-(4-хлорфенокси)-1H-индол-2-карбоновой кислоты 6 (R1=4-хлорфенил, 90 мг) в виде твердого вещества белого цвета. Эфир карбоновой кислоты 7 (R1=4-хлорфенил) гидролизуют согласно общему методу синтеза IX, а затем превращают карбоновую кислоту в соответствующий первичный амид, как описано в общем методе синтеза V, и получают искомое соединение Ip в виде твердого вещества цвета слоновой кости (50 мг), ТСХ (силикагель) Rf=0,09. Амид 3-метокси-1H-индол-2-карбоновой кислоты (Iq) Проводят реакцию этилового эфира 3-диазо-3H-индол-2-карбоновой кислоты 5 (300 мг, 1,38 ммоль) с метанолом (5,0 экв., 0,3 мг, 6,91 ммоль), как описано в общем методе синтеза VIII, и получают этиловый эфир 3-метокси-1H-индол-2-карбоновой кислоты 6 (R1=метил, 210 мг) в виде твердого вещества белого цвета [ТСХ (силикагель) Rf=0,50]. Эфир карбоновой кислоты 7 (R1=метил) гидролизуют согласно общему методу синтеза IX, а затем превращают карбоновую кислоту в соответствующий первичный амид, как описано в общем методе синтеза V, и получают искомое соединение Iq в виде твердого вещества желто-коричневого цвета (40 г), ТСХ (силикагель) Rf=0,03. Амид 3-этокси-1H-индол-2-карбоновой кислоты (Ir) Проводят реакцию этилового эфира 3-диазо-3H-индол-2-карбоновой кислоты 5 (300 мг, 1,38 ммоль) с этанолом (5,0 экв., 0,4 мг, 6,90 ммоль), как описано в общем методе синтеза VIII, и получают этиловый эфир 3-этокси-1H-индол-2-карбоновой кислоты 6 (R1=этил) в виде твердого вещества белого цвета. Эфир карбоновой кислоты 7 (R1=этил) гидролизуют согласно общему методу синтеза IX, а затем превращают карбоновую кислоту в соответствующий первичный амид, как описано в общем методе синтеза V, и получают искомое соединение Ir в виде твердого вещества желто-коричневого цвета (124 мг), ТСХ (силикагель) Rf=0,07. Амид 3-изопропокси-1H-индол-2-карбоновой кислоты (Is) Проводят реакцию этилового эфира 3-диазо-3H-индол-2-карбоновой кислоты 5 (300 мг, 1,38 ммоль) с изопропанолом (5,0 экв., 0,53 мг, 6,90 ммоль), как описано в общем методе синтеза VIII, и получают этиловый эфир 3-изопропокси-1H-индол-2-карбоновой кислоты 6 (R1=изопропил) в виде твердого вещества белого цвета (33 мг); ТСХ (силикагель) Rf=0,45. Эфир карбоновой кислоты 7 (R1=изопропил) гидролизуют согласно общему методу синтеза IX, а затем превращают карбоновую кислоту в соответствующий первичный амид, как описано в общем методе синтеза V, и получают искомое соединение Is в виде твердого вещества желто-коричневого цвета (126 мг), ТСХ (силикагель) Rf=0,10. Амид 3-трет-бутокси-1H-индол-2-карбоновой кислоты (It) Проводят реакцию этилового эфира 3-диазо-3H-индол-2-карбоновой кислоты 5 (220 мг, 1,0 ммоль) с t-BuOH (10,0 экв., 0,95 мг, 10,0 ммоль), как описано в общем методе синтеза VIII, и получают этиловый эфир 3-трет-бутокси-1H-индол-2-карбоновой кислоты 6 (R1=трет-бутил, 149 мг) в виде твердого вещества белого цвета. Эфир карбоновой кислоты 7 (R1=трет-бутил) гидролизуют согласно общему методу синтеза IX, а затем превращают карбоновую кислоту в соответствующий первичный амид, как описано в общем методе синтеза V, и получают искомое соединение It в виде твердого вещества светло-зеленого цвета (39 мг), ТСХ (силикагель) Rf=0,09. Амид 3-бензилокси-1H-индол-2-карбоновой кислоты (Iu) Проводят реакцию этилового эфира 3-диазо-3H-индол-2-карбоновой кислоты 5 (305 мг, 1,4 ммоль) с бензиловым спиртом (5,0 экв., 0,73 мг, 7,05 ммоль), как описано в общем методе синтеза VIII, и получают этиловый эфир 3-бензилокси-1H-индол-2-карбоновой кислоты 6 (R1=бензил) в виде твердого вещества белого цвета [МС набл.=296 (M+1)]. Эфир карбоновой кислоты 7 (R1=бензил) гидролизуют согласно общему методу синтеза IX, а затем превращают карбоновую кислоту в соответствующий первичный амид, как описано в общем методе синтеза V, и получают искомое соединение Iu в виде твердого вещества желто-коричневого цвета (115 мг), ТСХ (силикагель) Rf=0,1. Синтез вторичных амидов Iv-Iai Схема 3 R4=4-морфолино, 1-пиперидинил, 1-пирролидинил, 4-(трет-бутоксикарбонил)пиперазин-1-ил или 4-пиперазин-1-ил a) карбонилдиимидазол/THF и морфолин, пиперидин, пирролидин или N-(трет-бутоксикарбонил)пиперазин; b) NaH/DMF/R1-S-S-R1; c) CF3CO2H/HOAC для удаления защитной группы t-Boc в тех случаях, когда она вводилась; d) H2O2. (3-Бензолсульфонил-5-хлор-1H-индол-2-ил)морфолин-4-илметанон (Iv) 5-Хлор-(1H-индол-2-ил)морфолин-4-илметанон 8 (X=Cl, R4=морфолин-4-ил) обрабатывают фенилдисульфидом, как описано в общем методе синтеза VIIa, и получают 3-фенилсульфанил-5-хлор-1H-индол-2-ил)морфолин-4-илметанон. 3-фенилсульфанил-5-хлор-1H-индол-2-ил)морфолин-4-илметанон обрабатывают H2O2 (30% вес/об., 2,5 ммоль), как описано в общем методе синтеза VIIc, и получают искомое соединение Iv в виде твердого вещества белого цвета. (5-Фтор-3-п-толилсульфанил-1H-индол-2-ил)пирролидин-1-илметанон (Iw) 5-Фтор-1H-индол-2-карбоновую кислоту 3 (X=F, 516 мг, 3,0 ммоль) обрабатывают пирролидином (3,0 экв., 0,76 мл, 9,0 ммоль), как описано в общем методе синтеза VIa, и получают 5-фтор-1H-индол-2-илпирролидин-1-илметанон 8 (X=F, R4=пирролидин-1-ил; 620 мг, 89%) в виде твердого вещества белого цвета, т.пл. 254-255°C. 1H ЯМР (DMSO-d6) 5-Фтор-1H-индол-2-илпирролидин-1-илметанон (327 мг, 2,0 ммоль) обрабатывают пара-толилдисульфидом (450 мг, 2,6 ммоль, 1,3 экв.), как описано в общем методе синтеза VIIa, и получают искомое соединение Iw (334 мг, 47%) в виде аморфного твердого вещества белого цвета: 1H ЯМР (DMSO-d6) m/z=355 (M+1). (3-Фенилсульфанил-1H-индол-2-ил)пиперидин-1-илметанон (Ix) 1H-индол-2-карбоновую кислоту 3 (X=H, 750 мг, 4,66 ммоль) обрабатывают пиперидином (3,0 экв., 1,4 мл, 13,98 ммоль), как описано в общем методе синтеза VIa, и получают 1H-индол-2-илпиперидин-1-илметанон 8 (X=H, R4=пиперидин-1-ил; 979 мг, 92%) в виде твердого вещества белого цвета, т.пл. 161-162°C. 1H ЯМР (DMSO-d6) 1H-индол-2-илпиперидин-1-илметанон (456 мг, 2,0 ммоль) обрабатывают фенилдисульфидом (480 мг, 2,2 ммоль), как описано в общем методе синтеза VIIa, и получают искомое соединение Ix (440 мг, 65%) в виде непрозрачного маслянистого вещества. 1H ЯМР (DMSO-d6) m/z=337 (M+1). (5-Фтор-3-фенилсульфанил-1H-индол-2-ил)пирролидин-1-илметанон (Iy) 5-Фтор-1H-индол-2-карбоновую кислоту 3 (X=F, 516 мг, 3,0 ммоль) обрабатывают пирролидином (3,0 экв., 0,76 мл, 9,0 ммоль), как описано в общем методе синтеза VIa, и получают 5-фтор-1H-индол-2-илпирролидин-1-илметанон 8 (X=F, R4=пирролидин-1-ил; 620 мг, 89%) в виде твердого вещества белого цвета, т.пл. 254-255°C. 1H ЯМР (DMSO-d6) (5-Фтор-1H-индол-2-ил)пирролидин-1-илметанон (200 мг, 0,86 ммоль) обрабатывают фенилдисульфидом (1,5 экв., 281 мг, 1,29 ммоль), как описано в общем методе синтеза VIIa, и получают искомое соединение Iy (220 мг, 75%) в виде твердого вещества бледно-желтого цвета, т.пл. 184-186°C. 1H ЯМР (DMSO-d6) m/z=341 (M+1). [3-(2-Аминофенилсульфанил)-1H-индол-2-ил]пирролидин-1-илметанон (Iz) 1H-индол-2-карбоновую кислоту 3 (X=H, 2,0 г, 12,4 ммоль) обрабатывают пирролидином (3,0 экв., 3,1 мл, 37,2 ммоль), как описано в общем методе синтеза VIa, и получают 1H-индол-2-илпирролидин-1-илметанон 8 (X=H, R4=пирролидин-1-ил; 2,46 г, 93%) в виде твердого вещества белого цвета, т.пл. 213-214°C. 1H ЯМР (DMSO-d6) 1H-индол-2-илпирролидин-1-илметанон (428 мг, 2,0 ммоль) обрабатывают 2-аминофенилдисульфидом (1,4 экв., 694 мг, 2,8 ммоль), как описано в общем методе синтеза VIIa, и получают искомое соединение Iz (468 мг, 69%) в виде твердого вещества белого цвета: 1H ЯМР (DMSO-d6) m/z=338 (M+1). Гидрохлорид [3-(2-аминофенилсульфанил)-1H-индол-2-ил]пирролидин-1-илметанона (Iaa) Перемешивают [3-(2-аминофенилсульфанил)-1H-индол-2-ил]пирролидин-1-илметанон (Iz, 60 мг) в Et2O (5 мл) с 1N HCl (1 мл) и отделяют осадок фильтрованием. Осадок на фильтре промывают Et2O, сушат и получают искомое соединение Iaa (48 мг) в виде твердого вещества белого цвета, т.пл. 154-155°C; m/z=338 (M+1). [3-(2-Аминофенилсульфанил)-1H-индол-2-ил]пиперидин-1-илметанон (Iab) 1H-индол-2-карбоновую кислоту 3 (X=H, 750 мг, 4,66 ммоль) обрабатывают пиперидином (3,0 экв., 1,4 мл, 13,98 ммоль), как описано в общем методе синтеза VIa, и получают 1H-индол-2-илпиперидин-1-илметанон 8 (X=H, R4=пиперидин-1-ил; 979 мг, 92%) в виде твердого вещества белого цвета. 1H-индол-2-илпиперидин-1-илметанон (116 мг, 0,51 ммоль) обрабатывают 2-аминофенилдисульфидом (347 мг, 1,4 экв.), как описано в общем методе синтеза VIIa, и получают искомое соединение Iab (103 мг, 29%) в виде желто-коричневого твердого вещества, m/z=352 (M+1). [3-(2-Аминофенилсульфанил)-5-фтор-1H-индол-2-ил]пиперидин-1-илметанон (Iac) 5-Фтор-1H-индол-2-карбоновую кислоту 3 (X=F, 1,7 г, 9,5 ммоль) обрабатывают пиперидином, как описано в общем методе синтеза VIa, и получают 5-фтор-1H-индол-2-илпиперидин-1-илметанон 8 (X=F, R4=пиперидин-1-ил; 2,3 г, 100%) в виде твердого вещества белого цвета. 1H ЯМР (DMSO-d6) 5-Фтор-1H-индол-2-илпиперидин-1-илметанон (125 мг, 0,51 ммоль) обрабатывают 2-аминофенилдисульфидом (347 мг, 1,4 экв.), как описано в общем методе синтеза VIIa, и получают искомое соединение Iac (92 мг, 25%) в виде твердого вещества цвета слоновой кости; m/z=369 (M+1). [5-Фтор-3-(пара-толуол-4-сульфинил)-1H-индол-2-ил]пирролидин-1-илметанон (Iad) Соединение 1w (100 мг, 0,28 ммоль) обрабатывают H2O2 (5 мл) в MeCN (5 мл) и Na2CO3 (50 мг) и получают искомое соединение Iad (10 мг) в виде твердого вещества белого цвета. 1H ЯМР (DMSO-d6) m/z=371 (M+1). Гидрохлорид (3-фенилсульфанил-1H-индол-2-ил)пиперазин-1-илметанона (1ae) 1H-индол-2-карбоновую кислоту 3 (X=H, 1,0 мг, 6,21 ммоль) обрабатывают N-(трет-бутоксикарбонил)пиперазином (1,10 экв., 1,3 г, 6,83 ммоль), как описано в общем методе синтеза VIa, и получают трет-бутиловый эфир 4-(1H-индол-2-карбонил)пиперазин-1-карбоновой кислоты 8 (X=H, R4=трет-бутиловый эфир пиперазин-4-ил-1-карбоновой кислоты; 2,0 г, 99%) в виде твердого вещества белого цвета, т.пл. 205-206°C. 1H ЯМР (DMSO-d6) m/z=330 (M+1). Трет-бутиловый эфир 4-(1H-индол-2-карбонил)пиперазин-1-карбоновой кислоты (329 г, 1,0 ммоль) обрабатывают фенилдисульфидом (283 мг, 1,3 экв., 1,3 ммоль), как описано в общем методе синтеза VIIa, затем обрабатывают трифторуксусной кислотой (4 мл) в HOAc, чтобы удалить защитную Boc-группу, и получают (3-фенилсульфанил-1H-индол-2-ил)пиперазин-1-илметанон. (3-Фенилсульфанил-1H-индол-2-ил)пиперазин-1-илметанон растворяют в EtOAc, обрабатывают 1N HCl/Et2O и получают искомое соединение Iae (103 мг, 29%) в виде твердого вещества желто-коричневого цвета, т.пл. 240°C (разл.); m/z=338 (M+1). [5-Фтор-3-(пиридин-2-илсульфанил)-1H-индол-2-ил]пирролидин-1-илметанон (Iaf) 5-Фтор-1H-индол-2-карбоновую кислоту 3 (X=F, 516 мг, 3,0 ммоль) обрабатывают пирролидином (3,0 экв., 0,76 мл, 9,0 ммоль), как описано в общем методе синтеза VIa, и получают 5-фтор-1H-индол-2-илпирролидин-1-илметанон 8 (X=F, R4=пирролидин-1-ил; 620 мг, 89%) в виде твердого вещества белого цвета, т.пл. 254-255°C. 1H ЯМР (DMSO-d6) 5-Фтор-1H-индол-2-илпирролидин-1-илметанон (464 мг, 2,0 ммоль) обрабатывают 2,2′-дитиопиридином (220 мг, 2,6 ммоль, 1,3 экв.), как описано в общем методе синтеза VIIa, и получают искомое соединение Iaf (258 мг, 38%) в виде твердого вещества белого цвета: т.пл. 204-206°C. 1H ЯМР (DMSO-d6) m/z=355 (M+1). [3-(Пиридин-2-илсульфанил)-1H-индол-2-ил]пирролидин-1-илметанон (Iag) 1H-индол-2-карбоновую кислоту 3 (X=H, 2,0 г, 12,4 ммоль) обрабатывают пирролидином (3,0 экв., 3,1 мл, 37,2 ммоль), как описано в общем методе синтеза VIa, и получают 1H-индол-2-илпирролидин-1-илметанон 8 (X=H, R4=пирролидин-1-ил; 2,46 г, 93%) в виде твердого вещества белого цвета, т.пл. 213-214°C. 1H ЯМР (DMSO-d6) 1H-индол-2-илпирролидин-1-илметанон (214 мг, 1,0 ммоль) обрабатывают 2,2′-дитиопиридином (1,3 экв., 286 мг, 1,3 ммоль), как описано в общем методе синтеза VIIa, и получают искомое соединение Iag (200 мг, 69%) в виде твердого вещества бледно-желтого цвета, т.пл. 211-213°C. 1H ЯМР (DMSO-d6) Пиперидин-1-ил-[3-(пиридин-2-илсульфанил)-1H-индол-2-ил]метанон (Iah) 1H-индол-2-карбоновую кислоту 3 (X=H, 750 мг, 4,66 ммоль) обрабатывают пиперидином (3,0 экв., 1,4 мл, 13,98 ммоль), как описано в общем методе синтеза VIa, и получают 1H-индол-2-илпиперидин-1-илметанон 8 (X=H, R4=пиперидин-1-ил; 979 мг, 92%) в виде твердого вещества белого цвета. 1H-индол-2-илпиперидин-1-илметанон (114 мг, 0,50 ммоль) обрабатывают 2,2′-дитиопиридином (1,3 экв., 143 мг), как описано в общем методе синтеза VIIa, и получают искомое соединение Iah (117 мг, 69%) в виде твердого вещества желто-коричневого цвета; m/z=338 (M+1). [5-Фтор-3-(пиридин-2-илсульфанил)-1H-индол-2-ил]пиперидин-1-илметанон (Iai) 5-Фтор-1H-индол-2-карбоновую кислоту 3 (X=F, 1,7 г, 9,5 ммоль) обрабатывают пиперидином, как описано в общем методе синтеза VIa, и получают 5-фтор-1H-индол-2-илпиперидин-1-илметанон 8 (X=F, R4=пиперидин-1-ил; 2,3 г, 100%) в виде твердого вещества белого цвета. 1H ЯМР (DMSO-d6) 5-Фтор-1H-индол-2-илпиперидин-1-илметанон (123 мг, 0,50 ммоль) обрабатывают 2,2′-дитиопиридином (1,3 экв., 143 мг), как описано в общем методе синтеза VIIa, и получают искомое соединение Iai (120 мг, 68%) в виде твердого вещества желтого цвета, m/z=356 (M+1).
Биологические методы Анализ фильтрации казеинкиназы эпсилон 33P-АТФ для скрининга ингибиторов CK1 Цель: В ходе данного анализа измеряется способность соединений ингибировать фосфорилирование субстрата казеина ферментом казеинкиназой 1 Материалы: Оборудование: Лабораторный робот для жидкостей Beckman Biomek 2000 Автоматизированная 96-канальная пипетка Beckman Multimek 96 Вакуумный коллектор Millipore базовый комплект # MAVM0960R Дозатор жидкостей Titertek Multidrop Жидкостной сцинтилляционный счетчик Packard TopCount NXT Планшеты: Планшета Costar EIA/RIA #9018 Полистирольная планшета с 96 ячейками и U-образным дном Falcon #353910 Фильтрационные планшеты с 96 ячейками Millipore Multiscreen #MAPHNOB50 Адаптерные планшеты Millipore Multiscreen TopCount #SE3M203V6 Химические реактивы: EGTA, поставщик SIGMA #E-3889 Казеин (дефосфорилированный), поставщик SIGMA #C-4032 АТФ, поставщик SIGMA #A-7699 DTT, поставщик Fisher Biotech #BP1725 Трихлоруксусная кислота, поставщик SIGMA #T-6399
Ферменты: Казеинкиназа 1 Соединения: Соединения для анализа поставляются в виде замороженного исходного раствора с концентрацией 10 мМ в 100% ДМСО. Условия анализа: Конечный полный анализируемый объем на ячейку равен 50 мкл; состав готовится следующим образом: 5 мкл разбавленного исходного раствора соединения (10, 1, 0,1, 0,01 или 0,001 мкM), 5 мкл дефосфорилированного казеина с конечной концентрацией 0,2 мкг/мкл, 20 мкл CK1 20 мкл Методология: 1. Готовят 500 мл свежего аналитического буфера: 50 мM Tris, pH 7,5, 10 мM MgCl2, 2 мM DTT и 1 мM EGTA. 2. Соединения для анализа готовят, растворяя 10 мкл 10 мM исходного раствора в 100% ДМСО. С помощью робота для жидкостей Biomek 2000 готовят последовательные разбавления, чтобы получить конечные разбавления вещества 10, 1, 0,1, 0,01 и 0,001 мкM, добавляемые по 5 мкл в планшеты с U-образным дном Falcon. Обычно тестируют 8 соединений на одну 96-луночную планшету, причем столбцы 1 и 12 используются для контрольных ячеек. Стандартный скрининговый анализ будет включать 32 соединения, что соответствует 4 аналитическим планшетам. 3. Карты аналитических планшет составляются в соответствии со следующей структурой CK1 4. Добавляют 5 мкл соединения в соответствии с указанием, затем добавляют 5 мкл дефосфорилированного казеина (растворенного в дистиллированной H2О) (0,2 мкг/мкл) и 20 мкл CK1 5. В конце добавляют 20 мкл 6. Встряхивают аналитическую планшету Falcon с U-образным дном, содержащую указанные 50 мкл реакционного объема, а затем инкубируют при комнатной температуре в течение 2 час. 7. Через 2 час реакцию останавливают добавлением 65 мкл ледяной 2 мМ нерадиоактивной АТФ (приготовленной в аналитическом буфере) в аналитические планшеты с помощью Beckman Multimek. 8. Одновременно добавляют 25 мкл 100% ледяной TCA (трихлоруксусной кислоты), растворенной в дистиллированной H2O, в соответствующее число фильтрационных планшет Millipore MAPH. 9. С помощью ручного 8-канального дозатора переносят 100 мкл реакционной смеси из планшеты Falcon с U-образным дном в фильтрационные планшеты Millipore MAPH, предварительно обработанные TCA. 10. Осторожно перемешивают фильтрационные планшеты Millipore MAPH и оставляют при комнатной температуре по крайней мере на 30 мин для осаждения белков. 11. Через 30 минут фильтрационные планшеты помещают в вакуумный коллектор Millipore и фильтруют при давлении не выше 8 мм рт.ст., поскольку при более высоком вакууме в фильтрах MAPH возникает воздушная пробка. 12. Фильтрационные планшеты последовательно промывают и фильтруют 2×150 мкл 20% TCA, 2×150 мкл 10% TCA и 2×150 мкл 5% TCA (всего 6 промывок на планшету/900 мкл на ячейку). 13. Планшеты высушивают в течение ночи при комнатной температуре. На следующий день добавляют 40 мкл сцинтилляционной жидкости Packard Microscint-20 на ячейку с помощью дозатора Titertek Multidrop; запечатывают планшеты и ведут счет в течение 2 минут на ячейку на сцинтилляционном счетчике Packard Topcount NXT (фиксируют значения счетов в минуту на ячейку). Расчеты: 1. Регистрируют и заносят данные счетов в минуту в специализированную базу расчета и архивации данных (Activity Base, поставляемая IDBS, версия 5.0). 2. Столбец 1 в каждой планшете отражает общую активность фосфорилирования фермента в отсутствии любого ингибирующего соединения, а потому соответствует 100%. Колонка 12 отражает любую неспецифическую активность фосфорилирования/остаточную радиоактивность в отсутствии ингибирующего соединения и фермента. Как правило, наблюдается примерно 1% от полного числа счетов в минуту, которые являются неспецифическими. 3. Определяя «полное» и «неспецифическое» число счетов в минуту для каждой планшеты, можно установить % ингибирования способности фермента фосфорилировать субстрат при каждой концентрации тестового соединения. Такой % данных ингибирования используют для расчета величины IC50 (концентрация, при которой соединение в состоянии ингибировать активность фермента на 50%) для соединения, используя программу моделирования нелинейных зависимостей, включенную в протокол расчетов Activitybase (DG0027-CK1-D-BL) (Проект: RESR0290). 4. Кинетические исследования в данной аналитической системе показали, что значение Km для АТФ составляет 21 мкM. Анализ активности казеинкиназы 1 Цель: Оценка тестовых соединений для активности CKI Материалы и реактивы HEPES Sigma # H3375 м.в.=238,3; Буфер для киназы (КВ, 100 мл) готовится следующим образом:
Основную смесь АТФ готовят следующим образом: готовят 1 мл 1М раствора АТФ в воде (1 М исходный раствор АТФ). К 12 мл буфера для киназы (КВ): добавляют 12 мкл 1M раствора АТФ, затем добавляют 12 мкл 33P-АТФ (10 мкКи/мкл), NEG602H, Perkin Elmer Готовят реакционную планшету и проводят анализ следующим образом: 1. добавляют 10 мкл KB на ячейку вместе с тестовым ингибирующим соединением или без него в ячейки реакционной планшеты; 2. добавляют 60 мкл KB на ячейку; 3. добавляют 10 мкл 500 мкM пептидного субстрата на ячейку; 4. доводят температуру планшеты до 37°C; 5. добавляют 10 мкл разбавленной 1:10 CK1 6. инициируют реакцию добавлением 10 мкл основной смеси АТФ на ячейку; 7. помещают реакционную планшету в инкубатор при 37°C на 10 мин; 8. останавливают реакцию 10 мкл 1M АТФ. Переносят 20 мкл в планшету SAM и выдерживают 10 мин при комнатной температуре; 9. трижды промывают 100 мкл 2M раствором NaCl, затем три раза 100 мкл 2M NaCl и 1% H3PO4 и три раза 100 мкл воды на вакуумном коллекторе; 10. сушат фильтрационную планшету под лампой в течение 30 мин; 11. герметизируют дно планшеты и добавляют 20 мкл MicroScint 20; 12. считывают с помощью TOPCOUNT. Экспериментальная методика клеточного анализа циркадного ритма Клеточная культура: Наносят культуры фибробластов Mper1-luc Rat-1 (P2C4) каждые 3-4 дня (конфлюентность ~10-20%) на 150 см2 вентилируемые полистирольные культуральные колбы (Falcon # 35-5001) и выдерживают в культуральной среде [EMEM (Cellgro #10-010-CV); 10% фетальной бычьей сыворотки (FBS; Gibco #16000-044); и 50 ед. акт./мл пенициллин-стрептомицина (Cellgro #30-001-C1)] при 37°C и 5% CO2. Стабильная трансфекция: Проводят совместную трансфекцию культур фибробластов с конфлюентностью 30-50% вместе с векторами, содержащими селективный маркер на устойчивость к зеоцину для стабильной трансфекции и промотируемый репортерный ген люциферазы mPer-1. Через 24-48 час культуры переносят на 96-луночные планшеты и выдерживают в культуральной среде с добавлением 50-100 мкг/мл зеоцина (Invitrogen #45-0430) в течение 10-14 дней. Оценивают репортерную экспрессию устойчивых к зеоцину стабильных трансфектантов добавлением в культуральную среду 100 мкM люциферина (Promega #E1603) и анализом активности люциферазы на сцинтилляционном счетчике TopCount (Packard Model #C384V00). Синхронизируют клоны Rat-1, демонcтрирующие устойчивость к зеоцину и активность люциферазы, определяемую mPer1, посредством анафилактического шока, добавляя 50% лошадиной сыворотки [HS (Gibco #16050-122)] и оценивая активность циркадного репортера. Для тестирования соединений выбирают фибробласты Mper1-luc Rat-1 клона P2C4. Протокол синхронизации: Переносят фибробласты Mper1-luc Rat-1 (P2C4) (конфлюентность 40-50%) на непрозрачные 96-луночные культуральные планшеты (PerkinElmer #6005680) и выдерживают в культуральной среде с добавлением 100 мкг/мл зеоцина (Invitrogen #45-0430) до тех пор, пока культуры не достигнут 100% конфлюентности (48-72 час). Синхронизуют культуры с помощью 100 мкл синхронизирующей среды [EMEM (Cellgro #10-010-CV); 100 ед. акт./мл пенициллина-стрептомицина (Cellgro #30-001-C1); 50% HS (Gibco #16050-122)] в течение 2 час при 37°C и 5% CO2. После синхронизации культуры промывают 100 мкл EMEM (Cellgro #10-010-CV) в течение 10 мин при комнатной температуре. После промывания заменяют среду 300 мкл CO2-независимой средой [CO2I (Gibco #18045-088); 2 мM L-глутамина (Cellgro #25-005-C1); 100 ед. акт./мл пенициллина-стрептомицина (Cellgro #30-001-C1); 100 мкM люциферина (Promega #E1603)]. Добавляют соединения, тестируемые на предмет циркадного эффекта, к CO2-независимой среде в 0,3% DMSO (конечная концентрация). Сразу же запечатывают культуры пленкой TopSeal-A (Packard #6005185) и переносят для измерения активности люциферазы. Автоматизированные измерения циркадного репортера: После синхронизации хранят аналитические планшеты при 37oC в инкубаторе тканевых культур (Forma Scientific Model #3914). Оценивают активность люциферазы in vivo, измеряя относительный выход света по сцинтилляционному счетчику TopCount (Packard Model #C384V00). Переносят планшеты из инкубатора в считыватель с помощью роботизированного манипулятора ORCA (Beckman Instruments) и программного обеспечения автоматизированного регламента SAMI-NT (версия 3.3; SAGIAN/Beckman Instruments). Анализ данных: Используют Microsoft Excel и XLfit (версия 2.0.9; IDBS) для импорта, обработки и графического отображения данных. Проводят анализ периодов либо путем определения интервала между соответствующими минимумами выхода света в течение нескольких дней, либо посредством преобразования Фурье. Оба метода позволяют получить практически одинаковые оценки периода для всего диапазона циркадных периодов. Приводят активность как EC Анализ циркадного цикла крыс Данный анализ позволяет оценить воздействие тестового соединения на циркадный цикл in vivo. Исследование предполагает использование самцов крыс линии Wistar (Charles River) с начальной массой тела 200-250 г. Прежде чем приступить к тестированию в контролируемой среде, каждое животное размещают индивидуально, после чего поддерживают термонейтральную температуру окружающей среды в пределах 24-28°C в течение 12/12 час цикла день/ночь (с включением света в 06:00 час) и дают неограниченное количество стандартного лабораторного корма и воды. Каждой крысе имплантируют внутрибрюшинный биотелеметрический передатчик (Minnimitter-VMFH, серия 4000, Sunriver, OR) для мониторинга базовой температуры тела и общей активности. Каждый передатчик имплантируют в соответствии с рекомендациями изготовителя под общим наркозом кетамин/ксилазин (78/13 мг кг-1, внутрибрюшинно) и дают животным восстановиться в течение 7-10 дней. Для определения внутреннего циркадного цикла каждой особи после периода восстановления животных переводят на постоянный ночной цикл (цикл 0/24 час, день/ночь) и дают животным возможность свободно перемещаться в течение 7-10 дней до введения тестового соединения. В соответствии со схемой дозирования животные получают либо носитель, либо соединение (внутрибрюшинно, подкожно или перорально) в конкретные моменты ЦВ (цикрадного времени) в течение 48-часового периода. После реализации схемы дозирования за животными устанавливается наблюдение в течение 5-7 дней при постоянном ночном цикле (0/24-часовой цикл день/ночь). Для каждого эксперимента регистрируют брюшную температуру и данные по общей активности через 5-минутные интервалы. Для анализа используют программное обеспечение VitalView и Actiview, поставляемые Minimitter. Строят график регистрируемых брюшинных температур, получаемых для каждой крысы в первый день на горизонтальной линии. Совмещают линию наблюдаемых брюшинных температур с абсциссой циркадного времени (ось х). Откладывают регистрируемые брюшинные температуры для каждого последующего дня как отдельные линии аналогичным образом, чтобы получить ординату (ось y, дни). Соединяют начальный рост базовой температуры тела, который наблюдается ежедневно, прямой линией, что позволяет использовать сразу несколько дней для оценки циркадной фазы в любой заданный день для любой отдельно взятой крысы. Определяют влияние введения препарата на фазу, проводя прямую линию через несколько дней для оценки фазы до и после введения дозы. Лечение активным соединением будет вызывать более заметное смещение между прямой линией, соединяющей ежедневный начальный рост базовой температуры тела до введения соединения, и прямой линией, соединяющей начальный рост базовой температуры тела после введения соединения, относительно линий контрольного введения носителя до и после введения. Для опытных животных вычисляют разницу между такими фазами, экстраполированную на день до введения. Используют тест ANOVA наряду с t-критерием Стьюдента, для того чтобы сравнить циркадные сдвиги средней температуры тела в минутах между группами.
* Обозначает среднее по двум или более измерениям; соединения Iv-Iai: концентрация ингибирования CKI
Формула изобретения
1. Применение соединения формулы I или стереоизомера, энантиомера, рацемата или таутомера указанного соединения или их фармацевтически приемлемой соли для производства лекарственного средства, ингибирующего активность казеинкиназы I 2. Применение по п.1, в котором медикамент пригоден для лечения заболеваний и расстройств, ассоциированных с ингибированием активности казеинкиназы I 3. Применение по п.2, в котором рассматриваемое лечение приводит к удлинению периода циркадного ритма. 4. Применение по п.2, в котором заболевание или расстройство представляет собой нарушение настроения или нарушение сна. 5. Применение по п.4, в котором расстройство представляет собой нарушение настроения. 6. Применение по п.5, в котором нарушение настроения выбирается из группы, включающей депрессивное расстройство или биполярное расстройство. 7. Применение по п.6, в котором депрессивное расстройство представляет собой значительное депрессивное расстройство. 8. Применение по п.6, где биполярное расстройство выбирают из группы, включающей биполярное расстройство I типа и биполярное расстройство II типа. 9. Применение по п.4, в котором расстройство представляет собой нарушение сна. 10. Применение по п.9, в котором нарушение сна представляет собой расстройство сна, связанное с циркадным ритмом. 11. Применение по п.10, в котором расстройство сна, связанное с циркадным ритмом, выбирается из группы, включающей нарушение сна при посменной работе, синдром десинхроноза при перелетах, синдром преждевременной фазы сна и синдром задержки фазы сна. 12. Применение соединения для производства лекарственного средства по п.1, где соединение формулы (I) имеет следующие значения радикалов: 13. Применение соединения для производства лекарственного средства по п.12, где соединение формулы (I) имеет следующие значения радикалов: 14. Применение соединения для производства лекарственного средства по п.13, где соединение формулы (I) выбирается из группы, включающей амид 3-бензолсульфонил-5-хлор-1Н-индол-2-карбоновой кислоты и амид 3-бензолсульфонил-1Н-индол-2-карбоновой кислоты. 15. Применение соединения для производства лекарственного средства по п.12, где соединение формулы (I) имеет следующие значения радикалов: 16. Применение соединения для производства лекарственного средства по п.15, где соединение формулы (I) выбирается из группы, включающей метиламид 3-фенилсульфанил-1H-индол-2-карбоновой кислоты и метиламид 3-(пиридин-2-илсульфанил)-1Н-индол-2-карбоновой кислоты. 17. Применение соединения для производства лекарственного средства по п.1, где соединение формулы (I) имеет следующие значения радикалов: 18. Применение соединения для производства лекарственного средства по п.1, где соединение формулы (I) выбирается из группы, включающей амид 3-фенокси-1Н-индол-2-карбоновой кислоты, 19. Применение соединения для производства лекарственного средства по п.1, где соединение формулы (I) имеет следующие значения радикалов: 20. Применение соединения для производства лекарственного средства по п.19, где соединением формулы (I) является амид 3-(пиридин-2-илсульфанил)-1Н-индол-2-карбоновой кислоты. 21. Применение соединения для производства лекарственного средства по п.1, где соединение формулы (I) имеет следующие значения радикалов: 22. Применение соединения для производства лекарственного средства по п.21, где соединение формулы (I) выбирается из группы, включающей 23. Способ ингибирования активности казеинкиназы I 24. Способ по п.23, в котором упомянутое ингибирование активности казеинкиназы I
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 (CKI
(CKI Diagnostic and Statistical Manual of Mental Disorders
Diagnostic and Statistical Manual of Mental Disorders , Fourth Edition, Text Revision. Washington, DC, American Psychiatric Association, 2000) обозначаются термином «сезонного характера» при описании сезонного характера больших проявлений депрессии, при биполярных расстройствах I типа, биполярных расстройствах II типа или периодических больших депрессивных расстройствах (E.M. Tam et al., Can. J. Psychiatry (1995) 40, 457-466). Характеристики и диагнозы депрессивных нарушений, больших депрессивных расстройств, приступов больших депрессивных расстройств, биполярных расстройств I типа, биполярных расстройств II типа и сезонных эффектов описаны в DSM-IV.
, Fourth Edition, Text Revision. Washington, DC, American Psychiatric Association, 2000) обозначаются термином «сезонного характера» при описании сезонного характера больших проявлений депрессии, при биполярных расстройствах I типа, биполярных расстройствах II типа или периодических больших депрессивных расстройствах (E.M. Tam et al., Can. J. Psychiatry (1995) 40, 457-466). Характеристики и диагнозы депрессивных нарушений, больших депрессивных расстройств, приступов больших депрессивных расстройств, биполярных расстройств I типа, биполярных расстройств II типа и сезонных эффектов описаны в DSM-IV.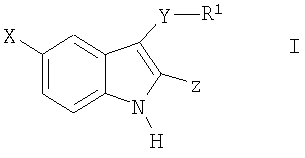
 М (микромоль на литр), nM (наномоль на литр), мкКи (микрокюри), имп./мин (число импульсов в минуту), об/мин (число оборотов в минуту), мм (миллиметр), мкм (микрометр), мк (микрон), нм (нанометр), м.д. (миллионные доли), фунт/кв. дюйм (фунт на квадратный дюйм), эк. или экв. (эквивалент), RT (время удержания), °C (градусы Цельсия), K (Кельвина).
М (микромоль на литр), nM (наномоль на литр), мкКи (микрокюри), имп./мин (число импульсов в минуту), об/мин (число оборотов в минуту), мм (миллиметр), мкм (микрометр), мк (микрон), нм (нанометр), м.д. (миллионные доли), фунт/кв. дюйм (фунт на квадратный дюйм), эк. или экв. (эквивалент), RT (время удержания), °C (градусы Цельсия), K (Кельвина).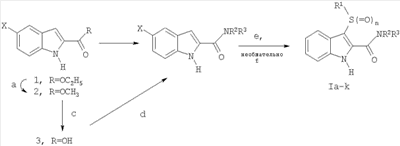
 или Cs2CO3, DMF, R1-S-S-R1 (R1=арил); f) H2O2.
или Cs2CO3, DMF, R1-S-S-R1 (R1=арил); f) H2O2.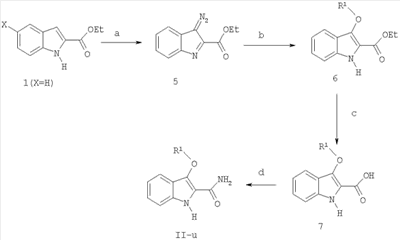
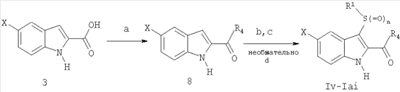
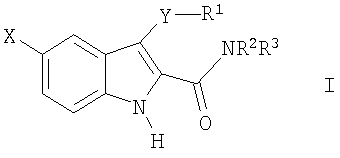
 (соль)
(соль)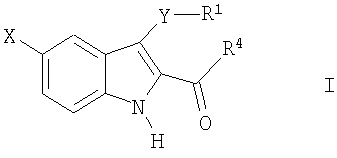
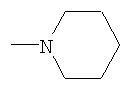
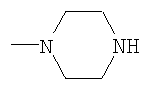
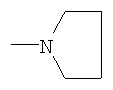
 –33P-АТФ 1 мКи/37 МБк, поставщик Perkin Elmer Life Sciences #NEG-602H
–33P-АТФ 1 мКи/37 МБк, поставщик Perkin Elmer Life Sciences #NEG-602H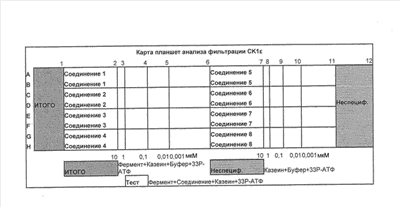
 -глицерофосфат Sigma # G-9891 м.в.=216,0; EDTA 0,5 M, pH 8,0 GibcoBRL; ортованадат натрия ACROS # 205330500 м.в.=183,9; DTT (DL-дитиотреитол) Sigma # D-5545 м.в.=154,2; хлорид магния ACROS # 41341-5000 м.в.=203,3; АТФ Sigma # A-7699 м.в.=551,1;
-глицерофосфат Sigma # G-9891 м.в.=216,0; EDTA 0,5 M, pH 8,0 GibcoBRL; ортованадат натрия ACROS # 205330500 м.в.=183,9; DTT (DL-дитиотреитол) Sigma # D-5545 м.в.=154,2; хлорид магния ACROS # 41341-5000 м.в.=203,3; АТФ Sigma # A-7699 м.в.=551,1; 
 +1h, которая представляет собой эффективную микромолярную концентрацию, вызывающую 1-часовое удлинение периода. Анализируют данные, аппроксимируя гиперболическую кривую к данным, выраженным как изменение периода (ось y) в сопоставлении с концентрацией тестового соединения (ось х) в XLfit, и интерполируя EC
+1h, которая представляет собой эффективную микромолярную концентрацию, вызывающую 1-часовое удлинение периода. Анализируют данные, аппроксимируя гиперболическую кривую к данным, выраженным как изменение периода (ось y) в сопоставлении с концентрацией тестового соединения (ось х) в XLfit, и интерполируя EC