Патент на изобретение №2391097
|
|||||||||||||||||||||||||||||
(54) КОМПОЗИЦИЯ И СПОСОБ ПРЯМОГО ПРЕССОВАНИЯ
(57) Реферат:
Изобретение относится к таблетке ингибитора ДПП-IV и способу приготовления спрессованной таблетки методом прямого прессования в виде разовой дозировочной формы. Ингибитор ДПП-IV представляет собой (S)-1-[(3-гидрокси-1-адамантил)амино]ацетил-2-цианопирролидин в свободной форме или в форме кислотно-аддитивной соли. Применяющиеся в композиции инертные наполнители улучшают характеристики сыпучести и уплотнения указанного лекарственного средства и таблетируемой смеси. Оптимальная сыпучесть обеспечивает равномерное заполнение штампа и регулирование массы. Применяющееся связующее обеспечивает достаточную когезионную способность, что позволяет спрессовать ингибитор ДПП-IV способом прямого прессования. Полученные таблетки обладают приемлемым профилем растворения in vitro, приемлемыми степенями твердости и стойкости к разламыванию. 3 н. и 23 з.п. ф-лы.
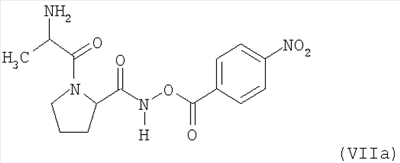
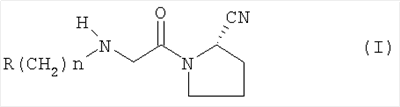
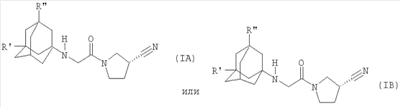
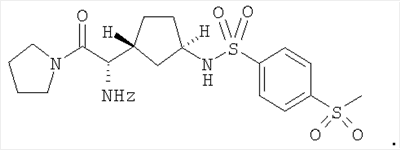
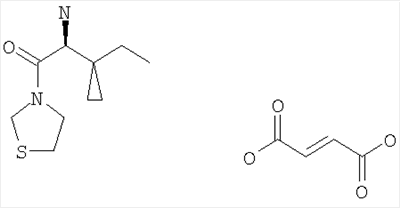
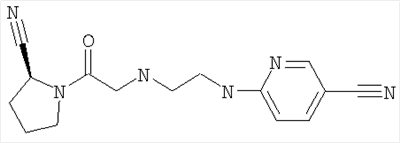
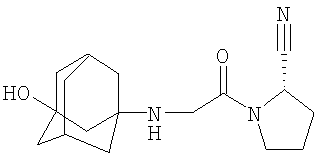
Настоящее изобретение относится к таблеткам, точнее к таблеткам, сформованным прямым прессованием соединения, ингибирующего дипептидилпептилазу IV (ДПП-IV), к способу их получения, к новым фармацевтическим композициям и к новым таблетирующимся порошкам, включающим композиции ингибиторов ДПП-IV, пригодным к прямому прессованию в таблетки. Настоящее изобретение также относится к способу получения таблеток путем смешивания активного ингредиента и специальных инертных наполнителей в новые композиции с последующим прямым прессованием композиций в таблетки прямого прессования. Предпочтительные соединения, ингибирующие ДПП-IV, к которым в первую очередь относится настоящее изобретение описаны ниже: В контексте настоящего изобретения “ингибитор ДПП-IV” также включает его активные метаболиты и пролекарства, такие как активные метаболиты и пролекарства ингибиторов ДПП-IV. “Метаболит” является активным производным ингибитора ДПП-IV, образовавшимся при метаболизме ингибитора ДПП-IV. “Пролекарство” является соединением, которое или подвергается метаболизму в ингибитор ДПП-IV или подвергается метаболизму в тот же метаболит(ы), что и ингибитор ДПП-IV. Ингибиторы ДПП-IV известны в данной области техники. Например, ингибиторы ДПП-IV в каждом случае в общем виде и конкретно раскрыты, например, в WO 98/19998, DE 19616 486 A1, WO 00/34241, WO 95/15309, WO 01/72290, WO 01/52825, WO 9310127, WO 9925719, WO 9938501, WO 9946272, WO 9967278 и WO 9967279. Предпочтительные ингибиторы ДПП-IV описаны в следующих заявках на патенты; WO 02053548, в особенности соединения 1001-1293 и примеры 1-124, WO 02067918, в особенности соединения 1000-1278 и 2001-2159, WO 02066627, в особенности описанные примеры, WO 02/068420, в особенности соединения, специально перечисленные в примерах I-LXIII и соответствующие описанные аналоги, еще более предпочтительными являются соединения 2 (28), 2 (88), 2 (119), 2 (136), описанные в таблице, в которой приведены значения IC50, WO 02083128, в особенности примеров 1-13, US 2003096846, в особенности специально описанные соединения, WO 2004/037181, в особенности примеров 1-33 и соединения, описанные в формуле изобретения в п.п.3-5, WO 0168603, в особенности соединения примеров 1-109, ЕР 1258480, в особенности соединения примеров 1-60, WO 0181337, в особенности примеров 1-118, WO 02083109, в особенности примеров 1А-1D, WO 030003250, в особенности соединения примеров 1-166, наиболее предпочтительно – 1-8, WO 03035067, в особенности соединения, описанные в примерах, WO 03/035057, в особенности соединения, описанные в примерах, US 2003216450, в особенности примеров 1-450, WO 99/46272, в особенности соединения, описанные в формуле изобретения в п.п.12, 14, 15 и 17, WO 0197808, в особенности соединения, описанные в формуле изобретения в п.2, WO 03002553, в особенности соединения примеров 1-33, WO 01/34594, в особенности соединения, описанные в примерах 1-4, WO 02051836, в особенности примеров 1-712, ЕР 1245568, в особенности примеров 1-7, ЕР 1258476, в особенности примеров 1-32, US 2003087950, в особенности описанные примеры, WO 02/076450, в особенности примеров 1-128, WO 03000180, в особенности примеров 1-162, WO 03000181, в особенности примеров 1-66, WO 03004498, в особенности примеров 1-33, WO 0302942, в особенности примеров 1-68, US 6482844, в особенности описанные примеры, WO 0155105, в особенности соединения, перечисленные в примерах 1 и 2, WO 0202560, в особенности примеров 1-166, WO 03004496, в особенности примеров 1-103, WO 03/024965, в особенности примеров 1-54, WO 0303727, в особенности примеров 1-209, WO 0368757, в особенности примеров 1-88, WO 03074500, в особенности примеров 1-72, примеров 4.1-4.23, примеров 5.1-5.10, примеров 6.1-6.30, примеров 7.1-7.23, примеров 8.1-8.10, примеров 9.1-9.30, WO 02038541, в особенности примеров 1-53, WO 02062764, в особенности примеров 1-293, предпочтительно – соединение примера 95 (2-{{3-(аминометил)-4-бутокси-2-неопентил-1-оксо-1,2 дигидро-6-изохинолил}окси}ацетамидгидрохлорид), WO 02308090, в особенности примеров 1-1-1-109, примеров 2-1-2-9, примера 3, примеров 4-1-4-19, примеров 5-1-5-39, примеров 6-1-6-4, примеров 7-1-7-10, примеров 8-1-8-8, примеров 7-1-7-7 на стр.90, примеров 8-1-8-59 на стр.91-95, примеров 9-1 до 9-33, примеров 10-1-10-20, US 2003225102, в особенности соединения 1-115, соединения примеров 1-121, предпочтительно – соединения а)-z), aa)-az), ba)-bz), ca)-cz) и da)-dk), WO 0214271, в особенности примеров 1-320 и US 2003096857, WO 2004/052850, в особенности специально описанные соединения, такие как примеры 1-42, и соединения, описанные в формуле изобретения в п.1, DE 10256264 А1, в особенности описанные соединения, такие как примеры 1-181, и соединения, описанные в формуле изобретения в п.5, WO 04/076433, в особенности специально описанные соединения, такие как перечисленные в таблице А, предпочтительно – соединения, перечисленные в таблице В, предпочтительно – соединения I-XXXXVII, или соединения, описанные в формуле изобретения в п.п.6-49, WO 04/071454, в особенности специально описанные соединения, например, соединения 1-53 или соединения, приведенные в таблицах Ia-If, или соединения, описанные в формуле изобретения в п.п.2-55, WO 02/068420 в особенности специально описанные соединения, такие как соединения I-LXIII или пример I и аналоги 1-140 или пример 2 и аналоги 1-174 или пример 3 и аналог 1, или пример 4-5, или пример 6 и аналоги 1-5, или пример 7 и аналоги 1-3, или пример 8 и аналог 1, или пример 9, или пример 10 и аналоги 1-531, еще более предпочтительными являются соединения, описанные в формуле изобретения в п.13, WO 03/000250, в особенности специально описанные соединения, такие как соединения 1-166, предпочтительно – соединения примеров 1-9, WO 03/024942, в особенности специально описанные соединения, такие как соединения 1-59, соединения, приведенные в таблице 1(1-68), соединения, описанные в формуле изобретения в п.п.6, 7, 8, 9, WO 03024965, в особенности специально описанные соединения, такие как соединения 1-54, WO 03002593, в особенности специально описанные соединения, такие как соединения, приведенные в таблице 1 или в формуле изобретения в п.п.2-15, WO 03037327, в особенности специально описанные соединения, такие как соединения примеров 1-209 WO 03/000250, в особенности специально описанные соединения, такие как соединения 1-166, предпочтительно – соединения примеров 1-9, WO 03/024942 в особенности специально описанные соединения, такие как соединения 1-59, соединения, приведенные в таблице 1(1-68), соединения, описанные в формуле изобретения в п.п.6, 7, 8, 9, WO 03024965, в особенности специально описанные соединения, такие как соединения 1-54, WO 03002593, в особенности специально описанные соединения, такие как соединения, приведенные в таблице 1 или в формуле изобретения в п.п.2-15, WO 03037327, в особенности специально описанные соединения, такие как соединения примеров 1-209, WO 0238541, WO 0230890, заявке на патент США Другие предпочтительные ингибиторы ДПП-IV включают конкретные примеры, раскрытые в патентах США В WO 9819998 раскрыты N-(N’-замещенный глицил)-2-цианопирролидины, в частности, 1-[2-[5-цианопиридин-2-ил]амино]-этиламино]ацетил-2-циано-(S)-пирролидин. Предпочтительные соединения, описанные в WO 03/002553, перечислены на стр.9-11 и включены в настоящую заявку в качестве ссылки. В опубликованной заявке на патент WO 0034241 и опубликованном патенте US 6110949 раскрыты N-замещенные адамантиламиноацетил-2-цианопирролидины и N-(замещенный глицил)-4-цианопирролидины соответственно. Представляющими интерес ингибиторами ДПП-IV в особенности являются указанные в формуле изобретения в п.п.1-4. В частности, в этих заявках описано соединение 1-[[(3-гидрокси-1-адамантил)амино]ацетил]-2-циано-(S)-пирролидин (также известное, как LAF237). В WO 9515309 раскрыты 2-цианопирролидинамиды аминокислот, как ингибиторы ДПП-IV и в WO 9529691 раскрыты пептидильные производные сложных диэфиров альфа-аминоалкилфосфорных кислот, в частности, содержащие пролиновую или родственные структуры. Представляющими интерес ингибиторами ДПП-IV в особенности являются указанные в таблицах 1-8. В WO 01/72290 представляющими интерес ингибиторами ДПП-IV в особенности являются указанные в примере 1 в формуле изобретения в п.п.1, 4 и 6. В WO 9310127 раскрыты бороновые сложные эфиры пролина, применимые в качестве ингибиторов ДПП-IV. Представляющими интерес ингибиторами ДПП-IV в особенности являются указанные в примерах 1-19. В опубликованной заявке на патент WO 9925719 раскрыт сулфостин, ингибитор ДПП-IV, полученный выращиванием микроорганизмов Streptomyces. В WO 9938501 раскрыты N-замещенные 4-8-членные гетероциклические кольца. Представляющими интерес ингибиторами ДПП-IV в особенности являются указанные в формуле изобретения в п.п.15-20. В WO 9946272 раскрыты соединения фосфора, как ингибиторы ДПП-IV. Представляющими интерес ингибиторами ДПП-IV в особенности являются указанные в формуле изобретения в 1-23. Другими предпочтительными ингибиторами ДПП-IV являются соединения формулы I, II или III, раскрытые в заявке на патент WO 03/057200 на стр.14-27. Наиболее предпочтительными ингибиторами ДПП-IV являются соединения, специально описанные на стр.28 и 29. В опубликованных заявках на патент WO 9967278 и WO 9967279 раскрыты пролекарства ДПП-IV и ингибиторы вида А-В-С, где С является стабильным или нестабильным ингибитором ДПП-IV. Предпочтительным N-пептидил-О-ароилгидроксиламином является соединение формулы VII в которой j равно 0, 1 или 2; R R В наиболее предпочтительном варианте осуществления настоящего изобретения N-пептидил-О-ароилгидроксиламином является соединение формулы VIIa или его фармацевтически приемлемая соль. N-пептидил-О-ароилгидроксиламины, например, формулы VII или VIIa и их получение описаны в публикации H.U.Demuth et al. in J. Enzyme Inhibition 1988, vol.2, стр.129-142, предпочтительно на стр.130-132. Наиболее предпочтительными ингибиторами являются N-(замещенный глицил)-2-цианопирролидины формулы (I) в которой R обозначает замещенный адамантил; и n равно от 0 до 3; в свободной форме или в форме молекулярной соли с кислотой. Термин “замещенный адамантил” означает адамантил, т.е. 1- или 2-адамантил, содержащий один или большее количество, например, 2 заместителя, выбранные из группы, включающей алкил, -OR1 и -NR2R3, где R1, R2 и R3 независимо обозначают водород, алкил, (С1-С8алканоил), карбамоил или -СО-NR4R5, где R4 и R5 независимо обозначают алкил, незамещенный или замещенный арил, и где один из R4 и R5 дополнительно обозначает водород или R4 и R5 совместно обозначают С2-С7алкилен. Термин “aryl” предпочтительно означает фенил. Замещенный фенил предпочтительно означает фенил, замещенный одним или большим количеством, например, двумя заместителями, выбранными из группы, включающей, например, алкил, алкоксигруппу, галоген и трифторметил. Термин “алкоксигруппа” означает алкил -O-. Термин “галоген” означает фтор, хлор, бром и йод. Термин “алкилен” означает обладающий линейной цепью мостик, содержащий от 2 до 7 атомов углерода, предпочтительно – от 3 до 6 атомов углерода, наиболее предпочтительно – 5 атомов углерода. Предпочтительной группой соединений, предлагаемых в настоящем изобретении, являются соединения формулы (I), в которых заместитель адамантила связан с мостиком или метиленовой группой, соседней с мостиковой. Соединения формулы (I), в которой глицил-2-цианопирролидиновый фрагмент связан с мостиком, заместителем R’ у адамантила предпочтительно является 3-гидроксигруппа. Соединения формулы (I), в которой глицил-2-цианопирролидиновый фрагмент связан с метиленовой группой, соседней с мостиковой, заместителем R’ у адамантила предпочтительно является 5-гидроксигруппа. Настоящее изобретение предпочтительно относится к соединению формулы (IA) или (IB) в которой R’ обозначает гидроксигруппу, С1-С7алкоксигруппу, С1-С8алканоилоксигруппу или R5R4N-CO-O-, где R4 и R5 независимо обозначают С1-С7алкил или фенил, который является незамещенным или замещен заместителем, выбранным из группы, включающей С1-С7алкил, С1-С7алкоксигруппу, галоген и трифторметил, и где R4 дополнительно обозначает водород; или R4 и R5 совместно обозначают С3-С6алкилен; и R” обозначает водород; или R’ и R” независимо обозначают С1-С7алкил; в свободной форме или в форме фармацевтически приемлемой молекулярной соли с кислотой. Эти ингибирующие ДПП-IV соединения формулы (I), (IA) или (IB) известны и описаны в патенте US 6166063, выданном 26 декабря 2000 г., и WO 01/52825. Специально раскрыты (S)-1-{2-[5-цианопиридин-2у1)амино]этиламиноацетил)-2-цианопирролидин и (S)-1-[(3-гидрокси-1 адамантил)амино]ацетил-2-цианопирролидин (LAF237). Они могут находиться в свободной форме или в форме молекулярной соли с кислотой. Фармацевтически приемлемые, т.е. нетоксичные и физиологически приемлемые соли являются предпочтительными, хотя можно применять и другие соли, например, при выделении или очистке соединений, предлагаемых в настоящем изобретении. Хотя предпочтительными молекулярными солями с кислотами являются гидрохлориды, также можно использовать соли с метансульфоновой, серной, лимонной, молочной и уксусной кислотой. Предпочтительными ингибиторами ДПП-IV являются описанные в публикации Mona Patel and col. (Expert Opinion Investig Drugs. 2003 Apr; 12(4): 623-33) в разделе 5, в особенности Р32/98, К-364, FE-999011, BDPX, NVP-DDP-728 и другие, и эта публикация включена в настоящее изобретение в качестве ссылки, в особенности в части описанных ингибиторов ДПП-IV. FE-999011 описан в заявке на патент WO 95/15309 стр.14, как соединение Другим предпочтительным ингибитором является соединение BMS-477118, раскрытое в патенте US Другим предпочтительным ингибитором является соединение GSK23A, раскрытое в WO 03/002531 (пример 9), также известное, как (2S,4S)-1-((2R)-2-амино-3-[(4-метоксибензил)сульфонил]-3-метилбутаноил)-4-фторпирролидин-2-карбонитрилгидрохлорид. Другие особенно предпочтительные ингибиторы ДПП-IV, предлагаемые в настоящем изобретении, описаны в заявке на международный патент WO 02/076450 (в особенности примеры 1-128) и в публикации Wallace Т. Ashton (Bioorganic & Medicinal Chemistry Letters 14 (2004) 859-863), в особенности соединение 1 и соединения, перечисленные в таблицах 1 и 2. Предпочтительным соединением является соединение 21е (таблица 1) формулы Р32/98 и Р3298 ( и описаны в WO 99/61431 под названиями Probiodrug, а также соединение Р 93/01. Другими предпочтительными ингибиторами ДПП-IV являются соединения, раскрытые в заявке на патент WO 02/083128, такие как описанные в формуле изобретения в п.п.1-5. Наиболее предпочтительными ингибиторами ДПП-IV являются соединения, специально описанные в примерах 1-13 и в формуле изобретения в п.п.6-10. Другие предпочтительные ингибиторы ДПП-IV описаны в заявках на патент WO 2004/037169, в особенности описанные в примерах 1-48, и WO 02/062764, в особенности описанные примеры 1-293, еще более предпочтительными являются соединения 3-(аминометил)-2-изобутил-1-оксо-4-фенил-1,2-дигидро-6-изохинолинкарбоксамид и 2-{[3-(аминометил)-2-изобутил-4-фенил-1-оксо-1,2-дигидро-6-изохинолил]окси}ацетамид, описанные на стр.7, а также в заявке на патент WO 2004/024184, в особенности в эталонных примерах 1-4. Другие предпочтительные ингибиторы ДПП-IV описаны в заявке на патент WO 03/004498, в особенности в примерах 1-33 и наиболее предпочтительным является соединение формулы описанное в примере 7 и также известное, как МК-0431. Предпочтительные ингибиторы ДПП-IV также описаны в заявке на патент WO 2004/037181, в особенности в примерах 1-33, наиболее предпочтительны соединения, описанные в формуле изобретения в п.п.3-5. Предпочтительными ингибиторами ДПП-IV являются N-замещенные адамантиламиноацетил-2-цианопирролидины, N-(замещенный глицил)-4-цианопирролидины, N-(N’-замещенный глицил)-2-цианопирролидины, N-аминоацилтиазолидины, N-аминоацилпирролидины, L-алло-изолейцилтиазолидин, L-трео-изолейцил пирролидин и L-алло-изолейцил пирролидин, 1-[2-[(5-цианопиридин-2-ил)амино]этиламино]ацетил-2-циано-(S)-пирролидин и их фармацевтические соли. Особенно предпочтительными являются 1-{2-[(5-цианопиридин-2-ил)амино]этиламино]ацетил-2-(S)-цианопирролидиндигидрохлорид (DPP728) формулы в особенности его дигидрохлорид, и (S)-1-[(3-гидрокси-1-адамантил)амино]ацетил-2-цианопирролидин (LAF237) формулы
и L-трео-изолейцилтиазолидин (код соединения в соответствии с Probiodrug: Р32/98, описанное выше), МК-0431, GSK23A, BMS-477118, 3-(аминометил)-2-изобутил-1-оксо-4-фенил-1,2-дигидро-6-изохинолинкарбоксамид и 2-{[3-(аминометил)-2-изобутил-4-фенил-1-оксо-1,2-дигидро-6-изохинолил]окси}ацетамид и необязательно в любом случае их фармацевтические соли. DPP728 и LAF237 являются особенно предпочтительными соединениями и специально раскрыты в примере 3 в WO 98/19998 и в примере 1 в WO 00/34241, соответственно. Ингибитор ДПП-IV Р32/98 (см. выше) специально описан в публикации Diabetes 1998, 47, 1253-1258. DPP728 и LAF237 можно приготовить так, как это описано на стр.20 в WO 98/19998 или в WO 00/34241. Предпочтительные композиции для введения LAF237 описаны в предварительной заявке на патент US Особенно предпочтительными являются активные при пероральном введении ингибиторы ДПП-IV. В каждом случае, в частности, в содержании пунктов формулы изобретения, относящихся к соединениям, в характеристиках конечных продуктов, описанных в примерах, в описаниях конечных продуктов, фармацевтических препаратов и в формуле изобретения в настоящее изобретение включены в качестве ссылки указанные в настоящей заявке публикации или заявки на патенты. Ингибирующие ДПП-IV соединения, например, соединения формулы (I) и соответствующие их фармацевтически приемлемые молекулярные соли с кислотами можно комбинировать с одним или большим количеством фармацевтически приемлемых носителей и, необязательно, с одним или большим количеством других обычных фармацевтических вспомогательных веществ и вводить энтерально, например, перорально, в форме таблеток, капсул, таблеток в форме капсул и т.п. или парентерально, например, внутривенно в форме стерильных растворов или суспензий для инъекций. Энтеральные и парентеральные композиции можно приготовить обычным образом. Ингибирующие ДПП-IV соединения, например, соединения формулы (I) и соответствующие их фармацевтически приемлемые молекулярные соли с кислотами можно приготовить в виде энтеральных и парентеральных фармацевтических композиций, содержащих количество активного вещества, которое эффективно для лечения патологических состояний, опосредуемых ингибированием ДПП-IV, таких композиций в виде разовых дозировочных форм и таких композиций, включающих фармацевтически приемлемый носитель. Ингибирующие ДПП-IV соединения, например, соединения формулы (I), включая соединения всех его подгрупп и всех примеров, можно вводить в энантиомерно чистой форме, например, содержащей >98%, предпочтительно – содержащей >99%; или вместе с R энантиомером, например, в рацемической форме. Указанные выше диапазоны дозировок приведены в пересчете на соединения формулы (I), исключая количество R энантиомера. Вследствие их способности ингибировать ДПП-IV, ингибирующие ДПП-IV соединения, например, соединения формулы (I) и соответствующие их фармацевтически приемлемые молекулярные соли с кислотами применимы для лечения патологических состояний, опосредуемых ингибированием ДПП-IV. На основании вышеизложенного и литературных данных предполагается, что соединения, раскрытые в настоящем изобретении, применимы для лечения патологических состояний, таких как инсулиннезависимый сахарный диабет, артрит, ожирение, трансплантация аллотрансплантата и связанный с кальцитонином остеопороз. Кроме того, на основе роли глюкагоноподобных пептидов, таких как GLP-1 и GLP-2, и их связи с ингибированием ДПП-IV предполагается, что соединения, раскрытые в настоящем изобретении, применимы, например, для обеспечения седативного или анксиолитического эффекта или ослабления послеоперационных катаболических изменений и гормональной реакции на стресс, или для снижения летальности и заболеваемости после инфаркта миокарда, или для лечения патологических состояний, связанных с указанными эффектами, которые могут быть опосредованы с помощью GLP-1 и/или GLP-2. Точнее, например, ингибирующие ДПП-IV соединения, например, соединения формулы (I) и соответствующие их фармацевтически приемлемые молекулярные соли с кислотами улучшают раннюю реакцию инсулина на пероральное введение глюкозы и поэтому применимы для лечения инсулиннезависимого сахарного диабета. Ингибирующие ДПП-IV соединения, предпочтительно – соединения формулы I, IA или IB, применимые в настоящем изобретении, являются гигроскопичными, приводят к затруднениям, связанным со стабильностью и по своей природе не являются прессующимися. Поэтому необходима сыпучая и когезионная композиция, пригодная для прямого прессования в прочные таблетки, обладающие приемлемым профилем растворения in vitro. Таблетки можно определить, как твердые фармацевтические дозировочные формы, содержащие лекарственные вещества с подходящими наполнителями или без них. Их изготавливают путем прессования или уплотнения композиции, содержащей активный ингредиент и некоторые инертные наполнители, подобранные для содействия обработке и улучшения характеристик продукта. Таблетки могут обладать или не обладать покрытием и их готовят из порошкообразных кристаллических веществ. Они могут включать различные разбавители, связующие, вещества, обеспечивающие распадаемость, смазывающие вещества, вещества, придающие скользкость и во многих случаях – красители. Применяющиеся инертные наполнители классифицируются по выполняемым или функциям. Например, смазывающее вещество можно использовать для улучшения сыпучести порошкообразной смеси в воронке и в штампе для получения таблетки. С конца XIX века широко применяются таблетки и большинство фармацевтических дозировочных форм продается в виде таблеток. Основной причиной распространенности таблеток в качестве дозировочных форм является простота, дешевизна и высокая скорость изготовления. К другими причинам относятся стабильность лекарственного препарата, удобство упаковки, транспортировки и распределения. Для пациента или потребителя таблетки обеспечивают удобство введения, легкость точного дозирования, компактность, портативность, мягкость вкуса, простоту введения и привлекательный отличительный внешний вид. Таблетки могут быть обычными, с пленочным или сахарным покрытием, содержащими разделяющую пополам насечку, рельефными, слоистыми или пролонгированного действия. Их можно изготовлять обладающими разными размерами, формой и цветом. Таблетки могут быть проглатываемыми, жевательными, или растворяющимися в защечном кармане или под языком. Их можно растворять в воде для местного или наружного применения. Стерильные таблетки обычно применяют для приготовления растворов для парентерального введения и для имплантации под кожу. В дополнение к активным, или терапевтическим ингредиентам таблетки могут содержать целый ряд инертных веществ, известных, как инертные наполнители. Последние можно классифицировать в соответствии с той ролью, которую они играют в готовой таблетке. Первичная композиция включает наполнитель, связующее, смазывающее вещество и вещество, придающее скользкость. Другие инертные наполнители, которые придают определенные физические характеристики готовой таблетке, в случае жевательных таблеток представляют собой красители и вкусовые добавки. Без инертных наполнителей большинство лекарственных средств и фармацевтических ингредиентов невозможно подвергнуть прямому прессованию в таблетки. Это в основном обусловлено плохими сыпучестью и когезионными характеристиками большинства лекарственных средств. Обычно инертные наполнители прибавляют в композицию для придания прессуемому веществу хорошей сыпучести и способности к прессованию. Такие характеристики придаются этим инертным наполнителям на стадиях предварительной обработки, таких как мокрое гранулирование, агрегирование, распылительная сушка, сфероидизация и кристаллизация. Смазывающие вещества обычно прибавляют для предотвращения прилипания таблетируемого материала к штампам, сведения к минимум трения при прессовании таблетки и обеспечения возможности отделения спрессованной таблетки от штампа. Такие смазывающие вещества обычно включают в готовую смесь для таблеток в количестве, обычно составляющем менее 1 мас.%. Кроме того, таблетки часто содержат разбавители, которые часто прибавляют для увеличения объемной массы смеси, так чтобы она была пригодна для прессования. Это часто является необходимым, когда доза лекарственного средства относительно мала. Другим обычно применяющимся классом инертных наполнителей в таблетках являются связующие. Связующие являются агентами, которые придают когезионную способность порошкообразному веществу. Обычно применяющиеся связующие включают крахмал и сахара, такие сахароза, глюкоза, декстроза и лактоза. Вещества, обеспечивающие распадаемость, часто включают для того, чтобы таблетка обладала приемлемой скоростью распада. Обычно вещества, обеспечивающие распадаемость, включают производные крахмала и соли карбоксиметилцеллюлозы. Другие необходимые характеристики инертных наполнителей включают следующие: – высокую прессуемость для обеспечения возможности получения прочных таблеток при низких сжимающих усилиях; – хорошие характеристики сыпучести, что может улучшить сыпучесть других инертных наполнителей в композиции; и – когезионную способность (чтобы таблетки не крошились во время обработки, транспортировки и использования). Существуют три промышленно важных способа изготовления прессованных таблеток: мокрое гранулирование, прямое прессование и сухое гранулирование (агрегирование или вальцовое уплотнение). Способ изготовления и тип инертных наполнителей выбирают для придания композиции таблетки необходимых физических характеристик, которые обеспечивают быстрое прессование таблеток. После прессования таблетки должны обладать рядом дополнительных характеристик, таких как внешний вид, твердость, способность к распаду и приемлемый профиль растворения. Выбор наполнителей и других инертных веществ будет зависеть от химических и физических характеристик лекарственного средства, поведения смеси во время обработки и характеристик готовой таблетки. Для определения химической и физической совместимости активного компонента с предлагаемыми инертными наполнителями проводят предварительные исследования композиций. Характеристики лекарственного средства, его дозировочных форм и экономичность технологии определяют выбор наилучшей технологии таблетирования. Обычно при изготовлении таблеток используют и мокрое гранулирование, и прямое прессование. Способ сухого гранулирования можно использовать, когда один из компонентов, лекарственное средство или разбавитель, обладают достаточной для таблетирования когезионной способностью. Способ включает смешивание, агрегирование ингредиентов, сухое просеивание, смазывание и прессование. Способ мокрого гранулирования используют для превращения порошкообразной смеси в гранулы, обладающие подходящими для таблетирования характеристиками сыпучести и когезионными характеристиками. Способ включает смешивание порошкообразных веществ в подходящем смесителе с последующим прибавлением гранулирующего раствора при воздействии сдвигового усилия на смешиваемые порошки для получения гранулята. Затем влажную массу пропускают через подходящее сито и сушат с помощью центробежной сушки или сушки в псевдоожиженном слое. Альтернативно, влажную массу можно высушить и обработать в мельнице. Способ в целом включает отвешивание, перемешивание сухого порошка, мокрое гранулирование, сушку, размол, примешивание смазывающего вещества и прессование. Обычно порошкообразные вещества не обладают адгезионными или когезионными характеристиками, достаточными для получения твердых, прочных гранул. Вследствие плохих когезионных характеристик большинства порошкообразных веществ для связывания частиц порошков друг с другом обычно необходимо связующее. Чувствительные к воздействию тепла и влаги лекарственные средства обычно нельзя приготовить с помощью мокрого гранулирования. Большое количество стадий обработки и длительность обработки приводят к затруднениям вследствие больших производственных затрат. Также известно, что мокрое гранулирование ухудшает прессуемость некоторых фармацевтических инертных наполнителей, таких как микрокристаллическая целлюлоза. Прямое прессование считается относительно быстрым способом, при котором порошкообразные вещества прессуют непосредственно без изменения физических и химических характеристик лекарственного средства. Активный ингредиент(ы), инертные наполнители для прямого прессования и другие вспомогательные вещества, такие как вещество, придающее скользкость, и смазывающее вещество смешивают в двухоболочечном смесителе или аналогичном аппарате с низким сдвиговым усилием, а затем прессуют в таблетки. Предполагается, что этот тип перемешивания достаточен для приготовления “фармацевтически приемлемых” дозировочных форм. Некоторые фармацевты-исследователи полагают, что необходимо тщательно подбирать способ прибавления смазывающего вещества в композицию. В соответствии с этим смазывающие вещества обычно прибавляют в гранулят путем осторожного перемешивания. Также полагают, что продолжительное перемешивание смазывающего вещества с гранулятом может существенным образом повлиять на твердость и время распада полученных таблеток. Чрезмерно длительное перемешивание смазывающего вещества с компонентами гранулята может сделать гранулу водонепроницаемой и снизит твердость таблетки или прочность прессованной таблетки. По этим причинам для приготовления дозировочных форм прямого прессования не используют перемешивание с большим сдвиговым усилием. Преимущества прямого прессования включают однородность смеси, малое количество технологических стадий, т.е. вся технология включает отвешивание порошкообразных веществ, перемешивание и прессование, следовательно требует меньших затрат, исключает нагрев и увлажнение, распад первичных частиц и обеспечивает механическую стабильность. Изготовители фармацевтических средств предпочитают технологии прямого прессования, а не технологии мокрого или сухого гранулирования вследствие непродолжительного времени обработки и экономичности. Однако прямое прессование обычно прямое прессование обычно ограничивается случаями, когда лекарственное средство или активный ингредиент обладает физическими характеристиками, необходимыми для получения фармацевтически приемлемых таблеток. Однако до проведения прямого прессования с активными ингредиентами часто необходимо объединить один или большее количество инертных наполнителей, поскольку многие ингредиенты не обладают необходимыми характеристиками. Поскольку каждый инертный наполнитель, прибавленный в композицию, увеличивает размер готовой таблетки, изготовители часто ограничены использованием технологии прямого прессования только для композиций, содержащих небольшую дозу активного ингредиента в одной спрессованной таблетке. Твердая дозировочная форма, содержащая большую дозу лекарственного средства, т.е. в которой само лекарственное средство составляет значительную долю полной массы прессованной таблетки, можно повергнуть прямому прессованию только, если само лекарственное средство обладает необходимыми физическими характеристиками, например когезионной способностью, достаточными для прямого прессования ингредиентов. Например, ингибитор ДПП-IV, например, соединения формулы (I) считаются содержащим большую дозу лекарственным средством. Большинство композиций таблеток включает 70-85 мас.% ингибитора ДПП-IV на таблетку. Это содержащееся в большой дозе лекарственное средство в сочетании с довольно плохими для прямого прессования физическими характеристиками не позволяет использовать прямое прессование, как способ изготовления готовой таблетки. Кроме того, активные ингредиенты обладают низкой стабильностью в присутствии воды, что является фактором, ограничивающим применение способа мокрого гранулирования. Другим ограничением прямого прессования, как способа изготовления таблеток, является возможный размер спрессованных таблеток. Если количество активного ингредиента является большим, то фармацевт-изготовитель может выбрать мокрое гранулирование активного ингредиента с другими инертными наполнителями для получения таблетки приемлемого размера, содержащей необходимое количество активного ингредиента. Количества наполнителя, связующего или других инертных наполнителей, необходимых для мокрого гранулирования, меньше необходимых для прямого прессования, поскольку способ мокрого гранулирования способствует приданию таблетке необходимых физических характеристик. Гидроксипропилметилцеллюлоза применяется в фармацевтической промышленности, как инертный наполнитель прямого прессования для твердых дозировочных форм. Гидроксипропилметилцеллюлоза представляет собой обработанную целлюлозу и регулирует выделение лекарственного средства из твердых дозировочных форм. Несмотря на преимущества прямого прессования, такие как непродолжительное время обработки и экономичность, мокрое гранулирование широко применяется в промышленности для приготовления твердых дозировочных форм. Мокрое гранулирование часто предпочтительнее прямого прессования, поскольку мокрое гранулирование с большей вероятностью обеспечивает преодоление любых затруднений, связанных с физическими характеристиками различных ингредиентов композиции. Оно приводит к материалу, который обладает характеристиками сыпучести и когезионными характеристиками, необходимыми для получения приемлемой твердой дозировочной формы. Привлекательность мокрого гранулирования по сравнению с прямым прессованием обусловлен по меньшей мере тремя преимуществами. Во-первых, мокрое гранулирование приводит к материалу, который прессуется с обеспечением лучших характеристик смачивания, в особенности в случае гидрофобных лекарственных веществ. Прибавление гидрофильных инертных наполнителей делает поверхность гидрофобного лекарственного средства более гидрофильной, уменьшает распад и устраняет затруднения, связанные с растворением. Во-вторых, при использовании мокрого гранулирования обычно улучшается однородность твердой дозировочной формы, поскольку все гранулы обычно содержат одно и то же количество лекарственного средства. Наконец, исключается отделение лекарственного средства(средств) от инертных наполнителей. Отделение может являться затруднением, связанным с прямым прессованием. В способе мокрого гранулирования оптимизируется размер и форма частиц, образующих прессуемый гранулят. Это обусловлено тем, что при мокром гранулировании сухого твердого вещества связующее “склеивает” частицы, так что они агломерируются в сферические гранулы. Несмотря на преимущества, обеспечиваемые в целом с помощью мокрого гранулирования, все же вследствие нестабильности соединений в присутствии воды желательно получать прямым прессованием таблетки, содержащие большую дозу ингибитора ДПП-IV, например, такого, как описываемого формулой (I). В промышленности необходимы способы и фармацевтические инертные наполнители, которые позволяют изготовителям получать прямым прессованием таблетки, содержащие большую дозу ингибитора ДПП-IV. Объектом настоящего изобретения является композиция ингибитора ДПП-IV в виде сыпучего когезионного таблетирующегося порошка, пригодного для прямого прессования в таблетку. Другим объектом настоящего изобретения является таблетка ингибитора ДПП-IV, полученная прямым прессованием в разовой дозировочной форме, обладающая приемлемым профилем растворения, а также приемлемыми степенями твердости и стойкости к разламыванию, а также небольшим временем распада. Другим объектом настоящего изобретения является способ приготовления спрессованной таблетки ингибитора ДПП-IV прямым прессованием в виде разовой дозировочной формы. Настоящее изобретение относится к прямому таблетированию сыпучей измельченной композиции ингибитора ДПП-IV в форме таблетирующегося порошка, пригодного для прямого прессования в таблетку, обладающую достаточной твердостью, небольшим временем распада и приемлемым профилем растворения. В дополнение к активному ингредиенту таблетируемый порошок содержит целый ряд инертных веществ, известных, как инертные наполнители. Последние можно классифицировать в соответствии с той ролью, которую они играют в готовой таблетке. Первичная композиция включает наполнители, связующие или разбавители, смазывающие вещества, вещества, обеспечивающие распадаемость, и вещества, придающие скользкость. Другие инертные наполнители, которые придают определенные физические характеристики готовой таблетке, в случае жевательных таблеток представляют собой красители и вкусовые добавки. Обычно инертные наполнители прибавляют в композицию для придания прессуемому веществу хорошей сыпучести и способности к прессованию. Предпочтительная композиция, предлагаемая в настоящем изобретении, включает следующие компоненты: активный ингредиент, который является соединением, ингибирующим ДПП-IV, связующие или разбавители, которые представляют собой микрокристаллическую целлюлозу и лактозу, вещество, обеспечивающее распадаемость, которое представляет собой натриевую соль гликолята крахмала, и смазывающее вещество, которое представляет собой стеарат магния. Можно выбрать 1, 2, 3 или большее количество разбавителей. Примеры фармацевтически приемлемых наполнителей и фармацевтически приемлемых разбавителей включают, но не ограничиваются только ими, кондитерский сахар, прессованный сахар, декстраты, декстрин, декстрозу, лактозу, маннит, микрокристаллическую целлюлозу, порошкообразную целлюлозу, сорбит, сахарозу и тальк. Наполнитель и/или разбавитель, например, может содержаться в количестве, составляющем от примерно 15 до примерно 40 мас.% в пересчете на композицию. Предпочтительные разбавители включают микрокристаллическую целлюлозу, которую получают регулируемым гидролизом альфа-целлюлозы, полученной в виде пульпы из волокнистых растительных материалов с использованием разбавленных растворов неорганических кислот. После гидролиза гидроцеллюлозу очищают фильтрованием и водную взвесь подвергают распылительной сушке с получением сухих твердых частиц, обладающих широким распределением по размерам. Подходящая микрокристаллическая целлюлоза обладает средним размером частиц, составляющим от примерно 20 нм до примерно 200 нм. Микрокристаллическая целлюлоза поступает от разных поставщиков. Подходящая микрокристаллическая целлюлоза включает Avicel РН 101, Avicel РН 102, Avicel РН 103, Avicel РН 105 и Avicel РН 200, выпускающиеся фирмой FMC Corporation. При осуществлении настоящего изобретения особенно предпочтительным является Avicel РН 102, который обладает наименьшими площадью поверхности и пористостью структуры. Предпочтительно, если микрокристаллическая целлюлоза содержится в композиции таблетки в количестве, составляющем от примерно 25 до примерно 70 мас.%. Другой предпочтительный диапазон для этого вещества составляет от примерно 30 до примерно 35 мас.%, другой предпочтительный диапазон составляет от примерно 30 до примерно 32 мас.%. Другим разбавителем является лактоза. Предпочтительно, если лактоза размолота и до использования в композиции обладает средним размером частиц, составляющим от примерно 50 мкм до примерно 500 мкм. Лактоза содержится в композиции таблетки в количестве, составляющем от примерно 5 до примерно 40 мас.% и содержание может составлять от примерно 18 до примерно 35 мас.%, и наиболее предпочтительно, если содержание может составлять от примерно 20 до примерно 25 мас.%. Можно выбрать 1, 2, 3 или большее количество веществ, обеспечивающих распадаемость. Примеры фармацевтически приемлемых веществ, обеспечивающие распадаемость включают, но не ограничиваются только ими, крахмалы; глины; целлюлозы; альгинаты; камеди; сшитые полимеры, например, сшитый поливинилпирролидон, сшитую кальциевую соль карбоксиметилцеллюлозы и сшитую натриевую соль карбоксиметилцеллюлозы; полисахариды сои; и гуаровую камедь. Вещество, обеспечивающее распадаемость, например, может содержаться в количестве, составляющем от примерно 2 до примерно 20%, например, от примерно 5 до примерно 10%, например, примерно 7 мас.% в пересчете на массу композиции. Вещество, обеспечивающее распадаемость, также является необязательным, но полезным компонентом композиции таблетки. Вещества, обеспечивающие распадаемость, включают для того, чтобы таблетка обладала приемлемой скоростью распада. Типичные вещества, обеспечивающие распадаемость включают производные крахмала и соли карбоксиметилцеллюлозы. Натриевая соль гликолята крахмала является предпочтительным веществом, обеспечивающим распадаемость, для этой композиции. Предпочтительно, если вещество, обеспечивающее распадаемость, содержится в композиции таблетки в количестве, составляющем от примерно 0 до примерно 10 мас.% и содержание может составлять от примерно 1 до примерно 4 мас.%, и наиболее предпочтительно, если содержание может составлять от примерно 1,5 до примерно 2,5 мас.%. Можно выбрать 1, 2, 3 или большее количество смазывающих веществ. Примеры фармацевтически приемлемых смазывающих веществ и фармацевтически приемлемых веществ, придающих скользкость, включают, но не ограничиваются только ими, коллоидный диоксид кремния, трисиликат магния, крахмалы, тальк, трехосновный фосфат кальция, стеарат магния, стеарат алюминия, стеарат кальция, карбонат магния, оксид магния, полиэтиленгликоль, порошкообразную целлюлозу и микрокристаллическую целлюлозу. Смазывающее вещество, например, может содержаться в количестве, составляющем от примерно 0,1 до примерно 5 мас.% в пересчете на композицию; тогда как, вещество, придающее скользкость, например, может содержаться в количестве, составляющем от примерно 0,1 до примерно 10 мас.%. Смазывающие вещества обычно прибавляют для предотвращения прилипания таблетируемых веществ к штампу, сведения к минимум трения при прессовании таблетки и обеспечения возможности отделения спрессованной таблетки от штампа. Такие смазывающие вещества обычно включают в готовую смесь для таблеток в количестве, обычно составляющем менее 1 мас.%. Смазывающий компонент может быть гидрофобным или гидрофильным. Примеры таких смазывающих веществ включают стеариновую кислоту, тальк и стеарат магния. Стеарат магния снижает трение между стенкой штампа и таблетируемой смесью во время прессования и извлечения таблеток. Он содействует предотвращению прилипания таблеток к штампам. Стеарат магния также способствует насыпанию порошка в воронку и штамп. Он обладает размером частиц в диапазоне 450-550 мкм и плотностью в диапазоне 1,00-1,80 г/мл. Он является стабильным и не полимеризуется в смеси для таблеток. Предпочтительное смазывающее вещество, стеарат магния, также используется в композиции. Предпочтительно, если смазывающее вещество содержится в композиции таблетки в количестве, составляющем от примерно 0,25 до примерно 6%; также предпочтительным является содержание, составляющее от примерно 0,5 до примерно 4 мас.%; и наиболее предпочтительно – от примерно 0,1 до примерно 2 мас.%. Другие возможные смазывающие вещества: тальк, полиэтиленгликоль, диоксид кремния и отвержденные растительные масла. В необязательном варианте осуществления настоящего изобретения смазывающее вещество не содержится в композиции, а распыляется на пуансоны или матрицы, а не прибавляется непосредственно в композицию. Необязательно можно использовать другие обычные твердые наполнители или носители, такие как, кукурузный крахмал, фосфат кальция, сульфат кальция, стеарат кальция, стеарат магния, стеариновая кислота, моно- и дистеарат глицерина, сорбит, маннит, желатин, натуральные или синтетические камеди, такие как карбоксиметилцеллюлоза, метилцеллюлоза, альгинат, декстрин, камедь акации, камедь карайи, камедь рожкового дерева, трагакантовая камедь и т.п., разбавители, связующие, смазывающие вещества, вещества, обеспечивающие распадаемость, красители и вкусовые вещества. Примеры фармацевтически приемлемых связующих включают, но не ограничиваются только ими, крахмалы; целлюлозы и их производные, например микрокристаллическую целлюлозу, гидроксипропилцеллюлозу гидроксиэтилцеллюлозу и гидроксипропилметилцеллюлозу; сахарозу; декстрозу; кукурузный сироп; полисахариды; и желатин. Связующее, например, может содержаться в количестве, составляющем от примерно 10 до примерно 40 мас.% в пересчете на композицию. Дополнительные примеры применимых инертных наполнителей описаны в публикации Handbook of pharmaceutical excipients, 3rd edition. Edited by A.H.Kibbe, Published by: American Pharmaceutical Association, Washington DC, ISBN: 0-917330-96-Х, и Handbook of Pharmaceutical Excipients (4th edition), Edited by Raymond С Rowe – Publisher: Science and Practice, которые включены в настоящее изобретение в качестве ссылки. Таким образом, в первом варианте осуществления настоящее изобретение относится к фармацевтической композиции, включающей: (a) ингибитор ДПП-IV в свободной форме или в форме молекулярной соли с кислотой, предпочтительно – LAF237; (b) фармацевтически приемлемый разбавитель, в которой в разовой дозировочной форме отношение массы ингибитора ДПП-IV, предпочтительно – LAF237, в пересчете на массу в сухом состоянии, к массе разбавителя, содержащегося в таблетке, составляет от 0,5 до 0,25, предпочтительно – от 0,4 до 0,28. Описанная выше композиция, в которой по меньшей мере одним разбавителем является микрокристаллическая целлюлоза и в которой в разовой дозировочной форме отношение массы ингибитора ДПП-IV, предпочтительно -LAF237 в пересчете на массу в сухом состоянии, к массе микрокристаллической целлюлозы, содержащейся в таблетке, составляет от 2 до 0,333, предпочтительно – от 1 до 0,333, наиболее предпочтительно – от 0,7 до 0,333. Описанная выше композиция, включающая от 20 до 120 мг LAF237 предпочтительно – от 25 до 100 мг LAF237 или его фармацевтически приемлемой молекулярной соли с кислотой. Описанная выше композиция, в которой разбавитель выбран из группы, включающей микрокристаллическую целлюлозу и лактозу, предпочтительно содержит в композиции микрокристаллическую целлюлозу и лактозу. Описанная выше композиция, которая дополнительно включает: (c) 0-20 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого вещества, обеспечивающего распадаемость; (d) 0,1-10 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого смазывающего вещества. Предпочтительной является описанная выше композиция, которая дополнительно включает: (c) 1-6 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого вещества, обеспечивающего распадаемость; (d) 0,25-6 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого смазывающего вещества. Приведенные выше отношения получены в пересчете на массу в сухом состоянии ингибиторов ДПП-IV и разбавителей. Разовая дозировочная форма представляет собой любой тип фармацевтической дозировочной формы, такой как капсулы, таблетки, гранулы, жевательные таблетки и т.п. В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, включающей: (a) 5-60 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV в свободной форме или в форме молекулярной соли с кислотой, предпочтительно LAF237; (b) 40-95 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого разбавителя; (c) 0-20 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого вещества, обеспечивающего распадаемость; и необязательно (d) 0,1-10 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого смазывающего вещества. Настоящее изобретение предпочтительно относится к фармацевтической композиции, включающей: (a) 20-40 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV в свободной форме или в форме молекулярной соли с кислотой, предпочтительно – LAF237; (b) 40-95 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого разбавителя; (c) 0-10 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого вещества, обеспечивающего распадаемость; и необязательно (d) 0,25-6 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого смазывающего вещества. Настоящее изобретение наиболее предпочтительно относится к фармацевтической композиции, включающей: (a) 20-35 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV в свободной форме или в форме молекулярной соли с кислотой, предпочтительно – LAF237; (b) 40-95 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого разбавителя; (c) 0-10 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого вещества, обеспечивающего распадаемость; и необязательно (d) 0,25-6 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого смазывающего вещества. Настоящее изобретение наиболее предпочтительно относится к фармацевтической композиции, включающей: (a) 20-35 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV в свободной форме или в форме молекулярной соли с кислотой, предпочтительно LAF237; (b) 62-78 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого разбавителя; (c) 0-10 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого вещества, обеспечивающего распадаемость; и необязательно (d) 0,1-10 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого смазывающего вещества. Настоящее изобретение наиболее предпочтительно относится к фармацевтической композиции, включающей: (a) 20-35 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV в свободной форме или в форме молекулярной соли с кислотой, предпочтительно LAF237; (b) 62-78 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого разбавителя; (c) 1-6 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого вещества, обеспечивающего распадаемость; и необязательно (d) 0,25-6 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого смазывающего вещества. Настоящее изобретение наиболее предпочтительно относится к фармацевтической композиции, включающей: (a) 22-28 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV в свободной форме или в форме молекулярной соли с кислотой, предпочтительно – LAF237; (b) 66-76 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого разбавителя; (c) 0-6 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого вещества, обеспечивающего распадаемость; и необязательно (d) 0,25-6 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого смазывающего вещества. Настоящее изобретение наиболее предпочтительно относится к фармацевтической композиции, включающей: (a) 22-28 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV в свободной форме или в форме молекулярной соли с кислотой, предпочтительно – LAF237; (b) 66-76 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого разбавителя; (c) 1-6 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого вещества, обеспечивающего распадаемость; и необязательно (d) 0,25-6 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого смазывающего вещества. В настоящей заявке указание на фармацевтически приемлемый разбавитель означает по меньшей мере один разбавитель, также включается смесь, например, 2 или 3 разбавителей. Предпочтительно, если описанные выше композиции включают: i) 1 или 2 разбавителя, выбранные из группы, включающей микрокристаллическую целлюлозу и лактозу; ii) эти 2 разбавителя – микрокристаллическую целлюлозу и лактозу; iii) 25-70%, предпочтительно – 35-55 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой микрокристаллической целлюлозы, или iv) 25-70%, предпочтительно – 35-55 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой микрокристаллической целлюлозы и 5-40%, предпочтительно – 18-35% лактозы. Наиболее предпочтительно, если описанные выше композиции включают 1 или 2 разбавителя, выбранные из группы, включающей микрокристаллическую целлюлозу, такую как Avicel PH 102, и лактозу. Наиболее предпочтительно, если фармацевтическая композиция включает фармацевтически приемлемое смазывающее вещество (d). В настоящей заявке указание на фармацевтически приемлемое вещество, обеспечивающее распадаемость, означает по меньшей мере одно вещество, обеспечивающее распадаемость, также включается смесь, например, 2 или 3 веществ, обеспечивающих распадаемость. В настоящей заявке указание на фармацевтически приемлемое смазывающее вещество означает по меньшей мере одно смазывающее вещество, также включается смесь, например, 2 или 3 смазывающих веществ. Предпочтительным ингибитором ДПП-IV является LAF237, предпочтительными разбавителями являются микрокристаллическая целлюлоза и лактоза или, предпочтительно – комбинация микрокристаллической целлюлозы и лактозы, предпочтительным веществом, обеспечивающим распадаемость, является натриевая соль гликолята крахмала, и предпочтительным смазывающим веществом является стеарат магния. Предпочтительными компонентами в предпочтительной композиции являются следующие: (a) 20-35 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV, например, LAF237; (b) 25-70 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой микрокристаллической целлюлозы; (c) 5-40 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой лактозы; (d) 0-10 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой натриевой соли гликолята крахмала; (e) 0,25-6 мас.% в пересчете на массу в сухом состоянии стеарата магния. Предпочтительными компонентами в предпочтительной композиции являются следующие: (a) 25-35 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV, например, LAF237; (b) 25-70 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой микрокристаллической целлюлозы; (c) 5-40 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой лактозы; (d) 0-10 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой натриевой соли гликолята крахмала; (e) 0,25-6 мас.% в пересчете на массу в сухом состоянии стеарата магния. Другой предпочтительной композицией является содержащая: (a) от примерно 30 до примерно 32 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV или ингибитора ДПП-IV формулы (I); (b) от примерно 40 до примерно 45 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой микрокристаллической целлюлозы; (c) от примерно 20 до примерно 25 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой лактозы; (d) от примерно 1,5 до примерно 2,5 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой натриевой соли гликолята крахмала; и (e) от примерно 0,1 до примерно 2 мас.% в пересчете на массу в сухом состоянии стеарата магния. Другой предпочтительной композицией является содержащая: (a) 20-35%, предпочтительно – 22-28 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV, например, LAF237; (b) 35-55 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой микрокристаллической целлюлозы; (c) 18-35 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой лактозы; (d) 1-4 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой натриевой соли гликолята крахмала; и (e) 0,5-4 мас.% в пересчете на массу в сухом состоянии стеарата магния. Еще одной предпочтительной композицией является содержащая: (a) от примерно 22 до примерно 28%, предпочтительно – 24-26 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV или ингибитора ДПП-IV формулы (I); (b) от примерно 45 до примерно 50 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой микрокристаллической целлюлозы; (c) от примерно 20 до примерно 25 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой лактозы; (d) от примерно 1,5 до примерно 2,5 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой натриевой соли гликолята крахмала; и (e) от примерно 0,1 до примерно 2 мас.% в пересчете на массу в сухом состоянии стеарата магния. Еще одной предпочтительной композицией является содержащая: (a) 24-26 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV или ингибитора ДПП-IV формулы (I); (b) от примерно 46 до примерно 48 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой микрокристаллической целлюлозы; (c) от примерно 23 до примерно 24,5 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой лактозы; (d) от примерно 1,5 до примерно 2,5 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой натриевой соли гликолята крахмала; и (e) от примерно 0,1 до примерно 2 мас.% в пересчете на массу в сухом состоянии стеарата магния. Еще одной предпочтительной композицией является содержащая: (a) 30-35 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV, например, LAF237; (b) 35-50 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой микрокристаллической целлюлозы; (c) 18-35 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой лактозы; (d) 1-4 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой натриевой соли гликолята крахмала; и (e) 0,5-4 мас.% в пересчете на массу в сухом состоянии стеарата магния. В другом варианте осуществления настоящее изобретение относится к любой из описанных выше композиций, в которых фармацевтически приемлемое смазывающее вещество (d) лишь необязательно содержится в композиции. Но предпочтительно, если фармацевтически приемлемое смазывающее вещество (d) содержится в композиции. Для прессованных таблеток, в особенности для таблеток, полученных прямым прессованием, предпочтительно, чтобы описанные выше композиции содержали от 20 до 35% наиболее предпочтительно – от 22 до 28 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV, предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой. К описанным в настоящем изобретении композициям необязательно можно прибавить дополнительные обычные инертные наполнители, такие как обычные твердые наполнители или носители, описанные выше в настоящем изобретении. Описанные выше композиции являются особенно подходящими для приготовления фармацевтических таблеток, например, прессованных таблеток или, предпочтительно – таблеток, полученных прямым прессованием, таблеток в форме капсул или капсул и обеспечивают необходимые физические характеристики, профили растворения и выделения лекарственного средства, как это необходимо врачу с общей подготовкой в данной области техники. Поэтому в дополнительном варианте осуществления настоящее изобретение относится к применению любой из описанных выше композиций для приготовления фармацевтических таблеток, таблеток в форме капсул или капсул, в частности, для гранулирования, прямого прессования и сухого гранулирования (агрегирования или вальцового уплотнения). Описанные выше композиции также являются особенно подходящими для приготовления таблеток, предпочтительно – прессованных таблеток и особенно предпочтительно – таблеток, полученных прямым прессованием. В частности, таблетки, полученные с помощью описанных выше композиций, в особенности приготовленные в виде таблеток, полученных прямым прессованием, или описанных ниже таблеток, полученных прямым прессованием, характеризуются лишь незначительными затруднениями, связанными с ломкостью, очень высокой прочностью при разрушении, улучшенной надежностью изготовления, оптимальными отношениями толщины таблетки к массе таблетки (таблетки, полученные прямым прессованием), меньшим содержанием воды в композиции, в особенности таблетки, полученные прямым прессованием, хорошим временем дисперсионного распада ДВ в соответствии с Британской Фармакопеей 1988 г., хорошим качеством диспергирования. Таким образом, настоящее изобретение прямого прессования ингибитора ДПП-IV включает смешивание и прессование. При выборе марок инертных наполнителей учитывается размер частиц, поддерживаемый в диапазоне, который обеспечивает однородность порошкообразной смеси и однородность содержания ингибитора ДПП-IV. Оно предотвращает разделение порошков в бункере во время прямого прессования. Преимуществами применения этих инертных наполнителей является то, что они придают порошкообразной смеси способность к прессованию, когезионность и сыпучесть. Кроме того, применение прямого прессования обеспечивает конкурентоспособность по стоимости изготовления единицы продукта, предельному сроку хранения, исключает нагрев и увлажнение, обеспечивает распад первичных частиц, механическую стабильность и обеспечивает однородность размеров частиц. Описанные преимущества предлагаемых в настоящем изобретении композиций также являются весьма полезными, например, для вальцового уплотнения или мокрого гранулирования или для заполнения капсул. При разработке описанных в настоящем изобретении композиций автор обнаружил, что прессованные таблетки, в особенности таблетки, полученные прямым прессованием, являются особенно предпочтительными, если: i) частицы, образующие ингибитор ДПП-IV, обладают размерами менее 250 мкм предпочтительно – от 10 до 250 мкм, и/или ii) содержание воды в таблетке составляет менее 10% после выдерживания в течение 1 недели при 25°С и 60% относительной влажности в помещении (OВ), и/или iii) отношения толщины таблетки к массе таблетки составляют от 0,002 до 0,06 мм/мг. Таким образом, настоящее изобретение относится к прессованной фармацевтической таблетке, предпочтительно – к фармацевтической таблетке, полученной прямым прессованием, включающей ингибитор ДПП-IV, в свободной форме или в форме молекулярной соли с кислотой, обладающий физическими характеристиками, которые делают таблетирование в фармацевтическую таблетку, полученную прямым прессованием, маловероятным или весьма затруднительным. Предпочтительным ингибитором ДПП-IV является LAF237. Таким образом, в первом варианте осуществления (а) настоящее изобретение относится к прессованным таблеткам, предпочтительно – к фармацевтическим таблеткам прямого прессования, в которой дисперсия содержит частицы, включающие ингибитор ДПП-IV, предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой, и в которых по меньшей мере 60%, предпочтительно – 80% и наиболее предпочтительно – 90% частиц, содержащихся в таблетке, обладают размерами, меньшими 250 мкм или, предпочтительно – от 10 до 250 мкм. Настоящее изобретение относится к прессованным таблеткам, предпочтительно – к фармацевтическим таблеткам прямого прессования, в которой дисперсия содержит частицы, включающие ингибитор ДПП-IV, предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой, и в которых по меньшей мере 60%, предпочтительно – 80% и наиболее предпочтительно – 90% частиц, содержащихся в таблетке, обладают размерами, превышающими 10 мкм. Термин “в которой по меньшей мере 60%, предпочтительно – 80% и наиболее предпочтительно – 90%” означает по меньшей мере 60%, предпочтительно – по меньшей мере 80% и наиболее предпочтительно – по меньшей мере 90%. Термин “в которой по меньшей мере 25%, предпочтительно – 35% и наиболее предпочтительно – 45%” означает по меньшей мере 25%, предпочтительно – по меньшей мере 35% и наиболее предпочтительно – по меньшей мере 45%. В частности, настоящее изобретение относится к прессованным таблеткам, предпочтительно – к фармацевтическим таблеткам прямого прессования, в которой дисперсия содержит частицы, включающие ингибитор ДПП-IV, предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой, и в которых по меньшей мере 25%, предпочтительно – 35% и наиболее предпочтительно – 45% частиц, содержащихся в таблетке, обладают размерами от 50 до 150 мкм. Во втором варианте осуществления (b) настоящее изобретение относится к прессованной таблетке, предпочтительно – к фармацевтической таблетке, полученной прямым прессованием, в которой дисперсия содержит частицы, включающие ингибитор ДПП-IV, предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой, и в которых отношения толщины таблетки к массе таблетки составляют от 0,002 до 0,06 мм/мг предпочтительно – от 0,01 до 0,03 мм/мг. Комбинация описанных выше первого и второго вариантов осуществления (а) и (b) дает прессованные таблетки, предпочтительно – таблетки, полученные прямым прессованием, обладающие хорошими характеристиками уплотнения. Таким образом, настоящее изобретение также относится к прессованной таблетке, предпочтительно – к таблетке, полученной прямым прессованием, в которой дисперсия содержит частицы, включающие ингибитор ДПП-IV, предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой, и в которой: i) по меньшей мере 60%, предпочтительно – 80% и наиболее предпочтительно – 90% частиц, содержащихся в таблетке, обладают размерами, меньшими 250 мкм или, предпочтительно – от 10 до 250 мкм, и ii) отношения толщины таблетки к массе таблетки составляют от 0,002 до 0,06 мм/мг или от 0,01 до 0,03 мм/мг предпочтительно в которой: i) по меньшей мере 25%, предпочтительно – 35% и наиболее предпочтительно – 45% частиц, содержащихся в таблетке, обладают размерами от 50 до 150 мкм, и ii) отношения толщины таблетки к массе таблетки составляют от 0,002 до 0,06 мм/мг или от 0,01 до 0,03 мм/мг. В третьем варианте осуществления настоящее изобретение относится к прессованной таблетке предпочтительно – к фармацевтической таблетке, полученной прямым прессованием, в которой дисперсия содержит частицы, включающие ингибитор ДПП-IV, предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой, и в которой: i) по меньшей мере 60%, предпочтительно – 80% и наиболее предпочтительно – 90% частиц, содержащихся в таблетке, обладают размерами, меньшими 250 мкм предпочтительно – от 10 до 250 мкм, ii) содержание воды в таблетке составляет менее 10% после выдерживания в течение 1 недели при 25°С и 60% OВ, и iii) отношения толщины таблетки к массе таблетки составляют от 0,002 до 0,06 мм/мг. Настоящее изобретение предпочтительно относится к прессованной таблетке, наиболее предпочтительно – к таблетке, полученной прямым прессованием, в которой дисперсия содержит частицы, включающие ингибитор ДПП-IV, предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой, и в которой: i) по меньшей мере 25%, предпочтительно – 35% и наиболее предпочтительно – 45% частиц, содержащихся в таблетке, обладают размерами от 50 до 150 мкм, ii) содержание воды в таблетке составляет менее 10% после выдерживания в течение 1 недели при 25°С и 60% OВ, и iii) отношения толщины таблетки к массе таблетки составляют от 0,002 до 0,06 мм/мг. Настоящее изобретение предпочтительно относится к прессованной таблетке наиболее предпочтительно – к таблетке, полученной прямым прессованием, в которой дисперсия содержит частицы, включающие ингибитор ДПП-IV, предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой, и в которой: i) по меньшей мере 25%, предпочтительно – 35% и наиболее предпочтительно – 45% частиц, содержащихся в таблетке, обладают размерами от 50 до 150 мкм, ii) содержание воды в таблетке составляет менее 5% после выдерживания в течение 1 недели при 25°С и 60% OВ, и iii) отношения толщины таблетки к массе таблетки составляют от 0,002 до 0,06 мм/мг. Настоящее изобретение предпочтительно относится к прессованной таблетке, наиболее предпочтительно – к таблетке, полученной прямым прессованием, в которой дисперсия содержит частицы, включающие ингибитор ДПП-IV, предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой, и в которой: i) по меньшей мере 25%, предпочтительно – 35% и наиболее предпочтительно – 45% частиц, содержащихся в таблетке, обладают размерами от 50 до 150 мкм, ii) содержание воды в таблетке составляет менее 5% после выдерживания в течение 1 недели при 25°С и 60% OВ, и iii) отношения толщины таблетки к массе таблетки составляют от 0,01 до 0,03 мм/мг. В особенно предпочтительном варианте осуществления описанные выше 3 варианта осуществления, т.е. прессованные таблетки и таблетки, полученные прямым прессованием, содержат описанные в настоящем изобретении композиции, такие как фармацевтическая композиция, включающая: (a) 20-35 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV в свободной форме или в форме молекулярной соли с кислотой, предпочтительно – LAF237; (b) 40-95 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого разбавителя; (c) 0-10 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого вещества, обеспечивающего распадаемость; (d) 0,25-6 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого смазывающего вещества. Предпочтительно, если частицы ДПП-IV, предпочтительно – частицы LAF237 включают более 70% ингибитора ДПП-IV, наиболее предпочтительно – более 90% или 95% и еще более предпочтительно – более 98% ингибитора ДПП-IV. Предпочтительно, если частицы LAF237 включают более 70% LAF237, наиболее предпочтительно – более 90% или 95% и еще более предпочтительно – более 98% LAF237. Согласно изобретению обнаружено, что определенные распределения частиц по размерам ингибитора ДПП-IV, предпочтительно – LAF237 особенно важны для обеспечения наилучшего уплотнения таблеток. В дополнительном предпочтительном варианте осуществления распределение частиц по размерам для выбранных инертных наполнителей (b), (с) и/или (d) сходно с распределением по размерам для частиц ингибитора ДПП-IV, предпочтительно – частиц LAF237. Термин “сходно”, означает, что размеры частиц инертного наполнителя в таблетке составляют от 5 до 400 мкм, или от 10 до 300 мкм, предпочтительно – от 10 до 250 мкм. Предпочтительные инертные наполнители, обладающие надлежащим распределением частиц по размерам, описаны, например, в публикации Handbook of Pharmaceutical Excipients (4th edition). Edited by Raymond С Rowe – Publisher: Science and Practice. Размер частиц лекарственного средства, например, размер частиц LAF237 регулируется путем кристаллизации, сушки и/или размола/просеивания (неограничивающие примеры описаны ниже). Размер частиц также можно уменьшить с помощью вальцового уплотнения и размола/просеивания. Получение частиц надлежащего размера хорошо известно и описано в данной области техники, например, в публикации “Pharmaceutical dosage forms: volume 2, 2nd edition, Ed.: H.A.Lieberman, L.Lachman, J.B.Schwartz (Chapter 3: SIZE REDUCTION)”. Исследованы частицы разного размера и обнаружено, что описанный в настоящем изобретении конкретный диапазон обеспечивает неожиданно хорошие результаты при прямом прессовании. ОПРЕДЕЛЕНИЕ РАСПРЕДЕЛЕНИЯ ЧАСТИЦ ПО РАЗМЕРАМ С ПОМОЩЬЮ СИТОВОГО АНАЛИЗА: Распределение частиц по размерам определяют с помощью ситового анализа, фотонной корреляционной спектроскопии или лазерной дифракции (международный стандарт ISO 13320-1), или электронной сенсорной зоны, поглощения света, седиментации или микроскопии, которые представляют собой методики, хорошо известные специалисту в данной области техники. Рассеивание является одной из самых старых методик классификации порошков по распределению частиц по размерам. Такие методики хорошо известны и описаны в данной области техники, например, в любом учебнике по аналитической химии или в Фармакопее США (ФСША) в публикации USP-NF (2004 – Chapter 786 – (The United States Pharmacopeial Convention, Inc., Rockville, MD)), в которой описаны стандарты, утвержденные к применению Управлением по контролю качества пищевых продуктов, медикаментов и косметических средств США (УПМ). Использованные методики описаны, например, в публикации Pharmaceutical dosage forms: volume 2, 2nd edition, Ed.: H.A.Lieberman, L.Lachman, J.B.Schwartz и являются хорошими примерами. Также отмечены (стр.187) дополнительные методики: электронной сенсорной зоны, поглощения света, проницаемости для воздуха, седиментации в газе или жидкости. При определении размеров частиц просеиванием с использованием струи воздуха воздух продувают вверх сквозь сито через вращающуюся щель, так что материал, находящийся в сите, подвергается псевдоожижению. Одновременно ко дну сита прилагается отрицательное давление, с помощью которого мелкие частицы удаляются в накопительное устройство. Ситовый анализ и определение среднего размера частиц проводят путем удаления частиц со стороны распределения, соответствующей мелким частицам, путем использования последовательности отдельных сит. Более подробное описание см. также в публикации “Particle Size Measurement”, 5th Ed., p.178, vol.1; Т.Allen, Chapman & Hall, London, UK, 1997. Для специалиста в данной области техники измерение размера, такое как указанное, является стандартной процедурой. Содержание воды в таблетке можно определить по методике потерь при сушке или по методике Карла Фишера, которые являются методиками, хорошо известными специалисту в данной области техники (например, содержание воды можно определить по потерям при сушке с помощью термогравиметрии). Такие методики methods хорошо известны и описаны в данной области техники, например, в любом учебнике по аналитической химии (J.A.Dean, Analytical Chemistry Handbook, Section 19, McGraw-Hill, New York, 1995) и в Фармакопее США (ФСША) в публикации USP-NF (2004), в которой описаны стандарты, утвержденные к применению Управлением по контролю качества пищевых продуктов, медикаментов и косметических средств США (УПМ) (2004 – ФСША – Chapter 921). Толщину таблетки измеряют линейкой, штангенциркулем с нониусом, микрометром или любым электронным способом измерения размеров. Для получения отношения мы берем толщину таблетки, выраженную в миллиметрах, и делим ее на массу таблетки, выраженную в миллиграммах. Такие методики хорошо известны и описаны в данной области техники, например, в любом учебнике по аналитической химии или в Фармакопее США (ФСША) в публикации USP-NF (2004), в которой описаны стандарты, утвержденные к применению Управлением по контролю качества пищевых продуктов, медикаментов и косметических средств США (УПМ). Настоящее изобретение предпочтительно относится к прессованной таблетке или таблетке, полученной прямым прессованием, которая способна диспергироваться в воде в течение периода времени, составляющего от 5 до 15 мин, с получением дисперсии, которая может проходить через сито, обладающее размером отверстий, равным 710 мкм, в соответствии с указанным в настоящем изобретении тестом Британской Фармакопеи для диспергирующихся таблеток. Таблетка, предлагаемая в настоящем изобретении, наряду с тем, что она быстро диспергируется в воде, обладает тем дополнительным преимуществом, что она соответствует требованиям теста Британской Фармакопеи (БФ) для диспергирующихся таблеток в отношении времени диспергирования и качестве дисперсии (т.е. прохождения через сито, обладающее размером отверстий, равным 710 мкм). Предпочтительно, если время диспергирования таблетки, предлагаемой в настоящем изобретении, составляет менее 15 мин, более предпочтительно – менее 12 мин и наиболее предпочтительно – менее 10 мин. Другим преимуществом таблеток, предлагаемых в настоящем изобретении, является то, что вследствие образования относительно мелкой дисперсии таблетка обладает меньшим временем растворения и поэтому лекарственное средство может намного быстрее всасываться в кровоток. Кроме того, малые времена диспергирования и относительно мелкие дисперсии, образуемые таблетками, предлагаемыми в настоящем изобретении, также являются полезными для проглатываемых таблеток. Таким образом, таблетки, предлагаемые в настоящем изобретении, можно использовать и для диспергирования в воде, и для непосредственного проглатывания. Те таблетки, предлагаемые в настоящем изобретении, которые предназначены для проглатывания, предпочтительно снабжать пленочным покрытием для облегчения проглатывания. В другом варианте осуществления настоящее изобретение относится к прессованной таблетке, обладающей повышенными скоростями растворения (растворения лекарственного средства), в которой дисперсия содержит частицы, т.е. частицы ДПП-IV, предпочтительно – частицы LAF237, включающие ингибитор ДПП-IV, предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой, в которой по меньшей мере 60%, предпочтительно – 80% и наиболее предпочтительно – 90% частиц, содержащихся в таблетке, обладают размерами от 10 до 250 мм, и в которой: i) от 0 до 10 мин от 85 до 99,5% выделяется активного ингредиента, и ii) от 10 до 15 мин от 90 до 99,5% выделяется активного ингредиента, предпочтительно в которой: i) в течение от 0 до 10 мин выделяется от 88 до 99,5% активного ингредиента, и ii) в течение от 10 до 15 мин выделяется от 95 до 99,5% активного ингредиента, или предпочтительно: i) в течение от 0 до 10 мин выделяется от 89 до 94% активного ингредиента, и ii) в течение от 10 до 15 мин выделяется от 96 до 99% активного ингредиента. Методика лопастного смесителя для измерения скорости растворения лекарственного средства (выраженного в процентах выделение) используется с применением 1000 мл 0,01 н. НСl. Такие методики хорошо известны и описаны в данной области техники, например, в любом учебнике по аналитической химии или в Фармакопее США (ФСША) в публикации USP-NF (2004 – Chapter 711), в которой описаны стандарты, утвержденные к применению Управлением по контролю качества пищевых продуктов, медикаментов и косметических средств США (УПМ). Настоящее изобретение также относится к способу получения прессованной таблетки ингибитора ДПП-IV в разовой дозировочной форме, в котором: i) по меньшей мере 60%, предпочтительно – 80% и наиболее предпочтительно – 90% частиц, включающих ингибитор ДПП-IV предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой, в таблетке обладают размерами от 10 до 250 мкм, ii) содержание воды в таблетке составляет менее 10% после выдерживания в течение 1 недели при 25°С и 60% OВ, и iii) отношения толщины таблетки к массе таблетки составляют от 0,002 до 0,06 мм который включает: (а) смешивание в количествах, выраженных в мас.% в пересчете на массу в сухом состоянии: (i) 5-60 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV, например, LAF237; и (ii) и по меньшей мере один инертный наполнитель, выбранный из группы, включающей разбавитель, вещество, обеспечивающее распадаемость, и смазывающее вещество, с получением композиции ингибитора ДПП-IV в форме таблетирующегося порошка, пригодного для прямого прессования в таблетку; и (b) прессование композиции, полученной на стадии (а), с получением таблетки ингибитора ДПП-IV в виде разовой дозировочной формы. Предпочтительно, если описанный выше способ включает: (a) смешивание в количествах, выраженных в мас.% в пересчете на массу в сухом состоянии: (i) 5-60 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV, например, LAF237; (ii) 40-95 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого разбавителя; (iii) 0-20 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого вещества, обеспечивающего распадаемость; и (iv) 0,1-10 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого смазывающего вещества, с получением композиции ингибитора ДПП-IV в форме таблетирующегося порошка, пригодного для прямого прессования в таблетку; и (b) прессование композиции, полученной на стадии (а), с получением таблетки ингибитора ДПП-IV в виде разовой дозировочной формы. Наиболее предпочтительно, если способ включает: (а) смешивание в количествах, выраженных в мас.% в пересчете на массу в сухом состоянии: (i) 25-35 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV, например, LAF237; (ii) 40-95 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого разбавителя; (iii) 0-10 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого вещества, обеспечивающего распадаемость; и (iv) 0,25-6 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого смазывающего вещества, с получением композиции ингибитора ДПП-IV в форме таблетирующегося порошка, пригодного для прямого прессования в таблетку; и (b) прессование композиции, полученной на стадии (а), с получением таблетки ингибитора ДПП-IV в виде разовой дозировочной формы. Предпочтительно, если смешанная композиция, применяющаяся на стадии (а), выбрана из числа описанных в настоящем изобретении предпочтительных композиций. Предпочтительным ингибитором ДПП-IV является LAF237, предпочтительными разбавителями являются микрокристаллическая целлюлоза или лактоза или, предпочтительно – комбинация микрокристаллической целлюлозы и лактозы, предпочтительным веществом, обеспечивающим распадаемость, является натриевая соль гликолята крахмала, и предпочтительным смазывающим веществом является стеарат магния. В наилучшем варианте осуществления способ включает: (a) смешивание в количествах, выраженных в мас.% в пересчете на массу в сухом состоянии: (i) 20-35% или, предпочтительно – 25-30 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой; (ii) 25-70 мас.% или, предпочтительно – 35-50 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой микрокристаллической целлюлозы, такой как AvicelPH 102; (iii) 5-40 мас.% или, предпочтительно – 18-35 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой лактозы; (iv) 0-10 мас.% или, предпочтительно – 1-4 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой натриевой соли гликолята крахмала; и (v) 0,25-6 мас.% или, предпочтительно – 0,5-4 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемого стеарата магния. с получением композиции ингибитора ДПП-IV в форме таблетирующегося порошка, пригодного для прямого прессования в таблетку; и (b) прессование композиции, полученной на стадии (а), с получением таблетки ингибитора ДПП-IV в виде разовой дозировочной формы. Настоящее изобретение также относится к способу получения прессованной таблетки ингибитора ДПП-IV в разовой дозировочной форме, который включает: (a) смешивание в количествах, выраженных в мас.% в пересчете на массу в сухом состоянии: (i) 30-32 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой; (ii) 40-45 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой микрокристаллической целлюлозы (Avicel PH 102); (iii) 20-25 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой лактозы; (iv) 1,5-2 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой натриевой соли гликолята крахмала; и (v) 0,1-2 мас.% в пересчете на массу в сухом состоянии стеарата магния, с получением композиции ингибитора ДПП-IV в форме таблетирующегося порошка, пригодного для прямого прессования в таблетку; и (b) прессование композиции, полученной на стадии (а), с получением таблетки ингибитора ДПП-IV в виде разовой дозировочной формы. Настоящее изобретение также относится к способу получения прессованной таблетки ингибитора ДПП-IV в разовой дозировочной форме, который включает: (а) смешивание в количествах, выраженных в мас.% в пересчете на массу в сухом состоянии: (i) 23-28 мас.% в пересчете на массу в сухом состоянии ингибитора ДПП-IV предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой; (ii) 45-50 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой микрокристаллической целлюлозы (Avicel PH 102); (iii) 20-25 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой лактозы; (iv) 1,5-2 мас.% в пересчете на массу в сухом состоянии фармацевтически приемлемой натриевой соли гликолята крахмала; и (v) 0,1-2 мас.% в пересчете на массу в сухом состоянии стеарата магния, с получением композиции ингибитора ДПП-IV в форме таблетирующегося порошка, пригодного для прямого прессования в таблетку; и (b) прессование композиции, полученной на стадии (а), с получением таблетки ингибитора ДПП-IV в виде разовой дозировочной формы. До стадии прессования (b) для композиции предпочтительно провести стадию просеивания для основного устранения комков, т.е. для устранения любых агломератов/уплотненного вещества. В другом варианте осуществления настоящее изобретение относится к капсуле, включающей описанные выше фармацевтические композиции, и предпочтительно в которой: i) по меньшей мере 60%, предпочтительно – 80% и наиболее предпочтительно – 90% частиц, образующих ингибитор ДПП-IV, предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой, в капсуле обладают размерами от 10 до 500 мкм, ii) содержание воды в таблетке составляет менее 10% после выдерживания в течение 1 недели при 25°С и 60% OВ. Более предпочтительно, если капсула содержит описанные выше фармацевтические композиции и предпочтительно в которой: i) по меньшей мере 60%, предпочтительно – 80% и наиболее предпочтительно – 90% частиц, включающих ингибитор ДПП-IV, предпочтительно – LAF237, в свободной форме или в форме молекулярной соли с кислотой, в капсуле обладают размерами от 10 до 250 мкм, ii) содержание воды в таблетке составляет менее 5% после выдерживания в течение 1 недели при 25°С и 60% OВ. Готовый продукт получают в форме таблеток, капсул и т.п. путем использования обычного таблетирующего или аналогичного оборудования. Наиболее предпочтительно, если ингибитор ДПП-IV для описанных в настоящем изобретении композиций, прессованных таблеток или способов выбран из группы, включающей 1-{2-[(5-цианопиридин-2-ил)амино]этиламино]ацетил-2-(S)-цианопирролидиндигидрохлорид, (S)-1-[(3-гидрокси-1-адамантил)амино]ацетил-2-цианопирролидин, L-трео-изолейцилтиазолидин, МК-0431, GSK23A, BMS-477118, 3-(аминометил)-2-изобутил-1-оксо-4-фенил-1,2-дигидро-6-изохинолинкарбоксамид и 2-{[3-(аминометил)-2-изобутил-4-фенил-1-оксо-1,2-дигидро-6-изохинолил]окси}ацетамид и необязательно в любом случае их фармацевтические соли. Наиболее предпочтительно, если ингибитором ДПП-IV является 1-[3-гидроксиадамант-1-иламино)-ацетил]-пирролидин-2(S)-карбонитрил (LAF237, или вилдаглиптин). В другом варианте осуществления настоящее изобретение относится к применению описанных в настоящем изобретении композиций, капсул, таблеток, прессованных таблеток, таблеток, полученных прямым прессованием, для лечения патологических состояний, таких как инсулиннезависимый сахарный диабет, артрит, ожирение, трансплантация аллотрансплантата, связанный с кальцитонином остеопороз, сердечная недостаточность, нарушенный метаболизм глюкозы, НПГ (нарушенная переносимость глюкозы), нейродегенеративные заболевания, такие как болезнь Альцгеймера и болезнь Паркинсона, модуляции гиперлипидемии, модуляции патологических состояний, связанных с гиперлипидемией, или для снижения уровней липопротеинов очень низкой плотности, липопротеинов низкой плотности, и Lp(a), сердечно-сосудистые заболевания или заболевания почек, например диабетическая кардиомиопатия, гипертрофия левого или правого желудочка, гипертрофическое медиальное утолщение артерий и/или крупных сосудов, гипертрофия мезентериальной сосудистой системы, мезентериальная гипертрофия, нейродегенеративные заболевания и нарушения познавательной способности, для обеспечения седативного или анксиолитического эффекта, для ослабления послеоперационных катаболических изменений и гормональной реакции на стресс, для снижения летальности и заболеваемости после инфаркта миокарда, для лечения патологических состояний, связанных с указанными эффектами, которые могут быть опосредованы с помощью GLP-1 и/или GLP-2. В каждом случае, в частности, в содержании пунктов формулы изобретения, относящихся к соединениям, в характеристиках конечных продуктов, описанных в примерах, в описаниях конечных продуктов, в методиках анализа и исследования (например, в документах ФСША), методиках получения частиц необходимого размера, фармацевтических препаратов, инертных наполнителей и в формуле изобретения в настоящее изобретение включены в качестве ссылки указанные в настоящей заявке публикации или заявки на патенты. Настоящее изобретение дополнительно иллюстрируется следующими примерами: Пример 1 Для получения таблетки, содержащей 25 мг активного ингредиента (таблетки, полученной прямым прессованием), готовят загрузку массой 7 кг с использованием следующих количеств в пересчете на единицу продукции: на единицу продукции 25 мг соединения 1-[3-гидроксиадамант-1-иламино)-ацетил]-пирролидин-2(S)-карбонитрила смешивают с 35,1 мг микрокристаллической целлюлозы, 17,5 мг безводной лактозы и 1,6 мг натриевой соли гликолята крахмала. Ингредиенты предварительно смешивают в промышленном бункерном смесителе, затем просеивают через сито с размером отверстий, равным 500 или 850 мкм. Смесь повторно перемешивают в промышленном бункерном смесителе, затем прибавляют в количестве стеарата магния, необходимое для включения 0,8 мг стеарата магния в таблетку, содержащую 25 мг активного ингредиента. На каждой стадии для обеспечения однородности смеси перемешивание проводят с помощью примерно 150-450 оборотов. После повторного перемешивания в бункерном смесителе смесь можно таблетировать в обычной таблетирующей машине. В случае таблетки, содержащей 25 мг активного ингредиента, масса одной таблетки составляет 80 мг. Таблетки, содержащие 50 мг активного ингредиента, обладают массой, равной 160 мг, и таблетки, содержащие 100 мг активного ингредиента, обладают массой, равной 320 мг соответственно. Смесь является порошком, который обладает превосходной сжимаемостью с образованием таблетки необходимого размера. Пример 2 Тот же способ, который описан выше в примере 1, можно использовать для приготовления описанной ниже предпочтительной таблетки, содержащей 50 мг активного ингредиента (полученной прямым прессованием).
Пример 3 Таблетки, приготовленные в соответствии с приведенным выше описанием и примерами, можно исследовать следующим образом. Методики исследования таблеток 1. Средняя масса таблетки. 20 таблеток взвешивают на аналитических весах и рассчитывают среднюю массу таблетки. 2. Прочность таблетки при разрушении (в килофунтах). 5 таблеток по отдельности исследуют с помощью прибора Schleuniger для определения прочности на раздавливание и рассчитывают среднюю прочность при разрушении. 3. Ломкость (потери в %). 10 точно взвешенных таблеток исследуют на ломкость в течение 10 мин с помощью прибора Roche Friabilator. Из таблеток удаляют пыль, их повторно взвешивают и потерю массы вследствие ломкости рассчитывать в процентах от исходной массы. 4. Время дисперсионного распада ДВ (Тест для диспергирующихся таблеток, описанный в British Pharmacopoeia, 1988, Volume II, page 895 – BP 1988). 6 таблеток исследуют в соответствии с указанным выше тестом БФ (без дисков) для диспергирующихся таблеток. При этом используют воду, обладающую температурой, равной 19-21°С. 5. Качество диспергирования. В соответствии с тестом БФ для однородности диспергирования для диспергирующихся таблеток (BP 1988 Volume II page 895) 2 таблетки помещают в 100 мл воды, обладающей температурой, равной 19-21°С, и дают им диспергироваться. Методики исследования гранул 1. Потери при сушке (ППС). Остаточную влажность гранулы (ППС) можно определить для образца массой 3-4 г с использованием анализатора влажности Computrac, установленного на температуру, равную 90°С, по методике, указанной изготовителем. 2. Средневзвешенный диаметр (СВД). Образец гранул массой 10 г просеивают в течение 2 мин при соответствующих импульсах и амплитудах просеивания на ультразвуковом сите Allen Bradley в соответствии с инструкциями изготовителя. Используют сита с размерами отверстий, равными 300, 250, 200, 150, 100, 53 и 40 мкм. СВД рассчитывают с помощью компьютерной программы по выраженным в процентах суммарным количествам вещества, проходящего через каждое сито. Пример 4 Улучшенная надежность изготовления Предварительную оценку прессуемости проводят с помощью пресса Carver с использованием различных композиций, а также бинарных смесей LAF 237 с различными инертными наполнителями, например микрокристаллической целлюлозой (Avicel PHI 02). Полученные данные показывают, что для предлагаемых в настоящем изобретении композиций при прессовании с повышающимся давлением (усилием прессования) обнаруживается значительное увеличение прочности таблетки. В частности, например, для смеси LAF237 с Avicel обнаруживается значительное увеличение прочности таблетки. Эти результаты показывают, что с точки зрения прессуемости микрокристаллическая целлюлоза, например, Avicel, является предпочтительным инертным наполнителем для объединения с LAF237. При увеличении давления (усилия прессования) для предлагаемых в настоящем изобретении композиций и выбранных диапазонов обнаруживается значительное увеличение прочности таблетки. Исследования прессуемости (D. Becker, personal communication) проводят с помощью оборудованного измерительной аппаратурой однопозиционного пресса Korsch с установленными на верхней и нижней частях пресса датчиками усилия и смещения. Из этих данных получены убедительные свидетельства того, что без разбавления достаточным количеством наполнителя, обладающего превосходной прессуемостью, содержание LAF237 таблетки обладают низкой твердостью/прочностью на раздавливание. Предлагаемые в настоящем изобретении композиции и выбранные диапазоны являются особенно подходящими для обеспечения необходимой прессуемости. С этой точки зрения микрокристаллическая целлюлоза, например, Avicel является хорошим наполнителем. Пример 5 Ломкость Исследования проведены с использованием прибора Manesty Betapress при 6 различных настройках: при 66-90 оборотов/мин (63000-86000 ТРН) и усилии, равном 7,5-15 кН. В исследованиях использовали насадки с плоскими гранями и скошенной кромкой (ПГСК) диаметром 9 мм для таблеток массой 250 мг и диаметром 10 мм для таблеток массой 310 мг (в зависимости от массы исследуемой таблетки использовали и другие диаметры). Полные массы таблеток выбирали так, чтобы таблетки ПГСК диаметром 9 и 10 мм содержали 100 мг LAF237 и таблетки обладали одинаковой толщиной. Определяли ломкость, профиль прессования, зависимость деформация-скорость и изменения массы. Полученные при исследовании результаты, включая данные по ломкости, использованы для определения переменных (распределения частиц по размерам в композиции, массы и толщины таблетки, содержания воды в таблетке и т.п.), влияющих на твердость. Пример 6 Механическое усилие (распределение частиц по размерам) Материал, содержащий частицы, обладающие размерами в необходимом диапазоне, можно получить из любой формы вилдаглиптина (LAF237), например, аморфного вилдаглиптина, с помощью механического усилия. Это усилие можно приложить с помощью ударного, сдвигового или сжимающего воздействия. В большинстве из имеющегося в продаже размалывающего оборудования используется комбинация этих воздействий. Для вилдаглиптина предпочтительно использовать механическую ударную или вихревую мельницу. Наиболее предпочтительная механическая ударная мельница может включать разного рода била, сита, облицовки и шарнирные листы. Для нашего способа предпочтительно использовать ударную мельницу с пластинчатым билом и щелевым ситом размером 5×2,5 см. Скорость при соударении должна меняться в диапазоне от 2 до 100 м/с (линейная скорость) в соответствии с изменениями от партии к партии. В нашем случае используется линейная скорость била, равная примерно 40-50 м/с.
Формула изобретения
1. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования, в которой дисперсия включает частицы, содержащие ингибитор ДПП-IV, представляющий собой (S)-1-[(3-гидрокси-1-адамантил)амино]ацетил-2-цианопирролидин в свободной форме или в форме кислотной соли присоединения, причем по меньшей мере 60% распределения частиц по размерам в таблетке составляет менее чем 250 мкм. 2. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.1, в которой дисперсия включает частицы, содержащие ингибитор ДПП-IV, представляющий собой (S)-1-[(3-гидрокси-1-адамантил)амино]ацетил-2-цианопирролидин в свободной форме или в форме кислотной соли присоединения, и при этом 3. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.1 или 2, в которой дисперсия включает частицы, содержащие ингибитор ДПП-IV, представляющий собой (S)-1-[(3-гидрокси-1-адамантил)амино]ацетил-2-цианопирролидин в свободной форме или в форме кислотной соли присоединения, и при этом 4. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.1, в которой распределение частиц по размерам в таблетке составляет от 50 до 150 мкм. 5. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.1, в которой содержание воды в таблетке составляет менее 5% через 1 неделю при 25°С и 60% относительной влажности в помещении. 6. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.1, в которой отношение толщины к массе таблетки составляет от 0,01 до 0,03 мм/мг. 7. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.1, в которой по меньшей мере 60% или по меньшей мере 80% распределения частиц по размерам в таблетке составляет от 10 до 250 мкм. 8. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.1, в которой по меньшей мере 25% или по меньшей мере 35% распределения частиц по размерам в таблетке составляет от 50 до 150 мкм. 9. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.1, где таблетка содержит 10. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.9, где таблетка содержит 11. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.9 или 10, где таблетка содержит 12. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.9 или 10, где таблетка содержит (а) 22-28 мас.% в пересчете на массу в сухом состоянии (S)-1-[(3-гидрокси-1-адамантил)амино]ацетил-2-цианопирролидина в свободной форме или в форме кислотной соли присоединения. 13. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.9 или 10, где таблетка содержит 14. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.9 или 10, включающая: 15. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.9 или 10, включающая: 16. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.9 или 10, включающая: 17. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.9 или 10, включающая: 18. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.9 или 10, включающая: 19. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по п.9 или 10, включающая: 20. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по любому из пп.1, 2, 4-10, из которой 21. Спрессованная фармацевтическая таблетка или фармацевтическая таблетка прямого прессования по любому из пп.1, 2, 4-10, в которой распределение частиц по размерам фармацевтически приемлемых эксципиентов в таблетке составляет от 5 до 400 мкм. 22. Спрессованная фармацевтическая таблетка по любому из пп.1, 2, 4-10, которая представляет собой фармацевтическую таблетку, полученную прямым прессованием. 23. Способ получения таблетки прямого прессования по любому из пп.1-22, в виде разовой дозированной формы, который включает: 24. Способ по п.23, в котором смешанную композицию, используемую на стадии (а), выбирают из композиций по пп.9-19. 25. Способ получения таблетки прямого прессования по любому из пп.1-22, в виде разовой дозированной формы, который включает: 26. Способ по п.25, в котором смешанная композиция включает:
|
|||||||||||||||||||||||||||||

 0011
0011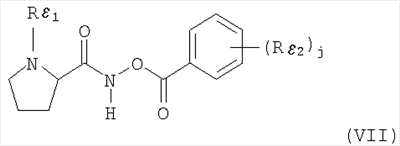
 1 обозначает боковую цепь природной аминокислоты; и
1 обозначает боковую цепь природной аминокислоты; и