Патент на изобретение №2391094
|
||||||||||||||||||||||||||
(54) ПРИМЕНЕНИЕ АГОНИСТА РЕЦЕПТОРА S1P И СПОСОБ ЛЕЧЕНИЯ, ОБЛЕГЧЕНИЯ ИЛИ ЗАДЕРЖКИ ПРОГРЕССИРОВАНИЯ НЕВРИТА ЗРИТЕЛЬНОГО НЕРВА ИЛИ ДЕМИЕЛИНИЗАЦИОННЫХ ЗАБОЛЕВАНИЙ
(57) Реферат:
Изобретение относится к лекарственным средствам и касается применения 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола в свободном виде или в виде фармацевтически приемлемой соли, или фосфата FTY720 при изготовлении лекарственного средства для лечения, облегчения или задержки прогрессирования неврита зрительного нерва. Также раскрыт способ лечения, облегчения или задержки прогрессирования неврита зрительного нерва у нуждающегося в этом субъекта, включающий введение указанному субъекту терапевтически эффективного количества 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола в свободном виде или в виде фармацевтически приемлемой соли, или фосфата FTY720, или терапевтически эффективного количества а) 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола или его фосфата в свободном виде или в виде фармацевтически приемлемой соли, и б) по меньшей мере одного сопутствующего агента, который выбирают из группы, состоящей из интерферонов и ингибиторов mTor. Изобретение направлено на расширение арсенала средств для лечения неврита зрительного нерва. 3 н. и 6 з.п. ф-лы.
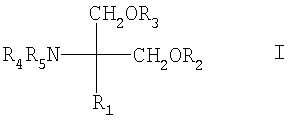
Настоящее изобретение относится к фармацевтическим комбинациям, содержащим, по меньшей мере, один агонист рецептора S1P, и их применению для лечения демиелинизационных заболеваний, например, рассеянного склероза и ассоциированных с ним болезней. Рассеянный склероз является иммунно-опосредованной болезнью белого вещества центральной нервной системы (ЦНС) с хронической воспалительной демиелинизацией, приводящей к угасанию двигательных и сенсорных функций и долговременной нетрудоспособности. Обычно клинические проявления заболевания начинаются в раннем периоде зрелости, при этом женщины численно превосходят мужчин в соотношении 2:1. Лечение рассеянного склероза эффективно только от части и в большинстве случаев может предоставить всего лишь задержку прогрессирования заболевания, несмотря на противовоспалительное и иммуносупрессивное лечение. Обычно клиницисты подразделяют пациентов на четыре типа моделей болезни (рассеянного склероза): – Рецидивирующий-ослабевающий (RR-MS): Отдельные двигательные, сенсорные, мозжечковые или визуальные приступы болезни, которые происходят более 1-2 недель и зачастую затухают через 1-2 месяца при лечении или без лечения. У некоторых пациентов возникает беспомощность при каждом эпизоде, тем не менее, они остаются клинически стабильными между рецидивами. Приблизительно 85% пациентов первоначально переносят форму рецидивирующе-ослабевающего (RR) рассеянного склероза (MS), но в течение 10 лет примерно у половины из них развивается форма вторично прогрессирующего MS. – Вторично прогрессирующий (SP-MS): Первоначально за формой RR следует постепенно возрастающая беспомощность с рецидивами или без них. Наиболее часто в период вторично прогрессирующего MS возникает значительная и необратимая нетрудоспособность. – Первично-прогрессирующий (PP-MS): Развитие болезни протекает с самого начала без каких-либо рецидивов или ремиссий, поражает около 15% больных MS. – Прогрессивный рецидивирующий (PR-MS): Прогрессирующее заболевание, сопровождающееся с самого начала выраженными острыми рецидивами; периоды между рецидивами отличаются постоянным развитием 20 болезни. В соответствии с этим существует потребность в веществах, эффективных для лечения демиелинизационных заболеваний, таких как рассеянный склероз или синдром Гийена-Барре, например, включая уменьшение, смягчение, стабилизацию или облегчение симптомов или болезни, которая поражает организм. В настоящее время обнаружено, что комбинация, содержащая, по меньшей мере один агонист рецептора S1P и сопутствующий агент, например, из тех, что определены ниже, обладает благоприятным воздействием на демиелинизационные заболевания, например, рассеянный склероз и ассоциированные с ним болезни. В соответствии с конкретными открытиями, сделанными в настоящем изобретении, предложены: 1. Фармацевтическая комбинация, содержащая: а) агонист рецептора S1P и б) по меньшей мере, один сопутствующий агент, который, как показано, обладает клинической активностью в отношении, по меньшей мере, одного симптома демиелинизационного заболевания, такого как рассеянный склероз или синдром Гийена-Барре. 2.1. Способ лечения демиелинизационного заболевания, например, рассеянного склероза или ассоциированных с ним болезней, или синдрома Гийена-Барре, включающий совместное введение, например, одновременно или последовательно, терапевтически эффективного количества агониста рецептора S1P, например, соединения формул от I до VII, как оно определено здесь далее, и, по меньшей мере, одного сопутствующего агента, как определено здесь далее. 2.2 Способ облегчения или замедления прогрессирования симптомов демиелинизационного заболевания, например, рассеянного склероза или синдрома Гийена-Барре, включающий совместное введение, например, одновременно или последовательно, терапевтически эффективного количества агониста рецептора S1P, например, соединения формул от I до VII, как оно определено здесь далее, и, по меньшей мере, одного сопутствующего агента, как определено здесь далее. Ранним симптомом рассеянного склероза является неврит зрительного нерва. В связи с этим, в настоящем изобретении предложены также: 2.3 Способ лечения, облегчения или замедления прогрессирования неврита зрительного нерва у нуждающегося в этом субъекта, включающий введение указанному субъекту терапевтически эффективного количества агониста рецептора S1P, например, соединения формул от I до VII, как оно определено здесь далее, например, соединения А или В, или его фармацевтически приемлемой соли. 3. Фармацевтическая комбинация, описанная выше, для использования в любом из способов 2.1-2.3. 4.1 Фармацевтическая композиция для лечения, облегчения или замедления прогрессирования неврита зрительного нерва, содержащая агонист рецептора S1P, например, соединение формул от I до VII, как оно определено здесь далее, например, соединение А или В, совместно с одним или несколькими фармацевтически приемлемыми разбавителями или носителями. 4.2 Соединение формул от I до VII, как оно определено здесь далее, например, соединение А или В для лечения, облегчения или замедления прогрессирования неврита зрительного нерва. 4.3 Агонист рецептора S1P, например, соединение формул от I до VII, как оно определено здесь далее, например, соединение А или В для использования при лечении, облегчении или замедлении прогрессирования неврита зрительного нерва. 5.1 Применение агониста рецептора S1P, например, соединения формул от I до VII, как оно определено здесь далее, например, соединения А или В для приготовления лекарственного средства для лечения, облегчения или замедления прогрессирования неврита зрительного нерва. 5.2 Применение а) агониста рецептора сфингозин-1-фосфата (S1P) и б) по меньшей мере одного сопутствующего агента, который, как показано, обладает клинической активностью в отношении, по меньшей мере одного симптома демиелинизационного заболевания, для приготовления фармацевтической комбинации для лечения, облегчения или замедления прогрессирования демиелинизационного заболевания, например, для приготовления фармацевтической комбинации для раздельного, одновременного или последовательного использования в таком способе. 5.3 Фармацевтическая композиция, описанная выше, для раздельного, одновременного или последовательного использования в медицине, например, в способе, раскрытом в 2.1-2.3. Термин “фармацевтическая комбинация”, используемый в данном контексте, означает продукт, полученный в результате смешивания или объединения более чем одного активного компонента, и включает в себя как фиксированные, так и нефиксированные комбинации активных компонентов. Термин “фиксированная комбинация”, как этот термин используется в данном контексте, означает, что активные компоненты, например, агонист рецептора S1P и сопутствующий агент оба вводятся пациенту одновременно в виде единого объекта или дозированной формы. Для примера, фиксированная комбинация может быть одной капсулой, содержащей два активных компонента. Термин “нефиксированная комбинация”, как этот термин используется в данном контексте, означает, что активный компонент, например агонист рецептора S1P, и сопутствующий агент оба вводятся пациенту в виде раздельных объектов либо вместе, одновременно, либо последовательно, но без специальных временных ограничений, причем такое введение обеспечивает терапевтически эффективные уровни двух соединений в организме, предпочтительно в одно и то же время. Для примера, нефиксированная комбинация может быть в виде двух капсул, каждая из которых содержит по одному активному компоненту, и цель такого введения заключается в том, чтобы пациент получал лечение с помощью обоих активных компонентов, находящихся в организме вместе. Агонист рецептора S1P представляет собой иммуномодулирующее соединение, которое вызывает лимфопению, возникающую в результате перераспределения, предпочтительно необратимого, лимфоцитов из кровотока во вторичные лимфатические ткани, не вызывая общей иммуносупрессии. Клетки Naïve изолируются; стимулируется миграция CD4 и CD8 Т-клеток и В-клеток крови в лимфатические узлы (ЛУ) и пейеровы бляшки (ПБ), и таким образом подавляется, например, инфильтрация клеток в трансплантированные органы. В качестве примеров соответствующих агонистов рецептора S1P можно назвать, например, – Соединения, раскрытые в европейской заявке ЕР 627406 А1, например, соединение формулы I
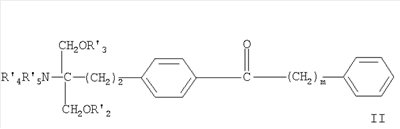
где R1 обозначает прямую или разветвленную (С12-22)углеродную цепь, – которая может содержать в цепи связь или гетероатом, выбранные из двойной связи, тройной связи, О, S, NR6, где R6 обозначает Н, алкил, аралкил, ацил или алкоксикарбонил и карбонил и/или – которая может содержать в качестве заместителя алкокси-, алкенилокси-, алкинилокси-, аралкилоксигруппу, ацил, алкиламино-, алкилтио-, ациламиногруппу, алкоксикарбонил, алкоксикарбониламино-, ацилоксигруппу, алкилкарбамоил, нитрогруппу, галоген, амино-, гидроксиимино-, гидрокси- или карбоксигруппу; или R1 обозначает – фенилалкил, где алкил обозначает прямую или разветвленную (С6-20)-углеродную цепь; или – фенилалкил, где алкил обозначает прямую или разветвленную (C6-30)-углеродную цепь, в которой указанный фенилалкил замещен – прямой или разветвленной (С6-20)углеродной цепью, необязательно замещенной галогеном, – прямой или разветвленной (С6-20)алкокси цепью, необязательно замещенной галогеном, – прямой или разветвленной (С6-20)алкенилоксигруппой, – фенилалкокси-, галогенфенилалкоксигруппой, фенилалкоксиалкилом, феноксиалкоксигруппой или феноксиалкилом, – циклоалкилалкилом, замещенным (C6-20)aлкилoм, – гетероарилалкилом, замещенным (С6-20)алкилом, – гетероциклическим (С6-20)алкилом или – гетероциклическим алкилом, замещенным (С2-20)алкилом, и при этом алкильный остаток может иметь – в углеродной цепи связь или гетероатом, выбранные из двойной связи, тройной связи, О, S, сульфинила, сульфонила или NR6, где R6 определен, как указано выше, а – в качестве заместителя – алкокси-, алкенилокси-, алкинилокси-, аралкилоксигруппу, ацил, алкиламино-, алкилтио-, ациламиногруппу, алкоксикарбонил, алкоксикарбониламино-, ацилоксигруппу, алкилкарбамоил, нитрогруппу, галоген, амино-, гидрокси- или карбоксигруппу, и каждый из радикалов R2, R3, R4 и R5 независимо обозначает Н, С1-4алкил или ацил или его фармацевтически приемлемую соль; – Соединения, раскрытые в европейской заявке ЕР 1002792 А1, например, соединение формулы II в которой m обозначает 1-9 и каждый из радикалов R или его фармацевтически приемлемую соль; – Соединения, раскрытые в европейской заявке ЕР 0778263 А1, например, соединение формулы III
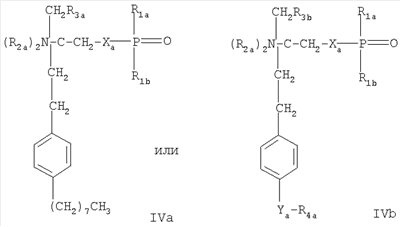
в которой W обозначает Н; C1-6алкил, С2-6алкенил или С2-6алкинил; незамещенный фенил или фенил, замещенный ОН; R Х обозначает Н или незамещенный или замещенный алкил с прямой цепью, имеющей число атомов углерода р, или незамещенную или замещенную алкоксигруппу с прямой цепью, имеющую число атомов углерода (р-1), например, замещенную 1-3 заместителями, выбранными из группы, содержащей C1-6алкил, ОН, C1-6алкокси-, ацилокси-, амино-, C1-6алкиламино-, ациламино-, оксогруппу, галоген(С1-6)алкил, галоген, незамещенный фенил или фенил, замещенный 1-3 заместителями, выбранными из группы, содержащей C1-6алкил, ОН, C1-6алкокси-, ацил, ацилокси-, амино-, C1-6алкиламино-, ациламиногруппу, галоген(С1-6)алкил и галоген; Y обозначает Н, C1-6алкил, ОН, C1-6алкоксигруппу, ацил, ацилокси-, амино-, C1-6алкиламино-, ациламиногруппу, галоген(С1-6)алкил или галоген, Z2 обозначает простую связь или прямую алкиленовую цепь, имеющую число атомов углерода q, каждое из p и q независимо обозначает целое число от 1 до 20, при условии, что 6 означает 1, 2 или 3, n означает 2 или 3, +q каждый из радикалов R или их фармацевтически приемлемую соль; – Соединения, раскрытые в публикации международной заявки WO 02/18395, например, соединение формулы IVa или IVb где Ха обозначает О, S, NR1s или группу -(CH2)na- незамещенную или замещенную 1-4 атомами галогена; nа обозначает 1 или 2, R1s обозначает Н или (С1-4)алкил, причем алкил незамещен или замещен галогеном; R1a обозначает Н, ОН, (С1-4)алкил или O(С1-4)алкил, причем алкил незамещен или замещен 1-3 атомами галогена; R1b обозначает Н, ОН или (С1-4)алкил, причем алкил незамещен или замещен галогеном; каждый R2a независимо выбран из Н или (С1-4)алкила, причем алкил незамещен или замещен галогеном; R3а обозначает Н, ОН, галоген или O(С1-4)алкил, причем алкил незамещен или замещен галогеном; и R3b обозначает Н, ОН, галоген, (С1-4)алкил, причем алкил незамещен или замещен гидроксигруппой, или O(С1-4)алкил, причем алкил незамещен или замещен галогеном; Ya обозначает -CH2-, -С(O)-, -СН(ОН)-, -C(=NOH)-, О или S, и R4a обозначает (С4-14)алкил или (С4-14)алкенил; или его фармацевтически приемлемую соль или гидрат; – Соединения, раскрытые в публикации международной заявки WO 02/076995, например, соединение формулы V
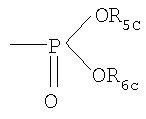
в которой mc обозначает 1, 2 или 3; Хс обозначает О или непосредственную связь; R1c обозначает Н; С1-6алкил, необязательно замещенный ОН, ацилом, галогеном, С3-10циклоалкилом, фенилом или гидроксифениленом; С2-6алкенил; С2-6алкинил; или фенил необязательно замещенный ОН; R2c обозначает
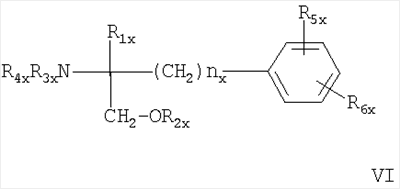
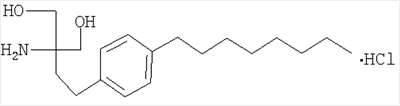
где R5c обозначает Н или С1-4алкил, необязательно замещенный 1, 2 или 3 атомами галогена, и R6c обозначает Н или С1-4алкил, необязательно замещенный галогеном; каждый из радикалов R3с и R4c необязательно обозначает Н, С1-4алкил, необязательно замещенный галогеном, или ацил, а Rc обозначает С13-20алкил, который необязательно может иметь в цепи атом кислорода и который может быть необязательно замещенным нитрогруппой, галогеном, амино-, гидрокси- или карбоксигруппой; или остаток формулы (а)
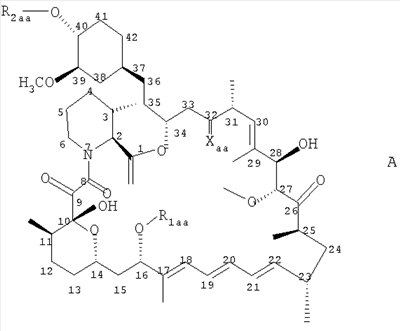
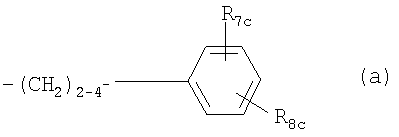
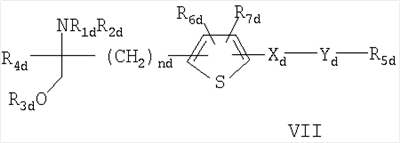
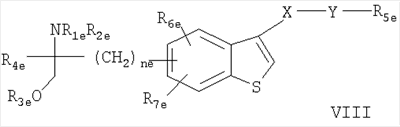
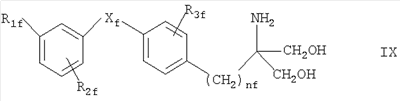
где R7c обозначает Н, С1-4алкил или С1-4алкокси, и R8c обозначает замещенный С1-20алканоил, фенилС1-14алкил, в котором С1-14алкил необязательно замещен галогеном или ОН, циклоалкилС1-14алкокси- или фенилС1-14алкоксигруппой, где циклоалкильное или фенильное кольцо необязательно замещено галогеном, С1-14алкилом и/или С1-14алкоксигруппой, фенилС1-14алкоксиС1-14алкилом, феноксиС1-14алкоксигруппой или феноксиС1-14алкилом, Rc также представляет собой остаток формулы (а), в котором R8c обозначает С1-14алкоксигруппу, если R1c обозначает С1-4алкил, С2-6алкенил или C2-6алкинил, или соединение формулы VI в которой nх обозначает 2, 3 или 4 R1x обозначает Н; C1-6алкил, необязательно замещенный ОН, ацилом, галогеном, циклоалкилом, фенилом или гидроксифениленом; С2-6алкенил; С2-6алкинил; или фенил, необязательно замещенный ОН; R2x обозначает Н, С1-4алкил или ацил каждый из радикалов R3х и R4x независимо обозначает Н, С1-4алкил, необязательно замещенный галогеном или ацилом, R5x обозначает Н, С1-4алкил или С1-4алкоксигруппу-, и R6x обозначает С1-20алканоил, замещенный циклоалкилом; циклоалкилС1-14алкоксигруппу, в которой циклоалкильное кольцо необязательно замещено галогеном, С1-4алкилом и/или С1-4алкоксигруппой; фенилС1-14алкоксигруппу, в которой фенильное кольцо необязательно замещено галогеном, С1-4алкилом и/или С1-4алкоксигруппой, R6х также представляет собой С4-14алкоксигруппу, если R1x обозначает С2-4алкил, замещенный ОН, или пентилокси-, либо гексилоксигруппу, если R1x обозначает С1-4алкил, при условии, что R6x отличен от фенилбутиленоксигруппы, когда либо R5х обозначает Н, или R1x обозначает метил, или его фармацевтически приемлемую соль; – Соединения, раскрытые в публикации международной заявки WO 02/06268 AI, например, соединение формулы VII в которой каждый из радикалов R1d и R2d независимо обозначают Н или аминозащитную группу; R3d обозначает водород или защитную группу гидроксила; R4d обозначает низш. алкил; nd обозначает целое число от 1 до 6; Xd обозначает этилен, винилен, этинилен, группу формулы – D-СН2– (где D обозначает карбонил, -СН(ОН)-, О, S или N), арил или арил, имеющий вплоть до трех заместителей, выбранных из группы а, определенной ниже; Yd обозначает простую связь, С1-10алкилен, С1-10алкилен, имеющий вплоть до трех заместителей, выбранных из групп а и б, C1-10алкилен, содержащий О или S в середине или на конце углеродной цепи, или С1-10алкилен, содержащий О или S в середине или на конце углеродной цепи, имеющей вплоть до трех заместителей, выбранных из групп а и б; R5d обозначает водород, циклоалкил, арил, гетероцикл, циклоалкил, имеющий вплоть до трех заместителей, выбранных из группы а и б, арил, имеющий вплоть до трех заместителей, выбранных из группы а и б, или гетероцикл, имеющий вплоть до трех заместителей, выбранных из группы а и б; и каждый из радикалов R6d и R7d независимо обозначает Н или заместитель, выбранный из группы а; <группа а> обозначает галоген, низш. алкил, галоген-низш. алкил, низш. алкокси-, низш. алкилтиогруппу, карбоксил, низш.алкоксикарбонил, гидроксигруппу, низш. алифатический ацил, амино-, моно-низш. алкиламино-, ди-низш.алкиламино-, низш. алифатическую ациламиногруппу, циано или нитро; <группа б> обозначает циклоалкил, арил, гетероцикл, каждый из которых необязательно имеет вплоть до трех заместителей, выбранных из группы а; при условии, что когда R5d обозначает водород, Yd представляет собой либо простую связь, либо линейный С1-10алкилен, или его фармацевтически приемлемую соль или сложный эфир. – Соединения, раскрытые в JP-14316985 (JP 2002316985), например, соединение формулы VIII: в которой R1e, R2e, R3e, R4е, R5e, R5е, R7e, ne, Хе и Ye имеют такие значения, как описано в JP-14316985; или его фармацевтически приемлемую соль или сложный эфир. – Соединения, раскрытые в публикациях международных заявок WO 03/29184 и WO 03/29205, например, соединение формулы IX в которой Xf обозначает О или S, a R1f, R2f, R3f и nf имеют такие значения, как описано в WO 03/29184 и 03/29205, например, 2-амино-2-[4-(3-бензилокси-фенокси)-2-хлорфенил]пропил-1,3-пропандиол или 2-амино-2-[4-(бензилокси-фенилтио)-2-хлорфенил]пропил-1,3-пропандиол. В каждом случае, когда приводятся ссылки на патентные заявки, сущность изобретений, относящихся к соединениям, включается в настоящую заявку посредством ссылки. Ацил может представлять собой остаток Ry-CO-, в котором Ry обозначает C1-6алкил, С3-6циклоалкил, фенил или фенилС1-4алкил. Если не установлено иначе, алкил, алкоксигруппа, алкенил или алкинил могут быть прямыми или разветвленными. Когда в соединениях формулы I углеводородная цепь радикала R1 является замещенной, она предпочтительно замещена галогеном, нитро-, амино-, гидрокси- или карбоксигруппой. Если углеводородная цепь прерывается необязательно замещенным фениленом, углеводородная цепь предпочтительно является незамещенной. Если фениленовый фрагмент является замещенным, то он предпочтительно замещен галогеном, нитро-, амино-, метокси-, гидрокси- или карбоксигруппой. Предпочтительными являются такие соединения формулы I, в которых R1 обозначает С13-20алкил, необязательно замещенный нитро, галогеном, амино-, гидрокси- или карбоксигруппой, и более предпочтительно те соединения, в которых R1 обозначает фенилалкил, замещенный С6-14алкильной цепью, необязательно замещенной галогеном, а алкильный фрагмент представлен С1-6алкилом, необязательно замещенным гидроксигруппой. Более предпочтительно, R1 обозначает фенилС1-6алкил, замещенный в фенильной части прямой или разветвленной, предпочтительно прямой С6-14алкильной цепью. Цепь С6-14алкила может находиться в орто-, мета- или параположении, предпочтительно в параположении. Предпочтительно каждый из радикалов R2-R5 обозначает Н. Предпочтительное соединение формулы I обозначает 2-амино-2-тетрадецил-1,3-пропандиол. Особенно предпочтительным агонистом рецептора SIP формулы I является FTY720, т.е. 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диол в свободной форме или в виде фармацевтически приемлемой соли (далее представлено в виде ссылки на Соединение А), например, как показанный гидрохлорид: Предпочтительное соединение формулы II представлено таким, где каждый из радикалов от R Предпочтительное соединение формулы III представлено таким, в котором W обозначает СН3, каждый из радикалов от R Предпочтительное соединение формулы IVa представлено PTY720-фосфатом (R2a обозначает Н, R3а обозначает ОН, Ха обозначает О, R1 а и R1b обозначают ОН). Предпочтительное соединение формулы IVb представлено фосфатом Соединения В (R2a обозначает Н, R3b обозначает ОН, Ха обозначает О, R1a и R1b обозначают ОН, Ya обозначает О и R4a обозначает гептил). Предпочтительное соединение формулы V обозначает фосфат Соединения Б. Предпочтительное соединение формулы V представлено моно-[(R)-2-амино-2-метил-4-(4-пентилоксифенил)бутил]-эфиром фосфорной кислоты. Предпочтительное соединение формулы VIII представлено (2R)-2-амино-4-[3-(4-циклогексилоксибутил)бензо[b]тиен-6-ил]-2-метилбутан-1-олом. Когда соединения формул от I до IX имеют в молекуле один или несколько асимметричных центров, настоящее изобретение следует понимать как охватывающее различные оптические изомеры, а также рацематы, диастереомеры и их смеси. Соединения формулы III или IVb, если атом углерода, несущий аминогруппу, является асимметричным, предпочтительно имеют две R-конфигурации при этом атоме углерода. Примеры фармацевтически приемлемых солей соединений формул от I до IX включают неорганические соли, такие как гидрохлорид, гидробромид и сульфат, соли с органическими кислотами, такие как ацетат, фумарат, малеат, бензоат, цитрат, малат, метансульфонат и бензолсульфонат, или, когда это целесообразно, соли с металлами, такими как натрий, калий, кальций и алюминий, соли с аминами, такими как триэтиламин, и соли с диосновными аминокислотами, такими как лизин. Соединения и соли, упоминаемые в способах по настоящему изобретению, охватывают формы гидратов и сольватов. Сопутствующий агент б) может быть выбран из следующих групп соединений: i) Интерфероны, например, пегилированные (с присоединенным ПЭГ) или непегилированные ii) Измененные пептидные лиганды, такие как глатирамер, например, в форме ацетата; iii) Иммуносупрессанты, необязательно обладающие антипролиферативной/противоопухолевой активностью, например, митоксантрон, метотрексат, азатиоприн, циклофосфамид, или стероиды, например, метилпреднизолон, преднизон или дексаметазон, или участвующие в секретировании стероидов вещества, например, АСТН (адренокортикотропный гормон); iv) Ингибиторы аденозиндеаминазы, например, кладрибин; v) IV иммуноглобулин G (например, как описано в Neurology, 1998, май 20 т.50 (5), c.1273-81); vi) Моноклональные антитела к различным поверхностным маркерам Т-клеток, например, натализумаб (ANTEGREN®) или алемтузумаб; vii) цитокины, промотирующие ТН2, например, IL-4, IL-10, или соединения, которые ингибируют экспрессию цитокинов, промотирующих ТН1, например, ингибиторы фосфодиэстеразы, например, пентоксифиллин; viii) Антиспастические агенты, включая баклофен, диазепам, пирацетам, дантролен, ламотригин, рифлузол, тизанидин, клонидин, бета-блокаторы, ципрогептадин, орфенадрин или каннабиноиды; ix) Антагонисты глутаматного рецептора АМРА, например, 2,3-дигидрокси-6-нитро-7-сульфамоилбензо(f)хиноксалин, [1,2,3,4,-тетрагидро-7-морфолин-ил-2,3-диоксо-6-(трифторметил)хиноксалин-1-ил]метилфосфонат, 1-(4-аминофенил)-4-метил-7,8-метилендиокси-5Н-2,3-бензодиазепин, или (-)1-(4-аминофенил)-4-метил-7,8-метилендиокси-4,5-дигидро-3-метилкарбамоил-2,3-бензодиазепин; х) Ингибиторы экспрессии VCAM-1 или антагонисты их лигандов, например, антагонисты xi) Ингибиторный фактор миграции анти-макрофага (анти-MIF); xii) Ингибиторы катепсина S; xiii) Ингибиторы mTor. Ингибиторы катепсина S включают, например: а) соединение, раскрытое в публикации международной заявки WO 03/20721, например, соединение формулы:
в которой R обозначает Н, -R2, -OR2 или NR1R2, где R1 обозначает Н, низш.алкил или С3-С10никлоалкил, и R2 обозначает низш.алкил или С3-С10циклоалкил, и при этом каждый из радикалов R1 и R2 независимо может быть необязательно замещен галогеном, гидроксигруппой, низш.алкоксигруппой, CN, NO2, или аминогруппой, необязательно замещенной моно- или ди-низш.алкилом; Х обозначает =N- или =C(Z)-, причем Z обозначает Н, -C(O)-NR3R4, -NH-C(O)-R3, -CH2-NH-C(O)-R3, -C(O)-R3, -S(O)-R3, -S(O)2-R3, -CH2-C(O)-R3, -CH2-NR3R4, -R4, -C где каждый из Р и Q независимо обозначает Н, низш.алкил или арил, R3 обозначает арил, арил-низш.алкил, С3-С10циклоалкил, С3-С10циклоалкил-низш.алкил, гетероциклил или гетероциклил-низш.алкил, R4 обозначает Н, арил, арил-низш.алкил, арил-низш.алкенил, С3-С10циклоалкил, С3-С10цикло алкил-низш.алкил, гетероциклил или гетероциклил-низш.алкил, или где R3 и R4 совместно с атомом азота, к которому они присоединены, образуют N-гетероциклическую группу, при этом N-гетероциклил обозначает насыщенный, частично ненасыщенный или ароматический азотсодержащий гетероциклический остаток, присоединенный посредством своего атома азота, содержащий от 3 до 8 атомов в кольце, необязательно включающих дополнительно 1, 2 или 3 гетероатома, выбранных из N, NR6, О, S, S(O) или S(O)2, причем R6 представляет собой Н или необязательно замещен (низш.алкилом, карбоксигруппой, ацилом (включая как низш.алкил-ацил, например, формил, ацетил или пропионил, так и арилацил, например, бензоил), амидогруппой, арилом, S(O) или S(O)2), и при этом N-гетероциклил необязательно сконденсирован в виде бициклической структуры, например, с бензольным или пиридиновым кольцом, и при этом N-гетероциклил необязательно связан со спиро-структурой из 3-8-членного циклоалкильного или гетероциклического кольца, причем гетероциклическое кольцо имеет от 3 до 10 атомов в цикле и содержит от 1 до 3 гетероатомов, выбранных из N, NR6, О, S, S(O) или S(O)2, где R6 имеет значения, определенные выше, и причем гетероциклил обозначает кольцо, имеющее от 3 до 10 атомов в цикле и содержащее от 1 до 3 гетероатомов, выбранных из N, NR6, О, S, S(O) или S(O)2, где R6 имеет значения, определенные выше, и причем каждый из радикалов R3 и R4 независимо при необходимости замещен одной или несколькими группами, например, 1-3 группами, выбранными из галогена, гидрокси, оксогруппы, низш.алкоксигруппы, CN или NO2, или при необходимости замещен (необязательно моно- или ди- низш.алкилом, замещенным аминогруппой, арилом, арил-низш.алкилом, N-гетероциклилом или N-гетероциклил-низш.алкилом (причем необязательное замещение включает от 1 до 3 заместителей, выбранных из галогена, гидрокси-, низш.алкоксигруппы, CN, NO2, или аминогруппу, необязательно моно- или ди-замещенную низш.алкилом)), и где R5 обозначает арил, арил-низш.алкил, арилоксигруппу, ароил или N-гетероциклил, определенные выше, и при этом R5 необязательно замещен посредством R7, который представляет собой от 1 до 5 заместителей, выбранных из галогена, гидроксигруппы, CN, NO2 или оксогруппы, или необязательно замещен (низш.алкоксигруппой, низш.алкилом, арилом, арилоксигруппой, ароилом, низш.алкилсульфонилом, арилсульфонилом, аминогруппой, необязательно замещенной моно- или ди-низш.алкилом, или N-гетероциклилом, или N-гетероциклил-низш.алкилом (причем N-гетероциклил имеет значения, определенные выше), и где R7 необязательно замещен от 1 до 3 заместителями, выбранными из галогена, гидроксигруппы, аминогруппы, необязательно замещенной моно- или ди-низш.алкилом, низш.алкилкарбонила, низш.алкоксигруппы или низш.алкиламидогруппы; R13 обозначает низш.алкил, С3-С10циклоалкил или С3-С10циклоалкил-низш.алкил, которые все независимо необязательно замещены галогеном, гидроксигруппой, CN, NO2 или аминогруппой, необязательно замещенной моно- или ди-низш.алкилом; и R14 представляет собой Н или необязательно замещен (арилом, арил-W-, арил-низш.алкил-W-, С3-С10циклоалкилом, С3-С10циклоалкил-W-, N-гетероциклил или N-гетероциклил-W- (где N-гетероциклил имеет значения, определенные выше), фталимидом, гидантоином, оксазолидиноном, или 2,6-диоксопиперазином), причем -W- обозначает -О-, -С(O)-, -NH(R6)-, -NH(R6)-C(O)-, -NH(R6)-С(O)-O-, (где R6 определен выше),-S(O)-, -S(O)2– или -S-, причем R14 необязательно замещен посредством R18, который представляет собой от 1 до 10 заместителей, выбранных из галогена, гидроксигруппы, CN, NO2, оксогруппы, амидогруппы, карбонила, сульфонамидогруппы, низш.алкилдиоксиметилена, или необязательно замещен (низш.алкоксигруппой, низш.алкилом, низш.алкенилом, низш.алкинилом, низш.алкоксикарбонилом, аминогруппой, необязательно замещенной моно- или ди-низш.алкилом, арилом, арил-низш.алкилом, арил-низш.алкенилом, арилоксигруппой, ароилом, низш.алкилсульфонилом, арилсульфонилом, N-гетероциклилом, N-гетероциклил-низш.алкилом (где N-гетероциклил определен выше), гетероциклил или R14 содержащий арил содержит арил, сконденсированный с кольцом, содержащим гетероатом, и причем R18 необязательно замещен посредством R19, который представляет собой от 1 до 4 заместителей, выбранных из галогена, гидроксигруппы, CN, NO2 или оксогруппы, или необязательно замещен (низш.алкоксигруппой, низш.алкилом, низш.алкокси-низш.алкилом, С3-С10циклоалкилом, низш.алкокси- карбонилом, галоид-низш.алкилом, аминогруппой, необязательно замещенной моно- или ди-низш.алкилом, арилом, арилоксигруппой, ароилом (например, бензоилом), ацилом (например, низш.алкилкарбонилом), низш.алкилсульфонилом, арилсульфонилом или N-гетероциклилом, или N-гетероциклил-низш.алкилом (где N-гетероциклил определен выше)), причем R19 необязательно замещен от 1 до 4 заместителями, выбранными из галогена, гидроксигруппы, CN, NO2, оксогруппы, аминогруппы, необязательно замещенной моно- или ди-низш.алкилом, низш.алкила, или низш.алкоксигруппы; б) соединение, описанное в международной публикации WO 00/69855, например, N2-(3-фуранилкарбонил)-L-норлейцин-2(S)-метил-4-оксотетрагидрофуран-3(R)-иламид; в) соединение, описанное в международных публикациях WO 01/19796, WO 01/19808, WO 02/51983, WO 03/24923, WO 03/24924, WO 03/41649 или WO 03/42197, например, Н-(2-(1-цианоциклопропиламино)-1(R)-(2-бензилсульфонилметил)-2-оксоэтил)морфолин-4-карбоксамид, N-(2-(цианометиламино)-1-(2-(дифторметокси)бензилсульфонилметил)-2-оксоэтил)пиридин-4-карбоксамид, N-(2-(цианометиламино)-1(R)-(2-(дифторметокси)бензилсульфонилметил)-2-оксоэтил)-3,4-дифторбензамид, N-(2-(цианометиламино)-1(R)-(2-(дифторметокси)бензилсульфонилметил)-2-оксоэтил)-3-метилбензамид, N-(2-(цианометиламино)-1(R)-(2-(дифторметокси)бензилсульфонилметил)-2-оксоэтил)-1Н-индол-5-карбоксамид, N-(2-(цианометиламино)-1(R)-(2-(дифторметокси)бензилсульфонилметил)-2-оксоэтил)-5-метилтиофен-2-карбоксамид, N-(2-(4-циано-1-метилпиперидин-4-иламино)-1(R)-(2-(дифторметокси)бензилсульфонилметил)-2-оксоэтил)морфолин-4-карбоксамид, N-(2-(цианометиламино)-1(R)-(2-(дифтopмeтoкcи)бeнзилcyльфoнилмeтил)-2-oкcoэтил)-4-фтopбeнзaмид, N-(2-(цианометиламино)-1(R)-(2-(дифторметокси)бензилсульфонилметил)-2-оксоэтил)тиофен-3-карбоксамид, N-(2-(цианометиламино)-1(R)-(2-(дифторметокси)бензилсульфонилметил)-2-оксоэтил)тиофен-2-карбоксамид или N-(2-(цианометиламино)-1(R)-(2-(дифторметокси)бензилсульфонилметил)-2-оксоэтил)морфолин-4-карбоксамид; г) соединение, описанное в международных публикациях WO 00/51998, WO 03/29200 или WO 03/37892, например, N-(1(S)-(N-(2-(бензилокси)-1(R)-цианоэтил)карбамоил)-2-циклогексилэтил)морфолин-4-карбоксамид; д) соединение, описанное в международных публикациях WO 02/14314, WO 02/14315 или WO 02/14317, например, N1-(3-хлор-2-(4-(2-гидрокси-3-(5-(метилсульфонил)-3-(4-(трифторметил)фенил)-4,5,6,7-тетрагидро-1Н-пиразоло(4,3-пиридин-1-ил)пропил)пиперазин-1-ил)фенил)-N3-метилмочевина, 1-(1-(3-(3-(4-бромфенил)-5-(метилсульфонил)-4,5,6,7-тетрагидро-1Н-пиразоло(4,3-с)пиридин-1-ил)-2-гидроксипропил)пиперидин-4-ил)-6-хлор-1,2,3,4-тетрагидрохинолин-2-он, или 1-(5-(метилсульфонил)-3-(4-(трифторметил)фенил-4,5,6,7-тетрагидро-1Н-пиразоло(4,3-с)пиридин-1-ил)-3-(4-(6-(4-морфолинил)-1Н-пирроло(3,2-с)пиридин-3 -ил)пиперидин-1-ил)пропан-2-ол; е) соединение, описанное в международной публикации WO 01/89451, например, ((S)-3-метил-1-((S)-3-оксо-1-(2-(3-пиридин-2-илфенил)ацетил)азепан-4-илкарбамоил)бутиламид 5-(2-морфолин-4-илэтокси)бензофуран-2-карбоновой кислоты; ж) соединение, описанное в международных публикациях WO 02/32879, WO 01/09169 или WO 00/59881 A1, например, N-(1-бензотиен-2-илкарбонил)-N-(2-(2-фторфенил)-4-оксо-1,2,3,4-тетрагидропиримидин-5-ил)-L-лейцинамид; з) соединение, описанное в международных публикациях WO 00/48992, WO 00/49007 или WO 00/49008. Термин “ингибитор mTOR”, используемый в данном контексте, включает в себя, но не ограничивается рапамицином (сиролимус) или его производным. Рапамицин представляет собой известный макролидный антибиотик, продуцируемый Streptomyces hygroscopicus. Подходящие производные рапамицина включают в себя, например, соединения формулы А в которой R1aa обозначает СН3 или С3-6алкинил, R2aa обозначает Н или -СН2-СН2-ОН, 3-гидрокси-2-(гидроксиметил)-2-метилпропаноил или тетразолил, и Хаа обозначает =O, (Н, Н) или (Н, ОН), при условии, что R2аа отлично от Н, когда Хаа обозначает =O и R1aa обозначает СН3, или его пролекарство, когда R2аа обозначает -СН2-СН2-ОН, например, его физиологически гидролизуемый простой эфир. Соединения формулы I раскрыты, например, в международных публикациях WO 94/09010, WO 95/16691, WO 96/41807, US 5362718 или WO 99/15530, которые включены в данное описание в качестве ссылок. Они могут быть получены как описано или по аналогии с тем, как описано в данных ссылках. Предпочтительные производные рапамицина представляют собой 32-дезоксорапамицин, 16-пент-2-инилокси-32-дезоксорапамицин, 16-пент-2-инилокси-32(S)-дигидрорапамицин, 16-пент-2-инилокси-32(S)-дигидро-40-O-(2-гидроксиэтил)рапамицин и, более предпочтительно, 40-O-(2-гидроксиэтил)рапамицин. Дополнительные примеры производных рапамицина включают в себя, например, CCI779 или 40-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]рапамицина или его фармацевтически приемлемую соль, как описано в US 5362718, АВТ578 или 40-(тетразолил)-рапамицин, в особенности, 40-эпи-(тетразолил)рапамицин, например, как описано в международной публикации WO 99/15530, или аналоги, описанные например, в международных публикациях WO 98/02441 и WOO 1/143 87, например, АР23573 или ТАFА-93. В каждом случае, когда цитируются патентные заявки или научные публикации, их сущность, относящаяся к соединениям, включается тем самым в контекст данной заявки посредством ссылки. Подобным образом включаются их фармацевтически приемлемые соли, соответствующие рацематы, диастереоизомеры, энантиомеры, таутомеры, а также соответствующие кристаллические модификации описанных выше соединений, если они имеют место, а именно, сольваты, гидраты и полиморфные формы, которые в них описаны. Соединения, используемые в качестве активных ингредиентов в комбинациях, соответствующих изобретению, могут быть получены и введены, как это описано, соответственно, в цитируемых документах. Также в объем притязаний настоящего изобретения входит сочетание более чем двух раздельных активных ингредиентов, как указано выше, т.е. фармацевтическая комбинация, находящаяся в пределах объема настоящего изобретения, может включать в себя три или более активных компонента. Далее как первый агент, так и сопутствующий агент не являются идентичными компонентами. Полезность соединений формулы I при лечении демиелинизационных заболеваний, например, рассеянного склероза или синдрома, как указывалось здесь выше, может быть продемонстрирована в тест методе на животных, а также в клинике, например, в соответствии с описанными ниже методами. Наиболее широко используемой животной моделью для рассеянного склероза является экспериментальный аутоиммунный энцефаломиелит (ЭАЭ) на основе гистопатологических и клинических признаков, одинаковых с заболеванием людей. A.1 In vivo: Мышиная модель SJL/J хронического прогрессирующего ЭАЭ. Течение болезни у этой мышиной модели имеет ряд общих признаков с SP-MS и PR-MS. Иммунизация: В день 0 самок мышей SJL/J иммунизируют (подкожной инъекцией в бок) с помощью 200 мкл инокулума, содержащего 500 мкг основного протеина бычьего миелина (МВР), эмульсифицированного в полном адъюванте Фрейда (CFA). В день 9 мышей поддерживают второй инъекцией МВР и дополнительной внутривенной инъекцией адъюванта, содержащей 200 нг токсина В. pertussis. Последняя инъекция Pertussis вводится в день 11. У большинства мышей, иммунизированных МВР, проявился тяжелый приступ ЭАЭ к 21 дню. Затем последовала фаза выздоровления, начавшаяся приблизительно на 25 день, в течение которой у мышей отсутствовали симптомы болезни в течение примерно 20 дней. Впоследствии, на 45-47 сутки, приблизительно у 50% животных проявилась прогрессирующая стадия заболевания. Следовательно, терапевтическое лечение с помощью тест соединений начинается на 21 день, когда болезнь в полной мере проявила себя, и продолжается до 70 дня, если не показано иначе. Рекомбинированный мышиный Соединение (а), например, соединение А или В при дозе 0,6 мг/кг перорально в комбинации с А.2 In vivo: Неврит зрительного нерва на модели крыс DA хронического затяжного ЭАЭ. Проявления глазной патологии, такие как неврит зрительного нерва (зрительный нейромиелит), часто встречаются при рассеянном склерозе, чему предшествует или что сопровождает образование бляшек в белом веществе головного мозга. Глазные области, в особенности, перекрест зрительных нервов являются важными мишенями при демиелинизационных формах ЭАЭ. В таких моделях ЭАЭ функциональная неспособность, вызванная демиелинизацией глазного нерва, может быть оценена при помощи электрофизиологических методов, таких как визуально побуждаемые корковые потенциалы и электроретинограмма, в сочетании с морфологическим анализом глазной ткани. Иммунизация: В день 0, самок крыс DA иммунизируют в основание хвоста единичной внутрикожной инъекцией при помощи 100-200 мкл инокулюма, содержащего рекомбинантный энцефалитогенный пептид, например, миелин олигодендроцитный гликопротеин или гомогенат ткани сингенной ЦНС, эмульсифицированный в одной части трифторуксусной кислоты (ТФУ) (объем:объем). Неврологические симптомы развиваются к 10 дню после иммунизации, и клиническую градацию ЭАЭ оценивают с использованием шкалы от 0 до 4 баллов. Терапевтическое лечение с помощью тест соединений начинается, когда болезнь в полной мере проявила себя, обычно на 12 день, и продолжается в течение 2 недель. Соединение (а), например, соединение А или В при дозе 0,3 мг/кг перорально, вводимой один раз в день в течение 2 недель, предотвращает прогрессирование болезни, по меньшей мере, на 2 месяца, по сравнению с контролями, обработанными разбавителем. Применение комбинационного лечения, субоптимальные дозы соединения А или В (<0.1 мг/кг перорально) и ингибитор mTOR (<1 мг/кг перорально) также сокращает развитие симптомов ЭАЭ и предотвращает связанную с болезнью потерю веса после терапевтического лечения на моделях крыс DA. В режиме профилактического лечения подобное сочетание соединения А или В и ингибитора mTOR предотвращает начало болезни на модели ЭАЭ у крыс Льюиса, индуцированной внутрикожной инъекцией нейроантигена морских свинок. Б. Клинические опыты Подходящими клиническими исследованиями являются, например, открыто меченое изучение эскалации доз у пациентов с рассеянным склерозом. Такие исследования подтверждают в особенности синергизм активных компонентов комбинации, соответствующей изобретению. Полезные эффекты на рассеянный склероз могут быть определены непосредственно из результатов данных исследований, что само по себе известно специалисту в данной области. В частности, подобные исследования подходят для сравнивания монотерапии с использованием активных компонентов и комбинации, соответствующей изобретению. Предпочтительно, дозу агента (а) увеличивают до достижения максимальной переносимой дозы, а сопутствующий агент (б) вводят в фиксированной дозе. Альтернативно, агент (а) вводят в фиксированной дозе, а дозу сопутствующего агента (б) увеличивают. Каждый пациент получает дозы агента (а) либо ежедневно, либо периодически, т.е. с прерыванием. Эффективность лечения можно определять при таких исследованиях, например, через 12, 18 или 24 недели посредством оценки баллов симптомов каждые 6 недель. Альтернативно, с целью подтверждения полезности упомянутой здесь комбинации, соответствующей изобретению, может быть применен сдвоенный слепой метод изучения с контролем плацебо. Введение фармацевтической комбинации согласно изобретению приводит не только к полезному эффекту, например, синергетическому терапевтическому эффекту, например, в отношении облегчения и задерживания прогрессирования или подавления симптомов, но также к неожиданным дальнейшим полезным эффектам, например, уменьшению побочных эффектов, улучшению качества жизни и снижению смертности, по сравнению с монотерапией с применением только одного из фармацевтически активных компонентов, используемых в комбинации, согласно данному изобретению. Дальнейшим полезным преимуществом является то, что могут быть использованы более низкие дозы активных ингредиентов в комбинации, например, необходимо, чтобы дозировки часто были бы не только меньшими, но также применялись бы реже, что может снижать случаи и тяжесть побочных эффектов. Это соответствует желанию и потребностям пациентов, которых лечат. Термины “совместное введение” или “комбинированное введение”, или тому подобные применяемые здесь термины означают осуществление введения выбранных терапевтических агентов одному пациенту и предназначены для включения терапевтических режимов, согласно которым не является необходимым введение одним и тем же путем или в одно и то же время. Целью настоящего изобретения является обеспечение фармацевтической композиции, содержащей количество, которое совместно обладает терапевтической эффективностью в отношении рассеянного склероза или связанных с ним нарушений, содержащей комбинацию согласно изобретению. В этой композиции первый агент а) и сопутствующий агент б) могут вводиться вместе, один за другим или раздельно в одной объединенной единичной лекарственной форме или в двух раздельных единичных дозированных формах. Единичная дозированная лекарственная форма может также представлять собой фиксированную комбинацию. Фармацевтические композиции для раздельного введения первого агента а) и сопутствующего агента б) или для введения в фиксированной комбинации, т.е. единой галеновой композиции, содержащей, по меньшей мере, два контрагента а) и б) в комбинации, соответствующей изобретению, могут быть приготовлены способом, который сам по себе известен, и являются подходящими для внутреннего, такого как через рот и ректального, и парентерального введения млекопитающим (теплокровным животным), включая людей, причем они содержат терапевтически эффективное количество, по меньшей мере, одного фармакологически активного контрагента комбинации одного, как, например, указано выше, или в сочетании с одним или несколькими фармацевтически приемлемыми носителями или разбавителями, особенно подходящими для внутреннего или парентерального применения. Подходящие фармацевтические композиции содержат, например, от приблизительно 0,1% до приблизительно 99,9%, предпочтительно от приблизительно 1% до приблизительно 60% активных компонентов. Фармацевтические препараты для комбинационной терапии для внутреннего или парентерального введения представляют собой, например, препараты в единичной лекарственной форме, такие как покрытые сахарной оболочкой таблетки, таблетки, капсулы или суппозитории, или ампулы. Если не указано иначе, их приготавливают способами, которые сами по себе известны, например, при помощи обыкновенного смешивания, гранулирования, покрытия сахаром, растворения или процесса лиофилизации. Специалист оценит, что единичное содержание контрагента комбинации, содержащееся в индивидуальной дозе каждой дозированной лекарственной формы, не обязательно должно само по себе составлять эффективное количество, поскольку необходимое эффективное количество может быть достигнуто посредством введения множества дозированных лекарственных форм. В частности, терапевтически эффективное количество каждого из контрагента комбинации в комбинации, соответствующей изобретению, может быть введено одновременно или последовательно или в любом ином порядке, а компоненты могут быть введены по отдельности или в виде фиксированной комбинации. Например, соответствующий изобретению способ задержки прогрессирования или лечения рассеянного склероза или связанных с ним нарушений может включать в себя (i) введение первого агента а) в свободной форме или в виде фармацевтически приемлемой соли и (ii) введение сопутствующего агента б) в свободной форме или в виде фармацевтически приемлемой соли, одновременно или последовательно, или в любом ином порядке, в объединенном терапевтически эффективном количестве, предпочтительно в синергетически эффективных количествах, например, суточными или периодическими дозировками, соответствующими описанным выше количествам. Индивидуальные контрагенты комбинации в комбинации, соответствующей изобретению, могут быть введены по отдельности в различное время в течение курса лечения или одновременно в виде раздельных форм или в виде единой комбинации. Более того, термин “введение” охватывает также применение пролекарственных форм контрагента комбинации, который превращается in vivo в сам этот агент комбинации. Поэтому настоящее изобретение следует понимать, как охватывающее все подобные режимы одновременного или другие виды лечения, а термин “введение” должен быть интерпретирован соответствующим образом. Эффективная дозировка каждого контрагента комбинации, применяемого в соответствующей изобретению комбинации, может изменяться в зависимости от конкретного соединения или применяемой фармацевтической композиции, режима введения, состояния, которое лечат, и тяжести этого состояния. Таким образом, режим дозировок комбинации, соответствующей изобретению, выбирают в соответствии с множеством разных факторов, включая путь введения и состояние функционирования почек и печени пациента. Обычный квалифицированный в своей области терапевт, лечащий врач или ветеринар может легко определить и прописать эффективное количество одного активного компонента, требуемого для облегчения, противостояния или приостановления развития состояния. Оптимальная точность при достижении концентрации активных ингредиентов в пределах диапазона, который приводит к эффективности и не является токсичным, требует режима, основанного на кинетике доступности активных ингредиентов в места-мишени, в особенности, когда сопутствующий агент б) представляет собой небольшую молекулу. Суточные дозировки первого агента а) могут, конечно, меняться в зависимости от множества факторов, например, выбранного соединения, особенностей состояния, которое лечат, и желаемого эффекта. Однако вообще удовлетворительные результаты достигаются при введении агента а) при концентрации суточной дозы порядка приблизительно от 0,03 до 2,5 мг/кг в день, особенно от 0,1 до 2,5 мг/кг в день, например, от 0,5 до 2,5 мг/кг в день, в виде одной дозы или раздельными дозами. Агонист рецептора S1P, например, соединение формулы от I до VII, например, соединение А или В, может быть введен любым традиционным путем, в частности, внутрь, например, перорально, например, в форме таблеток, капсул, растворов для питья, или парентерально, например, в форме растворов для инъекций или суспензий. Подходящие единичные дозированные лекарственные формы для перорального введения содержат от приблизительно 0,02 до 50 мг активного компонента, обычно от 0,1 до 30 мг, например, соединение А или В совместно с одним или несколькими фармацевтически приемлемыми их разбавителями или носителями. Эти дозировки также показаны, когда агонист рецептора S1P используется один при лечении неврита зрительного нерва. Интерфероны можно вводить человеку в следующем диапазоне дозировок: интерферон Глатирамер можно вводить человеку в диапазоне доз вплоть до 20 мг подкожно или вплоть до 50 мг перорально. Противоопухолевые/антипролиферативные иммуносупрессанты могут быть введены человеку в следующих диапазонах дозировок: циклофосфамид 500-1500 мг/м2 внутривенно; метотрексат вплоть до 20 мг перорально; митоксантрон 12 мг/м2 внутривенно, или азатиоприн 2 мг/кг перорально. Стероиды могут быть введены человеку в следующих диапазонах дозировок: метилпреднизолон 1-2 мг внутривенно, или 24-48 мг перорально; преднизон 1 мг/кг перорально, или АСТН вплоть до 100 MIU. Ингибиторы ADA, такие как кладрибин, могут быть введены человеку в диапазоне дозировок вплоть до 0,07 мг/кг/день. Внутривенный иммуноглобулин G может быть введен человеку в диапазоне дозировок вплоть до 400 мг/кг внутривенно. Моноклональные антитела к различным Т-клеточным поверхностным маркерам могут быть введены человеку в следующих диапазонах дозировок: натализумаб вплоть до 3 мг/кг внутривенно, алемтузумаб вплоть до 30 мг подкожно или внутривенно. Цитокины, промотирующие ТН2, могут быть введены человеку в следующих диапазонах дозировок: IL-4 вплоть до 3 мкг/кг подкожно, или IL-10 вплоть до 20 мкг/кг подкожно. Соединения, ингибирующие экспрессию 15 цитокинов, промотирующих ТН1, такие как ингибитор фосфодиэстеразы пентоксифиллин, могут быть введены человеку в диапазоне дозировок вплоть до 4 мг перорально. Противоспастические агенты могут быть введены человеку в следующих диапазонах дозировок: баклофен вплоть до 100 мг перорально, диазепам вплоть до 20 мг перорально, пирацетам вплоть до 24 мг перорально, дантролен вплоть до 100 мг перорально, ламотригин вплоть до 100 мг/день, рилузол вплоть до 100 мг перорально, тизанидин вплоть до 12 мг перорально, клонидин вплоть до 0,1 мг перорально, Ингибиторы катепсина S, например, соединение, описанное в международной публикации WO 03/20721, может быть введено человеку в диапазоне дозировок от 0,1 до 100 мг/кг/день. Ингибиторы mTor, например, рапамицин или его ингибиторы, например, 40-O-(2-гидроксиэтил)рапамицин, может быть введен человеку в диапазоне дозировок, изменяющемся от приблизительно 0,1 до 25 мг/кг/день. В случае применения для лечения, облегчения или задержки прогрессирования неврита зрительного нерва, агонист рецептора S1P, например, соединение формулы от I до VII, например, соединение А или В, может быть введен системно или местно посредством любого традиционного пути введения, в частности, внутрь, например, перорально, например, в виде таблеток или капсул, местно, например, в виде местной глазной композиции, например, содержащей глазной носитель. Фармацевтические композиции, содержащие агонист рецептора S1P в ассоциации с, по меньшей мере, одним фармацевтически приемлемым носителем или разбавителем, могут быть изготовлены обычным способом, например, смешиванием ингредиентов. Соединения формул от I до VII являются хорошо переносимыми в дозировках, требуемых для применения в соответствии с настоящим изобретением. Например, для соединения А сильная концентрация LD50 составляет >10 мг/кг перорально для крыс и обезьян.
Формула изобретения
1. Применение 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола в свободном виде или в виде фармацевтически приемлемой соли, или его фосфата FTY720 при изготовлении лекарственного средства для лечения, облегчения или задержки прогрессирования неврита зрительного нерва. 2. Применение по п.1, в котором используют гидрохлорид 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола. 3. Применение по п.1 или 2, при котором 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диол вводят совместно по меньшей мере с одним сопутствующим агентом, выбранным из группы, содержащей интерфероны и ингибиторы mTor. 4. Применение по п.1 или 2, при котором 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диол вводят совместно по меньшей мере с одним сопутствующим агентом, выбранным из группы, состоящей из 5. Способ лечения, облегчения или задержки прогрессирования неврита зрительного нерва у нуждающегося в этом субъекта, включающий введение указанному субъекту терапевтически эффективного количества 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола в свободном виде или в виде фармацевтически приемлемой соли, или его фосфата FTY720. 6. Способ по п.5, отличающийся тем, что вводят гидрохлорид 2-амино-2-[2-(4-октилфенил)этил] пропан-1,3-диола. 7. Способ лечения, облегчения или задержки прогрессирования неврита зрительного нерва, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества а) 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола или его фосфата в свободном виде или в виде фармацевтически приемлемой соли, и б) по меньшей мере одного сопутствующего агента, который выбирают из группы, состоящей из интерферонов и ингибиторов mTor. 8. Способ по п.7, отличающийся тем, что сопутствующий агент выбирают из группы, состоящей из 9. Способ по п.7 или 8, отличающийся тем, что вводят гидрохлорид 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола.
|
||||||||||||||||||||||||||

 2, R
2, R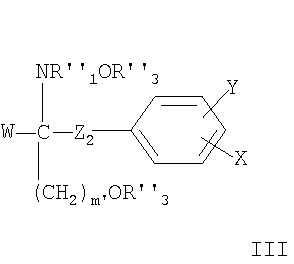
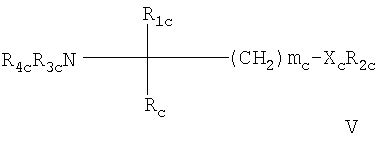

 -интерфероны, или
-интерфероны, или  -интерфероны, или
-интерфероны, или  -интерфероны, например, вводимые подкожно, внутримышечно или перорально, предпочтительно
-интерфероны, например, вводимые подкожно, внутримышечно или перорально, предпочтительно 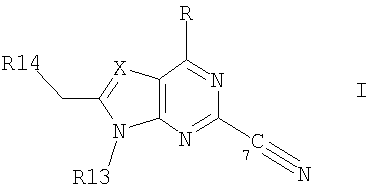
 C-CH2-R5, N-гетероциклил, N-гетероциклилкарбонил, или -C(P)=C(Q)-R4
C-CH2-R5, N-гетероциклил, N-гетероциклилкарбонил, или -C(P)=C(Q)-R4