Патент на изобретение №2390339
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКИХ РЕЦИДИВИРУЮЩИХ УРОГЕНИТАЛЬНЫХ БАКТЕРИАЛЬНЫХ И ВИРУСНЫХ ЗАБОЛЕВАНИЙ
(57) Реферат:
Изобретение относится к медицине, в частности к гинекологии и урологии, и касается лечения хронических рецидивирующих урогенитальных бактериальных и вирусных инфекций. Для этого получают аутологичные лимфоциты из крови больного. Затем культивируют указанные лимфоциты совместно с иммуномодулятором. Далее осуществляют внутриматочное введение 0,5-2,0 мл взвеси лимфоцитов в приемлемой среде при их концентрации 106-107 кл/мл. Способ без использования антибактериальных препаратов обеспечивает выраженные противовирусный и антибактериальный эффекты, нормализацию иммунного статуса при минимуме побочных явлений. 4 з.п.ф-лы, 3 табл.
Изобретение относится к медицине и относится к лечению хронических урогенитальных бактериальных и вирусных инфекций. Ряд причин, в первую очередь, такие как ослабление естественного отбора, широкое и часто неоправданное применение антибиотиков, загрязнение окружающей среды, привели к тому, что у многих людей иммунная система стала слабо реагировать на вторжение инфекционных агентов. В результате возникают вторичные иммунодефицитные состояния, которые определяются как нарушение иммунной защиты организма, развившиеся в постнатальном периоде вследствие действия ненаследственных индукторных факторов. Основными проявлениями иммунодефицита являются хронические рецидивирующие бактериальные и вирусные инфекции. Зачастую у больных с иммунодефицитами хронические инфекции вызываются условно-патогенными микроорганизмами и имеют вялотекущее течение, даже в случае активной терапии. Поэтому проблема лечения больных, страдающих хроническими рецидивирующими бактериальными и вирусными инфекциями на фоне вторичных иммунодефицитов, является одной из актуальных для современной медицины. Традиционно для лечения хронических урогенитальных бактериальных и вирусных заболеваний используются антибиотики и противовирусные препараты. Но все чаще врач сталкивается с ситуациями, когда новейшие антибактериальные и противовирусные препараты неспособны прекратить инфекционный процесс, а только переводят его в затяжную, стертую фазу, имитируя выздоровление, что в дальнейшем может приводить к развитию бесплодия у женщин. Объяснение этого факта, очевидно, следует искать в особенностях развития адаптивных и компенсаторных реакций в организме при остром и хроническом патологическом процессе. Острый патологический процесс реализуется с помощью энергетически обеспеченных и генетически запрограммированных механизмов, действие которых направлено на компенсацию возникших повреждений. Стволовые клетки костного мозга, резко снизив свою пролиферативную, миграционную и информационную активность в острейшую стадию повреждения, затем вновь через лимфоциты периферической крови начинают воспринимать информацию о поврежденном органе и вступают в процессы деления и дифференцировки клеток, а также мигрируют в тот тип ткани, в восстановлении которого организм нуждается в данный момент времени. Этот факт подтверждают данные о существенном повышении в крови в острой стадии инфаркта миокарда циркулирующих стволовых клеток костного мозга CD34/CXR4+, CD34/CD117+ и других мононуклеарных клеток, имеющих специфические сердечные, мышечные и эндотелиальные маркеры [Wojakowsk W., 2004; Minami Е. et al., 2005]. Исходом острого процесса повреждения может быть либо полное восстановление количества структур и объема выполняемых функций поврежденного органа, либо, что происходит чаще, наступает уменьшение количества структур и возрастание объема функции на единицу структуры, что ведет к гиперплазии и гипертрофии оставшихся клеток. Для пролонгирования стадии компенсаторной гипертрофии структурных элементов поврежденного органа, а также торможения развития дистрофии и гибели оставшихся в организме клеточных структур в результате их вынужденного перенапряжения (переход в фазу хронического повреждения) организм переходит на новый, менее интенсивный уровень жизнедеятельности. При этом тормозятся энергетические, пластические (пролиферативные) и регуляторные процессы. Выздоровление при остром процессе коррелирует с активацией иммунной системы: активированные лимфоциты принимают непосредственное участие в переносе регенерационной информации к поврежденным клеткам, а также регулируют пролиферацию и дифференцировку стволовых клеток за счет продукции биологически активных медиаторов и гормонов. Переход острого процесса в хронический сопровождается снижением функциональной и информационной активности лимфоцитов и других мононуклеаров, уменьшением продукции ими цитокинов, определяющих процесс регенерации органов и тканей, нарушением популяционного состава клеток периферической крови, а также их реактивности (снижение пролиферативного ответа на митогены) [Karra R. et al., 2005; Galasso G. et al., 2005]. По мере прогрессирования хронического процесса дизрегуляция иммунной системы прогрессирует особенно среди тех ее звеньев, которые ответственны за регенерацию поврежденных органов. В результате лечение хронических процессов становится неразрешимой задачей, т.к. сам организм, создавая иммунный дисбаланс, стремится нивелировать проводимую активационную терапию, чтобы затормозить процесс износа и гибели гиперфункционирующих структур жизненно важных поврежденных органов [Karra R. et al., 2005; Galasso G. et al., 2005]. Из вышеизложенного следует, что для ослабления клинических проявлений и улучшения качества жизни больных необходимо прежде всего восстановить функциональную активность иммунной системы и повысить ее регенерационный потенциал за счет применения иммунокорегирующей терапии. Однако несмотря на то, что в настоящее время создан значительный арсенал современных иммуномодулирующих препаратов, сложность и множественность механизмов их действия не позволяет выработать достаточно обоснованные рекомендации их применения [Сепиашвили Р.И., 2002; Караулов А.В., 2005]. Кроме того, такие факторы, как высокая вариабельность иммунного реагирования, наличие индивидуальной чувствительности к иммунотропным препаратам, варьирующие в процессе лечения, отсутствие клинического эффекта или положительной лабораторной динамики от применения иммуномодуляторов диктуют необходимость индивидуализированного подхода к каждому пациенту. Одним из таких направлений является местное введение иммуномодуляторов. Очевидно также, что наиболее эффективным является использование аутолимфоцитов или продуктов, выделяемых ими, в проведении такой терапии. В данном случае соблюдается принцип индивидуализированного подхода к каждому пациенту, а также уменьшается количество нежелательных побочных эффектов. Прототипом предлагаемого изобретения является способ лечения хронических рецидивирующих урогенитальных бактериальных и вирусных заболеваний методом локорегионарной цитокинотерапии, согласно которой ежедневно в течение 10-15 дней к шейке матки больной подводят тампон с комплексом аутологичных эндогенных цитокинов, полученных при стимуляции мононуклеарных клеток пациентки интерлейкином 2 (Патент RU 2232027, опубл. в 2004 г.). Очевидно, что в процессе культивирования клетки секретируют ряд важных клеточных метаболитов, регулирующих пролиферацию клеток, адгезию клеток, дифференцировку клеток, миграцию клеток, определяющих спектр синтезируемых и секретируемых метаболитов. Это могут быть различные клеточные метаболиты: секреторные, включая, например, биологически активные факторы роста, медиаторы воспаления и другие внеклеточные белки. В качестве примера можно привести: VEGF (сосудистый эндотелиальный фактор роста), FGF (фактор роста тромбоцитов) и IGF (инсулиноподобный фактор роста)(Gonzalez-Rubio, М. et al., 1996, Kidney Int. 50(1): 164-73; Abramovitch, R. et al., 1997, Int. J. Exp. Pathol. 78(2):57-70; Stein I. et al, 1995, Mol. Cell. Biol. 15(10):5363-8; Yang W. et al., 1997, FEBS Lett. 403(2): 139-42; West, N.R. et al. 1995, J.Neurosci. Res.40 (5):647-59). Однако известно, что биологические эффекты клеточных факторов роста и цитокинов определяются не только концентрацией отдельного цитокина, но, во многом, биологический эффект определяется соотношением отдельных цитокинов, например соотношение Решение данной проблемы лежит в использовании самих аутологичных иммунокомпетентных клеток, которые вводятся в орган, подлежащий лечению. Образно это можно сравнить со специализированным действием активированных иммунных клеток непосредственно в очаге «конфликта». В этом случае иммунокомпетентные клетки обеспечивают не только высокую эффективность и специализированную направленность иммунных реакций, но их действие не сопровождается побочными, нежелательными эффектами, т.е. иммунными процессами генерализированной формы. К ним относятся: повышение температуры тела, обострение сопутствующих хронических инфекций, активация аллергических и аутоиммунных процессов в организме Таким образом, нами предложен способ лечения хронических рецидивирующих урогенитальных бактериальных и вирусных инфекций, включающий предварительное получение аутологичных лимфоцитов крови больного, культивирование полученных лимфоцитов совместно с иммуномодуляторами в течение 3-6 часов и последующее внутриматочное введение 0,5-2,0 мл взвеси лимфоцитов в приемлемой среде при концентрации 106-107 кл/мл. Способ осуществляется следующим образом. 1. Проводят забор периферической крови любым известным способом, в частности иглой из локтевой вены пациента, в количестве 10-20 мл, после чего осуществляют получение лейкоцитарной суспензии, для этого 2 мл гепаринизированной крови смешивали с 1 мл подогретого до 37°C 3% раствора желатина и инкубировали в термостате при 37°C в течение 30 мин. После оседания эритроцитов слой плазмы, обогащенный лейкоцитами, отбирали в пластиковые пробирки и отмывали 10-кратным объемом фосфатно-солевого буфера (рН=7,4). Затем лейкоциты центрифугированием в течение 10 мин при 1000 об/мин ресуспендировали в растворе Хенкса без Са2+ и Mg2+. Проводят подсчет клеток в камере Горяева и проверку препарата на чистоту клеточной популяции и жизнеспособность клеток. Жизнеспособность клеток проверялась в камере Горяева после окраски метиленом – синим. После подсчета числа лимфоцитов концентрацию клеток доводили до 106-107 кл/мл. Другим методом выделения лимфоцитов является выделение лейкоцитов на растворе фиколла-урографина (плотность 1,077 г/см3). Выделенные лимфоциты переносят в стерильную центрифужную пробирку и четырежды отмывают стерильной средой RPMI 1640 путем центрифугирования в течение 7 минут при 200 g (1500 об/мин). Проводят подсчет клеток в камере Горяева и проверку препарата на чистоту клеточной популяции и жизнеспособность клеток. После подсчета числа лейкоцитов концентрацию клеток доводили до 106-107 кл/мл. 2. Полученные клетки, а именно лимфоциты периферической крови, ресуспендируют в культуральной ростовой среде или в стерильном изотоническом растворе натрия хлорида (0,9%). Клетки культивируют совместно с иммуномодуляторами, например с 1,0-0,005% стерильным раствором имунофана в течение 3-48 часов, при 37°C в атмосфере, содержащей 5% CO2, и при 95% влажности. Затем двукратно отмывают – 1-й раз – RPMI 1640, 2-й раз – изотоническим раствором натрия хлорида (0,9%). Отмытые клетки ресуспензируют в 1 мл стерильного изотонического раствора натрия хлорида (0,9%). Проводился подсчет клеток в камере Горяева и проверка препарата на чистоту клеточной популяции и жизнеспособность клеток. Представленные в табл. Таким образом, представленные данные свидетельствуют о достаточно высокой степени жизнеспособности аутолимфоцитов. Наибольший процент их жизнеспособности определялся после трех часовой инкубации с имунофаном. 3. Внутриматочное введение аутолимфоцитов, активированных имунофаном, проводится в условиях дневного стационара по назначению и под контролем врача гинеколога. В процедурном кабинете женщине в положении Тренделенбурга на гинекологическом кресле производят санацию наружных половых органов раствором антисептика, т.е. вводят во влагалище зеркало Куско, промывают слизистую дистиллированной водой, затем ватным тампоном на зажиме обрабатывают слизистую оболочку влагалища лекарственным средством октенисепт (octenisept). При санации используется октенисепт концентрации в разведении с водой в пропорции 1:6. Время воздействия 1-2 минуты. Затем аутологичные лимфоциты крови пациентки, активированные in vitro имунофаном или другим иммуномудулятором, вводятся в полость матки с помощью катетера для гистеосальпингографии (размер 8-F) в дозах: 1-е введение – 1×106, 2-е – 5×106, 3-е – 1×107, 4-е – 1×107 кл/мл. Взвесь аутолимфоцитов вводится внутриматочно в 0,5-2,0 мл стерильного физиологического раствора, затем гинекологическое кресло переводят в горизонтальное положение. Количество вводимой взвеси, а именно 0,5-2,0 мл, определено нами экспериментально и является существенным с нашей точки зрения, поскольку позволяет снизить нагрузку на организм. С целью предотвращения эвакуации иммунокомпетентных клеток из полости матки спустя 30 минут после введения клеток пациентку переводят в дневной стационар, где она находится в течение 4 часов под наблюдением врача гинеколога. Внутриматочное введение аутолимфоцитов проводятся 1 раз в неделю. Выделение лимфоидных клеток из венозной крови больного, оттитровка их концентрации, инкубация с раствором имунофана, проверка на чистоту и жизнеспособность проводится врачом лаборантом-иммунологом. Перед каждой процедурой проводится осмотр больных врачом гинекологом и иммунологом.
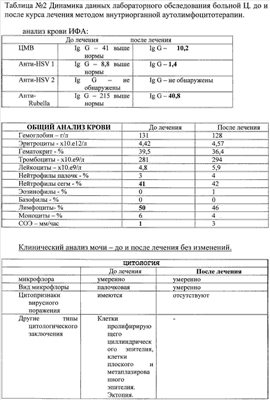
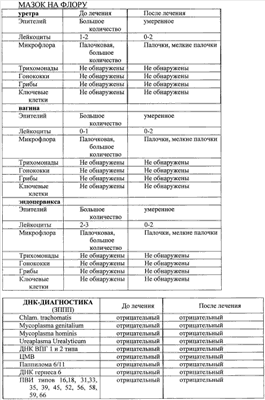
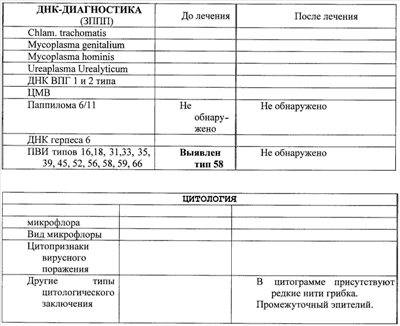
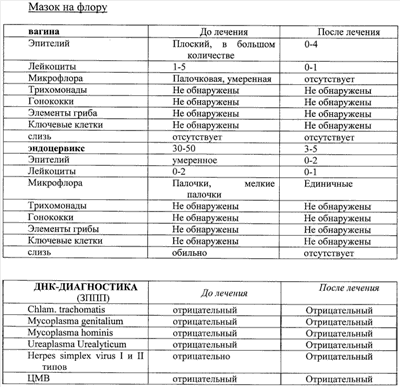
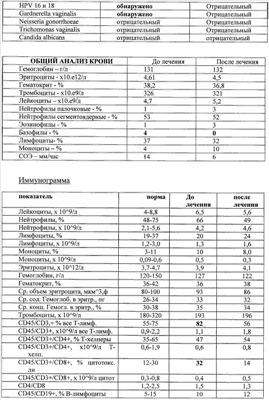
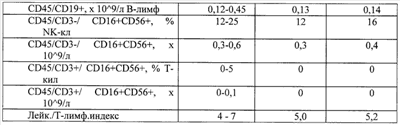
Примеры, подтверждающие эффективность предложенного метода лечения. Клинический случай Пациентка Ц., 26 лет, при первичном осмотре гинеколога пациентка предъявляла жалобы на нерегулярные менструации, обильные выделения из половых путей, зуд и жжение во влагалище. При влагалищном осмотре обнаружены гиперемия и отек слизистой влагалища, обильное отделяемое на стенках влагалища в виде белей бело-желтого цвета. Шейка матки эрозирована. Тело матки и придатки без особенностей. При лабораторном исследовании выявлено: антитела к ВИЧ 1/2, Сифилис, гепатит В и гепатит С – отрицательно (от 15.10.2007), анализ крови ИФА: Антитела к вирусу герпеса 1/2 положительно, также обнаружен вирус папиллома человека тип 58. Заключительный диагноз гинеколога: Дисфункция яичников репродуктивного периода. Эрозия шейки матки. Папиллома-вирусная инфекция, наружная форма. Банальный кольпит. Больной проведена комплексная терапия, включавшая антибактериальные препараты и иммуномодуляторы. Проведена лекарственная терапия: курс ликопида по 10 мг 2 раза в день 14 дней, свечи гексикон по 1 свече во влагалище 2 раза в день 10 дней, курс циклоферона по 2,0 мл в сутки 10 дней через день, микосист по 50 мд в сутки 7 дней, эстовэл по 1 таблетке 2 раза в день 3 месяца и гомеопатическая терапия: гормель и гинекохель с 5 по 25 дня цикла по 10 капель 2 раза в день 6 месяцев. После проведения лекарственной терапии состояние больной существенно не изменилось: несколько уменьшились зуд и жжение во влагалище и выделения из половых путей. При влагалищном осмотре сохраняется гиперемия и отек слизистой влагалища, обильное отделяемое на стенках влагалища в виде белей бело-желтого цвета. Шейка матки эрозирована. Тело матки и придатки без особенностей. Проведен курс внутривлагалищного введения аутолимфоцитов, активированных имунофаном по схеме: 1-е введение – 1×106, 2-е введение 2×106, 3-е – 1×107, 4-е – 1×107. Аутолимфоциты вводились с интервалом один раз в неделю. Для проведения внутриорганной (внутриматочной) аутолимфоцитотерапии у больной из локтевой вены брали 20 мл крови в стерильную пробирку с гепарином. В стерильных условиях из гепаринизированной крови выделили лимфоциты на растворе фиколла (плотность 1,077 г/см3). Выделенные лимфоциты перенесли в стерильную центифужную пробирку и четырежды отмыли стерильной средой RPMI 1640 путем центрифугирования в течение 7 минут при 200 g (1500 об/мин). Провели подсчет клеток в камере Горяева и проверку препарата на чистоту клеточной популяции и жизнеспособность клеток. После четвертой отмывки к суспензии лимфоцитов в концентрации 1×107 добавили 1 мл имунофана и инкубировали в течение трех часов при температуре 37°C, затем двукратно отмыли – 1-й раз – RPMI 1640, 2-й раз – изотоническим раствором натрия хлорида (0,9%). Отмытые клетки ресуспензировали в 1 мл стерильного изотонического раствора натрия хлорида (0,9%). Провели подсчет клеток в камере Горяева и проверку препарата на чистоту клеточной популяции и жизнеспособность клеток. В период проведения лечения, а также трехнедельного наблюдения за больной, после окончания курса внутриорганной аутолимфоцитотерапии не наблюдались какие-либо побочные действия данного способа лечения. Спустя три недели после последнего введения аутолимфоцитов оценивалась эффективность проводимой внутиорганной (внутриматочной) аутолимфоцитотерапии. Отмечалась положительная динамика клинических симптомов, больная не предъявляла жалобы на зуд, жжение слизистой, выделение из половых органов. Существенно улучшилось общее состояние: исчезли слабость, недомогание, периодическая субфебрильная температура, беспокоившая пациентку более года. Данные объективного исследования также свидетельствуют о положительных результатах проведенного курса лечения. При повторном влагалищном осмотре после лечения обнаружено: слизистая влагалища и стенок матки обычной окраски, отделяемое – бели прозрачные, в умеренном количестве. Тело матки и придатки без особенностей. Результаты лабораторных исследований, проведенных перед началом внутриорганной аутолимфоцитотерапии и через три недели после окончания курса лечения, отражают существенное снижение уровня IgG антител к CMV, IgG антител HSV – 1 тип, IgG антител Rubella. При повторном обследовании ПВИ (папиллома-вирус) не обнаружен. Результаты лабораторных исследований представлены в табл. Клинический случай Пациентка П., 31 года, наблюдалась врачом гинекологом по поводу: Папиллома-вирусная инфекция типы 16 и 18, наружная форма. Бактериальный вагиноз (Гарднереллез). Банальный кольпит. Хронический цистит, стадия ремиссии. Сопутствующий диагноз: хроническая рецидивирующая крапивница, поливалентная лекарственная аллергия. В анамнезе: хронический тонзиллит, хронический цистит. При первичном осмотре гинеколога пациентка предъявляла жалобы на зуд в области половых органов, дискомфорт, усиливающиеся после полового акта и при мочеиспускании, а также увеличение количества выделений из половых путей последние 1,5-2 месяца. При влагалищном осмотре обнаружены гиперемия и отек слизистой влагалища, обильные бели с резким запахом. На слизистой влагалища, в преддверии влагалища и на больших половых губах обнаружены множественные остроконечные кондилломы. Шейка матки не эрозирована, гиперемирована. Тело матки и придатки без особенностей. Пациентка также предъявляла жалобы на ежедневные высыпания по типу крапивницы, сопровождающиеся сильным зудом. Высыпания на коже беспокоят более 3 месяцев после перенесенной токсико-аллергической реакции на лекарственный препарат Рулид. Консультирована врачом аллергологом-иммунологом, подтвержден диагноз – рецидивирующая крапивница, поливалентная лекарственная аллергия к местным нескольким группам антибиотиков: аналгетикам и витаминам группы В. Проводимая традиционная терапия: курс ликопида по 10 мг 2 раза в день 14 дней, курс аллокина-альфа по 1 мг подкожно 6 инъекций, тинидазол по 2 таблетке 2 раза в сутки по схеме, крем «далацин С» местно на слизистую влагалища 6 дней. Далее курс поливалентного стафилококкового бактериофага по 20 мл 2 раза в день 10 дней. Через 2 недели после лечения больная предъявила жалобы на учащенное болезненное мочеиспускание, а также зуд и жжение при мочеиспускании. Учитывая неэффективность проводимой терапии, а также сопутствующую патологию – рецидивирующая крапивница в стадии обострения, поливалентная лекарственная аллергия больной был проведен курс внутривлагалищной аутолимфоцитотерапии. Лечение проводилось по схеме: 1-е введение – 1×106, 2-е – 5×106, 3-е – 1×107, 4-е – 1×107 клеток. Активированные имунофаном аутолимфоциты вводят внутривлагалищно, непосредственно на эпителий слизистой оболочки, методом орошения с использованием стерильного шприца с интервалом – 1 раз в неделю. В процессе проведения внутривлагалищной аутолимфоцитотерапии введение активированных имунофаном аутологичных лимфоцитов больной не сопровождалось никакими побочными эффектами. Результаты лабораторных исследований представлены в табл. Таблица Посев из влагалища до лечения Выявлены Ent. Faecalis 10*7 и Е. coli 10*7. После лечения патогенная флора не обнаружена. Клинический анализ мочи до лечения – увеличение количества плоского эпителия – 0-5-6 в поле зрения; увеличение количества переходного эпителия – 0-2-4 в поле зрения, большое количество лейкоцитов, бактерии обнаружены. Анализ мочи по Нечипоренко до лечения лейкоциты, 1/мл – 1200 эритроциты, 1/мл – 400 цилиндров, 1/мл – 0 После курса лечения клинический анализ мочи и анализ мочи по Нечипоренко в пределах нормы.
ПОСЕВ МОЧИ до лечения – Enterobacter – 100 млн КОЕ/мл После лечения микрофлора не обнаружена Обследована на инфекции, передающиеся половым путем – патологии не выявлено, мазок на флору – в пределах нормы. После курса лечения состояние больной улучшилось, прекратился зуд в области половых органов, учащенное болезненное мочеиспускание, исчезли также уртикарные высыпания, на теле и конечностях, прекратился кожный зуд. Спустя 2 недели после окончания курса ВАЛТ проведена операция: удаление остроконечных кондиллом на слизистой влагалища, больших половых губ и слизистой преддверия влагалища комбинированным способом. Кольпоскопия после курса лечения: патологии шейки матки не выявлено. УЗИ исследования: патологии мочевого пузыря не выявлено. Через 30 дней после курса лечения больная жалобы не предъявляет, при влагалищном осмотре слизистая влагалища не изменена, тело матки и придатки без особенностей. Клинический случай Больная З., 44 года, наблюдалась с диагнозом вторичное бесплодие, Антифосфолипидный синдром. В 1990 г. – естественная беременность, закончившаяся мед. абортом. В 2004, 2005, 2006, 2007 годах – безрезультатные попытки ЭКО. В 2007 г. в анализе крови обнаружено резкое повышение антифосфолипидных антител. Объективно: кожные покровы чистые, избыточного питания, телосложение гиперстенического типа. АД в норме. Обследована на инфекции, передающиеся половым путем – патологии не выявлено, мазок на флору – в пределах нормы. Вагинально: наружные половые органы развиты правильно, слизистая влагалища розовая, шейка матки цилиндрической формы, чистая. Матка нормальных размеров, яичники – без особенностей. Своды свободные. Выделения из половых путей – светлые, скудные. Клинический анализ крови: общий анализ мочи, основные показатели иммунограммы в пределах нормы. В анализе крови: антитела к спермальному антигену не обнаружены. При обследовании обнаружено: высокий уровень антител к При обследовании: за 2 месяца до проведения курса внутриматочной аутолимфоцитотерапии выявлен высокий уровень: Антифосфолипидные антитела IgG=36,79 Ед/мл (N<10 Ед/мл), Антитела к аннексину V IgG=1,68 Ед/мл (N<5 Ед/мл), Антитела к Антитела к протромбину IgG=0,01 Ед/мл (N<10 Ед/мл). При повторном обследовании перед началом курса внутриматочной аутолимфоцитотерапии эти показатели практически не изменились: Антифосфолипидные антитела IgG=36,9 Ед/мл (N<10 Ед/мл), Антитела к аннексину V IgG=0,08 Ед/мл (N<5 Ед/мл), Антитела к В2-гликопротеину I IgG>100 Ед/мл (N<5 Ед/мл), Антитела к протромбину IgG=0,01 Ед/мл (N<10 Ед/мл). В июне 2008 года проведен первый курс внутриматочной аутолимфоцитотерапии, отмечена тенденция к снижению уровня антител. Лечение проводилось по схеме: 1-е введение – 1×106, 2-е – 5×106, 3-е – 1×107, 4-е – 1×107 клеток. Взвесь аутолимфоцитов, активированных имунофаном, вводилась в полость матки в 0,5 мл стерильного физиологического раствора с помощью катетера для гистеосальпингографии (размер 8-F). Результаты обследования через месяц после окончания курса внутриматочной аутолимфоцитотерапии свидетельствуют о достоверном снижении уровня специфических антител: Антифосфолипидные антитела IgG=29,9 Ед/мл (N<10 Ед/мл), Антитела к аннексину V IgG=0,01 Ед/мл (N<5 Ед/мл), Антитела к Антитела к протромбину IgG=0,01 Ед/мл (N<10 Ед/мл). Спустя три месяца проведен повторный курс внутриматочной аутолимфоцитотерапии. Взвесь аутолимфоцитов, активированных in vitro в течение трех часов лекарственным препаратом преднизалоном в дозе 25 мг в 1,0 мл, вводилась в полость матки в 0,5 мл стерильного физиологического раствора с помощью катетера для гистеосальпингографии (размер 8-F) по схеме: 1-е введение 0,5×106 клеток, 2-е введение 0,5×106 клеток; 3-е введение 1×106 клеток; 4-е введение 1×106 клеток. Спустя месяц после курса лечения при повторном обследовании: антифосфолипидные антитела, антитела к Антифосфолипидные антитела IgG=13,85 Ед/мл (N<10 Ед/мл), Антитела к аннексину V IgG=0,01 Ед/мл (N<5 Ед/мл), Антитела к В2-гликопротеину I IgG=0,01 Ед/мл (N<5 Ед/мл), Антитела к протромбину IgG=0,24 Ед/мл (N<10 Ед/мл). Повторный осмотр гинеколога вагинально: слизистая влагалища розовая, шейка матки цилиндрической формы, чистая. Матка нормальных размеров, яичники – без особенностей. Своды свободные. Выделения из половых путей – светлые, скудные. Обследование на инфекции, передающиеся половым путем – патологии не выявлено, мазок на флору – в пределах нормы. Спустя два месяца после курса внутриматочной аутолимфоцитотерапии больной была проведена процедура ЭКО с положительным результатом. Клинический случай Больная Б., 40 лет, наблюдалась с диагнозом первичное бесплодие, хронический сальпингит, токсико-аллергическая реакция по типу сывороточной болезни на белковые среды, используемые на проведение процедуры ЭКО. Жалобы: на первичное бесплодие. Из анамнеза: у больной – хронический сальпингит, было проведено удаление маточных труб (2001 г.). Больной сделано 6 ЭКО, после некоторых ЭКО (2-я, 4-я, 6-я процедуры) на 3-4 й день отмечалось повышение температуры тела до 38 градусов Цельсия. Возможны токсико-аллергические реакции при проведении ЭКО. При первичном осмотре: Состояние удовлетворительное. Кожные покровы и видимые слизистые чистые, обычной окраски. Носовое дыхание свободное. В легких дыхание везикулярное, хрипов нет. Тоны сердца ясные, ЧСС=68 ударов в минуту, ритм правильный. АД – 120/80 мм рт.ст. Отеков нет. Вагинально: наружные половые органы развиты правильно, слизистая влагалища розовая, шейка матки цилиндрической формы, чистая. Матка нормальных размеров, яичники – без особенностей. Своды свободные. Выделения из половых путей – светлые, скудные. При лабораторном обследовании клинический анализ крови, общий анализ мочи, основные показатели иммунограммы в пределах нормы. Антифосфолипидные антитела IgG=2,51 Ед/мл (N<10 Ед/мл), Антитела к аннексину V IgG=0,01 Ед/мл (N<5 Ед/мл), Антитела к Антитела к протромбину IgG=3,61 Ед/мл (N<10 Ед/мл). Проведен первичный курс аутолимфоцитотерапии по схеме: 1-е введение – 1×106, 2-е – 5×106, 3-е – 1×107, 4-е – 1×107 клеток. Курс аутолимфоцитотерапии перенесла хорошо, без общих аллергических реакций. После лечения отмечалось улучшение общего состояния, прекратилась слабость, беспокоившая больную в течение нескольких лет. После курса лечения отмечалось также снижение уровня IgG антител к CMV. Спустя 4 месяца, за месяц до проведения повторной процедуры ЭКО (седьмой раз) проведен повторный курс внутриматочной аутолимфоцитотерапии по следующей схеме. Взвесь аутолимфоцитов, активированных in vitro в течении трех часов лекарственным препаратом преднизалоном в дозе 25 мг в 1,0 мл, вводилась в полость матки в 0,5 мл стерильного физиологического раствора с помощью катетера для гистеосальпингографии (размер 8-F) по схеме: 1-е введение 0,5×106 клеток, 2-е введение 0,5×106 клеток; 3-е введение 1×106 клеток; 4-е введение 1×106 клеток. Процедуру ЭКО перенесла нормально, у больной не отмечалось повышение температуры, кожных высыпаний. Процедура ЭКО оказалась успешной. Приведенные нами результаты продемонстрировали клиническую эффективность предложенного способа лечения. Предложенный способ при соблюдении принципа индивидуализированного подхода к каждому пациенту уменьшает количество нежелательных побочных эффектов, позволяет нормализовать иммунный статус, снижает выраженность воспалительных явлений, обладает выраженным противовирусным действием и антибактериальным действием.
Формула изобретения
1. Способ лечения хронических рецидивирующих урогенитальных бактериальных и вирусных инфекций, включающий предварительное получение аутологичных лимфоцитов крови больного, культивирование полученных лимфоцитов совместно с иммуномодуляторами и последующее внутриматочное введение 0,5-2,0 мл взвеси лимфоцитов в приемлемой среде при их концентрации 106-107 кл/мл. 2. Способ по п.1, отличающийся тем, что культивирование полученных лимфоцитов совместно с иммуномодуляторами осуществляют в течение 3-6 ч. 3. Способ по п.1, отличающийся тем, что в качестве иммуномодулятора используется имунофан. 4. Способ по п.1, отличающийся тем, что внутриматочное введение аутолимфоцитов проводят несколько раз. 5. Способ по п.4, отличающийся тем, что интервал между введениями составляет 1 неделя.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 -ИНФ и ИЛ-4 определяет тип развития иммунной реакции (клеточный или гуморальный). Однако значительная часть ростовых факторов, гормонов, медиаторов и других внеклеточных белков, которые секретируются культивируемыми клетками, во внеклеточной среде быстро инактивируются, т.е. теряют свою биологическую активность. С другой стороны, в составе культивируемых клеток находятся секреторные гранулы, содержащие белки, и зачастую белки, входящие в состав секреторных гранул, находятся в неактивном состоянии в виде прогормонов.
-ИНФ и ИЛ-4 определяет тип развития иммунной реакции (клеточный или гуморальный). Однако значительная часть ростовых факторов, гормонов, медиаторов и других внеклеточных белков, которые секретируются культивируемыми клетками, во внеклеточной среде быстро инактивируются, т.е. теряют свою биологическую активность. С другой стороны, в составе культивируемых клеток находятся секреторные гранулы, содержащие белки, и зачастую белки, входящие в состав секреторных гранул, находятся в неактивном состоянии в виде прогормонов. 1 данные свидетельствуют о достаточно высокой степени жизнеспособности аутологических лимфоцитов крови больного при активации имунофаном, непосредственно после выделения жизнеспособность клеток составила 90-97%. Через три часа после активации жизнеспособность клеток колебалась в пределах 80-90%. После шестичасовой инкубации – 81-77%, после 48-часовой – 50-60%.
1 данные свидетельствуют о достаточно высокой степени жизнеспособности аутологических лимфоцитов крови больного при активации имунофаном, непосредственно после выделения жизнеспособность клеток составила 90-97%. Через три часа после активации жизнеспособность клеток колебалась в пределах 80-90%. После шестичасовой инкубации – 81-77%, после 48-часовой – 50-60%.
 гликопротеину I.
гликопротеину I.