Патент на изобретение №2167880
|
||||||||||||||||||||||||||
(54) ИНДОЛОПИРРОЛОКАРБАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ САХАРОВ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ РОСТА ОПУХОЛЕЙ
(57) Реферат: Данное изобретение касается новых индолопирролокарбазольных производных сахаров общей формулы I, где R1 и R1а обозначают водород или группу гексозы формулы В, при условии, что один из R1 и R1а обозначает водород, а другой не является водородом; R2 и R’2 независимо обозначают водород, ОН; R3 и R’3 независимо обозначают водород, ОН; R4 и R’4 независимо обозначают водород, ОН, азидо, NH2 галоген; R5, R’5, R”5 независимо обозначают H, ОН, азидо, NR9R10, галоген, C(O)Ra, SR, OSO2Rc, OR или вместе образуют =O, при условии, что R2, R3, R4, R5 и R’2, R’3, R’4, R’5 и R”5 все одновременно не являются водородом, R обозначает водород, С1-7алкил, гетероциклическое 6-членное кольцо, содержащее 1 или 2 атома азота в качестве гетероатомов, причем указанный С1-7алкил может быть замещен фенилом; Ra обозначает ОН; Rc обозначает С1-7алкил; R6 обозначает водород, С1-7алкил, ОН, NH2, причем указанный С1-7алкил может быть замещен фенилом, который в свою очередь может быть замещен С1-7алкилом; R7 и R8 вместе обозначают О; R9 и R10 независимо обозначают водород или вместе с атомом азота, к которому они присоединены, образуют циклическое 6-членное неароматическое кольцо, содержащее один или два гетероатома, выбранные из группы N, О; X1, X’1, Х2 и Х’2 независимо обозначают H, галоген, -CN, -С(O)Ra при условии, что X’1, Х2 и Х’2 не являются 1,11-дихлор, и при условии, что, когда Х2 и Х’2 обозначает каждый H, X1 и X’1, каждый независимо обозначает H или галоген, R1 обозначает гексозу, R7 и R8 вместе обозначают О, каждый из R2, R5 и R4 обозначает ОН, R’2, R’3, R’4, R’5 и R”5 каждый обозначает H, Q обозначает NH, и тогда каждый из R3 и R6 не является NH2 и R3 не является метокси, когда R6 обозначает H; W представляет собой С; Q представляет собой NH, О или S; или его фармацевтически приемлемая соль. Соединения формулы I проявляют активность по отношению к топоизомеразе-1 и пригодны для ингибирования пролиферации опухолевых клеток, проявляя противоопухолевое действие, описывается также фармацевтическая композиция и способ ингибирования роста опухоли. 3 с. и 15 з.п. ф-лы, 5 табл. 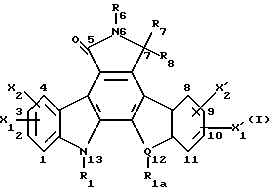 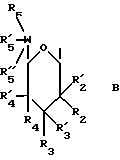
I. Область, к которой относится изобретение Данное изобретение относится к аминосахару и другим индолопирролокарбазольным производным сахаров, их солям и гидратам, некоторые из которых проявляют активность по отношению к топоизомеразе-I и пригодны для ингибирования пролиферации опухолевых клеток, проявляя противоопухолевое действие, а также к способу их получения. II. Описание уровня техники Индоло[2,3-a] карбазольные алкалоиды, такие как ребеккамицин (патент США N 4487925 и 4552842) и его водорастворимый клинически активный аналог, 6-(2-дтэтиламиноэтил)ребеккамицин (1) (патент США N 4785085) являются эффективными противоопухолевыми агентами, действующими на ДНК.  Топоизомеразы являются жизнеспособными ядерными фрагментами, которые решают топологические дилеммы в ДНК, такие как недокручивание, перекручивание и образование цепочек, которые обычно возникают во время репликации, транскрипции и, возможно, других процессов в ДНК. Эти ферменты позволяют ДНК срелаксировать путем образования нитевых разрывов с ферментными мостиками, которые действуют как неустойчивые проходы или основные точки для прохождения других нитей ДНК. Лекарства, действующие на топоизомеразу, влияют на эту реакцию разрыв-соединение в топоизомеразах ДНК. В присутствии активных по отношению к топоизомеразе агентов промежуточный продукт, называемый “расщепляемым комплексом”, аккумулируется и приводит к прекращению репликации/транскрипции, что в конце концов приводит к гибели клеток. Следовательно, расширение круга активных по отношению к топоизомеразе I агентов обеспечивает новый подход в арсенале терапевтических средств, используемых в клинике для лечения рака. В статье в Cancer Chemother. Pharmacol (1994), 34 (suppl): S 41 – S 45 обсуждаются активные по отношению к топоизомеразе I соединения, изучаемые в клинических исследованиях, обнаружено, что эти агенты являются эффективными клиническими противоопухолевыми агентами. Структурно эти клинические агенты относятся к камптотециновым алкалоидам (2)  Камптотецин В европейских патентных документах 0545195 B1, опубликованном 22 ноября 1995 г., и 0602597 A2, опубликованном 22 июня 1994 г., и в статьях в Cancer Research 1993, 53, 490-494 и 1995, 55, 1310-1315 описаны индоло[2,3-a]карбазольные производные (3), относящиеся к классу ребеккамицина, обладающие противоопухолевой активностью; однако основной механизм действия может быть непохож на действие камптотецина. Камптотецины действуют по механизму топоизомеразы 1. В заявке WO 95/30682 также описаны индолокарбазолы, родственные соединению (3) и обладающие противоопухолевой активностью. 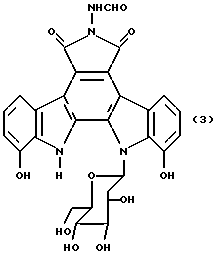 Hudkins и др. в WO 96/11933, опубликованной 25 апреля 1996 г., и в соответствующем патенте США N 5475110 описали ряд сконденсированных пирролокарбазолов и привели биологические свойства in vitro, такие как данные об ингибировании невральной холинацетилтрансферазы (ХАТ), об ингибировании некоторыми соединениями протеинкиназы С (ПКС). В патенте США N 5468849 описаны некоторые аналоги фторребеккамицина как полезные противоопухолевые агенты, а также способ их получения путем подпитки аналогом фтортриптофана штамма Saccharothrix aerocolonigenes, предпочтительно Saccharothrix aerocolonigenes C38,383-RK2 (ATCC 39243), продуцирующего ребеккамицин. Glicksman и др. в патенте США N 5468872 описал индолокарбазольные алкалоиды, которые отличаются по структуре от соединений формулы I согласно данному изобретению. Kojiri и др. в WO 96/04293, опубликованной 15 февраля 1996 г., описал индолопирролокарбазолы, содержащие дисахаридный заместитель, который отличается от наших аминозамещенных сахаров. В предшествующем уровне техники и в вышеуказанных источниках нет сведений о новом цитотоксичном аминосахаре и других индолопирролокарбазольных производных сахаров, некоторые из которых активны по отношению к топоизомеразе-I, описанных в настоящем изобретении. Сущность изобретения Цель данного изобретения состоит в создании новых индолопирролокарбазольных производных сахаров, которые ингибируют пролиферацию противоопухолевых клеток, некоторые из этих производных имеют улучшенную растворимость в воде и проявляют активность по отношению к топоизомеразе-I. Настоящее изобретение относится к новым противоопухолевым соединениям общей формулы I или их фармацевтически приемлемым солям 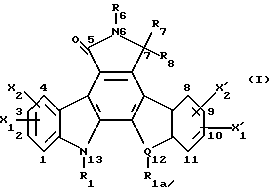 где R1 и R1a обозначают водород или группу гексозы формулы (B) 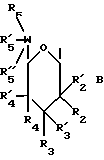 при условии, что один из R1 и R1a обозначает водород, а другой не является водородом; R2 и R’2 независимо обозначают водород, OH; R3 и R’3 независимо обозначают водород, OH; R4 и R’4 независимо обозначают водород, OH, азидо, NH2, галоген; R5, R’5, R”5 независимо обозначают H, OH, азидо, NR9R10, галоген, C(O)Ra, SR, OSO2Rc, OR или вместе образуют =O; при условии, что R2, R3, R4, R5, и R’2, R’3, R’4, R’5 и R”5 все одновременно не являются водородом, R обозначает водород, C1-7алкил, гетероциклическое 6-членное кольцо, содержащее 1 или 2 атома азота в качестве гетероатомов, причем указанный C1-7алкил может быть замещен фенилом; Ra обозначает OH; Rc обозначает C1-7алкил; R6 обозначает водород, C1-7алкил, OH, NH2, причем указанный C1-7алкил может быть замещен фенилом, который в свою очередь может быть замещен C1-7алкилом; R7 и R8 вместе обозначают O; R9 и R10 независимо обозначают водород или вместе с атомом азота, к которому они присоединены, образуют циклическое 6-членное неароматическое кольцо, содержащее один или два гетероатома, выбранные из группы N, O; X1, X’1, X2 и X’2 независимо обозначают H, галоген, -CN, -C(O)Ra, при условии, что X’1, X2 и X’2 не являются 1,11-дихлор, и при условии, что когда X2 и X’2 обозначает каждый H, X1 и X’1 каждый независимо обозначает H или галоген, R1 обозначает гексозу, R7 и R8 вместе обозначают O, и каждый из R2, R5 и R4 обозначает OH, R’2, R’3, R’4, R’5 и R”5 каждый обозначает H, Q обозначает NH, и тогда каждый из R3 и R6 не является NH2 и R3 не является метокси, когда R6 обозначает H. W представляет собой C; Q представляет собой NH, O или S; или его фармацевтически приемлемая соль. Другой аспект настоящего изобретения относится к способу ингибирования роста опухолей у млекопитающего, который заключается во введении последнему ингибирующего рост опухоли количества соединения формулы I. Еще один аспект изобретения предусматривает фармацевтическую композицию, которая включает противоопухолевое эффективное количество соединения формулы I в сочетании с одним или несколькими фармацевтически приемлемыми носителями, эксципиентами, разбавителями или добавками. Подробное описание изобретения Данное изобретение предусматривает новый аминосахар и родственные производные индолопирролокарбазола и их соли, некоторые из которых являются агентами по отношению к топоизомеразе-I. Эти соединения пригодны для ингибирования пролиферации противоопухолевых клеток и проявляют противоопухолевое действие. В данном описании, если иначе не оговаривается и не подразумевается, используются следующие определения. Цифры в индексах после обозначения атома углерода C обозначают число атомов углерода, которое может содержать конкретная группа. Например, C1-6 означает линейную или разветвленную насыщенную углеродную цепь, содержащую от одного до шести атомов углерода; примеры включают метил, этил, н-пропил, изопропил, н-бутил, втор.бутил, изобутил, трет. бутил, н-пентил, втор.пентил, изопентил и н-гексил. В зависимости от контекста C1-6 может также относиться к C1-6 алкилену, который соединяет две группы; примеры включают пропан-1,3-диил, бутан-1,4-диил, 2-метил-бутан-1,4-диил и т.д. C2-6алкенил означает линейную или разветвленную углеродную цепь, содержащую, по меньшей мере, одну углерод-углеродную двойную связь и содержащую от двух до шести атомов углерода; примеры включают этенил, пропенил, изопропенил, бутенил, изобутенил, пентенил и гексенил. В зависимости от контекста 2-6алкенил может также относиться к C2-6алкендиилу, соединяющему две группы; примеры включают этилен-1,2-диил (винилен), 2-метил-бутен-1,4-диил, 2-гексен-1,6-диил и т.д. C2-6алкинил означает линейную или разветвленную углеродную цепь, содержащую, по меньшей мере, одну углерод-углеродную тройную связь и содержащую от двух до шести атомов углерода; примеры включают этинил, пропинил, бутинил и гексинил. “Арил” означает ароматический углеводородный радикал, содержащий от шести до десяти атомов углерода; примеры включают фенил и нафтил. “Замещенный арил” означает арил, назависимо замещенный одной-пятью (предпочтительно, одной-тремя) группами, выбранными из C1-6алканоилокси, гидрокси, галогена, C1-6алкила, трифторметила, C1-6алкокси, арила, C2-6 алкенила, C1-6алканоила, нитро, амина, циано, азидо, C1-6алкиламино, ди-C1-6алкиламино и амидогрупп. “Галоген” обозначает фтор, хлор, бром и иод; фтор является предпочтительным. “Гетероарил” означает пяти- или шестичленное ароматическое кольцо, содержащее, по меньшей мере, один и до четырех неуглеродных атомов, выбранных из кислорода, серы и азота. Примеры гетероарилов включают тиенил, фурил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, триазолил, тиадиазолил, оксадиазолил, тетразолил, тиатриазолил, оксатриазолил, пиридил, пиримидил, паразинил, пиридазинил, триазинил, тетразинил и т. п. Соединения согласно настоящему изобретению имеют общую формулу 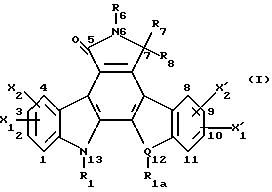 где R1 обозначает группу гексозы формулы (B) 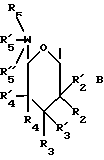 Предпочтительными соединениями формулы I являются соединения, у которых в R1 или R1a все заместители обозначают H, кроме R2, R3, и R4 каждый обозначает OH, и R5 обозначает NR9R10. Другие предпочтительные соединения формулы I представляют собой соединения, у которых в R1 или R1a все заместители обозначают H, кроме R2, R3 и R5 каждый обозначает OH и R4 обозначает NH2. Другими предпочтительными соединениями формулы I являются такие, у которых в R1 или R1a все заместители обозначают H, кроме R2, R3 и R4, каждый из которых обозначает OH, и R5 обозначает галоген. Другими предпочтительными соединениями формулы I являются такие, у которых R7 и R8, взятые вместе, обозначают O. Другими предпочтительными соединениями формулы I являются соединения, у которых X, X’1, X2 и X’2 независимо обозначают галоген. Другие предпочтительные соединения формулы I представляют собой соединения, у которых указанный галоген является фтором. Другими предпочтительными соединениями формулы I являются такие, у которых Q обозначает O, S или NH. Другими предпочтительными соединениями формулы I являются такие, у которых R2, R3 и R5 каждый обозначает OH; и R4 обозначает NH2, галоген или N3. Другими предпочтительными соединениями формулы I являются такие, у которых в R1 или R1a все заместители обозначают H, кроме R5, R3 и R4, каждый из которых обозначает OH и R2 обозначает галоген. Другими предпочтительными соединениями формулы I являются такие, у которых в R1 или R1a все заместители обозначают H, кроме R2 и R3, каждый из которых обозначает OH; R5 обозначает галоген; и R4 обозначает азидо, NH2 или OH. Другими предпочтительными соединениями формулы I являются такие, у которых в R1 или R1a все заместители обозначают H, кроме R2 и R3, каждый из которых обозначает OH; R5 обозначает галоген и R4 обозначает галоген или H. Другие предпочтительные соединения формулы I представляют собой соединения, у которых в R1 или R1a все заместители обозначают H, кроме R2 и R3, каждый из которых обозначает водород или гидрокси; R4 обозначает водород, галоген или азидо; и R5 обозначает гидрокси, азидо, галоген или NR9R10. Другими предпочтительными соединениями формулы I являются такие, у которых в R1 или R1a все заместители обозначают H, кроме R3 и R4, каждый из которых обозначает водород или гидрокси; R2 обозначает водород и R5 обозначает гидрокси, азидо, галоген или NR9R10. Другими предпочтительными соединениями формулы I являются такие, у которых в R1 или R1a все заместители обозначают H, кроме R3 и R5, каждый из которых обозначает водород или гидрокси; R2 обозначает водород, и R4 обозначает гидрокси, азидо, галоген или NH2. Другими предпочтительными соединениями формулы I являются такие, у которых в R1 или R1a все заместители обозначают H, кроме R2 и R4, каждый из которых обозначает водород или гидрокси; R3 обозначает водород и R5 обозначает гидрокси, азидо, галоген или NR9R10. Фармацевтически приемлемые соли и/или сольваты соединений формулы I также охватываются данным изобретением, которое также включает стереоизомеры, такие как энантиомеры, которые могут образоваться вследствие структурной асимметрии соединений формулы I, и аномеры, которые образуются вследствие стехиометрии R1. Соединения согласно данному изобретению могут существовать в виде фармацевтически приемлемых солей. Эти соли включают соли присоединения неорганических кислот, например, соляной и серной кислоты, и органических кислот, таких как уксусная, лимонная, метансульфоновая кислота, толуолсульфоновая кислота, винная и малеиновая кислота. Кроме того, соединения по изобретению содержат кислотную группу, последняя может существовать в виде солей щелочных металлов, например, калиевой соли и натриевой соли; солей щелочноземельных металлов, например, магниевой соли и кальциевой соли; и солей с органическими основаниями, например, этиламмониевой соли и соли аргинина. Соединения согласно данному изобретению являются полезными фармакологическими агентами с противоопухолевыми свойствами. В последние годы появились многочисленные сообщения, в которых предполагается, что роль лекарств, действующих на топоизомеразу-I, состоит в стабилизации ковалентного комплекса ДНК-топоизомераза-I с получением связанных с ферментом однонитиевых фрагментов ДНК. С фармакологической точки зрения существуют преимущества в действии на топоизомеразу-I; во-первых, сравнительно высокое ее содержание в размножающихся и заторможенных клетках предполагает независимость ее функции от скорости роста клеток и, во-вторых, активные по отношению к топоизомеразе-I агенты могут быть эффективными в процессе медленного роста и быстрого размножения опухолевых клеток. Было показано, что клетки из опухолей толстой кишки содержат более высокую внутриклеточную концентрацию топоизомеразы-I, чем обычные слизистые клетки, что предполагает возможность селективного цитотоксического преимущества. Таким образом, ингибирование пролиферации опухолевых клеток соединениями формулы I первоначально было показано путем эффективного ингибирования топоизомеразы-I. Селективные соединения формулы I, обычно имеющие значения EC50 менее 10 мкМ при проведении анализа топоизомеразы-I, были также испытаны при ингибировании пролиферации опухолевых клеток у человека/мыши. Соединения согласно данному изобретению изучались на их терапевтическое действие in vivo на опухоли (P388) у мышей, результаты приведены в нижеследующих примерах фармакологических испытаний (таблица 1). In vivo противоопухолевая эффективность Испытания in vivo начинали с имплантации мышам (BDF1 или CDF1) лейкозных клеток 10(6) P388 внутрибрюшинно. Лечение начинали через день после имплантации путем внутрибрюшинного введения определенной дозы один раз; использовали несколько различных доз для каждого соединения. Обычно в используемых группах было шесть мышей, которым вводили одну и ту же дозу, в параллельных контрольных группах больных лейкемией мышей было восемь-десять мышей. Оценку активности проводили на основе сравнения среднего времени выживания (MST) мыши, которой вводили лекарство (T) со средним временем выживания контрольной мыши (C). Активность определяли как % T/C > или = 125%, рассчитывали по уравнению MST(T)/MST(C)  100 = % T/C 100 = % T/CАктивность топоизомеразы I (in vitro) Активность топоизомеразы I определяли следующим образом. Методика определения включала образование однонитевых фрагментов в ДНК, индуцированное топоизомеразой I, что описано Hsiang и др., J. Biol. Chem. 260: 14873-14878 (1985). Образцы растворяли в 100% ДМСО, получая или 10 мкМ, или 10 мг/мл растворы, если иное не оговорено, которые разбавляли Tris-EDTA буфером. Морской бактериофаг PM2 DHK (Boehringer Mannheim) также разбавляли Tris-EDTA буфером до концентрации 0,02 мкг/мкл. Различные растворы испытуемого соединения смешивали с разбавленной ДНК и эту смесь добавляли в 1000 единиц (одна единица активности фермента обозначает количество, способное срелаксировать 100 нг сверхспиральной ДНК приблизительно за 30 мин при 37oC) аликвотных проб очищенной человеческой топоизомеразы I (Topogen) в 2X реакционном буфере для начала реакции. Смесь соединение-ДНК-фермент культивировали в течение 30 мин при 37oC перед прерыванием реакции теплым буферным раствором, содержащим додецилсульфат натрия и протеиназу K (Sigma). Эти смеси выдерживали при 37oC еще 10 мин, после чего смеси удаляли из водяной бани и экстрагировали смесью 24: 1 хлороформ/изоамиловый спирт. После центрифугирования аликвоты водных фаз помещают в лунки 0,9% агарозного (Sea Kem) геля в Tris-borate буфере, содержащем 0,5 мкг/мл бромистого этидия и подвергали электофорезу в течение 15 час для разделения различных топологических изомеров и “ников” и фрагментов ДНК. После обесцвечивания геля в воде продукты реакции ДНК, окрашенные бромистым этидием, подвергали визуализации при облучении геля УФ-светом. Негативы фотографий облученных гелей сканировали денситометром и определяли площади под пиками для того, чтобы получить образование однонитевых фрагментов ДНК в процентах для каждого образца. Для каждого соединения определяли среднюю эффективную концентрацию (EC50) путем интерполяции между точками полученная доза – кривая эффективности, которая определяет активность соединения по его действию на образование однонитевых фрагментов ДНК, опосредованных топоизомеразой I. Активность выбранных соединений по изобретению по отношению к топоизомеразе I показана в таблице II. Новые соединения согласно данному изобретению, являющиеся аминопроизводными и другими производными сахаров, показанные в таблице II, проявляют превосходную активность в отношении топоизомеразы-I, даже в субмикромолярном интервале концентраций. Однако априори эта активность является неожиданной и непредсказуемой для специалистов, так как небольшое изменение в структуре замещения приводит к совершенно неожиданному изменению активности. Это видно на примере различных значений активности соединений, полученных в примерах 18 и 19, по отношению к топоизомеразе-I. Соединение по примеру 19 является эффективным антиопухолевым агентом с субмикромолярной активностью по отношению к Торо-I, в то время как соединение по примеру 18 не обнаруживает активности по отношению к Торо-I при концентрации, даже превышающей 100 микромолей. Единственная разница между соединениями по примерам 18 и 19 заключается в том, что в соединении по примеру 18 X1 и X’1 обозначают 2,10-дифтор и R6 обозначает аминогруппу, а в соединении по примеру 19 X1 и X’1 обозначает 3,9-дифтор и R6 обозначает водород. Более того, ребеккамицин, у которого X1 и X’1 обозначает 1,11-дихлор, R4 обозначает метокси и R5 обозначает гидрокси, также не является активным по отношению к Торо-I. Определение цитотоксичности in vitro в отношении клеток Ингибирующая пролиферацию активность в отношении клеточной линии из толстой кишки человека определялась следующим образом. Цитотоксичность определяли в клетках HCT116 карциномы толстой кишки человека с использованием XTT (2,3-бис(2-метокси-4-нитро-5-сульфофенил)-5-[(фениламино)карбонил] -2H- тетразолия гидроокиси, как описано в литературе Scudiero, DA, Shoemaker, RH, Paull, KD, Monks, A, Tiermey, S, Nofziger, TH, Currens, MJ, Seniff, D, and Boyd, MR. Оценка влияния растворимого тетразолия/формазана на рост клеток и чувствительность лекарства в культуре, использующей линии клеток опухоли человека и других опухолей, проводилась в соответствии с методикой, описанной в Cancer Res. 48: 4827-4833, 1988. Клетки в количестве 4000 клеток/лунку помещали в планшеты с 96 лунками и через 24 часа добавляют лекарства и разбавляют. Клетки культивировали при 37oC в течение 72 час, затем добавляли тетразолиевый краситель XTT, содержащий феназинметосульфат. Фермент дегидрогеназа в жизнеспособных клетках восстанавливает XTT до формы, которая абсорбирует свет при 450 нм, что может быть количественно определено методом спектрофотометрии. Чем больше абсорбция, тем больше число жизнеспособных клеток. Результаты выражают в IC50, концентрации лекарства, требующегося для ингибирования пролиферации клеток (то есть абсорбции при длине волны 450 нм) на 50% по сравнению с контрольными клетками. Результаты для некоторых соединений согласно настоящему изобретению приведены в таблице III. Один аспект данного изобретения относится к введению соединения формулы I или его фармацевтически приемлемой соли или сольвата млекопитающему, которому имплантировали опухоли или который склонен к заболеванию раком. В общем соединение будут вводить дозой в интервале от примерно 0,01 мг/кг до примерно MTD (максимально переносимая доза). Хотя доза, режим и периодичность введения соединения формулы I в каждом случае нужно тщательно подбирать с учетом профессиональных знаний врача и возраста пациента, его веса и состояния, способа введения и природы или степени распространения заболевания раком. Термин “системное введение”, используемый в данном описании, относится к оральному подъязычному, трансбукальному, трансназальному, трансдермальному, ректальному, внутривентрикулярному, внутриоболочечному и подкожному методам введения. В соответствии с клинической практикой предпочтительно вводить соединения в таком количестве, которое обеспечит эффективное полезное действие, не вызывая вредных или нежелательных побочных эффектов. Описание конкретных форм осуществления изобретения Методика получения соединений формулы I показана на Схеме I, а получение ключевых/промежуточных соединений – на Схеме II. На Схемах I и II R2-R6, X1, X2, X’1, X’2 и Q указаны выше. PQ обозначает синтетическую органическую “защитную группу”, обычно используемую для “защиты” гидроксильной функциональности, например, ацильную группу, такую как ацетильную, трифторацетильную или арилалкильную группу, такую как бензильную и т.п. Подходящие “защитные” или “блокирующие” группы, используемые в органическом синтезе, хорошо известны специалистам и описаны в соответствующей литературе. См., например, Theodora Greene, Protective Groups in Organic Synthesis, John Wiley and Sons, New York. Исходными веществами на Схеме I являются дигалоидмалеимидные производные (II), такие как 3,4-диброммалеимид; и соответствующие производные индола формулы III. Добавление производных индола III (R” = H или Ar) к малеимиду II в присутствии основания, такого как этилмагнийбромид или т.п., в среде органических растворителей, например, ТГФ (то есть тетрагидрофурана), бензоле или толуоле или их смесей при температуре от -20oC до температуры флегмы приводит к образованию моно- и биспроизводных V и IV соответственно. Количество реагентов можно изменять, варьируя отношение V к IV в любую сторону. Промежуточное соединение VI затем может быть превращено в индолопирролокарбазольное соединение VI в условиях окислительной циклизации, таких как дициандихлорхинон (DDQ)/кислота/нагревание или ацетат палладия/кислота или иод, свет и т.п. Гликозилирование VI реакционноспособными производными сахара, такими как 1,2- эпоксид, описанные в публикациях J. Org. Chem. 1993, 58, 343-349 и J. American Chemical Society 1989, III, 6661-6666, или 1-галоид и другие, в присутствии соответствующего основания, такого как диизопропилэтиламин, гексаметилдисилазид, с образованием моно- или ди- или трианиона индолопирролокарбазольного соединения VI в органическом растворителе типа ТГФ, ДМФ (то есть диметилформамида), диоксана, бензола, ДМЭ (то есть диметоксиэтана) приводит к получению полностью защищенного производного VIII. Кроме того, более предпочтительно проводить гликозилирование путем взаимодействия 1-гидроксисоединения соответствующего защищенного производного сахара со структурой VI в хорошо известных условиях реакции Мицунобу [PPh3] /диалкилазидодикарбоксилат] в среде эфирного растворителя типа ТГФ или хлорированного растворителя типа CH2Cl2. Соответствующее производное сахара для гликозилирования может быть получено селективной модификацией различных гидроксильных групп с использованием известных методов. Например, в статье в J. Carbohydrate Chemistry (1995), 14, p. 1279-94 описано производное 6-галоид-6-деоксиглюкозы. Другой способ получения соединения VIII включает гликозилирование моноаддукта вначале в условиях, описанных выше, с образованием промежуточного соединения VII с последующими дегидрогалогенированием и циклизацией, как описано во многих хорошо известных публикациях для подобного превращения, включая нагревание или облучение УФ-светом раствора VII в растворителях типа диоксана, этанола или смеси растворителей. Соединение VIII является защищенной формой соединения формулы I. Выбор защитной группы в сахаре позволяет осуществлять селективную манипуляцию первичной гидроксильной группы. Например, когда первичная 6′-гидроксильная группа защищена p-метоксибензильной защитной группой (PMB), а остальные гидроксилы были защищены простыми бензильными группами (Bn), специалисты могут удалить PMB группу без снятия защиты бензильной группы. Таким образом, первичная 6′-гидроксильная группа окисляется с образованием соответствующей кислоты и ее сложноэфирного и амидного производных. Далее, при контролируемых условиях окисления с использованием реагента Десс-Мартина или т.п., 6-гидроксильная группа окисляется до соответствующего альдегида. Обработка альдегида хорошо известным фторирующим реагентом типа DAST привела к 6-дифторметильному производному. Точно так же модифицируются другие гидроксильные группы. Например, 4-гидроксильная группа производного галактозы (гексозный сахар в виде пиранозы, в которой 4-гидроксил ориентирует осевое положение) может быть использована для модификации 4-положения. Окисление 4-гидроксильной группы в соответствующим образом защищенном производном сахаре приводит к получению кетона, который затем может быть функционизирован с получением различных производных, включая 4-фторпроизводное, с использованием известных методов. Если 4-гидроксильная группа активируется, например, в случае 4-мезилата, она может подвергаться нуклеофильному замещению агентами, например, азидом (например, азидом натрия) с получением 4-азидо производного. С другой стороны, когда производное сахара с незащищенной 4-гидроксильной группой обрабатывается фторирующим агентом, DAST, получают 4-фторпроизводное. Подобным образом также модифицируются селективно другие гидроксильные группы. Например, модификация по известной из литературы методике позволяет ввести атом фтора в 2-положение сахара (Bioorg. Med. Chem., vol. 5, N 3, p. 497-500 (1997)). Это показано в примере 90. Простая манипуляция с защитной группой, такая как гидрирование или гидрирование с передачей в присутствии катализатора Перлмана, для удаления бензильных защитных групп во фрагментах сахара или, если необходимо, гидролиз KOH или NaOH группы, защищающей азот в малеимиде, с получением ангидрида после обработки кислотой с последующим нагреванием с соответствующим амином приведет к желаемому соединению формулы Ia с правильной структурой замещения. Селективная дериватизация каждой гидроксильной группы во фрагментах сахара в соединении Ia может быть достигнута путем манипуляции с защитной группой и удаления защитной группы, защищающей первичный гидроксил, в присутствии групп, защищающих вторичные гидроксильные группы. Например, когда соединение формулы Ia в глюкопиранозильной форме (а именно, гексозы формулы (B)), где все гидроксильные группы сахара свободны, обрабатывается силильным реагентом типа триметилсилила или трет.бутил-дифенилсилила или, предпочтительно, трет.бутил-диметилсилилтрифлата в присутствии основания в растворителе типа CH2Cl2 или ТГФ на холоде или при комнатной температуре, получают производное, в котором 3- и 6-положения защищены в виде силиловых эфиров. Селективное удаление защиты 6-силилового эфира можно достичь в регулируемых условиях в присутствии водной минеральной или органической кислоты, например, смеси трифторуксусной кислоты и воды в качестве растворителя при пониженной температуре, например, в интервале от -25oC до 0oC в течение периода времени от 30 мин до 3 час или до тех пор, пока реакция не завершится, о чем свидетельствует тонкослойная хроматография. Это промежуточное соединение подвергается дальнейшей дериватизации в 6-положении для активации 6-гидроксила в отщепляемую группу, типа мезилата или галогенида. Иначе, селективное мезилирование первичной 6-гидроксильной группы может также быть достигнуто непосредственно с применением соединения формулы Ia, где все гидроксильные группы сахара не защищены, в пиридине и в присутствии мезилхлорида в пиридине при 0oC. Нуклеофильное замещение соответствующим амином или другими нуклеофильными агентами типа азида до амина приведет к получению желательных соединений формулы I, таких как 6′-аминопроизводные сахара Ib. Таким способом было получено 6-метилсульфидное производное с применением натриевой соли тиольного производного или тиола и основания типа K2CO3 в ДМФ или органического амина типа триэтиламина или основания Гунига при температурах, меняющихся от комнатной до 150oC. 6-алкилсульфид, например, 6-метилсульфид, далее окисляется известными окислителями типа Оксона или м-хлорпербензойной кислоты или, предпочтительно, магниевой соли монопероксифталевой кислоты (MMPP) до их сульфидов и сульфона в контролируемых условиях. Подобно этому другие гидроксильные группы можно дериватизировать, если это желательно. Еще одна модификация соединения формулы I приведет к N-малеимидным замещенным (а именно R6) индолопирролокарбазольным производным Ic. Например, ангидрид, полученный путем гидролиза при помощи основания соответствующим образом защищенной формы соединения формулы I, можно подвергать взаимодействию с рядом аминопроизводных с получением желательных N-замещенных малеимидов. Как показано на Схеме II, N-замещенное малеимидное производное может быть получено или непосредственно из дигалоидмалеинового ангидрида при его обработке соответствующим аминопроизводным, или галогенированием малеимида с последующим алкилированием. Исходные производные индола, не имеющие заместителей в 2-положении, можно получить известными методами, и 2-арилиндолы могут быть получены из арилметилкетонов по хорошо известному методу Фишера получения индолов. Соединения, составляющие данное изобретение, и их способы получения станут более понятными из нижеследующих примеров, которые даны только для иллюстрации и никоим образом не ограничивают объем изобретения. Некоторые промежуточные соединения, а также другие обычные исходные материалы, например, II, III и IX, используемые при получении конечных продуктов формулы I, являются обычно промышленно доступными. Примеры получения некоторых конечных соединений формулы I (где в R1 все заместители являются водородом, если иное не оговаривается) приведены ниже. Описаны также способы синтеза некоторых промежуточных соединений, например, в примерах 1-11, 14, 91-96, 98-102, 104 и 105. Все реакции, осуществляемые в отсутствие воды, проводились в атмосфере азота или аргона с использованием сухих растворителей из бутылок фирмы Aldrich Sure Seal или свежеперегнанных растворителей. Колоночная хроматография проводилась с использованием силикагеля 60 (E M Science, 230-400 меш.) и вышеупомянутых растворителей в качестве элюента. Тонкослойную хроматографию проводили на силикагелевых пластинках Anatech GFLH или Whatman MK6F. Температуры плавления определяли в открытой капиллярной трубке при помощи прибора Thomas-Hoover для определения температуры плавления, если иначе не оговорено, и не корректировали. Инфракрасные спектры снимали при помощи спектрофотометра Perkin-Elmer 1800 Fourier в виде тонких пленок или гранул KBr. 1H ЯМР-спектры и 13C ЯМР-спектры снимались на приборах Bruker AM-300 или JEOL 300 или Bruker AC-300 или 500 Мегагерцевых приборах, спектры приведены в частях на миллион (ppm или  ) с использованием вышеупомянутого растворителя в качестве внутреннего эталона. Константы взаимодействия выражены в герцах и сигналы отображены как наблюдаемый синглет (s), триплет (t), квартет (q), мультиплет (m) и широкий (br). Масс-спектры низкой степени разрешения определялись на масс-спектрометре Finnigan Model 4500 Quadrapole путем прямой химической ионизации (DCI) с применением изобутана в качестве положительного CI газа, прибора Finnigan Model SSQ-70000 (отриц. или полож. ESI), или на Kratos MS-25, или на приборе Finnigan TSQ-70 (FAB). Масс-спектры высокой степени разрешения (HRMS) снимались на масс-спектрометре Kratos MS-50 с использованием бомбардировки ускоренными атомами с CsI в глицерине в качестве эталона или на приборе Finnigan MAT-900 с использованием электрораспылительной ионизации с полипропиленгликолем в качестве эталона.
Пример 1 ) с использованием вышеупомянутого растворителя в качестве внутреннего эталона. Константы взаимодействия выражены в герцах и сигналы отображены как наблюдаемый синглет (s), триплет (t), квартет (q), мультиплет (m) и широкий (br). Масс-спектры низкой степени разрешения определялись на масс-спектрометре Finnigan Model 4500 Quadrapole путем прямой химической ионизации (DCI) с применением изобутана в качестве положительного CI газа, прибора Finnigan Model SSQ-70000 (отриц. или полож. ESI), или на Kratos MS-25, или на приборе Finnigan TSQ-70 (FAB). Масс-спектры высокой степени разрешения (HRMS) снимались на масс-спектрометре Kratos MS-50 с использованием бомбардировки ускоренными атомами с CsI в глицерине в качестве эталона или на приборе Finnigan MAT-900 с использованием электрораспылительной ионизации с полипропиленгликолем в качестве эталона.
Пример 13,4-Диброммалеимид (II; R6 = H, y = Br). К перемешиваемому магнитной мешалкой раствору малеимида (25,0 г, 0,258 мол) в деионизированной воде (250 мл) быстро добавляют бром (100 г, 0,626 мол) и затем перекись бензоила (300 мг). Реакционную смесь нагревают при 50oC в течение 6,5 час и затем перемешивают при комнатной температуре в течение 11,5 час. Реакционную смесь охлаждают в бане со смесью лед/вода в течение 45 мин и выделившийся твердый осадок отфильтровывают, промывают водой и сушат на воздухе с получением 36,35 г (55,4%) вышеназванного соединения в виде белого твердого вещества, 75 МГц 13C ЯМР (ацетон-d6):  165,08, 130,73; FAB масс-спектр, m/e 253 (M+); Анал. Вычисл. C4HBr2NO2: C, 38,30; H, 2,05; N, 4,06; Br, 46,32. Найдено: C, 38,28; H, 2,06; N, 4,07; Br, 46,24.
Пример 2 165,08, 130,73; FAB масс-спектр, m/e 253 (M+); Анал. Вычисл. C4HBr2NO2: C, 38,30; H, 2,05; N, 4,06; Br, 46,32. Найдено: C, 38,28; H, 2,06; N, 4,07; Br, 46,24.
Пример 21-(трет. Бутилбензил)-3,4-диброммалеимид (II; R6 = трет.бутилбензил, y = Br). К перемешиваемому магнитной мешалкой раствору 3,4-диброммалеимида (20,0 г, 78,5 ммол) в ацетоне (1200 мл) добавляют карбонат калия (132 г, 0,954 мол). 4-(трет. Бутил)бензилбромид (24,98 г, 20,2 мл, 110 ммол) медленно добавляют в течение 15 мин и затем реакционную смесь перемешивают в темноте в течение 6 час. Реакционную смесь фильтруют через слой целита и промывают ацетоном. Упаривание в вакууме и последующая хроматография на силикагеле с использованием 50 % гексана в дихлорметане дает 22,5 г (71,5%) вышеназванного соединения в виде белого твердого вещества. 300 МГц 1H ЯМР (CDCl3):  7,45-7,25 (m, 4H), 4,75 (s, 2H), 1,32 (s, 9H); DCl масс-спектр, m/e 399 (M+); Анал. Вычисл. C15H15Br2NO2: C, 44,92; H, 3,77; N, 3,49. Найдено: C, 45,04; H, 3,81; N, 3,38.
Пример 3 7,45-7,25 (m, 4H), 4,75 (s, 2H), 1,32 (s, 9H); DCl масс-спектр, m/e 399 (M+); Анал. Вычисл. C15H15Br2NO2: C, 44,92; H, 3,77; N, 3,49. Найдено: C, 45,04; H, 3,81; N, 3,38.
Пример 32-(2-Бензо[b] тиенил)-5-фтор-1H-индол (III: X1-5F; X2 = H; R” = 2-бензо[b]тиенил, R’ = H) н-Бутиллитий в гексане (1,6 M, 255 мл, 0,41 мол) добавляют порциями по 5 мл к охлажденному (4oC) раствору тионафтена (47,8 г, 0,36 мол) в смеси сухой тетрагидрофуран/диэтиловый эфир (1:1, 400 мл) в атмосфере азота. Алкиллитий добавляют с такой скоростью, чтобы внутренняя температура реакции не превышала 8oC. После окончания добавления реакционную смесь доводят до комнатной температуры и перемешивают в течение 1 час, после чего охлаждают до 4oC и осторожно обрабатывают раствором ацетальдегида (50 мл) в сухом тетрагидрофуране (50 мл). Смесь доводят до комнатной температуры в течение 0,5 часа и затем гасят водой и разбавляют этилацетатом. Органический слой отделяют, промывают рассолом, сушат и концентрируют. Водную фазу дважды экстрагируют этилацетатом и объединяют с предыдущим органическим экстрактом для дальнейшей обработки. Очистка полученного остатка флеш-хроматографией на силикагеле (начиная элюирование с 7% этилацетата в гексане и далее 15% этилацетата в гексане) приводит к 29,25 г (46%) промежуточного спирта в виде бледно-желтого твердого вещества, который непосредственно используют в дальнейшем. Спирт (29,15 г, 0,16 мол) растворяют в безводном дихлорметане (800 мл) и реакционную смесь обрабатывают целитом (36 г) и пиридиний хлорохроматом (35 г). Спустя один час при комнатной температуре добавляют еще дихлорметан (400 мл), целит (36 г) и PCC (35 г). Смесь далее перемешивают дополнительно в течение 1 часа при комнатной температуре и затем разбавляют эфиром (1 л), фильтруют с отсасыванием через слой силикагеля и концентрируют. Изолируют метилкетон (27,6 г, 96%) в виде чистого белого твердого вещества. К перемешиваемой суспензии гидрохлорида 4-фторфенилгидразина (32,98 г, 0,20 мол) и метилкетона (27,5 г, 0,156 мол) в абсолютном этаноле (150 мл) добавляют одной порцией безводный ацетат натрия (16,6 г, 0,20 мол). Смесь кипятят с обратным холодильником в течение 2 час, затем охлаждают, разбавляют дихлорметаном и промывают раствором насыщенного бикарбоната натрия, 1N соляной кислотой и рассолом. Последующее высушивание и удаление растворителя, перекристаллизация остатка из горячего этанола приводит к чистому гидразону (40,08 г, 90%) в виде желтого твердого вещества. Гидразон (18,3 г, 64,4 ммол) помещают в круглодонную одногорлую колбу объемом 500 мл (снабженную обратным холодильником), которая содержит свежеплавленый хлорид цинка в атмосфере азота. Колбу затем помещают на 1 час в разогретую масляную баню (180oC). Спустя 1 час температуру масляной бани доводят до температуры 140oC и затем в колбу осторожно добавляют абсолютный этанол. Смесь кипятят с обратным холодильником в течение 6 час, охлаждают, разбавляют этилацетатом и промывают 1N соляной кислотой и рассолом, после чего высушивают и концентрируют до 1/3 объема. Фильтрование с отсасыванием приводит к вышеназванному продукту (22,4 г, 65%) в виде белого твердого вещества, т. пл. 263-264oC; 1H ЯМР (300 МГц, DMSO-d6):  11,91 (s, 1H), 7,99-7,96 (m, 1H), 7,89-7,86 (m, 2H), 7,83 (s, 1H), 7,43-7,29 (серия m, 4H), 7,03-6,96 (m, 1H), 6,81 (d, J = 1,5 Гц, 1H); 13C ЯМР (75 МГц, DMSO-d6): ppm 158,79, 155,72, 140,01, 138,35, 134,92, 133,92, 133,79, 128,64, 128,50, 124,93, 124,79, 123,70, 122,44, 119,73, 112,35, 112,22, 110,76, 110,41, 104,90, 104,59, 100,90, 100,84; ИК (KBr, см-1) 3421, 1625, 1586, 1567, 1501, 1448, 1412, 1286, 1201, 1188, 1128, 862,825, 783, 744, 725, 559, 515; MS (отриц. ESI, M-H) m/z 266. Анал. Вычисл. C16H10FNS: C, 71,89; H, 3,77; N, 5,24. Найдено: C, 71,82; H, 3,76; N, 5,13.
Пример 4 11,91 (s, 1H), 7,99-7,96 (m, 1H), 7,89-7,86 (m, 2H), 7,83 (s, 1H), 7,43-7,29 (серия m, 4H), 7,03-6,96 (m, 1H), 6,81 (d, J = 1,5 Гц, 1H); 13C ЯМР (75 МГц, DMSO-d6): ppm 158,79, 155,72, 140,01, 138,35, 134,92, 133,92, 133,79, 128,64, 128,50, 124,93, 124,79, 123,70, 122,44, 119,73, 112,35, 112,22, 110,76, 110,41, 104,90, 104,59, 100,90, 100,84; ИК (KBr, см-1) 3421, 1625, 1586, 1567, 1501, 1448, 1412, 1286, 1201, 1188, 1128, 862,825, 783, 744, 725, 559, 515; MS (отриц. ESI, M-H) m/z 266. Анал. Вычисл. C16H10FNS: C, 71,89; H, 3,77; N, 5,24. Найдено: C, 71,82; H, 3,76; N, 5,13.
Пример 4(E)-4-Фтор-2-нитро-  -диметиламиностирол.
Смесь 4-фтор-2-нитротолуола (185,0 г, 1,19 мол) и диметилацеталь N,N-диметилформамида (500 мл, 3,77 мол) в сухом диметилформамиде кипятят с обратным холодильником в течение 2 час в атмосфере азота с предшествующей азеотропной отгонкой метанола из реакционной смеси. Одновременно осуществляют другую реакцию (169,2 4-фтор-2-нитротолуола). Вышеназванное соединение общим весом 450 г (95% выделяют в виде красного твердого вещества (затвердевает при охлаждении), которое достаточно чистое для дальнейших превращений. Перегонка со стеклянной насадкой (трубка со стеклянными шариками) приводит к вышеназванному соединению (аналитически чистому для целей характеристики) в виде темно-красноватого кристаллического вещества, т.пл. 54-55oC; 1H ЯМР (300 МГц, DMSO-d6): -диметиламиностирол.
Смесь 4-фтор-2-нитротолуола (185,0 г, 1,19 мол) и диметилацеталь N,N-диметилформамида (500 мл, 3,77 мол) в сухом диметилформамиде кипятят с обратным холодильником в течение 2 час в атмосфере азота с предшествующей азеотропной отгонкой метанола из реакционной смеси. Одновременно осуществляют другую реакцию (169,2 4-фтор-2-нитротолуола). Вышеназванное соединение общим весом 450 г (95% выделяют в виде красного твердого вещества (затвердевает при охлаждении), которое достаточно чистое для дальнейших превращений. Перегонка со стеклянной насадкой (трубка со стеклянными шариками) приводит к вышеназванному соединению (аналитически чистому для целей характеристики) в виде темно-красноватого кристаллического вещества, т.пл. 54-55oC; 1H ЯМР (300 МГц, DMSO-d6):  7,72-7,62 (m, 2H), 7,37-7,32 (m, 1H), 7,33 (d, J = 13,4 Гц, 1H), 5,58 (d, J = 13,4 Гц, 1H), 2,58 (s, 6H); 13C ЯМР (75 МГц, DMSO-d6): ppm 158,19, 154,99, 146,16, 143,13, 143,02, 132,57, 132,54, 126,14, 126,04, 120,98, 120,69, 111,41, 111,07, 88,23; ИК (KBr, см-1) 3446, 1622, 1570, 1508, 1386, 1270, 1092, 940, 822, 798; MS (MH+) m/z 211. Анал. Вычисл. C10H11FN2O2: C, 57,14; H, 5,27; N, 13,33. Найдено: C, 57,09; H, 5,16; N, 13,46.
Пример 5 7,72-7,62 (m, 2H), 7,37-7,32 (m, 1H), 7,33 (d, J = 13,4 Гц, 1H), 5,58 (d, J = 13,4 Гц, 1H), 2,58 (s, 6H); 13C ЯМР (75 МГц, DMSO-d6): ppm 158,19, 154,99, 146,16, 143,13, 143,02, 132,57, 132,54, 126,14, 126,04, 120,98, 120,69, 111,41, 111,07, 88,23; ИК (KBr, см-1) 3446, 1622, 1570, 1508, 1386, 1270, 1092, 940, 822, 798; MS (MH+) m/z 211. Анал. Вычисл. C10H11FN2O2: C, 57,14; H, 5,27; N, 13,33. Найдено: C, 57,09; H, 5,16; N, 13,46.
Пример 56-Фториндол (III: X1 = F, X2 = R” = R’ = Н). (E)-4-Фтор-2-нитро-  -диметиламиностирол (120 г, 0,5 мол) растворяют в тетрагидрофуране (1 л) и подвергают гидрированию по Парру (Parr hydrogenation) (50 psi H2, комнатная температура, 24 час) с использованием 10% палладия на угле (30 г). Смесь фильтруют через целит (промывают ТГФ, метанолом и хлористым метиленом) и концентрируют досуха. Эту реакцию осуществляют дополнительно в три приема, чтобы переработать исходный материал, упомянутый выше. Перегонка с водяным паром приводит к получению вышеназванного соединения (192,6 г, 62% в виде белых игл, т.пл. 73-75oC; 1H ЯМР (300 МГц, DMSO-d6): -диметиламиностирол (120 г, 0,5 мол) растворяют в тетрагидрофуране (1 л) и подвергают гидрированию по Парру (Parr hydrogenation) (50 psi H2, комнатная температура, 24 час) с использованием 10% палладия на угле (30 г). Смесь фильтруют через целит (промывают ТГФ, метанолом и хлористым метиленом) и концентрируют досуха. Эту реакцию осуществляют дополнительно в три приема, чтобы переработать исходный материал, упомянутый выше. Перегонка с водяным паром приводит к получению вышеназванного соединения (192,6 г, 62% в виде белых игл, т.пл. 73-75oC; 1H ЯМР (300 МГц, DMSO-d6):  11,14 (br s, 1H), 7,51 (dd, J = 8,6, 5,5 Гц, 1H), 7,32 (t, J = 2,9 Гц, 1H), 7,16 (dd, J = 10,1, 2,3 Гц, 1H), 6,87-6,80 (m, 1H), 6,43-6,41 (m, 1H); 13C ЯМР (75 МГц, DMSO-d6): ppm 160,26, 157,16, 135,79, 135,63, 125,94, 125,89, 124,42, 120,97, 120,83, 107,43, 107,10, 101,17, 97,47, 97,13; ИК (KBr, см-1) 3392, 3072, 1626, 1508, 1448, 1342, 1144, 954, 846, 802, 728, 508; MS (MH+) m/z 136. Анал. Вычисл. C8H6FN: C, 71,10; H, 4,47; N, 10,36. Найдено: C, 71,28; H, 4,69; N, 10,24.
Пример 6 11,14 (br s, 1H), 7,51 (dd, J = 8,6, 5,5 Гц, 1H), 7,32 (t, J = 2,9 Гц, 1H), 7,16 (dd, J = 10,1, 2,3 Гц, 1H), 6,87-6,80 (m, 1H), 6,43-6,41 (m, 1H); 13C ЯМР (75 МГц, DMSO-d6): ppm 160,26, 157,16, 135,79, 135,63, 125,94, 125,89, 124,42, 120,97, 120,83, 107,43, 107,10, 101,17, 97,47, 97,13; ИК (KBr, см-1) 3392, 3072, 1626, 1508, 1448, 1342, 1144, 954, 846, 802, 728, 508; MS (MH+) m/z 136. Анал. Вычисл. C8H6FN: C, 71,10; H, 4,47; N, 10,36. Найдено: C, 71,28; H, 4,69; N, 10,24.
Пример 63,4-бис(5-Фтор-1H-индол-3-ил)-N-[4-(трет. бутил)бензил] -пиррол-2,5-дион (IV: X1 = F; X2 = R” = R’ = Н; R6 = 4-(трет.бутил)бензил). К перемешиваемому магнитной мешалкой раствору 5-фториндола (7,0 г, 51,8 ммол) в безводном бензоле (125 мл) добавляют под аргоном при перемешивании метилмагний иодид (3,0 М в эфире; 18,0 мл, 54,0 ммол). Смесь перемешивают при комнатной температуре в течение 30 мин и затем этот раствор добавляют при помощи шприца в течение 10 мин к энергично перемешиваемому раствору N-[4-(трет. бутил)бензил] -3,4-диброммалеимида (6,50 г, 16,2 ммол) в безводном бензоле (60 мл). Полученный темно-пурпурный раствор перемешивают при комнатной температуре под аргоном в течение 16 час и выливают в смесь 20% водной лимонной кислоты (350 мл) и этилацетата (500 мл). Органический слой промывают водой (200 мл) и рассолом (200 мл) и сушат (Na2SO4). Упаривание в вакууме с последующей флеш-хроматографией на силикагеле с использованием 100% дихлорметана, а затем 10% этилацетата в дихлорметане приводит к 3,68 г (44%) вышеназванного соединения в виде красного твердого вещества. 300 МГц 1H ЯМР (CDCl3):  8,63 (br s, 2H), 7,87 (d, J = 2,9 Гц, 2H), 7,46-7,34 (m, 4H), 7,23 (dd, 2H, J = 8,9, 4,4 Гц), 6,79 (ddd, 2H, J = 9,1, 8,9, 2,5 Гц), 6,48 (dd, 2H, J = 10,2, 2,5 Гц), 4,83 (s, 2H), 1,30 (s, 9H); 75 МГц 13C ЯМР (CDCl3): 8,63 (br s, 2H), 7,87 (d, J = 2,9 Гц, 2H), 7,46-7,34 (m, 4H), 7,23 (dd, 2H, J = 8,9, 4,4 Гц), 6,79 (ddd, 2H, J = 9,1, 8,9, 2,5 Гц), 6,48 (dd, 2H, J = 10,2, 2,5 Гц), 4,83 (s, 2H), 1,30 (s, 9H); 75 МГц 13C ЯМР (CDCl3):  172,15 (s), 157,73 (d, J = 235 Гц), 150,82 (s), 133,79 (s), 132,27 (s), 129,92 (s), 128,32 (s), 127,14 (s), 126,16 (d, J = 10,4 Гц), 125,72 (s), 112,19 (d, J = 9,8 Гц), 111,10 (d, J = 26,6 Гц), 106,95 (d, J = 4,3 Гц), 106,43 (d, J = 25,l Гц), 41,68 (s), 34,55 (s), 31,33 (s); FAB масс-спектр, m/e 509 (M+).
Пример 7 172,15 (s), 157,73 (d, J = 235 Гц), 150,82 (s), 133,79 (s), 132,27 (s), 129,92 (s), 128,32 (s), 127,14 (s), 126,16 (d, J = 10,4 Гц), 125,72 (s), 112,19 (d, J = 9,8 Гц), 111,10 (d, J = 26,6 Гц), 106,95 (d, J = 4,3 Гц), 106,43 (d, J = 25,l Гц), 41,68 (s), 34,55 (s), 31,33 (s); FAB масс-спектр, m/e 509 (M+).
Пример 73-Бром-4-(6-фтор-  -индол-3-ил) -индол-3-ил)  -пиррол-2,5-дион (V: X1 = 6F; R’ = R” = R6 = H; y = Br) и 3,4-бис(6-фтор -пиррол-2,5-дион (V: X1 = 6F; R’ = R” = R6 = H; y = Br) и 3,4-бис(6-фтор  -индол-3-ил) -индол-3-ил)  -пиррол-2,5-дион (IV: X1 = F; X2 = R’ = R” = R6 = H).
К раствору 6-фториндола (50,0 г, 0,37 мол) в безводном бензоле (1 л) в атмосфере азота добавляют с помощью шприца этилмагний бромид (3 М, 130 мл, 0,43 мол) с такой скоростью, чтобы температуру внутри поддерживать между 45-50oC. Затем смесь нагревают при 50-55oC в течение 0,5 час, после чего в реакционную смесь вносят суспензию 2,3-диброммалеимида (24,9 г, 0,093 мол) в безводном бензоле. Смесь кипятят с обратным холодильником в течение 22 час, охлаждают, разбавляют этилацетатом и подкисляют до pH 1 при помощи 1N HCl. Затем отделяют органическую фазу, промывают рассолом, сушат и концентрируют. Водную фазу разбавляют еще один раз этилацетатом и отделяют. Органическую фазу обрабатывают так, как описано выше и объединяют с первоначальной. Осуществляют другую реакцию на 50 г и объединяют перед хроматографией. Очистка объединенного остатка флеш-хроматографией на силикагеле (начиная элюирование с 10% этилацетата в гексане и далее 40% этилацетата в гексане) приводит к получению двух основных продуктов. Вышеназванное соединение формулы V (12,31 г, 21,5%) выделяют в виде кирпично-красного твердого вещества и вышеназванное соединение формулы IV (31,5 г, 41%) выделяют в виде красновато-оранжевой пены.
Для вышеназванного соединения формулы V: т.пл. 73-75oC; 1H ЯМР (300 МГц, DMSO-d6): -пиррол-2,5-дион (IV: X1 = F; X2 = R’ = R” = R6 = H).
К раствору 6-фториндола (50,0 г, 0,37 мол) в безводном бензоле (1 л) в атмосфере азота добавляют с помощью шприца этилмагний бромид (3 М, 130 мл, 0,43 мол) с такой скоростью, чтобы температуру внутри поддерживать между 45-50oC. Затем смесь нагревают при 50-55oC в течение 0,5 час, после чего в реакционную смесь вносят суспензию 2,3-диброммалеимида (24,9 г, 0,093 мол) в безводном бензоле. Смесь кипятят с обратным холодильником в течение 22 час, охлаждают, разбавляют этилацетатом и подкисляют до pH 1 при помощи 1N HCl. Затем отделяют органическую фазу, промывают рассолом, сушат и концентрируют. Водную фазу разбавляют еще один раз этилацетатом и отделяют. Органическую фазу обрабатывают так, как описано выше и объединяют с первоначальной. Осуществляют другую реакцию на 50 г и объединяют перед хроматографией. Очистка объединенного остатка флеш-хроматографией на силикагеле (начиная элюирование с 10% этилацетата в гексане и далее 40% этилацетата в гексане) приводит к получению двух основных продуктов. Вышеназванное соединение формулы V (12,31 г, 21,5%) выделяют в виде кирпично-красного твердого вещества и вышеназванное соединение формулы IV (31,5 г, 41%) выделяют в виде красновато-оранжевой пены.
Для вышеназванного соединения формулы V: т.пл. 73-75oC; 1H ЯМР (300 МГц, DMSO-d6):  11,14 (br s, 1H), 7,51 (dd, J = 8,6, 5,5 Гц, 1H), 7,32 (t, J = 2,9 Гц, 1H), 7,16 (dd, J = 10,1, 2,3 Гц, 1H), 6,87-6,80 (m, 1H), 6,43-6,41 (m, 1H); 13C ЯМР (75 МГц, DMSO-d6): ppm 160,26, 157,16, 135,79, 135,63, 125,94, 125,89, 124,42, 120,97, 120,83, 107,43, 107,10, 101,17, 97,47, 97,13; ИК (KBr, см-1) 3392, 3072, 1626, 1508, 1448, 1342, 1144, 954, 846, 802, 728, 508; MS (MH+) m/z 136. Анал. Вычисл. C8H6FN: C, 71,10; H, 4,47; N, 10,36. Найдено: C, 71,28; H, 4,69; N, 10,24.
Для вышеназванного соединения формулы IV: т.пл. 207-208oC (разл.); 1H ЯМР (300 МГц, DMSO-d6): 11,14 (br s, 1H), 7,51 (dd, J = 8,6, 5,5 Гц, 1H), 7,32 (t, J = 2,9 Гц, 1H), 7,16 (dd, J = 10,1, 2,3 Гц, 1H), 6,87-6,80 (m, 1H), 6,43-6,41 (m, 1H); 13C ЯМР (75 МГц, DMSO-d6): ppm 160,26, 157,16, 135,79, 135,63, 125,94, 125,89, 124,42, 120,97, 120,83, 107,43, 107,10, 101,17, 97,47, 97,13; ИК (KBr, см-1) 3392, 3072, 1626, 1508, 1448, 1342, 1144, 954, 846, 802, 728, 508; MS (MH+) m/z 136. Анал. Вычисл. C8H6FN: C, 71,10; H, 4,47; N, 10,36. Найдено: C, 71,28; H, 4,69; N, 10,24.
Для вышеназванного соединения формулы IV: т.пл. 207-208oC (разл.); 1H ЯМР (300 МГц, DMSO-d6):  12,10 (s, 1H), 11,37 (s, 1H), 8,03 (d, J = 2,9 Гц, 1H), 7,86 (dd, J = 8,9, 5,4, 2,3 Гц, 1H), 7,28 (dd, J = 9,6, 2,3 Гц, 1H), 7,00 (t, J = 9,3, 2,3 Гц, 1H); 13C ЯМР (75 МГц, DMSO-d6): ppm 170,12, 167,35, 160,70, 157,56, 137,65, 136,62, 136,45, 131,58, 131,56, 123,51, 123,38, 121,27, 115,40, 109,03, 108,70, 103,89, 98,47, 98,14; ИК (KBr, см-1) 3328, 3222, 1726, 1604, 1450, 1338, 1240, 1192, 1148, 840, 794; MS (MH+) m/z 309, 311. Анал. Вычисл. C12H6BrFN2O2: C, 46,63; H, 1,96; N, 9,06. Найдено: C, 46,70; H, 2,00; N, 8,94.
Пример 8 12,10 (s, 1H), 11,37 (s, 1H), 8,03 (d, J = 2,9 Гц, 1H), 7,86 (dd, J = 8,9, 5,4, 2,3 Гц, 1H), 7,28 (dd, J = 9,6, 2,3 Гц, 1H), 7,00 (t, J = 9,3, 2,3 Гц, 1H); 13C ЯМР (75 МГц, DMSO-d6): ppm 170,12, 167,35, 160,70, 157,56, 137,65, 136,62, 136,45, 131,58, 131,56, 123,51, 123,38, 121,27, 115,40, 109,03, 108,70, 103,89, 98,47, 98,14; ИК (KBr, см-1) 3328, 3222, 1726, 1604, 1450, 1338, 1240, 1192, 1148, 840, 794; MS (MH+) m/z 309, 311. Анал. Вычисл. C12H6BrFN2O2: C, 46,63; H, 1,96; N, 9,06. Найдено: C, 46,70; H, 2,00; N, 8,94.
Пример 83,9-Дифтор-12,13-дигидро  индол[2,3-a]пиррол[3,4-c]карбазол-5,7(6-N-[4-(трет. бутил)бензил] )-дион (VI: X1 = X’1 = F; X2 = X’2 = R’ = H; R6 = 4-(трет.бутил)бензил; Q = NH).
К перемешиваемому магнитной мешалкой раствору продукта из примера 6 (11,6 г, 22,8 ммол) в безводном бензоле (1700 мл) добавляют под аргоном при перемешивании моногидрат p-толуолсульфокислоты (170 мг) и DDQ (10,9 г, 48,0 ммол). Смесь кипятят с обратным холодильником в атмосфере аргона при перемешивании в течение 1 час и перемешивают при комнатной температуре в течение 16 час. Полученный темный твердый осадок отделяют фильтрованием, промывают холодным этилацетатом (50-70 мл) и сушат в вакууме в течение 1-2 час с получением 12,80 г (94%) вышеназванного соединения в виде желто-коричневого твердого вещества (моноэтилацетатный комплекс по протонному ЯМР; дальнейшим высушиванием в вакууме можно уменьшить содержание этилацетата от полутора до двух третей). Перекристаллизация из смеси ТГФ/этилацетат дает аналитически чистый продукт в виде светло-желтого твердого вещества (моноэтилацетатный комплекс по протонному ЯМР). 300 МГц 1H ЯМР (DMSO-d6): индол[2,3-a]пиррол[3,4-c]карбазол-5,7(6-N-[4-(трет. бутил)бензил] )-дион (VI: X1 = X’1 = F; X2 = X’2 = R’ = H; R6 = 4-(трет.бутил)бензил; Q = NH).
К перемешиваемому магнитной мешалкой раствору продукта из примера 6 (11,6 г, 22,8 ммол) в безводном бензоле (1700 мл) добавляют под аргоном при перемешивании моногидрат p-толуолсульфокислоты (170 мг) и DDQ (10,9 г, 48,0 ммол). Смесь кипятят с обратным холодильником в атмосфере аргона при перемешивании в течение 1 час и перемешивают при комнатной температуре в течение 16 час. Полученный темный твердый осадок отделяют фильтрованием, промывают холодным этилацетатом (50-70 мл) и сушат в вакууме в течение 1-2 час с получением 12,80 г (94%) вышеназванного соединения в виде желто-коричневого твердого вещества (моноэтилацетатный комплекс по протонному ЯМР; дальнейшим высушиванием в вакууме можно уменьшить содержание этилацетата от полутора до двух третей). Перекристаллизация из смеси ТГФ/этилацетат дает аналитически чистый продукт в виде светло-желтого твердого вещества (моноэтилацетатный комплекс по протонному ЯМР). 300 МГц 1H ЯМР (DMSO-d6):  11,83 (br s, 2H), 8,46 (dd, 2H, J = 9,7, 2,6 Гц), 7,69 (dd, 2H, J = 8,9, 4,6 Гц), 7,36 (ddd, 2H, J = 9,l, 8,9, 2,6 Гц), 7,34- 7,22 (m, 4H), 4,63 (s, 2H), 1,22 (s, 9H); FAB масс-спектр, m/e 507 (M+). Анал. Вычисл. C31H23F2N3O2 11,83 (br s, 2H), 8,46 (dd, 2H, J = 9,7, 2,6 Гц), 7,69 (dd, 2H, J = 8,9, 4,6 Гц), 7,36 (ddd, 2H, J = 9,l, 8,9, 2,6 Гц), 7,34- 7,22 (m, 4H), 4,63 (s, 2H), 1,22 (s, 9H); FAB масс-спектр, m/e 507 (M+). Анал. Вычисл. C31H23F2N3O2 C4H8O2: C, 70,58; H, 5,25; F, 6,38; N, 7,06. Найдено: C, 70,52; H, 5,31; F, 6,14; N, 7,00.
Пример 9 C4H8O2: C, 70,58; H, 5,25; F, 6,38; N, 7,06. Найдено: C, 70,52; H, 5,31; F, 6,14; N, 7,00.
Пример 92,10-Дифтор-12,13-дигидро-5  -индол[2,3-a] пиррол[3,4-c] карбазол-5,7(6 -индол[2,3-a] пиррол[3,4-c] карбазол-5,7(6 )-дион (VI: X1 = X’1 = F; X2 = X’2 = R’ = R6 = H; Q = NH).
2,3-Дихлор-5,6-дициано-1,4-бензохинон (15,81 г, 0,70 мол) добавляют одной порцией к перемешиваемой суспензии 3,4-бис(6-фтор-1 )-дион (VI: X1 = X’1 = F; X2 = X’2 = R’ = R6 = H; Q = NH).
2,3-Дихлор-5,6-дициано-1,4-бензохинон (15,81 г, 0,70 мол) добавляют одной порцией к перемешиваемой суспензии 3,4-бис(6-фтор-1 -индол-3-ил)-1 -индол-3-ил)-1 -пиррол-2,5-диона (11,5 г, 0,032 мол) и моногидрата толуолсульфокислоты (0,44 г) в бензоле (1 л) в атмосфере азота и смесь кипятят с обратным холодильником в течение 2 час, после чего ее охлаждают, выдерживают при комнатной температуре в течение 16 час и фильтруют с отсасыванием через пористый стеклянный фильтр. Осадок тщательно промывают бензолом, этилацетатом и эфиром, пока фильтрат не станет бесцветным. Параллельно осуществляют другую реакцию на 20,0 г с использованием таких же количественных соотношений реагентов, что и в первой реакции. После объединения выделяют вышеназванное соединение (15,51 г, 40%) в виде желтовато-зеленого твердого вещества, т.пл. >305oC; 1H ЯМР (300 МГц, DMSO-d6): -пиррол-2,5-диона (11,5 г, 0,032 мол) и моногидрата толуолсульфокислоты (0,44 г) в бензоле (1 л) в атмосфере азота и смесь кипятят с обратным холодильником в течение 2 час, после чего ее охлаждают, выдерживают при комнатной температуре в течение 16 час и фильтруют с отсасыванием через пористый стеклянный фильтр. Осадок тщательно промывают бензолом, этилацетатом и эфиром, пока фильтрат не станет бесцветным. Параллельно осуществляют другую реакцию на 20,0 г с использованием таких же количественных соотношений реагентов, что и в первой реакции. После объединения выделяют вышеназванное соединение (15,51 г, 40%) в виде желтовато-зеленого твердого вещества, т.пл. >305oC; 1H ЯМР (300 МГц, DMSO-d6):  11,67 (br s, 2H), 10,93 (br s, 1H), 8,84 (dd, J = 8,8, 5,8 Гц, 2H), 7,55 (dd, J = 10,0, 2,3 Гц, 2H), 7,11 (dt, J = 9,2, 2,3 Гц, 1H), 2,00 (q, J = 7,l Гц, 2H), 1,96 (s, 3H); 13C ЯМР (75 МГц, DMSO-d6): ppm 171,09, 170,32, 163,27, 160,08, 141,00, 140,83, 129,25, 125,69, 125,55, 119,54, 118,23, 115,09, 108,51, 108,19, 98,64, 98,28, 59,74, 20,74, 14,07; ИК (KBr, см-1) 3320, 1748, 1690, 1572, 1404, 1376, 1312, 1232, 1144, 1116, 840; MS (MH+) m/z 361. Анал. Вычисл. C20H9F2N3O2 11,67 (br s, 2H), 10,93 (br s, 1H), 8,84 (dd, J = 8,8, 5,8 Гц, 2H), 7,55 (dd, J = 10,0, 2,3 Гц, 2H), 7,11 (dt, J = 9,2, 2,3 Гц, 1H), 2,00 (q, J = 7,l Гц, 2H), 1,96 (s, 3H); 13C ЯМР (75 МГц, DMSO-d6): ppm 171,09, 170,32, 163,27, 160,08, 141,00, 140,83, 129,25, 125,69, 125,55, 119,54, 118,23, 115,09, 108,51, 108,19, 98,64, 98,28, 59,74, 20,74, 14,07; ИК (KBr, см-1) 3320, 1748, 1690, 1572, 1404, 1376, 1312, 1232, 1144, 1116, 840; MS (MH+) m/z 361. Анал. Вычисл. C20H9F2N3O2 1,0EtOAc 1,0EtOAc 0,1H2O: C, 63,89; H, 3,84; N, 9,31. Найдено: C, 64,12; H, 3,76; N, 9,55.
Пример 10 0,1H2O: C, 63,89; H, 3,84; N, 9,31. Найдено: C, 64,12; H, 3,76; N, 9,55.
Пример 103,9-Дифтор-12,13-дигидро-13-[3,4,6-трис-O-(фенилметил) –  – D-глюкопиранозил] -5 – D-глюкопиранозил] -5 -индол[2,3-a] пиррол[3,4-c] карбазол-5,7(6-N-[4- (трет. бутил)бензил] )-дион (VIII: X1 = X’1 = F; X2 = X’2 = R’ = R”’ = H; R6 = 4-(трет.бутил)бензил; Q = NH, PG = бензил).
К перемешиваемой магнитной мешалкой суспензии вещества из примера 8 (9,50 г, 17,7 ммол) в безводном ТГФ (450 мл) добавляют в течение 5-10 мин под аргоном при перемешивании бис(триметилсилил)амид натрия (1,0 М в ТГФ; 50,0 мл, 2,82 экв. ). Полученный темно-красный раствор перемешивают при комнатной температуре в течение 45 мин, осторожно обрабатывают с использованием шприца хлортриметилсиланом (5,06 мл, 40,0 ммол) и перемешивают при комнатной температуре в течение еще 1 час. Затем реакционную смесь кипятят с обратным холодильником и, поддерживая кипячение, добавляют раствор 1,2-ангидросахара IX (13,5 г, 31,2 ммол; см. J. Org. Chem. 1993, 58, 343-349) в безводном ТГФ (200 мл) в течение 3,5 час через капельную воронку. После окончания добавления реакцию кипятят с обратным холодильником в течение 10 час в атмосфере аргона, обрабатывают раствором 1,2-ангидросахара IX (800 мг) в безводном ТГФ (40 мл) и кипятят с обратным холодильником еще в течение 2,5 час. Смесь охлаждают до комнатной температуры в течение 45 мин, обрабатывают HCl (1,0 N, 280 мл) и перемешивают в течение 75 мин. Смесь распределяют между этилацетатом (2000 мл) и 0,5 N HCl (600 мл). Органический слой промывают насыщенным водным раствором бикарбоната натрия (300 мл), водой (350 мл) и рассолом (400 мл). Первоначальный водный кислый слой экстрагируют свежим этилацетатом (600 мл), который затем промывают водой (100 мл) и рассолом (150 мл). Объединенный органический экстракт сушат (Na2SO4) и упаривают в роторном испарителе до объема около 300 мл, полученный при этом желтый твердый остаток отделяют фильтрованием, промывают этилацетатом (300 мл) и сушат в вакууме с получением 3,00 г (31,6% вернувшегося чистого исходного продукта. Фильтрат концентрируют в вакууме, растворяют в смеси метиленхлорид/гексан и очищают флеш-хроматографией на силикагеле с использованием 5-10% этилацетата в гексане. Желтые фракции, содержащие наименее полярные пятна, упаривают до объема приблизительно 300 мл и оставляют на ночь, получая 625 мг (3,8%) красивых желтых призм N12,N13-дважды гликозилированного продукта (структура определена X-RAY кристаллографией). Дополнительные 380 мг (2,3% того же продукта выделяют из маточника. Дальнейшее элюирование с использованием 10-15% этилацетата в гексане дает 9,23 г (55,5%, 81%, учитывая непрореагировавший исходный продукт) аналитически чистого вышеназванного соединения формулы VIII в виде желтого твердого вещества. 500 МГц 1H ЯМР (DMSO-d6): -индол[2,3-a] пиррол[3,4-c] карбазол-5,7(6-N-[4- (трет. бутил)бензил] )-дион (VIII: X1 = X’1 = F; X2 = X’2 = R’ = R”’ = H; R6 = 4-(трет.бутил)бензил; Q = NH, PG = бензил).
К перемешиваемой магнитной мешалкой суспензии вещества из примера 8 (9,50 г, 17,7 ммол) в безводном ТГФ (450 мл) добавляют в течение 5-10 мин под аргоном при перемешивании бис(триметилсилил)амид натрия (1,0 М в ТГФ; 50,0 мл, 2,82 экв. ). Полученный темно-красный раствор перемешивают при комнатной температуре в течение 45 мин, осторожно обрабатывают с использованием шприца хлортриметилсиланом (5,06 мл, 40,0 ммол) и перемешивают при комнатной температуре в течение еще 1 час. Затем реакционную смесь кипятят с обратным холодильником и, поддерживая кипячение, добавляют раствор 1,2-ангидросахара IX (13,5 г, 31,2 ммол; см. J. Org. Chem. 1993, 58, 343-349) в безводном ТГФ (200 мл) в течение 3,5 час через капельную воронку. После окончания добавления реакцию кипятят с обратным холодильником в течение 10 час в атмосфере аргона, обрабатывают раствором 1,2-ангидросахара IX (800 мг) в безводном ТГФ (40 мл) и кипятят с обратным холодильником еще в течение 2,5 час. Смесь охлаждают до комнатной температуры в течение 45 мин, обрабатывают HCl (1,0 N, 280 мл) и перемешивают в течение 75 мин. Смесь распределяют между этилацетатом (2000 мл) и 0,5 N HCl (600 мл). Органический слой промывают насыщенным водным раствором бикарбоната натрия (300 мл), водой (350 мл) и рассолом (400 мл). Первоначальный водный кислый слой экстрагируют свежим этилацетатом (600 мл), который затем промывают водой (100 мл) и рассолом (150 мл). Объединенный органический экстракт сушат (Na2SO4) и упаривают в роторном испарителе до объема около 300 мл, полученный при этом желтый твердый остаток отделяют фильтрованием, промывают этилацетатом (300 мл) и сушат в вакууме с получением 3,00 г (31,6% вернувшегося чистого исходного продукта. Фильтрат концентрируют в вакууме, растворяют в смеси метиленхлорид/гексан и очищают флеш-хроматографией на силикагеле с использованием 5-10% этилацетата в гексане. Желтые фракции, содержащие наименее полярные пятна, упаривают до объема приблизительно 300 мл и оставляют на ночь, получая 625 мг (3,8%) красивых желтых призм N12,N13-дважды гликозилированного продукта (структура определена X-RAY кристаллографией). Дополнительные 380 мг (2,3% того же продукта выделяют из маточника. Дальнейшее элюирование с использованием 10-15% этилацетата в гексане дает 9,23 г (55,5%, 81%, учитывая непрореагировавший исходный продукт) аналитически чистого вышеназванного соединения формулы VIII в виде желтого твердого вещества. 500 МГц 1H ЯМР (DMSO-d6):  10,85 (br s, 1H), 8,84 (dd, 1H, J = 9,6, 2,7 Гц), 8,75 (dd, 1H, J = 9,6, 2,5 Гц), 7,54 (ddd, 1H, J = 9,1, 9,1, 2,7 Гц), 7,42-7,18 (m, 21H), 6,43 (d, 1H, J = 8,8 Гц), 5,38 (d, 1H, J = 6,3 Гц, 2’OH), 4,94-4,56 (m, 8H), 4,30-4,15 (m, 2H), 3,98-3,72 (m, 4H), 1,24 (s, 9H); FAB масс-спектр, m/e 939 (M+). Анал. Вычисл. C58H51F2N3O7: C, 74,11; H, 5,47; F, 4,04; N, 4,47. Найдено: C, 73,89; H, 5,51; F, 3,77; N, 4,26.
Пример 11 10,85 (br s, 1H), 8,84 (dd, 1H, J = 9,6, 2,7 Гц), 8,75 (dd, 1H, J = 9,6, 2,5 Гц), 7,54 (ddd, 1H, J = 9,1, 9,1, 2,7 Гц), 7,42-7,18 (m, 21H), 6,43 (d, 1H, J = 8,8 Гц), 5,38 (d, 1H, J = 6,3 Гц, 2’OH), 4,94-4,56 (m, 8H), 4,30-4,15 (m, 2H), 3,98-3,72 (m, 4H), 1,24 (s, 9H); FAB масс-спектр, m/e 939 (M+). Анал. Вычисл. C58H51F2N3O7: C, 74,11; H, 5,47; F, 4,04; N, 4,47. Найдено: C, 73,89; H, 5,51; F, 3,77; N, 4,26.
Пример 112,10-Дифтор-12,13-дигидро-13-[3,4,6-трис-O-(фенилметил) –  – D-глюкопиранозил] – D-глюкопиранозил]  индол[2,3-a]пиррол[3,4-c]карбазол-5,7 индол[2,3-a]пиррол[3,4-c]карбазол-5,7  дион (A = VIII: X1 = X’1 = F; X2 = X’2 = R6 = R”’ = H; Q = NH, PG = бензил) и 2,10-Дифтор-12,13-дигидpo-13-[2-O-3,4,6-трис-O-(фенилметил) дион (A = VIII: X1 = X’1 = F; X2 = X’2 = R6 = R”’ = H; Q = NH, PG = бензил) и 2,10-Дифтор-12,13-дигидpo-13-[2-O-3,4,6-трис-O-(фенилметил)  – D-глюкопиранозил] -3,4,6-трис-O-(фенилметил) – – D-глюкопиранозил] -3,4,6-трис-O-(фенилметил) – – D-глюкопиранозил] – D-глюкопиранозил] 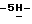 индол[2,3-a] пиррол[3,4-c] карбазол-5,7 индол[2,3-a] пиррол[3,4-c] карбазол-5,7  дион (B = VIII: X1 = X’1 = F; X2 = X’2 = R6 = H; Q = NH, PG = бензил; R”’ = 3,4,6-трис-O-(фенилметил) дион (B = VIII: X1 = X’1 = F; X2 = X’2 = R6 = H; Q = NH, PG = бензил; R”’ = 3,4,6-трис-O-(фенилметил)  – D-глюкопиранозил).
Раствор бис(триметилсилил)амида натрия (1М, 9,1 мл, 3,3 экв.) в тетрагидрофуране добавляют при помощи шприца к раствору 2,10-дифтор-12,13 – D-глюкопиранозил).
Раствор бис(триметилсилил)амида натрия (1М, 9,1 мл, 3,3 экв.) в тетрагидрофуране добавляют при помощи шприца к раствору 2,10-дифтор-12,13 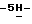 индол[2,3-a] пиррол[3,4-c]карбазол-5,7 индол[2,3-a] пиррол[3,4-c]карбазол-5,7  диона (11,17 г, 32,38 ммол) в безводном тетрагидрофуране (600 мл) при комнатной температуре. Спустя 25 мин в реакционную смесь по каплям добавляют раствор эпоксида (24,27 г, 56,11 ммол, 1,7 экв.) в безводном ТГФ (50 мл). Смесь кипятят с обратным холодильником в течение 6 час, затем обрабатывают насыщенным раствором хлористого аммония и разбавляют этилацетатом. Органический слой отделяют, промывают рассолом, сушат и упаривают. Очистка остатка флеш-хроматографией на силикагеле (начиная элюирование с 15% тетрагидрофурана в гексане и далее 40% тетрагидрофурана в гексане) приводит к получению вышеназванного соединения А формулы VIII (6,1 г, 30%) в виде желтой пены, непрореагировавшего исходного агликона (4,00 г) и бис-сахарного продукта В (10,9 г, 34%; MS(M+) вычисл. для C14H66F2N3O12 1226, 4615, наблюд. 1226, 4566) в виде желтой пены, которая превращается непосредственно в вышеназванное соединение A формулы VIII, как описано ниже. Для основного соединения формулы A = VIII: Т.пл. 140-147oC; 1H ЯМР (300 МГц, CDCl3): диона (11,17 г, 32,38 ммол) в безводном тетрагидрофуране (600 мл) при комнатной температуре. Спустя 25 мин в реакционную смесь по каплям добавляют раствор эпоксида (24,27 г, 56,11 ммол, 1,7 экв.) в безводном ТГФ (50 мл). Смесь кипятят с обратным холодильником в течение 6 час, затем обрабатывают насыщенным раствором хлористого аммония и разбавляют этилацетатом. Органический слой отделяют, промывают рассолом, сушат и упаривают. Очистка остатка флеш-хроматографией на силикагеле (начиная элюирование с 15% тетрагидрофурана в гексане и далее 40% тетрагидрофурана в гексане) приводит к получению вышеназванного соединения А формулы VIII (6,1 г, 30%) в виде желтой пены, непрореагировавшего исходного агликона (4,00 г) и бис-сахарного продукта В (10,9 г, 34%; MS(M+) вычисл. для C14H66F2N3O12 1226, 4615, наблюд. 1226, 4566) в виде желтой пены, которая превращается непосредственно в вышеназванное соединение A формулы VIII, как описано ниже. Для основного соединения формулы A = VIII: Т.пл. 140-147oC; 1H ЯМР (300 МГц, CDCl3):  10,50 (s, 1H), 8,79-8,74 (dd, J = 8,8, 5,8 Гц, 1H), 8,21 (dd, J = 8,8, 5,6 Гц, 2H), 7,59-7,33 (m, 11H), 7,28-7,12 (2m, 11H), 7,06-7,00 (m, 1H), 6,81 (dd, J = 9,1, 2,2 Гц, 1H), 6,61-6,58 (m, 1H), 5,83 (d, J = 9,0 Гц, 1H), 5,12 (d, J = 5,3 Гц, 1H), 5,08 (d, J = 5,2 Гц, 1H), 5,01-4,98 (m, 1H), 4,85 (d, J = 10,8 Гц, 1H), 4,73-4,72 (m, 1H), 4,55-4,35 (m, 4H), 4,07-3,93 (m, 3H), 3,76-3,72 (m, 1H); 13C ЯМР (75 МГц, CDCl3): ppm 169,55, 169,10, 164,43, 164,25, 161,18, 161,00, 143,00, 140,83, 142,83, 141,68, 141,50, 137,69, 137,59, 136,32, 130,45, 128,91, 128,74, 128,63, 128,56, 128,43, 128,06, 127,02, 126,89, 126,15, 126,01, 120,00, 119,01, 118,44, 118,17, 118,09, 110,33, 110,02, 109,48, 109,16, 98,04, 97,70, 97,34, 85,89, 85,62, 76,35, 75,36, 75,05, 74,09, 73,74, 66,75; ИК (KBr, см-1) 3430, 3334, 2914, 2870, 1752, 1702, 1580, 1452, 1328, 1232, 1140, 1062, 698; MS (MH+) вычисл. для C47H38F2N3O7 794,2678, наблюд. 794,2687. Анал. Вычисл. C47H38F2N3O7 10,50 (s, 1H), 8,79-8,74 (dd, J = 8,8, 5,8 Гц, 1H), 8,21 (dd, J = 8,8, 5,6 Гц, 2H), 7,59-7,33 (m, 11H), 7,28-7,12 (2m, 11H), 7,06-7,00 (m, 1H), 6,81 (dd, J = 9,1, 2,2 Гц, 1H), 6,61-6,58 (m, 1H), 5,83 (d, J = 9,0 Гц, 1H), 5,12 (d, J = 5,3 Гц, 1H), 5,08 (d, J = 5,2 Гц, 1H), 5,01-4,98 (m, 1H), 4,85 (d, J = 10,8 Гц, 1H), 4,73-4,72 (m, 1H), 4,55-4,35 (m, 4H), 4,07-3,93 (m, 3H), 3,76-3,72 (m, 1H); 13C ЯМР (75 МГц, CDCl3): ppm 169,55, 169,10, 164,43, 164,25, 161,18, 161,00, 143,00, 140,83, 142,83, 141,68, 141,50, 137,69, 137,59, 136,32, 130,45, 128,91, 128,74, 128,63, 128,56, 128,43, 128,06, 127,02, 126,89, 126,15, 126,01, 120,00, 119,01, 118,44, 118,17, 118,09, 110,33, 110,02, 109,48, 109,16, 98,04, 97,70, 97,34, 85,89, 85,62, 76,35, 75,36, 75,05, 74,09, 73,74, 66,75; ИК (KBr, см-1) 3430, 3334, 2914, 2870, 1752, 1702, 1580, 1452, 1328, 1232, 1140, 1062, 698; MS (MH+) вычисл. для C47H38F2N3O7 794,2678, наблюд. 794,2687. Анал. Вычисл. C47H38F2N3O7 1,0H2O: C, 69,54; H, 4,84; N, 5,17; H2O, 2,2. Найдено: C, 69,57; H, 4,70; N, 5,10; H2O, 0,4.
Соединение B превращают в соединение A перемешиванием раствора 2,10-дифтор-12,13-дигидро-13-[2-O-3,4,6-трис-O-(фенилметил) 1,0H2O: C, 69,54; H, 4,84; N, 5,17; H2O, 2,2. Найдено: C, 69,57; H, 4,70; N, 5,10; H2O, 0,4.
Соединение B превращают в соединение A перемешиванием раствора 2,10-дифтор-12,13-дигидро-13-[2-O-3,4,6-трис-O-(фенилметил)  – D-глюкопиранозил] -3,4,6-трис-O-(фенилметил) – – D-глюкопиранозил] -3,4,6-трис-O-(фенилметил) – – D глюкопиранозил] – – D глюкопиранозил] –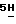 -индол[2,3-a] пиррол[3,4-c] карбазол-5,7 -индол[2,3-a] пиррол[3,4-c] карбазол-5,7  диона (10,9 г, 8,89 ммол) в сухом этилацетате (25 мл) и обработкой раствором безводного метанольного хлористого водорода (8М, 500 мл) в закрытой колбе в течение 96 час при комнатной температуре. Затем упаривают растворитель(ли) в вакууме и полученный остаток разбавляют этилацетатом и тетрагидрофураном и нейтрализуют до pH 8 насыщенным раствором бикарбоната натрия. Органическую фазу отделяют и промывают рассолом, а потом высушивают и концентрируют растворитель. Очистка остатка флеш-хроматографией на силикагеле (как описано выше) дает вышеназванное соединение A формулы VIII (5,7 г, 81%) в виде желтой пены, а также исходный агликоновый продукт (0,7 г).
Пример 12 диона (10,9 г, 8,89 ммол) в сухом этилацетате (25 мл) и обработкой раствором безводного метанольного хлористого водорода (8М, 500 мл) в закрытой колбе в течение 96 час при комнатной температуре. Затем упаривают растворитель(ли) в вакууме и полученный остаток разбавляют этилацетатом и тетрагидрофураном и нейтрализуют до pH 8 насыщенным раствором бикарбоната натрия. Органическую фазу отделяют и промывают рассолом, а потом высушивают и концентрируют растворитель. Очистка остатка флеш-хроматографией на силикагеле (как описано выше) дает вышеназванное соединение A формулы VIII (5,7 г, 81%) в виде желтой пены, а также исходный агликоновый продукт (0,7 г).
Пример 123,9-Дифтор-12,13-дигидро-13 -[  – D-глюкопиранозил]- 5 – D-глюкопиранозил]- 5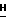 индол[2,3-a]пиррол[3,4-c] карбазол-5,7(6-N-[4-(трет.бутил)бензил]-)-дион (la: X1 = X’1 = F; X2 = X’2 = H; R6 = 4-(трет.бутил)бензил; Q = NH, R2 = R5 = OH). К перемешиваемому магнитной мешалкой раствору продукта из примера 10 (2,10 г, 2,23 ммол) в 95% этаноле (450 мл) и циклогексене (175 мл) добавляют 20% гидроксид палладия на угле (0,49 г) и смесь кипятят с обратным холодильником в атмосфере азота при интенсивном перемешивании в течение 20 час. Смесь фильтруют горячей через целит и промывают метанолом. Фильтрат концентрируют в вакууме и очищают флеш-хроматографией на силикагеле, используя 3-5% метанола в метиленхлориде, получают 1,35 г (90%) чистого вышеназванного соединения в виде желто-оранжевого твердого вещества. Аналитический образец, упаренный из этилацетата, высушенный в вакууме, выделяется в виде комплекса 1/2 EtOAc на молекулу. 300 МГц 1H ЯМР (DMSO-d6): индол[2,3-a]пиррол[3,4-c] карбазол-5,7(6-N-[4-(трет.бутил)бензил]-)-дион (la: X1 = X’1 = F; X2 = X’2 = H; R6 = 4-(трет.бутил)бензил; Q = NH, R2 = R5 = OH). К перемешиваемому магнитной мешалкой раствору продукта из примера 10 (2,10 г, 2,23 ммол) в 95% этаноле (450 мл) и циклогексене (175 мл) добавляют 20% гидроксид палладия на угле (0,49 г) и смесь кипятят с обратным холодильником в атмосфере азота при интенсивном перемешивании в течение 20 час. Смесь фильтруют горячей через целит и промывают метанолом. Фильтрат концентрируют в вакууме и очищают флеш-хроматографией на силикагеле, используя 3-5% метанола в метиленхлориде, получают 1,35 г (90%) чистого вышеназванного соединения в виде желто-оранжевого твердого вещества. Аналитический образец, упаренный из этилацетата, высушенный в вакууме, выделяется в виде комплекса 1/2 EtOAc на молекулу. 300 МГц 1H ЯМР (DMSO-d6):  11,81 (br s, 1H), 8,84 (dd, 1H, J = 9,7, 2,7 Гц), 8,76 (dd, 1H, J = 9,7, 2,6 Гц), 8,04 (dd, 1H, J = 9,3, 4,4 Гц), 7,70 (dd, 1H, J = 8,9, 4,6 Гц), 7,55-7,46 (m, 2H), 7,40-7,33 (m, 4H), 6,31 (d, 1H, J = 8,9 Гц), 6,12 (br s, 1H), 5,43 (d, 1H, J = 4,4 Гц), 5,17 (d, 1H, J = 5,5 Гц), 4,39 (d, 1H, J = 5,4 Гц), 4,90 (s, 2H), 4,13-4,07 (m, 1H), 4,00-3,96 (m, 2H), 3,87-3,80 (m, 1H), 3,63-3,46 (m, 2H), 1,24 (s, 9H); FAB масс-спектр, m/e 669 (M+). Анал. Вычисл. 37H33F2N3O7 11,81 (br s, 1H), 8,84 (dd, 1H, J = 9,7, 2,7 Гц), 8,76 (dd, 1H, J = 9,7, 2,6 Гц), 8,04 (dd, 1H, J = 9,3, 4,4 Гц), 7,70 (dd, 1H, J = 8,9, 4,6 Гц), 7,55-7,46 (m, 2H), 7,40-7,33 (m, 4H), 6,31 (d, 1H, J = 8,9 Гц), 6,12 (br s, 1H), 5,43 (d, 1H, J = 4,4 Гц), 5,17 (d, 1H, J = 5,5 Гц), 4,39 (d, 1H, J = 5,4 Гц), 4,90 (s, 2H), 4,13-4,07 (m, 1H), 4,00-3,96 (m, 2H), 3,87-3,80 (m, 1H), 3,63-3,46 (m, 2H), 1,24 (s, 9H); FAB масс-спектр, m/e 669 (M+). Анал. Вычисл. 37H33F2N3O7 1/2C4H8O2: C, 65,63; H, 5,22; F, 5,32; N, 5,89. Найдено: C, 65,04; H, 5,20; F, 5,32; N, 5,91.
Пример 13 1/2C4H8O2: C, 65,63; H, 5,22; F, 5,32; N, 5,89. Найдено: C, 65,04; H, 5,20; F, 5,32; N, 5,91.
Пример 132,10-Дифтор-12,13-дигидро-13 -[  – D-глюкопиранозил] – D-глюкопиранозил] 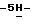 индол[2,3-a] пиррол[3,4-c]карбазол-5,7 индол[2,3-a] пиррол[3,4-c]карбазол-5,7  дион (Ia: X1 = X’1 = F; X2 = X’2 = R6 = H; Q = NH, R2 = R5 = OH) дион (Ia: X1 = X’1 = F; X2 = X’2 = R6 = H; Q = NH, R2 = R5 = OH)Раствор 2,10-дифтор-12,13-дигидро-13-[3,4,6-трис-O-(фенилметил) –  – D-глюкопиранозил] – D-глюкопиранозил] 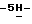 индол[2,3-a]пиррол[3,4-c]карбазол-5,7 индол[2,3-a]пиррол[3,4-c]карбазол-5,7  диона (4,36 г, 5,49 ммол) в смеси этанол и этилацетат (1:1, 100 мл) подвергают гидрированию по Парру (H2, 60 psi) в течение 6 часов при комнатной температуре с использованием 20% Pd(OH)2 на угле (4,4 г) в качестве катализатора. После фильтрования с отсасыванием через целит, фильтрат концентрируют досуха с получением оранжево-желтого твердого остатка, который очищают хроматографией на колонке с силикагелем (элюирование 50% тетрагидрофураном в гексане) с получением вышеназванного соединения (2,33 г, 77%) в виде желтого твердого вещества, т.пл. 255-260oC; 1H ЯМР (300 МГц, DMSO-d6): диона (4,36 г, 5,49 ммол) в смеси этанол и этилацетат (1:1, 100 мл) подвергают гидрированию по Парру (H2, 60 psi) в течение 6 часов при комнатной температуре с использованием 20% Pd(OH)2 на угле (4,4 г) в качестве катализатора. После фильтрования с отсасыванием через целит, фильтрат концентрируют досуха с получением оранжево-желтого твердого остатка, который очищают хроматографией на колонке с силикагелем (элюирование 50% тетрагидрофураном в гексане) с получением вышеназванного соединения (2,33 г, 77%) в виде желтого твердого вещества, т.пл. 255-260oC; 1H ЯМР (300 МГц, DMSO-d6): 11,77 (s, 1H), 11,19 (s, 1H), 9,14-9,03 (m, 2H), 7,89 (dd, J = 11,0, 2,0 Гц, 1H), 7,41 (dd, J = 9,8, 2,3 Гц, 1H), 7,27-7,19 (m, 2H), 6,26 (d, J = 8,9 Гц, 1H), 6,14-6,12 (m, 1H), 5,43 (d, J = 4,0 Гц, 1H), 5,17 (d, J = 5,5 Гц, 1H), 4,98 (d, J = 5,5 Гц, 1H), 4,24-3,94 (m, 3H), 3,83-3,81 (m, 1H), 3,59-3,57 (m, 1H), 3,50-3,42 (m, 1H); 13C ЯМР (75 МГц, DMSO-d6): ppm 170,99, 170,91, 163,43, 160,24, 143,12, 141,63, 130,09, 128,74, 126,02, 120,90, 119,35, 118,22, 118,14, 117,74, 116,54, 108,78, 108,57, 98,77, 98,55, 98,20, 84,64, 78,56, 76,44, 73,06, 67,51, 58,29; ИК (KBr, см-1) 3326, 1744, 1700, 1578, 1452, 1328, 1232, 1114, 1074, 828; MS (MH+) m/z 523. Анал. Вычисл. C26H19F2N3O7 11,77 (s, 1H), 11,19 (s, 1H), 9,14-9,03 (m, 2H), 7,89 (dd, J = 11,0, 2,0 Гц, 1H), 7,41 (dd, J = 9,8, 2,3 Гц, 1H), 7,27-7,19 (m, 2H), 6,26 (d, J = 8,9 Гц, 1H), 6,14-6,12 (m, 1H), 5,43 (d, J = 4,0 Гц, 1H), 5,17 (d, J = 5,5 Гц, 1H), 4,98 (d, J = 5,5 Гц, 1H), 4,24-3,94 (m, 3H), 3,83-3,81 (m, 1H), 3,59-3,57 (m, 1H), 3,50-3,42 (m, 1H); 13C ЯМР (75 МГц, DMSO-d6): ppm 170,99, 170,91, 163,43, 160,24, 143,12, 141,63, 130,09, 128,74, 126,02, 120,90, 119,35, 118,22, 118,14, 117,74, 116,54, 108,78, 108,57, 98,77, 98,55, 98,20, 84,64, 78,56, 76,44, 73,06, 67,51, 58,29; ИК (KBr, см-1) 3326, 1744, 1700, 1578, 1452, 1328, 1232, 1114, 1074, 828; MS (MH+) m/z 523. Анал. Вычисл. C26H19F2N3O7 0,25EtOAc 0,25EtOAc 0,40H2O: C, 58,68; H, 3,98; N, 7,60; H2O, 1,30. Найдено: C, 58,55; H, 4,18; N, 7,38; H2O, 1,20.
Пример 14 0,40H2O: C, 58,68; H, 3,98; N, 7,60; H2O, 1,30. Найдено: C, 58,55; H, 4,18; N, 7,38; H2O, 1,20.
Пример 142,10-Дифтор-12,13-дигидро-13-[2-O-(триэтилсилил)-3,4,6-трис- O-(фенилметил) –  – D-глюкопиранозил] -6-триэтилсилил – D-глюкопиранозил] -6-триэтилсилил 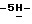 индол[2,3-a]пиррол[3,4-c] карбазол-5,7 индол[2,3-a]пиррол[3,4-c] карбазол-5,7  дион (A = VIII: X1 = X’1 – F; X2 = X’2 = H; R6 = R”’ = триэтилсилил; Q = NH, PG = бензил) и 2,10-дифтор-12,13-дигидро-13-[2-O-(триэтилсилил)-3,4,6-трис- O-(фенилметил) – дион (A = VIII: X1 = X’1 – F; X2 = X’2 = H; R6 = R”’ = триэтилсилил; Q = NH, PG = бензил) и 2,10-дифтор-12,13-дигидро-13-[2-O-(триэтилсилил)-3,4,6-трис- O-(фенилметил) – – D-глюкопиранозил]-5 – D-глюкопиранозил]-5 -индол[2,3-a]пиррол[3,4-c]карбазол-5,7 -индол[2,3-a]пиррол[3,4-c]карбазол-5,7  дион (B = VIII: X1 = X’1 = F; X2 = X’2 = R6 = H; R”’ = триэтилсилил; Q = NH, PG = бензил).
Триэтилсилил трифлат (9,0 мл, 40,0 ммол, 20 экв.) добавляют одной порцией к раствору 2,10-дифтор-12,13-дигидро-13-[3,4,6-трис- O-(фенилметил) – дион (B = VIII: X1 = X’1 = F; X2 = X’2 = R6 = H; R”’ = триэтилсилил; Q = NH, PG = бензил).
Триэтилсилил трифлат (9,0 мл, 40,0 ммол, 20 экв.) добавляют одной порцией к раствору 2,10-дифтор-12,13-дигидро-13-[3,4,6-трис- O-(фенилметил) – – D-глюкопиранозил] – D-глюкопиранозил]  индол[2,3-a] пиррол[3,4-c]карбазол-5,7 индол[2,3-a] пиррол[3,4-c]карбазол-5,7  диона (1,60 г, 2,0 ммол) в сухом пиридине (100 мл). Смесь перемешивают в закрытой колбе при комнатной температуре в течение 48 час и затем добавляют абсолютный этанол (5 мл). Спустя 10 мин растворитель удаляют в вакууме при комнатной температуре. Остаток затем разбавляют этилацетатом и тетрагидрофураном и подкисляют 0,1N соляной кислотой до кислой реакции. Далее отделяют органическую фазу, органическую фазу промывают рассолом, сушат над безводным сульфатом натрия и концентрируют. Очистки остатка флеш-хроматографией (2х) на силикагеле (элюирование 10% тетрагидрофураном в гексане в первый раз и 40% эфира в гексане во второй раз) приводят к вышеназванному соединению A (1,4 г) в виде желтой пены, содержащей незначительную примесь. Примесью является B. Полное превращение A в B можно осуществить растворением А (1,4 г, 1,37 ммол) в абсолютном этаноле (20 мл) и обработкой раствора ацетатом аммония (0,11 г, 1,40 ммол) при комнатной температуре в течение 2 час. Смесь затем разбавляют этилацетатом и тщательно промывают насыщенным раствором бикарбоната натрия и рассолом, а затем высушивают и концентрируют досуха. Вышеназванный продукт B (1,19 г, 96% выделяют в виде желтой пены.
Для A: Т. пл. 77-79oC; 1H ЯМР (300 МГц, CDCl3): диона (1,60 г, 2,0 ммол) в сухом пиридине (100 мл). Смесь перемешивают в закрытой колбе при комнатной температуре в течение 48 час и затем добавляют абсолютный этанол (5 мл). Спустя 10 мин растворитель удаляют в вакууме при комнатной температуре. Остаток затем разбавляют этилацетатом и тетрагидрофураном и подкисляют 0,1N соляной кислотой до кислой реакции. Далее отделяют органическую фазу, органическую фазу промывают рассолом, сушат над безводным сульфатом натрия и концентрируют. Очистки остатка флеш-хроматографией (2х) на силикагеле (элюирование 10% тетрагидрофураном в гексане в первый раз и 40% эфира в гексане во второй раз) приводят к вышеназванному соединению A (1,4 г) в виде желтой пены, содержащей незначительную примесь. Примесью является B. Полное превращение A в B можно осуществить растворением А (1,4 г, 1,37 ммол) в абсолютном этаноле (20 мл) и обработкой раствора ацетатом аммония (0,11 г, 1,40 ммол) при комнатной температуре в течение 2 час. Смесь затем разбавляют этилацетатом и тщательно промывают насыщенным раствором бикарбоната натрия и рассолом, а затем высушивают и концентрируют досуха. Вышеназванный продукт B (1,19 г, 96% выделяют в виде желтой пены.
Для A: Т. пл. 77-79oC; 1H ЯМР (300 МГц, CDCl3):  10,64 (s, 1H), 9,29 (dd, J = 8,8, 5,8 Гц, 1H), 9,23-9,20 (m, 1H), 7,33-7,20 (m, 15H), 7,13-7,04 (m, 4H), 5,77 (d, J = 8,8 Гц, 1H), 5,05 (d, J = ll,6 Гц, 1H), 4,89-4,79 (m, 2H), 4,67-4,63 (m, 2H), 4,54 (d, J = 12,4 Гц, 1H), 4,28 (m, 1H), 4,16 (m, 1H), 3,97 (m, 2H), 3,79-3,76 (m, 2H), 1,23-1,16 (m, 6H), 1,11-1,06 (m, 9H), 0,24 (t, J = 8,0 Гц, 9H), -0,29-(-0,50) (m, 6H); 13C ЯМР (75 МГц, CDCl3): ppm 175,34, 142,70, 141,88, 138,08, 137,40, 136,28, 128,72, 128,56, 128,27, 128,13, 128,05, 127,52, 127,40, 127,17, 126,73, 121,40, 118,12, 109,84, 109,53, 109,21, 98,26, 97,52, 86,12, 77,71, 77,44, 77,01, 76,72, 76,59, 75,53, 75,25, 74,26, 66,82, 6,91, 6,12, 4,03, 3,95; ИК (KBr, см-1) 3458, 3334, 2954, 2876, 1692, 1454, 1328, 1330, 1116, 1072, 732, 696; MS (M+) вычисл. для C59H66F2N3O7Si2 1022, 4407, наблюд. 1022, 4377.
Для B: Т. пл. не определена; 1H ЯМР (300 МГц, CDCl3): 10,64 (s, 1H), 9,29 (dd, J = 8,8, 5,8 Гц, 1H), 9,23-9,20 (m, 1H), 7,33-7,20 (m, 15H), 7,13-7,04 (m, 4H), 5,77 (d, J = 8,8 Гц, 1H), 5,05 (d, J = ll,6 Гц, 1H), 4,89-4,79 (m, 2H), 4,67-4,63 (m, 2H), 4,54 (d, J = 12,4 Гц, 1H), 4,28 (m, 1H), 4,16 (m, 1H), 3,97 (m, 2H), 3,79-3,76 (m, 2H), 1,23-1,16 (m, 6H), 1,11-1,06 (m, 9H), 0,24 (t, J = 8,0 Гц, 9H), -0,29-(-0,50) (m, 6H); 13C ЯМР (75 МГц, CDCl3): ppm 175,34, 142,70, 141,88, 138,08, 137,40, 136,28, 128,72, 128,56, 128,27, 128,13, 128,05, 127,52, 127,40, 127,17, 126,73, 121,40, 118,12, 109,84, 109,53, 109,21, 98,26, 97,52, 86,12, 77,71, 77,44, 77,01, 76,72, 76,59, 75,53, 75,25, 74,26, 66,82, 6,91, 6,12, 4,03, 3,95; ИК (KBr, см-1) 3458, 3334, 2954, 2876, 1692, 1454, 1328, 1330, 1116, 1072, 732, 696; MS (M+) вычисл. для C59H66F2N3O7Si2 1022, 4407, наблюд. 1022, 4377.
Для B: Т. пл. не определена; 1H ЯМР (300 МГц, CDCl3):  10,65 (s, 1H), 9,25-9,22 (m, 1H), 9,14 (dd, J = 8,8, 5,6 Гц, 1H), 7,72 (s, 1H), 7,33-7,21 (m, 14H), 7,16-7,03 (m, 4H), 5,77 (d, J = 8,8 Гц, 1H), 5,05 (d, J = 11,5 Гц, 1H), 4,87-4,78 (m, 2H), 4,69-4,63 (m, 2H), 4,59-4,51 (m, 1H), 4,28 (t, J = 8,8 Гц, 1H), 4,15 (t, J = 8,8 Гц, 1H), 4,02-3,91 (m, 2H), 3,79-3,73 (m, 2H), 0,23 (t, J = 8,0 Гц, 9H), -0,28-(-0,52) (m, 6H); 13C ЯМР (75 МГц, CDCl3): ppm 169,70, 169,66, 164,39, 161,18, 142,80, 142,64, 142,16, 141,99, 138,05, 137,37, 136,26, 130,65, 130,65-126,71 (11 сигналов, олефин. ), 121,11, 119,48, 119,11, 118,93, 118,68, 118,44, 110,04, 109,74, 109,44, 98,39, 98,04, 97,63, 97,26, 86,11, 86,06, 77,76, 77,21, 76,74, 75,52, 75,25, 74,30, 66,86, 6,10, 4,03; ИК (KBr, см-1) 3434, 2876, 1754, 1718, 1624, 1582, 1454, 1326, 1116, 1086, 738; MS (FAB, MH+) m/z вычисл. для C53H52F2N3O7Si 908,3543, наблюд. 908,3547.
Пример 15 10,65 (s, 1H), 9,25-9,22 (m, 1H), 9,14 (dd, J = 8,8, 5,6 Гц, 1H), 7,72 (s, 1H), 7,33-7,21 (m, 14H), 7,16-7,03 (m, 4H), 5,77 (d, J = 8,8 Гц, 1H), 5,05 (d, J = 11,5 Гц, 1H), 4,87-4,78 (m, 2H), 4,69-4,63 (m, 2H), 4,59-4,51 (m, 1H), 4,28 (t, J = 8,8 Гц, 1H), 4,15 (t, J = 8,8 Гц, 1H), 4,02-3,91 (m, 2H), 3,79-3,73 (m, 2H), 0,23 (t, J = 8,0 Гц, 9H), -0,28-(-0,52) (m, 6H); 13C ЯМР (75 МГц, CDCl3): ppm 169,70, 169,66, 164,39, 161,18, 142,80, 142,64, 142,16, 141,99, 138,05, 137,37, 136,26, 130,65, 130,65-126,71 (11 сигналов, олефин. ), 121,11, 119,48, 119,11, 118,93, 118,68, 118,44, 110,04, 109,74, 109,44, 98,39, 98,04, 97,63, 97,26, 86,11, 86,06, 77,76, 77,21, 76,74, 75,52, 75,25, 74,30, 66,86, 6,10, 4,03; ИК (KBr, см-1) 3434, 2876, 1754, 1718, 1624, 1582, 1454, 1326, 1116, 1086, 738; MS (FAB, MH+) m/z вычисл. для C53H52F2N3O7Si 908,3543, наблюд. 908,3547.
Пример 153,9-Дифтор-12,13-дигидро-13-[6-  -(метилсульфонил) – -(метилсульфонил) – – D-глюкопиранозил] – D-глюкопиранозил]  индол[2,3-a]пиррол[3,4-c]карбазол-5,7 индол[2,3-a]пиррол[3,4-c]карбазол-5,7  дион (Ib: X1 = X’1 = F; X2 = X’2 = R6 = H; R2 = R4 = OH; R5 = Мезилат) дион (Ib: X1 = X’1 = F; X2 = X’2 = R6 = H; R2 = R4 = OH; R5 = Мезилат)К перемешиваемому магнитной мешалкой раствору 3,9-дифтор-12,13-дигидро-13 -[  – D-глюкопиранозил] – D-глюкопиранозил]  индол[2,3-a] пиррол[3,4-c]карбазол-5,7 индол[2,3-a] пиррол[3,4-c]карбазол-5,7  диона (330 мг, 0,630 ммол) в безводном пиридине (8 мл) при oC в атмосфере азота прибавляют при помощи шприца метансульфонил хлорид (80 мкл, 1,03 ммол). Реакционную смесь перемешивают при 0oC в течение 3,25 час и контролируют по ТСХ на силикагеле (элюент EtOAc) появление пятна нового продукта с более высоким Rf по сравнению с исходным материалом. Добавляют дополнительно метансульфонил хлорид (20 мкл, 0,26 ммол) и реакцию перемешивают при 0oC в течение 1,25 час, затем обрабатывают с использованием EtOAc (350 мл) и насыщенного водного сульфата меди (II) (100 мл). Этилацетатный слой промывают насыщенным водным сульфатом меди (II) (3 х 150 мл), 0,1N HCl (200 мл), водой (200 мл), рассолом (200 мл) и сушат (Na2SO4). Упаривание в вакууме и последующая флеш-хроматография на силикагеле с использованием 4-6% метанола в дихлорметане дает 146 мг (39%) вышеназванного соединения в виде желтого твердого вещества: 500 МГц COSY 1H ЯМР (CD3COCD3) диона (330 мг, 0,630 ммол) в безводном пиридине (8 мл) при oC в атмосфере азота прибавляют при помощи шприца метансульфонил хлорид (80 мкл, 1,03 ммол). Реакционную смесь перемешивают при 0oC в течение 3,25 час и контролируют по ТСХ на силикагеле (элюент EtOAc) появление пятна нового продукта с более высоким Rf по сравнению с исходным материалом. Добавляют дополнительно метансульфонил хлорид (20 мкл, 0,26 ммол) и реакцию перемешивают при 0oC в течение 1,25 час, затем обрабатывают с использованием EtOAc (350 мл) и насыщенного водного сульфата меди (II) (100 мл). Этилацетатный слой промывают насыщенным водным сульфатом меди (II) (3 х 150 мл), 0,1N HCl (200 мл), водой (200 мл), рассолом (200 мл) и сушат (Na2SO4). Упаривание в вакууме и последующая флеш-хроматография на силикагеле с использованием 4-6% метанола в дихлорметане дает 146 мг (39%) вышеназванного соединения в виде желтого твердого вещества: 500 МГц COSY 1H ЯМР (CD3COCD3)  10,40 (s, 1H), 10,00 (br s, 1H), 8,97-8,86 (m, 2H), 8,02-7,96 (m, 2H), 7,42-7,33 (m, 2H), 6,43 (d, 1H, J = 9,2 Гц, 1’H), 4,98 (d, 1H, J = 11,0 Гц, 6”H), 4,48 (d, 1H, J = 10,0 Гц, 5’H), 4,22 (t, 1H, J = 9,7 Гц, 4’H), 4,00 (t, 1H, J = 9,3 Гц, 2’H), 3,89 (t, 1H, J = 9,0 Гц, 3’H), 3,23 (s, 3H); FAB масс-спектр, m/e 601 (M+).
Пример 16 10,40 (s, 1H), 10,00 (br s, 1H), 8,97-8,86 (m, 2H), 8,02-7,96 (m, 2H), 7,42-7,33 (m, 2H), 6,43 (d, 1H, J = 9,2 Гц, 1’H), 4,98 (d, 1H, J = 11,0 Гц, 6”H), 4,48 (d, 1H, J = 10,0 Гц, 5’H), 4,22 (t, 1H, J = 9,7 Гц, 4’H), 4,00 (t, 1H, J = 9,3 Гц, 2’H), 3,89 (t, 1H, J = 9,0 Гц, 3’H), 3,23 (s, 3H); FAB масс-спектр, m/e 601 (M+).
Пример 162,10-Дифтор-12,13-дигидро-13-[6-дезокси-6-(1,3-дигидро-1,3- диоксо-2-изохинолинил) –  – D-глюкопиранозил] – D-глюкопиранозил]  индол[2,3-a]пиррол[3,4-c]карбазол-5,7 индол[2,3-a]пиррол[3,4-c]карбазол-5,7  дион (A = Ib: X1 = X’1 = F; X2 = X’2 = R2 = R6 = H; R2 = R4 = OH; R5 = фталимид) дион (A = Ib: X1 = X’1 = F; X2 = X’2 = R2 = R6 = H; R2 = R4 = OH; R5 = фталимид)Фталимид калия (0,45 г, 2,43 ммол) добавляют одной порцией к перемешиваемому раствору 2,10-дифтор-12,13-дигидро-13-[6-  -(метилсульфонил) – -(метилсульфонил) – – D-глюкопиранозил] – D-глюкопиранозил]  индол[2,3-a]пиррол[3,4-c]карбазол-5,7 индол[2,3-a]пиррол[3,4-c]карбазол-5,7  диона (200 мг, 0,33 ммол) в безводном диметилформамиде (10 мл) и затем смесь нагревают при 130oC в течение 3 час, охлаждают до комнатной температуры и спустя ночь концентрируют в вакууме. Остаток обрабатывают этилацетатом (добавляют немного тетрагидрофурана) и промывают 0, 1N соляной кислотой и рассолом. Последующие высушивание и концентрирование растворителя, очистка остатка флеш-хроматографией на силикагеле (элюирование 7% метанола в хлороформе) дает вышеназванное соединение (46 мг, 21%) в виде желтого твердого вещества.
Т. пл. >300oC; 1H ЯМР (500 МГц, DMSO-d6): диона (200 мг, 0,33 ммол) в безводном диметилформамиде (10 мл) и затем смесь нагревают при 130oC в течение 3 час, охлаждают до комнатной температуры и спустя ночь концентрируют в вакууме. Остаток обрабатывают этилацетатом (добавляют немного тетрагидрофурана) и промывают 0, 1N соляной кислотой и рассолом. Последующие высушивание и концентрирование растворителя, очистка остатка флеш-хроматографией на силикагеле (элюирование 7% метанола в хлороформе) дает вышеназванное соединение (46 мг, 21%) в виде желтого твердого вещества.
Т. пл. >300oC; 1H ЯМР (500 МГц, DMSO-d6):  11,21 (m), 10,80 (s), 9,15-9,13 (m), 9,07-9,02 (m), 7,97 (d, J = 8,8 Гц, 1H), 7,86 (d, J = 11,1 Гц, 1H), 7,47-7,69 (m), 7,40 (d, J = 10,3 Гц, 1H), 7,31-7,23 (m), 7,20-7,17 (m), 6,09 (d, J = 9,l Гц, 1H), 5,73 (m), 5,64 (m), 5,30 и 5,26 (2m), 4,99 (m), 4,36-4,27 (m), 4,21 (m), 4,14-4,10 (m), 4,01-3,96 (m), 3,83-3,72 (2m), 3,57-3,53 (m); ИК (KBr, см-1) 3426, 1752, 1706, 1624, 1579, 1452, 1397, 1328, 1113, 1035; MS (отриц. ESI, M–) m/z 651.
Пример 17 11,21 (m), 10,80 (s), 9,15-9,13 (m), 9,07-9,02 (m), 7,97 (d, J = 8,8 Гц, 1H), 7,86 (d, J = 11,1 Гц, 1H), 7,47-7,69 (m), 7,40 (d, J = 10,3 Гц, 1H), 7,31-7,23 (m), 7,20-7,17 (m), 6,09 (d, J = 9,l Гц, 1H), 5,73 (m), 5,64 (m), 5,30 и 5,26 (2m), 4,99 (m), 4,36-4,27 (m), 4,21 (m), 4,14-4,10 (m), 4,01-3,96 (m), 3,83-3,72 (2m), 3,57-3,53 (m); ИК (KBr, см-1) 3426, 1752, 1706, 1624, 1579, 1452, 1397, 1328, 1113, 1035; MS (отриц. ESI, M–) m/z 651.
Пример 1713-[6-(Азидо-6-дезокси –  – D-глюкопиранозил)-2,10-дифтор-12,13-дигидро – D-глюкопиранозил)-2,10-дифтор-12,13-дигидро  индол[2,3-a]пиррол[3,4-c]карбазол-5,7 индол[2,3-a]пиррол[3,4-c]карбазол-5,7  дион (Ib: X1 = X’1 = F; X2 = X’2 = R6 = H; R2 = R4 = OH; R5 = N3).
Азид натрия (0,29 мг, 0,44 ммол) добавляют одной порцией к перемешиваемому раствору 2,10-дифтор-12,13-дигидро-13-[6 дион (Ib: X1 = X’1 = F; X2 = X’2 = R6 = H; R2 = R4 = OH; R5 = N3).
Азид натрия (0,29 мг, 0,44 ммол) добавляют одной порцией к перемешиваемому раствору 2,10-дифтор-12,13-дигидро-13-[6  (метилсульфонил) – (метилсульфонил) – – D-глюкопиранозил] – D-глюкопиранозил] 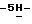 индол[2,3-a]пиррол[3,4-c]карбазол-5,7 индол[2,3-a]пиррол[3,4-c]карбазол-5,7  диона (132 мг, 0,22 ммол) и вносят молекулярные сита 4E (4 ангстрема) (50 мг) в безводном диметилформамиде (3 мл), после чего смесь нагревают при 60oC в течение 6 час, охлаждают до комнатной температуры, разбавляют этилацетатом (добавляют немного тетрагидрофурана) и промывают насыщенным раствором бикарбоната натрия и рассолом. Последующие высушивание и концентрирование растворителя, очистка остатка флеш-хроматографией на силикагеле (элюирование 10% метанола в хлороформе) дает вышеназванное соединение (40 мг, 33%) в виде желтого твердого вещества, разлаг. при 256oC; 1H ЯМР (500 МГц, DMSO-d6): диона (132 мг, 0,22 ммол) и вносят молекулярные сита 4E (4 ангстрема) (50 мг) в безводном диметилформамиде (3 мл), после чего смесь нагревают при 60oC в течение 6 час, охлаждают до комнатной температуры, разбавляют этилацетатом (добавляют немного тетрагидрофурана) и промывают насыщенным раствором бикарбоната натрия и рассолом. Последующие высушивание и концентрирование растворителя, очистка остатка флеш-хроматографией на силикагеле (элюирование 10% метанола в хлороформе) дает вышеназванное соединение (40 мг, 33%) в виде желтого твердого вещества, разлаг. при 256oC; 1H ЯМР (500 МГц, DMSO-d6):  11,89 (br s, 1H), 11,21 (br s, 1H), 11,14 (br s, 1H), 10,82 (s, 1H), 9,19 (dd, J = 8,8 Гц, 1H), 9,13-9,06 (m, 3H), 7,90 (dd, J = 10,8, 2,1 Гц, 1H), 7,71 (dd, J = 10,5, 2,1 Гц, 1H), 7,49 (dd, J = 9,6, 2,1 Гц, 1H), 7,35 (dd, J = 9A, 2,3 Гц, 1H), 7,30-7,22 (m, 4H), 6,33 (d, J = 8,7 Гц, 1H), 6,27 (d, J = 8,6 Гц, 1H), 5,72 (d, J = 5,2 Гц, 1H), 5,61 (d, J = 4,9 Гц, 1H), 5,33 (br s, 1H), 5,23-5,21 (m, 2H), 5,11 (d, J = 5,0 Гц, 1H), 4,20-4,10 (m, 4H), 4,02-3,94 (m, 3H), 3,85-3,83 (m, 1H), 3,79-3,69 (m, 3H), 3,63-3,58 (m, 3Н); ИК (KBr, см-1) 3422, 2110, 1740, 1700, 1622, 1580, 1450, 1381, 1329, 1231, 1170, 1115, 1074, 828, 763; HRMS (отриц. ESI, M-H– вычисл. для C26H17F2N6O6 547,1256, наблюд. 547,1199.
Пример 18 11,89 (br s, 1H), 11,21 (br s, 1H), 11,14 (br s, 1H), 10,82 (s, 1H), 9,19 (dd, J = 8,8 Гц, 1H), 9,13-9,06 (m, 3H), 7,90 (dd, J = 10,8, 2,1 Гц, 1H), 7,71 (dd, J = 10,5, 2,1 Гц, 1H), 7,49 (dd, J = 9,6, 2,1 Гц, 1H), 7,35 (dd, J = 9A, 2,3 Гц, 1H), 7,30-7,22 (m, 4H), 6,33 (d, J = 8,7 Гц, 1H), 6,27 (d, J = 8,6 Гц, 1H), 5,72 (d, J = 5,2 Гц, 1H), 5,61 (d, J = 4,9 Гц, 1H), 5,33 (br s, 1H), 5,23-5,21 (m, 2H), 5,11 (d, J = 5,0 Гц, 1H), 4,20-4,10 (m, 4H), 4,02-3,94 (m, 3H), 3,85-3,83 (m, 1H), 3,79-3,69 (m, 3H), 3,63-3,58 (m, 3Н); ИК (KBr, см-1) 3422, 2110, 1740, 1700, 1622, 1580, 1450, 1381, 1329, 1231, 1170, 1115, 1074, 828, 763; HRMS (отриц. ESI, M-H– вычисл. для C26H17F2N6O6 547,1256, наблюд. 547,1199.
Пример 186-Амино-13-(6-амино-6-дезокси –  – D-глюкопиранозил)-2,10-дифтор-12,13-дигидро – D-глюкопиранозил)-2,10-дифтор-12,13-дигидро 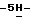 индол[2,3-a]пиррол[3,4-c]карбазол-5,7 индол[2,3-a]пиррол[3,4-c]карбазол-5,7  дион (Ic: X1 = X’1 = F; X2 = X’2 = H; R2 = R4 = OH; R5 = NH2 = R6).
Гидразингидрат (2 мл) добавляют к 2,10-дифтор-12,13-дигидро-13-[6-дезокси-6-(1,3-дигидро-1,3-диоксо-2- изохинолинил) – дион (Ic: X1 = X’1 = F; X2 = X’2 = H; R2 = R4 = OH; R5 = NH2 = R6).
Гидразингидрат (2 мл) добавляют к 2,10-дифтор-12,13-дигидро-13-[6-дезокси-6-(1,3-дигидро-1,3-диоксо-2- изохинолинил) – – D-глюкопиранозил] – D-глюкопиранозил] 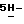 индол[2,3-a] пиррол[3,4-c] карбазол-5,7 индол[2,3-a] пиррол[3,4-c] карбазол-5,7  диону (19 мг, 0,029 ммол) и смесь перемешивают при комнатной температуре в течение 1 часа и при 50oC в течение 1 часа, после чего концентрируют в вакууме в течение 24 час. Очистка остатка с помощью ВЭЖХ (HPLC) на колонке с C18 YMC Pack ODS (30% изократический поток (isocratic flow) с использованием смеси метанол/вода/0,1% трифторуксусная кислота) приводит к вышеназванному соединению (10 мг, 27%) в виде оранжево-желтого твердого вещества, т. пл. >300oC; 1H ЯМР (500 МГц, DMSO-d6/D2O): диону (19 мг, 0,029 ммол) и смесь перемешивают при комнатной температуре в течение 1 часа и при 50oC в течение 1 часа, после чего концентрируют в вакууме в течение 24 час. Очистка остатка с помощью ВЭЖХ (HPLC) на колонке с C18 YMC Pack ODS (30% изократический поток (isocratic flow) с использованием смеси метанол/вода/0,1% трифторуксусная кислота) приводит к вышеназванному соединению (10 мг, 27%) в виде оранжево-желтого твердого вещества, т. пл. >300oC; 1H ЯМР (500 МГц, DMSO-d6/D2O):  8,49-8,89 (2m), 8,81 (m), 8,68 (m), 7,93 (m), 7,82 (d, J = 10,0 Гц, 1H), 7,73 (d, J = 10,2 Гц, 1H), 7,39 (d, J = 9,5 Гц, 1H), 7,12-7,11 (m), 6,93 (m), 6,20 (d, J = 8,9 Гц, 1H), 6,09 (d, J = 7,7 Гц, 1H), 4,22 (m), 4,16-4,12 (m), 4,14 (t, J = 8,9 Гц, 1H), 3,79 (t, J = 8,9 Гц, 1H), 3,75-3,73 (m), 3,61-3,52 (m), 3,40-3,34 (m), 3,31-3,27 (m); ИК (KBr, см-1) 3415, 1757, 1676, 1623, 1581, 1451, 1404, 1330, 1203, 1112, 839; HRMS (отриц. ESI, M-H–) вычисл. для C26H19F2N5O6 536,1460, наблюд. 536,1349.
Пример 19 8,49-8,89 (2m), 8,81 (m), 8,68 (m), 7,93 (m), 7,82 (d, J = 10,0 Гц, 1H), 7,73 (d, J = 10,2 Гц, 1H), 7,39 (d, J = 9,5 Гц, 1H), 7,12-7,11 (m), 6,93 (m), 6,20 (d, J = 8,9 Гц, 1H), 6,09 (d, J = 7,7 Гц, 1H), 4,22 (m), 4,16-4,12 (m), 4,14 (t, J = 8,9 Гц, 1H), 3,79 (t, J = 8,9 Гц, 1H), 3,75-3,73 (m), 3,61-3,52 (m), 3,40-3,34 (m), 3,31-3,27 (m); ИК (KBr, см-1) 3415, 1757, 1676, 1623, 1581, 1451, 1404, 1330, 1203, 1112, 839; HRMS (отриц. ESI, M-H–) вычисл. для C26H19F2N5O6 536,1460, наблюд. 536,1349.
Пример 1913-[6-Амино-6-дезокси –  – D-глюкопиранозил] -3,9-дифтор-12,13-дигидро – D-глюкопиранозил] -3,9-дифтор-12,13-дигидро 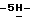 индол[2,3-a]пиррол[3,4-c]карбазол-5,7 индол[2,3-a]пиррол[3,4-c]карбазол-5,7  дион (Ib: X1 = X’1 = F; X2 = X’2 = R6 = H; R2-R4 = OH, R5 = NH2).
К раствору соединения, 13-[6-(Азидо-6-дезокси дион (Ib: X1 = X’1 = F; X2 = X’2 = R6 = H; R2-R4 = OH, R5 = NH2).
К раствору соединения, 13-[6-(Азидо-6-дезокси  – D-глюкопиранозил)-2,10-дифтор-12,13-дигидро – D-глюкопиранозил)-2,10-дифтор-12,13-дигидро 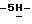 индол[2,3-a]пиррол[3,4-c]карбазол-5,7 индол[2,3-a]пиррол[3,4-c]карбазол-5,7  диона (98,9 мг, 0,180 ммол), в абсолютном метаноле (125 мл) в атмосфере азота в приборе Парра (Parr) добавляют хлористый палладий (II) (90 мг, 0,51 ммол). Смесь подвергают воздействию ультразвуком в течение 10 мин и затем помещают в качалку (трясучку) Парра (Parr shaker) при давлении водорода 70 psi на 45 часов. Смесь фильтруют через небольшой слой целита, промывают метанолом и концентрируют в вакууме. Очистка на колонке с Sephadex LH 20 элюированием метанолом (скорость потока 0,4-0,5 мл/мин) дает 69,6 мг (70%) вышеназванного соединения в виде желто-оранжевого твердого вещества: 500 МГц COSY 1H ЯМР (DMSO-d6): диона (98,9 мг, 0,180 ммол), в абсолютном метаноле (125 мл) в атмосфере азота в приборе Парра (Parr) добавляют хлористый палладий (II) (90 мг, 0,51 ммол). Смесь подвергают воздействию ультразвуком в течение 10 мин и затем помещают в качалку (трясучку) Парра (Parr shaker) при давлении водорода 70 psi на 45 часов. Смесь фильтруют через небольшой слой целита, промывают метанолом и концентрируют в вакууме. Очистка на колонке с Sephadex LH 20 элюированием метанолом (скорость потока 0,4-0,5 мл/мин) дает 69,6 мг (70%) вышеназванного соединения в виде желто-оранжевого твердого вещества: 500 МГц COSY 1H ЯМР (DMSO-d6):  11,20 (brs, 1H), 8,92 (dd, 1H, J = 9,7, 2,6 Гц), 8,81 (dd, 1H, J = 9,7, 2,6 Гц), 8,05 (dd, 1H, J = 9,0, 4,6 Гц), 7,95 (brs, 3H), 7,88 (dd, 1H, J = 8,9, 4,6 Гц), 7,48 (ddd, 1H, J = 2,5, 8,9, 9,1 Гц), 7,41 (ddd, 1H, J = 2,5, 8,9, 9,1 Гц), 6,41 (d, 1H, J = 8,8 Гц, 1’H), 5,70 (brs, 1H), 5,36 (brd, 2H, 2′, 3’OH), 4,23-4,19 (m, 1H, 5’H), 4,06-4,02 (m, 1H, 2’H), 3,89-3,84 (m, 1H, 3’H), 3,56 (t, 1H, J = 8,9 Гц, 4’H), 3,32-3,25 (m, 1H, 6’H), 3,313-3,08 (m, 1H, 6”H); FAB масс-спектр, m/e 522 (M+).
Пример 20 11,20 (brs, 1H), 8,92 (dd, 1H, J = 9,7, 2,6 Гц), 8,81 (dd, 1H, J = 9,7, 2,6 Гц), 8,05 (dd, 1H, J = 9,0, 4,6 Гц), 7,95 (brs, 3H), 7,88 (dd, 1H, J = 8,9, 4,6 Гц), 7,48 (ddd, 1H, J = 2,5, 8,9, 9,1 Гц), 7,41 (ddd, 1H, J = 2,5, 8,9, 9,1 Гц), 6,41 (d, 1H, J = 8,8 Гц, 1’H), 5,70 (brs, 1H), 5,36 (brd, 2H, 2′, 3’OH), 4,23-4,19 (m, 1H, 5’H), 4,06-4,02 (m, 1H, 2’H), 3,89-3,84 (m, 1H, 3’H), 3,56 (t, 1H, J = 8,9 Гц, 4’H), 3,32-3,25 (m, 1H, 6’H), 3,313-3,08 (m, 1H, 6”H); FAB масс-спектр, m/e 522 (M+).
Пример 204-[2-(Бензо[b]тиен-2-ил)-5-фтор 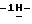 индол-3-ил]-3-хлор-1-метил индол-3-ил]-3-хлор-1-метил 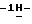 пиррол-2,5-дион (V: X1 = 5F; X2 = H = R’:R6 = Me; R” = бензо[b]тиенил; y = Cl).
К раствору 2-(2-бензо[b] тиенил-5-фториндола (10,0 г, 0,37 мол) в безводном тетрагидрофуране (250 мл) в атмосфере азота добавляют при помощи шприца этилмагний бромид (3М, 13,1 мл, 0,39 ммол) с такой скоростью, чтобы температура реакции поддерживалась между 45-50oC. Смесь затем нагревают при 50-55oC в течение 0,5 часа и охлаждают до комнатной температуры, а затем прикапывают в реакционную смесь раствор 3,4-дихлор-1-метилмалеимид (7,41 г, 0,41 мол) в безводном тетрагидрофуране. Смесь кипятят с обратным холодильником в течение 2 час, охлаждают, разбавляют этилацетатом, промывают насыщенным раствором хлористого аммония и рассолом, после чего высушивают и концентрируют растворитель до 1/4 объема. Фильтрование с отсасыванием полученной суспензии приводит к вышеназванному соединению (12,65 г, 82% в виде красно-фиолетового твердого вещества, т. пл. 250-251oC; 1H ЯМР (300 МГц, DMSO-d6): пиррол-2,5-дион (V: X1 = 5F; X2 = H = R’:R6 = Me; R” = бензо[b]тиенил; y = Cl).
К раствору 2-(2-бензо[b] тиенил-5-фториндола (10,0 г, 0,37 мол) в безводном тетрагидрофуране (250 мл) в атмосфере азота добавляют при помощи шприца этилмагний бромид (3М, 13,1 мл, 0,39 ммол) с такой скоростью, чтобы температура реакции поддерживалась между 45-50oC. Смесь затем нагревают при 50-55oC в течение 0,5 часа и охлаждают до комнатной температуры, а затем прикапывают в реакционную смесь раствор 3,4-дихлор-1-метилмалеимид (7,41 г, 0,41 мол) в безводном тетрагидрофуране. Смесь кипятят с обратным холодильником в течение 2 час, охлаждают, разбавляют этилацетатом, промывают насыщенным раствором хлористого аммония и рассолом, после чего высушивают и концентрируют растворитель до 1/4 объема. Фильтрование с отсасыванием полученной суспензии приводит к вышеназванному соединению (12,65 г, 82% в виде красно-фиолетового твердого вещества, т. пл. 250-251oC; 1H ЯМР (300 МГц, DMSO-d6):  12,50 (s, 1H), 8,03-7,79 (m, 1H), 7,93-7,89 (m, 1H), 7,83 (s, 1H), 7,52 (dd, J = 8,9, 4,4 Гц, 1H), 7,46-7,36 (m, 2H), 7,29 (dd, J = 9,9, 2,5 Гц, 1H), 7,16-7,09 (m, 1H), 3,37 (s, 3H); 13C ЯМР (75 МГц, DMSO-d6): ppm 167,71, 165,34, 159,10, 156,00, 139,48, 134,18, 133,76, 133,19, 133,06, 132,66, 127,41, 127,27, 125,20, 125,02, 124,22, 123,64, 122,55, 113,23, 113,10, 111,89, 111,54, 105,40, 105,07, 100,56, 24,61; ИК (KBr, см-1) 3336, 1778, 1706, 1636, 1490, 1441, 1383, 1297, 1170, 1010, 982, 881, 822, 800, 750, 736; MS (отриц. ESI M-H–) m/z 409. Анал. Вычисл. C21H12FN2O2S: C, 61,39; H, 2,94; N, 6,82. Найдено: C, 61,08; H, 2,88; N, 6,62.
Пример 21 12,50 (s, 1H), 8,03-7,79 (m, 1H), 7,93-7,89 (m, 1H), 7,83 (s, 1H), 7,52 (dd, J = 8,9, 4,4 Гц, 1H), 7,46-7,36 (m, 2H), 7,29 (dd, J = 9,9, 2,5 Гц, 1H), 7,16-7,09 (m, 1H), 3,37 (s, 3H); 13C ЯМР (75 МГц, DMSO-d6): ppm 167,71, 165,34, 159,10, 156,00, 139,48, 134,18, 133,76, 133,19, 133,06, 132,66, 127,41, 127,27, 125,20, 125,02, 124,22, 123,64, 122,55, 113,23, 113,10, 111,89, 111,54, 105,40, 105,07, 100,56, 24,61; ИК (KBr, см-1) 3336, 1778, 1706, 1636, 1490, 1441, 1383, 1297, 1170, 1010, 982, 881, 822, 800, 750, 736; MS (отриц. ESI M-H–) m/z 409. Анал. Вычисл. C21H12FN2O2S: C, 61,39; H, 2,94; N, 6,82. Найдено: C, 61,08; H, 2,88; N, 6,62.
Пример 213-Фтор-6-метил 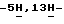 бензо[b] тиенил[2,3-a]-пиррол[3,4-c]карбазол-5,7-дион (VI: 1 = F; X2 = X’1 = X’2 = R’ = H; Q = S; R6 = Me).
Суспензия, содержащая 4-[2-(бензо[b]тиен-2-ил)-5-фтор бензо[b] тиенил[2,3-a]-пиррол[3,4-c]карбазол-5,7-дион (VI: 1 = F; X2 = X’1 = X’2 = R’ = H; Q = S; R6 = Me).
Суспензия, содержащая 4-[2-(бензо[b]тиен-2-ил)-5-фтор 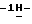 индол-3-ил] -3-хлор-1-метил индол-3-ил] -3-хлор-1-метил 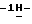 пиррол-2,5-дион (12,6 г, 30,7 ммол) в смеси сухой абсолютный этанол/диоксан (60%, 1 л) помещают в 2 л колбу из пирекса, снабженную обратным холодильником. Смесь перемешивают и облучают (ртутная лампа среднего давления Hanovia, 450 W) в течение 14 час, после чего охлаждают до комнатной температуры и дополнительно оставляют в холодильнике на 24 час при 5oC. Фильтрование с отсасыванием суспензии приводит к вышеназванному соединению (12,7 г, 95% в виде флуоресцирующего желто-зеленого, похожего на волокнистое стекло, твердого вещества, т. пл. >305oC; 1H ЯМР (500 МГц, DMSO-d6): пиррол-2,5-дион (12,6 г, 30,7 ммол) в смеси сухой абсолютный этанол/диоксан (60%, 1 л) помещают в 2 л колбу из пирекса, снабженную обратным холодильником. Смесь перемешивают и облучают (ртутная лампа среднего давления Hanovia, 450 W) в течение 14 час, после чего охлаждают до комнатной температуры и дополнительно оставляют в холодильнике на 24 час при 5oC. Фильтрование с отсасыванием суспензии приводит к вышеназванному соединению (12,7 г, 95% в виде флуоресцирующего желто-зеленого, похожего на волокнистое стекло, твердого вещества, т. пл. >305oC; 1H ЯМР (500 МГц, DMSO-d6):  9,50 (d, J = 7,8 Гц, 1H), 8,39 (d, J = 9,7 Гц, 1H), 8,05 (d, J = 7,8 Гц, 1H), 7,55-7,47 (m, 3H), 7,33-7,29 (m, 1H), 3,55 (s, 0,3H диоксан, 3Н), 2,96 (s, 3Н); 13C ЯМР (125 МГц, DMSO-d6 при 40oC): ppm 168,99, 168,73, 158,05, 138,98, 138,93, 137,97, 134,13, 129,91, 127,73, 127,07, 126,59, 125,40, 125,22, 122,99, 121,18, 118,50, 115,75, 115,55, 114,81, 112,85, 112,78, 109,87, 109,67, 66,45 (диоксан), 23,66; ИК (KBr, см-1) 3263, 1756, 1702, 1694, 1629, 1494, 1455, 1374, 1291, 1256, 1222, 1168, 1156, 1110, 982, 869, 806, 755, 745, 704, 613; MS (отриц. ESI M-H–) m/z 373. Анал. Вычисл. C21H11FN2O2S 9,50 (d, J = 7,8 Гц, 1H), 8,39 (d, J = 9,7 Гц, 1H), 8,05 (d, J = 7,8 Гц, 1H), 7,55-7,47 (m, 3H), 7,33-7,29 (m, 1H), 3,55 (s, 0,3H диоксан, 3Н), 2,96 (s, 3Н); 13C ЯМР (125 МГц, DMSO-d6 при 40oC): ppm 168,99, 168,73, 158,05, 138,98, 138,93, 137,97, 134,13, 129,91, 127,73, 127,07, 126,59, 125,40, 125,22, 122,99, 121,18, 118,50, 115,75, 115,55, 114,81, 112,85, 112,78, 109,87, 109,67, 66,45 (диоксан), 23,66; ИК (KBr, см-1) 3263, 1756, 1702, 1694, 1629, 1494, 1455, 1374, 1291, 1256, 1222, 1168, 1156, 1110, 982, 869, 806, 755, 745, 704, 613; MS (отриц. ESI M-H–) m/z 373. Анал. Вычисл. C21H11FN2O2S 0,3диоксан 0,3диоксан 1,5H2O: C, 65,93; H, 3,44; N, 6,93; H2O, 0,89. Найдено: C, 65,86; H, 3,43; N, 6,68; H2O, 0,56.
Пример 22 1,5H2O: C, 65,93; H, 3,44; N, 6,93; H2O, 0,89. Найдено: C, 65,86; H, 3,43; N, 6,68; H2O, 0,56.
Пример 223-Фтор-6-метил-13-[2,3,4,6-тетра-O-(фенилметил) –  – D-глюкопиранозил – D-глюкопиранозил 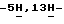 бензо[b] тиенил[2,3-a]-пиррол[3,4-c]карбазол-5,7 бензо[b] тиенил[2,3-a]-пиррол[3,4-c]карбазол-5,7  дион (VIII: X1 = F; X2 = X’1 = X’2 = H; Q = S; R6 = Me; PG = R”’ = бензил).
Диизопропил азодикарбоксилат (4,6 мл, 24,0 ммол, 4,5 экв.) добавляют по каплям к охлажденной (0oC) легкой суспензии 3-фтор-6-метил дион (VIII: X1 = F; X2 = X’1 = X’2 = H; Q = S; R6 = Me; PG = R”’ = бензил).
Диизопропил азодикарбоксилат (4,6 мл, 24,0 ммол, 4,5 экв.) добавляют по каплям к охлажденной (0oC) легкой суспензии 3-фтор-6-метил 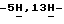 бензо[b] тиенил[2,3-a] -пиррол[3,4-c]карбазол-5,7-диона (2,0 г, 5,34 ммол), 2,3,4,6-тетра-O-бензил-В-глюкопиранозы (8,67 г, 16,03 ммол, 3,0 экв.) и трифенилфосфина (6,31 г, 24,0 ммол, 4,5 экв.) в безводном тетрагидрофуране (200 мл). Смесь перемешивают при 0oC в течение 1 часа, а затем ее разбавляют этилацетатом и промывают 0,1N соляной кислотой и рассолом. Последующие высушивание и концентрирование растворителя, очистка остатка флеш-хроматографией на силикагеле (элюирование 10% этилацетата в гексане и затем 15% этилацетата в гексане) дает вышеназванное соединение (4,60 г, 96%) в виде желтой пены, т. пл. 64-70oC; 1H ЯМР (500 МГц, DMSO-d6, смесь поворотных (конформационных) изомеров 1: 1): бензо[b] тиенил[2,3-a] -пиррол[3,4-c]карбазол-5,7-диона (2,0 г, 5,34 ммол), 2,3,4,6-тетра-O-бензил-В-глюкопиранозы (8,67 г, 16,03 ммол, 3,0 экв.) и трифенилфосфина (6,31 г, 24,0 ммол, 4,5 экв.) в безводном тетрагидрофуране (200 мл). Смесь перемешивают при 0oC в течение 1 часа, а затем ее разбавляют этилацетатом и промывают 0,1N соляной кислотой и рассолом. Последующие высушивание и концентрирование растворителя, очистка остатка флеш-хроматографией на силикагеле (элюирование 10% этилацетата в гексане и затем 15% этилацетата в гексане) дает вышеназванное соединение (4,60 г, 96%) в виде желтой пены, т. пл. 64-70oC; 1H ЯМР (500 МГц, DMSO-d6, смесь поворотных (конформационных) изомеров 1: 1):  9,87 и 9,78 (2m, 1H), 9,00-8,99 и 8,85-8,83 (2m, 1H), 8,11-8,02 (2m, 1,5H), 7,73 (d, J = 7,2 Гц, 1H), 7,58-7,54 (m, 2,5H), 7,38-7,23 (m, 15H), 7,18 (d, J = 7,9 Гц, 1H), 6,84 (t, J = 7,4 Гц, 0,5H), 6,78-6,75 (m, 0,5H), 6,67 (t, J = 7,6 Гц, 1H), 6,55 (t, J = 7,5 Гц, 1H), 6,51 (d, J = 8,8 Гц, 0,5H), 6,43 (d, J = 9,2 Гц, 0,5H), 6,12-6,10 (m, 2H), 4,95 (d, J = 10,9 Гц, 0,5H), 4,88-4,79 (m, 3H), 4,74-4,65 (m, 1H), 4,58-4,48 (m, 2,5H), 4,36-4,29 (m, 1,5H), 4,24-4,20 (m, 0,5H), 4,14 (br s, 0,5H), 4,11-4,00 (m, 3H), 3,93 (d, J = 10,6 Гц, 0,5H), 3,87 (br s, 1H), 3,18 (s, 3H); ИК (KBr, см-1) 3423, 2920, 2866, 1759, 1699, 1622, 1481, 1453, 1380, 1283, 1255, 1213, 1180, 1160, 1089, 744, 697; MS (FAB, M+), m/z 896.
Пример 23 9,87 и 9,78 (2m, 1H), 9,00-8,99 и 8,85-8,83 (2m, 1H), 8,11-8,02 (2m, 1,5H), 7,73 (d, J = 7,2 Гц, 1H), 7,58-7,54 (m, 2,5H), 7,38-7,23 (m, 15H), 7,18 (d, J = 7,9 Гц, 1H), 6,84 (t, J = 7,4 Гц, 0,5H), 6,78-6,75 (m, 0,5H), 6,67 (t, J = 7,6 Гц, 1H), 6,55 (t, J = 7,5 Гц, 1H), 6,51 (d, J = 8,8 Гц, 0,5H), 6,43 (d, J = 9,2 Гц, 0,5H), 6,12-6,10 (m, 2H), 4,95 (d, J = 10,9 Гц, 0,5H), 4,88-4,79 (m, 3H), 4,74-4,65 (m, 1H), 4,58-4,48 (m, 2,5H), 4,36-4,29 (m, 1,5H), 4,24-4,20 (m, 0,5H), 4,14 (br s, 0,5H), 4,11-4,00 (m, 3H), 3,93 (d, J = 10,6 Гц, 0,5H), 3,87 (br s, 1H), 3,18 (s, 3H); ИК (KBr, см-1) 3423, 2920, 2866, 1759, 1699, 1622, 1481, 1453, 1380, 1283, 1255, 1213, 1180, 1160, 1089, 744, 697; MS (FAB, M+), m/z 896.
Пример 233-Фтор-6-метил-13 -[  – D-глюкопиранозил – D-глюкопиранозил  бензо[b]тиенил[2,3-a] -пиррол[3,4-c] карбазол-5,7 бензо[b]тиенил[2,3-a] -пиррол[3,4-c] карбазол-5,7  дион (Ia: X1 = F; X2 = X’1 = X’2 = H; Q = S; R6 = Me; R2-R5 = OH).
К охлажденному (0oC), перемешиваемому раствору 3-фтор-6-метил-13-[2,3,4,6-тетра-O-(фенилметил) – дион (Ia: X1 = F; X2 = X’1 = X’2 = H; Q = S; R6 = Me; R2-R5 = OH).
К охлажденному (0oC), перемешиваемому раствору 3-фтор-6-метил-13-[2,3,4,6-тетра-O-(фенилметил) – – D-глюкопиранозил – D-глюкопиранозил  бензо[b]-тиенил[2,3-a] -пиррол[3,4-c]карбазол-5,7 бензо[b]-тиенил[2,3-a] -пиррол[3,4-c]карбазол-5,7  диона (4,5 г, 5,02 ммол) в этантиоле (30 мл) добавляют холодный (0oC) эфират трехфтористого бора (6,36 мл, 50,2 ммол). Смесь перемешивают при 0oC в течение 1 час, а затем продолжают перемешивание при комнатной температуре всего в течение 48 час. Добавляют дополнительно эфират трехфтористого бора (3,2 мл) через 12 час и 24 час. Растворитель удаляют в вакууме и оставшийся остаток обрабатывают смесью этилацетат/тетрагидрофуран и промывают 1N соляной кислотой и рассолом, после чего сушат и концентрируют растворитель. Очистка остатка флеш-хроматографией на силикагеле (элюирование 10% метанола в хлороформе и затем 15% метанола в хлороформе) дает вышеназванное соединение (2,53 г, 94%) в виде желтого твердого вещества, т.пл. >305oC; 1H ЯМР (500 МГц, DMSO-d6): диона (4,5 г, 5,02 ммол) в этантиоле (30 мл) добавляют холодный (0oC) эфират трехфтористого бора (6,36 мл, 50,2 ммол). Смесь перемешивают при 0oC в течение 1 час, а затем продолжают перемешивание при комнатной температуре всего в течение 48 час. Добавляют дополнительно эфират трехфтористого бора (3,2 мл) через 12 час и 24 час. Растворитель удаляют в вакууме и оставшийся остаток обрабатывают смесью этилацетат/тетрагидрофуран и промывают 1N соляной кислотой и рассолом, после чего сушат и концентрируют растворитель. Очистка остатка флеш-хроматографией на силикагеле (элюирование 10% метанола в хлороформе и затем 15% метанола в хлороформе) дает вышеназванное соединение (2,53 г, 94%) в виде желтого твердого вещества, т.пл. >305oC; 1H ЯМР (500 МГц, DMSO-d6):  9,85 и 9,71 (2d, J = 7,4 и 7,5 Гц, 1H), 8,96 и 8,89 (2d, J = 9,64 и 9,6 Гц, 1H), 8,13-8,05 (2m, 1,25H), 7,99 (dd, J = 9,0, 4,5 Гц, 0,75H), 7,61-7,41 (3m, 3H), 6,26 и 6,09 (2d, J = 8,8 и 9,3 Гц, 1H), 5,36-5,33 (3H), 4,84-4,72 (m, 1,5H), 4,04-3,98 (m, 1H), 3,92-3,86 (m, 1,75H), 3,76-3,68 (m, 2H), 3,63-3,54 (m, 1,75H), 3,16 (s, 3H); 13C ЯМР (125 МГц, DMSO-d6): ppm 169,34, 169,19, 169,04, 158,81, 156,95, 140,06, 138,48, 137,05, 133,12, 131,70, 131,49, 130,85, 129,75, 128,36, 127,40, 127,20, 126,52, 125,78, 125,71, 125,39, 122,80, 122,66, 122,35, 119,81, 116,33, 116,08, 115,94, 115,74, 110,70, 110,50, 105,28, 87,77, 81,36, 77,72, 70,89, 69,86, 61,28, 24,33; ИК (KBr, см-1) 3428, 1756, 1694, 1622, 1481, 1460, 1448, 1384, 1084, 745; MS (отриц. ESI M-H–) m/z 535.
Пример 24 9,85 и 9,71 (2d, J = 7,4 и 7,5 Гц, 1H), 8,96 и 8,89 (2d, J = 9,64 и 9,6 Гц, 1H), 8,13-8,05 (2m, 1,25H), 7,99 (dd, J = 9,0, 4,5 Гц, 0,75H), 7,61-7,41 (3m, 3H), 6,26 и 6,09 (2d, J = 8,8 и 9,3 Гц, 1H), 5,36-5,33 (3H), 4,84-4,72 (m, 1,5H), 4,04-3,98 (m, 1H), 3,92-3,86 (m, 1,75H), 3,76-3,68 (m, 2H), 3,63-3,54 (m, 1,75H), 3,16 (s, 3H); 13C ЯМР (125 МГц, DMSO-d6): ppm 169,34, 169,19, 169,04, 158,81, 156,95, 140,06, 138,48, 137,05, 133,12, 131,70, 131,49, 130,85, 129,75, 128,36, 127,40, 127,20, 126,52, 125,78, 125,71, 125,39, 122,80, 122,66, 122,35, 119,81, 116,33, 116,08, 115,94, 115,74, 110,70, 110,50, 105,28, 87,77, 81,36, 77,72, 70,89, 69,86, 61,28, 24,33; ИК (KBr, см-1) 3428, 1756, 1694, 1622, 1481, 1460, 1448, 1384, 1084, 745; MS (отриц. ESI M-H–) m/z 535.
Пример 243-Фтор-13 -[  – D-глюкопиранозил – D-глюкопиранозил  бензо[b] тиенил[2,3-a]-пиррол[3,4-c] карбазол-5,7 бензо[b] тиенил[2,3-a]-пиррол[3,4-c] карбазол-5,7  дион (Ia: R2-R5 = OH; R6 = X2 = X’1 = X’2 = H; Q = S).
3-Фтор-6-метил-13 -[ дион (Ia: R2-R5 = OH; R6 = X2 = X’1 = X’2 = H; Q = S).
3-Фтор-6-метил-13 -[ – D-глюкопиранозил – D-глюкопиранозил  бензо[b]тиенил[2,3-a] -пиррол[3,4-c] карбазол-5,7 бензо[b]тиенил[2,3-a] -пиррол[3,4-c] карбазол-5,7  дион (0,2 г, 0,37 ммол) суспендируют в водном 10% растворе гидроксида калия (30 мл) в атмосфере азота. Смесь осторожно кипятят с обратным холодильником в течение 3 час и затем титруют концентрированной HCl, пока не образуется плотный осадок. Осадок обрабатывают смесью этилацетат/тетрагидрофуран и промывают 1N соляной кислотой и рассолом, после чего сушат и концентрируют растворитель. Остаток растворяют в абсолютном этаноле (1 мл) и добавляют твердый ацетат аммония (3,0 г). Смесь плавят при 150oC в течение 3 час, затем охлаждают, разбавляют смесью этилацетат/тетрагидрофуран и промывают 1N соляной кислотой, рассолом, сушат и концентрируют растворитель. Очистка этого остатка флеш-хроматографией на силикагеле (элюирование 30% тетрагидрофурана в хлороформе и затем 50% тетрагидрофурана в хлороформе) дает вышеназванное соединение (69,5 мг, 36%) в виде желтого твердого вещества, т.пл. >305oC; 1H ЯМР (500 МГц, DMSO-d6): дион (0,2 г, 0,37 ммол) суспендируют в водном 10% растворе гидроксида калия (30 мл) в атмосфере азота. Смесь осторожно кипятят с обратным холодильником в течение 3 час и затем титруют концентрированной HCl, пока не образуется плотный осадок. Осадок обрабатывают смесью этилацетат/тетрагидрофуран и промывают 1N соляной кислотой и рассолом, после чего сушат и концентрируют растворитель. Остаток растворяют в абсолютном этаноле (1 мл) и добавляют твердый ацетат аммония (3,0 г). Смесь плавят при 150oC в течение 3 час, затем охлаждают, разбавляют смесью этилацетат/тетрагидрофуран и промывают 1N соляной кислотой, рассолом, сушат и концентрируют растворитель. Очистка этого остатка флеш-хроматографией на силикагеле (элюирование 30% тетрагидрофурана в хлороформе и затем 50% тетрагидрофурана в хлороформе) дает вышеназванное соединение (69,5 мг, 36%) в виде желтого твердого вещества, т.пл. >305oC; 1H ЯМР (500 МГц, DMSO-d6):  11,67 (s, 0,25H), 11,53 и 11,51 (2s, 1H), 9,95-9,93 и 9,91-9,89 (2m, 1H), 9,02 и 8,97 (2dd, J = 9,8, 2,7 и 9,7, 2,8 Гц, 1H), 8,24-8,23 и 8,18-8,16 (2m, 1H), 8,08 и 8,01 (2dd, J = 9,4, 4,4 и 9,1, 4,6 Гц, 1H), 7,69-7,63 (m, 2H), 7,54-7,48 (m, 1H), 6,34 и 6,09 (2d, J = 8,9 и 9,4 Гц, 1H), 5,37-5,35 (m, 1H), 5,28 и 5,22 (2br m, 2H), 4,75 (br m, 0,75H), 4,04 и 3,87-3,75 (2m, 3H), 3,68-3,58 (m, 2H), 3,55-3,52 (m, 2H); 13C ЯМР (125 МГц, DMSO-d6): ppm 170,39, 170,16, 158,76, 156,89, 140,05, 138,34, 136,87, 133,09, 131,76, 128,32, 127,28, 126,62, 125,64, 122,64, 120,60, 116,16, 115,95, 115,84, 110,76, 110,56, 107,35, 87,71, 81,13, 77,45, 70,74, 69,79, 67,01, 61,23; ИК (KBr, см-1) 3392, 1747, 1705, 1625, 1481, 1462, 1430, 1326, 1284, 1262, 1180, 1087, 804, 758, 747; HRMS (отриц. ESI M-H–) вычисл. для C26H18FN2O7S 521,0897, наблюд. 521,0802.
Пример 25 11,67 (s, 0,25H), 11,53 и 11,51 (2s, 1H), 9,95-9,93 и 9,91-9,89 (2m, 1H), 9,02 и 8,97 (2dd, J = 9,8, 2,7 и 9,7, 2,8 Гц, 1H), 8,24-8,23 и 8,18-8,16 (2m, 1H), 8,08 и 8,01 (2dd, J = 9,4, 4,4 и 9,1, 4,6 Гц, 1H), 7,69-7,63 (m, 2H), 7,54-7,48 (m, 1H), 6,34 и 6,09 (2d, J = 8,9 и 9,4 Гц, 1H), 5,37-5,35 (m, 1H), 5,28 и 5,22 (2br m, 2H), 4,75 (br m, 0,75H), 4,04 и 3,87-3,75 (2m, 3H), 3,68-3,58 (m, 2H), 3,55-3,52 (m, 2H); 13C ЯМР (125 МГц, DMSO-d6): ppm 170,39, 170,16, 158,76, 156,89, 140,05, 138,34, 136,87, 133,09, 131,76, 128,32, 127,28, 126,62, 125,64, 122,64, 120,60, 116,16, 115,95, 115,84, 110,76, 110,56, 107,35, 87,71, 81,13, 77,45, 70,74, 69,79, 67,01, 61,23; ИК (KBr, см-1) 3392, 1747, 1705, 1625, 1481, 1462, 1430, 1326, 1284, 1262, 1180, 1087, 804, 758, 747; HRMS (отриц. ESI M-H–) вычисл. для C26H18FN2O7S 521,0897, наблюд. 521,0802.
Пример 253,9-Дифтор-12,13-дигидро-13-[3,6-O-(трет. бутилдиметилсилил) –  – D-глюкопиранозил] – D-глюкопиранозил]  индол[2,3-a] пиррол[3,4-c] карбазол-5,7(6-N-[4-(трет.бутил)бензил] -)-дион (Ib: X1 = X’1 = F; X2 = X’2 = H; R6 = 4-(трет.бутил)бензил; Q = NH, R2 = R4 = OH; R3 = R5 = трет.бутилдиметилсилилокси).
К перемешиваемому магнитной мешалкой раствору продукта из примера 12 (750 мг, 1,12 ммол) и имидазола (1,9 г, 28 ммол) в безводном ДМФА (14 мл) в атмосфере N2 при перемешивании добавляют при помощи шприца трет.бутилдиметилсилил трифторметансульфонат (2,96 г, 2,57 мл, 11,2 ммол). Реакцию перемешивают при комнатной температуре в течение 1 часа и гасят абсолютным этанолом (5 мл). Смесь разбавляют этилацетатом (150 мл) и промывают водой (6 х 100 мл), рассолом (100 мл) и сушат (Na2SO4). Этот продукт используют непосредственно в следующей стадии без дополнительной очистки. Аналитически чистый образец очищен флеш-хроматографией на силикагеле смесью гексан/метиленхлорид: 300 МГц 1H ЯМР (CDCl3): индол[2,3-a] пиррол[3,4-c] карбазол-5,7(6-N-[4-(трет.бутил)бензил] -)-дион (Ib: X1 = X’1 = F; X2 = X’2 = H; R6 = 4-(трет.бутил)бензил; Q = NH, R2 = R4 = OH; R3 = R5 = трет.бутилдиметилсилилокси).
К перемешиваемому магнитной мешалкой раствору продукта из примера 12 (750 мг, 1,12 ммол) и имидазола (1,9 г, 28 ммол) в безводном ДМФА (14 мл) в атмосфере N2 при перемешивании добавляют при помощи шприца трет.бутилдиметилсилил трифторметансульфонат (2,96 г, 2,57 мл, 11,2 ммол). Реакцию перемешивают при комнатной температуре в течение 1 часа и гасят абсолютным этанолом (5 мл). Смесь разбавляют этилацетатом (150 мл) и промывают водой (6 х 100 мл), рассолом (100 мл) и сушат (Na2SO4). Этот продукт используют непосредственно в следующей стадии без дополнительной очистки. Аналитически чистый образец очищен флеш-хроматографией на силикагеле смесью гексан/метиленхлорид: 300 МГц 1H ЯМР (CDCl3):  10,06 (br s, 1H), 9,12 (dd, 1H, J = 9,2, 2,7 Гц), 7,88-7,81 (m, 1H), 7,72 (dd, 1H, J = 9,2, 3,9 Гц), 7,41 (ddd, 1H, J = 8,9, 8,9, 2,6 Гц), 7,25 (dd, 1H, J = 9,0, 4,1 Гц), 7,20-6,99 (m, 4H), 6,99 (ddd, 1H, J = 8,7, 8,7, 2,4 Гц), 5,97 (d, 1H, J = 8,9 Гц), 4,58-3,90 (m, 8H), 1,18 (s, 9H), 0,91 (s, 9H), 0,83 (s, 9H), 0,27 (s, 3H), 0,10 (s, 3H), 0,05 (s, 3H), -0,02 (s, 3H); FAB масс-спектр, m/e 897 (M+).
Пример 26 10,06 (br s, 1H), 9,12 (dd, 1H, J = 9,2, 2,7 Гц), 7,88-7,81 (m, 1H), 7,72 (dd, 1H, J = 9,2, 3,9 Гц), 7,41 (ddd, 1H, J = 8,9, 8,9, 2,6 Гц), 7,25 (dd, 1H, J = 9,0, 4,1 Гц), 7,20-6,99 (m, 4H), 6,99 (ddd, 1H, J = 8,7, 8,7, 2,4 Гц), 5,97 (d, 1H, J = 8,9 Гц), 4,58-3,90 (m, 8H), 1,18 (s, 9H), 0,91 (s, 9H), 0,83 (s, 9H), 0,27 (s, 3H), 0,10 (s, 3H), 0,05 (s, 3H), -0,02 (s, 3H); FAB масс-спектр, m/e 897 (M+).
Пример 263,9-Дифтор-12,13-дигидро-13-[3-O-(трет.бутилдиметилсилил) –  – D-глюкопиранозил] – D-глюкопиранозил]  индол[2,3-a] пиррол[3,4-c] карбазол-5,7(6-N-[4-(трет. бутил)бензил] -)-дион (Ib: X1 = X’1 = F; X2 = X’2 = H; R6 = 4-(трет.бутил)бензил; Q = NH, R2 = R4 = OH; R3 = трет.бутилдиметилсилилокси).
К перемешиваемому магнитной мешалкой раствору неочищенного продукта из примера 25 при -5oC добавляют смесь трифторуксусной кислоты: воды 9:1, предварительно охлажденной до -5oC. Реакцию перемешивают при -5oC в течение 45 мин, разбавляют этилацетатом (200 мл), промывают насыщенным водным раствором бикарбоната натрия (6 х 150 мл), водой (1 х 150 мл), рассолом (1 х 150 мл) и сушат (Na2SO4). Упаривание в вакууме и последующая флеш-хроматография на силикагеле смесью 1-10% метанола в метиленхлориде дают 59 мг (6%) исходного продукта (ср. соединение примера 25), 78 мг (10% полностью десилилированного продукта (ср. соединение примера 12)и 585 мг (74%) чистого вышеназванного продукта в виде желтого твердого вещества: 500 МГц COSY 1H ЯМР (DMSO-d6) индол[2,3-a] пиррол[3,4-c] карбазол-5,7(6-N-[4-(трет. бутил)бензил] -)-дион (Ib: X1 = X’1 = F; X2 = X’2 = H; R6 = 4-(трет.бутил)бензил; Q = NH, R2 = R4 = OH; R3 = трет.бутилдиметилсилилокси).
К перемешиваемому магнитной мешалкой раствору неочищенного продукта из примера 25 при -5oC добавляют смесь трифторуксусной кислоты: воды 9:1, предварительно охлажденной до -5oC. Реакцию перемешивают при -5oC в течение 45 мин, разбавляют этилацетатом (200 мл), промывают насыщенным водным раствором бикарбоната натрия (6 х 150 мл), водой (1 х 150 мл), рассолом (1 х 150 мл) и сушат (Na2SO4). Упаривание в вакууме и последующая флеш-хроматография на силикагеле смесью 1-10% метанола в метиленхлориде дают 59 мг (6%) исходного продукта (ср. соединение примера 25), 78 мг (10% полностью десилилированного продукта (ср. соединение примера 12)и 585 мг (74%) чистого вышеназванного продукта в виде желтого твердого вещества: 500 МГц COSY 1H ЯМР (DMSO-d6)  11,80 (brs, 1H), 8,82 (dd, 1H, J = 9,6, 2,7 Гц), 8,76 (dd, 1H, J = 9,7, 2,7 Гц), 8,03 (dd, 1H, J = 9,2, 4,4 Гц), 7,68 (dd, 1H, J = 8,9, 4,5 Гц), 7,51-7,45 (m, 2H), 7,38-7,31 (m, 4H), 6,28 (d, 1H, J = 9,1 Гц, 1’H), 6,08 (t, 1H, J = 3,9 Гц, 6’OH), 5,35 (d, 1H, J = 6,8 Гц, 4’OH), 4,88 (s, 2H), 4,81 (d, 1H, J = 6,8 Гц, 2’OH), 4,12-4,08 (m, 1H, 6’H), 3,98-3,93 (m, 1H, 5’H), 3,93-3,90 (m, 1H, 4’H), 3,86-3,82 (m, 1H, 6’H), 3,73 (t, 1H, J = 8,8 Гц, 3’H), 3,39 (ddd, 1H, J = 9,1, 8,8, 6,8 Гц, 2’H), 1,23 (s, 9H), 0,76 (s, 9H), 0,07 (s, 3H), -0,03 (s, 3H); FAB масс-спектр, m/e 783 (M+).
Пример 27 11,80 (brs, 1H), 8,82 (dd, 1H, J = 9,6, 2,7 Гц), 8,76 (dd, 1H, J = 9,7, 2,7 Гц), 8,03 (dd, 1H, J = 9,2, 4,4 Гц), 7,68 (dd, 1H, J = 8,9, 4,5 Гц), 7,51-7,45 (m, 2H), 7,38-7,31 (m, 4H), 6,28 (d, 1H, J = 9,1 Гц, 1’H), 6,08 (t, 1H, J = 3,9 Гц, 6’OH), 5,35 (d, 1H, J = 6,8 Гц, 4’OH), 4,88 (s, 2H), 4,81 (d, 1H, J = 6,8 Гц, 2’OH), 4,12-4,08 (m, 1H, 6’H), 3,98-3,93 (m, 1H, 5’H), 3,93-3,90 (m, 1H, 4’H), 3,86-3,82 (m, 1H, 6’H), 3,73 (t, 1H, J = 8,8 Гц, 3’H), 3,39 (ddd, 1H, J = 9,1, 8,8, 6,8 Гц, 2’H), 1,23 (s, 9H), 0,76 (s, 9H), 0,07 (s, 3H), -0,03 (s, 3H); FAB масс-спектр, m/e 783 (M+).
Пример 273,9-Дифтор-12,13-дигидро-13-[3-O-(трет. бутилдиметилсилил)-6- O-(метансульфонил) –  – D-глюкопиранозил] – D-глюкопиранозил]  индол[2,3-a]пиррол[3,4-c]карбазол-5,7(6-N-[4-(трет. бутил)бензил] -)-дион (Ib: X1 = X’1 = F; X2 = X’2 = H; R6 = 4-(трет.бутил)бензил; Q = NH, R2 = R4 = OH; R3 = трет.бутилдиметилсилилокси; R5 = метансульфонилокси).
К перемешиваемому магнитной мешалкой раствору чистого продукта из примера 26 (403 мг, 0,514 ммол) в безводном пиридине (7 мл) при -10oC под аргоном добавляют при помощи шприца в течение 1 мин метансульфонил хлорид (46 мкл, 0,594 ммол). Спустя 70 мин при -10oC отбирают аликвоту, добавляют к смеси этилацетата и насыщенного водного сульфата меди (II) и анализируют методом ТСХ на силикагеле с использованием 1-2% метанола в метиленхлориде. Определяют наличие в основном исходного материала с небольшим количеством продукта с более высоким f. Добавляют дополнительно метансульфонил хлорид (32 мкл), и реакцию проводят еще в течение 1 часа при -10oC. Через интервалы в 30 мин реакцию обрабатывают следующими порциями метансульфонил хлорида (33 мкл, 31 мкл, 31 мкл и 24 мкл). Спустя в целом 5 час при -10oC ТСХ показывает основное пятно продукта и немного исходного вещества с более низким Rf. Спустя еще 1,5 часа температуре реакции дают подняться до -1oC от -10oC. Реакционную смесь гасят добавлением 200 мкл абсолютного этанола, перемешивают в течение 5 мин и распределяют между этилацетатом (600 мл) и насыщенным водным сульфатом меди (II) (250 мл). Органический слой промывают насыщенным водным сульфатом меди (II) (200 мл), водой (200 мл) и рассолом (200 мл) и сушат (Na2SO4). Упаривание в вакууме и последующая флеш-хроматография на силикагеле 1% метанола в метиленхлориде дают 404 мг (91%) чистого вышеназванного продукта и 40 мг вернувшегося исходного вещества: 300 МГц 1H ЯМР (CDCl3): индол[2,3-a]пиррол[3,4-c]карбазол-5,7(6-N-[4-(трет. бутил)бензил] -)-дион (Ib: X1 = X’1 = F; X2 = X’2 = H; R6 = 4-(трет.бутил)бензил; Q = NH, R2 = R4 = OH; R3 = трет.бутилдиметилсилилокси; R5 = метансульфонилокси).
К перемешиваемому магнитной мешалкой раствору чистого продукта из примера 26 (403 мг, 0,514 ммол) в безводном пиридине (7 мл) при -10oC под аргоном добавляют при помощи шприца в течение 1 мин метансульфонил хлорид (46 мкл, 0,594 ммол). Спустя 70 мин при -10oC отбирают аликвоту, добавляют к смеси этилацетата и насыщенного водного сульфата меди (II) и анализируют методом ТСХ на силикагеле с использованием 1-2% метанола в метиленхлориде. Определяют наличие в основном исходного материала с небольшим количеством продукта с более высоким f. Добавляют дополнительно метансульфонил хлорид (32 мкл), и реакцию проводят еще в течение 1 часа при -10oC. Через интервалы в 30 мин реакцию обрабатывают следующими порциями метансульфонил хлорида (33 мкл, 31 мкл, 31 мкл и 24 мкл). Спустя в целом 5 час при -10oC ТСХ показывает основное пятно продукта и немного исходного вещества с более низким Rf. Спустя еще 1,5 часа температуре реакции дают подняться до -1oC от -10oC. Реакционную смесь гасят добавлением 200 мкл абсолютного этанола, перемешивают в течение 5 мин и распределяют между этилацетатом (600 мл) и насыщенным водным сульфатом меди (II) (250 мл). Органический слой промывают насыщенным водным сульфатом меди (II) (200 мл), водой (200 мл) и рассолом (200 мл) и сушат (Na2SO4). Упаривание в вакууме и последующая флеш-хроматография на силикагеле 1% метанола в метиленхлориде дают 404 мг (91%) чистого вышеназванного продукта и 40 мг вернувшегося исходного вещества: 300 МГц 1H ЯМР (CDCl3):  9,83 (brs, 1H), 9,08 (dd, 1H), 7,80-7,71 (m, 1H), 7,68 (dd, 1H), 7,52 (dd, 1H), 7,40 (ddd, 1H), 7,21-7,13 (m, 2H), 7,03-6,68 (m, 3H), 5,94 (d, 1H), 5,15-3,92 (m, 10H), 3,02 (s, 3H), 1,19 (s, 9H), 0,84 (s, 9H), 0,23 (s, 3H), -0,01 (s, 3H); FAB масс-спектр, m/e 861 (M+).
Пример 28 9,83 (brs, 1H), 9,08 (dd, 1H), 7,80-7,71 (m, 1H), 7,68 (dd, 1H), 7,52 (dd, 1H), 7,40 (ddd, 1H), 7,21-7,13 (m, 2H), 7,03-6,68 (m, 3H), 5,94 (d, 1H), 5,15-3,92 (m, 10H), 3,02 (s, 3H), 1,19 (s, 9H), 0,84 (s, 9H), 0,23 (s, 3H), -0,01 (s, 3H); FAB масс-спектр, m/e 861 (M+).
Пример 283,9-Дифтор-12,13-дигидро-13-[3-O-(трет. бутилдиметилсилил)- 6-(4N-морфолин) –  – D-глюкопиранозил] – D-глюкопиранозил]  индол[2,3-a] пиррол[3,4-c] карбазол-5,7(6-N-[4-(трет. бутил)бензил]-)-дион (Ib: X1 = X’1 = F; X2 = X’2 = H; R6 = 4-(трет.бутил)бензил; Q = NH, R2 = R4 = OH; R3 = трет.бутилдиметилсилилокси; R5 = морфолин).
К перемешиваемому магнитной мешалкой раствору чистого продукта из примера 27 (193 мг, 0,224 ммол) в безводном ДМСО (5 мл) под азотом добавляют морфолин (210 мкл, 2,41 ммол). Полученную красную реакционную смесь перемешивают в течение 69 час при 47oC и распределяют между этилацетатом (350 мл) и насыщенным водным раствором бикарбоната натрия (75 мл). Органический слой промывают водой (4 х 70 мл) и рассолом (75 мл) и сушат (Na2SO4). Упаривание в вакууме и последующая флеш-хроматография на силикагеле 20-25% этилацетата в метиленхлориде дают 9 мг (5% вернувшегося исходного вещества и затем 102 мг (53%; 56% на вернувшийся исходный материал) чистого вышеназванного продукта в виде желтого твердого вещества: 300 МГц 1H ЯМР (CDCl3): индол[2,3-a] пиррол[3,4-c] карбазол-5,7(6-N-[4-(трет. бутил)бензил]-)-дион (Ib: X1 = X’1 = F; X2 = X’2 = H; R6 = 4-(трет.бутил)бензил; Q = NH, R2 = R4 = OH; R3 = трет.бутилдиметилсилилокси; R5 = морфолин).
К перемешиваемому магнитной мешалкой раствору чистого продукта из примера 27 (193 мг, 0,224 ммол) в безводном ДМСО (5 мл) под азотом добавляют морфолин (210 мкл, 2,41 ммол). Полученную красную реакционную смесь перемешивают в течение 69 час при 47oC и распределяют между этилацетатом (350 мл) и насыщенным водным раствором бикарбоната натрия (75 мл). Органический слой промывают водой (4 х 70 мл) и рассолом (75 мл) и сушат (Na2SO4). Упаривание в вакууме и последующая флеш-хроматография на силикагеле 20-25% этилацетата в метиленхлориде дают 9 мг (5% вернувшегося исходного вещества и затем 102 мг (53%; 56% на вернувшийся исходный материал) чистого вышеназванного продукта в виде желтого твердого вещества: 300 МГц 1H ЯМР (CDCl3):  10,03 (brs, 1H), 9,09 (dd, 1H), 8,02-7,96 (m, 1H), 7,69 (dd, 1H), 7,39 (ddd, 1H), 7,30-7,23 (m, 1H), 7,21-7,17 (m, 2H), 7,07-6,96 (m, 3H), 5,96 (d, 1H), 4,53-3,93 (m, 6H), 3,72-3,57 (m, 4H), 3,19-2,98 (m, 2H), 2,82-2,71 (m, 2H), 2,68-2,58 (m, 2H), 1,19 (s, 9H), 0,88 (s, 9H), 0,27 (s, 3H), 0,08 (s, 3H); ESI (отриц.) масс-спектр, m/e 851 (M-H–).
Пример 29 10,03 (brs, 1H), 9,09 (dd, 1H), 8,02-7,96 (m, 1H), 7,69 (dd, 1H), 7,39 (ddd, 1H), 7,30-7,23 (m, 1H), 7,21-7,17 (m, 2H), 7,07-6,96 (m, 3H), 5,96 (d, 1H), 4,53-3,93 (m, 6H), 3,72-3,57 (m, 4H), 3,19-2,98 (m, 2H), 2,82-2,71 (m, 2H), 2,68-2,58 (m, 2H), 1,19 (s, 9H), 0,88 (s, 9H), 0,27 (s, 3H), 0,08 (s, 3H); ESI (отриц.) масс-спектр, m/e 851 (M-H–).
Пример 293,9-Дифтор-12,13-дигидро-13-[6-(4N-морфолин) –  – D-глюкопиранозил] – D-глюкопиранозил]  индол[2,3-a]пиррол[3,4-c]карбазол-5,7(6-N-[4-(трет.бутил)бензил]-)-дион (Ia: X1 = X’1 = F; X2 = X’2 = R6 = H; R5 = 4N-морфолин; Q = NH, R2 = R4 = OH).
К перемешиваемому магнитной мешалкой раствору чистого продукта из примера 28 (205 мг, 0,240 ммол) в абсолютном этаноле (160 мл) добавляют водный гидроксид калия (4,45 М, 42 мл, 187 ммол). Полученный темно-красный раствор нагревают в открытой колбе, пока весь этанол не испарится и останется твердое тягучее вещество (приблизительно 1,5 час). Смесь охлаждают в токе азота и добавляют концентрированную HCI (12N; 17 мл, 204 ммол). Смесь перемешивают 5 мин и добавляют абсолютный этанол (90 мл) и затем твердый ацетат аммония (85 г). Смесь нагревают при перемешивании в открытой колбе почти до кипения в течение 2,5-3 час, затем до 180oC (внутренняя температура плавления) приблизительно за 2 часа. Затем смесь нагревают далее до 200oC в течение 10-15 мин, быстро охлаждают в струе азота до 50-60oC и обрабатывают водой (200 мл), насыщенным водным бикарбонатом натрия (200 мл) и этилацетатом (800 мл). Органический слой промывают рассолом (200 мл), объединенные водные слои экстрагируют свежим этилацетатом (300 мл) и последний экстракт промывают рассолом (100 мл). Объединенный органический экстракт сушат (Na2SO4) и упаривают в вакууме. Сырой продукт растворяют в метаноле (400 мл) и обрабатывают безводным карбонатом калия (2,0 г) и дигидратом фтористого калия (1,03 г) и перемешивают при комнатной температуре в течение 15 час. Растворитель упаривают в вакууме, остаток снова растворяют в метаноле (250 мл), обрабатывают 1N HCI (15 мл) и упаривают в вакууме. Остаток растворяют в абсолютном этаноле (500 мл), упаривают в вакууме и этот процесс повторяют снова. Перекристаллизация из 95% этанола дает 79,6 мг (53%, 2 порции) чистого вышеназванного соединения в виде его HCl-соли: 500 МГц COSY 1H ЯМР (DMSO-d6): индол[2,3-a]пиррол[3,4-c]карбазол-5,7(6-N-[4-(трет.бутил)бензил]-)-дион (Ia: X1 = X’1 = F; X2 = X’2 = R6 = H; R5 = 4N-морфолин; Q = NH, R2 = R4 = OH).
К перемешиваемому магнитной мешалкой раствору чистого продукта из примера 28 (205 мг, 0,240 ммол) в абсолютном этаноле (160 мл) добавляют водный гидроксид калия (4,45 М, 42 мл, 187 ммол). Полученный темно-красный раствор нагревают в открытой колбе, пока весь этанол не испарится и останется твердое тягучее вещество (приблизительно 1,5 час). Смесь охлаждают в токе азота и добавляют концентрированную HCI (12N; 17 мл, 204 ммол). Смесь перемешивают 5 мин и добавляют абсолютный этанол (90 мл) и затем твердый ацетат аммония (85 г). Смесь нагревают при перемешивании в открытой колбе почти до кипения в течение 2,5-3 час, затем до 180oC (внутренняя температура плавления) приблизительно за 2 часа. Затем смесь нагревают далее до 200oC в течение 10-15 мин, быстро охлаждают в струе азота до 50-60oC и обрабатывают водой (200 мл), насыщенным водным бикарбонатом натрия (200 мл) и этилацетатом (800 мл). Органический слой промывают рассолом (200 мл), объединенные водные слои экстрагируют свежим этилацетатом (300 мл) и последний экстракт промывают рассолом (100 мл). Объединенный органический экстракт сушат (Na2SO4) и упаривают в вакууме. Сырой продукт растворяют в метаноле (400 мл) и обрабатывают безводным карбонатом калия (2,0 г) и дигидратом фтористого калия (1,03 г) и перемешивают при комнатной температуре в течение 15 час. Растворитель упаривают в вакууме, остаток снова растворяют в метаноле (250 мл), обрабатывают 1N HCI (15 мл) и упаривают в вакууме. Остаток растворяют в абсолютном этаноле (500 мл), упаривают в вакууме и этот процесс повторяют снова. Перекристаллизация из 95% этанола дает 79,6 мг (53%, 2 порции) чистого вышеназванного соединения в виде его HCl-соли: 500 МГц COSY 1H ЯМР (DMSO-d6):  12,67 (brs, 1H), 11,19 (s, 1H), 8,92 (dd, 1H, J = 9,7, 2,6 Гц), 8,79 (dd, 1H, J = 9,8, 2,3 Гц), 8,05 (dd, 1H, J = 9,0, 4,5 Гц), 7,94 (dd, 1H, J = 8,7, 4,5 Гц), 7,46 (ddd, 1H, J = 2,5, 8,9, 9,0 Гц), 7,41 (ddd, 1H, J = 2,6, 9,0, 9,1 Гц), 6,61 (d, 1H, J = 8,6 Гц, 1’H), 3,97 (t, 1H, J = 8,8 Гц, 2’H), 3,91-3,16 (m, 13H).
Пример 30 12,67 (brs, 1H), 11,19 (s, 1H), 8,92 (dd, 1H, J = 9,7, 2,6 Гц), 8,79 (dd, 1H, J = 9,8, 2,3 Гц), 8,05 (dd, 1H, J = 9,0, 4,5 Гц), 7,94 (dd, 1H, J = 8,7, 4,5 Гц), 7,46 (ddd, 1H, J = 2,5, 8,9, 9,0 Гц), 7,41 (ddd, 1H, J = 2,6, 9,0, 9,1 Гц), 6,61 (d, 1H, J = 8,6 Гц, 1’H), 3,97 (t, 1H, J = 8,8 Гц, 2’H), 3,91-3,16 (m, 13H).
Пример 303,9-Дифтор-12,13-дигидро-13-[6-азидо –  – D-глюкопиранозил] – D-глюкопиранозил] 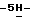 индол[2,3-a]пиррол[3,4-c]карбазол-5,7(6-гидрокси)-дион (Ic).
К перемешиваемому магнитной мешалкой раствору чистого 3,9-дифтор-12,13-дигидро-13-[6-азидо – индол[2,3-a]пиррол[3,4-c]карбазол-5,7(6-гидрокси)-дион (Ic).
К перемешиваемому магнитной мешалкой раствору чистого 3,9-дифтор-12,13-дигидро-13-[6-азидо – – D-глюкопиранозил] – D-глюкопиранозил] 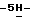 индол-[2,3-a] пиррол[3,4-c] карбазол-5,7[6(4-трет. бутилбензил)] -диона (20 мг, 0,029 ммол) в абсолютном этаноле (5 мл) добавляют водный гидроксид калия (4,45М, 1,1 мл, 4,9 ммол). Полученный темно-красный раствор нагревают в открытой колбе, пока весь этанол не испарится и останется твердое тягучее вещество (приблизительно 1,5 час). Смесь охлаждают в токе азота и добавляют абсолютный этанол (5 мл), а затем гидрохлорид гидроксиламина (685 мг). Смесь кипятят с обратным холодильником при перемешивании в течение 4 час, затем нагревают до 110oC (внутренняя температура плавления после того, как выпарен растворитель) в течение приблизительно 3 час. Смесь охлаждают в струе азота до комнатной температуры и обрабатывают 1N HCl (80 мл) и этилацетатом (400 мл). Органический слой промывают 1N HCl (3 х 50 мл), водой (2 х 50 мл) и рассолом (100 мл) и сушат (Na2SO4). Упаривание в вакууме и последующая очитка на колонке с Sephadex LH 20 элюированием метанолом (скорость потока 0,4-0,5 мл/мин) дают 4,3 мг (27%) вышеназванного продукта в виде желто-красного твердого вещества: IR (KBr) 2114 см-1; 500 МГц COSY 1H ЯМР (CD3OD) индол-[2,3-a] пиррол[3,4-c] карбазол-5,7[6(4-трет. бутилбензил)] -диона (20 мг, 0,029 ммол) в абсолютном этаноле (5 мл) добавляют водный гидроксид калия (4,45М, 1,1 мл, 4,9 ммол). Полученный темно-красный раствор нагревают в открытой колбе, пока весь этанол не испарится и останется твердое тягучее вещество (приблизительно 1,5 час). Смесь охлаждают в токе азота и добавляют абсолютный этанол (5 мл), а затем гидрохлорид гидроксиламина (685 мг). Смесь кипятят с обратным холодильником при перемешивании в течение 4 час, затем нагревают до 110oC (внутренняя температура плавления после того, как выпарен растворитель) в течение приблизительно 3 час. Смесь охлаждают в струе азота до комнатной температуры и обрабатывают 1N HCl (80 мл) и этилацетатом (400 мл). Органический слой промывают 1N HCl (3 х 50 мл), водой (2 х 50 мл) и рассолом (100 мл) и сушат (Na2SO4). Упаривание в вакууме и последующая очитка на колонке с Sephadex LH 20 элюированием метанолом (скорость потока 0,4-0,5 мл/мин) дают 4,3 мг (27%) вышеназванного продукта в виде желто-красного твердого вещества: IR (KBr) 2114 см-1; 500 МГц COSY 1H ЯМР (CD3OD)  8,53 (dd, 1H, J = 9,6, 2,1 Гц), 8,36 (dd, 1H, J = 9,5, 1,9 Гц), 7,68 (dd, 1H, J = 8,8, 3,7 Гц), 7,36 (dd, 1H, J = 8,8, 4,2 Гц), 7,24 (ddd, 1H, J = 8,7, 8,7, 2,0 Гц), 7,14 (ddd, 1H, J = 8,9, 8,8, 2,3 Гц), 5,98 (d, 1H, J = 9,0 Гц, 1’H), 4,47 (d, 1H, J = 12,1 Гц, 6’H), 4,28 (d, 1H, J = 12,1 Гц, 6”H), 4,11 (d, 1H, J = 9,4 Гц, 5’H), 3,91 (t, 1H, J = 9,4 Гц, 4’H), 3,61 (t, 1H, J = 9,0 Гц, 2’H), 3,46 (dd, 1H, J = 9,4, 9,0 Гц, 5’H); FAB масс-спектр, m/e 564 (M+).
Пример 31 8,53 (dd, 1H, J = 9,6, 2,1 Гц), 8,36 (dd, 1H, J = 9,5, 1,9 Гц), 7,68 (dd, 1H, J = 8,8, 3,7 Гц), 7,36 (dd, 1H, J = 8,8, 4,2 Гц), 7,24 (ddd, 1H, J = 8,7, 8,7, 2,0 Гц), 7,14 (ddd, 1H, J = 8,9, 8,8, 2,3 Гц), 5,98 (d, 1H, J = 9,0 Гц, 1’H), 4,47 (d, 1H, J = 12,1 Гц, 6’H), 4,28 (d, 1H, J = 12,1 Гц, 6”H), 4,11 (d, 1H, J = 9,4 Гц, 5’H), 3,91 (t, 1H, J = 9,4 Гц, 4’H), 3,61 (t, 1H, J = 9,0 Гц, 2’H), 3,46 (dd, 1H, J = 9,4, 9,0 Гц, 5’H); FAB масс-спектр, m/e 564 (M+).
Пример 313,9-Дифтор-12,13-дигидро-13-[6-амино –  – D-глюкопиранозил] – D-глюкопиранозил] 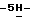 индол[2,3-a]пиррол[3,4-c]карбазол-5,7(6-гидрокси)-дион (Ic).
К раствору продукта из примера 30 (3,0 мг, 0,0053 ммол) в абсолютном метаноле (2 мл) в атмосфере азота в приборе Парра (Parr) добавляют хлорид палладия (II) (15 мг, 0,09 ммол). Смесь подвергают воздействию ультразвуком в течение 10 мин и помещают в качалку (трясучку) Парра (Parr shaker) при давлении водорода 65 psi на 24 час. Смесь фильтруют через небольшой слой целита, промывают метанолом и концентрируют в вакууме с получением 2 мг (66%) вышеназванного соединения в виде желто-оранжевого твердого вещества: FAB масс-спектр, m/e 538 (M+).
Дополнительные примеры соединений формулы I, которые могут быть синтезированы путем модификаций предшествующих синтетических методик, представлены далее в таблице IV, где заместители такие же, как в примере 29, если не указано иное.
Аналитические данные для некоторых примеров, показанных в таблице IV, даны ниже.
Пример 32: IR (KBr) 2110 см-1; 500 МГц COSY 1H ЯМР (CD3OD): индол[2,3-a]пиррол[3,4-c]карбазол-5,7(6-гидрокси)-дион (Ic).
К раствору продукта из примера 30 (3,0 мг, 0,0053 ммол) в абсолютном метаноле (2 мл) в атмосфере азота в приборе Парра (Parr) добавляют хлорид палладия (II) (15 мг, 0,09 ммол). Смесь подвергают воздействию ультразвуком в течение 10 мин и помещают в качалку (трясучку) Парра (Parr shaker) при давлении водорода 65 psi на 24 час. Смесь фильтруют через небольшой слой целита, промывают метанолом и концентрируют в вакууме с получением 2 мг (66%) вышеназванного соединения в виде желто-оранжевого твердого вещества: FAB масс-спектр, m/e 538 (M+).
Дополнительные примеры соединений формулы I, которые могут быть синтезированы путем модификаций предшествующих синтетических методик, представлены далее в таблице IV, где заместители такие же, как в примере 29, если не указано иное.
Аналитические данные для некоторых примеров, показанных в таблице IV, даны ниже.
Пример 32: IR (KBr) 2110 см-1; 500 МГц COSY 1H ЯМР (CD3OD):  8,81-8,79 (m, 2H), 7,68 (dd, 1H, J = 9,1, 4,0 Гц), 7,56 (dd, 1H, J = 8,8, 4,2 Гц), 7,38-7,25 (m, 6H), 6,05 (d, 1H, J = 8,5 Гц, 1’H), 4,75 (s, 2H), 4,29 (d, 1H, J = 12,8 Гц, 6’H), 4,17-4,06 (m, 2H, 5’H, 6”H), 4,00 (t, 1H, J = 8,9 Гц, 4’H), 3,70-3,65 (m, 2H, 2’H, 3’H), 1,27 (s, 9H); FAB масс-спектр, m/e 694 (M+).
Пример 33: желтое твердое вещество: IR (KBr) 2112, 1750, 1700 см-1; 500 МГц COSY 1H ЯМР (CD3OD) 8,81-8,79 (m, 2H), 7,68 (dd, 1H, J = 9,1, 4,0 Гц), 7,56 (dd, 1H, J = 8,8, 4,2 Гц), 7,38-7,25 (m, 6H), 6,05 (d, 1H, J = 8,5 Гц, 1’H), 4,75 (s, 2H), 4,29 (d, 1H, J = 12,8 Гц, 6’H), 4,17-4,06 (m, 2H, 5’H, 6”H), 4,00 (t, 1H, J = 8,9 Гц, 4’H), 3,70-3,65 (m, 2H, 2’H, 3’H), 1,27 (s, 9H); FAB масс-спектр, m/e 694 (M+).
Пример 33: желтое твердое вещество: IR (KBr) 2112, 1750, 1700 см-1; 500 МГц COSY 1H ЯМР (CD3OD)  8,78-8,72 (m, 2H), 7,77 (dd, 1H, J = 9,1, 4,1 Гц), 7,55 (dd, 1H, J = 8,8, 4,2 Гц), 7,33-7,26 (m, 2H), 6,12 (d, 1H, J = 8,5 Гц, 1’H), 4,27 (d, 1H, J = 11,5 Гц, 6’H), 4,15-4,07 (m, 2H, 5’H, 6”H), 4,01 (t, 1H, J = 8,7 Гц, 4’H), 3,74-3,67 (m, 2H, 2’H, 3’H); FAB масс-спектр, m/e 548 (M+).
Пример 34: желто-оранжевое твердое вещество: 500 МГц COSY 1H ЯМР (CD3OD) 8,78-8,72 (m, 2H), 7,77 (dd, 1H, J = 9,1, 4,1 Гц), 7,55 (dd, 1H, J = 8,8, 4,2 Гц), 7,33-7,26 (m, 2H), 6,12 (d, 1H, J = 8,5 Гц, 1’H), 4,27 (d, 1H, J = 11,5 Гц, 6’H), 4,15-4,07 (m, 2H, 5’H, 6”H), 4,01 (t, 1H, J = 8,7 Гц, 4’H), 3,74-3,67 (m, 2H, 2’H, 3’H); FAB масс-спектр, m/e 548 (M+).
Пример 34: желто-оранжевое твердое вещество: 500 МГц COSY 1H ЯМР (CD3OD)  8,81-8,61 (m, 2H), 7,88-7,04 (m, 7H), 6,32 (d, 1H, J = 8,9 Гц, 1’H), 4,20-3,30 (m, 6H); FAB масс-спектр, m/e 574 (M+).
Пример 35: желтое твердое вещество: FAB масс-спектр, m/e 605 (M+).
Пример 36: желтое твердое вещество, т.пл. 257-273oC: 1H ЯМР (500 МГц, DMSO-d6): 8,81-8,61 (m, 2H), 7,88-7,04 (m, 7H), 6,32 (d, 1H, J = 8,9 Гц, 1’H), 4,20-3,30 (m, 6H); FAB масс-спектр, m/e 574 (M+).
Пример 35: желтое твердое вещество: FAB масс-спектр, m/e 605 (M+).
Пример 36: желтое твердое вещество, т.пл. 257-273oC: 1H ЯМР (500 МГц, DMSO-d6):  11,73 (br s, 1H), 9,53-9,40 (2m, 1H), 8,65-8,63 (m, 1H), 8,25-7,91 (4m, 2H), 7,52-7,25 (3m, 2H), 6,21 и 6,10 (2d, J = 8,8, 9,3 Гц, 1H), 5,47-4,9 (серия m, 3H), 4,10-3,86 (3m, 3H), 3,56-3,53 (m, 7H), 2,99-2,57 (серия m, 4H); IR (KBr, см-1) 3412, 2924, 2800, 1706, 1653, 1602, 1567, 1481, 1463, 1425, 1321, 1301, 1198, 1110, 1067, 916, 804, 764, 742; MS (+ESI M+H+ m/z 610.
Пример 37 11,73 (br s, 1H), 9,53-9,40 (2m, 1H), 8,65-8,63 (m, 1H), 8,25-7,91 (4m, 2H), 7,52-7,25 (3m, 2H), 6,21 и 6,10 (2d, J = 8,8, 9,3 Гц, 1H), 5,47-4,9 (серия m, 3H), 4,10-3,86 (3m, 3H), 3,56-3,53 (m, 7H), 2,99-2,57 (серия m, 4H); IR (KBr, см-1) 3412, 2924, 2800, 1706, 1653, 1602, 1567, 1481, 1463, 1425, 1321, 1301, 1198, 1110, 1067, 916, 804, 764, 742; MS (+ESI M+H+ m/z 610.
Пример 3712-[6-Амино-6-дезокси –  – D-глюкопиранозил] -3-фтор – D-глюкопиранозил] -3-фтор 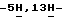 бензо[b] тиенил[2,3-a]пиррол[3,4-c]карбазол-5,7 бензо[b] тиенил[2,3-a]пиррол[3,4-c]карбазол-5,7  дион.
Трифенилфосфин (107 мг, 0,41 ммол) добавляют одной порцией к перемешиваемому раствору 12-[6-азидо-6-дезокси – дион.
Трифенилфосфин (107 мг, 0,41 ммол) добавляют одной порцией к перемешиваемому раствору 12-[6-азидо-6-дезокси – – D-глюкопиранозил]-3-фтор – D-глюкопиранозил]-3-фтор  бензо[b]тиенил[2,3-a]пиррол[3,4-c]карбазол-5,7 бензо[b]тиенил[2,3-a]пиррол[3,4-c]карбазол-5,7  диона (75 мг, 0,14 ммол) во влажном тетрагидрофуране (3 мл) в атмосфере азота, затем смесь нагревают при 50oC в течение 28 час, охлаждают до комнатной температуры и обрабатывают водным раствором гидроксида аммония в течение 1 часа при комнатной температуре и 1 час при 50oC. После охлаждения до комнатной температуры смесь концентрируют в вакууме и остаток обрабатывают метанолом, подкисляют 1N HCl/Et2O и упаривают досуха. Очистка этого остатка методом ВЭЖХ (HPLC) на колонке YMC Pack ODS (20х100), с использованием 87% B, приводит к вышеназванному соединению (54 мг, 71%) в виде желтого твердого вещества, температура разложение 290oC (запаянная ампула); 1H ЯМР (500 МГц, DMSO-d6): диона (75 мг, 0,14 ммол) во влажном тетрагидрофуране (3 мл) в атмосфере азота, затем смесь нагревают при 50oC в течение 28 час, охлаждают до комнатной температуры и обрабатывают водным раствором гидроксида аммония в течение 1 часа при комнатной температуре и 1 час при 50oC. После охлаждения до комнатной температуры смесь концентрируют в вакууме и остаток обрабатывают метанолом, подкисляют 1N HCl/Et2O и упаривают досуха. Очистка этого остатка методом ВЭЖХ (HPLC) на колонке YMC Pack ODS (20х100), с использованием 87% B, приводит к вышеназванному соединению (54 мг, 71%) в виде желтого твердого вещества, температура разложение 290oC (запаянная ампула); 1H ЯМР (500 МГц, DMSO-d6):  11,55 (br s, 1H), 9,94-9,90 (m, 1H), 9,03-8,96 (2m, 1H), 8,30-8,26 (m, 4H); 8,12-8,08 (m, 1H), 7,71-7,29 (серия m, 6H), 6,36 и 6,15 (2d, J = 8,9, 9,3 Гц, 1H), 5,81 и 5,55 (2m, 2H), 4,23-3,70 (5m, 2H), 3,60-3,57 и 2.94 (2m, 2H), 1,68-1,41 (3m, 2H); IR (KBr, см-1) 3401, 1702, 1624, 1482, 1460, 1328, 1284, 1209, 1182, 1087, 757, 746; MS (FAB, MH+ m/z 522.
Пример 39 11,55 (br s, 1H), 9,94-9,90 (m, 1H), 9,03-8,96 (2m, 1H), 8,30-8,26 (m, 4H); 8,12-8,08 (m, 1H), 7,71-7,29 (серия m, 6H), 6,36 и 6,15 (2d, J = 8,9, 9,3 Гц, 1H), 5,81 и 5,55 (2m, 2H), 4,23-3,70 (5m, 2H), 3,60-3,57 и 2.94 (2m, 2H), 1,68-1,41 (3m, 2H); IR (KBr, см-1) 3401, 1702, 1624, 1482, 1460, 1328, 1284, 1209, 1182, 1087, 757, 746; MS (FAB, MH+ m/z 522.
Пример 393,9-Дифтор-12-[6-амино-6-дезокси –  – D-глюкопиранозил]бензофуран-[2,3-a] пиррол[3,4-c]карбазол-5,7-дион – D-глюкопиранозил]бензофуран-[2,3-a] пиррол[3,4-c]карбазол-5,7-дионК перемешиваемому магнитной мешалкой раствору 3,9-дифтор-12 -[  – D-глюкопиранозил] бензофуран[2,3-a] пиррол[3,4-c] карбазол-5,7-диона (50 мг, 0,09 ммол) и порошкообразным молекулярным ситам 4 ангстрема (100 мг) в безводном пиридине (3 мл) при -30oC в атмосфере аргона прибавляют при помощи шприца метансульфонил хлорид (10 мкл, 0,12 ммол). Реакционную смесь перемешивают при -30oC в течение 1 час, затем при -10oC в течение 0,5 час, после чего добавляют дополнительную порцию метансульфонил хлорида (10 мкл, 0,12 ммол). Полученную смесь затем перемешивают при 0oC в течение 1 час, отфильтровывают с отсасыванием и концентрируют. Остаток обрабатывают смесью EtOAc/ТГФ (350 мл) и промывают водой, сушат (Na2SO4) и упаривают. Полученный остаток промывают толуолом с получением грубого желтого продукта, который непосредственно используют в следующей реакции без дополнительной очистки. Азид натрия (62 мг, 0,95 ммол) добавляют к перемешиваемому раствору 3,9-дифтор-12-[6-O-(метилсульфонил) – – D-глюкопиранозил] бензофуран[2,3-a] пиррол[3,4-c] карбазол-5,7-диона (50 мг, 0,09 ммол) и порошкообразным молекулярным ситам 4 ангстрема (100 мг) в безводном пиридине (3 мл) при -30oC в атмосфере аргона прибавляют при помощи шприца метансульфонил хлорид (10 мкл, 0,12 ммол). Реакционную смесь перемешивают при -30oC в течение 1 час, затем при -10oC в течение 0,5 час, после чего добавляют дополнительную порцию метансульфонил хлорида (10 мкл, 0,12 ммол). Полученную смесь затем перемешивают при 0oC в течение 1 час, отфильтровывают с отсасыванием и концентрируют. Остаток обрабатывают смесью EtOAc/ТГФ (350 мл) и промывают водой, сушат (Na2SO4) и упаривают. Полученный остаток промывают толуолом с получением грубого желтого продукта, который непосредственно используют в следующей реакции без дополнительной очистки. Азид натрия (62 мг, 0,95 ммол) добавляют к перемешиваемому раствору 3,9-дифтор-12-[6-O-(метилсульфонил) – – D-глюкопиранозил] бензофуран-[2,3-a]пиррол[3,4-c]карбазол-5,7-диона (54 мг, 0,09 ммол) в безводном ДМФА (3 мл), после чего смесь нагревают при 70oC в течение 1 час. Реакционную смесь охлаждают до комнатной температуры, разбавляют водой, сушат (Na2SO4) и концентрируют в вакууме. Грубый желтый продукт непосредственно используют в следующей реакции без дополнительной очистки. Смесь 3,9-дифтор-12-(6-азидо-6-дезокси – – D-глюкопиранозил] бензофуран-[2,3-a]пиррол[3,4-c]карбазол-5,7-диона (54 мг, 0,09 ммол) в безводном ДМФА (3 мл), после чего смесь нагревают при 70oC в течение 1 час. Реакционную смесь охлаждают до комнатной температуры, разбавляют водой, сушат (Na2SO4) и концентрируют в вакууме. Грубый желтый продукт непосредственно используют в следующей реакции без дополнительной очистки. Смесь 3,9-дифтор-12-(6-азидо-6-дезокси – – D-глюкопиранозил] бензофуран[2,3-a] пиррол[3,4-c]карбазол-5,7-диона (пример 40) (49 мг, 0,09 ммол) и 10% палладий на угле (50 мг) в смеси этанола (3 мл) и ТГФ (1 мл) гидрируют при 1 атм в течение 21 час. Полученную смесь фильтруют, промывают метанолом и ТГФ и концентрируют в вакууме. Неочищенный продукт хроматографируют (60% CH2Cl2:20% ТГФ и 20% раствора 90% MeOH и 10% NH4OH) с получением вышеназванного соединения (20 мг, 42%) в виде желтого твердого вещества: IR (KBr) 1753, 1701, 1479 см-1; 1H ЯМР (DMSO-d6, 400 МГц): – D-глюкопиранозил] бензофуран[2,3-a] пиррол[3,4-c]карбазол-5,7-диона (пример 40) (49 мг, 0,09 ммол) и 10% палладий на угле (50 мг) в смеси этанола (3 мл) и ТГФ (1 мл) гидрируют при 1 атм в течение 21 час. Полученную смесь фильтруют, промывают метанолом и ТГФ и концентрируют в вакууме. Неочищенный продукт хроматографируют (60% CH2Cl2:20% ТГФ и 20% раствора 90% MeOH и 10% NH4OH) с получением вышеназванного соединения (20 мг, 42%) в виде желтого твердого вещества: IR (KBr) 1753, 1701, 1479 см-1; 1H ЯМР (DMSO-d6, 400 МГц):  8,87-8,82 (m, 1H), 8,56-8,49 (m, 1H), 8,10-7,99 (m, 2H), 7,67-7,50 (m, 2H), 6,53 (d, 0,7H, J = 9,0 Гц), 6,14 (d, 0,3H, J = 9,0 Гц), 5,44-5,30 (m, 2H), 4,28-2,86 (m, 7H); ВЭЖХ (HPLC): 90,4% (247 нм).
Пример 45: 300 МГц 1H ЯМР (d6-ацетон) 8,87-8,82 (m, 1H), 8,56-8,49 (m, 1H), 8,10-7,99 (m, 2H), 7,67-7,50 (m, 2H), 6,53 (d, 0,7H, J = 9,0 Гц), 6,14 (d, 0,3H, J = 9,0 Гц), 5,44-5,30 (m, 2H), 4,28-2,86 (m, 7H); ВЭЖХ (HPLC): 90,4% (247 нм).
Пример 45: 300 МГц 1H ЯМР (d6-ацетон)  11,97 (brs, 1H), 9,91 (s, 1H), 9,12 (dd, 1H), 8,88 (dd, 1H), 7,92 (dd, 1H), 7,69 (dd, 1H), 7,47-7,23 (m, 2H), 7,48 (ddd, 1H, J = 2,5, 8,9, 9,1 Гц), 7,41 (ddd, 1H, J = 2,5, 8,9, 9,1 Гц), 6,73 (s, 1H, 1’H), 4,60-3,95 (m, 6H).
Пример 47: 500 МГц 1H ЯМР (CDCl3 с каплей d6-DMSO) 11,97 (brs, 1H), 9,91 (s, 1H), 9,12 (dd, 1H), 8,88 (dd, 1H), 7,92 (dd, 1H), 7,69 (dd, 1H), 7,47-7,23 (m, 2H), 7,48 (ddd, 1H, J = 2,5, 8,9, 9,1 Гц), 7,41 (ddd, 1H, J = 2,5, 8,9, 9,1 Гц), 6,73 (s, 1H, 1’H), 4,60-3,95 (m, 6H).
Пример 47: 500 МГц 1H ЯМР (CDCl3 с каплей d6-DMSO)  10,36 (d, 1H, JH-F = 4,2 Гц), 9,98 (brs, 1H), 8,81 (dd, 1H, J = 9,5, 2,6 Гц), 8,68 (dd, 1H, J = 9,5, 2,6 Гц), 7,47 (dd, 1H), 7,30-7,24 (m, 1H), 7,15-7,04 (m, 2H), 5,84 (d, 1H, J = 8,5 Гц), 5,02 (d, 1H, JH-F = 45,2 Гц, JH-H = 10,1 Гц), 4,72 (dd, 1H, JH-F = 49,6 Гц, JH-H = 10,1 Гц), 4,03-3,82 (m, 2H), 3,71-3,60 (m, 2H); ESI (отриц.) масс-спектр, m/e 524 (M-H)–.
Пример 48: 500 МГц 1H ЯМР (d6-DMSO) 10,36 (d, 1H, JH-F = 4,2 Гц), 9,98 (brs, 1H), 8,81 (dd, 1H, J = 9,5, 2,6 Гц), 8,68 (dd, 1H, J = 9,5, 2,6 Гц), 7,47 (dd, 1H), 7,30-7,24 (m, 1H), 7,15-7,04 (m, 2H), 5,84 (d, 1H, J = 8,5 Гц), 5,02 (d, 1H, JH-F = 45,2 Гц, JH-H = 10,1 Гц), 4,72 (dd, 1H, JH-F = 49,6 Гц, JH-H = 10,1 Гц), 4,03-3,82 (m, 2H), 3,71-3,60 (m, 2H); ESI (отриц.) масс-спектр, m/e 524 (M-H)–.
Пример 48: 500 МГц 1H ЯМР (d6-DMSO)  8,80-7,20 (m, 1H), 6,38 (d, 1H), 5,15-3,45 (m, 6H); ESI (отриц.) масс-спектр, m/e 540 (M-H)–.
Дополнительные примеры соединений формулы I, которые могут быть синтезированы путем модификаций предшествующих синтетических методик, представлены далее в таблице V, где заместители такие же, как в примере 29, если не указано иное.
Аналитические данные для некоторых примеров, показанных в таблице V, даны ниже.
Пример 50: желтое твердое вещество, т.пл. 242-248oC разл.: 1H ЯМР (500 МГц, DMSO-d6): 8,80-7,20 (m, 1H), 6,38 (d, 1H), 5,15-3,45 (m, 6H); ESI (отриц.) масс-спектр, m/e 540 (M-H)–.
Дополнительные примеры соединений формулы I, которые могут быть синтезированы путем модификаций предшествующих синтетических методик, представлены далее в таблице V, где заместители такие же, как в примере 29, если не указано иное.
Аналитические данные для некоторых примеров, показанных в таблице V, даны ниже.
Пример 50: желтое твердое вещество, т.пл. 242-248oC разл.: 1H ЯМР (500 МГц, DMSO-d6):  11,55 (bг m, 1H), 9,75-9,57 (2m, 1H), 9,01-8,87 (2m, 1H), 8,23-7,98 (3m, 2H), 7,57-7,34 (2m, 2H), 6,33 и 6,21 (2d, J = 8,8, 9,4 Гц, 1H), 5,69-5,61 (2m, 1H), 5,44-5,17 (2m, 2H), 4,12-3,96 (т, 4H), 3,66-3,55 (2m, 2H); IR (KBr, см-1) 3392, 2926, 1703, 1622, 1602, 1567, 1481, 1463, 1426, 1324, 1198, 1085, 915, 806, 763, 742; MS (-ESI M-H–) m/z 557.
Пример 52: желтое твердое вещество, т.пл. 248-250oC: 1H ЯМР (500 МГц, DMSO-d6): 11,55 (bг m, 1H), 9,75-9,57 (2m, 1H), 9,01-8,87 (2m, 1H), 8,23-7,98 (3m, 2H), 7,57-7,34 (2m, 2H), 6,33 и 6,21 (2d, J = 8,8, 9,4 Гц, 1H), 5,69-5,61 (2m, 1H), 5,44-5,17 (2m, 2H), 4,12-3,96 (т, 4H), 3,66-3,55 (2m, 2H); IR (KBr, см-1) 3392, 2926, 1703, 1622, 1602, 1567, 1481, 1463, 1426, 1324, 1198, 1085, 915, 806, 763, 742; MS (-ESI M-H–) m/z 557.
Пример 52: желтое твердое вещество, т.пл. 248-250oC: 1H ЯМР (500 МГц, DMSO-d6):  11,73, 11,65 и 11,62 (3s, 1H), 9,81-9,68 (2m, 1H), 9,07-8,99 (2m, 1H), 8,27-8,00 (m, 2H), 7,61-7,50 (m, H), 6,38 и 6,26 (2d, J = 8,8, 9,3 Гц, 1H), 5,69-5,21 (серия m, 3H), 5,05-4,82 (m, 2H), 4,25-3,82 (m, 2H), 3,72-3,61 (m, 1H); IR (KBr, см-1) 3384, 1706, 1622, 1602, 1568, 1481, 1463, 1325, 1198, 1086, 916, 806, 763, 742; MS (-ESI M-H–) m/z 541.
Пример 54: 300 МГц 1H ЯМР (CD3OD) 11,73, 11,65 и 11,62 (3s, 1H), 9,81-9,68 (2m, 1H), 9,07-8,99 (2m, 1H), 8,27-8,00 (m, 2H), 7,61-7,50 (m, H), 6,38 и 6,26 (2d, J = 8,8, 9,3 Гц, 1H), 5,69-5,21 (серия m, 3H), 5,05-4,82 (m, 2H), 4,25-3,82 (m, 2H), 3,72-3,61 (m, 1H); IR (KBr, см-1) 3384, 1706, 1622, 1602, 1568, 1481, 1463, 1325, 1198, 1086, 916, 806, 763, 742; MS (-ESI M-H–) m/z 541.
Пример 54: 300 МГц 1H ЯМР (CD3OD)  8,80 (dd, 1H, J = 9,6, 2,3 Гц), 8,72 (dd, 1H, J = 9,9, 2,8 Гц), 7,84-7,73 (m, 2H), 7,37-7,26 (m, 2H), 6,15 (d, 1H, J = 9,5 Гц), 4,34-4,27 (m, 1H), 4,14 (t, 1H, J = 9,5 Гц), 3,97 (t, 1H, J = 9,0 Гц), 3,74 (t, 1H, J = 9,0 Гц), 3,45 (dd, 1H, J = 14,8, 1,8 Гц), 3,15 (dd, 1H, J = 14,8, 3,9 Гц), 2,19 (s, 3H); отр. ESI масс-спектр, m/e 552 (M-H).
Пример 56 8,80 (dd, 1H, J = 9,6, 2,3 Гц), 8,72 (dd, 1H, J = 9,9, 2,8 Гц), 7,84-7,73 (m, 2H), 7,37-7,26 (m, 2H), 6,15 (d, 1H, J = 9,5 Гц), 4,34-4,27 (m, 1H), 4,14 (t, 1H, J = 9,5 Гц), 3,97 (t, 1H, J = 9,0 Гц), 3,74 (t, 1H, J = 9,0 Гц), 3,45 (dd, 1H, J = 14,8, 1,8 Гц), 3,15 (dd, 1H, J = 14,8, 3,9 Гц), 2,19 (s, 3H); отр. ESI масс-спектр, m/e 552 (M-H).
Пример 5612-[6-Азидо-6-дезокси –  – D-глюкопиранозил]-3-фтор – D-глюкопиранозил]-3-фтор  бензо[b]тиенил[2,3-a]пиррол[3,4-c]карбазол-5,7 бензо[b]тиенил[2,3-a]пиррол[3,4-c]карбазол-5,7  дион.
Азид натрия (216 мг, 3,30 ммол) добавляют одной порцией к перемешиваемому раствору 3-фтор-13-[6 дион.
Азид натрия (216 мг, 3,30 ммол) добавляют одной порцией к перемешиваемому раствору 3-фтор-13-[6  (метилсульфонил) – (метилсульфонил) – – D-глюкопиранозил] – D-глюкопиранозил]  бензо[b]тиенил[2,3-a]пиррол[3,4-c]карбазол-5,7-диона (0,20 г, 0,33 ммол) в безводном диметилформамиде (3 мл), после чего смесь нагревают при 120oC в течение 3 час, охлаждают до комнатной температуры и концентрируют в вакууме. Остаток очищают флеш-хроматографией на силикагеле (элюирование 40% тетрагидрофурана в гексане) с получением вышеназванного продукта (141 мг, 78% в виде желтого твердого вещества, температура разложения 265oC; 1H ЯМР (500 МГц, DMSO-d6): бензо[b]тиенил[2,3-a]пиррол[3,4-c]карбазол-5,7-диона (0,20 г, 0,33 ммол) в безводном диметилформамиде (3 мл), после чего смесь нагревают при 120oC в течение 3 час, охлаждают до комнатной температуры и концентрируют в вакууме. Остаток очищают флеш-хроматографией на силикагеле (элюирование 40% тетрагидрофурана в гексане) с получением вышеназванного продукта (141 мг, 78% в виде желтого твердого вещества, температура разложения 265oC; 1H ЯМР (500 МГц, DMSO-d6):  11,51 (br s, 1H), 9,94-9,87 (2m, 1H), 9,03-8,95 (2m, 1H), 8,20-7,99 (3m, 2H), 7,67-7,63 (m, 2H), 7,53-7,49 (m, 1H), 6,37 и 6,20 (2d, J = 8,9 и 9,4 Гц, 1H), 5,54-5,14 (серия m, 3H), 4,10-3,76 (4m, 3H), 3,67-3,26 (m, 3H); IR (KBr, см-1) 3332, 2103, 1702, 1481, 1461, 1431, 1372, 1324, 1283, 1230, 1211, 1178, 1079, 746; MS (-ESI, M-H–) m/z 546.
Пример 57: желтое твердое вещество, т.пл. 268-277oC (разл.); 1H ЯМР (500 МГц, DMSO-d6): 11,51 (br s, 1H), 9,94-9,87 (2m, 1H), 9,03-8,95 (2m, 1H), 8,20-7,99 (3m, 2H), 7,67-7,63 (m, 2H), 7,53-7,49 (m, 1H), 6,37 и 6,20 (2d, J = 8,9 и 9,4 Гц, 1H), 5,54-5,14 (серия m, 3H), 4,10-3,76 (4m, 3H), 3,67-3,26 (m, 3H); IR (KBr, см-1) 3332, 2103, 1702, 1481, 1461, 1431, 1372, 1324, 1283, 1230, 1211, 1178, 1079, 746; MS (-ESI, M-H–) m/z 546.
Пример 57: желтое твердое вещество, т.пл. 268-277oC (разл.); 1H ЯМР (500 МГц, DMSO-d6):  11,52 (br s, 1H), 9,75-9,51 (3m, 1H), 9,00-8,88 (2m, 1H), 8,30-7,97 (3m, 2H), 7,66-7,22 (3m, 2H), 6,35-6,20 (2m, 1H), 5,86-5,56 (m, 1H), 5,42-5,35 (m, 2H), 4,28-3,89 (m, 2H), 3,72-3,56 (m, 2H), 3,50-3,32 (m, 1H), 3,27-3,14 (m, 1H), 2,61-2,53 (4s, 3H); IR (KBr, см-1) 3412, 2950, 1707, 1625, 1605, 1481, 1464, 1385, 1324, 1283, 1198, 1086, 916, 746, 742; LCMS (-ESI, M-H–) m/z 685.
Пример 58: желто-оранжевое твердое вещества (смесь диастереомеров при фосфоре): 500 МГц 1H ЯМР (d6-DMSO; смесь двух диастереомеров и ротомеров) 11,52 (br s, 1H), 9,75-9,51 (3m, 1H), 9,00-8,88 (2m, 1H), 8,30-7,97 (3m, 2H), 7,66-7,22 (3m, 2H), 6,35-6,20 (2m, 1H), 5,86-5,56 (m, 1H), 5,42-5,35 (m, 2H), 4,28-3,89 (m, 2H), 3,72-3,56 (m, 2H), 3,50-3,32 (m, 1H), 3,27-3,14 (m, 1H), 2,61-2,53 (4s, 3H); IR (KBr, см-1) 3412, 2950, 1707, 1625, 1605, 1481, 1464, 1385, 1324, 1283, 1198, 1086, 916, 746, 742; LCMS (-ESI, M-H–) m/z 685.
Пример 58: желто-оранжевое твердое вещества (смесь диастереомеров при фосфоре): 500 МГц 1H ЯМР (d6-DMSO; смесь двух диастереомеров и ротомеров)  8,85-8,74 (m, 2H), 8,15-7,75 (m, 2H), 7,55-7,35 (m, 2H), 6,45-6,10 (m, 1H), 5,80-5,25 (m, 3H), 4,30-3,10 (m, 6H), 2,76, 2,74, 2,58 и 2,56 (все s, 3H); отр. ESI масс-спектр, m/e 568 (M-H)–.
Пример 59: 300 МГц 1H ЯМР (CD3OD): 8,85-8,74 (m, 2H), 8,15-7,75 (m, 2H), 7,55-7,35 (m, 2H), 6,45-6,10 (m, 1H), 5,80-5,25 (m, 3H), 4,30-3,10 (m, 6H), 2,76, 2,74, 2,58 и 2,56 (все s, 3H); отр. ESI масс-спектр, m/e 568 (M-H)–.
Пример 59: 300 МГц 1H ЯМР (CD3OD):  8,87 (dd, 1H, J = 9,6, 2,6 Гц), 8,78 (dd, 1H, J = 9,8, 2,6 Гц), 7,94 (dd, 1H, J = 8,9, 4,4 Гц), 7,83 (dd, 1H, J = 9,0, 4,1 Гц), 7,38-7,27 (m, 2H), 6,14 (d, 1H, J = 9,3 Гц), 4,34-4,18 (m, 2H), 3,94 (t, 1H, J = 9,2 Гц), 3,73 (t, 1H, J = 8,9 Гц), 3,51-3,22 (m, 4H); отр. ESI масс-спектр, m/e 596 (M-H)–.
Пример 60: желтое твердое вещество, т.пл. 228-232oC; 1H ЯМР (500 МГц, DMSO-d6): 8,87 (dd, 1H, J = 9,6, 2,6 Гц), 8,78 (dd, 1H, J = 9,8, 2,6 Гц), 7,94 (dd, 1H, J = 8,9, 4,4 Гц), 7,83 (dd, 1H, J = 9,0, 4,1 Гц), 7,38-7,27 (m, 2H), 6,14 (d, 1H, J = 9,3 Гц), 4,34-4,18 (m, 2H), 3,94 (t, 1H, J = 9,2 Гц), 3,73 (t, 1H, J = 8,9 Гц), 3,51-3,22 (m, 4H); отр. ESI масс-спектр, m/e 596 (M-H)–.
Пример 60: желтое твердое вещество, т.пл. 228-232oC; 1H ЯМР (500 МГц, DMSO-d6):  11,88 и 11,76 (2br m, 1H), 9,75-9,69 (2m, 1H), 8,73-8,62 (2m, 1H), 8,18 и 8,09 (2d, J = 4,8, 4,7 Гц, 1H), 7,99-7,92 (2m, 1H), 7,65-7,35 (m, 3H), 6,28 и 6,07 (2d, J = 8,9, 9,2 Гц, 1H), 5,29-4,97 (3m, 3H), 4,10-3,85 (3m, 2H), 3,60-3,48 (m, 2H), 2,97-2,70 (3m, 2H), 2,58 (m, 3H), 1,56-1,44 (m, 5H), 1,34 (m, 2H); IR (KBr, см-1) 3406, 2934, 1705, 1622, 1481, 1461, 1430, 1374, 1321, 1284, 1179, 1081, 1038, 758, 747; MS (+ESI, M+H+) m/z 590.
Пример 61: желтое твердое вещество, т.пл. 228-232oC; 1H ЯМР (500 МГц, DMSO-d6): 11,88 и 11,76 (2br m, 1H), 9,75-9,69 (2m, 1H), 8,73-8,62 (2m, 1H), 8,18 и 8,09 (2d, J = 4,8, 4,7 Гц, 1H), 7,99-7,92 (2m, 1H), 7,65-7,35 (m, 3H), 6,28 и 6,07 (2d, J = 8,9, 9,2 Гц, 1H), 5,29-4,97 (3m, 3H), 4,10-3,85 (3m, 2H), 3,60-3,48 (m, 2H), 2,97-2,70 (3m, 2H), 2,58 (m, 3H), 1,56-1,44 (m, 5H), 1,34 (m, 2H); IR (KBr, см-1) 3406, 2934, 1705, 1622, 1481, 1461, 1430, 1374, 1321, 1284, 1179, 1081, 1038, 758, 747; MS (+ESI, M+H+) m/z 590.
Пример 61: желтое твердое вещество, т.пл. 228-232oC; 1H ЯМР (500 МГц, DMSO-d6):  11,88 и 11,76 (2br m, 1H), 9,75-9,69 (2m, 1H), 8,73-8,62 (2m, 1H), 8,18 и 8,09 (2d, J = 4,8, 4,7 Гц, 1H), 7,99-7,92 (2m, 1H), 7,65-7,35 (m, 3H), 6,28 и 6,07 (2d, J = 8,9, 9,2 Гц, 1H), 5,29-4,97 (3m, 3H), 4,10-3,85 (3m, 2H), 3,60-3,48 (m, 2H), 2,97-2,70 (3m, 2H), 2,58 (m, 3H), 1,56-1,44 (m, 5H), 1,34 (m, 2H); IR (KBr, см-1) 3406, 2934, 1705, 1622, 1481, 1461, 1430, 1374, 1321, 1284, 1179, 1081, 1038, 758, 747; MS (+ESI, M+H+) m/z 590.
Пример 62: желтое твердое вещество, т.пл. 280-282oC; 1H ЯМР (500 МГц, DMSO-d6): 11,88 и 11,76 (2br m, 1H), 9,75-9,69 (2m, 1H), 8,73-8,62 (2m, 1H), 8,18 и 8,09 (2d, J = 4,8, 4,7 Гц, 1H), 7,99-7,92 (2m, 1H), 7,65-7,35 (m, 3H), 6,28 и 6,07 (2d, J = 8,9, 9,2 Гц, 1H), 5,29-4,97 (3m, 3H), 4,10-3,85 (3m, 2H), 3,60-3,48 (m, 2H), 2,97-2,70 (3m, 2H), 2,58 (m, 3H), 1,56-1,44 (m, 5H), 1,34 (m, 2H); IR (KBr, см-1) 3406, 2934, 1705, 1622, 1481, 1461, 1430, 1374, 1321, 1284, 1179, 1081, 1038, 758, 747; MS (+ESI, M+H+) m/z 590.
Пример 62: желтое твердое вещество, т.пл. 280-282oC; 1H ЯМР (500 МГц, DMSO-d6):  11,64 (br s, 1H), 9,83-9,68 (2m, 1H), 9,08-8,97 (2m, 1H), 8,45-7,10 (серия m, 8H), 6,37 и 6,25 (2d, J = 8,8, 9,1 Гц, 1H), 5,74-5,68 (2m, 1H), 5,50-5,21 (2m, 2H), 4,20-4,04 (2m, 4H), 3,71-3,60 (m, 2H); IR (KBr, см-1) 3369, 2918, 1752, 1712, 1601, 1580, 1558, 1482, 1456, 1413, 1319, 1256, 1197, 1094, 1020, 914, 805, 762; MS (-ESI, M-H–) m/z 632.
Пример 63: желтое твердое вещество, температура разложения 248oC; 1H ЯМР (500 МГц, DMSO-d6): 11,64 (br s, 1H), 9,83-9,68 (2m, 1H), 9,08-8,97 (2m, 1H), 8,45-7,10 (серия m, 8H), 6,37 и 6,25 (2d, J = 8,8, 9,1 Гц, 1H), 5,74-5,68 (2m, 1H), 5,50-5,21 (2m, 2H), 4,20-4,04 (2m, 4H), 3,71-3,60 (m, 2H); IR (KBr, см-1) 3369, 2918, 1752, 1712, 1601, 1580, 1558, 1482, 1456, 1413, 1319, 1256, 1197, 1094, 1020, 914, 805, 762; MS (-ESI, M-H–) m/z 632.
Пример 63: желтое твердое вещество, температура разложения 248oC; 1H ЯМР (500 МГц, DMSO-d6):  11,65 (br s, 1H), 9,78-9,73 (2m, 1H), 9,07-8,97 (2m, 1H), 8,30-7,95 (серия m, 3H), 7,61-7,42 (2m, 3H), 7,15-7,06 (m, 2H), 6,37 и 6,25 (2d, J = 8,8, 9,3 Гц, 1H), 5,81-5,22 (серия m, 3H), 4,32-4,12 (3m, 3H), 3,77-3,63 (m, 3H); IR (KBr, см-1) 3401, 2963, 1752, 1707, 1475, 1465, 1424, 1261, 1198, 1092, 1021, 801; LCMS (+ESI, M+H+) m/z 650.
Пример 64: получено 15,1 мг (49%), желтое твердое вещество, т.пл. 254-265oC (разл.); 1H ЯМР (500 МГц, DMSO-d6): 11,65 (br s, 1H), 9,78-9,73 (2m, 1H), 9,07-8,97 (2m, 1H), 8,30-7,95 (серия m, 3H), 7,61-7,42 (2m, 3H), 7,15-7,06 (m, 2H), 6,37 и 6,25 (2d, J = 8,8, 9,3 Гц, 1H), 5,81-5,22 (серия m, 3H), 4,32-4,12 (3m, 3H), 3,77-3,63 (m, 3H); IR (KBr, см-1) 3401, 2963, 1752, 1707, 1475, 1465, 1424, 1261, 1198, 1092, 1021, 801; LCMS (+ESI, M+H+) m/z 650.
Пример 64: получено 15,1 мг (49%), желтое твердое вещество, т.пл. 254-265oC (разл.); 1H ЯМР (500 МГц, DMSO-d6):  11,61 (br s, 1H), 9,76-9,66 (2m, 1H), 9,01-8,92 (2m, 1H), 8,31-7,96 (3m, 2H), 7,78 (br s, 1H), 7,85-7,45 (m, 2H), 6,30 и 6,19 (2d, J = 8,9, 9,4 Гц, 1H), 5,99 (br s, 1H), 5,50-5,16 (серия m, 3H), 4,12-3,92 (3m, 3H), 3,61-3,39 (m, 3H); IR (KBr, см-1) 3392, 2927, 1706, 1661, 1604, 1567, 1532, 1480, 1463, 1384, 1324, 1085, 916, 826, 807, 764, 742; MS (-ESI, M-H–) m/z 649.
Пример 65: желтое твердое вещество, т.пл. 244-246oC; 1H ЯМР (500 МГц, DMSO-d6): 11,61 (br s, 1H), 9,76-9,66 (2m, 1H), 9,01-8,92 (2m, 1H), 8,31-7,96 (3m, 2H), 7,78 (br s, 1H), 7,85-7,45 (m, 2H), 6,30 и 6,19 (2d, J = 8,9, 9,4 Гц, 1H), 5,99 (br s, 1H), 5,50-5,16 (серия m, 3H), 4,12-3,92 (3m, 3H), 3,61-3,39 (m, 3H); IR (KBr, см-1) 3392, 2927, 1706, 1661, 1604, 1567, 1532, 1480, 1463, 1384, 1324, 1085, 916, 826, 807, 764, 742; MS (-ESI, M-H–) m/z 649.
Пример 65: желтое твердое вещество, т.пл. 244-246oC; 1H ЯМР (500 МГц, DMSO-d6):  11,63 (br s, 1H), 9,75-9,67 (2m, 1H), 9,00-8,94 (2m, 1H), 8,28-8,20 (2m, 1H), 8,11-7,97 (2m, 1H), 7,57-7,50 (m, 2H), 6,30 и 6,16 (2d, J = 8,8, 9,3 Гц, 1H), 5,63-5,19 (серия m, 3H), 4,05-4,02 (m, 1H), 3,61-3,07 (m, 6H); IR (KBr, см-1) 3412, 1762, 1703, 1602, 1482, 1456, 1464, 1425, 1315, 1259, 1199, 1082, 916, 807, 763, 742; MS (-ESI, M-H–) m/z 637.
Пример 66: получено 4,7 мг (55%), желтое твердое вещество, т.пл. 252-254oC (разл.); 1H ЯМР (500 МГц, DMSO-d6): 11,63 (br s, 1H), 9,75-9,67 (2m, 1H), 9,00-8,94 (2m, 1H), 8,28-8,20 (2m, 1H), 8,11-7,97 (2m, 1H), 7,57-7,50 (m, 2H), 6,30 и 6,16 (2d, J = 8,8, 9,3 Гц, 1H), 5,63-5,19 (серия m, 3H), 4,05-4,02 (m, 1H), 3,61-3,07 (m, 6H); IR (KBr, см-1) 3412, 1762, 1703, 1602, 1482, 1456, 1464, 1425, 1315, 1259, 1199, 1082, 916, 807, 763, 742; MS (-ESI, M-H–) m/z 637.
Пример 66: получено 4,7 мг (55%), желтое твердое вещество, т.пл. 252-254oC (разл.); 1H ЯМР (500 МГц, DMSO-d6):  11,60 (br s, 1H), 9,83-9,71 (2m, 1H), 9,07-9,01 (2m, 1H), 8,30-8,07 (3m, 2H), 7,65-7,56 (2m, 2H), 6,43-6,30 (2m, 1H), 5,73-5,71 (m, 1H), 5,55-5,20 (2m, 2H), 4,21-4,07 (m, 4H), 3,81-3,52 (2m, 4H); IR (KBr, см-1) 3384, 2926, 1706, 1622, 1602, 1568, 1482, 1464, 1426, 1384, 1309, 1259, 1230, 1081, 916, 805, 763, 742; LCMS (-ESI, M-H–) m/z 653.
Пример 67: получено 10,5 мг (26%), желтое твердое вещество, температура разложения 290oC; 1H ЯМР (500 МГц, DMSO-d6): 11,60 (br s, 1H), 9,83-9,71 (2m, 1H), 9,07-9,01 (2m, 1H), 8,30-8,07 (3m, 2H), 7,65-7,56 (2m, 2H), 6,43-6,30 (2m, 1H), 5,73-5,71 (m, 1H), 5,55-5,20 (2m, 2H), 4,21-4,07 (m, 4H), 3,81-3,52 (2m, 4H); IR (KBr, см-1) 3384, 2926, 1706, 1622, 1602, 1568, 1482, 1464, 1426, 1384, 1309, 1259, 1230, 1081, 916, 805, 763, 742; LCMS (-ESI, M-H–) m/z 653.
Пример 67: получено 10,5 мг (26%), желтое твердое вещество, температура разложения 290oC; 1H ЯМР (500 МГц, DMSO-d6):  12,34 и 12,23 (2s, 1H), 11,58 (s, 1H), 9,75-9,63 (2m, 1H), 9,01-8,92 (2m, 1H), 8,23-8,15 (m, 1H), 8,17-7,96 (m, 1H), 7,53-7,46 (m, 2H), 7,11-6,85 (серия m, 2H), 6,32 и 6,15 (2d, J = 8,9, 9,3 Гц, 1H), 5,85-5,14 (серия m, 3H), 4,11-3,98 (m, 2H), 3,71-3,49 (m, 4H); IR (KBr, см-1) 3242, 2926, 1751, 1705, 1602, 1481, 1463, 1426, 1325, 1198, 1086, 915, 763, 742; MS (-ESI, M-H–) m/z 621.
Пример 71 12,34 и 12,23 (2s, 1H), 11,58 (s, 1H), 9,75-9,63 (2m, 1H), 9,01-8,92 (2m, 1H), 8,23-8,15 (m, 1H), 8,17-7,96 (m, 1H), 7,53-7,46 (m, 2H), 7,11-6,85 (серия m, 2H), 6,32 и 6,15 (2d, J = 8,9, 9,3 Гц, 1H), 5,85-5,14 (серия m, 3H), 4,11-3,98 (m, 2H), 3,71-3,49 (m, 4H); IR (KBr, см-1) 3242, 2926, 1751, 1705, 1602, 1481, 1463, 1426, 1325, 1198, 1086, 915, 763, 742; MS (-ESI, M-H–) m/z 621.
Пример 712,3,9,10-Тетрафтор-12-(4-дезокси-4,4-дифтор –  – D-глюкопиранозил] индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
К раствору периодинана Десс-Мартина (0,470 г, 1,11 ммол) в 30 мл дихлорметана добавляют по каплям раствор 6-(4-трет.бутилбензил)-2,3,9,10-тетрафтор-12-(2,3,6-три-O-бензил – – D-глюкопиранозил] индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
К раствору периодинана Десс-Мартина (0,470 г, 1,11 ммол) в 30 мл дихлорметана добавляют по каплям раствор 6-(4-трет.бутилбензил)-2,3,9,10-тетрафтор-12-(2,3,6-три-O-бензил – – D-глюкопиранозил] -индол[2,3-a] пиррол[3,4-c] карбазол-5,7-диона (0,540 г, 0,55 ммол) в 20 мл дихлорметана и смесь перемешивают при комнатной температуре под Ar в течение 1 час. Добавляют другую порцию реагента Десс-Мартина и продолжают перемешивание в течение 2 час. Полученную смесь разбавляют дихлорметаном, промывают (насыщ. NaHCO3-Na2S2O3, насыщ. NaHCO3, рассол), сушат (Na2SO4) и упаривают. Остаток хроматографируют (SiO2/гексан-этилацетат, 2:1) с получением кетона (0,360 г, 67% в виде темно-желтого твердого вещества.
К порции кетона (0,067 г, 0,07 ммол) в 2 мл дихлорметана добавляют DAST (0,036 мл, 0,28 ммол) и смесь перемешивают при комнатной температуре под Аг в течение 18 час. Затем смесь распределяют между дихлорметаном и насыщ. NaHCO3 и органическую фазу отделяют, промывают (рассол), сушат (Na2SO4) и упаривают с получением смолы. Флеш-хроматография (SiO2/гексан-этилацетат, 3:1) дает 6-(4-трет. бутилбензил)-2,3,9,10-тетрафтор-12-(4-дезокси-4,4-дифтор- 2,3,6-три-O-бензил – – D-глюкопиранозил] -индол[2,3-a] пиррол[3,4-c] карбазол-5,7-диона (0,540 г, 0,55 ммол) в 20 мл дихлорметана и смесь перемешивают при комнатной температуре под Ar в течение 1 час. Добавляют другую порцию реагента Десс-Мартина и продолжают перемешивание в течение 2 час. Полученную смесь разбавляют дихлорметаном, промывают (насыщ. NaHCO3-Na2S2O3, насыщ. NaHCO3, рассол), сушат (Na2SO4) и упаривают. Остаток хроматографируют (SiO2/гексан-этилацетат, 2:1) с получением кетона (0,360 г, 67% в виде темно-желтого твердого вещества.
К порции кетона (0,067 г, 0,07 ммол) в 2 мл дихлорметана добавляют DAST (0,036 мл, 0,28 ммол) и смесь перемешивают при комнатной температуре под Аг в течение 18 час. Затем смесь распределяют между дихлорметаном и насыщ. NaHCO3 и органическую фазу отделяют, промывают (рассол), сушат (Na2SO4) и упаривают с получением смолы. Флеш-хроматография (SiO2/гексан-этилацетат, 3:1) дает 6-(4-трет. бутилбензил)-2,3,9,10-тетрафтор-12-(4-дезокси-4,4-дифтор- 2,3,6-три-O-бензил – – D-глюкопиранозил] -индол[2,3-a] пиррол[3,4-c]карбазол-5,7-диона (0,054 г, 54%) в виде желтого твердого вещества: – D-глюкопиранозил] -индол[2,3-a] пиррол[3,4-c]карбазол-5,7-диона (0,054 г, 54%) в виде желтого твердого вещества:1H ЯМР (CDCl3, 400 МГц):  10,21 (s, 1H), 9,14 (dd, J = 10,6, 8,4 Гц, 1H), 9,02 (dd, J = 10,7, 8,2 Гц, 1H), 7,53 (d, J = 8,7 Гц, 2H), 7,40 (d, J = 8,7 Гц, 2H), 7,34 (m, 5H), 7,20-7,12 (m, 6H), 6,97 (dd, J = 10,0, 6,6 Гц, 1H), 6,80 (t, J = 7,4 Гц, 1H), 6,72 (t, J = 7,6 Гц, 1H), 6,13 (d, J = 7,2 Гц, 2H), 5,82 (d, J = 8,6 Гц, 1H), 4,97 (m, 3H), 4,80 (d, J = 11,1 Гц, 1H), 4,65 и 4,61 (ab q, J = 12,0 Гц, 2H), 4,24-4,01 (m, 6H), 3,37 (d, J = 10,6 Гц, 1H), 1,28 (s, 9H).
Защитные группы в этом соединении снимают обычным способом (i. водн. NaOH, ТГФ-EtOH; конц. HCl; ii. NH4OAc, D; iii. H2, Pd(OH)2-C, CHCl3-MeOH) с получением вышеназванного соединения (общий выход 24%) в виде желтого твердого вещества: 10,21 (s, 1H), 9,14 (dd, J = 10,6, 8,4 Гц, 1H), 9,02 (dd, J = 10,7, 8,2 Гц, 1H), 7,53 (d, J = 8,7 Гц, 2H), 7,40 (d, J = 8,7 Гц, 2H), 7,34 (m, 5H), 7,20-7,12 (m, 6H), 6,97 (dd, J = 10,0, 6,6 Гц, 1H), 6,80 (t, J = 7,4 Гц, 1H), 6,72 (t, J = 7,6 Гц, 1H), 6,13 (d, J = 7,2 Гц, 2H), 5,82 (d, J = 8,6 Гц, 1H), 4,97 (m, 3H), 4,80 (d, J = 11,1 Гц, 1H), 4,65 и 4,61 (ab q, J = 12,0 Гц, 2H), 4,24-4,01 (m, 6H), 3,37 (d, J = 10,6 Гц, 1H), 1,28 (s, 9H).
Защитные группы в этом соединении снимают обычным способом (i. водн. NaOH, ТГФ-EtOH; конц. HCl; ii. NH4OAc, D; iii. H2, Pd(OH)2-C, CHCl3-MeOH) с получением вышеназванного соединения (общий выход 24%) в виде желтого твердого вещества:IR (KBr) 3410, 1747, 1704, 1596, 1478, 1323 см-1; 1H ЯМР (DMSO-d6, 400 МГц):  11,39 (s, 1H), 11,34 (s, 1H), 8,93 (m, 2H), 8,03 (dd, J = 11,8, 6,8 Гц, 1H), 7,62 (dd, J = 10,7, 6,9 Гц, 1H), 6,54 (d, J = 9,2 Гц, 1H), 7,34 (m, 5H), 6,08 (m, 2H), 5,48 (d, J = 5,9 Гц, 1H), 4,43 (m, 1H), 4,22 (m, 1H), 4,06 (m, 2H), 3,66 (m, 1H).
MS (ESI) m/e 578 (M-H).
ВЭЖХ (HPLC): 91,1% (320 нм).
Пример 75: желтое твердое вещество: 500 МГц 1H ЯМР (d6-DMSO) 11,39 (s, 1H), 11,34 (s, 1H), 8,93 (m, 2H), 8,03 (dd, J = 11,8, 6,8 Гц, 1H), 7,62 (dd, J = 10,7, 6,9 Гц, 1H), 6,54 (d, J = 9,2 Гц, 1H), 7,34 (m, 5H), 6,08 (m, 2H), 5,48 (d, J = 5,9 Гц, 1H), 4,43 (m, 1H), 4,22 (m, 1H), 4,06 (m, 2H), 3,66 (m, 1H).
MS (ESI) m/e 578 (M-H).
ВЭЖХ (HPLC): 91,1% (320 нм).
Пример 75: желтое твердое вещество: 500 МГц 1H ЯМР (d6-DMSO)  11,85 (s, 1H), 11,18 (s, 1H), 8,92 (dd, 1H), 8,81 (dd, 1H), 8,06 (dd, 1H), 7,78 (dd, 1H), 7,49-7,39 (m, 2H), 6,28 (d, 1H, 1’H, J = 8,8 Гц), 5,85 (d, 1H, 3’OH), 5,45 (d, 1H, 2’OH), 4,25-3,89 (m, 3H, 2’H, 3’H, 5’H), 3,68 (t, 1H, 4’H), 1,42 (d, 3H, 6’H); Отриц. ESI масс-спектр, m/e 531 (M-H)–. IR (KBr) 2112 см-1.
Пример 79: желтое твердое вещество: 500 МГц 1H ЯМР (d6-DMSO) 11,85 (s, 1H), 11,18 (s, 1H), 8,92 (dd, 1H), 8,81 (dd, 1H), 8,06 (dd, 1H), 7,78 (dd, 1H), 7,49-7,39 (m, 2H), 6,28 (d, 1H, 1’H, J = 8,8 Гц), 5,85 (d, 1H, 3’OH), 5,45 (d, 1H, 2’OH), 4,25-3,89 (m, 3H, 2’H, 3’H, 5’H), 3,68 (t, 1H, 4’H), 1,42 (d, 3H, 6’H); Отриц. ESI масс-спектр, m/e 531 (M-H)–. IR (KBr) 2112 см-1.
Пример 79: желтое твердое вещество: 500 МГц 1H ЯМР (d6-DMSO)  12,72 (s, 1H), 11,18 (br s, 1H), 8,92 (dd, 1H), 8,80 (dd, 1H), 8,21 (br s, 1H), 8,07 (dd, 1H), 7,94 (dd, 1H), 7,48-7,39 (m, 2H), 6,60 (d, 1H, J = 7,8 Гц, 1’H), 5,98 (br s, 1H, 3’OH), 5,48 (brs, 1H, 2’OH), 4,55-4,50 (m, 1H, 5’H), 4,07-4,02 (m, 2H, 2’H, 3’H), 3,19 (t, 1H, 4’H), 1,43 (d, 1H, 4’H); Отриц. ESI масс-спектр, m/e 505 (M-H)–.
Пример 87: желтое твердое вещество: 300 МГц 1H ЯМР (CD3OD) 12,72 (s, 1H), 11,18 (br s, 1H), 8,92 (dd, 1H), 8,80 (dd, 1H), 8,21 (br s, 1H), 8,07 (dd, 1H), 7,94 (dd, 1H), 7,48-7,39 (m, 2H), 6,60 (d, 1H, J = 7,8 Гц, 1’H), 5,98 (br s, 1H, 3’OH), 5,48 (brs, 1H, 2’OH), 4,55-4,50 (m, 1H, 5’H), 4,07-4,02 (m, 2H, 2’H, 3’H), 3,19 (t, 1H, 4’H), 1,43 (d, 1H, 4’H); Отриц. ESI масс-спектр, m/e 505 (M-H)–.
Пример 87: желтое твердое вещество: 300 МГц 1H ЯМР (CD3OD)  8,84 (dd, 1H), 8,74 (dd, 1H), 7,77 (dd, 1H), 7,35-7,24 (m, 2H), 6,14 (d, 1H, J = 9,2 Гц), 4,55-4,50 (m, 1H, 5’H), 4,23-3,95 (m, 4H), 3,90 (t, 1H, J = 9,2 Гц), 3,74 (t, 1H, J = 9,0 Гц); Отриц. ESI масс-спектр, m/e 547 (M-H)–.
Пример 88: желтое твердое вещество: 500 МГц 1H ЯМР (CD3OD) 8,84 (dd, 1H), 8,74 (dd, 1H), 7,77 (dd, 1H), 7,35-7,24 (m, 2H), 6,14 (d, 1H, J = 9,2 Гц), 4,55-4,50 (m, 1H, 5’H), 4,23-3,95 (m, 4H), 3,90 (t, 1H, J = 9,2 Гц), 3,74 (t, 1H, J = 9,0 Гц); Отриц. ESI масс-спектр, m/e 547 (M-H)–.
Пример 88: желтое твердое вещество: 500 МГц 1H ЯМР (CD3OD)  8,89 (dd, 1H), 8,77 (dd, 1H), 7,81 (dd, 1H), 7,63 (dd, 1H), 7,33-7,26 (m, 2H), 6,15 (d, 1H, J = 8,9 Гц), 4,24-3,88 (m, 3H), 4,23-3,95 (m, 4H), 3,73 (t, 1H, J = 8,9 Гц), 3,59 (dd, 1H, J = 9,6, 8,9 Гц), 3,54 (t, 1H, J = 9,6 Гц); Отриц. ESI масс-спектр, m/e 521 (M-H)–.
Пример 89: желтое твердое вещество: IR (KBr) 3435, 3345, 1740, 1713, 1477, 1320 см-1; 1H ЯМР (THF-d8, 400 МГц): 8,89 (dd, 1H), 8,77 (dd, 1H), 7,81 (dd, 1H), 7,63 (dd, 1H), 7,33-7,26 (m, 2H), 6,15 (d, 1H, J = 8,9 Гц), 4,24-3,88 (m, 3H), 4,23-3,95 (m, 4H), 3,73 (t, 1H, J = 8,9 Гц), 3,59 (dd, 1H, J = 9,6, 8,9 Гц), 3,54 (t, 1H, J = 9,6 Гц); Отриц. ESI масс-спектр, m/e 521 (M-H)–.
Пример 89: желтое твердое вещество: IR (KBr) 3435, 3345, 1740, 1713, 1477, 1320 см-1; 1H ЯМР (THF-d8, 400 МГц):  11,50 (s, 1H), 10,12 (s, 1H), 10,12 (s, 1H), 9,08 (dd, J = 11,8, 8,6 Гц, 1H), 8,99 (dd, J = 11,0, 8,4 Гц, 1H), 7,71 (dd, J = 11,5, 6,6 Гц, 1H), 7,63 (dd, J = 10,3, 6,7 Гц, 1H), 6,11 (d, J = 8,9 Гц, 1H), 5,30 (d, J = 4,5 Гц, 1H), 5,01 (d, J = 4,1 Гц, 1H), 4,62 (d, J = 5,1 Гц, 1H), 4,56 (d, J = 9,7 Гц, 1H), 4,00 (s, 3H), 3,97-3,91 (m, 1H) 3,78-3,54 (m, 2H).
Пример 90 11,50 (s, 1H), 10,12 (s, 1H), 10,12 (s, 1H), 9,08 (dd, J = 11,8, 8,6 Гц, 1H), 8,99 (dd, J = 11,0, 8,4 Гц, 1H), 7,71 (dd, J = 11,5, 6,6 Гц, 1H), 7,63 (dd, J = 10,3, 6,7 Гц, 1H), 6,11 (d, J = 8,9 Гц, 1H), 5,30 (d, J = 4,5 Гц, 1H), 5,01 (d, J = 4,1 Гц, 1H), 4,62 (d, J = 5,1 Гц, 1H), 4,56 (d, J = 9,7 Гц, 1H), 4,00 (s, 3H), 3,97-3,91 (m, 1H) 3,78-3,54 (m, 2H).
Пример 903,9-Дифтор-12,13-дигидро-13-(2-фтор –  – D-глюкопиранозил]-5(H)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
Используя методику Мицунобу, описанную ранее в примере 22, 250 мг (0,465 ммол) продукта из примера 6 и 210 мг (0,464 ммол) 2-фтор-3,4,6-три-O-бензил-D-глюкопиранозы (полученной обработкой промышленно доступного три-O-бензил-D-глюкаля (1,5 г, 3,6 ммол) дифторидом ксенона (1,0 г, 5,91 ммол) в ацетонитриле (50 мл) и воде (5 мл) в течение 3 час при комнатной температуре. Последующая типичная обработка флеш-хроматографией на силикагеле с использованием 5% этилацетата в метиленхлориде дает 380 мг (23,4%) чистой 2-фтор-3,4,6-три-O-бензил-D-глюкопиранозы. Этот способ является модификацией опубликованного метода: см. T. Hayashi, B.W. Murray, R. Wang, and C.-H. Wong Bioorganic and Medicinal Chemistry, 1997, 5, 497-500.). Последующей очисткой флеш-хроматографией на силикагеле с использованием 20-60% метиленхлорида в гексане получают 120 мг (28%) достаточно чистого гликозилированного продукта: удаление защитных бензильных групп с использованием условий гидрирования (95% EtOH/циклогексен/20% Pd(OH)2/C, кипячение в течение 6-48 час) с последующим удалением 4-трет.бутильной защитной группы в условиях основного гидролиза (4,45М KOH, EtOH/кипячение; конц. HCl; NH4OAc/EtOH/нагревание в течение 8-48 час) приводят после очистки флеш-хроматографией на силикагеле с использованием ацетон : метилен хлорид : этилацетат, и последующей дополнительной очистки на Sephadex LH-20 метанолом к 15 мг (39% на две стадии снятия защит) чистого вышеназванного соединения в виде желто-оранжевого твердого вещества: 500 МГц 1H ЯМР (d6-DMSO): – D-глюкопиранозил]-5(H)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
Используя методику Мицунобу, описанную ранее в примере 22, 250 мг (0,465 ммол) продукта из примера 6 и 210 мг (0,464 ммол) 2-фтор-3,4,6-три-O-бензил-D-глюкопиранозы (полученной обработкой промышленно доступного три-O-бензил-D-глюкаля (1,5 г, 3,6 ммол) дифторидом ксенона (1,0 г, 5,91 ммол) в ацетонитриле (50 мл) и воде (5 мл) в течение 3 час при комнатной температуре. Последующая типичная обработка флеш-хроматографией на силикагеле с использованием 5% этилацетата в метиленхлориде дает 380 мг (23,4%) чистой 2-фтор-3,4,6-три-O-бензил-D-глюкопиранозы. Этот способ является модификацией опубликованного метода: см. T. Hayashi, B.W. Murray, R. Wang, and C.-H. Wong Bioorganic and Medicinal Chemistry, 1997, 5, 497-500.). Последующей очисткой флеш-хроматографией на силикагеле с использованием 20-60% метиленхлорида в гексане получают 120 мг (28%) достаточно чистого гликозилированного продукта: удаление защитных бензильных групп с использованием условий гидрирования (95% EtOH/циклогексен/20% Pd(OH)2/C, кипячение в течение 6-48 час) с последующим удалением 4-трет.бутильной защитной группы в условиях основного гидролиза (4,45М KOH, EtOH/кипячение; конц. HCl; NH4OAc/EtOH/нагревание в течение 8-48 час) приводят после очистки флеш-хроматографией на силикагеле с использованием ацетон : метилен хлорид : этилацетат, и последующей дополнительной очистки на Sephadex LH-20 метанолом к 15 мг (39% на две стадии снятия защит) чистого вышеназванного соединения в виде желто-оранжевого твердого вещества: 500 МГц 1H ЯМР (d6-DMSO):  11,68 (br s, 1H), 11,28 (br s, 1H), 8,88 (dd, 1H), 8,78 (dd, 1H), 8,10 (dd, 1H), 7,68 (dd, 1H), 7,60-7,43 (m, 2H), 6,77 (dd, 1H, J = 8,8, 2,5 Гц), 6,23 (br s, 1H), 5,77 (br s, 1H), 5,62 (br s, 1H), 4,32 (dt, 1H, J = 50,7, 9,0 Гц), 4,15-3,80 (m, 5H); Отриц. ESI масс-спектр, m/e 524 (M-H)–.
Пример 91 11,68 (br s, 1H), 11,28 (br s, 1H), 8,88 (dd, 1H), 8,78 (dd, 1H), 8,10 (dd, 1H), 7,68 (dd, 1H), 7,60-7,43 (m, 2H), 6,77 (dd, 1H, J = 8,8, 2,5 Гц), 6,23 (br s, 1H), 5,77 (br s, 1H), 5,62 (br s, 1H), 4,32 (dt, 1H, J = 50,7, 9,0 Гц), 4,15-3,80 (m, 5H); Отриц. ESI масс-спектр, m/e 524 (M-H)–.
Пример 913,9-Дифтор-12 -(  – D-глюкопиранозил]бензофуран[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
Желтое твердое вещество.
IR (KBr) 1757, 1706, 1483 см-1.
1H ЯМР (DMSO-d6, 400 МГц): – D-глюкопиранозил]бензофуран[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
Желтое твердое вещество.
IR (KBr) 1757, 1706, 1483 см-1.
1H ЯМР (DMSO-d6, 400 МГц):  11,45 (br s, 1H), 8,84-8,79 (m, 1H), 8,53-8,46 (m, 1H), 8,08-7,81 (m, 1H), 7,64-7,50 (m, 2H), 6,49 (d, 0,7H, J = 8,9 Гц), 6,07 (d, 0,3H, J = 8,9 Гц), 5,38-5,16 (m, 3H), 4,75-4,21 (m, 1H), 3,93-3,49 (m, 6H).
ВЭЖХ (HPLC): 97,5% (305 нм).
Пример 92 11,45 (br s, 1H), 8,84-8,79 (m, 1H), 8,53-8,46 (m, 1H), 8,08-7,81 (m, 1H), 7,64-7,50 (m, 2H), 6,49 (d, 0,7H, J = 8,9 Гц), 6,07 (d, 0,3H, J = 8,9 Гц), 5,38-5,16 (m, 3H), 4,75-4,21 (m, 1H), 3,93-3,49 (m, 6H).
ВЭЖХ (HPLC): 97,5% (305 нм).
Пример 923-Бром-9-фтор-12 -(  – D-глюкопиранозил] бензофуран[2,3-a]пиррол[3,4-c] карбазол-5,7-дион.
Желтое твердое вещество.
IR (KBr) 1775, 1708 см-1.
1H ЯМР (DMSO-d6, 400 МГц): – D-глюкопиранозил] бензофуран[2,3-a]пиррол[3,4-c] карбазол-5,7-дион.
Желтое твердое вещество.
IR (KBr) 1775, 1708 см-1.
1H ЯМР (DMSO-d6, 400 МГц):  11,69 и 11,49 (2 brs, 1H), 8,97 (d, 0,3H, J = 2,0 Гц), 8,91 (d, 0,7H, J = 2,0 Гц), 8,85-7,79 (m, 1H), 8,08-7,77 (m, 3H), 7,59-7,49 (m, 1H), 6,47 (d, 0,7H, J = 9,0 Гц), 6,07 (d, 0,3H, J = 9,0 Гц), 5,37-5,21 (m, 3H), 4,79-4,20 (m, 1H), 3,92-3,54 (m, 6H).
ВЭЖХ (HPLC): 92,5% (260 нм).
Пример 93 11,69 и 11,49 (2 brs, 1H), 8,97 (d, 0,3H, J = 2,0 Гц), 8,91 (d, 0,7H, J = 2,0 Гц), 8,85-7,79 (m, 1H), 8,08-7,77 (m, 3H), 7,59-7,49 (m, 1H), 6,47 (d, 0,7H, J = 9,0 Гц), 6,07 (d, 0,3H, J = 9,0 Гц), 5,37-5,21 (m, 3H), 4,79-4,20 (m, 1H), 3,92-3,54 (m, 6H).
ВЭЖХ (HPLC): 92,5% (260 нм).
Пример 933-Циано-9-фтор-12 -(  – D-глюкопиранозил]бензофуран[2,3-a]пиррол[3,4-c] карбазол-5,7-дион.
3-Бром-9-фтор-12 -( – D-глюкопиранозил]бензофуран[2,3-a]пиррол[3,4-c] карбазол-5,7-дион.
3-Бром-9-фтор-12 -( – D-глюкопиранозил] бензофуран[2,3-a]пиррол[3,4-c] карбазол-5,7-дион (189 мг 0,2 ммол) смешивают с цианидом цинка (14 мг, 0,6 ммол) и тетракис-(трифенилфосфин)палладием(0) (12 мг, 0,01 ммол) в очищенном от кислорода ДМФА (2 мл) и желтую кашицу нагревают при 80oC в атмосфере азота в течение 16 час. Смесь охлаждают до комнатной температуры, разбавляют EtOAc, промывают водой и рассолом, сушат (Na2SO4) и упаривают. Полученный остаток хроматографируют (гексан: EtOAc, 7:3) с получением 3-циан-9-фтор-12-(2,3,4,6-тетра-O-бензил – D-глюкопиранозил] бензофуран[2,3-a]пиррол[3,4-c] карбазол-5,7-дион (189 мг 0,2 ммол) смешивают с цианидом цинка (14 мг, 0,6 ммол) и тетракис-(трифенилфосфин)палладием(0) (12 мг, 0,01 ммол) в очищенном от кислорода ДМФА (2 мл) и желтую кашицу нагревают при 80oC в атмосфере азота в течение 16 час. Смесь охлаждают до комнатной температуры, разбавляют EtOAc, промывают водой и рассолом, сушат (Na2SO4) и упаривают. Полученный остаток хроматографируют (гексан: EtOAc, 7:3) с получением 3-циан-9-фтор-12-(2,3,4,6-тетра-O-бензил  – D-глюкопиранозил)бензофуран[2,3-a] пиррол[3,4-c] карбазол-5,7-диона (160 мг, 90% в виде желтого твердого вещества: IR (KBr) 2235 см-1. К раствору 3-циан-9-фтор-12-(2,3,4,6-тетра-O-бензил – – D-глюкопиранозил)бензофуран[2,3-a] пиррол[3,4-c] карбазол-5,7-диона (160 мг, 90% в виде желтого твердого вещества: IR (KBr) 2235 см-1. К раствору 3-циан-9-фтор-12-(2,3,4,6-тетра-O-бензил – – D-глюкопиранозил)бензофуран[2,3-a] пиррол[3,4-c] карбазол-5,7-диона (58 мг, 0,06 ммол) в 5 мл сухого CH2Cl2 добавляют по каплям треххлористый бор (0,39 мл, 1,0 М раствора в CH2Cl2) при -78oC. Полученный раствор доводят до 0oC и перемешивают в течение 2 час и затем снова охлаждают до -78oC, после чего добавляют метанол (5 мл). Полученную смесь согревают до комнатной температуры. Растворитель удаляют в вакууме и полученный осадок обрабатывают EtOAc/ТГФ и промывают 10% водной HCl и рассолом, затем высушивают (Na2SO4) и концентрируют растворитель. Очистка остатка с помощью ТСХ (ТГФ:гексан, 9:1) приводит к вышеназванному соединению (18 мг, 53%) в виде желтого твердого вещества: IR (KBr) 3417, 2220, 1757, 1708, 1635, 1478 см-1. 1H ЯМР (DMSO-d6, 400 МГц): – D-глюкопиранозил)бензофуран[2,3-a] пиррол[3,4-c] карбазол-5,7-диона (58 мг, 0,06 ммол) в 5 мл сухого CH2Cl2 добавляют по каплям треххлористый бор (0,39 мл, 1,0 М раствора в CH2Cl2) при -78oC. Полученный раствор доводят до 0oC и перемешивают в течение 2 час и затем снова охлаждают до -78oC, после чего добавляют метанол (5 мл). Полученную смесь согревают до комнатной температуры. Растворитель удаляют в вакууме и полученный осадок обрабатывают EtOAc/ТГФ и промывают 10% водной HCl и рассолом, затем высушивают (Na2SO4) и концентрируют растворитель. Очистка остатка с помощью ТСХ (ТГФ:гексан, 9:1) приводит к вышеназванному соединению (18 мг, 53%) в виде желтого твердого вещества: IR (KBr) 3417, 2220, 1757, 1708, 1635, 1478 см-1. 1H ЯМР (DMSO-d6, 400 МГц):  9,05 (s, 0,3H), 8,90 (s, 0,7H), 8,70-8,67 (m, 1H), 8,16-7,95 (m, 3H), 7,48-7,45 (m, 1H), 6,42 (d, 0,7H, J = 8,3 Гц), 6,11 (d, 0,3H, J = 8,3 Гц), 5,45-5,37 (m, 3H), 4,17-3,50 (7H); ВЭЖХ (HPLC): 91,4 o (260 нм).
Пример 94 9,05 (s, 0,3H), 8,90 (s, 0,7H), 8,70-8,67 (m, 1H), 8,16-7,95 (m, 3H), 7,48-7,45 (m, 1H), 6,42 (d, 0,7H, J = 8,3 Гц), 6,11 (d, 0,3H, J = 8,3 Гц), 5,45-5,37 (m, 3H), 4,17-3,50 (7H); ВЭЖХ (HPLC): 91,4 o (260 нм).
Пример 943-Йод-9-фтор-12 -(  – D-глюкопиранозил]бензофуран[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
3-Бром-9-фтор-12 -( – D-глюкопиранозил]бензофуран[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
3-Бром-9-фтор-12 -( – D-глюкопиранозил]бензофуран[2,3-a]пиррол[3,4-c]карбазол-5,7-дион (189 мг 0,2 ммол) смешивают с бис(трибутилолово) (0,2 мл, 0,4 ммол) и тетракис-(трифенилфосфин)палладием(0) (23 мг, 0,02 ммол) в очищенном от кислорода NMP (2 мл) и желтую кашицу нагревают при 90oC в атмосфере азота в течение 18 час. Смесь охлаждают до комнатной температуры, разбавляют EtOAc, промывают водой и рассолом, сушат (Na2SO4) и упаривают. Полученный остаток хроматографируют (гексан: EtOAc, 4:1) с получением 3-трибутилолово-9-фтор-12-(2,3,4,6-тетра-O-бензил – – D-глюкопиранозил]бензофуран[2,3-a]пиррол[3,4-c]карбазол-5,7-дион (189 мг 0,2 ммол) смешивают с бис(трибутилолово) (0,2 мл, 0,4 ммол) и тетракис-(трифенилфосфин)палладием(0) (23 мг, 0,02 ммол) в очищенном от кислорода NMP (2 мл) и желтую кашицу нагревают при 90oC в атмосфере азота в течение 18 час. Смесь охлаждают до комнатной температуры, разбавляют EtOAc, промывают водой и рассолом, сушат (Na2SO4) и упаривают. Полученный остаток хроматографируют (гексан: EtOAc, 4:1) с получением 3-трибутилолово-9-фтор-12-(2,3,4,6-тетра-O-бензил – – D-глюкопиранозил)бензофуран-[2,3-a] пиррол[3,4-c] карбазол-5,7-диона (160 мг, 90%) в виде желтого масла. К раствору этого желтого масла в 5 мл CH2Cl2 добавляют I2 (33 мг, 0,13 ммол) и смесь перемешивают при комнатной температуре в течение 0,5 час. Полученную смесь обрабатывают насыщенным NaHCO3, водой, рассолом, сушат и упаривают. Грубый остаток (118 мг, 91%) обрабатывают треххлористым бором (0,71 мл, 1,0 М раствора в CH2Cl2), как описано выше, и получают вышеназванное соединение в виде желтого твердого вещества: IR (KBr) 3140, 3040, 1753, 1703, 1405 см-1; 1H ЯМР (DMSO-d6 и D2O обмен., 400 МГц): – D-глюкопиранозил)бензофуран-[2,3-a] пиррол[3,4-c] карбазол-5,7-диона (160 мг, 90%) в виде желтого масла. К раствору этого желтого масла в 5 мл CH2Cl2 добавляют I2 (33 мг, 0,13 ммол) и смесь перемешивают при комнатной температуре в течение 0,5 час. Полученную смесь обрабатывают насыщенным NaHCO3, водой, рассолом, сушат и упаривают. Грубый остаток (118 мг, 91%) обрабатывают треххлористым бором (0,71 мл, 1,0 М раствора в CH2Cl2), как описано выше, и получают вышеназванное соединение в виде желтого твердого вещества: IR (KBr) 3140, 3040, 1753, 1703, 1405 см-1; 1H ЯМР (DMSO-d6 и D2O обмен., 400 МГц):  9,05 (d, 0,3H, J = 1,7 Гц), 8,89 (d, 0,7H, J = 1,7 Гц), 8,67 (dd, 0,3H, J = 9,5, 2,7 Гц), 8,62 (dd, 0,7H, J = 9,5, 2,7 Гц), 7,95-7,64 (m, 3H), 7,47-7,41 (m, 1H), 6,42 (d, 0,7H, J = 9,0 Гц), 6,00 (d, 0,3H, J = 9,0 Гц), 4,26-3,50 (m, 6H); ВЭЖХ (HPLC): 94,9% (320 нм).
Пример 95 9,05 (d, 0,3H, J = 1,7 Гц), 8,89 (d, 0,7H, J = 1,7 Гц), 8,67 (dd, 0,3H, J = 9,5, 2,7 Гц), 8,62 (dd, 0,7H, J = 9,5, 2,7 Гц), 7,95-7,64 (m, 3H), 7,47-7,41 (m, 1H), 6,42 (d, 0,7H, J = 9,0 Гц), 6,00 (d, 0,3H, J = 9,0 Гц), 4,26-3,50 (m, 6H); ВЭЖХ (HPLC): 94,9% (320 нм).
Пример 956-(4-Трет.бутилбензил)-2,3,9,10-тетрафтор-12-(2,3,4,6-тетра-O-бензил  – D-глюкопиранозил)бензофуран[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
К суспензии 6-(4-трет.бутилбензил)-2,3,9,10-тетрафториндол[2,3- a]пиррол[3,4-c] карбазол-5,7-диона (1,131 г, 2,08 ммол) и безводного Na2SO4 (5,0 г) в 25 мл сухого ТГФ добавляют тонко измельченный KOH (0,932 г, 16,6 ммол). Полученную смесь интенсивно перемешивают при комнатной температуре под Ar в течение 1,5 час. К полученной темно-пурпурной смеси добавляют раствор 2,3,4,6-тетра-O-бензил- – D-глюкопиранозил)бензофуран[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
К суспензии 6-(4-трет.бутилбензил)-2,3,9,10-тетрафториндол[2,3- a]пиррол[3,4-c] карбазол-5,7-диона (1,131 г, 2,08 ммол) и безводного Na2SO4 (5,0 г) в 25 мл сухого ТГФ добавляют тонко измельченный KOH (0,932 г, 16,6 ммол). Полученную смесь интенсивно перемешивают при комнатной температуре под Ar в течение 1,5 час. К полученной темно-пурпурной смеси добавляют раствор 2,3,4,6-тетра-O-бензил- -D-глюкопиранозил хлорида (1,450 г, 2,60 ммол) в 10 мл сухого ТГФ и продолжают перемешивание в течение 24 час. Добавляют дополнительно 0,200 г (0,36 ммол) хлорсахара и продолжают перемешивание еще в течение 24 час. Затем смесь разбавляют этилацетатом и гасят 1N HCl. Органическую фазу отделяют, промывают (рассол), сушат (Na2SO4) и упаривают с получением желтой пены. Флеш-хроматография (преадсорбируют на SiO2; элюируют смесью гексан-этилацетат, 5:1) дает продукт в виде светло-желтого стекловидного вещества. Это стекловидное вещество обрабатывают дихлорметаном и раствор разбавляют метанолом. Концентрирование этого раствора в роторном испарителе с последующим высушиванием в вакууме приводит к вышеназванному соединению (1,240 г, 54% в виде светло-желтого твердого вещества: IR (KBr) 3307, 3140, 1748, 1694, 1593, 1473, 1072 см-1; 1H ЯМР (DMSO-d6, 400 МГц): -D-глюкопиранозил хлорида (1,450 г, 2,60 ммол) в 10 мл сухого ТГФ и продолжают перемешивание в течение 24 час. Добавляют дополнительно 0,200 г (0,36 ммол) хлорсахара и продолжают перемешивание еще в течение 24 час. Затем смесь разбавляют этилацетатом и гасят 1N HCl. Органическую фазу отделяют, промывают (рассол), сушат (Na2SO4) и упаривают с получением желтой пены. Флеш-хроматография (преадсорбируют на SiO2; элюируют смесью гексан-этилацетат, 5:1) дает продукт в виде светло-желтого стекловидного вещества. Это стекловидное вещество обрабатывают дихлорметаном и раствор разбавляют метанолом. Концентрирование этого раствора в роторном испарителе с последующим высушиванием в вакууме приводит к вышеназванному соединению (1,240 г, 54% в виде светло-желтого твердого вещества: IR (KBr) 3307, 3140, 1748, 1694, 1593, 1473, 1072 см-1; 1H ЯМР (DMSO-d6, 400 МГц):  10,58 (s, 1H), 9,18 (dd, J = 10,7, 8,2 Гц, 1H), 9,07 (dd, J = 10,8, 8,2 Гц, 1H), 7,53 (d,] = 8,3 Гц, 1H), 7,41 (m, 6H), 7,28 (m, 8H), 7,22 (m, 4H), 6,94 (dd, J = 10,1, 6,5 Гц, 1H), 6,88 (t, J = 7,3 Гц, 1H), 6,81 (t, J = 7,3 Гц, 2H), 6,16 (d, J = 7,2 Гц, 2H), 5,75 (d, J = 8,4 Гц, 1H), 5,03 (d, J = 10,8 Гц, 1H), 4,96 (m, 2H), 4,78 (d, J = 10,8 Гц, 1H), 4,64 (d, J = 12,2 Гц, 1H), 4,58 (d, J = 12,2 Гц, 1H), 4,29 (t, J = 10,4 Гц, 1H), 4,07 (d, J = 10,1 Гц, 1H), 4,00-3,85 (m, 5H), 3,15 (d, J = 9,2 Гц, 1H), 1,28 (s, 9H).
Анал. Вычисл. C65H55F4N3O7: C, 73,22; H, 5,20; N, 3,94. Найдено: C, 72,92; H, 5,58; N, 4,02.
Пример 96 10,58 (s, 1H), 9,18 (dd, J = 10,7, 8,2 Гц, 1H), 9,07 (dd, J = 10,8, 8,2 Гц, 1H), 7,53 (d,] = 8,3 Гц, 1H), 7,41 (m, 6H), 7,28 (m, 8H), 7,22 (m, 4H), 6,94 (dd, J = 10,1, 6,5 Гц, 1H), 6,88 (t, J = 7,3 Гц, 1H), 6,81 (t, J = 7,3 Гц, 2H), 6,16 (d, J = 7,2 Гц, 2H), 5,75 (d, J = 8,4 Гц, 1H), 5,03 (d, J = 10,8 Гц, 1H), 4,96 (m, 2H), 4,78 (d, J = 10,8 Гц, 1H), 4,64 (d, J = 12,2 Гц, 1H), 4,58 (d, J = 12,2 Гц, 1H), 4,29 (t, J = 10,4 Гц, 1H), 4,07 (d, J = 10,1 Гц, 1H), 4,00-3,85 (m, 5H), 3,15 (d, J = 9,2 Гц, 1H), 1,28 (s, 9H).
Анал. Вычисл. C65H55F4N3O7: C, 73,22; H, 5,20; N, 3,94. Найдено: C, 72,92; H, 5,58; N, 4,02.
Пример 962,3,9,10-Тетрафтор-12 -(  – D-глюкопиранозил)индол[2,3-a] пиррол[3,4-c] карбазол-5,7-дион.
IR (KBr) 3432, 3310, 1743, 1702, 1475, 1331 см-1; 1H ЯМР (DMSO-d6, 400 МГц): – D-глюкопиранозил)индол[2,3-a] пиррол[3,4-c] карбазол-5,7-дион.
IR (KBr) 3432, 3310, 1743, 1702, 1475, 1331 см-1; 1H ЯМР (DMSO-d6, 400 МГц):  11,86 (s, 1H), 11,31 (s, 1H), 8,99 (dd, J = 11,1, 8,5 Гц, 1H), 8,92 (dd, J = 11,2, 8,3 Гц, 1H), 8,18 (dd, J = 11,7, 6,9 Гц, 1H), 7,62 (dd, J = 11,0, 7,0 Гц, 1H), 6,26 (d, J = 9,0 Гц, 1H), 6,19 (t, J = 4,2 Гц, 2H), 5,43 (d, J = 4,8 Гц, 1H), 5,17 (d, J = 5,7 Гц, 1H), 4,99 (d, J = 5,6 Гц, 1H), 4,10 (dd, J = 10,7, 4,2 Гц, 1H), 3,92 (m, 2H), 3,82 (m, 1H), 3,57 (m, 1H), 3,41 (m, 1H). ВЭЖХ (HPLC): 97,1% (320 нм).
Пример 97 11,86 (s, 1H), 11,31 (s, 1H), 8,99 (dd, J = 11,1, 8,5 Гц, 1H), 8,92 (dd, J = 11,2, 8,3 Гц, 1H), 8,18 (dd, J = 11,7, 6,9 Гц, 1H), 7,62 (dd, J = 11,0, 7,0 Гц, 1H), 6,26 (d, J = 9,0 Гц, 1H), 6,19 (t, J = 4,2 Гц, 2H), 5,43 (d, J = 4,8 Гц, 1H), 5,17 (d, J = 5,7 Гц, 1H), 4,99 (d, J = 5,6 Гц, 1H), 4,10 (dd, J = 10,7, 4,2 Гц, 1H), 3,92 (m, 2H), 3,82 (m, 1H), 3,57 (m, 1H), 3,41 (m, 1H). ВЭЖХ (HPLC): 97,1% (320 нм).
Пример 972,3,9,10-Тетрафтор-12-(6-фтор-6-дезокси –  – D-глюкопиранозил)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
IR (KBr) 3440, 3365, 1750, 1705, 1478 см-1; 1H ЯМР (DMSO-d6, 400 МГц): – D-глюкопиранозил)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
IR (KBr) 3440, 3365, 1750, 1705, 1478 см-1; 1H ЯМР (DMSO-d6, 400 МГц): 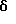 12,04 (s, 0,5H), 11,31 (s, 0,5H), 11,27 (s, 0,5H), 10,68 (s, 0,5H), 9,07 (dd, J = 11,3, 8,8 Гц, 0,5H), 8,95 (dd, J = 19,4, 9,2 Гц, 1H), 8,87 (dd, J = 10,9, 8,9 Гц, 0,5H), 8,17 (dd, J = 11,9, 6,9 Гц, 0,5H), 7,91 (dd, J = 11,5, 7,1 Гц, 1H), 7,71 (dd, J = 10,7, 6,9 Гц, 0,5H), 7,50 (dd, J = 9,6, 6,9 Гц, 0,5H), 6,34 (d, J = 8,8 Гц, 0,5H), 6,32 (d, J = 7,9 Гц, 2H), 5,98-4,73 (m, 5H), 4,22-3,46 (m, 4H). ВЭЖХ (HPLC): 98,2% (320 нм).
Пример 98 12,04 (s, 0,5H), 11,31 (s, 0,5H), 11,27 (s, 0,5H), 10,68 (s, 0,5H), 9,07 (dd, J = 11,3, 8,8 Гц, 0,5H), 8,95 (dd, J = 19,4, 9,2 Гц, 1H), 8,87 (dd, J = 10,9, 8,9 Гц, 0,5H), 8,17 (dd, J = 11,9, 6,9 Гц, 0,5H), 7,91 (dd, J = 11,5, 7,1 Гц, 1H), 7,71 (dd, J = 10,7, 6,9 Гц, 0,5H), 7,50 (dd, J = 9,6, 6,9 Гц, 0,5H), 6,34 (d, J = 8,8 Гц, 0,5H), 6,32 (d, J = 7,9 Гц, 2H), 5,98-4,73 (m, 5H), 4,22-3,46 (m, 4H). ВЭЖХ (HPLC): 98,2% (320 нм).
Пример 986-(4-Трет. бутилбензил)-2,3,9,10-тетрафтор-12-(2,3,4-три-O-бензил –  – D-галактопиранозил)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
Раствор 6-(4-трет.бутилбензил)-2,3,9,10-тетрафтор-12-(2,3,4- три-O-бензил-4-O-(метоксибензил) – – D-галактопиранозил)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
Раствор 6-(4-трет.бутилбензил)-2,3,9,10-тетрафтор-12-(2,3,4- три-O-бензил-4-O-(метоксибензил) – – D-галактопиранозил)индол[2,3-a] пиррол[3,4-c] карбазол-5,7-диона (0,135 г, 0,12 ммол) в 10 мл 10% TFA-CH2Cl2 перемешивают при комнатной температуре под Ar в течение 20 мин. Полученную смесь разбавляют дихлорметаном и затем промывают ее (насыщ. NaHCO3), сушат (MgSO4) и упаривают. Полученный остаток хроматографируют (SiO2/этилацетат-гексан, 1:2) с получением вышеназванного соединения (0,107 г, 90%) в виде желтого твердого вещества: – D-галактопиранозил)индол[2,3-a] пиррол[3,4-c] карбазол-5,7-диона (0,135 г, 0,12 ммол) в 10 мл 10% TFA-CH2Cl2 перемешивают при комнатной температуре под Ar в течение 20 мин. Полученную смесь разбавляют дихлорметаном и затем промывают ее (насыщ. NaHCO3), сушат (MgSO4) и упаривают. Полученный остаток хроматографируют (SiO2/этилацетат-гексан, 1:2) с получением вышеназванного соединения (0,107 г, 90%) в виде желтого твердого вещества:1H ЯМР (DMSO-d6, 400 МГц):  12,21 (s, 1H), 9,00 (dd, J = 11,1, 8,4 Гц, 1H), 8,90 (dd, J = 11,2, 8,4 Гц, 1H), 8,11 (dd, J = 12,0, 6,9 Гц, 1H), 7,61-7,18 (m, 15H), 6,71 (t, J = 7,4 Гц, 1H), 6,61 (t, J = 7,7 Гц, 2H), 6,39 (d, J = 9,2 Гц, 1H), 6,18 (d, J = 7,2 Гц, 2H), 4,89 (s, 2H), 4,87 (d, J = 13,9 Гц, 1H), 4,71 (d, J = 12,1 Гц, 1H), 4,58 (s, 1H), 4,49 (s, 2H), 4,33 (m, 1H), 4,20 (m, 2H), 4,00-3,66 (m, 4H), 3,58 (d, J = 11,2 Гц, 1H), 1,26 (s, 9H).
Пример 99 12,21 (s, 1H), 9,00 (dd, J = 11,1, 8,4 Гц, 1H), 8,90 (dd, J = 11,2, 8,4 Гц, 1H), 8,11 (dd, J = 12,0, 6,9 Гц, 1H), 7,61-7,18 (m, 15H), 6,71 (t, J = 7,4 Гц, 1H), 6,61 (t, J = 7,7 Гц, 2H), 6,39 (d, J = 9,2 Гц, 1H), 6,18 (d, J = 7,2 Гц, 2H), 4,89 (s, 2H), 4,87 (d, J = 13,9 Гц, 1H), 4,71 (d, J = 12,1 Гц, 1H), 4,58 (s, 1H), 4,49 (s, 2H), 4,33 (m, 1H), 4,20 (m, 2H), 4,00-3,66 (m, 4H), 3,58 (d, J = 11,2 Гц, 1H), 1,26 (s, 9H).
Пример 996-(4-Трет. бутилбензил)-2,3,9,10-тетрафтор-12-(2,3,4-три-O- бензил-4-дезокси  – D-галактопиранозил)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
К раствору 6-(4-трет.бутилбензил)-2,3,9,10-тетрафтор-12-(2,3,4-три-O-бензил – – D-галактопиранозил)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
К раствору 6-(4-трет.бутилбензил)-2,3,9,10-тетрафтор-12-(2,3,4-три-O-бензил – – D-галактопиранозил)индол[2,3-a] пиррол[3,4-c]карбазол-5,7-диона (0,402 г, 0641 ммол) в 10 мл ацетонитрила добавляют DMAP (0,100 г, 0,82 ммол), а затем фенилхлортионоформат (0,085 г, 0,49 ммол) и смесь нагревают при кипячении с обратным холодильником под Ar в течение 19 час. Затем добавляют дополнительно 0,043 г (0,25 ммол) фенилхлортионоформата и 0,030 г (0,25 ммол) DMAP и смесь нагревают при кипячении с обратным холодильником в течение 19 час. Охлажденную смесь распределяют между этилацетатом и насыщенным NaHCO3 и органическую фазу промывают, сушат и упаривают. Остаток подвергают флеш-хроматографии (SiO2/этилацетат-гексан, 1:3) и получают тионокарбонат (0,320 г, 0,29 ммол, 70%) в виде твердого вещества. Этот продукт растворяют в 10 мл толуола, раствор очищают продуванием струи Ar в течение 15 мин и затем добавляют AIBN (0,010 г, 0,06 ммол) и гидрид трибутилолова (0,126 г, 0,43 ммол). Полученный раствор нагревают при кипячении под Ar с обратным холодильником в течение 18 час. Затем добавляют дополнительно 0,043 г (0,25 ммол) трибутилолова и 0,010 г AIBN и продолжают нагревание при кипячении с обратным холодильником в течение 4 час. Охлажденную смесь упаривают и остаток подвергают флеш-хроматографии (SiO2/этилацетат-гексан, 1:2) и получают вышеназванное соединение (0,215, 78%) в виде желтого твердого вещества: – D-галактопиранозил)индол[2,3-a] пиррол[3,4-c]карбазол-5,7-диона (0,402 г, 0641 ммол) в 10 мл ацетонитрила добавляют DMAP (0,100 г, 0,82 ммол), а затем фенилхлортионоформат (0,085 г, 0,49 ммол) и смесь нагревают при кипячении с обратным холодильником под Ar в течение 19 час. Затем добавляют дополнительно 0,043 г (0,25 ммол) фенилхлортионоформата и 0,030 г (0,25 ммол) DMAP и смесь нагревают при кипячении с обратным холодильником в течение 19 час. Охлажденную смесь распределяют между этилацетатом и насыщенным NaHCO3 и органическую фазу промывают, сушат и упаривают. Остаток подвергают флеш-хроматографии (SiO2/этилацетат-гексан, 1:3) и получают тионокарбонат (0,320 г, 0,29 ммол, 70%) в виде твердого вещества. Этот продукт растворяют в 10 мл толуола, раствор очищают продуванием струи Ar в течение 15 мин и затем добавляют AIBN (0,010 г, 0,06 ммол) и гидрид трибутилолова (0,126 г, 0,43 ммол). Полученный раствор нагревают при кипячении под Ar с обратным холодильником в течение 18 час. Затем добавляют дополнительно 0,043 г (0,25 ммол) трибутилолова и 0,010 г AIBN и продолжают нагревание при кипячении с обратным холодильником в течение 4 час. Охлажденную смесь упаривают и остаток подвергают флеш-хроматографии (SiO2/этилацетат-гексан, 1:2) и получают вышеназванное соединение (0,215, 78%) в виде желтого твердого вещества:1H ЯМР (CDCl3, 400 МГц):  10,69 (s, 1H), 9,15 (dd, J = 10,7, 8,4 Гц, 1H), 9,06 (dd, J = 10,7, 8,3 Гц, 1H), 7,53-7,24 (m, 15H), 6,98 (dd, J = 10,1, 6,6 Гц, 1H), 6,83 (m, 1H), 6,78 (m, 2H), 6,18 (d, J = 7,0 Гц, 2H), 5,68 (d, J = 8,9 Гц, 1H), 4,95-4,68 (m, 5H), 4,19-3,75 (m, 7H), 3,30 (d, J = 10,5 Гц, 1H), 2,58 (m, 1H), 2,35 (m, 1H), 1,26 (s, 9H).
Пример 100 10,69 (s, 1H), 9,15 (dd, J = 10,7, 8,4 Гц, 1H), 9,06 (dd, J = 10,7, 8,3 Гц, 1H), 7,53-7,24 (m, 15H), 6,98 (dd, J = 10,1, 6,6 Гц, 1H), 6,83 (m, 1H), 6,78 (m, 2H), 6,18 (d, J = 7,0 Гц, 2H), 5,68 (d, J = 8,9 Гц, 1H), 4,95-4,68 (m, 5H), 4,19-3,75 (m, 7H), 3,30 (d, J = 10,5 Гц, 1H), 2,58 (m, 1H), 2,35 (m, 1H), 1,26 (s, 9H).
Пример 1002,3,9,10-Тетрафтор-12-(4-дезокси –  – D-глюкопиранозил)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
IR (KBr) 3440, 1745, 1710, 1474 см-1; 1H ЯМР (DMSO-d6, 400 МГц): – D-глюкопиранозил)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
IR (KBr) 3440, 1745, 1710, 1474 см-1; 1H ЯМР (DMSO-d6, 400 МГц):  11,89 (s, 1H), 11,31 (s, 1H), 8,99 (dd, J = 9,8, 8,9 Гц, 1H), 8,92 (dd, J = 10,3, 9,0 Гц, 1H), 8,14 (dd, J = 11,7, 6,5 Гц, 1H), 7,64 (dd, J = 10,5, 6,9 Гц, 1H), 6,21 (t, J = 4,5 Гц, 1H), 6,18 (d, J = 9,2 Гц, 1H), 5,07 (d, J = 5,6 Гц, 1H), 4,96 (d, J = 5,4 Гц, 1H), 4,28 (d, J = 12,1 Гц, 1H), 3,90-3,75 (m, 3H), 2,27 (m, 1H), 2,01 (m, 1H). ВЭЖХ (HPLC): 96,7% (320 нм).
Пример 101 11,89 (s, 1H), 11,31 (s, 1H), 8,99 (dd, J = 9,8, 8,9 Гц, 1H), 8,92 (dd, J = 10,3, 9,0 Гц, 1H), 8,14 (dd, J = 11,7, 6,5 Гц, 1H), 7,64 (dd, J = 10,5, 6,9 Гц, 1H), 6,21 (t, J = 4,5 Гц, 1H), 6,18 (d, J = 9,2 Гц, 1H), 5,07 (d, J = 5,6 Гц, 1H), 4,96 (d, J = 5,4 Гц, 1H), 4,28 (d, J = 12,1 Гц, 1H), 3,90-3,75 (m, 3H), 2,27 (m, 1H), 2,01 (m, 1H). ВЭЖХ (HPLC): 96,7% (320 нм).
Пример 1012,3,9,10-Тетрафтор-12-(2,3,4-три-O-бензил –  – D-глюкопиранозил)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
Раствор 2,3,9,10-тетрафтор-12-(2,3,4-три-O-бензил-6-O-(4-метоксибензил) – – D-глюкопиранозил)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
Раствор 2,3,9,10-тетрафтор-12-(2,3,4-три-O-бензил-6-O-(4-метоксибензил) – – D-глюкопиранозил)индол[2,3-a] пиррол[3,4-c]карбазол-5,7-диона (0,410 г, 0,43 ммол) в 10 мл 10% TFA-CH2Cl2 перемешивают при комнатной температуре под Ar в течение 15 мин. Полученную смесь разбавляют этилацетатом (50 мл) и затем промывают ее (1М, NaHCO3, 2 х 50 мл; H2O, 2 х 50 мл; рассол, 50 мл), сушат (MgSO4) и упаривают. Полученный остаток хроматографируют (SiO2/2-26% этилацетат-гексан) с получением вышеназванного соединения (0,346 г, 97%) в виде желтого твердого вещества: – D-глюкопиранозил)индол[2,3-a] пиррол[3,4-c]карбазол-5,7-диона (0,410 г, 0,43 ммол) в 10 мл 10% TFA-CH2Cl2 перемешивают при комнатной температуре под Ar в течение 15 мин. Полученную смесь разбавляют этилацетатом (50 мл) и затем промывают ее (1М, NaHCO3, 2 х 50 мл; H2O, 2 х 50 мл; рассол, 50 мл), сушат (MgSO4) и упаривают. Полученный остаток хроматографируют (SiO2/2-26% этилацетат-гексан) с получением вышеназванного соединения (0,346 г, 97%) в виде желтого твердого вещества:IR (CH2Cl2) 3333, 1753, 1700, 1478, 1093 см-1; 1H ЯМР (DMSO-d6, 400 МГц):  11,76 (s, 1H), 11,33 (s, 1H), 8,99 (dd, J = 10,8, 8,5 Гц, 1H), 8,93 (dd, J = 10,9, 8,5 Гц, 1H), 8,14 (dd, J = 11,8, 6,8 Гц, 1H), 7,66 (dd, J = 10,7, 6,9 Гц, 1H), 7,40 (m, 5H), 7,26 (m, 5H), 6,98 (t, J = 7,4 Гц, 1H), 6,83 (t, J = 7,6 Гц, 2H), 6,55 (d, J = 8,9 Гц, 1H), 6,44 (m, 1H), 6,10 (d, J = 7,6 Гц, 1H), 4,96 (d, J = 11,1 Гц, 1H), 4,92 (d, J = 11,0 Гц, 1H), 4,82 (m, 2H), 4,23 (t, J = 9,4 Гц, 1H), 4,20-4,06 (m, 3H), 3,98-3,95 (m, 2H), 3,66 (t, J = 9,0 Гц, 1H), 2,94 (d, J = 10,6 Гц, 1H); ВЭЖХ (HPLC): 98,9% (320 нм).
Анал. Вычисл. C47H35F4N3O7: C, 68,03; H, 4,25; N, 5,07. Найдено: C, 68,00; H, 4,72; N, 4,79.
Пример 102 11,76 (s, 1H), 11,33 (s, 1H), 8,99 (dd, J = 10,8, 8,5 Гц, 1H), 8,93 (dd, J = 10,9, 8,5 Гц, 1H), 8,14 (dd, J = 11,8, 6,8 Гц, 1H), 7,66 (dd, J = 10,7, 6,9 Гц, 1H), 7,40 (m, 5H), 7,26 (m, 5H), 6,98 (t, J = 7,4 Гц, 1H), 6,83 (t, J = 7,6 Гц, 2H), 6,55 (d, J = 8,9 Гц, 1H), 6,44 (m, 1H), 6,10 (d, J = 7,6 Гц, 1H), 4,96 (d, J = 11,1 Гц, 1H), 4,92 (d, J = 11,0 Гц, 1H), 4,82 (m, 2H), 4,23 (t, J = 9,4 Гц, 1H), 4,20-4,06 (m, 3H), 3,98-3,95 (m, 2H), 3,66 (t, J = 9,0 Гц, 1H), 2,94 (d, J = 10,6 Гц, 1H); ВЭЖХ (HPLC): 98,9% (320 нм).
Анал. Вычисл. C47H35F4N3O7: C, 68,03; H, 4,25; N, 5,07. Найдено: C, 68,00; H, 4,72; N, 4,79.
Пример 1022,3,9,10-Тетрафтор-12-((2,3,4-три-O-бензил –  – D-глюкопиранозид)уронат)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
К раствору 2,3,9,10-тетрафтор-12-(2,3,4-три-O-бензил – – D-глюкопиранозид)уронат)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
К раствору 2,3,9,10-тетрафтор-12-(2,3,4-три-O-бензил – – D-глюкопиранозил)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-диона (0,125 г, 0,15 ммол) в 12 мл сухого ДМФА добавляют пиридиний дихромат (ПДХ) (0,282 г, 0,75 ммол) и смесь перемешивают при комнатной температуре в течение 4 час. Добавляют дополнительно ПДХ (0,282 г (0,75 ммол) и повторяют это через 24 час. Всего добавляют 1,128 г (3,0 ммол) ПДХ и реакция осуществляется в течение 4 дней. Полученную смесь охлаждают до 5oC, обрабатывают 10 мл насыщенного NaHSOS и затем разбавляют водой (25 мл). Смесь экстрагируют смесью этилацетат-ТГФ (1:1, 4 х 25 мл) и объединенный экстракт промывают (2 х 25 мл насыщ. NaHSO3, 25 мл рассола), сушат (MgSO4) и упаривают. Полученный остаток хроматографируют (SiO2/0-20% MeOH-CH2Cl2) с получением вышеназванного соединения (-0,069 г, 55%) в виде желтого твердого вещества: – D-глюкопиранозил)индол[2,3-a]пиррол[3,4-c]карбазол-5,7-диона (0,125 г, 0,15 ммол) в 12 мл сухого ДМФА добавляют пиридиний дихромат (ПДХ) (0,282 г, 0,75 ммол) и смесь перемешивают при комнатной температуре в течение 4 час. Добавляют дополнительно ПДХ (0,282 г (0,75 ммол) и повторяют это через 24 час. Всего добавляют 1,128 г (3,0 ммол) ПДХ и реакция осуществляется в течение 4 дней. Полученную смесь охлаждают до 5oC, обрабатывают 10 мл насыщенного NaHSOS и затем разбавляют водой (25 мл). Смесь экстрагируют смесью этилацетат-ТГФ (1:1, 4 х 25 мл) и объединенный экстракт промывают (2 х 25 мл насыщ. NaHSO3, 25 мл рассола), сушат (MgSO4) и упаривают. Полученный остаток хроматографируют (SiO2/0-20% MeOH-CH2Cl2) с получением вышеназванного соединения (-0,069 г, 55%) в виде желтого твердого вещества:IR (CH2Cl2) 3412, 3260, 1746, 1710, 1597, 1477, 1320 см-1; 1H ЯМР (DMSO-d6, 400 МГц):  11,21 (s, 1H), 9,02 (dd, J = 10,8, 8,8 Гц, 1H), 8,57 (brs, 1H), 8,00 (m, 1H), 7,85 (m, 1H), 7,45 (d, J = 7,0 Гц, 1H), 7,33 (m, 3H), 7,19 (s, 5H), 7,00 (t, J = 7,4 Гц, 1H), 6,86 (t, J = 7,5 Гц, 2H), 6,38 (d, J = 7,2 Гц, 1H), 6,07 (d, J = 7,3 Гц, 1H), 4,93 (d, J = 10,8 Гц, 1H), 4,77 (d, J = 11,2 Гц, 1H), 4,73 (d, J = 10,8 Гц, 1H), 4,64 (d, J = 11,2 Гц, 1H), 4,29 (d, J = 8,8 Гц, 1H), 4,04 (m, 1H), 3,89 (m, 2H), 3,35 (m, 1H), 2,82 (m, 1H).
Пример 103 11,21 (s, 1H), 9,02 (dd, J = 10,8, 8,8 Гц, 1H), 8,57 (brs, 1H), 8,00 (m, 1H), 7,85 (m, 1H), 7,45 (d, J = 7,0 Гц, 1H), 7,33 (m, 3H), 7,19 (s, 5H), 7,00 (t, J = 7,4 Гц, 1H), 6,86 (t, J = 7,5 Гц, 2H), 6,38 (d, J = 7,2 Гц, 1H), 6,07 (d, J = 7,3 Гц, 1H), 4,93 (d, J = 10,8 Гц, 1H), 4,77 (d, J = 11,2 Гц, 1H), 4,73 (d, J = 10,8 Гц, 1H), 4,64 (d, J = 11,2 Гц, 1H), 4,29 (d, J = 8,8 Гц, 1H), 4,04 (m, 1H), 3,89 (m, 2H), 3,35 (m, 1H), 2,82 (m, 1H).
Пример 1032,3,9,10-Тетрафтор-12-[ (  – D-глюкопиранозид)уроновая кислота] индол-[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
Смесь 2,3,9,10-тетрафтор-12-[(2,3,4-три-O-бензил – – D-глюкопиранозид)уроновая кислота] индол-[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
Смесь 2,3,9,10-тетрафтор-12-[(2,3,4-три-O-бензил – – D-глюкопиранозид)уронат]индол[2,3-a]пиррол[3,4-c]карбазол-5,7-диона (0,030 г, 0,035 ммол) и 20% гидроксида палладия на угле (0,030 г) в смеси метанола (5 мл) и тетрагидрофурана (5 мл) гидрируют при 1 атм в течение 20 час. Добавляют еще 30 мг 20% гидроксида палладия на угле и продолжают гидрирование в течение еще 24 час. Полученную смесь фильтруют, осадок промывают ТГФ-MeOH-H2O (10:10:1, 4х5 мл) и фильтрат упаривают с получением твердого остатка. Флеш-хроматография (SiO2/2-20% MeOH-ТГФ и затем смесь 20% MeOH-ТГФ, содержащая 1-4% 2O) приводит к вышеназванному соединению (0,006 г, 30%) в виде желтого твердого вещества: – D-глюкопиранозид)уронат]индол[2,3-a]пиррол[3,4-c]карбазол-5,7-диона (0,030 г, 0,035 ммол) и 20% гидроксида палладия на угле (0,030 г) в смеси метанола (5 мл) и тетрагидрофурана (5 мл) гидрируют при 1 атм в течение 20 час. Добавляют еще 30 мг 20% гидроксида палладия на угле и продолжают гидрирование в течение еще 24 час. Полученную смесь фильтруют, осадок промывают ТГФ-MeOH-H2O (10:10:1, 4х5 мл) и фильтрат упаривают с получением твердого остатка. Флеш-хроматография (SiO2/2-20% MeOH-ТГФ и затем смесь 20% MeOH-ТГФ, содержащая 1-4% 2O) приводит к вышеназванному соединению (0,006 г, 30%) в виде желтого твердого вещества:IR (KBr) 3425, 3260, 1740, 1707, 1600, 1475, 1322 см-1; 1H ЯМР (DMSO-d6, 400 МГц):  13,11 (br s, 1H), 10,96 (br s, 1H), 9,02-7,51 (m, 5H), 6,21 (d, J = 8,9 Гц, 1H), 5,4-4,0 (m, 8H).
Пример 104 13,11 (br s, 1H), 10,96 (br s, 1H), 9,02-7,51 (m, 5H), 6,21 (d, J = 8,9 Гц, 1H), 5,4-4,0 (m, 8H).
Пример 1043-Карбокси-9-фтор-12 -(  – D-глюкопиранозил)бензофуран[2,3-a] пиррол-[3,4-c]карбазол-5,7-дион.
3-Циан-9-фтор-12-(2,3,4,6-тетра-O-бензил – – D-глюкопиранозил)бензофуран[2,3-a] пиррол-[3,4-c]карбазол-5,7-дион.
3-Циан-9-фтор-12-(2,3,4,6-тетра-O-бензил – – D-глюкопиранозил)бензофуран[2,3-a] пиррол[3,4-c] карбазол-5,7-дион (380 мг, 0,43 ммол) в EtOH: ТГФ (10 мл:5 мл) добавляют 4,0 М раствор NaOH (10 мл). Смесь осторожно кипятят с обратным холодильником в течение 24 час. Эту полученную смесь охлаждают до 0oC и обрабатывают концентрированной HCl (15 мл). Раствор перемешивают при комнатной температуре в течение 24 час и затем обрабатывают EyOH: ТГФ и промывают водой и рассолом, после чего высушивают и концентрируют растворитель. К этому остатку добавляют твердый ацетат аммония (5,0 г) и смесь расплавляют при 150oC в течение 1 часа, затем охлаждают, разбавляют EtOH: ТГФ, промывают водой, рассолом, сушат (Na2SO4) и концентрируют. Порцию этого неочищенного продукта (60 мг) гидрируют (Pd/C), как описано выше с получением вышеназванного соединения (18 мг, 50%) в виде желтого твердого вещества: IR (KBr) 3420, 1756, 1710, 1561, 1395 см-1; 1H ЯМР (DMSO-d6 и D2O обмен. , 400 МГц): – D-глюкопиранозил)бензофуран[2,3-a] пиррол[3,4-c] карбазол-5,7-дион (380 мг, 0,43 ммол) в EtOH: ТГФ (10 мл:5 мл) добавляют 4,0 М раствор NaOH (10 мл). Смесь осторожно кипятят с обратным холодильником в течение 24 час. Эту полученную смесь охлаждают до 0oC и обрабатывают концентрированной HCl (15 мл). Раствор перемешивают при комнатной температуре в течение 24 час и затем обрабатывают EyOH: ТГФ и промывают водой и рассолом, после чего высушивают и концентрируют растворитель. К этому остатку добавляют твердый ацетат аммония (5,0 г) и смесь расплавляют при 150oC в течение 1 часа, затем охлаждают, разбавляют EtOH: ТГФ, промывают водой, рассолом, сушат (Na2SO4) и концентрируют. Порцию этого неочищенного продукта (60 мг) гидрируют (Pd/C), как описано выше с получением вышеназванного соединения (18 мг, 50%) в виде желтого твердого вещества: IR (KBr) 3420, 1756, 1710, 1561, 1395 см-1; 1H ЯМР (DMSO-d6 и D2O обмен. , 400 МГц):  9,26 (brs, 1H), 8,83-8,76 (m, 1H), 8,22 (brs, 1H), 7,99-7,96 (m, 1H), 7,83-7,68 (m, 1H), 7,55- 7,45 (m, 1H), 6,51 (d, 0,6H, J = 8,9 Гц), 5,99 (d, 0,4H, J = 8,9 Гц), 4,31-3,43 (m, 6H); ВЭЖХ (HPLC): 94,0% (320 нм).
Пример 105 9,26 (brs, 1H), 8,83-8,76 (m, 1H), 8,22 (brs, 1H), 7,99-7,96 (m, 1H), 7,83-7,68 (m, 1H), 7,55- 7,45 (m, 1H), 6,51 (d, 0,6H, J = 8,9 Гц), 5,99 (d, 0,4H, J = 8,9 Гц), 4,31-3,43 (m, 6H); ВЭЖХ (HPLC): 94,0% (320 нм).
Пример 1053,9-Дифтор-6-[(2-гуанидин)-этил]-12,13-дигидро-13 -(  – D-глюкопиранозил] -5 – D-глюкопиранозил] -5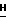 -индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
К перемешиваемому магнитной мешалкой раствору чистого продукта из примера 10 (3,35 г, 3,25 ммол) в абсолютном этаноле (600 мл) добавляют водный гидроксид калия (4,45 М, 60,0 мл, 267 ммол). Полученный темно-красный раствор нагревают в открытом сосуде, пока полтора объема этанола не упарится (около 3 час). Смесь охлаждают в струе азота и добавляют концентрированную HCl (12 N; 175 мл). Смесь перемешивают 15 мин и затем распределяют между водой (300 мл) и этилацетатом (800 мл). Органический слой промывают водой (300 мл), насыщенным водным бикарбонатом натрия (300 мл), сушат (Na2SO4) и упаривают в вакууме. Полученный твердый ангидрид обрабатывают этилендиамином (50 мл) и нагревают при кипячении в течение около 4-5 час, растворяют в абсолютном этаноле (175 мл), кипятят с обратным холодильником в течение 6 час и концентрируют в вакууме. Очистка флеш-хроматографией на силикагеле с использованием 2-10% метанола в метиленхлориде дает 1,72 г (55%) чистого 6N-(2-амино)-этил производного исходного соединения в виде оранжево-желтого твердого вещества: 300 МГц 1H ЯМР (CDCl3): -индол[2,3-a]пиррол[3,4-c]карбазол-5,7-дион.
К перемешиваемому магнитной мешалкой раствору чистого продукта из примера 10 (3,35 г, 3,25 ммол) в абсолютном этаноле (600 мл) добавляют водный гидроксид калия (4,45 М, 60,0 мл, 267 ммол). Полученный темно-красный раствор нагревают в открытом сосуде, пока полтора объема этанола не упарится (около 3 час). Смесь охлаждают в струе азота и добавляют концентрированную HCl (12 N; 175 мл). Смесь перемешивают 15 мин и затем распределяют между водой (300 мл) и этилацетатом (800 мл). Органический слой промывают водой (300 мл), насыщенным водным бикарбонатом натрия (300 мл), сушат (Na2SO4) и упаривают в вакууме. Полученный твердый ангидрид обрабатывают этилендиамином (50 мл) и нагревают при кипячении в течение около 4-5 час, растворяют в абсолютном этаноле (175 мл), кипятят с обратным холодильником в течение 6 час и концентрируют в вакууме. Очистка флеш-хроматографией на силикагеле с использованием 2-10% метанола в метиленхлориде дает 1,72 г (55%) чистого 6N-(2-амино)-этил производного исходного соединения в виде оранжево-желтого твердого вещества: 300 МГц 1H ЯМР (CDCl3):  10,65 (br s, 2H), 9,05 (dd, 1H), 8,94 (dd, 1H), 7,55 (dd, 1H), 7,45-7,14 (m, 18H), 7,00 (t, 1H), 6,87 (t, 2H), 6,14 (d, 2H), 5,95 (d, 1H), 5,05-4,58 (m, 6H), 4,40-4,34 (m, 1H), 4,12-3,85 (m, 8H), 3,22-3,15 (m, 2H), 2,96 (d, 1H); Полож. ESI масс-спектр, m/e 927 (M+H)+.
К перемешиваемому магнитной мешалкой раствору чистого вышеполученного продукта (1,72 г, 1,86 ммол) в безводном ТГФ (20 мл) добавляют N,N-диизопропилэтиламин (314 мл) и N,N’-бис(бензилоксикарбонил)-5-метилизотиомочевину (800 мг, 2,23 ммол: K. Nowak, L. Rania Rocz. Chem. 1969, 43. 1953) и реакцию нагревают в масляной бане при 70oC (температура бани) в течение 24 час. Раствор охлаждают до комнатной температуры, упаривают в вакууме и очищают флеш-хроматографией на силикагеле с использованием 5% этилацетата в метиленхлориде с получением 1,57 г (68%) чистого ди-CBz-защищенного гуанидин-производного исходного амина в виде желтого твердого вещества: 300 МГц 1H ЯМР (CDCl3): 10,65 (br s, 2H), 9,05 (dd, 1H), 8,94 (dd, 1H), 7,55 (dd, 1H), 7,45-7,14 (m, 18H), 7,00 (t, 1H), 6,87 (t, 2H), 6,14 (d, 2H), 5,95 (d, 1H), 5,05-4,58 (m, 6H), 4,40-4,34 (m, 1H), 4,12-3,85 (m, 8H), 3,22-3,15 (m, 2H), 2,96 (d, 1H); Полож. ESI масс-спектр, m/e 927 (M+H)+.
К перемешиваемому магнитной мешалкой раствору чистого вышеполученного продукта (1,72 г, 1,86 ммол) в безводном ТГФ (20 мл) добавляют N,N-диизопропилэтиламин (314 мл) и N,N’-бис(бензилоксикарбонил)-5-метилизотиомочевину (800 мг, 2,23 ммол: K. Nowak, L. Rania Rocz. Chem. 1969, 43. 1953) и реакцию нагревают в масляной бане при 70oC (температура бани) в течение 24 час. Раствор охлаждают до комнатной температуры, упаривают в вакууме и очищают флеш-хроматографией на силикагеле с использованием 5% этилацетата в метиленхлориде с получением 1,57 г (68%) чистого ди-CBz-защищенного гуанидин-производного исходного амина в виде желтого твердого вещества: 300 МГц 1H ЯМР (CDCl3):  11,80 (br s, 1H), 10,70 (br s, 1H), 9,18 (br s, 1H), 9,08 (dd, 1H), 8,92 (dd, 1H), 7,62-7,10 (m, 24H), 6,96 (t, 1H), 6,85 11,80 (br s, 1H), 10,70 (br s, 1H), 9,18 (br s, 1H), 9,08 (dd, 1H), 8,92 (dd, 1H), 7,62-7,10 (m, 24H), 6,96 (t, 1H), 6,85(t, 2H), 6,13 (d, 2H), 5,95 (d, 1H), 5,20-4,60 (m, 10H), 4,36 (t, 1H), 4,20-3,85 (m, 10H), 3,02 (d, 1H). К раствору вышеполученного продукта (1,58 г, 1,38 ммол) в смеси 3:1 метанол/этилацетат (120 мл) и 1N HCl (18 мл) в атмосфере азота добавляют 20% гидроксида палладия (II) на угле (722 мг). Смесь помещают в качалку (трясучку) для гидрирования (parr shaker) при давлении водорода 65 psi на 3 дня и затем фильтруют через небольшой слой целита. Целит промывают метанолом (3 х 50 мл) и концентрируют в вакууме с получением оранжевого твердого вещества. Очистка на Sephadex LH-20 элюированием метанолом дает 754 мг (91%) вышеназванного соединения в виде красно-оранжевого твердого вещества: 500 МГц 1H ЯМР (CD3OD):  8,83 (dd, 1H, J = 9,7, 2,8 Гц), 8,73 (dd, 1H, J = 8,9, 2,5 Гц), 7,77 (dd, 1H, J = 9,2, 4,1 Гц), 7,63 (dd, 1H, J = 8,9, 4,4 Гц), 7,34-7,25 (m, 2H), 6,15 (d, 1H, J = 8,5 Гц), 4,32-4,17 (m, 2H), 4,11-3,97 (m, 2H), 3,91-3,84 (m, 2H), 3,78-3,66 (m, 2H), 3,60-3,53 (m, 2H). FAB масс-спектр, m/e 609 (M+H)+.
Пример 106 8,83 (dd, 1H, J = 9,7, 2,8 Гц), 8,73 (dd, 1H, J = 8,9, 2,5 Гц), 7,77 (dd, 1H, J = 9,2, 4,1 Гц), 7,63 (dd, 1H, J = 8,9, 4,4 Гц), 7,34-7,25 (m, 2H), 6,15 (d, 1H, J = 8,5 Гц), 4,32-4,17 (m, 2H), 4,11-3,97 (m, 2H), 3,91-3,84 (m, 2H), 3,78-3,66 (m, 2H), 3,60-3,53 (m, 2H). FAB масс-спектр, m/e 609 (M+H)+.
Пример 1062,3,9,10-Тетрафтор-12-(2,3,4-три-O-бензил –  – D-глюкопиранозил-индол[2,3-a]-пиррол[3,4-c]карбазол-5,7-дион (R5, R’5 = F, R2-R4 = OH, X1, X’1, X2, X’2 = F, Q = NH) – D-глюкопиранозил-индол[2,3-a]-пиррол[3,4-c]карбазол-5,7-дион (R5, R’5 = F, R2-R4 = OH, X1, X’1, X2, X’2 = F, Q = NH)Раствор 2,3,9,10-тетрафтор-12-((6-дезокси-6,6-дифтор –  – D-глюкопиранозилиндол[2,3-a] -пиррол[3,4-c]карбазол-5,7-диона (0,166 г, 0,20 ммол) в 5 мл дихлорметана добавляют к холодному (5oC) раствору периодинана Десс-Мартина (0,106 г, 0,25 ммол) в 5 мл дихлорметана. Полученную смесь перемешивают при комнатной температуре в атмосфере аргона в течение 2 час. Реакционную смесь последовательно разбавляют этилацетатом (25 мл), промывают (1М NaHCO3 – 30% Na2S2O3, 2х10 мл; 1М NaHCO3, 2х10 мл; H2O, 10 мл; рассол, 10 мл), сушат (MgSO4) и упаривают. Полученный остаток хроматографируют (SiO2/2-30% этилацетат-гексан) и получают 2,3,9,10-тетрафтор-12-((2,3,4-три-O-бензил – – D-глюкопиранозилиндол[2,3-a] -пиррол[3,4-c]карбазол-5,7-диона (0,166 г, 0,20 ммол) в 5 мл дихлорметана добавляют к холодному (5oC) раствору периодинана Десс-Мартина (0,106 г, 0,25 ммол) в 5 мл дихлорметана. Полученную смесь перемешивают при комнатной температуре в атмосфере аргона в течение 2 час. Реакционную смесь последовательно разбавляют этилацетатом (25 мл), промывают (1М NaHCO3 – 30% Na2S2O3, 2х10 мл; 1М NaHCO3, 2х10 мл; H2O, 10 мл; рассол, 10 мл), сушат (MgSO4) и упаривают. Полученный остаток хроматографируют (SiO2/2-30% этилацетат-гексан) и получают 2,3,9,10-тетрафтор-12-((2,3,4-три-O-бензил – – D-глюкопиранозид)-урональдегид)индол[2,3-a] -пиррол[3,4-c] карбазол-5,7-дион (0,118 г, 71% в виде бледно-желтого твердого вещества: IR (CH2Cl2) 3344, 2930, 1753, 1724, 1597, 1479 см-1; 1H ЯМР (CDCl3, 400 МГц): – D-глюкопиранозид)-урональдегид)индол[2,3-a] -пиррол[3,4-c] карбазол-5,7-дион (0,118 г, 71% в виде бледно-желтого твердого вещества: IR (CH2Cl2) 3344, 2930, 1753, 1724, 1597, 1479 см-1; 1H ЯМР (CDCl3, 400 МГц):  11,08 (s, 0,3H), 10,68 (s, 1H), 3,85 (s, 0,3H), 8,97 (m, 0,3H), 8,79 (m, 0,3H), 8,43 (m, 1H), 7,99 (br s, 0,7H), 7,83 (m, 1H), 7,68 (m, 0,3H), 7,53-6,73 (m, 14H), 6,27 (m, 1H), 6,05 (d, J = 7,2 Гц, 2H), 5,80 (d, J = 9,0 Гц, 1H), 5,61 (s, 2H), 5,09 (d, J = 11,1 Гц, 1H), 4,91 (m, 3H), 4,29-3,85 (m, 4H), 3,74 (t, J = 8,8 Гц, 1H), 2,92 (d, J = 10,3 Гц, 1H).
К холодному (5oC) раствору альдегида (0,053 г, 0,085 ммол) в 5 мл дихлорметана в атмосфере аргона добавляют по каплям DAST (0,022 мл, 0,17 ммол). Полученную смесь перемешивают при комнатной температуре в течение 18 час. Реакционную смесь затем разбавляют этилацетатом (20 мл), промывают (1М NaHCO3 – 30% Na2S2O3, 2х10 мл; 1М NaHCO3, 2х10 мл; H2O, 10 мл; рассол, 10 мл), сушат (MgSO4) и упаривают. Остаток хроматографируют (SiO2/2-24% этилацетат-гексан) и получают 2,3,9,10-тетрафтор-12-(2,3,4-три-O-бензил-6-дезокси-6,6-дифтор – 11,08 (s, 0,3H), 10,68 (s, 1H), 3,85 (s, 0,3H), 8,97 (m, 0,3H), 8,79 (m, 0,3H), 8,43 (m, 1H), 7,99 (br s, 0,7H), 7,83 (m, 1H), 7,68 (m, 0,3H), 7,53-6,73 (m, 14H), 6,27 (m, 1H), 6,05 (d, J = 7,2 Гц, 2H), 5,80 (d, J = 9,0 Гц, 1H), 5,61 (s, 2H), 5,09 (d, J = 11,1 Гц, 1H), 4,91 (m, 3H), 4,29-3,85 (m, 4H), 3,74 (t, J = 8,8 Гц, 1H), 2,92 (d, J = 10,3 Гц, 1H).
К холодному (5oC) раствору альдегида (0,053 г, 0,085 ммол) в 5 мл дихлорметана в атмосфере аргона добавляют по каплям DAST (0,022 мл, 0,17 ммол). Полученную смесь перемешивают при комнатной температуре в течение 18 час. Реакционную смесь затем разбавляют этилацетатом (20 мл), промывают (1М NaHCO3 – 30% Na2S2O3, 2х10 мл; 1М NaHCO3, 2х10 мл; H2O, 10 мл; рассол, 10 мл), сушат (MgSO4) и упаривают. Остаток хроматографируют (SiO2/2-24% этилацетат-гексан) и получают 2,3,9,10-тетрафтор-12-(2,3,4-три-O-бензил-6-дезокси-6,6-дифтор – – D-глюкопиранозил)индол[2,3-a]-пиррол[3,4-c]карбазол-5,7-дион (0,046 г, 85%) в виде бледно-желтого твердого вещества: IR (CH2Cl2) 3400, 1757, 1728, 1598, 1478, 1320 см-1; 1H ЯМР (CDCl3, 400 МГц): – D-глюкопиранозил)индол[2,3-a]-пиррол[3,4-c]карбазол-5,7-дион (0,046 г, 85%) в виде бледно-желтого твердого вещества: IR (CH2Cl2) 3400, 1757, 1728, 1598, 1478, 1320 см-1; 1H ЯМР (CDCl3, 400 МГц):  9,98 (s, 1H), 8,85 (s, 2H), 7,71 (m, 1H), 7,51-7,26 (m, 11H), 7,09 (m, 1H), 7,00 (t, J = 7,4 Гц, 1H), 6,85 (t, J = 7,5 Гц, 2H), 6,24 (t, J = 53,7 Гц, 1H), 6,13 (d, J = 7,2 Гц, 2H), 5,80 (d, J = 9,0 Гц, 1H), 5,04 (d, J = 11,2 Гц, 1H), 4,89 (s, 2H), 4,84 (d, J = 11,2 Гц, 1H), 4,23 (m, 1H), 4,3 (m, 2H), 3,95 (d, J = 10,3 Гц, 1H), 3,81 (m, 1H), 3,04 (m, 1H); MS (ESI) m/e 848 (M-H).
Смесь три-O-бензилглюкопиранозида (0,035 г, 0,041 ммол) и 20% Pd(OH)2-C в смеси метанола (5 мл) и хлороформа (2 мл) гидрируют при давлении 1 атм в течение 16 час. Полученную смесь фильтруют и осадок на фильтре промывают смесью тетрагидрофуран- метанол (1:1). Фильтрат упаривают и остаток хроматографируют (SiO2/2-12% MeOH-CH2Cl2) и получают вышеназванное соединение (0,019 г, 80% в виде желтого твердого вещества: IR (KBr) 3385, 1748, 1713, 1595, 1476, 1326 см-1; 1H ЯМР (ТГФ-d8, 400 МГц): 9,98 (s, 1H), 8,85 (s, 2H), 7,71 (m, 1H), 7,51-7,26 (m, 11H), 7,09 (m, 1H), 7,00 (t, J = 7,4 Гц, 1H), 6,85 (t, J = 7,5 Гц, 2H), 6,24 (t, J = 53,7 Гц, 1H), 6,13 (d, J = 7,2 Гц, 2H), 5,80 (d, J = 9,0 Гц, 1H), 5,04 (d, J = 11,2 Гц, 1H), 4,89 (s, 2H), 4,84 (d, J = 11,2 Гц, 1H), 4,23 (m, 1H), 4,3 (m, 2H), 3,95 (d, J = 10,3 Гц, 1H), 3,81 (m, 1H), 3,04 (m, 1H); MS (ESI) m/e 848 (M-H).
Смесь три-O-бензилглюкопиранозида (0,035 г, 0,041 ммол) и 20% Pd(OH)2-C в смеси метанола (5 мл) и хлороформа (2 мл) гидрируют при давлении 1 атм в течение 16 час. Полученную смесь фильтруют и осадок на фильтре промывают смесью тетрагидрофуран- метанол (1:1). Фильтрат упаривают и остаток хроматографируют (SiO2/2-12% MeOH-CH2Cl2) и получают вышеназванное соединение (0,019 г, 80% в виде желтого твердого вещества: IR (KBr) 3385, 1748, 1713, 1595, 1476, 1326 см-1; 1H ЯМР (ТГФ-d8, 400 МГц):  10,55 (s, 1H), 10,18 (s, 1H), 9,14 (dd, J = 10,6, 8,8 Гц, 1H), 9,04 (dd, J = 10,6, 8,8 Гц, 1H), 7,79 (dd, J = 11,5, 6,6 Гц, 1H), 7,44 (dd, J = 9,8, 7,1 Гц, 1H), 6,56 (t, J = 53,7 Гц, 1H), 6,18 (d, J = 7,9 Гц, 1H), 5,52 (brs, 1H), 5,10 (brs, 1H), 4,71 (brs, 1H), 4,27 (m, 1H), 3,95 (m, 1H), 3,69 (m, 2H). ВЭЖХ (HPLC): 95,2% (230 нм). 10,55 (s, 1H), 10,18 (s, 1H), 9,14 (dd, J = 10,6, 8,8 Гц, 1H), 9,04 (dd, J = 10,6, 8,8 Гц, 1H), 7,79 (dd, J = 11,5, 6,6 Гц, 1H), 7,44 (dd, J = 9,8, 7,1 Гц, 1H), 6,56 (t, J = 53,7 Гц, 1H), 6,18 (d, J = 7,9 Гц, 1H), 5,52 (brs, 1H), 5,10 (brs, 1H), 4,71 (brs, 1H), 4,27 (m, 1H), 3,95 (m, 1H), 3,69 (m, 2H). ВЭЖХ (HPLC): 95,2% (230 нм).
Формула изобретения
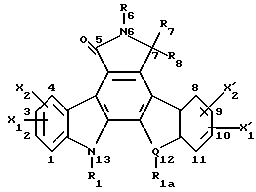 где R1 и R1a обозначают водород или группу гексозы формулы B 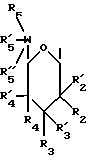 при условии, что один из R1 и R1a обозначает водород, а другой не является водородом; R2 и R’2 независимо обозначают водород, OH; R3 и R’3 независимо обозначают водород, OH; R4 и R’4 независимо обозначают водород, OH, азидо, NH2, галоген; R5, R’5, R”5 независимо обозначают H, OH, азидо, NR9R10, галоген, C(O)Ra, SR, OSO2Rc, OR, или вместе образуют =O; при условии, что R2, R3, R4, R5 и R’2, R’3, R’4, R’5 и R”5 все одновременно не являются водородом, R обозначает водород, C1-7алкил, гетероциклическое 6-членное кольцо, содержащее 1 или 2 атома азота в качестве гетероатомов, причем указанный C1-7алкил может быть замещен фенилом; Ra обозначает OH; Rc обозначает C1-7алкил; R6 обозначает водород, C1-7алкил, OH, NH2, причем указанный C1-7алкил может быть замещен фенилом, который в свою очередь может быть замещен C1-7алкилом; R7 и R8 вместе обозначают O; R9 и R10 независимо обозначают водород или вместе с атомом азота, к которому они присоединены, образуют циклическое 6-членное неароматическое кольцо, содержащее один или два гетероатома, выбранные из группы N, O; X1, X’1, X2 и X’2 независимо обозначают H, галоген, -CN, -C(O)Ra при условии, что X’1, X2 и X’2 не являются 1,11-дихлор, и при условии, что, когда X2 и X’2 обозначает каждый H, X1 и X’1, каждый независимо обозначает H или галоген, R1 обозначает гексозу, R7 и R8 вместе обозначают O, и каждый из R2, R5 и R4обозначает OH, R’2, R’3, R’4, R’5 и R”5 каждый обозначает H, Q обозначает NH, и тогда каждый из R3 и R6 не является NH2 и R3 не является метокси, когда R6 обозначает H; W представляет собой C; Q представляет собой NH, O или S; или его фармацевтически приемлемая соль. 2. Соединение по п.1, у которого в R1 или R1a все заместители обозначают H, кроме R2, R3 и R4, каждый из которых обозначает OH, и R5 обозначает NHR9R10. 3. Соединение по п.1, у которого в R1 или R1a все заместители обозначают H, кроме R2, R3 и R5, каждый из которых обозначает OH, и R4 обозначает NH2. 4. Соединение по п.1, у которого в R1 или R1a все заместители обозначают H, кроме R2, R3 и R4, каждый из которых обозначает OH, и R5 обозначает галоген. 5. Соединение по п.1, у которого R7 и R8, взятые вместе, обозначают O. 6. Соединение по п.1, у которого X1, X’1, X2 и X’2 независимо обозначают галоген. 7. Соединение по п.1, у которого указанный галоген является фтором. 8. Соединение по п.1, у которого Q обозначает O, S или NH. 9. Соединение по п.1, у которого R2, R3 и R5, каждый обозначает OH; и R4 обозначает NH2, галоген или N3. 10. Соединение по п.1, у которого в R1 или R1a все заместители обозначают H, кроме R5, R3 и R4, каждый из которых обозначает OH. 11. Соединение по п.1, у которого в R1 или R1a все заместители обозначают H, кроме R2 и R3, каждый из которых обозначает OH. 12. Соединение по п.1, у которого в R1 или R1a все заместители обозначают H, кроме R2 и R3, каждый из которых обозначает OH; R5 обозначает галоген и R4 обозначает галоген или H. 13. Соединение по п.1, у которого в R1 или R1a все заместители обозначают H, кроме R2 и R3, каждый из которых обозначает водород или гидрокси; R4 обозначает водород, галоген или азидо; R5 обозначает гидрокси, азидо, галоген или NR9R10. 14. Соединение по п.1, у которого в R1 или R1a все заместители обозначают H, кроме R3 и R4, каждый из которых обозначает водород или гидрокси; R2 обозначает водород и R5 обозначает гидрокси, азидо, галоген или NR9R10. 15. Соединение по п.1, у которого в R1 или R1a все заместители обозначают H, кроме R3 и R5, каждый из которых обозначает водород или гидрокси; R2 обозначает водород и R4 обозначает гидрокси, азидо, галоген или NH2. 16. Соединение по п.1, у которого в R1 или R1a a все заместители обозначают H, кроме R2 и R4 каждый из которых обозначает водород или гидрокси; R3 обозначает водород и R5 обозначает гидрокси, азидо, галоген или NR9R10. 17. Фармацевтическая композиция, включающая эффективное против опухолей количество соединения формулы I по любому из пп.1-16. 18. Способ ингибирования роста опухолей у млекопитающего, который включает введение млекопитающему ингибирующее рост опухолей количество соединения формулы I по любому из пп.1 – 16. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 22.08.2006
Извещение опубликовано: 20.12.2007 БИ: 35/2007
|
||||||||||||||||||||||||||
