Патент на изобретение №2167873
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ ПИРИДОНКАРБОНОВОЙ КИСЛОТЫ ИЛИ ИХ СОЛИ И АНТИБАКТЕРИАЛЬНОЕ СРЕДСТВО
(57) Реферат: Изобретение относится к новым соединениям формулы (1), где R1, R2, R3, R4, R5, R6, X, Y, Z, W имеют указанные в описании значения. Соединения формулы (1) обладают хорошими антибактериальными свойствами по отношению к грамотрицательным и грамположительным бактериям, а также имеют очень низкую токсичность, и поэтому могли бы быть полезными синтетическими антибактериальными средствами. 2 с. и 8 з.п. ф-лы, 2 табл. 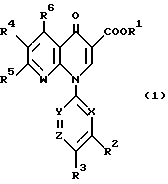
Изобретение относится к новым производным пиридонкарбоновой кислоты или их солям, обладающим превосходными антибактериальными свойствами и оральным всасыванием, и к антибактериальным средствам, содержащим такие соединения. Известно, что многие соединения, имеющие базовый скелет пиридонкарбоновой кислоты, полезны как синтетические антибактериальные средства благодаря их отличным антибактериальным свойствам и широкому антибактериальному спектру. Из таких соединений широкое применение в клинической практике для лечения инфекционных болезней нашли норфлоксацин (выложенная заявка N 53-141286 на патент Японии), эноксацин (выложенная заявка N 55-31042 на патент Японии), офлоксацин (выложенная заявка N 57-46986 на патент Японии), ципрофлоксацин (выложенная заявка N 58-76667 на патент Японии), тосуфлоксацин (выложенная заявка N 60-228479 на патент Японии) и тому подобное. Однако указанные соединения нуждаются в дальнейшем усовершенствовании в отношении антибактериальных активностей, всасывания в желудочно-кишечном тракте, метаболической стабильности и побочных эффектов и, в частности, в отношении фототоксичности и цитотоксичности. Таким образом, задачей настоящего изобретения является создание новых соединений, которые были бы удовлетворительными в указанных отношениях. Раскрытие сущности изобретения Ввиду описанной ситуации создатели настоящего изобретения провели интенсивные исследования в поиске соединений, которые были бы превосходными синтетическими антибактериальными средствами в клинической практике, и нашли, что новые соединения, представленные приведенной ниже общей формулой (1), обладают хорошими антибактериальными свойствами по отношению к грамотрицательным и грамположительным бактериям, а также имеют очень низкую токсичность и потому были бы очень полезными синтетическими антибактериальными средствами. На основе этой находки и было создано настоящее изобретение. 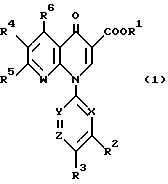 [В этой формуле R1 представляет атом водорода или карбоксильную защитную группу; R2 представляет гидроксильную группу, низшую алкоксигруппу или замещенную или незамещенную аминогруппу; R3 представляет атом водорода или атом галогена; R4 представляет атом водорода или атом галогена; R5 представляет атом галогена или необязательно замещенную насыщенную циклическую аминогруппу; R6 представляет атом водорода, атом галогена, нитрогруппу или необязательно защищенную аминогруппу; X, Y и Z могут быть одинаковыми или разными и соответственно представляют атом азота, -CH= или -CR7 = (где R7 представляет низшую алкильную группу, атом галогена или цианогруппу) (при условии, что по крайней мере один из символов X, Y и Z представляет атом азота) и W представляет атом азота или – CR8 = (где R8 представляет атом водорода, атом галогена или низшую алкильную группу)]. Таким образом, в соответствии с настоящим изобретением предлагаются производные пиридонкарбоновой кислоты, представленные данной выше общей формулой (I), или их соли и антибактериальные средства, содержащие производные пиридонкарбоновой кислоты или их фармацевтически приемлемые соли в качестве активных компонентов. Наилучший способ осуществления изобретения Новые производные пиридонкарбоновой кислоты по настоящему изобретению представлены общей формулой (1), приведенной выше, и термин “низший”, используемый для заместителей производных пиридонкарбоновой кислоты, представленных общей формулой (1), означает, что заместитель содержит 1-7, предпочтительно 1-5, углеродных атомов в случае линейного заместителя и 3-7 углеродных атомов в случае циклического заместителя. В общей формуле (1) R1 представляет атом водорода или карбоксил-защитную группу, причем используемый здесь термин “карбоксил-защитная группа” означает сложноэфирный остаток карбоксилата и карбоксил-защитная группа может представлять собой любой карбоксилатный сложноэфирный остаток, относительно легко расщепляющийся с образованием соответствующей свободной карбоксильной группы. Примерные карбоксил-защитные группы включают группы, которые могут быть отщеплены путем гидролиза, каталитического восстановления и других методов обработки при мягких условиях, такие, как низшие алкильные группы, такие, как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, трет-бутильная группа, пентильная группа, гексильная группа и гептильная группа; низшие алкенильные группы, такие, как винильная группа, аллильная группа, 1-пропенильная группа, бутенильная группа, пентенильная группа, гексенильная группа и гептенильная группа; аралкильные группы, такие, как бензильная группа; и арильные группы, такие, как фенильная группа и нафтильная группа; и группы, которые могут быть легко отщеплены в организме, такие, как низшие алканоилокси низшие алкильные группы, такие, как ацетоксиметильная группа и пивалоилоксиметильная группа; низшие алкоксикарбонилокси низшие алкильные группы, такие, как метоксикарбонил-оксиметильная группа и 1- этоксикарбонилоксиэтильная группа; низшие алкоксиметильные группы, такие, как метоксиметильная группа; лактонильная группа, такая, как фталидил; ди-низшая алкиламино низшая алкильная группа, такая, как 1-диметиламиноэтильная группа; и (5-метил-2-оксо-1,3-диоксол-4-ил)метильная группа. Следует отметить, что наиболее предпочтительно R1 представляет атом водорода. В общей формуле (1) R2 представляет гидроксильную группу, низшую алкоксигруппу или замещенную или незамещенную аминогруппу. Примеры заместителей для замещенной аминогруппы включают низшие алкильные группы, такие, как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, трет-бутильная группа, пентильная группа, гексильная группа и гептильная группа; низшие алкенильные группы, такие, как винильная группа, аллильная группа, 1-пропенильная группа, бутенильная группа, пентенильная группа, гексенильная группа и гептенильная группа; аралкильные группы, такие, как бензильная группа и 1-фенилэтильная группа; арильные группы, такие, как фенильная группа и нафтильная группа; низшие алканоильные группы, такие, как формильная группа, ацетильная группа, пропионильная группа, бутилильная группа и изобутилильная группа; низшие алкоксикарбонильные группы, такие, как метоксикарбонильная группа и этоксикарбонильная группа; ароильные группы, такие, как бензоильная группа и нафтоильная группа; аминокислотные остатки или олигопептидные остатки, такие, как глицил, лейцил, валил, аланил, фенилаланил, аланил-аланил, глицил-валил и глицил-глицил- валил, и аминокислотные остатки или олиго-пептидные остатки, в которых функциональная группа защищена ацилом, низшим аралкилом или другими защитными группами, обычно используемыми в химии пептидов; и циклическую аминогруппу. Из описанных выше заместителей могут быть выбраны один или два заместителя, которые могут быть одинаковыми или разными. Ожидается, что соединения, защищенные аминокислотными или олигопептидными остатками, будут иметь улучшенную растворимость в воде. Предпочтительно R2 представляет аминогруппу, низшую алкиламиногруппу, ди-низшую алкиламиногруппу, низшую алканоиламиногруппу, аминогруппу, защищенную аминокислотным остатком или аминогруппу, защищенную олигопептидным остатком. Более предпочтительные примеры R2 включают аминогруппу, метиламиногруппу, этиламиногруппу и диметиламиногруппу, из которых наиболее предпочтительной является аминогруппа. Следует отметить, что используемые для R2 низшие алкоксигруппы включают предпочтительно низшие алкоксигруппы, имеющие 1-4 углеродных атома, такие, как метоксигруппа, этоксигруппа, пропоксигруппа и бутоксигруппа, из которых предпочтительной является метоксигруппа. Далее, в общей формуле (1) R3 представляет атом водорода или атом галогена; R4 представляет атом водорода или атом галогена; R5 представляет атом галогена или необязательно замещенную насыщенную циклическую аминогруппу; R6 представляет атом водорода, атом галогена, нитрогруппу или необязательно защищенную аминогруппу; X, Y и Z могут быть одинаковыми или разными и соответственно представляют атом азота, -CH= или -CR7 = (где R7 представляет низшую алкильную группу, атом галогена или цианогруппу) и W представляет атом азота или -CR8 = (где R8 представляет атом водорода или атом галогена). Атомы галогена, представленные символами R3, R4, R5, R6, R7 и R9, включают атом фтора, атом хлора, атом брома и атом иода. Из них предпочтительными являются атом фтора и атом хлора и, в частности, R3-R7 предпочтительно представляют атом фтора, а R8 предпочтительно представляет атом хлора или атом брома. Низшие алкильные группы, представленные символами R7 и R8, включают такие, которые содержат 1-7 углеродных атомов, такие, как метильная группа, этильная группа, пропильная группа, бутильная группа, пентильная группа, гексильная группа и гептильная группа, из которых предпочтительной является метильная группа. Что касается радикалов X, Y и Z, то два или три из них могут быть одинаковыми или, альтернативно, они могут отличаться друг от друга. Необходимо, однако, чтобы по крайней мере один из X, Y и Z представлял атом азота. Примерными предпочтительными комбинациями X, Y и Z являются азот для X и -CH= или -CR7 = (где R7 представляет низшую алкильную группу, атом галогена или цианогруппу) для Y и Z; азот для Y и -CH= или -CR7 = (где R7 представляет низшую алкильную группу или атом галогена) для X и Z; и азот для X и Y и -CH= или -CR7 = (где R7 представляет низшую алкильную группу или атом галогена) для Z. Следует также отметить, что соединение формулы (1) имеет нафтилидиновый скелет, когда W представляет азот, и хинолиновый скелет, когда W представляет – CR8=, причем наиболее предпочтительным является случай, когда W представляет -CR8= (где R8 представляет атом галогена или низшую алкильную группу). Далее, необязательно замещенная насыщенная циклическая аминогруппа, представленная символом R5, может дополнительно содержать в своем кольце один или несколько гетероатомов, таких, как атом азота, атом кислорода и атом серы, а также углерод карбонила и может быть либо моноциклической, либо би- или трициклической. Насыщенная циклическая аминогруппа предпочтительно представляет собой 4-7-членное кольцо, когда она моноциклическая, 7-11-членное кольцо, когда она бициклическая, и 9-15-членное кольцо, когда она трициклическая. Примеры таких циклических аминогрупп включают насыщенные моноциклические аминогруппы, имеющие 3-7-членное кольцо, содержащее один атом азота, такие, как азиридин-1-ил, азетидин-1-ил, пирролидин-1-ил и пиперидин-1-ил; насыщенные моноциклические аминогруппы, имеющие 3- 7-членное кольцо, содержащее два атома азота, такие, как пиперазин-1-ил и гомопиперазин-1-ил; насыщенные моноциклические аминогруппы, имеющие 3-7-членное кольцо, содержащее, кроме атома азота, гетероатом, выбранный из атома кислорода и атома серы, такие, как оксазолидин-3-ил, морфолин-4-ил, тиазолидин-1-ил и тиоморфолин-4-ил; насыщенные би- или трициклические аминогруппы, такие, как тетрагидрохинолин-1-ил; и насыщенные спиро-аминогруппы или насыщенные аминогруппы с поперечными связями, имеющие 5-12-членное кольцо, такие, как 2,8-диаза-спиро[4.4] нонан-2-ил, 5- азаспиро [2.4]гептан-5-ил, 7-азабицикло[2.2.1] гептан-7-ил, 2,8-диазабицикло[4.3.0] нонан-8-ил, 5-метил-2,5-диазабицикло [2.2.1] гептан-2-ил, 2,5-диазабицикло-[2.2.1]гептан-2-ил и 3,8-диазабицикло [3.2.1]октан-3-ил. Атом, входящий в состав кольца такой насыщенной циклической аминогруппы, может быть замещенным подходящим заместителем и примеры таких заместителей включают гидроксильную группу, низшие алкильные группы, замещенные и незамещенные аминогруппы, замещенные и незамещенные амино низшие алкильные группы, низшие алкоксигруппы и атомы галогенов. Примерные низшие алкильные группы для заместителя насыщенной циклической аминогруппы включают такие, которые содержат 1-7 углеродных атомов, такие, как метильная группа, этильная группа, пропильная группа, бутильная группа, пентильная группа, гексильная группа и гептильная группа; примерные низшие алкоксигруппы включают такие, которые содержат 1-7 углеродных атомов, такие, как метоксигруппа, этоксигруппа и н-пропоксигруппа; и примерные галогеновые группы включают атом фтора, атом хлора и атом брома. Из заместителей насыщенных циклических аминогрупп замещенные аминогруппы и замещенные аминонизшие алкильные группы могут иметь заместитель, который может быть одинаковым с теми, что описаны для R2, и предпочтительные примеры замещенных аминогрупп и замещенных и незамещенных аминонизших алкильных групп включают метиламиногруппу, этиламиногруппу, диметиламиногруппу, аминометильную группу, 1-аминоэтильную группу, 2-аминоэтильную группу, 1-амино-1-этильную группу, метиламинометильную группу, этиламинометильную группу, диметиламинометильную группу, глицил-аминогруппу, лейцил-аминогруппу, валил-амингруппу, аланил-аминогруппу и аланил-аланил-аминогруппу. Из описанных выше насыщенных циклических аминогрупп наиболее предпочтительная группа для R5 включает группы, представленные следующими формулами (a) и (b): 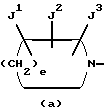 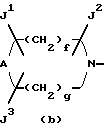 [где A представляет атом кислорода, атом серы или NR9 (где R9 представляет атом водорода или низшую алкильную группу), e представляет число от 3 до 5, f представляет число от 1 до 3, g представляет число от 0 до 2, J1, J2 и J3 которые могут быть одинаковыми или разными, представляют атом водорода, гидроксильную группу, низшую алкильную группу, аминонизшую алкильную группу, аминогруппу, низшую алкиламиногруппу, низшую алкоксигруппу или атом галогена]. Примеры низшей алкильной группы, аминонизшей алкильной группы, низшей алкиламиногруппы, низшей алкоксигруппы и атома галогена в представленных выше формулах (a) и (b) такие же, как те, что описаны для R2-R5. Примерные циклические аминогруппы, представленные формулой (a), включают азетидин-1-ил, пирролидин-1-ил и пиперидин-1-ил, а примерные циклические аминогруппы, представленные формулой (b), включают пиперазин-1-ил, морфолин-4-ил, тиоморфолин-4-ил, гомопиперазин-1-ил, N-тиазолидинил и N-оксазолидинил. Когда R5 представляет циклическую группу, то R5 предпочтительно представляет циклическую аминогруппу, представленную формулой (a), а наиболее предпочтительно – азетидин-1-ил или пирролидин-1-ил. Наиболее предпочтительными представленных формулами (a) и (b), являются следующие группы: 3-аминоазетидин-1-ильная группа, 3-метиламиноазетидин-1-ильная группа, 3-диметиламиноазетидин-1-ильная группа, 3-аминометилазетидин-1-ильная группа, 3-амино-2-метилазетидин-1-ильная группа, 3-амино-3-метилазетидин-1-ильная группа, 3-аланил-аминоазетидин-1-ильная группа, 3-валил-аминоазетидин-1-ильная группа, 3-пирролидин-1-ильная группа, 3-гидроксипирролидин-1-ильная группа, 3,4-дигидроксипирролидин-1-ильная группа, 3-метоксипирролидин-1-ильная группа, 3-метилпирролидин-1-ильная группа, 3-гидрокси-4-метилпирролидин-1-ильная группа, 3-аминопирролидин-1-ильная группа, 3-метиламинопирролидин-1-ильная группа, 3-диметиламинопирролидин-1-ильная группа, 3-этиламинопирролидин-1-ильная группа, 3-диэтиламинопирролидин-1-ильная группа, 3-аминометилпирролидин-1-ильная группа, 3-амино-3-метилпирролидин-1-ильная группа, 3-амино-4-метилпирролидин-1-ильная группа, 3-амино-5-метилпирролидин-1-ильная группа, 3-метиламино-4-метилпирролидин-1-ильная группа, 3-диметиламино-4-метилпирролидин-1-ильная группа, 3-этиламино-4-метилпирролидин-1-ильная группа, 3-диэтиламино-3-метилпирролидин-1-ильная группа, 3-диэтиламино-4-метилпирролидин-1-ильная группа, 3-аминометил-4-метилпирролидин-1-ильная группа, 3-метиламинометил-4-метилпирролидин-1-ильная группа, 3-диметиламинометил-4-метилпирролидин-1-ильная группа, 3-этиламинометил-4-метилпирролидин-1-ильная группа, 3-(1-аминоэтил)-4-метилпирролидин-1-ильная группа, 3-(2-аминоэтил)-4-метилпирролидин-1-ильная группа, 3-амино-4-этилпирролидин-1-ильная группа, 3-метиламино-4-этилпирролидин-1-ильная группа, 3-диметиламино-4-этилпиролидин-1-ильная группа, 3-этиламино-4-этилпирролидин-1-ильная группа, 3-диэтиламино-4-этилпирролидин-1-ильная группа, 3-аминометил-4-этилпирролидин-1-ильная группа, 3-метиламинометил-4-этилпирролидин-1-ильная группа, 3-диметиламинометил-4-этилпирролидин-1-ильная группа, 3-амино-3-метилпирролидин-1-ильная группа, 3-метиламино-3-метилпирролидин-1-ильная группа, 3-диметиламино-3-метилпирролидин-1-ильная группа, 3-амино-3,4-диметилпирролидин-1-ильная группа, 3-амино-4,4-диметилпирролидин-1-ильная группа, 3-амино-4,5-диметилпирролидин-1-ильная группа, 3-амино-2,4-диметилпирролидин-1-ильная группа, 3-метиламино-3,4-диметилпирролидин-1-ильная группа, 2-метил-3-аминопирролидин-1-ильная группа, 2-метил-3-диметиламинопирролидин-1-ильная группа, 3-амино-4-метоксипирролидин-1-ильная группа, 3-аланил-аминопирролидин-1-ильная группа, 3-валил-аминопирролидин-1-ильная группа, пиперазин-1-ильная группа, 4-метилпиперазин-1-ильная группа, 3-метилпиперазин-1-ильная группа, 2-метилпиперазин-1-ильная группа, 3,4-диметилпипераэин-1-ильная группа, 3,5-диметилпиперазин-1-ильная группа, 3,3-диметилпиперазин-1-ильная группа, 3,4,5-триметилпипераэин-1-ильная группа, пиперидин-1-ильная группа, 4-аминопиперидин-1-ильная группа, 4-диметиламинопиперидин-1-ильная группа, 4-гидроксипипери-дин-1-ильная группа, морфолин-4-ильная группа, 2-аминометилморфолин-4-ильная группа, 2- метиламиноморфолин-4-ильпая группа, 2-диметиламиноморфолин-4- ильная группа, тиоморфолин-4-ильная группа, гомопиперазип-1-ильная группа, 4-метилгомопиперазин-1-ильная группа, N-тиазолидинильная группа и N-оксазолидинильная группа. Необязательно защищенная аминогруппа, представленная символом R6, включает аминогруппу, а также аминогруппу, защищенную подходящей защитной группой. Примеры таких защищенных аминогрупп включают аминогруппу, защищенную низшей алканоильной группой, такой, как формил, ацетил, пропионил, пивалоил, гексаноил или тому подобное; низшей алкоксикарбонильной группой, такой, как метоксикарбонил, этоксикарбонил, пропоксикарбонил, трет-бутоксикарбонил, трет- пентилоксикарбонил, гексилоксикарбонил или тому подобное; ароильной группой, такой, как бензоил, толуоил, нафтоил или тому подобное; арил низшей алканоильной группой, такой, как фенилацетил, фенилпропионил или тому подобное; арилоксикарбонильной группой, такой, как феноксикарбонил, нафтилоксикарбонил или тому подобное; арилокси низшей алканоильной группой, такой, как феноксиацетил, феноксипропионил или тому подобное; аралкилоксикарбонильной группой, такой, как бензилоксикарбонил, фенетилоксикарбонил или тому подобное; или аралкильной группой, такой, как бензил, фенетил, бензгидрил, тритил или тому подобное. Предпочтительной комбинацией R1, R2, R3, R4, R5, R6, X, Y, Z и W является такая, в которой R1 представляет атом водорода, R2 представляет аминогруппу, низшую алкиламиногруппу или ди-низшую алкиламиногруппу, R3 представляет атом галогена, R4 представляет атом галогена, X представляет атом азота, Y и Z представляют -CH= или CR7 = (где R7 представляет низшую алкильную группу или атом галогена), W представляет -CR8 = (где R8 представляет атом галогена или низшую алкильную группу), R5 представляет группу формулы (a) (e = 3 или 4) и R6 представляет атом водорода. Более предпочтительной комбинацией R1, R2, R3, R4, R5, R6, X, Y, Z и W является такая, в которой R1 представляет атом водорода, R2 представляет аминогруппу, R3 представляет атом фтора, R4 представляет атом фтора, X представляет атом азота, Y представляет -CF=, Z представляет -CH=, W представляет -CCl=, -CBr= или -CCH3=, R5 представляет группу формулы (a) (e = 3) и R6 представляет атом водорода. Соли описанных выше производных пиридонкарбоновой кислоты формулы (1) могут быть кислотно-аддитивными или основно-аддитивными солями. Используемый в данном описании термин “соли” включает хелатные соли с соединением бора. Примерные кислотно-аддитивные соли включают (i) соли с минеральной кислотой, такой, как соляная кислота или серная кислота; (ii) соли с органической карбоновой кислотой, такой, как муравьиная кислота, лимонная кислота, трихлоруксусная кислота, трифторуксусная кислота, фумаровая кислота или малеиновая кислота; и (iii) соли с сульфоновой кислотой, такой, как метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, мезитиленсульфоновая кислота или нафталинсульфоновая кислота; и примерные основно-аддитивные соли включают (i’) соли с щелочным металлом, таким, как натрий или калий; (ii’) соли с щелочноземельным металлом, таким, как кальций или магний; (iii’) аммонийные соли; (iv’) соли с азотсодержащим органическим основанием, таким, как триметиламин, триэтиламин, трибутиламин, пиридин, N, N-диметиланилин, N-метилпиперидин, N-метилморфолин, диэтиламин, циклогексиламин, прокаин, дибензиламин, N-бензил-  -фенетиламин, 1-эфенамин или N, N’-дибензилэтилендиамин. Примерные соединения бора включают галогениды бора, такие, как фторид бора, и низшие ацилоксиборы, такой, как ацетоксибор.
Производные пиридонкарбоновой кислоты и их соли по настоящему изобретению могут находиться, кроме несольватированной формы, также в форме гидратов и сольватов. Таким образом, соединение настоящего изобретения включает кристаллическую, гидратную и сольватную формы. Кроме того, производные пиридонкарбоновой кислоты и их соли могут находиться в форме оптически активного вещества и такое оптически активное вещество тоже находится в ряду соединений настоящего изобретения. И еще, производное пиридонкарбоновой кислоты и его соль могут находиться в форме (цис- или транс-) стереоизомера и такой стереоизомер также входит в объем соединений настоящего изобретения.
Производные пиридонкарбоновой кислоты и их соли по настоящему изобретению, представленные описанной выше формулой (1), могут быть получены любым способом, надлежащим образом выбранным в соответствии с такими факторами, как тип заместителей, и пример такого способа описан ниже.
(Способ 1) -фенетиламин, 1-эфенамин или N, N’-дибензилэтилендиамин. Примерные соединения бора включают галогениды бора, такие, как фторид бора, и низшие ацилоксиборы, такой, как ацетоксибор.
Производные пиридонкарбоновой кислоты и их соли по настоящему изобретению могут находиться, кроме несольватированной формы, также в форме гидратов и сольватов. Таким образом, соединение настоящего изобретения включает кристаллическую, гидратную и сольватную формы. Кроме того, производные пиридонкарбоновой кислоты и их соли могут находиться в форме оптически активного вещества и такое оптически активное вещество тоже находится в ряду соединений настоящего изобретения. И еще, производное пиридонкарбоновой кислоты и его соль могут находиться в форме (цис- или транс-) стереоизомера и такой стереоизомер также входит в объем соединений настоящего изобретения.
Производные пиридонкарбоновой кислоты и их соли по настоящему изобретению, представленные описанной выше формулой (1), могут быть получены любым способом, надлежащим образом выбранным в соответствии с такими факторами, как тип заместителей, и пример такого способа описан ниже.
(Способ 1)Из соединений, представленных общей формулой (1), соединения (1а), в которых R1 представляет атом водорода или низшую алкильную группу и R5 представляет атом галогена, могут быть получены, например, способом 1, показанным на схеме реакций, представленной в конце описания. Более конкретно, соединение (1а) по настоящему изобретению получают путем осуществления взаимодействия соединения (А) с ортоформиатом, таким, как метилортоформиат или этилортоформиат, с получением производного акрилата (В), осуществления взаимодействия производного акрилата (В) с аминосоединением (C) с получением соединения (D), циклизации соединения (D) с получением соединения (Е) и гидролиза соединения (Е) с получением соединения (1а). Реакцию между соединением (А) и ортоформиатом обычно осуществляют при 0-160oC, предпочтительно 50-150oC, обычно в течение периода времени от 10 минут до 48 часов, предпочтительно в течение 1-10 часов. Ортоформиат используют по отношению к соединению (А) в эквимолярном количестве или более, предпочтительно в 1-10-кратном молярном количестве. Взаимодействие с соединением (C) может быть осуществлено без растворителя или в растворителе. Используемый в этой реакции растворитель может быть любым, лишь бы он не оказывал вредного влияния на реакцию, и примерные растворители включают ароматические углеводороды, такие, как бензол, толуол и ксилол; простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, моноглим и диглим; алифатические углеводороды, такие, как пентан, гексан, гептан и лигроин; галогенированные углеводороды, такие, как метиленхлорид, хлороформ и тетрахлорид углерода; непротонные полярные растворители, такие, как диметил-формамид и диметилсульфоксид; и спирты, такие, как метанол, этанол и пропанол. Эту реакцию обычно проводят при 0-150oC, предпочтительно при 0-100oC, обычно за период от 10 минут до 48 часов. Соединение (C) используют по отношению к соединению (А) в эквимолярном количестве или более, предпочтительно в 1-2-кратном молярном количестве. В соответствии с другим вариантом соединение (А) может быть подвергнуто взаимодействию с ацеталем, таким, как диметилацеталь N,N- диметилформамида или диэтилацеталь N-диметилформамида, и затем с соединением (C) для получения соединения (D). Растворитель, используемый в реакции с ацеталем, может быть любым, лишь бы он не оказывал вредного влияния на реакцию, и примерными растворителями являются те, что описаны выше. Эту реакцию обычно проводят при 0- 150oC, предпочтительно при комнатной температуре до 100oC обычно в течение времени от 10 минут до 48 часов, предпочтительно в течение 1-10 часов. Далее, циклизацию соединения (D) в соединение (Е) проводят в подходящем растворителе в присутствии или в отсутствии основания. Используемый в этой реакции растворитель может быть любым, лишь бы он не оказывал вредного влияния на реакцию, и примерные растворители включают ароматические углеводороды, такие, как бензол, толуол и ксилол; простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан и моноглим; галогенированные углеводороды, такие, как метиленхлорид, хлороформ и тетрахлорид углерода; спирты, такие, как метанол, этанол, пропанол и бутанол; и непротонные полярные растворители, такие, как диметилформамид и диметилсульфоксид. Примерами используемых основных соединений являются щелочные металлы, такие, как металлический натрий и металлический калий; гидриды металлов, такие, как гидрид натрия и гидрид кальция; неорганические соли, такие, как гидроксид натрия, гидроксид калия, карбонат натрия и карбонат калия; алкоксиды, такие, как метоксид натрия, этоксид натрия и трет-бутоксид калия; фториды металлов, такие, как фторид натрия и фторид калия; органические соли, такие, как триэтиламин и 1,8- диазабицикло[5.4.0]ундецен (DBU). Эту реакцию проводят при температуре 0-200oC, предпочтительно в интервале от комнатной температуры до 180oC и обычно завершают в течение времени от 5 минут до 24 часов. Основное соединение используют по отношению к соединению (D) в эквимолярном количестве или более, предпочтительно в 1-2-кратном молярном количестве. Соединение (Е) подвергают гидролизу, чтобы удалить карбоксил-защитную группу R1a и/или амино-защитную группу R2a, с получением соединения (1а). Гидролиз может быть проведен при любых условиях, обычно используемых в гидролизе, например, в присутствии основания, такого, как гидроксид натрия, гидроксид калия и карбонат калия, минеральной кислоты, такой, как соляная кислота, серная кислота и бромистоводородная кислота, или органической кислоты, такой, как п-толуолсульфоновая кислота, и в растворителе, таком, как вода, спирт, такой, как метанол, этанол или пропанол, или простой эфир, такой, как тетрагидрофуран, или диоксан, кетон, такой, как ацетон или метилэтилкетон, уксусная кислота или смесь таких растворителей. Реакцию обычно проводят при температуре от комнатной до 180oC, предпочтительно от комнатной температуры до 140oC, обычно в течение 1-24 часов. Следует отметить, что в случае получения соединения, в котором R6 в формуле (1) представляет необязательно защищенную аминогруппу, сначала получают соединение (Е) посредством описанных выше реакций с использованием соединения (А), в котором R6a представляет атом галогена или нитрогруппу, в качестве исходного материала, а затем получают соединение (E1a) путем аминирования упомянутого атома галогена или путем восстановления нитрогруппы и из соединения (E1a) получают соединение (1а) путем удаления амино-защитной группы, если это необходимо, и удаления карбоксил-защитной группы. (Способ 2) Из соединений, представленных общей формулой (1), соединения, в которых R5 представляет необязательно замещенную насыщенную циклическую аминогруппу, могут быть получены, например, способом 2, показанным на схеме, представленной в конце описания. Более конкретно, соединение (G) получают путем аминирования соединения (F) с использованием соединения, представленного формулой R5b-H. Эту реакцию проводят в растворителе, который не оказывает вредного влияния на реакцию, таком, как ароматические углеводороды, такие, как бензол, толуол или ксилол; спирты, такие, как метанол или этанол; простые эфиры, такие, как тетрагидрофуран, диоксан или моноглим; галогенированные углеводороды, такие, как метиленхлорид, хлороформ или тетрахлорид углерода; непротонные полярные растворители, такие, как диметилформамид, диметилсульфоксид или N- метилпирролидон; ацетонитрил или пиридин, и в необязательном присутствии нейтрализатора, такого, как карбонат натрия, карбонат кальция, гидрокарбонат натрия, триэтиламин, 1,8-диазабицикло[5.4.0] ундецен (DBU) при температуре от комнатной до 160oC. Время реакции составляет от нескольких минут до 48 часов, предпочтительно от 10 минут до 24 часов. Соединение 5b-H используют по отношению к соединению (F) в эквимолярном количестве или более, предпочтительно в 1-5-кратном молярном количестве. Следует отметить, что соединение (F) может быть получено так, как в описанном выше способе 1, и что, когда R1 представляет карбоксил-защитную группу, она может быть замещена атомом водорода путем гидролиза. (Способ 3) Из соединений, представленных общей формулой (1), соединения, в которых R1 представляет карбоксил-защитную группу могут быть получены, например, способом 3, показанным на схеме, представленной в конце описания. Более конкретно, соединение (1) получают путем осуществления взаимодействия соединения (Н) с галогенным соединением R1b-L2. Растворители, которые можно использовать в этой реакции, включают ароматические углеводороды, такие, как бензол и толуол; галогенированные углеводороды, такие, как метиленхлорид и хлороформ; непротонные полярные растворители, такие, как диметилформамид и диметилсульфоксид; и инертные растворители, такие, как ацетонитрил. Температура реакции обычно находится в пределах от комнатной температуры до 100oC. Реакцию предпочтительно проводят в присутствии основания, такоро, как триэтиламин, диизопропилэтиламин, дициклогексиламин, ДБУ, карбонат натрия, карбонат калия и гидроксид натрия. Следует отметить, что соединение (Н) может быть получено описанными выше способами 1 и способом 2. Когда в исходных материалах описанного выше способа 1, 2 или 3 присутствует аминогруппа, иминогруппа, гидрокси-группа, меркаптогруппа, карбоксильная группа или тому подобное, не участвующая в реакции, такую группу можно защитить на время реакции, а по окончании реакции защитную группу можно удалить традиционным методом. В качестве защитной группы, используемой в таком случае, может служить любая группа, лишь бы полученное в результате реакции соединение по настоящему изобретению можно было освободить от защиты без разложения его структуры, и в соответствии с предпочтительным вариантом можно использовать любую группу, обычно используемую в области химии пептидов, аминосахаров и нуклеиновых кислот (“Protective Groups in Organic Synthesis”, второе издание, T.W. Green and P.G.M. Wuts “John Wiley & Sons Inc., 1991). 1) J. Heterocyclic Chem. 22, 1033 (1985) 2) Liebigs Ann. Chem. 29 (1987) 3) J. Med. Chem. 31, 991 (1988) 4) J. Org. Chem. 35; 930 (1970) 5) Выложенная заявка N 62-246541 на патент Японии 6) Выложенная заявка N 62-26272 на патент Японии 7) Выложенная заявка N 63-145268 на патент Японии 8) J. Med. Chem. 29, 2363 (1986) 9) J. Fluorin Chem. 28, 361 (1985) 10) Выложенная заявка N 63-198664 на патент Японии 11) Выложенная заявка N 63-264461 на патент Японии 12) Выложенная заявка N 63-104974 на патент Японии 13) Заявка N 230948 на европейский патент 14) Выложенная заявка N 2- 282384 на патент Японии 15) Опубликованный японский перевод PCT международной публикации заявки N 3-502452 на патент 16) J. Het. Chem. 27, 1609 (1990) Исходное соединение (C) может быть получено любым способом, и ниже описан примерный способ получения. Исходное соединение (C) может быть получено путем замещения атома галогена, связанного с углеродным атомом, входящим в состав 6-членного кольца, амином, таким, как аммиак, алкиламин, бензиламин или тому подобное, с использованием известной реакции галоген-аминового замещения. Следует отметить, что в случае использования замещенного амина, такого, как алкиламин или бензиламин, заместитель замещенной аминогруппы можно удовлетворительно удалить традиционным способом, как показано на схеме реакций A, приведенной в конце описания. Когда R2a представляет замещенную или незамещенную аминогруппу или аминогруппу, замещенную защитной группой, может быть проведена аналогичная реакция галоген-аминового замещения. Когда нет легкодоступного кандидата на роль исходного материала, а именно дигалогензамещенного азотсодержащего шестичленного циклического соединения, имеющего заместители, соответствующие заместителям (R3, а когда X, Y и Z представляют – CR7= или -CH=, R7 или водород) на азотсодержащем шестичленном кольце целевого вещества, то целевое вещество можно получить, используя в качестве исходного материала более легкодоступное дигалогензамещенное азотсодержащее шестичленное циклическое соединение. Более конкретно, адекватную реакцию замены заместителей можно осуществить одновременно с реакцией галоген- аминового замещения замещенной аминогруппой. Примерами полезных реакций замены заместителей является процесс, в котором атом галогена замещают аминогруппой и затем аминогруппу заменяют другим атомом галогена или цианогруппой, используя такую реакцию, как реакция Зандмейера или реакция Шимана; процесс, в котором атом галогена заменяют гидроксильной группой и затем гидроксильную группу заменяют другим атомом галогена, используя галогенид фосфора или оксигалогенид фосфора; процесс, в котором атом брома или атом хлора заменяют атомом фтора, используя такой реагент, как фторид калия; процесс, в котором атом галогена заменяют атомом водорода путем гидрирования; процесс, в котором алкоксикарбонильную группу или ацильную группу восстанавливают до низшей алкильной группы, используя гидридное соединение; процесс, в котором карбоксильную группу заменяют атомом водорода путем декарбоксилирования; и комбинация вышеуказанных процессов. Следует отметить, что, когда соединение, имеющее введенную описанным образом аминогруппу или гидроксильную группу, подвергают дальнейшей реакции замены заместителей, то иногда бывает необходимой защита аминогруппы или гидроксильной группы. В таком случае зашита может быть осуществлена путем фталимидирования в случае аминогруппы и путем бензилоксидирования в случае гидроксильной группы. Защитную группу можно удалить на следующей подходящей стадии. Участвующий в реакции галоген-аминового замещения атом галогена, представленный на показанной выше схеме символом Hal, не ограничивается никаким конкретным видом. Но предпочтительным является атом фтора, обладающий высокой реакционноспособностью. В таком случае, если атом фтора находится в качестве заместителя в любом из других высоко реакционноспособных мест, такое место может быть защищено путем замены атома фтора другим атомом галогена, таким, как атом брома или атом хлора, с использованием реакций, описанных выше. В соответствии с другим вариантом исходное соединение (C) может быть получено путем восстановления нитрогруппы до аминогруппы обычным, способом, показанным на схеме Б, представленной в конце описания. Полученное описанными способами соединение по настоящему изобретению выделяют и очищают обычным методом. Соединение получают в форме соли, свободной карбоновой кислоты или свободного амина в зависимости от условий выделения и разделения. Однако благодаря возможности взаимного преобразования форм соединения настоящего изобретения могут быть получены в требуемой форме. Соединение, представленное приведенной выше общей формулой (1), или его соль можно приготавливать в виде антибактериальной композиции с фармацевтически приемлемым носителем, приспособленным для парентерального введения, такого, как инъекция, трансректального введения, закапывания в глаза или перорального введения в твердой или жидкой форме. Инъекционная форма антибактериальной композиции настоящего изобретения может быть изготовлена в виде раствора, суспензии или эмульсии в фармацевтически приемлемой стерилизованной воде или неводной среде. Примеры подходящих неводных носителей, разбавителей, сред и наполнителей включают пропиленгликоль, полиэтиленгликоль, растительные масла, такие, как оливковое масло, и органические сложные эфиры, пригодные для инъекции, такие, как этилолеат. Такая композиция может также содержать добавки, такие, как консервант, смачивающее вещество, эмульгатор и суспендирующее вещество. Композиция может быть стерилизована, например, путем фильтрования через фильтр для удаления бактерий или путем введения стерилизующего вещества в виде стерилизующего вещества или стерильной твердой композиции, растворимой в стерилизуемой среде для инъекции, непосредственно перед ее применением. Лекарственная форма для закапывания в глаза может, кроме соединения настоящего изобретения, предпочтительно содержать солюбилизатор, консервант, изотонирующее вещество, загущающее вещество и тому подобное. Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. При изготовлении таких твердых лекарственных форм соединения настоящего изобретения обычно смешивают с по крайней мере одним инертным разбавителем, таким, как сахароза, лактоза или крахмал. Лекарственная форма может также содержать иные, чем инертные разбавители, вещества, такие, как смазывающее вещество (например, стеарат магния и т.д.). В случае капсул, таблеток или пилюль лекарственная форма может также содержать буферное вещество. Таблетки и пилюли могут иметь энтерическое покрытие. Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертный разбавитель, обычно используемый в данной области техники, такой, как вода. Кроме такого инертного разбавителя, композиция может также содержать добавки, такие, как смачивающее вещество, эмульгирующее вещество, суспендирующее вещество, а также подсластитель, вкусовое вещество, ароматизирующее вещество. Лекарственные формы для энтерального введения предпочтительно могут, кроме соединения настоящего изобретения, содержать наполнитель, такой, как масло какао или воск для суппозиториев. Доза соединения настоящего изобретения изменяется в зависимости от природы вводимого соединения, способа введения, требуемого периода лечения и других факторов. Однако обычно соединения по настоящему изобретению вводят в количестве примерно 0,1-1000 мг/кг в сутки и, в частности, примерно 0,5-100 мг/кг в сутки. При необходимости такая доза может быть введена 2-4 порциями. Новые производные пиридонкарбоновой кислоты и их соли настоящего изобретения обладают очень сильным антибактериальным действием и низкими фототоксичностью и цитотоксичностью и потому могли бы найти широкое применение в качестве лекарственных средств для человека и других животных, а также в качестве лекарственных средств для рыб, пестицидов, консервантов для продуктов питания и тому подобное. Предполагается также, что соединение по настоящему изобретению обладает антивирусными свойствами и, в частности, анти-ВИЧ (вирус иммунодефицита человека) действием и потому будет эффективным в профилактике и лечении СПИДа. Далее настоящее изобретение описано более подробно на примерах и ссылочных примерах, которые ни в коей мере не ограничивают объем настоящего изобретения. Ссылочный пример 1 Синтез 2-(трет-бутиламино)-3,5,6-трифторпиридина К 40 мл ацетонитрила прибавляли 11,0 г 2,3,5,6-тетрафторпиридина и 18,5 г трет-бутиламина, и смесь перемешивали при 60oC в течение 3 дней, после чего отгоняли растворитель и тому подобное. К остатку прибавляли 100 мл хлороформа и смесь промывали 50 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 9,7 г указанного в заголовке соединения в виде бледно-желтого масла. 1H ЯМР (CDCl3)  , ,1,45 (с, 9H), 4,40 (шс, 1H), 7,16 (ддд, J=7 Гц, 8 Гц, 9 Гц, 1H) Ссылочный пример 2 Синтез 2-бензиламино-6-(трет-бутиламино)-3,5-дифторпиридина К 20 мл N-метилпирролидона прибавляли 9,7 г 2- (трет-бутиламино)-3,5,6-трифторпиридина с 15,5 г бензиламина; и смесь перемешивали при 160oC в течение дня и давали остыть. После добавления 50 мл хлороформа смесь промывали три раза 500 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением примерно 16,5 г указанного в заголовке соединения в виде темно-зеленого масла. Ссылочный пример 3 Синтез 2-амино-6-(трет-бутиламино)-3,5-дифторпиридина К 60 мл метанола прибавляли 10,7 г неочищенного 2-бензил- амино-6-(трет-бутиламино)-3,5-дифторпиридина, полученного так, как описано выше, вместе с 1,10 г 10%-ного палладия на угле и 3,8 г концентрированной соляной кислоты, и смесь гидрировали в течение дня. Отфильтровывали катализатор и отгоняли при пониженном давлении растворитель и тому подобное. К остатку прибавляли 150 мл хлороформа, и смесь промывали 80 мл 10%-ного водного раствора карбоната натрия, после чего промывки опять экстрагировали 50 мл хлороформа. Хлороформные слои объединяли и сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии (силикагель, 100 г; элюент: хлороформ: н-гексан, 2:1, и затем хлороформ) с получением 3,3 г указанного в заголовке соединения в виде светло-коричневого масла. 1H ЯМР (CDCl3)  ; ;1,43 (с, 9H), 4,11 (шс, 2H), 6,94 (т, J=10 Гц, 1H) Пример 1 Синтез этил 1-[6-трет-бутиламино)-3,5-дифторпиридин-2-ил]-8- хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 15 мл хлороформного раствора этил 3-этокси-2-(3-хлор- 2,4,5-трифторбензоил)акрилата, полученного из 4,20 г этил 3-хлор- 2,4,5-трифторбензоилацетата обычным способом, прибавляли 3,30 г 2- амино-6-(трет-бутиламино)-3,5-дифторпиридина. Раствор концентрировали при пониженном давлении с получением твердого остатка оранжевого цвета. К этому остатку прибавляли 4,0 г безводного карбоната калия и 8 мл N,N-диметилформамида и смесь перемешивали при 90oC в течение 10 минут, после чего давали ей остыть. Раствор разделяли путем добавления 50 мл хлороформа и 500 мл дистиллированной воды и хлороформный слой промывали два раза 500 мл дистиллированной воды, сушили над безводным сульфатом магния, концентрировали при пониженном давлении и давали ему отстояться. Осадок собирали путем фильтрования, промывали последовательно этанолом и диизопропиловым эфиром и в результате получили 4,67 г указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 203-205oC. 1H ЯМР (CDCl3)  ; ;1,39 (с, 9H), 1,40 (т, J=7 Гц, 3H), 4,40 (кв, J-7 Гц, 2H), 4,70 (шс, 1H), 7,21 (дд, J=8 Гц, 10 Гц, 1H), 8,31 (дд, J=8 Гц, 10H), 8,50 (с, 1H) Пример 2 Синтез этил 8-бром-1-[6-(трет-бутиламино)-3,5-дифтор- пиридин-2-ил]-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 5 мл хлороформного раствора этил 3-этокси-2-(3-бром-2,4,5- трифторбензоил)акрилата, полученного из 1,32 г этил 3-бром-2,4,5- трифторбензоилацетата обычным способом, прибавляли 2-амино-6- (трет-бутиламино)-3,5-дифторпиридин, пока контроль реакции путем ТСХ не подтвердил завершение превращения в аминоакрилатную форму. Раствор концентрировали при пониженном давлении с получением желтого твердого остатка. К этому остатку прибавляли 1,2 г безводного карбоната калия и 2 мл N,N-диметилформамида, и смесь перемешивали при 90oC в течение 15 минут, после чего давали ей остыть. Раствор разделяли путем добавления 30 мл хлороформа и 300 мл дистиллированной воды, и хлороформный слой промывали два раза 300 мл дистиллированной воды, сушили над безводным сульфатом магния, концентрировали при пониженном давлении и давали ему отстояться. Осадок собирали путем фильтрования, промывали последовательно этанолом и диизопропиловым эфиром и в результате получили 1,41 г указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 198-203oC 1H ЯМР (CDCl3)  ; ;1,38 (с, 9H), 1,40 (т, J=7 Гц, 3H), 4,40 (кв, J= 7 Гц, 2H), 4,71 (шс, 1H), 7,20 (дд, J = 8 Гц, 10 Гц, 1H), 8,36 (дд, J=9 Гц, 10H), 8,54 (с, 1H) Пример 3 Синтез этил 1-[6-(трет-бутиламино] -3,5-дифтордиридин-2-ил] – 6,7,8-трифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 1 мл хлороформного раствора этил 3-этокси-2-(2,3,4,5- тетрафторбензоил)акрилата, полученного из 0,27 г этил- 2,3,4,5- тетрафторбензоилацетата обычным способом, прибавляли 2-амино-6- (трет-бутиламино)-3,5-дифторпиридин, пока контроль реакции путем ТСХ не подтвердил завершение превращения в аминоакрилатную форму. Раствор концентрировали при пониженном давлении. К остатку прибавляли 0,6 г безводного карбоната калия и 1 мл N,N- диметилформамида и смесь перемешивали при 90oC в течение 15 минут, после чего давали ей остыть. Раствор разделяли путем добавления 30 мл хлороформа и 300 мл дистиллированной воды, и хлороформный слой промывали два раза 300 мл дистиллированной воды, сушили над безводным сульфатом магния, концентрировали при пониженном давлении и давали ему отстояться. Осадок собирали путем фильтрования, промывали последовательно этанолом и диизопропиловым эфиром и в результате получили 0,15 г указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 174-178oC 1H ЯМР (CDCl3)  ; ;1,40 (т, J= 7 Гц, 3H), 1,42 (с, 9H), 4,40 (кв, J=7 Гц, 2H), 4,71 (шс, 1H), 7,25 (дд, J=8 Гц, 10 Гц, 1H), 8,16 (ддд, J=2 Гц, 8 Гц, 10H), 8,48 (с, 1H) Пример 4 Синтез этил 1-[6-(трет-бутиламиио)-3,5-дифторпиридип-2-ил]- 7-хлор-6-фтор-4-оксо-1,4-дигидро-1,8-нафтилидин-3-карбоксилата К 1 мл хлороформного раствора этил 3-этокси-2-(2,6-дихлор-5- фторникотиноил)акрилата, полученного из 0,27 г этил 2,6-дихлор-5- фторникотиноилацетата обычным способом, прибавляли 2-амино-6- (трет-бутиламино)-3,5-дифторпиридин, пока контроль реакции путем ТСХ не подтвердил завершение превращения в аминоакрилатную форму. Раствор концентрировали при пониженном давлении. К остатку прибавляли 0,5 г безводного карбоната калия и 1 мл N,N- диметилформамида, и смесь перемешивали при 90oC в течение 15 минут, после чего давали ей остыть. Раствор разделяли путем добавления 30 мл хлороформа и 300 мл дистиллированной воды, и хлороформный слой промывали два раза 300 мл дистиллированной воды, сушили над безводным сульфатом магния, концентрировали при пониженном давлении и давали ему отстояться. Осадок собирали путем фильтрования, промывали последовательно этанолом и диизопропиловым эфиром и в результате получали 0,19 г указанного в заголовке соединения в виде желтых кристаллов. Температура плавления: 158-160oC 1H ЯМР (CDCl3)  ; ;1,39 (т, J= 7 Гц, 3H), 1,45 (с, 9H), 4,40 (кв, J=7 Гц, 2H), 4,68 (шс, 1H), 7,27 (т, J=9 Гц, 1H), 8,48 (д, J=7 Гц), 8,75 (с, 1H) Пример 5 Синтез 1-[-6-амино-3,5-дифторциридин-2-ил] -8-хлор-6,7- дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К смешанному раствору 10 мл 4 н. соляной кислоты и 10 мл уксусной кислоты прибавляли 4,10 г этил 1-[6-(трет-бутиламино)-3,5- дифторпиридин-2-ил] -8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3- карбоксилата и смесь перемешивали при нагревании с обратным холодильником в течение 5 часов. После добавления 20 мл дистиллированной воды раствору давали остыть. Осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 3,32 г указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 280oC или выше 1H ЯМР (d-ДМСО)  ; ;6,80 (с, 2H), 7,99 (т, J=9 Гц, 1H), 8,38 (т, J=9 Гц, 1H), 8,93 (с, 1H) [Ссылочный пример 4] Синтез 2-бензиламино-3,5,6-трифторпиридина К 50 мл ацетонитрила прибавляли 12,0 г 2,3,5,6-тетрафторпиридина и 18,0 г бензиламина и смесь перемешивали при нагревании с обратным холодильником в течение 2 часов, после чего отгоняли растворитель и тому подобное. К остатку прибавлял 150 мл этилацетата, и смесь промывали два раза 150 мл дистиллированной воды и 150 мл 10%-ного водного раствора лимонной кислоты. Этилацетатный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 16,0 г указанного в заголовке соединения в виде бледно-желтого масла. 1H ЯМР (CDCl3)  ; ;4,58 (д, J=6 Гц, 2H), 4,81 (шс, 1H), 7,23 (м, 1H), 7,35 (м, 5H) [Ссылочный пример 5] Синтез 2-амино-3,5, 6-трифторпиридина К 40 мл метанола прибавляли 7,60 г неочищенного 2-бензиламино-3,5,6- трифторпиридина, полученного так, как описано выше, вместе с 0,55 г 10%-ного палладия на угле и 2 мл уксусной кислоты, и смесь гидрировали при 50oC в течение дня. Отделяли путем фильтрования катализатор и отгоняли при пониженном давлении растворитель и тому подгибное. Осадок диспергировали в н-гексане и собирали путем фильтрования с получением 3,85 г укачанного в заголовке соединения в виде бесцветного твердого вещества. 1H ЯМР (CDCl3)  ; ;4,53 (шс, 2H), 7,27 (м, 1H) [Ссылочный пример 6] Синтез 2-амино-3,5-дифтор-6-(п-метоксибензиламино)пиридина К 10 мл N-метилпирролидона прибавляли 3,90 г 2-амино-3,5,6- трифторпиридина и 7,60 г п-метоксибензиламина.и смесь перемешивали в атмосфере азота при 140oC в течение дня, после чего давали остыть. К раствору прибавляли 50 мл хлороформа и промывали раствор три раза 500 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении, после чего остаток подвергали хроматографии (силикагель, 32 г; элюент: хлороформ) с получением 4,50 г указанного в заголовке соединения в виде бледно-желтого неочищенного масла. 1H ЯМР (CDCl3)  ; ;3,80 (с, 3H), 4,18 (шс, 1H), 4,49 (шс, 3H), 6,87 (д, J=9 Гц, 2H), 6,99 (т, J=10 Гц, 1H), 7,28 (т, J=10 Гц, 2H) Пример 6 Синтез этил-8-хлор-1-[3,5-дифтор-6- (п-метоксибензил-амино)пиридин-2-ил] – 6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 18 мл хлороформного раствора этил 3-этокси-2-(3-хлор-2,4,5- трифторбензоил)акрилата, полученного из 2,52 г этил 3-хлор-2,4,5- трифторбензоилацетата обычным способом, прибавляли 2,65 г 2-амино-3,5-дифтор- 6-(п-метоксибензиламино)пиридина. Раствор концентрировали при пониженном давлении и к остатку прибавляли 2,5 г безводного карбоната калия и 6 мл N,N- диметилформамида, и смесь перемешивали при 90oC в течение 15 минут, после чего давали ей остыть. Раствор разделяли путем добавления 50 мл хлороформа и 500 мл дистиллированной воды, и хлороформный слои промывали два раза 500 мл дистиллированной воды, сушили над безводным сульфатом магния, концентрировали при пониженном давлении и давали ему отстояться. Осадок диспергировали в этаноле, собирали путем фильтрования и промывали этанолом с получением 3,20 г указанного в заголовке соединения в виде желтого порошка. Температура плавления: 197-200oC 1H ЯМР (CDCl3)  ; ;1,40 (т, J=7 Гц, 3H), 3,80 (с, 3H), 4,41 (кв, J=7 Гц, 2H), 4,48 (м, 2H), 5,10 (шс, 1H), 6,83 (д, J=7 Гц, 2H), 7,20 (д, J=7 Гц, 2H), 7,25 (дд, J=8 Гц, 9 Гц, 1H), 8,31 (дд, J=8 Гц, 10 Гц, 1H), 8,47 (с, 1H) Пример 7 Синтез 1-(6-амино-3,5-дифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты К смешанному раствору 6 мл 4 н. соляной кислоты и 6 мл уксусной кислоты прибавляли 3,00 г этил 8-хлор-1-[3,5-дифтор- 6-(п-метоксибензиламино)пиридин-2-ил] -6,7-дифтор-4-оксо-1, 4-дигидрохинолин-3-карбоксилата, и смесь нагревали с обратным холодильником в течение 16 часов. Раствору давали остыть и отстояться, и осадок собирали путем декантации и промывали путем добавления небольшого количества дистиллированной воды, встряхивания, отстаивания и декантации. К осадку прибавляли 10 мл этанола и смесь нагревали с обратным холодильником при перемешивании в течение 1 часа, давали ей остыть и отстояться и собирали осадок путем декантации. К этому осадку опять прибавляли 10 мл хлороформа, и смесь перемешивали при нагревании с обратным холодильником в течение 1 часа, позволяли ей остыть, и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 1,25 г указанного в заголовке соединения в виде светло-коричневого порошка. Пример 8 Синтез 1-(6-амино-3,5-дифторпиридин-2-ил)-7-[(3S)]-3- аминопирролидин-1-ил]-8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 250 мг N,N-диметилформамида прибавляли 60 мг 1-(6-амино-3, 5-дифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1, 4- дигидрохинолин-3-карбоновой кислоты и 60 мг (3S)-3- аминопирролидина и смесь нагревали с обратным холодильником при перемешивании при 90oC в течение 1 часа. После добавления 1 мл этанола смеси давали остыть, после чего осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 41 мг указанного в заголовке соединения в виде светло-коричневого порошка. Температура плавления: 248-250oC (с разложением), 1H ЯМР (d6-ДМСО)  ; ;1,73 (м, 1H), 2,03 (м, 1H), 4,67 (м, 2H), 6,75 (шс, 2H), 7,95 (т, J=9 Гц, 1H), 7,98 (д, J=14Fu, 1H), 8,73 (с, 1H) (Часть сигналов перекрывалась протоном воды и была неразличимой). Пример 9 Синтез 7-(3-аминоазетидин-1-ил)-1-(6-амино-3, 5-дифтор- пиридин-2-ил]-8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 350 мг N,N-диметилформамида прибавляли 100 мг 1-(6-амино- 3,5-дифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты, 80 мг 3-аминоазетидиндигидрохлорида и 150 мг N-метилпирролидина, и смесь перемешивали при 90oC в течение 1 часа. После добавления 1 мл этанола смеси давали остыть, после чего осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 86 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 260- 263oC (с разложением) 1H ЯМР (d6-ДМСО)  ; ;3,73 (м, 1H), 4,09 (м, 2H), 4,67 (м, 2H), 6,74 (шс, 2H), 7,86 (д, J=14 Гц, 1H), 7,94 (т, J=9 Гц, 1H), 8,68 (с, 1H) Пример 10 Синтез 1-(6-амино-3,5-дифторпиридин-2-ил) -8-хлор-6-фтор-7- (3-метиламиноазетидин-1-ил) -4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты К 400 мг N,N-диметилформамида прибавляли 90 мг 1-(6-амино-3, 5-дифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 80 мг 3- метиламиноазетидиндигидрохлорида и 160 мг N-метилпирролидина и смесь перемешивали при 90oC в течение 1 часа. После добавления 0,5 мл этанола смеси давали остыть, после чего осадок собирали путем фильтрования и промывали последовательно, этанолом и диизопропиловым эфиром с получением 92 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 259-265oC (с разложением) 1H ЯМР (d6-ДМСО)  ; ;2,20 (с, 3H), 3,48 (м, 1H), 4,14 (м, 2H), 4,64 (м, 2H), 6,75 (шс, 2H), 7,86 (д, J=14 Гц, 1H) 7,94 (т, J=9 Гц, 1H), 8,68 (с, 1H) Пример 11 Синтез 1- (6-амино-3,5-дифторпиридин-2-ил)-7-(3-амино-3- метилазетидин-1-ил)-8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты К 350 мг N,N-диметилформамида прибавляли 80 мг 1-(6-амино-3, 5-дифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 60 мг 3-амино-3- метилазетидиндигидрохлорида и 150 мг N-метилпирролидина, и смесь перемешивали при 90oC в течение 40 минут. После добавления 0,5 мл этанола смеси давали остыть, после чего осадок собирали путем фильтрования и промывали этанолом с получением 64 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 280oC или выше. 1H ЯМР (d6-ДМСО)  ; ;1,35 (с, 3H), 4,19 (м, 2H), 4,30 (м, 2H), 6,75 (шс, 2H), 7,86 (д, J=14 Гц, 1H), 7,94 (т, J = 9 Гц, 1H), 8,68 (с, 1H) Пример 12 Синтез 3-гидроксиазетидиновой соли 1-(6-амино-3,5- дифторпиридин-2-ил)-8-хлор-6-фтор-7-(3-гидроксиазетидин-1-ил)- 4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 800 мг ацетонитрила прибавляли 100 мг 1-(6-амино-3,5- дифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин- 3-карбоновой кислоты, 60 мг 3-гидрокси-азетидингидрохлорида и 150 мг N-метилпирролидина, и смесь нагревали с обратным холодильником в течение 1 часа. Осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 56 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 185-190oC (с разложением) 1H ЯМР (d6-ДМСО)  ; ;3,45 (м, 2H), 3,65 (м, 2H), 4,14 (м, 2H), 4,39 (м, 1H), 4,46 (м, 1H), 4,68 (м, 2H), 6,70 (шс, 2H), 7,80 (д, J=14 Гц, 1H), 7,91 (т, J=9 Гц, 1H), 8,52 (с, 1H) Пример 13 Синтез N-метилпирролидиновой соли 1-(6-амино-3,5-дифторпиридин-2-ил)- 8-хлор-6-фтор-7-(3-гидроксиазетидин-1-ил)-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты К 2000 мг N,N-диметилформамида прибавляли 300 мг 1-(6- амино-3,5-дифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 110 мг 3-гидроксиазетидингидрохлорида и 300 мг N-метилпирролидина, и смесь перемешивали при 80oC в течение 10 часов. После добавления 2 мл этанола смеси давали остыть, после чего осадок собирали путем фильтрования и промывали последовательно, этанолом и диизопропиловым эфиром с получением 222 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 234-238oC (с разложением) 1H ЯМР (d6-ДМСО)  ; ;1,67 (м, 4H), 2,24 (с, 1H), 2,38 (м, 4H), 4,18 (м, 2H), 4,47 (м, 1H), 4,71 (м, 2H), 5,73 (м, 1H), 6,75 (шс, 2H), 7,86 (д, J=14 Гц, 1H), 7,94 (т, J=9 Гц, 1H), 8,67 (с, 1H) Пример 14 Синтез 1-(6-амино-3,5-дифторпиридин-2-ил)-8-хлор-6-фтор- 4-оксо-7-пиперазино-1,4-дигидрохинолин-3-карбоновой кислоты К 170 мг N,N-диметилформамида прибавляли 50 мг 1-(6-амино-3,5- дифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты и 50 мг пиперазина, и смесь перемешивали при 90oC в течение 1 часа. После добавления 0,3 мл этанола смеси давали остыть, после чего осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 33 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 273 – 277oC (с разложением) 1H ЯМР (d6-ДМСО)  ; ;2,82 (м, 4H), 3,16 (м, 4H), 6,76 (шс, 2H), 7,95 (т, J=9 Гц, 1H) 8,05 (д, J = 12 Гц, 1H), 8,79 (с, 1H), Ссылочный пример 7 Синтез 3,5,6-трифтор-2-(метиламино)пиридина К 10 мл ацетонитрила прибавляли 4,5 г 2,3,5,6-тетрафторпиридина и 10 мл метиламина (10% водного раствора), и смесь перемешивали при 50oC в течение 2 часов. К раствору прибавляли 50 мл хлороформа, и смесь промывали четыре раза 250 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде светло-коричневого неочищенного масла. 1H ЯМР (CDCl3)  ; ;2,99 (д, J=5 Гц, 3H), 4,53 (шс, 1H), 7,20 (ддд, J=7 Гц, 8 Гц, 9 Гц, 1H). Ссылочный пример 8 Синтез 2-бензиламино-3,5-дифтор-6-(метиламино)пиридина К 20 мл N-метилпирролидона прибавляли все количество вышеописанного 3,5,6-трифтор-2-(метиламино) пиридина вместе с 10 г бензиламина, и смесь перемешивали при 14oC в течение 19 часов, после чего давали остыть. К раствору прибавляли 50 мл хлороформа и смесь промывали шесть раз 200 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде неочищенного масла. Ссылочный пример 9 Синтез 2-амино-3,5-дифтор-6-(метиламино) пиридина К смешанному раствору 10 мл метанола и 1 мл концентрированной соляной кислоты прибавляли все количество описанного выше 2-бензиламино-3,5-дифтор-6-(метиламино) пиридина вместе с 0,55 г 10%-ного палладия на угле и смесь гидрировали при 50oC в течение ночи. Отделяли путем фильтрования катализатор и отгоняли при пониженном давлении растворитель и тому подобное. К остатку прибавляли 50 мл хлороформа, и смесь промывали 50 мл 5%-ного водного раствора карбоната натрия. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Твердый осадок собирали путем фильтрования с получением 840 мг указанного в заголовке соединения в виде бледно-серого твердого вещества. 1H ЯМР (CDCl3)  ; ;2,95 (д, J=5 Гц, 3H), 4,19 (шс, 3H), 6,98 (т, J=10 Гц, 1H) Пример 15 Синтез этил 8-хлор-6,7-дифтор-1-(3,5-дифтор-6-метил- аминопиридин-2-ил)-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 5 мл хлороформного раствора этил 3-этокси-2-(3-хлор-2,4,5- трифторбензоил)акрилата, полученного из 0,70 г этил 3-хлор-2,4,5- трифторбензоилацетата обычным способом, прибавляли 430 мг 2-амино- 3, 5-дифтор-6-(метиламино)пиридина. Раствор концентрировали при пониженном давлении. К остатку прибавляли 0,3 г безводного карбоната калия и 2 мл N,N-диметилформамида, и смесь перемешивали при 90oC в течение 10 минут, после чего давали ей остыть. Раствор разделяли путем добавления 30 мл хлороформа и 300 мл дистиллированной воды, и хлороформный слой промывали два раза 300 мл дистиллированной воды, сушили над безводным сульфатом магния, концентрировали при пониженном давлении и давали ему отстояться. Осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 784 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 207-209oC 1H ЯМР (CDCl3)  ; ;1,41 (т, J=7 Гц, 3H), 2,98 (д, J=5 Гц, 3H), 4,41 (кв, J=7 Гц, 2H), 4,85 (шс, 1H), 7,23 (дд, J=8 Гц, 9 Гц, 1H), 8,32 (дд, J=8 Гц, 10 Гц, 1H) 8,50 (с, 1H) Пример 16 Синтез 8-хлор-6,7-дифтор-1-(3,5-дифтор-6-метиламино- пиридин-2-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 3 мл смешанного раствора (1:1, об/об) 4 мл 4 н. соляной кислоты и 1 мл уксусной кислоты прибавляли 510 мг этил 8-хлор-6,7-дифтор-1- (3,5-дифтор-6-метиламинопиридин-2-ил] -4-оксо-1,4-дигидрохинолин-3-карбоксилата и смесь нагревали с обратным холодильником при перемешивании в течение 2,5 часов. После добавления 2 мл дистиллированной воды смесь давали остыть, после чего остаток собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 454 мг указанного в заголовке соединения в виде серого порошка. Температура плавления: 236-242oC 1H ЯМР (d6-ДМСО)  ; ;2,67 (д, J=5 Гц, 3H),5,94 (шс, 1H), 7,06 (т, J=8 Гц, 1H) 7,45 (дд, J=10 Гц, 12 Гц, 1H), 8,41 (дд, J=9 Гц, 10 Гц, 1H), 8,72 (с, 1H) Пример 17 Синтез 7-(3-аминоазетидин-1-ил)-8-хлор-6-фтор-1-(3,5-дифтор-6- метиламинопиридин-2-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 400 мг N,N-диметилформамида прибавляли 100 мг 8-хлор-6,7- дифтор-1-(3,5-дифтор-6-метиламинопиридин-2-ил)-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 60 мг 3-аминоазетидиндигидрохлорида и 120 мг N-метилпирродидина и смесь перемешивали при 100oC в течение 1 часа. После добавления 0,5 мл этанола смеси давали остыть, после чего осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 102 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 222-227oC (с разложением) 1H ЯМР (d6-ДМСО)  ; ;2,77 (д, J= 5 Гц, 3H), 3,75 (м, 1H), 4,07 (м, 2H), 4,67 (м, 2H), 7,19 (шс, 1H), 7,88 (д, J=14 Гц, 1H), 7,95 (т, J=7 Гц, 1H), 8,70 (с, 1H) Ссылочный пример 10 Синтез 2-бензиламино-3,5,6-трифтор-4-метилпиридина К 2 мл N-метилпирролидона прибавляли 1,65 г 2,3,5,6- тетрафтор-4-метилпиридина и 2,30 г бензиламина, и смесь перемешивали при 80oC в течение 2 часов, после чего давали остыть. После добавления 25 мл хлороформа смесь промывали три раза 300 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением указанного в заголовке соединения в неочищенной форме. Ссылочный пример 11 Синтез 2-амино-3,5, 6-трифтор-4-метилпиридина К 4 мл метанола прибавляли все количество описанного выше неочищенного 2-бензиламино-3,5,6-трифтор-4-метилпиридина вместе с 0,18 г 10%-ного палладия на угле и 2 мл уксусной кислоты и смесь гидрировали при 50oC в течение дня. Отделяли путем фильтрования катализатор и отгоняли при пониженном давлении растворитель и тому подобное с получением 1,35 г указанного в заголовке соединения в виде бесцветного твердого вещества. 1H ЯМР (CDCl3)  ; ;2,26 (т, J=2 Гц, 3H), 4,40 (шс, 2H) Ссылочный пример 12 Синтез 2-амино-3,5-дифтор-6-(п-метоксибензиламино)-4- метилпиридина К 3 мл N-метилпирролидона прибавляли 1,35 г 2-амино-3,5,6- трифтор-4-метилпиридина вместе с 3,0 г п-метоксибензиламина и смесь перемешивали в атмосфере азота при 140oC в течение 18 часов, после чего давали остыть. После прибавления 30 мл хлороформа смесь промывали три раза 300 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии (силикагель, 20 г; элюент: хлороформ: гексан, 1:1, и затем хлороформ) с получением 0,90 г указанного в заголовке соединения в виде бледно- желтого неочищенного масла. 1H ЯМР (CDCl3)  ; ;2,15 (т, J=2 Гц, 3H), 3,80 (с, 3H), 4,11 (шс, 2H), 4,41 (шс, 1H), 4,48 (м, 2H), 6,87 (д, J=8 Гц, 2H), 7,27 (д, J=8 Гц, 2H) Пример 18 Синтез этил 8-хлор-1-[3,5-дифтор-6-(п-метоксибензиламино) – 4-метилпиридин-2-ил]-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3- карбоксилата К 3 мл хлороформного раствора этил 3-этокси-2-(3-хлор-2,4,5- трифторбензоил)акрилата, полученного из 0,78 г этил 3-хлор-2,4,5- трифторбензоилацетата обычным способом, прибавляли 0,90 г 2-амино- 3,5-дифтор-6-(п-метоксибензиламино)-4- метилпиридина. Раствор концентрировали при пониженном давлении, и к остатку прибавляли 1,3 г безводного карбоната калия и 3 мл N, N-диметилформамида, и смесь перемешивали при 90oC в течение 15 минут, после чего давали ей остыть. Раствор разделяли путем добавления 30 мл хлороформа и 300 мл дистиллированное воды, и хлороформный слой промывали два раза 300 мл дистиллированной воды, сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде коричневого неочищенного масла. Пример 19 Синтез 1-(6-амино-3,5-дифтор-4-метилпиридин-2-ил)-8-хлор- 6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К смешанному раствору 2,5 мл 4 н. соляной кислоты и 2,5 мл уксусной кислоты прибавляли все количество вышеописанного этил 8- хлор-1-[3,5-дифтор-6-(п-метоксибензиламино)-4-метил-пиридин-2-ил] -6,7-дифтор-4- оксо-1,4-дигидрохинолин-3-карбоксилата, и смесь нагревали с обратным холодильником при перемешивании в течение 3 часов, после чего давали ей остыть и отстояться. К осадку прибавляли 10 мл дистиллированной воды, и раствор концентрировали при пониженном давлении. Повторяли 3 раза процедуру добавления 10 мл этанола и концентрирования раствора при пониженном давлении и к остатку прибавляли 6 мл хлороформа, и смесь нагревали с обратным холодильником при перемешивании в течение 1 часа, после чего позволяли ей остыть. Осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 128 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 253-257oC 1H ЯМР (d6-ДМСО)  ; ;2,24 (с, 3H), 6,67 (шс, 2H), 8,38 (т, J-9 Гц, 1H), 8,89 (с, 1H) Пример 20 Синтез 7-(3-аминоазетидин-1-ил)-1-(6-амино-3,5-дифтор-4- метилпиридин-2-ил)-8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты К 280 мг N,N-диметилформамида прибавляли 50 мг 1-(6-амино- 3,5-дифтор-4-метилпиридин-2-ил) -8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 40 мг 3-аминоазетидиндигидрохлорида и 120 мг N-метилпирролидина; и смесь перемешивали при 90oC в течение 1 часа. После добавления 0,4 мл этанола смеси давали остыть. Осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 45 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 243-245oC (с разложением), 1H ЯМР (d6-ДМСО)  ; ;2,23 (с, 3H), 3,71 (м, 1H), 4,05 (м, 2H), 4,67 (м, 2H), 6,60 (шс, 2H), 7,85 (д, J=14 Гц, 1H), 8,64 (с, 1H) [Ссылочный пример 13] Синтез 4-(трет-бутиламино)-2,3,5,6-тетрафторпиридина К 100 мл ацетонитрила прибавляли 24,5 г пентафторпиридина и смесь перемешивали в ледяной бане одновременно с прибавлением по каплям 30 г трет-бутиламина. После того как смесь нагрелась до комнатной температуры, прибавляли 150 мл хлороформа, и смесь промывали два раза 800 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 23 г указанного в заголовке соединения в виде бледно-желтого масла. Ссылочный пример 14 Синтез 2-бензиламино-4-(трет-бутиламино)-3,5,6-трифтор- пиридина К 10 мл N-метилпирролидона прибавляли 6,8 г 4-(трет- бутиламино)-2,3,5, 6-тетрафторпиридина вместе с 7,2 г бензиламина, и смесь перемешивали при 115oC в течение дня, после чего давали остыть, после добавления 40 мл хлороформа смесь промывали три раза 400 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением примерно 8,0 г указанного в заголовке соединения в виде темно-зеленого неочищенного масла. 1H ЯМР (CDCl3)  ; ;1,39 (с, 9H), 4,16 (шс, 1H), 4,55 (шс, 2H), 4,48 (м, 2H), 7,35 (м, 5H) Ссылочный пример 15 Синтез 2-амино-4-(трет-бутиламино)-3,5,6-трифторпиридина К 13 мл уксусной кислоты прибавляли 4,0 г неочищенного 2- бензиламино-4-(трет-бутил)амино-3,5,6-трифторпиридина, полученного так, как описано выше, вместе с 0,43 г 10%-ного палладия на угле, и смесь гидрировали при 60oC в течение 6 часов. Отделяли путем фильтрования катализатор и отгоняли при пониженном давлении растворитель и тому подобное с получением указанного в заголовке соединения в виде коричневого неочищенного масла. Ссылочный пример 16 Синтез этил 3-[(4-трет-бутиламино-3,5,6-пиридин-2-ил) амино] -2-(3-хлор-2,4,5-трифторфенил)акрилата К 1,4 г этил 3-хлор-2,4,5-трифторбензоилацетата прибавляли 1,5 г уксусного ангидрида и 1,5 г триэтилортоформиата, и смесь нагревали с обратным холодильником в течение 2 часов. Отгоняли растворитель и к остатку прибавляли толуол для азеотропной перегонки. К половине остатка прибавляли 3 мл хлороформа и к смеси прибавляли по каплям при охлаждении льдом 5 мл хлорофорного раствора 1 г 2-амино-3,5,6-трифтор-4-(трет-бутиламино) пиридина, после чего смесь перемешивали при комнатной температуре в течение 2 часов. Отгоняли растворитель, и твердый осадок собирали путем фильтрования и промывали диэтиловым эфиром с получением 1,14 г указанного в заголовке соединения. Пример 21 Синтез этил 1-(4-трет-бутиламино-3,5,6-трифторпиридин-2-ил) -8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 6 мл N,N-диметилформамидного раствора 1,14 г этил 3- [(4-трет-бутиламино-3,5,6-пиридин-2-ил)амино] -2-(3-хлор- 2,4,5-трифторфенил)акрилата прибавляли 700 мг карбоната калия, и смесь перемешивали при комнатной температуре в течение 3,5 часов. Реакционный раствор вливали в ледяную воду и прибавляли этилацетат для экстрагирования. Органический слой отделяли и сушили над безводным сульфатом магния, после чего отгоняли растворитель. Твердое содержимое собирали путем фильтрования с получением 1,25 г указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 145-146oC 1H ЯМР (CDCl3)  ; ;1,40 (т, J= 7 Гц, 3H), 1,48 (с, 9H), 4,41 (кв, J=7 Гц, 2H), 4,78 (1H, шс), 8,31 (т, J-9 Гц, 1H), 8,44 (1H, с) Пример 22 Синтез 1-(4-амино-3,5,6-трифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты К 300 мг этил 1-(4-трет-бутиламино-3,5,6-трифторпиридин-2- ил)-8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата прибавляли 3 мл 12 н. соляной кислоты и 0,5 мл уксусной кислоты, и смесь нагревали с обратным холодильником в течение 1,5 часов. Реакционному раствору давали остыть, и выпавшее в осадок твердое вещество собирали путем фильтрования и промывали последовательно этанолом и диэтиловым эфиром с получением 168 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 280-283oC 1H ЯМР (d6-ДМСО)  ; ;7,54 (с, 1H), 8,38 (дд, J=9 Гц, 10 Гц, 1H), 8,98 (с, 1H) Пример 23 Синтез 7- (3-аминоазетидин-1-ил]-1-(4-амино-3,5,6-три- фторпиридин-2-ил) -8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты К 1 мл диметилсульфоксидного раствора 70 мг 3- аминоазетидингидрохлорида и 250 мг триэтиламина при 80oC прибавляли при перемешивании 150 мг 1-(4-амино-3, 5,6- трифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохолин- 3-карбоновой кислоты, и смесь перемешивали при 80oC в течение 1 часа. Реакционному раствору давали остыть и декантировали его с диэтиловым эфиром. К остатку прибавляли этанол для диспергирования твердого содержимого, после чего твердое содержимое собирали путем фильтрования, промывали этанолом и высушивали с получением 85 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: разложение при 230oC или выше 1H ЯМР (d6-ДМСО+ТФА)  ; ;4,05 (м, 1H), 4,45 (м, 2H),4,77 (м, 2H), 7,50 (2H, шс), 7,93 (д, J=14 Гц, 1H), 8,32 (шс, 2H), 8,80 (с, 1H.) [Ссылочный пример 17] Синтез 3,5-диамино-2-хлорпиридина Смесь 2,19 железного порошка, 5 мл воды и 10 мл этанола перемешивали при 80oC в течение 2 минут. После постепенного прибавления 1 мл концентрированной соляной кислоты смесь перемешивали при той же температуре, пока раствор не стал нейтральным. К реакционному раствору прибавляли суспензию 1 г 2- хлор-3,5-динитропиридина в 5 мл этанола, и смесь перемешивали при 80oC в течение 40 минут. Давали реакционному раствору остыть, и удаляли железный порошок путем фильтрования через целит, после чего из фильтрата отгоняли растворитель. К остатку прибавляли этанол для диспергирования твердого содержимого, после чего твердое содержимое собирали путем фильтрования с получением 360 мг указанного в заголовке соединения. [Ссылочный пример 18] Синтез этил 3-[(5-амино-6-хлорпиридин-3-ил)амино]-2-(3-хлор- 2,4,5-трифторфенил) акрилата К 1,4 г этил 3-хлор-2,4,5-трифторбензоилацетата прибавляли 1,5 уксусного ангидрида и 1,5 триэтилортоформиата, и смесь нагревали с обратным холодильником в течение 2 часов. Отгоняли растворитель, и к остатку прибавляли толуол для азеотропной перегонки. К половине остатка прибавляли 3 мл хлороформа, и к смеси при комнатной температуре прибавляли по каплям раствор 360 мг 3,5-диамино-2-хлорпиридин в 3 мл этанола, после чего смесь перемешивали при комнатной температуре в течение 30 минут. Отгоняли растворитель, и остаток очищали путем колоночной хроматографии с получением 200 мг указанного в заголовке соединения. Пример 24 Синтез этил 1-(5-амино-6-хлорпиридин-3-ил)-8-хлор-6,7- дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К раствору 180 мг этил 3-[(5-амино-6-хлорпиридин-3-ил)- амино]-2-(3-хлор-2,4,5-трифторфенил)акрилата в 3 мл N,N- диметилформамида прибавляли 57 мг карбоната калия, и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор вливали в ледяную воду и экстрагировали этилацетатом. Органический слой отделяли и сушили над сульфатом магния, после чего отгоняли растворитель. Твердое содержимое собирали путем фильтрования с получением 125 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 233-236oC 1H ЯМР (CDCl3)  ; ;1,39 (т, J= 7 Гц, 3H), 4,40 (кв, J=7 Гц, 2H), 4,46 (шс, 2H), 7,04 (с, 1H), 7,26 (с, 1H), 7,86 (с, 1H), 3,32 (т, J=9 Гц, 1H), 8,37 (с, 1H) Пример 25 Синтез 1-(5-амино-6-хлорпиридин-3-ил)-8-хлор-6,7-дифтор- 4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 100 мг этил 1-(5-амино-6-хлорпиридин-3-ил)-8-хлор-6,7- дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата прибавляли 3 мл концентрированной соляной кислоты, и смесь нагревали с обратным холодильником в течение 2 часов. Реакционному раствору давали остыть, и выпавшее в осадок твердое вещество собирали путем фильтрования. Твердое вещество промывали этанолом с получением 86 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 277-281oC 1H ЯМР (d6-ДМСО)  ; ;7,37 (с, 1H), 7,86 (с, 1H), 8,41 (т, J=9 Гц, 1H), 8,69 (с, 1H) Пример 26 Синтез 7-(3-аминоазетидин-1-ил)-1-(5-амино-6-хлор- пиридин-3-ил)-8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты К 1 мл диметилсульфоксидного раствора 53 мг 3- аминоазетидиндигидрохлорида и 146 мг триэтиламина при 80oC прибавляли при перемешивании 80 мг 1-(5-амино-6-хлорпиридин-3-ил) -8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты, и смесь перемешивали при 80oC в течение 1 часа. Реакционному раствору давали остыть и декантировали его с диэтиловым эфиром. К остатку прибавляли этанол для диспергирования твердого содержимого, после чего твердое содержимое собирали путем фильтрования, промывали этанолом и высушивали с получением 45 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 280oC или выше 1H ЯМР (d6-ДМСО)  ; ;3,78 (м, 1H), 4,14 (м, 2H), 4,64 (м, 2H), 6,04 (шир., 2H), 7,30 (с, 1H), 7,75 (с, 1H), 7,89 (д, J=14 Гц, 1H), 8,49 (с, 1H) [Ссылочный пример 19] Полностью смешивали 25,3 г 5-фторурацила с 72,9 г пентахлорида фосфора, и смесь постепенно нагревали до 130oC и подвергали взаимодействию в течение 4 часов. (Реакционная смесь становилась жидкой примерно за 1 час, и реакция продолжалась с высокой скоростью). После добавления 300 мл ледяной воды и 200 мл хлороформа смесь перемешивали 20 минут. Нерастворимое содержимое отделяли путем фильтрования через целит и разделяли фильтрат. Хлороформный слой промывали 5%-ным водным раствором карбоната натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 30,6 г указанного в заголовке соединения в виде коричневого масла (которое кристаллизовалось при пониженной температуре). 1H ЯМР (CDCl3)  ; 8.49 (с, 1H) ; 8.49 (с, 1H)[Ссылочный пример 20] Синтез 4-(трет-бутиламино)-2-хлор-5-фторпиримидина К 20 мл ацетонитрила прибавляли 6,4 г 2,4-дихлор-5- фторпиримидина и 7,0 г трет-бутиламина, после чего смесь перемешивали при 50oC в течение 20 минут. Раствор концентрировали при пониженном давлении и разделяли путем прибавления 40 мл дистиллированной воды и 70 мл хлороформа. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Выпавшие в осадок бледно-желтые кристаллы диспергировали в диизопропиловом эфире и собирали путем фильтрования с получением 4,1 г указанного в заголовке соединения. 1H ЯМР (CDCl3)  ; ;1,51 (с, 9H), 5,07 (шс, 1H), 7,83 (д, J=3 Гц, 1H) [Ссылочный пример 21] Синтез 2-бензиламино-4-(трет-бутиламино)-5-фторпиримидина К 5 мл N-метилпирролидона прибавляли 1,8 г 4-(трет-бутиламино-2-хлор- 5-фторпиримидина и 4,0 г бензиламина, и смесь перемешивали при 140oC в течение 17 часов, после чего разделяли путем добавления 300 мл дистиллированной воды и 40 мл хлороформа. Хлороформный слой промывали два раза 300 мл дистиллированной воды, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Выпавшие в осадок бледно-желтые кристаллы диспергировали в диизопропиловом эфире и собирали путем фильтрования с получением 1,9 г указанного в заголовке соединения. 1H ЯМР (CDCl3)  ; ;1,40 (с, 9H), 4,54 (д, J=6 Гц, 2H), 4,71 (шс, 1H), 5,06 (шс, 1H), 7,33 (м, 5H), 7,65 (д, J=3 Гц, 1H) Ссылочный пример 22 Синтез 2-амино-4-(трет-бутиламино)-5-фторпиримидина К 8 мл уксусной кислоты прибавляли 1,0 г 2-бензиламино-4- (трет-бутиламино)-5-фторпиримидина вместе с 215 мг 10%-ного палладия на угле, и смесь гидрировали при 60oC в течение десяти дней. Отделяли путем фильтрования катализатор, и отгоняли при пониженном давлении растворитель и тому подобное. Три раза повторяли процедуру добавлению мл этанола и концентрирования при пониженном давлении, после чего остаток разделяли путем колоночной хроматографии (силикагель, 25 г; элюент: хлороформ, а затем хлороформ:метанол, 200: 1) и соответствующие фракции собирали и концентрировали при пониженном давлении с получением 360 мг указанного в заголовке соединения в виде бледно-серого твердого вещества. 1H ЯМР (CDCl3)  ; ;1,47 (с, 9H), 4,92 (шс, 1H), 5,57 (шс, 2H), 7,51 (д, J=3 Гц, 1H) Пример 27 Синтез этил-1-[4-(трет-бутиламино)-5-фторпиримидин-2-ил] -8- хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 3 мл хлороформного раствора этил 3-этокси-2-(3-хлор-2,4,5- трифторбензоил)акрилата, полученного из 210 мг этил 3-хлор-2,4,5- трифторбензоилацетата обычным способом, прибавляли 340 мг 2-амино- 4-(трет-бутиламино)-5-фторпиримидина. Раствор концентрировали при пониженном давлении. К остатку прибавляли 550 мг безводного карбоната калия и 2 мл N,N-диметилформамида, и смесь перемешивали при 90oC в течение 1 часа 10 минут, после чего давали ей остыть. Раствор разделяли путем добавления 30 мл хлороформа и 300 мл дистиллированной воды, хлороформный слой промывали два раза 300 мл дистиллированной воды, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток разделяли путем колоночной хроматографии (силикагель, 16 г; элюент: хлороформ: метанол, 200:1), и соответствующие фракции собирали и концентрировали при пониженном давлении. К остатку прибавляли 0,5 мл этанола, и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 98 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 201-205oC 1H ЯМР (CDCl3)  ; ;1,38 (т, J= 7 Гц, 3H), 1,43 (с, 9H), 4,39 (кв, J=7 Гц, 2H), 5,30 (шс, 1H), 8,02 (д, J=3 Гц, 1H), 8,24 (т, J=9 Гц, 1H), 8,90 (с, 1H) Пример 28 Синтез 1- (4-амино-5-фторпиридин-2-ил]-8-хлор-6,7-дифтор-4- оксо-1,4-дигидрохинолин-3-карбоновой кислоты К смешанному раствору (1:1, об/об) 0,4 мл 4н. соляной кислоты и 1 мл уксусной кислоты прибавляли 90 мг этил 1-[4-трет-бутиламино)- 5-фторпиримидин-2-ил]-8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3- карбоксилата, и смесь нагревали с обратным холодильником при перемещении в течение 3 с половиной часов, после чего давали ей остыть. Осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 48 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления 242-246oC 1H ЯМР ((d6-ДМСО)  ; ;8,04 (шс, 2H), 8,33 (д, J=3 Гц, 1H),8,34 (т, J=9 Гц, 1H), 9,02 (с, 1H) Пример 29 Синтез 7-(3-аминоазетидин-1-ил)-1-(4-амино-5-фторпири- мидин-2-ил)-8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 100 мг N,N-диметилформамида прибавляли 25 мг 1-[4-амино- 5-фторпиримидин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 20 мг 3-аминоазетидиндигидрохлорида и 50 мг N-метилпирролидина, и смесь перемешивали при 90oC в течение 1 часа. После добавления 0,2 мл этанола смеси давали остыть, и затем осадок собирали путем фильтрование и промывали последовательно этанолом и диизопропиловым эфиром с получением 10 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 269- 271oC (с разложением) 1H ЯМР (d6-ДМСО)  ; ;3,73 (м, 1H), 4,07 (м, 2H), 4,67 (м, 2H), 7,81 (д, J=15 Гц, 1H),7,95 (шс, 1H), 8,29 (д, J=3 Гц, 1H), 8,83 (с, 1H) Ссылочный пример 23 Синтез 2-амино-3,5-дифтор-6-метоксипиридина К 1 мл метанола прибавляли 500 мг 2-амино-3,5,6-трифторпиридина вместе с 800 мг 28%-ного раствора метоксида натрия в метаноле, и смесь перемешивали при 70oC в течение 3 с половиной часов, после чего давали остыть. После добавления 25 мл хлороформа смесь промывали 5 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением указанного в заголовке соединения. Пример 30 Синтез этил 8-хлор-1-(3,5-дифтор-6-метоксипиридин-2-ил)-6,7- дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 3 мл хлороформного раствора этил 3-этокси-2-(3-хлор-2,4,5- трифторбензоил)акрилата, полученного из 0,78 г этил 3-хлор-2,4,5- трифторбензоилацетата обычным способом, прибавляли 2-амино-3,5- дифтор-6-метоксипиридин, пока контроль реакции путем ТСХ не подтвердил завершение превращения в аминоакрилатную форму. Раствор концентрировали при пониженном давлении, и к остатку прибавляли 0,80 г безводного карбоната калия и 2 мл N,N-диметилформамида, и смесь перемешивали при 90oC в течение 15 минут, после чего давали ей остыть. Раствор разделяли путем добавления 30 мл хлороформа и 300 мл дистиллированной воды, и хлороформный слой промывали два раза 300 мл дистиллированной воды, сушили над безводным сульфатом магния, концентрировали при пониженном давлении и давали ему отстояться. Осадок собирали путем фильтрования и промывали этанолом с получением 615 мг указанного в заголовке соединения в виде бледно-коричневого порошка. Температура плавления: 140-143oC 1H ЯМР (CDCl3)  ; ;1,41 (т, J=7 Гц, 3H), 3,99 (с, 3H), 4,41 (кв, J=7 Гц, 2H), 7,44 (т, J=8 Гц, 1H), 8,33 (дд, J=8 Гц, 10 Гц), 8,45 (с, 1H) Пример 31 Синтез 8-хлор-1-(3,5-дифтор-6-метоксипиридин-2-ил)-6,7- дифтор-4-оксо- -1, 4-дигидрохинолин-3-карбоновой кислоты К смешанному раствору 1 мл 4н. соляной кислоты и 1 мл уксусной кислоты прибавляли 385 мг этил 8-хлор-1-(3,5-дифтор-6- метоксипиридин-2-ил]-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3- карбоксилата, и смесь нагревали с обратным холодильником при перемешивании в течение 30 минут. После добавления 2 мл дистиллированной воды раствору давали остыть и отстояться. Осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 297 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 205-210oC 1H ЯМР (d6-ДМСО)  ; ;3,92 (с, 3H), 8,39 (т, J=9 Гц, 1H), 8,40 (т, J=9 Гц, 1H), 9,03 (с, 1H) Пример 32 Синтез 7-(3-аминоазетидин-1-ил)-8-хлор-1-(3,5-дифтор-6- метоксипиридин-2-ил)-6-фтор-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты К 500 мг ацетонитрила прибавляли 75 мг 8-хлор-1-(3,5-дифтор- 6-метоксипиридин-2-ил)-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты, 65 мг 3-амино-азетидиндигидрохлорида и 150 мг N-метилпирролидина и смесь нагревали с обратным холодильником в течение 1 часа. Осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 28 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 171-175oC 1H ЯМР (d6-ДМСО)  ; ;3,70 (м, 1H), 3,91 (с, 3H), 4,05 (м, 2H), 4,66 (м, 2H), 7,88 (д, J=14 Гц, 1H), 8,34 (т, J=9 Гц, 1H), 8,79 (с, 1H) Пример 33 Синтез этил 7-хлор-1-(3,5-дифтор-6-метоксипиридин-2-ил)-6- фтор-4-оксо-1,4-дигидро-1,8-нафтилидин-3-карбоксилата К 10 мл хлороформного раствора этил 3-этокси-2-(2,6-дихлор- 5-фторникотиноил)акрилата, полученного из 1,25 г этил 2,6-дихлор- 5-фторникотиноилацетата обычным способом, прибавляли неочищенный 2-амино-3,5-дифтор-6-метоксипиридин, пока контроль реакции путем ТСХ не подтвердил завершение превращения в аминоакрлатную форму. Раствор концентрировали при пониженном давлении и к остатку прибавляли 2,0 г безводного карбоната калия и 4 мл N,N- диметилформамида и смесь перемешивали при 90oC в течение 20 минут, после чего давали ей остыть. Раствор разделяли путем добавления 50 мл хлороформа и 300 мл дистиллированной воды и хлороформный слой промывали два раза 300 мл дистиллированной воды, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Осадок диспергировали в этаноле, собирали фильтрованием и промывали последовательно этанолом и диизопропиловым эфиром с получением 1010 мг указанного в заголовке соединения в виде светло-коричневого порошка. Температура плавления: 208-212oC 1H ЯМР (CDCl3)  ; ;1,42 (т, J=7 Гц, 3H), 4,04 (с, 3H), 4,40 (кв, J=7 Гц, 2H), 7,50 (т, J=8 Гц, 1H), 8,48 (д, J=7 Гц), 8,69 (с, 1H) Пример 34 Синтез 7-хлор-1-(3,5-дифтор-6-метоксипиридин-2-ил)-6- фтор-4-оксо-1,4-дигидро-1,8-нафтилидин-3-карбоновой кислоты К 1,5 мл смешанного раствора (1:1, об/об) и 3 н. соляной кислоты и уксусной кислоты прибавляли 300 мг этил 7-хлор-1-(3,5- дифтор-метоксипиридин-2-ил)-6-фтор-4-оксо-1,4-дигидро-1,8- нафталидин-3-карбоксилата, и смесь нагревали с обратным холодильником при перемешивании в течение 1 часа. После добавления 2 мл дистиллированной воды смесь нагревали с обратным холодильником в течение 10 минут, после чего давали ей остыть и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 248 мг указанного в заголовке соединения в виде светло-коричневого порошка. Температура плавления: 220-225oC 1H ЯМР (d6-ДМСО)  ; ;3,97 (с, 3H), 8,42 (т, J=9 Гц, 1H), 8,76 (д, J=7 Гц, 1H), 9,21 (с, 1H) Пример 35 Синтез 7-[(3S)-3-аминопирролидин-1-ил] -1-(3,5-дифтор-6- метоксипиридин-2-ил)-6-фтор-4-оксо-1,4-дигидро-1,8-нафтилидин-3- карбоновой кислоты К 400 мг N,N-диметилформамида прибавляли 82 мг 7-хлор-1- (3,5-дифтор-6-метоксипиридин-2-ил) -6-фтор-4-оксо-1,1-дигидро-1,8- нафтилидин-3-карбоновой кислоты, 70 мг (3S)-3-аминопирролидина и 60 мг триэтиламина, и смесь нагревали с обратным холодильником при 80oC в течение 30 минут. После добавления 2,5 мл этанола смесь нагревали с обратным холодильником в течение 5 минут и затем давали остыть, после чего осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 102 мг указанного в заголовке соединения в виде бледно-коричневого порошка. Температура плавления: 231-233oC 1H ЯМР (d6-ДМСО)  ; ;1,65 (м, 1H), 1,93 (м, 1H), 3,95 (с, 3H), 8,02 (д, J=13 Гц, 1H), 8,35 (т, J=9 Гц, 1H), 8,94 (с, 1H) (Часть сигналов перекрывалась протоном воды и была неразличимой). Пример 36 Синтез 7-[(3S,4S)-3-амино-4-метилпирролидин-1-ил]-1-(3,5 дифтор-6-метоксипиридин-2-ил)-6-фтор-4-оксо-1,4-дигидро-1,8- нафтилидин-3-карбоновой кислоты К 500 мг N,N-диметилформамида прибавляли 85 мг 7-хлор-1- (3,5-дифтор-6-метоксипиридин-2-ил)-6-фтор-4-оксо-1,4-дигидро-1,8- нафтилидин-3-карбоновой кислоты, 70 мг (3S,4S)-3-амино-4- метилпирролидиндигидрохлоридаи 150 мг триэтиламина, и смесь нагревали с обратным холодильником при 80oC в течение 30 минут. После добавления 2,5 мл этанола смесь нагревали с обратным холодильником в течение 5 минут и затем давали остыть, после чего осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 105 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 226-229oC 1H ЯМР (d6-ДМСО)  ; ;0,94 (шс, J=8 Гц, 3H), 2,16 (м, 1H),3,95 (с, 3H), 8,02 (д, J=13 Гц, 1H), 8,35 (м, 1H), 8,95 (с, 1H) (Часть сигналов перекрывалась протоном воды и была неразличимой). Пример 37 Синтез 1-(6-амино-3,5-дифторпиридин-2-ил] -8-бром-6, 7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К смешанному раствору 3,5 мл 4 н. соляной кислоты и 3,5 мл уксусной кислоты прибавляли 1,38 г этил 8-бром-1-[6-(трет-бутиламино) -3,5-дифторпиридин-2-ил] -6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата, и смесь нагревали с обратным холодильником при перемешивании в течение 5 часов. После добавления 5 мл дистиллированной воды смеси давали остыть и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 1,10 г указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 272-278oC 1H ЯМР (d6-ДМСО)  ; ;6,80 (с, 2H), 7,99 (т, J=9 Гц, 1H), 8,38 (т, J=9 Гц, 1H), 8,93 (с, 1H) Пример 38 Синтез 1-(6-амино-3,5-дифторпиридин-2-ил)-6,7,8- трифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К смешанному раствору 0,5 мл 4 н. соляной кислоты и 0,5 мл уксусной кислоты прибавляли 235 мг этил 1-[6-(трет-бутиламино) -3,5-дифторпиридин-2-ил] -6,7,8-трифтор-4-оксо- 1,4-дигидрохинолин-3-карбоксилата, и смесь нагревали с обратным холодильником при перемешивании в течение 7 часов. После добавления 1 мл дистиллированной воды смеси давали остыть, и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 182 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 280oC или выше. 1H ЯМР (d6-ДМСО)  ; ;6,81 (шс, 2H), 8,04 (т, J=9 Гц, 1H), 8,23 (м, 1H), 8,98 (с, 1H) Пример 39 Синтез 7-(3-аминоазетидин-1-ил)-1-(6-амино-3,5-ифторпиридин -2-ил) -8-бром-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 300 мг N,N-диметилфopмaмидa прибавляли 105 мг 1-(6- амино-З,5-дифторпиридин-2-ил)-8-бром-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 70 мг 3-амино- азетидиндигидрохлорида и 150 мг N-метилпирролидина, и смесь перемешивали при 90oC в течение 1 часа. После добавления 0,3 мл этанола смеси давали остыть, и затем осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 79 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 258-264oC (с разложением) 1H ЯМР (d6-ДМСО)  ; ;3,73 (м, 1H), 4,06 (м, 2H), 4,69 (м, 2H), 6,75 (шс, 2H), 7,89 (д, J=14 Гц, 1H), 7,94 (т, J=9 Гц, 1H), 8,70 (с, 1H) Пример 40 Синтез 7-(3-аминоазетидин-1-ил)-1-(6-амино-3,5-дифторпиридин- 2-ил)-6,8-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 270 мг N,N-диметилформамида прибавляли 90 мг 1-(6-амино-3,5 -дифторпиридин-2-ил)-6,7,8-трифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты, 50 мг 3-амино-азетидиндигидрохлорида и 110 мг N-метилпирролидина, и смесь перемешивали при 90oC в течение 1 часа. После добавления 0,3 мл этанола смеси давали остыть и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 70 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 256-260oC (с разложением) 1H ЯМР (d6-ДМСО)  ; ;3,76 (м, 1H), 3,94 (м, 2H), 4,44 (м, 2H), 6,74 (шс, 2H), 7,78 (д, J=13 Гц, 1H), 7,99 (т, J=9 Гц, 1H), 8,73 (с, 1H) Пример 41 Синтез 1-(6-амино-З, 5-дифторпиридин-2-ил)-8-бром-6-фтор- 7-(3-метиламиноазетидин-1-ил)-4-оксо-1,4-дигидрохинолин-З- карбоновой кислоты К 800 мг N,N-диметилформамида прибавляли 260 мг 1-(6-амино- 3,5-дифторпиридин-2-ил) -8-бром-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 130 мг 3-метил- аминоазетидиндигидрохлорида и 300 мг N-метилпирролидина, и смесь перемешивали при 90oC в течение 1 часа. После добавления 0,5 мл этанола смеси давали остыть и затем осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 247 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 238-245oC (с разложением) 1H ЯМР (d6-ДМСО)  ; ;2,21 (с, 3H), 3,46 (м, 1H), 4,12 (м, 2H), 4,63 (м, 2H), 6,75 (шс, 2H), 7,88 (д, J=14 Гц, 1H), 7,94 (т, J=9 Гц, 1H), 8,70 (с, 1H) Пример 42 Синтез 7-[3-(этиламино)азетидин-1-ил]-1-(6-амино-3,5- дифторпиридин-2-ил)-8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 310 мг N,N-диметилформамида прибавляли 100 мг 1-(6-амино- 3,5-дифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 70 мг 3-(этиламино) азетидиндигидрохлорида и 150 мг N-метилпирролидина, и смесь перемешивали при 90oC в течение 15 минут. После добавления 1 мл этанола смеси давали остыть и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 107 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 241-245oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;0,98 (т, J=7 Гц, 3H), 2,49 (кв, J=7 Гц, 2H), 3,55 (м, 1H), 4,14 (м, 2H), 4,66 (м, 2H) 6,76 (шс, 2H), 7,86 (д, J=14 Гц, 1H), 7,95 (т, J=9 Гц, 1H), 8,69 (с, 1H) Пример 43 Синтез 7-[3-(диметиламино) азетидин-1-ил]-1-(6-амино-3,5- дифторпиридин-2-ил)-8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 310 мг N,N-диметилформамида прибавляли 100 мг 1-(6-амино- 3,5-дифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 100 мг 3-(диметиламино)- азетидиндигидрохлорида и 150 мг N-метилпирролидина и смесь перемешивали при 90oC в течение 15 минут. После добавления 1 мл этанола смеси давали остыть и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 87 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 283-287oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;2,07 (с, 6H), 3,03 (м, 1H), 4,24 (м, 2H), 4,55 (м, 2H), 6,77 (шс, 2H), 7,86 (д, J=14 Гц, 1H), 7,95 (т, J=9 Гц, 1H), 8,70 (с, 1H) Пример 44 Синтез 7-[3-(аминометил)азетидин-1-ил] -1-(6-амино-3,5- дифторпиридин-2-ил)-8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 280 мг N,N-диметилформамида прибавляли 80 мг 1-(6-амино-3,5 -дифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты, 100 мг 3-(аминометил)-азетидиндигидрохлорида и 200 мг N-метилпирролидина, и смесь перемешивали при 90oC в течение 25 минут. После добавления 0,5 мл этанола смеси давали остыть, и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 42 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 249-254oC 1H ЯМР (d6-ДМСО)  ; ;2,67 (м, 1H), 2,80 (м, 2H).4,21 (м, 2H), 4,49 (м, 2H), 6,73 (шс, 2H), 7,80 (д, J=14 Гц, 1H), 7,93 (т, J=10 Гц, 1H), 8,56 (с, 1H). Ссылочный пример 24 Синтез 4-амино-3-хлор-2,5,6-трифторпиридина В 100 мл ацетонитрила растворяли 20,5 г 3-хлор-2,4,5,6-тетрафторпиридина, и к раствору прибавляли 30 мл 25%-ного водного раствора аммиака тремя порциями, при этом смесь перемешивали и охлаждали водой, после чего продолжали перемешивание в течение еще 30 минут. Раствор концентрировали при пониженном давлении. После прибавления к твердому остатку 200 мл хлороформа раствор промывали 50 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении, после чего осадок собирали путем фильтрования с получением 16,6 г указанного в заголовке соединения в виде бесцветных чешуйчатых кристаллов. Ссылочный пример 25 Синтез 4-бром-3-хлор-2,5,6-трифторпиридина В 45 мл ацетонитрила растворяли 9,4 г 4-амино-3-хлор-2,5,6- трифторпиридина, и к раствору прибавляли 7,5 г трет-бутилнитрита по каплям за 25 минут с перемешиванием при 45oC, после чего нагревали с обратным холодильником в течение 40 минут и концентрировали при пониженном давлении. Остаток разделяли путем прибавления 150 мл хлороформ и 100 мл 2 н. соляной кислоты и хлороформный слой промывали 20 мл дистиллированной воды, сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 10,2 г указанного в заголовке соединения в виде бледно-желтого масла. Ссылочный пример 26 Синтез 4-бром-2-(трет-бутиламино)-5-хлор-3,6-дифторпиридина В 40 мл ацетонитрила растворяли 10,2 г 4-бром-3-хлор-2,5,6- трифторпиридина и 10,5 г трет-бутиламина и смесь нагревали с обратным холодильником в течение 1 часа и отгоняли при пониженном давлении растворитель, и тому подобное. К остатку прибавляли 80 мл хлороформа и смесь промывали 50 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 12,8 г указанного в заголовке соединения в виде красновато-оранжевого масла. Ссылочный пример 27 Синтез 2-(трет-бутиламино)-5-хлор-3,6-дифторпиридина К 30 мл метанола прибавляли 12,8 г 4-бром-2-(трет- бутиламино)-5-хлор-3,6-дифторпиридина и 2,5 г триэтиламина вместе с 0,57 г 10%-ного палладия на угле, и смесь гидрировали при 50oC в течение 5 дней. Отделяли путем фильтрования катализатор, и отгоняли при пониженном давлении растворитель и тому подобное. К остатку прибавляли 80 мл хлороформа, и смесь промывали 70 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 9,3 г указанного в заголовке соединения в виде коричневого масла. Ссылочный пример 28 Синтез 2-бензиламино-6-(трет-бутиламино)-3-хлор-5-фторпиридина К 10 мл N-метилпирролидона прибавляли 6,8 г 2-(трет- бутиламино)-5-хлор-3,6-дифторпиридина вместе с 8,0 г бензиламина, и смесь перемешивали при 150oC в течение дня и давали ей остыть. После добавления 80 мл хлороформа смесь промывали три раза 300 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии (силикагель, 100 г; элюент: хлороформ: н-гексан, 1:1) с получением примерно 7,0 г указанного в заголовке соединения в виде светло-коричневого неочищенного масла. Ссылочный пример 29 Синтез 2-амино-6-(трет-бутиламино)-3-хлор-5-фторпиридина и 2-амино-6-(трет-бутиламино)-5-фторпиридина К смешанному раствору 18 мл метанола и 1,4 г концентрированной соляной кислоты прибавляли 3,1 г 2-бензиламино-6-(трет-бутиламино)-3-хлор-5-фторпиридина вместе с 0,33 г 10%-ного палладия на угле, и смесь гидрировали при 30oC в течение 1 часа. Отделяли путем фильтрования катализатору, и отгоняли при пониженном давлении растворитель и тому подобное. К остатку прибавляли 50 мл хлороформа, и смесь промывали 10 мл 6%-ного водного раствора гидроксида натрия. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии (силикагель, 40 г; элюент: хлороформ: н-гексан, 3:1 и затем 1:1) с получением 1,35 г 2-амино-6-(трет-бутиламино)-3-хлор-5-фторпиридина в виде светло-коричневого масла и 0,32 г 2-амино-6-(трет-бутиламино)-5- фторпиридина в виде коричневого масла. 1H ЯМР (CDCl3)  ; ;1,44 (с, 9H), 4,32 (шс, 1H), 4,37 (шс, 1H), 7,02 (д, J=10 Гц, 1H) 2-амино-6-(трет-бутиламино)-5-фторпиридин 1H ЯМР (CDCl3)  ; ;1,46 (с, 9H), 3,99 (шс, 1H), 4,30 (шс, 1H), 5,61 (дд, J=2 Гц, 8 Гц, 1H), 6,91 (дд, J=8 Гц, 11 Гц, 1H) Пример 45 Синтез этил 1-[6-(трет-бутиламино)-3-хлор-5-фторпиридин-2- ил]-8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 3 мл хлороформного раствора этил 3-этокси-2-(3-хлор-2,4,5- трифторбензоил)акрилата, полученного из 0,84 г этил 3-хлор-2,4,5- трифторбензоилацетата обычным способом, прибавляли 0,65 г 2-амино- 6-(трет-бутиламино)-3-хлор-5-фторпиридина. Раствор концентрировали при пониженном давлении с получением желтого твердого остатка. К этом остатку прибавили 0,7 г безводного карбоната калия и 3 мл N- диметилформамида, и смесь перемешивали при 90oC в течение 25 минут, после чего давали ей остыть. Раствор разделяли путем добавления 40 мл хлороформа и 300 мл дистиллированной воды, и хлороформный слой промывали два раза 300 мл дистиллированной воды, сушили над безводным сульфатом магния, концентрировали при пониженном давлении и давали ему отстояться. Осадок собирали путем фильтрования, промывали последовательно этанолом и диизопропиловым эфиром, и в результате получили 1,06 г указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 210-213oC. 1H ЯМР (CDCl3)  ; ;1,38 (с, 9H), 1,41 (т, J=7 Гц, 3H), 4,41 (KB, J=7 Гц, 2H), 4,84 (шс, 1H)), 7,32 (д, J=10 Гц, 1H), 8,32 (дд, J=8 Гц, 10 Гц, 1H), 8,45 (с, 1H) Пример 46 Синтез 1-(6-амино-3-хлор-5-фторпиридин-2-ил)-8-хлор-6,7- дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 2,5 мл смешанного раствора (1:1) 4 н. соляной кислоты и уксусной кислоты прибавляли 600 мг этил 1-[6-(трет-бутиламино) – 3-хлор-5-фторпиридин-2-ил] -8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоксилата, и смесь нагревали с обратным холодильником при перемешивании в течение 4,5 часов. После добавления 2 мл дистиллированной воды раствору давали остыть, и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 458 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 280oC или выше 1Н ЯМР (d6-ДМСО)  ; ;7,10 (шс, 2H), 7,99 (д, J=10 Гц, 1H), 8,40 (т, J=10 Гц, 1H), 8,89 (с, 1H) Пример 47 Синтез 7-(З-аминоазетидин-1-ил)-1-(6-амино-3-хлор-5- фторпиридин-2-ил)-8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 300 мг N,N-диметилформамида прибавляли 100 мг 1-(6-амино- 3-хлор-5-фторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 70 мг 3-амино- азетидиндигидрохлорида и 150 мг N-метилпирролидина, и смесь перемешивали при 90oC в течение 30 минут. После добавления 0,3 мл этанола смеси давали остыть и затем осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 95 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 268-270oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;3,71 (м, 1H), 4,08 (м, 2H), 4,67 (м, 2H), 7,04 (шс, 2H), 7,87 (д, J= 14 Гц, 1H), 7,94 (д, J=10 Гц, 1H), 8,62 (с, 1H) Пример 48 Синтез 1-(6-амино-3-хлор-5-фторпиридин-2-ил)-8-хлор-6- фтор-7-(3-метиламиноазетидин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 300 мг N,N-диметилформамида прибавляли 103 мг 1-(6-амино- 3-хлор-5-фторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 85 мг 3-метил- аминоазетидиндигидрохлорида и 150 мг N-метилпирролидонад и смесь перемешивали при 85oC в течение 30 минут. После добавления 0,3 мл этанола смеси давали остыть и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 98 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 277-280oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;2,20 (с, 3H), 3,45 (м, 1H), 4,13 (м, 2H), 4,64 (м, 2H), 7,04 (шс, 2H), 7,87 (д, J-14 Гц, 1H), 7,94 (д, J=10 Гц, 1H), 8,62 (с, 1H) Пример 49 Синтез этил 1-[6-(трет-бутиламино)-5-фторпиридин-2-ил-1-8- хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 2 мл хлороформного раствора этил 3-этокси-2-(3-хлор-2,4,5- трифторбензоил)акрилата, полученного из 0,56 г этил 3-хлор-2,4,5- трифторбензоилацетата обычным способом, прибавляли 0,42 г 2-амино- 6-(трет-бутиламино)-5-фторпиридина. Раствор концентрировали при пониженном давлении с получением желтого твердого остатка. К этому остатку прибавляли 0,6 г безводного карбоната калия и 1,5 мл N,N- диметилформамида, и смесь перемешивали при 90oC в течение 20 минут, после чего давали ей остыть. Раствор разделяли путем добавления 40 мл хлороформа и 300 мл дистиллированной воды, и хлороформный слой промывали два раза 300 мл дистиллированной воды, сушили над безводным сульфатом магния, концентрировали при пониженном давлении и давали ему отстояться. Осадок собирали путем фильтрования, промывали последовательно этанолом и диизопропиловым эфиром и в результате получили 0,48 г указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 207-210oC 1H ЯМР (CDCl3)  ; ;1,37 (с, 9H), 1,40 (т, J=7 Гц, 3H), 4,40 (KB, J=7 Гц, 2H), 4,82 (шс, 1H), 6,52 (дд, J=3 Гц, 8 Гц, 1H, 7,25 (дд, J-8 Гц, 10 Гц, 1H), 8,31 (дд, J=8 Гц, 10 Гц, 1H), 8,61 (с, 1H) Пример 50 Синтез 1-(6-амино-5-фторпиридин-2-ил)-8-хлор-6,7-дифтор- 4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 2 мл смешанного раствора (1:1) 4 н. соляной кислоты и уксусной кислоты прибавляли 450 мг этил-[6-(трет-бутиламино)- 5-фторпиридин-2-ил]-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоксилата и смесь нагревали с обратным холодильником при перемешивании в течение 3 часов. После добавления 1 мл дистиллированной воды смеси давали остыть и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 342 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 232-235oC 1H ЯМР (d6-ДМСО)  ; ;6,87 (шс, 2H), 6,91 (дд, J=3 Гц, 8 Гц, 1H), 7,64 (дд, J=8 Гц, 11 Гц, 1H), 8,36 (т, J=9 Гц, 1H), 8,77 (с, 1H) Пример 51 Синтез 7-(З-аминоазетидин-1-ил)-1-(6-амино-5-фторпиридин-2-ил) -8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-З-карбоновой кислоты К 270 мг N,N-диметилформамида прибавляли 55 мг 1-(6-амино-6- фторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты, 70 мг 3-амино-азетидинцигидрохлорида и 80 мг N-метилпирролидина и смесь перемешивали при 90oC в течение 15 минут. После добавления 0,3 мл этанола смеси давали остыть и затем осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 62 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 250-254oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;3,71 (м, 1H), 4,05 (м, 2H), 4,67 (м, 2H), 6,78 (дд, J=3 Гц, 8 Гц, 1H), 6,80 (шс, 2H), 7,60 (дд, J=8 Гц, 10 Гц, 1H), 7,85 (д, J=14 Гц, 1H), 8,60 (с, 1H) Пример 52 Синтез 1-(6-амино-5-фторпиридин-2-ил)-8-хлор-6-фтор-7-(3-метиламиноазетидин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 300 мг N,N-диметилформамида прибавляли 101 мг 1-(6-амино- 5-фторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты, 85 мг 3-метиламино-азетидиндигидрохлорида и 150 мг N-метилпирролидина, и смесь перемешивали при 85oC в течение 30 минут. После добавления 0,3 мл этанола смеси давали остыть и затем осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 82 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 252-255oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;2,21 (с, 3H), 3,46 (м, 1H), 4,13 (м, 2H), 4,62 (м, 2H), 6,78 (м, 1H), 6,81 (шс, 2H), 7,60 (дд, J=8 Гц, 10 Гц, 1H), 7,84 (д, J=14 Гц, 1H), 8,60 (с, 1H) Ссылочный пример 30 Синтез N-(3-хлор-2,5,6-трифторпиридин-4-ил)-фталимида К смешанному раствору 40 мл дихлорметана и 20 мл N,N- метилформамида прибавляли 18,5 г 3-хлор-2,4,5,6-тетрафторпиридина и 20,5 г фталимида калия и перемешивали смесь при 40oC в течение суток. После добавления 40 мл хлороформа смесь промывали два раза 500 мл дистиллированной воды и один раз 500 мл 0,5%-ного водного раствора гидроксида натрия. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Осадок диспергировали в диизопропиловом эфире и собирали путем фильтрования с получением 32,0 г указанного в заголовке соединения в виде бесцветного порошка. Ссылочный пример 31 Синтез N-[2-(трет-бутиламино)-5-хлор-3,6-дифторпиридин-4 -ил]фталимида К 150 мл ацетонитрила прибавляли 30,0 г N-(3-хлор-2,5,6- трифторпиридин-4-ил)-фталимида вместе с 42,2 г трет-бутиламина, и смесь нагревали с обратным холодильником при перемешивании в течение 30 минут. Раствор концентрировали при пониженном давлении, после чего прибавляли 200 мл хлороформа и промывали 100 мл дистиллированной воды. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением примерно указанного в заголовке соединения в виде бесцветного твердого остатка. Ссылочный пример 32 Синтез N-(2-амино-5-хлор-3,6-дифторпиридин-4-ил)-фталимида К 80 мл трифторуксусной кислоты прибавляли все количество N-[2- (трет-бутиламино)-5-хлор-3,6-дифторпиридин-4-ил]фталимида и смесь перемешивали при 70oC в течение 5 с половиной часов. Раствор концентрировали при пониженном давлении. Осадок диспергировали в хлороформе и собирали фильтрованием с получением 19,5 г указанного в заголовке соединения в виде бесцветного порошка. Ссылочный пример 33 Синтез N-(2,5-дихлор-3,6-дифторпиридин-4-ил)фталимида К 80 мл ацетонитрила прибавляли 21,3 г N-(2-амино-5-хлор- 3,6-дифторпиридин-4-ил) фталимида вместе с 14,0 г хлорида меди (2) и смесь перемешивали при комнатной температуре с одновременным прибавлением по каплям 15,8 трет-бутилнитрита, растворенного в 30 мл ацетонитрила, в течение 10 минут. Смесь перемешивали при 60oC в течение 1 часа и концентрировали при пониженном давлении. Остаток разделяли путем прибавления 500 мл хлороформа и 250 мл 2 н. соляной кислоты, и хлороформный слой промывали 50 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Осадок растворяли и собирали путем фильтрования с получением 16,2 г указанного в заголовке соединения в виде бесцветного порошка. Ссылочный пример 34 Синтез 4-амино-2,5-дихлор-3,6-дифторпиридина К смешанному раствору 100 мл хлороформа и 40 мл метанола прибавляли 16,2 г N-(2,5-дихлор-3,6-дифторпиримидин-4- ил)фталимида вместе с 20 мл 25%-ного водного раствора аммиака, и смесь перемешивали при комнатной температуре в течение 30 минут. Раствор концентрировали при пониженном давлении, и после прибавления 150 мл хлороформа к остатку смесь промывали 20 мл 15%-ного водного раствора аммиака и затем 10 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 4,55 г указанного в заголовке соединения в виде бесцветного порошка. Ссылочный пример 35 Синтез 4-амино-2,5-дифторпиридина К 40 мл метанола прибавляли 4,5 г 4-амино-2,5-дихлор-3,6- дифторпиридина и 4,5 г триэтиламина вместе с 0,40 г 10%-ного палладия на углероде и смесь гидрировали при 50oC в течение 12 дней. Отделяли путем фильтрования катализатор и отгоняли при пониженном давлении растворитель и тому подобное. К остатку прибавляли 100 мл хлороформа и смесь промывали 10 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К остатку прибавляли 1,5 г триэтиламина, 0,35 г 10%-ного палладия на угле и 30 мл метанола, и смесь гидрировали при 50oC в течение 41 часа. Отделяли путем фильтрования катализатор и отгоняли при пониженном давлении растворитель и тому подобное. К остатку прибавляли 100 мл хлороформа, и смесь промывали 10 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 2,67 г указанного в заголовке соединения в виде выпавшего в осадок бесцветного твердого вещества. Ссылочный пример 36 Синтез 2-бензиламино-4-амино-5-фторпиридина К 1 мл N-метилпирролидона прибавляли 410 мг 4-амино-2,5- дифторпиридина вместе с 930 мг бензиламина и давали смеси взаимодействовать в атмосфере азота при 150oC в течение 3 дней, после чего давали ей остыть. После прибавления 30 мл хлороформа смесь промывали два раза 300 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии (силикагель, 15 г; элюент: хлороформ:метанол, 1:0 и затем 50:1) с получением 400 мг указанного в заголовке соединения в виде бесцветного твердого вещества. 1H ЯМР (CDCl3,)  ; ;4,06 (шс, 2H), 4,40 (д, J=6 Гц, 2H), 4,60 (шс, 1H), 5,69 (д, J=6 Гц, 1H), 7,33 (м, 5H), 7,75 (д, J=3 Гц, 1H) Ссылочный пример 37 Синтез 2,4-диамино-5-фторпиридингидрохлорида К 4 мл метанола с прибавленными к нему 400 мг концентрированной соляной кислоты прибавляли 350 мг 2- бензиламино-4-амино-5-фторпиридина вместе с 50 мг 10%-ного палладия на углероде, и смесь гидрировали при 40oC в течение 2 дней. Отделяли путем фильтрования катализатор и отгоняли при пониженном давлении растворитель и тому подобное. Повторяли 4 раза процедуру прибавления к остатку 10 мл дистиллированной воды и концентрирования при пониженном давлении и 2 раза процедуру прибавления 10 мл этанола и концентрирования при пониженном давлении. В качестве остатка получали 260 мг указанного в заголовке соединения в виде желтовато-оранжевой пасты. Ссылочный пример 38 Синтез этил 3-(4-амино-5-фторпиридин-2-ил)амино-2-(3-хлор- 2,4,5-трифторбензоил)акрилата и этил 3-(2-амино-5-фторпиридин-4- ил)амино-2-(З-хлор-2,4,5-трифторбензоил)акрилата К 1,2 мл хлороформного раствора этил 3-этокси-2-(3-хлор- 2,4,5-трифторбензоил) акрилата, полученного из 0,34 г этил 3-хлор- 2,4,5-трифторбензоилацетата обычным способом, прибавляли 0,25 г 2,4-диамино-5-фторпиридингидрохлорида вместе с 0,28 г N- метилпирролидина. Раствор концентрировали при пониженном давлении, и к остатку прибавляли 0,52 г безводного карбоната калия и 0,8 мл N,N-диметилформамида, и смесь перемешивали при 90oC в течение 15 минут, после чего давали ей остыть. Раствор разделяли путем добавления 20 мл хлороформа и 100 мл дистиллированной воды, и хлороформный слой промывали 100 мл дистиллированной воды, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии (силикагель, 14 г: элюент: хлороформ: метанол, 1:0 и затем 100:1) и фракцию, содержащую основной продукт, концентрировали при пониженном давлении. Осадок диспергировали в этаноле, собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 1,06 г указанной в заголовке смеси (1:1 по ЯМР) в виде бледно-коричневого порошка. Пример 53 Синтез этил 1-(4-амино-5-фторпиридин-2-ил)-8-хлор-6,7- дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 150 мг смеси этил 3-(4-амино-5-фторпиридин-2-ил)амино-2- (3-хлор-2,4,5-трифторбензоил)акрилата и этил 3-(2-амино-5- фторпиридин-4-ил)амино-2-(3-хлор-2,4,5-трифторбензоил)акрилата прибавляли 230 мг безводного карбоната калия и 450 мг N,N- диметилформамида и смесь перемешивали при 100oC в течение 20 минут, после чего давали ей остыть. Раствор разделяли путем добавления 20 мл хлороформа и 100 мл дистиллированной воды, и хлороформный слой промывали 100 мл дистиллированной воды, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии (силикагель, 3,2 г; элюент:хлороформ:метанол, 100:1) и фракцию, содержавшую основной продукт, концентрировали при пониженном давлении с получением 35 мг указанного в заголовке соединения в виде желтого твердого остатка. Температура плавления: 140-148oC 1H ЯМР (CDCI3)  ; ;1,38 (т, J=7 Гц, 3H), 4,37 (кв, J=7 Гц, 2H), 4,78 (шс, 2H), 6,78 (д, J=6 Гц, 1H), 8,11 (д, J=3 Гц, 1H), 8,27 (дд, J=8 Гц, 10 Гц, 1H), 8,55 (с, 1H) Пример 54 Синтез 1-(4-амино-5-фторпиридин-2-ил)-8-хлор-6,7-дифтор- 4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 400 мг смешанного раствора (1:1) 4 н. соляной кислоты и уксусной кислоты прибавляли 35 мг этил 1-(4-амино-5-фторпиридин-2- ил)-8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата, и смесь нагревали с обратным холодильником при перемешивании в течение 3 часов, после чего давали ей остыть. Осадок собирали путем фильтрования и промывали последовательно дистиллированной водой, этанолом и диизопропиловым эфиром с получением 31 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 280oC или выше 1H ЯМР (d6-ДМСО)  ; ;6,86 (шс, 2H), 7,00 (д, J=7 Гц, 1H), 8,12 (д, J=3 Гц, 1H), 8,39 (т, J=9 Гц, 1H), 8,74 (с, 1H) Пример 55 Синтез 7-(3-аминоазетидин-1-ил)-1-(4-амино-5-фторпиридин-2-ил) -8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 110 мг N,N-диметилформамида прибавляли 23 мг 1-[4- амино-5-фторпиридин-2-ил]-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-З-карбоновой кислоты, 20 мг 3- аминоазетидиндигидрохлорида и 50 мг N-метилпирролидина и смесь перемешивали при 90oC в течение 20 минут. После добавления 500 мг этанола смеси давали остыть и затем осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 23 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 280oC или выше. 1H ЯМР (d6-ДМСО)  ; ;3,75 (м, 1H), 4,10 (м, 2H),4,66 (м, 2H).,б,77 (шс, 2H), 6,92 (д, J==7 Гц, 1H), 7,86 (д, J-14 Гц, 1H), 8,08 (д, J=3 Гц, 1H), 8,57 (с, 1H) Ссылочный пример 39 Синтез метил 2,6-дихлор-5-фторникотината К 60 мл дихлорметана прибавляли 21,0 г 2,6-дихлор-5- фторникотиновой кислоты, 10 мл оксалилхлорида и 10 капель N,N- диметилформамида и смесь перемешивали при комнатной температуре в течение дня. Отгоняли при пониженном давлении растворитель и избыточные реагенты и остаток растворяли в 50 мл хлороформа. К раствору прибавляли по каплям 10 мл метанола и перемешивали его при комнатной температуре в течение 60 минут, после чего к раствору прибавляли 15 г безводного карбоната калия и перемешивали раствор еще 30 минут. Разделяли раствор путем прибавления 150 мл хлороформа и 150 мл дистиллированной воды и хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 26,6 г указанного в заголовке соединения в виде бесцветного неочищенного маслянистого остатка. Ссылочный пример 40 Синтез метил 6-трет-бутиламино-2, 5-дифторникотината К 30 мл диметилсульфоксида прибавляли три четверти (19, 95 г) метил 2,6-дихлор-5-фторникотината, синтезированного так, как описано выше, 14,5 г фторида калия (высушенного распылением) и 1,6 г тетраметиламмонийхлорида, и смесь перемешивали при 110oC в течение 2 с половиной часов, после чего давали ей остыть. После прибавления 100 мл хлороформа смесь промывали два раза 1 литром дистиллированной воды и один раз 1 литром 1%-ного водного раствора карбоната натрия. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. В результате получили неочищенный метил- 2,5,6-трифторникотинат в виде коричневого маслянистого остатками этот остаток растворяли в 60 мл ацетонитрила и к раствору прибавляли 12,0 г трет-бутиламина. Раствор концентрировали при пониженном давлении, и остаток разделяли путем прибавления 100 мл хлороформа и 60 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Осадок диспергировали в н-гексане и собирали путем фильтрования с получением 6,85 г указанного в заголовке соединения в виде бесцветных кристаллов. 1H ЯМР (CDCl3)  ; ;1,50 (с, 9H), 3,86 (с, 3H), 5,04 (шс, 1H), 7,71 (дд, J=7 Гц, 11 Гц, 1H) Ссылочный пример 41 Синтез метил-6-трет-бутиламино-5-фтор-2-(1,1,3,3-тетра- метилбутиламино)никотината К 7 мл N-метилпирролидона прибавляли 2,44 г метил 6-трет- бутиламино-2,5-дифторникотината и 4,0 г 1,1,3,3- тетраметилбутиламина, и смесь перемешивали при 140oC в течение 16 часов и давали ей остыть. После добавления 50 мл хлороформа смесь промывали три раза 300 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Коричневый маслянистый остаток подвергали колоночной хроматографии (силикагель, 40 г; элюент: хлороформ: н-гексан, 1:1) с получением 2,90 г указанного в заголовке соединения в виде бесцветного маслянистого остатка. 1H ЯМР (CDCl3)  ; ;0,96 (с, 9H), 1,51 (с, 9H), 1,53 (с, 6H), 3,76 (с, 3H), 4,87 (шс, 1H), 7,52 (д, J=12 Гц, 1H), 8,38 (шс, 1H) Ссылочный пример 42 Синтез 2-трет-бутиламино-3-фтор-5-метил-6-(1,1,3,3- тетраметилбутиламино)пиридина. В 20 мл тетрагидрофурана диспергировали 850 мг литийалюминийгидрида. Дисперсию охлаждали водой и перемешивали с одновременным прибавлением по каплям 2,80 г метил-6-трет- бутиламино-5-фтор-2-(1,1,3,3-тетраметилбутиламино) никотината, растворенного в 30 мл тетрагидрофурана. Реактор помещали в масляную баню при 50oC и смесь перемешивали два с половиной часа. Затем реактор охлаждали водой и прибавляли к реакционной смеси по каплям 8 мл этилацетата, после чего смесь перемешивали в течение 1 часа. Прибавляли по каплям 8 мл этанола и смесь перемешивали 1 час, после чего прибавляли по каплям 8 мл дистиллированной воды, и смесь перемешивали всю ночь. Осадок отделяли путем фильтрования и фильтрат концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии (силикагель, 40 г; элюент: хлороформ: н-гексан, 1:1) с получением 1,67 г указанного в заголовке соединения в виде бесцветного маслянистого остатка. 1H ЯМР (CDCl3)  ; ;0,99 (с, 9H), 1,47 (с, 9H), 1,52 (с, 6H), 1,91 (с, 3H), 3,73 (шс, 1H), 4,11 (шс, 1H), 6,81 (д, J=12 Гц, 1H) Ссылочный пример 43 Синтез 2,6-диамино-3-фтор-5-метилпиридина К 800 мг трифторуксусной кислоты прибавляли 340 мг 2-трет- бутиламино -3-фтор-5-метил-6-(1,1,3,3-тетраметилбутиламино) пиридина и смеси давали отстояться при комнатной температуре в течение 30 минут. Раствор концентрировали при пониженном давлении с получением неочищенного 2,6-диамино-3-фтор- 5-метилпиридина в виде бледно-коричневого твердого остатка. Пример 56 Синтез этил 1-(6-амино-5-фтор-3-метилпиридин-2-ил)-8-хлор- 6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 1 мл хлороформного раствора этил 3-этокси-2-(3-хлор- 2,4,5-трифторбензоил)акрилата, полученного из 280 мг этил 3- хлор-2,4,5-трифторбензоилацетата обычным способом, прибавляли весь 2,6-диамино-3-фтор-5-метилпиридин, полученный так, как описано выше, вместе с 2 мл метанола и 4 мл хлороформа. После отстаивания при комнатной температуре в течение 40 минут раствор концентрировали при пониженном давлении. К остатку прибавляли 600 мг безводного карбоната калия и 1 мл N,N-диметилформамида и смесь перемешивали при 85oC в течение 15 минут, после чего давали ей остыть. Раствор разделяли путем добавления 30 мл хлороформа и 300 мл дистиллированной воды, и хлороформный слой промывали два раза 300 мл дистиллированной воды, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К остатку прибавляли 0,5 мл этанола, и давали смеси отстояться в течение ночи. Осадок диспергировали в этаноле, собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 171 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 198-202oC 1H ЯМР (CDCl3,)  ; ;1,40 (т, J= 7 Гц, 3H), 2,02 (с, 3H), 4,39 (кв, J=7 Гц, 2H), 4,71 (шс, 2H), 7,25 (д, J=10 Гц, 1H) 8,34 (т, J=10 Гц, 1H), 8,34 (с, 1H) Пример 57 Синтез 1-(6-амино-5-фтор-3-метиолпиридин-2-ил)-8-хлор-6,7- дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 800 мг смешанного раствора (1:1) 4 н. соляной кислоты и уксусной кислоты прибавляли 160 мг этил 1-(6-амино-5-фтор-3- метилпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин- 3-карбоксилата, и смесь нагревали с обратным холодильником при перемешивании в течение 30 минут. После добавления 0,5 мл дистиллированной воды раствору давали остыть, и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 145 мг указанного в заголовке соединения в виде бледно-коричневого порошка. Температура плавления: 279-284oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;1,94 (с, 3H), 6,62 (шс, 2H), 7,57 (д, J=11 Гц, 1H), 8,40 (т, J=9 Гц, 1H), 8,72 (с, 1H) Пример 58 Синтез 7-(3-аминоазетидин-1-ил)-1-(6-амино-5-фтор-3- метилпиридин-2-ил)-8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-З- карбоновой кислоты К 250 мг N,N-диметилформамида прибавляли 80 мг 1-(6-амино-5- фтор-3-метилпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 60 мг 3-амино- азетидиндигидрохлорида и 120 мг N-метилпирролидина, и смесь перемешивали при 85oC в течение 45 минут. После прибавления 0,5 мл этанола смеси давали остыть и затем осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 72 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 256-258oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;1,90 (с, 3H), 3,69 (м, 1H), 4,03 (м, 2H), 4,66 (м, 2H), 6,57 (шс, 2H), 7,52 (д, J=11 Гц, 1H), 7,87 (д, J-14 Гц, 1H), 8,47 (с, 1H) Пример 59 Синтез 7-[3-(метиламино) азетидин-1-ил] -1-(6-амино- 5-фтор-3-метилпиридин-2-ил)-8-хлор-6-фтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты К 90 мг N,N-диметилформамида прибавляли 25 мг 1-(6-амино-5- фтор-3-метилпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 25 мг 3- (метиламино)азетидиндигидрохлорилаи 70 мг N-метилпирролидина, и смесь перемешивали при 85oC в течение 45 минут. После прибавления 0,2 мл этанола смеси давали остыть, и затем осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 20 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 251-253oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;1,90 (с, 3H), 2,20 (с, 1H), 3,44 (м, 1H), 4,12 (м, 2H), 4,63 (м, 2H), 6,57 (шс, 2H), 7,52 (д, J=11 Гц, 1H), 7,86 (д, J=14 Гц, 1H), 8,47 (с, 1H) Ссылочный пример 44 Синтез 6-трет-бутиламино-2-хлор-3-циано-5-фторпиридина К раствору 7,6 г 2,6-дихлор-3-циано-5-фторпиридина в 40 мл ацетонитрила прибавляли 8,8 г трет-бутиламина и смесь перемешивали при комнатной температуре в течение ночи. Из реакционного раствора отгоняли растворитель. Остаток разделяли путем прибавления метиленхлорида и воды. Органический слой сушили над безводным сульфатом магния и отгоняли растворитель с получением 6 г указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 84-85oC 1H ЯМР (CDCl3)  ; ;1,50 (с, 9H), 5,15 (шс, 1H), 7,25 (д, J=11 Гц, 1H) Ссылочный пример 45 Синтез 2-бензиламино-6-трет-бутиламино-3-циано-5-фторпиридина К 40 мл N-метилпирролидонового раствора 6 г 6-трет- бутиламино-2-хлор-3-циано-5-фторпиридина прибавляли 6,3 г бензиламина, и смесь перемешивали под атмосферой азота при 160oC в течение 3 часов, после чего давали ей остыть. Реакционный раствор разделяли путем прибавления хлороформа и воды, органический слой сушили над сульфатом магния и отгоняли растворитель. Выпавшие кристаллы отфильтровывали из остатка с получением 2 г указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления 138-140oC 1Н ЯМР (CDCl3)  ; ;1,38 (с, 9H), 4,63 (д, J=6 Гц, 2H), 4,87 (шс, 1H), 5,25 (шс, 1H), 7,31 (с, 5H) Ссылочный пример 46 Синтез 2-амино-6-трет-бутиламино-3-циано-5-фторпиридина К 500 мг 2-бензиламино-6-трет-бутиламино-3-циано-5- фторпиридина прибавляли 3 мл уксусной кислоты и 0,5 мл этанола, а затем 10 микролопаточек палладиевой чернили смесь перемешивали под атмосферой азота при 60oC в течение 2 дней. С помощью мембранного фильтра удаляли катализатор и из фильтрата отгоняли растворитель. К остатку прибавляли хлороформ, и смесь промывали водным раствором гидрокарбоната натрия. Органический слой собирали и сушили над сульфатом магния. Отгоняли растворитель с получением 300 мг указанного в заголовке соединения. Пример 60 Синтез этил 1-(6-трет-бутиламино-3-циано-5-фторпиридин-2-ил) -8-хлор-6,7-дифтор-1,4-дигидро-4-оксохинолон-3-карбоксилата Раствор 300 мг неочищенного 2-амино-6-трет-бутиламино-З- циано-5-фторпиридина в 2 мл этанола прибавляли по каплям к раствору 420 мг этил 3-этокси-2-(3-хлор-2,4,5-трифторбензоил) акрилата в 2 мл этанола при комнатной температуре, и смесь перемешивали всю ночь. Из реакционного раствора отгоняли растворитель, и к остатку прибавляли 3 мл N,N-диметилформамида в 210 мг карбоната калия, после чего смесь перемешивали при комнатной температуре в течение 90 минут и при 80oC в течение 2 часов. Реакционный раствор экстрагировали добавлением воды и этилацетата, и органический слой собирали и сушили над сульфатом магния. Отгоняли растворитель, и остаток собирали путем фильтрования с использованием этанола и промывали диэтиловым эфиром с получением 280 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 245oC или выше (с разложением). 1H ЯМР (CDCl3)  ; ;1,39 (с, 9H), 1,41 (т, J=7 Гц, 3H), 4,41 (кв, J=7 Гц, 2H), 5,39 (шс, 1H), 7,43 (д, J=10 Гц, 1H), 8,32 (т, J=9 Гц, 1H), 8,53 (с, 1H) Пример 61 Синтез 1-(6-амино-3-циано-5-фторпиридин-2-ил)-8-хлор- 6,7-дифтор-1,4-дигидро-4-оксохинолон-3-карбоновой кислоты К 280 мг этил 1-(6-трет-бутиламино-3-циано-5-фторпиридин-2- ил)-8-хлор-6,7-дифтор-1,4-дигидро-4-оксо-хинолон-3-карбоксилата прибавляли 3 мл 12 н. соляной кислоты и смесь нагревали с обратным холодильником в течение 6 часов, после чего давали ей остыть. Твердый осадок собирали путем фильтрования и промывали последовательно этанолом и диэтиловым эфиром с получением 120 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 277oC или выше (с разложением). 1H ЯМР (d6-ДМСО)  ; ;8,00 (шс, 2H), 8,21 (д, J=11 Гц, IH), 8,40 (т, J=9 Гц, 1H), 9,05 (с, 1H) Пример 62 Синтез 7-(3-аминоазетидин-1-ил)-1-(6-амино-3-циано-5- фторпиридин-2-ил)-8-хлор-6-фтор-1,4-дигидро-4-оксохинолон-3- карбоновой кислоты Раствор 40 мг 3-аминоазетидиндигидрохлорида и 80 мг триэтиламина в 300 мг N,N-диметилформамида перемешивали при 90oC и прибавляли к нему 50 мг 1-(6-амино-3-циано-5-фторпиридин-2-ил)-8- хлор-6,7-дифтор-1,4-дигидро-4-оксохинолон-3-карбоновой кислоты, после чего смесь перемешивали при 90oC в течение 10 минут. К реакционному раствору прибавляли 1 мл этанола и твердый осадок собирали и высушивали с получением 36 г указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 290oC или выше 1H ЯМР (d6-ДМСО)  ; ;4,09 (м, 1H), 4,48 (м, 2H), 4,79 (м, 2H), 7,90-8,06 (м, 3H), 8,16 (д, J= 11 Гц, 1H), 8,33 (шс, 2H), 8,85 (с, 1H) Пример 63 Синтез этил 1-[6-(трет-бутиламино)-3,5-дифторпиридин-2- ил] -6,7-дифтор-8-метил-1,4-дигидро-4-оксохинолин-3-карбоксилата К 3,4 г этил 2,4,5-трифтор-3-метилбензоилацетата прибавляли 3,2 г уксусного ангидрида и 2,3 г триэтилортоформиата, и смесь нагревали с обратным холодильником в течение 4 часов, после чего отгоняли растворитель. К остатку прибавляли толуол, и подвергали раствор азеотропной перегонке. После прибавления к остатку 5 мл этанола прибавляли по каплям при 0oC раствор 2,7 г 2-амино-6-(трет- бутиламино)-3,5-дифторпиридина в 20 мл этанола и смесь перемешивали при комнатной температуре в течение 20 минут. Из реакционного раствора отгоняли растворитель и остаток подвергали колоночной хроматографии на силикагеле с получением из элюента (этилацетат:гексан, 1:8) 4,6 г этил 2-(2,4,5-трифтор-З- метилбензоил)-3-[6-трет-бутиламино)-3,5-дифторпиридин-2- ил]аминоакрилата в виде масла. К раствору 4,6 г полученного описанным образом этил 2-(2,4, 5-трифтор-З-метилбензоил)-3-[6-(трет-бутиламино)-3, 5-дифторпиридин-2-ил]аминоакрилата в 10 мл диметилформамида прибавляли 1,35 г карбоната калия, и смесь перемешивали при 100oC в течение 50 минут. Реакционный раствор экстрагировали добавлением воды и уксусной кислоты, и органический слой собирали и сушили над сульфатом магния. Отгоняли растворитель и остаток собирали путем фильтрования с использованием этанола и промывали диэтиловым эфиром с получением 2,6 г указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 207-211oC 1H ЯМР (CDCl3)  ; ;1,34-1,48 (м, 12H), 1,82 (д, J=3 Гц, 3H), 4,40 (кв, J=7 Гц, 2H), 4,75 (шс, 1H), 7,23 (т, J=9 Гц, 1H), 8,22 (т, J=10 Гц, 1H), 8,50 (с, 1H) Пример 64 Синтез 1-(6-амино-3,5-дифторпиридин-2-ил)-6,7-дифтор-8 метил-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты К 2,5 г этил 1-[6-(трет-бутиламино)-3,5-дифторпиридин-2-ил]- 6,7-дифтор-8-метил-1,4-дигидро-4-оксохинолин-3-карбоксилата прибавляли 10 мл 12 н. соляной кислоты, и смесь нагревали с обратным холодильником всю ночь. Давали реакционному раствору отстояться и твердый осадок собирали путем фильтрования и промывали этанолом и затем диэтиловым эфиром с получением 1,7 г указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 274-277oC 1H ЯМР (d6-ДМСО)  ; ;1,84 (с, 3H), 6,91 (шс, 2H), 8,03 (т, J=9 Гц, 1H), 8,25 (т, J=9 Гц, 1H), 8,93 (с, 1H) Пример 65 Синтез 7-(3-аминоазетидин-1-ил)-1-(6-амино-3,5-дифторпиридин- 2-ил)-6-фтор-8-метил-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты Раствор 70 мг 3-аминоазетидиндигидрохлорида 200 мг 1,8- диазабицикло[5.4.0] ундецена и 300 мг пиридина перемешивали при 100oC и прибавляли к нему 110 мг 1-(6-амино-3,5-дифторпиридин-2- ил)-6,7-дифтор-8-метил-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты, после чего перемешивали при 100oC в течение 6 минут. Из реакционного раствора отгоняли растворитель у и к остатку прибавляли одну каплю уксусной кислоты и 3 мл этанола при нагревании, после чего раствору давали отстояться. Твердый осадок собирали и высушивали с получением 13 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 280oC или выше 1H ЯМР (d6-ДМСО)  ; ;1,60 (с, 3H), 3,77 (м, 2H), 3,93 (м, 1H), 4,46 (м, 2H), 6,86 (шс, 2H), 7,75 (д, J=13 Гц, 1H) 7,95 (т, J=9 Гц, 1H), 8,70 (с, 1H) Пример 66 Синтез 1-(6-амино-3,5-дифторпиридин-2-ил)-6-фтор-8-метил- 7-(3-метиламиноазетидин-1-ил)-1,4-дигидро-4-оксо-хинолон-3- карбоновой кислоты Указанное в заголовке соединение (20 мг) получили в виде бледно-желтого порошка аналогично тому, как описано в примере 65, за исключением того, что использовали 180 мг 1-(6-амино-3,5- дифторпиридин-2-ил)-6,7-дифтор-8-метил-1,4-дигидро-4- оксохинолин-3-карбоновой кислоты и 110 мг 3-амино- азетидинщигидрохлорида. Температура плавления: 229oC или выше 1H ЯМР (d6-ДМСО)  ; ;1,63 (с, 3H), 2,21 (с, 3H), 3,87 (м, 1H), 4,02 (м, 1H), 4,43 (м, 2H), 6,86 (шс, 2H), 7,75 (д, J=14 Гц, 1H), 7,97 (т, J=10 Гц, 1H), 8,71 (с, 1H) Пример 67 Синтез 7-(3-амино-3-метилазетидин-1-ил)-1-(6-амино-3,5- дифторпиридин-2-ил)-6-фтор-8-метил-1,4-дигидро-4-оксохинолон-3-карбоновой кислоты Указанное в заголовке соединение (60 мг) получили в виде бледно-желтого порошка аналогично тому, как описано в примере 65, за исключением того, что использовали 180 мг 1-(6-амино-3,5- дифторпиридин-2-ил)-6,7-дифтор-8-метил-1,4-дигидро-4-оксо- хинолин-3-карбоновой кислоты и 110 мг 3-амино-3-метилазетидиндигидрохлорида. Температура плавления: 235oC или выше 1H ЯМР (d6-ДМСО)  ; ;1,37 (с, 3H), 1,62 (с, 3H), 3,87 (м, 1H), 4,08 (м, 3H), 6,85 (шс, 2H), 7,74 (д, J=14 Гц, 1H), 7,96 (т, J=10 Гц, 1H), 8.70 (с, 1H) Пример 68 Синтез 1-(6-амино-3,5-дифторпиридин-2-ил)-6,8-дифтор-7- (3-метиламиноазетидин-1-ил)-4-оксо-1, 4-дигидрохинолин-3- карбоновой кислоты К 200 мг N,N-диметилформамида прибавляли 65 мг 1-(6-амино-З, 5-дифторпиридин-2-ил)-6,7,8-трифтор-4-оксо-1,4-дигидрохинолин- 3-карбоновой кислоты, 45 мг 3-метиламино-азетидиндигидрохлорида и 100 мг N-метилпирролидина вместе с 3 каплями этанола, и смесь перемешивали при 85oC в течение 30 минут. После прибавления 0,2 мл этанола смеси давали остыть и затем осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 52 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 262-268oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;2,19 (с, 3H), 3,52 (м, 1H), 4,01 (м, 2H), 4,44 (м, 2H), 6,75 (шс, 2H), 7,77 (д, J=13 Гц, 1H), 7,99 (т, J=9 Гц, 1H), 8,74 (с, 1H) Пример 69 Синтез 1-(6-амино-3,5-дифторпиридин-2-ил)-8-бром-6-фтор- 7-(3-гидроксиазетидин-1-ил)-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты К 270 мг N,N-диметилформамида прибавляли 110 мг 1-(6-амино- 3,5-дифторпиридин-2-ил)-8-бром-6,7-дифтор-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 50 мг 3-гидроксиазетидингидрохлорида и 100 мг N-метилпирролидина вместе с 3 каплями этанола и смесь перемешивали при 85oC в течение 25 минут. После прибавления 0,5 мл этанола смеси давали остыть и затем осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 101 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 215-220oC 1H ЯМР (d6-ДМСО)  ; ;4,06 (м, 2H), 4,51 (м, 3H), 5,75 (шс, 1H), 6,76 (шс, 2H), 7,79 (д, J=13 Гц, 1H), 7,99 (т, J=9 Гц, 1H), 8,75 (с, 1H) 1 Пример 70 Синтез 1-(6-амино-3,5-дифторпиридин-2-ил)-8-хлор-6-фтор- 7-(3-гидроксиазетидин-1-ил)-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты К 3,5 г N,N-диметилформамида прибавляли 2,00 г 1-(6- амино-3,5-дифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 1,00 г 3- гидроксиазетидингидрохлорида и 2,00 г N-метилпирролидина вместе с 0,2 мл этанола, и смесь перемешивали при 85oC в течение 10 минут. Отгоняли при пониженном давлении растворитель и тому подобное. После прибавления к остатку 10 мл этанола смесь нагревали с обратным холодильником в течение 10 минут, после чего давали ей остыть и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 2,10 г указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 235-238oC 1H ЯМР (d6-ДМСО)  ; ;4,18 (м, 2H), 4,48 (м, 1H), 4,72 (м, 2H), 5,74 (д, J=6 Гц, 1H), 6,76 (шс, 2H), 7,86 (д, J=14 Гц, 1H), 7,95 (т, J=9 Гц, 1H), 8,70 (с, 1H) Пример 71 Синтез 1-(6-амино-3,5-дифторпиридин-2-ил)-6,8-дифтор-7- (3-гидроксиазетидин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 280 мг N,N-диметилформамида прибавляли 125 мг 1-(6- амино-3,5-дифторпиридин-2-ил)-6,7,8-трифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 60 мг 3-гидроксиазетидингидрохлорида и 120 мг N-метилпирролидина вместе с 3 каплями этанола, и смесь перемешивали при 85oC в течение 10 минут. После прибавления 0,8 мл этанола смеси давали остыть и затем осадок собирали путем фильтрования и промывали последовательно, этанолом и диизопропиловым эфиром с получением 90 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 269-272oC 1H ЯМР (d6-ДМСО)  ; ;4,06 (м, 2H), 4,51 (м, 3H), 5,75 (шс, 1H), 6,76 (шс, 2H), 7,79 (д, J=13 Гц, 1H), 7,99 (т, J=9 Гц, 1H), 8,75 (с, 1H) Пример 72 Синтез этил 8-бром-1-[6-(трет-бутиламино)-5-фторпиридин-2- ил] -6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 1 мл хлороформного раствора этил 3-этокси-2-(3-бром-2,4,5- трифторбензоил)акрилата, полученного из 0,65 г этил 3-бром-2,4,5- трифторбензоилацетата обычным способом, прибавляли 0,3 г 2-амино- 6-(трет-бутиламино)-5-фторпиридина. Раствор концентрировали при пониженном давлении с получением желтовато-оранжевого остатка. К этому остатку прибавляли 0,4 г безводного карбоната калия и 2 мл N-диметилформамида, и смесь перемешивали при 90oC в течение 25 минут, после чего давали ей остыть. Раствор разделяли путем добавления 25 мл хлороформа и 400 мл дистиллированной воды, и хлороформный слой промывали 400 мл дистиллированной воды, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. После прибавления 2 мл этанола раствору давали отстояться. Осадок диспергировали в этаноле, собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 0,53 г указанного в заголовке соединения в виде бледно-желтого порошка. Температуру плавления: 192-195oC 1H ЯМР (CDCl3)  ; ;1,37 (с, 9H), 1,40 (т, J=7 Гц, 3H), 4,40 (кв, J=7 Гц, 2H), 4,83 (шс, 1H), 6,50 (дд, J=3 Гц, 8 Гц, 1H), 7,24 (дд, J=8 Гц, 10 Гц, 1H), 8,35 (т, J=9 Гц, 1H), 8,65 (с, 1H) Пример 73 Синтез 1-(6-амино-5-фторпиридин-2-ил)-8-бром-6,7-дифтор- 4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 4 мл смешанного раствора (1:1) 4 н. соляной кислоты и уксусной кислоты прибавляли 480 мг 8-бром-1-[6-(трет- бутиламино)-5-фторпиридин-2-ил]-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоксилата и смесь нагревали с обратным холодильником при перемешивании в течение 2 часов. После добавления 4 мл дистиллированной воды раствору давали остыть, и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 345 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 245-251oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;6,84-6,92 (м, 3H), 7,64 (дд, J=8 Гц, 11 Гц, 1H), 8,40 (т, J=9 Гц, 1H), 8,79 (с, 1H) Пример 74 Синтез 7-(3-аминоазетидин-1-ил)-1-(6-амино-5-фторпиридин- 2-ил)-8-бром-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 250 мг N,N-диметилформамида прибавляли 80 мг 1-(6-амино-5- фторпиридин-2-ил)-8-бром-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты, 55 мг 3-аминоазетидиндигидрохлорида и 150 мг N-метилпирролидина) и смесь перемешивали при 90oC в течение 10 минут. После прибавления 0,3 мл этанола раствору давали остыть, и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 68 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 245-250oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;3,72 (м, 1H), 4,02 (м, 2H), 4,67 (м, 2H), 6,73 (дд, J=2 Гц, 8 Гц, 1H, 6,82 (шс, 2H), 7,59 (дд, J=8 Гц, 10 Гц, 1H), 7,87 (д, J=14 Гц, 1H), 8,69 (с, 1H) Пример 75 Синтез 1-(6-амино-5-фторпиридин-2-ил)-8-бром-6-фтор-7-(З- метиламиноазетидин-1-ил)-4-оксо-1,4-дигидрохинолин-З-карбоновой кислоты К 250 мг N,N-диметилформамида прибавляли 80 мг 1-(6-амино-5- фторпиридин-2-ил)-8-бром-6,7-дифтор-4-оксо-1,4-дигидрохинолин- 3-карбоновой кислоты, 80 мг 3-метиламиноазетидиндигидрохлорида и 200 мг N-метилпирролидина и смесь перемешивали при 85oC в течение 10 минут. После прибавления 0,5 мл этанола раствору давали остыть и затем осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 66 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 210- 218oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;2,22 (с, 3H), 3,48 (м, 1H), 4,12 (м, 2H), 4,61 (м, 2H), 6,74 (д, J=10 Гц, 2H), 6,81 (шс, 2H), 7,59 (т, J=10 Гц, 1H), 7, 87 (д, J=14 Гц, 1H), 8,68 (с, 1H) Ссылочный пример 47 Синтез 2-амино-5-хлор-3,6-дифторпиридина К 25 мл метанола прибавляли 2,7 г 2-амино-4-бром-5-хлор- 3,6-дифторпиридина и 1,15 г триэтиламина вместе с 0, 145 г 10%-ного палладия на угле, и смесь гидрировали при комнатной температуре в течение 1,5 часов. Отделяли путем фильтрования катализатор и отгоняли при пониженном давлении растворитель и тому подобное. К остатку прибавляли 50 мл хлороформа и смесь промывали 30 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученные бесцветные чешуйчатые кристаллы диспергировали в смешанном растворителе диизопропилового эфира и н-гексана (1:2) и собирали путем фильтрования с получением 1,62 г указанного в заголовке соединения. Ссылочный пример 48 Синтез 2-амино-5-хлор-3-фтор-6-(п-метоксибензиламино) пиридина К 2 мл N-метилпирролидона прибавляли 510 мг 2-амино-5- хлор-3,6-дифторпиридина и 910 мг п-метоксибензиламина, и смесь перемешивали при 150oC в течение дня, после чего давали ей остыть. После прибавления 60 мл смешанного раствора бензола и н-гексана (1:1, об/об) раствор промывали два раза 400 мл дистиллированной воды. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 960 мг указанного в заголовке соединения в виде коричневого неочищенного масла. 1H ЯМР (CDCl3)  ; ;3,80 (с, 3H), 4,35 (шс, 2H), 4,50 (м, 2H), 4,86 (шс, 1H), 6,87 (д, J=8 Гц, 2H), 7,15 (д, J=10 Гц, 1H), 7,27 (д, J=8 Гц, 2H) Пример 76 Синтез этил 8-хлор-1-[5-хлор-3-фтор-6-(п-метоксибензиламино) -пиридин-2-ил]-6,7-дифтор-4-оксо-1,4-дигидрохинолин-З-карбоксилата К 2 мл хлороформного раствора этил 3-этокси-2-(3-хлор-2,4,5- трифторбензоил)акрилата, полученного из 0,56 г этил 3-хлор-2,4,5- трифторбензоилацетата обычным способом, прибавляли 0,66 г 2-амино- 5-хлор-3-фтор-6-(п-метоксибензиламино) пиридина. Раствор концентрировали при пониженном давлении. К остатку прибавляли 0,5 г безводного карбоната калия и 1,5 мл N,N-диметилформамида и смесь перемешивали при 90oC в течение 20 минут, после чего давали ей остыть. Раствор разделяли путем добавления 30 мл хлороформа и 300 мл дистиллированной воды, и хлороформный слой промывали 300 мл дистиллированной воды, сушили над безводным сульфатом магния и концентрировали при пониженном, давлении. После прибавления 4 мл этанола раствору давали отстояться. Осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 0,56 г указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 168-171oC 1H ЯМР (CDCl3,)  ; ;1,40 (т, J=7 Гц, 3H), 3,80 (с, 3H), 4,40 (д, J=7 Гц, 2H), 4,42 (кв, J= Гц, 2H), 5,46 (шс, 1H), 6,83 (д, J=9 Гц, 2H), 7,18 (д, J=9 Гц, 2H), 7,53 (д, J=8 Гц, 1H), 8,29 (т, J=9 Гц, 1H), 8,48 (с, 1H) Пример 77 Синтез этил 1-(6-амино-5-хлор-3-фторпиридин-2-ил)-8-хлор- 6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 530 мг этил 8-хлор-1-[5-хлор-3-фтор-6-(п- метоксибензиламино)пиридин-2-ил]-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоксилата прибавляли 2 мл трифторацетата и раствору давали отстояться в течение 30 минут при комнатной температуре. Раствор концентрировали при пониженном давлении, и к остатку прибавляли 4 мл этанола, после чего раствор концентрировали при пониженном давлении. Осадок диспергировали в этаноле, собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 462 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 186-189oC 1H ЯМР (CDCl3)  ; ;1,40 (т, J=7 Гц, 3H), 4,40 (KB, J=7 Гц, 2H), 5,02 (шс, 2H), 7,57 (д, J=8 Гц, 2H), 8,30 (т, J=9 Гц, 1H), 8,48 (с, 1H) Пример 78 Синтез 1-(6-амино-5-хлор-3-фторпиридин-2-ил)-8-хлор-6,7- дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 2 мл смешанного раствора (1:1) 4 н. соляной кислоты и уксусной кислоты прибавляли 430 мг этил 1-(6-амино-5-хлор-3- фторпиридин-2-ил]-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоксилата, и смесь нагревали с обратным холодильником при перемешивании в течение 6 часов, после чего давали остыть. Осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 375 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 280oC или выше 1H ЯМР (d6-ДМСО)  ; ;6,86 (шс, 2H), 8,15 (д, J=9 Гц, 1H), 8,38 (т, J=9 Гц, 1H), 8,95 (с, 1H) Пример 79 Синтез 7-(3-аминоазетидин-1-ил)-1-(6-амино-5-хлор- 3-фторпиридин-2-ил)-8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 280 мг N,N-диметилформамида прибавляли 90 мг 1-(6-амино-5- хлор-3-фторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 70 мг 3- аминоазетидиндигидрохлорида и 160 мг N-метилпирролидина, и смесь перемешивали при 85oC в течение 20 минут. После добавления 0,3 мл этанола смеси давали остыть и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 50 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 240-245oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;3,71 (м, 1H), 4,06 (м, 2H), 4,66 (м, 2H), 6,79 (шс, 2H), 7,85 (д, J=14 Гц, 1H), 8,08 (д, J=9 Гц, 1H), 8,70 (с, 1H) Ссылочный пример 49 Синтез 2,3,5-трифтор-6-изопропиламинопиридина К 20 мл ацетонитрила прибавляли 6,0 г 2,3,5,6- тетрафторпиридина и 6,0 г изопропиламина, и смесь перемешивали при комнатной температуре в течение 2 часов и концентрировали при пониженном давлении. После добавления 40 мл хлороформа раствор промывали 50 мл 3%-ного водного раствора карбоната калия. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 1,9 г указанного в заголовке соединения в виде бесцветного масла. Ссылочный пример 50 Синтез 3,5-дифтор-2-изопропиламино-6-(п-метоксибензиламино) пиридина К 4,1 г N-метилпирролидона прибавляли все количество 2,3,5- трифтор-6-изопропиламинопиридина, полученного так, как описано выше, вместе с 3,1 г п-метоксибензиламина, и смесь перемешивали при 150oC в течение 15 часов, после чего давали ей остыть. После прибавления 50 мл смешанного раствора бензола и н-гексана (1:1, об/об) раствор промывали два раза 400 мл дистиллированной воды. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 3,9 г указанного в заголовке соединения в виде коричневого неочищенного масла. Ссылочный пример 51 Синтез 2-амино-3,5-дифтор-6-изопропиламинопиридина К 1,9 г 3, 5-дифтор-2-изопропиламино-6-(п-метоксибензиламино) пиридина прибавляли 4 мл трифторацетата и смеси давали отстояться при комнатной температуре в течение 15 минут. Раствор концентрировали при пониженном давлении, и к остатку прибавляли 25 мл хлороформа, после чего раствор промывали 25 мл 5%-ного водного раствора карбоната натрия. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении, и остаток подвергали колоночной хроматографии (силикагель, 40 г; элюент: хлороформ) с получением 0,6 г указанного в заголовке соединения в виде коричневого масла. Пример 80 Синтез этил-8-хлор-6,7-дифтор-1-(3,5-дифтор-6- изопропиламинопиридин-2-ил]-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 2,5 мл хлороформного раствора этил 3-этокси-2-(3-хлор- 2,4,5-трифторбензоил)акрилата, полученного из 0,70 г этил 3-хлор- 2,4,5-трифторбензоилацетата обычным способом, прибавляли 600 мг 2- амино-3,5-дифтор-6-изопропиламинопиридина. Раствор концентрировали при пониженном давлении. К остатку прибавляли 600 мг безводного карбоната калия и 2 мл N,N-диметилформамида; и смесь перемешивали при 90oC в течение 20 минут, после чего давали ей остыть. Раствор разделяли путем добавления 30 мл хлороформа и 400 мл дистиллированной воды и хлороформный слой промывали два раза 400 мл дистиллированной воды, сушили над безводным сульфатом магния, концентрировали при пониженном давлении и давали отстояться. Осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 620 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 206-209oC 1H ЯМР (CDCI3)  ; ;1,20 (д, J=7 Гц, 3H), 1,24 (д, J=7 Гц, 3H), 1,40 (т, J=7 Гц, 3H), 4,11 (м, 1H), 4,40 (кв, J=7 Гц, 2H), 4,60 (шс, 1H), 7,22 (дд, J=8 Гц, 9 Гц, 1H), 8,32 (дд, J=8 Гц, 10 Гц, 1H), 8,49(с, 1H) Пример 81 Синтез 8-хлор-6,7-дифтор-1-(3,5 дифтор-6- изопропиламинопиридин-2-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 3 мл смешанного раствора (1:1, об/об) 4 н. соляной кислоты и уксусной кислоты прибавляли 300 мг этил 8-хлор-6,7- дифтор-1-(3,5-дифтор-6-изопропиламинопиридин-2-ил]-4-оксо- 1,4-дигидрохинолин-З-карбоксилата и смесь нагревали с обратным холодильником в течение 19 часов при перемешивании. Осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 265 мг указанного в заголовке соединения в виде желтого порошка. Температура плавления: 226-230oC 1H ЯМР (d6-ДМСО)  ; ;1,10 (д, J=7 Гц, 3H), 1,16 (д, J=7 Гц, 3H), 3,94 (м, 1H), 7,02 (шд, J=8 Гц, 2H), 7,97 (т, J=9 Гц, 1H), 8,39 (т, J=9 Гц, 1H), 8,92 (с, 1H) Пример 82 Синтез 7-(3-аминоазетидин-1-ил)-8-хлор-6-фтор-1-(3, 5-дифтор-6-изопропиламинопиридин-2-ил)-4-оксо-1,4-дигидрохинолин- 3-карбоновой кислоты К 160 мг N,N-диметилформамида прибавляли 55 мг 8-хлор-6,7- дифтор-1-(3,5-дифтор-6-изопропиламинопиридин-2-ил)-4-оксо-1,4- дигидрохинолин-З-карбоновой кислоты, 35 мг 3- аминоазетидиндигидрохлорида и 120 мг N-метилпирролидина, и смесь перемешивали при 80oC в течение 30 минут. После прибавления 0,5 мл этанола смеси давали остыть, и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 51 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 220-223oC 1H ЯМР (d6-ДМСО)  ; ;1,13 (д, J=7 Гц, 3H), 1,16 (д, J=7 Гц, 3H), 3,70 (м, 1H), 3,96 (м, 2H), 4,06 (м, 1H), 4,65 (м, 2H), 6,92 (шд, J=7 Гц, 2H), 7,87 (д, J-14 Гц, 1H), 7,92 (т, J=9 Гц, 1H), 8,66 (с, 1H) Пример 83 Синтез этил 1-[3,5-дифтор-6-(п-метоксибензиламино) пиридин-2-ил] -5,6,7,8-тетрафтор-4-оксо-1,4-дигидрохинолин-3- карбоксилата К 20 мл хлороформного раствора этил 3-этокси-2- пентафторбензоилакрилата, полученного из 5,6 г этил 2,3,4,5,6- пентафторбензоилацетата обычным способом, прибавляли 2-амино-3,5- дифтор-6-(п-метоксибензоиламино) пиридин, пока при ТСХ-анализе не исчезло этилакрилатное пятно. Раствор концентрировали при пониженном давлении. К остатку прибавляли 4,3 г безводного карбоната калия и 15 мл N,N-диметилформамида, и смесь перемешивали при 90oC в течение 15 минут, после чего давали ей остыть. Раствор разделяли путем добавления 100 мл хлороформа и 1 литра дистиллированной воды и хлороформный слой промывали два раза 1 литром дистиллированной воды, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Осадок диспергировали в этаноле, собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 6,15 г указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 203-208oC 1H ЯМР (CDCl3)  ; ;1,40 (т, J=7 Гц, 3H), 3,80 (с, 3H), 4,40 (д, J=7 Гц, 2H), 4,42 (кв, J=7 Гц, 2H), 5,46 (шс, 1H), 6,83 (д, J=9 Гц, 2H), 7,18 (д, J=9 Гц, 2H), 7,53 (д, J=8 Гц, 1H), 8,29 (т, J=9 Гц, 1H), 8,48 (с, 1H) Пример 84 Синтез этил 1-(6-амино-3,5-дифторпиридин-2-ил)-5,6,7,8- тетрафтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 1080 мг этил 1-[3,5-дифтор-6-(п-метоксибензиламино) пиридин-2-ил]-5,6,7,8-тетрафтор-4-оксо-1,4- дигидрохинолин-3-карбоксилата прибавляли 4 мл трифторуксусной кислоты, и смеси давали отстояться в течение 30 минут при комнатной температуре. Раствор концентрировали при пониженном давлении, и к остатку прибавляли 4 мл этанола, после чего раствор концентрировали при пониженном давлении. Осадок диспергировали в этаноле, собирали путем фильтрования и промывали этанолом с получением 960 мг указанного в заголовке соединения в виде серого порошка. Температура плавления: 223-230oC 1H ЯМР (CDCI3)  ; ;1,39 (т, J=7 Гц, 3H), 4,38 (д, J=7 Гц, 2H), 4,83 (шс, 2H), 6,83 (д, J=9 Гц, 2H), 7,35 (т, J=9 Гц, 1H), 8,32 (с, 1H) Пример 85 Синтез 1-(6-амино-3,5-дифторпиридин-2-ил)-5,6,7,8- тетрафтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 2 мл смешанного раствора (1:1) 4 н. соляной кислоты и уксусной кислоты прибавляли 320 мг этил 1-6-(амино-3,5- дифторпиридин-2-ил)-5,6,7,8-тетрафтор-4-оксо-1,4-дигидрохинолин -3-карбоксилата, и смесь нагревали в обратным холодильником в течение 3 часов при перемешивании, после чего давали остыть. Осадок собирали путем фильтрования и промывали этанолом с получением 280 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 236-242oC 1H ЯМР (d6-ДМСО)  ; ;6,82 (шс, 2H), 8,03 (т, J=9 Гц, 1H), 8,92 (с, 1H) Пример 86 Синтез 7-(3-аминоазетидин-1-ил)-1-(6-амино-3,5- дифторпиридин-2-ил)-5,6,8-трифтор-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты К 300 мг N,N-диметилформамида прибавляли 100 мг 1-(6-амино- 3,5-дифторпиридин-2-ил)-5,6,7,8-тетрафтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 70 мг 3-амино- азетидиндигидрохлоридаи 150 мг N-метилпирролидина, и смесь перемешивали при 90oC в течение 30 минут. После добавления 0,3 мл этанола смеси давали остыть, и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 50 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 264-271oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;3,77 (м, 1H), 3,96 (м, 2H), 4,46 (м, 2H), 6,75 (шс, 2H), 7,97 (т, J=9 Гц, 1H), 8,66 (с, 1H) Пример 87 Синтез этил 5-бензиламино-1-[3,5-дифтор-6- (п-метоксибензиламино)пиридин-2-ил]-6,7,8-трифтор-4-оксо-1,4- дигидрохинолин-3-карбоксилата К 8 мл толуола прибавляли 1,58 г этил 1-[3,5-дифтор-6-(п- метоксибензиламино) пиридин-2-ил] -5,6,7,8-тетрафтор-4-оксо-1,4- дигидрохинолин-3-карбоксилата вместе с 0,68 г бензиламина, и смесь перемешивали при 110oC в течение 20 минут, после чего давали ей остыть. После прибавления 15 мл толуола и 15 мл н-гексана смесь промывали два раза 300 мл дистиллированной воды. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К остатку прибавляли 4 мл этанола, давали раствору отстояться, и осадок собирали путем фильтрования и промывали этанолом с получением 1,20 г указанного в заголовке соединения в виде желтого порошка. Температура плавления: 146-148oC 1H ЯМР (CDCl3)  ; ;1,37 (т, J= 7 Гц, 3H), 3,79 (с, 3H), 4,37 (кв, J=7 Гц, 2H), 4,47 (шс, 1H), 4,68 (м, 2H), 5,01 (шс, 1H), 6,84 (д, J=9 Гц, 2H), 7,16-7,40 (м, 10H), 8,22 (с, 1H) Пример 88 Синтез этил 1-(6-амино-3,5-дифторпиридин-2-ил] -5- бензиламино-6,7,8-трифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 600 мг этил 5-бензиламино-1-[3,5-дифтор-6- (п-метоксибензиламино)пиридин-2-ил] -6,7,8-трифтор-4-оксо-1,4- дигидрохинолин-3-карбоксилата прибавляли 2 мл трифторуксусной кислоты и смеси давали отстояться при комнатной температуре в течение 20 минут. Раствор концентрировали при пониженном давлении и к остатку прибавляли 3 мл этанола, после чего опять концентрировали при пониженном давлении. Осадок диспергировали в этаноле, собирали путем фильтрования и промывали этанолом с получением 530 мг указанного в заголовке соединения в виде желтого порошка. Температура плавления: 176-180oC 1H ЯМР (CDCl3)  ; ;1,36 (т, J=7 Гц, 3H), 4,36 (кв, J=7 Гц, 2H), 4,47 (шс, 1H), 4,68 (д, J-4 Гц, 2H), 4,74 (шс, 1H), 6,84 (д, J=9 Гц, 2H), 7,24- 7,40 (м, 6H), 8,21 (с, 1H) Пример 89 Синтез этил 5-амино-1-(6-амино-3,5-дифторпиридин-2-ил)- 6,7,8-трифтор-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 5 мл уксусной кислоты прибавляли 260 мг этил 1-(6-амино-3,5-дифторпиридин-2-ил)-5-бензиламино-6,7,8-трифтор-4-оксо-1,4- дигидрохинолин-3-карбоксилата вместе с 50 мг 10%-ного палладия на угле у и смесь гидрировали при комнатной температуре в течение 4 часов. Отделяли путем фильтрования катализатор и отгоняли при пониженном давлении растворитель и тому подобное. Два раза повторяли процедуру прибавления к остатку 10 мл этанола и концентрирования при пониженном давлении. Осадок диспергировали в этаноле, собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым, эфиром с получением 160 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 225-230oC 1Н ЯМР (CDCl3)  ; ;1,38 (т, J=7 Гц, 3H), 4,38 (KB, J=7 Гц, 2H), 4,73 (шс, 2H), 4,68 (д, J=4 Гц, 2H), 6,8 (шс, 2H), 6,84 (д, J=9 Гц, 2H), 7,32 (т, J=9 Гц, 1H), 8,25 (с, 1H) Пример 90 Синтез 5-амино-1-(6-амино-3,5-дифторпиридин-2-ил)-6,7,8- трифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 1,5 мл смешанного раствора (1:1) 4 н. соляной кислоты и уксусной кислоты прибавляли 145 мг этил 5-амино-1-(6-амино-3,5- дифторпиридин-2-ил)-6,7,8-трифтор-4-оксо-1,4-дигидрохинолин-3- карбоксилата и смесь нагревали с обратным холодильником в течение 17 часов при перемешивании и затем давали остыть. Осадок собирали путем фильтрования и промывали этанолом с получением 129 мг указанного в заголовке соединения в виде желтого порошка. 1H ЯМР (d6-ДМСО)  ; ;6,78 (шс, 2H), 7,75 (шс, 1H), 7,99 (т, J=9 Гц, 1H), 8,77 (с, 1H) Пример 91 Синтез 5-амино-7-(3-аминоазетидин-1-ил)-1-(6-амино-3,5- дифторпиридин-2-ил)-6,8-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 210 мг N, N-диметилформамида прибавляли 50 мг 5-амино-1- (6-амино-3,5-дифторпиридин-2-ил)-6,7,8-трифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 40 мг 3-аминоазетидиндигидрохлорида и 150 мг N-метилпирролидина, и смесь перемешивали при 90oC в течение 1 часа и концентрировали при пониженном давлении. Два раза повторяли процедуру прибавления к остатку 2 мл диизопропилового эфира, перемешивания и декантации. К остатку прибавляли 2 мл этанола и 40 мл N-метилпирролидина, смеси давали отстояться в течение ночи, и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 26 мг указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 205-210oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;3,72 (м, 1H), 3,88 (м, 2H), 4,37 (м, 2H), 6,71 (шс, 2H), 7,23 (шс, 2H), 7,94 (т, J=9 Гц, 1H), 8,50 (с, 1H) Пример 92 Синтез этил 1-(6-трет-бутиламино-3,5-дифторпиридин-2-ил)-8- хлор-6,7-дифтор-5-нитро-4-оксо-1,4-дигидрохинолин-3-карбоксилата К 10 мл хлороформного раствора этил 3-этокси-2-(3-хлор- 2,4,5-трифтор-6-нитробензоил)акрилата, полученного из 3,25 г этил 3-хлор-2,4,5-трифтор-6-нитробензоилацетата обычным способом, прибавляли 2,14 г 2-амино-3,5-дифтор-6-трет- бутиламинопиридина. Раствор концентрировали при пониженном давлении, и к остатку прибавляли 2,7 г безводного карбоната калия и 10 мл N, N-диметилформамида, и смесь перемешивали при 90oC в течение 5 минут, после чего давали ей остыть. Раствор разделяли путем прибавления 100 мл хлороформа и 500 мл 2%-ного водного раствора лимонной кислоты и хлороформный слой промывали два раза 500 мл 2%-ного водного раствора лимонной кислоты, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Осадок диспергировали в этаноле, собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 3,13 г указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 215-217oC 1H ЯМР (CDCl3)  ; ;1,37 (т, J= 7 Гц, 3H), 1,39 (с, 9H), 4,39 (KB, J=7 Гц, 2H), 4,77 (шс, 1H), 7,24 (т, J=8 Гц,1H), 8,35 (т, J=9 Гц, 1H), 8,52 (с, 1H) Пример 93 Синтез 5-амино-1-(6-амино-3,5-дифторпиридин-2-ил)- 8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 10 мл муравьиной кислоты прибавляли 960 мг этил 1-(6-трет- бутиламино-3,5-дифторпиридин-2-ил)-8-хлор-6,7-дифтор-5-нитро-4- оксо-1,4-дигидрохинолин-3-карбоксилата вместе с 1,0 г железного порошками смесь перемешивали при 80-90oC в течение 5 часов 40 минут. Нерастворимое содержимое отделяли путем фильтрования через целит и содержимое, отделенное целитом и целит промывали муравьиной кислотой и хлороформом. Фильтрат и промывные воды концентрировали при пониженном давлении. К остатку прибавляли 6 мл смешанного раствора 4 н. соляной кислоты и уксусной кислоты (1:1), и смесь нагревали с обратным холодильником в течение 2 часов при перемешивании, после чего давали ей остыть. Осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 625 мг указанного в заголовке соединения в виде желтого порошка. Температура плавления: 280oC или выше 1H ЯМР (d6-ДМСО)  ; ;6,77 (шс, 2H), 7,94 (т, J=9 Гц, 1H), 8,20 (шс, 2H), 8,70 (с, 1H) Пример 94 Синтез 5-амино-7-(3-аминоазетидин-1-ил)-1-(6-амино-3,5- дифторпиридин-2-ил)-8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты К 550 мг пиридина прибавляли 185 мг 5-амино-1-(6-амино-3, 5-дифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин -3-карбоновой кислоты, 110 мг 3-аминоазетидиндигидрохлорида и 200 мг N-метилпирролидина, и смесь перемешивали при 100oC в течение 30 минут и концентрировали при пониженном давлении. После прибавления 2 мл этанола смесь перемешивали, и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 48 мг указанного в заголовке соединения в виде желтого порошка. 1H ЯМР (d6-ДМСО)  ; ;3,83 (м, 1H), 4,14 (м, 2H), 4,61 (м, 2H), 6,71 (шс, 2H), 7,52 (шс, 2H), 7,89 (т, J=9 Гц, 1H), 8,51 (с, 1H) Пример 95 Синтез этил 6,7-дифтор-1-(3,5-дифтор-6-п- метоксибензиламинопиридин-2-ил)-8-метил-5-нитро-1,4-дигидро- 4-оксохинолин-3-карбоксилата К 5,0 г этил 3,4,6-трифтор-5-метил-2-нитробензоилацетата прибавляли 11,5 г уксусного ангидрида и 4,7 г триэтилортоформиата у и смесь нагревали с обратным холодильником в течение 1,5 часов. Реакционному раствору давали остыть, отгоняли реагент и тому подобное, и к остатку прибавляли толуол для азеотропной перегонки. Осадок прибавляли к 10 мл этанола и к смеси прибавляли по каплям в ледяной бане раствор 5,0 г 2-амино-3,5-дифтор-6-п- метоксибензиламино)пиридина в 15 мл этанола и перемешивали ее при комнатной температуре в течение 10 минут. Из реакционного раствора отгоняли растворитель, и остаток подвергали колоночной хроматографии на силикагеле с получением 7,1 г масла из фракций, элюированных смесью этилацетат:гексан (1:10). К 7,0 г этого масла прибавляли 10 мл N,N-диметилформамида и 2,0 г карбоната калия, и смесь перемешивали при 70oC в течение 30 минут. К реакционному раствору прибавляли этилацетат и воду, и органический слой отделяли и сушили над сульфатом магния. Отгоняли растворитель и к остатку прибавляли этанол для диспергирования твердого содержимого, которое собирали путем фильтрования с получением 1,5 г указанного в заголовке соединения в виде бледно-желтого порошка. Температуру плавления: 225-227oC 1H ЯМР (CDCl3)  ; ;1,37 (т, J=7 Гц, 3H), 1,68 (д, J=3 Гц, 3H), 3,81 (с, 3H), 4,39 (KB, J=7 Гц, 2H),4,45 (с, 2H), 5,29 (шс, 1H), 6,83 (д, J=8 Гц, 2H), 7,17 (д, J=8 Гц, 2H), 7,31 (т, J=9 Гц, 1H), 8,45 (с, 1H) Пример 96 Синтез этил-5-амино-6,7-дифтор-1-(3,5-дифтор-6-п- метоксибензиламинопиридин-2-ил)-8-метил-1,4-дигидро-4- оксохинолин-3-карбоксилата К 10 мл раствора 1,7 г этил 6,7-дифтор-1-(4,6-дифтор-3-п- метоксибензиламинопиридин-2-ил)-8-метил-5-нитро-1,4-дигидро-4- оксохинолин-3-карбоксилата в уксусной кислоте прибавляли 1,4 г железного порошками смесь нагревали и перемешивали при 90oC в течение 4 часов 40 минут. Из реакционного раствора удаляли путем фильтрования катализатор и из фильтрата отгоняли растворитель. Остаток подвергали колоночной хроматографии на силикагеле. Фракцию, элюированную смесью хлороформ:метанол (10:1) концентрировали и к остатку прибавляли этанол. Порошкообразный осадок собирали путем фильтрования с получением 1,3 г указанного в заголовке соединения в виде бледно-коричневого порошка. Температура плавления: 150-153oC 1H ЯМР (d6-ДМСО)  ; ;1,24 (т, J=7 Гц, 3H), 1,30 (с, 3H), 3,71 (с, 3H), 4,20 (кв, J=7 Гц, 2H), 4,33 (дд, J= 5 Гц, 12 Гц, 2H), 6,76 (д, J=Q Гц, 2H) 7,14 (д, J=8 Гц, 2H), 7,85 (шс, 1H), 7,93 (т, J=10 Гц, 1H), 8,27 (с, 1H) Пример 97 Синтез 5-амино-1-(6-амино-З,5-дифторпиридин-2-ил)-6,7- дифтор-8-метил-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты К 0,99 г этил 5-амино-6,7-дифтор-1-(3,5-дифтор-6-п- метоксибензиламинопиридин-2-ил)-8-метил-1,4-дигидро-4- оксохинолин-3-карбоксилата прибавляли 10 мл 12 н. соляной кислоты и смесь нагревали с обратным холодильником в течение 10 часов. Реакционному раствору давали остыть, и твердое содержимое собирали путем фильтрования. Твердое содержимое промывали этанолом и затем диэтиловым эфиром с получением 880 мг указанного в заголовке соединения в виде желтого порошка. Температура плавления: 250oC или выше (с разложением). 1H ЯМР (d6-ДМСО)  ; ;1,60 (с, 3H), 6,80 (шс, 2H),7,96 (т, J=9 Гц, 1H) 8,69 (с, 1H) Ссылочный пример 52 Синтез 2-амино-4-бром-5-хлор-3,6-дифторпиридина К 20 мл ацетонитрила прибавляли 4,9 г 4-бром-3-хлор-2,5,6- трифторпиридина и 4 мл 25%-ного водного раствора аммиака, и смесь перемешивали при 55oC в течение 2 часов. Отгоняли при пониженном давлении растворитель и тому подобное. К остатку прибавляли 50 мл хлороформа и промывали раствор 50 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток диспергировали в смешанном растворе диизопкопилового эфира и н-гексана и собирали путем фильтрования с получением 3,8 г указанного в заголовке соединения в виде бледно- желтых игольчатых кристаллов. Ссылочный пример 53 Синтез 2-амино-4-бром-5-хлор-3-фтор-6-(1,1,3,3- тетраметилбутиламино)пиридина К 6 мл N-метилпирролидона прибавляли 2,4 г 2-амино-4-бром-5- хлор-3,6-дифторпиридина и 3,5 г 1,1,3,3-тетраметилбутиламина и смесь перемешивали при 140oC в течение 82 часов, после чего давали ей остыть. После прибавления 50 мл смешанного раствора бензола и н-гексана (1:1, об/об) раствор промывали два раза 400 мл дистиллированной воды. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Коричневый маслянистый остаток подвергали колоночной хроматографии (силикагель, 30 г; элюент: хлороформ: н-гексан, 1:1) с получением 1,6 г указанного в заголовке соединения в виде бесцветного маслянистого остатка. Ссылочный пример 54 Синтез 2-амино-3-фтор-6-(1,1,3,3-тетраметилбутиламино) пиридина К 10 мл метанола прибавляли 1,6 г 2-амино-4-бром-5-хлор-3- фтор-6-(1,1,3,3-тетраметилбутиламино)пиридина вместе с 0,47 г триэтиламина и 0,09 г 10%-ного палладия на угле, и смесь гидрировали при комнатной температуре в течение 39 часов. Отделяли путем фильтрования катализатор и отгоняли при пониженном давлении растворитель и тому подобное. К остатку прибавляли 50 мл хлороформа и смесь промывали 50 мл дистиллированной воды. Хлороформный слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии (силикагель, 25 г; элюент:хлороформ) с получением 0,75 г 2-амино-3-фтор-6-(1,1,3,3-тетраметилбутиламино)пиридина в виде бледно-коричневого масла и 0,2 г 2-амино-4-бром-3-фтор-6- (1,1,3,3-тетраметилбутиламино)пиридина в виде коричневого масла. Пример 98 Синтез этил 1-[3-фтор-6-(1,1,3,3-тетраметилбутиламино) пиридин-2-ил]-8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3- карбоксилата К 3 мл хлороформного раствора этил 3-этокси-2-(3-хлор-2,4,5- трифторбензоил)акрилата, полученного из 0,84 г этил 3-хлор-2,4,5- трифторбензоилацетата обычным способом, прибавляли 0,75 г, 2- амино-3-фтор-6-(1,1,3,3-тетраметилбутиламино)пиридина. Раствор концентрировали при пониженном давлении и к остатку прибавляли 0,65 г безводного калия и 1,5 мл N,N- диметилформамида и смесь перемешивали при 90oC в течение 1 часа, после чего давали ей остыть. Раствор разделяли путем прибавления 30 мл хлороформа и 300 мл дистиллированной воды, и хлороформный слой промывали два раза 300 мл дистиллированной воды, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 0,45 г указанного в заголовке соединения в виде бледно-желтого порошка. Температура плавления: 178-180oC 1H ЯМР (CDCl3)  ; ;0,96 (с, 9H), 1,41 (м, 9H), 1,77 (дд, J=15 Гц, 22 Гц, 2H), 4,42 (кв, J=7 Гц, 2H), 4,53 (шс, 1H), 6,44 (дд, J-3 Гц, 9 Гц, 1H), 7,30 (т, J=9 Гц, 1H), 8,30 (т, J=9 Гц, 1H), 8,56 (с, 1H) Пример 99 Синтез 1-(6-амино-3-фторпиридин-2-ил)-8-хлор-6,7-дифтор- 4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 1,2 мл смешанного раствора (1:1) 4 н. соляной кислоты и ацетата прибавляли 235 мг этил 1-[3-фтор-6-(1,1,3,3- тетраметилбутиламино)пиридин-2-ил] -8-хлор-6,7-дифтор-4-оксо- 1,4-дигидрохинолин-3-карбоксилата, и смесь нагревали с обратным холодильником в течение 6 часов при перемешивании и затем давали остыть. Осадок собирали путем фильтрования и промывали этанолом с получением 145 мг указанного в заголовке соединения в виде серого порошка. Температура плавления 228-230oC 1H ЯМР (d6-ДМСО)  ; ;6,70 (дд, J=3 Гц, 9 Гц, 1H), 7,66 (т, J=9 Гц, 1H), 8,38 (т, J=9 Гц, 1H), 8,87 (с, 1H) Пример 100 Синтез 7-(3-аминоазетидин-1-ил)-1-(6-амино-3-фторпиридин- 2-ил)-8-хлор-6-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты К 190 мг N,N-диметилформамида прибавляли 57 мг 1-(6-амино-3- фторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты, 37 мг 3-аминоазетидиндигидрохлорида и 100 мг N-метилпирролидина, и смесь перемешивали при 90oC в течение 30 минут. После прибавления 0,2 мл этанола смеси давали остыть и осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 40 мг указанного в заголовке соединения в виде бесцветного порошка. Температура плавления: 250-255oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;3,71 (м, 1H), 4,04 (м, 2H), 4,67 (м, 2H), 6,44 (шс, 2H), 6,62 (дд, J=3 Гц, 9 Гц, 1H),.7,61 (д, J=9 Гц, 1H), 7,85 (т, J=14 Гц, 1H), 8,63 (с, 1H) Пример 101 Синтез 5-амино-1-(6-амино-3,5-дифторпиридин-2-ил)- 8-хлор-6-фтор-7-(3-метиламиноазетидин-1-ил)-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты К 300 мг пиридина прибавляли 120 мг 5-амино-1-(6-амино- 3,5-дифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 80 мг 3- метиламиноазетидиндиацетата и 250 мг N-метилпирролидина, и смесь перемешивали при 100oC в течение 10 минут. После прибавления 5 мл диэтилового эфира смесь перемешивали и в течение 1 часа давали ей остыть и затем декантировали. Прибавляли к смеси 2 мл этанола и перемешивали ее. Осадок собирали путем фильтрования и промывали последовательно этанолом и диизопропиловым эфиром с получением 72 мг указанного в заголовке соединения в виде желтого порошка. Температура плавления: 204-213oC 1H ЯМР (d6-ДМСО)  ; ;2,02 (с, 3H), 4,05 (м, 2H), 4,57 (м, 2H), 6,70 (шс, 2H), 7,48 (шс, 1H), 7,89 (т, J=10 Гц, 1H), 8,49 (с, 1H) Пример 102 Синтез 5-амино-1-(6-амино-3,5-дифторпиридин-2-ил)- 8-хлор-6-фтор-7-(3-гидроксиаминоазетидин-1-ил)-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты К 300 мг пиридина прибавляли 120 мг 5-амино-1-(6-амино-3,5- дифторпиридин-2-ил)-8-хлор-6,7-дифтор-4-оксо-1,4- дигидрохинолин-3-карбоновой кислоты, 80 мг 3-гидроксиаминоазетидингидрохлорида и 250 мг N-метилпирролидина и смесь перемешивали при 100oC в течение 3 минут. После прибавления 5 мл диэтилового эфира смеси давали отстояться в течение 1 часа и затем декантировали. Прибавляли к смеси 2 мл этанола и перемешивали ее. Осадок собирали путем фильтрования и промывали последовательно этанолом и диэтиловым эфиром с получением 64 мг указанного в заголовке соединения в виде желтого порошка. Температура плавления: 267-290oC (с разложением). 1H ЯМР (d6-ДМСО)  ; ;4,09 (м, 2H),4,45 (м, 1H), 4,63 (м, 2H), 5,69 (д, J=6 Гц, 1H), 6,71 (шс, 2H), 7,48 (шс, 1H), 7,89 (т, J=-10 Гц, 1H), 8,51 (с, 1H) (1) Антибактериальное действие Соединения описанных выше примеров 9, 10, 12 и 39 оценивали по их минимальной дозе (концентрации), ингибирующей рост бактерий (MIC, мкг/мл), стандартным методом Японского химиотерапевтического общества (Japan Chemotherapy Society) (Chemotherapy 29(1), 76, 1981) с использованием стандартных штаммов (S. aureus 209P, S. epidermidis IF012293, P. (aeruginosa IFO 3445). Результаты показаны в таблице 1. Следует отметить, что ципрофлоксацин, левофлоксацин, спарфлоксацин и тосуфлоксацин, являющиеся традиционными антибактериальными средствами, также оценивали по их минимальной ингибирующей дозе (MIC, мкг/мл) для целей сравнения. Результаты тоже показаны в таблице 1. Результаты, показанные в таблице 1, показывают на то, что соединения по настоящему изобретению обладают отличными антибактериальными активностями, превосходящими те, которыми обладают традиционные бактериальные средства. (2) Испытание на фототоксичность Соединения описанных выше примеров 9, 10, 12 и 39 подвергали испытанию на фототоксичность описанным ниже методом. Самкам мышей ICR (возраст 5-6 недель) вводили внутривенно испытуемое соединение (40 мг/кг2/10 мл) и облучали УФ (320-400 нм, 1,8 мВт/см2/сек) в течение 4 часов. Проверяли аномалию на ушах в 0 часов (сразу после облучения) и через 24 часа и 48 часов. Ушную аномалию оценивали по следующим показателям: нет аномалии (0 баллов), очень слабая эритема (1 балл), явно выраженная эритема (2 балла), эритема от умеренной до сильной и образование отека (3 балла). Результаты показаны в таблице 2. С целью сравнения испытывали также тосуфлоксацин, являющийся традиционным известным антибактериальным средством. Результаты тоже показаны в таблице 2. Таблица 2 Результаты, представленные в таблице 2, показывают, что соединения по настоящему изобретению проявляют очень низкую токсичность. Формула изобретения
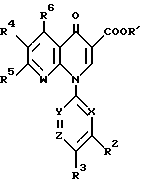 где R1 представляет атом водорода или низшую алкильную группу; R2 представляет низшую алкоксигруппу или аминогруппу, возможно замещенную низшей алкильной группой, бензильной группой, бензоильной группой, ди-(низший алкил)аминогруппой; R3 представляет атом водорода или атом галогена; R4 представляет атом водорода или атом галогена; R5 представляет атом галогена или является группой, представленной следующими формулами (а) или (b): 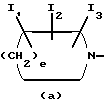 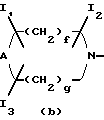 где А представляет группу NR9, где R9 представляет атом водорода или низшую алкильную группу; е = 3 – 5; f = 1 – 2; g = 1 – 2; I1, I2, и I3, которые могут быть одинаковыми или разными, представляют атом водорода, гидроксильную группу, низшую алкильную группу, амино-низшую алкильную группу, аминогруппу, низшую алкиламиногруппу; R6 представляет атом водорода, атом галогена, нитрогруппу или незамещенную или замещенную аминогруппу, которая может быть замещена бензилом; Х, Y, Z могут быть одинаковыми или разными и соответственно представляют атом азота, -СН= или CR7=; R7 представляет низшую алкильную группу, атом галогена или цианогруппу, при условии, что по крайней мере один из символов X, Y, и Z представляет атом азота; W представляет атом азота или -CR8=; R8 представляет атом водорода, атом галогена или низшую алкильную группу. 2. Производное пиридонкарбоновой кислоты или его соль по п.1, где W представляет -CR8 = , где R8 представляет атом водорода, атом галогена или низшую алкильную группу. 3. Производное пиридонкарбоновой кислоты или его соль по п.1 или 3, где R5 является группой, представленной следующими формулами (а) или (b): 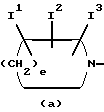 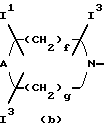 где А представляет NR9, где R9 представляет атом водорода или низшую алкильную группу; е = 3 – 5; f = 1 – 2; g = 0 – 2; I1, I2 и I3, которые могут быть одинаковыми или разными, представляют атом водорода, гидроксильную группу, низшую алкильную группу, аминонизшую алкильную группу, аминогруппу, низшую алкиламиногруппу, низшую алкоксигруппу или атом галогена. 4. Производное пиридонкарбоновой кислоты или его соль по п.4, где R5 является группой, представленной формулой (а). 5. Производное пиридонкарбоновой кислоты или его соль по п.5, где е в формуле (а) представляет число 3 или 4. 6. Производное пиридонкарбоновой кислоты или его соль по п.6, где R1 представляет атом водорода, R2 представляет аминогруппу, низшую алкиламиногруппу или ди-низшую алкиламиногруппу, R3 представляет атом галогена, R4 представляет атом галогена, R6 представляет атом водорода, Х представляет атом азота, Y и Z представляют -СН= или -CR7, где R7 представляет низшую алкильную группу или атом галогена, W представляет -CR8=, где R8 представляет атом галогена или низшую алкильную группу. 7. Производное пиридонкарбоновой кислоты или его соль по п.7, где R2 представляет аминогруппу, R3 представляет атом фтора, R4 представляет атом фтора, Y представляет -CF=, Z представляет -СН=, W представляет -CR8=, где R8 представляет атом хлора, атом брома или метильную группу, и е в формуле (а) представляет число 3. 8. Производное пиридонкарбоновой кислоты или его соль по п.1, где соединение, представленное формулой (1) является 1-(6-амино-3,5-дифторпиридин-2-ил)-8-бром-6-фтор-7-(3-метиламиноазетидин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислотой. 9. Производное пиридонкарбоновой кислоты или его соль по п.1, где соединение, представленное формулой (1) является 1-(6-амино-3,5-дифторпиридин-2-ил)-8-хлор-6-фтор-7-(3-гидроксиазетидин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислотой. 10. Антибактериальное средство, содержащее производное пиридонкарбоновой кислоты или его соль по п.1 в качестве активного компонента и фармацевтически приемлемый носитель. РИСУНКИ
|
||||||||||||||||||||||||||
