Патент на изобретение №2167867
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ТРОВАФЛОКСАЦИНА
(57) Реферат: Настоящее изобретение относится к способу получения тровафлоксацина посредством взаимодействия 7-хлор-1-(2,4-дифторфенил)- 6-фтор-1,4-дигидро-4-оксо-1,8 нафтиридин-3-карбоновой кислоты с азабицикло(3.1.0)гексильным производным. Тровафлоксацин получают без использования и последующего удаления защитных групп на внешней аминогруппе, что позволяет экономить время и стоимость синтеза. 5 з.п. ф-лы. Изобретение относится к способу получения антибактериальных хинолон- и нафтиридонкарбоновых кислот, имеющих внешнюю первичную аминогруппу. Этот способ осуществляют без использования или последующего удаления защитных групп на внешней первичной аминогруппе. Хинолон- и нафтиридонкарбоновые кислоты, их цвиттерионные соли и фармацевтически пригодные соли полезны в качестве антибактериальных агентов, их получают способами, описанными, например, в Патенте США N 4738968 (Matsumoto и др. ), Патенте США N 4382937 (Matsumoto и др.), Патенте США N 4382892 (Hayakawa и др.), Патенте США N 4571396 (Hutt и др.), Патенте США N 4416884 (Ishikawa и др. ), Патенте США N 4775668 (Jefson и др.). Патенте США N 5164402 (Brighty) и Патентной Публикации Великобритании N 2191776 (Toyama Chemical Co. Ltd. ). Такие хинолон- и нафтиридонкарбоновые кислоты и их цвиттерионные соли получают (см., например, Патенте США N 5164402, Brighty) посредством взаимодействия соединения формулы I 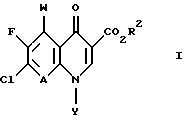 где R2 представляет C1-C6-алкил, в особенности, этил или метил, или водород; A представляет CH, CF, CCl, COCH3, CCH3, CCN или N; Y, когда представлен независимо, является этилом, трет-бутилом, винилом, циклопропилом, 2-фторэтилом, пара-фторфенилом или орто, пара-дифторфенилом; или A представляет атом углерода и вместе с Y и атомами углерода и азота, к которым A и Y присоединены, образуют пяти- или шестичленный цикл, который может содержать кислород или двойную связь и который может иметь метил или метилен, присоединенный к кольцу; и W представляет H, F, Cl, Br, C1-C4-алкил, C1-C4-алкоксил, аминогруппу или NHCH3; с соединением, имеющим аминогруппу и формулу II HR1(CH2)aNHX, (II) где a равно О или 1; R1 представляет циклическую вторичную аминогруппу; и X представляет защитную группу, такую как трет-бутоксикарбониламиногруппа. Взаимодействие соединения формулы I с соединением формулы II дает в результате вытеснение хлора с 7-ого атома углерода соединения формулы I и присоединение к нему вторичной аминогруппы. Примерами соединений формулы II являются 3-азабицикло-[3.1.0] гексан и 3-азабицикло[4.1.0] гептан (Патент США N 5164402, Brighty) и пирролидины (Патент США N 4382937 и Патент США N 4738968, Matsumoto и др.), каждое из них несет защищенную аминогруппу. Необходимо, чтобы соединение формулы II имело на своей первичной аминогруппе защитную группу (в виде “X”) для предотвращения конкуренции первичной аминогруппы со вторичной аминогруппой за образование связи с 7 атомом углерода соединения формулы I. Однако необходимость для такой защитной группы добавлять по крайней мере две дополнительные стадии к синтезу хинолон- и нафтиридонкарбоновых кислот: (1) добавление защитной группы на первичную аминогруппу соединения формулы II до реакции с соединением формулы I и (2) удаление защитной группы после реакции с соединением формулы I. Эти дополнительные стадии, естественно, повышают стоимость синтеза, увеличивают время, за которое можно завершить синтез, и ограничивают время, которое сотрудники могут потратить на другие эксперименты. Поэтому высоко необходим и является преимущественным способ получения хинолон- и нафтиридонкарбоновых кислот, который опускает применение защитных групп. Упоминание или определение любой ссылки в разделе данной заявки не толкуется как признание ее в качестве прототипа настоящей заявки. КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ Согласно данному изобретению предложен способ получения соединения формулы III: 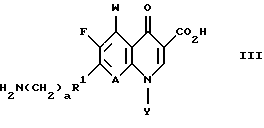 или его цвиттерионной соли, отличающийся тем, что он включает стадию взаимодействия в присутствии третичного аминного основания: (а) соединения формулы IV 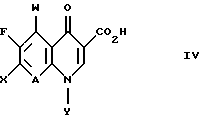 где A представляет CH, CF, CCl, COCH3, CCH3, CCN или N; Y, когда представлен независимо, является этилом, трет- бутилом, винилом, циклопропилом, 2-фторэтилом, пара-фторфенилом или орто, пара-дифторфенилом; или A представляет атом углерода и вместе с Y и атомами углерода и азота, к которым присоединены A и Y, образует пяти- или шестичленный цикл, который может содержать кислород или двойную связь и который может иметь присоединенный к кольцу метил или метилен; W представляет H, F, Cl, Br, C1-C4алкил, C1– C4-алкоксил, аминогруппу или NHCH3; и X представляет галоген, c (b) соединением формулы V: HR1(CH2)aNH2(ZH)b, V где R1 представляет циклическую вторичную аминогруппу, имеющую нуклеофильный атом азота; ZH представляет кислоту; а равно 0 или 1; и b составляет величину в диапазоне от 1 до количества основных атомов азота в соединении формулы V. В предпочтительном варианте данного изобретения соединение формулы IV представляет 7-хлор-1-(2, 4-дифторфенил)-6- фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновую кислоту: 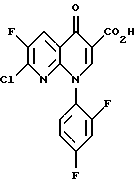 соединение формулы V представляет дикислую соль (1  ,5 ,5 ,6 ,6 ) -6-амино-3-азабицикло[3.1.0] гексана и имеет формулу VI: ) -6-амино-3-азабицикло[3.1.0] гексана и имеет формулу VI: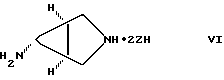 соединение формулы III представляет  -7-(6- амино-3-азабицикло[3.1.0] гекс-3-ил)-1-(2,4-дифторфенил)-6- фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновую кислоту, известную также как тровафлоксацин (trovafloxacin): -7-(6- амино-3-азабицикло[3.1.0] гекс-3-ил)-1-(2,4-дифторфенил)-6- фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновую кислоту, известную также как тровафлоксацин (trovafloxacin):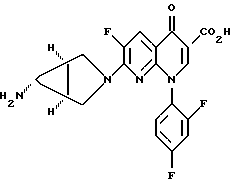 Использованный здесь термин “алкил” включает углеводородную группу с линейной или разветвленной цепью, такую как метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил; трет-бутил и др. Использованный здесь термин “арил” включает ароматическую углеводородную группу, такую как фенил или нафтил, необязательно замещенный 1-3 заместителями, независимо выбранными из группы, состоящей из фтора, хлора, циано, нитро, трифторметила, (C1-C6)-алкокси, (C6-C10)-арилокси, трифторметокси, дифторметокси и (C1-C6)-алкила. Использованный здесь термин “основные атомы азота” обозначает атомы азота соединения формулы V, которые способны образовывать соль с ZH. Использованный здесь термин “реакция взаимодействия” обозначает реакцию между соединением формулы IV и соединением формулы III или его цвиттерионной солью. Использованный здесь термин “циклическая вторичная аминогруппа” обозначает моно-, би- или трициклическую алкильную или алкенильную группу, имеющую в составе по крайней мере одного кольца нуклеофильный атом азота. Использованный здесь термин “галоген” обозначает фтор, хлор, бром и йод. Использованный здесь термин “нуклеофильный атом азота” обозначает атом азота, образующий три sp3 связи, одна из которых осуществляется с атомом водорода и способна вытеснять атом галогена с 7-ого атома углерода соединения формулы IV. Использованный здесь термин “третичное аминное основание” обозначает органическое соединение, имеющее атом азота, образующий три связи, каждая из которых является sp2 или sp3 исключительно с атомами углерода. Использованный здесь термин “его цвиттерионная соль” формулы III обозначает соединение формулы III, существующее в виде внутренней соли, в котором его протон карбоновой кислоты находится на любом из его атомов азота. СОЕДИНЕНИЯ ФОРМУЛЫ IV Соединения формулы IV можно получить посредством гидролиза сложных эфиров соединений формулы IV, которые, в свою очередь, можно получить согласно способам Патента США N 4738968 (Mastsumoto и др.), Патента США N 4382892 (Hayakawa и др.). Патента США N 4416884 (Ishikawa и др.) или Патентной Публикации Великобритании N 2191776 (Toyama Chemical Co. Ltd.). Альтернативно соединения формулы IV, где A представляет N, a W, X и Y определены выше, можно получить согласно схеме 1, приведенной ниже. Никотиновую кислоту 1 превращают в ее производное – хлорангидрид кислоты и затем конденсируют с этилацетоацетатом, получая сложный эфир 2a. Деацетилирование 2a посредством тозилата пиридиния дает  -кетоэфир 2b, который можно получить непосредственно из хлорангидрида кислоты – производного 1 после конденсации с этилмалонатом в присутствии бутиллития. Обработка 2b триэтилортоформиатом и ангидридом уксусной кислоты дает енольные эфиры 3, которые подвергают реакции присоединения-элиминирования посредством HN-Y, получая енамины 4. Циклизацию 4 проводят, используя основание, такое как карбонат натрия или гидрид натрия, и получая эфир нафтиридон карбоновой кислоты 5, который гидролизуют, используя метансульфоновую кислоту в смеси тетрагидрофуран/вода= 9:1 и получая нафтиридонкарбоновую кислоту 6 – соединение формулы IV. (Схему 1 см. в конце текста).
X предпочтительно представляет хлор. Более предпочтительно, когда Y представляет 2,4-дифторфенил или циклопропил, W представляет водород, X представляет хлор и A представляет N или CH. Наиболее предпочтительно, когда Y представляет 2,4-дифторфенил, W представляет водород, X представляет хлор и A представляет азот.
Наиболее предпочтительно, когда соединение формулы IV является 7-хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин- 3-карбоновой кислотой, которую получают гидролизом этил 7- хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8- нафтиридан-3-карбоксилата, предпочтительно посредством метансульфоновой кислоты и смеси тетрагидрофуран/вода=9:1.
Этил 7-хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоксилат мажет быть получен согласно Патентной Публикации Великобритании GB N 2191786 (Toyama Chemical Co.Ltd.).
СОЕДИНЕНИЯ ФОРМУЛЫ V -кетоэфир 2b, который можно получить непосредственно из хлорангидрида кислоты – производного 1 после конденсации с этилмалонатом в присутствии бутиллития. Обработка 2b триэтилортоформиатом и ангидридом уксусной кислоты дает енольные эфиры 3, которые подвергают реакции присоединения-элиминирования посредством HN-Y, получая енамины 4. Циклизацию 4 проводят, используя основание, такое как карбонат натрия или гидрид натрия, и получая эфир нафтиридон карбоновой кислоты 5, который гидролизуют, используя метансульфоновую кислоту в смеси тетрагидрофуран/вода= 9:1 и получая нафтиридонкарбоновую кислоту 6 – соединение формулы IV. (Схему 1 см. в конце текста).
X предпочтительно представляет хлор. Более предпочтительно, когда Y представляет 2,4-дифторфенил или циклопропил, W представляет водород, X представляет хлор и A представляет N или CH. Наиболее предпочтительно, когда Y представляет 2,4-дифторфенил, W представляет водород, X представляет хлор и A представляет азот.
Наиболее предпочтительно, когда соединение формулы IV является 7-хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин- 3-карбоновой кислотой, которую получают гидролизом этил 7- хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8- нафтиридан-3-карбоксилата, предпочтительно посредством метансульфоновой кислоты и смеси тетрагидрофуран/вода=9:1.
Этил 7-хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоксилат мажет быть получен согласно Патентной Публикации Великобритании GB N 2191786 (Toyama Chemical Co.Ltd.).
СОЕДИНЕНИЯ ФОРМУЛЫ VСоединения формулы V представлены формулой: HR1(CH2)aNH2(ZH)b, V где R1 представляет циклическую вторичную аминогруппу, а равно 0 или 1; ZH представляет кислоту; и b равно величине в диапазоне от 1 до количества основных атомов азота в соединении формулы V. Полезные циклические вторичные аминогруппы включают (но не ограничены этим) азиридинил, азетидинил, пирролидинил, 3- гидроксилпирролидинил, 3-диметиламинопирролидинил, 3- ацетиламинопирролицинил, 3-метилацетиламинопирролидинил, 3- аминопирролидинил, 3-метиламинопирролидинил, пиперидинил, 4- метиламинопиперидинил, пиперазинил, N-метилпиперазинил, N- этилпиперазинил, N-пропилпиперазинил, N-изопропилпиперазинил, N- ацетилпиперазинил, 3-метилпиперазинил, N-метил-2-метилпиперазинил, N-метил-3-метилпиперазинил, N-аллилпиперазинил, N-этоксикарбонил-2- метилпиперазинил, 3,5-диметилпиперазинил, 2,5- диметилпиперазинил, N-(гидроксиэтил)пиперазинил, морфолинил, гексаметилениминил, гептаметилениминил, 3-азабицикло[3.1.0]гексил и 3-азабицикло[4.1.0] гептил, причем циклические вторичные аминогруппы необязательно замещены одной (или более) нитрогруппой, хлором, бромом, фтором, йодом или алкилсульфонильной группой. Примеры необязательно замещенных 3-азабицикло[3.1.0] гексильной и 3-азабицикло[4.1.0]гептильной групп обнаружены в Патенте США N 5164402 (Brighty). Соединения формулы V представляют соли HR1(CH2)aNH2 и ZH. В качестве ZH подходят любые карбоновые кислоты; предпочтительно ZH представляет минеральную кислоту, такую как HCl, HBr, азотная кислота или серная кислота; C1-C6-алкилсульфоновую кислоту, такую как метансульфоновая кислота, трифторметансульфоновая кислота или этансульфоновая кислота; или C6-C10-арилсульфоновую кислоту, такую как бензолсульфоновая кислота, толуолсульфоновая кислота или нафталинсульфоновая кислота. Вообще, соединения формулы V получают путем смешивания в любом подходящем органическом растворителе ZH и HR1 (CH2)aNH2, при этом используют от одного эквивалента ZH (или его небольшой избыток) на эквивалент HR1(CH2)aNH2 до одного эквивалента ZH (или небольшой его избыток) на эквивалент основного атома в HR1(CH2)aNH2. Для получения соединения формулы V можно удалить растворитель обычными способами или согласно данному изобретению для следующей реакции можно использовать раствор. Будет понятно, что, так как R1 представляет циклическую вторичную аминогруппу, HR1(CH2)aNH2 имеет по крайней мере два основных атома азота, а именно NH2 и вторичной аминогруппы (аминогрупп) R1; согласно “b” предпочтительное количество ZH единиц в соединении формулы составляет по крайней мере два. По-другому, когда предшественник HR1(CH2)aNH2 представляет соединение, которое имеет лабильную относительно кислоты защитную группу на -NH2 и на вторичной аминогруппе (смотри Патент США N 5164402 (Brighty)), соединение формулы IV можно получить на месте путем удаления защитных групп с ZH. В одном варианте данного изобретения HR1(CH2)aNH2 представляет 3-аминопирролидин или 3-аминэтилпирролидин. В другом варианте данного изобретения R1 представляет бициклическую группу, которая включает 3-членное кольцо и 4-членное кольцо. Примеры таких бициклических групп обнаружены в Патенте США N 5164402 (Brighty). В предпочтительном варианте данного изобретения b равно количеству основных азотов в соединении формулы V. Предпочтительно, HR1(CH2)aNH2 представляет (1  ,5 ,5 ,6 ,6 ) 6-амино-3-азабицикло[3.1.0] гексан. Наиболее предпочтительно, соединение формулы V представляет соль дитозилат (1 ) 6-амино-3-азабицикло[3.1.0] гексан. Наиболее предпочтительно, соединение формулы V представляет соль дитозилат (1 ,5 ,5 ,6 ,6 ) 6-амино-3-азабицикло[3.1.0] гексана.
СОЕДИНЕНИЯ ФОРМУЛЫ III ) 6-амино-3-азабицикло[3.1.0] гексана.
СОЕДИНЕНИЯ ФОРМУЛЫ IIIСоединения формулы III имеют структуру: 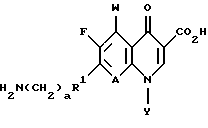 и включают их цвиттерионные соли. Соединения формулы III и их цвиттерионные соли получают способом, который включает стадию взаимодействия в присутствии третичного аминного основания: (а) соединения формулы IV 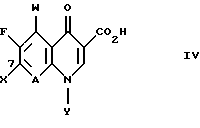 где A представляет CH, CF, CCl, COCH3, CCH3, CCN или N; Y, когда представлен независимо, является этилом, трет-бутилом, винилом, циклопропилом, 2-фторэтилом, пара-фторфенилом или орто, пара-дифторфенилом; или A представляет атом углерода и вместе с Y и атомами углерода и азота, к которым присоединены A и Y, образует пяти- или шестичленный цикл, который может содержать кислород или двойную связь и который может иметь присоединенный к кольцу метил или метилен; W представляет H, F, Cl, Br, C1-C4-алкил, C1-C4-алкоксил, аминогруппу или NHCH3; и X представляет галоген, с (б) соединением формулы V: HR1(CH2)aNH2  (ZH)b, V (ZH)b, Vгде R1 представляет циклическую вторичную аминогруппу, имеющую нуклеофильный атом азота; ZH представляет кислоту; а равно 0 или 1; и b составляет величину в диапазоне от 1 до количества основных атомов азота в соединении формулы V. Реакция взаимодействия протекает с хорошим выходом, например 75% или более, и избегает использования (а именно, добавления и удаления) защитных групп. Не привязываясь к какой-либо конкретной теории, заявитель полагает, что нуклеофильный атом азота вторичной аминогруппы соединения формулы V вытесняет галоген (X) с 7-ого атома углерода соединения формулы IV и образует с ним связь. Понятно, что, так как реакцию взаимодействия проводят в присутствии третичного аминного основания, протонированные формы соединения формулы IV существуют в некоторых равновесных концентрациях с протонированной формой третичного аминного основания. Полагают, что протонирование группы -NH2 соединения формулы V делает эту группу -NH2 ненуклеофильной, так что полученная группа -NH3+ эффективно не конкурирует с циклической вторичной аминогруппой соединения формулы V за 7-ой атом углерода соединения формулы IV. После добавления циклической вторичной аминогруппы и удаления X– полученное соединение формулы III может самопроизвольно образовывать стабильную внутреннюю соль в виде цвиттериона и осаждаться из раствора (в зависимости от присутствия или типа, используемого в реакции взаимодействия растворителя). Вообще, соединения формулы III или их цвиттерионные соли получают, объединяя в любом порядке соединение формулы IV, соединение формулы V и третичное аминное основание. Предпочтительно, третичное аминное основание имеет формулу (R2) (R2) (R2)N, где каждый R2 независимо представляет C1-C6 алкильную или C6-C10-арильную группу; или третичное аминное основание представляет ароматическое соединение, имеющее эндоциклический атом азота. Подходящее третичное аминное основание включает (но не ограничено этим) триэтиламин, N, N-диизопропилэтиламин, диметилизопропиламин, метилдибутиламин, трифениламин, пиридин, 4-диметиламинопиридин, 2,6-лутидин, 2,4,6-коллидин, N,N,N’,N’-тетраметил-1,8-нафталиндиамин и подобные. Соотношение соединения формулы IV и соединения формулы V обычно составляет 1:1, хотя можно использовать небольшой избыток соединения формулы IV или соединения формулы V. Соотношение третичного аминного основания и соединения формулы IV или соединения формулы V обычно составляет примерно от 1: 1 до 10:1, предпочтительно примерно от 2:1 до 5:1 и наиболее предпочтительно примерно 3:1. Использование третичного аминного основания в основном избегает образования нежелательного побочного продукта реакции взаимодействия, а именно продукта, получаемого по реакции обеих (вторичной и первичной) аминогрупп соединения формулы V с галогенами (X) по 7-ому атому углерода, по крайней мере одного и предпочтительно по крайней мере двух эквивалентов соединения формулы IV. Например, использование триэтиламина в реакции между 7-хлор-1-(2,4- дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3- карбоновой кислотой и солью дитозилатом (1  ,5 ,5 ,6 ,6 ) -6-амино-3- азабицикло[3.1.0] гексана сильно снижает образование соединения формулы VII: ) -6-амино-3- азабицикло[3.1.0] гексана сильно снижает образование соединения формулы VII: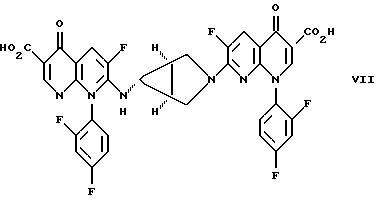 Кроме того, когда используют триэтиламин в реакции взаимодействия между 7-хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислотой и солью дитозилатом 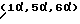 -6-амино-3-азабицикло[3.1.0] гексана, нельзя детектировать образование гипотетического соединения VIII: -6-амино-3-азабицикло[3.1.0] гексана, нельзя детектировать образование гипотетического соединения VIII: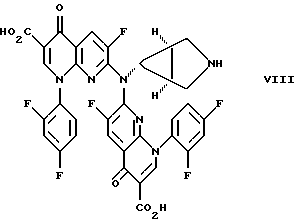 Подходящие для реакции взаимодействия растворители включают (C1-C6) спирты, такие как метанол, этанол и изопропанол; простые эфиры, такие как тетрагидрофуран (ТГФ) и диэтиловый эфир; полярные апротонные растворители, такие как диметилсульфоксид, ацетонитрил, диметилформамид и N- метилпирроллидинон и их смеси. Соединения формулы IV и формулы V должны быть по крайней мере частично растворимы в выбранном для реакции взаимодействия растворителе; поэтому выбор подходящего растворителя или смеси растворителей полностью находится в компетенции специалиста. Предпочтительным растворителем реакции взаимодействия является метанол или этанол. Более предпочтительным растворителем реакции взаимодействия является метанол. Удобно проводить реакцию взаимодействия при температуре около 60oC или выше и в течение периода времени примерно от 1 часа до 48 часов, предпочтительно примерно от 2 до 24 часов. Более предпочтительно проводить реакцию взаимодействия при температуре кипения с обратным холодильником конкретного выбранного растворителя и в течение периода времени примерно от 6 до 20 часов. Вообще, продукт реакции взаимодействия, а именно соединение формулы III или его цвиттерионная соль, не растворяется в растворителе реакции взаимодействия и осаждается после образования. Поэтому соединение формулы III или его цвиттерионную соль можно выделять просто фильтрованием из используемого в реакции взаимодействия растворителя и необязательным промыванием растворителем того же типа, как используемый в реакции взаимодействия, в случае, когда соединение формулы III или его цвиттерионная соль растворимы в растворителе для реакции взаимодействия, то соединение формулы III или его цвиттерионную соль можно выделить посредством концентрирования реакционной смеси, необязательно в вакууме, и очистки полученного остатка способом колоночной хроматографии, например, на силикагеле; кристаллизации из обычных лабораторных растворителей или другим известным специалистам способом очистки. Предпочтительно, соединение формулы III представляет тровафлоксацин (trovafloxacin), который может существовать в виде цвиттерионной соли. Тровафлоксацин удобно получать путем взаимодействия в присутствии описанного выше третичного аминного основания 7-хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро-4-оксо- 1,8-нафтиридин-3-карбоновой кислоты с соединением формулы VI. Предпочтительно, соединение формулы VI представляет соль дитозилат (1  ,5 ,5 ,6 ,6 ) -6-амино-3- азабицикло[3.1.0]гексана, а третичное аминное основание представляет триэтиламин.
Полагают, что нуклеофильный атом азота вторичной аминогруппы соединения формулы VI, а именно эндоциклический атом азота (1 ) -6-амино-3- азабицикло[3.1.0]гексана, а третичное аминное основание представляет триэтиламин.
Полагают, что нуклеофильный атом азота вторичной аминогруппы соединения формулы VI, а именно эндоциклический атом азота (1 ,5 ,5 ,6 ,6 ) -6-амино-3-азабицикло[3.1.0] гексана вытесняет хлор с 7-ого атома углерода 7-хлор-1-(2,4-дифторфенил)-6-фтор-1,4- дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты и образует с ним связь, давая тровафлоксацин или его цвиттерионную соль.
Реакция 7-хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты с соединением формулы VI преимущественно происходит в присутствии описанного выше растворителя для реакции взаимодействия. Предпочтительным растворителем для реакции взаимодействия является метанол.
СПОСОБЫ ПРИМЕНЕНИЯ СОЕДИНЕНИЙ ФОРМУЛЫ III ) -6-амино-3-азабицикло[3.1.0] гексана вытесняет хлор с 7-ого атома углерода 7-хлор-1-(2,4-дифторфенил)-6-фтор-1,4- дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты и образует с ним связь, давая тровафлоксацин или его цвиттерионную соль.
Реакция 7-хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты с соединением формулы VI преимущественно происходит в присутствии описанного выше растворителя для реакции взаимодействия. Предпочтительным растворителем для реакции взаимодействия является метанол.
СПОСОБЫ ПРИМЕНЕНИЯ СОЕДИНЕНИЙ ФОРМУЛЫ IIIСоединения формулы III, их цвиттерионные соли и их фармацевтически приемлемые соли полезны для лечения бактериальных инфекций широкого спектра, в особенности грамположительных бактериальных штаммов. Такие фармацевтически приемлемые соли, включая (но не ограничиваясь этим) соли соляной, бромистоводородной, метансульфоновой, винной, серной, лимонной, уксусной и малеиновой кислот, получают посредством смешивания одного эквивалента указанной выше кислоты с соединением формулы III или его цвиттерионной соли в присутствии инертного растворителя. Раствор можно концентрировать, получая фармацевтически приемлемую соль соединения формулы III или его цвиттерионной соли в изолированном виде. Соединения формулы III, их цвиттерионные соли и их фармацевтически приемлемые соли можно принимать сами по себе, но обычно их принимают в смеси с фармацевтическим носителем, выбранным в соответствии с предлагаемым способом приема и стандартной фармацевтической практикой. Например, их можно принимать орально в виде таблеток, содержащих такие наполнители, как крахмал или лактоза, или в капсулах сами по себе или в смеси с наполнителями, или в виде эликсиров или суспензий, содержащих вкусовые и подкрашивающие агенты. В случае животных эти вещества преимущественно содержатся в пище животных или питьевой воде при концентрации 5-5000 млн. долей, предпочтительно 25-500 млн. долей. Их можно вводить парентерально, например внутримышечно, внутривенно или подкожно. Для парентерального введения лучше всего их использовать в виде стерильного водного раствора, который может содержать другие растворенные вещества, например достаточное количество соли или глюкозы для изотоничности раствора. В случае животных можно вводить эти соединения внутримышечно или подкожно при уровне дозировки около 0,1-50 мг/кг/день, преимущественно 0,2-10 мг/кг/день ежедневно одной дозой или поделить и вводить до 3 раз в день. Соединения формулы III, их цвиттерионные соли и их фармацевтически приемлемые соли можно вводить людям для лечения бактериальных заболеваний оральным или парентеральным способом, орально можно принимать эти соединения при уровне дозировки примерно от 0,1 до 500 мг/кг/день, преимущественно от 0,5 до 50 мг/кг/день одной дозой или поделить и вводить до 3 раз в день. Внутримышечно можно вводить соединение одной дозой или поделить и вводить до 3 раз в день, внутривенное введение может включать непрерывную капельницу. Как известно специалистам, необходимо варьировать прием в зависимости от веса и состояния подлежащего лечению пациента и выбранного конкретного способа введения. Антибактериальная активность соединений формулы III, их цвиттерионных солей и их фармацевтически приемлемых солей показана посредством тестирования репликаторным способом Стира (Steer’s replicator technique), который является стандартным in vitro способом бактериального тестирования и описан Е. Steers и др. Antibiotics and Chemotherapy, 9, 307 (1959). Следующие примеры даны в помощь пониманию данного изобретения и, конечно, их не следует толковать как конкретное ограничение описанного и заявленного здесь изобретения. Такие вариации данного изобретения, которые находятся в компетенции специалистов, включая замену всех известных сейчас и разработанных после эквивалентов, считают включенными и попадающими в область данного изобретения. В приведенных ниже примерах, если не указано по-другому, “Ac” обозначает ацетил, “Et” обозначает этил, “Me” обозначает метил и “ТГФ” обозначает тетрагидрофуран. ПРИМЕРЫ: СИНТЕЗ ТРОВАФЛОКСАЦИНА ИЛЛЮСТРАТИВНОГО СОЕДИНЕНИЯ ФОРМУЛЫ III Пример 1 (1  ,5 ,5 ,6 ,6 ) -3-N-бензил-6-нитро-2,4-диоксо-3-азабицикло-[3.1.0] гексан. N-Бензилмалеимид (500 г, 2,67 ммоль), 90% бромнитрометан (831 г, 5,34 ммоль) порошкообразные молекулярные сита, 200 меш (2020 г) и толуол (12 л) перемешивают под азотом при -10 oC. Медленно примерно за 3 часа добавляют 1,2-диметил-1,4,5,6-тетрагидропиримидин (616 г, 5,49 ммоль), поддерживая температуру реакции во время добавления < -8oC. По завершении добавления реакционную смесь перемешивают в течение 1,5 часов при 25oC, фильтруют в атмосфере азота на герметичном фильтре под давлением для удаления сит и полученную смолу и сита промывают толуолом (2 л). Объединенные фильтраты промывают 2N разбавленной соляной кислотой (3 x 750 мл), обрабатывают углем (50 г) при 70oC, фильтруют 1 час, концентрируют и растирают с 2-пропанолом (~4 л), получая кристаллы указанного выше в заголовке продукта (223 г, 34%), т. пл. 116-118oC; (найдено: C 58,2; H 4,1; N 11,3; рассчитано для C12H10N2O4: C 58,5; H 4,1; N 11,4%); m/z 246 (M+), 200 (M+ -NO2, 100%); ) -3-N-бензил-6-нитро-2,4-диоксо-3-азабицикло-[3.1.0] гексан. N-Бензилмалеимид (500 г, 2,67 ммоль), 90% бромнитрометан (831 г, 5,34 ммоль) порошкообразные молекулярные сита, 200 меш (2020 г) и толуол (12 л) перемешивают под азотом при -10 oC. Медленно примерно за 3 часа добавляют 1,2-диметил-1,4,5,6-тетрагидропиримидин (616 г, 5,49 ммоль), поддерживая температуру реакции во время добавления < -8oC. По завершении добавления реакционную смесь перемешивают в течение 1,5 часов при 25oC, фильтруют в атмосфере азота на герметичном фильтре под давлением для удаления сит и полученную смолу и сита промывают толуолом (2 л). Объединенные фильтраты промывают 2N разбавленной соляной кислотой (3 x 750 мл), обрабатывают углем (50 г) при 70oC, фильтруют 1 час, концентрируют и растирают с 2-пропанолом (~4 л), получая кристаллы указанного выше в заголовке продукта (223 г, 34%), т. пл. 116-118oC; (найдено: C 58,2; H 4,1; N 11,3; рассчитано для C12H10N2O4: C 58,5; H 4,1; N 11,4%); m/z 246 (M+), 200 (M+ -NO2, 100%);  H (300 МГц, CDCl3) 7,3 (м, 5H, Ph), 4,54 (с, 2H, бензильн.), 4,45 (с, 1H, 6b), 3,35 (с, 2H, 3-цикл).
Пример 2 H (300 МГц, CDCl3) 7,3 (м, 5H, Ph), 4,54 (с, 2H, бензильн.), 4,45 (с, 1H, 6b), 3,35 (с, 2H, 3-цикл).
Пример 2(1  ,5 ,5 ,6 ,6 ) -3-N-бензил-6-нитро-3-азабицикло[3.1.0] гексан.
Тетрагидрофуран (350 мл), боргидрид натрия (14,1 г) и полученный выше (1 ) -3-N-бензил-6-нитро-3-азабицикло[3.1.0] гексан.
Тетрагидрофуран (350 мл), боргидрид натрия (14,1 г) и полученный выше (1 ,5 ,5 ,6 ,6 ) -3-N-бензил-6-нитро-3-азабицикло[3.1.0] гексан (35,0 г, ммоль) перемешивают под азотом в течение 0,25 часа и затем обрабатывают по капле комплексом трифторид бора-ТГФ, содержащим 21,5% BF3 (44,9 мл), регулируя экзотерму < 40oC. По завершении добавления реакционную смесь перемешивают в течение 3 часов при 40oC, медленно гасят смесью вода/ТГФ=1:1 (70 мл), получая избыточное пенообразование, и перемешивают в течение 0,5 часа при 50oC, чтобы убедиться, что полностью произведено гашение непрореагировавшего диборана, образовавшегося на месте. Гашение дает пасту соли, которую фильтруют и промывают ТГФ (140 мл); объединенные фильтраты частично концентрируют, разбавляют водой (350 мл) и затем концентрируют, удаляя большую часть ТГФ, и экстрагируют этилацетатом (140 мл). Полученный этилацетатный раствор концентрируют, получая указанный выше в заголовке продукт в виде прозрачного масла (30,6 г, 97%). Элементный анализ выполняют для соли мезилата, которую готовят путем смешивания эквивалента (1 ) -3-N-бензил-6-нитро-3-азабицикло[3.1.0] гексан (35,0 г, ммоль) перемешивают под азотом в течение 0,25 часа и затем обрабатывают по капле комплексом трифторид бора-ТГФ, содержащим 21,5% BF3 (44,9 мл), регулируя экзотерму < 40oC. По завершении добавления реакционную смесь перемешивают в течение 3 часов при 40oC, медленно гасят смесью вода/ТГФ=1:1 (70 мл), получая избыточное пенообразование, и перемешивают в течение 0,5 часа при 50oC, чтобы убедиться, что полностью произведено гашение непрореагировавшего диборана, образовавшегося на месте. Гашение дает пасту соли, которую фильтруют и промывают ТГФ (140 мл); объединенные фильтраты частично концентрируют, разбавляют водой (350 мл) и затем концентрируют, удаляя большую часть ТГФ, и экстрагируют этилацетатом (140 мл). Полученный этилацетатный раствор концентрируют, получая указанный выше в заголовке продукт в виде прозрачного масла (30,6 г, 97%). Элементный анализ выполняют для соли мезилата, которую готовят путем смешивания эквивалента (1 ,5 ,5 ,6 ,6 ) -3-N-бензил-6-нитро-3-азабицикло[3.1.0] -гексана с эквивалентом метансульфоновой кислоты в спиртовом растворителе и концентрирования полученной смеси (найдено: C 49,8; H 6,0; N 9,1; S 10,2; рассчитано для C12H14N2O2 ) -3-N-бензил-6-нитро-3-азабицикло[3.1.0] -гексана с эквивалентом метансульфоновой кислоты в спиртовом растворителе и концентрирования полученной смеси (найдено: C 49,8; H 6,0; N 9,1; S 10,2; рассчитано для C12H14N2O2  CH4O3S: C 49,7; H 5,8; N 8,9; S 10,2%); m/z 218 (М+); CH4O3S: C 49,7; H 5,8; N 8,9; S 10,2%); m/z 218 (М+);  H (300 МГц, CDCl3) 7,3 (м, 5H, Ph), 4,63 (с, 1H, 6b), 3,6 (с, 1H, бензильн.), 3,14 (д, 2H, 5-цикл), 2,51 (м, 2H, 3-цикл).
Пример 3.
(1 H (300 МГц, CDCl3) 7,3 (м, 5H, Ph), 4,63 (с, 1H, 6b), 3,6 (с, 1H, бензильн.), 3,14 (д, 2H, 5-цикл), 2,51 (м, 2H, 3-цикл).
Пример 3.
(1 ,5 ,5 ,6 ,6 ) -3-N-бензил-6-нитро-3-азабицикло[3.1.0] гексан. Полученный выше (1 ) -3-N-бензил-6-нитро-3-азабицикло[3.1.0] гексан. Полученный выше (1 ,5 ,5 ,6 ,6 ) -3-N-бензил-6-нитро-3-азабицикло[3.1.0] гексан (25,05 г, 114,8 ммоль), катализатор (5% платина-на-углероде, содержание воды 66%) (10,02 г) и метанол (250 мл) гидрируют 24 часа в аппарате Парра при 50oC, 3,5 атм. Катализатор отфильтровывают, а фильтрат концентрируют в вакууме, получая указанный выше в заголовке продукт в виде масла (20,24 г, 93,6%), GC-чистота (газовая хроматография) 81,5%. Из гексана получают белые кристаллы, т.пл. 99-102oC (гексан). ) -3-N-бензил-6-нитро-3-азабицикло[3.1.0] гексан (25,05 г, 114,8 ммоль), катализатор (5% платина-на-углероде, содержание воды 66%) (10,02 г) и метанол (250 мл) гидрируют 24 часа в аппарате Парра при 50oC, 3,5 атм. Катализатор отфильтровывают, а фильтрат концентрируют в вакууме, получая указанный выше в заголовке продукт в виде масла (20,24 г, 93,6%), GC-чистота (газовая хроматография) 81,5%. Из гексана получают белые кристаллы, т.пл. 99-102oC (гексан).  H (300 МГц, CDCl3) 7,31-7,18 (м, 5H), 3,53 (с, 2H), 2,94 (д, J=8,8 Гц, 2H), 2,64 (с, 1H), 2,36 (дм, J=8,6 Гц, 2H), 1,53 (с, 2H), 1,32 (дд, J= 1,9 и 3,3 Гц); H (300 МГц, CDCl3) 7,31-7,18 (м, 5H), 3,53 (с, 2H), 2,94 (д, J=8,8 Гц, 2H), 2,64 (с, 1H), 2,36 (дм, J=8,6 Гц, 2H), 1,53 (с, 2H), 1,32 (дд, J= 1,9 и 3,3 Гц);  C (75,5 МГц, CDCl3) 139,5, 128,5, 128,1, 126,7, 59,2, 54,5, 32,5, 25,8; m/z 189 (М+Н)+. Элементный анализ выполняют для соли мезилата, которую готовят путем смешивания эквивалента (1 C (75,5 МГц, CDCl3) 139,5, 128,5, 128,1, 126,7, 59,2, 54,5, 32,5, 25,8; m/z 189 (М+Н)+. Элементный анализ выполняют для соли мезилата, которую готовят путем смешивания эквивалента (1 ,5 ,5 ,6 ,6 ) -3-N-бензил-6-нитро-3-азабицикло[3.1.0] гексана с эквивалентом метансульфоновой кислоты в спиртовом растворителе и концентрирования полученной смеси (найдено: C 54,7; H 7,1; N 9,75; S 11,5; рассчитано для C12H16N2 ) -3-N-бензил-6-нитро-3-азабицикло[3.1.0] гексана с эквивалентом метансульфоновой кислоты в спиртовом растворителе и концентрирования полученной смеси (найдено: C 54,7; H 7,1; N 9,75; S 11,5; рассчитано для C12H16N2 CH4 CH4 CH4O3S: C 54,9; H 7,1; N 9,85; S 11,3%).
Пример 4 CH4O3S: C 54,9; H 7,1; N 9,85; S 11,3%).
Пример 4(1  ,5 ,5 ,6 ,6 ) -3-N-бензил-6-трет-бутилоксикарбониламино-3- азабицикло[3.1.0] гексан. Этилацетат (225 мл), ди-трет-бутил дикарбонат (30,8 г, 141 моль) и полученный выше (1 ) -3-N-бензил-6-трет-бутилоксикарбониламино-3- азабицикло[3.1.0] гексан. Этилацетат (225 мл), ди-трет-бутил дикарбонат (30,8 г, 141 моль) и полученный выше (1 ,5 ,5 ,6 ,6 )-3-N-бензил-6-амино-3-азабицикло[3.1.0] гексан (21,6 г, 115 моль) перемешивают при комнатной температуре и добавляют раствор карбоната натрия (24,7 г, 233 ммоль) и гидроксида натрия (9,35 г, 234 ммоль) в воде (200 мл) при температуре < 30oC. Полученную двухфазную реакционную смесь перемешивают в течение 3 часов при 30oC и затем разделяют. Полученную органическую фазу концентрируют до 25% исходного объема и обрабатывают гексаном (150 мл). Полученные кристаллы выделяют фильтрованием и промывают гексаном (50 мл), получая указанное выше в заголовке соединение в виде белых игл (18,4 г, 56%), т. пл. 132-133oC (EtOAc-гексан); (найдено: C 71,0; H 8,45; N 9,8; рассчитано для C17H24N2O2: C 70,8; H 8,4; N 9,7%); m/z 289 (M+ +1); )-3-N-бензил-6-амино-3-азабицикло[3.1.0] гексан (21,6 г, 115 моль) перемешивают при комнатной температуре и добавляют раствор карбоната натрия (24,7 г, 233 ммоль) и гидроксида натрия (9,35 г, 234 ммоль) в воде (200 мл) при температуре < 30oC. Полученную двухфазную реакционную смесь перемешивают в течение 3 часов при 30oC и затем разделяют. Полученную органическую фазу концентрируют до 25% исходного объема и обрабатывают гексаном (150 мл). Полученные кристаллы выделяют фильтрованием и промывают гексаном (50 мл), получая указанное выше в заголовке соединение в виде белых игл (18,4 г, 56%), т. пл. 132-133oC (EtOAc-гексан); (найдено: C 71,0; H 8,45; N 9,8; рассчитано для C17H24N2O2: C 70,8; H 8,4; N 9,7%); m/z 289 (M+ +1);  H (300 МГц, CDCl3) 7,29 (м, 5H, Ph), 4,62 (широкий с, NH), 3,61 (с, 2H, бензильн.), 3,1 (д, 2H, 5-цикл), 2,92 (с, 1H, 6b), 2,50 (д, 2H, 5-цикл), 1,56 (с, 2H, 3-цикл), 1,4 (с, 9H); Vmax (DRIFTS) см-1 3370 (NH), 1687 (карбонил уретана).
Пример 5 H (300 МГц, CDCl3) 7,29 (м, 5H, Ph), 4,62 (широкий с, NH), 3,61 (с, 2H, бензильн.), 3,1 (д, 2H, 5-цикл), 2,92 (с, 1H, 6b), 2,50 (д, 2H, 5-цикл), 1,56 (с, 2H, 3-цикл), 1,4 (с, 9H); Vmax (DRIFTS) см-1 3370 (NH), 1687 (карбонил уретана).
Пример 5(1  ,5 ,5 ,6 ,6 ) -6-трет-бутилоксикарбониламино-3-азабицикло-[3.1.0] гексан. Метанол (200 мл), катализатор (10% палладий-на-углероде, содержащий 55% воды) (10 г) и полученный выше (1 ) -6-трет-бутилоксикарбониламино-3-азабицикло-[3.1.0] гексан. Метанол (200 мл), катализатор (10% палладий-на-углероде, содержащий 55% воды) (10 г) и полученный выше (1 ,5 ,5 ,6 ,6 ) -3-N-бенэил-6-трет-бутилоксикарбониламино-3-азабицикло-[3.1.0] гексан (20 г, 101 ммоль) гидрируют в течение ночи в аппарате Парра при комнатной температуре и катализатор отфильтровывают и промывают метанолом (20 мл). Объединенный фильтрат концентрируют и замещают циклогексаном (300 мл). Полученную пасту кристаллов концентрируют далее примерно до 100 мл и выделяют указанный выше в заголовке продукт в виде белых кристаллов (12,2 г, 89%); т. пл. 119-125oC (циклогексан); (найдено: C 60,35; H 9,3; N 14,1; рассчитано для C10H18N2O2: C 60,6; H 9,15; N 14,1%); m/z 199 (M+ +1); ) -3-N-бенэил-6-трет-бутилоксикарбониламино-3-азабицикло-[3.1.0] гексан (20 г, 101 ммоль) гидрируют в течение ночи в аппарате Парра при комнатной температуре и катализатор отфильтровывают и промывают метанолом (20 мл). Объединенный фильтрат концентрируют и замещают циклогексаном (300 мл). Полученную пасту кристаллов концентрируют далее примерно до 100 мл и выделяют указанный выше в заголовке продукт в виде белых кристаллов (12,2 г, 89%); т. пл. 119-125oC (циклогексан); (найдено: C 60,35; H 9,3; N 14,1; рассчитано для C10H18N2O2: C 60,6; H 9,15; N 14,1%); m/z 199 (M+ +1);  H (300 МГц, CDCl3) 4,8 (широкий с, NH), 3,13 (д, 2H, 5-цикл), 3,0 (с, NH), 2,9 (д, 2H, 5-цикл), 2,29 (с, 1H, 6b), 1,57 (с, 2H, 3-цикл), 1,39 (с, 9H); Vmax (DRIFTS) см-1 3321 (NH), 3174 (NH).
Пример 6 H (300 МГц, CDCl3) 4,8 (широкий с, NH), 3,13 (д, 2H, 5-цикл), 3,0 (с, NH), 2,9 (д, 2H, 5-цикл), 2,29 (с, 1H, 6b), 1,57 (с, 2H, 3-цикл), 1,39 (с, 9H); Vmax (DRIFTS) см-1 3321 (NH), 3174 (NH).
Пример 6Соль дитозилат (1  ,5 ,5 ,6 ,6 ) -6-амино-3-азабицикло[3.1.0]-гексана. Полученный выше (1 ) -6-амино-3-азабицикло[3.1.0]-гексана. Полученный выше (1 ,5 ,5 ,6 ,6 ) -6-трет-бутилоксикарбониламино-3-азабицикло[3.1.0]гексан (15,0 г, 75,8 ммоль), метанол (300 мл) и толуолсульфоновую кислоту (28,8 г, 151,6 ммоль) нагревают при температуре кипения с обратным холодильником в течение 2 часов. Реакционный раствор концентрируют до кристаллической пасты и кристаллы выделяют фильтрованием, промывают метанолом и сушат в вакууме, получая указанное выше в заголовке соединение (25,6 г, 76%); т. пл. 247-248oC (метанол); (найдено: C 51,5; H 6,0; N 6,3; S 14,55; рассчитано для C5H10N2 ) -6-трет-бутилоксикарбониламино-3-азабицикло[3.1.0]гексан (15,0 г, 75,8 ммоль), метанол (300 мл) и толуолсульфоновую кислоту (28,8 г, 151,6 ммоль) нагревают при температуре кипения с обратным холодильником в течение 2 часов. Реакционный раствор концентрируют до кристаллической пасты и кристаллы выделяют фильтрованием, промывают метанолом и сушат в вакууме, получая указанное выше в заголовке соединение (25,6 г, 76%); т. пл. 247-248oC (метанол); (найдено: C 51,5; H 6,0; N 6,3; S 14,55; рассчитано для C5H10N2 C14H16 O6S2 51,8; H 5,9; N 6,3; S 14,5%); m/z 96 (M+ -2); C14H16 O6S2 51,8; H 5,9; N 6,3; S 14,5%); m/z 96 (M+ -2);  H (400 МГц, ДМСО-d6) 8,49 (широкий C, 5H, NH и SO3H), 7,51 (д, 2H, Abq), 7,12 (д, 2H, Abq), 3,3 (м, 4H, 5-цикл), 2,6 (с, 1H, 6b), 2,27 (с, 6H, ArMe), 2,11 (с, 2H, 3-цикл).
Пример H (400 МГц, ДМСО-d6) 8,49 (широкий C, 5H, NH и SO3H), 7,51 (д, 2H, Abq), 7,12 (д, 2H, Abq), 3,3 (м, 4H, 5-цикл), 2,6 (с, 1H, 6b), 2,27 (с, 6H, ArMe), 2,11 (с, 2H, 3-цикл).
Пример7-Хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро- 4-оксо-1,8-нафтиридин-3-карбоновая кислота. Смесь тетрагидрофурана (450 мл), воды (50 мл), метансульфоновой кислоты (127 мл) и этил 7-хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро- 4-оксо-1,8-нафтиридин-3-карбоксилата (Патентная Публикация Великобритании N GB 2191776) нагревают при температуре кипения с обратным холодильником в течение 1 часа и затем охлаждают до 25oC. Полученные кристаллы выделяют, промывают тетрагидрофураном и сушат в вакууме, получая 41,3 г (89%) указанного выше в заголовке соединения: т. пл. 250oC; (найдено; С 50,4; H 1,7; Cl 9,9; F 16,0; N 8,0; рассчитано для C15H6ClF3N2O3 C 50,8; H 1,7; Cl 10,0; F 16,1; N 7,9%) 1H ЯМР (300 МГц, ДМСО-d6)  : 13,9 (с, 1H), 9,09 (с, 1H), 8,77 (д, J=7,5 Гц, 1H), 7,86 (тд, J=5,9 и 8,8 Гц, 1H), 7,66 (ддд, J=2,7, 9,0 и 11,8 Гц, 1H), 7,39 (тм, J=8,6 Гц, 1H); Vmax (DRIFTS) см-1 3130, 3060, 2947, 2885, 2821, 2723, 2637, 2594, 1734, 1641, 1623, 1579, 1544, 1516.
Пример 8 : 13,9 (с, 1H), 9,09 (с, 1H), 8,77 (д, J=7,5 Гц, 1H), 7,86 (тд, J=5,9 и 8,8 Гц, 1H), 7,66 (ддд, J=2,7, 9,0 и 11,8 Гц, 1H), 7,39 (тм, J=8,6 Гц, 1H); Vmax (DRIFTS) см-1 3130, 3060, 2947, 2885, 2821, 2723, 2637, 2594, 1734, 1641, 1623, 1579, 1544, 1516.
Пример 8Тровафлоксацин. Полученную выше 7-хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновую кислоту (500 мг, 1,41 ммоль), полученную выше соль дитозилат (1  ,5 ,5 ,6 ,6 ) -6-амино-3-азабицикло[3.1.0]гексана (624 мг, 1,41 ммоль), триэтиламин (0,6 мл, 4,23 ммоль) и метанол (5 мл) нагревают при температуре кипения с обратным холодильником в течение 16 часов. Полученное белое твердое вещество собирают фильтрованием, кипятят с обратным холодильником в ТГФ и повторно выделяют, получая указанный в заголовке продукт в виде его цвиттериона (450 мг, 75%): т. пл. 225-228oC (разлагается); ) -6-амино-3-азабицикло[3.1.0]гексана (624 мг, 1,41 ммоль), триэтиламин (0,6 мл, 4,23 ммоль) и метанол (5 мл) нагревают при температуре кипения с обратным холодильником в течение 16 часов. Полученное белое твердое вещество собирают фильтрованием, кипятят с обратным холодильником в ТГФ и повторно выделяют, получая указанный в заголовке продукт в виде его цвиттериона (450 мг, 75%): т. пл. 225-228oC (разлагается);  H (300 МГц, ДМСО-d6): 8,81 (с, 1H), 8,03 (д, J=12,7 Гц, 1H), 7,80 (тд, J= 6,0 и 8,7 Гц), 7,63 (м, 1H), 7,35 (тм, J=8,6 Гц, 1H), 3,2-3,8 (широкий м, 4H), 1,92 (с, 1H), 1,53 (с, 2H).
Соединение формулы VII выделяют из маточника посредством хроматографии. H (300 МГц, ДМСО-d6): 8,81 (с, 1H), 8,03 (д, J=12,7 Гц, 1H), 7,80 (тд, J= 6,0 и 8,7 Гц), 7,63 (м, 1H), 7,35 (тм, J=8,6 Гц, 1H), 3,2-3,8 (широкий м, 4H), 1,92 (с, 1H), 1,53 (с, 2H).
Соединение формулы VII выделяют из маточника посредством хроматографии.  H (300 МГц, ДМСО-d6): 14,85 (широкий с, 2H), 2,85 (с, 1H), 8,80 (с, 1H), 8,56 (широкий с, 1H), 8,07 (д, J= 5,7 Гц, 1H), 8,04 (д, J=3,6 Гц, 1H), 7,84-7,82 (м, 2H), 7,64 (тд, J=9,7 и 2,5 Гц, 1H), 7,40-7,36 (м, 2H), 7,25 (широкий с, 1H), 3,50 (широкий с, 4H), 2,14 (с, 1H), 1,87 (широкий с, 2H).
В описании цитируется ряд работ, которые целиком включены здесь в виде ссылок. H (300 МГц, ДМСО-d6): 14,85 (широкий с, 2H), 2,85 (с, 1H), 8,80 (с, 1H), 8,56 (широкий с, 1H), 8,07 (д, J= 5,7 Гц, 1H), 8,04 (д, J=3,6 Гц, 1H), 7,84-7,82 (м, 2H), 7,64 (тд, J=9,7 и 2,5 Гц, 1H), 7,40-7,36 (м, 2H), 7,25 (широкий с, 1H), 3,50 (широкий с, 4H), 2,14 (с, 1H), 1,87 (широкий с, 2H).
В описании цитируется ряд работ, которые целиком включены здесь в виде ссылок.
Формула изобретения
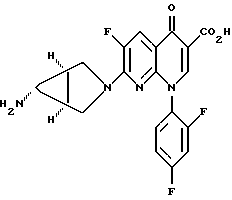 или его цвиттерионной соли посредством взаимодействия 7-хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты с азабицикло[3.1.0] гексильным производным, в присутствии третичного аминного основания, отличающийся тем, что в качестве азабицикло[3.1.0]гексильного производного используют соединение формулы VI: 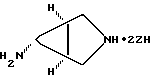 где ZH представляет собой кислоту. 2. Способ по п. 1, где кислоту выбирают из группы, состоящей из минеральной кислоты, C1-C6-алкилсульфоновой кислоты и C6-C10-арилсульфоновой кислоты. 3. Способ по п.2, где C6-C10-арилсульфоновая кислота является толуолсульфоновой кислотой. 4. Способ по п.1, где процесс проводят в присутствии органического растворителя. 5. Способ по п.4, где органический растворитель является метанолом. 6. Способ по п.1, где третичное аминное основание является триэтиламином. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 28.07.2003
Извещение опубликовано: 10.05.2005 БИ: 13/2005
|
||||||||||||||||||||||||||
