Патент на изобретение №2167863
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ БУТАДИЕНА И СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОИЗВОДНЫЕ АМИДОБУТАДИЕНА И СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОИЗВОДНЫЕ ПИРРОЛИДИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ
(57) Реферат: Изобретение относится к новым производным бутадиена формулы (1-а), где кольцо А представляет пиридиновое, пиримидиновое или бензольное кольцо, которое может быть необязательно замещено; кольцо В представляет пиридиновое, оксозамещенное пиридиновое, пиримидиновое, бензольное или C1-4-алкилендиоксизамещенное бензольное кольцо; R1 представляет C1-6-алкил; R2 представляет водород; -COR32 представляет C2-7-алкоксикарбонил и т.д.; -COR42 представляет карбоксильную группу и т.д., или его фармацевтически приемлемые соли; производные амидобутадиена формулы (1-b), где значения А, В, R1, R2, -COR32 указаны выше, -COR43 представляет карбамоильную группу, которая может быть необязательно замещена и т.д., или его фармацевтически приемлемые соли; производное пирролидина формулы (2), где А, В, R1, R2 указаны выше, R5 представляет пиридилзамещенную C1-6-алкильную группу и т.д., или его фармацевтически приемлемая соль. Способ получения соединения формулы (1-а) включает обработку диэфирного соединения формулы (4) кислотой или основанием с последующим превращением продукта в его фармацевтически приемлемую соль. Способ получения соединения формулы (1-b) включает взаимодействие соединения формулы (1-а) с соединением формулы (5), где R40 представляет замещенную или незамещенную аминогруппу. Способ получения соединения формулы (2) включает реакцию внутримолекулярной циклизации соединения формулы (1-с). 7 с. и 8 з.п.ф-лы, 43 табл. 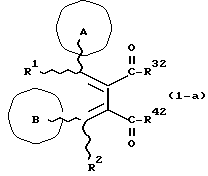 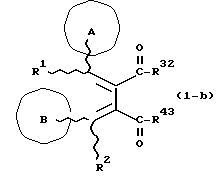 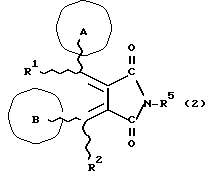 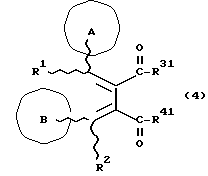 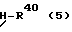 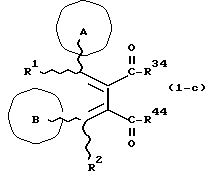
Изобретение относится к новым производным бутадиена и новым производным пирролидина, которые оба обладают превосходной активностью в отношении ингибирования активности или образования ингибитора активатора плазминогена типа 1 (PAI-1) в живом организме, и могут использоваться в качестве антитромботических агентов, а также к способам их получения. Тромбоз обозначает условия коагуляции крови в сердце к кровеносных сосудах в живом организме, в результате чего кровеносные сосуды сужаются или закупориваются, а затем возникающее нарушение циркуляции в тканях, окружающих указанный кровеносный сосуд, приводит к образованию некроза или отека в этих тканях. В результате возникают различные артериальные и тромботические заболевания, такие как инфаркт миокарда, тромбы внутри предсердия, приводящие к мерцанию предсердий, артериальный склероз, грудная жаба, удар, инфаркт легких, тромбы глубоких вен (DVT), синдром диссеминированного внутрисосудистого коагулирования (DIC), диабетические осложнения, рестеноз после чрезкожной транслюминальной коронарной ангиопластики (PTCA) и т.д. Рассматриваются различные факторы, принимающие участие в образовании тромбов, например изменение состояния стенок кровеносных сосудов, изменение скорости потока крови и изменение в компонентах плазмы. Компонентами тромба являются, например, тромбоциты, эритроциты, лейкоциты, фибрин и т.д. Во многих случаях фибринолиз (фибринолитическая система) вторично активируется в живом организме для осуществления лизиса микротромбов, образующихся в живом организме. Так, например, плазминоген, неактивный предшественник, превращается в активный плазмин (протеазу, существующую, главным образом, в плазме) под действием активатора плазминогена, специфического для его активных сайтов (РА; активатора тканевого плазминогена (t-PA), активатора плазминогена урокиназы (u-PA) и т.д), и активированный плазмин может нарушить лизиновую связь полипептидной цепи фибрина, за счет чего происходит лизис тромба. С другой стороны, активность РА регулируется его специфическим ингибитором, ингибитором активатора плазминогена типа 1 (PAI-1). Поэтому активность фибринолиза определяется балансом между количеством PA и PAI-1, причем оба они секретируются эндотелиальными клетками сосудов, и увеличение или уменьшение PAI-1 продуцирования в клетках, или изменение активности самих PAI-1 молекул немедленно влияет на фибринолиз в крови. Другими словами, может оказаться возможным предотвращать или лечить различные тромботические заболевания, представленные вышеперечисленными заболеваниями, за счет непосредственного воздействия на эндотелиальные клетки сосудов и ингибирования PAI-1 активности или их продуцирования и за счет повышения активности РА. С учетом вышеизложенного ранее широко использовали ферментные препараты, такие как активатор тканевого плазминогена, урокиназа, стрептокиназа и т.д. для лизиса и предотвращения образования тромбов. Однако эти лекарства имеют ряд недостатков, например, они быстро инактивируются в крови и в результате очень быстро теряют свои фармакологические активности или их можно вводить только парентерально, но не перорально. С другой стороны, в ЕР-А-563798 в качестве антитромботичесного агента раскрыт 3[(Е)-бензилиден] -4-[(Е)-3,4,5-триметоксибензилиден]- 2,5-пирролидиндион и сложный метиловый эфир (Е)-2-[(Е)-3,4,5-триметоксибензилиден]-3-карбокси-4-фенил-3-бутеновой кислоты, но эти соединения также обладают некоторыми недостатками, такими как недостаточно высокие биодоступность, безопасность в качестве лекарственного препарата и стабильность; например, (1) низкая стабильность в воде, (2) быстрый метаболизм в печени, (3) токсичность в отношении печени и хромосом и т.д. Кроме того, в Nouveau Journal De Chimie Vol. I, N 5, p. 413-418 (1977) раскрыта бензилиденянтарная кислота в качестве продукта восстановления электролитов, но ее фармакологические активности до сих пор не были раскрыты. Задачей настоящего изобретения является создание новых производных бутадиена и новых производных пирролидина, которые не имели бы вышеперечисленных недостатков обычных антитромботических агентов, которые можно было бы вводить перорально или парентерально, и которые демонстрировали бы высокую антитромботическую активность. Другой задачей настоящего изобретения является создание способа получения этих соединений. Авторы настоящего изобретения провели интенсивные исследования и нашли новое производное бутадиена и новое производное пирролидина, которые обладают превосходной антитромботической активностью благодаря ингибированию продуцирования PAI-1, что и составляет суть настоящего изобретения. Таким образом, настоящее изобретение относится к производному бутадиена формулы (1-а) 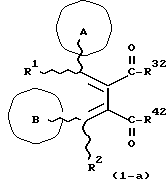 где кольцо A представляет пиридиновое, пиримидиновое или бензольное кольцо, которое может быть необязательно замещено двумя-тремя группами, выбранными из C1-C6алкоксигруппы, C3-C10циклоалкилоксигруппы, нитрогруппы, гидроксильной группы, ди-C1-С6алкиламиногруппы и атомов галоидов. Кольцо B представляет пиридиновое, оксозамещенное пиридиновое, пиримидиновое или бензольное кольцо или C1-C4алкилендиоксизамещенное бензольное кольцо. R1 и R2 различны, и каждый представляет атом водорода или низшую алкильную группу, одна из групп: -COR32 и -COR42 представляет C2-C7алкоксикарбонил или C1-C6алкоксизамещенный C2-C7алкоксикарбонил, и другая группа представляет карбоксильную группу, при условии, что оба кольца А и В не являются одновременно незамещенным бензольным кольцом, и что если кольцо А представляет три-(низшая алкокси)бензольное кольцо, тогда кольцо В представляет пиридиновое, оксозамещенное пиридиновое или пиримидиновое кольцо, или по крайней мере один из R1 и R2 представляет низшую алкильную группу, или его фармацевтически приемлемой соли. В настоящем изобретении предложено также производное амидобутадиена формулы (1-b) 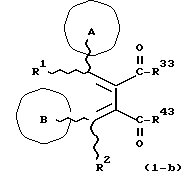 где кольцо А представляет пиридиновое, пиримидиновое или бензольное кольцо, которое может быть необязательно замещено двумя-тремя группами, выбранными из C1-C6алкоксигруппы, C3-C10циклоалкилоксигруппы, нитрогруппы, гидроксигруппы, ди-C1-C6алкиламиногруппы и атомов галоидов. Кольцо В представляет пиридиновое, оксозамещенное пиридиновое или пиримидиновое, или бензольное кольцо, или C1-C4 алкилендиоксизамещенное кольцо. R1 и R2 одинаковы или различны, и каждый представляет атом водорода или низшую алкильную группу, одна из групп: -COR33 и – COR43 представляет C2-C7алкоксикарбонил или C1-C6алкоксизамещенная C2-C7алкоксикарбонил, а другая представляет карбамоильную группу, которая может быть необязательно этерифицированной или амидированной карбоксильной группой, при условии, что оба кольца А и В одновременно не являются незамещенным бензольным кольцом, и если кольцо А представляет три-(низшая алкокси)бензольное кольцо, тогда кольцо В представляет замещенную или незамещенную гетероциклическую группу, или по крайней мере один из R1 и R2 представляет низшую алкильную группу, или его фармацевтически приемлемая соль. Далее в настоящем изобретении предложено производное пирролидина формулы (2) 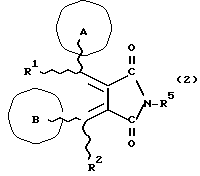 где кольцо А представляет пиридиновое, пиримидиновое или бензольное кольцо, которое может быть необязательно замещено двумя-тремя группами, выбранными из низшей C1-C6алкоксигруппы, C3-C10циклоалкоксигруппы, нитрогруппы, гидроксильной группы, ди-C1-C6алкиламиногруппы, атом галоида. Кольцо В представляет пиридиновое, оксозамещенное пиридиновое, пиримидиновое бензольное кольцо или C1-C4алкилендиоксизамещенное бензольное кольцо. R1 и R2 различны, и каждый представляет атом водорода или низшую алкильную группу, R5 представляет пиридилзамещенную С1-С6алкильную группу, ди-С1-С6алкиламино-С1-С6алкильную группу или С1-С6алкилзамещенную пиперазинильную группу, при условии, что оба кольца А и В не являются одновременно незамещенным бензольным кольцом, и если кольцо А представляет три (низший алкокси)бензольное кольцо, тогда кольцо В пиридиновое, оксозамещенное пиридиновое или пиримидиновое кольцо, или по крайней мере один из R1 и R2 представляет низшую алкильную группу, или его фармацевтически приемлемая соль. Гетероциклическая группа в кольце А и кольце В производного бутадиена (1-а), производного амидобутадиена (1-b) и производного пирролидина (2) включает, например, 5- или 6-членную азотсодержащую гетеромоноциклическую группу, такую как пиридиновое кольцо, пиримидиновое кольцо и т.д. Кроме того, указанная гетероциклическая группа может быть необязательно замещена, например, оксогруппой, гидроксильной группой, низшей алкоксигруппой, атомом галоида и т.д. Среди заместителей бензольного кольца для кольца А в качестве низшей алкильной группы может быть метил, этил, пропил, бутил и т.д., в качестве алкоксигруппы может быть низшая алкоксигруппа (например, метокси, этокси, бутокси и т.д.), низшая алкилендиоксигруппа (например, метилендиокси и т.д. ), циклоалкилоксигруппа (например, циклопропилокси, циклопентилокси и т.д.), и метокси и циклопентилокси предпочтительны. Замещенные или незамещенные аминогруппы включают ди-(низший алкил) аминогруппу, такую как диметиламино, диэтиламино и т.д., а атомом галоида является фтор, хлор, бром, йод, причем атом хлора предпочтителен. Низшая алкоксигруппа на бензольном кольце кольца В представляет метокси, этокси, пропилокси, бутокси и т.д., причем метокси предпочтительна. Низшая алкилендиоксигруппа на бензольном кольце кольца В представляет метилендиокси, этилендиокси и т.д., а ди-(низший алкил) аминогруппа представляет диметиламино, диэтиламино и т.д. Низшая алкильная группа в R1 или R2 представляет метил, этил, пропил, изопропил, бутил и т.д., причем метил предпочтителен. Если группы: -COR32, -COR42, -COR33 и COR43 представляют эстерифицированную карбоксильную группу, указанные сложноэфирные остатки включают, например, низшую алкильную группу (например, метил, этил, изопропил, пропил, бутил, и т.д.) низшей алкоксизамещенную низшую алкильную группу (например, метоксиметил, 2-метоксиэтил, и т.д.), причем метил, изопропил и 2-метоксиэтил предпочтительны, особенно предпочтителен метил. Если группа -COR33 или группа -COR43 представляет амидированную карбоксильную группу, такая группа включает, например, карбамоильную группу, которая может быть необязательно замещена одной или двумя группами, выбранными из замещенной или незамещенной алкильной группы, замещенной или незамещенной фенильной группы, замещенной или незамещенной аминогруппы и замещенной или незамещенной азотсодержащей гетероциклической группы, или группы формулы 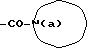 где кольцо (а) представляет замещенную или незамещенную 5- или 6-членную азотсодержащую гетеромоноциклическую группу. Замещенная или незамещенная алкильная группа для групп: -COR33, -COR43 и R5 включает, например, низшую алкильную группу (например, метил, этил, изопропил, бутил и т. д), пиридил- или 1-оксопиридил-низшую алкильную группу (например, пиридилметил, пиридилэтил, 1-оксопиридилметил и т.д.), пиперазинил-низшую алкильную группу (например, пиперазинилметил и т.д.), пиперидил-низшую алкильную группу (например, пиперидилметил), гидрокси-низшую алкильную группу (например, гидроксиэтил и т.д.), ди-(низший алкил)амино- низшую алкильную группу (например, диметиламиноэтил, диэтиламинометил, диэтиламиноэтил и т. д.), и т.д., и замещенная или незамещенная фенильная группа включает, например, фенил, ди-(низший алкил)аминофенильную группу (например, диметиламинофенил, и т.д.), морфолинофенильную группу, (низший алкил)пиперазинилкарбонилфенильную группу (например, метилпиперазинилкарбонилфенил, и т.д.) и т.д. Замещенная или незамещенная аминогруппа включает, например, аминогруппу, ди-(низший алкил) аминогруппу (например, диметиламино, диэтиламино и т.д.), морфолино-(низший-алкил) аминогруппу (например, морфолинометиламино и т.д.) и замещенная или незамещенная азотсодержащая гетероциклическая группа включает, например, 5- или 6-членную азотсодержащую гетеромоноциклическую группу, такую как пиридиновое кольцо, которое может быть необязательно замещено аминогруппой, низшей алкоксигруппой или оксогруппой, пиперазиновое кольцо, которое может быть необязательно замещено группой, выбранной из оксогруппы и низшей алкильной группы, пиперидиновое кольцо, которое может быть необязательно замещено низшей алкильной группой, изоксазольное кольцо, которое может быть необязательно замещено низшей алкильной группой, пиразольное кольцо, триазольное кольцо или пиримидиновое кольцо. Азотсодержащая гетеромоноциклическая группа кольца (а) включает 5- или 6-членную азотсодержащую гетеромоноциклическую группу, такую как пиперазинильная группа, пиперидильная группа, морфолинильная группа, пиразолильная группа, причем эти группы могут быть необязательно замещены низшей алкильной группой или аминогруппой и т.д. Предпочтительные соединения (1-а) представляют соединения формулы (1-а), в которых группа -COR32 представляет эстерифицированную карбоксильную группу, а группа -COR42 представляет карбоксильную группу. Предпочтительные соединения формулы (1-b) представляют соединения формулы (1-b), в которых группа -COR33 представляет эстерифицированную карбоксильную группу, а группа -COR43 представляет амидированную карбоксильную группу. Другими предпочтительными соединениями (1-а), (1-b) и (2) являются соединения, в которых в формулах (1-а), (1-b) и (2) кольцо А представляет бензольное кольцо, замещенное группой, выбранной из алкоксигруппы, нитрогруппы, гидроксильной группы, ди-(низший алкил) аминогруппы и атомов галоидов; кольцо В представляет 5- или 6-членную азотсодержащую гетеромоноциклическую группу, бензольное кольцо или низшей алкилендиоксизамещенное бензольное кольцо, и более предпочтительно такие соединения, в которых в этих формулах кольцо А представляет бензольное кольцо, замещенное двумя или тремя группами, выбранными из низшей алкоксигруппы, нитрогруппы, гидроксильной группы, ди-(низший алкил) аминогруппы и атома галоида; кольцо В представляет пиридиновое кольцо, бензольное кольцо или низшей алкилендиоксизамещенное бензольное кольцо; R1 представляет низшую алкильную группу, a R2 представляет атом водорода. Предпочтительными соединениями формулы (1-b) являются соединения, в которых в формуле (1-b) группа -COR33 представляет низшую алкоксикарбонильную группу или низшей алкоксизамещенную низшую алкоксикарбонильную группу, а группа -COR43 представляет карбамоильную группу, замещенную одной группой, выбранной из пиридильной группы, оксозамещенной пиридильной группы, аминозамещенной пиридильной группы, низшей алкоксизамещенной пиридильной группы, низшим алкилом замещенной пиперидильной группы, низшим алкилом замещенной пиперазинильной группы, пиперазинильной группы, замещенной низшей алкильной группы и оксогруппы, низшим алкилом замещенной изоксазолильной группы, пиразолильной группы, триазолильной группы, пиридилзамещенной низшей алкильной группы, оксозамещенный пиридил-низшей алкильной группы, ди-(низший алкил)-фенильной группы, морфолино-фенильной группы, (низший алкил) пиперазинил-карбонилфенильной группы, гидрокси-низшей алкильной группы и ди-{низший алкил) аминогруппы, или группы формулы 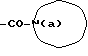 где кольцо (а) представляет замещенную или незамещенную 5- или 6-членную азотсодержащую гетеромоноциклическую группу. Далее, предпочтительными соединениями (2) являются соединения формулы (2), в которых R5 представляет пиридилзамещенную низшую алкильную группу, ди-(низший алкил) амино-низшую алкильную группу, гидрокси-низшую алкильную группу, ди-(низший алкил) аминогруппу, или низшим алкилом замещенную пиперазинильную группу. Более предпочтительными соединениями (1-а), (1-b) и (2) являются соединения формулы (1-а), (1-b) и (2), в которых кольцо А представляет бензольное кольцо, замещенное двумя или тремя группами, выбранными из метоксигруппы, циклопентилоксигруппы, нитрогруппы, гидроксигруппы, диметиламиногруппы и атома хлора, a R1 представляет метильную группу. Наиболее предпочтительными соединениями (1-b) являются соединения формулы (1-b), в которых группа -COR33 представляет метоксикарбонильную группу, изопропилоксикарбонильную группу или 2-метоксиэтоксикарбонильную группу, а группа -COR43 представляет незамещенную карбамоильную группу или карбамоильную группу, замещенную одной группой, выбранной из пиридилметильной группы, 2-аминопиридильной группы, пиридильной группы, 1-оксопиридильной группы, 4-метилпиперазинильной группы, 4-метил-4-оксопиперазинильной группы, 1-метилпиперидильной группы, 5-метилизоксазолильной группы, 3-пиразолильной группы, 1,3,4-триазолильной группы, 1-оксопиридилметильной группы, диметиламиноэтильной группы, гидроксиэтильной группы и диметиламиногруппы. Наиболее предпочтительными соединениями (2) являются соединения формулы (2), в которых 5 представляет атом водорода, пиридилметильную группу, диметиламиноэтильную группу, гидроксиэтильную группу, диметиламиногруппу или 4-метилпиперазинильную группу. Желательные соединения (1-а), (1-b) и (2) настоящего изобретения имеют четыре изомера благодаря их двум двойным связям, соответственно также имеют оптические изомеры благодаря асимметричному атому углерода, и настоящее изобретение также включает эти изомеры и их смеси. Среди этих четырех изомеров предпочтительными изомерами являются те, в которых существует транс(Е)-конфигурация, относительно двойной связи, связывающей кольцо В, а среди этих изомеров более предпочтительными являются изомеры с цис(Е)-конфигурацией относительно двойной связи, связывающей кольцо А. Среди целевых соединений настоящего изобретения предпочтительными являются соединения (1-b) и (2), а среди них более предпочтительными являются соединения (1-b). Предпочтительными соединениями (1-b) настоящего изобретения являются следующие: (1Z, 3E)-1-метил-1-(3,5-диметоксифенил)-2- метоксикарбонил-3-[N-(4-метилпиперазин-1-ил) аминокарбонил]-4-фенилбутадиен; (1Z, 3E)-1-метил-1-(3,5-диметоксифенил)-2- метоксикарбонил-3-[N-(4-пиридил)аминокарбонил]-4-(3,4- метилендиоксифенил) бутадиен; (1Z, 3E)-1-метил-1-(3,5-диметоксифенил)-2-метоксикарбонил-3- [N-(4-пиридилметил)аминокарбонил]-4-фенилбутадиен; (1Z, 3E)-1-метил-1-(3-хлор-4,5-диметоксифенил)-2-метоксикарбонил-3- [N-(3-пиридилметил)аминокарбонил]-4-фенилбутадиен и (1Z, 3E)-1-метил-1-(3-хлор-4,5-диметоксифенил) -2-метоксикарбонил-3-аминокарбонил-4-(4-пиридил) бутадиен, или их фармацевтически приемлемые соли, и т.д. Предпочтительными соединениями (2) настоящего изобретения являются: (3Z, 4E)-3-(3,5-диметокси-  -метилбензилиден)-4- бензилиден-1-(4-пиридилметил)пирролидин-2,5-дион; -метилбензилиден)-4- бензилиден-1-(4-пиридилметил)пирролидин-2,5-дион;(3Z, 4E)-3-(3-хлор-4,5-диметокси-  -метилбензилиден)-4-(4- пиридилметилиден) пирролидин-2,5-дион; -метилбензилиден)-4-(4- пиридилметилиден) пирролидин-2,5-дион;(3Z, 4E)-3-(3-метокси-4-циклопентилокси-  -метилбензилиден) -4-(4-пиридилметилиден)пирролидин-2,5-дион; -метилбензилиден) -4-(4-пиридилметилиден)пирролидин-2,5-дион;(3Z, 4E)-3-(3-циклопентилокси-4-метокси-  – метилбензилиден)-4-(4-пиридилметилиден)пирролидин-2,5-дион – метилбензилиден)-4-(4-пиридилметилиден)пирролидин-2,5-дион (3Z, 4E)-3-(3,5-диметокси-  -метилбензилиден)-4- (4- пиридилметилиден)пирролидин-2,5-дион, -метилбензилиден)-4- (4- пиридилметилиден)пирролидин-2,5-дион,или их фармацевтически приемлемые соли, и т.д. Целевые соединения (1-а), (1-b) и (2) настоящего изобретения можно использовать в клиниках либо в свободной форме, либо в форме их фармацевтически приемлемых солей. Фармацевтически приемлемые соли включают, например, соли неорганических кислот (например, гидрохлорид, сульфат, гидробромид и т.д.), соли органических кислот (например, ацетат, фумарат, оксалат, метансульфонат и т.д.). Если у целевого соединения настоящего изобретения имеется такой заместитель, как карбоксильная группа, имидная группа и т.д., эти соединения можно использовать в форме их основных солей, таких как соли щелочных металлов (например, натриевая соль, калиевая соль и т.д.), или соли щелочно-земельных металлов (например, соль кальция и т.д.). Соединения настоящего изобретения и их фармацевтически приемлемые соли включают также их гидраты и сольваты. Целевые соединения (1-а), (1-b) и (2) настоящего изобретения и их фармацевтически приемлемые соли можно вводить перорально или парентерально, или их можно вводить в форме фармацевтических препаратов, таких как таблетки, гранулы, капсулы, порошки, растворы для инъекций, ингаляции и т.д. Дозы целевых соединений (1-а), (1-b) и (2) настоящего изобретения и их фармацевтически приемлемых солей могут меняться в зависимости от способа введения, возраста, веса и состояния пациента, или тяжести заболевания, подлежащего лечению, но обычно находятся в интервале от около 0,1 до 100 мг/кг/день в случае перорального приема. В случае парентерального введения интервал соответствует от около 0,01 до 10 мг/кг/день. Целевое соединение (1-а) настоящего изобретения можно получить, обрабатывая диэфир соединения формулы (4): 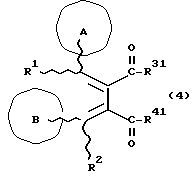 где группа -COR31 и группа -COR41 одинаковы или различны, и каждая представляет эстерифицированную карбоксильную группу, а кольцо А, кольцо В, R1 и R2 имеют указанные ранее значения, кислотой или основанием. Целевое соединение (1-b) настоящего изобретения можно получить, осуществляя реакцию соединения (1-а) или его соли, или его реакционноспособного производного с соединением формулы (5) H-R40 где R40 представляет замещенную или незамещенную аминогруппу. Целевое соединение (2) настоящего изобретения можно получить, подвергая соединение формулы (1-c) 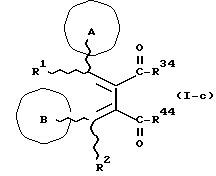 где одна из групп -COR34 и -COR44 представляет карбоксильную группу, которая может быть необязательно эстерифицирована, а другая представляет карбамоильную группу, карбамоильную группу, замещенную замещенной или незамещенной алкильной группой, карбамоильную группу, замещенную замещенной или незамещенной аминогруппой, или карбамоильную группу, замещенную замещенной или незамещенной азотсодержащей гетероциклической группой, кольцо А, кольцо В, R1 и R2 имеют указанные ранее значения или его соль, реакции внутримолекулярной циклизации. Целевое соединение (2), в котором R5 представляет замещенную или незамещенную алкильную группу, замещенную или незамещенную аминогруппу, или замещенную или незамещенную азотсодержащую гетероциклическую группу, можно получить, осуществляя взаимодействие соединения формулы (2-а) 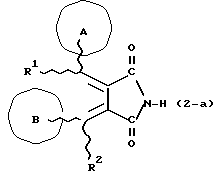 где кольцо А, кольцо В, R1 и R2 имеют указанные ранее значения или его соли с соединением формулы (3) R51 -X где R51 представляет замещенную или незамещенную алкильную группу, замещенную или незамещенную аминогруппу, или замещенную или незамещенную азотсодержащую гетероциклическую группу, а X представляет реакционноспособный остаток. Обработку диэстерсоединения 4 кислотой или основанием осуществляют в подходящем растворителе или без растворителя. Растворителем может служить любой инертный растворитель, который не мешает реакции, например такой органический растворитель, как этиленгликоль, N,N-диметилформамид, гексаметилфосфорамид, бензол, тетрагидрофуран, диоксан, толуол, этилацетат, низший спирт (метанол, этанол и т.д.), дихлорметан, 1,2-дихлорэтан, хлороформ, четыреххлористый углерод, 1,3-диметил- 2-имидазолидинон, диэтиловый эфир, диметоксиэтан, диметилсульфоксид, сероуглерод, ацетон и т.д. или смеси этих растворителей и воды. Основания включают, например, щелочные металлы, гидроксиды щелочных металлов, гидриды щелочных металлов, алкоксиды щелочных металлов, алкиламиды щелочных металлов (например, литийдиизопропиламид (LDA, и т.д.), низшие алкилы щелочных металлов (например, н-бутиллитий и т.д.), или такие органические амины, как три-(низший) алкиламин, 1,8- диазабицикло[5.4.0] ундека-7-ен, и т.д. Кислоты включают либо обычные протонированные кислоты, либо обычные кислоты Льюиса. Реакцию предпочтительно ведут при охлаждении или при нагревании, например при температуре от -60oC до 150oC, предпочтительно при температуре от 15oC до температуры кипения растворителя. Реакцию конденсации соединения (1-а) или его соли с соединением (5) ведут в присутствии дегидратирующего агента в подходящем растворителе. Дегидратирующие агенты включают, например, 1,3-дициклогексилкарбодиимид (DCC), карбонилдиимидазол (CDI) и т.д. Солями соединения (1-а) могут быть такие обычные соли, как соли щелочных или щелочно-земельных металлов и т.п. Эти соли можно предпочтительно превратить заранее в свободные соединения, а затем использовать в реакции с соединением (5). Реакцию конденсации реакционноспособного производного соединения (1-а) и соединения (5) осуществляют в присутствии акцептора кислоты в подходящем растворителе. Реакционноспособным производным может быть любое обычное производное, которое пригодно для образования связи кислота – амид, например галоидангидриды, смешанные ангидриды кислот, активные сложные эфиры и т.д. Акцептор кислоты включает, например, гидроксиды щелочных металлов, карбонаты щелочных металлов, бикарбонаты щелочных металлов, триалкиламины, N, N-диалкиланилины, пиридин, и т.д. Растворители включают, например, дихлорметан, хлороформ, 1,2-дихлорэтан, диэтиловый эфир, тетрагидрофуран, диоксан, N,N-диметилформамид, диметилсульфоксид, толуол, бензол и т.д. Соединение (5) используют в количестве от 1 до 3 моль, предпочтительно в количестве от 1,1 – 1,3 моль до 1 моль соединения (1-а) или его соли, или его реакционноспособного производного. Реакцию внутримолекулярной циклизации соединения (1-c) предпочтительно ведут в присутствии основания или кислоты в подходящем растворителе или без растворителя. Растворителем может быть любой инертный растворитель, который не мешает реакции, например такой органический растворитель, как этиленгликоль, N,N-диметилформамид, гексаметилфосфорамид, бензол, тетрагидрофуран, диоксан, толуол, этилацетат, низший спирт (например, метанол, этанол и т.д.), дихлорметан, 1,2-дихлорэтан, хлороформ, четыреххлористый углерод, 1,3-диметил-2-имидазолидинон, диэтиловый эфир, диметоксиэтан, диметилсульфоксид, сероуглерод, ацетон и т. д. , или смеси этих органических растворителей и воды. Основания включают, например, щелочные металлы, гидроксиды щелочных металлов, гидриды щелочных металлов, алкоксиды щелочных металлов, алкиламиды щелочных металлов, например, литийдиизопропиламид (LDA), (низшие) алкилы щелочных металлов (например, н-бутиллитий, и т.п.) или такие органические амины, как три-(низший алкил) амин, 1,8- диазабицикло[5.4.0]ундека-7-ен, и т. д. Кислоты включают обычные протонированные кислоты или обычные кислоты Льюиса. Реакцию ведут при охлаждении или при нагревании, например при температуре от -60oC до 150oC, предпочтительно при температуре от 15oC до температуры кипения растворителя. Реакцию конденсации соединения (2-а) или его соли и соединения (3) осуществляют в присутствии акцептора кислоты в подходящем растворителе. Соль соединения (2-а) является, например, солью щелочного металла и т.п. Акцептором кислоты может быть любой обычный акцептор, и они включают, например, гидриды щелочных металлов (например, гидрид натрия), гидроксиды щелочных металлов (например, гидроксид натрия), карбонаты щелочных металлов (например, карбонат калия), алкоксиды щелочных металлов (например, метоксид натрия), алкиламиды щелочных металлов (например, литийдиизопропиламид) или щелочные металлы, например натрий. Реакционноспособный осадок X включает, например, атом галоида (например, атом хлора, брома, йода и т.д.), сульфонилоксигруппу (например, трифторметансульфонилокси, толуолсульфонилокси, метансульфонилокси и т.д.) и т.д. Растворитель включает, например, дихлорметан, хлороформ, 1,2-дихлорэтан, диэтиловый эфир, тетрагидрофуран, диоксан, этиленгликоль, N,N-диметилформамид, диметилсульфоксид, толуол, бензол и т.д. Реакцию конденсации ведут при охлаждении или при нагревании, например при температуре от -60oC до 100oC, предпочтительно при температуре от -60oC до 20oC. Соединение (3) используют в этой реакции в количестве от 1 до 5 моль, на 1 моль соединения (2-а) или его соли. Исходное соединение (4) можно получить при взаимодействии соединения формулы (6) 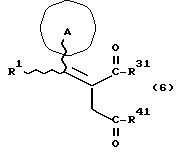 где кольцо A, R1, -COR31 и COR41 имеют указанные ранее значения, с соединением формулы (7) 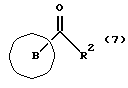 где кольцо В и R2 имеют указанные ранее значения. Исходное соединение (4) можно также получить при взаимодействии соединения формулы (8) 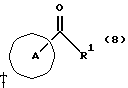 где кольцо А и R1 имеют указанные ранее значения, с соединением формулы (9) 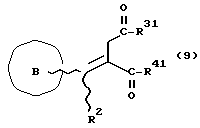 где кольцо В, R2, -COR31 и -COR41, имеют указанные ранее значения. Реакцию конденсации соединения (6) и соединения (7) или соединения (8) и соединения (9) осуществляют в присутствии основания в подходящем растворителе. Эти основания включают алкоксиды щелочных металлов или алкиламиды щелочных металлов, такие как трет-бутоксид калия, метоксид натрия, литийдиизопропиламид (LDA) и т.д. Растворители включают, например, низшие спирты (например, метанол, этанол, трет-бутанол и т.д.), дихлорметан, хлороформ, 1,2-дихлорэтан, диэтиловый эфир, тетрагидрофуран, диоксан, этиленгликоль, N,N-диметилформамид, диметилсульфоксид, толуол, бензол и т.д. Реакцию ведут при охлаждении или при нагревании, например, при температуре от -30oC до температуры кипения растворителя, который используют более предпочтительно при температуре от 15oC до 80oC. Среди исходных соединений (6) его транс(Е)-изомер можно получить, например, в результате конденсации соединения (8) с соединением формулы (10) 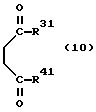 где -COR31 и -COR41 имеют указанные ранее значения, в присутствии основания в подходящем растворителе. Среди исходных соединений (6) его цис(Е)-изомер можно получить в реакции присоединения и элиминирования соответствующего транс(Е)-изомера, например, добавляя нуклеофильный реагент (например, тиофенол) к транс(Е)-изомеру соединения (6) с последующим элиминированием нуклеофила из полученного аддукта в присутствии основания. В описании и в формуле изобретения термин алкильная группа и алкоксильная группа относятся к группам, содержащим от 1 до 20 атомов углерода, предпочтительно от 1 до 10 атомов углерода и более предпочтительно к группам, содержащим от 1 до 6 атомов углерода соответственно. Термины низшая алкильная группа и низшая алкоксигруппа относятся к группам, содержащим от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода соответственно. Термин циклоалкильная группа означает группу, содержащую от 3 до 10 атомов углерода, предпочтительно от 5 до 8 атомов углерода. Термин низшая алкилендиоксигруппа означает группу, содержащую от 1 до 4 атомов углерода. Предпочтительный вариант осуществления изобретения Настоящее изобретение иллюстрируется более подробно следующими примерами, но ими не ограничивается. Пример 1 (1) К раствору ванилина (50 г) в N,N-диметилформамиде (600 мл) добавляют 62,5% гидрида натрия (13,9 г) и циклопентилбромид (38,8 мл) при охлаждении льдом, и полученную смесь перемешивают при 90oC в течение ночи. Полученную смесь концентрируют при пониженном давлении для удаления N,N-диметилформамида, а к остатку добавляют воду. Полученную смесь экстрагируют этилацетатом, а экстракт промывают, сушат и концентрируют при пониженном давлении для удаления растворителя. Полученный остаток очищают на хроматографической колонке с силикагелем (элюент: гексан:этилацетат = 3:1) до получения 4-циклопентилокси-3- метоксибензальдегида (65 г). Выход 90%. ИК: 2960, 1683, 1583, 1506, 1266, 1135, 730 см-1. (2) Раствор вышеуказанного продукта (10 г) и диметилсукцината (8,0 г) в трет-бутиловом спирте (20 мл) добавляют к раствору трет-бутоксида калия (5,1 г) в трет-бутиловом спирте (50 мл), и полученную смесь перемешивают при комнатной температуре в течение часа. Реакционную смесь выливают в смесь лед – вода и полученную смесь промывают днизопропиловым эфиром. pH смеси доводят до pH 1 соляной кислотой, и полученную смесь экстрагируют этилацетатом. Полученный экстракт промывают, сушат и концентрируют при пониженном давлении. Полученный остаток растворяют в дихлорметане (100 мл), и к этому добавляют диизопропилэтиламин (11,8 мл) и метоксиметилхлорид (3,9 мл) при охлаждении льдом, и полученную смесь перемешивают при комнатной температуре в течение одного часа. К этой смеси добавляют воду, и полученную смесь экстрагируют этилацетатом. Экстракт промывают, сушат и концентрируют при пониженном давлении. Полученный остаток очищают на хроматографической колонке с силикагелем (элюент: гексан: этилацетат = 3:1) до получения метил (Е)-3-(4-циклопентилокси-3-метоксифенил)-2-(метоксиметоксикарбонилметил) акрилата (10,9 г). Выход 63%. ИК: 2957, 1741, 1710, 1599, 1513, 1256, 1145 см-1. (3) К раствору тиофенола (5,9 мл) в 50 мл тетрагидрофурана добавляют 15% раствор н-бутиллития в гексане (2,2 мл) при 0oC в атмосфере азота, и полученную смесь перемешивают при комнатной температуре в течение 30 минут. К этой смеси добавляют раствор соединения, полученного в (2) (13,4 г) в 100 мл тетрагидрофурана, и полученную смесь перемешивают при комнатной температуре в течение ночи. Полученную смесь экстрагируют этилацетатом, и экстракт промывают, сушат и концентрируют при пониженном давлении для удаления растворителя. Остаток очищают на хроматографической колонке с силикагелем (элюент: гексан: этилацетат = 3: 1) до получения метил (2R*, 3S*)-3-(4-циклопентилокси-3-метокси- фенил)-2-метоксиметоксикарбонилметил-3-фенилтиопропионата (14,5 г). Выход: 84%. ИК: 2957, 1736, 1585, 1512, 1265, 1143 см-1. (4) К раствору вышеуказанного продукта (14,5 г) в 300 мл хлороформа добавляют порциями 3-хлорпербензойную кислоту (5,1 г) при 0oC. Полученную смесь перемешивают при той же температуре в течение 30 минут. К смеси добавляют гидроксид кальция (10 г), и полученную смесь перемешивают, фильтруют, и полученный фильтрат концентрируют при пониженном давлении. К остатку добавляют толуол (300 мл), и полученную смесь кипятят с обратным холодильником в течение 30 минут. Эту смесь концентрируют при пониженном давлении, а полученный остаток очищают на хроматографической колонке с силикагелем (элюент: гексан: этилацетат = 3:1) до получения метил (Z)-3-(4- циклопентилокси-3-метоксифенил)-2-(метоксиметоксикарбонил- метил)-акрилата (9,0 г). Выход: 67%. ИК: 2956, 1744, 1718, 1600, 1511, 1144 см-1. (5) Раствор полученного ранее продукта (10,3 г) в 100 мл тетрагидрофурана прикапывают к раствору литийдиизопропиламида, который получают из диизопропиламина (4,6 мл) и н-бутиллития (20 мл) в тетрагидрофуране (60 мл) при -78oC в атмосфере азота, и полученную смесь перемешивают при той же температуре в течение 30 минут. К этой смеси прикапывают раствор бензальдегида (3,5 г) в 30 мл тетрагидрофурана при -100oC, и полученную смесь перемешивают при той же температуре в течение 20 минут. К этой смеси добавляют водный раствор аммонийхлорида, и полученную смесь экстрагируют этилацетатом. Этот экстракт промывают, сушат и концентрируют при пониженном давлении. Остаток растворяют в дихлорметане (50 мл), и к этому добавляют триэтиламин (11 мл) и метансульфонилхлорид (2,5 мл) при 0oC, и полученную смесь перемешивают при комнатной температуре в течение одного часа. К смеси добавляют воду, и полученную смесь экстрагируют этилацетатом. Этот экстракт промывают, сушат и концентрируют при пониженном давлении. Остаток очищают на хроматографической колонке с силикагелем (элюент: гексан:этилацетат = 3:1) до получения (1Z, 3E)-1-(4-циклопентилокси-3-метоксифенил)-2-метоксикарбонил-3- метоксиметоксикарбонил-4-фенилбутадиена (7,3 г). Выход 58%. ИК: 2957, 1717, 1597, 1509, 1264, 1160, 696 см-1. (6) К раствору вышеуказанного продукта (7,3 г) в 50 мл тетрагидрофурана добавляют концентрированную соляную кислоту (5 мл), и полученную смесь перемешивают при комнатной температуре в течение одного часа. К этой смеси добавляют насыщенный водный раствор натрийхлорида, и полученную смесь экстрагируют этилацетатом. Этот экстракт сушат, концентрируют при пониженном давлении. Остаток очищают на хроматографической колонке с силикагелем (элюент: хлороформ: метанол = 20:1) до получения (1Z,3E)-1-(4-циклопентилокси- 3-метоксифенил)-2-метоксикарбонил-3-карбокси-4-фенилбутадиена (6,1 г). Выход: 92%. ИК: 3500-3000 (шир), 2958, 1712, 1690, 1600, 1509, 1270, 694 см-1. (7) К раствору вышеуказанного продукта (0,75 г) в 20 мл тетрагидрофурана добавляют карбонилдиимидазол (0,35 г), и полученную смесь перемешивают при комнатной температуре в течение 30 минут. К раствору добавляют 28% водный аммиак (0,7 мл), и полученную смесь перемешивают при комнатной температуре в течение 30 минут. К этой смеси добавляют воду, и полученную смесь экстрагируют хлороформом. Экстракт сушат и концентрируют при пониженном давлении. Остаток очищают на хроматографической колонке с силикагелем (элюент: хлороформ: ацетон = 5: 1) до получения (1Z,3E)-1-(4-циклопентилокси-3-метоксифенил)-2-метоксикарбонил-3- аминокарбонил-4-фенилбутадиена (0,48 г). Его строение и физические свойства представлены в таблице 1. Выход 64%. Т. плавления 158-159oC. Пример 2 (1) К раствору соединения, полученного в примере 1-(6), (0,3 г) в 10 мл дихлорметана добавляют триэтиламин (0,15 мл) и изобутилхлорформиат (0,14 мл) при 0oC, и полученную смесь перемешивают в течение 30 минут. К этому раствору добавляют 4-пиколиламин (0,11 мл), и полученную смесь перемешивают в течение 30 минут. К смеси добавляют воду и полученную смесь экстрагируют хлороформом. Этот экстракт сушат, концентрируют при пониженном давлении, и остаток очищают на хроматографической колонке с силикагелем (элюент: хлороформ: метанол = 50:1) до получения (1Z,3E)-1-(3-метокси-4-циклопентилоксифенил)-2- метоксикарбонил-3-(4-пиридилметил-аминокарбонил)-4-фенилбутадиена (0,29 г). Выход 80%. (2) К полученному ранее продукту (0,29 г) добавляют 4 н. раствор хлористого водорода в этилацетате, и полученную смесь тщательно растирают с эфиром до получения (1Z, 3E)-1-(3-метокси-4-циклопентилоксифенил)-2-метоксикарбонил-3- (4-пиридилметиламинокарбонил)-4-фенилбутадиенгидрохлорида (0,29 г). Его структура и физические свойства представлены в таблице 1. Выход 93%. Т.пл. 105-130oC. Примеры 3 и 4 Соответствующие исходные соединения обрабатывают согласно способу примера 2, получая соединения, перечисленные в таблице 1. Пример 5 К раствору соединения, полученного в примере 1-(7), (0,28 г) в 10 мл тетрагидрофурана добавляют 2 н. водный раствор гидроксида натрия (1 мл) и полученную смесь перемешивают при комнатной температуре в течение 10 минут. Полученную смесь нейтрализуют 2 н. соляной кислотой и экстрагируют хлороформом. Полученный экстракт сушат, концентрируют при пониженном давлении, а остаток очищают на хроматографической колонке с силикагелем (элюент: гексан: этилацетат = 2:1) до получения (3Z, 4E)-4-бензилиден-3-(4-циклопентилокси-3-метоксибензилиден)- пирролидин-2,5-диона (0,24 г). Его структура и физические свойства представлены в таблице 2. Выход 93%. Т. плавления 203-204oC. Пример 6 (1) К раствору соединения, полученного в примере 2-(2), (0,25 г) в 10 мл тетрагидрофурана добавляют 2 н. водный раствор гидроксида натрия (1,1 мл) и полученную смесь перемешивают при комнатной температуре. К этой смеси добавляют воду и смесь экстрагируют хлороформом. Экстракт сушат и концентрируют при пониженном давлении для удаления растворителя. Остаток очищают на хроматографической колонке с силикагелем (элюент: этилацетат:гексан = 1:1) до получения (3Z,4E)-3-(4- циклопентилокси-3-метоксибензилиден)-4-бензилиден-1-(4- пиридилметил) пирролидин-2, 5-диона (0, 12 г). Выход 55%. (2) К вышеуказанному продукту (0,12 г) добавляют 4 н. раствор хлористого водорода в диоксане и полученную смесь тщательно растирают с эфиром до получения (3Z,4E)-3-(4- циклопентилокси-3-метокси-бензилиден)-4-бензилиден-1-(4- пиридилметил)-пирролидин-2,5-дионгидрохлорида (90 мг). Структура и физические свойства его представлены в таблице 2. Выход 76%. Т. плавления 117-130oC (с разложением). Примеры 7 и 8 Соответствующие исходные соединения обрабатывают таким же способом, что и в примере 6, до получения соединений, указанных в таблице 2. Пример 9 (1) К раствору соединения, полученного в примере 1-(6), (0,3 г) в 10 мл дихлорметана добавляют триэтиламин (0,15 мл) и изобутилхлорформиат (0,14 мл) при 0oC, и полученную смесь перемешивают в течение 30 минут. К этой смеси добавляют N,N- диметилэтилендиамин (0,12 мл), и полученную смесь перемешивают в течение 30 минут. К этой смеси добавляют воду и полученную смесь экстрагируют хлороформом. Этот экстракт сушат и концентрируют при пониженном давлении. К остатку добавляют 5 мл тетрагидрофурана и 2 н. водный раствор гидроксида натрия (0,7 мл), и полученную смесь перемешивают при комнатной температуре в течение 10 минут. К этой смеси добавляют воду и смесь экстрагируют хлороформом. Экстракт сушат и концентрируют при пониженном давлении. Остаток очищают на хроматографической колонке с силикагелем (элюент: хлороформ: метанол = 20:1) до получения (3Z,4E)-3-(4-циклопентилокси-3- метоксибензилиден)-4-бензилиден-1-(2-(N, N-диметиламино)этил)- пирролидин-2,5-диона (0,25 г). Выход 76%. (2) К вышеуказанному продукту (0,25 г) добавляют 4 н. раствор хлористого водорода в этилацетате и полученную смесь тщательно растирают с эфиром до получения (3Z,4E)-3-(4-циклопентилокси-3- метоксибензилиден)-4-бензилиден-1-(2-(N,N-диметиламино) этил) пирролидин-2,5-дион-гидрохлорида (0,17 г). Его структура и физические свойства представлены в таблице 2. Выход 88%. Т.пл. 95-110oC (с разложением). Пример 10 Соответствующие исходные соединения обрабатывают по способу примера 9 до получения соединений, перечисленных в таблице 2. Пример 11 (1) К раствору метилмагниййодида, который получают из магния (2,9 г) и метилйодида (7,5 мл) в 150 мл диэтилового эфира добавляют по каплям раствор 4-циклопентилокси-3- метоксибензальдегида (17,6 г) в тетрагидрофуране (40 мл) при 0oC и полученную смесь перемешивают при комнатной температуре в течение одного часа. Реакционную смесь добавляют к насыщенному водному раствору аммонийхлорида (20 мл) при 0oC и эту смесь экстрагируют этилацетатом. Полученный экстракт концентрируют при пониженном давлении, а остаток растворяют в ацетонитриле (300 мл) и к этому добавляют диоксид марганца (55 г) при 0oC. Полученную смесь нагревают до комнатной температуры и эту смесь перемешивают в течение трех дней. К реакционной смеси добавляют церит (20 г) и полученную смесь перемешивают в течение 30 минут. Нерастворившийся материал отфильтровывают, полученный фильтрат концентрируют при пониженном давлении. Остаток кристаллизуют из охлажденного гексана до получения 4-ацетил-1-циклопентилокси-2-метоксибензола (13,8 г). Выход: 73,6%. Т.плавления 55-56oC. (2) Раствор вышеуказанного продукта (9,7 г) и диметил(Е)-бензилиденсукцината (10 г) в 100 мл тетрагидрофурана прикапывают к раствору трет-бутоксида калия (4,8 г) в трет-бутиловом спирте (100 мл) при комнатной температуре и полученную смесь перемешивают при той же температуре в течение часа. К реакционной смеси прикапывают диизопропиловый эфир (200 мл) и полученную смесь экстрагируют водой. pH водного слоя доводят до pH 1-2 с помощью концентрированной соляной кислоты и полученную смесь снова экстрагируют этилацетатом. Этот экстракт концентрируют при пониженном давлении и 2/5 части остатка собирают, и растворяют в 100 мл хлороформа. К полученной смеси прикапывают несколько капель N,N-диметилформамида и тионилхлорид (1/8 мл) при комнатной температуре, и полученную смесь кипятят с обратным холодильником в течение 30 минут. Реакционную смесь охлаждают льдом и прикапывают к раствору водного аммиака (20 мл) в 50 мл хлороформа, и полученную смесь перемешивают в течение 30 минут. 50 мл воды добавляют к реакционной смеси и затем эту смесь экстрагируют хлороформом. Полученный экстракт концентрируют при пониженном давлении для удаления растворителя, а остаток очищают хроматографически на колонке с силикагелем (элюент: хлороформ:ацетон = 20:1) и кристаллизуют из смеси гексан-этилацетат до получения (1Z,3E)-1- метил-1-(4-цикло-пентилокси-3-метоксифенил)-2-метоксикарбонил-3- аминокарбонил-4-фенилбутадиена (0,42 г). Его структура и физические свойства представлены в таблице 3. Т. плавления 133-134oC. Примеры 12-22 Соответствующие исходные соединения обрабатывают по способу примера 11 до получения соединений, перечисленных в таблицах 3-5. Пример 23 (1) К раствору трет-бутоксида калия (2,4 г) в трет-бутиловом спирте (25 мл) прикапывают раствор 3,4,5- триметоксиацетофенона (5,0 г) и диметил(Е)бензилиденсукцината (4,5 г) в тетрагидрофуране (20 мл) при 20-25oC, и полученную смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь выливают в воду, и смесь промывают диизопропиловым эфиром, pH водного слоя доводят до pH 1 соляной кислотой и экстрагируют этилацетатом. Полученный экстракт сушат и концентрируют при пониженном давлении, а остаток очищают на хроматографической колонке с силикагелем (элюент: хлороформ: метанол = 50:1 до 20:1) до получения 1-метил-1-(3,4,5- триметоксифенил)-2-метоксикарбонил-3-карбокси-4-фенилбутадиена (6,5 г) в виде смеси (1Е, 3Е)-изомера и (1Z,3E) изомера. Выход 66,3%. ИК: 3420, 2950, 1720, 1715, 1690, 1585, 1240, 1125, 695 см-1. (2) К раствору полученного ранее продукта (6,5 г) в 30 мл хлороформа прикапывают несколько капель N,N-диметилформамида и тионилхлорид (1,15 мл), и полученную смесь кипятят с обратным холодильником в течение 30 минут. Этот раствор прикапывают к концентрированному водному аммиаку (20 мл) при 0oC, и полученную смесь перемешивают при комнатной температуре в течение 30 минут. Эту смесь экстрагируют хлороформом, и полученный экстракт сушат, концентрируют при пониженном давлении, и остаток очищают на хроматографической колонке с силикагелем (элюент: гексан:этилацетат = 1:1 до 1:2). Элюент концентрируют и кристаллизуют из эфира и выпавшие в осадок кристаллы собирают фильтрованием и затем перекристаллизовывают из смеси гексан – этилацетат до получения (1E, 3E)-1-метил-1-(3,4,5- триметоксифенил)-2-метоксикарбонил-3-аминокарбонил-4- фенилбутадиена (2,6 г). Структура и физические свойства его представлены в таблице 6. Выход 40,1%. Т. плавления 155-157oC. (3) Фильтрат, полученный ранее в (2), концентрируют при пониженном давлении, а остаток кристаллизуют из диизопропилового эфира, а затем перекристаллизовывают из смеси гексан-этилацетат до получения (1Z,3E)-1-метил-1- (3,4,5-триметоксифенил)-2-метоксикарбонил-3-аминокарбонил-4- фенилбутадиена (2,1 г). Структура и физические свойства представлены в таблице 5. Выход 32,4%. Т. плавления 118-120oC. Пример 24 (1) К раствору трет-бутоксида калия (14,5 г) в трет- бутиловом спирте (100 мл) добавляют смесь ацетофенона (15,5 г) и диметилсукцината (27,1 г), и полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь выливают в смесь льда и воды, и полученную смесь промывают диизопропиловым эфиром. pH водного слоя устанавливают до pH 2-3 концентрированной соляной кислотой, а затем экстрагируют этилацетатом. Экстракт сушат и концентрируют при пониженном давлении. Остаток растворяют в 150 мл метанола, и к этому прикапывают тионилхлорид (12,5 мл) при охлаждении льдом. Эту смесь перемешивают при комнатной температуре в течение ночи и концентрируют при пониженном давлении для удаления растворителя. Осадок промывают этилацетатом, сушат и концентрируют при пониженном давлении для удаления растворителя. Полученный осадок очищают на хроматографической колонке с силикагелем (элюент: гексан:этилацетат = 4:1) до получения (Е)-2-бензилиден-альфа- метилянтарной кислоты диметилового сложного эфира (18,6 г) и диметиловый эфир (Z)-2-бeнзилидeн-  -мeтилянтapнoй кислоты (6,2 г), диметиловый эфир (Е)-2-бенэилиден- -мeтилянтapнoй кислоты (6,2 г), диметиловый эфир (Е)-2-бенэилиден- -метилянтарной кислоты. Выход: 58%, маслянистый продукт.
ИК: 2970, 2940, 2860, 1745, 1440, 1270, 1200, 1180, 1135, 1060, 770, 705 см-1 -метилянтарной кислоты. Выход: 58%, маслянистый продукт.
ИК: 2970, 2940, 2860, 1745, 1440, 1270, 1200, 1180, 1135, 1060, 770, 705 см-1Диметиловый эфир (Z)-2-бeнзилидeн-  -мeтилянтapнoй кислоты. Выход 19%. Маслянистый продукт.
ИК: 2960, 2920, 2850, 1740, 1710, 1440, 1320, 1250, 1195, 1170, 1140, 765, 700 см-1.
(2) Раствор диметилового эфира (Е)-2-бензилиден- -мeтилянтapнoй кислоты. Выход 19%. Маслянистый продукт.
ИК: 2960, 2920, 2850, 1740, 1710, 1440, 1320, 1250, 1195, 1170, 1140, 765, 700 см-1.
(2) Раствор диметилового эфира (Е)-2-бензилиден- -метилянтарной кислоты (5,0 г) и 3,4,5-триметоксибензальдегид (4,0 г) в 20 мл тетрагидрофурана прикапывают к раствору трет-бутоксида калия (2,3 г) в трет-бутиловом спирте (20 мл), и полученную смесь перемешивают при комнатной температуре в течение часа. Реакционную смесь выливают в смесь льда и воды, и полученную смесь промывают. pH водного слоя устанавливают до pH 2-3 концентрированной соляной кислотой, и эту смесь экстрагируют этилацетатом. Экстракт сушат, концентрируют при пониженном давлении, и полученный остаток растворяют в хлороформе (30 мл). К полученной смеси добавляют тионилхлорид (1,5 мл) и три капли N, N-диметилформамида, и полученную смесь кипятят с обратным холодильником в течение 30 минут. Полученную смесь прикапывают к 28% водному аммиаку (20 мл) при охлаждении льдом, и полученную смесь перемешивают при комнатной температуре в течение 10 минут. К смеси добавляют воду, и экстрагируют ее хлороформом. Полученные экстракты сушат и концентрируют при пониженном давлении для удаления растворителя. Остаток очищают на хроматографической колонке с силикагелем (элюент: гексан:этилацетат = 1:1) до получения (1Е,3E)-1-(3,4,5-триметоксифенил)-2-метоксикарбонил-3- аминокарбонил-4-метил-4-фенилбутадиена (4,7 г). Его строение и физические свойства представлены в таблице 6. Выход 57%. Т.пл. 156-157oC.
Пример 25 -метилянтарной кислоты (5,0 г) и 3,4,5-триметоксибензальдегид (4,0 г) в 20 мл тетрагидрофурана прикапывают к раствору трет-бутоксида калия (2,3 г) в трет-бутиловом спирте (20 мл), и полученную смесь перемешивают при комнатной температуре в течение часа. Реакционную смесь выливают в смесь льда и воды, и полученную смесь промывают. pH водного слоя устанавливают до pH 2-3 концентрированной соляной кислотой, и эту смесь экстрагируют этилацетатом. Экстракт сушат, концентрируют при пониженном давлении, и полученный остаток растворяют в хлороформе (30 мл). К полученной смеси добавляют тионилхлорид (1,5 мл) и три капли N, N-диметилформамида, и полученную смесь кипятят с обратным холодильником в течение 30 минут. Полученную смесь прикапывают к 28% водному аммиаку (20 мл) при охлаждении льдом, и полученную смесь перемешивают при комнатной температуре в течение 10 минут. К смеси добавляют воду, и экстрагируют ее хлороформом. Полученные экстракты сушат и концентрируют при пониженном давлении для удаления растворителя. Остаток очищают на хроматографической колонке с силикагелем (элюент: гексан:этилацетат = 1:1) до получения (1Е,3E)-1-(3,4,5-триметоксифенил)-2-метоксикарбонил-3- аминокарбонил-4-метил-4-фенилбутадиена (4,7 г). Его строение и физические свойства представлены в таблице 6. Выход 57%. Т.пл. 156-157oC.
Пример 25Диметиловый эфир (Z)-2-бензилиден-альфа-метилянтарной кислоты (5,3 г), полученный в примере 24-(1), обрабатывают по способу примера 24-(2) до получения (1E, 3Z)-1-(3,4,5-триметоксифенил)-2- метоксикарбонил-3-аминокарбонил-4-метил-4-фенилбутадиена (6,7 г). Строение и физические свойства его представлены в таблице 7. Выход: 76%. Т. плавления 141-143oC. Пример 26 К раствору соединения (0,32 г), полученного в примере 11-(2), в 20 мл тетрагидрофурана добавляют 2 н. водный раствор гидроксида натрия (3,6 мл) при 0oC, и полученную смесь перемешивают в течение 10 минут. К реакционной смеси добавляют 2 н. соляную кислоту (3,6 мл) и полученную смесь экстрагируют этилацетатом. Этот экстракт концентрируют при пониженном давлении для удаления растворителя, и остаток очищают с помощью хроматографической колонки с силикагелем (элюент: хлороформ:ацетон = 10:1); и после кристаллизации из диэтилового эфира получают (3Z,4E)-4-бeнзилидeн-3-(4-циклопентилокси-3- метокси-  -метилбензилиден)пирролидин -2,5-дион (0,17 г). Строение и физические его свойства представлены в таблице 8. Выход 58%. Т.пл. 193-194oC.
Примеры 27-38 -метилбензилиден)пирролидин -2,5-дион (0,17 г). Строение и физические его свойства представлены в таблице 8. Выход 58%. Т.пл. 193-194oC.
Примеры 27-38Соответствующие исходные соединения обрабатывают по способу примера 26 до получения соединений, перечисленных в таблицах 8-10. Примеры 39-43 Соответствующие исходные соединения обрабатывают по способу примера 1 до получения соединений, перечисленных в таблице 11. Примеры 44-48 Соответствующие исходные соединения обрабатывают по способу примера 5 до получения соединений, перечисленных в таблице 12. Пример 49 (1) 100 г ванилина растворяют в 800 мл хлороформа, и к этому добавляют при перемешивании газообразный хлор при комнатной температуре в течение около 1 часа до получения твердого вещества белого цвета. Через смесь пропускают сжатый воздух для удаления растворенного в ней хлора, и выпавшее в осадок твердое вещество собирают фильтрованием, промывают и сушат. Маточный раствор концентрируют и тщательно растирают с диэтиловым эфиром, а осадок собирают фильтрованием, промывают и сушат. Выпавшее в осадок твердое вещество и порошок, полученный таким образом, объединяют до получения 3-хлорванилина (115,25 г). Выход: 94%, Т.пл. 163oC. (2) Вышеуказанный продукт (62 г) растворяют в N,N-диметилформамиде (600 мл), и к этому добавляют карбонат калия (91,8 г) и метилйодид (37,2 мл) при комнатной температуре, и полученную смесь перемешивают при той же температуре в течение 5 часов. Реакционную смесь концентрируют и к ней добавляют воду. Полученную смесь экстрагируют этилацетатом, и этилацетатный слой промывают, сушат и концентрируют при пониженном давлении для удаления растворителя до получения 3-хлор-4,5-диметоксибензальдегида (65,15 г). Выход 97,7%. Т. плавления 54oC. (3) К раствору магния (11,87 г) в 500 мл диэтилового эфира постепенно добавляют, прикапывая, раствор метилйодида (30,4 мл) в 100 мл диэтилового эфира в атмосфере азота. После добавления смесь перемешивают в течение 30 минут до тех пор, пока кипение с обратным холодильником не прекращается. К полученной смеси добавляют по каплям раствор соединения (70 г), полученный ранее (2) в 400 мл тетрагидрофурана при охлаждении льдом. Полученную смесь нагревают до комнатной температуры и еще перемешивают в течение 30 минут. К реакционной смеси добавляют небольшое количество воды, и реакцию гасят. К реакционной смеси добавляют водный раствор аммонийхлорида, и полученную смесь экстрагируют этилацетатом. Этилацетатный слой промывают, сушат и концентрируют при пониженном давлении для удаления растворителя и получения 3-хлор-4,5-диметокси-1-(1-гидроксиэтил) бензола (75 г). Вышеуказанный продукт (75 г) растворяют в ацетонитриле (500 мл) и к этому добавляют диоксид марганца (400 мл), и полученную смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют церит, и смесь перемешивают в течение одного часа. Эту смесь фильтруют через подушку целита, и маточный раствор концентрируют. Остаток очищают на хроматографической колонке с силикагелем (элюент: гексан:этилацетат = 3:1), и перекристаллизовывают из гексана до получения 3-хлор-4,5- диметоксиацетофенона (62,0 г). Выход 82,8%. Т.плавления 47-49oC. (4) Раствор вышеуказанного продукта (11,3 г) в диметилсукцинате (11,54 г) в 50 мл тетрагидрофурана добавляют постепенно и по каплям к раствору трет-бутоксида калия (6,5 г) в трет-бутиловом спирте (30 мл) при комнатной температуре. Полученную смесь перемешивают при комнатной температуре в течение одного часа, нагревают до 70oC, а затем перемешивают в течение одного часа. Реакционную смесь охлаждают и выливают в смесь воды и льда, а затем растворяют в изопропиловом эфире для очистки, а затем смесь экстрагируют водой. pH водного слоя доводят до pH 2-3 концентрированной соляной кислотой, и свободную карбоновую кислоту экстрагируют этилацетатом. Полученный экстракт сушат и концентрируют при пониженном давлении до получения 4-(3- хлор-4,5-диметоксифенил) -4-метил-3-метоксикарбонил-3- бутеновой кислоты в виде масла янтарного цвета. Полученный таким образом продукт растворяют в дихлорметане (100 мл) и к этому добавляют диизопропилэтиламин (11,0 мл) и метоксиметилхлорид (4,8 мл) при 0oC, и полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют, и к ней добавляют водный раствор лимонной кислоты, а затем экстрагируют этилацетатом. Полученный экстракт промывают, сушат и концентрируют при пониженном давлении. Остаток очищают на хроматографической колонке с силикагелем (элюент: этилацетат:гексан = 1:3 до 2: 3) до получения метоксиметилового эфира (Z)-4-(3-хлор-4,5-диметоксифенил) -4-метил-3- метоксикарбонил-3-бутеновой кислоты (3,18 г) и метоксиметилового эфира (Е)-4-(3-хлор-4,5-диметоксифенил)-4-метил-3- метоксикарбонил-3-бутеновой кислоты (9,12 г). Метоксиметиловый эфир: (Е)-4-(3-хлор-4,5-диметоксифенил)-4-метил-3- метоксикарбонил-3-бутеновой кислоты. Выход: 16,2%. ИК: 1735, 1563, 1491, 1148, 932 см-1. Метоксиметиловый эфир: (Е)-4-(3-хлор-4,5- диметоксифенил) -4-метил-3-метоксикарбонил-3-бутеновой кислоты. Выход: 46,5%. ИК: 1738, 1562, 1491, 1146, 932 см-1. (5) К раствору диизопропиламина (1,33 мл) в тетрагидрофуране (20 мл) постепенно добавляют, прикапывая, 1,6 н. раствор н-бутиллития в гексане (5,91 мл) при 0oC, и полученную смесь перемешивают при той же температуре в течение 30 минут. Раствор охлаждают до -78oC, и к этому постепенно добавляют по каплям раствор метоксиметилового эфира (Z)-4- (3-хлор-4,5-диметоксифенил) -4-метил-3-метоксикарбонил-3-бутеновой кислоты (2,94 г) в 20 мл тетрагидрофурана, и полученную смесь далее перемешивают при той же температуре в течение 30 минут. Реакционную смесь охлаждают до -90oC и к ней добавляют постепенно, прикапывая, раствор изоникотинальдегида (1,01 г) в 10 мл тетрагидрофурана, и полученную смесь перемешивают при -90oC в течение 20 минут. К реакционной смеси добавляют насыщенный водный раствор аммонийхлорида и полученную смесь экстрагируют этилацетатом. Органический слой промывают, сушат и концентрируют при пониженном давлении для удаления растворителя и до получения метоксиметилового эфира (Z)-4-(3-хлор-4,5-диметоксифенил)-4- метил-3-метоксикарбонил-2-(4-пиридилгидроксиметил)-3-бутеновой кислоты. Полученный ранее продукт растворяют в дихлорметане (50 мл) и к этому добавляют триэтиламин (7,54 мл), и метансульфонилхлорид (0,977 мл) при 0oC. Полученную смесь нагревают до комнатной температуры и перемешивают в течение ночи. К этой смеси добавляют 1,8-диазабицикло-[5.4.0]ундека-7-ен (DBU 1,18 мл) и полученную смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь концентрируют и к ней добавляют воду. Полученную смесь экстрагируют этилацетатом, промывают, сушат и концентрируют при пониженном давлении для удаления растворителя. Остаток очищают на хроматографической колонке с силикагелем (элюент: хлороформ:ацетон = 6:1) до получения (1Z, 3E)-1-метил-1-(3-хлор-4,5- диметоксифенил)-2-метоксикарбонил-3-метоксиметокси-карбонил-4-(4- пиридил)бутадиена (2,007 г). Выход 55,1%. ИК: 1720, 1594, 1563, 1490, 1253, 1047, 927 см-1. (6) К раствору полученного ранее продукта (2,0 г) в 20 мл тетрагидрофурана добавляют 12 н. соляную кислоту (2,0 мл) при 0oC, и полученную смесь перемешивают при комнатной температуре в течение двух часов. Реакционную смесь охлаждают льдом, и pH доводят до pH 4-5 с помощью 2 н. водного раствора гидроксида натрия, и полученную смесь экстрагируют этилацетатом. Экстракт сушат и концентрируют при пониженном давлении до получения (1Z,3E)-1-метил-1-(3-хлор-4,5- диметоксифенил)-2-метоксикарбонил-3-карбокси-4-(4-пиридил) бутадиена в виде твердого вещества желтого цвета. Вышеуказанный продукт растворяют в дихлорметане (20 мл) и к этому добавляют триэтиламин (0,67 мл) и изобутилхлорформиат (0,62 мл) при охлаждении льдом. Полученную смесь перемешивают при той же температуре в течение 30 минут и к этому добавляют 28% водный аммиак (2,8 мл) при 0oC. Полученную смесь перемешивают при 0oC в течение 30 минут. Двукратно разбавленный насыщенный водный раствор натрийхлорида добавляют к реакционной смеси и ее экстрагируют хлороформом. Полученный экстракт сушат, концентрируют при пониженном давлении и полученный остаток очищают на хроматографической колонке с силикагелем (элюент: хлороформ:метанол = 20:1) до получения 1-метил-1-(3-хлор-4,5- диметоксифенил)-2-метоксикарбонил-3-аминокарбонил-4-(4-пиридил) бутадиена (1,498 г) Выход: 83%. ИК: 1720, 1676, 1595, 1240, 1047, 999, 855 см-1. Полученный таким образом продукт представляет смесь стереоизомеров по отношению к двойной связи в 1-положении, и отношение Z-изомера к Е-изомеру составляет 2,5:1. (7) Полученный ранее продукт очищают и разделяют на хроматографической колонке с силикагелем (элюент: хлороформ:ацетон = 5:1) до получения (1Z, 3E)-1-метил-1-(3-хлор-4,5-диметоксифенил) -2-метокси-карбонил-3-аминокарбонил-4-(4-пиридил) бутадиена. Строение и физические свойства его представлены в таблице 13. Примеры 50-53 Соответствующие исходные соединения обрабатывают по способу примера 49 до получения соединений, представленных в таблице 13. Пример 54 (1) Соединение (800 мг), полученное в примере 49-(7), растворяют в 20 мл тетрагидрофурана, и к этому добавляют 2 н. водный раствор гидроксида натрия (0,48 мл) при охлаждении льдом. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение одного часа. К реакционной смеси добавляют воду, и полученную смесь экстрагируют хлороформом. Полученный экстракт промывают, сушат и концентрируют при пониженном давлении. Остаток очищают на хроматографической колонке с силикагелем (элюент: хлороформ:метанол = 20:1), и далее перекристаллизовывают из смеси гексана и этилацетата до получения (3Z, 4E)-3-(3-хлор- 4,5-диметокси-  -метилбензилиден)-4-(4-пиридил-метилиден)- пирролидин-2,5-диона (82 мг). Выход: 11,1%. Т.пл. более 194oC (с разложением).
ИК: 1721, 1599, 1491, 1328, 1049 см-1.
(2) Полученный ранее продукт (75 мг) растворяют в смеси тетрагидрофурана (1 мл) и диоксана (1 мл), и к этому добавляют 4 н. раствор хлористого водорода в диоксане (0,054 мл), и полученную смесь перемешивают при комнатной температуре для кристаллизации до получения твердого вещества бледно-желтого цвета. Полученную смесь концентрируют при пониженном давлении для удаления растворителя, а остаток тщательно растирают с диэтиловым эфиром, и полученное перемешивают далее в смеси метанола и диэтилового эфира при комнатной температуре для кристаллизации до получения (3Z,4E)-3-(3-хлор-4,5-диметокси- -метилбензилиден)-4-(4-пиридил-метилиден)- пирролидин-2,5-диона (82 мг). Выход: 11,1%. Т.пл. более 194oC (с разложением).
ИК: 1721, 1599, 1491, 1328, 1049 см-1.
(2) Полученный ранее продукт (75 мг) растворяют в смеси тетрагидрофурана (1 мл) и диоксана (1 мл), и к этому добавляют 4 н. раствор хлористого водорода в диоксане (0,054 мл), и полученную смесь перемешивают при комнатной температуре для кристаллизации до получения твердого вещества бледно-желтого цвета. Полученную смесь концентрируют при пониженном давлении для удаления растворителя, а остаток тщательно растирают с диэтиловым эфиром, и полученное перемешивают далее в смеси метанола и диэтилового эфира при комнатной температуре для кристаллизации до получения (3Z,4E)-3-(3-хлор-4,5-диметокси- -метилбензилиден)- 4-(4-пиридилметилиден)-пирролидин-2,5-дионгидрохлорида (70 мг). Строение и физические свойства представлены в таблице 14. Выход: 85,3%. Т.плавления более 200oC (с разложением).
ИК: 1728, 1634, 1491, 1312 см-1.
Примеры 55-58 -метилбензилиден)- 4-(4-пиридилметилиден)-пирролидин-2,5-дионгидрохлорида (70 мг). Строение и физические свойства представлены в таблице 14. Выход: 85,3%. Т.плавления более 200oC (с разложением).
ИК: 1728, 1634, 1491, 1312 см-1.
Примеры 55-58Соответствующие исходные соединения обрабатывают по способу примера 54 до получения соединений, представленных в таблице 14. Пример 59 (1) К раствору трет-бутоксида калия (16,8 г) в трет-бутиловом спирте (150 мл) прикапывают при перемешивании раствор бензальдегида (15,9 г) и диметилсукцината (26,3 г) в трет-бутиловом спирте (20 мл) при комнатной температуре, и полученную смесь перемешивают в течение 30 минут. Реакционную смесь выливают в смесь лед – вода (200 мл), и полученную смесь экстрагируют изопропиловым эфиром. pH водного слоя доводят до pH 2-3, и экстрагируют этилацетатом. Полученный экстракт промывают, сушат и концентрируют при пониженном давлении. Остаток растворяют в смеси толуола (50 мл) и монометилового эфира этиленгликоля (50 мл), и к этому прикапывают тионилхлорид (16,4 мл) при 0oС. Полученную смесь оставляют выстаиваться при комнатной температуре в течение ночи, и затем концентрируют при пониженном давлении. Остаток очищают на хроматографической колонке с силикагелем (элюент: гексан:этилацетат = 4:1) до получения 2-метоксиэтилового эфира (Е)-3-метоксикарбонил-4-фенил-3-бутеновой кислоты (26,9 г). Выход: 65%. (2) Раствор вышеполученного продукта (14 г) и 3-циклопентилокси-4-метоксибензальдегида (11,1 г) в трет-бутиловом спирте (100 мл) прикапывают к раствору трет-бутоксида калия (6,2 г) в трет-бутиловом спирте (40 мл) при комнатной температуре, и полученную смесь перемешивают при той же температуре в течение часа. Реакционную смесь выливают в воду, и полученную смесь экстрагируют диизопропиловым эфиром. pH водного слоя устанавливают равным 2-3 соляной кислотой и экстрагируют этилацетатом. Полученный экстракт промывают, сушат и концентрируют при пониженном давлении для удаления растворителя. Остаток промывают диэтиловым эфиром до получения метилового сложного эфира (E)-2-[(E)-3-циклопентилокси-4-метоксибензилиден]-3-карбокси- 4-фенил-3-бутеновой кислоты (23,4 г). Выход 67%. (3) К раствору вышеполученного продукта (5,0 г) в 100 мл хлороформа добавляют несколько капель N,N-диметилформамида и тионилхлорид (0,82 мл), и полученную смесь кипятят с обратным холодильником в течение 30 минут. Полученный раствор прикапывают при интенсивном перемешивании в 2-пиколиламин при охлаждении льдом. Полученную смесь перемешивают далее в течение 30 минут и органический слой отделяют, промывают, сушат и концентрируют при пониженном давлении. Остаток очищают на хроматографической колонке с силикагелем (элюент: хлороформ: ацетон = 5:1) до получения (1E,3E)- 1-(3-циклопентилокси-4-метоксибензилиден)-2-(2-метоксиэтокси- карбонил)-3-(2-пиридилметиламинокарбонил)-4-фенилбутадиена (2,7 г). Выход: 24%. (4) К раствору вышеуказанного продукта (2,7 г) в 20 мл тетрагидрофурана добавляют 4 н. раствор хлористого водорода в диоксане (1,33 мл) и полученную смесь перемешивают в течение 10 минут. Эту смесь концентрируют при пониженном давлении для удаления растворителя и остаток кристаллизуют из изопропилового эфира до получения (1E,3E)-1-(3-циклопентилокси-4-метоксибензилиден) -2-(2-метоксиэтокси-карбонил)-3-(2-пиридилметиламинокарбонил) -4-фенил-бутадиен- гидрохлорида (1,9 г). Строение и физические свойства его представлены в таблице 15. Выход: 66%. Т.плавления 167-168oC. Примеры 60-85 Соответствующие исходные соединения обрабатывают тем же способом, что и в примере 59, до получения соединений, представленных в таблицах 15-20. Пример 86 (1) К раствору соединения (1,17 г), полученного в примере 59-(4), в 10 мл тетрагидрофурана добавляют 2 н. водный раствор гидроксида натрия (10 мл), и полученную смесь перемешивают при комнатной температуре в течение 10 минут. К этой смеси добавляют 2 н. соляную кислоту и полученную смесь концентрируют при пониженном давлении. К остатку добавляют хлороформ и полученную смесь промывают, сушат и концентрируют при пониженном давлении до получения (3E,4E)-3-(3-циклопентилокси-4-метоксибензилиден)-4- бензилиден-1-(2-пиридилметил)-пирролидин-2,5-диона (1,1 г). Выход: 98%. (2) К раствору вышеуказанного продукта (1,1 г) в 10 мл тетрагидрофурана добавляют 4 н. раствор хлористого водорода в диоксане (0,7 мл) при 0oC и полученную смесь перемешивают в течение 10 минут. Эту смесь концентрируют при пониженном давлении, и остаток кристаллизуют из эфира до получения (3E, 4E)-3-(3- циклопентилокси-4-метоксибензилиден)-4-бензилиден-1-(2- пиридилметил)-пирролидин-2,5-дионгидрохлорида (1,1 г). Его строение и физические свойства представлены в таблице 21. Выход: 88%. Т.плавления 134-135oC. Примеры 87-103 Соответствующие исходные соединения обрабатывают по способу примера 86 до получения соединений, представленных в таблицах 21-24. Примеры 104-107 Соответствующие исходные соединения обрабатывают по способу примера 23-(1) и полученные таким образом продукты очищают на хроматографической колонке с силикагелем для выделения (1E,3E)-изомеров из смеси, которые далее А обрабатывают по способу примера 2 до получения соединений, представленных в таблице 25. Пример 108 Соответствующие исходные соединения обрабатывают по способу примеров 23-(1) и 23-(2) до получения соединений, представленных в таблице 25. Примеры 109-111 Соответствующие исходные соединения обрабатывают по способу примера 6 до получения соединений, представленных в таблице 26. Пример 112 Соответствующие исходные соединения обрабатывают по способу примера 5 до получения соединений, представленных в таблице 26. Примеры 113-116 Соответствующие исходные соединения обрабатывают по способу примера 11 до получения соединений, представленных в таблице 27. Примеры 117-130 Соответствующие исходные соединения обрабатывают по способу примера 1-(1) до 1-(6) до получения соединений, представленных в таблицах 28 и 29. Примеры 131-144 Соответствующие исходные соединения обрабатывают по способу примеров 1-(1), 1-(2), 1-(5) и 1-(6) или примера 23 до получения соединений, представленных в таблицах 30 и 31. Пример 145 (1) 3,5-Диметоксиацетофенон (246 г) и диметиловый сложный эфир (E)-бензилиденянтарной кислоты (320 г) растворяют в трет-бутиловом спирте (1300 мл) и к этому добавляют трет-бутоксид калия (168,6 г) при комнатной температуре, и полученную смесь перемешивают. Эту смесь охлаждают до комнатной температуры и эту смесь перемешивают далее при той же температуре в течение двух часов. К реакционной смеси добавляют воду (3 л) и диизопропиловый эфир (700 мл), и выделяют водный слой. К оставшемуся органическому слою добавляют воду и водный слой выделяют. Водные слои объединяют, pH устанавливают равным 2-3 концентрированной соляной кислотой. Полученный маслянистый продукт экстрагируют этилацетатом, полученный экстракт сушат и концентрируют до получения маслянистого 1-метил-1-(3,5-диметоксифенил)-2-метоксикарбонил- 3-карбокси-4-фенилбутадиена (580 г), который представляет смесь (1Z,3E)-изомера и (1E, 3E)-изомера. Полученный таким образом маслянистый продукт растворяют в смеси диизопропиловый эфир-гексан и полученную смесь перемешивают при комнатной температуре, а выпавшие в осадок кристаллы собирают. К этим кристаллам добавляют этилацетат (1 л), и полученную смесь нагревают примерно при 80oC, а оставшиеся кристаллы собирают фильтрованием до получения (1E, 3E)-1-метил-1-(3,5-диметоксифенил)-2-метоксикарбонил-3- карбокси-4-фенилбутадиена (то же соединение, что и соединение в примере 135) (117 г). Маточный раствор (фильтрат) концентрируют и к остатку добавляют 700 мл этилацетата, и в него добавляют (1Z,3E)-изомер в качестве затравки. Полученную смесь перемешивают, а выпавшие в осадок кристаллы собирают, получая (1Z,3E)-1-метил-1-(3,5- диметоксифенил)-2-метоксикарбонил-3-карбокси-4-фенилбутадиен (то же соединение, что и в примере 121) (192 г). (2) (1Z, 3E)-1-метил-1-(3,5-диметоксифенил)-2-метокси- карбонил-3-карбокси-4-фенилбутадиен (487 г) растворяют в метиленхлориде (1000 мл) и к этому добавляют N,N-диметилформамид (1 мл). К этой смеси прикапывают оксазолилхлорид (133,3 мл) и полученную смесь перемешивают в течение одного часа. Реакционную смесь концентрируют, а остаток растворяют в тетрагидрофуране (4 л) и к этому добавляют по каплям смесь триэтиламина (214 мл) и 1-амино-4-метилпиперазина (168 мг) при 0oC. Реакционную смесь экстрагируют этилацетатом и полученный экстракт сушат, концентрируют и остаток кристаллизуют из диизопропилового эфира до получения (1Z,3E)-1-метил-1-(3,5- диметоксифенил)-2-метоксикарбонил-3-[N-(4-метилпиперазин-1-ил) аминокарбонил]-4-фенил-бутадиена (490 г). Выход 81%. Т.плавления 117-121oC. (3) Полученный ранее продукт (268 г) растворяют в хлороформе, и к этому добавляют 4 н. соляную кислоту в этилацетате (125 мл) при 0oC. Полученную смесь выливают в охлажденный диэтиловый эфир и выпавшие в осадок кристаллы собирают фильтрованием, получая (1Z,3E)-1-метил-1-(3, 5-диметоксифенил)-2-метоксикарбонил-3-[N-(4-метилпиперазин-1 -ил)-аминокарбонил]-4-фенилбутадиен моногидрохлорид (то же соединение, что и в примере 147) (278 г). Выход: 97%. Т. плавления более 234oC (с разложением). Пример 146 (1E, 3E)-1-метил-1-(3,5-диметоксифенил)-2-метокси- карбонил-3-карбокси-4-фенилбутадиен (114 г), полученный в примере 145-(1), суспендируют в трет-бутиловом спирте и к этому добавляют трет-бутоксид калия (40,1 г), и полученную смесь перемешивают. Реакционной смеси дают остыть до комнатной температуры и далее перемешивают в течение двух часов. Реакционную смесь обрабатывают по способу примера 145 до получения (1E,3E)-1-метил-1-(3,5-диметоксифенил)-2- метоксикарбонил-3-карбокси-4-фенилбутадиена (то же соединение, что и соединение примера 135) (32 г) и (1Z,3E)-1-метил-1-(3,5- диметоксифенил)-2-метоксикарбонил-3-карбокси-4-фенилбутадиена (то же соединение, что и соединение примера 121) (61,5 г). Примеры 147-174 Соответствующие исходные соединения обрабатывают по способу примера 11 до получения соединений, представленных в таблицах 32-36. Примеры 175-179 Соответствующие исходные соединения обрабатывают по способу примера 49 до получения соединений, представленных в таблице 37. Пример 180 (1) Трет-бутоксид калия (14,2 г) растворяют в трет-бутиловом спирте (120 мл) и к этому добавляют по каплям раствор 3,5-диметокси-бензальдегида (20 г) и диметилсукцината (21,1 г) в тетрагидрофуране. Полученную смесь перемешивают при комнатной температуре в течение 30 минут и к смеси добавляют воду и изопропиловый эфир. Водный слой выделяют, а оставшийся органический слой дополнительно экстрагируют водой. Водные слои объединяют, и их pH доводят до pH 2-3 концентрированной соляной кислотой. Полученный маслянистый продукт экстрагируют этилацетатом, экстракт сушат, концентрируют при пониженном давлении до получения метилового сложного эфира 4-(3,5- диметоксифенил)-3-карбокси-3-бутеновой кислоты (42 г) в виде маслянистого продукта. (2) Полученный ранее продукт растворяют в метаноле (200 мл) и к этому добавляют концентрированную серную кислоту (2 мл), и полученную смесь кипятят с обратным холодильником в течение 13 часов. Реакционную смесь концентрируют и к этому добавляют воду и диэтиловый эфир. Органический слой собирают, промывают и концентрируют при пониженном давлении. Полученный остаток очищают на хроматографической колонке с силикагелем (элюент: этилацетат:гексан = 1:4) до получения диметилового сложного эфира (Е)-2-(3,5-диметоксибензилиден) янтарной кислоты (18,4 г). Выход: 52%. (3) Полученный ранее продукт (18,4 г) и 3,5-диметоксиацетофенон (11,83 г) растворяют в трет-бутиловом спирте (70 мл), и к этому добавляют трет-бутоксид калия (8,42 г), и полученную смесь перемешивают. Реакционную смесь перемешивают в течение двух часов, и к этому добавляют воду и изопропиловый эфир. Водный слой выделяют, и оставшийся органический слой экстрагируют водой. Водные слои объединяют, их pH устанавливают равным 2-3 концентрированной соляной кислотой. Полученный маслянистый продукт экстрагируют этилацетатом, полученный экстракт сушат и концентрируют при пониженном давлении. Изопропиловый эфир добавляют к остатку, и выпавшие в осадок кристаллы собирают фильтрованием до получения (1Z, 3E)-1-метил-1-(3,5-диметоксифенил)-2-метокси-карбонил-3- карбокси-4-(3,5-диметоксифенил)бутадиена (4,74 г). Выход 17,1%. (4) Маточный раствор (фильтрат) концентрируют, а изопропиловый эфир добавляют к остатку. Полученную смесь перемешивают при комнатной температуре, и выпавшие в осадок кристаллы собирают, получая 1-метил-1-(3,5-диметоксифенил)-2-метоксикарбонил-3- карбокси-4-(3,5-диметоксифенил)бутадиен (9,2 г) в форме смеси (1Z,3E)-изомера и (1E,3E)-изомера. Выход 33,3%. (5) Полученную ранее смесь (9,0 г) суспендируют в трет-бутиловом спирте (50 мл) и к этому добавляют трет-бутоксид калия (2,51 г). Полученную смесь перемешивают при комнатной температуре в течение 2 часов, а затем подкисляют, добавляя воду и 12 н. соляную кислоту. Полученную смесь экстрагируют этилацетатом, экстракт сушат и концентрируют. К остатку добавляют диизопропиловый эфир (30 мл), и полученную смесь перемешивают при 0oC. Выпавшие в осадок кристаллы собирают до получения (1Z,3E)-1-метил-1-(3,5- диметоксифенил)-2-метоксикарбонил-3-карбокси-4-(3,5- диметоксифенил)бутадиена (3,6 г). Выход 13,0%. Т.плавления 137-140oC. ИК: 1724, 1670, 1591, 1423, 1206, 1156 см-1. (6) (1Z, 3E)-1-метил-1-(3,5-диметоксифенил)-2-метокси- карбонил-3-карбокси-4-(3,5-диметоксифенил) бутадиен (1,70 г) растворяют в дихлорметане (20 мл), и к этому добавляют каталитическое количество N,N-диметилформамида и оксалилхлорид (0,4 мл). Полученную смесь перемешивают при комнатной температуре в течение одного часа и реакционную смесь концентрируют. К остатку добавляют тетрагидрофуран (20 мл) и полученную смесь прикапывают к раствору 1-метилпиперазина (462 мг) и триэтиламина (0,65 мл) в 20 мл тетрагидрофурана, и полученную смесь перемешивают при 0oC в течение 30 минут. К реакционной смеси добавляют воду и этилацетат и органический слой собирают. Оставшийся водный слой экстрагируют этилацетатом. Органические слои объединяют, сушат и концентрируют. Остаток очищают на хроматографической колонке с силикагелем (элюент: хлороформ:метанол = 30:1) до получения (1Z,3E)-1-метил- 1-(3,5-диметоксифенил)-2-метокси-карбонил-3-(4-метилпиперазин- 1-ил)карбонил-4-(3,5-диметоксифенил)бутадиена (2,0 г). Выход: 99,2%. ИК: 1727, 1591, 1425, 1200, 1155 см-1. (7) Полученный ранее продукт (2,0 г) растворяют в хлороформе (10 мл) и к этому добавляют 4 н. соляную кислоту в этилацетате (1,05 мл) при 0oC, и полученную смесь перемешивают несколько минут. К реакционной смеси добавляют диметиловый эфир и полученную смесь перемешивают. Выпавшие в осадок кристаллы собирают фильтрованием до получения (1Z,3E)-1- метил-1-(3,5-диметоксифенил)-2-метоксикарбонил-3-(4- метилпиперазин-1-ил)карбонил-4-(3,5-диметоксифенил) бутадиен  моногидрохлорида (1,70 г). Строение и физические свойства представлены в таблице 38.
Выход 79,5%. Т.плавления более 133oC (с разложением).
ИК: 3436, 1725, 1591, 1425, 1206, 1156 см-1.
Примеры 181-183 моногидрохлорида (1,70 г). Строение и физические свойства представлены в таблице 38.
Выход 79,5%. Т.плавления более 133oC (с разложением).
ИК: 3436, 1725, 1591, 1425, 1206, 1156 см-1.
Примеры 181-183Соответствующие исходные соединения обрабатывают по способу примера 180 до получения соединений, перечисленных в таблице 38. Пример 184 Соответствующие исходные соединения обрабатывают по способу примера 26 до получения соединения, указанного в таблице 39. Примеры 185-189 Соответствующие исходные соединения обрабатывают по способу примера 11 до получения соединений, представленных в таблице 40. Промышленная применимость Производные бутадиена (1-а), производные амидобутадиена (1-b) и производные пирролидина (2) настоящего изобретения и их фармацевтически приемлемые соли демонстрируют превосходную активность по ингибированию РАI-1, и, следовательно, их можно использовать для профилактики или лечения различных тромбозов, таких как инфаркт миокарда, тромбы внутри предсердия, приводящие к мерцанию предсердий, артериальный склероз, грудная жаба, удар, инфаркт легкого, тромбоз глубоких вен (DVT), синдром диссеминированного внутрисосудистого коагулирования (DIC), диабетические осложнения, рестеноз после чрескожной транслюминальной коронарной ангиопластики (РТСА) и т.д. Кроме того, соединения настоящего изобретения (1-а), (1-b) и (2) также демонстрируют прекрасную биодоступность, безопасность в качестве медикаментов и стабильность, и, следовательно, они обладают низкой токсичностью и безопасностью при использовании в качестве лекарства. Среди соединений настоящего изобретения (1-b) особенно соединения с транс(Е)-конфигурацией относительно двойной связи, связывающей кольцо В, и цис(Z)-конфигурацией относительно двойной связи, связывающей кольцо А, демонстрируют (i) высокую растворимость в воде, (ii) высокую стабильность в процессе метаболизма в печени, (iii) низкую токсичность в отношении печени и хромосом, (iv) высокую светостабильность. Экспериментальные данные Ингибирующую активность образования ингибитора активатора плазминогена типа 1 (РАI-1) исследуют in vitro: Изучалось влияние испытываемых соединений на образование РАI-1, вызванного липополисахаридом (ЛПС) или трансформирующим фактором роста-  (ТФР- (ТФР- ) в культуре бычьих ангиоэндотелиальных клеток. Т.е. ингибирующая активность испытываемых соединений на образование РАI-1 in vitro определялась по методике, описанной в J.Biochemistry, v. 120, pp. 1203-1206 (1996). Бычьи каротидные эндотелиальные клетки культивировали в ростовой среде, которую готовили из E’MEM-среды (изготавливаемой Nissui Seiyku Kabushikaisha), содержащей 10% фетальную телячью сыворотку (FCS) и 2 мМ L-глутамина, культивирование проводили в 24-луночной микропланшете. Затем ростовую среду заменяли E’MEM-средой, исключая FCS, и микропланшету инкубировали в течение 24 ч. После инкубации среду дополнительно меняли на E’MEM-среду, исключая FCS, и в нее добавляют (i) испытываемое вещество (конечная концентрация: 1 мкМ) и ЛПС (3 мкг ) в культуре бычьих ангиоэндотелиальных клеток. Т.е. ингибирующая активность испытываемых соединений на образование РАI-1 in vitro определялась по методике, описанной в J.Biochemistry, v. 120, pp. 1203-1206 (1996). Бычьи каротидные эндотелиальные клетки культивировали в ростовой среде, которую готовили из E’MEM-среды (изготавливаемой Nissui Seiyku Kabushikaisha), содержащей 10% фетальную телячью сыворотку (FCS) и 2 мМ L-глутамина, культивирование проводили в 24-луночной микропланшете. Затем ростовую среду заменяли E’MEM-средой, исключая FCS, и микропланшету инкубировали в течение 24 ч. После инкубации среду дополнительно меняли на E’MEM-среду, исключая FCS, и в нее добавляют (i) испытываемое вещество (конечная концентрация: 1 мкМ) и ЛПС (3 мкг мл), или (ii) испытываемое соединение (конечная концентрация: 2 мкг) и ТФР- мл), или (ii) испытываемое соединение (конечная концентрация: 2 мкг) и ТФР- (0,3 нг (0,3 нг мл), микропланшету инкубировали в течение 24 ч, отбирали культуральный супернатант. Количество антигена РАI-1 в культуральном супернатанте определяли методом ELISA, используя коммерчески доступный набор для РАI-1 “Imulyse РАI-1” (производимый Biopool АВ, Швеция). Ингибирующю активность (скорость ингибирования) испытываемых соединений на образование РАI-1 подсчитывают по следующему уравнению 1. Влияние испытываемых соединений на образование РАI-1, вызванных ЛПС, показано в таблице 41 и, вызванных ТФР- мл), микропланшету инкубировали в течение 24 ч, отбирали культуральный супернатант. Количество антигена РАI-1 в культуральном супернатанте определяли методом ELISA, используя коммерчески доступный набор для РАI-1 “Imulyse РАI-1” (производимый Biopool АВ, Швеция). Ингибирующю активность (скорость ингибирования) испытываемых соединений на образование РАI-1 подсчитывают по следующему уравнению 1. Влияние испытываемых соединений на образование РАI-1, вызванных ЛПС, показано в таблице 41 и, вызванных ТФР- , показано в таблице 42.
Уравнение 1 , показано в таблице 42.
Уравнение 1 A: количество PAI-1 антигена в случае, когда LPS и TGF добавляются к испытываемому соединению; B: количество РАI-1 антигена в случае, когда не добавляется ни испытываемое, ни LPS, ни TGF; C: количество РАI-1 антигена при добавлении LPS или TGF. Антикоагулирующая активность на моделе флевотромбоза у крыс: Модель флевотромбоза у крыс (тромбоз у крыс формируют комбинацией застоя и гиперкоагуляции потока крови) воспроизводят на мужской особи крыс Wister весом 250-380 г методом, раскрытым в Thrombosis Research, v.54, 399-410. Раствор испытываемого соединения растворяют или суспендируют в водном растворе Nikkol HCO-60 (конечная концентрация: 0,1%) в концентрации 3 мг/10 мл, чтобы получить раствор испытываемого соединения. Этот раствор принудительно вводят испытуемым животным один раз в день в течение 3-х дней в дозе 10 мл/кг, используя гастрозоид для орального введения. Крысам контрольной группы вводят только 0,1% вводный раствор Nikkol HCO-60, как указано выше. Спустя два часа после последнего введения испытываемого соединения крысам делают инъекцию тромбопластина. Антикоагулирующую активность испытываемых соединений рассчитывают по уравнению 2. Результаты представлены в таблице 43. Уравнение 2:  Токсичность: Соединение по примеру 169 в твердом виде принудительно орально вводят крысам в течение 14 дней в дозе 300 мг/кг, при этом не фиксировалось смерть крыс. Таким образом, можно сделать вывод о нетоксичности предложенных соединений. Формула изобретения
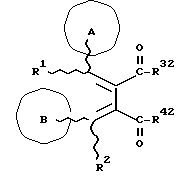 где кольцо А представляет пиридиновое, пиримидиновое или бензольное кольцо, которое может быть необязательно замещено двумя-тремя группами, выбранными из C1-6алкоксигруппы, C3-10циклоалкилоксигруппы, нитрогруппы, гидроксигруппы, ди-C1-6алкиламиногруппы и атома галоида; кольцо В представляет пиридиновое, оксозамещенное пиридиновое, пиримидиновое, бензольное или C1-4алкилендиокси замещенное бензольное кольцо; R1 представляет C1-6алкильную группу; R2 представляет атом водорода; группа -COR32 представляет C2-7алкоксикарбонил или C1-6алкоксизамещенный C2-7алкоксикарбонил; группа -COR42 представляет карбоксильную группу, при условии, что (а) оба кольца А и В одновременно не являются незамещенными бензольными кольцами, и (b) если кольцо A представляет три-C1-6алкоксибензольное кольцо, тогда кольцо В представляет пиридиновое, оксозамещенное пиридиновое или пиримидиновое кольцо или, по крайней мере, один из R1 и R2 представляет C1-6алкильную группу, или его фармацевтически приемлемые соли. 2. Производное амидобутадиена формулы (1-b) 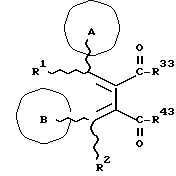 где кольцо А представляет пиридиновое, пиримидиновое или бензольное кольцо, которое может быть необязательно замещено двумя-тремя группами, выбранными из C1-6алкоксигруппы, C3-10циклоалкилокси группы, нитрогруппы, гидроксигруппы, ди-C1-6алкиламиногруппы и атома галоида; кольцо В представляет пиридиновое, оксозамещенное пиридиновое, пиримидиновое, бензольное или C1-4алкилендиоксизамещенное бензольное кольцо; R1 представляет C1-6алкильную группу, R2 представляет водород, группа -COR33 представляет C2-7алкоксикарбонил или C1-6алкоксизамещенный C2-7алкоксикарбонил; -COR43 представляет карбамоильную группу, которая может быть необязательно замещена одной группой, выбранной из пиридильной, оксозамещенной пиридильной группы, аминозамещенной пиридильной группы, C1-6алкоксизамещенной пиридильной группы, C1-6алкилзамещенной пиперидильной группы, C1-6алкилзамещенной пиперазинильной группы, пиперазинильной группы, замещенной C1-6алкилом и оксогруппой, C1-6алкилзамещенной изоксазолильной группы, пиразолильной группы, триазолильной группы, пиридилзамещенной C1-6алкильной группы, оксозамещенной пиридил-C1-6алкильной группы, ди-C1-6алкилфенильной группы, морфолинофенильной группы, C1-6алкилпиперазинилкарбонилфенильной группы, гидрокси-C1-6алкильной группы и ди-C1-6алкиламиногруппы, или группу формулы  где кольцо (а) представляет пиперазинильную группу, пиперидильную группу, морфолиновую группу, пиразолилгруппу, причем эти группы, необязательно, замещены C1-6алкильной или аминогруппой, при условии, что (а) оба кольца А и В одновременно не являются незамещенными бензольными кольцами, и (b) если кольцо А представляет три-C1-6алкоксибензольное кольцо, тогда кольцо В представляет пиридиновое кольцо, оксозамещенное пиридиновое кольцо или пиримидиновое кольцо, или, по крайней мере, один из R1 и R2 представляет C1-6алкильную группу, или его фармацевтически приемлемая соль. 3. Соединение по п.2, отличающееся тем, что кольцо А представляет бензольное кольцо, замещенное двумя или тремя группами, выбранными из метоксигруппы, циклопентилоксигруппы, нитрогруппы, гидроксигруппы, диметиламиногруппы и атома хлора, R1 представляет метильную группу, группа -COR33 представляет метоксикарбонильную группу, изопропилоксикарбонильную группу или 2-метоксиэтоксикарбонильную группу, группа -COR43 представляет карбамоильную группу, необязательно замещенную одной группой, выбранной из пиридилметильной группы, 2-аминопиридильной группы, пиридильной группы, 1-оксопиридильной группы, 4-метилпиперазинильной группы, 4-метил-4-оксопиперазинильной группы, 1-метилпиперидильной группы, 5-метилизоксазолильной группы, 3-пиразолильной группы, 1,3,4-триазолильной группы, 1-оксопиридилметильной группы, диметиламиноэтильной группы, гидроксиэтильной группы и диметиламиногруппы, или его фармацевтически приемлемые соли. 4. Производное пирролидина формулы (2) 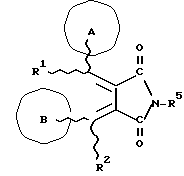 где кольцо А представляет пиридиновое, пиримидиновое или бензольное кольцо, которое может быть необязательно замещено двумя-тремя группами, выбранными из C1-6алкоксигруппы, C3-10циклоалкилокси группы, нитрогруппы, гидроксигруппы, ди-C1-6алкиламиногруппы и атома галоида; кольцо В представляет пиридиновое, оксозамещенное пиридиновое, пиримидиновое, бензольное или C1-4алкилендиоксизамещенное бензольное кольцо; R1 представляет C1-6алкильную группу; R2 представляет водород; R5 представляет пиридилзамещенную C1-6алкильную, ди-C1-6алкиламино-C1-6алкильную группу, гидрокси-C1-6алкильную, ди-C1-6алкиламиногруппу, или C1-6алкилзамещенную пиперазинильную группу, при условии, что (а) оба кольца А и В одновременно не являются незамещенными бензольными кольцами, и (b) если кольцо А представляет три-C1-6алкоксибензольное кольцо, тогда кольцо В представляет пиридиновое кольцо, оксозамещенное пиридиновое кольцо или пиримидиновое кольцо, или, по крайней мере, один из R1 и R2 представляет C1-6алкильную группу, или его фармацевтически приемлемая соль. 5. Соединение по п. 4, отличающееся тем, что кольцо А представляет бензольное кольцо, замещенное двумя или тремя группами, выбранными из метоксигруппы, циклопентилоксигруппы, нитрогруппы, гидроксигруппы, диметиламиногруппы и атома хлора, R1 представляет метильную группу, R5 представляет атом водорода, пиридилметильную группу, диметиламиноэтильную группу, гидроксиэтильную группу, диметиламиногруппу или 4-метилпиперазинильную группу, или его фармацевтически приемлемые соли. 6. Соединение по любому из пп.2 и 3, отличающееся тем, что конфигурация относительно двойной связи, связанной с кольцом В, является транс(Е)-конфигурацией, а конфигурация относительно двойной связи, связанной с кольцом А, является цис(Z)-конфигурацией, или его фармацевтически приемлемые соли. 7. Соединение по любому из пп.4 и 5, отличающееся тем, что конфигурация относительно двойной связи, связанной с кольцом В является транс(E)-конфигурацией или его фармацевтически приемлемые соли. 8. Соединение по п.2, выбранное из: (1Z, 3E)-1-метил-1-(3,5-диметоксифенил)-2-метоксикарбонил-3-[N-(4-метилпиперазин-1-ил)аминокарбонил]-4-фенилбутадиена; (1Z, 3E)-1-мeтил-1-(3,5-димeтoкcифeнил)-2-метоксикарбонил-3-[N-(4-пиридил)аминокарбонил]-4-(3,4-метилендиоксифенил)бутадиена; (1Z, 3E)-1-метил-1-(3,5-диметоксифенил)-2-метоксикарбонил-3-[N-(4-пиридилметил)аминокарбонил]-4-фенилбутадиена; (1Z, 3Е)-1-метил-1-(3-хлор-4,5-диметоксифенил)-2-метоксикарбонил-3-[N-(3-пиридилметил)аминокарбонил]-4-фенилбутадиена и (1Z, 3E)-1-метил-1-(3-хлор-4,5-диметоксифенил)-2-метоксикарбонил-3-аминокарбонил-4-(4-пиридил)бутадиена или его фармацевтически приемлемые соли. 9. Соединение по п. 2, которое представляет собой (1Z,3E)-1-метил-1-(3,5-диметоксифенил)-2-метокси-карбонил-3-[N-(4-метилпиперазин-1-ил)аминокарбонил]-4-фенилбутадиен или его фармацевтически приемлемая соль. 10. Соединение по п.2, которое представляет собой (1Z,3E)-1-метил-1-(3,5-диметоксифенил)-2-метокси-карбонил-3-[N-(4-пиридил)аминокарбонил] -4-(3,4-метилендиоксифенил)бутадиена или его фармацевтически приемлемые соли. 11. Соединение по п.8, которое выбирают из: (3Z, 4E)-3-(3,5-диметокси-  -метилбензилиден)-4-бензилиден-1-(4-пиридилметил)пирролидин-2,5-диона; -метилбензилиден)-4-бензилиден-1-(4-пиридилметил)пирролидин-2,5-диона;(3Z, 4E)-3-(3-xлop-4,5-димeтoкcи-  -мeтилбeнзилидeн)-4-(4-пиридилметилиден)пирролидин-2,5-диона -мeтилбeнзилидeн)-4-(4-пиридилметилиден)пирролидин-2,5-диона(3Z, 4E)-3-(3-метокси-4-циклопентилокси-  -метилбензилиден)-4-(4-пиридилметилиден)пирролидин-2,5-диона -метилбензилиден)-4-(4-пиридилметилиден)пирролидин-2,5-диона(3Z, 4E)-3-(3-циклoпeнтилoкcи-4-мeтoкcи-  -мeтилбeнзилидeн)-4-(4-пиридилметилиден)пирролидин-2,5-диона и -мeтилбeнзилидeн)-4-(4-пиридилметилиден)пирролидин-2,5-диона и(3Z,4Е)-3-(3,5-диметокси-  -метилбензилиден)-4-(4-пиридилметилиден)пирролидин-2,5-диона -метилбензилиден)-4-(4-пиридилметилиден)пирролидин-2,5-дионаили их фармацевтически приемлемые соли. 12. Способ получения производного бутадиена формулы (1-a) 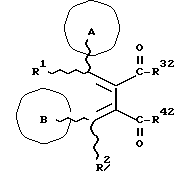 где кольцо А представляет пиридиновое, пиримидиновое или бензольное кольцо, которое может быть необязательно замещено двумя-тремя группами, выбранными из C1-6алкоксигруппы, C3-10циклоалкилокси группы, нитрогруппы, гидроксигруппы, ди-C1-6алкиламиногруппы и атома галоида; кольцо В представляет пиридиновое, оксозамещенное пиримидиновое, бензольное или C1-4алкилендиоксизамещенное замещенное бензольное кольцо; R1 представляет C1-6алкильную группу; R2 представляет атом водорода; группа -COR32 представляет C2-7алкоксикарбонил или C1-6алкоксизамещенный C2-7алкоксикарбонил; группа -COR42 представляет карбоксильную группу, при условии, что (а) оба кольца А и В одновременно не являются незамещенными бензольными кольцами, и (b) если кольцо А представляет три-C1-6алкоксибензольное кольцо, тогда кольцо В представляет пиридиновое, оксозамещенное пиридиновое или пиримидиновое кольцо или, по крайней мере, один из R1 и R2 представляет C1-6алкильную группу, или его фармацевтически приемлемые соли, отличающийся тем, что он включает обработку диэфирного соединения формулы (4) 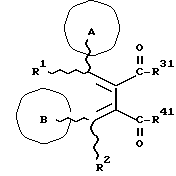 где кольцо А, кольцо В, R1 и R2 имеют указанные ранее значения, а группы -COR31– и -COR41 одинаковы или различны, и каждая представляет C2-7алкоксикарбонильную группу или C1-6алкоксизамещенный-C2-7алкоксикарбонильная группа, кислотой или основанием, при необходимости с последующим превращением продукта в его фармацевтически приемлемую соль. 13. Способ получения производного амидобутадиена формулы (1-b) 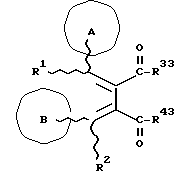 где кольцо А представляет пиридиновое, пиримидиновое или бензольное кольцо, которое может быть необязательно замещено двумя-тремя группами, выбранными из C1-6алкоксигруппы, C3-10циклоалкилокси группы, нитрогруппы, гидроксигруппы, ди-C1-6алкиламиногруппы и атома галоида; кольцо В представляет пиридиновое, оксозамещенное пиридиновое, пиримидиновое, бензольное или C1-4алкилендиоксизамещенное бензольное кольцо; R1 представляет C1-6алкильную группу; R1 представляет водород; группа -COR33 представляет C2-7алкоксикарбонил или C1-6алкоксизамещенный C2-7алкоксикарбонил; -COR43 представляет карбамоильную группу, которая может быть необязательно замещена одной группой, выбранной из пиридильной, оксозамещенной пиридильной группы, аминозамещенной пиридильной группы, C1-6алкоксизамещенной пиридильной группы, C1-6алкилзамещенной пиперидильной группы, C1-6алкилзамещенной пиперазинильной группы, пиперазинильной группы, замещенной C1-6алкилом и оксогруппой, C1-6алкилзамещенной изоксазолильной группы, пиразолильной группы, триазолильной группы, пиридилзамещенной C1-6алкильной группы, оксозамещенной пиридил-C1-6алкильной группы, ди-C1-6алкилфенильной группы, морфолинофенильной группы, C1-6алкилпиперазинилкарбонилфенильной группы, гидрокси-C1-6алкильной группы и ди-C1-6алкиламиногруппы, или группу формулы  где кольцо (а) представляет пиперазинильную группу, пиперидильную группу, морфолиновую группу, пиразолилгруппу, причем эти группы, необязательно, замещены C1-6алкильной или аминогруппой, при условии, что (а) оба кольца А и В одновременно не являются незамещенными бензольными кольцами, и (b) если кольцо А представляет три-C1-6алкоксибензольное кольцо, тогда кольцо В представляет пиридиновое кольцо, оксозамещенное пиридиновое кольцо или пиримидиновое кольцо, или по крайней мере один из R1 и R2 представляет C1-6алкильную группу или его фармацевтически приемлемая соль, отличающийся тем, что он включает взаимодействие соединения бутадиена формулы (1-а) 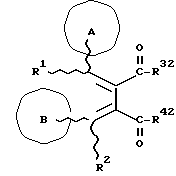 где кольцо А, кольцо В, R1 и R2 имеют указанные ранее значения; группа -COR32 представляет C2-7алкоксикарбонил или C1-6алкоксизамещенный C2-7алкоксикарбонил; группа -COR42 представляет карбоксильную группу, или его соли, или его реакционноспособного производного, с соединением формулы (5) H-R40 где R40 представляет замещенную или незамещенную аминогруппу, одной из групп, выбранной из пиридильной, оксозамещенной пиридильной группы, аминозамещенной пиридильной группы, C1-6алкоксизамещенной пиридильной группы, C1-6алкилзамещенной пиперидильной группы, C1-6алкилзамещенной пиперазинильной группы, пиперазинильной группы, замещенной C1-6алкилом и оксогруппой, C1-6алкилзамещенной изоксазолильной группы, пиразолильной группы, триазолильной группы, пиридилзамещенной C1-6алкильной группы, оксозамещенной пиридил-C1-6алкильной группы, ди-C1-6алкилфенильной группы, морфолинофенильной группы, C1-6алкилпиперазинилкарбонилфенильной группы, гидрокси-C1-6алкильной группы и ди-C1-6алкиламиногруппы, или группу формулы  где кольцо (а) представляет пиперазинильную группу, пиперидильную группу, морфолиновую группу, пиразолильную группу, причем эти группы, необязательно, замещены C1-6алкильной или аминогруппой, и, при необходимости, с последующим превращением продукта в его фармацевтически приемлемую соль. 14. Способ получения производного пирролидина формулы (2) 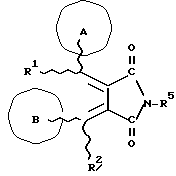 где кольцо А представляет пиридиновое, пиримидиновое или бензольное кольцо, которое может быть необязательно замещено двумя-тремя группами, выбранными из C1-6алкоксигруппы, C3-10циклоалкилокси группы, нитрогруппы, гидроксигруппы, ди-C1-6алкиламиногруппы и атома галоида, кольцо В представляет пиридиновое, оксозамещенное пиридиновое, пиримидиновое, бензольное или C1-4алкилендиоксизамещенное бензольное кольцо; R1 представляет C1-6алкильную группу; R2 представляет водород, R5 представляет пиридилзамещенную C1-6алкильную группу, гидрокси-C1-6алкильную группу, ди-C1-6алкиламиногруппу, или C1-6алкилзамещенную пиперазинильную группу, при условии, что если кольцо А представляет три-C1-6алкоксибензольное кольцо, тогда кольцо В представляет пиридиновое кольцо, оксозамещенное пиридиновое кольцо или пиримидиновое кольцо, или, по крайней мере один из R1 и R2 представляет C1-6алкильную группу, или его фармацевтически приемлемая соль, отличающийся тем, что он включает реакцию внутримолекулярной циклизации соединения формулы (1-c) или его соли 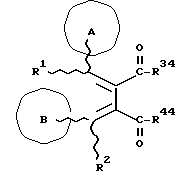 где кольцо А, кольцо В, R1 и R2 имеют указанные ранее значения; группа -COR34 представляет C2-7алкоксикарбонил или C1-6алкоксизамещенный C2-7алкоксикарбонил, карбоксильную группу; -COR44 представляет карбамоильную группу, которая может быть необязательно замещена одной группой, выбранной из C1-6алкилзамещенной пиперазинильной группы, пиридилзамещенной C1-6алкильной группы, гидрокси-C1-6алкильной группы и ди-C1-6алкиламиногруппы, и при необходимости с последующим превращением полученного продукта в его фармацевтически приемлемую соль. 15. Способ получения производного пирролидина формулы (2-b) 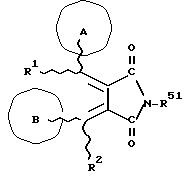 где кольцо А представляет пиридиновое, пиримидиновое или бензольное кольцо, которое может быть необязательно замещено двумя-тремя группами, выбранными из C1-6алкоксигруппы, C3-10циклоалкилокси группы, нитрогруппы, гидроксигруппы, ди-C1-6алкиламиногруппы и атома галоида; кольцо В представляет пиридиновое, оксозамещенное пиридиновое, пиримидиновое, бензольное или C1-4алкилендиоксизамещенное бензольное кольцо; R1 представляет C1-6алкильную группу, R2 представляет водород, R51 представляет атом пиридилзамещенную C1-6алкильную, ди-C1-6алкиламино-C1-6алкильную группу, гидрокси-C1-6алкильную, ди-C1-6алкиламиногруппу, или C1-6алкилзамещенную пиперазинильную группу, при условии, что (а) оба кольца А и В одновременно не являются незамещенными бензольными кольцами, и (b) если кольцо А представляет три-C1-6алкоксибензольное кольцо, тогда кольцо В представляет пиридиновое кольцо, оксозамещенное пиридиновое кольцо или пиримидиновое кольцо, или, по крайней мере, один из R1 и R2 представляет C1-6алкильную группу или его фармацевтически приемлемая соль, отличающийся тем, что он включает осуществление взаимодействия соединения формулы (2-а) 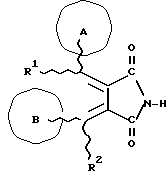 где кольцо А, кольцо В, R1 и R2 имеют указанные ранее значения, или его соли, с соединением формулы (3) R51-X где R51 имеет указанные ранее значения; X представляет атом галогена или сульфонилоксигруппу, и при необходимости, с последующим превращением полученного продукта в его фармацевтически приемлемую соль. Приоритет по пунктам и признакам: 29.03.96 – по пп.1 – 15, кроме значений “B-оксозамещенное пиридиновое кольцо, C1-6алкилендиоксизамещенное бензольное кольцо”; 26.03.97 – по пп.1 – 15, где B имеет значение оксозамещенное пиридиновое кольцо; 13.02.97 – по пп.1 – 15, где B имеет значение C1-6алкилендиоксизамещенное бензольное кольцо. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 27.03.2006
Извещение опубликовано: 20.12.2007 БИ: 35/2007
|
||||||||||||||||||||||||||
