Патент на изобретение №2167858
|
||||||||||||||||||||||||||
(54) N-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ АНИЛИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩИМ ДЕЙСТВИЕМ НА СИНТАЗУ ОКИСЛА АЗОТА, ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ, ПРОИЗВОДНЫЕ НИТРОФЕНИЛКАРБОНОВОЙ КИСЛОТЫ
(57) Реферат: Предложены новые производные анилина формулы (1), где R1 представляет SR6 или NR7R8, R6 представляет прямую или разветвленную алкильную группу и др. , R7 представляет атом водорода, прямую или разветвленную алкильную группу и др. , R8 представляет атом водорода, прямую или разветвленную алкильную группу, R2 представляет атом водорода, прямую или разветвленную алкильную группу и др. , R3 представляет атом водорода или прямую или разветвленную алкильную группу и др., R4 представляет атом водорода, прямую или разветвленную алкильную группу и др., R5 представляет атом водорода, прямую или разветвленную алкильную группу и др., Y1, Y2, Y3 и Y4 представляют атом водорода, галогена, гидроксигруппу и др., n и m каждый равны целому числу 0 или 1 , или возможные стереоизомеры или оптически активные формы соединений, или фармацевтически приемлемы их соли. Соединения обладают сильнодействующей ингибирующей активностью на синтазу окисла азота, и их используют в качестве терапевтических средств для лечения цереброваскулярных заболеваний, таких как внутримозговое кровоизлияние, инфаркт головного мозга, отек головного мозга и др. 40 с. и 55 з.п.ф-лы, 2 ил., 51 табл. 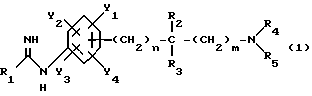
Изобретение относится к N-замещенным производным анилина, в частности к соединениям, представленным общей формулой (1), которые имеют ингибирующее действие на синтазу окисла азота (COA, NOS), которые подавляют получение окисла азота (OA, NO), и тем самым оказываются эффективными против патологии при цереброваскулярных заболеваниях, в частности при обтурирующих цереброваскулярных заболеваниях, в которые могут вовлекаться избыточный NO или NO-метаболиты, а также при травматических повреждениях головного мозга, припадке, головной боли и других болях, толерантности к морфину и зависимости от морфина, болезни Альцгеймера, болезни Паркинсона, септических шоках, хроническом ревматоидном артрите, остеоартрите, вирусных и невирусных инфекциях и диабете; кроме того, изобретение относится к возможным стереоизомерам и оптически активным формам соединений, фармацевтически приемлемым солям их, а также к способам предотвращения или лечения терапевтическими препаратами, содержащими их в качестве активного ингредиента. Предшествующий уровень техники Окклюзия или пониженное давление перфузии в мозговой артерии или сонной артерии благодаря определенному механизму вызывает ишемический некроз в ткани головного мозга и это состояние называют “церебральным инфарктом”. Церебральный инфаркт грубо классифицируют как церебральную эмболию и церебральный тромбоз в зависимости от вовлеченного механизма. Церебральная эмболия характеризуется образованием тромбов в мозговой артерии вследствие отрыва внутрисердечных сгустков крови или, редко, сгустков крови на артериальных стенках, и церебральный тромбоз первоначально базируется на склеротических повреждениях мозговых артерий, которые осложняются повышенной взкостью крови или пониженным давлением перфузии, приводя к окклюзии артерии, которая может развиться в ишемический некроз мозговой ткани (“NOKEKKANS HOGAI”, под ред. Hisao MANABE and Teruo OMAE, опубл. Life Science, pp. 54-55, 1992). Независимо от того, является ли причиной церебральная эмболия или тромбоз, образование отека наблюдается в ишемической мозговой ткани либо одновременно, либо до развития инфаркта. Вазогенный отек мозга проявляется через несколько часов после начала церебральной ишемии и продолжается в течение приблизительно одной недели с момента его образования. После этого отек мозга постепенно уменьшается и, в зависимости от области инфаркта, отек сохраняется как область инфаркта на протяжении от одного до трех месяцев. Поскольку мозг покрыт жестким черепом, отек мозга вызывает увеличение объема мозга. Если отек мозга превысит некоторый предел, то происходит внезапное увеличение в давлении ткани и внутричерепного давления, часто вызывая губительную грыжу и, в конце концов, усугубляя повреждение мозга, которое определяет объем области последующего инфаркта (“CT, MRI JIDAI MO NOSOTCHUGAKU, PART I in “Two Volumes”, Kenji INAMURA and Akio TERASHI, опубликованной Nihon Rinshosha, pp. 231-239, 1993). Кроме того, если область мозга задета инфарктом (становится инфарктной), тo функции, которые выполнялись поврежденной областью, например восприятия, ощущения и памяти, могут быть потеряны. Таким образом, лечение отека мозга и инфаркта, которые являются критическими для качества жизни пациента и прогноза его заболевания, представляет клинически важную задачу. Что касается отека мозга, то в настоящее время используемые способы лечения опираются на гипериною, дренаж церебральной жидкости и использование гипертонических растворов, стероидов и др.; однако, почти во всех случах этих воздействий, эти способы являются лишь транзиторными и от них не следует многого ожидать в достижении терапевтической эффективности (“NOSOTCHU CHIRYO MANUAL”, ed. by Masakuni KAMEYAMA, опубл. Igaku Shoin, pp. 34-36, 1991). Поэтому существует потребность в разработке лекарственных средств, которые действуют по совершенно отличному механизму, чем обычное этиологическое наблюдение, и которые могли бы оказаться эффективными при лечении ишемических цереброваскулярных заболеваний. Доминирующая в настоящее время теория, основанная на анализах генетической ДНК, предполагает, что NOS существует в, по крайней мере, трех изоформах, а именно кальцийзависимой N-cNOS (тип 1), которая присутствует в нейронах, кальцийзависимой E-cNOS (тип 3), которая присутствует, в основном, в васкулярных эндотелиальных клетках и, предположительно, кальцийнезависимой iNOS (тип 2), которая вызывается и синтезируется путем стимуляции цитокинами и/или липополисахаридами (ЛПС, LPS) в макрофагах и многих других клетках (Nathan et al., FASE3 J. 16, 3051- 3064, 1992; Nagafuji et ai., Mol. Chem. Neuropathol. 26. 107-157, 1995). Механизм, который, как полагают, является наиболее вероятным для объяснения повреждения головного мозга, которое сопутствует церебральной ишемии, представляет путь, включающий последовательность повышения внеклеточного уровня глутаминовой кислоты, гиперактивации рецепторов глутаминовой кислоты на постсинапсах, повышения внутриклеточного уровня кальция и активации кальцийзависимых ферментов (Siesjo, J. Cereb. Blood Flow Metab. 1, 155-185, 1981; Siesjo, J. Neurosurg. 60, 883-908, 1984; Choi, Trends Neurosci. 11, 465-469, 1988; Siesjo and Bengstsson, J. Cereb. Blood Flow Metab. 9, 127-140, 1989). Как уже упоминалось, N-cNOS является кальцийзависимой, поэтому ингибирование аномальной активации этого типа NOS-изоформы должно способствовать нейрозащитным действиям NOS-ингибиторов (Dawson et al. Annals Neurol. 32, 297-311, 1992). На самом деле, мРНК уровень N-cNOS и количество N-cNOS-содержащих нейронов начинают увеличиваться сразу после церебральной ишемии и их временные изменения совпадают с развитием инфаркта у крыс (Zhang et al., Brain Res. 654, 85-95, 1994). Кроме того, у модели точечной церебральной ишемии мыши процент ингибирования N-cNOS-активности и процент уменьшения объема инфаркта коррелируют друг с другом, по крайней мере, в диапазоне дозы L-NNA, который уменьшает объем инфаркта (Carreau et al., Eur. J. Pharmacol. 256, 241-249, 1994). Далее, кроме того, сообщалось, что у N-cNOS нокаутированных мышей инфарктный объем, наблюдаемый после точечной церебральной ишемии, значительно меньше, чем у контроля (Huang et al., Science 265, 1863-1885, 1994). Имеется сообщение, которое подтверждает вовлечение iNOS в механизм происхождения и развития ишемического повреждения мозга. Кратко, после 12 ч точечной церебральной ишемии у крыс, мРНК iNOS-ы начинает увеличиваться в коре головного мозга поврежденной полусферы и, через 2 дня, она достигает максимума параллельно с iNOS-активностью, вероятно имея происхождение из полиядерных лейкоцитов (ladecola et al., J. Cereb. Blood Flow Metab. 15, 52-59, 1995; ladecola et al. , J. Cereb. Blood Flow Metab. 15, 378-384, 1995). Сообщается, что когда сложный метиловый эфир NG-нитро-L-аргинина (L-NAME), который является одним из NOS-ингибиторов, вводят через 3 часа после возникновения ишемии с учетом вышеописанных временных изменений, объем инфаркта существенно уменьшается (Zhang et.al., J. Cereb. Blood Flow Metab. 15, 595-601, 1995). Далее, кроме того, сообщается, что количество iNOS и ее ферментативная активность увеличивается в астроцитах или микрососудах головного мозга после возникновения церебральной ишемии у крыс (Endoh et al., Neurosci. Lett. 154, 125-128, 1993; Endoh et al., Brain Res. 651, 92-100, 1994; Nagafuji et al., in Brain Edema IX (lto et al., eds.), 60, pp. 285-288, 1994, Springer-Verlag; Toshiaki NAGAFUJI and Toru MATSUI, Jikken Igaku, 13, 127-135, 1995; Nagafuji et al., Mol. Chem. Neuropathol. 26, 107-157, 1995). Эти сообщения подтверждают, что N-cNOS или iNOS могут быть тесно связаны с механизмом распространения и развития повреждения ткани после церебральной ишемии. Что касается NO, то он представляет, по крайней мере, одну из неотъемлемых частей эндотелийпроизводимого расслабляющего фактора (EDRF) и, отсюда, как полагают, принимает участие в корректировке давления кровеносных сосудов и кровотока (Moncada et al., Pharmacol. Rev. 43, 109-142, 1991). В самом деле, сообщается, что если крысам вводят высокие дозы L-NNA, то церебральный кровоток, как установлено, уменьшается дозазависимым образом, по мере того как кровяное давление увеличивается (Tori MATSUI et al., Jikken Igaku, 11, 55-60, 1993). Головной мозг имеет механизм, благодаря которому церебральный кровоток поддерживается на постоянном уровне, несмотря на изменения кровяного давления выше определенного диапазона (который обычно называют “механизмом авторегуляции”) (“NOSOTCHU JIKKEN HANDBOOK”, под ред. Keiji SANO, публ. IPC, 247- 249, 1990). Сообщение Matsui et al. подтверждает повреждение функционирования этого “механизма авторегуляции”. Поэтому, если E- cNOS, в частности, ингибировать свыше определенного предела в эпизоде ишемии головного мозга, то церебральный кровоток будет уменьшаться и кровяное давление будет увеличиваться, тем самым ухудшая динамику микроциркуляции, вероятно, приводя к распространению ишемического поражения. Настоящими изобретателями ранее установлено, что NG -нитро-L-аргинин (L-NNA), являющийся, как известно, NOS- ингибитором, обладает улучшающим действием против отека мозга и инфаркта, как показано на модели точечной церебральной ишемии крысы (Nagafuji et al., Neurosci. Lett. 147, 159-162, 1992; Открытая публикация Пат.Японии N 192080/1994), а также некроза нейронной клетки, как показано на модели ишемии переднего мозга песчанки (gerbil) (Nagafuji et al., Eur. J. Pharmacol. Env. Tox. 248, 325-328, 1993). С другой стороны, как сообщается, относительно высокие дозы NOS-ингибиторов являются совершенно не эффективными против ишемического повреждения мозга или иногда обостряющими его (ladecoia et al., J. Cereb. Blood Flow Metab. 14, 175-192, 1994; Toshiaki NAGAFUI and Toru MATSUI, Jikken Igaku, 13, 127-135, 1995; Nagafuji et al. , Mol.Chem. Neuropathol. 26, 107-157, 1995). Следует отметить, что фактически все работы, в которых сообщается об изменениях NO или его метаболитов в головном мозге после перманентной или временной церебральной ишемии, согласуются по результатам, которые показывают увеличение уровней этих субстанций (Toshiaki NAGAFUJI and Toru MATSUI, Jikken Igaku, 13, 127-135, 1995; Nagafuji et al. , Mol.Chem.Neuropathol. 26, 107-157, 1995). Одной из причин для объяснения того факта, что имеются противоречивые сообщения об эффективности NOS-ингибиторов в моделях церебральной ишемии, может быть низкая селективность используемых NOS-ингибиторов для N-cNOS или iNOS. В самом деле, не существует NOS-ингибиторов, включая L-NNA и L-NAME, которые имеют высокое селективное ингибирующее действие на определенную NOS-изоформу (Nagafuji et al., Neuroreport 6, 1541-1545, 1995; Nagafuji et al., Mol.Chem. Neuropathol. 26, 107-157, 1995). Поэтому можно заключить, что требуемые терапевтические средства для лечения ишемических цереброваскулярных заболеваний должны иметь селективное ингибирующее действие на N-cNOS или iNOS (Nowicki et al., Eur. J. Pharmacol. 204, 339-340, 1991; Dawson et al., Proc. Natl. Acad. Sci. USA 88, 6368-6371, 1991; Iadecola et al., J. Cereb. Blood Flow Metab. 15, 52-59, 1995; ladecoia et al., J. Cereb. Blood Flow Metab. 15, 378-384, 1995; Toshiaki NAGAFUJI and Toru MATSUI, Jikken Igaku, 13, 127-135, 1995; Nagafuji et al., Mol.Chem. Neuropathol. 26, 107-157, 1995). Имеются также подтверждения того, что N-cNOS- ингибиторы имеют потенциал для использования в качестве лекарственных средств для лечения травматических повреждений головного мозга (Oury et al., J.Biol.Chem. 268, 15394-15398, 1993; MacKenzie et al., Neuroreport 6, 1789-1794,1995), припадка (Rigaud-Monnet et al., J. Cereb. Blood Flow Metab. 14, 581-590, 1994), головной боли и других болей (Moore et al., Br. J. Pharmacol. 102, 198-202, 1991; Olesen., Trends Pharmacol. 15, 149-153, 1994), толерантности к морфину и зависимости от морфина (Kolesnikov et al., Eur. J. Pharmacol. 221, 399-400, 1992; Cappendijk et al., Neurosci. Lett. 162, 97-100, 1993), болезни Альцгеймера (Hu and EI-FaKahany, Neuroreport 4, 760-762, 1993; Meda et al., Nature 374, 647-650, 1995) и болезни Паркинсона (Youdim et al., Advanced Neurol. 60, 259-266, 1993; Schulz et al., J. Neurochem. 64, 936-939, 1995). При стимулировании некоторыми видами цитокинов и/или LPS, iNOS индуцируются в иммуноцитах, таких как макрофаги и глиальные клетки, и других клетках, и образующееся большое количество NO будет расширять кровеносные сосуды, вызывая пагубное (фатальное) падение кровяного давления. Поэтому считают, что iNOS-ингибитор может быть эффективным против септических шоков (Kilbourn and Griffith, J. Natl. Cncer Inst. 84, 827-831, 1992; Cobb et al., Crit. Care Med. 21, 1261-1263, 1993; Lorente et al., Crit. Care Med. 21, 1287-1295, 1993). Кроме того, было высказано предположение, что iNOS-ингибиторы полезны в качестве лекарственных средств для лечения хронического ревматоидного артрита и остеоартрита (Farrell et al., Ann, Rheum. Dis. 51, 1219-1222, 1992; Hauselmann et al. , FEBS Lett. 352, 361-364, 1994; Islante et al., Br. J. Pharmacol. 110, 701-706, 1993), вирусных и невирусных инфекций (Zembvitz and Vane, Proc. Natl. Acad. Sci. USA 89, 2051-2055, 1992; Koprowski et al., Proc. Natl. Acad. Sci. USA 90, 3024-3027, 1993) и диабета (Koib et al., Life Sci. PL213-PL217, 1991). До сих пор известными NOS-ингибиторами, которые имеют селективность к N-cNOS, являются NG-циклопропил-L-аргинин (L-CPA) (Lamberte et al., Eur.J. Pharmacol. 216, 131-134, 1992), L-NNA (Furfine et al., Biochem. 32, 8512-8517, 1993), S-метил-L-тиоцитруллин (L-MIN) (Narayanan and Griffith, J. Med. Chem. 37, 885-887, 1994; Furfine et al., J. Biol. Chem. 37, 885-887, 1994; Furfine et al., J. Biol. Chem. 269, 26677-26683, 1994; WO95/09619; Narayanan et al., J. Biol. Chem. 270, 11103-11110, 1995; Nagafuji et al., Neuroreport 6, 1541-1545, 1995) и S-этил-L-тиоцитруллин (L-EIN) (Furfine et al., J. Biol. Chem. 269, 26677-26683, 1994; WO95/09619; Narayanan et al., J. Biol. Chem. 270, 11103-11110, 1995). Кроме того, ингибиторами, которые, как сообщают, имеют селективность к iNOS, являются NG-иминоэтил-L-орнитрин (L-NIO) (McCall et al. , Br. J. Pharmacol. 102, 234-238, 1991) и аминогуанидин (AG) (Griffith et al., Br. J. Pharmacol. 110, 963-968, 1993; Hasan et al., Eur. J. Pharmacol. 249, 101-106, 1993). Сущность изобретения Целью настоящего изобретения является разработка новых соединений, которые имеют селективное ингибирующее действие на кальцийзависимую NOS, которая присутствует, в основном, в головном мозге, в частности в нейронах (N-cNOS), или на, по-видимому, кальцийнезависимую и способную индуцироваться NOS (iNOS), и которые используют в качестве лекарственных средств для лечения цереброваскулярных заболеваний, болезни Альцгеймера как обезболивающие, для лечения толерантности к морфину или зависимости от морфина, сепсиса, хронического ревматоидного артрита, остеоартрита, вирусных и невирусных инфекций, диабета и болезни Паркинсона. В результате интенсивных исследований, проведенных для того, чтобы добиться поставленной цели, данными изобретателями было установлено, что N-замещенные производные анилина, представленные общей формулой (1), или возможные стереоизомеры или оптически активные формы данных соединений, а также фармацевтически приемлемые соли их имеют ингибирующее действие против N-cNOS или iNOS или обладают селективностью к N-cNOS или iNOS, которые превосходят существующие NOS-ингибиторы, тем самым демонстрируя заметную эффективность как лекарственные препараты для лечения цереброваскулярных заболеваний (особенно как лекарственные средства для лечения обтурирующих цереброваскулярных заболеваний): 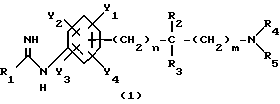 где R1 является SR6 или NR7R8; где R6 представляет необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или прямую или разветвленную алкенильную группу, имеющую 2-6 углеродных атомов; R7 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, циклическую алкильную группу, имеющую 3-8 углеродных атомов, прямую или разветвленную алкенильную группу, имеющую 2-6 углеродных атомов, прямую или разветвленную алкинильную группу, имеющую 3-6 углеродных атомов, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или нитрогруппу; R8 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1- 6 углеродных атомов, или карбоксильную группу, или может объединяться с R3 с образованием 3-8-членного кольца; R3 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или может объединяться с R2 с образованием 3-8-членного кольца; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, необязательно замещенную ацильную группу, имеющую 1-8 углеродных атомов, амидиногруппу, которая может быть замещена на атоме азота прямой или разветвленной алкильной группой, имеющей 1-6 углеродных атомов, или циклической алкильной группой, имеющей 3-8 углеродных атомов, или нитрогруппой, или может соединяться с R5 с образованием 3-8-членного кольца; R5 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1- 6 углеродных атомов, алкоксикарбониламиногруппу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или аминогруппу, или может соединяться с R4 с образованием 3-8-членного кольца; Y1, Y2 Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, нитрогруппу, цианогруппу, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, циклическую алкильную группу, имеющую 3-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкенильную группу, имеющую 2-6 углеродных атомов, прямую или разветвленную алкинильную группу, имеющую 2-6 углеродных атомов, необязательно замещенную прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, прямую или разветвленную алкилтиогруппу, имеющую 1-6 углеродных атомов, NY5Y6 или COY7; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или необязательно замещенную циклическую алкильную группу, имеющую 3-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; Y7 представляет атом водорода, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или циклическую алкильную группу, имеющую 3-6 углеродных атомов, алкоксигруппу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или NY5Y6; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или циклическую алкильную группу, имеющую 3-6 углеродных атомов, и n и m равны, каждый, целому числу, 0 или 1. Данное изобретение выполнено с учетом этих представлений. Кроме того, данными изобрететателями установлено, что соединения, представленные общей формулой (21), являются интермедиатами, полезными для синтеза соединений, представленных общей формулой (1): 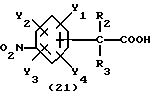 где R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или может соединяться с R3 с образованием 3-8-членного кольца; R3 представляет прямую или разветвленную алкильную группу, имеющую 1- 6 углеродных атомов, или может соединяться с R2 с образованием 3-8-членного кольца; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, циклическую алкильную группу, имеющую 3-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, алкильная часть которой может необязательно иметь заместитель, прямую или разветвленную алкилтиогруппу, имеющую 1-6 углеродных атомов, NY5Y6 или COY7; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или, альтернативно, Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; Y7 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или циклическую алкильную группу, имеющую 3-6 углеродных атомов, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или циклическую алкильную группу, имеющую З-6 углеродных атомов. Открытая Публикация Пат. Японии N 13391/1975; Clin. Sci. Mol. Med. 53, 355-364, 1977; J. Chem. Eng. Data, 22, 3, 224-245, 1977; Clin. Sci. Mol. Med. 54, 673-677, 1978; J. Biochem. 94, 123-128, 1983 и Международная Публикация WO94/21621 раскрывают соединения, которые родственны соединениям данного изобретения, представленным общей формулой (1). Кроме того, часть соединений данного изобретения, представленных общей формулой (1), описана родовым понятием в Открытой Публикации Пат. Японии NN 97933/1977, 99227/1977 и 158249/1987. Однако в этих патентах совсем не ссылаются на NOS ингибирующее действие соединений, соответствующих соединениям данного изобретения, и на другие аспекты, такие как их использование в качестве лекарственных средств для лечения цереброваскулярных заболеваний, травматических повреждений мозга, припадка, болезни Альцгеймера, болезни Паркинсона, головной и других болей, толерантности к морфину или зависимости от морфина, септических шоков, хронического ревматоидного артрита, остеоартрита, вирусных или невирусных инфекций и диабета. Следует отметить также, что в Международной Публикации WO95/00505, которая не была опубликована до даты приоритета данной заявки (December 12, 1994), но которая была опубликована позже, и J. Chem. Soc. Perkin Trans. 1, 2025-2030, 1977 раскрывается часть соединений данного изобретения, которые представлены общей формулой (1), и в указанной Международной Публикации также представлена часть соединений данного изобретения, подпадающих под родовое понятие. Далее, также в Международной Публикации WO95/09619, которая не была опубликована до даты приоритета данной заявки (December 12, 1994), но которая была опубликована позже, раскрывается часть соединений данного изобретения общей формулы (1), подпадающих под родовое понятие. Как будет продемонстрировано с помощью испытаний в дальнейшем, соединения, описанные в Примерах изобретения, имеют намного превосходящее NOS ингибирующее действие, а также чрезвычайно высокую селективность как к N-cNOS, так и к iNOS по сравнению с соединениями, описанными в Международной Публикации WO95/00505 и WO95/09619. Краткое описание рисунков Фиг. 1 представляет график эффективности соединения Примера 96 в уменьшении (улучшении состояния) отека мозга, образовавшегося после 48 ч окклюзии левой средней мозговой артерии у крыс; фиг. 2 представляет график эффективности соединения Примера 96 в уменьшении инфаркта мозга, образовавшегося после 3 ч окклюзии левой средней мозговой артерии и последующей 24 ч повторной перфузии у крыс. Наиболее предпочтительный вариант выполнения данного изобретения В данном изобретении иллюстративным примером прямой или разветвленной алкильной группы, имеющей 1-6 углеродных атомов, может быть метильная, этильная, н-пропильная, изо-пропильная, н-бутильная, втор-бутильная, трет-бутильная, пентильная или гексильная группа или т.п.; иллюстративным примером прямой или разветвленной алкенильной группы, имеющей 2-6 углеродных атомов, может быть винильная, аллильная, бутенильная или пентенильная или т.п.; иллюстративным примером циклоалкильной группы, имеющей 3-8 углеродных атомов, может быть циклопропильная, циклобутильная, циклопентильная или циклогексильная группа или т.п.; иллюстративным примером прямой или разветвленной алкинильной группы, имеющей 3-6 углеродных атомов, может быть пропинильная, бутинильная или пентинильная группа или т. п.; иллюстративным примером прямой или разветвленной алкоксигруппы, имеющей 1-6 углеродных атомов, может быть метокси, этокси, изо-пропокси или н-пропоксигруппа и т.п.; иллюстративным примером прямой или разветвленной алкоксикарбонильной группы, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, может быть метоксикарбонильная, этоксикарбонильная, н-пропоксикарбонильная, изо-пропоксикарбонильная, н-бутокси карбонильная или трет-бутоксикарбонильная группа; иллюстративным примером ацильной группы, имеющей 1-8 углеродных атомов, может быть ацетильная, пропионильная, бутирильная, изобутирильная или бензоильная группа или т. п. иллюстративным примером прямой или разветвленной алкилтиогруппы, имеющей 1-6 углеродных атомов, может быть метилтио, этилтио или пропилтио или т.п.; иллюстративным примером заместителя в необязательно замещенной прямой или разветвленной алкильной группе, имеющей 1-6 углеродных атомов, или в необязательно замещенной ацильной группе, имеющей 1- 8 углеродных атомов, или в необязательно замещенной прямой или разветвленной алкоксигруппе, имеющей 1-6 углеродных атомов, может быть атом галогена, гидрокарбонильная группа, такая как фенильная группа или т. п.; иллюстративным примером необязательно замещенной прямой или разветвленной алкоксигруппы может быть метильная, этильная, 2-фторэтильная или н-пропильная группа или т. п.; иллюстративным примером необязательно замещенной прямой или разветвленной алкоксигруппы, имеющей 1-6 углеродных атомов, может быть метокси, этокси, трифторметокси, пропокси или бензилокси или т. п.; иллюстративным примером замещенной ацильной группы, имеющей 1-8 углеродных атомов, может быть ацетильная или бензоильная группа или т.п.; иллюстративным примером NY5Y6 может быть амино-, метиламино-, диметиламино-, этилметиламино-, пиперидино-, ацетамидо-, N-метилацетамидо-, т-бутоксикарбониламино- или N-метил-т-бутоксикарбониламиногруппа или т. п.; иллюстративным примером COY7 может быть формильная, карбоксильная, ацетильная, пропионильная, циклобутирильная, метоксикарбонильная, этоксикарбонильная, т-бутоксикарбонильная, аминокарбонильная, метиламинокарбонильная, этиламинокарбонильная, диметиламинокарбонильная или этилметиламинокарбонильная группа или т. п.; R1 представляет предпочтительно меркаптогруппу, замещенную прямой или разветвленной алкильной группой, имеющей 1-6 углеродных атомов, или аминогруппу, замещенную прямой или разветвленной алкильной группой, имеющей 1-6 углеродных атомов, или нитроаминогруппу, причем метилтио-, этилтио-, этиламино- или нитроаминогруппа особенно предпочтительны; R2 представляет предпочтительно атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, причем атом водорода, метильная или этильная группа особенно предпочтительны; R3 представляет предпочтительно атом водорода или прямую или разветвленную алкильную группу, имеющую 1- 6 углеродных атомов, причем атом водорода или метильная группа особенно предпочтительны; иллюстративным примером заместителя в случае, когда R2 и R3 соединяются вместе с образованием 3-8-членного кольца, может быть циклопропильная, циклобутильная, циклопентильная или циклогексильная группа; R4 представляет предпочтительно атом водорода; R5 представляет предпочтительно атом водорода; m и n оба предпочтительно равны 0, если заместители, кроме 1, Y2, Y3 и Y4, в общей формуле (1) находятся в м-положении бензольного кольца и если заместители, кроме Y1, Y2, Y3 и Y4, в общей формуле (1) находятся п-положении бензольного кольца, и предпочтительно, чтобы m равно 1 и n равно 0 или чтобы m равно 0 и n равно 1; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, предпочтительно, атом водорода, атом галогена, цианогруппу, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть необязательно замещена 1-3 атомами галогена, циклическую алкильную группу, имеющую 3-6 углеродных атомов, которая может быть необязательно замещена 1-3 атомами галогена, прямую или разветвленную алкенильную группу, имеющую 2-6 углеродных атомов, необязательно замещенную прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, прямую или разветвленную алкилтиогруппу, имеющую 1-6 углеродных атомов, метиламиногруппу, этиламиногруппу, диметиламиногруппу или этилметиламиногруппу и, более предпочтительно, представляют атом водорода, атом галогена, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть необязательно замещена 1-3 атомами галогена, циклическую алкильную группу, имеющую 3-6 углеродных атомов, которая может быть необязательно замещена 1-3 атомами галогена, прямую или разветвленную алкенильную группу, имеющую 2-6 углеродных атомов, необязательно замещенную прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, прямую или разветвленную алкилтиогруппу, имеющую 1-6 углеродных атомов, метиламиногруппу, этиламиногруппу, диметиламиногруппу и этилметиламиногруппу. Соединения изобретения, которые представлены общей формулой (1), можно типично синтезировать по схемам A, приведенным в конце описания. Среди соединений формулы (1) одно, которое представлено формулой (6) с R1, являющимся SR6, можно синтезировать из соединения формулы (3) через соединение формулы (4). Соединение формулы (6), где R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или может соединяться с R3 с образованием 3-8-членного кольца; R3 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или может соединяться с R2 с образованием 3-8-членного кольца; R4 представляет алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или необязательно замещенную ацильную группу, имеющую 1-8 углеродных атомов; R5 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или алкоксикарбониламиногруппу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R6 представляет необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или прямую или разветвленную алкенильную группу, имеющую 2-6 углеродных атомов; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, циклическую алкильную группу, имеющую 3-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, которая может иметь заместитель в алкильной части, прямую или разветвленную алкилтиогруппу, имеющую 1-6 углеродных атомов, NY5Y6 или COY7; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или, альтернативно, Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; Y7 представляет необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, циклическую алкильную группу, имеющую 3-6 углеродных атомов, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или циклическую алкильную группу, имеющую 3-6 углеродных атомов; m равно целому числу 0 или 1; n равно целому числу 0 или 1, может быть синтезировано следующим ниже способом при условии, что R2, R3, R4, R5, R6 Y1 Y2, Y3, Y4, m и n в нижеследующих формулах (3), (4), (5) и (6), являются, каждый, такими же, как определено выше, и Х представляет атом брома или иода. Соединение, представленное формулой (3), подвергают взаимодействию с тиофосгеном в присутствии либо неорганического основания, такого как карбонат кальция или карбонат калия, либо органического основания, такого как триэтиламин или N,N-диметиламинопиридин, предпочтительно в присутствии карбоната кальция или N, N-диметиламинопиридина, в инертном к реакции растворителе, таком как хлороформ, метиленхлорид, вода или диметилформамид, предпочтительно в метиленхлориде или смеси метиленхлорида и воды, при температуре в диапазоне от 0oC до точки кипения реакционной смеси, предпочтительно при комнатной температуре, и после этого продукт реакции обрабатывают концентрированным раствором аммиака, получая соединение, представленное формулой (4). Затем соединение формулы (4) подвергают взаимодействию с соединением формулы (5) в инертном к реакции растворителе, таком как ацетонитрил, ацетон, 1,4-диоксан, метанол или этанол, при температуре в диапазоне от комнатной температуры до точки кипения реакционной смеси, предпочтительно в ацетонитриле при кипячении реакционной смеси с обратным холодильником, получая при этом соединение формулы (6). Альтернативно, соединение формулы (6), где R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или может соединяться с R3 с образованием 3-8-членного кольца; R4 и R5, которые могут быть одинаковыми или различными, представляют, каждый, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или R4 и R5 могут соединяться вместе с образованием 3-8-членного кольца; R3, Y1, Y2, Y3, Y4, X, m и n являются, каждый, такими же, как определено выше, может быть синтезировано нижеследующим способом при условии, что R2, R3, R4, R5, R6, Y1, Y2, Y3, Y4, X, m и n в нижеследующих формулах (3), (4), (5) и (6) являются, каждый, такими же, как определено выше. Соединение, представленное формулой (3), подвергают взаимодействию с бензоилхлоридом и тиоцианатом аммония в инертном к реакции растворителе, таком как ацетон, при температуре в диапазоне от комнатной до точки кипения реакционной смеси, предпочтительно при комнатной температуре, и после этого реакционную смесь кипятят с обратным холодильником вместе с водным 10% раствором гидроксида натрия, получая тем самым соединение формулы (4). В дальнейшем соединение формулы (4) подвергают взаимодействию с неорганической кислотой, такой как хлористоводородная кислота, серная кислота или азотная кислота, получая четвертичную аммониевую соль, которую, в свою очередь, подвергают взаимодействию с соединением формулы (5) в инертном к реакции растворителе, таком как ацетонитрил, ацетон, 1,4-диоксан, метанол или этанол, при температуре в диапазоне от комнатной до точки кипения реакционной смеси, предпочтительно в ацетонитриле, причем реакционную смесь кипятят с обратным холодильником, получая соединение формулы (6). Среди соединений формулы (1) одно, которое представлено формулой (8), причем R1 является NR7R8, где R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой является прямой или разветвленной с 1-6 углеродными атомами, или может соединяться с R3 с образованием 3-8-членного кольца; R4 представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, прямую или разветвленную алкоксикарбонильную группу, имеющую 1-6 углеродных атомов, необязательно замещенную ацильную группу, имеющую 1-8 углеродных атомов, или может соединяться с R5 с образованием 3-8-членного кольца при условии, что когда R5 является атомом водорода, R4 не является алкильной группой; R5 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную с 1-6 углеродными атомами, или алкоксикарбониламиногруппу, алкильная часть которой является прямой или разветвленной с 1-6 углеродными атомами, или может соединяться с R4 с образованием 3-8-членного кольца; R7 представляет прямую, разветвленную или циклическую алкильную группу, имеющую 1-6 углеродных атомов, прямую или разветвленную алкенильную группу, имеющую 2-6 углеродных атомов, или прямую или разветвленную алкинильную группу, имеющую 3-8 углеродных атомов; R8 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R3, Y1, Y2, Y3 Y4, m и n являются, каждый, такими же, как определено выше, может быть синтезировано из соединений формул (6), (4) и (3), используемых в качестве исходных веществ, при условии, что R2, R3, R4, R5, R7, R8, Y1, Y2, Y3 Y4, X, m и n в нижеследующих формулах (3), (4), (5), (6), (7), (34), (35), (36) и (37) являются, каждый, такими же, как определено выше, причем R6 необязательно является замещенной прямой или разветвленной алкильной группой, имеющей 1-6 углеродных атомов. Соединение формулы (8) можно получить путем взаимодействия соединения формулы (6) с амином формулы (35) в инертном к реакции растворителе при нагревании предпочтительно в диметилформамиде при 80oC. Альтернативно, соединение формулы (8) можно получить путем превращения соединения формулы (4) в соединение формулы (34) в соответствии со способом C. A. Maryanoff et al. (J. Org. Chem. 51, 1882-1884, 1986) и затем путем взаимодействия соединения (34) с амином формулы (35). Далее, кроме того, соединение формулы (8) можно получить путем нагревания соединения формулы (3) при температуре кипения флегмы вместе с соединением формулы (7) в растворителе, таком как пиридин. Альтернативно, соединение формулы (8) можно получить путем взаимодействия соединения формулы (3) с соединением формулы (36) согласно способу М. A. Poss et al. (Tetrahedron Lett. 33, 5933-5936, 1992) так, чтобы получить соединение формулы (37) и затем удалить т-бутоксикарбонильную защищающую группу в условиях, которые будут приведены ниже. Среди соединений формулы (1) одно, которое представлено формулой (9) с R1, являющимся NHNO2, и одно, которое представлено формулой (10) с R1, являющимся NH2, могут быть синтезированы из соединения формулы (3), используемого в качестве исходного вещества, при условии, что R2, R3, R4, R5, Y1, Y2, Y3, Y4, m и n в нижеследующих формулах (3), (9) и (10) являются, каждый, такими же, как определено выше. Соединение формулы (9) может быть получено путем взаимодействия соединения формулы (3) с N-метил-N’-нитро-N-нитрозогуанидином или N-нитро-S-метилизотиомочевиной в инертном к реакции растворителе, таком как ацетонитрил, этанол, метанол или вода, предпочтительно в ацетонитриле, при температуре в диапазоне от комнатной температуры до точки кипения реакционной смеси, предпочтительно при комнатной температуре, необязательно в присутствии триэтиламина или уксусной кислоты. Соединение формулы (10) может быть получено путем восстановления соединения, представленного формулой (9). Восстановление может быть проведено в инертном к реакции растворителе, таком как метанол, в присутствии муравьиной кислоты и палладиевой черни при комнатной температуре. Среди соединений формулы (1) одно, в котором R4 является атомом водорода, может быть синтезировано нижеследующим способом. Среди соединений, представленных формулами (6), (8), (9) или (10), соединения, в которых R4 представляет алкоксикарбонильную защитную группу, алкильная часть которой является прямой или разветвленной с 1-6 углеродными атомами, депротонируют обработкой депротонирующим агентом, получая соединения, в которых R4 представляет атом водорода. Депротонирование можно проводить при тех же условиях, которые обычно используют в соответствии с конкретным типом защитной группы, подлежащей удалению. Например, если R4 представляет т-бутоксикарбонильную группу, депротонирование предпочтительно проводят в инертном к реакции растворителе, таком как метиленхлорид, этилацетат, метанол, этанол, 1,4-диоксан или вода, или в отсутствие каких-либо растворителей при температуре в диапазоне от 0oC до комнатной температуры в присутствии депротонирующего агента, такого как трифторуксусная кислота, хлористоводородная кислота, серная кислота или метансульфокислота, и особенно предпочтительно использование трифторуксусной кислоты при комнатной температуре в безводных условиях. Следует, однако, заметить, что те соединения, в которых R2, Y1, Y2, Y3 и Y4 представляют, каждый, т-бутоксикарбонильную группу, превращаются в такие соединения, в которых каждый из вышеупомянутых заместителей представляет карбоксильную группу, в то время как те соединения, в которых R5 является т-бутоксикарбониламиногруппой, превращаются с помощью депротонирования в такие соединения, в которых R5 является аминогруппой. 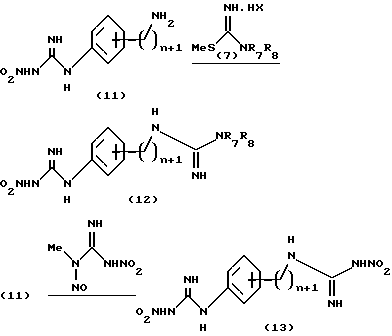 Среди соединений формулы (1) соединения, которые представлены формулами (12) и (13), могут быть синтезированы из соединения формулы (11), используемого в качестве исходного вещества, при условии, что R7, R8, X, n в нижеследующих формулах (7), (12) и (13) являются, каждый, такими же, как определено выше. Соединение, представленное формулой (12), можно получить нагреванием соединения формулы (11), которое представляет соединение формулы (9), в котором R2, R3, R4, R5, Y1, Y2, Y3, и Y4 представляют, каждый, атом водорода и m равно 0, при температуре кипения флегмы вместе с соединением формулы (7) в растворителе, таком как пиридин. Кроме того, соединение, представленное формулой (13), можно получить путем взаимодействия соединения формулы (11) с N-метил-N’-нитро-N-нитрозогуанидином в растворителе, таком как пиридин, при температуре в диапазоне от комнатной температуры до точки кипения реакционной смеси, предпочтительно при комнатной температуре. Соединение формулы (3), из которого должны быть получены соединения формулы (1), может быть типично получено по схемам Б, приведенным в конце описания. Соединение формулы (3), где R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или он может соединяться с R3 с образованием 3-8-членного кольца; R3 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или он может соединяться с R2 с образованием 3-8-членного кольца; R4 представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой является прямой или разветвленной алкильной группой, имеющей 1-6 углеродных атомов, или необязательно замещенную ацильную группу, имеющую 1-8 углеродных атомов, или он может соединяться с R5 с образованием 3-8-членного кольца; R5 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или алкоксикарбониламиногруппу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1- 6 углеродных атомов, или он может соединяться с 4 с образованием 3-8-членного кольца; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть необязательно замещена 1-3 атомами галогена, циклическую алкильную группу, имеющую 3-6 углеродных атомов, которая может быть необязательно замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, алкильная часть которой может необязательно иметь заместитель, прямую или разветвленную алкилтиогруппу, имеющую 1-6 углеродных атомов, NY5Y6 или COY7; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или алкоксикарбонильную группу, алкильная часть которой является прямой или разветвленной с 1-6 углеродными атомами, или, альтернативно, Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; Y7 представляет прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или циклическую алкильную группу, имеющую 3-6 углеродных атомов; m равно целому числу 0 или 1; n равно целому числу 0 или 1, может быть синтезировано из соединения формулы (2), используемого в качестве исходного вещества, при условии, что R2, R3, R4, R5, Y1, Y2, Y3, Y4, m и n в нижеследующих формулах (2) и (3) являются, каждый, такими же, как определено выше. Соединение формулы (2) подвергают реакции каталитического восстановления в инертном к реакции растворителе, таком как этанол, метанол, этилацетат, уксусная кислота или 1,4-диоксан, предпочтительно в этаноле или метаноле, в атмосфере водорода при температуре в диапазоне от комнатной температуры до точки кипения реакционной смеси, предпочтительно при комнатной температуре, используя в качестве катализатора палладий на углероде, никель Ренея и оксид платины; альтернативно, соединение формулы (2) подвергают восстановлению хлоридом никеля (II) и борогидридом натрия и т.д.; в любом случае, восстанавливают нитрогруппу соединения формулы (2) с получением соединения формулы (3). Эти соединения формулы (3), в которых R4 представляет алкоксикарбонильную группу, алкильная часть которой является прямой или разветвленной с 1-6 углеродными атомами, можно также получить путем превращения аминогруппы, представленной NHR5 в этих соединениях формулы (3), где R4 означает атом водорода в карбамате. Если R4 представляет метоксикарбонильную группу, то вышеупомянутую реакцию с получением карбамата, который имеет алкоксикарбонильную группу, алкильная часть которой является прямой или разветвленной с 1-6 углеродными атомами, можно осуществить с метилхлоркарбонатом в инертном к реакции растворителе, таком как метиленхлорид, в присутствии органического основания, такого как триэтиламин или N,N-диметиламинопиридин, при температуре в диапазоне от oC до комнатной температуры. Если R4 представляет т-бутоксикарбонильную группу, реакцию можно осуществить с ди-т-бутилдикарбонатом в инертном к реакции растворителе, таком как метиленхлорид, диметилформамид или смеси 1,4-диоксана и воды, в присутствии органического основания, такого как триэтиламин или N,N-диметиламинопиридин, или неорганического основания, такого как гидроксид натрия или бикарбонат натрия, при температуре в диапазоне от 0oC до комнатной температуры. Среди соединений формулы (3) одно, которое представлено формулой (44), где R9 представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть необязательно замещена 1-3 атомами галогена, циклическую алкильную группу, имеющую 3-6 углеродных атомов, которая может быть необязательно замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, которая может иметь заместитель в алкильной части, прямую или разветвленную алкилтиогруппу, имеющую 1-6 углеродных атомов, NY5Y6; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или, альтернативно, Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца, может быть синтезировано из соединений формул (38) и (39), используемых в качестве исходных веществ, при условии, что 9 в следующих формулах (38), (39), (40), (41), (42), (43) и (44) является таким, как определено выше, и R11 представляет аминогруппу, защищенную т-бутоксикарбонильной группой, фталоильной группой, трифторуксусной группой и т. п., и, кроме того, при условии, что Y1, Y2, Y3 и Y4 в следующих формулах (38), (41), (42), (43) и (44) являются, каждый, таким же, как определено выше. Путем замещения первичной гидроксильной группы в соединении формулы (38) атомом брома можно получить соединение формулы (40), где Y1, Y2, Y3 и Y4 являются, каждый, таким же, как определено выше. Бромирование можно проводить в инертном к реакции растворителе, таком как метиленхлорид, в присутствии четырехбромистого углерода и трифенилфосфина при температуре в диапазоне от 0oC до комнатной температуры. Кроме того, соединение формулы (40), где Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, которая может необязательно иметь заместитель в алкильной части, прямую или разветвленную алкилтиогруппу, имеющую 1-6 углеродных атомов, или NY5Y6; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода или необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или, альтернативно, Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца, можно также получить путем взаимодействия соединения формулы (39), где Y1, Y2, Y3, Y4 являются, каждый, таким же, как определено выше, с N-бромсукцинимидом в инертном к реакции растворителе, таком как тетрахлорид углерода или бензол, в присутствии  , ,  – азобис(изобутиронитрила) при нагревании при температуре флегмы.
Затем соединение формулы (40), – азобис(изобутиронитрила) при нагревании при температуре флегмы.
Затем соединение формулы (40),где Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может необязательно быть замещенной 1-3 атомами галогена, циклическую алкильную группу, имеющую 3-6 углеродных атомов, которая может быть необязательно замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, которая может необязательно иметь заместитель в алкильной части, прямую или разветвленную алкилтиогруппу, имеющую 1-6 углеродных атомов, или NY5Y6; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или, альтернативно, Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца, подвергают взаимодействию с цианидом натрия или цианидом калия, получая соединение формулы (41). Защищающую аминогруппу в полученном соединении формулы (41) удаляют, получая соединение формулы (42), которое затем подвергают взаимодействию с гидрирующим восстанавливающим агентом, предпочтительно литийалюминийгидридом, в присутствии серной кислоты, в инертном к реакции растворителе, таком как эфир или тетрагидрофуран, предпочтительно в эфире, при температуре в диапазоне от комнатной температуры до точки кипения реакционной смеси, предпочтительно при нагревании при температуре флегмы, при этом цианогруппа восстанавливается, образуя соединение формулы (43). Алифатическую аминогруппу в соединении формулы (43), в свою очередь, ацилируют или превращают в карбамат соединением формулы (28) или (29), получая соединение формулы (44). Если R9 является метильной группой, ацилирование аминогруппы может быть проведено путем взаимодействия соединения формулы (43) с ацетилирующим агентом, таким как ацетилхлорид или ангидрид уксусной кислоты, в инертном к реакции растворителе, таком как метиленхлорид, в присутствии органического основания, такого как триэтиламин или N,N-диметиламинопиридин, при температуре в диапазоне от 0oC до комнатной температуре. Соединения формулы (2), из которых должны быть получены соединения формулы (3), могут быть типично получены по схемам В, приведенным в конце описания. Среди соединений формулы (2) одно, которое представлено формулой (17), где R4 и R5, которые могут быть одинаковыми или различными, представляют, каждый, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или, альтернативно, 4 и R5 могут соединяться вместе с образованием 3- 8-членного кольца; n равно целому числу 1 или 2; Y1, Y2, Y3 и Y4 являются, каждый, таким же, как определено выше, может быть синтезировано из соединения формулы (27) через соединения формул (14) и (15) при условии, что R4, R5, Y1, Y2, Y3, Y4 и n в следующих формулах (27), (14), (15), (16) и (17) являются, каждый, таким же, как определено выше, и X является атомом хлора или атомом брома. Карбоксильную группу в формуле (27) восстанавливают восстанавливающим/гидрирующим агентом, предпочтительно дибораном, путем нагревания при температуре кипения флегмы в инертном к реакции растворителе, таком как тетрагидрофуран, получая при этом соединение формулы (14). Затем первичную гидроксильную группу в соединении формулы (14) замещают атомом галогена при обычных условиях реакции, получая соединение формулы (15). Если X является атомом хлора, то реакцию галогенирования проводят с тионилхлоридом в инертном к реакции растворителе, таком как бензол, в присутствии подходящего основания, такого как пиридин, при температуре в диапазоне от 0oC до комнатной температуры. Полученное соединение формулы (15), в свою очередь, подвергают взаимодействию с амином формулы (16) в инертном к реакции растворителе, таком как диметилформамид, в присутствии органического основания, такого как триэтиламин или N,N-диметиламинопиридин, или неорганического основания, такого как бикарбонат натрия или карбонат калия, при температуре в диапазоне от 0oC до комнатной температуры, получая соединение формулы (17). Среди соединений формулы (2) одно, которое представлено формулой (17), где R4 и R5 представляют оба алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную с 1-6 углеродными атомами; n равно 1; Y1, Y2, Y3 и Y4 являются, каждый, таким же, как определено выше, может быть синтезировано следующим способом при условии, что R4 R5 Y1, Y2, Y3 , Y4 и n в следующих формулах (15), (16) и (17) являются, каждый, таким же, как определено выше. Соединения формулы (15) подвергают взаимодействию с соединением формулы (16) в инертном к реакции растворителе, таком как диметилформамид, в присутствии гидрида натрия, при температуре в диапазоне от 0oC до комнатной температуры, получая соединение формулы (17). Среди соединений формулы (2) одно, которое представлено формулой (30), где R5 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, циклическую алкильную группу, имеющую 3-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, которая может иметь заместитель в алкильной части, прямую или разветвленную алкилтиогруппу, имеющую 1-6 углеродных атомов, NY5Y6 или COY7; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или алкоксикарбонильную группу, алкильная часть которой является прямой или разветвленной алкильной группой, имеющей 1-6 углеродных атомов, или, альтернативно, Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; Y7 представляет прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или циклическую алкильную группу, имеющую 3-6 углеродных атомов; R9 и n являются, каждый, таким же, как определено выше, может быть синтезировано из соединений формул (15) и (19) через соединение формулы (18), при условии, что X, Y1, Y2, Y3, Y4 и n в нижеследующих формулах (15), (18), (19), (20), (28), (29) и (30) являются, каждый, таким же, как определено выше. Путем взаимодействия соединения формулы (15) с аммиаком в инертном к реакции растворителе, таком как безводный диметилсульфоксид, при температуре в диапазоне от 0oC до комнатной температуры, можно получить соединение формулы (18), где R5 является атомом водорода. Кроме того, подвергая соединение формулы (19) восстановительному аминированию с амином формулы (20), где 5 представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, можно получить соединение формулы (18), где R5 является таким же, как определено выше. Восстановительное аминирование проводят подходящим восстанавливающим агентом, таким как цианоборогидрид натрия, в инертном к реакции растворителе, таком как этанол или метанол, при температуре в диапазоне от 0oC до комнатной температуры. Затем аминогруппу в соединении формулы (18), где R5 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацилируют или превращают в карбамат таким же способом, как описано выше, получая соединение формулы (30), где R5 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов. Среди соединений формулы (2) одно, которое представлено формулой (32), где Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, циклическую алкильную группу, имеющую 3-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, которая может иметь заместитель в алкильной части, прямую или разветвленную алкилтиогруппу, имеющую 1-6 углеродных атомов, NY5Y6 или COY7; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или, альтернативно, Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; Y7 представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, циклическую алкильную группу, имеющую 3-6 углеродных атомов, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или циклическую алкильную группу, имеющую 3-6 углеродных атомов; R9 и n являются, каждый, таким же, как определено выше, может быть синтезировано из соединения формул (14) и (15) через соединение формулы (31), при условии, что R9, X, Y1, Y2, Y3, Y4 и n в следующих формулах (14), (15), (28), (29), (31) и (32) являются, каждый, таким же, как определено выше. Соединение формулы (31) можно получить, либо подвергая соединение формулы (14) и фталимид реакции Mitsunobu, либо подвергая взаимодействию соединение формулы (15) с фталимидом калия в инертном к реакции растворителе, таком как диметилформамид, при комнатной температуре. Затем фталимидную защищающую группу в соединении формулы (31) удаляют в присутствии гидразина и после этого осуществляют превращение в карбамат или осуществляют ацилирование тем же самым способом, как описано выше, тем самым получая соединение формулы (32). Среди соединений формулы (2) одно, которое представлено формулой (22), где R2 и R3, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или, альтернативно, R2 и R3 могут соединяться вместе с образованием 3-8-членного кольца; R10 представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, циклическую алкильную группу, имеющую 3-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, которая может иметь заместитель в алкильной части, прямую или разветвленную алкилтиогруппу, имеющую 1-6 углеродных атомов, NY5Y6 или COY7; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или алкоксикарбонильную группу, алкильная часть которой является прямой или разветвленной алкильной группой, имеющей 1-6 углеродных атомов, или, альтернативно, Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; Y7 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, циклическую алкильную группу, имеющую 3-6 углеродных атомов, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6; где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или циклическую алкильную группу, имеющую 3-6 углеродных атомов, может быть получено, подвергая соединение формулы (21), где R2, R3, Y1, Y2, Y3, Y4 являются, каждый, такими же, как определено выше, реакции Curtius перегруппировки и реакции присоединения различных спиртов формулы (33), где R10 является таким же, как определено выше. Реакцию Curtius перегруппировки и реакцию присоединения различных спиртов можно провести путем взаимодействия соединения формулы (21), где R2, R3, Y1, Y2, Y3 и Y4 являются, каждый, такими же, как определено выше, с реагентом, таким как дифенилфосфорилазид, при комнатной температуре, получая азид кислоты из карбоновой кислоты, и затем путем взаимодействия азида кислоты со спиртом, таким как метанол, этанол или т-бутанол, при нагревании при температуре кипения флегмы. Альтернативно, реакции можно проводить путем взаимодействия соединения формулы (21) с реагентом, таким как дифенилфосфорилазид, при нагревании при температуре кипения флегмы, получая азид кислоты из карбоновой кислоты, в спирте, таком как метанол, этанол или т-бутанол, в присутствии органического основания, такого как триэтиламин или N,N-диметиламинопиридин. Среди соединений формулы (2) одно, которое представлено формулой (24), где R9 представляет прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов; R10 является таким, как определено выше, можно получить путем превращения амино группы в соединении формулы (23) в карбамат тем же самым способом, как описано выше, и после этого осуществления этерификации обычным способом. Этерификацию обычно осуществляют, используя подходящий конденсирующий агент и различные спирты в инертном к реакции растворителе в присутствии органического основания при 0-50oC. В случае получения т-бутилового сложного эфира реакция может быть осуществлена с 1-этил-3-(3-диметиламино пропил)карбодиимидом гидрохлоридом и т-бутанолом в метиленхлориде в присутствии органического основания, такого как триэтиламин или N,N-диметиламинопиридин, при 0-50oC, предпочтительно при комнатной температуре. Альтернативно, в случае получения метилового сложного эфира реакция может быть осуществлена с триметилсилилдиазометаном в инертном к реакции растворителе, таком как метанол или эфир, которые используют либо индивидуально, либо в смеси, при температуре в диапазоне от 0oC до комнатной температуры. Среди соединений формулы (2) одно, которое представлено формулой (26), где R9 и R10 являются, каждый, таким, как определено выше, можно получить из соединения формулы (25), сначала превращая его в 3- или 4-нитро-DL-фенилглицин в соответствии со способом H.Tsunematsu et al. (Journal of biochemistry 88, 1773-1783, 1980) и после этого превращая аминогруппу в карбамат тем же самым способом, как описано выше, и затем осуществляя этерификацию. Если соединения изобретения, которые представлены общей формулой (1), имеют асимметрические углероды в их структуре, то чистые формы их стереоизомеров и оптически активные формы их можно получить с помощью известных методов в данной области, таких как хроматография на колонках, разделяющих оптические изомеры, и фракционная кристаллизация. Соединения изобретения, которые представлены общей формулой (1), могут быть превращены в любые фармацевтически приемлемые соли, к которым относятся, например, соли с неорганическими кислотами, такими как хлористоводородная кислота, серная кислота, азотная кислота, бромистоводородная кислота и иодистоводородная кислота, соли с органическими кислотами, такими как муравьиная кислота, уксусная кислота, щавелевая кислота и винная кислота, соли со щелочными металлами, такими как калий и натрий, и соли со щелочноземельными металлами, такими как кальций и магний. Соединения изобретения или их соли могут быть сформированы с подходящими наполнителями, адъювантами, смазками, антисептиками, дезинтеграторами, забуферивающими агентами, связующими, стабилизаторами, смачивающими агентами, эмульгаторами, окрашивающими агентами, придающими вкус агентами, ароматизаторами и т.д. для того, чтобы получить таблетки, гранулы, облагороженные гранулы, порошки, капсулы, сиропы, эликсиры, суспензии, эмульсии, инъекции и т. д. для перорального или парентерального применения. В том случае, когда цереброваскулярные заболевания, подлежащие лечению, находятся в гиперострой фазе (непосредственно после удара [тромбоз, эмболия]), острой фазе (через 2-3 дня после удара) или в субострой фазе (через 1-3 дня вплоть до 2 недель после удара), сначала предусматривается введение при помощи внутримышечной или внутривенной инъекции. Кроме того, в хронической фазе (третья неделя после удара и позже) можно проводить оральное введение, если пациент способен принимать внутрь лекарственное средство. Соединения изобретения или соли их можно вводить в дозах, которые различаются в зависимости от физического телосложения пациента, его или ее возраста, физического состояния, тяжести заболевания, времени отклонения от нормы после начала заболевания и других факторов; предполагаются типичные суточные дозы в диапазоне от 0,1 до 100 мг/вес тела. Обычно следует иметь в виду, что даже если вводят одну и ту же дозу, концентрация в плазме может иногда значительно различаться от пациента к пациенту; поэтому оптимальная доза лекарственного средства, в идеальном случае, должна определяться для каждого пациента на основе контроля концентрации лекарственного средства в плазме. Если соединения изобретения или их соли должны быть сформированы как препараты для внутреннего применения, то в качестве наполнителей удобно использовать лактозу, сахарозу, сорбит, маннит, крахмалы, такие как картофельный крахмал или кукурузный крахмал, производные крахмала, и обычные добавки, такие как производные целлюлозы или желатин, причем смазки, такие как стеарат магния, карбовоски и полиэтиленгликоль, необязательно добавляют одновременно; полученные смеси можно сформировать обычным способом в гранулы, таблетки, капсулы или другие формы, пригодные для внутреннего применения. Если соединения изобретения или их соли должны быть сформированы в виде водных препаратов, то эффективные количества главных ингредиентов следует растворить в дистиллированной воде для инъекции, с добавлением антиоксидантов, стабилизаторов, добавок для растворения, забуфферивающих агентов, консервантов и т.д., как требуется, и после достижения полного растворения их фильтруют, заполняют в ампулы, герметизируют и стерилизуют с помощью подходящей среды, такой как пар высокого давления или сухой нагрев с тем, чтобы получить лекарственные средства для инъекции. Если соединения данного изобретения или их соли должны быть сформированы в виде лиофилизованных препаратов, то водные растворы, имеющие главные ингредиенты, растворенные в дистиллированной воде для инъекции, могут быть лиофильно высушены обычным способом, необязательно после добавления наполнителей, которые обеспечивают легкую лиофилизацию, такие как сахара (например, лактоза, мальтоза или сахароза), спирты сахаров (например, маннит или инозит), глицин и т.п. Получение соединений данного изобретения будет описано более детально со ссылкой на нижеследующие примеры, но следует иметь в виду, что эти примеры никоим образом не ограничивают данное изобретение. Кроме того, с целью иллюстрации использования изобретения были исследованы селективное ингибирующее действие соединений общей формулы (1) на три NOS-изоформы и их улучшенное действие против окклюзивного цереброваскулярного заболевания в модели удара (тромбоз, эмболия) у крыс и эти результаты представлены ниже в разделе Испытания. Примеры В Таблицах 1-26 представлены формулы химических структур соединений и номера соответствующих Примеров их получения. Среди соединений, синтезированных в Примерах, соединения, которые представлены общей формулой (1), перечислены ниже в Таблицах 27-48. Пример 1 Синтез т-бутилового эфира N-(1-метил-1-(3-нитрофенил)этил)карбаминовой кислоты Пример 1а Раствор т-бутилового эфира 3-нитрофенилуксусной кислоты (1,56 г) в диметилформамиде (30 мл) добавляют по каплям к смеси гидрида натрия (содержание 60%, 631 мг) и диметилформамида (45 мл) при 0oC. Затем реакционную смесь перемешивают в течение 10 мин, добавляют по каплям метилиодид (2 экв. , 0,9 мл) при 0oC и перемешивают в течение 30 мин, и перемешивают в течение 16 ч при комнатной температуре. Реакционную смесь концнентрируют при пониженном давлении, к образовавшемуся остатку добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат = 97:3), получая 367 мг т-бутилового эфира 2-метил-2-(3-нитрофенил)пропионовой кислоты (выход 28%). 1H-ЯМР (CDCl3),  : 1,39 (9H, с), 1,59 (6H, с), 7,46-7,69 (2H, м), 8,08-8,25 (2H, м).
Пример 1b : 1,39 (9H, с), 1,59 (6H, с), 7,46-7,69 (2H, м), 8,08-8,25 (2H, м).
Пример 1bСмесь диметилового соединения (1,1 г), полученного в вышеприведенной реакции, и фторуксусной кислоты (25 мл) перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь концентрируют при пониженном давлении и образующийся остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=4:6), получая 0,87 г 2-метил-2-(3- нитрофенил)пропионовой кислоты, количественно. 1H-ЯМР (CDCl3),  : 1,67 (6H, с), 7,52-7,76 (2H,м), 8,12-8,29 (2H, м).
Пример 1с : 1,67 (6H, с), 7,52-7,76 (2H,м), 8,12-8,29 (2H, м).
Пример 1сСмесь 2-метил-2-(3-нитрофенил)пропионовой кислоты (866 мг), полученной в Примере 1b, дифенилфосфорилазида (0,89 мл), триэтиламина (0,58 мл) и т-бутанола (15 мл) кипятят с обратным холодильником в течение 16 ч и концентрируют при пониженном давлении. Остаток растворяют в бензоле и промывают последовательно 5% водным раствором лимонной кислоты, водой, насыщенным водным раствором хлорида натрия, насыщенным водным раствором бикарбоната натрия; органический слой сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=85:15), получая 649 мг названного соединения (выход 56%). 1H-ЯМР (CDCl3),  : 1,38 (9H, с), 1,65 (6H, с), 5,08 (1H, шс), 7,46-7,75 (2H, м), 8,07-8,28 (2H, м).
МС (м/з) 280 (М+).
Пример 2 : 1,38 (9H, с), 1,65 (6H, с), 5,08 (1H, шс), 7,46-7,75 (2H, м), 8,07-8,28 (2H, м).
МС (м/з) 280 (М+).
Пример 2Синтез т-бутилового эфира N-(1-метил-1-(3-аминофенил) этил)карбаминовой кислоты Смесь соединения (649 мг), полученного в Примере 1, 10% палладий на углероде (300 мг) и этанола (100 мл) перемешивают в атмосфере водорода при комнатной температуре в течение 16 ч. Реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении; полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=7:3), получая 439 мг названного соединения (выход 76%). 1H-ЯМР(CDCl3),  : 1,37 (9H, с), 1,60 (6H, с), 3,62 (2H, шс), 4,87 (1H, шс), 6,53-6,81 (3H, м), 7,07-7,13 (1H, м).
МС (м/з) 250 (М+).
Пример 3 : 1,37 (9H, с), 1,60 (6H, с), 3,62 (2H, шс), 4,87 (1H, шс), 6,53-6,81 (3H, м), 7,07-7,13 (1H, м).
МС (м/з) 250 (М+).
Пример 3Синтез т-бутилового эфира N-(1-метил-1-(3-тиоуреидофенил) этил) карбаминовой кислоты Тиофосген (0,12 мл) и раствор соединения (284 мг), полученного в Примере 2, в метиленхлориде (10 мл) добавляют по каплям к суспензии карбоната кальция (3,19 мг) в воде (5 мл) при комнатной температуре и перемешивают при комнатной температуре в течение 5 ч; после этого к реакционной смеси добавляют 25% водный раствор аммиака (5 мл) и перемешивают при комнатной температуре в течение 16 ч. После нейтрализации 2N HCl реакционную смесь экстрагируют этилацетатом и органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=6:4), получая 351 мг названного соединения (выход 89%). 1H-ЯМР (CDCl3),  : 1,36 (9H, с), 1,60 (6H, с), 5,04 (1H, шс), 6,21 (2H, шс), 7,05-7,42 (4H, м), 8,07 (1H, шс).
МС (м/з) 309 (М+).
Пример 4 : 1,36 (9H, с), 1,60 (6H, с), 5,04 (1H, шс), 6,21 (2H, шс), 7,05-7,42 (4H, м), 8,07 (1H, шс).
МС (м/з) 309 (М+).
Пример 4Синтез гидроиодида т-бутилового эфира N-(1-метил-1-(3-(S-метилизотиоуреидо)фенил)этил)карбаминовой кислоты К смеси соединения (164 мг), полученного в Примере 3, и ацетонитрила (15 мл) добавляют метилиодид (0,1 мл) и реакционную смесь кипятят с обратным холодильником в течение 2 ч. Реакционную смесь концентрируют при пониженном давлении и полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – хлороформ: метанол= 95:5), получая 130 мг названного соединения (выход 54%). 1H-ЯМР(CDCl3),  : 1,37 (9H, с), 1,60 (6H, с), 2,47 (3H, с), 4,93 (1H, шс), 6,77-7,29 (4H, м).
Пример 5 : 1,37 (9H, с), 1,60 (6H, с), 2,47 (3H, с), 4,93 (1H, шс), 6,77-7,29 (4H, м).
Пример 5Синтез дигидрохлорида N-(1-метил-1-(3-(S-метилизотиоуреидо)фенил)этил)амина Смесь соединения (130 мг), полученного в Примере 4, и трифторуксусной кислоты (15 мл) перемешивают при комнатной температуре в течение 2 ч, и концентрируют при пониженном давлении. Остаток растворяют в этаноле (5 мл), после этого при комнатной температуре добавляют раствор хлористого водорода в 1,4-диоксане (4N, 0,29 мл) и реакционную смесь концентрируют при пониженном давлении. Остаток растворяют в воде, промывают этилацетатом и лиофильно сушат, получая 100 мг названного соединения (выход 84%). 1H-ЯМР (D2O),  : 1,77 (6H, с), 2,70 (3H, с), 7,40-7,68 (4H, м).
МС (м/з) 223 (М+) : 1,77 (6H, с), 2,70 (3H, с), 7,40-7,68 (4H, м).
МС (м/з) 223 (М+)Пример 6 Синтез т-бутилового эфира N-(1-метил-1-(3-(N’-нитрогуанидино)фенил)этил)карбаминовой кислоты Смесь соединения (145 мг), полученного в Примере 2, ацетонитрила (10 мл), N-метил-N’-нитро-N-нитрозогуанидина (85 мг), триэтиламина (0,08 мл) и уксусной кислоты перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь концентрируют при пониженном давлении и полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан: этилацетат = 1:1), получая 106 мг названного соединения (выход 54%). 1H-ЯМР(CDCl3),  : 1,36 (9H, с), 1,62 (6H, с), 5,06 (1H, шс), 7,16-7,47 (4H, м), 9,73 (1H, шс).
ББА-МС (м/з) 338 (M++1).
Пример 7 : 1,36 (9H, с), 1,62 (6H, с), 5,06 (1H, шс), 7,16-7,47 (4H, м), 9,73 (1H, шс).
ББА-МС (м/з) 338 (M++1).
Пример 7Синтез гидрохлорида N-(1-метил-1-(3-(N’-нитрогуанидино)фенил)этил)амина Используя соединение, полученное в Примере 6, как исходное вещество, по методике, аналогичной Примеру 5, получают 66 мг названного соединения (выход 77%). 1H-ЯМР (D2O),  : 1,76 (6H, с), 7,37-7,62 (4H, м) : 1,76 (6H, с), 7,37-7,62 (4H, м)ББА-МС (м/з) 238 (М++1) Пример 8 Синтез т-бутилового эфира N-(1-(3-нитрофенил)этил)карбаминовой кислоты Пример 8а Используя т-бутиловый эфир 3-нитрофенилуксусной кислоты как исходное вещество и метилиодид (1 экв.) в качестве реагента, по методикам, аналогичным Примерам 1a и 1b, получают 2-(3-нитрофенил)пропионовую кислоту. 1H-ЯМР (CDCl3),  : 1,59(3H, д, J= 7,3 Гц), 3,88(1H, к, J=7,3 Гц), 7,49-7,68(2H, м), 8,13-8,21(2H, м).
Пример 8b : 1,59(3H, д, J= 7,3 Гц), 3,88(1H, к, J=7,3 Гц), 7,49-7,68(2H, м), 8,13-8,21(2H, м).
Пример 8bИспользуя 2-(3-нитрофенил)пропионовую кислоту как исходное вещество, по методике, аналогичной Примеру 1с, получают 183 мг названного соединения (выход 67%). 1H-ЯМР (CDCl3),  : 1,41(9H, с), 1,48(3H, д, J=6,6 Гц), 4,68- 5,06(2H, м), 7,47-7,66(2H, м), 8,10-8,17(2H, м).
МС (м/з) 266(М+) : 1,41(9H, с), 1,48(3H, д, J=6,6 Гц), 4,68- 5,06(2H, м), 7,47-7,66(2H, м), 8,10-8,17(2H, м).
МС (м/з) 266(М+)Пример 9 Синтез т-бутилового эфира N-(1-(3-аминофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 8, как исходное вещество, по методике, аналогичной Примеру 2, получают 496 мг названного соединения (выход 78%). 1H-ЯМР (CDCl3),  : 1,40-1,42(12H, м), 3,66(2H, шс), 4,58-4,86(2H, м), 6,55-6,70(3H, м), 7,08-7,14(1H, м).
Пример 10 : 1,40-1,42(12H, м), 3,66(2H, шс), 4,58-4,86(2H, м), 6,55-6,70(3H, м), 7,08-7,14(1H, м).
Пример 10Синтез т-бутилового эфира N-(1-(3-тиоуреидофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 9, как исходное вещество, по методике, аналогичной Примеру 3, получают 246 мг названного соединения (выход 89%). 1H-ЯМР (CDCl3),  : 1,41(9H, с), 1,43(3H, д, J=6,9 Гц), 4,67- 4,79(1H, м), 4,80-4,98(1H, м), 6,14(2H, шс), 7,09-7,43(4H, м), 7,97(1H, шс).
Пример 11 : 1,41(9H, с), 1,43(3H, д, J=6,9 Гц), 4,67- 4,79(1H, м), 4,80-4,98(1H, м), 6,14(2H, шс), 7,09-7,43(4H, м), 7,97(1H, шс).
Пример 11Синтез гидроиодида т-бутилового эфира N-(1-(3-(S-метилизотиоуреидо)фенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 10, как исходное вещество, по методике, аналогичной Примеру 4, получают 318 мг названного соединения (выход 87%). 1H-ЯМР (CDCl3),  : 1,42-1,45(12H, м), 2,60(3H,с), 4,68- 4,91(2H, м), 7,03-7,37(4H, м).
Пример 12 : 1,42-1,45(12H, м), 2,60(3H,с), 4,68- 4,91(2H, м), 7,03-7,37(4H, м).
Пример 12Синтез дигидрохлорида N-(1-(3-(S-метилизотиоуреидо)фенил)этил)амина Используя соединение, полученное в Примере 11, как исходное вещество, по методике, аналогичной Примеру 5, получают 192 мг названного соединения, количественно. 1H-ЯМР (D2O),  : 1,67(3H, д, J=6,9 Гц), 2,70(3H,с), 4,61(1H, к, J=6,9 Гц), 7,42-7,67(4H, м).
МС (м/з) 209 (M+) : 1,67(3H, д, J=6,9 Гц), 2,70(3H,с), 4,61(1H, к, J=6,9 Гц), 7,42-7,67(4H, м).
МС (м/з) 209 (M+)Пример 13 Синтез т-бутилового эфира N-(1-(3-(N’-нитрогуанидино)фенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 9, как исходное вещество, по методике, аналогичной Примеру 6, получают 123 мг названного соединения (выход 40%). 1H-ЯМР (CDCl3),  : 1,41(9H,с), 1,46(3Н, д, J=6,9 Гц), 4,72- 4,80(1H, м), 4,89(1H, д, J=6,3 Гц), 7,17-7,49(4H, м), 9,25(1H, шс).
ББА-МС (м/з) 324 (М++1) : 1,41(9H,с), 1,46(3Н, д, J=6,9 Гц), 4,72- 4,80(1H, м), 4,89(1H, д, J=6,3 Гц), 7,17-7,49(4H, м), 9,25(1H, шс).
ББА-МС (м/з) 324 (М++1)Пример 14 Синтез гидрохлорида N-(1-(3-(N’-нитрогуанидино)фенил)этил)амина Используя соединение, полученное в Примере 13, как исходное вещество, по методике, аналогичной Примеру 7, получают 92 мг названного соединения (выход 84%). 1H-ЯМР (D2O),  : 1,66(3H, д, J=6,9 Гц), 4,58(1H, к, J=6,9 Гц), 7,38-7,61(4H, м).
ББА-МС (м/з) 224-(М++1) : 1,66(3H, д, J=6,9 Гц), 4,58(1H, к, J=6,9 Гц), 7,38-7,61(4H, м).
ББА-МС (м/з) 224-(М++1)Пример 15 Синтез т-бутилового эфира N-(1-(3-нитрофенил)пропил)карбаминовой кислоты Пример 15а Используя т-бутиловый эфир 3-нитрофенилуксусной кислоты как исходное вещество и используя также этилиодид (1 экв.) в качестве реагента, по методикам, аналогичным Примерам 1а и 1b, получают 2-(3-нитрофенил)масляную кислоту. 1H-ЯМР (CDCl3),  : 0,94(3H, д, J=7,3 Гц), 1,79-1,95 (1H, м), 2,10-2,26 (1H, м), 3,60 (1H, т, J=7,6 Гц), 7,49-7,78(2H, м), 8,13-8,28(2H, м).
Пример 15b : 0,94(3H, д, J=7,3 Гц), 1,79-1,95 (1H, м), 2,10-2,26 (1H, м), 3,60 (1H, т, J=7,6 Гц), 7,49-7,78(2H, м), 8,13-8,28(2H, м).
Пример 15bИспользуя 3-нитрофенилуксусную кислоту как исходное вещество по методике, аналогичной Примеру 1с, получают 1,0 г названного соединения (выход 96%), 1H-ЯМР (CDCl3),  : 0,93(3H, т, J=7,3 Гц), 1,42 (9H, с), 1,73- 1,84 (2H, м), 4,51-4,71 (1H, м), 4,78-4,98 (1H, м), 7,47-7,67 (2H, м), 8,10-8,13 (2H, м).
Пример 16 : 0,93(3H, т, J=7,3 Гц), 1,42 (9H, с), 1,73- 1,84 (2H, м), 4,51-4,71 (1H, м), 4,78-4,98 (1H, м), 7,47-7,67 (2H, м), 8,10-8,13 (2H, м).
Пример 16Синтез т-бутилового эфира N-(1-(3-аминофенил)пропил)карбаминовой кислоты Используя соединение, полученное в Примере 15, как исходное вещество, по методике, аналогичной Примеру 2, получают 701 мг названного соединения (выход 79%). 1H-ЯМР (CDCl3),  : 0,87 (3H, т, J=7,3 Гц), 1,41 (9H, с), 1,68-1,87 (2H, м), 3,64(2H, шс), 4,30-4,50 (1H, м), 4,62-4,86 (1H, м), 6,55-6,66(3H, м), 7,07-7,13(1H, м).
Пример 17 : 0,87 (3H, т, J=7,3 Гц), 1,41 (9H, с), 1,68-1,87 (2H, м), 3,64(2H, шс), 4,30-4,50 (1H, м), 4,62-4,86 (1H, м), 6,55-6,66(3H, м), 7,07-7,13(1H, м).
Пример 17Синтез т-бутилового эфира N-(1-(3-тиоуреидофенил)пропил)карбаминовой кислоты Используя соединение, полученное в Примере 16, как исходное вещество, по методике, аналогичной Примеру 3, получают 371 мг названного соединения (выход 97%). 1H-ЯМР (CDCl3),  : 0,92(3H, т, J=7,3 Гц), 1,40(9H,с), 1,69- 1,80(2H, м), 4,40-4,60(1H, м), 4,80-5,00(1H, м), 6,15(2H, шс), 7,09-7,42 (4H, м), 7,97(1H,шс).
Пример 18 : 0,92(3H, т, J=7,3 Гц), 1,40(9H,с), 1,69- 1,80(2H, м), 4,40-4,60(1H, м), 4,80-5,00(1H, м), 6,15(2H, шс), 7,09-7,42 (4H, м), 7,97(1H,шс).
Пример 18Синтез гидроиодида т-бутилового эфира N-(1-(3-(S-метилизотиоуреидофенил)пропил)карбаминовой кислоты Используя соединение, полученное в Примере 17, как исходное вещество, по методике, аналогичной Примеру 4, получают 443 мг названного соединения (выход 82%). 1H-ЯМР (CDCl3),  : 0,90(3H, т, J=7,3 Гц), 1,41 (9H,с), 1,70-1,80(2H, м), 2,59(3H,с), 4,39-4,61(1H,м), 4,85(1H, д, J=7,6 Гц), 7,01-7,36(4H, м).
Пример 19 .
Синтез дигидрохлорида N-(1-(3-(S-метилизотиоуреидо)фенил)пропил)амина : 0,90(3H, т, J=7,3 Гц), 1,41 (9H,с), 1,70-1,80(2H, м), 2,59(3H,с), 4,39-4,61(1H,м), 4,85(1H, д, J=7,6 Гц), 7,01-7,36(4H, м).
Пример 19 .
Синтез дигидрохлорида N-(1-(3-(S-метилизотиоуреидо)фенил)пропил)аминаИспользуя соединение, полученное в Примере 18, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 267 мг названного соединения (выход 93%). 1H-ЯМР (D2O),  : 0,89(3H, т, J=7,3 Гц), 1,91-2,16(2H, м), 2,70(3H, с), 4,30-4,36 (1H, м), 7,43-7,70(4H, м).
МС (м/з) 223 (М+) : 0,89(3H, т, J=7,3 Гц), 1,91-2,16(2H, м), 2,70(3H, с), 4,30-4,36 (1H, м), 7,43-7,70(4H, м).
МС (м/з) 223 (М+)Пример 20 Синтез т-бутилового эфира N-(1-(3-(N’-нитрогуанидино)фенил)пропил)карбаминовой кислоты Используя соединение, полученное в Примере 16, в качестве исходного вещества, по методике, аналогичной Примеру 6, получают 406 мг названного соединения (выход 87%). 1H-ЯМР (CDCl3),  : 0,94(3H, т, J=7,3 Гц), 1,40(9H,с), 1,72-1,83(2H, м), 4,43-4,58(1H, м), 4,84-5,01(1H, м), 7,19-7,48(4H, м), 9,56(1H, шс).
ББА-МС (м/з) 338(М++1).
Пример 21 : 0,94(3H, т, J=7,3 Гц), 1,40(9H,с), 1,72-1,83(2H, м), 4,43-4,58(1H, м), 4,84-5,01(1H, м), 7,19-7,48(4H, м), 9,56(1H, шс).
ББА-МС (м/з) 338(М++1).
Пример 21Синтез гидрохлорида N-(1-(3-(N’-нитрогуанидино)фенил)пропил)амина Используя соединение, полученное в Примере 20, как исходное вещество, по методике, аналогичной Примеру 5, получают 270 мг названного соединения (выход 83%). 1H-ЯМР (D2O),  : 0,89(3H, т, J=7,3 Гц), 1,93-2,12 (2H, м), 4,30(1H, т, J=8,6 Гц), 7,39-7,61(4H, м).
ББА-МС (м/з) 238(М++1) : 0,89(3H, т, J=7,3 Гц), 1,93-2,12 (2H, м), 4,30(1H, т, J=8,6 Гц), 7,39-7,61(4H, м).
ББА-МС (м/з) 238(М++1)Пример 22 Синтез т-бутилового эфира N-(3-нитрофенилметил)карбаминовой кислоты Триэтиламин (2,8 мл) и ди-т-бутилкарбонат (2,3 г) добавляют к раствору гидрохлорида 3-нитробензиламина (1,5 г) в диметилформамиде (30 мл) и перемешивают при комнатной температуре в течение 16 ч. Добавляют воду и 2 N HCl к реакционной смеси в количестве, необходимом для доведения pH до 3; после экстракции этилацетатом органический слой последовательно промывают насыщенным водным раствором хлорида натрия, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и коцентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан: этилацетат=6:4), получая 1,9 г названного соединения (выход 94%). 1H-ЯМР (CDCl3),  : 1,47(9H, с), 4,42(2H, д, J=6,3 Гц), 4,92- 5,10(1H, м), 7,48-7,65(2H, м), 8,11-8,15(2H, м).
Пример 23 : 1,47(9H, с), 4,42(2H, д, J=6,3 Гц), 4,92- 5,10(1H, м), 7,48-7,65(2H, м), 8,11-8,15(2H, м).
Пример 23Синтез т-бутилового эфира N-(3-аминофенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 22, как исходное вещество, по методике, аналогичной Примеру 2, получают 1,1 г названного соединения, количественно. 1H-ЯМР (CDCl3),  : 1,46(9H, с), 3,66(2H, шс), 4,21(2H, д, J=5,9 Гц), 4,73-4,87(1H, м), 6,56-6,67(3H, м), 7,07-7,13 (1H, м).
Пример 24 : 1,46(9H, с), 3,66(2H, шс), 4,21(2H, д, J=5,9 Гц), 4,73-4,87(1H, м), 6,56-6,67(3H, м), 7,07-7,13 (1H, м).
Пример 24Синтез т-бутилового эфира N-(3-тиоуреидофенилметил)кар баминовой кислоты Используя соединение, полученное в Примере 23, как исходное вещество, по методике, аналогичной Примеру 3, получают 382 мг названного соединения (выход 81%). 1H-ЯМР (CDCl3),  : 1,45(9H, с), 4,32(2H, д, J=5,9 Гц), 4,97- 5,11(1H, м), 6,22(2H, шс), 7,12-7,27(3H, м), 7,36-7,42(1H, м), 8,19(1H, шс).
ББА-МС (м/з) 282(М++1) : 1,45(9H, с), 4,32(2H, д, J=5,9 Гц), 4,97- 5,11(1H, м), 6,22(2H, шс), 7,12-7,27(3H, м), 7,36-7,42(1H, м), 8,19(1H, шс).
ББА-МС (м/з) 282(М++1)Пример 25 Синтез гидроиодида т-бутилового эфира N-(3-(S-метилизотиоуреидо)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 24, как исходное вещество, по методике, аналогичной Примеру 4, получают 489 мг названного соединения, (выход 85%). 1H-ЯМР (CDCl3),  : 1,46(9H, с), 2,46(3H, с), 4,28(2H, д, J=5,6 Гц), 4,75-4,89(1H, м), 6,81-6,97(3H, м), 7,24-7,29(1H, м).
ББА-МС (м/з) 296(М++1) : 1,46(9H, с), 2,46(3H, с), 4,28(2H, д, J=5,6 Гц), 4,75-4,89(1H, м), 6,81-6,97(3H, м), 7,24-7,29(1H, м).
ББА-МС (м/з) 296(М++1)Пример 26 Синтез дигидрохлорида N-(3-(S-метилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 25, как исходное вещество, по методике, аналогичной Примеру 5, получают 150 мг названного соединения (выход 94%). 1H-ЯМР (D2O),  : 2,70 (3H, c), 4,25 (2H, c),7,31-7,66 (4H, м).
ББА-МС (м/з) 196(М++1) : 2,70 (3H, c), 4,25 (2H, c),7,31-7,66 (4H, м).
ББА-МС (м/з) 196(М++1)Пример 27 Синтез гидроиодида т-бутилового эфира N-(3-(S-этилизотиоуреидо)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 24, как исходное вещество и также этилиодид в качестве реагента, по методике, аналогичной Примеру 4, получают 178 мг названного соединения (выход 68%). 1H-ЯМР (CDCl3),  : 1,37(3H, т, J=7,3 Гц), 1,46(9H, с), 3,06(2H, к, J= 7,3 Гц), 4,29(2H, д, J=5,9 Гц), 4,78-4,92(1H, м), 6,87-7,31(4H, м).
Пример 28 : 1,37(3H, т, J=7,3 Гц), 1,46(9H, с), 3,06(2H, к, J= 7,3 Гц), 4,29(2H, д, J=5,9 Гц), 4,78-4,92(1H, м), 6,87-7,31(4H, м).
Пример 28Синтез дигидрохлорида N-(3-(S-этилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 27, как исходное вещество, по методике, аналогичной Примеру 5, получают 105 мг названного соединения (выход 92%). 1H-ЯМР (D2O),  : 1,43 (3H, т, J= 7,3 Гц), 3,25(2H, к, J=7,3 Гц), 4,25(2H, с), 7,43-7,66(4H, м).
МС (м/з) 209(М+) : 1,43 (3H, т, J= 7,3 Гц), 3,25(2H, к, J=7,3 Гц), 4,25(2H, с), 7,43-7,66(4H, м).
МС (м/з) 209(М+)Пример 29 Синтез т-бутилового эфира N-(3-(S-(2-фтороэтил)изотиоуреидо)фенилметил)карбаминовой кислоты К смеси соединения (500 мг), полученного в Примере 24, и ацетонитрила (20 мл) добавляют 1-бром-2-фтороэтан (0,26 мл) и реакционную смесь кипятят с обратным холодильником в течение 2 ч. Реакционную смесь дистиллируют при пониженном давлении и полученный остаток растворяют в этилацетате, промывают последовательно насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, органический слой сушат безводным сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан: этилацетат=6:4), получая 50 мг названного соединения (выход 9%). 1H-ЯМР (CDCl3),  : 1,46(9H, с), 3,36(2H, неразрешенный дт, J=22,1, 5,9 Гц), 4,27(2H, д, J= 5,6 Гц), 4,66(2H, неразрешенный дт, J=47,2, 5,9 Гц), 4,80-4,94(1H, м), 6,77-6,97(3H, м), 7,24-7,29(1H, м).
Пример 30 : 1,46(9H, с), 3,36(2H, неразрешенный дт, J=22,1, 5,9 Гц), 4,27(2H, д, J= 5,6 Гц), 4,66(2H, неразрешенный дт, J=47,2, 5,9 Гц), 4,80-4,94(1H, м), 6,77-6,97(3H, м), 7,24-7,29(1H, м).
Пример 30Синтез дигидрохлорида N-(3-(S-(2-фтороэтил)изотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 29, как исходное вещество, по методике, аналогичной Примеру 5, получают 36 мг названного соединения, (выход 79%). 1H-ЯМР (D2O),  : 3,61(2H, неразрешенный дт, J=25,4, 5,3 Гц), 4,24(2H, с), 4,82(2H, неразрешенный дт, J=46,5, 5,3 Гц), 7,41-7,71(4H, м).
Пример 31 : 3,61(2H, неразрешенный дт, J=25,4, 5,3 Гц), 4,24(2H, с), 4,82(2H, неразрешенный дт, J=46,5, 5,3 Гц), 7,41-7,71(4H, м).
Пример 31Синтез гидробромида т-бутилового эфира N-(3-(S-(2-пропенил)изотиоуреидо)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 24, как исходное вещество, по методике, аналогичной Примеру 4, получают 118 мг названного соединения (выход 34%). 1H-ЯМР (CDCl33),  : 1,46(9H, c), 3,85(2H, д, J=6,6 Гц), 4,30(2H, д, J= 5,9 Гц), 4,93-5,05(1H, м), 5,28(1H, д, J=9,9 Гц), 5,44(1H, д, J=16,8 Гц), 5,83-5,98(1H, м), 7,03-7,36(4H, м).
МС (м/з) 321(М+) : 1,46(9H, c), 3,85(2H, д, J=6,6 Гц), 4,30(2H, д, J= 5,9 Гц), 4,93-5,05(1H, м), 5,28(1H, д, J=9,9 Гц), 5,44(1H, д, J=16,8 Гц), 5,83-5,98(1H, м), 7,03-7,36(4H, м).
МС (м/з) 321(М+)Пример 32 Синтез дигидрохлорида N-(3-(S-(2-пропенил)изотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 31, как исходное вещество, по методике, аналогичной Примеру 5, получают 73 мг названного соединения (выход 85%). 1H-ЯМР (D2O),  : 3,91(2H, д, J=6,6 Гц), 4,24(2H, с), 5,36(1H, д, J=10,2 Гц), 5,44(1H, д, J=16,8 Гц), 5,93-6,08(1H, м), 7,42-7,66(4H, м).
МС (м/з) 221(М+) : 3,91(2H, д, J=6,6 Гц), 4,24(2H, с), 5,36(1H, д, J=10,2 Гц), 5,44(1H, д, J=16,8 Гц), 5,93-6,08(1H, м), 7,42-7,66(4H, м).
МС (м/з) 221(М+)Пример 33 Синтез т-бутилового эфира N-(3-(N’-нитрогуанидино)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 23, как исходное вещество, по методике, аналогичной Примеру 6, получают 201 мг названного соединения (выход 70%). 1H-ЯМР (CDCl3),  : 1,45(9H, с), 4,33(2H, д, J=6,3 Гц), 4,86- 5,00(1H, м), 6,55(1H, шс), 7,17-7,47(4H, м), 9,03(1H, шс).
ББА-МС (м/з) 310(М++1) : 1,45(9H, с), 4,33(2H, д, J=6,3 Гц), 4,86- 5,00(1H, м), 6,55(1H, шс), 7,17-7,47(4H, м), 9,03(1H, шс).
ББА-МС (м/з) 310(М++1)Пример 34 Синтез N-(3-(N’-нитрогуанидино)фенилметил)амина Смесь соединения (230 мг), полученного в Примере 33, метиленхлорида (3 мл) и трифторуксусной кислоты (1,15 мл) перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь концентрируют при пониженном давлении, к полученному остатку добавляют 25% водный раствор аммиака и реакционную смесь экстрагируют хлороформом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – метанол), получая 117 мг названного соединения (выход 75%). 1H-ЯМР (CDCl3),  : 4,14(2H, с), 7,30-7,34(2H, м), 7,45(1H, д, J=7,9 Гц), 7,56(1H, с).
Пример 35 : 4,14(2H, с), 7,30-7,34(2H, м), 7,45(1H, д, J=7,9 Гц), 7,56(1H, с).
Пример 35Синтез формиата т-бутилового эфира N-(3-гуанидинофенилметил)карбаминовой кислоты Раствор соединения (190 мг), полученного в Примере 33, в смеси 4,4% муравьиная кислота/метанол (10 мл) добавляют по каплям к суспензии палладиевой черни (200 мг) в смеси 4,4% муравьиная кислота/метанол (10 мл) при комнатной температуре и перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении; полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – хлороформ:метанол=8:2), получая 71 мг названного соединения (выход 37%). 1H-ЯМР (CDCl3),  : 1,39(9H, с), 4,22(2H, д, J=5,9 Гц), 5,59-5,76(1H, м), 7,05-7,36(4H, м), 9,72(1H, шс).
ББА-МС (м/з) 265(М++1) : 1,39(9H, с), 4,22(2H, д, J=5,9 Гц), 5,59-5,76(1H, м), 7,05-7,36(4H, м), 9,72(1H, шс).
ББА-МС (м/з) 265(М++1)Пример 36 Синтез дигидрохлорида N-(3-гуанидинофенилметил)амина Используя соединение, полученное в Примере 35, как исходное вещество, по методике, аналогичной Примеру 5, получают 57 мг названного соединения, количественно. 1H-ЯМР (D2O),  : 4,22(2H,с), 7,35-7,60(4H, м).
ББА-МС (м/з) 165(М++1) : 4,22(2H,с), 7,35-7,60(4H, м).
ББА-МС (м/з) 165(М++1)Пример 37 Синтез N-(3-нитрофенилметил)диметиламина Раствор м-нитро-  -бромэтана (3,2 г) в диметилформамиде (50 мл) добавляют по каплям к раствору гидрохлорида диметиламина (1,45 г) и триэтиламина (4,36 мл) в диметилформамиде (50 мл). Реакционную смесь перемешивают в течение 1 ч при комнатной температуре и затем температуру поднимают до 50oC, при которой перемешивают в течение 3 ч. Реакционную смесь отгоняют при пониженном давлении, добавляют воду к остатку и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат= 2:1), получая 2,56 г названного соединения (выход 96%).
1H-ЯМР (CDCl3), -бромэтана (3,2 г) в диметилформамиде (50 мл) добавляют по каплям к раствору гидрохлорида диметиламина (1,45 г) и триэтиламина (4,36 мл) в диметилформамиде (50 мл). Реакционную смесь перемешивают в течение 1 ч при комнатной температуре и затем температуру поднимают до 50oC, при которой перемешивают в течение 3 ч. Реакционную смесь отгоняют при пониженном давлении, добавляют воду к остатку и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат= 2:1), получая 2,56 г названного соединения (выход 96%).
1H-ЯМР (CDCl3),  : 2,26(6H, с), 3,15(2H, с), 7,49 (1H, дд, J=7,9, 7,6 Гц), 7,67 (1H, д, J=7,6 Гц), 8,12 (1H, д, J=7,9 Гц), 8,19 (1H, с).
Пример 38 : 2,26(6H, с), 3,15(2H, с), 7,49 (1H, дд, J=7,9, 7,6 Гц), 7,67 (1H, д, J=7,6 Гц), 8,12 (1H, д, J=7,9 Гц), 8,19 (1H, с).
Пример 38Синтез N-(3-аминофенилметил)диметиламина Используя соединение, полученное в Примере 37, как исходное вещество, по методике, аналогичной Примеру 2, получают 1,6 г названного соединения (выход 99%). 1H-ЯМР (CDCl3),  : 2,24(6H, с), 3,37(2H, с), 3,45(2H, шс), 6,58(1H, д, J=6,6 Гц), 6,66-6,69(2H, м), 7,10(1H, дд, J=7,6, 6,6 Гц).
Пример 39 : 2,24(6H, с), 3,37(2H, с), 3,45(2H, шс), 6,58(1H, д, J=6,6 Гц), 6,66-6,69(2H, м), 7,10(1H, дд, J=7,6, 6,6 Гц).
Пример 39Синтез ацетата N-(3-(N’-нитрогуанидино)фенилметил)диметиламина Используя соединение, полученное в Примере 38, как исходное вещество, по методике, аналогичной Примеру 6, получают 0,11 г названного соединения (выход 42%). 1H-ЯМР (ДМСО-d6),  : 2,13(3H, с), 2,16(6H с), 3,37(2H, с), 7,08(1H, д, J=7,3 Гц), 7,22-7,30(3H, м), 8,26- 8,80(1H, м).
МС (м/з) 191(М+-46) : 2,13(3H, с), 2,16(6H с), 3,37(2H, с), 7,08(1H, д, J=7,3 Гц), 7,22-7,30(3H, м), 8,26- 8,80(1H, м).
МС (м/з) 191(М+-46)Пример 40 Синтез N-(3-тиоуреидофенилметил)диметиламина Бензоилхлорид (0,18 мл) добавляют к раствору тиоцианата аммония (0,12 г) в ацетоне (7 мл) и кипятят с обратным холодильником в течение 5 ч. Затем добавляют раствор соединения (0,21 г), полученного в Примере 38, в ацетоне (6 мл). Реакционную смесь перемешивают при комнатной температуре в течение 20 мин и затем добавляют воду, получая желтый осадок, который отделяют фильтрацией. К выделенному продукту добавляют 10% водный раствор гидроксида натрия (20 мл) и кипятят с обратным холодильником в течение 5 мин. Реакционную смесь подкисляют 35% HCl, затем слабо подщелачивают 28% водным раствором аммиака и концентрируют до 20 мл при пониженном давлении. Полученный осадок отфильтровывают и фильтрат экстрагируют хлороформом; органический слой сушат безводным сульфатом магния и растворитель концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – хлороформ:метанол=5:1), получая 0,1 г названного соединения (выход 35%). 1H-ЯМР (ДМСО-d6),  : 2,22(6H, с), 3,49(2H, с), 6,72(2H, шс), 7,15-7,36(4H, м), 9,12(1H, шс).
МС (м/з) 209(М+) : 2,22(6H, с), 3,49(2H, с), 6,72(2H, шс), 7,15-7,36(4H, м), 9,12(1H, шс).
МС (м/з) 209(М+)Пример 41 Синтез моногидрохлорида мононитрата N-(3-(S-метилизотиоуреидо)фенилметил)диметиламина К смеси соединения (42,7 мг), полученного в Примере 40, и тетрагидрофурана (2 мл) добавляют 60% азотную кислоту (0,1 мл) и полученную смесь концентрируют при пониженном давлении, получая нитрат, который подвергают той же самой реакции, как в Примере 4; остаток растворяют в этаноле (1 мл) и добавляют при комнатной температуре раствор хлористого водорода в 1,4-диоксане (4N, 1 мл); затем, реакционную смесь концентрируют при пониженном давлении. Остаток растворяют в воде, промывают этилацетатом и лиофильно сушат, получая 46,9 мг названного соединения (выход 71%). 1H-ЯМР (ДМСО-d6),  : 2,34(6H, с), 2,42(3H, с), 3,54(2H, с), 4,45(3H, ш), 6,86(1H, д, J=7,9 Гц), 6,92(1H, с), 6,99(1H, д, J=7,6 Гц), 7,25(1H, дд, J=7,9, 7,6 Гц), 7,69(1H, с).
МС (м/з) 223(М+) : 2,34(6H, с), 2,42(3H, с), 3,54(2H, с), 4,45(3H, ш), 6,86(1H, д, J=7,9 Гц), 6,92(1H, с), 6,99(1H, д, J=7,6 Гц), 7,25(1H, дд, J=7,9, 7,6 Гц), 7,69(1H, с).
МС (м/з) 223(М+)Пример 42 Синтез N-(3-нитрофенилметил)метиламина К смеси цианоборогидрида натрия (2,52 г), триэтиламина (18,7 мл), метиламина гидрохлорида (5,42 г) и метанола (660 мл) добавляют по каплям м-нитробензальдегид (10,10 г) на протяжении 20 мин при комнатной температуре и полученную смесь перемешивают при комнатной температуре в течение 20 ч. pH реакционной смеси доводят до 2 путем добавления 10% HCl и метанол отгоняют при пониженном давлении. Остаток промывают хлороформом, 10% водный раствор гидроксида калия добавляют к водному слою для доведения pH до значения 12 и смесь экстрагируют хлороформом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – хлороформ:метанол= 95:5), получая 3,0 г названного соединения (выход 27%). 1H-ЯМР (CDCl3),  : 1,52(1H, шс), 2,47(3H, с), 3,87(2H, с), 7,50(1H, дд, J=7,8, 7,8 Гц), 7,68(1H, д, J=7,8 Гц), 8,20(1H, д, J=7,8 Гц), 8,44(1H, с).
Пример 43 : 1,52(1H, шс), 2,47(3H, с), 3,87(2H, с), 7,50(1H, дд, J=7,8, 7,8 Гц), 7,68(1H, д, J=7,8 Гц), 8,20(1H, д, J=7,8 Гц), 8,44(1H, с).
Пример 43Синтез т-бутилового эфира N-(3-нитрофенилметил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 42, как исходное вещество, по методике, аналогичной Примеру 22, получают 4,1 г названного соединения (выход 85%). 1H-ЯМР (CDCl3),  : 1,49(9H, с), 2,87(3H, с), 4,51(2H, с), 7,49-7,56(2H, м), 8,11-8,15(2H, м).
Пример 44 : 1,49(9H, с), 2,87(3H, с), 4,51(2H, с), 7,49-7,56(2H, м), 8,11-8,15(2H, м).
Пример 44Синтез т-бутилового эфира N-(3-аминофенилметил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 43, как исходное вещество, по методике, аналогичной Примеру 2, получают 2,96 г названного соединения (выход 81%). 1H-ЯМР (CDCl3),  : 1,48(9H, с), 2,80(3H, с), 3,40(2H, ш), 4,33(2H, с), 6,44-6,64(3H, м), 7,10(1H, дд, J=7,8, 7,8 Гц).
ББА-МС (м/з) 236 (М+) : 1,48(9H, с), 2,80(3H, с), 3,40(2H, ш), 4,33(2H, с), 6,44-6,64(3H, м), 7,10(1H, дд, J=7,8, 7,8 Гц).
ББА-МС (м/з) 236 (М+)Пример 45 Синтез т-бутилового эфира N-(3-тиоуреидофенилметил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 44, как исходное вещество, по методике, аналогичной Примеру 3, получают 2,21 г названного соединения (выход 86%). 1H-ЯМР (CDCl3),  : 1,47(9H, с), 2,84(3H, с), 4,42(2H, с), 6,36(2H, шс), 7,10-7,18(3H, м), 7,39(1H, дд, J=7,8, 7,8 Гц), 8,56(1H, с) : 1,47(9H, с), 2,84(3H, с), 4,42(2H, с), 6,36(2H, шс), 7,10-7,18(3H, м), 7,39(1H, дд, J=7,8, 7,8 Гц), 8,56(1H, с)ББА-МС (м/з) 296(М++1) Пример 46 Синтез гидроиодида т-бутилового эфира N-(3-(S-этилизотиоуреидо)фенилметил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 45, как исходное вещество, по методике, аналогичной Примеру 27, получают 0,27 г названного соединения (выход 69%). 1H-ЯМР (CDCl3),  : 1,35(3H, т, J=7,3 Гц), 1,48(9H, с), 2,81(3H, с), 3,01(2H, к, J= 7,3 Гц), 4,38(2H, с), 4,55(1H, шс), 6,78-6,82 (2H, м), 6,89(1H, д, J=7,6 Гц), 7,25(1H, дд, J=7,6, 7,6 Гц).
ББА-МС (м/з) 324(М++1) : 1,35(3H, т, J=7,3 Гц), 1,48(9H, с), 2,81(3H, с), 3,01(2H, к, J= 7,3 Гц), 4,38(2H, с), 4,55(1H, шс), 6,78-6,82 (2H, м), 6,89(1H, д, J=7,6 Гц), 7,25(1H, дд, J=7,6, 7,6 Гц).
ББА-МС (м/з) 324(М++1)Пример 47 Синтез дигидрохлорида N-(3-(S-этилизотиоуреидо)фенилметил)метиламина Используя соединение, полученное в Примере 46, как исходное вещество, по методике, аналогичной Примеру 5, получают 85,5 мг названного соединения (выход 87%). 1H-ЯМР (D2O),  : 1,43(3H, т, J=7,3 Гц), 2,78(3H, с), 3,27 (2H, к, J=7,3 Гц), 4,37(2H, с), 7,47-7,51(2H, м), 7,56(1H, д, J=7,6 Гц), 7,66(1H, дд, J= 7,6, 7,3 Гц).
Пример 48 : 1,43(3H, т, J=7,3 Гц), 2,78(3H, с), 3,27 (2H, к, J=7,3 Гц), 4,37(2H, с), 7,47-7,51(2H, м), 7,56(1H, д, J=7,6 Гц), 7,66(1H, дд, J= 7,6, 7,3 Гц).
Пример 48Синтез т-бутилового эфира N-(4-нитрофенилэтил)карбаминовой кислоты Используя гидрохлорид N-(4-нитрофенилэтил)амин как исходное вещество, по методике, аналогичной Примеру 22, получают названное соединение, количественно. 1H-ЯМР (CDCl3),  : 1,41(9H, с), 2,72-3,02 (2H, м), 3,19- 3,50(2H, м), 7,23(2H, д, J=9,0 Гц), 8,05 (2H, д, J=9,0 Гц,).
ББА-МС (м/з) 267(М++1) : 1,41(9H, с), 2,72-3,02 (2H, м), 3,19- 3,50(2H, м), 7,23(2H, д, J=9,0 Гц), 8,05 (2H, д, J=9,0 Гц,).
ББА-МС (м/з) 267(М++1)Пример 49 Синтез т-бутилового эфира N-(4-aминoфeнилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 48, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 78%). 1H-ЯМР (CDCl3),  : 1,43(9H, с), 2,62-2,69(2H, м), 3,22- 3,36(2H, м), 3,57(2H, шс), 4,56-4,72(1H, м), 6,61(2H, д, J=8,3 Гц), 6,95 (2H, д, J=8,3 Гц).
МС (м/з) 236 (М+) : 1,43(9H, с), 2,62-2,69(2H, м), 3,22- 3,36(2H, м), 3,57(2H, шс), 4,56-4,72(1H, м), 6,61(2H, д, J=8,3 Гц), 6,95 (2H, д, J=8,3 Гц).
МС (м/з) 236 (М+)Пример 50 Синтез т-бутилового эфира N-(4-тиоуреидофенилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 49, как исходное вещество, по методике, аналогичной Примеру 3, получают названное соединение (выход 71%). 1H-ЯМР (ДМСО-d6),  : 1,39(9H, с), 2,57-2,71(2H, м), 3,10- 3,21(2H, м), 6,70-6,84(1H, м), 7,13(2H, д, J=8,3 Гц), 7,30(2H, д, J=8,3 Гц), 9,59(1H, с).
МС (м/з) 295 (М+) : 1,39(9H, с), 2,57-2,71(2H, м), 3,10- 3,21(2H, м), 6,70-6,84(1H, м), 7,13(2H, д, J=8,3 Гц), 7,30(2H, д, J=8,3 Гц), 9,59(1H, с).
МС (м/з) 295 (М+)Пример 51 Синтез гидроиодида т-бутилового эфира N-(4-(S-метилизотиоуреидо)фенилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 50, как исходное вещество, по методике, аналогичной Примеру 4, получают названное соединение, количественно. 1H-ЯМР (CDCl3),  : 1,42(9H, с), 2,71(3H, с), 2,99(2H, т, J=6,9 Гц), 3,26-3,38(2H, м), 4,80-4,92(1H, м), 6,75-7,08(2H, м), 7,18-7,27(4H, м).
МС(м/з) 309(М+) : 1,42(9H, с), 2,71(3H, с), 2,99(2H, т, J=6,9 Гц), 3,26-3,38(2H, м), 4,80-4,92(1H, м), 6,75-7,08(2H, м), 7,18-7,27(4H, м).
МС(м/з) 309(М+)Пример 52 Синтез дигидрохлорида N-(4-(S-метилизотиоуреидо)фенилэтил) амина Используя соединение, полученное в Примере 51, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 2,71(3H, с), 3,08(2H, т, J=7,3 Гц), 3,30-3,36(2H, м), 7,35-7,52(4H, м).
ББА-МС (м/з) 210(М++1) : 2,71(3H, с), 3,08(2H, т, J=7,3 Гц), 3,30-3,36(2H, м), 7,35-7,52(4H, м).
ББА-МС (м/з) 210(М++1)Пример 53 Синтез т-бутилового эфира N-(4-(N’-нитрогуанидино)фенилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 49, как исходное вещество, по методике, аналогичной Примеру 6, получают названное соединение (выход 35%). 1H-ЯМР (ДМСО-d6),  : 1,38(9H, с), 2,66-2,72(2H, м), 3,10- 3,18(2H, м), 6,82(1H, шс), 7,20(4H, с), 8,13(1H, шс), 9,52(1H, с).
ББА-МС (м/з) 324(М++1) : 1,38(9H, с), 2,66-2,72(2H, м), 3,10- 3,18(2H, м), 6,82(1H, шс), 7,20(4H, с), 8,13(1H, шс), 9,52(1H, с).
ББА-МС (м/з) 324(М++1)Пример 54 Синтез N-(4-(N’-нитрогуанидино)фенилэтил)амина Используя соединение, полученное в Примере 53, как исходное вещество, реакцию проводят по методике, аналогичной Примеру 5, и продукт очищают с помощью колоночной хроматографии на основном силикагеле (элюент – метиленхлорид: метанол=95:5), перекристаллизовывают из смеси этанол и диэтиловый эфир, получая названное соединение (выход 57%). 1H-ЯМР (ДМСО-d6),  : 2,60-2,65(2H, м), 2,77(2H, т, J=6,9 Гц), 5,75(2H, ш), 7,20(4H, с), 8,27-8,30(2H, м).
ББА-МС (м/з) 224 (M++l) : 2,60-2,65(2H, м), 2,77(2H, т, J=6,9 Гц), 5,75(2H, ш), 7,20(4H, с), 8,27-8,30(2H, м).
ББА-МС (м/з) 224 (M++l)Пример 55 Синтез 3-(2-бромэтил)нитробензола Тетрабромид углерода (2,48 г) и трифенилфосфин (2,35 г) добавляют к смеси 3- нитрофенэтилового спирта (1,0 г) и метиленхлорида (20 мл) при охлаждении льдом и перемешивают в течение 30 мин при охлаждении льдом. Реакционную смесь дистиллируют при пониженном давлении и полученный остаток очищают с помощью колоночной хроматографии на силикагеле (злюент, н-гексан:этилацетат=4:1), получая 1,58 г названного соединения, количественно. 1H-ЯМР (CDCl3),  : 3,29(2H, т, J= 6,9 Гц), 3,65(2H, т, J=6,9 Гц), 7,48-7,61(2H, м), 8,08-8,10(2H, м).
МС (м/з) 230 (М+) : 3,29(2H, т, J= 6,9 Гц), 3,65(2H, т, J=6,9 Гц), 7,48-7,61(2H, м), 8,08-8,10(2H, м).
МС (м/з) 230 (М+)Пример 56 Синтез т-бутилового эфира N-(3-нитрофенилэтил)карбаминовой кислоты К смеси соединения (1,58 г), полученного в Примере 55, и диметилсульфоксида (30 мл) добавляют 28% водный раствор аммиака (15 мл) и полученную смесь перемешивают при комнатной температуре в течение 2,5 ч. Непрореагировавший 28% водный раствор аммиака отгоняют при пониженном давлении и к полученному остатку добавляют ди-т-бутилбикарбонат (6,5 г) и триэтиламин (1,3 мл), реакцию проводят при комнатной температуре в течение 18 ч. Реакционный раствор разбавляют этилацетатом и промывают последовательно 2N HCl и водой; органический слой сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хромато-графии на силикагеле (элюент – н-гексан:этилацетат=4:1), получая 1,22 г названного соединения (выход 77%). 1H-ЯМР (CDCl3),  : 1,42(9H, с), 2,91-2,97(2H, м), 3,41-3,46(2H, м), 4,98-5,13(1H, м), 7,45-7,58(2H, м), 8,05- 8,08(2H, м).
МС (м/з) 266(М+) : 1,42(9H, с), 2,91-2,97(2H, м), 3,41-3,46(2H, м), 4,98-5,13(1H, м), 7,45-7,58(2H, м), 8,05- 8,08(2H, м).
МС (м/з) 266(М+)Пример 57 Синтез т-бутилового эфира N-(3-аминофенилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 56, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 69%). 1H-ЯМР (CDCl3),  : 1,44(9H, с), 2,70(2H, т, J=6,9 Гц), 3,34-3,48(2H, м), 4,48-4,60(1H, м), 6,53-6,60(3H, м), 7,80(1H, т, J=7,6 Гц).
МС (м/з) 236(М+) : 1,44(9H, с), 2,70(2H, т, J=6,9 Гц), 3,34-3,48(2H, м), 4,48-4,60(1H, м), 6,53-6,60(3H, м), 7,80(1H, т, J=7,6 Гц).
МС (м/з) 236(М+)Пример 58 Синтез т-бутилового эфира N-(3-тиоуреидофенилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 57, как исходное вещество, по методике, аналогичной Примеру 3, получают названное соединение (выход 82%). 1H-ЯМР (CDCl3),  : 1,29(9H, с), 2,76-2,81(2H, м), 3,35- 3,49(2H, м), 4,53-4,68(1H, м), 6,46(2H, шс), 7,02-7,35(4H, м), 8,09(1H, шс).
МС (м/з) 295 (М+) : 1,29(9H, с), 2,76-2,81(2H, м), 3,35- 3,49(2H, м), 4,53-4,68(1H, м), 6,46(2H, шс), 7,02-7,35(4H, м), 8,09(1H, шс).
МС (м/з) 295 (М+)Пример 59 Синтез гидроиодида т-бутилового эфира N-(3-(S-метилизотиоуреидо)фенилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 58, как исходное вещество, по методике, аналогичной Примеру 4, получают названное соединение (выход 94%). 1H-ЯМР (CDCl3),  : 1,39(9H, с), 2,76(3H, с), 2,81(2H, т, J=6,9 Гц), 3,35-3,38(2H, м), 4,75-4,87(1H, м), 7,15-7,19(3H, м), 7,30-7,38(1H, м), 7,72(2H, ш).
МС (м/з) 309(М+) : 1,39(9H, с), 2,76(3H, с), 2,81(2H, т, J=6,9 Гц), 3,35-3,38(2H, м), 4,75-4,87(1H, м), 7,15-7,19(3H, м), 7,30-7,38(1H, м), 7,72(2H, ш).
МС (м/з) 309(М+)Пример 60 Синтез дигидрохлорида N-(3-(S-метилизотиоуреидо)фенилэтил)амина Используя соединение, полученное в Примере 59, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 2,72(3H, с), 3,05-3,11(2H, м), 3,34(2H, т, J=7,3 Гц), 7,31-7,59(4H, м).
МС (м/з) 209 (М+) : 2,72(3H, с), 3,05-3,11(2H, м), 3,34(2H, т, J=7,3 Гц), 7,31-7,59(4H, м).
МС (м/з) 209 (М+)Пример 61 Синтез т-бутилового эфира N-(3-(N’-нитрогуанидино)фенилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 57, как исходное вещество, по методике, аналогичной Примеру 6, получают названное соединение (выход 59%). 1H-ЯМР (CDCl3),  : 1,29(9H, с), 2,79(2H, т, J=6,3 Гц), 3,38-3,43(2H, м), 4,91-5,03(1H, м), 7,11-7,36(4H, м), 9,76(1H, шс).
ББА-МС (м/з) 324(М++1) : 1,29(9H, с), 2,79(2H, т, J=6,3 Гц), 3,38-3,43(2H, м), 4,91-5,03(1H, м), 7,11-7,36(4H, м), 9,76(1H, шс).
ББА-МС (м/з) 324(М++1)Пример 62 Синтез гидрохлорида N-(3-(N’-нитрогуанидино)фенилэтил)амина Используя соединение, полученное в Примере 61, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 44%). 1H-ЯМР (D2O),  : 3,04(2H, т, J=7,3 Гц), 3,31(2H, т, J=7,3 Гц), 7,26-7,55(4H, м).
Пример 63 : 3,04(2H, т, J=7,3 Гц), 3,31(2H, т, J=7,3 Гц), 7,26-7,55(4H, м).
Пример 63Синтез 2-т-бутоксикарбониламино-3-(4-нитрофенил)пропионовой кислоты 2N водный раствор гидроксида натрия (12,3 мл) и ди-т-бутилдикарбонат (6,36 г) добавляют к смеси 4-нитрофенилаланина (5,35 г), 1,4-диоксана (80 мл) и воды (40 мл) при охлаждении льдом и перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь концентрируют при пониженном давлении и полученный остаток разбавляют этилацетатом и промывают последовательно 2N HCl и водой; органический слой сушат безводным сульфатом натрия и растворитель концентрируют при пониженном давлении. Полученный остаток перекристаллизовывают из смеси этилацетата и н-гексана, получая названное соединение, количественно. 1H-ЯМР (CDCl3), 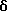 : 1,36(9H, с), 3,06-3,25(2H, м), 4,01-4,78(1H, м), 7,45(2H, д, J=9,0 Гц), 8,08(2H, д, J=9,0 Гц).
МС (м/з) 310(М+) : 1,36(9H, с), 3,06-3,25(2H, м), 4,01-4,78(1H, м), 7,45(2H, д, J=9,0 Гц), 8,08(2H, д, J=9,0 Гц).
МС (м/з) 310(М+)Пример 64 Синтез метилового эфира 2-т-бутоксикарбониламино-3-(4-нитрофенил)пропионовой кислоты К смеси соединения (1,15 г), полученного в Примере 63, диэтилового эфира (6 мл) и метанола (14 мл) добавляют раствор триметилсилилдиазометана в н-гексане (2,0 М, 7,4 мл) и полученную смесь перемешивают при комнатной температуре в течение 16 ч. Реакционный раствор концентрируют при пониженном давлении, получая названное соединение, количественно. 1H-ЯМР (CDCl3),  : 1,45(9H, с), 3,08-3,31(2H, м), 3,75(3H, с), 4,38-4,78(1H, м), 4,95-5,42(1H, м), 7,28(2H, д, J=9,0 Гц), 8,09(2H, д, J=9,0 Гц).
МС (м/з) 324(М+) : 1,45(9H, с), 3,08-3,31(2H, м), 3,75(3H, с), 4,38-4,78(1H, м), 4,95-5,42(1H, м), 7,28(2H, д, J=9,0 Гц), 8,09(2H, д, J=9,0 Гц).
МС (м/з) 324(М+)Пример 65 Синтез метилового эфира 2-т-бутоксикарбониламино-3-(4-аминофенил)пропионовой кислоты Используя соединение, полученное в Примере 64, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 87%). 1H-ЯМР (CDCl3),  : 1,41(9H, с), 2,95(2H, д, J=5,8 Гц), 3,61(2H, шс), 3,68(3H, с), 4,40-4,58(1H, м), 5,04-5,08(1H, м), 6,58(2H, д, J=8,3 Гц), 6,88(2H, д, J=8,3 Гц).
МС (м/з) 294(М+) : 1,41(9H, с), 2,95(2H, д, J=5,8 Гц), 3,61(2H, шс), 3,68(3H, с), 4,40-4,58(1H, м), 5,04-5,08(1H, м), 6,58(2H, д, J=8,3 Гц), 6,88(2H, д, J=8,3 Гц).
МС (м/з) 294(М+)Пример 66 Синтез метилового эфира 2-т-бутоксикарбониламино-3-(4-тиоуреидофенил)пропионовой кислоты Используя соединение, полученное в Примере 65, как исходное вещество, по методике, аналогичной Примеру 3, получают названное соединение (выход 73%). 1H-ЯМР (CDCl3),  : 1,41(9H, с), 2,97-3,19(2H, м), 3,74(3H, с), 4,56-4,60(1H, м), 5,11(1H, д, J=7,9 Гц), 6,28(2H, шс), 7,18(2H, д, J=5,9 Гц), 7,21(2H, д, J=5,9 Гц), 8,36(1H, с).
ББА-МС (м/з) 354(М++1) : 1,41(9H, с), 2,97-3,19(2H, м), 3,74(3H, с), 4,56-4,60(1H, м), 5,11(1H, д, J=7,9 Гц), 6,28(2H, шс), 7,18(2H, д, J=5,9 Гц), 7,21(2H, д, J=5,9 Гц), 8,36(1H, с).
ББА-МС (м/з) 354(М++1)Пример 67 Синтез гидроиодида метилового эфира 2-т-бутоксикарбониламино-3-(4-(S-метилизотиоуреидо)пропионовой кислоты Используя соединение, полученное в Примере 66, как исходное вещество, по методике, аналогичной Примеру 4, получают названное соединение (выход 80%). 1H-ЯМР (CDCl3),  : 1,42(9H, с), 2,64(3H, с), 2,99-3,17(2H, м), 3,72(3H, с), 4,48-4,53(1H, м), 5,04(1H, д, J=7,9 Гц), 6,25- 6,53(2H, м), 7,13(2H, д, J=8,6 Гц), 7,17(2H, д, J=8,6 Гц).
ББА-МС (м/з) 368(М++1) : 1,42(9H, с), 2,64(3H, с), 2,99-3,17(2H, м), 3,72(3H, с), 4,48-4,53(1H, м), 5,04(1H, д, J=7,9 Гц), 6,25- 6,53(2H, м), 7,13(2H, д, J=8,6 Гц), 7,17(2H, д, J=8,6 Гц).
ББА-МС (м/з) 368(М++1)Пример 68 Синтез дигидрохлорида метилового эфира 2-амино-3-(4-(S-метилизотиоуреидо)фенил)пропионовой кислоты Используя соединение, полученное в Примере 67, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 2,70(3H, с), 3,28-3,47(2H, м), 3,85(3H, с), 4,45-4,52(1H, м), 7,39(2H, д, J=8,6 Гц), 7,45(2H, д, J=8,6 Гц).
ББА-МС (м/з) 268(М++1) : 2,70(3H, с), 3,28-3,47(2H, м), 3,85(3H, с), 4,45-4,52(1H, м), 7,39(2H, д, J=8,6 Гц), 7,45(2H, д, J=8,6 Гц).
ББА-МС (м/з) 268(М++1)Пример 69 Синтез метилового эфира 2-т-бутоксикарбониламино-3-(4-(N’-нитрогуанидино)фенил)пропионовой кислоты Используя соединение, полученное в Примере 65, как исходное вещество, по методике, аналогичной Примеру 6, получают названное соединение (выход 74%). 1H-ЯМР (CDCl3),  : 1,41(9H, с), 3,00-3,20(2H, м), 3,73(3H, с), 4,50-4,36(1H, м), 5,20(1H, д, J=7,6 Гц), 7,20-7,28(4H, м).
ББА-МС (м/з) 382(М++1) : 1,41(9H, с), 3,00-3,20(2H, м), 3,73(3H, с), 4,50-4,36(1H, м), 5,20(1H, д, J=7,6 Гц), 7,20-7,28(4H, м).
ББА-МС (м/з) 382(М++1)Пример 70 Синтез метилового эфира 2-амино-3-(4-(N’-нитрогуанидино)фенил)пропионовой кислоты Используя соединение, полученное в Примере 69, как исходное вещество, по методике, аналогичной Примеру 54, получают названное соединение (выход 65%). 1H-ЯМР (CDCl3),  : 2,80-2,91(1H, м), 3,07-3,17(1H, м), 3,74(3H, с), 3,70-3,82(1H, м), 7,24-7,34(4H, м).
ББА-МС (м/з) 282(М++1) : 2,80-2,91(1H, м), 3,07-3,17(1H, м), 3,74(3H, с), 3,70-3,82(1H, м), 7,24-7,34(4H, м).
ББА-МС (м/з) 282(М++1)Пример 71 Синтез т-бутилового эфира 2-т-бутоксикарбониламино-3-(4-нитрофенил)пропионовой кислоты К смеси соединения (6,9 г), полученного в Примере 63, и метиленхлорида (70 мл) добавляют т-бутанол (20 мл), N,N-диметиламинопиридин (2,63 г) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (4,9 г) и полученную смесь перемешивают при комнатной температуре в течение 4 дней. Реакционную смесь разбавляют этилацетатом и промывают последовательно 2N HCl и насыщенным водным раствором хлорида натрия; органический слой сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=3:1), получая 7,64 г названного соединения (выход 97%). 1H-ЯМР (CDCl3),  : 1,417(9H, с), 1,419(9H, с), 3,08-3,30 (2H, м), 4,45-4,53(1H, м), 5,02-5,11 (1H, м), 7,36(2H, д, J=8,6 Гц), 8,16(2H, д, J= 5,6 Гц).
ББА-МС(м/з) 367(М++1) : 1,417(9H, с), 1,419(9H, с), 3,08-3,30 (2H, м), 4,45-4,53(1H, м), 5,02-5,11 (1H, м), 7,36(2H, д, J=8,6 Гц), 8,16(2H, д, J= 5,6 Гц).
ББА-МС(м/з) 367(М++1)Пример 72 Синтез т-бутилового эфира 2-т-бутоксикарбониламино-3-(4-аминофенил)пропионовой кислоты Используя соединение, полученное в Примере 71, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 84%). 1H-ЯМР (ДМСО-d6),  : 1,36(18H, с), 2,51-2,80 (2H, м), 3,88- 3,94(1H, м), 4,58-4,80(2H, м), 6,48(2H, д, J=7,9 Гц), 6,86(2H, д, J=7,9 Гц).
ББА-МС (м/з) 337(М++1) : 1,36(18H, с), 2,51-2,80 (2H, м), 3,88- 3,94(1H, м), 4,58-4,80(2H, м), 6,48(2H, д, J=7,9 Гц), 6,86(2H, д, J=7,9 Гц).
ББА-МС (м/з) 337(М++1)Пример 73 Синтез т-бутилового эфира 2-т-бутоксикарбониламино-3-(4-тиоуреидофенил)пропионовой кислоты Используя соединение, полученное в Примере 72, как исходное вещество, по методике, аналогичной Примеру 3, получают названное соединение, количественно. 1H-ЯМР (CDCl3),  : 1,41(9H, с), 1,42(9H, с), 2,96-3,14(2H, м), 4,22-4,46(1H, м), 5,16(1H, д, J=7,3 Гц), 6,40(2H, шс), 7,18(2H, д, J=8,3 Гц), 7,24(2H, д, J=8,3 Гц), 8,70(1H, шс).
ББА-МС (м/з) 396(М++1) : 1,41(9H, с), 1,42(9H, с), 2,96-3,14(2H, м), 4,22-4,46(1H, м), 5,16(1H, д, J=7,3 Гц), 6,40(2H, шс), 7,18(2H, д, J=8,3 Гц), 7,24(2H, д, J=8,3 Гц), 8,70(1H, шс).
ББА-МС (м/з) 396(М++1)Пример 74 Синтез гидроиодида т-бутилового эфира 2-т-бутоксикарбониламино-3-(4-(S-метилизотиоуреидо)фенил)пропионовой кислоты Используя соединение, полученное в Примере 73, как исходное вещество, по методике, аналогичной Примеру 4, получают названное соединение (выход 99%). 1H-ЯМР (CDCl3),  : 1,42(18H, с), 2,76(3H, с), 2,99-3,16(2H, м), 4,42-4,45(1H, м), 5,07(1H, д, J=7,9 Гц), 7,26(4H, с), 8,55(2H, ш) : 1,42(18H, с), 2,76(3H, с), 2,99-3,16(2H, м), 4,42-4,45(1H, м), 5,07(1H, д, J=7,9 Гц), 7,26(4H, с), 8,55(2H, ш)ББА-МС (м/з) 410(М++1) Пример 75 Синтез дигидрохлорида 2-амино-3-(4-(S-метилизотиоуреидо)фенил)пропионовой кислоты Используя соединение, полученное в Примере 74, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 91%). 1H-ЯМР (D2O),  : 2,69(3H, с), 3,23-3,36(2H, м), 4,21-4,26(1H, м), 7,37(2H, д, J=8,6 Гц), 7,46(2H, д, J=8,6 Гц).
МС (м/з) 253(М+) : 2,69(3H, с), 3,23-3,36(2H, м), 4,21-4,26(1H, м), 7,37(2H, д, J=8,6 Гц), 7,46(2H, д, J=8,6 Гц).
МС (м/з) 253(М+)Пример 76 Синтез т-бутилового эфира 2-т-бутоксикарбониламино-3-(4-(N’-нитрогуанидино)фенил)пропионовой кислоты Используя соединение, полученное в Примере 72, как исходное вещество, по методике, аналогичной Примеру 6, получают названное соединение (выход 67%). 1H-ЯМР (ДМСО-d6),  : 1,36(9H, с), 1,39(9H, с), 2,80-2,98(2H, м), 4,02-4,07(1H, м), 7,10(1H, д, J=7,9 Гц), 7,19-7,26(4H, м), 8,14(1H, шс), 9,49(1H, с).
ББА-МС (м/з) 424(М++1) : 1,36(9H, с), 1,39(9H, с), 2,80-2,98(2H, м), 4,02-4,07(1H, м), 7,10(1H, д, J=7,9 Гц), 7,19-7,26(4H, м), 8,14(1H, шс), 9,49(1H, с).
ББА-МС (м/з) 424(М++1)Пример 77 Синтез дигидрохлорида 2-амино-3-(4-(N’-нитрогуанидино)фенил)пропионовой кислоты Используя соединение, полученное в Примере 76, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (ДМСО-d6 + D2O),  : 3,05-3,22 (2H, м), 4,12-4,17(1H, м), 7,25-7,33(4H, м).
ББА-МС (м/з) 268(М+1) : 3,05-3,22 (2H, м), 4,12-4,17(1H, м), 7,25-7,33(4H, м).
ББА-МС (м/з) 268(М+1)Пример 78 Синтез метилового эфира 2-т-бутоксикарбониламино-2-(4-аминофенил)уксусной кислоты К смеси 4-нитрофенилуксусной кислоты (2,0 г), бензола (40 мл) и N-бромсукцинимида (3,3 г), добавляют 2,2′-азобис(2-метилпропионитрил) (0,16 г) и нагревают при температуре флегмы в течение 22 ч. Реакционную смесь разбавляют этилацетатом и промывают последовательно 2N HCl и водой; органический слой сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат:уксусная кислота=75:25:1), получая 2-бром-2- (4-нитрофенил)уксусную кислоту. Полученное бромосоединение смешивают с 28% водным раствором аммиака (5 мл) и перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь концентрируют при пониженном давлении; к полученному остатку добавляют 1N водный раствор гидроксида натрия (20 мл), 1,4-диоксан (10 мл) и ди-т-бутилдикарбонат (7,2 г) и перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь концентрируют при пониженном давлении и полученный остаток растворяют в смеси метанола (20 мл) и диэтилового эфира (10 мл); раствор триметилсилилдиазометана (2,0 М) в н-гексане добавляют до тех пор, пока реакционная смесь не перестанет вспениваться; затем реакционную смесь концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан: этилацетат= 3: 1), получая метиловый эфир 2-т-бутоксикарбониламино-2-(4-нитрофенил)уксусной кислоты. Полученный метиловый эфир подвергают обработке, как в Примере 2, получая 0,77 г названного соединения (выход 25%). 1H-ЯМР (CDCl3),  : 1,42(9H, с), 3,68(3H, с), 3,75(2H, шс), 5,16(1H, д, J=6,9 Гц), 5,45-5,56(1H, м), 6,60(2H, д, J=8,6 Гц), 7,10(2H, д, J=8,6 Гц).
МС (м/з) 280 (М+) : 1,42(9H, с), 3,68(3H, с), 3,75(2H, шс), 5,16(1H, д, J=6,9 Гц), 5,45-5,56(1H, м), 6,60(2H, д, J=8,6 Гц), 7,10(2H, д, J=8,6 Гц).
МС (м/з) 280 (М+)Пример 79 Синтез метилового эфира 2-т-бутоксикарбониламино-2-(4-тиоуреидофенил)уксусной кислоты Используя соединение, полученное в Примере 78, как исходное вещество, по методике, аналогичной Примеру 3, получают названное соединение (выход 43%). 1H-ЯМР (CDCl3),  : 1,42(9H, с), 3,73(3H, с), 5,25-5,38(1H, м), 5,73-5,90(1H, м), 6,41(2H, шс), 7,23(2H, д, J=8,3 Гц), 7,42(2H, д, J=8,3 Гц), 8,70(1H, шс).
МС (м/з) 339(М+) : 1,42(9H, с), 3,73(3H, с), 5,25-5,38(1H, м), 5,73-5,90(1H, м), 6,41(2H, шс), 7,23(2H, д, J=8,3 Гц), 7,42(2H, д, J=8,3 Гц), 8,70(1H, шс).
МС (м/з) 339(М+)Пример 80 Синтез гидроиодида метилового эфира 2-т-бутоксикарбониламино-2-(4-(S-метилизотиоуреидо)фенил)уксусной кислоты Используя соединение, полученное в Примере 79, как исходное вещество, по методике, аналогичной Примеру 4, получают названное соединение (выход 52%). 1H-ЯМР (CDCl3),  : 1,43(9H, с), 2,70(3H, с), 3,73(3H, с), 5,30-5,34(1H, м), 5,73-5,77(1H, м), 7,27(2H, д, J=8,3 Гц), 7,38-7,60(4H, м).
МС (м/з) 353(М+) : 1,43(9H, с), 2,70(3H, с), 3,73(3H, с), 5,30-5,34(1H, м), 5,73-5,77(1H, м), 7,27(2H, д, J=8,3 Гц), 7,38-7,60(4H, м).
МС (м/з) 353(М+)Пример 81 Синтез дигидрохлорида метилового эфира 2-амино-2-(4-(S-метилизотиоуреидо)фенил)уксусной кислоты Используя соединение, полученное в Примере 80, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 88%). 1H-ЯМР (D2O),  : 2,71(3H, с), 3,85(3H, с), 5,40(1H, с), 7,52(2H, д, J= 8,6 Гц), 7,64(2H, д, J=8,6 Гц).
МС (м/з) 253 (М+) : 2,71(3H, с), 3,85(3H, с), 5,40(1H, с), 7,52(2H, д, J= 8,6 Гц), 7,64(2H, д, J=8,6 Гц).
МС (м/з) 253 (М+)Пример 82 Синтез т-бутилового эфира N-(4-аминофенилметил)карбаминовой кислоты Гидроксид натрия (1,77 г) добавляют к смеси N-(4-аминофенилметил)амина (3,0 г) и воды (30 мл) при охлаждении льдом и перемешивают в течение 5 мин при охлаждении льдом; после этого к реакционной смеси при охлаждении льдом добавляют ди-т-бутилдикарбонат (4,88 г) и перемешивают в течение 10 ч при комнатной температуре. Осадок, который образуется во время реакции, собирают фильтрацией, получая 5,83 г названного соединения (выход 92%). 1H-ЯМР (CDCl3),  : 1,45(9H, с), 3,64(2H, шс), 4,18(2H, д, J=5,5 Гц), 6,64(2H, д, J=8,5 Гц), 7,07(2H, д, J=8,5 Гц).
Пример 83 : 1,45(9H, с), 3,64(2H, шс), 4,18(2H, д, J=5,5 Гц), 6,64(2H, д, J=8,5 Гц), 7,07(2H, д, J=8,5 Гц).
Пример 83Синтез т-бутилового эфира N-(4-(N’-циклопропилгуанидино)фенилметил)карбаминовой кислоты Соединение (0,946 г), полученное в Примере 82, добавляют к смеси гидроиодида N-циклопропил-S-метилизомочевины (1,0 г) и пиридина (10 мл) и нагревают при температуре флегмы в течение 2 дней. Реакционную смесь концентрируют при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=2:1), получая 0,131 г названного соединения (выход 12%). 1H-ЯМР (CD3OD),  : 0,61-0,65(2H, м), 0,76-0,86(2H, м), 1,44(9H, с), 2,72-2,86(1H, м), 4,18-4,24(2H, м), 7,23-7,34(4H, м).
Пример 84 : 0,61-0,65(2H, м), 0,76-0,86(2H, м), 1,44(9H, с), 2,72-2,86(1H, м), 4,18-4,24(2H, м), 7,23-7,34(4H, м).
Пример 84Синтез N-(4-(N’-циклопропилгуанидино)фенилметил)амина Используя соединение, полученное в Примере 83, как исходное вещество, по методике, аналогичной Примеру 34, получают названное соединение (выход 53%). 1H-ЯМР (CD3OD),  : 0,58-0,65(2H, м), 0,73-0,86(2H, м), 2,72-2,88(1H, м), 3,76(2H, с), 7,30(2H, д, J=8,6 Гц), 7,35(2H, д, J=8,6 Гц).
Пример 85 : 0,58-0,65(2H, м), 0,73-0,86(2H, м), 2,72-2,88(1H, м), 3,76(2H, с), 7,30(2H, д, J=8,6 Гц), 7,35(2H, д, J=8,6 Гц).
Пример 85Синтез т-бутилового эфира N-(4-(N’-нитрогуанидино)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 82, как исходное вещество, по методике, аналогичной Примеру 6, получают названное соединение (выход 56%). 1H-ЯМР (CD3OD),  : 1,44(9H, с), 4,22(2H, с), 7,27(2H, д, J=8,5 Гц), 7,34(2H, д, J=8,5 Гц).
Пример 86 : 1,44(9H, с), 4,22(2H, с), 7,27(2H, д, J=8,5 Гц), 7,34(2H, д, J=8,5 Гц).
Пример 86Синтез N-(4-(N’-нитрогуанидино)фенилметил)амина Используя соединение, полученное в Примере 85, как исходное вещество, по методике, аналогичной Примеру 34, получают названное соединение (выход 75%). 1H-ЯМР (CD3OD),  : 4,12(2H, с), 7,41(2H, д, J=8,6 Гц), 7,49(2H, д, J= 8,6 Гц).
Пример 87 : 4,12(2H, с), 7,41(2H, д, J=8,6 Гц), 7,49(2H, д, J= 8,6 Гц).
Пример 87Синтез т-бутилового эфира N-(3-(N’-циклопропилгуанидино)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 23, как исходное вещество, по методике, аналогичной Примеру 83, получают названное соединение (выход 8,8%). 1H-ЯМР (CDCl3),  : 0,62-0,76(2H, м), 0,80-0,95(2H, м), 1,46(9H, с), 2,73-2,92(1H, м), 4,30(2H, д, J=5,5 Гц), 4,93-5,07(1H, м), 6,52(1H, шс), 7,12-7,39(4H, м), 7,98(1H, шс).
Пример 88 : 0,62-0,76(2H, м), 0,80-0,95(2H, м), 1,46(9H, с), 2,73-2,92(1H, м), 4,30(2H, д, J=5,5 Гц), 4,93-5,07(1H, м), 6,52(1H, шс), 7,12-7,39(4H, м), 7,98(1H, шс).
Пример 88Синтез N-(3-(N’-циклопропилгуанидино)фенилметил)амина Используя соединение, полученное в Примере 87, как исходное вещество, по методике, аналогичной Примеру 34, получают названное соединение (выход 51%). 1H-ЯМР (CD3OD),  : 0,61-0,69(2H,м), 0,80-0,87(2H, м), 2,72- 2,90(1H, м), 3,77(2H, с), 7,13-7,35 (4H, м).
Пример 89 : 0,61-0,69(2H,м), 0,80-0,87(2H, м), 2,72- 2,90(1H, м), 3,77(2H, с), 7,13-7,35 (4H, м).
Пример 89Синтез N-(3-(N’-циклопропилгуанидинометил)фенил)-N’-нитрогуанидина Используя соединение, полученное в Примере 34, как исходное вещество, по методике, аналогичной Примеру 83, получают названное соединение (выход 22%). 1H-ЯМР (CD3OD),  : 0,57-0,62(2H, м), 0,78-0,84(2H, м), 2,52-2,68(1H, м), 4,86(2H, с), 7,18-7,40(4H, м).
Пример 90 : 0,57-0,62(2H, м), 0,78-0,84(2H, м), 2,52-2,68(1H, м), 4,86(2H, с), 7,18-7,40(4H, м).
Пример 90Синтез N-(3-(N’-нитрогуанидинометил)фенил)-N’-нитрогуанидина Используя соединение, полученное в Примере 34, как исходное вещество и также используя N-метил-N’-нитро-N’-нитрозогуанидин в качестве реагента, реакцию проводят по методике, аналогичной Примеру 83, получая названное соединение (выход 25%). 1H-ЯМР (CD3OD),  : 4,50(2H, с), 7,20-7,22(1H, м), 7,32-7,43(3H, м).
Пример 91 : 4,50(2H, с), 7,20-7,22(1H, м), 7,32-7,43(3H, м).
Пример 91Синтез т-бутилового эфира N-(3-(S-н-пропилизотиоуреидо)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 24, как исходное вещество и также используя н-пропилиодид в качестве реагента, реакцию проводят по методике, аналогичной Примеру 29, получая 227 мг названного соединения (выход 99%). 1H-ЯМР (CDCl3),  : 1,04(3H, т, J=7,3 Гц), 1,46(9H, с), 1,68- 1,81(2H, м), 3,10(2H, т, J=7,3 Гц), 4,31(2H, д, J=5,6 Гц), 4,84-4,98(1H, м),6,98-7,35(4H, м).
ББА-МС (м/з) 324(М++1) : 1,04(3H, т, J=7,3 Гц), 1,46(9H, с), 1,68- 1,81(2H, м), 3,10(2H, т, J=7,3 Гц), 4,31(2H, д, J=5,6 Гц), 4,84-4,98(1H, м),6,98-7,35(4H, м).
ББА-МС (м/з) 324(М++1)Пример 92 Синтез дигидрохлорида N-(3-(S-н-пропилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 91, как исходное вещество, по методике, аналогичной Примеру 5, получают 173 мг названного соединения (выход 83%). 1H-ЯМР (D2O),  : 1,05(3H, т, J=7,3 Гц), 1,73-1,87(2H, м), 3,22(2H, т, J=7,3 Гц), 4,25(2H, с), 7,43- 7,66(4H, м).
ББА-МС (м/з) 224(М++1) : 1,05(3H, т, J=7,3 Гц), 1,73-1,87(2H, м), 3,22(2H, т, J=7,3 Гц), 4,25(2H, с), 7,43- 7,66(4H, м).
ББА-МС (м/з) 224(М++1)Пример 93 Синтез т-бутилового эфира N-(3-(S-н-бутилизотиоуреидо)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 24, как исходное вещество, а также используя н-бутилиодид в качестве реагента, реакцию проводят по методике, аналогичной Примеру 29, получают 220 мг названного соединения (выход 92%). 1H-ЯМР (CDCl33),  : 0,94(3H, т, J=7,3 Гц), 1,39-1,53(2H, м), 1,46(9H, с), 1,64-1,75(2H, м), 3,14(2H, т, J=7,3 Гц), 4,31(2H, д, J=5,6 Гц), 4,82-4,98(1H, м), 7,02-7,36(4H, м).
ББА-МС (м/з) 338(М++1) : 0,94(3H, т, J=7,3 Гц), 1,39-1,53(2H, м), 1,46(9H, с), 1,64-1,75(2H, м), 3,14(2H, т, J=7,3 Гц), 4,31(2H, д, J=5,6 Гц), 4,82-4,98(1H, м), 7,02-7,36(4H, м).
ББА-МС (м/з) 338(М++1)Пример 94 Синтез дигидрохлорида N-(3-(S-н-бутилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 93, как исходное вещество, по методике, аналогичной Примеру 5, получают 194 мг названного соединения (выход 96%). 1H-ЯМР (D2O),  : 0,93(3H, т, J=7,3 Гц), 1,40-1,53(2H, м), 1,70-1,80(2H, м), 3,23(2H, т, J=7,3 Гц), 4,24(2H, с), 7,43-7,65(4H, м).
ББА-МС (м/з) 238(М++1) : 0,93(3H, т, J=7,3 Гц), 1,40-1,53(2H, м), 1,70-1,80(2H, м), 3,23(2H, т, J=7,3 Гц), 4,24(2H, с), 7,43-7,65(4H, м).
ББА-МС (м/з) 238(М++1)Пример 95 Синтез т-бутилового эфира N-(1-метил-1-(3-(S-этилизотиоуреидо) фенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 3, как исходное вещество, а также используя этилиодид в качестве реагента, реакцию проводят по методике, аналогичной Примеру 29, получая 110 мг названного соединения (выход 97%). 1H-ЯМР (CDCl3),  : 1,37(9H, с), 1,37(3H, т, J=7,3 Гц), 1,60(6H, с), 3,04(2H, к, J=7,3 Гц), 4,92(1H, шс), 6,77- 7,28(4H, м).
МС (м/з) 337 (М+) : 1,37(9H, с), 1,37(3H, т, J=7,3 Гц), 1,60(6H, с), 3,04(2H, к, J=7,3 Гц), 4,92(1H, шс), 6,77- 7,28(4H, м).
МС (м/з) 337 (М+)Пример 96 Синтез дигидрохлорида N-(1-метил-1-(3-(S-этилизотиоуреидо)фенил)этил)амина Используя соединение, полученное в Примере 95, как исходное вещество, по методике, аналогичной Примеру 5, получают 72 мг названного соединения (выход 71%). 1H-ЯМР (D2O),  : 1,42(3H, т, J=7,3 Гц), 1,77(6H, с), 3,24(2H, к, J=7,3 Гц), 7,37-7,68(4H, м).
МС (м/з) 237 (М+) : 1,42(3H, т, J=7,3 Гц), 1,77(6H, с), 3,24(2H, к, J=7,3 Гц), 7,37-7,68(4H, м).
МС (м/з) 237 (М+)Пример 97 Синтез N-(4-нитрофенилэтил)диметиламина Используя п-нитрофенэтилбромид как исходное вещество и также используя бикарбонат натрия в качестве основания, по методике, аналогичной примеру 37, получают 2,3 г названного соединения (выход 54%). 1H-ЯМР (CDCl3),  : 2,30(6H, с), 2,56(2H, т, J=7,3 Гц), 2,89(2H, т, J= 7,3 Гц), 7,37(2H, д, J=8,9 Гц), 8,14(2H, д, J=8,9 Гц).
МС (м/з) 194(М+) : 2,30(6H, с), 2,56(2H, т, J=7,3 Гц), 2,89(2H, т, J= 7,3 Гц), 7,37(2H, д, J=8,9 Гц), 8,14(2H, д, J=8,9 Гц).
МС (м/з) 194(М+)Пример 98 Синтез дигидрохлорида N-(4-аминофенилэтил)диметиламина Используя соединение, полученное в Примере 97, как исходное вещество, после добавления раствора хлористого водорода (4N) в 1,4-диоксане, по методике, аналогичной Примеру 2, получают 2,37 г названного соединения (выход 85%). 1H-ЯМР (CDCl33),  : 2,27(6H, с), 2,55(2H, т, J=6,9 Гц), 2,80(2H, т, J= 6,9 Гц), 7,23(2H, д, J=8,3 Гц), 7,31(2H, д, J=8,3 Гц).
МС (м/з) 164(М+) : 2,27(6H, с), 2,55(2H, т, J=6,9 Гц), 2,80(2H, т, J= 6,9 Гц), 7,23(2H, д, J=8,3 Гц), 7,31(2H, д, J=8,3 Гц).
МС (м/з) 164(М+)Пример 99 Синтез N-(4-(N’-нитрогуанидино)фенилэтил)диметиламина Используя соединение, полученное в Примере 98, как исходное вещество и затем растворяя его в смеси растворителей, состоящей из ацетонитрила и метанола, по методике, аналогичной Примеру 6, получают 45 мг названного соединения (выход 30%). 1H-ЯМР (CDCl3),  : 2,28(6H, с), 2,43-2,49(2H,м), 2,64- 2,69(2H, м), 6,61(2H, д, J=8,2 Гц), 6,98(2H, д, J=8,2 Гц).
МС (м/з) 219 (М+-32) : 2,28(6H, с), 2,43-2,49(2H,м), 2,64- 2,69(2H, м), 6,61(2H, д, J=8,2 Гц), 6,98(2H, д, J=8,2 Гц).
МС (м/з) 219 (М+-32)Пример 100 Синтез N-(4-тиоуреидофенилэтил)диметиламина Используя соединение, полученное в Примере 98, как исходное вещество, по методике, аналогичной Примеру 3, получают 1,46 г названного соединения (выход 99%). 1H-ЯМР (CDCl3),  : 2,29(6H, с), 2,54(2H, т, J=6,9 Гц), 2,80(2H, т, J= 6,9 Гц), 6,04(2H, шс), 7,15(2H, д, J= 8,6 Гц), 7,28(2H, д, J=8,6 Гц), 7,85(1H, шс).
МС (м/з) 223 (М+) : 2,29(6H, с), 2,54(2H, т, J=6,9 Гц), 2,80(2H, т, J= 6,9 Гц), 6,04(2H, шс), 7,15(2H, д, J= 8,6 Гц), 7,28(2H, д, J=8,6 Гц), 7,85(1H, шс).
МС (м/з) 223 (М+)Пример 101 Синтез моногидрохлорида мононитрата N-(4-(S-метилизотиоуреидо)фенилэтил)диметиламина Используя соединение, полученное в Примере 100, как исходное вещество, по методике, аналогичной Примеру 41, получают 0,18 г названного соединения (выход 99%). 1H-ЯМР (ДМСО-d6),  : 2,68(3H, с), 2,86(6H, с), 2,99-3,05(2H, м), 3,17-3,44(2H, м), 7,31(2H, д, J=8,3 Гц), 7,43(2H, д, J=8,3 Гц), 9,27(1H, шс), 9,69(1H, шс), 11,22(1H, шс).
МС (м/з) 237(М+) : 2,68(3H, с), 2,86(6H, с), 2,99-3,05(2H, м), 3,17-3,44(2H, м), 7,31(2H, д, J=8,3 Гц), 7,43(2H, д, J=8,3 Гц), 9,27(1H, шс), 9,69(1H, шс), 11,22(1H, шс).
МС (м/з) 237(М+)Пример 102 Синтез моногидрохлорида мононитрата N-(4-(S-этилтиоуреидо)фенилэтил)диметиламина Используя соединение, полученное в Примере 100, как исходное вещество и также используя этилиодид в качестве реагента, по методике, аналогичной Примеру 41, получают 107 мг названного соединения (выход 48%). 1H-ЯМР (ДМСО-d6),  : 1,22(3H, т, J=7,3 Гц), 2,27(6H, с), 2,50-2,60(2H, м), 2,64-2,85(2H, м), 2,89(2H, к, J=7,3 Гц), 6,74(2H, д, J=7,9 Гц), 7,07(2H, д, J=7,9 Гц).
МС (м/з) 251(М+) : 1,22(3H, т, J=7,3 Гц), 2,27(6H, с), 2,50-2,60(2H, м), 2,64-2,85(2H, м), 2,89(2H, к, J=7,3 Гц), 6,74(2H, д, J=7,9 Гц), 7,07(2H, д, J=7,9 Гц).
МС (м/з) 251(М+)Пример 103 Синтез т-бутилового эфира N-(4-(S-этилизотиоуреидо)фенилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 50, как исходное вещество и также используя этилиодид в качестве реагента, реакцию проводят по методике, аналогичной Примеру 29, получая названное соединение (выход 85%). 1H-ЯМР (ДМСО-d6),  : 1,22(3H, т, J=7,3 Гц), 1,38(9H, с), 2,58-2,65(2H, м), 2,90(2H, к, J= 7,3 Гц), 3,06-3,15(2H, м), 6,21- 6,58(1H, шс), 6,68-6,84(2H, м), 7,05(2H, д, J=8,3 Гц) : 1,22(3H, т, J=7,3 Гц), 1,38(9H, с), 2,58-2,65(2H, м), 2,90(2H, к, J= 7,3 Гц), 3,06-3,15(2H, м), 6,21- 6,58(1H, шс), 6,68-6,84(2H, м), 7,05(2H, д, J=8,3 Гц)МС (м/з) 323 (М+) Пример 104 Синтез дигидрохлорида N-(4-(S-этилизотиоуреидо)фенилэтил)амина Используя соединение, полученное в Примере 103, как исходное вещество, по методике, аналогичной Примеру 5, получают 0,18 г названного соединения (выход 93%). 1H-ЯМР (D2O),  : 1,41(3H, т, J=7,3 Гц), 3,02-3,10(2H, м), 3,18-3,34(4H, м), 7,36(2H, д, J=8,3 Гц), 7,47(2H, д, J=8,3 Гц).
ББА-МС (м/з) 224 (М++1) : 1,41(3H, т, J=7,3 Гц), 3,02-3,10(2H, м), 3,18-3,34(4H, м), 7,36(2H, д, J=8,3 Гц), 7,47(2H, д, J=8,3 Гц).
ББА-МС (м/з) 224 (М++1)Пример 105 Синтез N-(1-(3-нитрофенил)этил)метиламина Используя 3′-нитроацетофенон как исходное вещество, по методике, аналогичной Примеру 42, получают 4,14 г названного соединения (выход 80%). 1H-ЯМР (CDCl3),  : 1,38(3H, д, J=6,8 Гц), 2,32(3H, с), 3,79(1H, к, J= 6,8 Гц), 7,51(1H, дд, J=7,8, 7,8 Гц), 7,69-7,74(1H, м), 8,03-8,14(1H, м), 8,17-8,26(1H, м).
Пример 106 : 1,38(3H, д, J=6,8 Гц), 2,32(3H, с), 3,79(1H, к, J= 6,8 Гц), 7,51(1H, дд, J=7,8, 7,8 Гц), 7,69-7,74(1H, м), 8,03-8,14(1H, м), 8,17-8,26(1H, м).
Пример 106Синтез т-бутилового эфира N-(1-(3-нитрофенил)этил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 105, как исходное вещество, по методике, аналогичной Примеру 22, получают названное соединение, количественно. 1H-ЯМР (CDCl3),  : 1,49(9H, с), 1,55(3H, д, J=5,8 Гц), 2,64(3H, с), 5,34-5,71(1H, м), 7,43-7,69(2H, м), 8,07-8,20(2H, м).
Пример 107 : 1,49(9H, с), 1,55(3H, д, J=5,8 Гц), 2,64(3H, с), 5,34-5,71(1H, м), 7,43-7,69(2H, м), 8,07-8,20(2H, м).
Пример 107Синтез т-бутилового эфира N-(1-(3-аминофенил)этил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 106, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 86%). 1H-ЯМР (CDCl3),  : 1,44(3H, д, J=6,9 Гц), 1,49(9H, с), 2,58(3H, с), 3,53-3,75(2H, м), 5,37-5,59(1H, м), 6,55-6,87(3H, м), 7,11(1H, дд, J=8,2, 7,6 Гц).
Пример 108 : 1,44(3H, д, J=6,9 Гц), 1,49(9H, с), 2,58(3H, с), 3,53-3,75(2H, м), 5,37-5,59(1H, м), 6,55-6,87(3H, м), 7,11(1H, дд, J=8,2, 7,6 Гц).
Пример 108Синтез т-бутилового эфира N-(1-(3-тиоуреидофенил)этил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 107, как исходное вещество, по методике, аналогичной Примеру 3, получают названное соединение, количественно. 1H-ЯМР (CDCl3),  : 1,39-1,55(12H, м), 2,61(3H, с), 5,30- 5,50(1H, м), 6,32(2H, шс), 7,11-7,22(3H, м), 7,38(1H, дд, J=8,2, 7,9 Гц), 8,72(1H, шс).
МС (м/з) 309 (М+) : 1,39-1,55(12H, м), 2,61(3H, с), 5,30- 5,50(1H, м), 6,32(2H, шс), 7,11-7,22(3H, м), 7,38(1H, дд, J=8,2, 7,9 Гц), 8,72(1H, шс).
МС (м/з) 309 (М+)Пример 109 Синтез гидроиодида т-бутилового эфира N-(1-(3-(S-метилизотиоуреидо)фенил)этил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 108, как исходное вещество, по методике, аналогичной Примеру 4, получают названное соединение (выход 87%). 1H-ЯМР (CDCl3),  : 1,44-1,53 (12H, м), 2,61(3H, с), 2,77(3H, с), 5,26-5,57(1H, м), 7,14-7,57(4H, м), 8,51(2H, ш).
Пример 110 : 1,44-1,53 (12H, м), 2,61(3H, с), 2,77(3H, с), 5,26-5,57(1H, м), 7,14-7,57(4H, м), 8,51(2H, ш).
Пример 110Синтез дигидрохлорида N-(1-(3-(S-метилизотиоуреидо)фенил)этил)метиламина Используя соединение, полученное в Примере 109, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 1,71(3H, д, J=6,8 Гц), 2,63(3H, с), 2,72(3H, с), 4,45 (1H, к, J=6,8 Гц), 7,34-7,84(4H, м).
МС (м/з) 223 (М+) : 1,71(3H, д, J=6,8 Гц), 2,63(3H, с), 2,72(3H, с), 4,45 (1H, к, J=6,8 Гц), 7,34-7,84(4H, м).
МС (м/з) 223 (М+)Пример 111 Синтез гидроиодида т-бутилового эфира N-(1-(3-(S-этилизотиоуреидо)фенил)этил)метилкарбаминовой кислоты Используя соединение, полученное в примере 108, в качестве исходного вещества, по методике, аналогичной Примеру 27, получают названное соединение (выход 83%). 1H-ЯМР (CDCl3),  : 1,40(3H, т, J=7,3 Гц), 1,43- 1,61(12H, м), 2,62(3H, с), 3,35(2H, к, J=7,3 Гц), 5,29-5,56(1H, м), 7,16-7,28(2H, м), 7,28-7,34(1H, м), 7,35- 7,43(1H,м), 8,17(2H, ш).
Пример 112 : 1,40(3H, т, J=7,3 Гц), 1,43- 1,61(12H, м), 2,62(3H, с), 3,35(2H, к, J=7,3 Гц), 5,29-5,56(1H, м), 7,16-7,28(2H, м), 7,28-7,34(1H, м), 7,35- 7,43(1H,м), 8,17(2H, ш).
Пример 112Синтез дигидрохлорида N-(1-(3-(S-этилизoтиoуpeидo)фенил)этил)метиламина Используя соединение, полученное в Примере 111, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 98%). 1H-ЯМР (D2O),  : 1,43(3H, т, J=7,3 Гц), 1,70(3H, д, J=6,8 Гц), 2,63(3H, с), 3,25(2H, к, J=7,3 Гц), 4,44(1H, к, J=6,8 Гц), 7,40-7,74(4H, м).
МС (м/з) 237 (М+) : 1,43(3H, т, J=7,3 Гц), 1,70(3H, д, J=6,8 Гц), 2,63(3H, с), 3,25(2H, к, J=7,3 Гц), 4,44(1H, к, J=6,8 Гц), 7,40-7,74(4H, м).
МС (м/з) 237 (М+)Пример 113 Синтез т-бутилового эфира N-(1-(3-(N’-нитрогуанидино)фенил)этил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 107, в качестве исходного вещества, по методике, аналогичной Примеру 6, получают названное соединение (выход 61%). 1H-ЯМР (CDCl3),  : 1,43-1,48(12H, м), 2,56(3H, с), 3,52-3,82(1H, м), 6,52-6,68(3H, м), 7,10(1H, дд, J=8,2, 7,6 Гц).
Пример 114 : 1,43-1,48(12H, м), 2,56(3H, с), 3,52-3,82(1H, м), 6,52-6,68(3H, м), 7,10(1H, дд, J=8,2, 7,6 Гц).
Пример 114Синтез N-(1-(3-(N’-нитрогуанидино)фенил)этил)метиламина Используя соединение, полученное в Примере 113, в качестве исходного вещества, по методике, аналогичной Примеру 55, получают названное соединение (выход 29%). 1H-ЯМР (CDCl3),  : 1,33(3H, д, J=6,8 Гц), 2,31(3H, с, 3,54(1H, к, J=6,8 Гц), 6,49-6,73(3H, м), 7,11(1H, дд, J=7,8, 7,3 Гц).
МС (м/з) 237 (М+) : 1,33(3H, д, J=6,8 Гц), 2,31(3H, с, 3,54(1H, к, J=6,8 Гц), 6,49-6,73(3H, м), 7,11(1H, дд, J=7,8, 7,3 Гц).
МС (м/з) 237 (М+)Пример 115 Синтез гидроиодида т-бутилового эфира N-(3-(S-метилизотиоуреидо)фенилметил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 45, в качестве исходного вещества, по методике, аналогичной Примеру 4, получают названное соединение (выход 56%). 1H-ЯМР (CDCl3),  : 1,47(9H, с), 2,44(3H, с), 2,81(3H, с), 4,38(2H, с), 6,79-6,83(2H, м), 6,90(1H, д, J=7,6 Гц), 7,25(1H, дд, J=8,6, 7,6 Гц).
Пример 116 : 1,47(9H, с), 2,44(3H, с), 2,81(3H, с), 4,38(2H, с), 6,79-6,83(2H, м), 6,90(1H, д, J=7,6 Гц), 7,25(1H, дд, J=8,6, 7,6 Гц).
Пример 116Синтез дигидрохлорида N-(3-(S-метилизотиоуреидо)фенилметил)метиламина Используя соединение, полученное в Примере 115, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 56%). 1H-ЯМР (D2O),  : 2,70(3H, с), 2,75(3H, с), 4,28(2H, с), 7,40-7,71(4H, м).
Пример 117 : 2,70(3H, с), 2,75(3H, с), 4,28(2H, с), 7,40-7,71(4H, м).
Пример 117Синтез N-(2-метокси-5-нитрофенилметил)фталимида Фталимид натрия (836 мг) добавляют к раствору 2-метокси-5-нитробензилбромида (1,01 г) в диметилформамиде (41 мл) и перемешивают при комнатной температуре в течение 10 мин. Добавляют воду и 2N HCl к реакционной смеси и проводят экстракцию этилацетатом; затем органический слой последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Образующийся остаток промывают последовательно этилацетатом и гексаном, получая 1,2 г названного соединения (выход 94%). 1H-ЯМР (ДМСО-d6),  : 3,97(3H,с), 4,80(2H,с), 7,26(1H, д, J=9,3 Гц), 7,82-7,93(4H, м), 7,99(1H, д, J=2,9 Гц), 8,40(1H, дд, J=9,3, 2,9 Гц).
Пример 118 : 3,97(3H,с), 4,80(2H,с), 7,26(1H, д, J=9,3 Гц), 7,82-7,93(4H, м), 7,99(1H, д, J=2,9 Гц), 8,40(1H, дд, J=9,3, 2,9 Гц).
Пример 118Синтез т-бутилового эфира N-(2-метокси-5-нитpофенилметил)карбаминовой кислоты К раствору соединения (357 мг), полученного в Примере 117, и метанола (10 мл) добавляют моногидрат гидразина (0,06 мл) и перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь подкисляют путем добавления 2N HCl и промывают этилацетатом. Водный слой подщелачивают путем добавления 2N водного раствора гидроксида натрия и экстрагируют зтилацетатом; затем органический слой последовательно промывают водой и насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. К раствору образовавшегося остатка в диметилформамиде (10 мл) добавляют ди-т-бутилдикарбонат (274 мг) и триэтиламин (0,17 мл) и перемешивают при комнатной температуре в течение 3 ч. Добавляют воду и 2N HCl к реакционной смеси и проводят экстракцию этилацетатом; затем органический слой последовательно промывают водой и насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=1:1), получая 62 мг названного соединения (выход 20%). 1H-ЯМР (CDCl3),  : 1,47(9H, с), 3,96(3H, с), 4,23-4,40(2H, м), 4,80-5,09(1H, м), 6,92(1H, д, J=9,3 Гц), 8,16-8,20(2H, м).
Пример 119 : 1,47(9H, с), 3,96(3H, с), 4,23-4,40(2H, м), 4,80-5,09(1H, м), 6,92(1H, д, J=9,3 Гц), 8,16-8,20(2H, м).
Пример 119Синтез т-бутилового эфира N-(5-амино-2-метоксифенилметил)карбаминовой кислоты Используя соединение, полученное в примере 118, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают названное соединение (выход 95%). 1H-ЯМР (CDCl3),  : 1,44(9H, c), 3,34(2H, ш), 3,76(3H, с), 4,22(2H, д, J=5,9 Гц), 4,80-5,19(1H, м), 6,57(1H, дд, J=8,6, 3,0 Гц), 6,64-6,82(2H, м).
Пример 120 : 1,44(9H, c), 3,34(2H, ш), 3,76(3H, с), 4,22(2H, д, J=5,9 Гц), 4,80-5,19(1H, м), 6,57(1H, дд, J=8,6, 3,0 Гц), 6,64-6,82(2H, м).
Пример 120Синтез т-бутилового эфира N-(2-метокси-5-тиоуреидофенилметил)карбаминовой кислоты К смеси соединения (52 мг), полученного в Примере 119, и N,N-диметиламинопиридина (53 мг) в метиленхлориде (5 мл) добавляют по каплям тиофосген (0,02 мл) и перемешивают при комнатной температуре в течение 15 мин. К реакционной смеси добавляют 28% водный раствор аммиака (5 мл) и перемешивают при комнатной температуре в течение 1,5 ч. После нейтрализации 2N HCl реакционную смесь экстрагируют метиленхлоридом и органический слой промывают последовательно водой и насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – этилацетат), получая 58 мг названного соединения (выход 91%). 1H-ЯМР (CDCl3),  : 1,44(9H, с), 3,86(3H, с), 4,27(2H, д, J=6,3 Гц), 4,90-5,05(1H, м), 5,95(2H, шс), 6,88(1H, д, J=8,6 Гц), 7,09-7,16(2H, м), 7,66(1H, шс).
Пример 121 : 1,44(9H, с), 3,86(3H, с), 4,27(2H, д, J=6,3 Гц), 4,90-5,05(1H, м), 5,95(2H, шс), 6,88(1H, д, J=8,6 Гц), 7,09-7,16(2H, м), 7,66(1H, шс).
Пример 121Синтез гидроиодида т-бутилового эфира N-(5-(S-этилизотиоуреидо)- 2-метоксифенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 120, в качестве исходного вещества, по методике, аналогичной Примеру 27, получают названное соединение (выход 90%). 1H-ЯМР (CDCl3),  : 1,38(3H, т, J=7,3 Гц), 1,45(9H, с), 3,30(2H, к, J= 7,3 Гц), 3,86(3H, с), 4,18-4,31(2H, м), 5,00-5,15(1H, м), 6,89(1H, д, J=9,3 Гц), 7,14-7,26(2H, м).
МС (м/з) 339 (М+) : 1,38(3H, т, J=7,3 Гц), 1,45(9H, с), 3,30(2H, к, J= 7,3 Гц), 3,86(3H, с), 4,18-4,31(2H, м), 5,00-5,15(1H, м), 6,89(1H, д, J=9,3 Гц), 7,14-7,26(2H, м).
МС (м/з) 339 (М+)Пример 122 Синтез дигидрохлорида N-(5-(S-этилизотиоуреидо)- 2-метоксифенилметил)амина Используя соединение, полученное в Примере 121, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 1,41(3H, т, J=7,3 Гц), 3,23(2H, к, J=7,3 Гц), 3,95(3H, с), 4,22(2H, с), 7,22(1H, д, J=8,9 Гц), 7,35(1H, д, J=2,6 Гц), 7,44(1H, дд, J=8,9, 2,6 Гц).
МС (м/з) 175 (М+-61) : 1,41(3H, т, J=7,3 Гц), 3,23(2H, к, J=7,3 Гц), 3,95(3H, с), 4,22(2H, с), 7,22(1H, д, J=8,9 Гц), 7,35(1H, д, J=2,6 Гц), 7,44(1H, дд, J=8,9, 2,6 Гц).
МС (м/з) 175 (М+-61)Пример 123 Синтез N-(3-нитрофенилметил)ацетамида Уксусный ангидрид (0,08 мл) добавляют по каплям к раствору 3-нитробензиламина гидрохлорида (139 мг) и триэтиламина (0,22 мл) в метиленхлориде (10 мл) и перемешивают при комнатной температуре в течение 2 ч. К реакционной смеси добавляют 2N HCl и проводят экстракцию метиленхлоридом; затем органический слой промывают последовательно водой и насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – этилацетат), получая 102 мг названного соединения (выход 71%). 1H-ЯМР (CDCl3),  : 2,03(3H, с), 4,51(2H, д, J=5,8 Гц), 6,43- 6,86(1H, м), 7,48(1H, дд, J=7,8, 6,8 Гц), 7,63(1H, д, J=7,8 Гц), 8,07-8,11(1H, м).
Пример 124 : 2,03(3H, с), 4,51(2H, д, J=5,8 Гц), 6,43- 6,86(1H, м), 7,48(1H, дд, J=7,8, 6,8 Гц), 7,63(1H, д, J=7,8 Гц), 8,07-8,11(1H, м).
Пример 124Синтез N-(3-аминофенилметил)ацетамида Используя соединение, полученное в Примере 123, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают названное соединение (выход 69%). 1H-ЯМР (CDCl3),  : 1,97(3H, с), 3,70(2H, шс), 4,28(2H, д, J=5,9 Гц), 6,00-6,28(1H, м), 6,48-6,68(3H, м), 7,00-7,14 (1H, м).
Пример 125 : 1,97(3H, с), 3,70(2H, шс), 4,28(2H, д, J=5,9 Гц), 6,00-6,28(1H, м), 6,48-6,68(3H, м), 7,00-7,14 (1H, м).
Пример 125Синтез N-(3-тиоуреидофенилметил)ацетамида Используя соединение, полученное в Примере 124, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают названное соединение, количественно. 1H-ЯМР (CDCl3),  : 1,98(3H, с), 4,33(2H, д, J=5,8 Гц), 6,94(2H, шс), 7,00-7,14(1H, м), 7,20-7,37(3H, м), 7,71- 7,91(1H, м), 9,49(1H, шс).
Пример 126 : 1,98(3H, с), 4,33(2H, д, J=5,8 Гц), 6,94(2H, шс), 7,00-7,14(1H, м), 7,20-7,37(3H, м), 7,71- 7,91(1H, м), 9,49(1H, шс).
Пример 126Синтез гидроиодида N-(3-(S-этилизотиоуреидо)фенилметил)ацетамида Используя соединение, полученное в Примере 124, в качестве исходного вещества, по методике, аналогичной Примеру 27, получают названное соединение (выход 67%). 1H-ЯМР(ДMСO-d6),  : 1,33(3H, т, J=7,3 Гц), 1,89(3H, с), 3,31(2H, к, J= 7,3 Гц), 4,30(2H, д, J= 5,9 Гц), 7,19-7,22(2H, м), 7,29(1H, д, J=7,6 Гц), 7,46(1H, дд, J=7,6, 7,6 Гц), 8,30-8,50(1H, м), 9,33(2H, ш).
МС (м/з) 251(М+) : 1,33(3H, т, J=7,3 Гц), 1,89(3H, с), 3,31(2H, к, J= 7,3 Гц), 4,30(2H, д, J= 5,9 Гц), 7,19-7,22(2H, м), 7,29(1H, д, J=7,6 Гц), 7,46(1H, дд, J=7,6, 7,6 Гц), 8,30-8,50(1H, м), 9,33(2H, ш).
МС (м/з) 251(М+)Пример 127 Синтез ди-т-бутилового эфира N-(2-метил-3-нитрофенилметил)иминодикарбоновой кислоты Раствор 2-метил-3-нитробензилхлорида (1,07 г) в диметилформамиде (30 мл) добавляют по каплям к раствору ди-т-бутилиминодикарбоксилата (1,38 г) и гидрида натрия (содержание 60%, 0,30 г) в диметилформамиде (30 мл) при 0oC. После 1-часового перемешивания при комнатной температуре температуру смеси поднимают до 80oC и перемешивают в течение 1 ч. Реакционную смесь концентрируют при пониженном давлении, к остатку добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=10:1), получая 1,49 г названного соединения (выход 96%). 1H-ЯМР (CDCl3),  : 1,46(9H, с), 1,48(9H, с), 2,43(3H, с), 4,37-4,41(2H, м), 7,30(1H, дд, J=8,1, 8,0 Гц), 7,51(1H, д, J=8,0 Гц), 7,69(1H, д, J=8,1 Гц).
Пример 128 : 1,46(9H, с), 1,48(9H, с), 2,43(3H, с), 4,37-4,41(2H, м), 7,30(1H, дд, J=8,1, 8,0 Гц), 7,51(1H, д, J=8,0 Гц), 7,69(1H, д, J=8,1 Гц).
Пример 128Синтез т-бутилового эфира N-(3-амино-2-метилфенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 127, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают названное соединение (выход 74%). 1H-ЯМР (CDCl3),  : 1,46(9H, с), 2,11(3H, с), 3,62(2H, шс), 4,29(2H, д, J=5,3 Гц), 4,55-4,78(1H, м), 6,63-6,71(2H, м), 6,99(1H, дд, J=7,9, 7,6 Гц).
МС (м/з) 236 (М+) : 1,46(9H, с), 2,11(3H, с), 3,62(2H, шс), 4,29(2H, д, J=5,3 Гц), 4,55-4,78(1H, м), 6,63-6,71(2H, м), 6,99(1H, дд, J=7,9, 7,6 Гц).
МС (м/з) 236 (М+)Пример 129 Синтез т-бутилового эфира N-(2-метил-3-тиоуреидофенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 128, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают названное соединение (выход 88%). 1H-ЯМР (CDCl3),  : 1,46(9H, с), 2,27(3H, с), 4,34(2H, д, J=5,6 Гц), 4,71-4,94(1H, м), 5,83(2H, ш), 7,15-7,30(5H, м), 7,71(1H, шс).
Пример 130 : 1,46(9H, с), 2,27(3H, с), 4,34(2H, д, J=5,6 Гц), 4,71-4,94(1H, м), 5,83(2H, ш), 7,15-7,30(5H, м), 7,71(1H, шс).
Пример 130Синтез гидроиодида т-бутилового эфира N-(3-(S-этилизотиоуреидо)-2-метилфенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 129, в качестве исходного вещества, по методике, аналогичной Примеру 27, получают названное соединение (выход 89%). 1H-ЯМР (CDCl3),  : 1,40(3H, т, J=7,8 Гц), 1,47(9H, с), 2,32(3H, с), 3,27(2H, к, J= 7,8 Гц), 4,36(2H, д, J=5,7 Гц), 4,66-4,86(1H, м), 7,19-7,37(3H, м).
Пример 131 : 1,40(3H, т, J=7,8 Гц), 1,47(9H, с), 2,32(3H, с), 3,27(2H, к, J= 7,8 Гц), 4,36(2H, д, J=5,7 Гц), 4,66-4,86(1H, м), 7,19-7,37(3H, м).
Пример 131Синтез дигидрохлорида N-(3-(S-этилизотиоуреидо)-2-метилфенилметил)амина Используя соединение, полученное в Примере 130, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 66%). 1H-ЯМР (D2O),  : 1,43(3H, т, J=7,6 Гц), 2,29(3H, с), 3,25(2H, к, J=7,6 Гц), 4,31(2H, с), 7,37-7,54(3H, м).
МС (м/з) 223(М+) : 1,43(3H, т, J=7,6 Гц), 2,29(3H, с), 3,25(2H, к, J=7,6 Гц), 4,31(2H, с), 7,37-7,54(3H, м).
МС (м/з) 223(М+)Пример 132 Синтез (2-хлор-3-нитрофенил)метанола Боран-тетрагидрофуран комплекс (1,0 М, 20 мл) добавляют по каплям к раствору 2-хлор-3-нитробензойной кислоты (5,0 г) в безводном тетрагидрофуране (30 мл) в атмосфере азота и смесь нагревают при температуре флегмы в течение 16 ч. К реакционной смеси добавляют воду, и это экстрагируют этилацетатом; органический слой промывают последовательно насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=5:2), получая 3,5 г названного соединения (выход 84%). 1H-ЯМР (CDCl3),  : 2,04(1H, т, J= 5,9 Гц), 4,88(2H, д, J=5,9 Гц), 7,45(1H, дд, J=7,9, 7,9 Гц), 7,72-7,82(2H, м).
Пример 133 : 2,04(1H, т, J= 5,9 Гц), 4,88(2H, д, J=5,9 Гц), 7,45(1H, дд, J=7,9, 7,9 Гц), 7,72-7,82(2H, м).
Пример 133Синтез ди-т-бутилового эфира N-(2-хлор-3-нитрофенилметил)иминодикарбоновой кислоты Смесь соединения (1,01 г), полученного в Примере 132, и тионилхлорида (50 мл) нагревают при температуре флегмы в течение 48 ч. Реакционную смесь концентрируют при пониженном давлении; полученный остаток растворяют в диметилформамиде (25 мл) и добавляют по каплям к раствору гидрида натрия (содержание 60%, 0,24 г) и ди-т-бутилиминодикарбоксилата (1,29 г) в диметилформамиде (25 мл) при 0oC. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и перемешивают при 80oC в течение 2 ч. К реакционной смеси добавляют воду и 2N HCl и проводят экстракцию этилацетатом; затем органический слой промывают последовательно водой и насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=5:1), получая 1,70 г названного соединения (выход 82%). 1H-ЯМР (CDCl3),  : 1,47(9H, с), 1,48(9H, с), 4,97(2H, с), 7,32-7,42(2H, м), 7,66-7,72(1H, м).
Пример 134 : 1,47(9H, с), 1,48(9H, с), 4,97(2H, с), 7,32-7,42(2H, м), 7,66-7,72(1H, м).
Пример 134Синтез ди-т-бутилового эфира N-(3-амино-2-хлорофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 133, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают названное соединение (выход 67%). 1H-ЯМР (CDCl3),  : 1,44(9H, с), 1,48(9H, с), 4,10(2H, шс), 4,86(2H, с), 6,53-6,66(2H, м), 7,06(1H, дд, J=8,3, 7,8 Гц).
МС (м/з) 356(М+) : 1,44(9H, с), 1,48(9H, с), 4,10(2H, шс), 4,86(2H, с), 6,53-6,66(2H, м), 7,06(1H, дд, J=8,3, 7,8 Гц).
МС (м/з) 356(М+)Пример 135 Синтез ди-т-бутилового эфира N-(2-хлор-3-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 134, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают названное соединение (выход 82%). 1H-ЯМР (CDCl3),  : 1,46(9H, с), 1,47(9H, с), 4,90(2H, с), 6,35(2H, шс), 7,11-7,13(1H, м), 7,31-7,43(2H, м), 8,05(1H, шс).
Пример 136 : 1,46(9H, с), 1,47(9H, с), 4,90(2H, с), 6,35(2H, шс), 7,11-7,13(1H, м), 7,31-7,43(2H, м), 8,05(1H, шс).
Пример 136Синтез гидроиодида ди-т-бутилового эфира N-(2-хлор-3-(S-этилизотиоуреидо)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 135, в качестве исходного вещества, по методике, аналогичной Примеру 27, получают названное соединение (выход 38%). 1H-ЯМР (CDCl3), 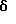 : 1,40(3H, т, J=7,3 Гц), 1,45(18H, с), 3,34(2H, к, J= 7,3 Гц), 4,92(2H, с), 7,22-7,36(3H,м).
Пример 137 : 1,40(3H, т, J=7,3 Гц), 1,45(18H, с), 3,34(2H, к, J= 7,3 Гц), 4,92(2H, с), 7,22-7,36(3H,м).
Пример 137Синтез дигидрохлорида N-(2-хлор-3-(S-этилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 136, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 97%). 1H-ЯМР (D2O),  : 1,44(3H, т, J=7,3 Гц), 3,26(2H, к, J=7,3 Гц), 4,42(2H, с), 7,53-7,70(3H, м).
МС (м/з) 243(М+) : 1,44(3H, т, J=7,3 Гц), 3,26(2H, к, J=7,3 Гц), 4,42(2H, с), 7,53-7,70(3H, м).
МС (м/з) 243(М+)Пример 138 Синтез т-бутилового эфира N-(1-(3-нитрофенил)циклогексил)карбаминовой кислоты Пример 138а Используя т-бутиловый эфир 3-нитрофенилуксусной кислоты в качестве исходного вещества и также используя 1,5-дибромпентан (1экв.) в качестве реагента, по методикам, аналогичным Примерам 1а и 1b, получают названное 1-(3-нитрофенил)циклогексанкарбоновую кислоту. 1H-ЯМР (CDCl3),  : 1,19-1,86(8H, м), 2,49-2,54(2H, м), 7,49-7,81(2H, м), 8,10-8,33(2H, м).
Пример 138b : 1,19-1,86(8H, м), 2,49-2,54(2H, м), 7,49-7,81(2H, м), 8,10-8,33(2H, м).
Пример 138bИспользуя 1-(3-нитрофенил)циклогексанкарбоновую кислоту в качестве исходного вещества, по методике, аналогичной Примеру 1с, получают 110 мг названного соединения (выход 28%). 1H-ЯМР (CDCl3),  : 1,39(9H, с), 1,52-1,82(8H, м), 2,21- 2,25(2H, м), 4,94(1H, шс), 7,46-7,77(2H, м), 8,06-8,29 (2H, м).
Пример 139 : 1,39(9H, с), 1,52-1,82(8H, м), 2,21- 2,25(2H, м), 4,94(1H, шс), 7,46-7,77(2H, м), 8,06-8,29 (2H, м).
Пример 139Синтез т-бутилового эфира N-(1-(3-аминофенил)циклогексил)карбаминовой кислоты Используя соединение, полученное в Примере 138, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 877 мг названного соединения (выход 65%). 1H-ЯМР (CDCl3),  : 1,38(9H, с), 1,48-1,78(8H, м), 2,08- 2,30(2H, м), 3,59(2H, шс), 4,75(1H, шс), 6,52-6,82(3H, м), 7,06- 7,12(1H, м).
Пример 140 : 1,38(9H, с), 1,48-1,78(8H, м), 2,08- 2,30(2H, м), 3,59(2H, шс), 4,75(1H, шс), 6,52-6,82(3H, м), 7,06- 7,12(1H, м).
Пример 140Синтез т-бутилового эфира N-(1-(3-тиоуреидофенил)циклогексил)карбаминовой кислоты Используя соединение, полученное в Примере 139, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 224 мг названного соединения (выход 93%). 1H-ЯМР (CDCl3),  : 1,35(9H, с), 1,50-1,81(8H, м), 2,06- 2,17(2H, м), 4,93(1H, шс), 6,21(2H, шс), 7,03-7,42(4H, м), 8,03(1H, шс).
Пример 141 : 1,35(9H, с), 1,50-1,81(8H, м), 2,06- 2,17(2H, м), 4,93(1H, шс), 6,21(2H, шс), 7,03-7,42(4H, м), 8,03(1H, шс).
Пример 141Синтез т-бутилового эфира N-(1-(3-(S-метилизотиоуреидо)фенил)циклогексил)карбаминовой кислоты Используя соединение, полученное в Примере 140, в качестве исходного вещества и используя также метилиодид в качестве реагента, реакцию проводят, как в Примере 29, получая 85 мг названного соединения (выход 70%). 1H-ЯМР (CDCl3),  : 1,36(9H, с), 1,49-1,83(8H, м), 2,15- 2,20(2H, м), 2,46(3H, с), 4,55(1H, шс), 4,81(1H, шс), 6,75- 7,26(4H, м).
Пример 142 : 1,36(9H, с), 1,49-1,83(8H, м), 2,15- 2,20(2H, м), 2,46(3H, с), 4,55(1H, шс), 4,81(1H, шс), 6,75- 7,26(4H, м).
Пример 142Синтез дигидрохлорида N-(1-(3-(S-метилизотиоуреидо)-фенил) циклогексил)амина Используя соединение, полученное в Примере 141, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 74 мг названного соединения (выход 94%). 1H-ЯМР (D2O),  : 1,43-2,02 (8H,м), 2,48-2,52 (2H,м), 2,69 (3H, с), 7,44-7,78 (4H, м) : 1,43-2,02 (8H,м), 2,48-2,52 (2H,м), 2,69 (3H, с), 7,44-7,78 (4H, м)БАА-МС (м/з) 264 (М++1). Пример 143 Синтез т-бутилового эфира N-(1-(3-(S-этилизотиоуреидо)фенил)циклогексил)карбаминовой кислоты Используя соединение, полученное в Примере 140, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают 108 мг названного соединения (выход 93%). 1H-ЯМР (CDCl3),  : 1,34-1,39(3H, м), 1,37(9H, с), 1,49- 1,82(8H, м), 2,15-2,20(2H, м), 2,92-3,20(2H, м), 4,52(1H, шс), 4,80(1H, шс), 6,75-7,28(4H, м).
Пример 144 : 1,34-1,39(3H, м), 1,37(9H, с), 1,49- 1,82(8H, м), 2,15-2,20(2H, м), 2,92-3,20(2H, м), 4,52(1H, шс), 4,80(1H, шс), 6,75-7,28(4H, м).
Пример 144Синтез дигидрохлорида N-(1-(3-(S-этилизотиоуреидо)фенил)циклогексил)амина Используя соединение, полученное в Примере 143, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 79 мг названного соединения (выход 87%). 1H-ЯМР (D2O),  : 1,32-2,08(8H, м), 1,41(3H, т, J=7,3 Гц), 2,47-2,52(2H, м), 3,23(2H, к, J=7,3 Гц), 7,43-7,74 (4H, м) : 1,32-2,08(8H, м), 1,41(3H, т, J=7,3 Гц), 2,47-2,52(2H, м), 3,23(2H, к, J=7,3 Гц), 7,43-7,74 (4H, м)ББА-МС (м/з) 278(М++1) Пример 145 Синтез т-бутилового эфира N-(1-(3-(S-н-пропилизотиоуреидо)фенил)циклогексил)карбаминовой кислоты Используя соединение, полученное в Примере 140, в качестве исходного вещества, по методике, аналогичной Примеру 91, получают 78 мг названного соединения (выход 69%). 1H-ЯМР (CDCl3),  : 1,02(3H, т, J=7,3 Гц), 1,36(9H, с), 1,49- 1,82(10H, м), 2,15-2,20(2H, м), 2,90-3,14(2H, м), 4,52(1H, шс), 4,80(1H, шс), 6,73-7,28(4H, м).
Пример 146 : 1,02(3H, т, J=7,3 Гц), 1,36(9H, с), 1,49- 1,82(10H, м), 2,15-2,20(2H, м), 2,90-3,14(2H, м), 4,52(1H, шс), 4,80(1H, шс), 6,73-7,28(4H, м).
Пример 146Синтез дигидрохлорида N-(1-(3-(S-н-пропилизотиоуреидо)фенил)циклогексил)амина Используя соединение, полученное в Примере 145, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 64 мг названного соединения (выход 98%). 1H-ЯМР (D2O),  : 1,04(3H, т, J=7,3 Гц), 1,39-2,05(10H, м), 2,47-2,52(2H, м), 3,20(2H, т, J=7,3 Гц), 7,43-7,74(4H, м).
ББА-МС (м/з) 292(М++1) : 1,04(3H, т, J=7,3 Гц), 1,39-2,05(10H, м), 2,47-2,52(2H, м), 3,20(2H, т, J=7,3 Гц), 7,43-7,74(4H, м).
ББА-МС (м/з) 292(М++1)Пример 147 Синтез т-бутилового эфира N-(1-(3-нитрофенил)циклопентил)карбаминовой кислоты Пример 147а Используя т-бутиловый эфир 3-нитрофенилуксусной кислоты в качестве исходного вещества и также используя 1,4-дибромбутан (1 экв.) в качестве реагента, по методикам, аналогичным Примерам 1а и 1b, получают 1-(3-нитрофенил)циклопентанкарбоновую кислоту. 1H-ЯМР (CDCl3),  : 1,78-2,05(6H, м), 2,68-2,74(2H, м), 7,46-7,74(2H, м), 8,10-8,25(2H, м).
Пример 147b : 1,78-2,05(6H, м), 2,68-2,74(2H, м), 7,46-7,74(2H, м), 8,10-8,25(2H, м).
Пример 147bИспользуя 1-(3-нитрофенил)циклопентанкарбоновую кислоту в качестве исходного вещества, по методике, аналогичной Примеру 1с, получают 211 мг названного соединения (выход 54%). 1H-ЯМР (CDCl3),  : 1,37(9H, с), 1,86-2,23(8H, м), 4,97(1H, шс), 7,45-7,78(2H, м), 8,06-3,27(2H, м).
Пример 148 : 1,37(9H, с), 1,86-2,23(8H, м), 4,97(1H, шс), 7,45-7,78(2H, м), 8,06-3,27(2H, м).
Пример 148Синтез т-бутилового эфира N-(1-(3-аминофенил)циклопентил)карбаминовой кислоты Используя соединение, полученное в Примере 147, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 1,81 г названного соединения (выход 96%). 1H-ЯМР (CDCl3),  : 1,35(9H, с), 1,72-2,18(8H, м), 3,60(2H, шс), 4,83(1H, шс), 6,51-7,11(4H, м).
Пример 149 : 1,35(9H, с), 1,72-2,18(8H, м), 3,60(2H, шс), 4,83(1H, шс), 6,51-7,11(4H, м).
Пример 149Синтез т-бутилового эфира N-(1-(3-тиоуреидофенил)циклопентил)карбаминовой кислоты Используя соединение, полученное в Примере 148, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 296 мг названного соединения, количественно. 1H-ЯМР (CDCl3),  : 1,33(9H, с), 1,84-2,21(8H, м), 4,91(1H, шс), 6,24 (2H, шс), 6,87-7,40(4H, м), 7,90(1H, шс).
Пример 150 : 1,33(9H, с), 1,84-2,21(8H, м), 4,91(1H, шс), 6,24 (2H, шс), 6,87-7,40(4H, м), 7,90(1H, шс).
Пример 150Синтез т-бутилового эфира N-(1-(3-(S-метилизотиоуреидо)фенил)циклопентил)карбаминовой кислоты Используя соединение, полученное в Примере 149, в качестве исходного вещества и также используя метилиодид в качестве реагента, проводят реакцию, как в Примере 29, получают 89 мг названного соединения (выход 94%). 1H-ЯМР (CDCl3),  : 1,34(9H, с), 1,80-2,18(8H, м), 2,47(3H, с), 4,57(1H, шс), 4,84(1H, шс), 6,78-7,27(4H, м).
Пример 151 : 1,34(9H, с), 1,80-2,18(8H, м), 2,47(3H, с), 4,57(1H, шс), 4,84(1H, шс), 6,78-7,27(4H, м).
Пример 151Синтез дигидрохлорида N-(1-(3-(S-метилизотиоуреидо)фенил)циклопентил)амина Используя соединение, полученное в Примере 150, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 72 мг названного соединения (выход 95%). 1H-ЯМР (D2O),  : 1,87-1,97(4H, м), 2,30-2,35(4H, м), 2,70(3H, с), 7,39-7,67(4H, м).
ББА-МС (м/з) 250(М++1) : 1,87-1,97(4H, м), 2,30-2,35(4H, м), 2,70(3H, с), 7,39-7,67(4H, м).
ББА-МС (м/з) 250(М++1)Пример 152 Синтез т-бутилового эфира N-(1-(3-(S-этилизотиоуреидо)фенил)циклопентил)карбаминовой кислоты Используя соединение, полученное в Примере 149, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают 97 мг названного соединения (выход 97%). 1H-ЯМР (CDCl3),  : 1,26-1,39(12H, m), 1,80-2,30(8H, м), 2,95-3,20(2H, м), 4,55(1H, шс), 4,86(1H, шс), 6,77-7,24 (4H, м).
Пример 153 : 1,26-1,39(12H, m), 1,80-2,30(8H, м), 2,95-3,20(2H, м), 4,55(1H, шс), 4,86(1H, шс), 6,77-7,24 (4H, м).
Пример 153Синтез дигидрохлорида N-(1-(3-(S-этилизотиоуреидо)фенил)циклопентил)амина Используя соединение, полученное в Примере 152, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 79 мг названного соединения (выход 88%). 1H-ЯМР (D2O),  : 1,42(3H, т, J=7,3 Гц), 1,88-1,98(4H, м), 2,30-2,35(4H, м), 3,24(2H, q, J=7,3 Гц), 7,39-7,68(4H, м).
ББА-МС (м/з) 264(М++1) : 1,42(3H, т, J=7,3 Гц), 1,88-1,98(4H, м), 2,30-2,35(4H, м), 3,24(2H, q, J=7,3 Гц), 7,39-7,68(4H, м).
ББА-МС (м/з) 264(М++1)Пример 154 Синтез т-бутилового эфира N-(1-(3-(S-н-пропилизотиоуреидо)фенил)циклопентил)карбаминовой кислоты Используя соединение, полученное в Примере 149, в качестве исходного вещества, по методике, аналогичной Примеру 91, получают 94 мг названного соединения (выход 98%). 1H-ЯМР (CDCl3),  : 1,03(3H, т, J=7,3 Гц), 1,34(9H, с), 1,70-2,17(10H, м), 2,95-3,15(2H, м), 4,54(1H, шс), 4,85(1H, шс), 6,76-7,25(4H, м).
Пример 155 : 1,03(3H, т, J=7,3 Гц), 1,34(9H, с), 1,70-2,17(10H, м), 2,95-3,15(2H, м), 4,54(1H, шс), 4,85(1H, шс), 6,76-7,25(4H, м).
Пример 155Синтез дигидрохлорида N-(1-(3-(S-н-пропилизотиоуреидо)фенил)циклопентил)амина Используя соединение, полученное в Примере 154, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 83 мг названного соединения, количественно. 1H-ЯМР (D2O),  : 1,04(3H, т, J=7,3 Гц), 1,73-1,97(6H, м), 2,29-2,35(4H, м), 3,20(2H, т, J=7,3 Гц), 7,40-7,64(4H, м).
ББА-МС (м/з) 278(М++1) : 1,04(3H, т, J=7,3 Гц), 1,73-1,97(6H, м), 2,29-2,35(4H, м), 3,20(2H, т, J=7,3 Гц), 7,40-7,64(4H, м).
ББА-МС (м/з) 278(М++1)Пример 156 Синтез т-бутилового эфира N-(1-(3-нитрофенил)циклобутил)карбаминовой кислоты Пример 156а Используя т-бутиловый эфир 3-нитрофенилуксусной кислоты в качестве исходного вещества и также используя 1,3- дибромпропан (1 экв.) в качестве реагента, по методикам, аналогичным Примерам 1а и 1b, получают 1-(3-нитрофенил)циклобутанкарбоновую кислоту. 1H-ЯМР (CDCl3),  : 1,86-2,27(2H, м), 2,50-2,62(2H, m), 2,88- 2,97(2H, м), 7,48-7,64(2H, м), 8,10-8,17(2H, м).
Пример 156b : 1,86-2,27(2H, м), 2,50-2,62(2H, m), 2,88- 2,97(2H, м), 7,48-7,64(2H, м), 8,10-8,17(2H, м).
Пример 156bИспользуя 1-(3-нитрофенил)циклобутанкарбоновую кислоту в качестве исходного вещества, по методике, аналогичной Примеру 1c, получают 2,0 г названного соединения (выход 89%). 1H-ЯМР (CDCl3),  : 1,36(9H, с), 1,85-2,26(2H, м), 2,46- 2,62(4H, м), 5,28(1H, шс), 7,51-8,28(4H, м).
Пример 157 : 1,36(9H, с), 1,85-2,26(2H, м), 2,46- 2,62(4H, м), 5,28(1H, шс), 7,51-8,28(4H, м).
Пример 157Синтез т-бутилового эфира N-(1-(3-аминофенил)циклобутил)карбаминовой кислоты Используя соединение, полученное в Примере 156, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 1,2 г названного соединения (выход 62%). 1H-ЯМР (CDCl3),  : 1,36(9H, с), 1,72-2,12(2H, м), 2,48- 2,53(4H, м), 3,64(2H, шс), 4,99(1H, шс), 6,54-7,15(4H, м).
Пример 158 : 1,36(9H, с), 1,72-2,12(2H, м), 2,48- 2,53(4H, м), 3,64(2H, шс), 4,99(1H, шс), 6,54-7,15(4H, м).
Пример 158Синтез т-бутилового эфира N-(1-(3-тиоуреидофенил)циклобутил)карбаминовой кислоты Используя соединение, полученное в Примере 157, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 302 мг названного соединения, количественно. 1H-ЯМР (CDCl3),  : 1,34(9H, с), 1,80-2,24(2H, м), 2,37- 2,59(4H, м), 5,24(1H, шс),6,34(2H, шс), 7,04-7,45(4H, м), 8,24(1H,с).
Пример 159 : 1,34(9H, с), 1,80-2,24(2H, м), 2,37- 2,59(4H, м), 5,24(1H, шс),6,34(2H, шс), 7,04-7,45(4H, м), 8,24(1H,с).
Пример 159Синтез т-бутилового эфира N-(1-(3-(S-метилизотиоуреидо)фенил)циклобутил)карбаминовой кислоты Используя соединение, полученное в Примере 158, в качестве исходного вещества и также используя метилиодид в качестве реагента, проводят реакцию, как в Примере 29, получая 150 мг названного соединения (выход 96%). 1H-ЯМР (CDCl3),  : 1,35(9H, с), 1,76-2,20(2H, м), 2,46- 2,72(7H, м), 4,56 (1H, шс), 5,07(1H, шс), 6,78-7,25(4H, м).
Пример 160 : 1,35(9H, с), 1,76-2,20(2H, м), 2,46- 2,72(7H, м), 4,56 (1H, шс), 5,07(1H, шс), 6,78-7,25(4H, м).
Пример 160Синтез дигидрохлорида N-(1-(3-(S-метилизотиоуреидо)фенил)циклобутил)амина Используя соединение, полученное в Примере 159, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 110 мг названного соединения (выход 86%). 1H-ЯМР (D2O),  : 1,88-2,29(2H, м), 2,60-2,84(7H, м), 7,42-7,69(4H, м).
Пример 161 : 1,88-2,29(2H, м), 2,60-2,84(7H, м), 7,42-7,69(4H, м).
Пример 161Синтез т-бутилового эфира N-(1-(3-(S-этилизотиоуреидо)фенил)циклобутил)карбаминовой кислоты Используя соединение, полученное в Примере 158, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают 150 мг названного соединения (выход 91%). 1H-ЯМР (CDCl3),  : 1,26-1,43(12H, м), 1,79-2,16(2H, м), 2,48-2,54(4H, м), 2,90-3,14(2H, м), 4,54(1H, шс), 5,07(1H, шс), 6,78-7,24(4H, м).
Пример 162 : 1,26-1,43(12H, м), 1,79-2,16(2H, м), 2,48-2,54(4H, м), 2,90-3,14(2H, м), 4,54(1H, шс), 5,07(1H, шс), 6,78-7,24(4H, м).
Пример 162Синтез дигидрохлорида N-(1-(3-(S-этилизотиоуреидо)фенил)циклобутил)амина Используя соединение, полученное в Примере 161, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 100 мг названного соединения (выход 83%). 1H-ЯМР (D2O),  : 1,42(3H, т, J=7,3 Гц), 1,94- 2,23(2H, м), 2,60-2,84(4H, м), 3,24(2H, к, J=7,3 Гц), 7,42-7,69(4H, м).
Пример 163 : 1,42(3H, т, J=7,3 Гц), 1,94- 2,23(2H, м), 2,60-2,84(4H, м), 3,24(2H, к, J=7,3 Гц), 7,42-7,69(4H, м).
Пример 163Синтез т-бутилового эфира N-(1-(3-нитрофенил)циклопропил)карбаминовой кислоты Пример 163а Используя т-бутиловый эфир 3-нитрофенилуксусной кислоты в качестве исходного вещества и также используя 1,2-дибрмоэтан (1 экв.) в качестве реагента, по методикам, аналогичным Примерам 1а и 1b, получают 1-(3-нитрофенил)циклопропанкарбоновую кислоту. 1H-ЯМР (CDCl3),  : 1,34(2H, дд, J=7,3, 4,3 Гц), 3,56 (2H, дд, J=7,3, 4,3 Гц), 7,46-7,71(2H, м), 8,13-8,21(2H, м).
Пример 163b : 1,34(2H, дд, J=7,3, 4,3 Гц), 3,56 (2H, дд, J=7,3, 4,3 Гц), 7,46-7,71(2H, м), 8,13-8,21(2H, м).
Пример 163bИспользуя 1-(3-нитрофенил)циклопропанкарбоновую кислоту в качестве исходного вещества, по методике, аналогичной Примеру 1с, получают 162 мг названного соединения (выход 78%). 1H-ЯМР (CDCl3),  : 1,31-1,45(13H, м), 5,34(1H, шс), 7,43-7,48(2H, м), 8,03-8,08(2H, м).
Пример 164 : 1,31-1,45(13H, м), 5,34(1H, шс), 7,43-7,48(2H, м), 8,03-8,08(2H, м).
Пример 164Синтез т-бутилового эфира N-(1-(3-aминoфeнил)циклoпропил)карбаминовой кислоты Используя соединение, полученное в Примере 163, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 18,7 мг названного соединения (выход 2%). 1H-ЯМР (CDCl33),  : 1,18-1,28(4H, м), 1,43(9H, с), 3,61(2H, шс), 5,24 (1H, шс), 6,49-6,61 (2H, м), 7,03-7,09(2H, м).
Пример 165 : 1,18-1,28(4H, м), 1,43(9H, с), 3,61(2H, шс), 5,24 (1H, шс), 6,49-6,61 (2H, м), 7,03-7,09(2H, м).
Пример 165Синтез т-бутилового эфира N-(1-(3-тиоуреидофенил)циклопропил)карбаминовой кислоты Используя соединение, полученное в Примере 164, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 20 мг названного соединения (выход 87%). 1H-ЯМР (CDCl3),  : 1,24-1,35(4H, м), 1,43(9H, с), 5,31 (1H, шс), 6,21 (2H, шс), 7,03-7,37 (4H, м), 8,10(1H, шс).
Пример 166 : 1,24-1,35(4H, м), 1,43(9H, с), 5,31 (1H, шс), 6,21 (2H, шс), 7,03-7,37 (4H, м), 8,10(1H, шс).
Пример 166Синтез т-бутилового эфира N-(1-(3-(S-этилизотиоуреидо)фенил)циклопропил)карбаминовой кислоты Используя соединение, полученное в Примере 165, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают 20 мг названного соединения (выход 92%). 1H-ЯМР (CDCl3),  : 1,21- 1,25(4H, м), 1,35(3H, т, J=7,3 Гц), 1,43(9H, с), 2,95-3,10(2H, м), 5,29(1H, шс), 6,73-6,88(2H, м), 7,18-7,27(2H, м).
Пример 167 : 1,21- 1,25(4H, м), 1,35(3H, т, J=7,3 Гц), 1,43(9H, с), 2,95-3,10(2H, м), 5,29(1H, шс), 6,73-6,88(2H, м), 7,18-7,27(2H, м).
Пример 167Синтез дигидрохлорида N-(1-(3-(S-этилизотиоуреидо)-фенил) циклопропил)амина Используя соединение, полученное в Примере 166, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 21 мг названного соединения, количественно. 1H-ЯМР (D2O),  : 1,31-1,49(7H, м), 3,23(2H, к, J=7,3 Гц), 7,39-7,44(2H, м), 7,59-7,61(2H, м).
Пример 168 : 1,31-1,49(7H, м), 3,23(2H, к, J=7,3 Гц), 7,39-7,44(2H, м), 7,59-7,61(2H, м).
Пример 168Синтез т-бутилового эфира N-(1-(3-(N’-нитрогуанидино)фенил)циклогексил)карбаминовой кислоты Используя соединение, полученное в Примере 139, в качестве исходного вещества, по методике, аналогичной Примеру 6, получают 63 мг названного соединения (выход 32%). 1H-ЯМР (CDCl3),  : 1,35(9H, с), 1,51-1,86 (8H, м), 2,14- 2,19(2H, м), 4,95(1H, шс), 7,15-7,47(4H, м), 9,66(1H, шс).
Пример 169 : 1,35(9H, с), 1,51-1,86 (8H, м), 2,14- 2,19(2H, м), 4,95(1H, шс), 7,15-7,47(4H, м), 9,66(1H, шс).
Пример 169Синтез гидрохлорида N-(1-(3-(N’-нитрогуанидино)фенил)циклогексил)амина Используя соединение, полученное в Примере 168, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 51 мг названного соединения (выход 97%). 1H-ЯМР (D2O),  : 1,43-2,07(8H, м), 2,48-2,53(2H, м), 7,37-7,62(4H, м).
Пример 170 : 1,43-2,07(8H, м), 2,48-2,53(2H, м), 7,37-7,62(4H, м).
Пример 170Синтез т-бутилового эфира N-(1-(3-(N’-нитрогуанидино)фенил)циклопентил)карбаминовой кислоты Используя соединение, полученное в Примере 148, в качестве исходного вещества, по методике, аналогичной Примеру 6, получают 121 мг названного соединения (выход 61%). 1H-ЯМР (CDCl3),  : 1,34(9H, с), 1,87-2,24(8H, м), 4,94(1H, шс), 7,14-7,45(4H, м), 9,67(1H, шс).
Пример 171 : 1,34(9H, с), 1,87-2,24(8H, м), 4,94(1H, шс), 7,14-7,45(4H, м), 9,67(1H, шс).
Пример 171Синтез гидрохлорида N-(1-(3-(N’-нитрогуанидино)фенил)циклопентил)амина Используя соединение, полученное в Примере 170, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 78 мг названного соединения (выход 98%). 1H-ЯМР (D2O),  : 1,90-1,97(4H, м), 2,29-2,32(4H, м), 7,37-7,61(4H, м).
Пример 172 : 1,90-1,97(4H, м), 2,29-2,32(4H, м), 7,37-7,61(4H, м).
Пример 172Синтез т-бутилового эфира N-(1-(3-(N’-нитрогуанидино)фенил)циклобутил)карбаминовой кислоты. Используя соединение, полученное в Примере 157, в качестве исходного вещества, по методике, аналогичной Примеру 6, получают 106 мг названного соединения (выход 53%). 1H-ЯМР (CDCl3),  : 1,35(9H, с), 1,87-2,28 (2H, м), 2,38- 2,63(4H, м), 5,26(1H, шс), 7, 15-7,48(4H, м), 9,69(1H, шс).
Пример 173 : 1,35(9H, с), 1,87-2,28 (2H, м), 2,38- 2,63(4H, м), 5,26(1H, шс), 7, 15-7,48(4H, м), 9,69(1H, шс).
Пример 173Синтез гидрохлорида N-(1-(3-(N’-нитрогуанидино)фенил)циклобутил)амина Используя соединение, полученное в Примере 172, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 72 мг названного соединения (выход 98%). 1H-ЯМР (D2O),  : 1,90-2,28(2H, м), 2,59-2,84(4H, м), 7,38- 7,63(4H, м).
Пример 174 : 1,90-2,28(2H, м), 2,59-2,84(4H, м), 7,38- 7,63(4H, м).
Пример 174Синтез т-бутилового эфира N-(1-(3-(S-этилизотиоуреидо)фенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 10, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают 71 мг названного соединения (выход 74%). 1H-ЯМР (CDCl3),  : 1,34-1,44(15H, м), 2,90-3,12(2H, м), 4,42-4,54(1H, м), 4,76(1H, шс), 6,82-7,29(4H, м).
Пример 175 : 1,34-1,44(15H, м), 2,90-3,12(2H, м), 4,42-4,54(1H, м), 4,76(1H, шс), 6,82-7,29(4H, м).
Пример 175Синтез дигидрохлорида N-(1-(3-(S-этилизотиоуреидо)фенил)этил)амина Используя соединение, полученное в Примере 174, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 53 мг названного соединения (выход 97%). 1H-ЯМР (D2O),  : 1,42(3H, т, J=7,6 Гц), 1,67(3H, д, J=6,9 Гц), 3,25 (2H, к, J=7,6 Гц), 4,60(1H, к, J=6,9 Гц), 7,42-7,67(4H, м).
Пример 176 : 1,42(3H, т, J=7,6 Гц), 1,67(3H, д, J=6,9 Гц), 3,25 (2H, к, J=7,6 Гц), 4,60(1H, к, J=6,9 Гц), 7,42-7,67(4H, м).
Пример 176Синтез т-бутилового эфира N-(1-(3-(S-этилизотиоуреидо)фенил)пропил)карбаминовой кислоты Используя соединение, полученное в Примере 17, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают 820 мг названного соединения (выход 91%). 1H-ЯМР (CDCl3),  : 0,88(3H, т, J=7,3 Гц), 1,30-1,50(12H, м), 1,72-1,78(2H, м), 3,00-3,17(2H, м), 4,40-4,58(2H, м), 4,78(1H, шс), 6,80-6,94(2H, м), 7,22-7,28(2H, м).
Пример 177 : 0,88(3H, т, J=7,3 Гц), 1,30-1,50(12H, м), 1,72-1,78(2H, м), 3,00-3,17(2H, м), 4,40-4,58(2H, м), 4,78(1H, шс), 6,80-6,94(2H, м), 7,22-7,28(2H, м).
Пример 177Синтез дигидрохлорида N-(1-(3-(S-этилизотиоуреидо)фенил)пропил)амина Используя соединение, полученное в Примере 176, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 653 мг названного соединения (выход 82%). 1H-ЯМР (D2O),  : 0,89(3H, т, J=7,3 Гц), 1,42(3H, т, J=7,3 Гц), 1,94-2,13(2H, м), 3,24(2H, к, J=7,3 Гц), 4,33(1H, т, J=7,3 Гц), 7,44-7,68(4H, м).
Пример 178 : 0,89(3H, т, J=7,3 Гц), 1,42(3H, т, J=7,3 Гц), 1,94-2,13(2H, м), 3,24(2H, к, J=7,3 Гц), 4,33(1H, т, J=7,3 Гц), 7,44-7,68(4H, м).
Пример 178Синтез 2-метил-2-(4-нитрофенил)пропанола Пример 178а Используя дифенилметиловый эфир 4-нитрофенилуксусной кислоты в качестве исходного вещества и также используя метилиодид (2 экв.) в качестве реагента, по методикам, аналогичным Примерам 1а и 1b, получают 2-метил-2-(4-нитрофенил)пропионовую кислоту. 1H-ЯМР (CDCl3),  : 1,65(6H,c), 7,57(2H, д, J=8,9 Гц), 8,20(2H, д, J=8,9 Гц).
Пример 178b : 1,65(6H,c), 7,57(2H, д, J=8,9 Гц), 8,20(2H, д, J=8,9 Гц).
Пример 178bИспользуя 2-метил-2-(4-нитрофенил) пропионовую кислоту в качестве исходного вещества, по методике, аналогичной Примеру 132, получают 172 мг названного соединения (выход 88%). 1H-ЯМР (CDCl3),  : 1,38(6H, с), 3,69(2H, с), 7,56(2H, д, J=8,9 Гц), 8,18(2H, д, J=8,9 Гц).
Пример 179 : 1,38(6H, с), 3,69(2H, с), 7,56(2H, д, J=8,9 Гц), 8,18(2H, д, J=8,9 Гц).
Пример 179Синтез N-(2-метил-2-(4-нитрофенил)пропил)фталимида Раствор соединения (152 мг), полученного в Примере 178, в безводном тетрагидрофуране (10 мл) добавляют по каплям к смеси трифенилфосфина (484 мг), диэтилазодикарбоксилата (0,29 мл) и безводного тетрагидрофурана (20 мл) при 0oC в атмосфере азота. Затем раствор фталимида (272 мг) в безводном тетрагидрофуране (10 мл) добавляют по каплям к реакционной смеси при 0oC, перемешивают в течение 10 мин и перемешивают в течение 4 ч при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении и полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=8:2), получая 439 мг названного соединения (выход 88%). 1H-ЯМР (CDCl3),  : 1,46(6H, с), 3,84(2H, с), 7,72(2H, д, J=8,9 Гц), 7,75-7,83(4H,м), 8,17(2H, д, J=8,9 Гц).
Пример 180 : 1,46(6H, с), 3,84(2H, с), 7,72(2H, д, J=8,9 Гц), 7,75-7,83(4H,м), 8,17(2H, д, J=8,9 Гц).
Пример 180Синтез N-(2-метил-2-(4-нитрофенил)пропил)амина К смеси соединения (152 мг), полученного в Примере 179, метанола (10 мл) и хлороформа (10 мл) добавляют моногидрат гидразина (0,05 мл) и нагревают при температуре флегмы в течение 24 ч. Реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении; после добавления 2N HCl смесь промывают этилацетатом. Затем водный слой подщелачивают 2N водным раствором гидроксида натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении, получая 71 мг названного соединения (выход 78%). 1H-ЯМР (CDCl3),  : 1,36(6H, с), 2,87(2H,с), 7,52(2H, д, J=8,9 Гц), 8,18(2H, д, J=8,9 Гц).
Пример 181 : 1,36(6H, с), 2,87(2H,с), 7,52(2H, д, J=8,9 Гц), 8,18(2H, д, J=8,9 Гц).
Пример 181Синтез т-бутилового эфира N-(2-метил-2-(4-нитрофенил)пропил)карбаминовой кислоты Используя соединение, полученное в Примере 180, в качестве исходного вещества, по методике, аналогичной Примеру 22, получают 77 мг названного соединения (выход 86%). 1H-ЯМР (CDCl3),  : 1,37(6H, с), 1,38(9H, с), 3,36(2H, д, J=6,3 Гц), 4,30-4,40(1H, м), 7,53(2H, д, J=8,9 Гц), 8,18(2H, д, J=8,9 Гц).
Пример 182 : 1,37(6H, с), 1,38(9H, с), 3,36(2H, д, J=6,3 Гц), 4,30-4,40(1H, м), 7,53(2H, д, J=8,9 Гц), 8,18(2H, д, J=8,9 Гц).
Пример 182Синтез т-бутилового эфира N-(2-(4-аминофенил)-2-метилпропил)карбаминовой кислоты Используя соединение, полученное в Примере 181, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 796 мг названного соединения (выход 65%). 1H-ЯМР (CDCl3),  : 1,26(6H, с), 1,40(9H, с), 3,26(2H, д, J=5,9 Гц), 3,60(2H, шс), 4,20-4,38(1H, м), 6,66(2H, д, J=8,6 Гц), 7,12(2H, д, J=8,6 Гц).
Пример 183 : 1,26(6H, с), 1,40(9H, с), 3,26(2H, д, J=5,9 Гц), 3,60(2H, шс), 4,20-4,38(1H, м), 6,66(2H, д, J=8,6 Гц), 7,12(2H, д, J=8,6 Гц).
Пример 183Синтез т-бутилового эфира N-(2-метил-(4-тиоуреидофенил)пропил)карбаминовой кислоты Используя соединение, полученное в Примере 182, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 240 мг названного соединения (выход 98%). 1H-ЯМР (CDCl3),  : 1,32(6H, с), 1,38(9H, с), 3,30(2H, д, J=6,3 Гц), 4,38-4,50(1H, м), 6,20(2H, шс), 7,20(2H, д, J=8,3 Гц), 7,42(2H, д, J=8,3 Гц), 8,19(1H, шс).
Пример 184 : 1,32(6H, с), 1,38(9H, с), 3,30(2H, д, J=6,3 Гц), 4,38-4,50(1H, м), 6,20(2H, шс), 7,20(2H, д, J=8,3 Гц), 7,42(2H, д, J=8,3 Гц), 8,19(1H, шс).
Пример 184Синтез т-бутилового эфира N-(2-(S-этилизотиоуреидо)фенил)-2-метилпропил)карбаминовой кислоты Используя соединение, полученное в Примере 183, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают 120 мг названного соединения (выход 91%). 1H-ЯМР (CDCl3),  : 1,30(6H, с), 1,34-1,40(12H, м), 3,00- 3,18(2H, м), 3,29(2H, д, J= 6,3 Гц), 4,20(1H, шс), 4,40-4,60(1H, м), 6,80-6,95(2H, м), 7,28(2H, д, J=7,6 Гц).
Пример 185 : 1,30(6H, с), 1,34-1,40(12H, м), 3,00- 3,18(2H, м), 3,29(2H, д, J= 6,3 Гц), 4,20(1H, шс), 4,40-4,60(1H, м), 6,80-6,95(2H, м), 7,28(2H, д, J=7,6 Гц).
Пример 185Синтез дигидрохлорида N-(2-(4-(S-этилизотиоуреидо)фенил)-2-метилпропил)амина Используя соединение, полученное в Примере 184, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 110 мг названного соединения, количественно. 1H-ЯМР (D2O),  : 1,39-1,46(9H, м), 3,19-3,29(4H, м), 7,40(2H, д, J=8,6 Гц), 7,63 (2H, д, J=8,6 Гц).
Пример 186 : 1,39-1,46(9H, м), 3,19-3,29(4H, м), 7,40(2H, д, J=8,6 Гц), 7,63 (2H, д, J=8,6 Гц).
Пример 186Синтез т-бутилового эфира N-(2-метил-2-(4-(N’-нитрогуанидино)фенил)пропил)карбаминовой кислоты Используя соединение, полученное в Примере 182, в качестве исходного вещества, по методике, аналогичной Примеру 6, получают 163 мг названного соединения (выход 82%). 1H-ЯМР (CDCl3),  : 1,34(6H, с), 1,39(9H, с), 3,32(2H, д, J=6,3 Гц), 4,18-4,28(1H, м), 7,29(2H, д, J=8,3 Гц), 7,48(2H, д, J=8,3 Гц), 9,85(1H, шс).
Пример 187 : 1,34(6H, с), 1,39(9H, с), 3,32(2H, д, J=6,3 Гц), 4,18-4,28(1H, м), 7,29(2H, д, J=8,3 Гц), 7,48(2H, д, J=8,3 Гц), 9,85(1H, шс).
Пример 187Синтез гидрохлорида N-(2-метил-2-(4-(N’-нитрогуанидино)фенил)пропил)амина Используя соединение, полученное в Примере 186, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 90 мг названного соединения (выход 92%). 1H-ЯМР (D2O),  : 1,45(6H, с), 3,27(2H, с), 7,38(2H, д, J=8,6 Гц), 7,58(2H, д, J=8,6 Гц).
Пример 188 : 1,45(6H, с), 3,27(2H, с), 7,38(2H, д, J=8,6 Гц), 7,58(2H, д, J=8,6 Гц).
Пример 188Синтез N-(1,1-диметил-2-(4-нитрофенил)этил)амина Раствор фентермина (  , , – диметилбензолэтанамин) (1,0 г) в хлороформе (20 мл) добавляют по каплям к серной кислоте (3,57 мл) при 0oC; затем по каплям добавляют при 0oC дымящую азотную кислоту (удельная плотность1,52, 2,8 мл). Реакционную смесь перемешивают при 0oC в течение 2 ч, подщелачивают водой и 2N водным раствором гидроксида натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – хлороформ: метанол= 9: 1), получая 367 мг названного соединения (выход 28%).
1H-ЯМР (CDCl3), – диметилбензолэтанамин) (1,0 г) в хлороформе (20 мл) добавляют по каплям к серной кислоте (3,57 мл) при 0oC; затем по каплям добавляют при 0oC дымящую азотную кислоту (удельная плотность1,52, 2,8 мл). Реакционную смесь перемешивают при 0oC в течение 2 ч, подщелачивают водой и 2N водным раствором гидроксида натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – хлороформ: метанол= 9: 1), получая 367 мг названного соединения (выход 28%).
1H-ЯМР (CDCl3),  : 1,15(6H, с), 2,78(2H, с), 7,37(2H, д, J=8,6 Гц), 8,16(2H, д, J=8,6 Гц).
Пример 189 : 1,15(6H, с), 2,78(2H, с), 7,37(2H, д, J=8,6 Гц), 8,16(2H, д, J=8,6 Гц).
Пример 189Синтез т-бутилового эфира N-(1,1-диметил-2-(4-нитрофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 188, в качестве исходного вещества, по методике, аналогичной Примеру 22, получают 473 мг названного соединения (выход 89%). 1H-ЯМР (CDCl3),  : 1,28(6H, с), 1,48(9H, с), 3,15(2H, с), 4,24(1H, шс), 7,31(2H, д, J=8,6 Гц), 8,07(2H, д, J=8,6 Гц).
Пример 190 : 1,28(6H, с), 1,48(9H, с), 3,15(2H, с), 4,24(1H, шс), 7,31(2H, д, J=8,6 Гц), 8,07(2H, д, J=8,6 Гц).
Пример 190Синтез т-бутилового эфира N-(2-(4-аминофенил)-1,1-диметилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 189, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 350 мг названного соединения (выход 87%). 1H-ЯМР (CDCl3),  : 1,24(6H, с), 1,46(9H, с), 2,84(2H, с), 3,58(2H, шс), 4,27(1H, шс), 6,61(2H, д, J=8,2 Гц), 6,94(2H, д, J=8,2 Гц).
Пример 191 : 1,24(6H, с), 1,46(9H, с), 2,84(2H, с), 3,58(2H, шс), 4,27(1H, шс), 6,61(2H, д, J=8,2 Гц), 6,94(2H, д, J=8,2 Гц).
Пример 191Синтез т-бутилового эфира N-(1,1-диметил-2-(4-тиоуреидофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 190, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 152 мг названного соединения (выход 93%). 1H-ЯМР (CDCl3),  : 1,26(6H, с), 1,47(9H, с), 3,02(2H, с), 4,26(1H, шс), 6,06(2H, шс), 7,14(2H, д, J=8,3 Гц), 7,23(2H, д, J=8,3 Гц), 7,85(1H, шс).
Пример 192 : 1,26(6H, с), 1,47(9H, с), 3,02(2H, с), 4,26(1H, шс), 6,06(2H, шс), 7,14(2H, д, J=8,3 Гц), 7,23(2H, д, J=8,3 Гц), 7,85(1H, шс).
Пример 192Синтез т-бутилового эфира N-(1,1-диметил-2-(4-(S-этилизотиоуреидо)фенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 191, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают 150 мг названного соединения (выход 91%). 1H-ЯМР (CDCl3),  : 1,25(6H, с), 1,37(3H, т, J=7,3 Гц), 1,46(9H, с), 2,92(2H, с), 2,98-3,18(2H, м), 4,25(1H, шс), 4,49(1H, шс), 6,78-6,90(2H, м), 7,09(2H, д, J=7,9 Гц).
Пример 193 : 1,25(6H, с), 1,37(3H, т, J=7,3 Гц), 1,46(9H, с), 2,92(2H, с), 2,98-3,18(2H, м), 4,25(1H, шс), 4,49(1H, шс), 6,78-6,90(2H, м), 7,09(2H, д, J=7,9 Гц).
Пример 193Синтез дигидрохлорида N-(1,1-диметил-2-(4-(S-этилизотиоуреидо)фенил)этил)амина Используя соединение, полученное в Примере 192, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 140 мг названного соединения, количественно. 1H-ЯМР (D2O),  : 1,37(6H, с), 1,4(3H, т, J=7,6 Гц), 3,02(2H, с), 3,23(2H, к, J=7,6 Гц), 7,37(2H, д, J=8,3 Гц), 7,44(2H, д, J=8,3 Гц).
Пример 194 : 1,37(6H, с), 1,4(3H, т, J=7,6 Гц), 3,02(2H, с), 3,23(2H, к, J=7,6 Гц), 7,37(2H, д, J=8,3 Гц), 7,44(2H, д, J=8,3 Гц).
Пример 194Синтез т-бутилового эфира N-(1,1-диметил-2-(4-(N’-нитрогуанидино)фенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 190, в качестве исходного вещества, по методике, аналогичной Примеру 6, получают 70 мг названного соединения (выход 43%). 1H-ЯМР (CDCl3),  : 1,28(6H, с), 1,48(9H, с), 3,05(2H, с), 4,30(1H, шс), 7,23(2H, д, J=8,6 Гц), 7,28(2H, д, J=8,6 Гц), 9,73(1H, шс).
Пример 195 : 1,28(6H, с), 1,48(9H, с), 3,05(2H, с), 4,30(1H, шс), 7,23(2H, д, J=8,6 Гц), 7,28(2H, д, J=8,6 Гц), 9,73(1H, шс).
Пример 195Синтез гидрохлорида N-(1,1-диметил-2-(4-(N’-нитрогуанидино)фенил)этил)амина Используя соединение, полученное в Примере 194, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 56 мг названного соединения (выход 97%). 1H-ЯМР (D2O),  : 1,37(6H, с), 3,00(2H, с), 7,34-7,44(4H, м).
Пример 196 : 1,37(6H, с), 3,00(2H, с), 7,34-7,44(4H, м).
Пример 196Синтез (4-метокси-3-нитрофенил)метанола Используя 4-метокси-3-нитробензойную кислоту в качестве исходного вещества, по методике, аналогичной Примеру 132, получают 5,4 г названного соединения (выход 98%). 1H-ЯМР (CDCl3),  : 1,87(1H, т, J=5,9 Гц), 3,96(3H, с), 4,69(2H, д, J= 5,9 Гц), 7,08(1H, д, J=8,6 Гц), 7,55(1H, дд, J=8,6, 2,3 Гц), 7,85(1H, д, J= 2,3 Гц).
Пример 197 : 1,87(1H, т, J=5,9 Гц), 3,96(3H, с), 4,69(2H, д, J= 5,9 Гц), 7,08(1H, д, J=8,6 Гц), 7,55(1H, дд, J=8,6, 2,3 Гц), 7,85(1H, д, J= 2,3 Гц).
Пример 197Синтез N-(4-метокси-3-нитрофенилметил)фталимида Используя соединение, полученное в Примере 196, в качестве исходного вещества, по методике, аналогичной Примеру 179, получают 2,74 г названного соединения (выход 59%). 1H-ЯМР (CDCl3),  : 3,93(3H, с), 4,82(2H, с), 7,03(1H, д, J=8,8 Гц), 7,65(1H, дд, J=8,8, 2,4 Гц), 7,70-7,75(2H, м), 7,84-7,89(2H, м), 7,92(1H, д, J=2,4 Гц).
Пример 198 : 3,93(3H, с), 4,82(2H, с), 7,03(1H, д, J=8,8 Гц), 7,65(1H, дд, J=8,8, 2,4 Гц), 7,70-7,75(2H, м), 7,84-7,89(2H, м), 7,92(1H, д, J=2,4 Гц).
Пример 198Синтез т-бутилового эфира N-(4-метокси-3-нитрофенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 197, в качестве исходного вещества, реакцию проводят, как в Примере 118, получая 1,47 г названного соединения (выход 92%). 1H-ЯМР (CDCl3),  : 1,46(9H, с), 3,95(3H, с), 4,29(2H, д, J=5,4 Гц), 4,93(1H, ш), 7,05(1H, д, J=8,8 Гц), 7,49(1H, дд, J=8,8, 2,4 Гц), 7,77(1H, д, J=2,4 Гц).
Пример 199 : 1,46(9H, с), 3,95(3H, с), 4,29(2H, д, J=5,4 Гц), 4,93(1H, ш), 7,05(1H, д, J=8,8 Гц), 7,49(1H, дд, J=8,8, 2,4 Гц), 7,77(1H, д, J=2,4 Гц).
Пример 199Синтез т-бутилового эфира N-(3-амино-4-метоксифенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 198, в качестве исходного вещества, реакцию проводят, как в Примере 2, получая 1,24 г названного соединения (выход 96%). 1H-ЯМР (CDCl3),  : 1,46(9H, с), 3,79(2H, ш), 3,83(3H, с), 4,16(2H, д, J=5,6 Гц), 4,71(1H, ш), 6,60-6,65(2H, м), 6,72(1H, д, J=8,3 Гц).
Пример 200 : 1,46(9H, с), 3,79(2H, ш), 3,83(3H, с), 4,16(2H, д, J=5,6 Гц), 4,71(1H, ш), 6,60-6,65(2H, м), 6,72(1H, д, J=8,3 Гц).
Пример 200Синтез т-бутилового эфира N-(4-метокси-3-тиоуреидофенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 199, в качестве исходного вещества, реакцию проводят, как в Примере 120, получая 605 мг названного соединения (выход 97%). 1H-ЯМР (ДМСО-d6),  : 1,39(9H, с), 3,79(3H, с), 4,03(1H, д, J=5,9 Гц), 6,92-7,03(2H, м), 7,23-7,27(1H, м), 7,30(2H, ш), 7,61(1H, с), 8,96(1H, с).
Пример 201 : 1,39(9H, с), 3,79(3H, с), 4,03(1H, д, J=5,9 Гц), 6,92-7,03(2H, м), 7,23-7,27(1H, м), 7,30(2H, ш), 7,61(1H, с), 8,96(1H, с).
Пример 201Синтез гидроиодида т-бутилового эфира N-(3-(S-этилизотиоуреидо)-4-метоксифенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 200, в качестве исходного вещества, по методике, аналогичной Примеру 27, получают 591 мг названного соединения (выход 89%). 1H-ЯМР (CDCl3),  : 1,39(3H, т, J=7,3 Гц), 1,46(9H, с), 3,30(2H, к, J= 7,3 Гц), 3,86(3H, с), 4,25(2H, д, J=5,6 Гц), 4,93(1H, ш), 6,93(1H, д, J=8,4 Гц), 7,22-7,30(3H, м).
Пример 202 : 1,39(3H, т, J=7,3 Гц), 1,46(9H, с), 3,30(2H, к, J= 7,3 Гц), 3,86(3H, с), 4,25(2H, д, J=5,6 Гц), 4,93(1H, ш), 6,93(1H, д, J=8,4 Гц), 7,22-7,30(3H, м).
Пример 202Синтез дигидрохлорида N-(3-(S-этилизотиоуреидо)-4-метоксифенилметил)амина Используя соединение, полученное в Примере 201, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 102 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 1,33(3H, т, J=7,3 Гц), 3,29(2H, к, J=7,3 Гц), 3,86(3H, с), 3,97-4,01(2H, м), 7,24(1H, д, J=8,6 Гц), 7,44(1H, д, J=2,0 Гц), 7,56(1H, дд, J=8,6, 2,0 Гц), 8,45(3H, ш), 9,53(1H, ш), 11,28(1H, ш).
Пример 203 : 1,33(3H, т, J=7,3 Гц), 3,29(2H, к, J=7,3 Гц), 3,86(3H, с), 3,97-4,01(2H, м), 7,24(1H, д, J=8,6 Гц), 7,44(1H, д, J=2,0 Гц), 7,56(1H, дд, J=8,6, 2,0 Гц), 8,45(3H, ш), 9,53(1H, ш), 11,28(1H, ш).
Пример 203Синтез (4-хлор-3-нитрофенил)метанола Используя 4-хлор-3-нитробензойную кислоту в качестве исходного вещества, по методике, аналогичной Примеру 132, получают 1,53 г названного соединения (выход 82%). 1H-ЯМР (CDCl3), 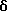 : 1,96(1H, т, J=5,4 Гц), 4,78(2H, д, J=5,4 Гц), 7,48-7,57(2H, м), 7,90(1H, с).
Пример 204 : 1,96(1H, т, J=5,4 Гц), 4,78(2H, д, J=5,4 Гц), 7,48-7,57(2H, м), 7,90(1H, с).
Пример 204Синтез N-(4-хлор-3-нитрофенилметил)фталимида Используя соединение, полученное в Примере 203, в качестве исходного вещества, по методике, аналогичной Примеру 179, получают 1,65 г названного соединения (выход 87%). 1H-ЯМР (CDCl3),  : 4,87(2H, с), 7,50(1H, д, J=8,3 Гц), 7,60(1H, дд, J= 8,3, 2,0 Гц), 7,73-7,80(2H, м), 7,83-7,91(2H, м), 7,93(1H, д, J=2,0 Гц).
Пример 205 : 4,87(2H, с), 7,50(1H, д, J=8,3 Гц), 7,60(1H, дд, J= 8,3, 2,0 Гц), 7,73-7,80(2H, м), 7,83-7,91(2H, м), 7,93(1H, д, J=2,0 Гц).
Пример 205Синтез т-бутилового эфира N-(4-хлор-3-нитрофенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 204, в качестве исходного вещества, по методике, аналогичной Примеру 118, получают 626 мг названного соединения (выход 78%). 1H-ЯМР (CDCl3),  : 1,46(9H, с), 4,33-4,37(2H, м), 5,01(1H, ш), 7,41-7,54(2H, м), 7,79(1H, д, J=1,5 Гц).
Пример 206 : 1,46(9H, с), 4,33-4,37(2H, м), 5,01(1H, ш), 7,41-7,54(2H, м), 7,79(1H, д, J=1,5 Гц).
Пример 206Синтез т-бутилового эфира N-(3-амино-4-хлорофенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 205, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 376 мг названного соединения (выход 87%). 1H-ЯМР (CDCl3),  : 1,47(9H, с), 4,18-4,22(2H, м), 4,79(1H, ш), 6,59(1H, дд, J=8,3, 1,5 Гц), 6,69(1H, д, J=1,5 Гц), 7,17(1H, д, J=8,3 Гц).
Пример 207 : 1,47(9H, с), 4,18-4,22(2H, м), 4,79(1H, ш), 6,59(1H, дд, J=8,3, 1,5 Гц), 6,69(1H, д, J=1,5 Гц), 7,17(1H, д, J=8,3 Гц).
Пример 207Синтез т-бутилового эфира N-(4-хлор-3-тиоуреидофенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 206, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 100 мг названного соединения (выход 81%). 1H-ЯМР (CDCl3),  : 1,44(9H, с), 4,28(2H, д, J=5,9 Гц), 5,26(1H, ш), 6,49 (2H, ш), 7,14(1H, дд, J=8,3, 1,5 Гц), 7,37- 7,42(2H, м), 8,15(1H, ш).
Пример 208 : 1,44(9H, с), 4,28(2H, д, J=5,9 Гц), 5,26(1H, ш), 6,49 (2H, ш), 7,14(1H, дд, J=8,3, 1,5 Гц), 7,37- 7,42(2H, м), 8,15(1H, ш).
Пример 208Синтез гидроиодида т-бутилового эфира N-(4-хлop-3-(S-этилизoтиoуpеидо)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 207, в качестве исходного вещества, по методике, аналогичной Примеру 27, получают 113 мг названного соединения (выход 75%). 1H-ЯМР (CDCl3),  : 1,40(3H, т, J=7,3 Гц), 1,46(9H, с), 3,20(2H, к, J= 7,3 Гц), 4,28(2H, д, J=6,3 Гц), 4,94(1H, ш), 7,10- 7,14(2H, м), 7,40(1H, д, J=9,3 Гц).
Пример 209 : 1,40(3H, т, J=7,3 Гц), 1,46(9H, с), 3,20(2H, к, J= 7,3 Гц), 4,28(2H, д, J=6,3 Гц), 4,94(1H, ш), 7,10- 7,14(2H, м), 7,40(1H, д, J=9,3 Гц).
Пример 209Синтез дигидрохлорида N-(4-хлор-3-(S-этилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 208, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 97 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 1,34(3H, т, J=7,3 Гц), 3,32(2H, к, J=7,3 Гц), 4,01-4,08 (2H, м), 7,56-7,63 (2H, м), 7,71(1H, д, J=8,3 Гц), 8,61(3H, ш), 9,41(2H, ш), 11,90(1H, ш).
Пример 210 : 1,34(3H, т, J=7,3 Гц), 3,32(2H, к, J=7,3 Гц), 4,01-4,08 (2H, м), 7,56-7,63 (2H, м), 7,71(1H, д, J=8,3 Гц), 8,61(3H, ш), 9,41(2H, ш), 11,90(1H, ш).
Пример 210Синтез метилового эфира 2-(3-аминофенил)-2-т-бутокси карбониламиноуксусной кислоты Используя 3-нитрофенилуксусную кислоту в качестве исходного вещества, по методике, аналогичной Примеру 78, получают 2,09 г названного соединения (выход 27%). 1H-ЯМР (CDCl3),  : 1,43(9H, с), 3,81(3H, с), 5,20(1H, д, J=7,3 Гц), 5,51-5,66 (1H, м), 6,61-6,74 (3H, м), 7,09-7,15 (1H, м).
МС (м/з) 280(М+) : 1,43(9H, с), 3,81(3H, с), 5,20(1H, д, J=7,3 Гц), 5,51-5,66 (1H, м), 6,61-6,74 (3H, м), 7,09-7,15 (1H, м).
МС (м/з) 280(М+)Пример 211 Синтез метилового эфира 2-т-бутоксикарбониламино-2-(3-(S-метилизотиоуреидо)фенил)уксусной кислоты Используя соединение, полученное в Примере 210, в качестве исходного вещества, по методике, аналогичной Примеру 40, получают 2-т-бутоксикарбониламино-2-(3-тиоуреидо, уксусную кислоту. Полученное соединение растворяют в смеси метанола (10 мл) и диэтилового эфира (5 мл) и раствор триметилсилилдиазометана (2,0 М) в н-гексане добавляют при комнатной температуре до тех пор, пока реакционная смесь не перестанет вспениваться. Реакционную смесь концентрируют при пониженною давлении и остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=3:1), получая 0,15 г названного соединения (выход 21%). 1H-ЯМР (CDCl3),  : 1,42(9H, с), 2,44(3H, с), 3,71(3H,с), 4,61(2H, шс), 5,27(1H, d, J=7,6 Гц), 5,56-5,67(1H, м), 6,86-6,92(2H, м), 7,02 (1H, д, J= 7,9 Гц), 7,24-7,37 (1H, м).
ББА-МС (м/з) 354(М++1) : 1,42(9H, с), 2,44(3H, с), 3,71(3H,с), 4,61(2H, шс), 5,27(1H, d, J=7,6 Гц), 5,56-5,67(1H, м), 6,86-6,92(2H, м), 7,02 (1H, д, J= 7,9 Гц), 7,24-7,37 (1H, м).
ББА-МС (м/з) 354(М++1)Пример 212 Синтез дигидрохлорида метилового эфира 2-амино-2-(3-(S-метилизотиоуреидо)фенил)уксусной кислоты Используя соединение, полученное в Примере 211, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 123 мг названного соединения (выход 90%). 1H-ЯМР (D2O),  : 2,70 (3H, с), 3,84 (3H, с), 5,37 (1H, с), 7,30-7,57 (3H, м), 7,65-7,71(1H, м).
ББА-МС (м/з) 254 (М++1) : 2,70 (3H, с), 3,84 (3H, с), 5,37 (1H, с), 7,30-7,57 (3H, м), 7,65-7,71(1H, м).
ББА-МС (м/з) 254 (М++1)Пример 213 Синтез 2-т-бутоксикарбониламино-3-(3-нитрофенил)пропионовой кислоты Используя 3-нитрофенилаланин в качестве исходного вещества, по методике, аналогичной Примеру 63, получают 2,54 г названного соединения, количественно. 1H-ЯМР (CDCl3),  : 1,41(9H, с), 3,01-3,22(1H, м), 3,25- 3,45(1H, м), 4,60-4,73 (1H, м), 5,02-5,11 (1H, м), 7,45-7,56 (2H, м), 8,07-8,14 (2H, м).
ББА-МС (м/з) 311 (М+ +1) : 1,41(9H, с), 3,01-3,22(1H, м), 3,25- 3,45(1H, м), 4,60-4,73 (1H, м), 5,02-5,11 (1H, м), 7,45-7,56 (2H, м), 8,07-8,14 (2H, м).
ББА-МС (м/з) 311 (М+ +1)Пример 214 Синтез метилового эфира 2-т-бутоксикарбониламино-3-(3-нитрофенил)пропионовой кислоты Используя соединение, полученное в Примере 213, в качестве исходного вещества, по методике, аналогичной Примеру 64, получают 2,7 г названного соединения, количественно. 1H-ЯМР (CDCl3),  : 1,41(9H, с), 3,12(1H, дд, J=13,9, 6,3Гц), 3,30(1H, дд, J= 13,9, 5,6 Гц), 3,76(3H, с), 4,57- 4,68(1H, м), 5,10-5,17(1H, м), 7,46-7,53 (2H, м), 7,99-8,04(1H, м), 8,08-8,17 (1H, м).
Пример 215 : 1,41(9H, с), 3,12(1H, дд, J=13,9, 6,3Гц), 3,30(1H, дд, J= 13,9, 5,6 Гц), 3,76(3H, с), 4,57- 4,68(1H, м), 5,10-5,17(1H, м), 7,46-7,53 (2H, м), 7,99-8,04(1H, м), 8,08-8,17 (1H, м).
Пример 215Синтез метилового эфира 3-(3-аминофенил)-2-т-бутокси-карбониламинопропионовой кислоты Используя соединение, полученное в Примере 214, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 1,84 г названного соединения (выход 81%). 1H-ЯМР (CDCl3),  : 1,42 (9H, с), 2,90-3,02 (2H, м), 3,62 (2H, шс), 3,71 (3H, с), 4,47-4,61 (1H, м), 4,92-5,00 (1H, м), 6,45-6,58 (3H, м), 7,04-7,10 (1H, м).
Пример 216 : 1,42 (9H, с), 2,90-3,02 (2H, м), 3,62 (2H, шс), 3,71 (3H, с), 4,47-4,61 (1H, м), 4,92-5,00 (1H, м), 6,45-6,58 (3H, м), 7,04-7,10 (1H, м).
Пример 216Синтез метилового эфира 2-т-бутоксикарбониламино-3-(3-(S-метилизотиоуреидо)фенил)пропионовой кислоты Используя соединение, полученное в Примере 215, в качестве исходного вещества, по методике, аналогичной Примеру 211, получают 0,10 г названного соединения (выход 4%). 1H-ЯМР (CDCl3),  : 1,36 (9H, с), 2,46 (3H, с), 2,85- 2,93(1H, м), 3,08-3,15 (1H, м), 3,73 (3H, с), 4,57-4,69 (2H, м), 4,98-5,01 (1H, м), 6,72-6,80 (3H, м), 7,19-7,27 (1H, м).
Пример 217 : 1,36 (9H, с), 2,46 (3H, с), 2,85- 2,93(1H, м), 3,08-3,15 (1H, м), 3,73 (3H, с), 4,57-4,69 (2H, м), 4,98-5,01 (1H, м), 6,72-6,80 (3H, м), 7,19-7,27 (1H, м).
Пример 217Синтез дигидрохлорида метилового эфира 2-амино-3-(3-(S-метилизотиоуреидо)фенил)пропионовой кислоты Используя соединение, полученное в Примере 216, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 33 мг названного соединения (выход 81%). 1H-ЯМР (D2O),  : 2,69(3H, с), 3,30(1H, дд, J=14,5, 7,3 Гц), 3,40(1H, дд, J= 14,5, 6,3 Гц), 3,84 (3H, с), 4,45-4,50 (1H, м), 7,28-7,40 (3H, м), 7,54-7,59(1H, м).
Пример 218 : 2,69(3H, с), 3,30(1H, дд, J=14,5, 7,3 Гц), 3,40(1H, дд, J= 14,5, 6,3 Гц), 3,84 (3H, с), 4,45-4,50 (1H, м), 7,28-7,40 (3H, м), 7,54-7,59(1H, м).
Пример 218Синтез метилового эфира 3-т-бутоксикарбониламино-2-(4-нитрофенил)пропионовой кислоты Используя монометил 3-фенилсукцинат в качестве исходного вещества, по методике, аналогичной Примеру 1с, получают 4,2 г названного соединения (выход 40%). 1H-ЯМР (CDCl3),  : 1,42(9H, с), 3,53-3,68(2H, м), 3,72(3H, с), 4,00-4,12 (1H, м), 4,85-4,95 (1H, м), 7,45 (2H, д, J=8,6 Гц), 8,20 (2H, д, J=8,6 Гц).
Пример 219 : 1,42(9H, с), 3,53-3,68(2H, м), 3,72(3H, с), 4,00-4,12 (1H, м), 4,85-4,95 (1H, м), 7,45 (2H, д, J=8,6 Гц), 8,20 (2H, д, J=8,6 Гц).
Пример 219Синтез метилового эфира 2-(4-аминофенил)-3-т-бутокси-карбониламинопропионовой кислоты Используя соединение, полученное в Примере 218, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 3,1 г названного соединения (выход 81%). 1H-ЯМР (CDCl3),  : 1,48 (9H, с), 3,47-3,82 (5H, м), 3,72 (3H, с), 4,87-4,95 (1H, м), 6,68(2H, д, J=8,5 Гц), 7,09(2H, д, J=8,5 Гц).
Пример 220 : 1,48 (9H, с), 3,47-3,82 (5H, м), 3,72 (3H, с), 4,87-4,95 (1H, м), 6,68(2H, д, J=8,5 Гц), 7,09(2H, д, J=8,5 Гц).
Пример 220Синтез метилового эфира 3-т-бутоксикарбониламино-2-(4-(N’-нитрогуанидино)фенил)пропионовой кислоты Используя соединение, полученное в Примере 219, в качестве исходного вещества, по методике, аналогичной Примеру 6, получают 0,86 г названного соединения (выход 68%). 1H-ЯМР (CDCl3),  : 1,42(9H,с), 3,39-3,89(3H, м), 3,66(3H,с), 4,80-4,92 (1H, м), 6,23(2H, д, J=8,3 Гц), 7,03(2H, д, J=8,3 Гц).
Пример 221 : 1,42(9H,с), 3,39-3,89(3H, м), 3,66(3H,с), 4,80-4,92 (1H, м), 6,23(2H, д, J=8,3 Гц), 7,03(2H, д, J=8,3 Гц).
Пример 221Синтез гидрохлорида метилового эфира 3-амино-2-(4-(N’-нитрогуанидино)фенил)пропионовой кислоты Используя соединение, полученное в Примере 220, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 348 мг названного соединения, количественно. 1H-ЯМР (D2O),  : 3,44(1H, дд, J=13,2, 6,9 Гц), 3,63-3,80(1H, м), 3,76 (3H, с), 4,22-4,28 (1H, м), 7,48 (2H, д, J=8,9 Гц), 7,53 (2H, д, J=8,9 Гц).
Пример 222 : 3,44(1H, дд, J=13,2, 6,9 Гц), 3,63-3,80(1H, м), 3,76 (3H, с), 4,22-4,28 (1H, м), 7,48 (2H, д, J=8,9 Гц), 7,53 (2H, д, J=8,9 Гц).
Пример 222Синтез 3-т-бутоксикарбониламино-2-(4-(N’-нитрогуанидино)фенил)пропионовой кислоты Смесь соединения (0,42 г), полученного в Примере 220, 2N водного раствора гидроксида натрия (0,6 мл) и метанола (10 мл) перемешивают при комнатной температуре в течение 5 ч. Реакционную смесь концентрируют при пониженном давлении, к остатку добавляют 5% водный раствор лимонной кислоты и этилацетат. Органический слой промывают водой, сушат и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – метанол:метиленхлорид=5:95), получая 0,34 г названного соединения (выход 84%). 1H-ЯМР (ДМСО-d6),  : 1,35 (9H, с), 3,05-3,18 (1H, м), 3,32-3,41 (3H, м), 3,52-3,58 (1H, м), 6,50 (2H, д, J=8,6 Гц), 6,88(2H, д, J=8,6 Гц).
Пример 223 : 1,35 (9H, с), 3,05-3,18 (1H, м), 3,32-3,41 (3H, м), 3,52-3,58 (1H, м), 6,50 (2H, д, J=8,6 Гц), 6,88(2H, д, J=8,6 Гц).
Пример 223Синтез гидрохлорида 3-амино-2-(4-(N’-нитрогуанидино) фенил)пропионовой кислоты Используя соединение, полученное в Примере 222, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 287 мг названного соединения, количественно. 1H-ЯМР (D2O),  : 3,40(1H, дд, J=13,2, 6,9 Гц), 3,67(1H, дд, J=13,2, 7,9 Гц), 4,18 (1H, дд, J=7,9, 6,9 Гц), 7,48 (2H, д, J=8,9 Гц), 7,55 (2H, д, J= 8,9 Гц).
Пример 224 : 3,40(1H, дд, J=13,2, 6,9 Гц), 3,67(1H, дд, J=13,2, 7,9 Гц), 4,18 (1H, дд, J=7,9, 6,9 Гц), 7,48 (2H, д, J=8,9 Гц), 7,55 (2H, д, J= 8,9 Гц).
Пример 224Синтез метилового эфира 3-т-бутоксикарбониламино-2-(4-тиоуреидофенил)пропионовой кислоты Используя соединение, полученное в Примере 219, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 1,10 г названного соединения (выход 94%). 1H-ЯМР (CDCl3),  : 1,41 (9H, с), 3,38-3,70 (2H, м), 3,69 (3H, с), 3,82-3,97 (1H, м), 5,04-5,16 (1H, м),) 6,57(2H, шс), 7,22(2H, d, J=8,3 Гц), 7,30(2H, д, J=8,3 Гц), 9,00(1H, шс).
МС (м/з) 353 (М+) : 1,41 (9H, с), 3,38-3,70 (2H, м), 3,69 (3H, с), 3,82-3,97 (1H, м), 5,04-5,16 (1H, м),) 6,57(2H, шс), 7,22(2H, d, J=8,3 Гц), 7,30(2H, д, J=8,3 Гц), 9,00(1H, шс).
МС (м/з) 353 (М+)Пример 225 Синтез метилового эфира 3-т-бутоксикарбониламино-2-(4-(S-этилизотиоуреидо)фенил)пропионовой кислоты Используя соединение, полученное в Примере 224, в качестве исходного вещества и также используя этилиодид в качестве реагента, по методике, аналогичной Примеру 29, получают 0,55 г названного соединения (выход 96%). 1H-ЯМР (CDCl3),  : 1,34 (3H, т, J=7,3 Гц), 1,42 (9H, с), 2,92-3,08 (2H, м), 3,40-3,72(2H, м), 3,67(3H, с), 3,78-3,90(1H, м), 4,67(1H, br), 4,90-5,06 (1H, м), 6,78(2H, д, J=7,9 Гц), 7,17 (2H, д, J=7,9 Гц).
ББА-МС (м/з) 382 (М++1) : 1,34 (3H, т, J=7,3 Гц), 1,42 (9H, с), 2,92-3,08 (2H, м), 3,40-3,72(2H, м), 3,67(3H, с), 3,78-3,90(1H, м), 4,67(1H, br), 4,90-5,06 (1H, м), 6,78(2H, д, J=7,9 Гц), 7,17 (2H, д, J=7,9 Гц).
ББА-МС (м/з) 382 (М++1)Пример 226 Синтез дигидрохлорида метилового эфира 3-амино-2-(4-(S-этилизотиоуреидо)фенил)пропионовой кислоты Используя соединение, полученное в Примере 225, в качестве исходного вещества, по методике, аналогичною Примеру 5, получают 0,199 г названного соединения (выход 83%). 1H-ЯМР (D2O),  : 1,41 (3H, т, J=7,3 Гц), 3,24 (2H, к, J=7,3 Гц), 3,44 (1H, дд, J=13,2, 6,9 Гц), 3,69- 3,74(1H, m), 3,76(3H, с), 4,21-4,27(1H, м), 7,44(2H, д, J=8,9 Гц), 7,52(2H, д, J=8,9 Гц).
ББА-МС (м/з) 282 (М+ +1) : 1,41 (3H, т, J=7,3 Гц), 3,24 (2H, к, J=7,3 Гц), 3,44 (1H, дд, J=13,2, 6,9 Гц), 3,69- 3,74(1H, m), 3,76(3H, с), 4,21-4,27(1H, м), 7,44(2H, д, J=8,9 Гц), 7,52(2H, д, J=8,9 Гц).
ББА-МС (м/з) 282 (М+ +1)Пример 227 Синтез N-(2-нитрофенилметил)фталимида Используя 2-нитрофенилметилбромид в качестве исходного вещества, по методике, аналогичной Примеру 117, получают 6,24 г названного соединения (выход 96%). 1H-ЯМР (CDCl3),  : 5,31 (2H, с), 7,25- 7,27 (1H, м), 7,45 (1H, т, J=7,6 Гц), 7,55(1 H, т, J=7,6 Гц), 7,75-7,94(4H, м), 8,11(1H, д, J=7,9 Гц).
МС (м/з) 282 (М+) : 5,31 (2H, с), 7,25- 7,27 (1H, м), 7,45 (1H, т, J=7,6 Гц), 7,55(1 H, т, J=7,6 Гц), 7,75-7,94(4H, м), 8,11(1H, д, J=7,9 Гц).
МС (м/з) 282 (М+)Пример 228 Синтез т-бутилового эфира N-(2-нитрофенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 227, в качестве исходного вещества, по методике, аналогичной Примеру 118, получают 7,59 г названного соединения, количественно. 1H-ЯМР (CDCl3),  : 1,43(9H, с), 4,57(2H, д, J=6,6 Гц), 5,30- 5,43(1H, м), 7,38-7,50 (1H, м), 7,62-7,64 (2H, м), 8,05 (1H, д, J=7,9 Гц).
Пример 229 : 1,43(9H, с), 4,57(2H, д, J=6,6 Гц), 5,30- 5,43(1H, м), 7,38-7,50 (1H, м), 7,62-7,64 (2H, м), 8,05 (1H, д, J=7,9 Гц).
Пример 229Синтез т-бутилового эфира N-(2-аминофенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 228, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 4,54 г названного соединения (выход 92%). 1H-ЯМР (CDCl3),  : 1,42(9H,с), 4,18 (2H, д, J=6,4 Гц), 6,40-6,79(1H, м), 6,85-7,23(2H, м), 7,80(1H, д, J=8,0 Гц).
МС (м/з) 222 (М+) : 1,42(9H,с), 4,18 (2H, д, J=6,4 Гц), 6,40-6,79(1H, м), 6,85-7,23(2H, м), 7,80(1H, д, J=8,0 Гц).
МС (м/з) 222 (М+)Пример 230 Синтез т-бутилового эфира N-(2-тиоуреидофенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 229, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 525 мг названного соединения (выход 26%). 1H-ЯМР (CDCl3),  : 1,40(9H, с), 4,26(2H, д, J=5,9 Гц), 5,38-5,57(1H, м), 6,42 (2H, шс), 7,28-7,38 (4H, м), 9,27 (1H, шс).
МС (м/з) 281(М+) : 1,40(9H, с), 4,26(2H, д, J=5,9 Гц), 5,38-5,57(1H, м), 6,42 (2H, шс), 7,28-7,38 (4H, м), 9,27 (1H, шс).
МС (м/з) 281(М+)Пример 231 Синтез гидроиодида т-бутилового эфира N-(2-(S-этилизотиоуреидо)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 230, 5 качестве исходного вещества, по методике, аналогичной Примеру 27, получают 0,60 г названного соединения, количественно. 1H-ЯМР (CDCl3),  : 1,34(3H, т, J=7,3 Гц), 1,43(9H,с), 2,88- 3,06(2H, м), 4,15 (2H, д, J=4,4 Гц), 4,80 (2H, шс), 5,25-5,38 (1H, м), 6,80(1H, д, J= 7,8 Гц), 6,98(1H, т, J=7,8 Гц), 7,13-7,34 (2H, м).
МС (м/з) 309(М+) : 1,34(3H, т, J=7,3 Гц), 1,43(9H,с), 2,88- 3,06(2H, м), 4,15 (2H, д, J=4,4 Гц), 4,80 (2H, шс), 5,25-5,38 (1H, м), 6,80(1H, д, J= 7,8 Гц), 6,98(1H, т, J=7,8 Гц), 7,13-7,34 (2H, м).
МС (м/з) 309(М+)Пример 232 Синтез дигидрохлорида N-(2-(S-этилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 231, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 451 мг названного соединения (выход 86%). 1H-ЯМР (D2O),  : 1,40(3H, т, J= 7,3 Гц), 3,24 (2H, к, J=7,3 Гц), 4,23(2H, с), 20 7,47-7,64(4H, м).
ББА-МС (м/з) 210 (М++1) : 1,40(3H, т, J= 7,3 Гц), 3,24 (2H, к, J=7,3 Гц), 4,23(2H, с), 20 7,47-7,64(4H, м).
ББА-МС (м/з) 210 (М++1)Пример 233 Синтез т-бутилового эфира N-(1-(3-(N’-т-бутоксикарбонил- N”-этилгуанидино)фенил)циклогексил)карбаминовой кислоты К смеси соединения (100 мг), полученного в Примере 139, N-этил-N’-т-бутоксикарбонилтиомочевины (85 мг) и диметилформамида (5 мл) добавляют гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (79 мг) при комнатной температуре и смесь перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь разбавляют этилацетатом и промывают насыщенных водным раствором хлорида натрия; органический слой затем сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – хлороформ:метанол= 98:2), получая 156 мг названного соединения (выход 98%). 1H-ЯМР (CDCl3),  : 1,00-1,08 (3H, м), 1,27-1,82(8H, м), 1,53 (9H, с), 1,62 (9H, с), 2,07-2,30 (2H, м), 3,32- 3,48 (2H, м), 4,84 (1H, шс), 6,98-7,40(4H, м), 8,02(1H, с).
Пример 234 : 1,00-1,08 (3H, м), 1,27-1,82(8H, м), 1,53 (9H, с), 1,62 (9H, с), 2,07-2,30 (2H, м), 3,32- 3,48 (2H, м), 4,84 (1H, шс), 6,98-7,40(4H, м), 8,02(1H, с).
Пример 234Синтез дигидрохлорида N-(1-(3-(N’-этилгуанидино)фенил)циклогексил)амина Используя соединение, полученное в Примере 233, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 85 мг названного соединения (выход 78%). 1H-ЯМР (D2O),  : 1,23 (3H, т, J=7,3 Гц), 1,31-1,64(4H, м), 1,64-1,86 (2H, м), 1,90-2,06(2H, м), 2,40-2,60(2H, м), 3,33(2H, к, J=7,3 Гц), 7,30-7,77(4H, m).
Пример 235 : 1,23 (3H, т, J=7,3 Гц), 1,31-1,64(4H, м), 1,64-1,86 (2H, м), 1,90-2,06(2H, м), 2,40-2,60(2H, м), 3,33(2H, к, J=7,3 Гц), 7,30-7,77(4H, m).
Пример 235Синтез т-бутилового эфира N-(1-(3-(N’-т-бутоксикарбонил-N”-этилгуанидино)фенил)циклопентил)карбаминовой кислоты Используя соединение, полученное в Примере 148, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают 160 мг названного соединения (выход 99%). 1H-ЯМР (CDCl3),  : 1,00-1,20(3H, м), 1,34(9H, с), 1,53(9H, с), 1,72-1,92 (4H, м), 1,93-2,10 (2H, м), 2,12-2,35 (2H, м), 3,30-3,50 (2H, м), 4,82(1H, шс), 6,90-7,20(4H, м), 8,02(1H, с).
Пример 236 : 1,00-1,20(3H, м), 1,34(9H, с), 1,53(9H, с), 1,72-1,92 (4H, м), 1,93-2,10 (2H, м), 2,12-2,35 (2H, м), 3,30-3,50 (2H, м), 4,82(1H, шс), 6,90-7,20(4H, м), 8,02(1H, с).
Пример 236Синтез дигидрохлорида N-(1-(3-(N’-этилгуанидино)фенил)циклопентил)амина Используя соединение, полученное в Примере 235, как исходное вещество, по методике, аналогичной Примеру 5, получают 88 мг названного соединения (выход 79%). 1H-ЯМР (D2O),  : 1,23(3H, т, J=7,3 Гц), 1,82-2,06(4H, м), 2,22-2,40(4H, м), 3,33(2H, к, J=7,3 Гц), 7,34-7,61(4H, м).
Пример 237 : 1,23(3H, т, J=7,3 Гц), 1,82-2,06(4H, м), 2,22-2,40(4H, м), 3,33(2H, к, J=7,3 Гц), 7,34-7,61(4H, м).
Пример 237Синтез т-бутилового эфира N-(1-(3-(N’-т-бутоксикарбонил-N”-этилгуанидино)фенил)циклобутил)карбаминовой кислоты Используя соединение, полученное в Примере 157, как исходное вещество, по методике, аналогичной Примеру 233, получают 171 мг названного соединения, количественно. 1H-ЯМР (CDCl3),  : 1,00-1,21(3H, м), 1,36(9H, с), 1,53(9H, с), 1,65-1,98(1H, м), 2,01-2,22(1H, м), 2,26-2,60(4H, м), 3,35- 3,50(2H, м), 5,17(1H, шс), 6,95-7,20(4H, м), 8,01(1H,с).
Пример 238 : 1,00-1,21(3H, м), 1,36(9H, с), 1,53(9H, с), 1,65-1,98(1H, м), 2,01-2,22(1H, м), 2,26-2,60(4H, м), 3,35- 3,50(2H, м), 5,17(1H, шс), 6,95-7,20(4H, м), 8,01(1H,с).
Пример 238Синтез дигидрохлорида N-(1-(3-(N’-этилгуанидино)фенил)циклобутил)амина Используя соединение, полученное в Примере 237, как исходное вещество, по методике, аналогичной Примеру 5, получают 85 мг названного соединения (выход 73%). 1H-ЯМР (D2O),  : 1,24(3H, т, J=7,3 Гц), 1,94-2,04(1H, м), 2,19-2,24(1H, м), 2,60-2,84(4H, м), 3,33(2H, к, J=7,3 Гц), 7,35-7,63(4H, м).
Пример 239 : 1,24(3H, т, J=7,3 Гц), 1,94-2,04(1H, м), 2,19-2,24(1H, м), 2,60-2,84(4H, м), 3,33(2H, к, J=7,3 Гц), 7,35-7,63(4H, м).
Пример 239Синтез (3-нитро-5-трифторметилфенил)метанола Используя 3-нитро-5-трифторометилбензойную кислоту как исходное вещество, по методике, аналогичной Примеру 132, получают 4,6 г названного соединения (выход 98%). 1H-ЯМР (CDCl3),  : 2,21(1H, т, J= 5,6 Гц), 4,92(2H, д, J=5,6 Гц), 7,99(1H, с), 8,41(1H, с), 8,44(1H, с).
Пример 240 : 2,21(1H, т, J= 5,6 Гц), 4,92(2H, д, J=5,6 Гц), 7,99(1H, с), 8,41(1H, с), 8,44(1H, с).
Пример 240Синтез (3-бромметил-5-трифторметилнитробензола Используя соединение, полученное в Примере 239, как исходное вещество, по методике, аналогичной Примеру 55, получают 7,72 г названного соединения, количественно. 1H-ЯМР (CDCl3),  : 4,58(2H, с), 7,99(1H, с), 8,44(1H, с), 8,46(1H, с).
Пример 241 : 4,58(2H, с), 7,99(1H, с), 8,44(1H, с), 8,46(1H, с).
Пример 241Синтез ди-т-бутилового эфира N-(3-нитро-5-трифторметилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 240, как исходное вещество, по методике, аналогичной Примеру 127, получают 2,6 г названного соединения (выход 59%). 1H-ЯМР (CDCl3),  : 1,51(18H, с), 4,92(2H, с), 7,93(1H, с), 8,41(2H, с).
Пример 242 : 1,51(18H, с), 4,92(2H, с), 7,93(1H, с), 8,41(2H, с).
Пример 242Синтез ди-т-бутилового эфира N-(3-амино-5-трифтор-метилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 241, как исходное вещество, по методике, аналогичной Примеру 2, получают 2,19 г названного соединения (выход 99%). 1H-ЯМР (CDCl3),  : 1,46(18H, с), 4,71(2H, с), 6,76-6,90(3H, м).
Пример 243 : 1,46(18H, с), 4,71(2H, с), 6,76-6,90(3H, м).
Пример 243Синтез ди-т-бутилового эфира N-(3-тиоуреидо-5-трифторметилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 242, как исходное вещество, по методике, аналогичной Примеру 120, получают 1,02 г названного соединения, количественно. 1H-ЯМР (CDCl3),  : 1,48(18H, с), 4,82(2H, с), 6,26(2H, ш), 7,45-7,50(3H, м), 8,32(1H, с).
Пример 244 : 1,48(18H, с), 4,82(2H, с), 6,26(2H, ш), 7,45-7,50(3H, м), 8,32(1H, с).
Пример 244Синтез ди-т-бутилового эфира N-(3-(S-этилизотиоуреидо)-5-трифторметилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 243, как исходное вещество, по методике, аналогичной Примеру 95, получают 99 мг названного соединения (выход 59%). 1H-ЯМР (CDCl3),  : 1,36(3H, т, J=7,3 Гц), 1,47(18H, с), 2,90- 3,12(2H, м), 4,78(2H, с), 7,00-7,22(3H, с).
Пример 245 : 1,36(3H, т, J=7,3 Гц), 1,47(18H, с), 2,90- 3,12(2H, м), 4,78(2H, с), 7,00-7,22(3H, с).
Пример 245Синтез дигидрохлорида N-(3-(S-этилизотиоуреидо)-5-трифторметилфенилметил)амина Используя соединение, полученное в Примере 244, как исходное вещество, по методике, аналогичной Примеру 5, получают 81 мг названного соединения (выход 88%). 1H-ЯМР (D2O),  : 1,42(3H, т, J=7,3 Гц), 3,26(2H, к, J=7,3 Гц), 4,33(2H, с), 7,72 (1H, с), 7,83(1H, с), 7,89(1H, с).
Пример 246 : 1,42(3H, т, J=7,3 Гц), 3,26(2H, к, J=7,3 Гц), 4,33(2H, с), 7,72 (1H, с), 7,83(1H, с), 7,89(1H, с).
Пример 246Синтез ди-т-бутилового эфира N-(3-(N’-нитрогуанидино)-5-трифторметилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 242, как исходное вещество, по методике, аналогичной Примеру 6, получают 17,2 мг названного соединения (выход 5,6%). 1H-ЯМР (CDCl3),  : 1,48 (18H, с), 4,84 (2H, с), 7,50-7,60 (3H, м), 9,79 (1H, с).
Пример 247 : 1,48 (18H, с), 4,84 (2H, с), 7,50-7,60 (3H, м), 9,79 (1H, с).
Пример 247Синтез гидрохлорида N-(3-(N’-нитрогуанидино)-5-трифторметилфенилметил)амина Используя соединение, полученное в Примере 246, как исходное вещество, по методике, аналогичной Примеру 5, получают 81 мг названного соединения (выход 88%). 1H-ЯМР (D2O),  : 4,29 (2H, с), 7,68-7,78 (3H, м).
Пример 248 : 4,29 (2H, с), 7,68-7,78 (3H, м).
Пример 248Синтез N-(3-фтор-4-метилфенил)фталимида Смесь 3-фтор-4-метиланилина (12,5 г), фталевого ангидрида (17,8 г), триэтиламина (27,9 мл) и хлороформа (100 мл) кипятят с обратным холодильником в течение 6 дней и концентрируют при пониженном давлении. Остаток растворяют в этилацетате и промывают последовательно 2N HCl и насыщенным водным раствором хлорида натрия; затем органический слой сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Впоследствии к полученному остатку добавляют хлороформ и нерастворимое вещество отфильтровывают, тогда как фильтрат концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – хлороформ:метанол= 98:2), получая 18,7 г названного соединения (выход 73%). 1H-ЯМР (CDCl3),  : 2,33 (1H, с), 7 (1H, с), 7,18 (1H, с), 7,28-7,34 (1H, м), 7,79-7,82 (2H, м), 7,94-7,98 (2H, м).
Пример 249 : 2,33 (1H, с), 7 (1H, с), 7,18 (1H, с), 7,28-7,34 (1H, м), 7,79-7,82 (2H, м), 7,94-7,98 (2H, м).
Пример 249Синтез N-(4-бромметил-3-фторфенил)фталимида Смесь соединения (1,0 г), полученного в Примере 248, N-бромсукцинимида (698 мг),  , ,  – -азобис(изобутиронитрила) (каталитическое количество) и четыреххлористого углерода (20 мл) кипятят с обратным холодильником в течение 16 ч. Реакционную смесь концентрируют при пониженном давлении и полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=8:2), получая 605 мг названного соединения (выход 46%).
1H-ЯМР(CDCl3), – -азобис(изобутиронитрила) (каталитическое количество) и четыреххлористого углерода (20 мл) кипятят с обратным холодильником в течение 16 ч. Реакционную смесь концентрируют при пониженном давлении и полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=8:2), получая 605 мг названного соединения (выход 46%).
1H-ЯМР(CDCl3),  : 4,55 (2H, с), 7,28-7,33 (2H, м), 7,50- 7,56 (1H, м), 7,80-7,84(2H, м), 7,96-7,99(2H, м).
Пример 250 : 4,55 (2H, с), 7,28-7,33 (2H, м), 7,50- 7,56 (1H, м), 7,80-7,84(2H, м), 7,96-7,99(2H, м).
Пример 250Синтез N-(4-цианометил-3-фторфенил)фталимида К раствору цианида натрия (99 мг) в диметилсульфоксиде (5 мл), по каплям добавляют при 60oC раствор соединения (605 мг), полученного в Примере 249, в диметилсульфоксиде (10 мл) и перемешивают при 60oC в течение 40 мин. Реакционную смесь разбавляют водой и экстрагируют смесью этилацетат/диэтиловый эфир (1:1); после этого органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат= 6:4), получая 164 мг названного соединения (выход 32%). 1H-ЯМР(CDCl3),  : 3,83 (2H, с), 7,33-7,41 (2H, м), 7,57-7,63 (1H, м), 7,81-7,84 (2H, м), 7,96-8,00 (2H, м).
Пример 251 : 3,83 (2H, с), 7,33-7,41 (2H, м), 7,57-7,63 (1H, м), 7,81-7,84 (2H, м), 7,96-8,00 (2H, м).
Пример 251Синтез 4-цианометил-3-фтороанилина К раствору соединения (164 мг), полученного в Примере 250, в метаноле (5 мл) добавляют моногидрат гидразина (0,057 мл) и кипятят с обратным холодильником в течение 3 ч. Реакционную смесь концентрируют при пониженном давлении и полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=6:4), получая 67 мг названного соединения (выход 76%). 1H-ЯМР (CDCl3),  : 3,62 (2H, с), 3,84 (2H, шс), 6,37-6,47 (2H, м), 7,09-7,16 (1H, м).
Пример 252 : 3,62 (2H, с), 3,84 (2H, шс), 6,37-6,47 (2H, м), 7,09-7,16 (1H, м).
Пример 252Синтез 4-(2-аминоэтил)-3-фтороанилина К суспензии литийалюминийгидрида (76 мг) в диэтиловом эфире (5 мл) добавляют при охлаждении льдом концентрированную серную кислоту (0,053 мл) и перемешивают при комнатной температуре в течение 1 ч. Впоследствии добавляют по каплям при комнатной температуре раствор соединения (100 мг), полученного в примере 251, в диэтиловом эфире и кипятят с обратным холодильником в течение 18 ч. К реакционной смеси добавляют при охлаждении льдом воду (1 мл) и 2N водный раствор гидроксида натрия (10 мл) и смесь экстрагируют диэтиловым эфиром; органический слой сушат безводным сульфатом натрия и концентрируют при пониженном давлении, получая 110 мг названного соединения количественно. 1H-ЯМР(CDCl3),  : 2,65 (2H, т, J=6,9 Гц), 2,88 (2H, т, J=6,9 Гц), 3,70 (2H, шс), 6,34-6,42 (2H, м), 6,91-6,98 (1H, м).
Пример 253 : 2,65 (2H, т, J=6,9 Гц), 2,88 (2H, т, J=6,9 Гц), 3,70 (2H, шс), 6,34-6,42 (2H, м), 6,91-6,98 (1H, м).
Пример 253Синтез т-бутилового эфира N-(2-(4-амино-2-фторофенил)этил)карбаминовой кислоты К раствору соединения (110 мг), полученного в Примере 252, в метиленхлориде (10 мл) добавляют при охлаждении льдом ди-т-бутилдикарбонат (113 мг) и перемешивают в течение 1 ч при охлаждении льдом. Реакционную смесь концентрируют при пониженном давлении и полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=6:4), получая 51 мг названного соединения (выход 39%). 1H-ЯМР (CDCl3),  : 1,43 (9H, с), 2,70 (2H, т, J=6,9 Гц), 3,22-3,38 (2H, м), 3,70 (2H, шс), 4,58 (1H, шс), 6,34-6,40 (2H, м), 6,90-6,96 (1H, м).
Пример 254 : 1,43 (9H, с), 2,70 (2H, т, J=6,9 Гц), 3,22-3,38 (2H, м), 3,70 (2H, шс), 4,58 (1H, шс), 6,34-6,40 (2H, м), 6,90-6,96 (1H, м).
Пример 254Синтез т-бутилового эфира N-(2-(2-фторо-4-тиоуреидофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 253, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 172 мг названного соединения, количественно. 1H-ЯМР (CDCl3)  1,42 (9H, с), 2,84 (2H, т, J=6,9 Гц), 3,30-3,44 (2H, м), 4,63 (1H, шс), 6,19 (2H, шс), 6,95-6,99 (2H, м), 7,20-7,35 (1H, м), 8,10 (1H, шс).
Пример 255 1,42 (9H, с), 2,84 (2H, т, J=6,9 Гц), 3,30-3,44 (2H, м), 4,63 (1H, шс), 6,19 (2H, шс), 6,95-6,99 (2H, м), 7,20-7,35 (1H, м), 8,10 (1H, шс).
Пример 255Синтез т-бутилового эфира N-(2-(4-(S-этилизотиоуреидо)-2-фторфенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 254, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают 151 мг названного соединения (выход 92%). 1H-ЯМР(CDCl3),  : 1,36 (3H, т, J=7,3 Гц), 1,43 (9H, с), 2,78 (2H, т, J= 6,9 Гц), 2,92-3,15 (2H, м), 3,28-3,40 (2H, м), 4,58 (1H, шс), 6,60-6,70 (2H, м), 7,07-7,13 (1H, м).
Пример 256 : 1,36 (3H, т, J=7,3 Гц), 1,43 (9H, с), 2,78 (2H, т, J= 6,9 Гц), 2,92-3,15 (2H, м), 3,28-3,40 (2H, м), 4,58 (1H, шс), 6,60-6,70 (2H, м), 7,07-7,13 (1H, м).
Пример 256Синтез дигидрохлорида N-(2-(4-(S-этилизотиоуреидо)-2-фторофенил)этил)амина Используя соединение, полученное в Примере 253, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 141 мг названного соединения, количественно. 1H-ЯМР(D2O  : 1,41 (3H, т, J=3,7 Гц), 3,09 (2H, т, J=7,3 Гц), 3,23 (2H, к, J=7,3 Гц), 3,29 (2H, т, J=3,7 Гц), 7,19-7,24 (2H, м), 7,45-7,52 (1H, м).
Пример 257 : 1,41 (3H, т, J=3,7 Гц), 3,09 (2H, т, J=7,3 Гц), 3,23 (2H, к, J=7,3 Гц), 3,29 (2H, т, J=3,7 Гц), 7,19-7,24 (2H, м), 7,45-7,52 (1H, м).
Пример 257Синтез т-бутилового эфира N-(2-(4-(N’-т-бутоксикарбонил-N’-этилгуанидино)-2-фторофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 253, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают 167 мг названного соединения (выход 76%). 1H-ЯМР(CDCl3),  : 1,19 (3H, т, J=7,3 Гц),1,43 (9H, с), 1,48 (9H, с), 2,70-2,86 (2H, м), 3,22-3,48 (4H, м), 5,94 (1H, шс), 6,50- 7,22 (3H, м), 8,02 (1H, с).
Пример 258 : 1,19 (3H, т, J=7,3 Гц),1,43 (9H, с), 1,48 (9H, с), 2,70-2,86 (2H, м), 3,22-3,48 (4H, м), 5,94 (1H, шс), 6,50- 7,22 (3H, м), 8,02 (1H, с).
Пример 258Синтез дигидрохлорида N-(2-(4-(N’-этилгуанидино)-2-фторофенил)этил)амина Используя соединение, полученное в Примере 257, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 75 мг названного соединения (выход 67%). 1H-ЯМР (D2O),  : 1,23 (3H, т, J=7,3 Гц), 3,07 (2H, т, J=7,3 Гц), 3,27-3,36 (4H, м), 7,11-7,45 (3H, м).
Пример 259 : 1,23 (3H, т, J=7,3 Гц), 3,07 (2H, т, J=7,3 Гц), 3,27-3,36 (4H, м), 7,11-7,45 (3H, м).
Пример 259Синтез т-бутилового эфира N-(2-(2-фторо-4-(N’-нитро-гуанидино)фенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 253, в качестве исходного вещества, по методике, аналогичной Примеру 6, получают 65 мг названного соединения (выход 48%). 1H-ЯМР(CDCl3),  : 1,42 (9H, с), 2,87 (2H, т, J=6,6 Гц), 3,30-3,46 (2H, м), 4,69 (1H, шс), 7,00-7,12 (2H, м), 7,28- 7,40 (1H, м), 9,84 (1H, с).
Пример 260 : 1,42 (9H, с), 2,87 (2H, т, J=6,6 Гц), 3,30-3,46 (2H, м), 4,69 (1H, шс), 7,00-7,12 (2H, м), 7,28- 7,40 (1H, м), 9,84 (1H, с).
Пример 260Синтез гидрохлорида N-(2-(2-фторо-4-(N’-нитрогуанидино)фенил)этил)амина Используя соединение, полученное в Примере 259, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 28 мг названного соединения (выход 57%). 1H-ЯМР(D2O),  : 3,07 (2H, т, J=7,3 Гц), 3,30 (2H, т, J=7,3 Гц), 7,15-7,45 (3H, м).
Пример 261 : 3,07 (2H, т, J=7,3 Гц), 3,30 (2H, т, J=7,3 Гц), 7,15-7,45 (3H, м).
Пример 261Синтез 2-фторо-5-нитробензилового спирта Используя 2-фторо-5-нитробензойную кислоту в качестве исходного вещества, по методике, аналогичной Примеру 132, получают названное соединение (выход 95%). 1H-ЯМР (CDCl3),  : 2,10 (1H, т, J=5,9 Гц), 4,86 (2H, д, J=5,9 Гц), 7,16-7,24 (1H, м), 8,15-8,25 (1H, м), 8,40-8,47 (1H, м).
Пример 262 : 2,10 (1H, т, J=5,9 Гц), 4,86 (2H, д, J=5,9 Гц), 7,16-7,24 (1H, м), 8,15-8,25 (1H, м), 8,40-8,47 (1H, м).
Пример 262Синтез 2-фторо-5-нитробензилбромида Используя соединение, полученное в Примере 261, в качестве исходного вещества, по методике, аналогичной Примеру 55, получают названное соединение (выход 98%). 1H-ЯМР(CDCl3),  : 4,53 (2H, с), 7,22-7,30 (1H, м), 8,18- 8,27 (1H, м), 8,40-8,47 (1H, м).
МС (м/з) 234 (М+) : 4,53 (2H, с), 7,22-7,30 (1H, м), 8,18- 8,27 (1H, м), 8,40-8,47 (1H, м).
МС (м/з) 234 (М+)Пример 263 Синтез ди-т-бутилового эфира N-(2-фторо-5-нитрофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 262, в качестве исходного вещества, по методике, аналогичной Примеру 127, получают названное соединение (выход 99%). 1H-ЯМР (CDCl3),  : 1,50 (18H, с), 4,91 (2H, с), 7,15-7,22 (1H, м), 8,12-8,21 (2H, м).
Пример 264 : 1,50 (18H, с), 4,91 (2H, с), 7,15-7,22 (1H, м), 8,12-8,21 (2H, м).
Пример 264Синтез ди-т-бутилового эфира N-(2-диметиламино-5-нитрофенилметил)иминодикарбоновой кислоты Смесь соединения (1,0 г), полученного в Примере 263, гидрохлорида диметиламина (485 мг), триэтиламина (0,8 мл) и диметилформамида (10 мл) нагревают при 80oC в течение 5,5 ч. Реакционную смесь дистиллируют при пониженном давлении и к остатку добавляют воду и 2N HCl; после экстракции этилацетатом органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=3:1), получая 1,1 г названного соединения, количественно. 1H-ЯМР(CDCl3),  : 1,39 (18H, с), 2,78 (6H, с), 4,78 (2H, с), 6,97 (1H, д, J=8,6 Гц), 7,95-8,02 (2H, м).
Пример 265 : 1,39 (18H, с), 2,78 (6H, с), 4,78 (2H, с), 6,97 (1H, д, J=8,6 Гц), 7,95-8,02 (2H, м).
Пример 265Синтез ди-т-бутилового эфира N-(5-амино-2-диметиламинофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 264, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают названное соединение (выход 99%). 1H-ЯМР(CDCl3),  : 1,42(18H, с), 2,58(6H, с), 3,48 (2H, шс), 4,85 (2H, с), 6,43-6,54 (2H, м),6,94 (1H, д, J=8,3 Гц).
МС (м/з) 365 (М+) : 1,42(18H, с), 2,58(6H, с), 3,48 (2H, шс), 4,85 (2H, с), 6,43-6,54 (2H, м),6,94 (1H, д, J=8,3 Гц).
МС (м/з) 365 (М+)Пример 266 Синтез ди-т-бутилового эфира N-(5-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-диметиламинофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 265, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают названное соединение (выход 73%). 1H-ЯМР(CDCl3),  : 1,08-1,12 (3H, м), 1,43 (18H, с), 1,53 (9H, с), 2,68 (6H, с), 3,10-3,48 (2H, м), 4,85 (2H, с), 6,84-7,12 (3H, м).
МС (м/з) 535 (М+) : 1,08-1,12 (3H, м), 1,43 (18H, с), 1,53 (9H, с), 2,68 (6H, с), 3,10-3,48 (2H, м), 4,85 (2H, с), 6,84-7,12 (3H, м).
МС (м/з) 535 (М+)Пример 267 Синтез тригидрохлорида N-(2-диметиламино-5-(N’-этил гуанидино)фенилметил)амина Используя соединение, полученное в Примере 266, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 67%). 1H-ЯМР (D2O),  : 1,24 (3H, т, J=7,3 Гц), 3,24 (6H, с), 3,35 (2H, к, J= 7,3 Гц), 4,41 (2H, с), 7,49-7,58 (2H, м), 7,82 (1H, д, J=8,9 Гц).
МС (м/з) 235 (М+) : 1,24 (3H, т, J=7,3 Гц), 3,24 (6H, с), 3,35 (2H, к, J= 7,3 Гц), 4,41 (2H, с), 7,49-7,58 (2H, м), 7,82 (1H, д, J=8,9 Гц).
МС (м/з) 235 (М+)Пример 268 Синтез ди-т-бутилового эфира N-(2-диметиламино-5-тио уреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 265, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают названное соединение (выход 91%). 1H-ЯМР(CDCl3),  : 1,44 (18H, с), 2,68 (6H, с), 4,84 (2H, с), 6,22 (2H, шс), 6,92-7,00 (1H, м), 7,04-7,16 (2H, м), 8,25 (1H, шс).
МС (м/з) 424 (М+) : 1,44 (18H, с), 2,68 (6H, с), 4,84 (2H, с), 6,22 (2H, шс), 6,92-7,00 (1H, м), 7,04-7,16 (2H, м), 8,25 (1H, шс).
МС (м/з) 424 (М+)Пример 269 Синтез ди-т-бутилового эфира N-(2-диметиламино-5-(S-этилизотиоуреидо)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 268, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают названное соединение (выход 92%). 1H-ЯМР (CDCl3),  : 1,34 (3H, т, J=7,3 Гц), 1,42 (18H, с), 2,63 (6H, с), 2,83-3,13 (2H, м), 4,87 (2H, с), 6,69-7,06 (3H, м).
МС (м/з) 452 (М+) : 1,34 (3H, т, J=7,3 Гц), 1,42 (18H, с), 2,63 (6H, с), 2,83-3,13 (2H, м), 4,87 (2H, с), 6,69-7,06 (3H, м).
МС (м/з) 452 (М+)Пример 270 Синтез тригидрохлорида N-(2-диметиламино-5-(S-этилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 269, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 67%). 1H-ЯМР (D2O),  : 1,43 (3H, т, J=7,3 Гц), 3,27 (2H, к, J=7,3 Гц), 3,33 (6H, с), 4,48 (2H, с), 7,66 (1H, д, J=2,3 Гц), 7,72 (1H, дд, J=8,6, 2,3 Гц), 7,97 (1H, д, J=8,6 Гц).
МС (м/з) 252 (М+) : 1,43 (3H, т, J=7,3 Гц), 3,27 (2H, к, J=7,3 Гц), 3,33 (6H, с), 4,48 (2H, с), 7,66 (1H, д, J=2,3 Гц), 7,72 (1H, дд, J=8,6, 2,3 Гц), 7,97 (1H, д, J=8,6 Гц).
МС (м/з) 252 (М+)Пример 271 Синтез т-бутилового эфира N-(2-метокси-5-(N’-нитро гуанидино)фенилметил)карбаминовой кислоты Смесь соединения (130 мг), полученного в Примере 119, триэтиламина (0,09 мл), S-метил-N-нитроизомочевины (84 мг), ацетонитрила (3 мл) и метанола (1 мл) кипятят с обратным холодильником в течение 20 ч. Реакционную смесь дистиллируют при пониженном давлении и полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – хлороформ:этилацетат=1:1), получая 57,2 мг названного соединения (выход 33%). 1H-ЯМР(CDCl3),  : 1,43 (9H, с), 3,87 (3H, с), 4,28 (2H, д, J=5,9 Гц), 5,20 (1H, шс), 6,91 (1H, д, J=9,3 Гц), 7,19-7,28 (2H, м), 9,28 (1H, шс).
Пример 272 : 1,43 (9H, с), 3,87 (3H, с), 4,28 (2H, д, J=5,9 Гц), 5,20 (1H, шс), 6,91 (1H, д, J=9,3 Гц), 7,19-7,28 (2H, м), 9,28 (1H, шс).
Пример 272Синтез гидрохлорида N-(2-метокси-5-(N’-нитрогуанидино)фенилметил)амина Используя соединение, полученное в Примере 271, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 41 мг названного соединения (выход 90%). 1H-ЯМР(D2O),  : 3,95 (3H, с), 4,20 (2H, с). 7,18 (1H, д, J=8,9 Гц), 7,34 (1H, д, J=2,6 Гц), 7,41 (1H, дд, J=8,9, 2,6 Гц).
Пример 273 : 3,95 (3H, с), 4,20 (2H, с). 7,18 (1H, д, J=8,9 Гц), 7,34 (1H, д, J=2,6 Гц), 7,41 (1H, дд, J=8,9, 2,6 Гц).
Пример 273Синтез т-бутилового эфира N-(5-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-метоксифенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 119, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают названное соединение (выход 61%). 1H-ЯМР(CDCl3),  : 1,00-1,20 (3H, м), 1,44 (9H, с), 1,53 (9H, с), 3,30-3,50 (2H, м), 3,85 (3H, с), 4,28 (2H, шс), 5,00 (1H, шс), 6,80-7,20 (3H, м).
Пример 274 : 1,00-1,20 (3H, м), 1,44 (9H, с), 1,53 (9H, с), 3,30-3,50 (2H, м), 3,85 (3H, с), 4,28 (2H, шс), 5,00 (1H, шс), 6,80-7,20 (3H, м).
Пример 274Синтез дигидрохлорида N-(5-(N’-этилгуанидино)-2-метоксифенилметил) амина Используя соединение, полученное в Примере 273, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 95%). 1H-ЯМР (D2O),  : 1,21 (3H, т, J=7,3 Гц), 3,29 (3H, к, J=7,3 Гц), 3,93 (3H, с), 4,17 (2H, с), 7,16 (1H, д, J=8,9 Гц), 7,28 (1H, д, J=2,6 Гц), 7,38 (1H, дд, J=8,9, 2,6 Гц).
МС (м/з) 222 (М+) : 1,21 (3H, т, J=7,3 Гц), 3,29 (3H, к, J=7,3 Гц), 3,93 (3H, с), 4,17 (2H, с), 7,16 (1H, д, J=8,9 Гц), 7,28 (1H, д, J=2,6 Гц), 7,38 (1H, дд, J=8,9, 2,6 Гц).
МС (м/з) 222 (М+)Пример 275 Синтез т-бутилового эфира N-(2-метокси-5-(N’-метил гуанидино)фенилметил)карбаминовой кислоты Соединение, полученное в Примере 121, растворяют в этилацетате и раствор промывают насыщенным водным раствором бикарбоната натрия, сушат безводным сульфатом магния и концентрируют при пониженном давлении. Смесь полученного остатка (150 мг), гидрохлорида метиламина (33 мг), триэтиламина (0,13 мл) и диметилформамида (6 мл) перемешивают при 80oC в течение 5 ч. Реакционную смесь концентрируют при пониженном давлении и полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – хлороформ:метанол= 6:1), получая 106,1 мг названного соединения (выход 78%). 1H-ЯМР(CDCl3),  : 1,40 (9H, с), 2,96 (3H, д, J=3,9 Гц), 3,83 (3H, с), 4,20 (2H, д, J= 5,9 Гц), 5,50 (1H, шс), 6,85 (1H, д, J=9,3 Гц), 7,00-7,20 (2H, м), 9,54 (1H, шс).
МС (м/з) 308 (М+) : 1,40 (9H, с), 2,96 (3H, д, J=3,9 Гц), 3,83 (3H, с), 4,20 (2H, д, J= 5,9 Гц), 5,50 (1H, шс), 6,85 (1H, д, J=9,3 Гц), 7,00-7,20 (2H, м), 9,54 (1H, шс).
МС (м/з) 308 (М+)Пример 276 Синтез дигидрохлорида N-(2-метокси-5-(N’-метилгуанидино)фенилметил)амина Используя соединение, полученное в Примере 275, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 55%). 1H-ЯМР(D2O), 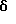 : 2,88 (3H, с), 3,93 (3H, с), 4,17 (2H, с), 7,16 (1H, д, J=8,9 Гц), 7,28 (1H, д, J=2,6 Гц), 7,38 (1H, дд, J=8,9, 2,6 Гц).
МС (м/з) 208 (М+).
Пример 277 : 2,88 (3H, с), 3,93 (3H, с), 4,17 (2H, с), 7,16 (1H, д, J=8,9 Гц), 7,28 (1H, д, J=2,6 Гц), 7,38 (1H, дд, J=8,9, 2,6 Гц).
МС (м/з) 208 (М+).
Пример 277Синтез N-(3-(т-бутоксикарбониламинометил)-4-метоксифенил)амидиносульфокислоты К смеси соединения (327 мг), полученного в Примере 120, дигидрата молибдата натрия (25 мг), метанола (10 мл) и воды (1 мл) добавляют по каплям при 0oC водный пероксид водорода (0,3 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1,5 ч, и метанол отгоняют при пониженном давлении. Полученную суспензию собирают фильтрацией, промывают водой и сушат при пониженном давлении, получая 335 мг названного соединения (выход 93%). 1Н-ЯМР (ДМСО-d6),  : 1,40 (9H, с), 3,83 (3H, с), 4,12 (2H, д, J=5,9 Гц), 7,03-7,19 (3H, м), 8,98 (1H, шс), 9,50 (1H, шс), 11,30 (1H, шс).
Пример 278 : 1,40 (9H, с), 3,83 (3H, с), 4,12 (2H, д, J=5,9 Гц), 7,03-7,19 (3H, м), 8,98 (1H, шс), 9,50 (1H, шс), 11,30 (1H, шс).
Пример 278Синтез т-бутилового эфира N-(2-метокси-5-(N’-н-пропил гуанидино)фенилметил)карбаминовой кислоты К суспензии соединения (160 мг), полученного в Примере 277, в ацетонитриле (5 мл), по каплям добавляют н-пропиламин (0,05 мл) и перемешивают при комнатной температуре в течение 1,5 ч. Реакционную смесь концентрируют при пониженном давлении и к полученному остатку добавляют 2N водный раствор гидроксида натрия и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой и насыщенным водным раствором хлорида натрия, сушат безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на основном силикагеле (элюент – н-гексан: этилацетат=1:2), получая 160 мг названного соединения, количественно. 1H-ЯМР (CDCl3),  : 0,93 (3H, т, J=7,3 Гц), 1,42 (9H, с), 1,49-1,59 (2H, м), 3,15 (2H, т, J= 7,3 Гц), 3,80 (3H, с), 4,22 (2H, шс), 4,92 (1H, шс), 6,75-6,86 (3H, м).
МС (м/з) 336 (М+) : 0,93 (3H, т, J=7,3 Гц), 1,42 (9H, с), 1,49-1,59 (2H, м), 3,15 (2H, т, J= 7,3 Гц), 3,80 (3H, с), 4,22 (2H, шс), 4,92 (1H, шс), 6,75-6,86 (3H, м).
МС (м/з) 336 (М+)Пример 279 Синтез дигидрохлорида N-(2-метокси-5-(N’-н-пропил гуанидино)фенилметил)амина Используя соединение, полученное в Примере 278, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 71%). 1H-ЯМР (D2O),  : 0,93 (3H, т, J=7,3 Гц), 1,55-1,68 (2H, м), 3,22 (2H, т, J=7,3 Гц), 3,93 (3H, с), 4,17 (2H, с), 7,16 (1H, д, J=8,6 Гц), 7,28 (1H, д, J=2,6 Гц), 7,38 (1H, дд, J=8,6, 2,6 Гц).
МС (м/з) 236 (М+) : 0,93 (3H, т, J=7,3 Гц), 1,55-1,68 (2H, м), 3,22 (2H, т, J=7,3 Гц), 3,93 (3H, с), 4,17 (2H, с), 7,16 (1H, д, J=8,6 Гц), 7,28 (1H, д, J=2,6 Гц), 7,38 (1H, дд, J=8,6, 2,6 Гц).
МС (м/з) 236 (М+)Пример 280 Синтез ди-т-бутилового эфира N-(2-диметиламино-5-(N’-нитрогуанидино)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 265, в качестве исходного вещества, по методике, аналогичной Примеру 6, получают названное соединение (выход 52%). 1H-ЯМР(CDCl3),  : 1,43 (18H, с), 2,71 (6H, с), 4,86 (2H, с), 7,02-7,16 (3H, м), 9,82 (1H, шс).
Пример 281 : 1,43 (18H, с), 2,71 (6H, с), 4,86 (2H, с), 7,02-7,16 (3H, м), 9,82 (1H, шс).
Пример 281Синтез дигидрохлорида N-(2-диметиламино-5-(N’-нитро гуанидино)фенилметил)амина Используя соединение, полученное в Примере 280, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 83%). 1H-ЯМР (D2O),  : 3,13 (6H, с), 4,38 (2H, с), 7,51-7,55 (2H, м), 7,73 (1H, дд, J=7,9, 1,3 Гц).
Пример 282 : 3,13 (6H, с), 4,38 (2H, с), 7,51-7,55 (2H, м), 7,73 (1H, дд, J=7,9, 1,3 Гц).
Пример 282Синтез ди-т-бутилового эфира N-(2-(N-этил-N-метиламино)-5- нитрофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 263, в качестве исходного вещества и также используя этилметиламин в качестве реагента, по методике, аналогичной Примеру 264, получают названное соединение (выход 42%). 1H-ЯМР (CDCl3),  : 1,18 (3H, т, J=7,2 Гц), 1,45 (18H, с), 2,81 (3H, с), 3,05 (2H, к, J=7,2 Гц), 4,82 (2H, с), 7,06 (1H, д, J=8,2 Гц), 8,04-8,15 (2H, м).
Пример 283 : 1,18 (3H, т, J=7,2 Гц), 1,45 (18H, с), 2,81 (3H, с), 3,05 (2H, к, J=7,2 Гц), 4,82 (2H, с), 7,06 (1H, д, J=8,2 Гц), 8,04-8,15 (2H, м).
Пример 283Синтез ди-т-бутилового эфира N-(5-амино-2-(N-этил-N-метиламино)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 282, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают названное соединение (выход 58%). 1H-ЯМР (CDCl3),  : 1,04 (3H, т, J=7,0 Гц), 1,42 (18H, с), 2,56 (3H, с), 2,79 (2H, к, J=7,0 Гц), 3,55 (2H, шс), 4,84 (2H, с), 6,43-6,56 (3H, м).
МС (м/з) 379 (М+) : 1,04 (3H, т, J=7,0 Гц), 1,42 (18H, с), 2,56 (3H, с), 2,79 (2H, к, J=7,0 Гц), 3,55 (2H, шс), 4,84 (2H, с), 6,43-6,56 (3H, м).
МС (м/з) 379 (М+)Пример 284 Синтез ди-т-бутилового эфира N-(5-(N’-т-бутоксикарбонил- N”-этилгуанидино)-2-(N-этил-N-метиламино)фенилметил) иминодикарбоновой кислоты Используя соединение, полученное в Примере 283, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают названное соединение (выход 77%). 1H-ЯМР(CDCl3),  : 1,09 (3H, т, J=7,2 Гц), 1,29-2,66 (21H, м), 2,65 (3H, с), 2,86 (2H, к, J=7,2 Гц), 3,30-3,50 (2H, м), 4,84 (2H, с), 6,80-7,11 (3H, м).
МС (м/з) 549 (М+) : 1,09 (3H, т, J=7,2 Гц), 1,29-2,66 (21H, м), 2,65 (3H, с), 2,86 (2H, к, J=7,2 Гц), 3,30-3,50 (2H, м), 4,84 (2H, с), 6,80-7,11 (3H, м).
МС (м/з) 549 (М+)Пример 285 Синтез тригидрохлорида N-(5-(N’-этилгуанидино)-2-(N-этил-N-метиламино)фенилметил)амина Используя соединение, полученное в Примере 284, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 83%). 1H-ЯМР (D2O),  : 1,15-1,26 (6H, м), 3,21 (3H, с), 3,26-3,38 (2H, м), 3,54-3,65 (2H, м), 4,39 (2H, с), 7,35-7,57 (2H, м), 7,75 (1H, д, J=8,6 Гц).
Пример 286 : 1,15-1,26 (6H, м), 3,21 (3H, с), 3,26-3,38 (2H, м), 3,54-3,65 (2H, м), 4,39 (2H, с), 7,35-7,57 (2H, м), 7,75 (1H, д, J=8,6 Гц).
Пример 286Синтез ди-т-бутилового эфира N-(2-(N-этил-N-метиламино)-5-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 283, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают названное соединение (выход 77%). 1H-ЯМР(CDCl3),  : 1,14 (3H, т, J=7,1 Гц), 1,45 (18H, с), 2,66 (3H, с), 2,89 (2H, к, J=7,1 Гц), 4,83 (2H, с), 6,15 (2H, шс), 6,94-7,14 (3H, м), 8,00 (1H, шс).
МС (м/з) 439 (М++1).
Пример 287 : 1,14 (3H, т, J=7,1 Гц), 1,45 (18H, с), 2,66 (3H, с), 2,89 (2H, к, J=7,1 Гц), 4,83 (2H, с), 6,15 (2H, шс), 6,94-7,14 (3H, м), 8,00 (1H, шс).
МС (м/з) 439 (М++1).
Пример 287Синтез ди-т-бутилового эфира N-(5-(S-этилизотиоуреидо)-2-(N- этил-N-метиламино)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 286, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают названное соединение (выход 66%). 1H-ЯМР (CDCl3),  : 1,04 (3H, т, J=7,2 Гц), 1,31-1,45 (21H, м), 2,61 (3H, с), 2,83 (2H, к, J=7,2 Гц), 3,00-3,20 (2H, м), 4,47 (1H, шс), 4,86 (2H, с), 6,60-6,85 (2H, м), 7,05 (1H, д, J=8,2 Гц).
МС (м/з) 466 (М+) : 1,04 (3H, т, J=7,2 Гц), 1,31-1,45 (21H, м), 2,61 (3H, с), 2,83 (2H, к, J=7,2 Гц), 3,00-3,20 (2H, м), 4,47 (1H, шс), 4,86 (2H, с), 6,60-6,85 (2H, м), 7,05 (1H, д, J=8,2 Гц).
МС (м/з) 466 (М+)Пример 288 Синтез тригидрохлорида N-(5-(3-этилизотиоуреидо)-2-(N-этил-N-метиламино)фенилметил)амина Используя соединение, полученное в Примере 287, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 95%). 1H-ЯМР (D2O),  : 1,24 (3H, т, J=7,3 Гц), 1,43 (3H, т, J=7,3 Гц), 3,27 (2H, к, J=7,3 Гц), 3,37 (3H, с), 3,72 (2H, к, J=7,3 Гц), 4,51 (2H, с), 7,69 (1H, д, J=2,3 Гц), 7,74 (1H, дд, J=8,6, 2,3 Гц), 7,94 (1H, д, J=8,6 Гц).
МС (м/з) 266 (М+) : 1,24 (3H, т, J=7,3 Гц), 1,43 (3H, т, J=7,3 Гц), 3,27 (2H, к, J=7,3 Гц), 3,37 (3H, с), 3,72 (2H, к, J=7,3 Гц), 4,51 (2H, с), 7,69 (1H, д, J=2,3 Гц), 7,74 (1H, дд, J=8,6, 2,3 Гц), 7,94 (1H, д, J=8,6 Гц).
МС (м/з) 266 (М+)Пример 289 Синтез т-бутилового эфира N-(2-(4-(N’-т-бутоксикарбонил-S-метилизотиоуреидо)фенил)этил)карбаминовой кислоты К смеси соединения (280 мг), полученного в Примере 51, бикарбоната натрия (87 мг) и метиленхлорида (5 мл), добавляют ди-т-бутилдикарбонат (227 мг) и перемешивают при комнатной температуре в течение 15 ч; после этого добавляют метиленхлорид и воду. Органический слой сушат безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=3:1), получая 303 мг названного соединения (выход 81%). 1H-ЯМР(CDCl3),  : 1,26-1,56 (18H, м), 2,40(3H, с), 2,77-2,80 (2H, м), 3,35-3,38 (2H, м), 4,69 (1H, шс), 7,20 (4H, с), 11,28 (1H, шс).
Пример 290 : 1,26-1,56 (18H, м), 2,40(3H, с), 2,77-2,80 (2H, м), 3,35-3,38 (2H, м), 4,69 (1H, шс), 7,20 (4H, с), 11,28 (1H, шс).
Пример 290Синтез т-бутилового эфира N-(2-(4-(N’-т-бутоксикарбонил-N”-метоксигуанидино)фенил)этил)карбаминовой кислоты К смеси соединения (190 мг), полученного в Примере 289, триэтиламина (0,14 мл), гидрохлорида О-метилгидроксиламина (84 мг) и ацетонитрила (5 мл), добавляют раствор нитрата серебра (90 мг) в ацетонитриле (2 мл) и перемешивают при 0oC в течение 15 мин. Реакционную смесь фильтруют через Целит и фильтрат концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – хлороформ:этилацетат=3:1), получая 75 мг названного соединения (выход 38%). 1H-ЯМР(CDCl3),  : 1,43 (9H, с), 1,51 (9H, с), 2,72 (2H, т, J=6,9 Гц), 3,32-3,35 (2H, м), 3,80 (3H, с), 4,53 (1H, шс), 7,08 (2H, д, J=8,5 Гц), 7,40 (2H, д, J=8,5 Гц), 7,85 (1H, шс), 8,88 (1H, шс).
МС (м/з) 408 (М+) : 1,43 (9H, с), 1,51 (9H, с), 2,72 (2H, т, J=6,9 Гц), 3,32-3,35 (2H, м), 3,80 (3H, с), 4,53 (1H, шс), 7,08 (2H, д, J=8,5 Гц), 7,40 (2H, д, J=8,5 Гц), 7,85 (1H, шс), 8,88 (1H, шс).
МС (м/з) 408 (М+)Пример 291 Синтез дигидрохлорида N-(2-(4-(N’-метоксигуанидино)фенил)этил)амина Используя соединение, полученное в Примере 290, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 3,04 (2H, т, J=7,2 Гц), 3,29 (2H, т, J=7,2 Гц), 3,81 (3H, с), 7,30 (2H, д, J=8,6 Гц), 7,42 (2H, д, J=8,6 Гц).
МС (м/з) 208 (М+) : 3,04 (2H, т, J=7,2 Гц), 3,29 (2H, т, J=7,2 Гц), 3,81 (3H, с), 7,30 (2H, д, J=8,6 Гц), 7,42 (2H, д, J=8,6 Гц).
МС (м/з) 208 (М+)Пример 292 Синтез (2,6-диметокси-3-нитрофенил)метанола Используя 2,6-диметокси-3-нитробензойную кислоту в качестве исходного вещества, по методике, аналогичной Примеру 132, получают названное соединение (выход 39%). 1H-ЯМР (CDCl3),  : 3,98 (6H, с), 4,79 (2H, с), 6,75 (1H, д, J=9,2 Гц), 7,99 (1H, д, J=9,2 Гц).
Пример 293 : 3,98 (6H, с), 4,79 (2H, с), 6,75 (1H, д, J=9,2 Гц), 7,99 (1H, д, J=9,2 Гц).
Пример 293Синтез 2,6-диметокси-3-нитробензил бромида Используя соединение, полученное в Примере 292, в качестве исходного вещества, по методике, аналогичной Примеру 55, получают названное соединение (выход 98%). 1H-ЯМР (CDCl3),  : 4,00 (3H, с), 4,02 (3H, с), 4,62 (2H, с), 6,74 (1H, д, J=9,2 Гц), 8,02 (1H, д, J=9,2 Гц).
МС (м/з) 276 (М+) : 4,00 (3H, с), 4,02 (3H, с), 4,62 (2H, с), 6,74 (1H, д, J=9,2 Гц), 8,02 (1H, д, J=9,2 Гц).
МС (м/з) 276 (М+)Пример 294 Синтез ди-т-бутилового эфира N-(2,6-диметокси-3-нитрофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 293, а качестве исходного вещества, по методике, аналогичной Примеру 127, получают названное соединение (выход 71%). 1H-ЯМР(CDCl3),  : 1,44-1,48 (18H, м), 3,86 (3H, с), 3,88 (3H, с), 4,94 (2H, с), 6,68 (1H, д, J=9,2 Гц), 7,93 (1H, д, J=9,2 Гц).
Пример 295 : 1,44-1,48 (18H, м), 3,86 (3H, с), 3,88 (3H, с), 4,94 (2H, с), 6,68 (1H, д, J=9,2 Гц), 7,93 (1H, д, J=9,2 Гц).
Пример 295Синтез ди-т-бутилового эфира N-(3-амино-2,6-диметоксифенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 294, а качестве исходного вещества, по методике, аналогичной Примеру 2, получают названное соединение (выход 45%). 1H-ЯМР (CDCl3),  : 1,42 (18H, с), 3,50 (2H, шс), 3,70 (6H, с), 4,91 (2H, с), 6,56 (1H, д, J=8,3 Гц), 6,63 (1H, д, J=8,3 Гц).
МС (м/з) 382 (М+) : 1,42 (18H, с), 3,50 (2H, шс), 3,70 (6H, с), 4,91 (2H, с), 6,56 (1H, д, J=8,3 Гц), 6,63 (1H, д, J=8,3 Гц).
МС (м/з) 382 (М+)Пример 296 Синтез ди-т-бутилового эфира N-(2,6-диметокси-3-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 295, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают названное соединение (выход 46%). 1H-ЯМР (CDCl3),  : 1,44 (18H, с), 3,79 (3H, с), 3,81 (3H, с), 4,89 (2H, с), 6,11 (2H, шс), 6,66 (1H, д, J=8,9 Гц), 7,12 (1H, д, J=8,9 Гц), 7,63 (1H, шс).
МС (м/з) 441 (М+) : 1,44 (18H, с), 3,79 (3H, с), 3,81 (3H, с), 4,89 (2H, с), 6,11 (2H, шс), 6,66 (1H, д, J=8,9 Гц), 7,12 (1H, д, J=8,9 Гц), 7,63 (1H, шс).
МС (м/з) 441 (М+)Пример 297 Синтез ди-т-бутилового эфира N-(2,6-диметокси-3-(S-этилизотиоуреидо)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 296, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают названное соединение (выход 71%). 1H-ЯМР (CDCl3),  : 1,35-1,51 (21H, м), 3,00-3,12 (2H, м), 3,70 (3H, с), 3,76 (3H, с), 4,58 (1H, шс), 4,91 (2H, с), 6,58 (1H, д, J=8,9 Гц), 6,75-6,78 (1H, м).
МС (м/з) 469 (М+) : 1,35-1,51 (21H, м), 3,00-3,12 (2H, м), 3,70 (3H, с), 3,76 (3H, с), 4,58 (1H, шс), 4,91 (2H, с), 6,58 (1H, д, J=8,9 Гц), 6,75-6,78 (1H, м).
МС (м/з) 469 (М+)Пример 298 Синтез дигидрохлорида N-(2,6-диметокси-3-(S-этилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 297, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 1,43 (3H, т, J=7,3 Гц), 3,34 (2H, к, J=7,3 Гц), 3,63 (3H, с), 3,66 (3H, с), 4,28 (2H, с), 7,01 (1H, д, J=8,9 Гц), 7,42 (1H, д, J= 8,9 Гц).
МС (м/з) 269 (М+) : 1,43 (3H, т, J=7,3 Гц), 3,34 (2H, к, J=7,3 Гц), 3,63 (3H, с), 3,66 (3H, с), 4,28 (2H, с), 7,01 (1H, д, J=8,9 Гц), 7,42 (1H, д, J= 8,9 Гц).
МС (м/з) 269 (М+)Пример 299 Синтез т-бутилового эфира N-(1-(3-(N’-т-бутоксикарбонил-N”-этилгуанидино)фенил)-1-метилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 2, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают названное соединение (выход 81%). 1H-ЯМР (CDCl3),  : 1,11-1,60 (27H, м), 3,30-3,40 (2H, м), 5,00 (2H, с), 7,00-7,34 (4H, м).
МС (м/з) 420 (М+) : 1,11-1,60 (27H, м), 3,30-3,40 (2H, м), 5,00 (2H, с), 7,00-7,34 (4H, м).
МС (м/з) 420 (М+)Пример 300 Синтез дигидрохлорида N-(1-(3-(N’-этилгуанидино)енил)-1-метилэтил)амина Используя соединение, полученное в Примере 299, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1Н-ЯМР (D2O),  : 1,24 (3H, т, J=7,3 Гц), 1,77 (6H, с), 3,33 (2H, к, J= 7,3 Гц), 7,36-7,68 (4H, м).
МС (м/з) 220 (М+) : 1,24 (3H, т, J=7,3 Гц), 1,77 (6H, с), 3,33 (2H, к, J= 7,3 Гц), 7,36-7,68 (4H, м).
МС (м/з) 220 (М+)Пример 301 Синтез N-(3-(ди-(т-бутоксикарбонил)аминометил)фенил)-амидиносульфокислоты Используя ди-т-бутиловый эфир N-(3-тиоуреидофенилметил)иминодикарбоновой кислоты в качестве исходного вещества, по методике, аналогичной Примеру 277, получают названное соединение (выход 98%). 1H-ЯМР (ДМСО-d6),  : 1,42 (18H, с), 4,71 (2H, с), 7,15-7,24 (3H, м), 7,43-7,49 (1H, м), 9,61 (1H, шс), 11,50 (1H, шс).
Пример 302 : 1,42 (18H, с), 4,71 (2H, с), 7,15-7,24 (3H, м), 7,43-7,49 (1H, м), 9,61 (1H, шс), 11,50 (1H, шс).
Пример 302Синтез ди-т-бутилового эфира N-(3-(N’,N’-диметилгуанидино)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 301, в качестве исходного вещества и также используя гидрохлорид диметиламина и триэтиламин в качестве реагентов, по методике, аналогичной Примеру 278, получают названное соединение (выход 50%). 1H-ЯМР (CDCl3),  : 1,45 (18H, с), 2,98 (6H, с), 4,73 (2H, с), 6,75-6,87 (3H, м), 7,16-7,19 (1H, м).
МС (м/з) 392 (М+) : 1,45 (18H, с), 2,98 (6H, с), 4,73 (2H, с), 6,75-6,87 (3H, м), 7,16-7,19 (1H, м).
МС (м/з) 392 (М+)Пример 303 Синтез дигидрохлорида N-(3-(N’,N’-диметилгуанидино)фенилметил)амина Используя соединение, полученное в Примере 302, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 96%). 1H-ЯМР (D2O),  : 3,14 (6H, с), 4,19 (2H, с), 7,31-7,57 (4H, м).
МС (м/з) 192 (М+) : 3,14 (6H, с), 4,19 (2H, с), 7,31-7,57 (4H, м).
МС (м/з) 192 (М+)Пример 304 Синтез ди-т-бутилового эфира N-(3-(N’-этил-N’-метилгуанидино)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 301, в качестве исходного вещества и также используя этилметиламин в качестве реагента, по методике, аналогичной Примеру 278, получают названное соединение (выход 27%). 1H-ЯМР (CDCl3),  : 1,17 (3H, т, J=7,3 Гц), 1,45 (18H, с), 2,95 (3H, с), 3,38 (2H, к, J=7,3 Гц), 4,73 (2H, с), 6,75-7,19 (4H, м).
МС (м/з) 406 (М+) : 1,17 (3H, т, J=7,3 Гц), 1,45 (18H, с), 2,95 (3H, с), 3,38 (2H, к, J=7,3 Гц), 4,73 (2H, с), 6,75-7,19 (4H, м).
МС (м/з) 406 (М+)Пример 305 Синтез дигидрохлорида N-(3-(N’-этил-N’-метилгуанидино) фенилметил)амина Используя соединение, полученное в Примере 304, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 1,28 (3H, т, J=7,3 Гц), 3,12 (3H, с), 3,53(2H, к, J= 7,3 Гц), 4,23(2H, с), 7,30-7,70(4H, м).
МС (м/з) 206 (М+) : 1,28 (3H, т, J=7,3 Гц), 3,12 (3H, с), 3,53(2H, к, J= 7,3 Гц), 4,23(2H, с), 7,30-7,70(4H, м).
МС (м/з) 206 (М+)Пример 306 Синтез ди-т-бутилового эфира N-(3-(N’-(2-пропинил)гуанидино)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 301, в качестве исходного вещества и также используя пропаргиламин в качестве реагента, по методике, аналогичной Примеру 278, получают названное соединение (выход 55%). 1H-ЯМР (CDCl3),  : 1,45 (18H, с), 2,26 (1H, с), 4,04 (2H, с), 4,73 (2H, с), 6,78-6,90 (3H, м), 7,21 (1H, дд, J=7,6 Гц).
МС (м/з) 402 (М+) : 1,45 (18H, с), 2,26 (1H, с), 4,04 (2H, с), 4,73 (2H, с), 6,78-6,90 (3H, м), 7,21 (1H, дд, J=7,6 Гц).
МС (м/з) 402 (М+)Пример 307 Синтез дигидрохлорида N-(3-(N’-(2-пропинил)гуанидино) фенилметил)амина Используя соединение, полученное в Примере 306, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 2,81 (1H, т, J=2,6 Гц), 4,15 (2H, д, J=2,6 Гц), 4,24 (2H, с), 7,28-7,41 (2H, м), 7,47 (1H, д, J=7,9 Гц), 7,58 (1H, дд, J=7,9, 7,9 Гц).
МС (м/з) 202 (М+) : 2,81 (1H, т, J=2,6 Гц), 4,15 (2H, д, J=2,6 Гц), 4,24 (2H, с), 7,28-7,41 (2H, м), 7,47 (1H, д, J=7,9 Гц), 7,58 (1H, дд, J=7,9, 7,9 Гц).
МС (м/з) 202 (М+)Пример 308 Синтез N-(2-нитрофенилэтил)фталимида Используя 2-нитрофенилэтиловый спирт в качестве исходного вещества, по методике, аналогичной Примеру 179, получают названное соединение (выход 97%). 1H-ЯМР (CDCl3),  : 3,31 (2H, т, J=6,9 Гц), 4,10 (2H, т, J=6,9 Гц), 7,28-7,50 (3H, м), 7,68-7,74 (2H, м), 7,77-7,84 (2H, м), 7,96-8,20 (1H, м).
Пример 309 : 3,31 (2H, т, J=6,9 Гц), 4,10 (2H, т, J=6,9 Гц), 7,28-7,50 (3H, м), 7,68-7,74 (2H, м), 7,77-7,84 (2H, м), 7,96-8,20 (1H, м).
Пример 309Синтез т-бутилового эфира N-(2-нитрофенил)карбаминовой кислоты Используя соединение (2,18 г), полученное в Примере 308, как исходное вещество, по методике, аналогичной Примеру 180, получают 2-нитрофенилэтиламин. Двухслойную смесь, содержащую полученное аминовое соединение, ди-т-бутилдикарбонат (1,77 г), метиленхлорид (120 мл) и 2 N водный раствор гидроксида натрия (30 мл), перемешивают при комнатной температуре в течение 14 ч. Органический слой сушат безводным сульфатом натрия и перегоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=3:1), получая 1,95 г названного соединения (выход 99%). 1H-ЯМР (CDCl3),  : 1,42 (9H, с), 3,09 (2H, т, J=6,6 Гц), 3,46 (2H, дт, J= 6,6, 6,6 Гц), 4,79 (1H, шс), 7,34-7,43 (2H, м), 7,50-7,59 (1H, м), 7,91-7,97 (1H, м).
МС (м/з) 266 (М+) : 1,42 (9H, с), 3,09 (2H, т, J=6,6 Гц), 3,46 (2H, дт, J= 6,6, 6,6 Гц), 4,79 (1H, шс), 7,34-7,43 (2H, м), 7,50-7,59 (1H, м), 7,91-7,97 (1H, м).
МС (м/з) 266 (М+)Пример 310 Синтез т-бутилового эфира N-(2-аминофенилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 309, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 94%). 1H-ЯМР (CDCl3),  : 1,45 (9H, с), 2,70 (2H, т, J=6,9 Гц), 3,28 (2H, дт, J= 6,9 Гц), 3,93 (2H, шс), 4,87 (1H, шс), 6,64-6,74 (2H, м), 6,96-7,09 (2H, м).
МС (м/з) 236 (М+) : 1,45 (9H, с), 2,70 (2H, т, J=6,9 Гц), 3,28 (2H, дт, J= 6,9 Гц), 3,93 (2H, шс), 4,87 (1H, шс), 6,64-6,74 (2H, м), 6,96-7,09 (2H, м).
МС (м/з) 236 (М+)Пример 311 Синтез т-бутилового эфира N-(2-тиоуреидофенилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 310, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 98%). 1H-ЯМР (CDCl3),  : 1,35 (9H, с), 2,80 (2H, т, J=6,9 Гц), 3,32 (2H, дт, J=6,9, 6,9 Гц), 4,80 (1H, шс), 6,28 (2H, шс), 7,20-7,28 (4H, м).
МС (м/з) 295 (М+) : 1,35 (9H, с), 2,80 (2H, т, J=6,9 Гц), 3,32 (2H, дт, J=6,9, 6,9 Гц), 4,80 (1H, шс), 6,28 (2H, шс), 7,20-7,28 (4H, м).
МС (м/з) 295 (М+)Пример 312 Синтез т-бутилового эфира N-(2-S-этилизотиоуреидо)фенилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 311, как исходное вещество, по методике, аналогичной Примеру 95, получают названное соединение (выход 81%). 1H-ЯМР (CDCl3),  : 1,33-1,40 (3H, м), 1,39 (9H, с), 2,69 (2H, т, J=6,3 Гц), 3,00-3,20 (2H, м), 3,32 (2H, дт, J=6,3, 6,3 Гц), 4,56 (2H, шс), 5,27 (1H, шс), 6,80-6,88(1H, м), 6,95-7,05(1H, м), 7,12-7,24(2H, м).
МС (м/з) 323(М+) : 1,33-1,40 (3H, м), 1,39 (9H, с), 2,69 (2H, т, J=6,3 Гц), 3,00-3,20 (2H, м), 3,32 (2H, дт, J=6,3, 6,3 Гц), 4,56 (2H, шс), 5,27 (1H, шс), 6,80-6,88(1H, м), 6,95-7,05(1H, м), 7,12-7,24(2H, м).
МС (м/з) 323(М+)Пример 313 Синтез дигидрохлорида N-(2-S-этилизотиоуреидо)фенилэтил)амина Используя соединение, полученное в Примере 312, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 81%). 1H-ЯМР (D2O),  : 1,35-1,50 (3H, м), 2,99 (2H, т, J=7,3 Гц), 3,20-3,33 (4H, м), 7,36-7,42 (1H, м), 7,44-7,60 (3H, м).
Пример 314 : 1,35-1,50 (3H, м), 2,99 (2H, т, J=7,3 Гц), 3,20-3,33 (4H, м), 7,36-7,42 (1H, м), 7,44-7,60 (3H, м).
Пример 314Синтез ди-т-бутилового эфира N-(5-амино-2-фторофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 263, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 87%). 1H-ЯМР (CDCl3),  : 1,45(18H, с), 3,50 (2H, шс), 4,78 (2H, с), 6,47-6,54 (2H, м), 6,77-6,85 (1H, м).
Пример 315 : 1,45(18H, с), 3,50 (2H, шс), 4,78 (2H, с), 6,47-6,54 (2H, м), 6,77-6,85 (1H, м).
Пример 315Синтез ди-т-бутилового эфира N-(2-фторо-5-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 314, как исходное вещество, по методике, аналогичной Примеру 120, получают названное соединение (выход 99%). 1H-ЯМР (CDCl3),  : 1,48(18H, с), 4,84 (2H, с), 6,11 (2H, шс), 7,09-7,14 (3H, м), 8,06 (1H, шс).
Пример 316 : 1,48(18H, с), 4,84 (2H, с), 6,11 (2H, шс), 7,09-7,14 (3H, м), 8,06 (1H, шс).
Пример 316Синтез т-бутилового эфира N-(5-(S-этилизотиоуреидо)-2-фторфенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 315, как исходное вещество, по методике, аналогичной Примеру 95, получают названное соединение (выход 53%). 1H-ЯМР (CDCl3),  : 1,33-1,39 (3H, м), 1,45 (9H, с), 3,00-3,17 (2H, м), 4,32 (2H, д, J=5,6 Гц), 4,49 (1H, шс), 4,85 (1H, шс), 6,71-7,01 (4H, м).
МС (м/з) 327 (М+) : 1,33-1,39 (3H, м), 1,45 (9H, с), 3,00-3,17 (2H, м), 4,32 (2H, д, J=5,6 Гц), 4,49 (1H, шс), 4,85 (1H, шс), 6,71-7,01 (4H, м).
МС (м/з) 327 (М+)Пример 317 Синтез дигидрохлорида N-(5-(S-этилизотиоуреидо)-2-фторофенилметил)амина Используя соединение, полученное в Примере 316, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 83%). 1H-ЯМР (D2O),  : 1,41 (3H, т, J=7,3 Гц), 3,20-3,28 (2H, м), 4,29 (2H, с), 7,39-7,53 (3H, м).
МС (м/з) 227 (М+) : 1,41 (3H, т, J=7,3 Гц), 3,20-3,28 (2H, м), 4,29 (2H, с), 7,39-7,53 (3H, м).
МС (м/з) 227 (М+)Пример 318 Синтез N-(2-гидрокси-5-нитрофенилметил)фталимида К раствору соединения, полученного в Примере 117, в безводном метиленхлориде (30 мл), добавляют по каплям раствор трибромида бора в метиленхлориде (1,0 М, 9 мл) при -78oC в атмосфере азота и смесь перемешивают при -78oC в течение 1 ч, затем перемешивают при комнатной температуре в течение 21 ч. К реакционной смеси добавляют воду и это экстрагируют хлороформом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=1:1), получая 743 мг названного соединения (выход 83%). 1H-ЯМР (CDCl3),  : 4,84 (2H, с), 6,99 (1H, д, J=9,2 Гц), 7,85-7,92 (4H, м), 7,95 (1H, дд, J=9,2, 2,6 Гц), 8,06 (1H, дд, J=9,2, 2,6 Гц), 11,4 (1H, с).
МС (м/з) 298 (М+) : 4,84 (2H, с), 6,99 (1H, д, J=9,2 Гц), 7,85-7,92 (4H, м), 7,95 (1H, дд, J=9,2, 2,6 Гц), 8,06 (1H, дд, J=9,2, 2,6 Гц), 11,4 (1H, с).
МС (м/з) 298 (М+)Пример 319 Синтез N-(2-этокси-5-нитрофенилметил)фталимида К смеси гидрида натрия (содержание 60%, 36 мг) и безводного диметилформамида (5 мл), последовательно по каплям в атмосфере азота добавляют раствор соединения (224 мг), полученного в Примере 318, в безводном диметилформамиде (3 мл) и этилиодид (0,072 мл) и перемешивают при комнатной температуре в течение 24 ч. Добавляют воду к реакционной смеси, которую перегоняют при пониженном давлении; после этого к полученному остатку добавляют этилацетат и воду. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и дистиллируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=1:1), получая 213 мг названного соединения (выход 87%). 1H-ЯМР (CDCl3),  : 1,47 (3H, т, J=3,7 Гц), 4,17 (2H, к, J=7,3 Гц), 4,93 (2H, с), 6,90 (1H, д, J=9,2 Гц), 7,74-7,91 (4H, м), 8,05 (1H, д, J=2,6 Гц), 8,17 (1H, дд, J=9,2, 2,6 Гц).
МС (м/з) 326 (М+) : 1,47 (3H, т, J=3,7 Гц), 4,17 (2H, к, J=7,3 Гц), 4,93 (2H, с), 6,90 (1H, д, J=9,2 Гц), 7,74-7,91 (4H, м), 8,05 (1H, д, J=2,6 Гц), 8,17 (1H, дд, J=9,2, 2,6 Гц).
МС (м/з) 326 (М+)Пример 320 Синтез т-бутилового эфира N-(2-этокси-5-нитрофенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 319, как исходное вещество, по методике, аналогичной Примеру 309, получают названное соединение (выход 95%). 1H-ЯМР (CDCl3)  : 1,45 (9H, с), 1,49 (3H, т, J=7,3 Гц), 4,17 (2H, к, J= 7,3 Гц), 4,36 (2H, д, J=5,9 Гц), 4,98 (1H, шс), 6,86-6,91 (1H, м), 8,14-8,17 (2H, м).
Пример 321 : 1,45 (9H, с), 1,49 (3H, т, J=7,3 Гц), 4,17 (2H, к, J= 7,3 Гц), 4,36 (2H, д, J=5,9 Гц), 4,98 (1H, шс), 6,86-6,91 (1H, м), 8,14-8,17 (2H, м).
Пример 321Синтез т-бутилового эфира N-(5-амино-2-этоксифенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 320, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 75%). 1H-ЯМР (CDCl3),  : 1,38 (3H, т, J=6,9 Гц), 1,44 (9H, с), 3,41 (2H, шс), 3,97 (2H, к, J=6,9 Гц), 4,23 (2H, д, J=5,9 Гц), 5,00(1H, шс), 6,55 (1H, дд, J=8,6, 3,0 Гц), 6,66-6,69 (2H, м).
Пример 322 : 1,38 (3H, т, J=6,9 Гц), 1,44 (9H, с), 3,41 (2H, шс), 3,97 (2H, к, J=6,9 Гц), 4,23 (2H, д, J=5,9 Гц), 5,00(1H, шс), 6,55 (1H, дд, J=8,6, 3,0 Гц), 6,66-6,69 (2H, м).
Пример 322Синтез т-бутилового эфира N-(2-этокси-5-тиоуреидофенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 321, как исходное вещество, по методике, аналогичной Примеру 120, получают названное соединение, количественно. 1H-ЯМР (CDCl3),  : 1,44 (3H, т, J=7,3 Гц), 1,44 (9H, с), 4,07 (2H, к, J= 7,3 Гц), 4,28 (2H, д, J=6,3 Гц), 5,03 (1H, шс), 6,04 (2H, шс), 6,85 (1H, д, J=8,6 Гц), 7,07-7,16 (2H, м), 7,85 (1H, шс).
МС (м/з) 325 (М+) : 1,44 (3H, т, J=7,3 Гц), 1,44 (9H, с), 4,07 (2H, к, J= 7,3 Гц), 4,28 (2H, д, J=6,3 Гц), 5,03 (1H, шс), 6,04 (2H, шс), 6,85 (1H, д, J=8,6 Гц), 7,07-7,16 (2H, м), 7,85 (1H, шс).
МС (м/з) 325 (М+)Пример 323 Синтез гидроиодида т-бутилового эфира N-(2-этокси-5-(S-этилизотиоуреидо)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 322, как исходное вещество, по методике, аналогичной Примеру 27, получают названное соединение (выход 90%). 1H-ЯМР (CDCl3),  : 1,38 (6H, т, J=7,6 Гц), 1,45 (9H, с), 3,22 (2H, к, J= 7,6 Гц), 4,07 (2H, к, J=7,6 Гц), 4,28-4,29 (2H, м), 5,02 (1H, шс), 6,84 (1H, д, J=8,6 Гц), 7,06-7,10 (2H, м).
МС (м/з) 353 (М+) : 1,38 (6H, т, J=7,6 Гц), 1,45 (9H, с), 3,22 (2H, к, J= 7,6 Гц), 4,07 (2H, к, J=7,6 Гц), 4,28-4,29 (2H, м), 5,02 (1H, шс), 6,84 (1H, д, J=8,6 Гц), 7,06-7,10 (2H, м).
МС (м/з) 353 (М+)Пример 324 Синтез дигидрохлорида N-(2-этокси-5-(S-этилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 323, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 1,41 (3H, т, J=6,9 Гц), 1,43 (3H, т, J=6,9 Гц), 3,15-3,30 (2H, м), 4,16-4,31 (4H, м), 7,20 (1H, д, J=8,9 Гц), 7,34 (1H, д, J=2,6 Гц), 7,42 (1H, дд, J=8,9, 2,6 Гц).
МС (м/з) 253 (М+) : 1,41 (3H, т, J=6,9 Гц), 1,43 (3H, т, J=6,9 Гц), 3,15-3,30 (2H, м), 4,16-4,31 (4H, м), 7,20 (1H, д, J=8,9 Гц), 7,34 (1H, д, J=2,6 Гц), 7,42 (1H, дд, J=8,9, 2,6 Гц).
МС (м/з) 253 (М+)Пример 325 Синтез гидроиодида т-бутилового эфира N-(5-(N’-т-бутоксикарбонил- N”-этилгуанидино)-2-этоксифенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 321, как исходное вещество, по методике, аналогичной Примеру 233, получают названное соединение (выход 90%). 1H-ЯМР (CDCl3),  : 1,06 (3H, т, J=7,3 Гц), 1,40-1,47 (3H, м), 1,45 (9H, с), 1,53 (9H, с), 3,33-3,43 (2H, м), 4,06 (2H, к, J= 7,3 Гц), 4,16 (2H, д, J=5,9 Гц), 4,97 (1H, шс), 6,83 (1H, д, J=8,3 Гц), 7,04-7,12 (2H, м).
Пример 326 : 1,06 (3H, т, J=7,3 Гц), 1,40-1,47 (3H, м), 1,45 (9H, с), 1,53 (9H, с), 3,33-3,43 (2H, м), 4,06 (2H, к, J= 7,3 Гц), 4,16 (2H, д, J=5,9 Гц), 4,97 (1H, шс), 6,83 (1H, д, J=8,3 Гц), 7,04-7,12 (2H, м).
Пример 326Синтез дигидрохлорида N-(2-этокси-5-(N’-нитрогуанидино)фенилметил)амина Используя соединение, полученное в Примере 325, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 1,21 (3H, т, J=7,3 Гц), 1,43 (3H, т, J=6,9 Гц), 3,29 (2H, к, J=7,3 Гц), 4,17-4,28 (4H, м), 7,16 (1H, д, J=8,9 Гц), 7,29 (1H, д, J=2,6 Гц), 7,36 (1H, дд, J=8,9, 2,6 Гц).
МС (м/з) 236 (М+) : 1,21 (3H, т, J=7,3 Гц), 1,43 (3H, т, J=6,9 Гц), 3,29 (2H, к, J=7,3 Гц), 4,17-4,28 (4H, м), 7,16 (1H, д, J=8,9 Гц), 7,29 (1H, д, J=2,6 Гц), 7,36 (1H, дд, J=8,9, 2,6 Гц).
МС (м/з) 236 (М+)Пример 327 Синтез т-бутилового эфира N-(2-этокси-5-(N’-нитрогуанидино)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 321, как исходное вещество, по методике, аналогичной Примеру 6, получают названное соединение, количественно. 1H-ЯМР (CDCl3),  : 1,44 (9H, с), 1,44-1,48 (3H, м), 4,05- 4,11 (2H, м), 4,30 (2H, д, J=3,0 Гц), 5,08 (1H, шс), 6,88-6,99 (1H, м), 7,16-7,27 (2H, м), 9,63 (1H, шс).
МС (м/з) 353 (М+) : 1,44 (9H, с), 1,44-1,48 (3H, м), 4,05- 4,11 (2H, м), 4,30 (2H, д, J=3,0 Гц), 5,08 (1H, шс), 6,88-6,99 (1H, м), 7,16-7,27 (2H, м), 9,63 (1H, шс).
МС (м/з) 353 (М+)Пример 328 Синтез гидрохлорида N-(2-этокси-5-(N’-нитрогуанидино)фенилметил)амина Используя соединение, полученное в Примере 327, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 1,43 (3H, т, J=6,9 Гц), 4,19-4,29 (4H, м), 7,17 (1H, д, J=8,6 Гц), 7,34 (1H, д, J=2,6 Гц), 7,39 (1H, дд, J=8,6, 2,6 Гц).
Пример 329 : 1,43 (3H, т, J=6,9 Гц), 4,19-4,29 (4H, м), 7,17 (1H, д, J=8,6 Гц), 7,34 (1H, д, J=2,6 Гц), 7,39 (1H, дд, J=8,6, 2,6 Гц).
Пример 329Синтез N-(5-амино-2-метоксифенилметил)фталимида Используя соединение, полученное в Примере 117, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 91%). 1H-ЯМР (CDCl3),  : 3,63 (2H, шс), 3,79 (3H, с), 4,85 (2H, с), 6,52-6,59 (2H, м), 6,70 (1H, д, J=2,3 Гц), 7,68-7,76 (2H, м), 7,82-7,90 (2H, м).
Пример 330 : 3,63 (2H, шс), 3,79 (3H, с), 4,85 (2H, с), 6,52-6,59 (2H, м), 6,70 (1H, д, J=2,3 Гц), 7,68-7,76 (2H, м), 7,82-7,90 (2H, м).
Пример 330Синтез N-(2-метокси-5-(N’-трифтороацетоксиамино)фенил метил)фталимида К раствору соединения (150 мг), полученному в Примере 329, пиридина (0,13 мл) в безводном метиленхлориде (5 мл), добавляют по каплям ангидрид трифторуксусной кислоты (0,165 мл) при комнатной температуре и перемешивают при комнатной температуре в течение 1 ч. К реакционной смеси добавляют воду и это экстрагируют метиленхлоридом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и дистиллируют при пониженном давлении. Полученный остаток промывают хлороформом, получая 176 мг названного соединения (выход 88%). 1H-ЯМР (CDCl3),  : 3,86 (3H, с), 4,89 (2H, с), 6,87 (1H, д, J=8,9 Гц), 7,17 (1H, д, J= 2,3 Гц), 7,66 (1H, дд, J=8,9, 2,3 Гц), 7,71-7,74 (2H, м), 7,83-7,87 (2H, м).
МС (м/з) 378 (М+) : 3,86 (3H, с), 4,89 (2H, с), 6,87 (1H, д, J=8,9 Гц), 7,17 (1H, д, J= 2,3 Гц), 7,66 (1H, дд, J=8,9, 2,3 Гц), 7,71-7,74 (2H, м), 7,83-7,87 (2H, м).
МС (м/з) 378 (М+)Пример 331 Синтез N-(2-гидрокси-5-(N’-трифторацетоксиамино) фенилметил)фталимида Используя соединение, полученное в Примере 330, как исходное вещество, по методике, аналогичной Примеру 318, получают названное соединение (выход 93%). 1H-ЯМР (ДМСО-d6),  : 4,71 (2H, с), 6,84 (1H, д, J=8,9 Гц), 7,16 (1H, д, J= 2,3 Гц), 7,52 (1H, дд, J=8,9, 2,3 Гц), 7,86-7,97 (4Н, м), 9,88 (1H, с), 10,88 (1H, с).
МС (м/з) 364 (М+) : 4,71 (2H, с), 6,84 (1H, д, J=8,9 Гц), 7,16 (1H, д, J= 2,3 Гц), 7,52 (1H, дд, J=8,9, 2,3 Гц), 7,86-7,97 (4Н, м), 9,88 (1H, с), 10,88 (1H, с).
МС (м/з) 364 (М+)Пример 332 Синтез N-(2-бензилокси-5-(N’-трифторацетоксиамино)фенилметил)фталимида Используя соединение, полученное в Примере 331, как исходное вещество и, кроме того, используя карбонат калия и бензилбромид как основание и реагент соответственно, по методике, аналогичной Примеру 319, получают названное соединение (выход 53%). 1H-ЯМР (ДМСО-d6),  : 4,80 (2H, с), 5,19 (2H, с), 7,00-7,18 (2H, м), 7,27-7,52 (5H, м), 7,68 (1H, дд, J=8,9, 2,6 Гц), 7,85-7,98 (4H, м), 10,99 (1H, шс).
МС (м/з) 454 (М+) : 4,80 (2H, с), 5,19 (2H, с), 7,00-7,18 (2H, м), 7,27-7,52 (5H, м), 7,68 (1H, дд, J=8,9, 2,6 Гц), 7,85-7,98 (4H, м), 10,99 (1H, шс).
МС (м/з) 454 (М+)Пример 333 Синтез N-(5-амино-2-бензилоксифенилметил)амина Используя соединение (684 мг), полученное в Примере 332, как исходное вещество, по методике, аналогичной Примеру 180, получают N-(3-аминометил-4-бензилоксифенил)-2,2,2-трифторацетамид. К раствору образовавшегося аминосоединения в 6% безводном метаноле (10,6 мл) добавляют карбонат калия (265 мг) и кипятят с обратным холодильником в течение 2 ч. Реакционную смесь дистиллируют при пониженном давлении и к полученному остатку добавляют этилацетат и воду. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и дистиллируют при пониженном давлении, получая при этом 339 мг названного соединения (выход 98%). 1H-ЯМР (CDCl3),  : 3,79 (2H, с), 5,02 (2H, с), 6,54 (1H, дд, J=8,6, 3,0 Гц), 6,65 (1H, д, J=3,0 Гц), 6,76 (1H, д, J=8,6 Гц), 7,30-7,43 (5H, м).
МС (м/з) 228 (М+) : 3,79 (2H, с), 5,02 (2H, с), 6,54 (1H, дд, J=8,6, 3,0 Гц), 6,65 (1H, д, J=3,0 Гц), 6,76 (1H, д, J=8,6 Гц), 7,30-7,43 (5H, м).
МС (м/з) 228 (М+)Пример 334 Синтез т-бутилового эфира N-(5-амино-2-бензилоксифенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 333, как исходное вещество, по методике, аналогичной Примеру 253, получают названное соединение (выход 78%). 1H-ЯМР (CDCl3),  : 1,44 (9H, с), 4,26 (2H, д, J=5,9 Гц), 4,98 (1H, шс), 5,01 (2H, с), 6,55 (1H, дд, J=8,3, 2,6 Гц), 6,67 (1H, д, J=2,6 Гц), 6,76 (1H, д, J=8,3 Гц), 7,31-7,40 (5H, м).
МС (м/з) 328 (М+) : 1,44 (9H, с), 4,26 (2H, д, J=5,9 Гц), 4,98 (1H, шс), 5,01 (2H, с), 6,55 (1H, дд, J=8,3, 2,6 Гц), 6,67 (1H, д, J=2,6 Гц), 6,76 (1H, д, J=8,3 Гц), 7,31-7,40 (5H, м).
МС (м/з) 328 (М+)Пример 335 Синтез т-бутилового эфира N-(2-бензилокси-5-тиоуреидофенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 334, как исходное вещество, по методике, аналогичной Примеру 120, получают названное соединение (выход 81%). 1H-ЯМР (ДМСО-d6),  : 1,40 (9H, с), 4,17 (2H, д, J=5,9 Гц), 5,13 (2H, с), 7,00 (1H, д, J= 8,6 Гц), 7,07 (1H, д, J=2,3 Гц), 7,11-7,22 (2H, м), 7,26-7,50 (4H, м), 9,51 (1H, шс).
Пример 336 : 1,40 (9H, с), 4,17 (2H, д, J=5,9 Гц), 5,13 (2H, с), 7,00 (1H, д, J= 8,6 Гц), 7,07 (1H, д, J=2,3 Гц), 7,11-7,22 (2H, м), 7,26-7,50 (4H, м), 9,51 (1H, шс).
Пример 336Синтез т-бутилового эфира N-(2-бензилокси-5-(S-этилизотиоуреидо)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 335, как исходное вещество, по методике, аналогичной Примеру 95, получают названное соединение (выход 93%). 1H-ЯМР (CDCl3),  : 1,36 (3H, т, J=7,3 Гц), 1,43 (9H, с), 3,00-3,07 (2H, м), 4,32 (2H, д, J= 5,6 Гц), 4,50 (1H, шс), 4,97 (1H, шс), 5,07 (2H, с), 6,72-6,90 (3H, м), 7,32-7,42 (5H, м).
МС (м/з) 415 (М+) : 1,36 (3H, т, J=7,3 Гц), 1,43 (9H, с), 3,00-3,07 (2H, м), 4,32 (2H, д, J= 5,6 Гц), 4,50 (1H, шс), 4,97 (1H, шс), 5,07 (2H, с), 6,72-6,90 (3H, м), 7,32-7,42 (5H, м).
МС (м/з) 415 (М+)Пример 337 Синтез дигидрохлорида N-(2-бензилокси-5-(S-этилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 336, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 94%). 1H-ЯМР (D2O),  : 1,42 (3H, т, J=7,3 Гц), 3,23 (2H, к, J=7,3 Гц), 4,24 (2H, с), 5,34 (2H, с), 7,24-7,60 (8H, м).
Пример 338 : 1,42 (3H, т, J=7,3 Гц), 3,23 (2H, к, J=7,3 Гц), 4,24 (2H, с), 5,34 (2H, с), 7,24-7,60 (8H, м).
Пример 338Синтез т-бутилового эфира N-(2-бензилокси-5-(N’-т-бутоксикарбонил-N”-этилгуанидино)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 334, как исходное вещество, по методике, аналогичной Примеру 233, получают названное соединение (выход 70%). 1H-ЯМР (CDCl3),  : 1,07 (3H, т, J=6,9 Гц), 1,44 (9H, с), 1,53 (9H, с), 3,36-3,41 (2H, м), 4,43 (2H, д, J=5,6 Гц), 4,98 (1H, шс), 5,10 (2H, с), 6,92 (1H, д, J=8,6 Гц), 7,01-7,19 (2H, м), 7,30-7,45 (5H, м).
Пример 339 : 1,07 (3H, т, J=6,9 Гц), 1,44 (9H, с), 1,53 (9H, с), 3,36-3,41 (2H, м), 4,43 (2H, д, J=5,6 Гц), 4,98 (1H, шс), 5,10 (2H, с), 6,92 (1H, д, J=8,6 Гц), 7,01-7,19 (2H, м), 7,30-7,45 (5H, м).
Пример 339Синтез дигидрохлорида N-(2-бензилокси-5-(N’-этилгуанидино)фенилметил)амина Используя соединение, полученное в Примере 338, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 94%). 1H-ЯМР (D2O),  : 1,21 (3H, т, J=7,3 Гц), 3,29 (2H, к, J=7,3 Гц), 4,22(2H, с), 5,32(2H, с), 7,20-7,58(8H, м).
МС (м/з) 298 (М+) : 1,21 (3H, т, J=7,3 Гц), 3,29 (2H, к, J=7,3 Гц), 4,22(2H, с), 5,32(2H, с), 7,20-7,58(8H, м).
МС (м/з) 298 (М+)Пример 340 Синтез т-бутилового эфира N-(2-бензилокси-5-(N’-нитрогуанидино)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 334, как исходное вещество, по методике, аналогичной Примеру 6, получают названное соединение (выход 87%). 1H-ЯМР (ДМСО-d6),  : 1,40 (9H, с), 4,19 (2H, д, J=4,0 Гц), 5,15 (2H, с), 7,02-7,20 (4H, м), 7,28-7,51 (5H, м), 8,30 (1H, с).
Пример 341 : 1,40 (9H, с), 4,19 (2H, д, J=4,0 Гц), 5,15 (2H, с), 7,02-7,20 (4H, м), 7,28-7,51 (5H, м), 8,30 (1H, с).
Пример 341Синтез гидрохлорида N-(2-бензилокси-5-(N’-нитрогуанидино)фенилметил)амина Используя соединение, полученное в Примере 340, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 32%). 1H-ЯМР (D2O),  : 4,22 (2H, с), 5,31 (2H, с), 7,20-7,24 (1H, м), 7,32-7,39 (2H, м), 7,40-7,57 (5H, м).
Пример 342 : 4,22 (2H, с), 5,31 (2H, с), 7,20-7,24 (1H, м), 7,32-7,39 (2H, м), 7,40-7,57 (5H, м).
Пример 342Синтез дифенилметилового эфира 2-метокси-5-нитрофенилуксусной кислоты Используя 2-метоксифенилуксусную кислоту (5,00 г) как исходное вещество, по методике, аналогичной Примеру 188, получают 2-метокси-5-нитрофенилуксусную кислоту. К раствору образовавшегося нитросоединения в метиленхлориде (140 мл) добавляют раствор дифенилдиазометана в метиленхлориде при комнатной температуре до тех пор, пока реакционная смесь не станет пурпурной, и затем добавляют уксусную кислоту до тех пор, пока не исчезнет пурпурный цвет реакционной смеси. Реакционную смесь промывают последовательно насыщенным водным раствором бикарбоната натрия, насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и дистиллируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан: этилацетат= 3:1), получая 2,34 г названного соединения (выход 21%). 1H-ЯМР (CDCl3),  : 3,73 (3H, c), 3,77 (2H, с), 6,88 (1H, д, J=8,9 Гц), 6,91 (1H, с), 7,20-7,39 (10H, м), 8,12 (1H, д, J=2,6 Гц), 8,20 (1H, дд, J= 8,6, 2,6 Гц).
Пример 343 : 3,73 (3H, c), 3,77 (2H, с), 6,88 (1H, д, J=8,9 Гц), 6,91 (1H, с), 7,20-7,39 (10H, м), 8,12 (1H, д, J=2,6 Гц), 8,20 (1H, дд, J= 8,6, 2,6 Гц).
Пример 343Синтез дифенилметилового эфира 2-(2-метокси-5-нитрофенил)пропионовой кислоты Используя соединение, полученное в Примере 342, как исходное вещество и, кроме того, используя метилиодид (1 экв.) как реагент, по методике, аналогичной Примеру 1а, получают названное соединение (выход 46%). 1H-ЯМР (CDCl3),  : 1,55 (3H, д, J=7,3 Гц), 3,63 (3H, с), 4,08 (1H, к, J= 7,3 Гц), 6,84 (1H, д, J=8,9 Гц), 6,91 (1H, с), 7,15-7,38 (10H, м), 8,12 (1H, д, J=2,6 Гц), 8,19 (1H, дд, J=8,9, 2,6 Гц).
Пример 344 : 1,55 (3H, д, J=7,3 Гц), 3,63 (3H, с), 4,08 (1H, к, J= 7,3 Гц), 6,84 (1H, д, J=8,9 Гц), 6,91 (1H, с), 7,15-7,38 (10H, м), 8,12 (1H, д, J=2,6 Гц), 8,19 (1H, дд, J=8,9, 2,6 Гц).
Пример 344Синтез дифенилметилового эфира 2-(2-метокси-5-нитрофенил)-2-метилпропионовой кислоты Используя соединение, полученное в Примере 343, как исходное вещество, по методике, аналогичной Примеру 343, получают названное соединение (выход 82%). 1H-ЯМР (CDCl3),  : 1,60 (6H, с), 3,26 (3H, с), 6,73 (1H, д, J=8,9 Гц), 6,94 (1H, с), 7,12-7,31 (10H, м), 8,19 (1H, дд, J=8,9, 2,6 Гц), 8,26 (1H, д, J=2,6 Гц).
Пример 345 : 1,60 (6H, с), 3,26 (3H, с), 6,73 (1H, д, J=8,9 Гц), 6,94 (1H, с), 7,12-7,31 (10H, м), 8,19 (1H, дд, J=8,9, 2,6 Гц), 8,26 (1H, д, J=2,6 Гц).
Пример 345Синтез 2-(2-метокси-5-нитрофенил)-2-метилпропионовой кислоты Используя соединение, полученное в Примере 344, как исходное вещество, по методике, аналогичной Примеру 1b, получают названное соединение (выход 88%). 1H-ЯМР (CDCl3),  : 1,60 (6H, с), 3,92 (3H, с), 6,95 (1H, д, J=9,2 Гц), 8,18-8,23 (2H, м).
МС (м/з) 239 (М+) : 1,60 (6H, с), 3,92 (3H, с), 6,95 (1H, д, J=9,2 Гц), 8,18-8,23 (2H, м).
МС (м/з) 239 (М+)Пример 346 Синтез т-бутилового эфира N-(1-(2-метокси-5-нитрофенил)-1-метилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 345, как исходное вещество, по методике, аналогичной Примеру 1с, получают названное соединение (выход 40%). 1H-ЯМР (CDCl3),  : 1,33 (9H, шс), 1,70 (6H, с), 3,95 (3H, с), 5,06 (1H, шс), 6,94 (1H, д, J=8,9 Гц), 8,15 (1H, дд, J=8,9, 2,6 Гц).
Пример 347 : 1,33 (9H, шс), 1,70 (6H, с), 3,95 (3H, с), 5,06 (1H, шс), 6,94 (1H, д, J=8,9 Гц), 8,15 (1H, дд, J=8,9, 2,6 Гц).
Пример 347Синтез т-бутилового эфира N-(1-(5-амино-2-метоксифенил)-1-метилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 346, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 87%). 1H-ЯМР (CDCl3),  : 1,33 (9H, шс), 1,65 (6H, с), 3,77 (3H, с), 5,21 (1H, шс), 6,54 (1H, дд, J=8,6, 3,0 Гц), 6,70-6,74 (2H, м).
МС (м/з) 280 (М+) : 1,33 (9H, шс), 1,65 (6H, с), 3,77 (3H, с), 5,21 (1H, шс), 6,54 (1H, дд, J=8,6, 3,0 Гц), 6,70-6,74 (2H, м).
МС (м/з) 280 (М+)Пример 348 Синтез т-бутилового эфира N-(1-(2-метокси-5-тиоуреидофенил)-1-метилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 347, как исходное вещество, по методике, аналогичной Примеру 120, получают названное соединение, количественно. 1H-ЯМР (CDCl3),  : 1,35 (9H, с), 1,66 (6H, с), 3,85 (3H, с), 5,08 (1H, шс), 6,14 (2H, шс), 6,90 (1H, д, J=8,9 Гц), 7,07 (1H, дд, J=8,9, 2,0 Гц), 7,23 (1H, д, J=2,0 Гц), 7,80 (1H, шс).
МС (м/з) 339 (М+) : 1,35 (9H, с), 1,66 (6H, с), 3,85 (3H, с), 5,08 (1H, шс), 6,14 (2H, шс), 6,90 (1H, д, J=8,9 Гц), 7,07 (1H, дд, J=8,9, 2,0 Гц), 7,23 (1H, д, J=2,0 Гц), 7,80 (1H, шс).
МС (м/з) 339 (М+)Пример 349 Синтез гидроиодида т-бутилового эфира N-(1-(5-(S-этилизотиоуреидо)-2-метоксифенил)-1-метилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 348, как исходное вещество, по методике, аналогичной Примеру 27, получают названное соединение (выход 70%). 1H-ЯМР (CDCl3),  : 1,34 (9H, с), 1,36 (3H, т, J=7,6 Гц), 1,66 (6H, с), 3,03 (2H, к, J=7,6 Гц), 3,81 (3H, с), 5,16 (1H, шс), 6,80-6,91 (3H, м).
МС (м/з) 367 (М+) : 1,34 (9H, с), 1,36 (3H, т, J=7,6 Гц), 1,66 (6H, с), 3,03 (2H, к, J=7,6 Гц), 3,81 (3H, с), 5,16 (1H, шс), 6,80-6,91 (3H, м).
МС (м/з) 367 (М+)Пример 350 Синтез N-(1-(5-(S-этилизотиоуреидо)-2-метоксифенил)-1-метилэтил)амина Используя соединение (111 мг), полученное в Примере 349, в качестве исходного вещества, реакцию осуществляют по методике, аналогичной Примеру 5, и полученный остаток очищают с помощью колоночной хроматографии на основном силикагеле (элюент – н-гексан: хлороформ=1:3), получая 24,9 мг названного соединения (выход 42%). 1H-ЯМР (CDCl3), 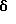 : 1,34-1,41 (3H, м), 1,51 (6H, с), 3,01-3,15 (2H, м), 3,85 (3H, с), 4,50 (1H, шс), 6,69-6,92 (3H, м).
МС (м/з) 267 (М+) : 1,34-1,41 (3H, м), 1,51 (6H, с), 3,01-3,15 (2H, м), 3,85 (3H, с), 4,50 (1H, шс), 6,69-6,92 (3H, м).
МС (м/з) 267 (М+)Пример 351 Синтез N,N’-ди-(т-бутоксикарбонил)-N-(3-нитрофенилметил)гидразина К раствору трифенилфосфина (2,06 г) в тетрагидрофуране (20 мл), добавляют по каплям при охлаждении льдом раствор ди-т-бутилазодикарбоксилата (1,80 г) в тетрагидрофуране (15 мл) и перемешивают в течение 15 мин. К реакционной смеси добавляют по каплям раствор м-нитробензилового спирта (1,0 г) в тетрагидрофуране (15 мл) и перемешивают при комнатной температуре в течение 63 ч. Реакционную смесь концентрируют при пониженном давлении и полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан: этилацетат= 1:1), получая 2,25 г названного соединения (выход 94%). 1Н-ЯMP(CDCl3),  : 1,47 (9H, с), 1,49 (9H, с), 4,72 (2H, с), 6,30 (1H, шс), 7,51 (1H, т, J=7,3 Гц), 7,65 (1H, д, J=7,3 Гц), 8,15 (1H, д, J=7,3 Гц), 8,16 (1H, с).
Пример 352 : 1,47 (9H, с), 1,49 (9H, с), 4,72 (2H, с), 6,30 (1H, шс), 7,51 (1H, т, J=7,3 Гц), 7,65 (1H, д, J=7,3 Гц), 8,15 (1H, д, J=7,3 Гц), 8,16 (1H, с).
Пример 352Синтез N-(3-аминофенилметил)-N,N’-ди-(т-бутоксикарбонил)гидразина Используя соединение, полученное в Примере 351, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 985 мг названного соединения (выход 62%). 1H-ЯМР (CDCl3),  : 1,44 (9H, с), 1,48 (9H, с), 4,56 (2H, с), 6,25 (1H, шс), 6,59 (1H, д, J=6,9 Гц), 6,65 (1H, д, J=6,9 Гц), 6,81-6,98 (2H, м).
Пример 353 : 1,44 (9H, с), 1,48 (9H, с), 4,56 (2H, с), 6,25 (1H, шс), 6,59 (1H, д, J=6,9 Гц), 6,65 (1H, д, J=6,9 Гц), 6,81-6,98 (2H, м).
Пример 353Синтез N,N’-ди-(т-бутоксикарбонил)-N-(3-тиоуреидофенилметил)гидразина Используя соединение, полученное в Примере 352, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 173 мг названного соединения (выход 74%). 1H-ЯМР (CDCl3),  : 1,35 (9H, с), 1,48 (9H, с), 4,60 (2H, с), 6,44 (1H, шс), 6,57 (2H, шс), 7,08-7,21 (2H, м), 7,26-7,40 (2H, м), 8,27 (1H, м).
Пример 354 : 1,35 (9H, с), 1,48 (9H, с), 4,60 (2H, с), 6,44 (1H, шс), 6,57 (2H, шс), 7,08-7,21 (2H, м), 7,26-7,40 (2H, м), 8,27 (1H, м).
Пример 354Синтез гидроиодида N,N’-ди-(т-бутоксикарбонил)-N-(3-(S-этилизотиоуреидо)фенилметил)гидразина Используя соединение, полученное в Примере 353, в качестве исходного вещества, по методике, аналогичной Примеру 27, получают 143 мг названного соединения (выход 79%). 1H-ЯМР (CDCl3),  : 1,41 (3H, т, J=7,3 Гц), 1,44 (9H, с), 1,48 (9H, с), 3,31 (2H, к, J=7,3 Гц), 4,64 (2H, с), 6,40 (1H, шс), 7,23- 7,41 (4H, м).
Пример 355 : 1,41 (3H, т, J=7,3 Гц), 1,44 (9H, с), 1,48 (9H, с), 3,31 (2H, к, J=7,3 Гц), 4,64 (2H, с), 6,40 (1H, шс), 7,23- 7,41 (4H, м).
Пример 355Синтез тригидрохлорида 3-(S-этилизотиоуреидо)фенилметил)гидразина Используя соединение, полученное в Примере 354, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 62 мг названного соединения (выход 79%). 1H-ЯМР (ДМСО-d6),  : 1,34 (3H, т, J=7,3 Гц), 3,28-3,40 (2H, м), 4,08 (2H, с), 7,30 (1H, д, J=7,6 Гц), 7,41 (1H, с), 7,42 (1H, д, J=7,6 Гц), 7,53 (1H, т, J=7,6 Гц), 9,26 (1H, шс), 9,61 (1H, шс), 11,51 (1H, шс).
МС (м/з) 224 (М+) : 1,34 (3H, т, J=7,3 Гц), 3,28-3,40 (2H, м), 4,08 (2H, с), 7,30 (1H, д, J=7,6 Гц), 7,41 (1H, с), 7,42 (1H, д, J=7,6 Гц), 7,53 (1H, т, J=7,6 Гц), 9,26 (1H, шс), 9,61 (1H, шс), 11,51 (1H, шс).
МС (м/з) 224 (М+)Пример 356 Синтез N,N’-ди-(т-бутоксикарбонил)-N-(3-(N’-нитрогуанидино)фенилметил)гидразина Используя соединение, полученное в Примере 352, в качестве исходного вещества, по методике, аналогичной Примеру 6, получают 22 мг названного соединения (выход 18%). 1H-ЯМР (CDCl3),  : 1,32 (9H, с), 1,48 (9H, с), 4,62 (2H, с), 6,48 (1H, шс), 7,15-7,25 (2H, м), 7,38 (1H, т, J=7,3 Гц), 7,49 (1H, ш), 9,54 (1H, шс).
МС (м/з) 224 (М+-200) : 1,32 (9H, с), 1,48 (9H, с), 4,62 (2H, с), 6,48 (1H, шс), 7,15-7,25 (2H, м), 7,38 (1H, т, J=7,3 Гц), 7,49 (1H, ш), 9,54 (1H, шс).
МС (м/з) 224 (М+-200)Пример 357 Синтез дигидрохлорида 3-(N’-нитрогуанидино)фенилметил)гидразина Используя соединение, полученное в Примере 356, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 15 мг названного соединения (выход 74%). 1H-ЯМР (ДМСО-d6),  : 3,75 (2H, с), 7,08-7,40 (6H, м), 8,26 (2H, шс).
МС (м/з) 208 (М+-16).
Пример 358 : 3,75 (2H, с), 7,08-7,40 (6H, м), 8,26 (2H, шс).
МС (м/з) 208 (М+-16).
Пример 358Синтез т-бутилового эфира N-(4-нитрофенилпропил)карбаминовой кислоты Используя 4-(4-нитрофенил)масляную кислоту в качестве исходного вещества, по методике, аналогичной Примеру 1с, получают 400 мг названного соединения (выход 30%). 1H-ЯМР (CDCl3),  : 1,44 (9H, с), 1,84 (2H, к, J=7,3 Гц), 2,75 (2H, т, J= 7,3 Гц), 3,10-3,26 (2H, м), 4,57 (1H, шс), 7,34 (2H, д, J=8,8 Гц), 8,15 (2H, д, J=8,8 Гц).
МС (м/з) 281 (М++1) : 1,44 (9H, с), 1,84 (2H, к, J=7,3 Гц), 2,75 (2H, т, J= 7,3 Гц), 3,10-3,26 (2H, м), 4,57 (1H, шс), 7,34 (2H, д, J=8,8 Гц), 8,15 (2H, д, J=8,8 Гц).
МС (м/з) 281 (М++1)Пример 359 Синтез т-бутилового эфира N-(4-аминофенилпропил)карбаминовой кислоты Используя соединение, полученное в Примере 358, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 170 мг названного соединения (выход 48%). 1H-ЯМР (CDCl3),  : 1,45 (9H, с), 1,75 (2H, к, J=7,3 Гц), 2,53 (2H, т, J= 7,3 Гц), 3,04-3,18 (2H, м), 3,53 (2H, шс), 4,48 (1H, шс), 6,62 (2H, д, J= 8,3 Гц), 6,95 (2H, д, J=8,3 Гц).
Пример 360 : 1,45 (9H, с), 1,75 (2H, к, J=7,3 Гц), 2,53 (2H, т, J= 7,3 Гц), 3,04-3,18 (2H, м), 3,53 (2H, шс), 4,48 (1H, шс), 6,62 (2H, д, J= 8,3 Гц), 6,95 (2H, д, J=8,3 Гц).
Пример 360Синтез т-бутилового эфира N-(4-(N’-нитрогуанидино)фенилпропил)карбаминовой кислоты Используя соединение, полученное в Примере 359, в качестве исходного вещества, по методике, аналогичной Примеру 6, получают 42 мг названного соединения (выход 37%). 1H-ЯМР (CDCl3),  : 1,41 (9H, с), 1,82 (2H, к, J=7,3 Гц), 2,70 (2H, т, J= 7,3 Гц), 3,16 (2H, т, J=7,3, 7,3 Гц), 4,54 (1H, шс), 7,24 (2H, д, J=8,3 Гц), 7,31 (2H, д, J=8,3 Гц), 9,60 (1H, шс).
Пример 361 : 1,41 (9H, с), 1,82 (2H, к, J=7,3 Гц), 2,70 (2H, т, J= 7,3 Гц), 3,16 (2H, т, J=7,3, 7,3 Гц), 4,54 (1H, шс), 7,24 (2H, д, J=8,3 Гц), 7,31 (2H, д, J=8,3 Гц), 9,60 (1H, шс).
Пример 361Синтез гидрохлорида N-(4-(N’-нитрогуанидино)фенилпропил)амина Используя соединение, полученное в Примере 360, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 35,5 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 1,94 (2H, к, J=7,5 Гц), 2,67 (2H, т, J=7,5 Гц), 2,74-2,86 (2H, м), 7,20 (2H, д, J=8,6 Гц), 7,26 (2H, д, J=8,6 Гц), 8,16 (1H, шс), 9,58 (1H, с).
МС (м/з) 237 (М+) : 1,94 (2H, к, J=7,5 Гц), 2,67 (2H, т, J=7,5 Гц), 2,74-2,86 (2H, м), 7,20 (2H, д, J=8,6 Гц), 7,26 (2H, д, J=8,6 Гц), 8,16 (1H, шс), 9,58 (1H, с).
МС (м/з) 237 (М+)Пример 362 Синтез ди-т-бутилового эфира N-(3-нитрофенилметил)-иминодикарбоновой кислоты Используя м-нитробензилбромид в качестве исходного вещества, по методике, аналогичной Примеру 127, получают 11,7 г названного соединения, количественно. 1H-ЯМР (CDCl3),  : 1,48 (18H, с), 4,86 (2H, с), 7,49 (1H, дд, J=7,9, 7,5 Гц), 7,65 (1H, д, J=7,5 Гц), 8,13 (1H, д, J=7,9 Гц), 8,19 (1H, с).
Пример 363 : 1,48 (18H, с), 4,86 (2H, с), 7,49 (1H, дд, J=7,9, 7,5 Гц), 7,65 (1H, д, J=7,5 Гц), 8,13 (1H, д, J=7,9 Гц), 8,19 (1H, с).
Пример 363Синтез ди-т-бутилового эфира N-(3-аминофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 362, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 5,45 г названного соединения (выход 41%). 1H-ЯМР (CDCl3),  : 1,45 (18H, с), 3,60 (2H, шс), 4,68 (2H, с), 6,53-6,58 (1H, м), 6,60 (1H, с), 6,66 (1H, д, J=7,6 Гц), 7,07 (1H, дд, J=7,9, 7,6 Гц).
Пример 364 : 1,45 (18H, с), 3,60 (2H, шс), 4,68 (2H, с), 6,53-6,58 (1H, м), 6,60 (1H, с), 6,66 (1H, д, J=7,6 Гц), 7,07 (1H, дд, J=7,9, 7,6 Гц).
Пример 364Синтез ди-т-бутилового эфира N-(3-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 363, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 2,1 г названного соединения, количественно. 1H-ЯМР (CDCl3),  : 1,47 (18H, с), 4,78 (2H, с), 6,12 (2H, шс), 7,10-7,42 (4H, м), 7,96 (1H, шс).
Пример 365 : 1,47 (18H, с), 4,78 (2H, с), 6,12 (2H, шс), 7,10-7,42 (4H, м), 7,96 (1H, шс).
Пример 365Синтез гидроиодида ди-т-бутилового эфира N-(3-(S-метилизотиоуреидо)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 364, в качестве исходного вещества, по методике, аналогичной Примеру 4, получают 1,81 г названного соединения (выход 70%). 1H-ЯМР (CDCl3),  : 1,46 (18H, с), 2,46 (3H, с), 4,49 (1H, шс), 4,75 (2H, с), 6,76-6,88 (2H, м), 6,95 (1H, д, J=7,6 Гц), 7,20-7,28 (1H, м).
Пример 366 : 1,46 (18H, с), 2,46 (3H, с), 4,49 (1H, шс), 4,75 (2H, с), 6,76-6,88 (2H, м), 6,95 (1H, д, J=7,6 Гц), 7,20-7,28 (1H, м).
Пример 366Синтез ди-т-бутилового эфира N-(3-(N’-метилгуанидино)фенилметил)иминодикарбоновой кислоты Смесь соединения (158 мг), полученного в Примере 365, гидрохлорида метиламина (31 мг), триэтиламина (156 мг) и диметилформамида (3 мл) нагревают при 80oC в течение 4 ч. Реакционную смесь концентрируют при пониженном давлении и полученный остаток очищают с помощью колоночной хроматографии на основном силикагеле (элюент – метиленхлорид:метанол=20:1), получая 60 мг названного соединения (выход 72%). 1H-ЯМР (CDCl3),  : 1,45 (18H, с), 2,85 (3H, с), 4,73 (2H, с), 6,81 (1H, д, J=7,9 Гц), 6,85 (1H, с), 6,89 (1H, д, J=7,6 Гц), 7,21 (1H, дд, J=7,9, 7,6 Гц).
Пример 367 : 1,45 (18H, с), 2,85 (3H, с), 4,73 (2H, с), 6,81 (1H, д, J=7,9 Гц), 6,85 (1H, с), 6,89 (1H, д, J=7,6 Гц), 7,21 (1H, дд, J=7,9, 7,6 Гц).
Пример 367Синтез дигидрохлорида N-(3-(N’-метилгуанидино)фенилметил)амина Используя соединение, полученное в Примере 366, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 49 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 2,84 (3H, д, J=4,3 Гц), 4,03 (2H, с), 7,22 (1H, д, J=7,3 Гц), 7,44-7,51 (1H, м), 7,69-7,86 (2H, м), 9,82 (1H, шс).
МС (м/з) 178 (М+) : 2,84 (3H, д, J=4,3 Гц), 4,03 (2H, с), 7,22 (1H, д, J=7,3 Гц), 7,44-7,51 (1H, м), 7,69-7,86 (2H, м), 9,82 (1H, шс).
МС (м/з) 178 (М+)Пример 368 Синтез ди-т-бутилового эфира N-(3-(N’-этилгуанидино)-фенилметил) иминодикарбоновой кислоты Используя соединение, полученное в Примере 365, в качестве исходного вещества и также используя гидрохлорид этиламина в качестве реагента, по методике, аналогичной Примеру 366, получают 59 мг названного соединения (выход 61%). 1H-ЯМР (CDCl3),  : 1,19 (3H, т, J=7,3 Гц), 1,45 (18H, с), 3,23 (2H, к, J= 7,3 Гц), 4,73 (2H, с), 6,80 (1H, д, J=7,9 Гц), 6,85 (1H, с), 6,88 (1H, д, J=7,5 Гц), 7,21 (1H, дд, J=7,9, 7,5 Гц) : 1,19 (3H, т, J=7,3 Гц), 1,45 (18H, с), 3,23 (2H, к, J= 7,3 Гц), 4,73 (2H, с), 6,80 (1H, д, J=7,9 Гц), 6,85 (1H, с), 6,88 (1H, д, J=7,5 Гц), 7,21 (1H, дд, J=7,9, 7,5 Гц)Пример 369 Синтез дигидрохлорида N-(3-(N’-этилгуанидино)фенилметил)амина Используя соединение, полученное в Примере 368, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 28,6 мг названного соединения (выход 71%). 1H-ЯМР (ДМСО-d6),  : 1,16 (3H, т, J=6,9 Гц), 3,26-3,38 (2H, м), 4,03 (2H, д, J=5,6 Гц), 7,21 (1H, д, J=7,6 Гц), 7,36 (1H, д, J=7,9 Гц), 7,39 (1H, с), 7,48 (1H, дд, J=7,9, 7,6 Гц), 7,77 (1H, шс), 7,96-8,02 (1H, м), 8,47 (2H, шс), 9,92 (1H, шс).
МС (м/з) 192 (М+) : 1,16 (3H, т, J=6,9 Гц), 3,26-3,38 (2H, м), 4,03 (2H, д, J=5,6 Гц), 7,21 (1H, д, J=7,6 Гц), 7,36 (1H, д, J=7,9 Гц), 7,39 (1H, с), 7,48 (1H, дд, J=7,9, 7,6 Гц), 7,77 (1H, шс), 7,96-8,02 (1H, м), 8,47 (2H, шс), 9,92 (1H, шс).
МС (м/з) 192 (М+)Пример 370 Синтез ди-т-бутилового эфира N-(3-(N’-н-пропилгуанидино)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 365, в качестве исходного вещества и также используя н-пропиламин в качестве реагента, по методике, аналогичной Примеру 366, получают 15 мг названного соединения (выход 64%). 1H-ЯМР (CDCl3),  : 0,96 (3H, т, J=7,6 Гц), 1,45 (18H, с), 1,54-1,66 (2H, м), 3,15 (2H, т, J=7,3 Гц), 4,73 (2H, с), 6,84-6,97 (3H, м), 7,21 (1H, д, J=7,9 Гц).
Пример 371 : 0,96 (3H, т, J=7,6 Гц), 1,45 (18H, с), 1,54-1,66 (2H, м), 3,15 (2H, т, J=7,3 Гц), 4,73 (2H, с), 6,84-6,97 (3H, м), 7,21 (1H, д, J=7,9 Гц).
Пример 371Синтез дигидрохлорида N-(3-(N’-н-пропилгуанидино)фенилметил)амина Используя соединение, полученное в Примере 370, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 10,7 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 0,92 (3H, т, J=7,3 Гц), 1,50-1,62 (2H, м), 3,20 (2H, дт, J= 6,6, 6,3 Гц), 4,04 (2H, д, J=5,6 Гц), 7,23 (1H, д, J=7,9 Гц), 7,34 (1H, с), 7,35 (1H, д, J=7,6 Гц), 7,48 (1H, дд, J=7,9, 7,6 Гц), 7,67-7,73 (1H, м), 7,90-7,96 (1H, м), 9,73 (1H, шс).
МС (м/з) 206 (М+) : 0,92 (3H, т, J=7,3 Гц), 1,50-1,62 (2H, м), 3,20 (2H, дт, J= 6,6, 6,3 Гц), 4,04 (2H, д, J=5,6 Гц), 7,23 (1H, д, J=7,9 Гц), 7,34 (1H, с), 7,35 (1H, д, J=7,6 Гц), 7,48 (1H, дд, J=7,9, 7,6 Гц), 7,67-7,73 (1H, м), 7,90-7,96 (1H, м), 9,73 (1H, шс).
МС (м/з) 206 (М+)Пример 372 Синтез N-(3-(S-этилизотиоуреидо)фенилметил)диметиламина К раствору соединения (43,5 мг), полученного в Примере 40, в ацетонитриле (5 мл), добавляют хлористый водород в 1,4-диоксане (4N, 0,1 мл) и этилиодид (50 мг) и кипятят с обратным холодильником в течение 5 ч. Реакционную смесь концентрируют при пониженном давлении и полученный остаток очищают с помощью колоночной хроматографии на основном силикагеле (элюент – метиленхлорид:метанол=5:1), получая 9,2 мг названного соединения (выход 19%). 1H-ЯМР (CDCl3),  : 1,23 (3H, т, J=7,3 Гц), 2,14 (6H, с), 2,89 (2H, к, J=7,3 Гц), 3,31(2H, с), 6,16 (2H, шс), 6,60-6,64 (2H, м), 6,84 (1H, д, J=7,3 Гц), 7,16 (1H, дд, J=7,6, 7,3 Гц).
Пример 373 : 1,23 (3H, т, J=7,3 Гц), 2,14 (6H, с), 2,89 (2H, к, J=7,3 Гц), 3,31(2H, с), 6,16 (2H, шс), 6,60-6,64 (2H, м), 6,84 (1H, д, J=7,3 Гц), 7,16 (1H, дд, J=7,6, 7,3 Гц).
Пример 373Синтез N-(3-(N’-т-бутоксикарбонил-N”-этилгуанидинофенилметил)диметиламина Используя соединение, полученное в Примере 38, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают 104 мг названного соединения (выход 61%). 1H-ЯМР (CDCl3),  : 1,05-1,10 (3H, м), 1,51(9H, с), 2,25 (6H, с), 3,39-3,42 (4H, м), 7,16-7,33 (4H, м).
МС (м/з) 320 (М+) : 1,05-1,10 (3H, м), 1,51(9H, с), 2,25 (6H, с), 3,39-3,42 (4H, м), 7,16-7,33 (4H, м).
МС (м/з) 320 (М+)Пример 374 Синтез дигидрохлорида N-(3-(N’-этилгуанидино)фенилметил)диметиламина Используя соединение, полученное в Примере 373, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 48,2 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 1,15 (3H, т, J=6,8 Гц), 2,70 (3H, д, J=5,0 Гц), 3,29 (2H, к, J= 6,8 Гц), 4,27 (2H, д, J=4,9 Гц), 7,28 (1H, д, J=7,6 Гц), 7,42-7,56 (2H, м), 7,80 (1H, шс), 8,00- 8,08 (1H, м), 9,92 (1H, с), 10,92 (1H, шс).
МС (м/з) 220 (М+) : 1,15 (3H, т, J=6,8 Гц), 2,70 (3H, д, J=5,0 Гц), 3,29 (2H, к, J= 6,8 Гц), 4,27 (2H, д, J=4,9 Гц), 7,28 (1H, д, J=7,6 Гц), 7,42-7,56 (2H, м), 7,80 (1H, шс), 8,00- 8,08 (1H, м), 9,92 (1H, с), 10,92 (1H, шс).
МС (м/з) 220 (М+)Пример 375 Синтез т-бутилового эфира N-(3-(N’-т-бутоксикарбонил-N”-этилгуанидино)фенилметил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 44, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают 107 мг названного соединения (выход 69%). 1H-ЯМР (CDCl3),  : 1,06-1,18 (3H, м), 1,48 (18H, с), 2,83 (3H, с), 3,38 (2H, к, J=7,0 Гц), 4,42 (2H, с), 7,06-7,34 (4H, м), 10,58 (1H, шс).
Пример 376 : 1,06-1,18 (3H, м), 1,48 (18H, с), 2,83 (3H, с), 3,38 (2H, к, J=7,0 Гц), 4,42 (2H, с), 7,06-7,34 (4H, м), 10,58 (1H, шс).
Пример 376Синтез дигидрохлорида N-(3-(N’-этилгуанидино)фенилметил)метиламина Используя соединение, полученное в Примере 375, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 57,6 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 1,16 (3H, т, J=6,9 Гц), 2,55 (3H, т, J=5,3 Гц), 3,25-3,35 (2H, м), 4,12 (2H, т, J=5,3 Гц), 7,25 (1H, д, J=7,9 Гц), 7,40 (1H, д, J= 7,9 Гц), 7,41 (1H, шс), 7,49 (1H, т, J=7,9 Гц), 7,75 (1H, шс), 7,94 (1H, т, J=5,3 Гц), 9,22 (1H, шс), 9,78 (1H, шс).
МС (м/з) 206 (М+) : 1,16 (3H, т, J=6,9 Гц), 2,55 (3H, т, J=5,3 Гц), 3,25-3,35 (2H, м), 4,12 (2H, т, J=5,3 Гц), 7,25 (1H, д, J=7,9 Гц), 7,40 (1H, д, J= 7,9 Гц), 7,41 (1H, шс), 7,49 (1H, т, J=7,9 Гц), 7,75 (1H, шс), 7,94 (1H, т, J=5,3 Гц), 9,22 (1H, шс), 9,78 (1H, шс).
МС (м/з) 206 (М+)Пример 377 Синтез N-(3-нитрофенилметил)бензилметиламина К раствору соединения (630 мг), полученного в Примере 42, и триэтиламина (768 мг) в ацетонитриле (20 мл), добавляют по каплям при комнатной температуре бензилбромид (778 мг). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и, после добавления воды, экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=4:1), получая 925 мг названного соединения (выход 95%). 1H-ЯМР (CDCl3),  : 2,21 (3H, с), 3,57 (2H, с), 3,60 (2H, с), 7,26-7,40 (5H, м), 7,48 (1H, дд, J=8,3, 7,6 Гц), 7,70 (1H, д, J=7,6 Гц), 8,10 (1H, д, J=8,3 Гц), 8,24 (1H, с).
Пример 378 : 2,21 (3H, с), 3,57 (2H, с), 3,60 (2H, с), 7,26-7,40 (5H, м), 7,48 (1H, дд, J=8,3, 7,6 Гц), 7,70 (1H, д, J=7,6 Гц), 8,10 (1H, д, J=8,3 Гц), 8,24 (1H, с).
Пример 378Синтез N-(3-аминофенилметил)бензилметиламина Используя соединение, полученное в Примере 377, в качестве исходного вещества и также используя 5% палладий на углероде и этилацетат в качестве катализатора и растворителя соответственно, реакцию проводят по методике, аналогичной Примеру 2, получая 487 мг названного соединения (выход 61%). 1H-ЯМР (CDCl3),  : 2,18 (3H, с), 3,43 (2H, с), 3,51 (2H, с), 3,64 (2H, шс), 6,58 (1H, д, J=8,6 Гц), 6,73 (с, 1H), 6,75 (1H, д, J=7,6 Гц), 7,10 (1H, дд, J=8,6, 7,6 Гц), 7,21-7,39 (5H, м).
Пример 379 : 2,18 (3H, с), 3,43 (2H, с), 3,51 (2H, с), 3,64 (2H, шс), 6,58 (1H, д, J=8,6 Гц), 6,73 (с, 1H), 6,75 (1H, д, J=7,6 Гц), 7,10 (1H, дд, J=8,6, 7,6 Гц), 7,21-7,39 (5H, м).
Пример 379Синтез N-(3-тиоуреидофенилметил)бензилметиламина Используя соединение, полученное в Примере 378, в качестве исходного вещества, по методике, аналогичной Примеру 40, получают 153 мг названного соединения (выход 32%). 1H-ЯМР (CDCl3),  : 2,19 (3H, с), 3,54 (4H, с), 6,15 (2H, шс), 6,60 (с, 1H), 6,75-6,79 (1H, м), 7,10-7,20 (1H, м), 7,26-7,36 (6H, м), 8,01-8,18 (1H, шс).
Пример 380 : 2,19 (3H, с), 3,54 (4H, с), 6,15 (2H, шс), 6,60 (с, 1H), 6,75-6,79 (1H, м), 7,10-7,20 (1H, м), 7,26-7,36 (6H, м), 8,01-8,18 (1H, шс).
Пример 380Синтез дигидрохлорида N-(3-(S-этилизотиоуреидо)фенилметил)бензилметиламина Используя соединение, полученное в Примере 379, в качестве исходного вещества, по методике, аналогичной Примеру 372, получают N-(3-(S-этилизотиоуреидо)фенил- метил)бензилметиламин. К этому соединению добавляют раствор хлористого водорода в 1,4-диоксане (4N, 0,1 мл) и смесь концентрируют при пониженном давлении, получая 9,3 мг названного соединения (выход 6%). 1H-ЯМР (ДМСО-d6),  : 1,34 (3H, т, J=7,3 Гц), 2,54 (3H, д, J=3,6 Гц), 3,30-3,40 (2H, м), 4,20-4,31 (2H, м), 4,38-4,49 (2H, м), 7,40-7,50 (4H, м), 7,55-7,68 (5H, м), 9,43 (1H, шс), 9,72 (1H, шс), 11,24 (1H, шс), 11,66 (1H, шс).
Пример 381 : 1,34 (3H, т, J=7,3 Гц), 2,54 (3H, д, J=3,6 Гц), 3,30-3,40 (2H, м), 4,20-4,31 (2H, м), 4,38-4,49 (2H, м), 7,40-7,50 (4H, м), 7,55-7,68 (5H, м), 9,43 (1H, шс), 9,72 (1H, шс), 11,24 (1H, шс), 11,66 (1H, шс).
Пример 381Синтез N-(3-(N’-т-бутоксикарбонил-N”-этилгуанидино)фенилметил)бензилметиламина Используя соединение, полученное в Примере 378, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают 96 мг названного соединения (выход 62%). 1H-ЯМР (CDCl3),  : 1,01-1,18 (3H, м), 1,52(9H, с), 2,18(3H, с), 3,36-3,41 (2H, м), 3,49(2H, с), 3,54(2H, с), 4,71 (1H, шс), 7,08 (1H, шс), 7,26-7,35 (9H, м), 10,70 (1H, шс).
Пример 382 : 1,01-1,18 (3H, м), 1,52(9H, с), 2,18(3H, с), 3,36-3,41 (2H, м), 3,49(2H, с), 3,54(2H, с), 4,71 (1H, шс), 7,08 (1H, шс), 7,26-7,35 (9H, м), 10,70 (1H, шс).
Пример 382Синтез дигидрохлорида N-(3-(N’-этилгуанидино)фенил-метил) бензилметиламина Используя соединение, полученное в Примере 381, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 133 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 1,16 (3H, т, J=6,9 Гц), 2,56 (3H, с), 3,27-3,33 (2H, м), 4,17-4,27 (2H, м), 4,36-4,47 (2H, м), 7,29 (1H, д, J=6,9 Гц), 7,48-7,60 (8H, м), 7,73- 7,80 (1H, м), 7,93-7,99 (2H, м), 9,75 (1H, шс), 10,87 (1H, шс).
МС (м/з) 296 (М+) : 1,16 (3H, т, J=6,9 Гц), 2,56 (3H, с), 3,27-3,33 (2H, м), 4,17-4,27 (2H, м), 4,36-4,47 (2H, м), 7,29 (1H, д, J=6,9 Гц), 7,48-7,60 (8H, м), 7,73- 7,80 (1H, м), 7,93-7,99 (2H, м), 9,75 (1H, шс), 10,87 (1H, шс).
МС (м/з) 296 (М+)Пример 383 Синтез N-(3-нитрофенилметил)этиламина Используя м-нитробензальдегид в качестве исходного вещества и также используя гидрохлорид этиламина в качестве реагента, по методике, аналогичной Примеру 42, получают 2,8 г названного соединения (выход 47%). 1H-ЯМР (CDCl3),  : 1,15 (3H, т, J=7,3 Гц), 2,69 (2H, к, J=7,3 Гц), 3,91 (2H, с), 7,49 (1H, дд, J=7,9, 7,6 Гц), 7,68 (1H, д, J=7,6 Гц), 8,11 (1H, д, J=7,9 Гц), 8,21 (1H, с).
Пример 384 : 1,15 (3H, т, J=7,3 Гц), 2,69 (2H, к, J=7,3 Гц), 3,91 (2H, с), 7,49 (1H, дд, J=7,9, 7,6 Гц), 7,68 (1H, д, J=7,6 Гц), 8,11 (1H, д, J=7,9 Гц), 8,21 (1H, с).
Пример 384Синтез т-бутилового эфира N-(3-нитрофенилметил)этилкарбаминовой кслоты Используя соединение, полученное в Примере 383, в качестве исходного вещества, по методике, аналогичной Примеру 22, получают 1,94 г названного соединения (выход 99%). 1H-ЯМР (CDCl3),  : 1,11 (3H, т, J=7,3 Гц), 1,48 (9H, с), 3,20-3,40 (2H, м), 4,50 (2H, с), 7,50 (1H, т, J=8,3 Гц), 7,55-7,60 (1H, м), 8,11 (1H, с), 8,12 (1H, д, J=7,6 Гц).
Пример 385 : 1,11 (3H, т, J=7,3 Гц), 1,48 (9H, с), 3,20-3,40 (2H, м), 4,50 (2H, с), 7,50 (1H, т, J=8,3 Гц), 7,55-7,60 (1H, м), 8,11 (1H, с), 8,12 (1H, д, J=7,6 Гц).
Пример 385Синтез т-бутилового эфира N-(3-аминофенилметил)этилкарбаминовой кислоты Используя соединение, полученное в Примере 384, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 890 мг названного соединения, количественно. 1H-ЯМР (CDCl3),  : 1,06 (3H, т, J=6,9 Гц), 1,47 (9H, с), 3,13-3,26 (2H, м), 3,64 (2H, с), 4,34 (2H, с), 6,55-6,65 (3H, м), 7,09(1H, т, J=7,9 Гц).
Пример 386 : 1,06 (3H, т, J=6,9 Гц), 1,47 (9H, с), 3,13-3,26 (2H, м), 3,64 (2H, с), 4,34 (2H, с), 6,55-6,65 (3H, м), 7,09(1H, т, J=7,9 Гц).
Пример 386Синтез т-бутилового эфира N-(3-тиоуреидофенилметил) этилкарбаминовой кислоты Используя соединение, полученное в Примере 385, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 460 мг названного соединения (выход 78%). 1H-ЯМР (CDCl3),  : 1,09 (3H, т, J=6,9 Гц), 1,47 (9H, с), 3,22-3,30(2H, м), 4,42 (2H, с), 6,09 (2H, шс), 7,11 (1H, с), 7,12 (1H, д, J=5,9 Гц), 7,19 (1H, д, J=7,6 Гц), 7,39 (1H, дд, J=7,6, 5,9 Гц), 7,92 (1H, шс).
Пример 387 : 1,09 (3H, т, J=6,9 Гц), 1,47 (9H, с), 3,22-3,30(2H, м), 4,42 (2H, с), 6,09 (2H, шс), 7,11 (1H, с), 7,12 (1H, д, J=5,9 Гц), 7,19 (1H, д, J=7,6 Гц), 7,39 (1H, дд, J=7,6, 5,9 Гц), 7,92 (1H, шс).
Пример 387Синтез гидроиодида т-бутилового эфира N-(3-(S- этилизотиоуреидофенилметил)этилкарбаминовой кислоты Используя соединение, полученное в Примере 386, в качестве исходного вещества, по методике, аналогичной Примеру 27, получают 155 мг названного соединения (выход 49%). 1H-ЯМР (CDCl3),  : 1,06 (3H, т, J=6,9 Гц), 1,36 (3H, т, J=7,3 Гц), 1,47 (9H, с), 2,97-3,12 (2H, м), 3,12-3,37 (2H, м), 4,39 (2H, с), 4,48 (1H, шс), 6,75-6,86 (2H, м), 6,90(1H, д, J=7,3 Гц), 7,25 (1H, дд, J=7,9, 7,3 Гц).
Пример 388 : 1,06 (3H, т, J=6,9 Гц), 1,36 (3H, т, J=7,3 Гц), 1,47 (9H, с), 2,97-3,12 (2H, м), 3,12-3,37 (2H, м), 4,39 (2H, с), 4,48 (1H, шс), 6,75-6,86 (2H, м), 6,90(1H, д, J=7,3 Гц), 7,25 (1H, дд, J=7,9, 7,3 Гц).
Пример 388Синтез дигидрохлорида N-(3-(S-этилизoтиoуpeидoфeнилметил)этиламина Используя соединение, полученное в Примере 387, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 162 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 1,26 (3H, т, J=6,9 Гц), 1,33 (3H, т, J=7,3 Гц), 2,90-3,01 (2H, м), 3,35 (2H, к, J=7,3 Гц), 4,11 (2H, с), 7,35 (1H, д, J=6,9 Гц), 7,50-7,66 (3H, м), 9,53 (2H, шс), 9,75 (1H, шс), 11,79 (1H, шс).
МС (м/з) 237 (М+) : 1,26 (3H, т, J=6,9 Гц), 1,33 (3H, т, J=7,3 Гц), 2,90-3,01 (2H, м), 3,35 (2H, к, J=7,3 Гц), 4,11 (2H, с), 7,35 (1H, д, J=6,9 Гц), 7,50-7,66 (3H, м), 9,53 (2H, шс), 9,75 (1H, шс), 11,79 (1H, шс).
МС (м/з) 237 (М+)Пример 389 Синтез т-бутилового эфира N-(2-метокси-5-нитрофенилметил)метилкарбаминовой кислоты К метиламину (в виде 40% MeOH раствора, 50 мл), добавляют при охлаждении льдом 5-нитро-2-бензилбромид (1,04 г) и перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь концентрируют при пониженном давлении и полученный остаток подвергают обработке, как в Примере 22, получая названное соединение (выход 39%). 1H-ЯМР (CDCl3),  : 1,46(9H, с), 2,92 (3H, с), 3,95 (3H, с), 4,44 (2H, с), 6,92 (1H, д, J=9,2 Гц), 7,90-8,19 (2H, м).
Пример 390 : 1,46(9H, с), 2,92 (3H, с), 3,95 (3H, с), 4,44 (2H, с), 6,92 (1H, д, J=9,2 Гц), 7,90-8,19 (2H, м).
Пример 390Синтез т-бутилового эфира N-(5-амино-2-метоксифенилметил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 389, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 436 мг названного соединения, количественно. 1H-ЯМР (CDCl3),  : 1,46 (9H, с), 2,84 (3H, с), 3,41 (2H, с), 3,75 (3H, с), 4,39 (2H, с), 6,47-6,53 (1H, м), 6,56 (1H, дд, J=8,6, 2,3 Гц), 6,70 (1H, д, J=8,6 Гц).
Пример 391 : 1,46 (9H, с), 2,84 (3H, с), 3,41 (2H, с), 3,75 (3H, с), 4,39 (2H, с), 6,47-6,53 (1H, м), 6,56 (1H, дд, J=8,6, 2,3 Гц), 6,70 (1H, д, J=8,6 Гц).
Пример 391Синтез т-бутилового эфира N-(5-(N’-т-бутоксикарбонил-N”- этилгуанидино)-2-метоксифенилметил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 390, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают 75 мг названного соединения (выход 65%). 1H-ЯМР(CDCl3),  : 1,06 (3H, т, J=7,3 Гц), 1,47 (9H, с), 1,54 (9H, с), 2,87 (3H, с), 3,38 (2H, к, J=7,3 Гц), 3,84 (3H, с), 4,42 (2H, с), 6,86 (1H, д, J=8,6 Гц), 6,97 (1H, с), 7,02-7,13 (1H, м), 10,47 (1H, шс).
Пример 392 : 1,06 (3H, т, J=7,3 Гц), 1,47 (9H, с), 1,54 (9H, с), 2,87 (3H, с), 3,38 (2H, к, J=7,3 Гц), 3,84 (3H, с), 4,42 (2H, с), 6,86 (1H, д, J=8,6 Гц), 6,97 (1H, с), 7,02-7,13 (1H, м), 10,47 (1H, шс).
Пример 392Синтез дигидрохлорида N-(5-(N’-этилгуанидино)-2-метоксифенилметил) метиламина Используя соединение, полученное в Примере 391, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 42,6 мг названного соединения (выход 91%). 1H-ЯМР(ДМСО-d6),  : 1,15 (3H, т, J=6,9 Гц), 2,52-2,58 (3H, м), 3,20-3,38 (2H, м), 3,87 (3H, с), 4,05-4,17 (2H, м), 7,15 (1H, д, J=8,3 Гц), 7,27 (1H, д, J=8,9 Гц), 7,36 (1H, с), 7,42-7,61 (1H, м), 7,66-7,81 (1H, м), 9,05 (1H, шс), 9,60 (1H, шс) : 1,15 (3H, т, J=6,9 Гц), 2,52-2,58 (3H, м), 3,20-3,38 (2H, м), 3,87 (3H, с), 4,05-4,17 (2H, м), 7,15 (1H, д, J=8,3 Гц), 7,27 (1H, д, J=8,9 Гц), 7,36 (1H, с), 7,42-7,61 (1H, м), 7,66-7,81 (1H, м), 9,05 (1H, шс), 9,60 (1H, шс)МС (м/з) 236 (М+) Пример 393 Синтез т-бутилового эфира N-(2-метокси-5-тиоуреидофенилметил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 390, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 223 мг названного соединения (выход 96%). 1H-ЯМР (CDCl3),  : 1,47 (9H, с), 2,89 (3H, с), 3,85 (3H, с), 4,41 (2H, с), 5,98 (2H, шс), 6,88 (1H, д, J=8,6 Гц), 7,01 (1H, с), 7,05-7,15 (1H, м), 7,71 (1H, с).
Пример 394 : 1,47 (9H, с), 2,89 (3H, с), 3,85 (3H, с), 4,41 (2H, с), 5,98 (2H, шс), 6,88 (1H, д, J=8,6 Гц), 7,01 (1H, с), 7,05-7,15 (1H, м), 7,71 (1H, с).
Пример 394Синтез гидроиодида т-бутилового эфира N-(5-(3-этилизотиоуреидо)-2-метоксифенилметил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 393, в качестве исходного вещества, по методике, аналогичной Примеру 27, получают 217 мг названного соединения (выход 66%). 1H-ЯМР (CDCl3),  : 1,35 (3H, т, J=7,3 Гц), 1,45 (9H, с), 2,84 (3H, с), 2,92-3,10 (2H, м), 3,79 (9H, с), 4,41 (2H, с), 6,73-6,81 (3H, м).
Пример 395 : 1,35 (3H, т, J=7,3 Гц), 1,45 (9H, с), 2,84 (3H, с), 2,92-3,10 (2H, м), 3,79 (9H, с), 4,41 (2H, с), 6,73-6,81 (3H, м).
Пример 395Синтез дигидрохлорида N-(5-(S-этилизотиоуреидо)-2-метоксифенилметил)метиламина Используя соединение, полученное в Примере 394, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 207,8 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 1,33 (3H, т, J=7,3 Гц), 2,52- 2,59 (3H, м), 3,22-3,36 (2H, м), 3,89 (3H, с), 4,03-4,18 (2H, м), 7,20 (1H, д, J=8,6 Гц), 7,37 (1H, д, J=8,6 Гц), 7,47 (1H, с), 9,08 (2H, шс), 9,57 (1H, шс), 11,45 (1H, шс).
МС (м/з) 253 (М+) : 1,33 (3H, т, J=7,3 Гц), 2,52- 2,59 (3H, м), 3,22-3,36 (2H, м), 3,89 (3H, с), 4,03-4,18 (2H, м), 7,20 (1H, д, J=8,6 Гц), 7,37 (1H, д, J=8,6 Гц), 7,47 (1H, с), 9,08 (2H, шс), 9,57 (1H, шс), 11,45 (1H, шс).
МС (м/з) 253 (М+)Пример 396 Синтез N-(2-метокси-5-нитрофенилметил)диметиламина Используя 5-нитро-2-бензилбромид в качестве исходного вещества, по методике, аналогичной Примеру 37, получают 3,4 г названного соединения (выход 82%). 1H-ЯМР (CDCl3),  : 2,29 (6H, с), 3,47 (2H, с), 3,94 (3H, с), 6,92 (1H, д, J=8,9 Гц), 8,17 (1H, дд, J=8,9, 3,0 Гц), 8,23 (1H, д, J=3,0 Гц).
Пример 397 : 2,29 (6H, с), 3,47 (2H, с), 3,94 (3H, с), 6,92 (1H, д, J=8,9 Гц), 8,17 (1H, дд, J=8,9, 3,0 Гц), 8,23 (1H, д, J=3,0 Гц).
Пример 397Синтез N-(5-амино-2-метоксифенилметил)диметиламина Используя соединение, полученное в Примере 396, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 1,05 г названного соединения (выход 37%). 1H-ЯМР (CDCl3),  : 2,26 (6H, с), 3,39 (4H, с), 3,76 (3H, с), 6,58 (1H, дд, J=8,6, 3,0 Гц), 6,71 (1H, д, J=8,6 Гц), 6,72 (1H, д, J=3,0 Гц).
Пример 398 : 2,26 (6H, с), 3,39 (4H, с), 3,76 (3H, с), 6,58 (1H, дд, J=8,6, 3,0 Гц), 6,71 (1H, д, J=8,6 Гц), 6,72 (1H, д, J=3,0 Гц).
Пример 398Синтез N-(5-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2- метоксифенилметил)диметиламина Используя соединение, полученное в Примере 397, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают 44 мг названного соединения (выход 45%). 1H-ЯМР (CDCl3),  : 1,02-1,15 (3H, м), 1,53 (9H, с), 2,35 (6H, с), 3,39-3,48 (2H, м), 3,49 (2H, с), 3,85 (3H, с), 6,87 (1H, д, J=8,3 Гц), 7,05-7,26 (2H, с).
Пример 399 : 1,02-1,15 (3H, м), 1,53 (9H, с), 2,35 (6H, с), 3,39-3,48 (2H, м), 3,49 (2H, с), 3,85 (3H, с), 6,87 (1H, д, J=8,3 Гц), 7,05-7,26 (2H, с).
Пример 399Синтез дигидрохлорида N-(5-(N’-этилгуанидино)-2-метоксифенилметил)диметиламина Используя соединение, полученное в Примере 398, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 44 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 1,15 (3H, т, J=6,9 Гц), 2,73 (6H, д, J=5,0 Гц), 3,29 (2H, к, J=6,9 Гц), 3,88 (3H, с), 4,25 (2H, д, J=5,0 Гц), 7,18 (1H, д, J= 8,9 Гц), 7,31 (1H, дд, J=8,9, 1,9 Гц), 7,44 (1H, д, J=l,9 Гц), 7,60 (1H, шс), 7,78-7,88(1H, м), 9,65(1H, шс), 10,41(1H, шс).
МС (м/з) 250 (М+) : 1,15 (3H, т, J=6,9 Гц), 2,73 (6H, д, J=5,0 Гц), 3,29 (2H, к, J=6,9 Гц), 3,88 (3H, с), 4,25 (2H, д, J=5,0 Гц), 7,18 (1H, д, J= 8,9 Гц), 7,31 (1H, дд, J=8,9, 1,9 Гц), 7,44 (1H, д, J=l,9 Гц), 7,60 (1H, шс), 7,78-7,88(1H, м), 9,65(1H, шс), 10,41(1H, шс).
МС (м/з) 250 (М+)Пример 400 Синтез N-(2-метокси-5-тиоуреидофенилметил)диметиламина Используя соединение, полученное в Примере 397, в качестве исходного вещества, по методике, аналогичной Примеру 40, получают 410 мг названного соединения (выход 62%). 1H-ЯМР (CDCl3),  : 2,26 (6H, с), 3,43 (2H, с), 3,85 (3H, с), 6,00 (2H, шс), 6,88 (1H, д, J=8,6 Гц), 7,17 (1H, дд, J=8,5, 2,6 Гц), 7,23 (1H, д, J= 2,6 Гц), 7,77 (1H, шс).
Пример 401 : 2,26 (6H, с), 3,43 (2H, с), 3,85 (3H, с), 6,00 (2H, шс), 6,88 (1H, д, J=8,6 Гц), 7,17 (1H, дд, J=8,5, 2,6 Гц), 7,23 (1H, д, J= 2,6 Гц), 7,77 (1H, шс).
Пример 401Синтез дигидрохлорида N-(5-(S-этилизотиоуреидо)-2-метоксифенилметил)диметиламина Используя соединение, полученное в Примере 400, в качестве исходного вещества, по методике, аналогичной Примеру 380, получают 69,5 мг названного соединения (выход 98%). 1H-ЯМР (ДМСО-d6),  : 1,33 (3H, т, J=7,3 Гц), 2,73 (6H, д, J= 5,0 Гц), 3,28-3,42 (2H, м), 3,89 (3H, с), 4,26 (2H, д, J=5,0 Гц), 7,24 (1H, д, J=8,6 Гц), 7,38-7,44 (1H, м), 7,57-7,60 (1H, м), 9,27 (1H, шс), 9,65 (1H, шс), 10,61 (1H, шс), 11,58 (1H, шс).
МС (м/з) 267 (М+) : 1,33 (3H, т, J=7,3 Гц), 2,73 (6H, д, J= 5,0 Гц), 3,28-3,42 (2H, м), 3,89 (3H, с), 4,26 (2H, д, J=5,0 Гц), 7,24 (1H, д, J=8,6 Гц), 7,38-7,44 (1H, м), 7,57-7,60 (1H, м), 9,27 (1H, шс), 9,65 (1H, шс), 10,61 (1H, шс), 11,58 (1H, шс).
МС (м/з) 267 (М+)Пример 402 Синтез N-(3-нитрофенилметил)бензиламина К раствору м-нитробензилбромида (1,0 г) и диизопропилэтиламина (1,19 г) в метаноле (50 мл) добавляют бензилбромид (495 мг) по каплям при охлаждении льдом. Реакционную смесь перемешивают при комнатной температуре в течение 3 дней и, после добавления воды, экстрагируют этилацетом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан: этилацетат=4:1), получая 555 мг названного соединения (выход 50%). 1H-ЯМР (CDCl3),  : 3,83 (2H, с), 3,91 (2H, с), 7,23-7,38 (5H, м), 7,49 (1H, т, J=7,9 Гц), 7,70 (1H, д, J=7,9 Гц), 8,07- 8,14 (1H, м), 8,21 (1H, с).
Пример 403 : 3,83 (2H, с), 3,91 (2H, с), 7,23-7,38 (5H, м), 7,49 (1H, т, J=7,9 Гц), 7,70 (1H, д, J=7,9 Гц), 8,07- 8,14 (1H, м), 8,21 (1H, с).
Пример 403Синтез т-бутилового эфира N-(3-аминофенилметил)бензилкарбаминовой кислоты Используя соединение, полученное в Примере 402, в качестве исходного вещества, обработку проводят по методике, аналогичной Примеру 22, и полученное соединение затем подвергают той же самой реакции, как в Примере 2, получая 517 мг названного соединения (выход 73%). 1H-ЯМР (CDCl3),  : 1,49 (9H, с), 3,65 (2H, шс), 4,25-4,43 (4H, м), 6,50-6,63 (3H, м), 7,11 (1H, т, J=7,9 Гц), 7,20-7,40 (5H, м).
Пример 404 : 1,49 (9H, с), 3,65 (2H, шс), 4,25-4,43 (4H, м), 6,50-6,63 (3H, м), 7,11 (1H, т, J=7,9 Гц), 7,20-7,40 (5H, м).
Пример 404Синтез т-бутилового эфира N-(3-тиоуреидофенилметил)-бензилкарбаминовой кислоты Используя соединение, полученное в Примере 403, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 223 мг названного соединения (выход 97%). 1H-ЯМР (CDCl3),  : 1,49 (9H, с), 4,41 (4H, шс), 6,16(2H, шс), 7,02-7,23(5H, м), 7,26-7,41(4H, м), 8,29(1H, шс).
Пример 405 : 1,49 (9H, с), 4,41 (4H, шс), 6,16(2H, шс), 7,02-7,23(5H, м), 7,26-7,41(4H, м), 8,29(1H, шс).
Пример 405Синтез гидроиодида т-бутилового эфира N-(3-(S-этилизотиоуреидо)фенилметил)бензилкарбаминовой кислоты Используя соединение, полученное в Примере 404, в качестве исходного вещества, по методике, аналогичной Примеру 27, получают 205 мг названного соединения (выход 66%). 1H-ЯМР (CDCl3),  : 1,37 (3H, т, J=6,9 Гц), 1,49 (9H, с), 3,00-3,12 (2H, м), 4,25-4,48 (4H, м), 6,75-6,90 (2H, м), 7,18-7,38 (7H, м).
Пример 406 : 1,37 (3H, т, J=6,9 Гц), 1,49 (9H, с), 3,00-3,12 (2H, м), 4,25-4,48 (4H, м), 6,75-6,90 (2H, м), 7,18-7,38 (7H, м).
Пример 406Синтез дигидрохлорида N-(3-(S-этилизотиоуреидо)фенилметил)бензиламина Используя соединение, полученное в Примере 405, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 176 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 1,35 (3H, т, J=6,9 Гц), 3,30-3,42 (2H, м), 4,17-4,26 (4H, м), 7,38-7,65 (9H, м), 9,46 (1H, шс), 9,78 (1H, шс), 10,02 (1H, шс), 11,80 (1H, шс).
МС (м/з) 299 (М+) : 1,35 (3H, т, J=6,9 Гц), 3,30-3,42 (2H, м), 4,17-4,26 (4H, м), 7,38-7,65 (9H, м), 9,46 (1H, шс), 9,78 (1H, шс), 10,02 (1H, шс), 11,80 (1H, шс).
МС (м/з) 299 (М+)Пример 407 Синтез т-бутилового эфира N-(2-метил-3-нитрофенилметил)метилкарбаминовой кислоты Используя 2-метил-3-нитробензилбромид в качестве исходного вещества, по методике, аналогичной Примеру 389, получают 900 мг названного соединения (выход 74%). 1H-ЯМР(CDCl3),  : 1,47 (9H, с), 2,38 (3H, с), 2,83 (3H, с), 4,51 (2H, с), 7,30-7,34 (2H, м), 7,65-7,69 (1H, м).
Пример 408 : 1,47 (9H, с), 2,38 (3H, с), 2,83 (3H, с), 4,51 (2H, с), 7,30-7,34 (2H, м), 7,65-7,69 (1H, м).
Пример 408Синтез т-бутилового эфира N-(3-амино-2-метилфенил-метил) метилкарбаминовой кислоты Используя соединение, полученное в Примере 407, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают 805 мг названного соединения, количественно. 1H-ЯМР(CDCl3),  : 1,48 (9H, с), 2,08 (3H, с), 2,73 (3H, с), 3,62 (2H, шс), 4,44 (2H, с), 6,59 (1H, д, J=7,6 Гц), 6,64 (1H, д, J=7,6 Гц), 6,99 (1H, т, J=7,6 Гц).
Пример 409 : 1,48 (9H, с), 2,08 (3H, с), 2,73 (3H, с), 3,62 (2H, шс), 4,44 (2H, с), 6,59 (1H, д, J=7,6 Гц), 6,64 (1H, д, J=7,6 Гц), 6,99 (1H, т, J=7,6 Гц).
Пример 409Синтез т-бутилового эфира N-(2-метил-3-тиоуреидофенилметил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 408, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 225 мг названного соединения (выход 91%). 1H-ЯМР (CDCl3),  : 1,47 (9H, с), 2,23 (3H, с), 2,84 (3H, с), 4,46 (2H, с), 5,79 (2H, шс), 7,17 (1H, дд, J=6,9, 6,6 Гц), 7,23-7,32 (2H, м), 7,56 (1H, шс).
Пример 410 : 1,47 (9H, с), 2,23 (3H, с), 2,84 (3H, с), 4,46 (2H, с), 5,79 (2H, шс), 7,17 (1H, дд, J=6,9, 6,6 Гц), 7,23-7,32 (2H, м), 7,56 (1H, шс).
Пример 410Синтез гидроиодида т-бутилового эфира N-(3-(S-этилизотиоуреидо)-2-метилфенилметил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 409, в качестве исходного вещества, по методике, аналогичной Примеру 27, получают 114 мг названного соединения (выход 76%). 1H-ЯМР(CDCl3),  : 1,39 (3H, т, J=7,6 Гц), 1,47 (9H, с), 2,07 (3H, с), 2,78 (3H, с), 3,02-3,18 (2H, м), 4,35 (1H, шс), 4,45 (2H, с), 6,75 (1H, д, J=7,3 Гц), 6,82 (1H, д, J=7,6 Гц), 7,11 (1H, дд, J=7,6, 7,3 Гц).
Пример 411 : 1,39 (3H, т, J=7,6 Гц), 1,47 (9H, с), 2,07 (3H, с), 2,78 (3H, с), 3,02-3,18 (2H, м), 4,35 (1H, шс), 4,45 (2H, с), 6,75 (1H, д, J=7,3 Гц), 6,82 (1H, д, J=7,6 Гц), 7,11 (1H, дд, J=7,6, 7,3 Гц).
Пример 411Синтез дигидрохлорида N-(3-(S-этилизотиоуреидо)-2-метилфенилметил)метиламина Используя соединение, полученное в Примере 410, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 128 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 1,34 (3H, т, J=6,9 Гц), 2,27 (3H, с), 2,60-2,65 (3H, м), 3,25-3,35 (2H, м), 4,20-4,27 (2H, м), 7,31 (1H, д, J=7,6 Гц), 7,41 (1H, дд, J= 7,6, 7,3 Гц), 7,60 (1H, д, J=7,3 Гц), 9,23 (2H, шс), 9,45-9,60 (1H, м), 11,46 (1H, шс).
МС (м/з) 238 (M++1) : 1,34 (3H, т, J=6,9 Гц), 2,27 (3H, с), 2,60-2,65 (3H, м), 3,25-3,35 (2H, м), 4,20-4,27 (2H, м), 7,31 (1H, д, J=7,6 Гц), 7,41 (1H, дд, J= 7,6, 7,3 Гц), 7,60 (1H, д, J=7,3 Гц), 9,23 (2H, шс), 9,45-9,60 (1H, м), 11,46 (1H, шс).
МС (м/з) 238 (M++1)Пример 412 Синтез т-бутилового эфира N-(3-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-метилфенилметил)метилкарбаминовой кислоты Используя соединение, полученное в Примере 408, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают 43 мг названного соединения (выход 53%). 1H-ЯМР(CDCl3),  : 1,01-1,18 (3H, м), 1,48 (9H, с), 1,54 (9H, с), 2,18 (3H, с), 2,81 (3H, с), 3,38-3,42 (2H, м), 4,45 (1H, с), 7,05-7,26 (3H, м), 10,56 (1H, шс).
Пример 413 : 1,01-1,18 (3H, м), 1,48 (9H, с), 1,54 (9H, с), 2,18 (3H, с), 2,81 (3H, с), 3,38-3,42 (2H, м), 4,45 (1H, с), 7,05-7,26 (3H, м), 10,56 (1H, шс).
Пример 413Синтез дигидрохлорида N-(3-(N’-этилгуaнидинo)-2-метилфенилметил)метиламина Используя соединение, полученное в Примере 412, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 30,5 мг названного соединения, количественно. 1H-ЯМР(ДМСО-d6),  : 1,15 (3H, т, J=7,3 Гц), 2,28 (3H, с), 2,63 (3H, т, J=5,0 Гц), 3,22-3,35 (2H, м), 4,19(2H, т, J=5,6 Гц), 7,26 (1H, д, J=7,6 Гц), 7,35 (1H, дд, J=7,6, 7,3 Гц), 7,45 (1H, шс), 7,52 (1H, д, J=7,3 Гц), 7,61-7,72 (1H, м), 9,21 (2H, шс), 9,55 (1H, шc).
MC (м/з) 220 (М+) : 1,15 (3H, т, J=7,3 Гц), 2,28 (3H, с), 2,63 (3H, т, J=5,0 Гц), 3,22-3,35 (2H, м), 4,19(2H, т, J=5,6 Гц), 7,26 (1H, д, J=7,6 Гц), 7,35 (1H, дд, J=7,6, 7,3 Гц), 7,45 (1H, шс), 7,52 (1H, д, J=7,3 Гц), 7,61-7,72 (1H, м), 9,21 (2H, шс), 9,55 (1H, шc).
MC (м/з) 220 (М+)Пример 414 Синтез N-(2-метил-3-тиоуреидофенилметил)диметиламина Используя N-(3-амино-2-метилфенилметил)диметиламин в качестве исходного вещества, по методике, аналогичной Примеру 40, получают 355 мг названного соединения (выход 56%). 1H-ЯМР(CDCl3),  : 2,25 (6H, с), 2,32 (3H, с), 3,40 (2H, с), 5,81 (2H, шс), 7,14-7,32 (3H, м), 7,53-7,72 (1H, м).
Пример 415 : 2,25 (6H, с), 2,32 (3H, с), 3,40 (2H, с), 5,81 (2H, шс), 7,14-7,32 (3H, м), 7,53-7,72 (1H, м).
Пример 415Синтез дигидрохлорида N-(3-(S-этилизотиоуреидо)-2-метилфенилметил)диметиламина Используя соединение, полученное в Примере 414, в качестве исходного вещества, по методике, аналогичной Примеру 380, получают 108 мг названного соединения (выход 83%). 1H-ЯМР(ДМСО-d6),  : 1,34 (3H, т, J=7,3 Гц), 2,31 (3H, с), 2,77 (6H, д, J= 4,0 Гц), 3,28-3,40 (2H, м), 4,40 (2H, д, J=5,3 Гц), 7,35-7,46 (2H, м), 7,72 (1H, д, J=6,9 Гц), 9,56 (1H, шс), 10,66 (1H, шс), 11,49 (1H, шс).
МС (м/з) 252 (M++1) : 1,34 (3H, т, J=7,3 Гц), 2,31 (3H, с), 2,77 (6H, д, J= 4,0 Гц), 3,28-3,40 (2H, м), 4,40 (2H, д, J=5,3 Гц), 7,35-7,46 (2H, м), 7,72 (1H, д, J=6,9 Гц), 9,56 (1H, шс), 10,66 (1H, шс), 11,49 (1H, шс).
МС (м/з) 252 (M++1)Пример 416 Синтез N-(3-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-метилфенилметил)диметиламина Используя N-(3-амино-2-метилфенилметил)диметиламин в качестве исходного вещества, по методике, аналогичной Примеру 233, получают 46 мг названного соединения (выход 45%). 1H-ЯМР(CDCl3),  : 1,00-1,08 (3H, м), 1,52 (9H, с), 2,26 (9H, с), 3,33-3,43 (2H, м), 3,42 (2H, с), 4,30 (1H, шс), 7,02-7,20 (3H, м), 10,57 (1H, шс).
Пример 417 : 1,00-1,08 (3H, м), 1,52 (9H, с), 2,26 (9H, с), 3,33-3,43 (2H, м), 3,42 (2H, с), 4,30 (1H, шс), 7,02-7,20 (3H, м), 10,57 (1H, шс).
Пример 417Синтез дигидрохлорида N-(3-(N’-этилгуанидино)-2-метил-фенилметил)диметиламина Используя соединение, полученное в Примере 416, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 37,3 мг названного соединения (выход 92%). 1H-ЯМР (ДМСО-d6),  : 1,15 (3H, т, J=7,3 Гц), 2,32 (3H, с), 2,77 (6H, д, J= 4,0 Гц), 3,23-3,35 (2H, м), 4,38 (2H, д, J=5,3 Гц), 7,29 (1H, д, J=7,6 Гц), 7,37 (1H, дд, J=7,9, 7,6 Гц), 7,53 (1H, шс), 7,64 (1H, д, J=7,9 Гц), 7,70-7,86 (1H, м), 9,67 (1H, шс), 10,71 (1H, шс).
МС (м/з) 235 (M++1) : 1,15 (3H, т, J=7,3 Гц), 2,32 (3H, с), 2,77 (6H, д, J= 4,0 Гц), 3,23-3,35 (2H, м), 4,38 (2H, д, J=5,3 Гц), 7,29 (1H, д, J=7,6 Гц), 7,37 (1H, дд, J=7,9, 7,6 Гц), 7,53 (1H, шс), 7,64 (1H, д, J=7,9 Гц), 7,70-7,86 (1H, м), 9,67 (1H, шс), 10,71 (1H, шс).
МС (м/з) 235 (M++1)Пример 418 Синтез 2-метокси-3-нитробензилового спирта Смесь метилового эфира 2-метокси-3-нитробензойной кислоты (4,82 г), литийборогидрида (298 мг), триметилбората (0,27 мл) и безводного тетрагидрофурана (200 мл) кипятят с обратным холодильником в течение 5 ч. Реакционную смесь дистиллируют при пониженном давлении и к полученному остатку добавляют этилацетат и воду. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и дистиллируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=1:1), получая 3,18 г названного соединения (выход 76%). 1H-ЯМР(CDCl3),  : 2,08 (1H, т, J=5,6 Гц), 3,94 (3H, с), 4,81 (2H, д, J= 5,6 Гц), 7,23 (1H, т, J=7,9 Гц), 7,69 (1H, д, J=7,9 Гц), 7,79 (1H, д, J=7,9 Гц).
Пример 419 : 2,08 (1H, т, J=5,6 Гц), 3,94 (3H, с), 4,81 (2H, д, J= 5,6 Гц), 7,23 (1H, т, J=7,9 Гц), 7,69 (1H, д, J=7,9 Гц), 7,79 (1H, д, J=7,9 Гц).
Пример 419Синтез 2-метокси-3-нитробензилбромида Используя соединение, полученное в Примере 418, в качестве исходного вещества, по методике, аналогичной Примеру 55, получают названное соединение, количественно. 1H-ЯМР(CDCl3),  : 4,03 (3H, с), 4,57 (2H, с), 7,21 (1H, т, J=7,9 Гц), 7,65 (1H, дд, J=7,9, 1,6 Гц), 7,81 (1H, дд, J=7,9, 1,6 Гц).
Пример 420 : 4,03 (3H, с), 4,57 (2H, с), 7,21 (1H, т, J=7,9 Гц), 7,65 (1H, дд, J=7,9, 1,6 Гц), 7,81 (1H, дд, J=7,9, 1,6 Гц).
Пример 420Синтез ди-т-бутилового эфира N-(2-метокси-3-нитрофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 419, в качестве исходного вещества, по методике, аналогичной Примеру 127, получают названное соединение (выход 64%). 1H-ЯМР(CDCl3),  : 1,46 (18H, с), 3,92 (3H, с), 4,91 (2H, с), 7,19 (1H, т, J=7,9 Гц), 7,41 (lH, д, J=7,9 Гц), 7,74 (1H, д, J=7,9 Гц).
Пример 421 : 1,46 (18H, с), 3,92 (3H, с), 4,91 (2H, с), 7,19 (1H, т, J=7,9 Гц), 7,41 (lH, д, J=7,9 Гц), 7,74 (1H, д, J=7,9 Гц).
Пример 421Синтез ди-т-бутилового эфира N-(3-амино-2-метоксифенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 420, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают названное соединение (выход 94%). 1H-ЯМР(CDCl3),  : 1,44 (18H, с), 3,75 (3H, с), 4,85 (2H, с), 6,54 (1H, д, J=7,3 Гц), 6,64 (1H, д, J=7,3 Гц), 6,87 (1H, т, J=7,3 Гц).
Пример 422 : 1,44 (18H, с), 3,75 (3H, с), 4,85 (2H, с), 6,54 (1H, д, J=7,3 Гц), 6,64 (1H, д, J=7,3 Гц), 6,87 (1H, т, J=7,3 Гц).
Пример 422Синтез ди-т-бутилового эфира N-(2-метокси-3-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 421, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают названное соединение (выход 98%). 1H-ЯМР(CDCl3),  : 1,46 (18H, с), 3,83 (3H, с), 4,86 (2H, с), 6,29 (2H, шс), 7,11-7,20 (3H, м), 7,88 (1H, шс).
Пример 423 : 1,46 (18H, с), 3,83 (3H, с), 4,86 (2H, с), 6,29 (2H, шс), 7,11-7,20 (3H, м), 7,88 (1H, шс).
Пример 423Синтез т-бутилового эфира N-(3-(S-этилизотиоуреидо)-2-метоксифенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 422, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают названное соединение (выход 86%). 1H-ЯМР(CDCl3),  : 1,39 (3H, т, J=6,9 Гц), 1,45 (9H, с), 3,08-3,18 (2H, м), 3,77 (3H, с), 4,31-4,32 (2H, м), 4,54 (2H, шс), 4,98 (1H, шс), 6,80-7,01 (3H, м).
Пример 424 : 1,39 (3H, т, J=6,9 Гц), 1,45 (9H, с), 3,08-3,18 (2H, м), 3,77 (3H, с), 4,31-4,32 (2H, м), 4,54 (2H, шс), 4,98 (1H, шс), 6,80-7,01 (3H, м).
Пример 424Синтез дигидрохлорида N-(3-(S-этилизотиоуреидо)-2-метоксифенилметил)амина Используя соединение, полученное в Примере 423, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 88%). 1H-ЯМР(D2O),  : 1,43 (3H, т, J=7,3 Гц), 3,27 (2H, к, J=7,3 Гц), 3,87 (3H, с), 4,28 (2H, с), 7,35 (1H, т, J=7,9 Гц), 7,45 (1H, дд, J=7,9, 2,0 Гц), 7,54 (1H, дд, J=7,9, 2,0 Гц).
Пример 425 : 1,43 (3H, т, J=7,3 Гц), 3,27 (2H, к, J=7,3 Гц), 3,87 (3H, с), 4,28 (2H, с), 7,35 (1H, т, J=7,9 Гц), 7,45 (1H, дд, J=7,9, 2,0 Гц), 7,54 (1H, дд, J=7,9, 2,0 Гц).
Пример 425Синтез ди-т-бутилового эфира N-(3-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-метоксифенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 421, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают названное соединение (выход 50%). 1H-ЯМР(CDCl3), 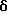 : 1,45 (27H, с), 1,48-1,58 (3H, м), 3,38- 3,48 (2H, м), 3,78 (3H, с), 4,86 (2H, с), 7,00-7,25 (3H, м).
Пример 426 : 1,45 (27H, с), 1,48-1,58 (3H, м), 3,38- 3,48 (2H, м), 3,78 (3H, с), 4,86 (2H, с), 7,00-7,25 (3H, м).
Пример 426Синтез дигидрохлорида N-(3-(N’-этилгуанидино)-2-метоксифенилметил)амина Используя соединение, полученное в Примере 425, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 93%). 1H-ЯМР(D2O),  : 1,23 (3H, т, J=7,3 Гц), 3,34 (2H, к, J=7,3 Гц), 3,87 (3H, с), 4,25 (2H, с), 7,29 (1H, т, J=7,6 Гц), 7,39-7,49 (2H, м).
Пример 427 : 1,23 (3H, т, J=7,3 Гц), 3,34 (2H, к, J=7,3 Гц), 3,87 (3H, с), 4,25 (2H, с), 7,29 (1H, т, J=7,6 Гц), 7,39-7,49 (2H, м).
Пример 427Синтез ди-т-бутилового эфира N-(3-метил-5-нитрофенилметил)иминодикарбоновой кислоты Используя 3-метил-5-нитробензилбромид в качестве исходного вещества, по методике, аналогичной Примеру 127, получают названное соединение (выход 92%). 1H-ЯМР(CDCl3),  : 1,49 (18H, с), 2,44 (3H, с), 4,82 (2H, с), 7,44 (1H, с), 7,94 (1H, с), 7,98 (1H, с).
Пример 428 : 1,49 (18H, с), 2,44 (3H, с), 4,82 (2H, с), 7,44 (1H, с), 7,94 (1H, с), 7,98 (1H, с).
Пример 428Синтез ди-т-бутилового эфира N-(5-амино-3-метилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 427, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают названное соединение (выход 89%). 1H-ЯМР(CDCl3),  : 1,46 (18H, с), 2,23 (3H, с), 3,56 (2H, шс), 4,65 (2H, с), 6,39 (1H, с), 6,41 (1H, с), 6,49 (1H, с).
Пример 429 : 1,46 (18H, с), 2,23 (3H, с), 3,56 (2H, шс), 4,65 (2H, с), 6,39 (1H, с), 6,41 (1H, с), 6,49 (1H, с).
Пример 429Синтез ди-т-бутилового эфира N-(3-метил-5-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 428, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают названное соединение, количественно. 1H-ЯМР(CDCl3),  : 1,48 (18H, с), 2,34 (3H, с), 4,74 (2H, с), 6,10 (2H, шс), 6,91 (1H, с), 6,96 (1H, с), 7,06 (1H, с), 7,84 (1H, шс).
Пример 430 : 1,48 (18H, с), 2,34 (3H, с), 4,74 (2H, с), 6,10 (2H, шс), 6,91 (1H, с), 6,96 (1H, с), 7,06 (1H, с), 7,84 (1H, шс).
Пример 430Синтез т-бутилового эфира N-(5-(S-этилизотиоуреидо)-3-метилфенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 429, как исходное вещество, по методике, аналогичной Примеру 95, получают названное соединение (выход 70%). 1H-ЯМР (CDCl3),  : 1,36 (3H, т, J=7,3 Гц), 1,46 (9H, с), 2,30 (3H, с), 2,95-3,10 (2H, м), 4,24 (2H, д, J=5,6 Гц), 4,49 (1H, шс), 4,80 (1H, шс), 6,64 (2H, с), 6,76 (1H, с).
Пример 431 : 1,36 (3H, т, J=7,3 Гц), 1,46 (9H, с), 2,30 (3H, с), 2,95-3,10 (2H, м), 4,24 (2H, д, J=5,6 Гц), 4,49 (1H, шс), 4,80 (1H, шс), 6,64 (2H, с), 6,76 (1H, с).
Пример 431Синтез дигидрохлорида N-(5-(S-этилизотиоуреидо)-3-метилфенилметил)амина Используя соединение, полученное в Примере 430, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 70%). 1H-ЯМР (D2O),  : 1,42 (3H, т, J=7,3 Гц), 2,40 (3H, с), 3,23 (2H, к, J= 7,3 Гц), 4,20 (2H, с), 7,23 (1H, с), 7,28 (1H, с), 7,37 (1H, с).
Пример 432 : 1,42 (3H, т, J=7,3 Гц), 2,40 (3H, с), 3,23 (2H, к, J= 7,3 Гц), 4,20 (2H, с), 7,23 (1H, с), 7,28 (1H, с), 7,37 (1H, с).
Пример 432Синтез ди-т-бутилового эфира N-(-5-(N’-т-бутоксикарбонил-N”-этилгуанидино)-3-метилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 428, как исходное вещество, по методике, аналогичной Примеру 233, получают названное соединение (выход 64%). 1H-ЯМР (CDCl3),  : 1,01-1,15 (3H, м), 1,47 (27, м), 2,32 (3H, с), 3,34-3,45 (2H, м), 4,72 (2H, с), 6,82-7,00 (3H, м).
Пример 433 : 1,01-1,15 (3H, м), 1,47 (27, м), 2,32 (3H, с), 3,34-3,45 (2H, м), 4,72 (2H, с), 6,82-7,00 (3H, м).
Пример 433Синтез дигидрохлорида N-(5-(N’-этилгуанидино)-3-метил-фенилметил)амина Используя соединение, полученное в Примере 432, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 80%). 1H-ЯМР (D2O),  : 1,22 (3H, т, J=7,3 Гц), 2,38 (3H, с), 3,32 (2H, к, J= 7,3 Гц), 4,17 (2H, с), 7,15 (1H, с), 7,20 (1H, с), 7,26 (1H, с).
Пример 434 : 1,22 (3H, т, J=7,3 Гц), 2,38 (3H, с), 3,32 (2H, к, J= 7,3 Гц), 4,17 (2H, с), 7,15 (1H, с), 7,20 (1H, с), 7,26 (1H, с).
Пример 434Синтез ди-т-бутилового эфира N-(2-бензиламино-5-нитрофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 263, как исходное вещество и, кроме того, используя бензиламин в качестве реагента, по методике, аналогичной Примеру 264, получают названное соединение (выход 71%). 1H-ЯМР (CDCl3),  : 1,46 (18H, с), 4,45-4,48 (2H, м), 4,75 (2H, с), 6,42-6,55 (1H, м), 7,13-7,39 (5H, м), 7,97-8,09 (1H, м), 8,17-8,23 (1H, м).
Пример 435 : 1,46 (18H, с), 4,45-4,48 (2H, м), 4,75 (2H, с), 6,42-6,55 (1H, м), 7,13-7,39 (5H, м), 7,97-8,09 (1H, м), 8,17-8,23 (1H, м).
Пример 435Синтез ди-т-бутилового эфира N-(5-амино-2-бензиламино-фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 434, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 32%). 1H-ЯМР (CDCl3),  : 1,44 (18H, с), 4,31 (2H, с), 4,69 (2H, с), 6,43 (1H, д, J=8,3 Гц), 6,52 (1H, д, J=8,3 Гц), 6,68 (1H, с), 7,19-7,40 (5H, м).
Пример 436 : 1,44 (18H, с), 4,31 (2H, с), 4,69 (2H, с), 6,43 (1H, д, J=8,3 Гц), 6,52 (1H, д, J=8,3 Гц), 6,68 (1H, с), 7,19-7,40 (5H, м).
Пример 436Синтез ди-т-бутилового эфира N-(2-бензиламино-5-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 435, как исходное вещество, по методике, аналогичной Примеру 120, получают названное соединение (выход 32%). 1H-ЯМР (CDCl3),  : 1,45 (18H, с), 4,39 (2H, д, J=5,6 Гц), 4,70 (2H, с), 5,91 (2H, шс), 6,10 (1H, т, J=5,6 Гц), 6,50 (1H, д, J=8,6 Гц), 6,90-6,94 (1H, м), 7,13-7,14 (1H, м), 7,25-7,34 (5H, м), 7,55 (1H, шс).
Пример 437 : 1,45 (18H, с), 4,39 (2H, д, J=5,6 Гц), 4,70 (2H, с), 5,91 (2H, шс), 6,10 (1H, т, J=5,6 Гц), 6,50 (1H, д, J=8,6 Гц), 6,90-6,94 (1H, м), 7,13-7,14 (1H, м), 7,25-7,34 (5H, м), 7,55 (1H, шс).
Пример 437Синтез т-бутилового эфира N-(2-бензиламино-5-(S-этилизотиоуреидо)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 436, как исходное вещество, по методике, аналогичной Примеру 95, получают названное соединение (выход 48%). 1H-ЯМР (CDCl3),  : 1,34 (3H, т, J=7,3 Гц), 1,40 (9H, с), 3,00 (2H, к, J= 7,3 Гц), 4,25 (2H, д, J=6,3 Гц), 4,36 (2H, с), 4,83 (1H, шс), 5,16 (1H, шс), 6,50-6,54 (1H, м), 6,60- 6,75 (2H, м), 7,20-7,39 (5H, м).
Пример 438 : 1,34 (3H, т, J=7,3 Гц), 1,40 (9H, с), 3,00 (2H, к, J= 7,3 Гц), 4,25 (2H, д, J=6,3 Гц), 4,36 (2H, с), 4,83 (1H, шс), 5,16 (1H, шс), 6,50-6,54 (1H, м), 6,60- 6,75 (2H, м), 7,20-7,39 (5H, м).
Пример 438Синтез тригидрохлорида N-(2-бензиламино-5-(S-этилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 437, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 99%). 1H-ЯМР (D2O),  : 1,40 (3H, т, J=7,3 Гц), 3,20 (2H, к, J=7,3 Гц), 4,21 (2H, с), 4,53 (2H, с), 6,88 (1H, д, J=8,6 Гц), 7,20 (1H, дд, J=8,6, 2,6 Гц), 7,26 (1H, д, J=2,6 Гц).
Пример 439 : 1,40 (3H, т, J=7,3 Гц), 3,20 (2H, к, J=7,3 Гц), 4,21 (2H, с), 4,53 (2H, с), 6,88 (1H, д, J=8,6 Гц), 7,20 (1H, дд, J=8,6, 2,6 Гц), 7,26 (1H, д, J=2,6 Гц).
Пример 439Синтез ди-т-бутилового эфира N-(2-бензиламино-5-(N’-т-бутоксикарбонил-N”-этилгуанидино)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 435, как исходное вещество, по методике, аналогичной Примеру 233, получают названное соединение (выход 54%). 1H-ЯМР (CDCl3),  : 1,04 (3H, т, J=7,3 Гц), 1,44 (18H, с), 1,52 (9H, с), 3,30-3,41 (2H, м), 4,38 (2H, д, J=4,6 Гц), 4,53 (1H, шс), 4,69 (2H, с), 5,87 (1H, шс), 6,51 (1H, д, J=8,6 Гц), 6,86-6,94 (1H, м), 7,08-7,13 (1H, м), 7,32-7,35 (5H, м).
Пример 440 : 1,04 (3H, т, J=7,3 Гц), 1,44 (18H, с), 1,52 (9H, с), 3,30-3,41 (2H, м), 4,38 (2H, д, J=4,6 Гц), 4,53 (1H, шс), 4,69 (2H, с), 5,87 (1H, шс), 6,51 (1H, д, J=8,6 Гц), 6,86-6,94 (1H, м), 7,08-7,13 (1H, м), 7,32-7,35 (5H, м).
Пример 440Синтез тригидрохлорида N-(2-бензиламино-5-(N’-этилгуанидино)фенилметил)амина Используя соединение, полученное в Примере 439, как исходное вещество, по методике, аналогичной примеру 5, получают названное соединение (выход 89%) 1H-ЯМР (D2O),  : 1,19 (3H, т, J=7,3 Гц), 3,28 (2H, к, J= 7,3 Гц), 4,16 (2H, с), 4,52 (2H, с), 6,90 (1H, д, J=8,6 Гц), 7,16- 7,24 (2H, м), 7,32-7,48 (5H, м).
Пример 441 : 1,19 (3H, т, J=7,3 Гц), 3,28 (2H, к, J= 7,3 Гц), 4,16 (2H, с), 4,52 (2H, с), 6,90 (1H, д, J=8,6 Гц), 7,16- 7,24 (2H, м), 7,32-7,48 (5H, м).
Пример 441Синтез N-(2-(2-т-бутоксикарбониламиноэтил)фенил)амидиносульфоновой кислоты Используя соединение, полученное в Примере 331, как исходное вещество, по методике, аналогичной Примеру 277, получают названное соединение (выход 86%). 1H-ЯМР (ДМСО-d6),  : 1,36 (9H, с), 2,64 (2H, т, J=6,9 Гц), 3,16 (2H, дт, J= 5,3, 6,9 Гц), 6,72 (1H, т, J=5,3 Гц), 7,12-7,20 (1H, м), 7,28-7,40 (3H, м), 9,48 (1H, шс), 11,29 (1H, шс).
Пример 442 : 1,36 (9H, с), 2,64 (2H, т, J=6,9 Гц), 3,16 (2H, дт, J= 5,3, 6,9 Гц), 6,72 (1H, т, J=5,3 Гц), 7,12-7,20 (1H, м), 7,28-7,40 (3H, м), 9,48 (1H, шс), 11,29 (1H, шс).
Пример 442Синтез N-(2-(N’-этилгуанидино)фенилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 441, как исходное вещество и также используя гидрохлорид этиламина в качестве реагента, по методике, аналогичной Примеру 302, получают названное соединение, количественно. 1H-ЯМР (CDCl3),  : 1,22 (3H, т, J=7,3 Гц), 1,36 (9H, с), 2,75 (2H, т, J= 6,3 Гц), 3,28-3,37 (4H, м), 3,99 (2H, шс), 5,89 (1H, шс), 6,91-7,03 (2H, м), 7,13-7,19 (2H, м).
Пример 443 : 1,22 (3H, т, J=7,3 Гц), 1,36 (9H, с), 2,75 (2H, т, J= 6,3 Гц), 3,28-3,37 (4H, м), 3,99 (2H, шс), 5,89 (1H, шс), 6,91-7,03 (2H, м), 7,13-7,19 (2H, м).
Пример 443Синтез дигидрохлорида N-(2-(N’-этилгуанидино)фенилэтил)амина Используя соединение, полученное в Примере 442, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 90%). 1H-ЯМР (D2O),  : 1,21 (3H, т, J=7,3 Гц), 3,01 (2H, т, J=7,6 Гц), 3,19-3,37 (4H, м), 7,32-7,50 (4H, м).
Пример 444 : 1,21 (3H, т, J=7,3 Гц), 3,01 (2H, т, J=7,6 Гц), 3,19-3,37 (4H, м), 7,32-7,50 (4H, м).
Пример 444Синтез ди-т-бутилового эфира N-(5-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-фторфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 314, как исходное вещество, по методике, аналогичной Примеру 233, получают названное соединение (выход 70%). 1H-ЯМР (CDCl3),  : 1,03-1,08 (3H, м), 1,47 (27H, с), 3,15-3,22 (2H, м), 4,83 (2H, с), 6,99-7,15 (3H, м).
Пример 445 : 1,03-1,08 (3H, м), 1,47 (27H, с), 3,15-3,22 (2H, м), 4,83 (2H, с), 6,99-7,15 (3H, м).
Пример 445Синтез дигидрохлорида N-(5-(N’-этилгуанидино)-2-фторфенилметил)амина Используя соединение, полученное в Примере 414, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 90%). 1H-ЯМР (D2O),  : 1,22 (3H, т, J=7,3 Гц), 3,31 (2H, д, J=7,3 Гц), 4,27 (2H, с), 7,28-7,46 (3H, м).
Пример 446 : 1,22 (3H, т, J=7,3 Гц), 3,31 (2H, д, J=7,3 Гц), 4,27 (2H, с), 7,28-7,46 (3H, м).
Пример 446Синтез ди-т-бутилового эфира N-(2-метиламино-5-нитрофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 263, как исходное вещество и также используя гидрохлорид метиламина в качестве реагента, по методике, аналогичной Примеру 264, получают названное соединение (выход 99%). 1H-ЯМР (CDCl3),  : 1,50 (18H, с), 2,92 (3H, д, J=4,9 Гц), 4,68 (2H, с), 6,50 (1H, д, J=9,3 Гц), 6,72 (1H, шс), 8,08-8,15 (2H, м).
Пример 447 : 1,50 (18H, с), 2,92 (3H, д, J=4,9 Гц), 4,68 (2H, с), 6,50 (1H, д, J=9,3 Гц), 6,72 (1H, шс), 8,08-8,15 (2H, м).
Пример 447Синтез ди-т-бутилового эфира N-(5-амино-2-метиламинофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 446, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 61%). 1H-ЯМР (CDCl3),  : 1,46 (18H, с), 2,78 (3H, с), 3,60 (2H, шс), 4,63 (2H, с), 6,45-6,68 (3H, м).
МС (м/з) 351 (М+) : 1,46 (18H, с), 2,78 (3H, с), 3,60 (2H, шс), 4,63 (2H, с), 6,45-6,68 (3H, м).
МС (м/з) 351 (М+)Пример 448 Синтез ди-т-бутилового эфира N-(5-(N’-т-бутоксикарбонил-N”- этилгуанидино)-2-метиламинофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 447, как исходное вещество, по методике, аналогичной Примеру 233, получают названное соединение (выход 47%). 1H-ЯМР (CDCl3),  : 1,05 (3H, т, J=7,3 Гц), 1,47-1,53 (27H, м), 2,84 (3H, с), 3,35-3,39 (2H, м), 4,63 (2H, с), 5,30 (1H, шс), 6,55 (1H, д, J=8,6 Гц), 6,99-7,07 (2H, м), 10,39 (1H, шс).
Пример 449 : 1,05 (3H, т, J=7,3 Гц), 1,47-1,53 (27H, м), 2,84 (3H, с), 3,35-3,39 (2H, м), 4,63 (2H, с), 5,30 (1H, шс), 6,55 (1H, д, J=8,6 Гц), 6,99-7,07 (2H, м), 10,39 (1H, шс).
Пример 449Синтез тригидрохлорида N-(5-(N’-этилгуанидино)-2-метиламинофенилметил)амина Используя соединение, полученное в Примере 448, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 1,25 (3H, т, J=7,3 Гц), 3,10 (3H, с), 3,35(2H, к, J= 7,3 Гц), 4,36(2H, с), 7,50-7,51 (3H, м).
МС (м/з) 221 (М+) : 1,25 (3H, т, J=7,3 Гц), 3,10 (3H, с), 3,35(2H, к, J= 7,3 Гц), 4,36(2H, с), 7,50-7,51 (3H, м).
МС (м/з) 221 (М+)Пример 450 Синтез ди-т-бутилового эфира N-(2-метиламино-5-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 447, как исходное вещество, по методике, аналогичной Примеру 120, получают названное соединение (выход 61%). 1H-ЯМР (CDCl3),  : 1,48 (18H, с), 2,84 (3H, д, J=3,5 Гц), 4,63 (2H, с), 5,50 (2H, шс), 6,50 (1H, д, J=8,6 Гц), 7,04 (1H, дд, J=8,6, 2,7 Гц), 7,12 (1H, д, J=2,7 Гц), 7,99 (1H, шс).
МС (м/з) 410 (М+) : 1,48 (18H, с), 2,84 (3H, д, J=3,5 Гц), 4,63 (2H, с), 5,50 (2H, шс), 6,50 (1H, д, J=8,6 Гц), 7,04 (1H, дд, J=8,6, 2,7 Гц), 7,12 (1H, д, J=2,7 Гц), 7,99 (1H, шс).
МС (м/з) 410 (М+)Пример 451 Синтез ди-т-бутилового эфира N-(5-(S-этилизотиоуреидо)-2-метиламинофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 450, как исходное вещество, по методике, аналогичной Примеру 95, получают названное соединение (выход 61%). 1H-ЯМР (CDCl3),  : 1,31 (3H, т, J=7,3 Гц), 1,47 (18H, с), 2,82 (3H, с), 3,01 (2H, к, J=7,3 Гц), 4,64 (2H, с), 6,55 (1H, д, J=7,6 Гц), 6,81-6,88 (2H, м).
МС (м/з) 438 (М+) : 1,31 (3H, т, J=7,3 Гц), 1,47 (18H, с), 2,82 (3H, с), 3,01 (2H, к, J=7,3 Гц), 4,64 (2H, с), 6,55 (1H, д, J=7,6 Гц), 6,81-6,88 (2H, м).
МС (м/з) 438 (М+)Пример 452 Синтез тригидрохлорида N-(5-(S-этилизотиоуреидо)-2-метиламинофенилметил)амина Используя соединение, полученное в Примере 451, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 1,42 (3H, т, J=7,3 Гц), 3,04 (3H, с), 3,25 (2H, к, J= 7,3 Гц), 4,32 (2H, с), 7,40 (1H, д, J=8,6 Гц), 7,49-7,55 (2H, м).
МС (м/з) 238 (М+) : 1,42 (3H, т, J=7,3 Гц), 3,04 (3H, с), 3,25 (2H, к, J= 7,3 Гц), 4,32 (2H, с), 7,40 (1H, д, J=8,6 Гц), 7,49-7,55 (2H, м).
МС (м/з) 238 (М+)Пример 453 Синтез ди-т-бутилового эфира N-(2-этиламино-5-нитрофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 263, как исходное вещество и также используя гидрохлорид этиламина в качестве реагента, по методике, аналогичной Примеру 264, получают названное соединение (выход 52%). 1H-ЯМР (CDCl3),  : 1,33 (3H, т, J=7,3 Гц), 1,50 (18H, с), 3,14-3,34 (2H, м), 5,37 (2H, с), 6,52 (1H, д, J=8,0 Гц), 6,65 (1H, шс), 8,05-8,25 (2H, м).
МС (м/з) 395 (М+) : 1,33 (3H, т, J=7,3 Гц), 1,50 (18H, с), 3,14-3,34 (2H, м), 5,37 (2H, с), 6,52 (1H, д, J=8,0 Гц), 6,65 (1H, шс), 8,05-8,25 (2H, м).
МС (м/з) 395 (М+)Пример 454 Синтез ди-т-бутилового эфира N-(5-амино-2-этиламинофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 453, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 71%). 1H-ЯМР (CDCl3),  : 1,25 (3H, т, J=7,3 Гц), 1,46 (18H, с), 3,07 (2H, к, J=7,3 Гц), 3,55 (2H, шс), 4,64 (2H, с), 6,46-6,67 (3H, м).
МС (м/з) 365 (М+) : 1,25 (3H, т, J=7,3 Гц), 1,46 (18H, с), 3,07 (2H, к, J=7,3 Гц), 3,55 (2H, шс), 4,64 (2H, с), 6,46-6,67 (3H, м).
МС (м/з) 365 (М+)Пример 455 Синтез ди-т-бутилового эфира N-(5-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-этиламинофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 454, как исходное вещество, по методике, аналогичной Примеру 233, получают названное соединение (выход 50%). 1H-ЯМР (CDCl3),  : 1,30 (3H, т, J=7,2 Гц), 1,43- 1,53 (30H, м), 3,11-3,17 (2H, м), 3,34-3,40 (2H, м), 4,45 (1H, шс), 4,64 (2H, с), 5,29 (1H, шс), 6,55 (1H, д, J= 8,5 Гц), 6,98 (1H, дд, J=8,5, 2,7 Гц), 7,07 (1H, д, J=2,7 Гц).
Пример 456 : 1,30 (3H, т, J=7,2 Гц), 1,43- 1,53 (30H, м), 3,11-3,17 (2H, м), 3,34-3,40 (2H, м), 4,45 (1H, шс), 4,64 (2H, с), 5,29 (1H, шс), 6,55 (1H, д, J= 8,5 Гц), 6,98 (1H, дд, J=8,5, 2,7 Гц), 7,07 (1H, д, J=2,7 Гц).
Пример 456Синтез тригидрохлорида N-(2-этиламино-5-(N’-этилгуанидино)фенилметил)амина Используя соединение, полученное в Примере 455, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 89%). 1H-ЯМР (D2O),  : 1,24 (3H, т, J=7,3 Гц), 1,36 (3H, т, J=7,3 Гц), 3,34 (2H, к, J=7,3 Гц), 3,48 (2H, к, J=7,3 Гц), 4,44 (2H, с), 7,50-7,52 (3H, м).
МС (м/з) 235 (М+) : 1,24 (3H, т, J=7,3 Гц), 1,36 (3H, т, J=7,3 Гц), 3,34 (2H, к, J=7,3 Гц), 3,48 (2H, к, J=7,3 Гц), 4,44 (2H, с), 7,50-7,52 (3H, м).
МС (м/з) 235 (М+)Пример 457 Синтез ди-т-бутилового эфира N-(2-этиламино-5-тио уреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 454, как исходное вещество, по методике, аналогичной Примеру 120, получают названное соединение (выход 55%). 1H-ЯМР (CDCl3),  : 1,29 (3H, т, J=7,3 Гц), 1,47 (18H, с), 3,14 (2H, к, J= 7,3 Гц), 4,64 (2H, с), 5,90 (2H, шс), 6,56 (1H, д, J=8,6 Гц), 6,98-7,12 (2H, м), 7,55 (1H, шс).
МС (м/з) 424 (М+) : 1,29 (3H, т, J=7,3 Гц), 1,47 (18H, с), 3,14 (2H, к, J= 7,3 Гц), 4,64 (2H, с), 5,90 (2H, шс), 6,56 (1H, д, J=8,6 Гц), 6,98-7,12 (2H, м), 7,55 (1H, шс).
МС (м/з) 424 (М+)Пример 458 Синтез ди-т-бутилового эфира N-(2-этилaминo-(S-этилизотиоуреидо)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 457, как исходное вещество, по методике, аналогичной Примеру 95, получают названное соединение (выход 60%). 1H-ЯМР (CDCl3),  : 1,28 (3H, т, J=7,3 Гц), 1,34 (3H, т, J=7,3 Гц), 1,47 (18H, с), 3,01 (2H, к, J=7,3 Гц), 3,12 (2H, к, J=7,3 Гц), 4,66 (1H, д, J=8,3 Гц), 6,55 (1H, д, J=8,3 Гц), 6,79 (1H, дд, J=8,3, 2,4 Гц), 6,86 (1H, д, J= 2,4 Гц).
МС (м/з) 453 (М+) : 1,28 (3H, т, J=7,3 Гц), 1,34 (3H, т, J=7,3 Гц), 1,47 (18H, с), 3,01 (2H, к, J=7,3 Гц), 3,12 (2H, к, J=7,3 Гц), 4,66 (1H, д, J=8,3 Гц), 6,55 (1H, д, J=8,3 Гц), 6,79 (1H, дд, J=8,3, 2,4 Гц), 6,86 (1H, д, J= 2,4 Гц).
МС (м/з) 453 (М+)Пример 459 Синтез тригидрохлорида N-(2-этиламино-(S-этилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 458, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 63%). 1H-ЯМР (D2O),  : 1,31 (3H, т, J=7,3 Гц), 1,41 (3H, т, J=7,3 Гц), 3,23 (2H, к, J=7,3 Гц), 3,32-3,42 (2H, м), 4,28 (2H, с), 7,30-7,49 (3H, м).
МС (м/з) 252 (М+) : 1,31 (3H, т, J=7,3 Гц), 1,41 (3H, т, J=7,3 Гц), 3,23 (2H, к, J=7,3 Гц), 3,32-3,42 (2H, м), 4,28 (2H, с), 7,30-7,49 (3H, м).
МС (м/з) 252 (М+)Пример 460 Синтез ди-т-бутилового эфира N-(2-этил-5-нитрофенилметил)иминодикарбоновой кислоты Используя 3-хлорметил-4-этилнитробензол, как исходное вещество, по методике, аналогичной Примеру 127, получают названное соединение (выход 72%). 1H-ЯМР (CDCl3),  : 1,28 (3H, т, J=7,4 Гц), 1,49 (18H, с), 2,76 (2H, к, J=7,4 Гц), 4,88 (2H, с), 7,33 (1H, д, J=8,3 Гц), 7,99-8,10 (2H, м).
Пример 461 : 1,28 (3H, т, J=7,4 Гц), 1,49 (18H, с), 2,76 (2H, к, J=7,4 Гц), 4,88 (2H, с), 7,33 (1H, д, J=8,3 Гц), 7,99-8,10 (2H, м).
Пример 461Синтез ди-т-бутилового эфира N-(5-амино-2-этилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 460, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 99%). 1H-ЯМР (CDCl3),  : 1,16 (3H, т, J=7,3 Гц), 1,44 (18H, с), 2,54 (2H, к, J=7,3 Гц), 4,77 (2H, шс), 6,45-6,60 (2H, м), 6,95 (1H, д, J=8,3 Гц).
МС (м/з) 350 (М+) : 1,16 (3H, т, J=7,3 Гц), 1,44 (18H, с), 2,54 (2H, к, J=7,3 Гц), 4,77 (2H, шс), 6,45-6,60 (2H, м), 6,95 (1H, д, J=8,3 Гц).
МС (м/з) 350 (М+)Пример 462 Синтез ди-т-бутилового эфира N-(2-этил-5-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 461, как исходное вещество, по методике, аналогичной Примеру 120, получают названное соединение (выход 87%). 1H-ЯМР (CDCl3),  : 1,23 (3H, т, J=7,5 Гц), 1,47 (18H, с), 2,65 (2H, к, J= 7,5 Гц), 4,81 (2H, с), 6,11 (2H, сш), 7,00 (1H, д, J=l,8 Гц), 7,04 (1H, дд, J=8,0, 1,8 Гц), 7,23 (1H, д, J=8,0 Гц), 7,99 (1H, шс).
Пример 463 : 1,23 (3H, т, J=7,5 Гц), 1,47 (18H, с), 2,65 (2H, к, J= 7,5 Гц), 4,81 (2H, с), 6,11 (2H, сш), 7,00 (1H, д, J=l,8 Гц), 7,04 (1H, дд, J=8,0, 1,8 Гц), 7,23 (1H, д, J=8,0 Гц), 7,99 (1H, шс).
Пример 463Синтез ди-т-бутилового эфира N-(5-(S-этилизотиоуреидо)-2-этилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 462, как исходное вещество, по методике, аналогичной Примеру 95, получают названное соединение (выход 76%). 1H-ЯМР (CDCl3),  : 1,19 (3H, т, J=7,3 Гц), 1,28-1,34 (3H, м), 1,43 (18H, с), 2,61 (2H, к, J=7,3 Гц), 3,00- 3,10 (2H, м), 4,80 (2H, с), 6,67-7,10 (3H, м).
МС (м/з) 437 (М+) : 1,19 (3H, т, J=7,3 Гц), 1,28-1,34 (3H, м), 1,43 (18H, с), 2,61 (2H, к, J=7,3 Гц), 3,00- 3,10 (2H, м), 4,80 (2H, с), 6,67-7,10 (3H, м).
МС (м/з) 437 (М+)Пример 464 Синтез дигидрохлорида ди-т-бутилового эфира N-(5-(S-этилизотиоуреидо)-2-этилфенилметил)амина Используя соединение, полученное в Примере 463, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 77%). 1H-ЯМР (D2O),  : 1,23 (3H, т, J=7,4 Гц), 1,42 (3H, т, J=7,4 Гц), 2,74 (2H, к, J=7,4 Гц), 3,25 (2H, к, J=7,4 Гц), 4,29 (2H, с), 7,34-7,41 (2H, м), 7,52 (1H, д, J=8,2 Гц).
MC (м/з) 237 (М+) : 1,23 (3H, т, J=7,4 Гц), 1,42 (3H, т, J=7,4 Гц), 2,74 (2H, к, J=7,4 Гц), 3,25 (2H, к, J=7,4 Гц), 4,29 (2H, с), 7,34-7,41 (2H, м), 7,52 (1H, д, J=8,2 Гц).
MC (м/з) 237 (М+)Пример 465 Синтез ди-т-бутилового эфира N-(5-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-этилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 461, как исходное вещество, по методике, аналогичной Примеру 233, получают названное соединение (выход 80%). 1H-ЯМР (CDCl3),  : 1,08 (3H, т, J=7,3 Гц), 1,26 (3H, т, J=7,5 Гц), 1,43-1,69 (27H, м), 2,66 (2H, к, J=7,3 Гц), 3,39 (2H, к, J=7,5 Гц), 4,81 (2H, с), 6,96-7,27 (3H, м), 10,61 (1H, шс).
Пример 466 : 1,08 (3H, т, J=7,3 Гц), 1,26 (3H, т, J=7,5 Гц), 1,43-1,69 (27H, м), 2,66 (2H, к, J=7,3 Гц), 3,39 (2H, к, J=7,5 Гц), 4,81 (2H, с), 6,96-7,27 (3H, м), 10,61 (1H, шс).
Пример 466Синтез дигидрохлорида N-(2-этил-5-(N’-этилгуанидино)фенилметил)амина Используя соединение, полученное в Примере 465, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 89%). 1H-ЯМР (D2O),  : 1,19-1,25 (6H, м), 2,74 (2H, к, J=7,5 Гц), 3,10 (2H, к, J=7,3 Гц), 4,27 (2H, с), 7,29-7,34 (2H, м), 7,45 (1H, д, J=7,9 Гц).
МС (м/з) 221 (M++1) : 1,19-1,25 (6H, м), 2,74 (2H, к, J=7,5 Гц), 3,10 (2H, к, J=7,3 Гц), 4,27 (2H, с), 7,29-7,34 (2H, м), 7,45 (1H, д, J=7,9 Гц).
МС (м/з) 221 (M++1)Пример 467 Синтез ди-т-бутилового эфира N-(2-метил-5-нитрофенилметил)иминодикарбоновой кислоты Используя 3-хлорметил-4-метилнитробензол, как исходное вещество, по методике, аналогичной Примеру 127, получают названное соединение (выход 37%). 1H-ЯМР (CDCl3),  : 1,49 (18H, с), 2,42 (3H, с), 4,83 (2H, с), 7,27-7,32 (1H, м), 7,99-8,03 (2H, м).
Пример 468 : 1,49 (18H, с), 2,42 (3H, с), 4,83 (2H, с), 7,27-7,32 (1H, м), 7,99-8,03 (2H, м).
Пример 468Синтез ди-т-бутилового эфира N- (5-амино-2-метилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 467, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 82%). 1H-ЯМР (CDCl3),  : 1,44 (18H, с), 2,18 (3H, с), 3,51 (2H, шс), 4,71 (2H, с), 6,47-6,52 (2H, м), 6,85 (1H, д, J=8,1 Гц).
Пример 469 : 1,44 (18H, с), 2,18 (3H, с), 3,51 (2H, шс), 4,71 (2H, с), 6,47-6,52 (2H, м), 6,85 (1H, д, J=8,1 Гц).
Пример 469Синтез ди-т-бутилового эфира N-(2-метил-5-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 468, как исходное вещество, по методике, аналогичной Примеру 120, получают названное соединение (выход 99%). 1H-ЯМР (CDCl3),  : 1,48 (18H, с), 2,30 (3H, с), 4,75 (2H, с), 6,04 (2H, шс), 6,95-7,01 (2H, м), 7,24 (1H, д, J=7,3 Гц), 7,83 (1H, шс).
МС (м/з) 396 (М+) : 1,48 (18H, с), 2,30 (3H, с), 4,75 (2H, с), 6,04 (2H, шс), 6,95-7,01 (2H, м), 7,24 (1H, д, J=7,3 Гц), 7,83 (1H, шс).
МС (м/з) 396 (М+)Пример 470 Синтез ди-т-бутилового эфира N-(5-(S-этилизотиоуреидо)-2-метилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 469, как исходное вещество, по методике, аналогичной Примеру 95, получают названное соединение (выход 87%). 1H-ЯМР (CDCl3),  : 1,36 (3H, т, J=7,3 Гц), 1,44 (18H, с), 2,25 (3H, с), 2,95-3,05 (2H, м), 4,74 (2H, с), 6,63-6,75 (2H, м), 7,05 (1H, д, J=7,9 Гц).
МС (м/з) 424 (М+) : 1,36 (3H, т, J=7,3 Гц), 1,44 (18H, с), 2,25 (3H, с), 2,95-3,05 (2H, м), 4,74 (2H, с), 6,63-6,75 (2H, м), 7,05 (1H, д, J=7,9 Гц).
МС (м/з) 424 (М+)Пример 471 Синтез дигидрохлорида N-(5-(S-этилизотиоуреидо)-2-метилфенилметил)амина Используя соединение, полученное в Примере 470, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 83%). 1H-ЯМР (D2O),  : 1,42 (3H, т, J=7,3 Гц), 2,43 (3H, с), 3,25 (2H, к, J= 7,3 Гц), 4,28 (2H, с), 7,31-7,50 (3H, м).
МС (м/з) 223 (М+) : 1,42 (3H, т, J=7,3 Гц), 2,43 (3H, с), 3,25 (2H, к, J= 7,3 Гц), 4,28 (2H, с), 7,31-7,50 (3H, м).
МС (м/з) 223 (М+)Пример 472 Синтез ди-т-бутилового эфира N-(5-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-метилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 471, как исходное вещество, по методике, аналогичной Примеру 233, получают названное соединение (выход 55%). 1H-ЯМР (CDCl3),  : 1,07 (3H, т, J=7,0 Гц), 1,44-1,53 (27H, м), 2,30 (3H, с), 3,31-3,45 (2H, м), 4,65 (1H, шс), 4,75 (2H, с), 6,95-7,20 (3H, м).
МС (м/з) 507 (М++1) : 1,07 (3H, т, J=7,0 Гц), 1,44-1,53 (27H, м), 2,30 (3H, с), 3,31-3,45 (2H, м), 4,65 (1H, шс), 4,75 (2H, с), 6,95-7,20 (3H, м).
МС (м/з) 507 (М++1)Пример 473 Синтез дигидрохлорида N-(5-(N’-этилгуанидино)-2-метилфенилметил)амина Используя соединение, полученное в Примере 472, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 85%). 1H-ЯМР (D2O),  : 1,23 (3H, т, J=7,4 Гц), 2,71 (3H, с), 3,31 (2H, к, J= 7,4 Гц), 4,24 (2H, с), 7,24-7,29 (2H, м), 7,39-7,44 (1H, м).
МС (м/з) 206 (М+) : 1,23 (3H, т, J=7,4 Гц), 2,71 (3H, с), 3,31 (2H, к, J= 7,4 Гц), 4,24 (2H, с), 7,24-7,29 (2H, м), 7,39-7,44 (1H, м).
МС (м/з) 206 (М+)Пример 474 Синтез N-(3-метокси-4-метилфенил)фталимида Используя 3-метокси-4-метиланилин, как исходное вещество, по методике, аналогичной Примеру 248, получают 1,55 г названного соединения (выход 14%). 1H-ЯМР (CDCl3),  : 2,26 (3H, с), 3,85 (3H, с), 6,82-6,95 (2H, м), 7,21-7,30 (1H, м), 7,77-7,81 (2H, м), 7,94-7,97 (2H, м).
Пример 475 : 2,26 (3H, с), 3,85 (3H, с), 6,82-6,95 (2H, м), 7,21-7,30 (1H, м), 7,77-7,81 (2H, м), 7,94-7,97 (2H, м).
Пример 475Синтез N-(4-бромметил-3-метоксифенил)фталимида Используя соединение, полученное в Примере 474, как исходное вещество, по методике, аналогичной Примеру 249, получают 80 мг названного соединения (выход 74%). 1H-ЯМР (CDCl3),  : 3,93 (3H, с), 4,58 (2H, с), 6,96-7,10 (2H, м), 7,42-7,50 (1H, м), 7,79-7,82 (2H, м), 7,95-7,98 (2H, м).
Пример 476 : 3,93 (3H, с), 4,58 (2H, с), 6,96-7,10 (2H, м), 7,42-7,50 (1H, м), 7,79-7,82 (2H, м), 7,95-7,98 (2H, м).
Пример 476Синтез N-(4-цианометил-3-метоксифенил)фталимида Используя соединение, полученное в Примере 475, как исходное вещество, по методике, аналогичной Примеру 250, получают 26 мг названного соединения (выход 42%). 1H-ЯМР (CDCl3),  : 3,73 (2H, с), 3,90 (3H, с), 7,01-7,14 (2H, м), 7,48-7,53 (1H, м), 7,80-7,83 (2H, м), 7,96-7,99 (2H, м).
Пример 477 : 3,73 (2H, с), 3,90 (3H, с), 7,01-7,14 (2H, м), 7,48-7,53 (1H, м), 7,80-7,83 (2H, м), 7,96-7,99 (2H, м).
Пример 477Синтез 4-цианометил-3-метоксианилина Используя соединение, полученное в Примере 476, в качестве исходного вещества, по методике, аналогичной Примеру 251, получают 640 мг названного соединения (выход 94%). 1H-ЯМР(CDCl3),  : 3,55 (2H, с), 3,75 (2H, шс), 3,80 (3H, с), 6,18-6,35 (2H, м), 7,00-7,14 (1H, м).
Пример 478 : 3,55 (2H, с), 3,75 (2H, шс), 3,80 (3H, с), 6,18-6,35 (2H, м), 7,00-7,14 (1H, м).
Пример 478Синтез 4-(2-аминоэтил)-3-метоксианилина Используя соединение, полученное в Примере 477, в качестве исходного вещества, по методике, аналогичной Примеру 252, получают 608 мг названного соединения (выход 93%). 1H-ЯМР(CDCl3),  : 1,68 (2H, шс), 2,64 (2H, т, J=6,9 Гц), 2,84 (2H, т, J= 6,9 Гц), 3,61 (2H, шс), 3,76 (3H, с), 6,18-6,26 (2H, м), 6,84-6,95 (1H, м).
Пример 479 : 1,68 (2H, шс), 2,64 (2H, т, J=6,9 Гц), 2,84 (2H, т, J= 6,9 Гц), 3,61 (2H, шс), 3,76 (3H, с), 6,18-6,26 (2H, м), 6,84-6,95 (1H, м).
Пример 479Синтез т-бутилового эфира N-(2-(4-амино-2-метоксифенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 478, как исходное вещество, по методике, аналогичной Примеру 253, получают 253 мг названного соединения (выход 31%). 1H-ЯМР (CDCl3),  : 1,43 (9H, с), 2,68 (2H, т, J=6,9 Гц), 3,20-3,35 (2H, м), 3,62 (2H, шс), 3,77 (3H, с), 4,63 (1H, шс), 6,20-6,25 (2H, м), 6,82-6,92 (1H, м).
Пример 480 : 1,43 (9H, с), 2,68 (2H, т, J=6,9 Гц), 3,20-3,35 (2H, м), 3,62 (2H, шс), 3,77 (3H, с), 4,63 (1H, шс), 6,20-6,25 (2H, м), 6,82-6,92 (1H, м).
Пример 480Синтез т-бутилового эфира N-(2-(2-метокси-4-тиоуреидофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 479, как исходное вещество, по методике, аналогичной Примеру 120, получают 70 мг названного соединения (выход 91%). 1H-ЯМР (CDCl3),  : 1,42 (9H, с), 2,79 (2H, т, J=6,9 Гц), 3,25-3,40 (2H, м), 3,82 (3H, с), 4,60 (1H, шс), 6,12 (2H, ш), 6,71-6,79 (2H, м), 7,16-7,18 (1H, м), 7,93 (1H, с).
Пример 481 : 1,42 (9H, с), 2,79 (2H, т, J=6,9 Гц), 3,25-3,40 (2H, м), 3,82 (3H, с), 4,60 (1H, шс), 6,12 (2H, ш), 6,71-6,79 (2H, м), 7,16-7,18 (1H, м), 7,93 (1H, с).
Пример 481Синтез ди-т-бутилового эфира N-(2-(4-(S-этилизотиоуреидо)-2-метоксифенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 480, как исходное вещество, по методике, аналогичной Примеру 95, получают 50 мг названного соединения (выход 66%). 1H-ЯМР (CDCl3),  : 1,37 (3H, т, J=7,3 Гц), 1,43 (9H, с), 2,75 (2H, т, J= 6,6 Гц), 2,95-3,20 (2H, м), 3,20-3,38 (2H, м), 3,79 (3H, с), 4,54 (1H, шс), 4,61 (1H, шс), 6,38-6,60 (2H, м), 7,00-7,05 (1H, м).
Пример 482 : 1,37 (3H, т, J=7,3 Гц), 1,43 (9H, с), 2,75 (2H, т, J= 6,6 Гц), 2,95-3,20 (2H, м), 3,20-3,38 (2H, м), 3,79 (3H, с), 4,54 (1H, шс), 4,61 (1H, шс), 6,38-6,60 (2H, м), 7,00-7,05 (1H, м).
Пример 482Синтез N-(2-(4-(S-этилизотиоуреидо)-2-метоксифенил)этил)амина дигидрохлорида Используя соединение, полученное в Примере 481, как исходное вещество, по методике, аналогичной Примеру 5, получают 45 мг названного соединения (выход 81%). 1H-ЯМР (D2O),  : 1,42 (3H, т, J=7,3 Гц), 3,03 (2H, т, J=6,9 Гц), 3,19-3,28 (4H, м), 3,88 (3H, с), 6,95-7,00 (2H, м), 7,36-7,39 (1H, м).
Пример 483 : 1,42 (3H, т, J=7,3 Гц), 3,03 (2H, т, J=6,9 Гц), 3,19-3,28 (4H, м), 3,88 (3H, с), 6,95-7,00 (2H, м), 7,36-7,39 (1H, м).
Пример 483Синтез т-бутилового эфира N-(2-(4-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-метоксифенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 479, как исходное вещество, по методике, аналогичной Примеру 233, получают 118 мг названного соединения (выход 95%). 1H-ЯМР (CDCl3),  : 1,19 (3H, т, J=7,3 Гц), 1,43 (9H, с), 1,52 (9H, с), 2,78 (2H, т, J= 6,6 Гц), 3,32-3,44 (4H, м), 3,80 (3H, с), 4,62 (1H, шс), 6,56-6,90 (2H, м), 7,30-7,80 (1H, м), 8,02 (1H, шс).
Пример 484 : 1,19 (3H, т, J=7,3 Гц), 1,43 (9H, с), 1,52 (9H, с), 2,78 (2H, т, J= 6,6 Гц), 3,32-3,44 (4H, м), 3,80 (3H, с), 4,62 (1H, шс), 6,56-6,90 (2H, м), 7,30-7,80 (1H, м), 8,02 (1H, шс).
Пример 484Синтез дигидрохлорида N-(2-(4-(N’-этилгуанидино)-2-метоксифенил)этил)амина Используя соединение, полученное в Примере 483, как исходное вещество, по методике, аналогичной примеру 5, получают 72 мг названного соединения, количественно. 1H-ЯМР (D2O),  : 1,23 (3H, т, J=7,3 Гц), 3,01 (2H, т, J=6,9 Гц), 3,22-3,61 (4H, м), 3,87 (3H, с), 6,89-6,96 (2H, м), 7,30-7,33 (1H, м).
Пример 485 : 1,23 (3H, т, J=7,3 Гц), 3,01 (2H, т, J=6,9 Гц), 3,22-3,61 (4H, м), 3,87 (3H, с), 6,89-6,96 (2H, м), 7,30-7,33 (1H, м).
Пример 485Синтез N-(2-метокси-4-метилфенил)фталимида Используя 2-метокси-4-метиланилин как исходное вещество, по методике, аналогичной Примеру 248, получают 4,46 г названного соединения (выход 11%). 1H-ЯМР (CDCl3),  : 2,41 (3H, с), 3,77 (3H, с), 6,86-6,90 (2H, м), 7,11-7,14 (1H, м), 7,75-7,78 (2H, м), 7,89-7,95 (2H, м).
Пример 486 : 2,41 (3H, с), 3,77 (3H, с), 6,86-6,90 (2H, м), 7,11-7,14 (1H, м), 7,75-7,78 (2H, м), 7,89-7,95 (2H, м).
Пример 486Синтез N-(4-бромметил-2-метоксифенил)фталимида Используя соединение, полученное в Примере 485, как исходное вещество, по методике, аналогичной Примеру 249, получают 4,46 г названного соединения (выход 76%). 1H-ЯМР (CDCl3),  : 3,82 (3H, с), 4,52 (2H, с), 7,08-7,24 (3H, м), 7,76-7,80 (2H, м), 7,93-7,96 (2H, м).
Пример 487 : 3,82 (3H, с), 4,52 (2H, с), 7,08-7,24 (3H, м), 7,76-7,80 (2H, м), 7,93-7,96 (2H, м).
Пример 487Синтез N-(4-цианометил-2-метоксифенил)фталимида Используя соединение, полученное в Примере 486, как исходное вещество, по методике, аналогичной Примеру 250, получают 2,0 г названного соединения (выход 50%). 1H-ЯМР (CDCl3),  : 3,83 (5H, с), 7,02-7,29 (3H, м), 7,77-7,81 (2H, м), 7,93-7,96 (2H, м).
Пример 488 : 3,83 (5H, с), 7,02-7,29 (3H, м), 7,77-7,81 (2H, м), 7,93-7,96 (2H, м).
Пример 488Синтез 4-цианометил-2-метоксианилина Используя соединение, полученное в Примере 487, как исходное вещество, по методике, аналогичной Примеру 251, получают 844 мг названного соединения (выход 77%). 1H-ЯМР (CDCl3),  : 3,65 (2H, с), 3,70-3,95 (5H, м), 6,56-6,72 (3H, м).
Пример 489 : 3,65 (2H, с), 3,70-3,95 (5H, м), 6,56-6,72 (3H, м).
Пример 489Синтез 4-(2-аминоэтил)-2-метоксианилина Используя соединение, полученное в Примере 488, как исходное вещество, по методике, аналогичной Примеру 252, получают 230 мг названного соединения (выход 62%). 1H-ЯМР (CDCl3),  : 1,43 (2H, шс), 2,65 (2H, т, J=6,9 Гц), 2,92 (2H, т, J=6,9 Гц), 3,69 (2H, шс), 3,84 (3H, с), 6,61-6,72 (3H, м).
Пример 490 : 1,43 (2H, шс), 2,65 (2H, т, J=6,9 Гц), 2,92 (2H, т, J=6,9 Гц), 3,69 (2H, шс), 3,84 (3H, с), 6,61-6,72 (3H, м).
Пример 490Синтез т-бутилового эфира N-(2-(4-амино-3-метоксифенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 489, как исходное вещество, по методике, аналогичной Примеру 253, получают 95 мг названного соединения (выход 26%). 1H-ЯМР (CDCl3),  : 1,44 (9H, с), 2,69 (2H, т, J=6,9 Гц), 3,28-3,44 (2H, м), 3,84 (3H, с), 4,54 (1H, шс), 6,59-6,72 (3H, м).
Пример 491 : 1,44 (9H, с), 2,69 (2H, т, J=6,9 Гц), 3,28-3,44 (2H, м), 3,84 (3H, с), 4,54 (1H, шс), 6,59-6,72 (3H, м).
Пример 491Синтез т-бутилового эфира N-(2-(3-метокси-4-тиоуреидофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 490, как исходное вещество, по методике, аналогичной Примеру 120, получают 38 мг названного соединения (выход 73%). 1H-ЯМР (CDCl3),  : 1,43 (9H, с), 2,80 (2H, т, J=7,3 Гц), 3,30- 3,44 (2H, м), 3,85 (3H, с), 4,57 (1H, шс), 6,07 (2H, шс), 6,80-6,83 (2H, м), 7,21-7,24 (1H, м), 7,62 (1H, шс).
Пример 492 : 1,43 (9H, с), 2,80 (2H, т, J=7,3 Гц), 3,30- 3,44 (2H, м), 3,85 (3H, с), 4,57 (1H, шс), 6,07 (2H, шс), 6,80-6,83 (2H, м), 7,21-7,24 (1H, м), 7,62 (1H, шс).
Пример 492Синтез т-бутилового эфира N-(2-(4-(S-этилизотиоуреидо)-3-метоксифенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 491, как исходное вещество, по методике, аналогичной Примеру 95, получают 25 мг названного соединения (выход 61%). 1H-ЯМР (CDCl3),  : 1,38 (3H, т, J=7,3 Гц), 1,44 (9H, с), 2,75 (2H, т, J= 6,9 Гц), 2,83-3,14 (2H, м), 3,30-3,42 (2H, м), 3,82 (3H, с), 4,52 (1H, шс), 6,72-6,76 (2H, м), 7,26 (1H, с).
Пример 493 : 1,38 (3H, т, J=7,3 Гц), 1,44 (9H, с), 2,75 (2H, т, J= 6,9 Гц), 2,83-3,14 (2H, м), 3,30-3,42 (2H, м), 3,82 (3H, с), 4,52 (1H, шс), 6,72-6,76 (2H, м), 7,26 (1H, с).
Пример 493Синтез дигидрохлорида N-(2-(4-(S-этилизотиоуреидо)-3-метоксифенил)этил)амина Используя соединение, полученное в Примере 492, как исходное вещество, по методике, аналогичной Примеру 5, получают 19 мг названного соединения (выход 92%). 1H-ЯМР (D2O),  : 1,42 (3H, т, J=7,3 Гц), 3,05 (2H, т, J=7,3 Гц), 3,18-3,34 (4H, м), 3,90 (3H, с), 7,02 (1H, д, J=7,9 Гц), 7,15 (1H, с), 7,30 (1H, д, J=7,9 Гц).
Пример 494 : 1,42 (3H, т, J=7,3 Гц), 3,05 (2H, т, J=7,3 Гц), 3,18-3,34 (4H, м), 3,90 (3H, с), 7,02 (1H, д, J=7,9 Гц), 7,15 (1H, с), 7,30 (1H, д, J=7,9 Гц).
Пример 494Синтез 4-(2-аминоэтил)-2-хлоранилина Используя 2-хлор-4-цианометиланилин как исходное вещество, по методике, аналогичной Примеру 252, получают 614 мг названного соединения, количественно. 1H-ЯМР (CDCl3),  : 1,21 (2H, шс), 2,61 (2H, т, J=6,9 Гц), 2,90 (2H, т, J=6,9 Гц), 3,96 (2H, шс), 6,69-7,09 (3H, м).
Пример 495 : 1,21 (2H, шс), 2,61 (2H, т, J=6,9 Гц), 2,90 (2H, т, J=6,9 Гц), 3,96 (2H, шс), 6,69-7,09 (3H, м).
Пример 495Синтез т-бутилового эфира N-(2-(4-aминo-3-хлopфенил) этил)карбаминовой кислоты Используя соединение, полученное в Примере 494, как исходное вещество, по методике, аналогичной Примеру 253, получают 912 мг названного соединений (выход 94%). 1H-ЯМР (CDCl3),  : 1,44 (9H, с), 2,66 (2H, т, J=6,9 Гц), 3,20-3,40 (2H, м), 3,97 (2H, шс), 4,54 (1H, шс), 6,69- 7,07 (3H, м).
Пример 496 : 1,44 (9H, с), 2,66 (2H, т, J=6,9 Гц), 3,20-3,40 (2H, м), 3,97 (2H, шс), 4,54 (1H, шс), 6,69- 7,07 (3H, м).
Пример 496Синтез т-бутилового эфира N-(2-(3-хлор-4-тиоуреидофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 495, как исходное вещество, по методике, аналогичной Примеру 120, получают 114 мг названного соединения (выход 94%). 1H-ЯМР (CDCl3),  : 1,43 (9H, с), 2,79 (2H, т, J=6,9 Гц), 3,33-3,40 (2H, м), 4,68 (1H, шс), 6,24 (2H, шс), 7,15-7,18 (1H, м), 7,34-7,39 (2H, м), 7,93 (1H, шс).
Пример 497 : 1,43 (9H, с), 2,79 (2H, т, J=6,9 Гц), 3,33-3,40 (2H, м), 4,68 (1H, шс), 6,24 (2H, шс), 7,15-7,18 (1H, м), 7,34-7,39 (2H, м), 7,93 (1H, шс).
Пример 497Синтез т-бутилового эфира N-(2-(3-хлор-4-(S-этилизотиоуреидо)фенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 496, как исходное вещество, по методике, аналогичной примеру 95, получают 118 мг названного соединения (выход 95%). 1H-ЯМР (CDCl3),  : 1,40 (3H, т, J=7,3 Гц), 1,44 (9H, с), 2,73 (2H, т, J= 6,9 Гц), 2,96-3,20 (2H, м), 3,31-3,35 (2H, м), 4,52 (1H, шс), 6,92-7,04 (2H, м), 7,22 (1H, с).
Пример 498 : 1,40 (3H, т, J=7,3 Гц), 1,44 (9H, с), 2,73 (2H, т, J= 6,9 Гц), 2,96-3,20 (2H, м), 3,31-3,35 (2H, м), 4,52 (1H, шс), 6,92-7,04 (2H, м), 7,22 (1H, с).
Пример 498Синтез дигидрохлорида N-(2-(3-хлор-4-(S-этилизотио уреидо)фенил)этил)амина Используя соединение, полученное в Примере 497, как исходное вещество, по методике, аналогичной Примеру 5, получают 95 мг названного соединения, количественно. 1H-ЯМР (D2O),  : 1,44 (3H,т, J=7,3 Гц), 3,07 (2H, т, J=7,3 Гц), 3,22-3,35 (4H, м), 7,40-7,49 (2H, м), 7,62 (1H, с).
Пример 499 : 1,44 (3H,т, J=7,3 Гц), 3,07 (2H, т, J=7,3 Гц), 3,22-3,35 (4H, м), 7,40-7,49 (2H, м), 7,62 (1H, с).
Пример 499Синтез N-(2-фтор-4-метилфенил)фталимида Используя 2-фтор-4-метиланилин как исходное вещество, по методике, аналогичной Примеру 248, получают 8,8 г названного соединения (выход 22%). 1Н-ЯМР (CDCl3),  : 2,42 (3H, с), 7,06-7,26 (3H, м), 7,78-7,81 (2H, м), 7,94-7,97 (2H, м).
Пример 500 : 2,42 (3H, с), 7,06-7,26 (3H, м), 7,78-7,81 (2H, м), 7,94-7,97 (2H, м).
Пример 500Синтез N-(4-бромметил-2-фторфенил)фталимида Используя соединение, полученное в Примере 499, как исходное вещество, по методике, аналогичной Примеру 249, получают 6,0 г названного соединения (выход 92%). 1H-ЯМР (CDCl3), 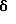 : 4,49 (2H, с), 7,30-7,38 (3H, м), 7,80- 7,83 (2H, м), 7,96-7,99 (2H, м).
Пример 501 : 4,49 (2H, с), 7,30-7,38 (3H, м), 7,80- 7,83 (2H, м), 7,96-7,99 (2H, м).
Пример 501Синтез N-(4-цианометил-2-фторфенил)фталимида Используя соединение, полученное в Примере 500, как исходное вещество, по методике, аналогичной Примеру 250, получают 2,0 г названного соединения (выход 40%). 1H-ЯМР (CDCl3),  : 3,84 (2H, с), 7,27-7,47 (3H, м), 7,79-7,84 (2H, м), 7,96-8,00 (2H, м).
Пример 502 : 3,84 (2H, с), 7,27-7,47 (3H, м), 7,79-7,84 (2H, м), 7,96-8,00 (2H, м).
Пример 502Синтез 4-цианометил-2-фтороанилина Используя соединение, полученное в Примере 501, как исходное вещество, по методике, аналогичной Примеру 251, получают 290 мг названного соединения (выход 95%). 1H-ЯМР (CDCl3),  : 3,62 (2H, с), 3,78 (2H, шс), 6,72-6,97 (3H, м).
Пример 503 : 3,62 (2H, с), 3,78 (2H, шс), 6,72-6,97 (3H, м).
Пример 503Синтез 4-(2-аминоэтил)-2-фторанилина Используя соединение, полученное в Примере 502, как исходное вещество, по методике, аналогичной Примеру 252, получают 290 мг названного соединения (выход 97%). 1H-ЯМР (CDCl3),  : 1,21 (2H, шс), 2,62 (2H, т, J=6,9 Гц), 2,90 (2H, т, J=6,9 Гц), 3,64 (2H, шс), 6,67-6,85 (3H, м).
Пример 504 : 1,21 (2H, шс), 2,62 (2H, т, J=6,9 Гц), 2,90 (2H, т, J=6,9 Гц), 3,64 (2H, шс), 6,67-6,85 (3H, м).
Пример 504Синтез т-бутилового эфира N-(2-(4-амино-3-фторофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 503, как исходное вещество, по методике, аналогичной Примеру 253, получают 290 мг названного соединения (выход 65%). 1H-ЯМР (CDCl3),  : 1,44 (9H, с), 2,67 (2H, т, J=6,9 Гц), 2,65-2,75 (2H, м), 3,64 (2H, шс), 4,53 (1H,шс), 6,68-6,84 (3H, м).
Пример 505 : 1,44 (9H, с), 2,67 (2H, т, J=6,9 Гц), 2,65-2,75 (2H, м), 3,64 (2H, шс), 4,53 (1H,шс), 6,68-6,84 (3H, м).
Пример 505Синтез т-бутилового эфира N-(2-(3-фтор-4-тиоуреидофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 504, как исходное вещество, по методике, аналогичной Примеру 120, получают 88 мг названного соединения (выход 98%). 1H-ЯМР (CDCl3),  : 1,43 (9H, с), 2,80 (2H, т, J=6,9 Гц), 3,33-3,40 (2H, м), 4,62 (1H, шс), 6,15 (2H, шс), 7,03-7,06 (2H, м), 7,29-7,35 (1H, м), 7,74 (1H, шс).
Пример 506 : 1,43 (9H, с), 2,80 (2H, т, J=6,9 Гц), 3,33-3,40 (2H, м), 4,62 (1H, шс), 6,15 (2H, шс), 7,03-7,06 (2H, м), 7,29-7,35 (1H, м), 7,74 (1H, шс).
Пример 506Синтез т-бутилового эфира N-(2-(4-(S-этилизотиоуреидо)-3-фторфенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 505, как исходное вещество, по методике, аналогичной Примеру 95, получают 79 мг названного соединения (выход 83%). 1H-ЯМР (CDCl3),  : 1,37 (3H, т, J=7,3 Гц), 1,44(9H, с), 2,74 (2H, т, J= 6,9 Гц), 2,95-3,20 (2H, м), 3,28-3,44 (2H, м), 4,53 (1H, шс), 6,85-7,00 (3H, м).
Пример 507 : 1,37 (3H, т, J=7,3 Гц), 1,44(9H, с), 2,74 (2H, т, J= 6,9 Гц), 2,95-3,20 (2H, м), 3,28-3,44 (2H, м), 4,53 (1H, шс), 6,85-7,00 (3H, м).
Пример 507Синтез дигидрохлорида N-(2-(4-(S-этилизотиоуреидо)-3-фторфенил)этил) амина Используя соединение, полученное в Примере 506, как исходное вещество, по методике, аналогичной Примеру 5, получают 44 мг названного соединения (выход 64%). 1H-ЯМР (D2O),  : 1,42 (3H, т, J=7,3 Гц), 3,07 (2H, т, J=7,3 Гц), 3,20-3,34 (4H, м), 7,25-7,45 (3H, м).
Пример 508 : 1,42 (3H, т, J=7,3 Гц), 3,07 (2H, т, J=7,3 Гц), 3,20-3,34 (4H, м), 7,25-7,45 (3H, м).
Пример 508Синтез 2-(5-метокси-2-нитрофенил)этиламина К раствору 2-(3-метоксифенил)этиламина (1,51 г) в хлороформе (30 мл), последовательно добавляют по каплям при охлаждении льдом дымящую азотную кислоту (удельная плотность 1,52, 0,84 мл) и серную кислоту (1,07 мл) и перемешивают при охлаждении льдом в течение 3 ч. К реакционной смеси добавляют воду и 2N водный раствор гидроксида натрия и затем экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – хлороформ:метанол=9:1), получая 400 мг названного соединения (выход 21%). 1H-ЯМР (CDCl3),  : 1,51 (2H, шс), 3,00-3,20 (4H, м), 3,89 (3H, с), 6,81-6,84 (2H, м), 8,04-8,08 (1H, м).
Пример 509 : 1,51 (2H, шс), 3,00-3,20 (4H, м), 3,89 (3H, с), 6,81-6,84 (2H, м), 8,04-8,08 (1H, м).
Пример 509Синтез т-бутилового эфира N-(2-(5-метокси-2-нитрофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 508, как исходное вещество, по методике, аналогичной Примеру 22, получают 448 мг названного соединения (выход 74%). 1H-ЯМР (CDCl3),  : 1,43 (9H, с), 3,14 (2H, т, J=6,9 Гц), 3,42-3,50 (2H, м), 3,88 (3H, с), 4,73 (1H, mс), 6,82- 6,86 (2H, м), 8,05-8,08 (1H, м).
Пример 510 : 1,43 (9H, с), 3,14 (2H, т, J=6,9 Гц), 3,42-3,50 (2H, м), 3,88 (3H, с), 4,73 (1H, mс), 6,82- 6,86 (2H, м), 8,05-8,08 (1H, м).
Пример 510Синтез т-бутилового эфира N-(2-(2-амино-5-метоксифенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 509, как исходное вещество, по методике, аналогичной Примеру 2, получают 300 мг названного соединения (выход 75%). 1H-ЯМР (CDCl3),  : 1,45 (9H, с), 2,70 (2H, т, J=6,9 Гц), 3,27-3,35 (2H, м), 3,74 (3H, с), 4,82 (1H, шс), 6,62- 6,64 (3H, м).
Пример 511 : 1,45 (9H, с), 2,70 (2H, т, J=6,9 Гц), 3,27-3,35 (2H, м), 3,74 (3H, с), 4,82 (1H, шс), 6,62- 6,64 (3H, м).
Пример 511Синтез т-бутилового эфира N-(2-(5-метокси-2-тиоуреидо-фенил)этил) карбаминовой кислоты Используя соединение, полученное в Примере 510, как исходное вещество, по методике, аналогичной Примеру 120, получают 170 мг названного соединения, количественно. 1H-ЯМР (CDCl3),  : 1,34 (9H, с), 2,76 (2H, т, J=6,9 J Гц), 3,28-3,40 (2H, м), 3,79 (3H, с), 4,82 (1H, шс), 6,32 (2H, шс), 6,78-6,81 (2H, м), 7,15-7,27 (1H, м), 8,03 (1H, шс).
Пример 512 : 1,34 (9H, с), 2,76 (2H, т, J=6,9 J Гц), 3,28-3,40 (2H, м), 3,79 (3H, с), 4,82 (1H, шс), 6,32 (2H, шс), 6,78-6,81 (2H, м), 7,15-7,27 (1H, м), 8,03 (1H, шс).
Пример 512Синтез т-бутилового эфира N-(2-(2-(S-этилизотиоуреидо)-5-метоксифенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 511, как исходное вещество, по методике, аналогичной Примеру 95, получают 54 мг названного соединения (выход 82%). 1H-ЯМР (CDCl3),  : 1,37 (3H, т, J=7,3 Гц), 1,40 (9H, с), 2,67 (2H, т, J= 6,6 Гц), 3,00-3,20 (2H, м), 3,28-3,40 (2H, м), 3,77 (3H, с), 5,30 (1H, шс), 6,70-6,81 (3H, м).
Пример 513 : 1,37 (3H, т, J=7,3 Гц), 1,40 (9H, с), 2,67 (2H, т, J= 6,6 Гц), 3,00-3,20 (2H, м), 3,28-3,40 (2H, м), 3,77 (3H, с), 5,30 (1H, шс), 6,70-6,81 (3H, м).
Пример 513Синтез дигидрохлорида N-(2-(2-(S-этилизотиоуреидо)-5- метоксифенил)этил)амина Используя соединение, полученное в Примере 512, как исходное вещество, по методике, аналогичной Примеру 5, получают 52 мг названного соединения, количественно. 1H-ЯМР (D2O),  : 1,40-1,50 (3H, м), 2,94 (2H, т, J=7,6 Гц), 3,19-3,25 (4H, м), 3,87 (3H, с), 7,00-7,10 (2H, м), 7,30-7,34 (1H, м).
Пример 514 : 1,40-1,50 (3H, м), 2,94 (2H, т, J=7,6 Гц), 3,19-3,25 (4H, м), 3,87 (3H, с), 7,00-7,10 (2H, м), 7,30-7,34 (1H, м).
Пример 514Синтез т-бутилового эфира N-(2-(5-метокси-2-(N’-нитрогуанидино)фенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 510, как исходное вещество, по методике, аналогичной Примеру 6, получают 59 мг названного соединения (выход 57%). 1H-ЯМР (CDCl3),  : 1,29 (9H, с), 2,77 (2H, т, J=6,3 Гц), 3,30-3,37 (2H, м), 3,81 (3H, с), 4,78 (1H, шс), 6,79-6,85 (2H, м), 7,19-7,22 (1H, м).
Пример 515 : 1,29 (9H, с), 2,77 (2H, т, J=6,3 Гц), 3,30-3,37 (2H, м), 3,81 (3H, с), 4,78 (1H, шс), 6,79-6,85 (2H, м), 7,19-7,22 (1H, м).
Пример 515Синтез гидрохлорида N-(2-(5-метокси-2-(N’-нитрогуанидино)фенил)этил)амина Используя соединение, полученное в Примере 514, как исходное вещество, по методике, аналогичной Примеру 5, получают 45 мг названного соединения, количественно. 1H-ЯМР (D2O),  : 2,97 (2H, т, J=7,9 Гц), 3,22 (2H, т, J=7,9 Гц), 3,87 (3H, с), 7,00-7,06 (2H, м), 7,31-7,34 (1H, м).
Пример 516 : 2,97 (2H, т, J=7,9 Гц), 3,22 (2H, т, J=7,9 Гц), 3,87 (3H, с), 7,00-7,06 (2H, м), 7,31-7,34 (1H, м).
Пример 516Синтез т-бутилового эфира N-(2-(2-(N’-т-бутоксикарбонил-N”-этилгуанидино)-5-метоксифенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 510, как исходное вещество, по методике, аналогичной Примеру 233, получают 112 мг названного соединения (выход 90%). 1H-ЯМР (CDCl3),  : 0,96-1,18 (3H, м), 1,35 (9H, с), 1,54, (9H, с), 2,70-2,72 (2H, м), 3,28-3,41 (4H, м), 3,79 (3H, с), 4,67 (1H, шс), 6,70-6,82 (2H, м), 7,02-7,20 (1H, м), 8,02 (1H, шс).
Пример 517 : 0,96-1,18 (3H, м), 1,35 (9H, с), 1,54, (9H, с), 2,70-2,72 (2H, м), 3,28-3,41 (4H, м), 3,79 (3H, с), 4,67 (1H, шс), 6,70-6,82 (2H, м), 7,02-7,20 (1H, м), 8,02 (1H, шс).
Пример 517Синтез дигидрохлорида N-(2-(2-(N’-этилгуанидино)-5-метоксифенил)этил)амина Используя соединение, полученное в Примере 516, как исходное вещество, по методике, аналогичной Примеру 5, получают 70 мг названного соединения (выход 94%). 1H-ЯМР (D2O),  : 1,21 (3H, т, J=7,3 Гц), 2,96 (2H, т, J=7,6 Гц), 3,20-3,34 (4H, м), 3,87 (3H, с), 7,00-7,10(2H, м), 7,28-7,32 (1H, м).
Пример 518 : 1,21 (3H, т, J=7,3 Гц), 2,96 (2H, т, J=7,6 Гц), 3,20-3,34 (4H, м), 3,87 (3H, с), 7,00-7,10(2H, м), 7,28-7,32 (1H, м).
Пример 518Синтез т-бутилового эфира N-(4-гидроксиметил-2-метилфенил)карбаминовой кислоты Литийалюминийгидрид (5,02 г) суспендируют в тетрагидрофуране (300 мл). К суспензии медленно при комнатной температуре добавляют 4-амино-3-метилбензойную кислоту (10,53 г) и реакционную смесь кипятят с обратным холодильником в течение 3 ч. После добавления этилацетата и воды реакционную смесь перемешивают в течение 30 мин и затем добавляют Целит и безводный сульфат натрия. Полученную реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении, получая неочищенный продукт. Затем к неочищенному продукту последовательно добавляют гидроксид натрия (3,07 г) и ди-т-бутилдикарбонат (15,2 г) и смесь перемешивают на протяжении ночи при комнатной температуре. К реакционной смеси добавляют этилацетат и, после промывания водой один раз, органический слой сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=5:1, получая 7,658 г названного соединения (выход 46%). 1H-ЯМР (CDCl3),  : 7,77 (1H, д, J=9,0 Гц), 7,22-7,13 (2H, м), 6,27 (1H, шс), 4,59 (2H, с), 2,25 (3H, с), 1,79 (1H, шс), 1,52 (9H, с).
Пример 519 : 7,77 (1H, д, J=9,0 Гц), 7,22-7,13 (2H, м), 6,27 (1H, шс), 4,59 (2H, с), 2,25 (3H, с), 1,79 (1H, шс), 1,52 (9H, с).
Пример 519Синтез т-бутилового эфира N-(4-бромметил-2-метилфенил)карбаминовой кислоты Соединение (1,035 г), полученное в Примере 518, растворяют в метиленхлориде (20 мл) и к раствору, при охлаждении льдом, последовательно добавляют трифенилфосфин (1,38 г) и четырехбромистый углерод (1,74 г). Реакционную смесь перемешивают в течение 30 мин при охлаждении льдом, затем перемешивают при комнатной температуре в течение 30 мин и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=5:1), получая 476,6 мг названного соединения (выход 36%). 1H-ЯМР (CDCl3),  : 7,84 (1H, д, J=8,1 Гц), 7,29-7,15 (2H, м), 6,28 (1H, шс), 4,46 (2H, с), 2,24 (3H, с), 1,52 (9H, с).
Пример 520 : 7,84 (1H, д, J=8,1 Гц), 7,29-7,15 (2H, м), 6,28 (1H, шс), 4,46 (2H, с), 2,24 (3H, с), 1,52 (9H, с).
Пример 520Синтез т-бутилового эфира N-(4-цианометил-2-метилфенил)карбаминовой кислоты Соединение (155,1 мг), полученное в Примере 519, растворяют в диметилсульфоксиде (5 мл). К раствору добавляют цианид натрия (127 мг) и смесь нагревают при 50oC при перемешивании в течение 10 мин. К полученной реакционной смеси добавляют этилацетат и органический слой промывают дважды водой, сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=3:1), получая 77,7 мг названного соединения (выход 61%). 1H-ЯМР (CDCl3),  : 7,84 (1H, д, J=8,8 Гц), 7,17-7,08 (2H, м), 6,28 (1H, шс), 3,67 (2H, с), 2,25 (3H, с), 1,52 (9H, с).
Пример 521 : 7,84 (1H, д, J=8,8 Гц), 7,17-7,08 (2H, м), 6,28 (1H, шс), 3,67 (2H, с), 2,25 (3H, с), 1,52 (9H, с).
Пример 521Синтез 4-цианометил-2-метиланилина Соединение (1,16 г), полученное в Примере 520, растворяют в метиленхлориде (15 мл); к раствору добавляют трифторуксусную кислоту (4 мл) и смесь перемешивают при комнатной температуре в течение 1 ч. К реакционной смеси добавляют насыщенный водный раствор бикарбоната натрия и затем экстрагируют метиленхлоридом. Органический слой сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=3:1), получая 480,5 мг названного соединения (выход 70%). 1H-ЯМР (CDCl3),  : 7,06-6,93 (2H, м), 6,65 (1H, д, J=8,1 Гц), 3,67 (2H, шс), 3,61 (2H, с), 2,16 (3H, с).
Пример 522 : 7,06-6,93 (2H, м), 6,65 (1H, д, J=8,1 Гц), 3,67 (2H, шс), 3,61 (2H, с), 2,16 (3H, с).
Пример 522Синтез 4-(2-аминоэтил)-2-метиланилина Используя соединение, полученное в Примере 521, в качестве исходного вещества, по методике, аналогичной Примеру 252, получают 486,5 мг названного соединения (выход 100%). 1H-ЯМР(CDCl3),  : 6,93-6,83 (2H, м), 6,62 (1H, д, J=8,3 Гц), 3,52 (2H, шс), 2,90 (2H, т, J=6,8 Гц), 2,62 (2H, т, J=6,8 Гц), 2,15 (3H, с), 1,69 (2H, шс).
Пример 523 : 6,93-6,83 (2H, м), 6,62 (1H, д, J=8,3 Гц), 3,52 (2H, шс), 2,90 (2H, т, J=6,8 Гц), 2,62 (2H, т, J=6,8 Гц), 2,15 (3H, с), 1,69 (2H, шс).
Пример 523Синтез т-бутилового эфира N-(2-(4-амино-3-метилфенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 522, в качестве исходного вещества, по методике, аналогичной Примеру 253, получают 477,4 мг названного соединенная (выход 59%). 1H-ЯМР(CDCl3),  : 6,91-6,83 (2H, м), 6,62(1H, д, J=7,8 Гц), 4,52 (1H, шс), 3,53 (2H, шс), 3,31 (2H, дт, J=5,4, 7,3 Гц), 2,66 (2H, т, J=7,3 Гц), 2,15 (3H, с), 1,44 (9H, с).
Пример 524 : 6,91-6,83 (2H, м), 6,62(1H, д, J=7,8 Гц), 4,52 (1H, шс), 3,53 (2H, шс), 3,31 (2H, дт, J=5,4, 7,3 Гц), 2,66 (2H, т, J=7,3 Гц), 2,15 (3H, с), 1,44 (9H, с).
Пример 524Синтез т-бутилового эфира N-(2-(3-метил-4-тиоуреидофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 523, как исходное вещество, по методике, аналогичной Примеру 120, получают 82,7 мг названного соединения (выход 96%). 1H-ЯМР (CDCl3),  : 7,84 (1H, шс), 7,20-7,04 (3H, м), 6,00 (2H, шс), 4,62 (1H, шс), 3,36 (2H, дт, J=6,3, 6,6 Гц), 2,77(2H, т, J=6,6 Гц), 2,29(3H, с), 1,43(9H, с).
Пример 525 : 7,84 (1H, шс), 7,20-7,04 (3H, м), 6,00 (2H, шс), 4,62 (1H, шс), 3,36 (2H, дт, J=6,3, 6,6 Гц), 2,77(2H, т, J=6,6 Гц), 2,29(3H, с), 1,43(9H, с).
Пример 525Синтез т-бутилового эфира N-(2-(4-(S-этилизотиоуреидо)-3-метилфенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 524, как исходное вещество, по методике, аналогичной Примеру 27, получают 82,4 мг названного соединения (выход 94%). 1H-ЯМР (CDCl3),  : 7,00 (1H, с). 6,96 (1H, д, J=8,0 Гц), 6,75 (1H, д, J= 8,0 Гц), 4,52 (1H, шс), 4,37 (1H, шс), 3,34 (2H, дт, J=6,3, 6,6 Гц), 3,20-2,95 (2H, м), 2,71 (2H, т, J=6,6 Гц), 2,13 (3H, с), 1,44 (9H, с), 1,38 (3H, т, J=7,3 Гц).
Пример 526 : 7,00 (1H, с). 6,96 (1H, д, J=8,0 Гц), 6,75 (1H, д, J= 8,0 Гц), 4,52 (1H, шс), 4,37 (1H, шс), 3,34 (2H, дт, J=6,3, 6,6 Гц), 3,20-2,95 (2H, м), 2,71 (2H, т, J=6,6 Гц), 2,13 (3H, с), 1,44 (9H, с), 1,38 (3H, т, J=7,3 Гц).
Пример 526Синтез дигидрохлорида N-(2-(4-(S-этилизотиоуреидо)-3-метилфенил)этил)амина Используя соединение, полученное в Примере 525, как исходное вещество, по методике, аналогичной Примеру 5, получают 75,5 мг названного соединения (выход 100%). 1H-ЯМР (ДМСО-d6),  : 11,55 (1H, шс), 9,50 (2H, шс), 8,23 (3H, шс), 7,28 (1H, с), 7,20 (2H, с), 3,45-3,23 (2H, м), 3,15- 2,87 (4H, м), 2,19 (3H, с), 1,30 (3H, т, J=7,1 Гц).
Пример 527 : 11,55 (1H, шс), 9,50 (2H, шс), 8,23 (3H, шс), 7,28 (1H, с), 7,20 (2H, с), 3,45-3,23 (2H, м), 3,15- 2,87 (4H, м), 2,19 (3H, с), 1,30 (3H, т, J=7,1 Гц).
Пример 527Синтез т-бутилового эфира N-(2-(4-(N’-т-бутоксикарбонил-N”-этилгуанидино)фенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 49, как исходное вещество, по методике, аналогичной Примеру 233, получают 74,4 мг названного соединения (выход 10%). 1H-ЯМР (CDCl3),  : 1,03-1,16 (3H, м), 1,43 (9H, с), 1,51 (9H, с), 2,76-2,82 (2H, м), 3,27-3,46 (4H, м), 4,62 (1H, шс), 6,98-7,28 (5H, м).
МС (м/з) 406 (М+) : 1,03-1,16 (3H, м), 1,43 (9H, с), 1,51 (9H, с), 2,76-2,82 (2H, м), 3,27-3,46 (4H, м), 4,62 (1H, шс), 6,98-7,28 (5H, м).
МС (м/з) 406 (М+)Пример 528 Синтез дигидрохлорида N-(2-(4-(N’-этилгуанидино)фенил)этил)амина Используя соединение, полученное в Примере 527, как исходное вещество, по методике, аналогичной Примеру 5, получают 44,6 мг названного соединения (выход 89%). 1H-ЯМР (D2O),  : 1,21 (3H, т, J=7,3 Гц), 3,03 (2H, т, J=7,3 Гц), 3,25-3,35 (4H, м), 7,29 (2H, д, J=8,6 Гц), 7,40 (2H, д, J=8,6 Гц).
МС (м/з) 206 (М+) : 1,21 (3H, т, J=7,3 Гц), 3,03 (2H, т, J=7,3 Гц), 3,25-3,35 (4H, м), 7,29 (2H, д, J=8,6 Гц), 7,40 (2H, д, J=8,6 Гц).
МС (м/з) 206 (М+)Пример 529 Синтез ди-т-бутилового эфира N-(3-амино-2-метилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 127, как исходное вещество, по методике, аналогичной Примеру 2, получают 4,4 г названного соединения (выход 80%). 1H-ЯМР (CDCl3),  : 1,43 (18H, с), 2,03 (3H, с), 3,45 (2H, шс), 4,74 (2H, с), 6,43-6,98 (3H, м).
МС (м/з) 336 (М+) : 1,43 (18H, с), 2,03 (3H, с), 3,45 (2H, шс), 4,74 (2H, с), 6,43-6,98 (3H, м).
МС (м/з) 336 (М+)Пример 530 Синтез ди-т-бутилового эфира N-(2-метил-3-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 529, как исходное вещество, по методике, аналогичной Примеру 120, получают 1,896 г названного соединения (выход 86%). 1H-ЯМР (CDCl3),  : 1,46 (18H, с), 2,25 (3H, с), 4,80 (2H, с), 5,83 (2H, шс), 7,15 (2H, д, J=7,6 Гц), 7,23-7,29 (1H, м), 7,80 (1H, с).
Пример 531 : 1,46 (18H, с), 2,25 (3H, с), 4,80 (2H, с), 5,83 (2H, шс), 7,15 (2H, д, J=7,6 Гц), 7,23-7,29 (1H, м), 7,80 (1H, с).
Пример 531Синтез N-(3-(ди-(т-бутоксикарбонил)аминометил)-2-метилфенил)амидиносульфокислоты Используя соединение, полученное в Примере 530, как исходное вещество, по методике, аналогичной Примеру 277, получают 1,96 г названного соединения (выход 92%). 1H-ЯМР (CDCl3),  : 1,48 (18H, с), 2,22 (3H, с), 4,80 (2H, с), 7,13-7,24 (2H, м), 7,28- 7,36 (2H, м).
Пример 532 : 1,48 (18H, с), 2,22 (3H, с), 4,80 (2H, с), 7,13-7,24 (2H, м), 7,28- 7,36 (2H, м).
Пример 532Синтез ди-т-бутилового эфира N-(3-(N’-этилгуанидино)-2-метилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 531, как исходное вещество и также используя этиламина гидрохлорид в качестве реагента, по методике, аналогичной Примеру 278, получают названное соединение, количественно. 1H-ЯМР (CDCl3),  : 1,17 (3H, т, J=7,2 Гц), 1,43 (18H, с), 2,09 (3H, с), 3,24 (2H, к, J= 7,2 Гц), 3,89 (2H, шс), 4,76 (2H, с), 6,72-6,79 (2H, м), 7,02-7,10 (1H, м), 7,28 (1H, с).
МС (м/з) 406 (М+) : 1,17 (3H, т, J=7,2 Гц), 1,43 (18H, с), 2,09 (3H, с), 3,24 (2H, к, J= 7,2 Гц), 3,89 (2H, шс), 4,76 (2H, с), 6,72-6,79 (2H, м), 7,02-7,10 (1H, м), 7,28 (1H, с).
МС (м/з) 406 (М+)Пример 533 Синтез дигидрохлорида N-(3-(N’-этилгуанидино)-2-метилфенилметил)амина Используя соединение, полученное в Примере 532, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 1,21 (3H, т, J=7,3 Гц), 2,28 (3H, с), 3,31(2H, к, J= 7,3 Гц), 4,29(2H, с), 7,32-7,46 (3H, м).
МС (м/з) 206 (М+) : 1,21 (3H, т, J=7,3 Гц), 2,28 (3H, с), 3,31(2H, к, J= 7,3 Гц), 4,29(2H, с), 7,32-7,46 (3H, м).
МС (м/з) 206 (М+)Пример 534 Синтез ди-т-бутилового эфира N-(3-(N’-этил-N’-метилгуанидино)-2-метилфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 531, как исходное вещество, по методике, аналогичной Примеру 304, получают 77,6 мг названного соединения (выход 27%). 1H-ЯМР (CDCl3),  : 1,19 (3H, т, J=6,9 Гц), 1,43 (18H, с), 2,08 (3H, с), 2,96 (3H, с), 3,41 (2H, к, J=6,9 Гц), 4,77 (2H, с), 6,73 (2H, т, J=7,6 Гц), 7,05 (1H, т, J=7,6 Гц).
МС (м/з) 420 (М+) : 1,19 (3H, т, J=6,9 Гц), 1,43 (18H, с), 2,08 (3H, с), 2,96 (3H, с), 3,41 (2H, к, J=6,9 Гц), 4,77 (2H, с), 6,73 (2H, т, J=7,6 Гц), 7,05 (1H, т, J=7,6 Гц).
МС (м/з) 420 (М+)Пример 535 Синтез дигидрохлорида N-(3-(N’-этил-N’-метилгуанидино)-2-метилфенилметил)амина Используя соединение, полученное в Примере 534, как исходное вещество, по методике, аналогичной Примеру 5, получают 42,7 мг названного соединения (выход 81%). 1H-ЯМР (D2O),  : 1,28 (3H, т, J=7,2 Гц), 2,27 (3H, с), 3,15 (3H, с), 3,52 (2H, к, J=7,3 Гц), 4,30 (2H, с), 7,34 (1H, дд, J=7,6, 2,0 Гц), 7,41-7,48 (2H, м).
МС (м/з) 220 (М+) : 1,28 (3H, т, J=7,2 Гц), 2,27 (3H, с), 3,15 (3H, с), 3,52 (2H, к, J=7,3 Гц), 4,30 (2H, с), 7,34 (1H, дд, J=7,6, 2,0 Гц), 7,41-7,48 (2H, м).
МС (м/з) 220 (М+)Пример 536 Синтез N-(2-хлор-3-(ди-(т-бутоксикарбонил)аминометил)фенил)амидиносульфокислоты Используя соединение, полученное в Примере 135, как исходное вещество, по методике, аналогичной Примеру 277, получают 0,68 г названного соединения (выход 97%). 1H-ЯМР (CDCl3),  : 1,45 (18H, с), 4,90 (2H, с), 7,22-7,29 (1H, м), 7,38-7,46 (2H, м).
Пример 537 : 1,45 (18H, с), 4,90 (2H, с), 7,22-7,29 (1H, м), 7,38-7,46 (2H, м).
Пример 537Синтез ди-т-бутилового эфира N-(2-хлор-3-(N’-этилгуанидино)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 536, как исходное вещество, по методике, аналогичной Примеру 442, получают названное соединение, количественно. 1H-ЯМР (CDCl3),  : 1,20 (3H, т, J=7,3 Гц), 1,45 (18H, с), 3,28 (2H, к, J= 7,3 Гц), 4,89 (2H, с), 6,77 (1H, д, J=7,7 Гц), 6,87 (1H, д, J=7,7 Гц), 7,13 (1H, т, J=7,7 Гц).
МС (м/з) 426 (М+) : 1,20 (3H, т, J=7,3 Гц), 1,45 (18H, с), 3,28 (2H, к, J= 7,3 Гц), 4,89 (2H, с), 6,77 (1H, д, J=7,7 Гц), 6,87 (1H, д, J=7,7 Гц), 7,13 (1H, т, J=7,7 Гц).
МС (м/з) 426 (М+)Пример 538 Синтез дигидрохлорида N-(2-хлор-3-(N’-этилгуанидино)фенилметил)амина Используя соединение, полученное в Примере 537, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 1,22 (3H, т, J=7,3 Гц), 3,333 (2H, к, J=7,3 Гц), 4,39 (2H, с), 7,51-7,62 (3H, м).
МС (м/з) 226 (М+) : 1,22 (3H, т, J=7,3 Гц), 3,333 (2H, к, J=7,3 Гц), 4,39 (2H, с), 7,51-7,62 (3H, м).
МС (м/з) 226 (М+)Пример 539 Синтез ди-т-бутилового эфира N-(2-хлор-3-(N’-этил-N’-метилгуанидино)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 536, как исходное вещество, по методике, аналогичной Примеру 304, получают 0,12 г названного соединения (выход 38%). 1H-ЯМР (CDCl3),  : 1,21 (3H, т, J=6,9 Гц), 1,44 (18H, с), 2,98 (3H, с), 3,43 (2H, к, J=6,9 Гц), 3,85 (1H, шс), 4,88 (2H, с), 6,75 (1H, д, J=7,6 Гц), 6,84 (1H, д, J=7,6 Гц), 7,11 (1H, т, J=7,6 Гц).
МС (м/з) 440 (М+) : 1,21 (3H, т, J=6,9 Гц), 1,44 (18H, с), 2,98 (3H, с), 3,43 (2H, к, J=6,9 Гц), 3,85 (1H, шс), 4,88 (2H, с), 6,75 (1H, д, J=7,6 Гц), 6,84 (1H, д, J=7,6 Гц), 7,11 (1H, т, J=7,6 Гц).
МС (м/з) 440 (М+)Пример 540 Синтез дигидрохлорида N-(2-хлор-3-(N’-этил-N’-метил гуанидино)фенилметил)амина Используя соединение, полученное в Примере 539, как исходное вещество, по методике, аналогичной Примеру 5, получают 76,2 мг названного соединения (выход 90%). 1H-ЯМР (D2O),  : 1,28 (3H, т, J=7,3 Гц), 3,16 (3H, с), 3,53 (2H, к, J= 7,3 Гц), 4,40 (2H, с), 7,51-7,60 (3H, м).
МС (м/з) 240 (М+) : 1,28 (3H, т, J=7,3 Гц), 3,16 (3H, с), 3,53 (2H, к, J= 7,3 Гц), 4,40 (2H, с), 7,51-7,60 (3H, м).
МС (м/з) 240 (М+)Пример 541 Синтез N-(3-(т-бутоксикарбониламиноэтил)фенил)амидино сульфокислоты Используя соединение, полученное в Примере 58, как исходное вещество, по методике, аналогичной Примеру 277, получают 1,99 г названного соединения (выход 80%). 1H-ЯМР (ДМСО-d6),  : 1,35 (9H, с), 2,74 (3H, т, J=6,9 Гц), 3,12-3,33 (2H, м), 6,74 (1H, шс), 7,10-7,20 (3H, м), 7,39 (1H, т, J=7,6 Гц), 9,08 (1H, шс), 9,63 (1H, с), 11,45 (1H, с).
Пример 542 : 1,35 (9H, с), 2,74 (3H, т, J=6,9 Гц), 3,12-3,33 (2H, м), 6,74 (1H, шс), 7,10-7,20 (3H, м), 7,39 (1H, т, J=7,6 Гц), 9,08 (1H, шс), 9,63 (1H, с), 11,45 (1H, с).
Пример 542Синтез т-бутилового эфира N-(3-(N’-этилгуанидино)фенилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 541, как исходное вещество, по методике, аналогичной Примеру 442, получают 0,415 г названное соединение (выход 93%). 1H-ЯМР (CDCl3),  : 1,16-1,21 (3H, м), 1,46 (9H, с), 2,68- 2,81 (2H, м), 3,22-3,47 (4H, м), 4,95 (2H, шс), 5,35 (1H, шс), 6,81-6,85 (3H, м), 7,15-7,22 (1H, м).
МС (м/з) 306 (М+) : 1,16-1,21 (3H, м), 1,46 (9H, с), 2,68- 2,81 (2H, м), 3,22-3,47 (4H, м), 4,95 (2H, шс), 5,35 (1H, шс), 6,81-6,85 (3H, м), 7,15-7,22 (1H, м).
МС (м/з) 306 (М+)Пример 543 Синтез дигидрохлорида N-(3-(N’-этилгуанидино)фенилэтил)амина Используя соединение, полученное в Примере 542, как исходное вещество, по методике, аналогичной Примеру 5, получают 0,356 г названного соединения (выход 94%). 1H-ЯМР (D2O),  : 1,22 (3H, т, J=7,3 Гц), 3,03 (2H, т, J=7,3 Гц), 3,26-3,36 (4H, м), 7,22-7,25 (2H, м), 7,31 (1H, д, J=8,3 Гц), 7,47 (1H, д, J=8,6 Гц).
МС (м/з) 206 (М+) : 1,22 (3H, т, J=7,3 Гц), 3,03 (2H, т, J=7,3 Гц), 3,26-3,36 (4H, м), 7,22-7,25 (2H, м), 7,31 (1H, д, J=8,3 Гц), 7,47 (1H, д, J=8,6 Гц).
МС (м/з) 206 (М+)Пример 544 Синтез т-бутилового эфира N-(3-(N’-этил-N’-метилгуанидино)фенилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 541, как исходное вещество, по методике, аналогичной Примеру 304, получают 126,5 г названного соединения (выход 27%). 1H-ЯМР (CDCl3),  : 1,17 (3H, т, J=6,9 Гц), 1,40 (9H, с), 2,70 (2H, т, J= 6,9 Гц), 2,93 (3H, с), 3,33-3,41 (4H, м), 3,86 (2H, ш), 4,74 (1H, шс), 6,65-6,78 (3H, м), 7,16 (1H, т, J=7,6 Гц).
ББА-МС (м/з) 321 (М++1) : 1,17 (3H, т, J=6,9 Гц), 1,40 (9H, с), 2,70 (2H, т, J= 6,9 Гц), 2,93 (3H, с), 3,33-3,41 (4H, м), 3,86 (2H, ш), 4,74 (1H, шс), 6,65-6,78 (3H, м), 7,16 (1H, т, J=7,6 Гц).
ББА-МС (м/з) 321 (М++1)Пример 545 Синтез дигидрохлорида N-(3-(N’-этил-N’-метилгуанидино)фенилэтил)амина Используя соединение, полученное в Примере 544, как исходное вещество, по методике, аналогичной Примеру 5, получают 106 г названного соединения (выход 93%). 1H-ЯМР (D2O),  : 1,26 (3H, т, J=7,3 Гц), 3,03 (2H, т, J=7,3 Гц), 3,13 (3H, с), 3,30 (2H, т, J=7,3 Гц), 3,50 (2H, к, J=7,3 Гц), 7,21-7,23 (2H, м), 7,31 (1H, д, J=7,9 Гц), 7,48 (1H, т, J=8,2 Гц).
МС (м/з) 220 (М+) : 1,26 (3H, т, J=7,3 Гц), 3,03 (2H, т, J=7,3 Гц), 3,13 (3H, с), 3,30 (2H, т, J=7,3 Гц), 3,50 (2H, к, J=7,3 Гц), 7,21-7,23 (2H, м), 7,31 (1H, д, J=7,9 Гц), 7,48 (1H, т, J=8,2 Гц).
МС (м/з) 220 (М+)Пример 546 Синтез ди-т-бутилового эфира N-(5-нитро-2-пиперидинофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 263, как исходное вещество, и также используя пиперидин как реагент, в отсутствии растворителя, по методике, аналогичной Примеру 264, получают 1,524 г названного соединения (выход 98%). 1H-ЯМР (CDCl3),  : 1,45 (18H, с), 1,60-1,79 (6H, м), 2,91- 2,95 (4H, м), 4,82 (2H, с), 7,04 (1H, д, J=8,6 Гц), 8,00 (1H, д, J=2,3 Гц), 8,09 (1H, дд, J=8,6, 2,3 Гц) : 1,45 (18H, с), 1,60-1,79 (6H, м), 2,91- 2,95 (4H, м), 4,82 (2H, с), 7,04 (1H, д, J=8,6 Гц), 8,00 (1H, д, J=2,3 Гц), 8,09 (1H, дд, J=8,6, 2,3 Гц)ББА-МС (м/з) 436 (М++1) Пример 547 Синтез ди-т-бутилового эфира N-(5-амино-2-пиперидинофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 546, как исходное вещество, по методике, аналогичной Примеру 2, получают 1,01 г названного соединения (выход 72%). 1H-ЯМР (CDCl3),  : 1,41 (18H, с), 1,43-1,72 (6H, м), 2,65-2,73 (4H, м), 3,45 (2H, ш), 4,84 (2H, с), 6,44 (1H, д, J=2,6 Гц), 6,12 (1H, дд, J=8,3, 2,6 Гц), 6,89 (1H, д, J=8,3 Гц).
ББА-МС (м/з) 406 (M++1) : 1,41 (18H, с), 1,43-1,72 (6H, м), 2,65-2,73 (4H, м), 3,45 (2H, ш), 4,84 (2H, с), 6,44 (1H, д, J=2,6 Гц), 6,12 (1H, дд, J=8,3, 2,6 Гц), 6,89 (1H, д, J=8,3 Гц).
ББА-МС (м/з) 406 (M++1)Пример 548 Синтез ди-т-бутилового эфира N-(2-пиперидино-5-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 547, как исходное вещество, по методике, аналогичной Примеру 120, получают 0,59 г названного соединения (выход 81%). 1H-ЯМР (CDCl3),  : 1,44 (18H, с), 1,56-1,79 (6H, м), 2,78- 2,83 (4H, м), 4,83 (2H, с), 5,99 (2H, шс), 6,93-6,94 (1H, м), 7,05-7,06 (2H, м), 7,72 (1H, шс).
МС (м/з) 464 (М+) : 1,44 (18H, с), 1,56-1,79 (6H, м), 2,78- 2,83 (4H, м), 4,83 (2H, с), 5,99 (2H, шс), 6,93-6,94 (1H, м), 7,05-7,06 (2H, м), 7,72 (1H, шс).
МС (м/з) 464 (М+)Пример 549 Синтез ди-т-бутилового эфира N-(5-(S-этилизотиоуреидо)-2-пиперидинофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 548, как исходное вещество, по методике, аналогичной Примеру 95, получают 0,271 г названного соединения (выход 85%). 1H-ЯМР (CDCl3),  : 1,26 (3H, т, J=7,3 Гц), 1,41 (18H,), 1,48-1,73 (6H, м), 2,67-2,85 (4H, м), 2,92-3,13 (2H, м), 4,82 (1H, ш), 4,86 (2H, с), 6,62-6,78 (2H, м), 7,00 (1H, д, J=8,3 Гц).
МС (м/з) 492 (М+) : 1,26 (3H, т, J=7,3 Гц), 1,41 (18H,), 1,48-1,73 (6H, м), 2,67-2,85 (4H, м), 2,92-3,13 (2H, м), 4,82 (1H, ш), 4,86 (2H, с), 6,62-6,78 (2H, м), 7,00 (1H, д, J=8,3 Гц).
МС (м/з) 492 (М+)Пример 550 Синтез тригидрохлорида N-(5-(S-этилизотиоуреидо)-2-пиперидинофенилметил)амина Используя соединение, полученное в Примере 549, как исходное вещество, по методике, аналогичной Примеру 5, получают 128,4 мг названного соединения (выход 58%). 1H-ЯМР (D2O),  : 1,41 (3H, т, J=7,3 Гц), 1,67-1,85 (2H, м), 1,94-2,11 (4H, м), 3,24 (2H, к, J=7,3 Гц), 3,40-3,69 (4H, м), 4,42 (2H, с), 7,56-7,68 (2H, м), 7,78-7,92 (1H, м).
МС (м/з) 292 (М+) : 1,41 (3H, т, J=7,3 Гц), 1,67-1,85 (2H, м), 1,94-2,11 (4H, м), 3,24 (2H, к, J=7,3 Гц), 3,40-3,69 (4H, м), 4,42 (2H, с), 7,56-7,68 (2H, м), 7,78-7,92 (1H, м).
МС (м/з) 292 (М+)Пример 551 Синтез N-(3-(ди-(т-бутоксикарбонил)аминометил)-4-пиперидинофенил) амидиносульфокислоты Используя соединение, полученное в Примере 548, как исходное вещество, по методике, аналогичной Примеру 277, получают 152 г названного соединения (выход 74%). 1H-ЯМР (CDCl3),  : 1,42 (18H, с), 1,50-1,73 (6H, м), 2,67- 2,85 (4H, м), 4,83 (2H, с), 7,06 (1H, с), 7,15 (1H, д, J=8,6 Гц), 7,22-7,32 (1H, м).
Пример 552 : 1,42 (18H, с), 1,50-1,73 (6H, м), 2,67- 2,85 (4H, м), 4,83 (2H, с), 7,06 (1H, с), 7,15 (1H, д, J=8,6 Гц), 7,22-7,32 (1H, м).
Пример 552Синтез ди-т-бутилового эфира N-(5-(N’-этилгуанидино)-2- пиперидинофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 551, как исходное вещество, по методике, аналогичной Примеру 442, получают 0,11 г названного соединения (выход 53%). 1H-ЯМР (CDCl3),  : 1,17 (3H, т, J=7,3 Гц), 1,40 (18H, с), 1,47-1,75 (6H, м), 2,68-2,83 (4H, м), 3,21 (2H, к, J=7,3 Гц), 4,84 (2H, с), 6,69 (1H, с), 6,75 (1H, д, J=8,3 Гц), 6,97 (1H, д, J=8,3 Гц).
МС (м/з) 475 (М+) : 1,17 (3H, т, J=7,3 Гц), 1,40 (18H, с), 1,47-1,75 (6H, м), 2,68-2,83 (4H, м), 3,21 (2H, к, J=7,3 Гц), 4,84 (2H, с), 6,69 (1H, с), 6,75 (1H, д, J=8,3 Гц), 6,97 (1H, д, J=8,3 Гц).
МС (м/з) 475 (М+)Пример 553 Синтез тригидрохлорида N-(5-(N’-гуанидино)-2-пиперидинофенилметил)амина Используя соединение, полученное в Примере 552, как исходное вещество, по методике, аналогичной Примеру 5, получают 76,7 мг названного соединения (выход 87%). 1H-ЯМР (D2O),  : 1,23 (3H, т, J=7,3 Гц), 1,69-1,81 (2H, м), 1,97-2,09 (4H, м), 3,34 (2H, к, J=7,3 Гц), 3,51 (4H, т, J=5,6 Гц), 4,39 (2H, с), 7,48 (1H, д, J=2,3 Гц), 7,53 (1H, дд, J=8,9, 2,3 Гц), 7,77 (1H, д, J=8,9 Гц).
ББА-МС (м/з) 276 (М+ +1) : 1,23 (3H, т, J=7,3 Гц), 1,69-1,81 (2H, м), 1,97-2,09 (4H, м), 3,34 (2H, к, J=7,3 Гц), 3,51 (4H, т, J=5,6 Гц), 4,39 (2H, с), 7,48 (1H, д, J=2,3 Гц), 7,53 (1H, дд, J=8,9, 2,3 Гц), 7,77 (1H, д, J=8,9 Гц).
ББА-МС (м/з) 276 (М+ +1)Пример 554 Синтез ди-т-бутилового эфира N-(2-хлор-5-нитрофенилметил)иминодикарбоновой кислоты Используя 2-хлор-5-нитробензоилбромид как исходное вещество, по методике, аналогичной Примеру 127, получают 3,5 г названного соединения (выход 92%). 1H-ЯМР (CDCl3),  : 1,49 (9H, с), 1,50 (9H, с), 4,95 (2H, с), 7,53 (1H, дд, J=5,6, 3,2 Гц), 8,02-8,13 (2H, м).
ББА-МС (м/з) 387 (М+ +1) : 1,49 (9H, с), 1,50 (9H, с), 4,95 (2H, с), 7,53 (1H, дд, J=5,6, 3,2 Гц), 8,02-8,13 (2H, м).
ББА-МС (м/з) 387 (М+ +1)Пример 555 Синтез ди-т-бутилового эфира N-(5-амино-2-хлорфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 554, в качестве исходного вещества и также используя никель Ренея в качестве катализатора, по методике, аналогичной Примеру 2, получают 3,17 г названного соединения (выход 98%). 1H-ЯМР (CDCl3),  : 1,48 (18H, с), 3,69 (2H, шс), 4,82 (2H, с), 6,47 (1H, с), 6,49-6,52 (1H, м), 7,08 (1H, д, J=7,6 Гц).
МС (м/з) 356 (М+) : 1,48 (18H, с), 3,69 (2H, шс), 4,82 (2H, с), 6,47 (1H, с), 6,49-6,52 (1H, м), 7,08 (1H, д, J=7,6 Гц).
МС (м/з) 356 (М+)Пример 556 Синтез ди-т-бутилового эфира N-(2-хлор-5-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 555, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 0,45 г названного соединения (выход 74%). 1H-ЯМР (CDCl3),  : 1,48 (18H, с), 4,87 (2H, с), 6,12 (2H, шс), 7,04 (1H, с), 7,09 (1H, д, J=8,6 Гц), 7,41 (1H, д, J=8,6 Гц), 8,03 (1H, шс).
МС (м/з) 415 (М+) : 1,48 (18H, с), 4,87 (2H, с), 6,12 (2H, шс), 7,04 (1H, с), 7,09 (1H, д, J=8,6 Гц), 7,41 (1H, д, J=8,6 Гц), 8,03 (1H, шс).
МС (м/з) 415 (М+)Пример 557 Синтез т-бутилового эфира N-(2-хлор-5-(S-этилизотиоуреидо)фенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 556, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают 0,37 г названного соединения (выход 99%). 1H-ЯМР (CDCl3),  : 1,26 (3H, т, J=7,3 Гц), 1,44 (9H, с), 4,12 (2H, к, J= 7,3 Гц), 4,35 (2H, д, J=5,9 Гц), 5,00 (1H, шс), 6,68-6,83 (1H, м), 6,93 (1H, с), 7,21-7,33 (1H, м) : 1,26 (3H, т, J=7,3 Гц), 1,44 (9H, с), 4,12 (2H, к, J= 7,3 Гц), 4,35 (2H, д, J=5,9 Гц), 5,00 (1H, шс), 6,68-6,83 (1H, м), 6,93 (1H, с), 7,21-7,33 (1H, м)ББА-МС (м/з) 343 (М+ +1) Пример 558 Синтез дигидрохлорида N-(2-хлор-5-(S-этилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 557, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 198,3 мг названного соединения (выход 59%). 1H-ЯМР (D2O),  : 1,42 (3H, т, J=7,3 Гц), 3,25 (2H, к, J=7,3 Гц), 4,38 (2H, с), 7,47 (1H, дд, J=8,6, 2,6 Гц), 7,55 (1H, д, J=2,6 Гц), 7,71 (1H, д, J=8,6 Гц).
ББА-МС (м/з) 244 (М+ +1) : 1,42 (3H, т, J=7,3 Гц), 3,25 (2H, к, J=7,3 Гц), 4,38 (2H, с), 7,47 (1H, дд, J=8,6, 2,6 Гц), 7,55 (1H, д, J=2,6 Гц), 7,71 (1H, д, J=8,6 Гц).
ББА-МС (м/з) 244 (М+ +1)Пример 559 Синтез ди-т-бутилового эфира N-(5-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-хлорфенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 555 в качестве исходного вещества, по методике, аналогичной Примеру 233, получают 0,159 г названного соединения (выход 52%). 1H-ЯМР (CDCl3),  : 1,07-1,40 (3H, м), 1,46 (18H, с), 1,48 (9H, с), 3,38-3,43 (2H, м), 4,87 (2H, с), 6,75-6,98 (1H, м), 7,28-7,42 (2H, м).
ББА-МС (м/з) 527 (М+ +1) : 1,07-1,40 (3H, м), 1,46 (18H, с), 1,48 (9H, с), 3,38-3,43 (2H, м), 4,87 (2H, с), 6,75-6,98 (1H, м), 7,28-7,42 (2H, м).
ББА-МС (м/з) 527 (М+ +1)Пример 560 Синтез дигидрохлорида N-(2-хлор-5-(N’-этилгуанидино) фенилметил)амина Используя соединение, полученное в Примере 559, как исходное вещество, по методике, аналогичной Примеру 5, получают 62,2 мг названного соединения (выход 69%). 1H-ЯМР (D2O),  : 1,23 (3H, т, J=7,3 Гц), 3,33 (2H, к, J=7,3 Гц), 4,35 (2H, с), 7,38 (1H, дд, J=8,6, 2,6 Гц), 7,45 (1H, д, J=2,6 Гц), 7,64 (1H, д, J=8,6 Гц).
ББА-МС (м/з) 277 (М+ +1) : 1,23 (3H, т, J=7,3 Гц), 3,33 (2H, к, J=7,3 Гц), 4,35 (2H, с), 7,38 (1H, дд, J=8,6, 2,6 Гц), 7,45 (1H, д, J=2,6 Гц), 7,64 (1H, д, J=8,6 Гц).
ББА-МС (м/з) 277 (М+ +1)Пример 561 Синтез метилового эфира 2-(2-бензилоксифенил)-2-метилпропионовой кислоты Используя метиловый эфир 2-бензилоксифенилуксусной кислоты в качестве исходного вещества и также используя т-бутоксид калия в качестве основания, по методике, аналогичной Примеру 1а, получают метиловый эфир 2-(2-бензилоксифенил)пропионовой кислоты. Используя диизопропиламид лития в качестве основания, полученный метиловый эфир 2-(2-бензилоксифенил)пропионовой кислоты далее обрабатывают, как в Примере 1а, получая 4,72 г названного соединения (выход 70%). 1H-ЯМР (CDCl3),  : 1,58 (6H, с), 3,42 (3H, с), 5,07 (2H, с), 6,91 (1H, дд, J= 7,3, 1,2 Гц), 6,99 (1H, дд, J=7,3, 1,2 Гц), 7,21 (1H, дд, J=7,9, 1,8 Гц), 7,33 (1H, дд, J=7,9, 1,8 Гц), 7,35-7,40 (5H, м).
Пример 562 : 1,58 (6H, с), 3,42 (3H, с), 5,07 (2H, с), 6,91 (1H, дд, J= 7,3, 1,2 Гц), 6,99 (1H, дд, J=7,3, 1,2 Гц), 7,21 (1H, дд, J=7,9, 1,8 Гц), 7,33 (1H, дд, J=7,9, 1,8 Гц), 7,35-7,40 (5H, м).
Пример 562Синтез метилового эфира 2-(2-бензилокси-5-нитрофенил)-2-метилпропионовой кислоты К смеси серной кислоты (0,27 мл) и азотной кислоты (0,34 мл) добавляют по каплям при 5oC раствор соединения (1,0 г), полученного в Примере 561, в уксусной кислоте (30 мл). Реакционную смесь перемешивают при 45oC в течение 4 ч, выливают в воду со льдом и к смеси добавляют этилацетат. Органический слой промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=9:1), получая 530 мг названного соединения (выход 46%). 1H-ЯМР(CDCl3),  : 1,60 (6H, с), 3,42 (3H, с), 5,29 (2H, с), 6,99 (1H, д, J=9,2 Гц), 7,33-7,45 (5H, м), 8,16 (1H, дд, J=9,2, 3,1 Гц), 8,25 (1H, д, J=3,1 Гц).
Пример 563 : 1,60 (6H, с), 3,42 (3H, с), 5,29 (2H, с), 6,99 (1H, д, J=9,2 Гц), 7,33-7,45 (5H, м), 8,16 (1H, дд, J=9,2, 3,1 Гц), 8,25 (1H, д, J=3,1 Гц).
Пример 563Синтез 2-(2-бензилокси-5-нитрофенил)- 2-метилпропионовой кислоты К соединению (1,54 г), полученного в Примере 562, в 1,4-диоксане (20 мл) добавляют водный раствор гидроксида лития (1,0 М, 47 мл). Реакционную смесь кипятят с обратным холодильником при 100oC в течение 12 ч и затем добавляют 2N HCl и этилацетат. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток перекристаллизовызают из этилацетата, получая 1,355 г названного соединения (выход 92%). 1H-ЯМР (CDCl3),  : 1,60 (6H, с), 5,02 (2H, с), 6,91 (1H, д, J=9,2 Гц), 7,30-7,37 (5H, м), 8,16 (1H, дд, J=9,2, 3,1 Гц), 8,25 (1H, д, J=3,1 Гц).
Пример 564 : 1,60 (6H, с), 5,02 (2H, с), 6,91 (1H, д, J=9,2 Гц), 7,30-7,37 (5H, м), 8,16 (1H, дд, J=9,2, 3,1 Гц), 8,25 (1H, д, J=3,1 Гц).
Пример 564Синтез N-(1-(2-бензилокси-5-нитрофенил)-1-метилэтил)амина К смеси соединения (1,6 г), полученного в Примере 563, метиленхлорида (20 мл) и триэтиламина (0,92 мл) добавляют дифенилфосфорилазид (1,37 мл). Реакционную смесь перемешивают при комнатной температуре в течение 10 ч и добавляют 2N HCl и хлороформ. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. К полученному остатку добавляют воду (16 мл) и 1,4-диоксан (52 мл). Реакционную смесь кипятят с обратным холодильником в течение 2 ч и добавляют 2 N HCl и хлороформ. После добавления 2N водного раствора гидроксида натрия и хлороформа к водному слою органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток перекристаллизовывают из смеси этилацетата и н-гексана, получая 1,09 г названного соединения (выход 75%). 1H-ЯМР (CDCl3),  : 1,58 (6H, с), 2,01 (2H, шс), 5,25 (2H, с), 7,03 (1H, д, J=9,2 Гц), 7,37-7,45 (5H, м), 8,13 (1H, дд, J=9,2, 3,1 Гц), 8,35 (1H, д, J=3,1 Гц).
Пример 565 : 1,58 (6H, с), 2,01 (2H, шс), 5,25 (2H, с), 7,03 (1H, д, J=9,2 Гц), 7,37-7,45 (5H, м), 8,13 (1H, дд, J=9,2, 3,1 Гц), 8,35 (1H, д, J=3,1 Гц).
Пример 565Синтез т-бутилового эфира N-(1-(2-бензилокси-5-нитрофенил)-1-метилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 564, в качестве исходного вещества и также используя карбонат калия в качестве основания, по методике, аналогичной Примеру 63, получают 828 мг названного соединения (выход 94%). 1H-ЯМР (CDCl3),  : 1,34 (9H, с), 1,71 (6H, с), 5,07 (1H, шс), 5,18 (2H, с), 7,00 (1H, д, J=9,2 Гц), 7,35-7,48 (5H, м), 8,13 (1H, дд, J=9,2, 3,1 Гц), 8,29 (1H, д, J=3,1 Гц).
Пример 566 : 1,34 (9H, с), 1,71 (6H, с), 5,07 (1H, шс), 5,18 (2H, с), 7,00 (1H, д, J=9,2 Гц), 7,35-7,48 (5H, м), 8,13 (1H, дд, J=9,2, 3,1 Гц), 8,29 (1H, д, J=3,1 Гц).
Пример 566Синтез т-бутилового эфира N-(1-(5-амино-2-бензилоксифенил)-1-метилэтил)карбаминовой кислоты К смеси соединения (100 мг), полученного в Примере 565, гексагидрата хлорида никеля (II) (123 мг) и метанола (6 мл) добавляют борогидрид натрия (39 мг). Реакционную смесь перемешивают при комнатной температуре в течение 10 мин; затем добавляют 2N HCl и также добавляют насыщенный водный раствор бикарбоната натрия и хлороформ. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=3:2), получая 87 мг названного соединения (выход 94%). 1H-ЯМР (CDCl3),  : 1,34 (9H, с), 1,66 (6H, с), 2,80 (2H, ш), 4,99 (2H, с), 5,27 (1H, шс), 6,54 (1H, дд, J=8,6, 2,4 Гц), 6,74 (1H, д, J=8,6 Гц), 6,78 (1H, д, J=8,6 Гц), 7,29-7,49 (5H, м).
Пример 567 : 1,34 (9H, с), 1,66 (6H, с), 2,80 (2H, ш), 4,99 (2H, с), 5,27 (1H, шс), 6,54 (1H, дд, J=8,6, 2,4 Гц), 6,74 (1H, д, J=8,6 Гц), 6,78 (1H, д, J=8,6 Гц), 7,29-7,49 (5H, м).
Пример 567Синтез т-бутилового эфира N-(1-(2-бензилокси-5-(N’-нитрогуанидино)фенил)-1-метилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 566, в качестве исходного вещества, по методике, аналогичной Примеру 6, получают 110 мг названного соединения (выход 89%). 1H-ЯМР (CDCl3),  : 1,36 (9H, с), 1,69 (6H, с), 5,11 (2H, с), 7,01 (1H, д, J= 8,5 Гц), 7,18 (1H, дд, J=8,5, 2,4 Гц), 7,31 (1H, д, J=2,4 Гц), 7,34-7,46 (5H, м), 9,35 (1H, шс).
Пример 568 : 1,36 (9H, с), 1,69 (6H, с), 5,11 (2H, с), 7,01 (1H, д, J= 8,5 Гц), 7,18 (1H, дд, J=8,5, 2,4 Гц), 7,31 (1H, д, J=2,4 Гц), 7,34-7,46 (5H, м), 9,35 (1H, шс).
Пример 568Синтез N-(1-(2-бензилокси-5-(N’-нитрогуанидино)фенил)- 1-метилметил)амина Используя соединение, полученное в Примере 567, в качестве исходного вещества, по методике, аналогичной Примеру 34, получают 47,4 мг названного соединения (выход 58%). 1H-ЯМР (CDCl3),  : 1,58 (6H, с), 5,16 (2H, с), 7,01 (1H, д, J=8,5 Гц), 7,16 (1H, дд, J=8,5, 2,4 Гц), 7,34 (1H, д, J=2,4 Гц), 7,35-7,46 (5H, м).
Пример 569 : 1,58 (6H, с), 5,16 (2H, с), 7,01 (1H, д, J=8,5 Гц), 7,16 (1H, дд, J=8,5, 2,4 Гц), 7,34 (1H, д, J=2,4 Гц), 7,35-7,46 (5H, м).
Пример 569Синтез т-бутилового эфира N-(1-(2-бензилокси-5-(N’-т-бутоксикарбонил-N”-этилгуанидино)фенил)-1-метилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 566, как исходное вещество, по методике, аналогичной Примеру 233, получают 106 мг названного соединения (выход 72%). 1H-ЯМР (CDCl3),  : 1,09 (3H, т, J=7,3 Гц), 1,34 (9H, с), 1,53 (9H, с), 1,67 (6H, с), 3,34-3,46 (2H, м), 4,80 (1H, шс), 5,07 (2H, с), 5,14 (1H, шс), 6,94 (1H, д, J=8,6 Гц), 7,02- 7,07 (1H, м), 7,22 (1H, с), 7,32-7,50 (5H, д), 10,53 (1H, ш).
Пример 570 : 1,09 (3H, т, J=7,3 Гц), 1,34 (9H, с), 1,53 (9H, с), 1,67 (6H, с), 3,34-3,46 (2H, м), 4,80 (1H, шс), 5,07 (2H, с), 5,14 (1H, шс), 6,94 (1H, д, J=8,6 Гц), 7,02- 7,07 (1H, м), 7,22 (1H, с), 7,32-7,50 (5H, д), 10,53 (1H, ш).
Пример 570Синтез N-(1-(2-бензилокси-5-(N’-этилгуанидино)фенил) -1-метилэтил)амина Используя соединение, полученное в Примере 569, в качестве исходного вещества, по методике, аналогичной Примеру 34, получают 58 мг названного соединения (выход 88%). 1H-ЯМР (CDCl3),  : 1,16 (3H, т, J=7,3 Гц), 1,51 (6H, с), 3,23(2H, к, J= 7,3 Гц), 3,69 (2H, ш), 5,09 (2H, с), 6,75 (1H, дд, J=8,5, 2,4 Гц), 6,89 (1H, д, J=8,5 Гц), 6,95 (1H, д, J=2,4 Гц), 7,29-7,47 (5H, м).
Пример 571 : 1,16 (3H, т, J=7,3 Гц), 1,51 (6H, с), 3,23(2H, к, J= 7,3 Гц), 3,69 (2H, ш), 5,09 (2H, с), 6,75 (1H, дд, J=8,5, 2,4 Гц), 6,89 (1H, д, J=8,5 Гц), 6,95 (1H, д, J=2,4 Гц), 7,29-7,47 (5H, м).
Пример 571Синтез т-бутилового эфира N-(1-(2-бензилокси-5-тиоуреидофенил)-1- метилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 566, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 114 мг названного соединения (выход 98%). 1H-ЯМР (CDCl3),  : 1,35 (9H, с), 1,67 (6H, с), 5,09 (2H, с), 6,16 (2H, шс), 6,95 (1H, д, J=8,6 Гц), 7,05 (1H, дд, J=8,6, 2,4 Гц), 7,27 (1H, д, J= 2,4 Гц), 7,36-7,46 (5H, м), 7,80 (1H, шс).
Пример 572 : 1,35 (9H, с), 1,67 (6H, с), 5,09 (2H, с), 6,16 (2H, шс), 6,95 (1H, д, J=8,6 Гц), 7,05 (1H, дд, J=8,6, 2,4 Гц), 7,27 (1H, д, J= 2,4 Гц), 7,36-7,46 (5H, м), 7,80 (1H, шс).
Пример 572Синтез т-бутилового эфира N-(1-(2-бензилокси-5-(S-этилизoтиoуpеидо)фенил)-1-метилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 571 в качестве исходного вещества, по методике, аналогичной Примеру 95, получают 105,5 мг названного соединения (выход 92%). 1H-ЯМР (CDCl3),  : 1,32-1,37 (3H, м), 1,34 (9H, с), 1,67 (6H, с), 3,03 (2H, к, J= 7,3 Гц), 5,04 (2H, с), 5,22 (1H, шс), 6,78 (1H, дд, J=8,6, 2,4 Гц), 6,90 1H, д, J=8,6 Гц), 6,95 (1H, д, J=2,4 Гц), 7,31-7,50 (5H, м).
Пример 573 : 1,32-1,37 (3H, м), 1,34 (9H, с), 1,67 (6H, с), 3,03 (2H, к, J= 7,3 Гц), 5,04 (2H, с), 5,22 (1H, шс), 6,78 (1H, дд, J=8,6, 2,4 Гц), 6,90 1H, д, J=8,6 Гц), 6,95 (1H, д, J=2,4 Гц), 7,31-7,50 (5H, м).
Пример 573Синтез N-(1-(2-бензилокси-5-(S-этилизотиоуреидо)фенил)-1-метилэтил)амина Используя соединение, полученное в Примере 572, в качестве исходного вещества, по методике, аналогичной Примеру 34, получают 51 мг названного соединения (выход 63%). 1H-ЯМР (CDCl3),  : 1,32 (3H, т, J=7,3 Гц), 1,68(6H, с), 2,97 (2H, к, J= 7,3 Гц), 5,15 (2H, с), 5,63 (4H, ш), 6,67 (1H, д, J=8,5 Гц), 6,77-6,82 (2H, м), 7,32-7,42 (5H, м).
Пример 574 : 1,32 (3H, т, J=7,3 Гц), 1,68(6H, с), 2,97 (2H, к, J= 7,3 Гц), 5,15 (2H, с), 5,63 (4H, ш), 6,67 (1H, д, J=8,5 Гц), 6,77-6,82 (2H, м), 7,32-7,42 (5H, м).
Пример 574Синтез метилового эфира 2-(2-бензилокси-3-нитрофенил)-2-метилпропионовой кислоты По методике, аналогичной Примеру 562, получают 140 мг названного соединения (выход 12%). 1H-ЯМР (CDCl3),  : 1,57 (6H, с), 3,38 (3H, с), 4,84 (2H, с), 7,20 (1H, т, J=7,9 Гц), 7,31-7,45 (5H, м), 7,58 (1H, дл, J=7,9, 1,8 Гц), 7,75 (1H, дд, J=7,9, 1,8 Гц).
Пример 575 : 1,57 (6H, с), 3,38 (3H, с), 4,84 (2H, с), 7,20 (1H, т, J=7,9 Гц), 7,31-7,45 (5H, м), 7,58 (1H, дл, J=7,9, 1,8 Гц), 7,75 (1H, дд, J=7,9, 1,8 Гц).
Пример 575Синтез 2-(2-бензилокси-3-нитрофенил)-2-метилпропионовой кислоты Используя соединение, полученное в Примере 574 в качестве исходного вещества, по методике, аналогичной Примеру 563, получают 370 мг названного соединения (выход 86%). 1H-ЯМР (CDCl3), 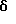 : 1,54 (6H, с), 4,83 (2H, с), 7,19 (1H, т, J=7,9 Гц), 7,29-7,41 (5H, м), 7,57 (1H, дд, J=7,9, 1,2 Гц), 7,76 (1H, дд, J=7,9, 1,2 Гц) : 1,54 (6H, с), 4,83 (2H, с), 7,19 (1H, т, J=7,9 Гц), 7,29-7,41 (5H, м), 7,57 (1H, дд, J=7,9, 1,2 Гц), 7,76 (1H, дд, J=7,9, 1,2 Гц)Пример 576 Синтез N-(1-(2-бензилокси-3-нитрофенил)-1-метилэтил)амина Используя соединение, полученное в Примере 575, в качестве исходного вещества, по методике, аналогичной Примеру 564, получают 268 мг названного соединения (выход 81%). 1H-ЯМР (CDCl3),  : 1,52 (6H, с), 2,03 (2H, с), 5,24 (2H, с), 7,14 (1H, т, J=7,9 Гц), 7,34-7,49 (5H, м), 7,68 (1H, дд, J=3,7, 1,8 Гц), 7,71 (1H, дд, J=3,7, 1,8 Гц).
Пример 577 : 1,52 (6H, с), 2,03 (2H, с), 5,24 (2H, с), 7,14 (1H, т, J=7,9 Гц), 7,34-7,49 (5H, м), 7,68 (1H, дд, J=3,7, 1,8 Гц), 7,71 (1H, дд, J=3,7, 1,8 Гц).
Пример 577Синтез т-бутилового эфира N-(1-(2-бензилокси-3-нитрофенил)-1-метилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 576 в качестве исходного вещества, по методике, аналогичной Примеру 565, получают 329 мг названного соединения (выход 91%). 1H-ЯМР (CDCl3),  : 1,37 (9H, с), 1,69 (6H, с), 4,86 (2H, с), 5,03 (1H, шс), 7,18 (1H, т, J=7,9 Гц), 7,33-7,46 (3H, м), 7,50-7,66 (2H, м), 7,67 (1H, дд, J=7,9, 1,8 Гц), 7,73 (1H, дд, J=7,9, 1,8 Гц).
Пример 578 : 1,37 (9H, с), 1,69 (6H, с), 4,86 (2H, с), 5,03 (1H, шс), 7,18 (1H, т, J=7,9 Гц), 7,33-7,46 (3H, м), 7,50-7,66 (2H, м), 7,67 (1H, дд, J=7,9, 1,8 Гц), 7,73 (1H, дд, J=7,9, 1,8 Гц).
Пример 578Синтез т-бутилового эфира N-(1-(3-амино-2-бензилоксифенил)-1-метилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 577 в качестве исходного вещества, по методике, аналогичной Примеру 566, получают 244 мг названного соединения (выход 81%). 1H-ЯМР (CDCl3),  : 1,35 (9H, с), 1,72 (6H, с), 3,67 (2H, с), 4,96 (2H, с), 5,34 (1H, ш), 6,69 (1H, дд, J=7,9, 1,8 Гц), 6,82 (1H, дд, J=7,9, 1,8 Гц), 6,90 (1H, т, J=7,9 Гц), 7,30-7,46 (3H, м), 7,51-7,55 (2H, м).
Пример 579 : 1,35 (9H, с), 1,72 (6H, с), 3,67 (2H, с), 4,96 (2H, с), 5,34 (1H, ш), 6,69 (1H, дд, J=7,9, 1,8 Гц), 6,82 (1H, дд, J=7,9, 1,8 Гц), 6,90 (1H, т, J=7,9 Гц), 7,30-7,46 (3H, м), 7,51-7,55 (2H, м).
Пример 579Синтез т-бутилового эфира N-(1-(2-бензилокси-3-(N’-т- бутоксикарбонил-N”-этилгуанидино)фенил)-1-метилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 578, как исходное вещество, по методике, аналогичной Примеру 233, получают 82,4 мг названного соединения (выход 70%). 1H-ЯМР (CDCl3),  : 1,03-1,14 (3H, м), 1,37 (9H, с), 1,20-1,60 (9H, м), 1,69 (6H, с), 3,15-3,43 (2H, м), 4,81-5,16 (3H, м), 6,97-7,23 (3H, м), 7,30-7,42 (3H, м), 7,45-7,53 (2H, м).
Пример 580 : 1,03-1,14 (3H, м), 1,37 (9H, с), 1,20-1,60 (9H, м), 1,69 (6H, с), 3,15-3,43 (2H, м), 4,81-5,16 (3H, м), 6,97-7,23 (3H, м), 7,30-7,42 (3H, м), 7,45-7,53 (2H, м).
Пример 580Синтез N-(1-(2-бензилокси-3-(N’-этилгуанидино)фенил)-1-метилэтил)амина Используя соединение, полученное в Примере 579, как исходное вещество, по методике, аналогичной Примеру 34, получают 46,5 мг названного соединения (выход 92%). 1H-ЯМР (CDCl3),  : 1,12 (3H, т, J=7,3 Гц), 1,53 (63H, с), 3,19(2H, к, J= 7,3 Гц), 5,17 (2H, с), 6,86 (1H, дд, J=7,9 1,8 Гц), 6,97 (1H, т, J=7,9 Гц), 7,04 (1H, дд, J=7,9, 1,8 Гц), 7,25-7,46 (3H, м), 7,47-7,49 (2H, м).
Пример 581 : 1,12 (3H, т, J=7,3 Гц), 1,53 (63H, с), 3,19(2H, к, J= 7,3 Гц), 5,17 (2H, с), 6,86 (1H, дд, J=7,9 1,8 Гц), 6,97 (1H, т, J=7,9 Гц), 7,04 (1H, дд, J=7,9, 1,8 Гц), 7,25-7,46 (3H, м), 7,47-7,49 (2H, м).
Пример 581Синтез т-бутилового эфира N-(1-(2-бензилокси-3-тиоуреидофенил)-1-метилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 578, как исходное вещество, по методике, аналогичной Примеру 120, получают 94 мг названного соединения (выход 99,6%). 1H-ЯМР (CDCl3),  : 1,34 (9H, с), 1,65 (6H, с), 4,92 (2H, с), 5,13 (1H, с), 6,38 (2H, шс), 7,11 (1H, т, J=7,9 Гц), 7,17-7,21 (1H, м), 7,30-7,44 (4H, м), 7,56-7,61 (2H, м), 8,37 (1H, с).
Пример 582 : 1,34 (9H, с), 1,65 (6H, с), 4,92 (2H, с), 5,13 (1H, с), 6,38 (2H, шс), 7,11 (1H, т, J=7,9 Гц), 7,17-7,21 (1H, м), 7,30-7,44 (4H, м), 7,56-7,61 (2H, м), 8,37 (1H, с).
Пример 582Синтез т-бутилового эфира N-(1-(2-бензилокси-3-(S-этилизотиоуреидо)фенил)-1-метилэтил)карбаминовой кислоты Используя соединение, полученное в Примере 581, как исходное вещество, по методике, аналогичной Примеру 95, получают 98 мг названного соединения (выход 98%). 1Н-ЯМР (CDCl3),  : 1,28 (3H, т, J=7,3 Гц), 1,35 (9H, с), 1,68 (6H, с), 3,00-3,07 (2H, м), 4,52 (2H, шс), 4,99 (2H, с), 5,17 (1H, шс), 6,80-6,85 (1H, м), 7,01 (1H, т, J=7,9 Гц), 7,11 (1H, дд, J=7,9, 1,8 Гц), 7,27-7,42 (3H, м), 7,49-7,54 (2H, м).
Пример 583 : 1,28 (3H, т, J=7,3 Гц), 1,35 (9H, с), 1,68 (6H, с), 3,00-3,07 (2H, м), 4,52 (2H, шс), 4,99 (2H, с), 5,17 (1H, шс), 6,80-6,85 (1H, м), 7,01 (1H, т, J=7,9 Гц), 7,11 (1H, дд, J=7,9, 1,8 Гц), 7,27-7,42 (3H, м), 7,49-7,54 (2H, м).
Пример 583Синтез N-(1-(2-бензилокси-3-(S-этилизотиоуреидо)фенил)-1-метилэтил)амина Используя соединение, полученное в Примере 582, как исходное вещество, по методике, аналогичной Примеру 34, получают 72 мг названного соединения (выход 95%). 1H-ЯМР (CDCl3),  : 1,30 (3H, т, J=7,3 Гц), 1,53 (6H, с), 2,12 (2H, шс), 2,96-3,08 (2H, м), 4,60 (1H, шс), 5,10 (2H, с), 6,79-6,87 (1H, м), 7,00 (1H, т, J=7,9 Гц), 7,10 (1H, дд, J=7,9, 1,8 Гц), 7,28-7,41 (5H, м), 7,47 (1H, дд, J=7,9, 1,8 Гц).
Пример 584 : 1,30 (3H, т, J=7,3 Гц), 1,53 (6H, с), 2,12 (2H, шс), 2,96-3,08 (2H, м), 4,60 (1H, шс), 5,10 (2H, с), 6,79-6,87 (1H, м), 7,00 (1H, т, J=7,9 Гц), 7,10 (1H, дд, J=7,9, 1,8 Гц), 7,28-7,41 (5H, м), 7,47 (1H, дд, J=7,9, 1,8 Гц).
Пример 584Синтез ди-т-бутилового эфира N-(5-нитро-2-(пирролидин-1-ил) фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 263, как исходное вещество и также используя пирролидин в качестве реагента, по методике, аналогичной Примеру 264, получают названное соединение (выход 80%). 1H-ЯМР (CDCl3),  : 1,47 (18H, с), 1,95-2,05 (4H, с), 3,38-3,42 (4H, м), 4,87 (2H, с), 6,70-6,80 (1H, м), 7,95-8,03 (2H, м).
Пример 585 : 1,47 (18H, с), 1,95-2,05 (4H, с), 3,38-3,42 (4H, м), 4,87 (2H, с), 6,70-6,80 (1H, м), 7,95-8,03 (2H, м).
Пример 585Синтез ди-т-бутилового эфира N-(5-амино-2-(пирролидин-1-ил)фенилметил)иминодикарбоновой кислоты. Используя соединение, полученное в Примере 584, как исходное вещество, по методике, аналогичной Примеру 2, получают названное соединение (выход 98%). 1H-ЯМР (CDCl3),  : 1,40 (18H, с), 1,84-1,88 (4H, м), 2,89-2,93 (4H, м), 4,50 (2H, шс), 4,81 (2H, с), 6,45-6,53 (2H, м), 6,88 (1H, д, J=8,3 Гц) : 1,40 (18H, с), 1,84-1,88 (4H, м), 2,89-2,93 (4H, м), 4,50 (2H, шс), 4,81 (2H, с), 6,45-6,53 (2H, м), 6,88 (1H, д, J=8,3 Гц)МС (м/з) 392 (М++1) Пример 586 Синтез ди-т-бутилового эфира N-(2-(пирролидин-1-ил)-5-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 585, как исходное вещество, по методике, аналогичной Примеру 120, получают названное соединение (выход 94%). 1H-ЯМР (CDCl3),  : 1,44 (18H, с), 1,94-1,97 (4H, м), 3,12-3,16 (4H, м), 4,78 (2H, с), 5,94 (2H, шс), 6,91-7,00 (3H, м), 7,66 (1H, шс).
МС (м/з) 450 (М+) : 1,44 (18H, с), 1,94-1,97 (4H, м), 3,12-3,16 (4H, м), 4,78 (2H, с), 5,94 (2H, шс), 6,91-7,00 (3H, м), 7,66 (1H, шс).
МС (м/з) 450 (М+)Пример 587 Синтез ди-т-бутилового эфира N-(5-(S-этилизотиоуреидо)-2-(пирролидин-1-ил)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 586, как исходное вещество, по методике, аналогичной Примеру 95, получают названное соединение (выход 85%). 1H-ЯМР (CDCl3),  : 1,33 (3H, т, J=7,3 Гц), 1,41(18H, с), 1,87-1,90 (4H, м), 2,90-3,10 (4H, м), 4,39-4,69 (2H, м), 4,81 (2H, с), 6,62-6,82 (2H, м), 6,95 (1H, д, J=8,1 Гц).
Пример 588 : 1,33 (3H, т, J=7,3 Гц), 1,41(18H, с), 1,87-1,90 (4H, м), 2,90-3,10 (4H, м), 4,39-4,69 (2H, м), 4,81 (2H, с), 6,62-6,82 (2H, м), 6,95 (1H, д, J=8,1 Гц).
Пример 588Синтез тригидрохлорида N-(5-(S-этилизотиоуреидо)-2-пирролидин- 1-ил)фенилметил)амина Используя соединение, полученное в Примере 587, как исходное вещество, по методике, аналогичной примеру 5, получают названное соединение (выход 63%). 1H-ЯМР (D2O),  : 1,41 (3H, т, J=7,3 Гц), 2,07-2,29 (4H, м), 3,25 (2H, к, J=7,5 Гц), 3,60-3,83 (4H, м), 4,46 (2H, с), 7,60-7,82 (3H, м).
МС (м/з) 278 (М+) : 1,41 (3H, т, J=7,3 Гц), 2,07-2,29 (4H, м), 3,25 (2H, к, J=7,5 Гц), 3,60-3,83 (4H, м), 4,46 (2H, с), 7,60-7,82 (3H, м).
МС (м/з) 278 (М+)Пример 589 Синтез ди-т-бутилового эфира N-(5-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-(пирролидин-1-ил)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 585, как исходное вещество, по методике, аналогичной Примеру 233, получают названное соединение (выход 71%). 1H-ЯМР (CDCl3),  : 1,06 (3H, т, J=7,3 Гц), 1,48 (18H, с), 1,59 (9H, с), 1,93-2,03 (4H, м), 3,00-3,10 (4H, м), 3,33-3,43 (2H, м), 4,58 (1H, шс), 4,79 (2H, с), 6,90-6,95 (3H, м), 10,49 (1H, шс).
Пример 590 : 1,06 (3H, т, J=7,3 Гц), 1,48 (18H, с), 1,59 (9H, с), 1,93-2,03 (4H, м), 3,00-3,10 (4H, м), 3,33-3,43 (2H, м), 4,58 (1H, шс), 4,79 (2H, с), 6,90-6,95 (3H, м), 10,49 (1H, шс).
Пример 590Синтез тригидрохлорида N-(5-(N’-этилгуанидино)-2-(пирролидин-1-ил)фенилметил)амина Используя соединение, полученное в Примере 589, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 91%). 1H-ЯМР (D2O),  : 1,24 (3H, т, J=7,3 Гц), 2,29-2,31 (4H, м), 3,35 (2H, к, J=7,3 Гц), 3,84-4,00 (4H, м), 4,45 (2H, с), 7,51-7,78 (3H, м).
Пример 591 : 1,24 (3H, т, J=7,3 Гц), 2,29-2,31 (4H, м), 3,35 (2H, к, J=7,3 Гц), 3,84-4,00 (4H, м), 4,45 (2H, с), 7,51-7,78 (3H, м).
Пример 591Синтез т-бутилового эфира N-(2-(4-(N’-т-бутоксикарбонил-N”-этилгуанидино)-3-метоксифенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 490, как исходное вещество, по методике, аналогичной Примеру 233, получают 12 мг названного соединения (выход 16%). 1H-ЯМР (CDCl3),  : 1,05-1,20 (3H, м), 1,44 (9H, с), 1,52 (9H, с), 2,78 (2H, т, J=6,9 Гц), 3,32-3,47 (4H, м), 3,84 (3H, с), 4,57 (1H, шс), 6,74-6,92 (3H, м).
Пример 592 : 1,05-1,20 (3H, м), 1,44 (9H, с), 1,52 (9H, с), 2,78 (2H, т, J=6,9 Гц), 3,32-3,47 (4H, м), 3,84 (3H, с), 4,57 (1H, шс), 6,74-6,92 (3H, м).
Пример 592Синтез дигидрохлорида N-(2-(4-(N’-этилгуанидино)-3-метоксифенил)этил)амина Используя соединение, полученное в Примере 591, как исходное вещество, по методике, аналогичной Примеру 5, получают 8 мг названного соединения (выход 94%). 1H-ЯМР (D2O),  : 1,20 (3H, т, J=7,3 Гц), 3,03 (2H, т, J=7,3 Гц), 3,24-3,33 (4H, м), 3,89 (3H, с), 6,99 (1H, д, J=7,9 Гц), 7,10 (1H, с), 7,27 (1H, д, J=7,9 Гц).
Пример 593 : 1,20 (3H, т, J=7,3 Гц), 3,03 (2H, т, J=7,3 Гц), 3,24-3,33 (4H, м), 3,89 (3H, с), 6,99 (1H, д, J=7,9 Гц), 7,10 (1H, с), 7,27 (1H, д, J=7,9 Гц).
Пример 593Синтез т-бутилового эфира N-(2-(4-(N’-т-бутоксикарбонил-N”-этилгуанидино)-3-хлорфенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 495, как исходное вещество, по методике, аналогичной Примеру 233, получают 27 мг названного соединения (выход 17%). 1H-ЯМР (CDCl3),  : 1,27 (3H, т, J=7,3 Гц), 1,44 (9H, с), 2,75 (2H, т, J=6,9 Гц), 3,30-3,50 (4H, м), 4,53 (1H, шс), 7,00-7,30 (3H, м).
Пример 594 : 1,27 (3H, т, J=7,3 Гц), 1,44 (9H, с), 2,75 (2H, т, J=6,9 Гц), 3,30-3,50 (4H, м), 4,53 (1H, шс), 7,00-7,30 (3H, м).
Пример 594Синтез дигидрохлорида N-(2-(3-хлор-4-(N’-этилгуанидино)фенил)этил)амина Используя соединение, полученное в Примере 593, как исходное вещество, по методике, аналогичной Примеру 5, получают 17 мг названного соединения (выход 88%). 1H-ЯМР (D2O),  : 1,22 (3H, т, J=7,3 Гц), 3,04 (2H, т, J=7,3 Гц), 3,27-3,36 (4H, м), 7,33-7,44 (2H, м), 7,56 (1H, с).
Пример 595 : 1,22 (3H, т, J=7,3 Гц), 3,04 (2H, т, J=7,3 Гц), 3,27-3,36 (4H, м), 7,33-7,44 (2H, м), 7,56 (1H, с).
Пример 595Синтез т-бутилового эфира N-(2-(4-(N’-т-бутоксикарбонил- N”-этилгуанидино)-3-фторофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 504, как исходное вещество, по методике, аналогичной Примеру 233, получают 90 мг названного соединения (выход 54%). 1H-ЯМР (CDCl3),  : 1,10-1,32 (3H, м), 1,44 (9H, с), 1,48 (9H, с), 2, 77 (2H, т, J=6,9 Гц), 3,35-3,46 (4H, м), 4,55 (1H, шс), 6,90-7,00 (3H, м).
Пример 596 : 1,10-1,32 (3H, м), 1,44 (9H, с), 1,48 (9H, с), 2, 77 (2H, т, J=6,9 Гц), 3,35-3,46 (4H, м), 4,55 (1H, шс), 6,90-7,00 (3H, м).
Пример 596Синтез дигидрохлорида N-(2-(4-(N’-т-бутоксикарбонил-N”- этилгуанидино)-3-фторофенил)этил)амина Используя соединение, полученное в Примере 595, как исходное вещество, по методике, аналогичной Примеру 5, получают 53 мг названного соединения (выход 93%). 1H-ЯМР (D2O),  : 1,22 (3H, т, J=7,3 Гц), 3,04 (2H, т, J=7,3 Гц), 3,27-3,36 (4H, м), 7,19-7,41 (3H, м).
Пример 597 : 1,22 (3H, т, J=7,3 Гц), 3,04 (2H, т, J=7,3 Гц), 3,27-3,36 (4H, м), 7,19-7,41 (3H, м).
Пример 597Синтез т-бутилового эфира N-(1-(3-(N’-т-бутоксикарбонил)-N”-этилгуанидино)фенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 9, как исходное вещество, по методике, аналогичной Примеру 233, получают 280 мг названного соединения (выход 81%). 1H-ЯМР (CDCl3),  : 1,02-1,20 (3H, м), 1,42 (12H, шс), 1,51 (9H, с), 3,38-3,42 (2H, м), 4,64-4,90 (2H, м), 6,90-7,20(4H, м).
Пример 598 : 1,02-1,20 (3H, м), 1,42 (12H, шс), 1,51 (9H, с), 3,38-3,42 (2H, м), 4,64-4,90 (2H, м), 6,90-7,20(4H, м).
Пример 598Синтез дигидрохлорида N-(1-(3-(N’-этилгуанидино)фенил)этил)амина Используя соединение, полученное в Примере 597, как исходное вещество, по методике, аналогичной Примеру 5, получают 54 мг названного соединения (выход 88%). 1H-ЯМР (D2O),  : 1,22 (3H, т, J=7,3 Гц), 1,65 (3H, д, J=6,9 Гц), 3,32 (2H, к, J=7,3 Гц), 4,57 (1H, к, J=6,9 Гц), 7,34- 7,60 (4H, м).
Пример 599 : 1,22 (3H, т, J=7,3 Гц), 1,65 (3H, д, J=6,9 Гц), 3,32 (2H, к, J=7,3 Гц), 4,57 (1H, к, J=6,9 Гц), 7,34- 7,60 (4H, м).
Пример 599Синтез т-бутилового эфира N-(2-(4-(N’-т-бутоксикарбонил-N”-этилгуанидино)-3-метилфенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 523, как исходное вещество, по методике, аналогичной Примеру 233, получают 43,5 мг названного соединения (выход 39%). 1H-ЯМР (CDCl3),  : 10,5 (1H, шс), 7,18-7,00 (3H, м), 4,57 (1H, шс), 4,40 (1H, шс), 3,36 (2H, дт, J=5,4, 6,4 Гц), 2,76 (2H, т, J=6,4 Гц), 2,23 (3H, с), 1,52 (9H, с), 1,44 (9H, с), 1,03-1,19 (3H, м).
Пример 600 : 10,5 (1H, шс), 7,18-7,00 (3H, м), 4,57 (1H, шс), 4,40 (1H, шс), 3,36 (2H, дт, J=5,4, 6,4 Гц), 2,76 (2H, т, J=6,4 Гц), 2,23 (3H, с), 1,52 (9H, с), 1,44 (9H, с), 1,03-1,19 (3H, м).
Пример 600Синтез дигидрохлорида N-(2-(4-(N’-этилгуанидино)- 3-метилфенил)этил)амина Используя соединение, полученное в Примере 599, как исходное вещество, по методике, аналогичной примеру 5, получают 28,3 мг названного соединения (выход 93%). 1H-ЯМР (ДМСО-d6),  : 9,54 (1H, с), 8,00-8,25 (4H, м), 7,80 (1H, шс), 7,50 (2H, шс), 7,23 (1H, с), 7,20-7,12 (2H, м), 3,34- 3,17 (2H, м), 3,18-2,82 (4H, м), 2,19 (3H, с), 1,11 (3H, т, J=7,1 Гц).
Пример 601 : 9,54 (1H, с), 8,00-8,25 (4H, м), 7,80 (1H, шс), 7,50 (2H, шс), 7,23 (1H, с), 7,20-7,12 (2H, м), 3,34- 3,17 (2H, м), 3,18-2,82 (4H, м), 2,19 (3H, с), 1,11 (3H, т, J=7,1 Гц).
Пример 601Синтез т-бутилового эфира N-(3-хлор-4-гидроксиметилфенил)карбаминовой кислоты Воду добавляют к 4-амино-2-хлорбензиловому спирту (1,0125 г) и, после добавления гидроксида натрия (283 мг) и ди-т-бутилдикарбоната (1,543 г) при комнатной температуре, смесь перемешивают на протяжении ночи при комнатной температуре. К реакционной смеси добавляют этилацетат и органический слой промывают водой один раз, сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=3:1), получая 1,0576 г названного соединения (выход 64%). 1H-ЯМР(CDCl3),  : 7,56 (1H, д, J=2,1 Гц), 7,35 (1H, д, J=8,3 Гц), 7,15 (1H, дд, J= 2,1, 8,3 Гц), 6,55 (1H, с), 4,71 (2H, с), 2,01 (1H, шс), 1,52 (9H, с).
Пример 602 : 7,56 (1H, д, J=2,1 Гц), 7,35 (1H, д, J=8,3 Гц), 7,15 (1H, дд, J= 2,1, 8,3 Гц), 6,55 (1H, с), 4,71 (2H, с), 2,01 (1H, шс), 1,52 (9H, с).
Пример 602Синтез т-бутилового эфира N-(3-хлор-4-цианометилфенил)карбаминовой кислоты Соединение (555,3 мг), полученное в Примере 601, растворяют в метиленхлориде (10 мл); к раствору последовательно при охлаждении льдом добавляют трифенилфосфин (735 мг) и четырехбромистый углерод (930 мг) и смесь перемешивают в течение 30 мин, затем перемешивают при комнатной температуре в течение 30 мин. Затем, растворитель отгоняют при пониженном давлении и полученный остаток растворяют в диметилсульфоксиде (5 мл); к раствору добавляют цианид калия (117,8 мг), нагревают при 50oC и перемешивают в течение 10 мин. К полученной реакционной смеси добавляют этилацетат и органический слой промывают водой дважды, сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=3:1), получая 89,6 мг названного соединения (выход 16%). 1H-ЯМР(CDCl3),  : 7,66 (1H, д, J=2,2 Гц), 7,39 (1H, д, J=8,6 Гц), 7,18 (1H, дд, J=2,2, 8,6 Гц), 6,53 (1H, шс), 3,78 (2H, с), 1,52 (9H, с).
Пример 603 : 7,66 (1H, д, J=2,2 Гц), 7,39 (1H, д, J=8,6 Гц), 7,18 (1H, дд, J=2,2, 8,6 Гц), 6,53 (1H, шс), 3,78 (2H, с), 1,52 (9H, с).
Пример 603Синтез 3-хлор-4-цианометиланилина Используя соединение, полученное в Примере 602, как исходное вещество, по методике, аналогичной Примеру 521, получают 184,7 мг названного соединения (выход 88%). 1H-ЯМР (CDCl3),  : 7,21 (1H, д, J=8,1 Гц), 6,73 (1H, д, J=2,5 Гц), 6,57 (1H, дд, J=2,5, 8,3 Гц), 3,80 (2H, шс), 3,71 (2H, с).
Пример 604 : 7,21 (1H, д, J=8,1 Гц), 6,73 (1H, д, J=2,5 Гц), 6,57 (1H, дд, J=2,5, 8,3 Гц), 3,80 (2H, шс), 3,71 (2H, с).
Пример 604Синтез 4-(2-аминоэтил)-3-хлоранилина Используя соединение, полученное в Примере 603, как исходное вещество, по методике, аналогичной Примеру 252, получают 189 мг названного соединения (выход 100%). 1H-ЯМР (CDCl3),  : 7,00 (1H, д, J=8,3 Гц), 6,71 (1H, д, J=2,4 Гц), 6,52 (1H, дд, J= 2,4, 8,3 Гц), 3,64 (2H, шс), 2,98-2,87 (2H, м), 2,83-2,71 (2H, м), 1,24 (2H, шс).
Пример 605 : 7,00 (1H, д, J=8,3 Гц), 6,71 (1H, д, J=2,4 Гц), 6,52 (1H, дд, J= 2,4, 8,3 Гц), 3,64 (2H, шс), 2,98-2,87 (2H, м), 2,83-2,71 (2H, м), 1,24 (2H, шс).
Пример 605Синтез т-бутилового эфира N-(2-(4-амино-2-хлорфенил) этил)карбаминовой кислоты Используя соединение, полученное в Примере 604, как исходное вещество, по методике, аналогичной Примеру 253, получают 208,3 мг названного соединения (выход 64%). 1H-ЯМР (CDCl3),  : 6,98 (1H, д, J=8,1 Гц), 6,70 (1H, д, J=2,4 Гц), 6,52 (1H, дд, J=2,4, 8,1 Гц), 4,55(1H, шс), 3,64 (2H, шс), 3,32 (2H, дт, J=6,6, 6,6 Гц), 2,81 (2H, т, J=6,6 Гц), 2,81 (2H, т, J=6,6 Гц), 1,43 (9H, с).
Пример 606 : 6,98 (1H, д, J=8,1 Гц), 6,70 (1H, д, J=2,4 Гц), 6,52 (1H, дд, J=2,4, 8,1 Гц), 4,55(1H, шс), 3,64 (2H, шс), 3,32 (2H, дт, J=6,6, 6,6 Гц), 2,81 (2H, т, J=6,6 Гц), 2,81 (2H, т, J=6,6 Гц), 1,43 (9H, с).
Пример 606Синтез т-бутилового эфира N-(2-(2-хлор-4-тиоуреидофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 605, как исходное вещество, по методике, аналогичной Примеру 120, получают 78,9 мг названного соединения (выход 100%). 1H-ЯМР (CDCl3),  : 8,42 (1H, шс), 7,38-7,20 (2H, м), 7,17- 7,04 (1H, м), 6,30 (2H, шс), 4,69 (1H, шс), 3,38 (2H, дт, J=6,6, 6,6 Гц), 2,94 (2H, т, J=6,6 Гц), 1,42 (9H, с).
Пример 607 : 8,42 (1H, шс), 7,38-7,20 (2H, м), 7,17- 7,04 (1H, м), 6,30 (2H, шс), 4,69 (1H, шс), 3,38 (2H, дт, J=6,6, 6,6 Гц), 2,94 (2H, т, J=6,6 Гц), 1,42 (9H, с).
Пример 607Синтез т-бутилового эфира N-(2-(2-хлор-4-(S-этилизотиоуреидо)фенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 606 как исходное вещество, по методике, аналогичной Примеру 27, получают 66,7 мг названного соединения (выход 78%). 1H-ЯМР (CDCl3),  : 7,15 (1H, д, J=8,3 Гц), 6,96 (1H, д, J=2,2 Гц), 6,77 (1H, дд, J=2,2, 8,3 Гц), 4,58 (1H, шс), 4,28 (2H, шс), 3,36 (2H, дт, J=6,6, 6,6 Гц), 3,01 (2H, к, J=7,3 Гц), 2,88 (2H, т, J=6,6 Гц), 1,44 (9H, с), 1,36 (3H, т, J=7,3 Гц).
Пример 608 : 7,15 (1H, д, J=8,3 Гц), 6,96 (1H, д, J=2,2 Гц), 6,77 (1H, дд, J=2,2, 8,3 Гц), 4,58 (1H, шс), 4,28 (2H, шс), 3,36 (2H, дт, J=6,6, 6,6 Гц), 3,01 (2H, к, J=7,3 Гц), 2,88 (2H, т, J=6,6 Гц), 1,44 (9H, с), 1,36 (3H, т, J=7,3 Гц).
Пример 608Синтез дигидрохлорида N-(2-(2-хлор-4-(S-этилизотио уреидо)фенил)этил)амина Используя соединение, полученное в Примере 607, как исходное вещество, по методике, аналогичной Примеру 5, получают 65,3 мг названного соединения (выход 100%). 1H-ЯМР (ДМСО-d6),  : 11,88 (1H, шс), 9,58 (2H, шс), 8,32 (3H, шс), 7,53 (1H, д, J=8,1 Гц), 7,52 (1H, д, J=2,2 Гц), 4,10-3,60 (2H, м), 3,35 (2H, к, J=7,3 Гц), 3,14-2,93 (2H, м), 1,30 (3H, т, J=7,3 Гц).
Пример 609 : 11,88 (1H, шс), 9,58 (2H, шс), 8,32 (3H, шс), 7,53 (1H, д, J=8,1 Гц), 7,52 (1H, д, J=2,2 Гц), 4,10-3,60 (2H, м), 3,35 (2H, к, J=7,3 Гц), 3,14-2,93 (2H, м), 1,30 (3H, т, J=7,3 Гц).
Пример 609Синтез т-бутилового эфира N-(2-(4-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-хлорфенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 605, как исходное вещество, по методике, аналогичной Примеру 233, получают 71,5 мг названного соединения (выход 52%). 1H-ЯМР (CDCl3),  : 10,70 (1H, шс), 7,25-6,72 (4H, м), 4,58 (1H, шс), 3,47-3,27 (4H, м), 2,91 (2H, т, J=6,4 Гц), 1,49 (9H, с), 1,44 (9H, с), 1,19 (3H, т, J=7,3 Гц).
Пример 610 : 10,70 (1H, шс), 7,25-6,72 (4H, м), 4,58 (1H, шс), 3,47-3,27 (4H, м), 2,91 (2H, т, J=6,4 Гц), 1,49 (9H, с), 1,44 (9H, с), 1,19 (3H, т, J=7,3 Гц).
Пример 610Синтез дигидрохлорида N-(2-(2-хлор-4-(N’-этилгуанидино)фенил)этил)амина Используя соединение, полученное в Примере 609, как исходное вещество, по методике, аналогичной Примеру 5, получают 51,7 мг названного соединения (выход 100%). 1H-ЯМР (ДМСО-d6),  : 9,98 (1H, с), 8,35 (3H, шс), 8,11 (1H, шс), 7,83 (2H, шс), 7,44 (1H, д, J=8,3 Гц), 7,35 (1H, д, J=2,2 Гц), 7,18 (1H, дд, J= 2,2, 8,3 Гц), 5,00- 3,50 (2H, м), 3,36-3,15 (2H, м), 3,10-2,90 (2H, м), 1,13 (3H, т, J=7,1 Гц).
Пример 611 : 9,98 (1H, с), 8,35 (3H, шс), 8,11 (1H, шс), 7,83 (2H, шс), 7,44 (1H, д, J=8,3 Гц), 7,35 (1H, д, J=2,2 Гц), 7,18 (1H, дд, J= 2,2, 8,3 Гц), 5,00- 3,50 (2H, м), 3,36-3,15 (2H, м), 3,10-2,90 (2H, м), 1,13 (3H, т, J=7,1 Гц).
Пример 611Синтез ди-т-бутилового эфира N-(2-(N-бензил-N-метиламино)-5-нитрофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 263, как исходное вещество и также используя N-метилбензиламин в качестве реагента, по методике, аналогичной Примеру 264, получают названное соединение (выход 56%). 1H-ЯМР (CDCl3),  : 1,47 (18H, с), 2,73 (2H, с), 4,19 (2H, с), 4,93 (2H, с), 7,07 (1H, д, J=8,9 Гц), 7,26- 7,33 (5H, м), 8,03-8,09 (2H, м).
Пример 612 : 1,47 (18H, с), 2,73 (2H, с), 4,19 (2H, с), 4,93 (2H, с), 7,07 (1H, д, J=8,9 Гц), 7,26- 7,33 (5H, м), 8,03-8,09 (2H, м).
Пример 612Синтез ди-т-бутилового эфира N-(5-амино-2-(N-бензил-N-метиламино)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 611, как исходное вещество, по методике, аналогичной Примеру 566, получают названное соединение (выход 91%). 1H-ЯМР (CDCl3),  : 1,43 (18H, с), 2,48 (3H, с), 3,50 (2H, с), 3,91 (2H, с), 4,98 (2H, с), 6,45-6,47 (1H, м), 6,52- 6,56 (1H, м), 6,98 (1H, д, J=8,3 Гц), 7,25-7,40 (5H, м).
Пример 613 : 1,43 (18H, с), 2,48 (3H, с), 3,50 (2H, с), 3,91 (2H, с), 4,98 (2H, с), 6,45-6,47 (1H, м), 6,52- 6,56 (1H, м), 6,98 (1H, д, J=8,3 Гц), 7,25-7,40 (5H, м).
Пример 613Синтез т-бутилового эфира N-(2-(N-бензил-N-метиламино)-5-тиоуреидофенилметил)иминодикарбоновой кислоты. Используя соединение, полученное в Примере 612, как исходное вещество, по методике, аналогичной Примеру 120, получают названное соединение (выход 94%). 1H-ЯМР (CDCl3),  : 1,46 (18H, с), 2,59 (3H, с), 4,02 (2H, с), 4,96 (2H, с), 6,03 (2H, шс), 6,98-7,00 (1H, м), 7,03-7,08 (1H, м), 7,16 (1H, д, J=8,3 Гц), 7,26-7,37 (5H, м), 7,80 (1H, шс).
Пример 614 : 1,46 (18H, с), 2,59 (3H, с), 4,02 (2H, с), 4,96 (2H, с), 6,03 (2H, шс), 6,98-7,00 (1H, м), 7,03-7,08 (1H, м), 7,16 (1H, д, J=8,3 Гц), 7,26-7,37 (5H, м), 7,80 (1H, шс).
Пример 614Синтез тригидрохлорида N-(2-N-бензил-N-метиламино)-5-(S-этилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 613, как исходное вещество, проводят обработку, как в Примере 95, и полученное соединение подвергают обработке, как в Примере 5, с получением названного соединения (выход 95%). 1H-ЯМР (D2O),  : 1,41 (3H, т, J=7,3 Гц), 3,12 (3H, с), 3,23 (2H, к, J= 7,3 Гц), 3,94 (2H, с), 4,46 (2H, с), 7,20-7,23 (2H, м), 7,34-7,46 (4H, м), 7,58 (1H, дд, J=8,3, 2,6 Гц), 7,76 (1H, д, J=8,9 Гц).
Пример 615 : 1,41 (3H, т, J=7,3 Гц), 3,12 (3H, с), 3,23 (2H, к, J= 7,3 Гц), 3,94 (2H, с), 4,46 (2H, с), 7,20-7,23 (2H, м), 7,34-7,46 (4H, м), 7,58 (1H, дд, J=8,3, 2,6 Гц), 7,76 (1H, д, J=8,9 Гц).
Пример 615Синтез ди-т-бутилового эфира N-(2-(N-бензил-N-метиламино)-5-(N’-т-бутоксикарбонил-N”-этилгуанидино)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 612, как исходное вещество, по методике, аналогичной Примеру 233, получают названное соединение (выход 58%). 1H-ЯМР (CDCl3),  : 1,05-1,11 (3H, м), 1,45 (18H, с), 1,53 (9H, с), 2,58 (3H, с), 3,32-3,45 (2H, м), 4,01 (2H, с), 4,97 (2H, с), 6,92-7,17 (3H, м), 7,26-7,39 (5H, м).
Пример 616 : 1,05-1,11 (3H, м), 1,45 (18H, с), 1,53 (9H, с), 2,58 (3H, с), 3,32-3,45 (2H, м), 4,01 (2H, с), 4,97 (2H, с), 6,92-7,17 (3H, м), 7,26-7,39 (5H, м).
Пример 616Синтез тригидрохлорида N-(2-(N-бензил-N-метиламино)-5-(N’-этилгуанидино)фенилметил)амина Используя соединение, полученное в Примере 615, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 89%). 1H-ЯМР (D2O),  : 1,23 (3H, т, J=7,6 Гц), 3,23 (3H, с), 3,33 (2H, к, J= 7,6 Гц), 3,82 (2H, с), 4,54 (2H, с), 7,18-7,25 (3H, м), 7,34-7,48 (3H, м), 7,53 (1H, дд, J=8,9, 2,3 Гц), 7,77 (1H, д, J=8,9 Гц).
Пример 617 : 1,23 (3H, т, J=7,6 Гц), 3,23 (3H, с), 3,33 (2H, к, J= 7,6 Гц), 3,82 (2H, с), 4,54 (2H, с), 7,18-7,25 (3H, м), 7,34-7,48 (3H, м), 7,53 (1H, дд, J=8,9, 2,3 Гц), 7,77 (1H, д, J=8,9 Гц).
Пример 617Синтез N-(1-(2-метил-3-нитрофенил)этил)фталимида Используя 1-(2-метил-3-нитрофенил)этанол в качестве исходного вещества, по методике, аналогичной Примеру 179, получают названное соединение (выход 52%). 1H-ЯМР (ДМСО-d6),  : 1,81 (3H, д, J=7,3 Гц), 2,31 (3H, с), 5,69 (1H, к, J= 7,3 Гц), 7,48 (1H, дд, J=7,9, 7,9 Гц), 7,75 (1H, д, J=7,9 Гц), 7,84 (4H, с), 7,97 (1H, д, J=7 Гц).
Пример 618 : 1,81 (3H, д, J=7,3 Гц), 2,31 (3H, с), 5,69 (1H, к, J= 7,3 Гц), 7,48 (1H, дд, J=7,9, 7,9 Гц), 7,75 (1H, д, J=7,9 Гц), 7,84 (4H, с), 7,97 (1H, д, J=7 Гц).
Пример 618Синтез т-бутилового эфира N-(1-(2-метил-3-нитрофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 617, как исходное вещество, по методике, аналогичной Примеру 309, получают названное соединение (выход 85%). 1H-ЯМР (CDCl3),  : 1,40 (9H,с), 1,41 (3H, д, J=6,3 Гц), 2,46 (3H, с), 4,83 (1H, шс), 4,98-5,14 (1H, м), 7,31 (1H, дл, J=7,9, 7,9 Гц), 7,53 (1H, д, J=7,9 Гц), 7,61 (1H, д, J=7,9 Гц).
Пример 619 : 1,40 (9H,с), 1,41 (3H, д, J=6,3 Гц), 2,46 (3H, с), 4,83 (1H, шс), 4,98-5,14 (1H, м), 7,31 (1H, дл, J=7,9, 7,9 Гц), 7,53 (1H, д, J=7,9 Гц), 7,61 (1H, д, J=7,9 Гц).
Пример 619Синтез т-бутилового эфира N-(1-(3-амино-2-метилфенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 618, как исходное вещество, по методике, аналогичной Примеру 566, получают названное соединение (выход 70%). 1H-ЯМР (CDCl3),  : 1,41 (3H, д, J=6,3 Гц), 1,42 (9H, с), 2,14 (3H, с), 3,61 (2H, шс), 4,74 (1H, шс), 4,98- 5,15 (1H, м), 6,62 (1H, д, J=7,9 Гц), 6,74 (1H, д, J=7,9 Гц), 7,02 (1H, дд, J=7,9, 7,9 Гц).
Пример 620 : 1,41 (3H, д, J=6,3 Гц), 1,42 (9H, с), 2,14 (3H, с), 3,61 (2H, шс), 4,74 (1H, шс), 4,98- 5,15 (1H, м), 6,62 (1H, д, J=7,9 Гц), 6,74 (1H, д, J=7,9 Гц), 7,02 (1H, дд, J=7,9, 7,9 Гц).
Пример 620Синтез т-бутилового эфира N-(1-(2-метил-3-тиоуреидофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 619, как исходное вещество, по методике, аналогичной Примеру 120, получают названное соединение, количественно. 1H-ЯМР (CDCl3),  : 1,39 (3H, д, J=6,3 Гц), 1,41 (9H, с), 2,33 (3H, с), 4,89 (1H, шс), 4,90-5,03 (1H, м), 7,15 (1H, д, J=7,6 Гц), 7,24-7,34 (2H, м), 7,71 (1H, шс).
Пример 621 : 1,39 (3H, д, J=6,3 Гц), 1,41 (9H, с), 2,33 (3H, с), 4,89 (1H, шс), 4,90-5,03 (1H, м), 7,15 (1H, д, J=7,6 Гц), 7,24-7,34 (2H, м), 7,71 (1H, шс).
Пример 621Синтез т-бутилового эфира N-(1-(3-(S-этилизотиоуреидо)-2-метилфенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 620, как исходное вещество, по методике, аналогичной Примеру 95, получают названное соединение (выход 80%). 1H-ЯМР (CDCl3),  : 1,36-1,45 (3H, м), 1,40 (3H, д, J=7,3 Гц), 1,42 (9H, с), 2,16 (3H, с), 3,02-3,18 (2H, м), 4,36 (1H, шс), 4,75 (1H, шс), 4,93-5,08 (1H, м), 6,73 (1H, д, J=7,6 Гц), 6,98 (1H, д, J=7,6 Гц), 7,13 (1H, дд, J= 7,6, 7,6 Гц).
Пример 622 : 1,36-1,45 (3H, м), 1,40 (3H, д, J=7,3 Гц), 1,42 (9H, с), 2,16 (3H, с), 3,02-3,18 (2H, м), 4,36 (1H, шс), 4,75 (1H, шс), 4,93-5,08 (1H, м), 6,73 (1H, д, J=7,6 Гц), 6,98 (1H, д, J=7,6 Гц), 7,13 (1H, дд, J= 7,6, 7,6 Гц).
Пример 622Синтез дигидрохлорида N-(1-(3-(S-этилизотиоуреидо)-2-метилфенил)этил)амина Используя соединение, полученное в Примере 621, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 92%). 1H-ЯМР (D2O),  : 1,43 (3H, т, J=7,3 Гц), 1,62 (3H, д, J=6,9 Гц), 2,29 (3H, с), 3,24-3,28 (2H, м), 4,88 (1H, к, J=6,9 Гц), 7,37 (1H, дд, J=7,9, 1,3 Гц), 7,50 (1H, дд, J=-7,9, 7,9 Гц), 7,60 (1H, дд, J=7,9, 1,3 Гц).
Пример 623 : 1,43 (3H, т, J=7,3 Гц), 1,62 (3H, д, J=6,9 Гц), 2,29 (3H, с), 3,24-3,28 (2H, м), 4,88 (1H, к, J=6,9 Гц), 7,37 (1H, дд, J=7,9, 1,3 Гц), 7,50 (1H, дд, J=-7,9, 7,9 Гц), 7,60 (1H, дд, J=7,9, 1,3 Гц).
Пример 623Синтез т-бутилового эфира N-(1-(3-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-метилфенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 619, как исходное вещество, по методике, аналогичной Примеру 233, получают названное соединение (выход 38%). 1H-ЯМР (CDCl3),  : 1,00-1,20 (3H, м), 1,40 (3H, д, J=7,3 Гц), 1,41 (9H, с), 1,54 (9H, с), 2,29 (3H, с), 3,36- 3,45 (2H, м), 4,80 (1H, шс), 4,90-5,10 (1H, м), 7,10-7,30 (2H, м).
Пример 624 : 1,00-1,20 (3H, м), 1,40 (3H, д, J=7,3 Гц), 1,41 (9H, с), 1,54 (9H, с), 2,29 (3H, с), 3,36- 3,45 (2H, м), 4,80 (1H, шс), 4,90-5,10 (1H, м), 7,10-7,30 (2H, м).
Пример 624Синтез дигидрохлорида N-(1-(3-(N’-этилгуанидино)-2-метилфенил)этил)амина Используя соединение, полученное в Примере 623, как исходное вещество, по методике, аналогичной Примеру 5, получают названное соединение (выход 92%). 1H-ЯМР (D2O),  : 1,22 (3H, т, J=7,3 Гц), 1,62 (3H, д, J=6,6 Гц), 2,28 (3H, с), 3,31 (2H, к, J=7,3 Гц), 4,87 (1H, к, J=6,6 Гц), 7,34 (1H, дд, J= 7,6, 1,3 Гц), 7,45 (1H, дд, J=7,6, 7,6 Гц), 7,53 (1H, дд J=7,6, 1,3 Гц).
Пример 625 : 1,22 (3H, т, J=7,3 Гц), 1,62 (3H, д, J=6,6 Гц), 2,28 (3H, с), 3,31 (2H, к, J=7,3 Гц), 4,87 (1H, к, J=6,6 Гц), 7,34 (1H, дд, J= 7,6, 1,3 Гц), 7,45 (1H, дд, J=7,6, 7,6 Гц), 7,53 (1H, дд J=7,6, 1,3 Гц).
Пример 625Синтез N-бензоил-4-тиоуреидобензиламина Используя 4-амино-N-бензоилбензиламин в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 143,5 мг названного соединения (выход 76%). 1H-ЯМР (ДМСО-d6),  : 4,44 (2H, д, J=5,9 Гц), 7,20-7,38 (5H, м), 7,40-7,58 (4H, м), 7,89 (1H, д, J=6,6 Гц), 9,03 (1H, т, J=5,9 Гц), 9,64 (1H, с).
Пример 626 : 4,44 (2H, д, J=5,9 Гц), 7,20-7,38 (5H, м), 7,40-7,58 (4H, м), 7,89 (1H, д, J=6,6 Гц), 9,03 (1H, т, J=5,9 Гц), 9,64 (1H, с).
Пример 626Синтез N-бензоил-4-(S-этилизотиоуреидо)бензиламина К смеси N-бензоил-4-тиоуреидобензиламина (139,1 мг) и ацетонитрила (10 мл) добавляют этилиодид (0,5 мл) и кипятят с обратным холодильником в течение 3 ч. К реакционной смеси добавляют насыщенный водный раствор бикарбоната натрия и ее экстрагируют этилацетатом. Органический слой промывают последовательно водой и насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – хлороформ: метанол=20:1), получая 134,8 мг названного соединения (выход 88%). 1H-ЯМР (CDCl3),  : 1,36 (3H, т, J=6,9 Гц), 2,67 (1H, шс), 2,90-3,11 (2H, м), 4,46 (1H, шс), 4,60 (2H, д, J=5,6 Гц), 6,25-6,41 (1H, м), 6,91 (2H, шд, J=8,3 Гц), 7,29 (2H, д, J=8,3 Гц), 7,38-7,53 (3H, м), 7,75-7,83 (3H, м), 7,79 (2H, д, J=6,6 Гц).
Пример 627 : 1,36 (3H, т, J=6,9 Гц), 2,67 (1H, шс), 2,90-3,11 (2H, м), 4,46 (1H, шс), 4,60 (2H, д, J=5,6 Гц), 6,25-6,41 (1H, м), 6,91 (2H, шд, J=8,3 Гц), 7,29 (2H, д, J=8,3 Гц), 7,38-7,53 (3H, м), 7,75-7,83 (3H, м), 7,79 (2H, д, J=6,6 Гц).
Пример 627Синтез N-бензоил-4-(N’-т-бутоксикарбонил-N”-этилгуанидино)бензиламина Используя соединение, полученное в Примере 625, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают 180,8 мг названного соединения (выход 66%). 1H-ЯМР (CDCl3),  : 1,10-1,21 (3H, м), 1,47 (9H, с), 3,32- 3,48 (2H, м), 4,62 (2H, д, J= 5,9 Гц), 6,62 (1H, шс), 7,11 (2H, шс), 7,25-7,60 (6H, м), 7,78-7,88 (2H, м), 10,70 (1H, шс).
Пример 628 : 1,10-1,21 (3H, м), 1,47 (9H, с), 3,32- 3,48 (2H, м), 4,62 (2H, д, J= 5,9 Гц), 6,62 (1H, шс), 7,11 (2H, шс), 7,25-7,60 (6H, м), 7,78-7,88 (2H, м), 10,70 (1H, шс).
Пример 628Синтез N-бензоил-3-(N’-этилгуанидино)бензиламина Смесь соединения (180,8 мг), полученного в Примере 627, и трифторуксусной кислоты (5 мл) перемешивают при комнатной температуре в течение 30 мин. Реакционную смесь концентрируют при пониженном давлении и, после добавления насыщенного водного раствора бикарбоната натрия, экстрагируют этилацетатом. Органический слой сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении, получая 46,1 мг названного соединения (выход 34%). 1H-ЯМР (ДМСО-d6),  : 1,06 (3H, т, J=7,3 Гц), 3,11 (2H, к, J=7,3 Гц), 4,40 (2H, д, J=6,5 Гц), 5,30 (2H, шс), 6,73 (2H, д, J=8,3 Гц), 7,14 (2H, д, J=8,3 Гц), 7,43-7,58 (3H, м), 7,86-7,96 (2H, м), 8,96 (1H, т, J=6,5 Гц).
Пример 629 : 1,06 (3H, т, J=7,3 Гц), 3,11 (2H, к, J=7,3 Гц), 4,40 (2H, д, J=6,5 Гц), 5,30 (2H, шс), 6,73 (2H, д, J=8,3 Гц), 7,14 (2H, д, J=8,3 Гц), 7,43-7,58 (3H, м), 7,86-7,96 (2H, м), 8,96 (1H, т, J=6,5 Гц).
Пример 629Синтез 3-амино-N-бензоилбензиламина Используя N-бензоил-3-нитробензиламин в качестве исходного вещества, по методике, аналогичной Примеру 566, получают 985 мг названного соединения (выход 86%). 1H-ЯМР (CDCl3),  : 3,69 (2H, с), 4,55 (2H, д, J=5,3 Гц), 6,39 (1H, шс), 6,57-6,60 (1H, м), 6,67 (1H, с), 6,72 (1H, д, J=7,7 Гц), 7,13 (1H, т, J=7,9 Гц), 7,37-7,54 (3H, м), 7,77 (1H, с), 7,78 (1H, д, J=8,3 Гц).
Пример 630 : 3,69 (2H, с), 4,55 (2H, д, J=5,3 Гц), 6,39 (1H, шс), 6,57-6,60 (1H, м), 6,67 (1H, с), 6,72 (1H, д, J=7,7 Гц), 7,13 (1H, т, J=7,9 Гц), 7,37-7,54 (3H, м), 7,77 (1H, с), 7,78 (1H, д, J=8,3 Гц).
Пример 630Синтез N-бензоил-3-тиоуреидобензиламина Используя соединение, полученное в Примере 629, в качестве исходного вещества, по методике, аналогичной Примеру 3, получают 147 мг названного соединения (выход 58%). 1H-ЯМР (ДМСО-d6),  : 4,48 (2H, д, J=5,9 Гц), 7,08 (1H, д, J=7,6 Гц), 7,22-7,57 (8H, м), 7,90 (2H, д, J=6,6 Гц), 8,98 (1H, шс), 9,68 (1H, с).
Пример 631 : 4,48 (2H, д, J=5,9 Гц), 7,08 (1H, д, J=7,6 Гц), 7,22-7,57 (8H, м), 7,90 (2H, д, J=6,6 Гц), 8,98 (1H, шс), 9,68 (1H, с).
Пример 631Синтез N-бензоил-3-(S-этилизотиоуреидо)бензиламина Используя соединение, полученное в Примере 630, в качестве исходного вещества, по методике, аналогичной Примеру 626, получают 39,0 мг названного соединения (выход 93%). 1H-ЯМР (CDCl3),  : 1,35 (3H, т, J=7,3 Гц), 3,00 (2H, к, J=7,3 Гц), 4,52 (1H, шс), 4,59 (2H, д, J=5,6 Гц), 6,50 (1H, шс), 6,85 (1H, д, J=8,1 Гц), 6,90 (1H, с), 7,01 (1H, д, J=7,6 Гц), 7,27 (1H, дд, J=8,l, 7,6 Гц), 7,38- 7,50 (3H, м), 7,76-7,79 (2H, м).
Пример 632 : 1,35 (3H, т, J=7,3 Гц), 3,00 (2H, к, J=7,3 Гц), 4,52 (1H, шс), 4,59 (2H, д, J=5,6 Гц), 6,50 (1H, шс), 6,85 (1H, д, J=8,1 Гц), 6,90 (1H, с), 7,01 (1H, д, J=7,6 Гц), 7,27 (1H, дд, J=8,l, 7,6 Гц), 7,38- 7,50 (3H, м), 7,76-7,79 (2H, м).
Пример 632Синтез N-бензоил-3-(N’-т-бутоксикарбонил-N”-этилгуанидино)бензиламина Используя соединение, полученное в Примере 629, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают 57 мг названного соединения (выход 59%). 1H-ЯМР (CDCl3),  : 1,03-1,20 (3H, м), 1,47 (9H, с), 3,30- 3,42 (2H, м). 4,61 (2H, д, J= 5,6 Гц), 4,88 (1H, шс), 6,91 (1H, шс), 6,92-7,20 (4H, м), 7,26-7,55 (5H, м), 7,82 (2H, д, J=6,9 Гц).
Пример 633 : 1,03-1,20 (3H, м), 1,47 (9H, с), 3,30- 3,42 (2H, м). 4,61 (2H, д, J= 5,6 Гц), 4,88 (1H, шс), 6,91 (1H, шс), 6,92-7,20 (4H, м), 7,26-7,55 (5H, м), 7,82 (2H, д, J=6,9 Гц).
Пример 633Синтез моногидрохлорида N-бензоил-3-(N’-этилгуанидино)бензиламина Используя соединение, полученное в Примере 632, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 31,7 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 1,14 (3H, т, J=6,9 Гц), 3,21-3,38 (2H, м), 4,50 (2H, д, J=5,6 Гц), 7,10 (1H, д, J=6,9 Гц), 7,19 (1H, с), 7,24 (1H, д, J=7,9 Гц), 7,34-7,71 (5H, м), 7,75-7,79 (3H, м), 9,04 (1H, шс), 9,46-9,59 (1H, м).
Пример 634 : 1,14 (3H, т, J=6,9 Гц), 3,21-3,38 (2H, м), 4,50 (2H, д, J=5,6 Гц), 7,10 (1H, д, J=6,9 Гц), 7,19 (1H, с), 7,24 (1H, д, J=7,9 Гц), 7,34-7,71 (5H, м), 7,75-7,79 (3H, м), 9,04 (1H, шс), 9,46-9,59 (1H, м).
Пример 634Синтез 1-(2-метокси-5-нитрофенил)этанола К раствору 2-метокси-5-нитробензальдегида (450 мг) в толуоле (30 мл), добавляют по каплям при охлаждении льдом раствор триметилалюминия в гексане (3,0 мл). После перемешивания при комнатной температуре в течение 1 ч, к реакционной смеси добавляют воду, затем экстрагируют этилацетатом. Органический слой промывают последовательно водой и насыщенным водным раствором хлорида натрия, сушат безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – н-гексан:этилацетат=2:1), получая 385 мг названного соединения (выход 79%). 1H-ЯМР (CDCl3),  : 1,51 (3H, д, J=6,3 Гц), 2,25 (1H, д, J=3,3 Гц), 3,96 (3H, с), 5,12-5,23 (1H, м), 6,93 (1H, д, J=9,2 Гц), 8,18 (1H, дд, J=9,2, 2,6 Гц), 8,35 (1H, д, J=2,6 Гц).
Пример 635 : 1,51 (3H, д, J=6,3 Гц), 2,25 (1H, д, J=3,3 Гц), 3,96 (3H, с), 5,12-5,23 (1H, м), 6,93 (1H, д, J=9,2 Гц), 8,18 (1H, дд, J=9,2, 2,6 Гц), 8,35 (1H, д, J=2,6 Гц).
Пример 635Синтез N-(1-(2-метокси-5-нитрофенил)этил)фталимида Используя соединение, полученное в Примере 634, в качестве исходного вещества, по методике, аналогичной Примеру 179, получают 358 мг названного соединения (выход 57%). 1H-ЯМР (CDCl3),  : 1,87 (3H, д, J=7,3 Гц), 3,87 (3H, с), 5,82 (1H, к, J= 7,3 Гц), 6,89 (1H, д, J=9,2 Гц), 7,70 (2H, дд, J=5,3, 3,0 Гц), 7,81 (2H, дд, J=5,3, 3,0 Гц), 8,21 (1H, дд, J=9,2, 2,7 Гц), 8,54 (1H, д, J=2,7 Гц).
Пример 636 : 1,87 (3H, д, J=7,3 Гц), 3,87 (3H, с), 5,82 (1H, к, J= 7,3 Гц), 6,89 (1H, д, J=9,2 Гц), 7,70 (2H, дд, J=5,3, 3,0 Гц), 7,81 (2H, дд, J=5,3, 3,0 Гц), 8,21 (1H, дд, J=9,2, 2,7 Гц), 8,54 (1H, д, J=2,7 Гц).
Пример 636Синтез т-бутилового эфира N-(1-(5-амино-2-метоксифенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 635, в качестве исходного вещества, по методике, аналогичной Примеру 309, получают т-бутиловый эфир N-(1-(2-метокси-5-нитрофенил)этил)карбаминовой кислоты. Полученное нитросоединение подвергают реакции, аналогичной Примеру 2, с получением 165 мг названного соединения (выход 58%). 1H-ЯМР (CDCl3),  : 1,39 (3H, д, J=7,3 Гц), 1,42 (9H, с), 3,40 (2H, шс), 3,79 (3H, с), 4,78-4,90 (1H, м), 5,28-5,41 (1H, м), 6,52-6,60 (2H, м), 6,71 (1H, д, J=8,4 Гц).
Пример 637 : 1,39 (3H, д, J=7,3 Гц), 1,42 (9H, с), 3,40 (2H, шс), 3,79 (3H, с), 4,78-4,90 (1H, м), 5,28-5,41 (1H, м), 6,52-6,60 (2H, м), 6,71 (1H, д, J=8,4 Гц).
Пример 637Синтез т-бутилового эфира N-(1-(2-метокси-5-тиоуреидофенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 636, в качестве исходного вещества, по методике, аналогичной Примеру 120, получают 110 мг названного соединения (выход 90%). 1H-ЯМР (CDCl3),  : 1,38 (3H, д, J=6,9 Гц), 1,41 (9H, с), 3,87 (3H, с), 4,90-5,01 (1H, м), 5,02-5,09 (1H, м), 5,91 (2H, шс), 6,88 (1H, д, J=8,3 Гц), 7,05-7,17 (2H, м), 7,58 (1H, с).
Пример 638 : 1,38 (3H, д, J=6,9 Гц), 1,41 (9H, с), 3,87 (3H, с), 4,90-5,01 (1H, м), 5,02-5,09 (1H, м), 5,91 (2H, шс), 6,88 (1H, д, J=8,3 Гц), 7,05-7,17 (2H, м), 7,58 (1H, с).
Пример 638Синтез гидроиодида т-бутилового эфира N-(1-(5-(S-этилизотиоуреидо)-2-метоксифенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 637, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают 129 мг названного соединения (выход 81%). 1H-ЯМР (CDCl3),  : 1,36 (3H, т, J=7,3 Гц), 1,39 (3H, д, J=6,9 Гц), 1,42 (9H, с), 3,02 (2H, к, J=7,3 Гц), 3,83 (3H, с), 4,82-4,95 (1H, м), 5,10-5,28 (1H, м), 6,73-7,01 (3H, м).
Пример 639 : 1,36 (3H, т, J=7,3 Гц), 1,39 (3H, д, J=6,9 Гц), 1,42 (9H, с), 3,02 (2H, к, J=7,3 Гц), 3,83 (3H, с), 4,82-4,95 (1H, м), 5,10-5,28 (1H, м), 6,73-7,01 (3H, м).
Пример 639Синтез дигидрохлорида N-(1-(5-(S-этилизотиоуреидо)-2-метоксифенил)этил)амина Используя соединение, полученное в Примере 638, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 112,6 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 1,33 (3H, т, J=7,3 Гц), 1,52 (3H, т, J=6,6 Гц), 3,22-3,40 (2H, м), 3,89 (3H, с), 4,50-4,71 (1H, м), 7,18 (1H, д, J=8,6 Гц), 7,31 (1H, д, J= 8,6 Гц), 7,49 (1H, с), 8,55 (2H, шс), 9,18 (1H, шс), 9,74 (1H, шс), 11,56 (1H, шс).
Пример 640 : 1,33 (3H, т, J=7,3 Гц), 1,52 (3H, т, J=6,6 Гц), 3,22-3,40 (2H, м), 3,89 (3H, с), 4,50-4,71 (1H, м), 7,18 (1H, д, J=8,6 Гц), 7,31 (1H, д, J= 8,6 Гц), 7,49 (1H, с), 8,55 (2H, шс), 9,18 (1H, шс), 9,74 (1H, шс), 11,56 (1H, шс).
Пример 640Синтез т-бутилового эфира N-(1-(5-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-метоксифенил)этил)карбаминовой кислоты Используя соединение, полученное в Примере 636, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают 66 мг названного соединения (выход 62%). 1H-ЯМР (CDCl3),  : 1,06 (3H, т, J=6,9 Гц), 1,38 (3H, д, J=7,0 Гц), 1,42 (9H, с), 1,53 (9H, с), 3,31-3,46 (2H, м), 3,86 (3H, с), 4,53 (1H, шс), 4,90-5,03 (1H, м), 5,07 (1H, шс), 6,86 (1H, д, J=8,9 Гц), 7,02-7,12 (2H, м), 10,50 (1H, шс).
Пример 641 : 1,06 (3H, т, J=6,9 Гц), 1,38 (3H, д, J=7,0 Гц), 1,42 (9H, с), 1,53 (9H, с), 3,31-3,46 (2H, м), 3,86 (3H, с), 4,53 (1H, шс), 4,90-5,03 (1H, м), 5,07 (1H, шс), 6,86 (1H, д, J=8,9 Гц), 7,02-7,12 (2H, м), 10,50 (1H, шс).
Пример 641Синтез дигидрохлорида N-(1-(5-(N’-этилгуанидино)-2-метоксифенил)этил)амина Используя соединение, полученное в Примере 640, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают 58,5 мг названного соединения, количественно. 1H-ЯМР (ДМСО-d6),  : 1,15 (3H, т, J=6,9 Гц), 1,49 (3H, д, J=6,8 Гц), 3,28 (2H, дк, J=6,0, 6,9 Гц), 3,88 (3H, с), 4,52-4,65 (1H, м), 7,14 (1H, д, J= 8,6 Гц), 7,18- 7,26 (1H, м), 7,30-7,34 (1H, м), 7,43-7,58 (2H, м), 7,66-7,78 (1H, м), 8,36 (2H, шс), 9,59 (1H, шс).
Пример 642 : 1,15 (3H, т, J=6,9 Гц), 1,49 (3H, д, J=6,8 Гц), 3,28 (2H, дк, J=6,0, 6,9 Гц), 3,88 (3H, с), 4,52-4,65 (1H, м), 7,14 (1H, д, J= 8,6 Гц), 7,18- 7,26 (1H, м), 7,30-7,34 (1H, м), 7,43-7,58 (2H, м), 7,66-7,78 (1H, м), 8,36 (2H, шс), 9,59 (1H, шс).
Пример 642Синтез ди-т-бутилового эфира N-(2-(N-ацетил-N-метиламино)-5-нитрофенилметил)иминодикарбоновой кислоты К смеси соединения (540 мг), полученного в Примере 446, карбоната калия (1,96 г) и ацетонитрила (30 мл) добавляют ацетилхлорид (890 мг) и кипятят с обратным холодильником в течение 24 ч. К реакционной смеси добавляют этилацетат, смесь промывают водой, сушат сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент – метиленхлорид:этилацетат=5:1), получая 330 мг названного соединения (выход 55%). 1H-ЯМР (CDCl3),  : 1,50 (18H, с), 1,84 (3H, с), 3,23 (3H, с), 4,79 (2H, с), 7,33 (1H, д, J=8,4 Гц), 8,12 (1H, д, J=2,3 Гц), 8,19 (1H, дд, J=8,4, 2,3 Гц).
Пример 643 : 1,50 (18H, с), 1,84 (3H, с), 3,23 (3H, с), 4,79 (2H, с), 7,33 (1H, д, J=8,4 Гц), 8,12 (1H, д, J=2,3 Гц), 8,19 (1H, дд, J=8,4, 2,3 Гц).
Пример 643Синтез ди-т-бутилового эфира N-(2-(N-ацетил-N-метиламино)-5-аминофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 642, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают названное соединение (выход 96%). 1H-ЯМР (CDCl3),  : 1,48 (18H, с), 1,80 (3H, с), 3,15 (3H, с), 3,77 (2H, шс), 4,64 (1H, д, J=17,2 Гц), 4,65 (1H, д, J=17,2 Гц), 6,45 (1H, д, J=2,3 Гц), 6,55 (1H, дд, J=8,3, 2,3 Гц), 6,86 (1H, д, J=8,3 Гц).
Пример 644 : 1,48 (18H, с), 1,80 (3H, с), 3,15 (3H, с), 3,77 (2H, шс), 4,64 (1H, д, J=17,2 Гц), 4,65 (1H, д, J=17,2 Гц), 6,45 (1H, д, J=2,3 Гц), 6,55 (1H, дд, J=8,3, 2,3 Гц), 6,86 (1H, д, J=8,3 Гц).
Пример 644Синтез ди-т-бутилового эфира N-(2-(N-ацетил-N-метиламино)-5-тиоуреидофенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 643, в качестве исходного вещества, по методике, аналогичной примеру 120, получают названное соединение (выход 80%). 1H-ЯМР (CDCl3),  : 1,48 (18H, с), 1,83 (3Н, с), 3,19 (3H,с), 4,70 (1H, д, J= 17,2 Гц), 4,71 (1H, д, J=17,2 Гц), 6,26 (2H, шс), 7,14-7,26 (3H, м), 8,32 (1H, шс).
Пример 645 : 1,48 (18H, с), 1,83 (3Н, с), 3,19 (3H,с), 4,70 (1H, д, J= 17,2 Гц), 4,71 (1H, д, J=17,2 Гц), 6,26 (2H, шс), 7,14-7,26 (3H, м), 8,32 (1H, шс).
Пример 645Синтез ди-т-бутилового эфира N-(2-(N-ацетил-N-метиламино)-5-(S-этилизотиоуреидо)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 644, в качестве исходного вещества, по методике, аналогичной Примеру 95, получают названное соединение (выход 83%). 1H-ЯМР (CDCl3),  : 1,35 (3H, т, J=6,9 Гц), 1,45 (18H, с), 1,82 (3H, с), 2,90-3,15 (2H, м), 3,18 (3H, с), 4,53 (2H, шс), 4,69 (1H, д, J=17,2 Гц), 4,70 (1H, д, J=17,2 Гц), 6,76 (1H, шс), 6,79-6,92 (1H, м), 7,04 (1H, д, J= 7,9 Гц).
Пример 646 : 1,35 (3H, т, J=6,9 Гц), 1,45 (18H, с), 1,82 (3H, с), 2,90-3,15 (2H, м), 3,18 (3H, с), 4,53 (2H, шс), 4,69 (1H, д, J=17,2 Гц), 4,70 (1H, д, J=17,2 Гц), 6,76 (1H, шс), 6,79-6,92 (1H, м), 7,04 (1H, д, J= 7,9 Гц).
Пример 646Синтез дигидрохлорида N-(2-(N-ацетил-N-метиламино)-5-(S-этилизотиоуреидо)фенилметил)амина Используя соединение, полученное в Примере 645, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 53%). 1H-ЯМР (D2O),  : 1,43 (3H, т, J=7,6 Гц), 2,37 (3H, с), 3,26 (2H, к, J= 7,6 Гц), 3,44 (3H, с), 4,12 (1H, д, J=14,2 Гц), 4,14 (1H, д, J=14,2 Гц), 7,50-7,60 (3H, м).
Пример 647 : 1,43 (3H, т, J=7,6 Гц), 2,37 (3H, с), 3,26 (2H, к, J= 7,6 Гц), 3,44 (3H, с), 4,12 (1H, д, J=14,2 Гц), 4,14 (1H, д, J=14,2 Гц), 7,50-7,60 (3H, м).
Пример 647Синтез ди-т-бутилового эфира N-(2-(N-ацетил-N-метиламино)-(5-(N’-т-бутоксикарбонил-N”-этилгуанидино)фенилметил)иминодикарбоновой кислоты Используя соединение, полученное в Примере 643, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают названное соединение (выход 69%). 1H-ЯМР (CDCl3),  : 1,19 (3H, т, J=7,4 Гц), 1,47 (27H, с), 1,82 (3H, с), 3,20 (3H, с), 3,30-3,44 (2H, м), 4,70 (1H, д, J=16,8 Гц), 4,71 (1H, д, J= 16,8 Гц), 6,85-7,05 (2H, м), 7,08 (1H, д, J=7,6 Гц).
Пример 648 : 1,19 (3H, т, J=7,4 Гц), 1,47 (27H, с), 1,82 (3H, с), 3,20 (3H, с), 3,30-3,44 (2H, м), 4,70 (1H, д, J=16,8 Гц), 4,71 (1H, д, J= 16,8 Гц), 6,85-7,05 (2H, м), 7,08 (1H, д, J=7,6 Гц).
Пример 648Синтез дигидрохлорида N-(2-(N-ацетил-N-метиламино)-(5-(N’-этилгуанидино)фенилметил)амина Используя соединение, полученное в Примере 647, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 27%). 1H-ЯМР (D2O), 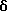 : 1,24 (3H, т, J=7,6 Гц), 2,36 (3H, с), 3,34 (2H, к, J= 7,6 Гц), 3,42 (3H, с), 4,09 (1H, д, J=14,2 Гц), 4,12 (1H, д, J=14,2 Гц), 7,43-7,53 (3H, м).
Пример 649 : 1,24 (3H, т, J=7,6 Гц), 2,36 (3H, с), 3,34 (2H, к, J= 7,6 Гц), 3,42 (3H, с), 4,09 (1H, д, J=14,2 Гц), 4,12 (1H, д, J=14,2 Гц), 7,43-7,53 (3H, м).
Пример 649Синтез 2-диметиламино-3-нитробензойной кислоты Используя 2-бром-3-нитробензойную кислоту в качестве исходного вещества, по методике, аналогичной Примеру 264, получают 4,8 г названного соединения (выход 96%). 1H-ЯМР (CDCl3),  : 2,99 (6H, с), 7,56 (1H, дд, J=7,9, 7,9 Гц), 7,91 (1H, дд, J=7,9, 1,7 Гц), 8,60 (1H, дд, J=7,9, 1,7 Гц).
ББА-МС (м/з) 211 (М+ +1) : 2,99 (6H, с), 7,56 (1H, дд, J=7,9, 7,9 Гц), 7,91 (1H, дд, J=7,9, 1,7 Гц), 8,60 (1H, дд, J=7,9, 1,7 Гц).
ББА-МС (м/з) 211 (М+ +1)Пример 650 Синтез (2-диметиламино-3-нитрофенил)метанола Используя соединение, полученное в Примере 650, в качестве исходного вещества, по методике, аналогичной Примеру 132, получают 4,23 г названного соединения (выход 94%). 1H-ЯМР (CDCl3),  : 2,80 (6H, с), 3,16-3,28 (1H, м), 4,80 (2H, д, J=4,4 Гц), 7,19 (1H, дд, J=7,8, 7,8 Гц), 7,53- 7,61 (2H, м).
ББА-МС (м/з) 197 (М++1) : 2,80 (6H, с), 3,16-3,28 (1H, м), 4,80 (2H, д, J=4,4 Гц), 7,19 (1H, дд, J=7,8, 7,8 Гц), 7,53- 7,61 (2H, м).
ББА-МС (м/з) 197 (М++1)Пример 651 Синтез N-(2-диметиламино-3-нитрофенилметил)фталимида Используя соединение, полученное в Примере 650, в качестве исходного вещества, по методике, аналогичной Примеру 179, получают 4,4 г названного соединения (выход 63%). 1H-ЯМР (CDCl3),  : 2,84 (6H, с), 4,99 (2H, с), 7,09 (1H, дд, J=7,9 Гц), 7,31 (1H, д, J=7,9 Гц), 7,53 (1H, д, J=7,9 Гц), 7,74-7,79 (2H, м), 7,87-7,91 (2H, м).
ББА-МС (м/з) 325 (М++1) : 2,84 (6H, с), 4,99 (2H, с), 7,09 (1H, дд, J=7,9 Гц), 7,31 (1H, д, J=7,9 Гц), 7,53 (1H, д, J=7,9 Гц), 7,74-7,79 (2H, м), 7,87-7,91 (2H, м).
ББА-МС (м/з) 325 (М++1)Пример 652 Синтез т-бутилового эфира N-(2-диметиламино-3-нитрофенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 651, в качестве исходного вещества, по методике, аналогичной Примеру 309, получают 3,74 г названного соединения (выход 94%). 1H-ЯМР (CDCl3),  : 1,46 (9H, с), 2,77 (6H, с), 4,42 (2H, д, J=5,6 Гц), 5,02 (1H, шс), 7,15 (1H, дд, J=7,9, 7,9 Гц), 7,52 (2H, д, J=7,9 Гц).
ББА-МС (м/з) 295 (М+) : 1,46 (9H, с), 2,77 (6H, с), 4,42 (2H, д, J=5,6 Гц), 5,02 (1H, шс), 7,15 (1H, дд, J=7,9, 7,9 Гц), 7,52 (2H, д, J=7,9 Гц).
ББА-МС (м/з) 295 (М+)Пример 653 Синтез т-бутилового эфира N-(3-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-диметиламинофенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 652, в качестве исходного вещества, по методике, аналогичной Примеру 233, получают названное соединение (выход 71%). 1H-ЯМР (CDCl3),  : 1,06-1,25 (3H, м), 1,46 (9H, с), 1,51 (9H, с), 2,78 (6H, с), 3,32-3,48 (2H, м), 4,28-4,43 (2H, м), 4,67-5,33 (2H, м), 6,55-6,68 (1H, м), 6,94 (1H, дд, J=7,6, 7,6 Гц), 7,05-7,23 (2H, м).
ББА-МС (м/з) 436 (М+) : 1,06-1,25 (3H, м), 1,46 (9H, с), 1,51 (9H, с), 2,78 (6H, с), 3,32-3,48 (2H, м), 4,28-4,43 (2H, м), 4,67-5,33 (2H, м), 6,55-6,68 (1H, м), 6,94 (1H, дд, J=7,6, 7,6 Гц), 7,05-7,23 (2H, м).
ББА-МС (м/з) 436 (М+)Пример 654 Синтез тригидрохлорида N-(3-(N’-этилгуанидино)-2-диметиламинофенилметил)амина Используя соединение, полученное в Примере 653, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение, количественно. 1H-ЯМР (D2O),  : 1,22 (3H, т, J=7,3 Гц), 2,90 (3H, с), 2,91 (3H, с), 3,33 (2H, к, J=7,3 Гц), 4,32 (2H, с), 7,37-7,58 (3H, м).
Пример 655 : 1,22 (3H, т, J=7,3 Гц), 2,90 (3H, с), 2,91 (3H, с), 3,33 (2H, к, J=7,3 Гц), 4,32 (2H, с), 7,37-7,58 (3H, м).
Пример 655Синтез т-бутилового эфира N-(5-(N’-т-бутоксикарбонил-N”-этилгуанидино)-2-гидроксифенилметил)карбаминовой кислоты Используя соединение, полученное в Примере 338, в качестве исходного вещества, по методике, аналогичной Примеру 2, получают названное соединение (выход 74%). 1H-ЯМР (CDCl3),  : 1,06 (3H, т, J=7,3 Гц), 1,46 (9H, с), 1,52 (9H, с), 3,32-3,40 (2H, м), 4,19 (2H, д, J=6,9 Гц), 5,22-5,30 (1H, м), 6,88-7,08 (3H, м).
Пример 656 : 1,06 (3H, т, J=7,3 Гц), 1,46 (9H, с), 1,52 (9H, с), 3,32-3,40 (2H, м), 4,19 (2H, д, J=6,9 Гц), 5,22-5,30 (1H, м), 6,88-7,08 (3H, м).
Пример 656Синтез дигидрохлорида N-(5-(N’-этилгуанидино)-2-гидроксифенилметил)амина Используя соединение, полученное в Примере 655, в качестве исходного вещества, по методике, аналогичной Примеру 5, получают названное соединение (выход 77%). 1H-ЯМР (D2O),  : 1,21 (3H, т, J=7,3 Гц), 3,29 (2H, к, J=7,3 Гц), 4,17 (2H, с), 7,02-7,04 (1H, м), 7,22-7,26 (2H, м).
Тест-Примеры : 1,21 (3H, т, J=7,3 Гц), 3,29 (2H, к, J=7,3 Гц), 4,17 (2H, с), 7,02-7,04 (1H, м), 7,22-7,26 (2H, м).
Тест-ПримерыТест-Пример 1 Соединения изобретения оценивают по их ингибирующему действию на известные в настоящее время три NOS-изоформы по сравнению с существующими NOS-ингибиторами. Следующие NOS-ингибиторы используют в качестве контрольных соединений: L – NNA, L – CPA, L – MIN, L – EIN, L – NAME, NG – амино-L-аргинин (L – AA), L – NIO, NG-монометил-L-аргинин (L – NMMA) Неочищенные образцы ферментов NOS-изоформ получают при помощи следующих методик (Nagafuji et al., Neuroreport 6, 1541- 1545, 1995). Неочищенные образцы ферментов N-cNOS получают при помощи следующих методик. Нормальных необработанных крыс-самцов линии Spraque Dawley (SD) (вес тела 300-400 г) обезглавливают; весь мозг немедленно извлекают из каждого животного и кору головного мозга отделяют на льду. Затем добавляют 5 объемов 50 мМ Трис-HCl, содержащего 1 мМ DTT (pH 7,4), смесь гомогенизируют в течение 3 мин и центрифугируют при 1000 х g в течение 10 мин. Полученный супернатант далее центрифугируют при 100 000 х g в течение 60 мин и растворимую цитозольную фракцию, в конечном счете, полученного супернатанта используют в качестве неочищенного образца фермента N-cNOS. Неочищенные образцы ферментов E-cNOS получают при помощи следующей методики. Клетки легочного артериального эндотелия коровы (CPAE) культивируют в MEM-среде, содержащей 20%FBS (сыворотка плода коровы). Спустя несколько дней клетки выделяют из сосуда, используя 0,25% раствор трипсина, содержащий 1 мМ ЭДТК (EDTA), и после добавления подходящего количества FBS центрифугируют при 1000 об/мин в течение 10 мин. К осаждающимся клеткам добавляют подходящее количество фосфатного буфера (pH 7,4), свободного от Ca и Mg, и их центрифугируют при 1000 об/мин в течение 10 мин. Ту же самую стадию повторяют для того, чтобы промыть клетки, которые, после добавления 50 мМ Трис- HCl (pH 7,4), содержащего 1% Тритон Х-100 и 1мМ DTT, выдерживают на льду в течение 1 ч. Затем смесь гомогенизируют в течение 3 мин и выдерживают на льду в течение 30 мин при периодическом перемешивании. Наконец, смесь центрифугируют при 100 000 х g в течение 60 мин и полученный супернатант используют в качестве неочищенного образца фермента E-NOS. Неочищенный образец фермента iNOS получают при помощи следующих методик. Крысам вводят интраперитонеально LPS (10 мг/кг) и спустя 6 ч проводят перфузию транскардиальным способом физиологическим раствором, содержащим 10 Е/мл гепарина; после этого извлекают легкие. Затем добавляют 5 объемов 50 мМ Трис-HCl, содержащего 1 мМ DTT (pH 7,4), и смесь гомогенизируют в течение 3 мин с последующим центрифугированием гомогената при 1000 х g в течение 10 мин. Полученный супернатант центрифугируют при 100 000 х g в течение 60 мин и растворимую цитозольную фракцию, в конечном счете, полученного супернатанта используют в качестве неочищенного образца фермента i-NOS. Способ измерения NOS- активности является, в основном, таким, о котором уже сообщалось настоящими изобретателями, и состоит из определения количественно конверсии субстрата – L-[3H] аргинина в продукт реакции – L-[3H]цитруллин (Nagafuji et al., in Brain Edema IX (lto et al., eds.) 60, pp. 285-288, 1994; Nagafuji et al., Neuroreport 6, 1541-1545, 1995). Реакционный раствор состоит из 100 нМ L-[3H]аргинина, полученного неочищенного образца NOS-фермента (10-30 мкг/мл белка), 1,25 мМ CaCl2, 1 мМ ЭДТК (EDTA), 10 мкг/мл калмодулина (calmodulin), 1 мМ NADPH, 100 мкм тетрагидробиоптерина, 10 мкм FAD, 10 мкм FMN и 50 мМ Трис-HCl (pH 7,4), к которому добавляют одно из соединений данного изобретения или одно из контрольных соединений. Реакцию начинают путем добавления L-[3H] аргинина и последующей инкубации при 37oC в течение 10 мин, реакцию обрывают путем добавления 2 мл 50 мМ Трис-HCl (pH 5,5), содержащего 1 мМ ЭДТК (EDTA), и помещения смеси на лед. Реакционный раствор пропускают через колонку с катионообменной смолой (Dowex AG50WX-8, Na+-форма, 3,2 мл), чтобы отделить реакционный продукт – L-[3H] цитруллин от непрореагировавшего остаточного субстрата – L-[3H] аргинина. Элюат объединяют с другим элюатом, являющимся результатом пропускания заданного количества дистиллированной воды через колонку, и помещают в мини-ампулу для обнаружения L-[3H]цитруллина. После этого добавляют сцинтилляционную жидкость и с помощью сцинтилляционного счетчика измеряют содержание радиоактивности с целью определения количества L-[3H]цитруллина. Активность N-cNOS или E-cNOS определяют путем вычитания активности, обруживаемой в отсутствие CaCl2 и калмодулина, из активности, обнаруживаемой в присутствии CaCl2 и калмодулина. Активность iNOS определяют в отсутствие CaCl2 и калмодулина. Концентрацию белка каждого неочищенного образца фермента определяют с помощью набора для микроанализа Biorad Co. Каждый опыт проводят дважды. Таблицы 49, 50 и 51 иллюстрируют средние значения IC50 (концентрация, необходимая для ингибирования 50% активности) всех тест-соединений по отношению к каждой NOS-форме, полученные в одном – четырех независимых экспериментах. Таблицы также иллюстрируют отношения IC50-значений друг к другу как индекс селективности. Из Таблиц 49, 50 и 51 становится ясным следующее. 1. Соединения Примеров 28,96, 104, 122, 131, 171, 175, 270 и 324 являются более сильнодействующими в ингибировании N-cNOS, чем L-MIN, который демонстрирует наибольшую N-cNOS ингибирующую активность среди существующих NOS- ингибиторов. 2. С точки зрения селективности N-cNOS по сравнению с Е-cNOS соединения Примеров 96, 122, 131, 175, 267, 270, 298, 324, 337, 350, 438, 452, 458, 466, 473, 538 и 560 имеют более селективное ингибирующее действие на N-cNOS, чем L-EIN, который демонстрирует наивысшее N-cNOS ингибирующее действие на N-cNOS среди существующих NOS-ингибиторов. 3. Соединения Примеров 12, 28, 96, 104 и 131 являются более сильнодействующими в ингибировании iNOS, чем L-MIN, который демонстрирует наибольшую N-cNOS ингибирующую активность среди существующих NOS-ингибиторов. 4. С точки зрения селективности iNOS по сравнению с E-cNOS, соединения Примеров 96, 131, 267 и 538 имеют более селективное ингибирующее действие на iNOS, чем L-NIO, который демонстрирует наибольшее селективное ингибирующее действие на iNOS среди существующих NOS-ингибиторов. Тест-Пример 2 Эксперимент проводят с целью оценить эффективность соединения в пределах объема данного изобретения, используя модель локализованной церебральной ишемии крысы. Такие модели получают, пережимая левую среднюю церебральную артерию (МСА) в соответствии со способом, уже сообщенным настоящими изобретателями (Nagafuji et al., Neurosci. Lett. 147, 159-162, 1992; Nagafuji et al. , in Brain Edema IX (Ito et al., eds.) 60, pp. 285-288, 1994, Springer- Verlag; Nagafuji et al., Neuroreport 6, 1541-1545, 1995). Самцов-крыс возраста восьми-девяти недель линии SD подвергают ингаляции 2% галотаном (70% N2O и 30% O2), чтобы вызвать анестезию, затем 1% галотаном, чтобы поддержать анестезию, и вводят полиэтиленовый катетер в правую бедренную вену для введения лекарственного препарата. Каждую из таким образом анестезированных крыс помещают в латеральном положении на операционный столик. Делают кожный надрез между левым наружным слуховым отверстием и латеральным углом глаза и осуществляют надрез вдоль переднего края височной мышцы по направлению вниз к скуловой дуге, причем височную мышцу позже извлекают с помощью биполярного коагулятора. Под хирургическим микроскопом третью ветвь тройничного нерва идентифицируют в нижней чти височной кости как бегущую внутри височной мышцы и делают маленькое отверстие с диаметром около 3 мм с помощью стоматологической бормашины, лезвие которой было помещено в охлажденный льдом физиологический раствор, в положении между овальным отверстием, от которого простирается идентифицированная третья ветвь, и глазничной щелью. Тонкий слой кости удаляют с помощью микрокрючка и держателя микроиглы. Затем твердую мозговую оболочку и паутинную мозговую оболочку слегка надрезают с помощью иглы (27G) и микрокрючка, и МСА ствол пережимают мини-зажимом в проксимальной части к чечевицеобразной-полосатой (lenticulostriate) артерии (LSA). В моделях перманентной окклюзии как МСА ствол, так и LSA отрезают прижиганием с помощью биополярного коагулятора. В моделях временной окклюзии осуществляют лишь окклюзию мини-зажимом и зажим удаляют под хирургическим микроскопом для того, чтобы допустить повторную перфузию. Немедленно после окклюзии МСА инъецируют через правую бедренную вену либо контрольный растворитель (0,9% физиологический раствор, 10 мкл/ч), либо соединение Примера 96 (0,12-3,6 мкг/кг). После этого осмотический насос (Alzet), соединенный с катетером, погружают под кожу каждой крысы и начинают продолжительную инфузию растворителя или тестового соединения (0,01-0,3 мкг/кг/мин). Наконец, гелевую пену, которая была погружена в антибиотиксодержащий физиологический раствор, вводят в рассеченную полость, на рану накладывают шов и всех животных возвращают в индивидуальные боксы. Содержание воды в головном мозге, которое является показателем образования отека мозга, определяют способом сухой-влажный (Nagafuji et al., Neurosci. Lett. 147, 159-162, 1992) следующим образом. Через сорок восемь часов после МСА- окклюзии крыс обезглавливают и оба, правое и левое полушария большого мозга, извлекают из каждого животного в пределах 60 секунд; влажный вес мозговой ткани каждого полушария определяют путем взвешивания на химических весах в пределах 90 секунд. После этого полушария сушат в сушильном шкафу при 105oC в течение 3 дней и определяют их сухой вес. Содержание воды в головном мозге определяют по следующей формуле: (влажный вес – сухой вес)/(влажный вес) х 100 (%). Процентное отношение содержания воды в стороне, подвергнутой удару (эмболия, тромбоз) (левое полушарие), к содержанию воды в контралатеральной стороне (правое полушарие) представлено на фиг.1. В эксперименте по оценке действия на уменьшение объема инфаркта головного мозга крыс обезглавливают после 3 ч МСА-окклюзии с последующей 24-часовой повторной перфузией и весь мозг извлекают; после этого делают шесть серийных венечных срезов с 2-миллиметровыми интервалами из лобной доли (Nagafuji et al., Neuroreport 6, 1541-1545, 1995). Срезы помещают в раствор 2% 2,3,5-трифенилтетразолия гидрохлорида (ТТС) в физиологическом растворе при 37oC на 30 мин и делают фотографию обеих сторон каждого среза). Фотографические изображения считывают сканером и область инфаркта в каждом срезе определяют на компьютере в соответствии со следующим уравнением: область инфаркта в полушарии, подвергнутом удару, = (нормальная область в контралатеральном полушарии) – (нормальная область в полушарии, подвергнутом удару), используя программу анализа изображения (NIH Image), чтобы избежать переоценки области инфаркта из-за образования отека. Объем инфаркта рассчитывают как общую сумму объемов индивидуальных фокусов, которые определяют по формуле (область инфаркта) х (1 мм), и эти результаты представлены на фиг. 2. Все экспериментальные данные выражают как среднее  стандартная ошибка, причем число животных в каждой группе указано в скобках. Для статистического анализа проводят параметрический Dunnett’s множественный сравнительный тест, и случай, имеющий фактор риска (р значение) менее чем 0,05, рассматривают как “статистически существенный”.
Как показано на фиг. 1, процентное отношение содержания воды в полушарии, подвергнутом удару, к контралатеральному полушарию контрольной группы увеличивается до около 103,8% после 48 ч МСА-окклюзии, явно указывая на образование отека. Это увеличение в процентном отношении содержания воды уменьшается в зависимости от дозы при введении соединения Примера 96; в группе, которую подвергают продолжительной инфузии соединения при 0,3 мкг/кг/мин после внутривенного введения болюса 3,6 мкг/кг, процентное отношение содержания воды уменьшается до приблизительно 102,1%, что статистически существенно (р < 0,01). Абсолютное содержание воды в контралaтеpaльнoм полушарии контрольной группы составляло 79,29 стандартная ошибка, причем число животных в каждой группе указано в скобках. Для статистического анализа проводят параметрический Dunnett’s множественный сравнительный тест, и случай, имеющий фактор риска (р значение) менее чем 0,05, рассматривают как “статистически существенный”.
Как показано на фиг. 1, процентное отношение содержания воды в полушарии, подвергнутом удару, к контралатеральному полушарию контрольной группы увеличивается до около 103,8% после 48 ч МСА-окклюзии, явно указывая на образование отека. Это увеличение в процентном отношении содержания воды уменьшается в зависимости от дозы при введении соединения Примера 96; в группе, которую подвергают продолжительной инфузии соединения при 0,3 мкг/кг/мин после внутривенного введения болюса 3,6 мкг/кг, процентное отношение содержания воды уменьшается до приблизительно 102,1%, что статистически существенно (р < 0,01). Абсолютное содержание воды в контралaтеpaльнoм полушарии контрольной группы составляло 79,29  0,06%.
Как показано на фиг. 2, обширный инфаркт над дорсальным полосатым телом и корой головного мoзгa в левом полушарии, который оценили около 104,2 мм2, наблюдался после 3 ч окклюзии и 24 ч повторной перфузии. Область (объем) инфаркта может быть уменьшена, в зависимости от дозы, при введении соединения Примера 96; в группе, которую подвергают продолжительной инфузии 0,3 мкг/кг/мин. после внутривенного введения болюса 3,6 мкг/кг, объем инфаркта уменьшался на приблизительно 79,7%, что статистически существенно (р < 0,01).
Эти экспериментальные данные подтверждают, что соединения данного изобретения, включающего Пример 96, дают преимущества, которые делают их эффективными и предпочтительными для цели лечения цереброваскулярных заболеваний.
Промышленная применимость 0,06%.
Как показано на фиг. 2, обширный инфаркт над дорсальным полосатым телом и корой головного мoзгa в левом полушарии, который оценили около 104,2 мм2, наблюдался после 3 ч окклюзии и 24 ч повторной перфузии. Область (объем) инфаркта может быть уменьшена, в зависимости от дозы, при введении соединения Примера 96; в группе, которую подвергают продолжительной инфузии 0,3 мкг/кг/мин. после внутривенного введения болюса 3,6 мкг/кг, объем инфаркта уменьшался на приблизительно 79,7%, что статистически существенно (р < 0,01).
Эти экспериментальные данные подтверждают, что соединения данного изобретения, включающего Пример 96, дают преимущества, которые делают их эффективными и предпочтительными для цели лечения цереброваскулярных заболеваний.
Промышленная применимостьСоединения данного изобретения демонстрируют более сильную N-cNOS или iNOS ингибирующую активность, чем существующие NOS-ингибиторы или они демонстрируют, в частности, высокую селективность в ингибирующем действии против N-cNOS или iNOS среди трех NOS-изоформ; следовательно, соединения полезны в качестве терапевтических средств для лечения патологии при цереброваскулярных заболеваниях, в частности окклюзивных цереброваскулярных заболеваний, а также травматических повреждений головного мозга, припадка, головной боли и других болей, толерантности к морфину или зависимости от морфина, болезни Альцгеймера, болезни Паркинсона, септических шоков, хронического ревматоидного артрита, остеоартрита, вирусных или невирусных инфекций и диабета. Формула изобретения
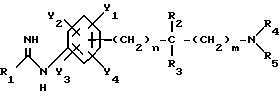 где R1 представляет SR6 или NR7R8; R6 представляет необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или прямую или разветвленную алкенильную группу, имеющую 2-6 углеродных атомов; R7 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, циклическую алкильную группу, имеющую 3-8 углеродных атомов, прямую или разветвленную алкинильную группу, имеющую 3-6 углеродных атомов, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или нитрогруппу; R8 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или карбоксильную группу; R3 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; или R2 и R3 могут соединяться вместе с образованием 3-8-членного кольца; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или амидиногруппу, которая может быть замещена на атоме азота циклической алкильной группой, имеющей 3-8 углеродных атомов, или нитрогруппой; R5 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбониламино группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или аминогруппу; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 2. Соединения общей формулы (1) по п.1 или их возможные стереоизомеры, или их оптически активные формы или их фармацевтически приемлемые соли, в которой R1 представляет SR6, где R6 представляет необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или прямую или разветвленную алкенильную группу, имеющую 2-6 углеродных атомов; R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или карбоксильную группу; R3 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или R2 и R3 могут соединяться вместе с образованием 3-8-членного кольца; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или амидиногруппу, которая может быть замещена на атоме азота циклической алкильной группой, имеющей 3-8 углеродных атомов, или нитрогруппой; R5 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый целому числу 0 или 1. 3. Соединение общей формулы (1) по п.1 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, где R1 представляет SR6, где R6 представляет необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R2 и R3, которые могут быть одинаковыми или отличными, представляют, каждый, атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или R2 и R3 могут соединяться вместе с образованием 3-8-членного кольца; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 4. Соединение общей формулы (1) по п.1 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, где заместители, кроме Y1, Y2, Y3 и Y4, являются м-замещенными на бензольном ядре; R1 представляет метилтио- или этилтиогруппу; R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или может соединяться с R3 с образованием 3-8-членного кольца; R3 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или может соединяться с R2 с образованием 3-8-членного кольца; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 5. Соединение общей формулы (1) по п.1 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, где заместители, кроме Y1, Y2, Y3 и Y4, являются м-замещенными на бензольном ядре; R1 представляет метилтио- или этилтиогруппу; R2 и R3 представляют, каждый, атом водорода; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R5 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 6. Соединение общей формулы (1) по п.1 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, где заместители, кроме Y1, Y2, Y3 и Y4, являются м-замещенными на бензольном ядре; R1 представляет метилтио- или этилтиогруппу; R2 представляет атом водорода или метильную или этильную группу; R3 представляет атом водорода или метильную группу; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 7. Соединение общей формулы (1) по п.1 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, где заместители, кроме Y1, Y2, Y3 и Y4, являются п-замещенными на бензольном ядре; R1 представляет метилтио- или этилтиогруппу; R2 представляет атом водорода или метильную или этильную группу; R3 представляет атом водорода или метильную группу; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 8. Соединение общей формулы (1) по п.1 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, где R1 представляет NR7R8, где R7 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, циклическую алкильную группу, имеющую 3-8 углеродных атомов, или нитрогруппу, и R8 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или карбоксильную группу; R3 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или может соединяться с R2 с образованием 3-8-членного кольца; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или амидиногруппу, которая может быть замещена на атоме азота циклической алкильной группой, имеющей 3-8 углеродных атомов, или нитрогруппой; R5 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, Y1, Y2, Y3, и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 9. Соединение общей формулы (1) по п.1 или его возможные стероизомеры или его оптически активные формы, или его фармацевтически приемлемые соли, где заместители, кроме Y1, Y2, Y3 и Y4, являются м-замещенными на бензольном ядре; R1 представляет NR7R8, где R7 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, циклическую алкильную группу, имеющую 3-8 углеродных атомов, или нитрогруппу, и R8 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или карбоксильную группу; R3 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или может соединяться с R2 с образованием 3-8-членного кольца; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или амидогруппу, которая может быть замещена на атоме азота циклической алкильной группой, имеющей 3-8 углеродных атомов, или нитрогруппой; R5 представляет атом водорода, или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 10. Соединение общей формулы (1) по п.1 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, где R1 представляет нитроамино- или этиламиногруппу; R2 и R3, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или R2 и R3 могут соединяться вместе с образованием 3-8-членного кольца; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 11. Соединение общей формулы (1) по п.1 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, где заместители, кроме Y1, Y2, Y3 и Y4, являются м-замещенными на бензольном ядре; R1 представляет нитроамино- или этиламиногруппу; R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или может соединяться с R3 с образованием 3-8-членного кольца; R3 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или может соединяться с R2 с образованием 3-8-членного кольца; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 12. Соединение общей формулы (1) по п.1 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, где заместители, кроме Y1, Y2, Y3 и Y4, являются м-замещенными на бензольном ядре; R1 представляет нитроамино- или этиламиногруппу; R2 представляет атом водорода или метильную или этильную группу; R3 представляет атом водорода или метильную группу; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 13. Соединение общей формулы (1) по п.1 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, где заместители, кроме Y1, Y2, Y3 и Y4, являются п-замещенными на бензольном ядре; R1 представляет нитроамино- или этиламиногруппу; R2 представляет атом водорода или метильную или этильную группу; R3 представляет атом водорода или метильную группу; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 14. Соединение общей формулы (1) по п.1 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, где заместители, кроме Y1, Y2, Y3 и Y4, являются м-замещенными на бензольном ядре; R1 представляет нитроамино- или этиламиногруппу; R2 и R3 представляют, каждый, атом водорода; R4 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R5 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 15. Соединение по п.1, которое выбирают из группы, которая включает: N-(1-(3-(S-метилизотиоуреидо)фенил)-1-метил)этил)амин; N-(1-метил-1-(3-(N’-нитрогуанидино)фенил)этил)амин; N-(1-(3-(S-метилизотиоуреидо)фенил) этил)амин; N-(1-(3-(N’-нитрогуанидино)фенил)этил)амин; N-(1-(3-(N’-нитрогуанидино)фенил)пропил)амин; N-(3-(S-метилизотиоуреидо)фенилметил)амин; N-(3-(S-этилизoтиoуpeидo)фeнилмeтил)мeтилaмин; N-(4-(S-метилизотиоуреидо)фенилэтил)амин; N-(1-(3-(S-этилизотиоуреидо)фенил)-1-метил)этил)амин; N-(4-(S-этилизотиоуреидо)фенилэтил)диметиламин; N-(4-(S-этилизотиоуреидо)фенилэтил)амин; N-(3-(S-метилизотиоуреидо)фенилэтил)амин; N-(1-(3-(S-этилизотиоуреидо)фенил)этил)метиламин; N-(1-(3-(S-этилизотиоуреидо)фенил)циклопентил)амин; N-(1-(3-(N’-нитрогуанидино)фенил)циклопентил)амин; N-(1-(3-(S-метилизотиоуреидо)фенил)циклогексил)амин; N-(1-(3-(S-этилизотиоуреидо)фенил)циклогексил)амин; N-(1-(3-(N’-нитрогуанидино)фенил)циклогексил)амин; N-(1-(3-(S-этилизотиоуреидо)фенил)этил)амин; N-(1-(3-(N’-нитрогуанидино)фенил)циклобутил)амин; N-(1-(3-(S-метилизотиоуреидо)фенил)циклобутил)амин; N-(1-(3-(S-этилизотиоуреидо)фенил)циклобутил)амин; N-(1-(3-(S-этилизотиоуреидо)фенил)циклопропил)амин; N-(5-(S-этилизотиоуреидо)-2-метоксифенилметил)амин; N-(3-(S-этилизотиоуреидо)-2-метилфенилметил)амин; N-(2-хлор-3-(S-этилизотиоуреидо)фенилметил)амин; N-(1-(3-(S-этилизотиоуреидо)фенил)пропил)амин; N-(2-димeтилaминo-5-(N’-этилгуанидино)фенилметил)амин; N-(2-диметиламино-5-(S-этилизотиоуреидо)фенилметил)амин; N-(5-(S-этилизотиоуреидо)-2-(N-этил-N-метиламино)фенилметил)амин; N-(2,6-диметокси-3-(S-этилизотиоуреидо)фенилметил)амин; N-(2-этокси-5-(S-этилизотиоуреидо)фенилметил)амин; N-(2-бензилокси-5-(S-этилизотиоуреидо)фенилметил)амин; N-(1-(5-(S-этилизотиоуреидо)-2-метоксифенил)-1-метилэтил)амин; N-(3-(N’-этилгуанидино)фенилметил)амин; N-(3-(S-этилизотиоуреидо)-2-метилфенилметил)метиламин; N-(2-бензиламино-5-(S-этилизотиоуреидо)фенилметил)амин; N-(5-(N’-этилгуанидино)-2-фторофенилметил)амин; N-(5-(S-этилизотиоуреидо)-2-метиламинофенилметил)амин; N-(2-этиламино-(S-этилизотиоуреидо)фенилметил)амин; N-(2-этил-5-(N’-этилгуанидино)фенилметил)амин; N-(5-(N’-этилгуанидино)-2-метилфенилметил)амин; N-(2-(4-(S-этилизотиоуреидо)-2-метоксифенил)этил)амин; N-(3-(N’-этилгуанидино)-2-метилфенилметил)амин; N-(2-хлор-3-(N’-этилгуанидино)фенилметил)амин и N-(2-хлор-5-(N’-этилгуанидино)фенилметил)амин или его возможная оптически активная форма или его фармацевтически приемлемая соль. 16. Соединение общей формулы (1) по п.1 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, где R1 представляет SR6, где R6 – необязательно замещенная прямая или разветвленная алкильная группа, имеющая 1-6 углеродных атомов, или прямая или разветвленная алкенильная группа, имеющая 2-6 углеродных атомов; R2 и R3, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или R2 и R3 могут соединяться вместе с образованием 3-8-членного кольца; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или амидиногруппу, которая может быть замещена на атоме азота циклической алкильной группой, имеющей 3-8 углеродных атомов, или нитрогруппой; R5 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 17. Соединение общей формулы (1) по п.1 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, где R1 представляет собой NR7R8, где R7 – атом водорода, прямая или разветвленная алкильная группа, имеющая 1-6 углеродных атомов, циклическая алкильная группа, имеющая 3-8 углеродных атомов, или нитрогруппа и R8 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R2 и R3, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или R2 и R3 могут соединяться вместе с образованием 3-8-членного кольца; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или амидиногруппу, которая может быть замещена на атоме азота циклической алкильной группой, имеющей 3-8 углеродных атомов, или нитрогруппой; R5 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 18. Производные нитрофенилкарбоновой кислоты общей формулы (21) или их оптически активные формы, или их фармацевтически приемлемые соли 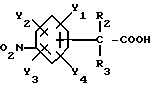 где R2 и R3 независимо представляют атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или R2 и R3 вместе могут соединяться с образованием 3-8-членного кольца; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, алкильная часть которой может необязательно иметь заместитель, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, и каждый представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов. 19. N-Замещенные производные анилина общей формулы (1) или их оптически активные формы или их фармацевтически приемлемые соли 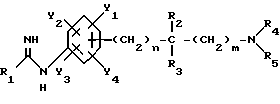 где R1 является SR6 или NHR7, где R6 представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или прямую или разветвленную алкенильную группу, имеющую 2-6 углеродных атомов; R7 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, циклическую алкильную группу, имеющую 3-8 углеродных атомов, или нитрогруппу; R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или карбоксильную группу; R3 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или R2 и R3 вместе могут образовывать 3-8-членное кольцо; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или амидиногруппу, которая может быть замещена на атоме азота циклической алкильной группой, имеющей 3-8 углеродных атомов, или нитрогруппой; R5 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4 представляют, каждый, атом водорода; n = 0 или 1; m = 0. 20. Соединение общей формулы (1) по п.19 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, в котором R1 является SR6, где R6 представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или прямую или разветвленную алкенильную группу, имеющую 2-6 углеродных атомов; R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или карбоксильную группу; R3 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или R2 и R3 вместе образуют 3-8-членное кольцо; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или амидиногруппу, которая может быть замещена на атоме азота циклической алкильной группой, имеющей 3-8 углеродных атомов, или нитрогруппой; R5 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4 представляют, каждый, атом водорода; n = 0 или 1; m = 0. 21. Соединение общей формулы (1) по п.19 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, в котором R1 является SR6, где R6 представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R2 и R3, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4 представляют, каждый, атом водорода; n = 0 или 1; m = 0. 22. Соединение общей формулы (1) по п.19 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, в котором заместители, кроме Y1, Y2, Y3 и Y4, являются м-замещенными на бензольном ядре; R1 представляет метилтио- или этилтиогруппу; R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R3 представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или R2 и R3 вместе образуют 3-8-членное кольцо; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4 представляют, каждый, атом водорода; n = 0 или 1; m = 0. 23. Соединение общей формулы (1) по п.19 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, в котором заместители, кроме Y1, Y2, Y3 и Y4, являются м-замещенными на бензольном ядре; R1 представляет метилтио- или этилтиогруппу; R2 и R3 представляют, каждый, атом водорода; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R5 представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4 представляют, каждый, атом водорода; n = 0 или 1; m = 0. 24. Соединение общей формулы (1) по п.19 или его возможные стереоизомеры, или его оптически активные формы или его фармацевтически приемлемые соли, в котором заместители, кроме Y1, Y2, Y3 и Y4, являются м-замещенными на бензольном ядре; R1 представляет метилтио- или этилтиогруппу; R2 представляет атом водорода или метильную или этильную группу; R3 представляет атом водорода или метильную группу; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4 представляют, каждый, атом водорода; n и m, каждый, равен 0. 25. Соединение общей формулы (1) по п.19 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, в котором заместители, кроме Y1, Y2, Y3 и Y4 являются п-замещенными на бензольном ядре; R1 представляет метилтио- или этилтиогруппу; R2 представляет атом водорода или метильную или этильную группу; R3 представляет атом водорода или метильную группу; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4 представляют, каждый, атом водорода; n = 1; m = 0. 26. Соединение общей формулы (1) по п.19 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, в котором R1 является NHR7, где R7 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, циклическую алкильную группу, имеющую 3-8 углеродных атомов, или нитрогруппу; R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или карбоксильную группу; R3 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или R2 и R3 вместе могут образовывать 3-8-членное кольцо; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или амидиногруппу, которая может быть замещена на атоме азота циклической алкильной группой, имеющей 3-8 углеродных атомов, или нитрогруппой; R5 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4 представляют, каждый, атом водорода; n = 0 или 1; m = 0. 27. Соединение общей формулы (1) по п.19 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, в которой заместители, кроме Y1, Y2, Y3 и Y4, являются м-замещенными на бензольном ядре; R1 представляет NHR7, где R7 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, циклическую алкильную группу, имеющую 3-8 углеродных атомов, или нитрогруппу; R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или карбоксильную группу; R3 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или R2 и R3 могут соединяться с образованием 3-8-членного кольца; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или амидиногруппу, которая может быть замещена на атоме азота циклической алкильной группой, имеющей 3-8 углеродных атомов, или нитрогруппой; R5 представляет атом водорода, или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4 представляют, каждый, атом водорода; n = 0 или 1; m = 0. 28. Соединение общей формулы (1) по п.19 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, в котором R1 представляет нитроаминогруппу; R2 и R3, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4 представляют, каждый, атом водорода; n = 0 или 1; m = 0. 29. Соединение общей формулы (1) по п.19 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, в которой заместители, кроме Y1, Y2, Y3 и Y4, являются м-замещенными на бензольном ядре; R1 представляет нитроаминогруппу; R2 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R3 представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или R2 и R3 могут образовывать 3-8-членное кольцо; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4 представляют, каждый, атом водорода; n = 0 или 1; m = 0. 30. Соединение общей формулы (1) по п.19 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, в которой заместители, кроме Y1, Y2, Y3 и Y4, являются м-замещенными на бензольном ядре; R1 представляет нитроаминогруппу; R2 представляет атом водорода или метильную или этильную группу; R3 представляет атом водорода или метильную группу; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4 представляют, каждый, атом водорода; n и m, каждый, равен 0. 31. Соединение общей формулы (1) по п.19 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, в которой заместители, кроме Y1, Y2, Y3 и Y4, являются п-замещенными на бензольном ядре; R1 представляет нитроаминогруппу; R2 представляет атом водорода или метильную или этильную группу; R3 представляет атом водорода или метильную группу; R4 и R5 представляют, каждый, атом водорода; Y1, Y2, Y3 и Y4 представляют, каждый, атом водорода; n = 1; m = 0. 32. Соединение общей формулы (1) по п.19 или его возможные стереоизомеры, или его оптически активные формы, или его фармацевтически приемлемые соли, в которой заместители, кроме Y1, Y2, Y3 и Y4, являются м-замещенными на бензольном ядре; R1 представляет нитроаминогруппу; R2 и R3 представляют, каждый, атом водорода; R4 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R5 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4 представляют, каждый, атом водорода; n = 0 или 1; m = 0. 33. Соединение по п. 19, которое представляет собой N-(4-(S-метилизотиоуреидо)фенилэтил)амин или его фармацевтически приемлемую соль. 34. Соединение по п. 19, которое представляет собой N-(4-(S-этилизотиоуреидо)фенилэтил)амин или его фармацевтически приемлемую соль. 35. Терапевтическое средство для лечения цереброваскулярных заболеваний, содержащее в качестве эффективного ингредиента соединение общей формулы (1) или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль. 36. Терапевтическое средство по п.35, где типом цереброваскулярных заболеваний является внутримозговое кровоизлияние. 37. Терапевтическое средство по п.35, где типом цереброваскулярных заболеваний является субарахноидальное кровоизлияние. 38. Терапевтическое средство по п.35, где типом цереброваскулярных заболеваний является инфаркт головного мозга. 39. Терапевтическое средство по п.35, где типом цереброваскулярных заболеваний является отек головного мозга. 40. Терапевтическое средство для лечения болезни Альцгеймера, содержащее в качестве эффективного ингредиента соединение общей формулы (1) или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль. 41. Анальгезирующее средство, содержащее в качестве эффективного ингредиента соединение общей формулы (1) или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль. 42. Терапевтическое средство для лечения толерантности к морфину или зависимости от морфина, содержащее в качестве эффективного ингредиента соединение общей формулы (1) или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль. 43. Терапевтическое средство для лечения септических шоков, содержащее в качестве эффективного ингредиента соединение общей формулы (1) или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль. 44. Терапевтическое средство для лечения хронического ревматоидного артрита, содержащее в качестве эффективного ингредиента соединение общей формулы (1) или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль. 45. Терапевтическое средство для лечения остеоартрита, содержащее в качестве эффективного ингредиента соединение общей формулы (1) или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль. 46. Терапевтическое средство для лечения вирусных или невирусных инфекций, содержащее в качестве эффективного ингредиента соединение общей формулы (1) или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль. 47. Терапевтическое средство для лечения диабета, содержащее в качестве эффективного ингредиента соединение по п.1 или его фармацевтически приемлемую соль. 48. Терапевтическое средство для лечения цереброваскулярных заболеваний, содержащее в качестве эффективного ингредиента соединение по п.1, которое представляет собой N-5-(S-этилизотиоуреидо)-2-метоксифенилметил)амин или его фармацевтически приемлемую соль. 49. Терапевтическое средство по п.48, где типом цереброваскулярных заболеваний является внутримозговое кровоизлияние. 50. Терапевтическое средство по п.48, где типом цереброваскулярных заболеваний является субарахноидальное кровоизлияние. 51. Терапевтическое средство по п.48, где типом цереброваскулярных заболеваний является инфаркт головного мозга. 52. Терапевтическое средство по п.48, где типом цереброваскулярных заболеваний является отек головного мозга. 53. Терапевтическое средство для лечения цереброваскулярных заболеваний, содержащее в качестве эффективного ингредиента соединение общей формулы (1) по п. 19 или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль. 54. Терапевтическое средство по п.53, где типом цереброваскулярных заболеваний является внутримозговое кровоизлияние. 55. Терапевтическое средство по п.53, где типом цереброваскулярных заболеваний является субарахноидальное кровоизлияние. 56. Терапевтическое средство по п.53, где типом цереброваскулярных заболеваний является инфаркт головного мозга. 57. Терапевтическое средство по п.53, где типом цереброваскулярных заболеваний является отек головного мозга. 58. Терапевтическое средство для лечения цереброваскулярных заболеваний, содержащее в качестве эффективного ингредиента соединение по п.19, которое представляет собой N-(4-(S-метилизотиоуреидо)фенилэтил)амин или его фармацевтически приемлемую соль. 59. Терапевтическое средство по п.58, где типом цереброваскулярных заболеваний является внутримозговое кровоизлияние. 60. Терапевтическое средство по п.58, где типом цереброваскулярных заболеваний является субарахноидальное кровоизлияние. 61. Терапевтическое средство по п.58, где типом цереброваскулярных заболеваний является инфаркт головного мозга. 62. Терапевтическое средство по п.58, где типом цереброваскулярных заболеваний является отек головного мозга. 63. Терапевтическое средство для лечения цереброваскулярных заболеваний, содержащее в качестве эффективного ингредиента соединение по п.19, которое представляет собой N-(4-(S-этилизотиоуреидо)фенилэтил)амин или его фармацевтически приемлемую соль. 64. Терапевтическое средство по п.63, где типом цереброваскулярных заболеваний является внутримозговое кровоизлияние. 65. Терапевтическое средство по п.63, где типом цереброваскулярных заболеваний является субарахноидальное кровоизлияние. 66. Терапевтическое средство по п.63, где типом цереброваскулярных заболеваний является инфаркт головного мозга. 67. Терапевтическое средство по п.63, где типом цереброваскулярных заболеваний является отек головного мозга. 68. Терапевтическое средство для лечения септических шоков, содержащее соединение общей формулы (1) по п.19, или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль. 69. Терапевтическое средство для лечения цереброваскулярных заболеваний, содержащее в качестве эффективного ингредиента соединение общей формулы (1) по п.1 или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль, в котором R1 является SR6, где R6 представляет необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или прямую или разветвленную алкенильную группу, имеющую 2-6 углеродных атомов; R2 и R3, которые могут быть одинаковыми или различными, представляют каждый атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; или R2 и R3 могут соединяться вместе с образованием 3-8-членного кольца; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или амидиногруппу, которая может быть замещена на атоме азота циклической алкильной группой, имеющей 3-8 углеродных атомов, или нитрогруппой; R5 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют каждый атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут быть объединены вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 70. Терапевтическое средство для лечения цереброваскулярных заболеваний, содержащее в качестве эффективного ингредиента соединение общей формулы (1) по п.1 или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль, где R1 является NR7R8, где R7 представляет атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, циклическую алкильную группу, имеющую 3-8 углеродных атомов, или нитрогруппу, и R8 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R2 и R3, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или R2 и R3 могут соединяться вместе с образованием 3-8-членного кольца; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или амидиногруппу, которая может быть замещена на атоме азота циклической алкильной группой, имеющей 3-8 углеродных атомов, или нитрогруппой, R5 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют каждый атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют каждый атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 71. Терапевтическое средство для лечения болезни Паркинсона, содержащее в качестве эффективного ингредиента соединение общей формулы (1) или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль. 72. Терапевтическое средство для лечения травматических повреждений головного мозга, содержащее в качестве эффективного ингредиента соединение общей формулы (1) или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль. 73. Терапевтическое средство для лечения припадка, содержащее в качестве эффективного ингредиента соединение общей формулы (1) или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль. 74. Терапевтическое средство для лечения цереброваскулярных заболеваний, содержащее в качестве эффективного ингредиента, соединение по п.15 или его фармацевтически приемлемую соль. 75. Терапевтическое средство по п.74, где типом цереброваскулярных заболеваний является внутримозговое кровоизлияние. 76. Терапевтическое средство по п.74, где типом цереброваскулярных заболеваний является субарахноидальное кровоизлияние. 77. Терапевтическое средство по п.74, где типом цереброваскулярных заболеваний является инфаркт головного мозга. 78. Терапевтическое средство по п.74, где типом цереброваскулярных заболеваний является отек головного мозга. 79. Терапевтическое средство для лечения болезни Альцгеймера, содержащее в качестве эффективного ингредиента соединения по п.15 или его фармацевтически приемлемую соль. 80. Анальгезирующее средство, содержащее в качестве эффективного ингредиента соединение по п.15 или его фармацевтически приемлемую соль. 81. Терапевтическое средство для лечения толерантности к морфину или зависимости от морфина, содержащее в качестве эффективного ингредиента соединение по п.15 или его фармацевтически приемлемую соль. 82. Терапевтическое средство для лечения септических шоков, содержащее в качестве эффективного ингредиента соединение по п.15 или его фармацевтически приемлемую соль. 83. Терапевтическое средство для лечения хронического ревматоидного артрита, содержащее в качестве эффективного ингредиента соединение по п.15 или его фармацевтически приемлемую соль. 84. Терапевтическое средство для лечения остеоартрита, содержащее в качестве эффективного ингредиента соединение по п.15 или его фармацевтически приемлемую соль. 85. Терапевтическое средство для лечения вирусных или невирусных инфекций, содержащее в качестве эффективного ингредиента соединение по п.15 или его фармацевтически приемлемую соль. 86. Терапевтическое средство для лечения диабета, содержащее в качестве эффективного ингредиента соединение по п.15 или его фармацевтически приемлемую соль. 87. Терапевтическое средство для лечения болезни Паркинсона, содержащее в качестве эффективного ингредиента соединение по п.15 или его фармацевтически приемлемую соль. 88. Терапевтическое средство для лечения травматических повреждений головного мозга, содержащее в качестве эффективного ингредиента соединение по п.15 или его фармацевтически приемлемую соль. 89. Терапевтическое средство для лечения припадка, содержащее в качестве эффективного ингредиента соединение по п.15 или его фармацевтически приемлемую соль. 90. Терапевтическое средство, обладающее NOS ингибирующей активностью, содержащее эффективный ингредиент, отличающееся тем, что содержит в качестве эффективного ингредиента соединение общей формулы (1) или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль. 91. Терапевтическое средство, обладающее NOS ингибирующей активностью, содержащее эффективный ингредиент, отличающееся тем, что содержит в качестве эффективного ингредиента соединение общей формулы (1) по п.19 или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль. 92. Терапевтическое средство, обладающее NOS ингибирующей активностью, содержащее эффективный ингредиент, отличающееся тем, что в качестве эффективного ингредиента содержит N-(4-(S-метилизотиоуреидо)фенил)этил)амин или его фармацевтически приемлемую соль. 93. Терапевтическое средство, обладающее NOS ингибирующей активностью, содержащее эффективный ингредиент, отличающееся тем, что в качестве эффективного ингредиента содержит соединение общей формулы (1) по п.1 или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль, в которой R1 является SR6, где R6 представляет необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или прямую или разветвленную алкенильную группу, имеющую 2-6 углеродных атомов; R2 и R3, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; или R2 и R3 могут соединяться вместе с образованием 3-8-членного кольца; R4 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или амидиногруппу, которая может быть замещена на атоме азота циклической алкильной группой, имеющей 3-8 углеродных атомов, или нитрогруппой; R5 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут быть объединены вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 94. Терапевтическое средство, обладающее NOS ингибирующей активностью, содержащее эффективный ингредиент, отличающееся тем, что в качестве эффективного ингредиента содержит соединение общей формулы (1) по п.1 или его возможный стереоизомер, или его оптически активную форму, или его фармацевтически приемлемую соль, в которой R1 является NR7R8, где R7 представляет атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, циклическую алкильную группу, имеющую 3-8 углеродных атомов, или нитрогруппу, и R8 представляет атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; R2 и R3, которые могут быть одинаковыми или различными, представляют каждый атом водорода или прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или R2 и R3 могут соединяться вместе с образованием 3-8-членного кольца; R4 представляет атом водорода, прямую или разветвленную сильную группу, имеющую 1-6 углеродных атомов, алкоксикарбонильную группу, алкильная часть которой представляет прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, или амидиногруппу, которая может быть замещена на атоме азота циклической алкильной группой, имеющей 3-8 углеродных атомов, или нитрогруппой; R5 представляет атом водорода, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов; Y1, Y2, Y3 и Y4, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, атом галогена, гидроксильную группу, прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, которая может быть замещена 1-3 атомами галогена, прямую или разветвленную алкоксигруппу, имеющую 1-6 углеродных атомов, или NY5Y6, где Y5 и Y6, которые могут быть одинаковыми или различными, представляют, каждый, атом водорода, необязательно замещенную прямую или разветвленную алкильную группу, имеющую 1-6 углеродных атомов, ацильную группу, имеющую 1-8 углеродных атомов, или Y5 и Y6 могут соединяться вместе с образованием 3-8-членного кольца; n и m равны, каждый, целому числу 0 или 1. 95. Терапевтическое средство, обладающее NOS ингибирующей активностью, содержащее эффективный ингредиент, отличающееся тем, что в качестве эффективного ингредиента содержит N-(5-(S-этилизотиоуреидо)-2-метоксифенилметил)амин или его фармацевтически приемлемую соль. Приоритет по пунктам: 07.06.95 по пп.1 – 34; 12.12.94 по пп.35 – 66; 07.06.95 по пп.67 – 70; 12.12.95 по пп.71 – 73. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 13.12.2003
Извещение опубликовано: 10.05.2005 БИ: 13/2005
|
||||||||||||||||||||||||||
