|
(21), (22) Заявка: 2008127703/15, 07.07.2008
(24) Дата начала отсчета срока действия патента:
07.07.2008
(43) Дата публикации заявки: 20.01.2010
(46) Опубликовано: 10.05.2010
(56) Список документов, цитированных в отчете о
поиске:
RU 2269573 С2, 27.04.2005. Detection of Trichomonosis in Vaginal and Urine Specimens from Women by culture and PCR. Lisa F. et al. Journal of Clinical Microbiologi, October 2000, vol.38,  10, p 3585-3588. Diagnosis of Trichomononas Vaginalis infection Using PCR Method Compared To Culture and Wet Mount Microscopy. Rasoul Jamali et al. Int. Med J Vol.5 10, p 3585-3588. Diagnosis of Trichomononas Vaginalis infection Using PCR Method Compared To Culture and Wet Mount Microscopy. Rasoul Jamali et al. Int. Med J Vol.5  1 June 2006. 1 June 2006.
Адрес для переписки:
660022, г.Красноярск-22, ул. Партизана-Железняка, 1, Медицинская академия, патентный отдел
|
(72) Автор(ы):
Усольцева Ольга Сергеевна (RU),
Шипулин Герман Александрович (RU),
Гущин Александр Евгеньевич (RU),
Котловский Юрий Васильевич (RU),
Воеводина Татьяна Викторовна (RU)
(73) Патентообладатель(и):
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ “КРАСНОЯРСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ имени профессора В.Ф. Войно-Ясенецкого ФЕДЕРАЛЬНОГО АГЕНТСТВА ПО ЗДРАВООХРАНЕНИЮ И СОЦИАЛЬНОМУ РАЗВИТИЮ” (RU)
|
(54) СПОСОБ ДИАГНОСТИКИ ТРИХОМОНИАЗА
(57) Реферат:
Изобретение относится к медицине и биологии и может быть использовано для диагностики трихомониаза и определения наличия ДНК Trichomonas vaginalis в исследуемом образце. Заявлен способ диагностики трихомониаза методом полимеразной цепной реакции с детекцией электрофорезом в геле. Заявленное изобретение обеспечивает более высокую чувствительность полимеразной цепной реакции при проведении диагностики трихомониаза. 3 табл. 1 ил.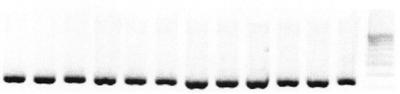
Изобретение относится к медицине и биологии и может быть использовано для диагностики трихомониаза и определения наличия ДНК Trichomonas vaginalis в исследуемом образце.
На сегодняшний день регламентированными методами диагностики трихомониаза является бактериоскопический и культуральный [1, 2, 3]. Бактериоскопический (микроскопия нативного препарата и с окраской) как самый доступный, дешевый и простой метод широко используется в практическом здравоохранении. Однако микроскопия нативного препарата возможна только непосредственно после взятия материала, так как трихомонада способна существовать и двигаться во внешней среде очень непродолжительное время, а именно двигательная активность позволяет идентифицировать ее в препарате. Определение трихомонад в окрашенном препарате тоже иногда вызывает сомнения из-за возможности присутствия атипичных форм простейшего или потере морфологических признаков при фиксации и окраске, низком титре возбудителя или из-за большого количества эпителия, лейкоцитов и сходства трихомонад с полиморфно-ядерными лейкоцитами. Поэтому бактериоскопия требует специальной квалификации и опыта для выявления данного заболевания. Для обеспечения диагностики культуральным методом также требуется концентрация нескольких сотен живых простейших в пробе. Работа с культурой требует больших затрат и занимает значительное количество времени, что неблагоприятно и для пациента и с точки зрения возможности дальнейшего распространения инфекции.
По сообщениям разных исследователей чувствительность метода микроскопии варьирует от 38% до 60% [1, 3], а чувствительность культурального метода не превышает 85% [1, 2, 3]. Следовательно, данные методы лабораторной диагностики трихомониаза не отвечают современным требованиям по своей чувствительности, специфичности, способности оценивать и контролировать результаты лечения.
Ограничения культуральных и микроскопических методов для выявления Т.vaginalis вызывают необходимость развивать альтернативные методы.
Иммуноферментные методы неоднократно предлагались для диагностики трихомониаза, однако они не дают удовлетворительных результатов. Специфические антитела могут присутствовать в течение 1 года после излечения заболевания, что делает невозможным дифференцировать состояние болезни от реконвалесценции, либо могут совсем не обнаруживаться из-за низкого их титра и недостаточного гуморального ответа организма. Определение антигенов Trichomonas vaginalis также не обеспечивает должной чувствительности из-за способности простейшего к “мимикрии” путем адсорбции на своей поверхности белков плазмы хозяина [6].
Несмотря на вышеизложенные трудности в диагностике, официальная статистика МЗ РФ по заболеваемости за последние годы показывает, что трихомониаз занимает лидирующее место среди инфекций, передаваемых половым путем. Предполагается, что около 180-200 млн женщин в мире инфицированы Trichomonas vaginalis [3]. А если учитывать, что у 25-50% женщин и у большинства мужчин наблюдают бессимптомное трихомонадоносительство, то о реальном проценте заболеваемости можно только предполагать [4, 3]. Причем более 90% случаев представляет собой смешанный протозойно-бактериальный процесс, что также затрудняет клиническую диагностику инфекции [5].
Данная ситуация позволяет предположить, что аналитическая чувствительность диагностических тестов недостаточна. Учитывая то, что среда обитания для трихомонад у мужчин менее благоприятна, чем у женщин, концентрация возбудителя может быть достаточно низкой, особенно в начальный период после заражения, однако риск передачи инфекции не снижается. Следовательно, необходимы подходы, позволяющие обеспечить необходимый уровень чувствительности методов при проведении диагностики.
В связи с изложенными проблемами в настоящее время активно развиваются молекулярно-генетические методы идентификации Т.vaginalis, обладающие высокой специфичностью и чувствительностью, и наравне с культуральным методом широко используются в клинике. В эту группу входит полимеразная цепная реакция с электрофоретической детекцией. Чувствительность и специфичность этого метода превышает вышеперечисленные [1, 7]. Однако существует вероятность ложноположительных результатов из-за перекрестных реакций вследствие подбора недостаточно специфичной мишени ДНК возбудителя. Ложноотрицательные реакции могут возникать, когда участок для амплификации не консервативен. Следовательно, необходима разработка новых праймеров с учетом последних молекулярно-генетических исследований в этой области.
В настоящее время разрабатываются различные модификации молекулярных методов исследования, направленные на исключение возможности возникновения ошибок и с целью улучшения чувствительности.
Известен способ диагностики трихомониаза, основанный на полимеразной цепной реакции (ПЦР) с использованием праймеров
TVK 3/7:
– ATTGTCGAACATTGGTCTTACCCTC
– TCTGTGCCGTCTTCAAGTATGC
дающих в процессе ПЦР продукт длиной 300 пар оснований, с дальнейшей его детекцией методом электрофореза [13].
Недостатком этого способа является низкая чувствительность:
литературные данные указывают на чувствительность праймеров к данной области генома Trichomonas vaginalis в 88% [13].
Известен способ диагностики трихомониаза, основанный на полимеразной цепной реакции (ПЦР) с использованием праймеров [9]
TVA 5-1/6:
– ATGTTCTATCTTTTCATTGT (5-24),
– GATCACCACCTTAGTTTACA (102-83);
Продуктом амплификации с использованием этой пары параймеров будет участок ДНК Trichomonas vaginalis 98 пар оснований.
По литературным данным чувствительность праймеров TVA 5-1/6 составляет около 69% [9].
Известен способ диагностики трихомониаза, основанный на полимеразной цепной реакции (ПЦР) с использованием пар праймеров [14]
TV1/TV2:
– TAATGGCAGAATCTTTGGAGAAA (850-872),
– GAACTTTAACCGAAGGACTTCG (1161-1140)
или BTUB9/2
– CATTGATAACGAAGCTCTTTACGAT (847-874),
– CATGTTGTGCCGGACATAACCAT (960-938);
дающих продукт длиной 312 и 112 пар оснований соответственно с дальнейшей его детекцией методом электрофореза.
| Табл 1. |
| Результаты исследования клинических проб на наличие Trichomonas vaginalis культуральным методом и ПЦР [14] |
 проб проб |
14 |
4 |
1 |
3 |
1 |
1 |
1 |
1 |
1 |
1 |
3 |
22 |
6 |
1 |
1 |
1 |
4 |
2 |
3 |
3 |
1 |
2 |
2 |
10 |
1 |
1 |
1 |
1 |
15 |
3 |
| культура |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
| BTU В 9/2 |
+ |
+ |
+ |
+ |
+ |
– |
+ |
+ |
– |
+ |
– |
+ |
+ |
– |
+ |
– |
+ |
+ |
– |
– |
+ |
+ |
– |
– |
+ |
+ |
– |
– |
+ |
– |
| TVK 3/7 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
– |
– |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
– |
– |
– |
– |
– |
– |
| TV1/TV2 |
+ |
– |
+ |
– |
– |
– |
+ |
– |
– |
– |
– |
+ |
– |
+ |
– |
– |
+ |
– |
+ |
– |
+ |
– |
+ |
– |
– |
– |
– |
– |
– |
+ |
| «+» положительный результат |
| «-» – отрицательный |
Недостатком диагностики трихомониаза методом ПЦР с данными праймерами является низкая чувствительность, составляющая 59% в реакции с TV1/TV2 и 77% с BTUB9/2 [14].
Таким образом, вышеперечисленные способы не могут обеспечить должной чувствительности которая по разным данным находится в пределах 59%-88% [8, 9, 10, 11, 12, 13, 14].
Задачей предлагаемого способа является увеличение выявляемости трихомониаза.
Поставленную задачу решают за счет того, что используют праймеры (TV7) нуклеотидного состава:
CACTGTGAACAAATCAGGACGCTT (788-764)
TTGGATACTCCTACTCTCGCCCTTG (568-591);
инкубационная смесь конечным объемом 36 мкл, содержащая: 6 mM Tris-HCl (рН 8.5 25°С); 3 mM MgSO4; 25 mM KCl; ксиленцианол; 2 mM dNTP; 10 рМ праймеров; 10 мкл ДИК матрицы; 5 ед. Tag-ДНК полимеразы; и программа амплификации: 95°С – 5 мин – 1 цикл, 95°С – 20 сек; 55°С – 20 сек; 72°С – 40 сек – 10 циклов и 93°С – 5 сек; 55°С – 5 сек; 72°С – 10 сек – 30 циклов, с последующей детекцией продукта реакции электрофорезом в геле и оценкой результата по размеру ампликона, который в случае наличия в исследуемом материале Т.vaginalis, должен быть длиной 221 пар оснований.
Для разработки способа:
1) провели дизайн праймеров;
2) оценили специфичность и чувствительность с использованием геномных баз данных (в том числе NCBI) и программ Primer Premier 5, OligoCalculator, Vector NTI Advanced v9.0;
3) рассчитали границы температурного режима реакции;
4) синтезировали олигонуклеотидную последовательность разработанных праймеров с использованием ДНК-синтезатора ASM 800 synthesizer (фирмы Bioset);
5) провели очистку синтезированных праймеров по стандартному протоколу с контролем электрофорезом в полиакриламидном геле;
6) определили оптимальную температуру отжига праймеров путем постановки ПЦР на амплификаторе T-gradient (фирмы Biometra);
7) эмпирически оптимизировали состав реакционной смеси для ПЦР с данными праймерами;
Так как чувствительность ПЦР в первую очередь определяется качеством праймеров, поэтому
– использовали в качестве мишени для амплификации, определяемой нуклеотидной последовательностью праймеров, консервативный участок гена (Trichomonas vaginalis strain TV2 small subunit ribosomal RNA) T.Vaginalis;
– использовали в качестве мишени для амплификации, определяемой нуклеотидной последовательностью праймеров, участок гена специфичный только для Trihomonas vaginalis;
– провели анализ энергетического профиля ДНК с оценкой выбранной последовательности по GC составу, структуре и длине;
– исходя из нуклеотидного состава разработанных праймеров (TV7)
– CACTGTGAACAAATCAGGACGCTT (788-764)
– TTGGATACTCCTACTCTCGCCCTTG (568-591) и с учетом характеристик, рассчитанных в Primer Premier 5, OligoCalculator, Vector NTI Advanced v9.0, определили теоретические границы концентраций компонентов реакционной смеси;
– исходя из характеристик и нуклеотидного состава праймеров, определили теоретические границы температурного режима проведения полимеразной цепной реакции, а также времени этапов денатурации, отжига и элонгации.
Получение экспериментальных данных позволило максимально оптимизировать условия реакции с данной последовательностью праймеров.
Способ реализуют следующим образом.
Выявляют возбудить трихомониаза (простейшее Trichomonas vaginalis) методом полимеразной цепной реакции (ПЦР). Для этого выделяют ДНК из исследуемого образца и проводят амплификацию с использованием олигонуклеотидных праймеров с последующим переносом продукта амплификации на гель и оценку результата реакции.
Выделение ДНК возбудителя для ПЦР проводят путем фенолхлороформной экстракции. Инкубационная смесь для ПЦР конечным объемом 36 мкл содержит: 6 mM Tris-HCl (рН 8.5 25°C); 3 mM MgSO4; 25 mM KCl; ксиленцианол; 2 mM dNTP; 10 рМ праймеров; 10 мкл ДНК матрицы; 5 ед. Tag-ДНК полимеразы. ПЦР проводят с использованием горячего старта во избежание неспецифического отжига праймеров. Для этого нижнюю смесь, содержащую праймеры и dNTP, отделют от верхней воском, который плавится при температуре около 70°C. Это обеспечивает запуск реакции только в ячейке амплификатора с последующим циклическим изменением температуры по заданным параметрам. Температурный режим проведения ПЦР:
После завершения ПЦР оценку результата реакции проводят в комнате для анализа продуктов ПЦР. Анализируют продукт амплификации разделением фрагментов ДНК в 2% агарозном геле в стандартном ТБЕ буфере для электрофореза. В лунку добавляют по 10 мкл образца. Электрофорез проводят около 25 мин. Результаты электрофореза учитывают, просматривая гель в ультрафиолетовом свете с длиной волны 254 нм на приборе «Трансиллюминатор» с последующей визуализацией на компьютере. Положительными считают пробы, полосы которых располагаются в геле на том же расстоянии от старта, что и полоса маркерной лестницы, соответствующая величине фрагмента в 221 пар оснований.
Для определения диагностической чувствительности метода ПЦР с использованием разработанных олигонуклеотидных праймеров (TV7) сравнивали результаты микробиологического посева клинического материала, полученного от 16 пациентов с результатами ПЦР диагностики с TV7 этих же образцов (табл.2, чертеж).
Результат амплификации ДНК, выделенного из микробиологического посева, с использованием синтетических олигонуклеотидных праймеров показан на чертеже. Полосы расположены на том же растоянии от старта, что и полоса маркерной лестницы, соответствующая размеру фрагмента длиной 221 пар оснований, что свидетельствует о наличии в исследуемых образцах Т.vaginalis.
Микробиологический посев проводят по стандартной методике. То есть осуществляют внесение вагинального соскоба в питательную среду, высокоспецифичную только для Trichomonas vaginalis, инкубируют смесь при 37°C в течение 24 часа с последующей визуальной оценкой придонного роста в виде плотного белого осадка.
Выделение ДНК для ПЦР проводят путем фенолхлороформной экстракции.
| Табл.2 |
| Результаты исследования клинических проб на наличие Trichomonas vaginalis культуральным методом и ПЦР. |
 пр пр |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
| м/п |
– |
– |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
– |
– |
+ |
+ |
+ |
+ |
+ |
| ПЦР |
– |
– |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
– |
– |
+ |
+ |
+ |
+ |
+ |
| м/п – результат анализа на наличие Trichomonas vaginalis методом микробиологического посева |
| ПЦР – результат анализа на наличие Trichomonas vaginalis методом ПЦР с разработанными (tub 1/2) праимерами. |
По результатам эксперимента все пробы, положительные с использованием культурального метода, были положительны в ПЦР с TV7.
Для оценки способа было также проведено сравнение результатов анализов клинического материала от 25 пациентов, проведенных методом ПЦР с разработанными праймерами (TV7), а методом прямой иммунофлуорисценции (ПИФ) было исследовано 7 и микробиологическим посевом 22 (табл.3).
Для проведения анализа использовали следующий клинический материал:
У женщин:
– отделяемое задненижнего свода влагалища, забранное универсальным зондом, объемом 0,05±0,025 мл.
– соскоб из цервикального канала, забранный универсальным зондом или цитощеткой, объемом 0,05±0,025 мл.
У мужчин:
– соскоб из уретры, забранный универсальным зондом или цитощеткой, объемом 0,05±0,025 мл.
| Табл.3 |
| Результаты исследования клинического материала, проведенного методами микробиологического посева. ПЦР с tub 1/2 и ПИФ |
 пр пр |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
| м/б посев |
– |
– |
– |
н/т |
– |
н/т |
– |
+ |
+ |
– |
+ |
– |
н/т |
– |
– |
– |
+ |
н/т |
+ |
– |
+ |
– |
– |
– |
+ |
| ПЦР |
+ |
+ |
– |
+ |
– |
– |
– |
+ |
+ |
– |
+ |
– |
+ |
+ |
– |
+ |
+ |
– |
+ |
+ |
+ |
– |
– |
+ |
+ |
| ПИФ |
+ |
+ |
н/т |
+ |
– |
– |
– |
+ |
– |
– |
– |
н/г |
+ |
н/т |
– |
+ |
– |
– |
– |
н/т |
– |
– |
– |
+ |
– |
| н/т – проба не тестировалась |
Из 25 образцов 15 показали наличие возбудителя методом ПЦР с разработанными праймерами (TV7). Из 15 проб, положительных по ПЦР, по м/б посеву были положительны 7 (46%), 4 отрицательных по посеву показали наличие возбудителя по методу ПИФ. Все 7 проб, положительных по ПИФ, были положительны по ПЦР (100%), причем в одной пробе подтвердилось наличие возбудителя всеми тремя методами. Две пробы были положительны только при анализе методом ПЦР с разработанными праймерами (TV7).
Полученные данные позволяют сделать вывод об очень высокой чувствительности предлагаемого способа. Статистическую обработку результатов проводили по критерию знаков.
Разработанный способ иллюстрируется следующим примерами.
Пример  1. 1.
Больная, 37 лет обратилась с жалобами на обильные выделения из половых путей, зуд вульвы, дискомфорт. При осмотре: шейка матки цилиндрическая, передняя губа гипертрофирована, множество открытых проток желез. Гипертрофия шейки матки.
Микроскопическое исследование отделяемого цервикального канала, уретры и влагалища показало лейкоцитоз в 30-35, 10-12, 40-45, в поле зрения соответственно, трихомонады с характерной сопутствующей микрофлорой в виде внеклеточных грамотрицательных кокков и палочек. Обнаружены трихомонады также в результате микробиологического посева. При этом иммуноферментный анализ крови дал отрицательный результат на антитела к Trichomonas vaginalis. Было также проведено исследование клинического материала на наличие трихомонад методом ПЦР с разработанными праймерами. Для проведения анализа использовали отделяемое задненижнего свода влагалища, забранное универсальным зондом объемом 0,05±0,025 мл. ДНК возбудителя для ПЦР выделили по стандартной методике, путем фенолхлороформной экстракции. Полимеразную цепную реакцию проводили в пробирках типа эппендорф, объемом 0,2 мл, содержащих 6 mМ Tris-HCl (рН 8.5 25°C); 3 mM MgSO4; 25 mM KCl; ксиленцианол; 2 mM dNTP; 10 рМ праймеров; 5 ед. Tag-ДНК полимеразы и 10 мкл ДНК, выделенной из клинического материала пациента. ПЦР проводили с использованием горячего старта во избежание неспецифического отжига праймеров. Для этого нижнюю смесь, содержащую праймеры и dNTP, отделют от верхней воском, который плавится при температуре около 70°C. Далее пробирки поместили в амплификатор, который обеспечивает циклическое изменение температуры по заданной программе (95°C – 5 мин – 1 цикл; 95°C – 20 сек; 55°C – 20 сек; 72°C – 40 сек – 10 циклов и 93°C – 5 сек; 55°C – 5 сек; 72°C – 10 сек – 30 циклов), необходимое для прохождения реакции и получения продукта в виде участка ДНК (ампликона) Trichomonas vaginalis в достаточной, для дальнейшей детекции, концентрации. После завершения ПЦР анализировали продукт амплификации разделением фрагментов ДНК в 2% агарозном геле в стандартном ТБЕ буфере для электрофореза. В лунку добавляли по 10 мкл образца. Электрофорез проводили около 25 мин. Результаты электрофореза учитывали, просматривая гель в ультрафиолетовом свете с длиной волны 254 нм на приборе «Трансиллюминатор» с последующей визуализацией на компьютере. В результате анализа продуктов реакции, в геле четко дифференцировалась полоса, располагающаяся на том же расстоянии от старта, что и полоса маркерной лестницы, имеющая величину фрагмента около 221 п.н., что соответствует специфическому фрагменту ДНК, который должен быть получен в результате полимеразной цепной реакции, в случае присутствия в клиническом материале Trichomonas vaginalis. Таким образом, результат анализа был положительный. Больной был поставлен диагноз трихомониаз.
Пример  2. 2.
Больная, 57 лет. Жалобы на периодические выделения из половых путей. В анамнезе: оперирована по поводу кисты яичника и миомы матки. Проходила лечение трихомониаза в 2007 году, муж не лечился. Половые контакты регулярные, не защищенные. При микроскопическом исследовании клинического материала трихомонад не обнаружено, однако мазок воспалительного характера, лейкоцитоз в пределах 20-25 в поле зрения. ПИФ и ИФА отрицательны на трихомонады. Но по микробиологическому посеву хороший придонный рост. Исследование ПЦР, используя вышеописанный способ, также показало присутствие в пробе ДНК Trichomonas vaginalis. ПИФ выявил антигены mycoplasma hominis. Был поставлен диагноз хронический трихомониаз, микоплазмоз в стадии ремиссии.
Предлагаемый способ позволяет обеспечить высокую выявляемость трихомониаза и может быть использован не только для диагностики, но и для контроля после лечения.
Список литературы
1. Адаскевич В.П. Инфекции, передаваемые половым путем. – Нижний Новгород: Издательство НГМА, М.: Медицинская книга, 1999, 416 с.
2. Арустамова С.В. О смешанных инфекциях женских гениталий грибами Candida и влагалищными трихомонадами: Автореф.  канд. мед. наук. – Омск, 1974. – 15 с. канд. мед. наук. – Омск, 1974. – 15 с.
3. Беднова В.Н., Погорельский Л.В., Васильев М.М. и др. Тактика обследования и терапии больных инфекционными урогенитальными заболеваниями, осложненными дисбактериозом (пособие для врачей). М., 1996, 14 с.
 4. – С.63-66. 4. – С.63-66.
 4. – С.39-42. 4. – С.39-42.
 4. – С.56-57. 4. – С.56-57.
 3. – С.4-6. 3. – С.4-6.
Формула изобретения
Способ диагностики трихомониаза методом полимеразной цепной реакции с детекцией электрофорезом в геле, отличающийся тем, что в реакции используются праймеры (TV7) нуклеотидного состава:
CACTGTGAACAAATCAGGACGCTT (788-764),
TTGGATACTCCTACTCTCGCCCTTG (568-591);
инкубационная смесь конечным объемом 36 мкл, содержащая: 6 мМ Tris-HCl (рН 8,5 25°С); 3 mM MgSO4; 25 mM KCl; ксиленцианол; 2 mM dNTP; 10 рМ праймеров; 10 мкл ДНК матрицы; 5 ед. Tag-ДНК полимеразы; и программа амплификации: 95°С – 5 мин – 1 цикл, 95°С – 20 с; 55°С – 20 с; 72°С – 40 с – 10 циклов и 93°С – 5 с; 55°С – 5 с; 72°С – 10 с – 30 циклов, с последующей детекцией продукта реакции электрофорезом в геле и оценкой результата по размеру ампликона, который в случае наличия в исследуемом материале T.vaginalis, должен быть длиной 221 пар оснований.
РИСУНКИ
|