|
|
(21), (22) Заявка: 2007140566/13, 03.05.2006
(24) Дата начала отсчета срока действия патента:
03.05.2006
(30) Конвенционный приоритет:
04.05.2005 FR 05.04562
(43) Дата публикации заявки: 10.06.2009
(46) Опубликовано: 10.05.2010
(56) Список документов, цитированных в отчете о
поиске:
CARVALLO M. et.al. Characterization of an alpha-L-arabinofuranosidase gene (abfl) from Penicillium purpurogenum and its expression, Mycol Res., 2003, 107(Pt4), p.388-94. KOSEKI T. et.al. Role of two alpha-L-arabinofuranosidases in arabinoxylan degradation and characteristics of the encoding genes from shochu koji molds, Aspergillus kawachii andAspergillus awamori. J Biosci Bioeng. 2003, 96(3), p.232-41. US 5989887, 23.11.1999. DE IOANNES P et al. An alpha-L-arabinofuranosidase from Penicillium purpurogenum: production, purification and properties J Biotechnol. 2000, 76(2-3), p.253-8. RU 2017433, 15.08.1994.
(85) Дата перевода заявки PCT на национальную фазу:
04.12.2007
(86) Заявка PCT:
FR 2006/000998 20060503
(87) Публикация PCT:
WO 2006/117482 20061109
Адрес для переписки:
191002, Санкт-Петербург, а/я 5, ООО “Ляпунов и партнеры”, пат.пов. Ю.В.Кузнецовой
|
(72) Автор(ы):
ФРАНСУА Жан Мари (FR),
ПАРРУ Жан-Люк (FR),
ТУРРАСС Оливье (FR),
НОР Оливье (FR)
(73) Патентообладатель(и):
АДИССЕО ФРАНС С.А.С. (FR)
|
(54) ГЕН ABFB-1 PENICILLIUM FUNICULOSUM
(57) Реферат:
Изобретение относится к биотехнологии и представляет собой полипептид, обладающий  -L-арабинофуранозидазной активностью, выбранный из следующих полипептидов: полипептид с SEQ ID No.2, полипептид, аминокислотная последовательность которого находится между положениями 28 и 507 SEQ ID No.2, фрагмент полипептида с SEQ ID No.2, обладающий активностью -L-арабинофуранозидазной активностью, выбранный из следующих полипептидов: полипептид с SEQ ID No.2, полипептид, аминокислотная последовательность которого находится между положениями 28 и 507 SEQ ID No.2, фрагмент полипептида с SEQ ID No.2, обладающий активностью  -L-арабинофуранозидазы, полипептид, обладающий активностью -L-арабинофуранозидазы, полипептид, обладающий активностью  -L-арабинофуранозидазы В и проявляющий, по меньшей мере, 90% идентичность с полипептидом SEQ ID No.2. Изобретение также относится к полинуклеотиду, кодирующему данный полипептид, экспрессионной кассете и вектору, содержащим полинуклеотид, и организму-хозяину, содержащему данный полипептид. Изобретение позволяет расширить арсенал средств для гидролиза -L-арабинофуранозидазы В и проявляющий, по меньшей мере, 90% идентичность с полипептидом SEQ ID No.2. Изобретение также относится к полинуклеотиду, кодирующему данный полипептид, экспрессионной кассете и вектору, содержащим полинуклеотид, и организму-хозяину, содержащему данный полипептид. Изобретение позволяет расширить арсенал средств для гидролиза  -L-арабинофуранозильных связей в арабинофуранозилолигосахаридных соединениях. 7 н. и 2 з.п. ф-лы, 4 ил., 2 табл. -L-арабинофуранозильных связей в арабинофуранозилолигосахаридных соединениях. 7 н. и 2 з.п. ф-лы, 4 ил., 2 табл.
Настоящее изобретение касается гена abfB-1, выделенного из Penicillium funiculosum, и полипептида ABFB-1, кодируемого этим геном и обладающего активностью  -L-арабинофуранозидазы В. -L-арабинофуранозидазы В.
Penicillium funiculosum представляет собой таларомицет семейства Aspergilleae. Факт обнаружения этого микроорганизма во множестве органических субстратов, подверженных воздушному или водному загрязнению, указывает на то, что этот грибок обладает необычайно богатым арсеналом гидролитических ферментов. Применение этой ферментной смеси в питании животных способствует деполимеризации природных органических субстратов и позволяет улучшить их перевариваемость. Так, в заявке WO 99/57325 описывается штамм Penicillium funiculosum, обозначаемый IMI378536, который вырабатывает ферментную смесь, приспособленную, в частности, для применения в питании животных. Тем не менее, такие ферментные смеси, вырабатываемые Penicillium funiculosum, биохимически слабо охарактеризованы. В действительности, в получаемом ферментированном сусле обычно измеряется только ограниченное количество ферментных активностей, таких как ксиланаза и бета-глюканаза. Эти активности отражают лишь часть совокупности ферментов, присутствующих в смеси.
Соединения типа гемицеллюлоз сельскохозяйственного назначения составляют, вслед за целлюлозой, второй по значимости резерв полисахаридов в составе растительных тканей. Эта группа представлена широким спектром гетерополисахаридов, основными представителями которых являются ксиланы, арабинаны, галактаны, глюканы и маннаны. Арабиноза в фурфурольной форме широко представлена среди таких гетерополисахаридов, как арабинаны и арабиноксиланы. Арабинан представляет собой полимер из остатков арабинофуранозы, соединенных связями  -1-5, который может быть замещен в положении O-2 или O-3 одним или двумя остатками арабинозы. Что касается арабиноксиланов, -1-5, который может быть замещен в положении O-2 или O-3 одним или двумя остатками арабинозы. Что касается арабиноксиланов,  -L-арабинофуранозильные остатки соединяются с основной -L-арабинофуранозильные остатки соединяются с основной  -1-4-ксилопиранозильной цепью связями -1-4-ксилопиранозильной цепью связями 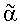 -1-3 и -1-3 и 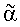 -1-2. Присутствие остатков арабинозы в боковых цепях может препятствовать ферментативному гидролизу гемицеллюлоидных соединений при разного рода промышленном применении, например для улучшения перевариваемости кормов для животных. Ферменты, расщепляющие -1-2. Присутствие остатков арабинозы в боковых цепях может препятствовать ферментативному гидролизу гемицеллюлоидных соединений при разного рода промышленном применении, например для улучшения перевариваемости кормов для животных. Ферменты, расщепляющие  -L-арабинофуранозидные связи, могут действовать синергично с ксиланазами при осуществлении гидролиза арабиноксиланов и арабинанов. -L-арабинофуранозидные связи, могут действовать синергично с ксиланазами при осуществлении гидролиза арабиноксиланов и арабинанов.
Таким образом, арабиназные активности (эндо-, экзоарабиназные и, в большинстве своем,  -L-арабинофуранозидазные активности) могут действенным образом, синергично с ксиланазами, вносить свой вклад в деполимеризацию гемицеллюлоидных соединений. Гемицеллюлоидные и пектиновые соединения могут составлять до 50% общего содержания углеводов в растительном сырье и представляют собою важный источник энергии для животных. Улучшение перевариваемости этих соединений связано с уменьшением доли замещения арабинозильными остатками гемицеллюлозных соединений (Brice, R.E., Morrison, I.M. 1982, Carbohydr. Res. 101: 93-100). -L-арабинофуранозидазные активности) могут действенным образом, синергично с ксиланазами, вносить свой вклад в деполимеризацию гемицеллюлоидных соединений. Гемицеллюлоидные и пектиновые соединения могут составлять до 50% общего содержания углеводов в растительном сырье и представляют собою важный источник энергии для животных. Улучшение перевариваемости этих соединений связано с уменьшением доли замещения арабинозильными остатками гемицеллюлозных соединений (Brice, R.E., Morrison, I.M. 1982, Carbohydr. Res. 101: 93-100).
Ферменты, гидролизующие связи между остатками L-арабинозы, были выделены из таких микроорганизмов, как бактерии и нитчатые грибы. Такие арабинозидазы в основном представлены  -L-арабинофуранозидазами (ЕС 3.2.1.55), способными гидролизовать невосстанавливающие -L-арабинофуранозидазами (ЕС 3.2.1.55), способными гидролизовать невосстанавливающие  -L-арабинофуранозильные связи в составе L-арабиноксиланов или таких соединений, как арабинаны и арабиногалактаны. -L-арабинофуранозильные связи в составе L-арабиноксиланов или таких соединений, как арабинаны и арабиногалактаны.
 -L-Арабинофуранозидазы (ЕС 3.2.1.55) разделены на два семейства гликозидгидролаз (GH 51 и GH 54) по сходству полипептидной последовательности. Эти два семейства различаются и по специфичности к полисахаридному субстрату. В первой группе (GH 51) представлены арабинофуранозидазы типа А, действующие только на короткие линейные структуры арабинофуранозильных олигосахаридов, связанных в положении -L-Арабинофуранозидазы (ЕС 3.2.1.55) разделены на два семейства гликозидгидролаз (GH 51 и GH 54) по сходству полипептидной последовательности. Эти два семейства различаются и по специфичности к полисахаридному субстрату. В первой группе (GH 51) представлены арабинофуранозидазы типа А, действующие только на короткие линейные структуры арабинофуранозильных олигосахаридов, связанных в положении  -1-5. Во вторую группу входят арабинофуранозидазы типа В (GH 54), катализирующие гидролиз связей -1-5. Во вторую группу входят арабинофуранозидазы типа В (GH 54), катализирующие гидролиз связей  -1-5, -1-5,  -1-3 и -1-3 и  -1-2 боковых цепей арабинофуранозилолигосахаридов. -1-2 боковых цепей арабинофуранозилолигосахаридов.
Арабинофуранозидазы В (ABFB) были выделены из множества бактерий, а также из нитчатых грибов. Род Aspergillus здесь наиболее представлен, однако этот фермент выделяли и из представителей родов Trichoderma, Penicillium и Fusarium.
В WO 96/29416, WO 96/06935, WO 2004/018662 и US 5,989,887 описываются гены арабинофуранозидазы Aspergillus niger. Сопоставление полипептидных последовательностей указывает на то, что белок abfB A. niger на 72,4% идентичен белку ABFB-1 P. funiculosum. В этих патентных заявках не описано ни одной характеристики, существенной для применения полипептида в питании животных.
Описано (Clinche et al. J. Agric. Food Chem., 45, 2379 -2383, 1997) три L-арабинофуранозидазы из Aspergillus terreus, потенциально применимых в виноделии.
В другой публикации (Gielkens et al. Microbiology, 145, 735-741, 1999) описывается ген abfB Aspergillus nidulans.
Гены abfB Aspergillus kawachii и Aspergillus awamori были описаны Косеки и др. (Koseki et al. J. of Bioscience and Bioengineering, vol. 96, no. 3, 232-241, 2003). Эти ферменты находят применение в сбраживании японского ликера сёчу.
Описан также ген abfB нитчатого гриба Trichoderma reesei (Margolles-Clark et al. Applied and Environmental Microbiology, 3840-3846, 1996).
Кроме того, описаны две внеклеточные  -L-арабинофуранозидазы Fusarium oxysporum (Panagiotou et al. Can J 10 Microbiol. 2003: 49(10):639-4). -L-арабинофуранозидазы Fusarium oxysporum (Panagiotou et al. Can J 10 Microbiol. 2003: 49(10):639-4).
Карвальо и др. (Carvallo et al. Mycol. Res., 107 (4), 388-394, 2003) описывают  -L-арабинофуранозидазу из Penicillium purpurogenum. Сопоставление полипептидных последовательностей говорит о том, что белок abf-1 P. purpurogenum на 85,6% идентичен белку ABFB-1 Р. funiculosum. В этой статье не описано ни одной характеристики, существенной для применения этого полипептида в питании животных. -L-арабинофуранозидазу из Penicillium purpurogenum. Сопоставление полипептидных последовательностей говорит о том, что белок abf-1 P. purpurogenum на 85,6% идентичен белку ABFB-1 Р. funiculosum. В этой статье не описано ни одной характеристики, существенной для применения этого полипептида в питании животных.
Сакамото и др. (Sakamoto et al. FEBS Letters 560, 199-204, 2004) описывают ген abnx Penicillium chrysogenum, кодирующий фермент с арабинаназной активностью, отличной, однако, от ABFB.
Тем не менее, описанные ферменты ABFB не обладают оптимальными свойствами, необходимыми для применения в питании животных. В самом деле, для применения в питании животных ABFB должны обладать свойствами, совместимыми с условиями обработки, которой подвергаются корма, предназначенные для такой обработки. В частности, активность используемых ферментов должна быть устойчива при температурах и уровне кислотности, при которых обрабатываются корма, и, по возможности, являться оптимальной как при условиях приготовления кормов, так и при условиях, имеющих место в пищеварительной системе животных, питающихся этими кормами.
Кроме того, эти ферменты должны обладать широким спектром действия на различные полисахариды (арабинаны, арабиноксиланы и арабиногалактаны) для обеспечения эффективного улучшения перевариваемости кормов животными. Это улучшение перевариваемости кормов для животных позволяет повысить их питательную ценность. Таким образом, ферменты, обладающие улучшенными показателями специфичности (стереоспецифичность, энантиослективность), активности или сродства по отношению к приподным субстратам (арабиноксиланам и арабинанам), представляют большой интерес для питания животных.
Настоящее изобретение описывает L-арабинофуранозидазу В (ABFB-1) Penicillium funiculosum, подходящую для применения в питании животных, а также ген, кодирующий этот фермент. Настоящее изобретение касается также гомологов, вариантов и фрагментов ABFB-1, обладающих теми же каталитическими свойствами.
Для активности ферментов ABFB, соответствующих настоящему изобретению, предпочтительно свойственна повышенная оптимальная температура.
Другим преимуществом настоящего изобретения является то, что экспрессия ABFB-1 у Penicillium funiculosum естественным образом оказывается сильно индуцированной в условиях индукции целлюлолитических и гемицеллюлолитических ферментов (культуральная среда промышленного типа для производства целлюлолитических и гемицеллюлолитических ферментов).
Ферменты, соответствующие настоящему изобретению, имеют и другие промышленные и агропромышленные области применения. Отметим, в частности, обработку фруктовых соков, производство бумаги, производство топлив или химических продуктов из гемицеллюлоидных биомасс, производство алкогольных продуктов сбраживанием.
Описание последовательностей
SEQ ID No. 1: Геномная последовательность гена abfB-1 Penicillium funiculosum.
SEQ ID No. 2: Аминокислотная последовательность полипептида ABFB-1 Penicillium funiculosum, обладающего  -L-арабинофуранозидазной активностью типа В. -L-арабинофуранозидазной активностью типа В.
SEQ ID No. 3: Праймер XbaI-abfB.
SEQ ID No. 4: Праймер HindIII-abfB.
Описание изобретения
Настоящее изобретение относится к полипептиду, пригодному к применению в питании животных, представляющему собою полипептид, выбираемый из следующих полипептидов:
– полипептид SEQ ID No. 2,
– полипептид, аминокислотная последовательность которого находится между положениями 28 и 507 SEQ ID No. 2,
– фрагмент полипептида SEQ ID No. 2, обладающий  -L-арабинофуранозидазной активностью типа В, -L-арабинофуранозидазной активностью типа В,
– полипептид, обладающий  -L-арабинофуранозидазной активностью типа В и являющийся идентичным полипептиду SEQ ID No. 2, по меньшей мере, на 90%. -L-арабинофуранозидазной активностью типа В и являющийся идентичным полипептиду SEQ ID No. 2, по меньшей мере, на 90%.
Настоящее изобретение также относится к полинуклеотиду, кодирующему  -L-арабинофуранозидазу типа В, выбираемую из числа следующих полинуклеотидов: -L-арабинофуранозидазу типа В, выбираемую из числа следующих полинуклеотидов:
– полинуклеотид, нуклеотидная последовательность которого находится между положениями 845 и 2368 SEQ ID No. 1,
– полинуклеотид, нуклеотидная последовательность которого находится между положениями 927 и 2368 SEQ ID No. 1,
– полинуклеотид, кодирующий такой полипептид, как определено выше.
Другим объектом настоящего изобретения является полинуклеотид, имеющий последовательность, представленную SEQ ID No. 1, или последовательностью, комплементарную SEQ ID No. 1.
Настоящее изобретение относится также к экспрессионным кассетам, в которых в направлении транскрипции расположены:
– промотор, способный функционировать в организме хозяина;
– полинуклеотид по настоящему изобретению и
– последовательность, терминирующая транскрипцию, способная функционировать в организме хозяина.
Другим объектом настоящего изобретения является вектор, содержащий полинуклеотид по настоящему изобретению и/или экспрессионную кассету по настоящему изобретению.
Настоящее изобретение относится также к организму-хозяину, трансформированному полинуклеотидом по настоящему изобретению, экспрессионной кассетой по настоящему изобретению и/или вектором по настоящему изобретению.
В одном из воплощений настоящего изобретения организм-хозяин выбирают из дрожжей и нитчатых грибов.
Предпочтительно организмом-хозяином является штамм Penicillium funiculosum.
Настоящее изобретение также относится к кормовой добавке для животных, содержащей полипептид по настоящему изобретению, организм-хозяин по настоящему изобретению или ферментационное сусло из организма-хозяина, соответствующего настоящему изобретению.
Предпочтительно эта кормовая добавка представлена в виде жидкости или в виде порошка.
Другим аспектом настоящего изобретения является корм для животных, включающий в себя питательную основу для животных и кормовую добавку для животных по настоящему изобретению.
Настоящее изобретение относится также к применению полипептида ABFB по настоящему изобретению или организма-хозяина по настоящему изобретению для производства кормовой добавки для животных или корма для животных.
Другим объектом настоящего изобретения является применение полипептида ABFB по настоящему изобретению или организма-хозяина по настоящему изобретению для гидролиза  -L-арабинофуранозильных связей в арабинофуранозилолигосахаридах. -L-арабинофуранозильных связей в арабинофуранозилолигосахаридах.
Полипептиды
Таким образом, настоящее изобретение относится к полипептидам ABFB, обладающим  -L-арабинофуранозильной активностью типа В. Предпочтительно эти полипептиды выделяются из Penicillium funiculosum. -L-арабинофуранозильной активностью типа В. Предпочтительно эти полипептиды выделяются из Penicillium funiculosum.
Под “ -L-арабинофуранозидазой В” понимаются -L-арабинофуранозидазой В” понимаются  -L-арабинофуранозидазы (ЕС 3.2.1.55) типа В (GH 54), которые катализируют гидролиз связей -L-арабинофуранозидазы (ЕС 3.2.1.55) типа В (GH 54), которые катализируют гидролиз связей  -1,5; -1,5;  -1,3 и -1,3 и  -1,2 боковых цепей, содержащихся в арабинофуранозилолигосахаридных соединениях. -1,2 боковых цепей, содержащихся в арабинофуранозилолигосахаридных соединениях.
 -L-арабинофуранозидаза В штамма IMI378536 Penicillium funiculosum представлена последовательностью SEQ ID No. 2. -L-арабинофуранозидаза В штамма IMI378536 Penicillium funiculosum представлена последовательностью SEQ ID No. 2.
Под “полипептидом, пригодным для применения в питании животных” понимается полипептид, свойства которого таковы, что он подходит для питания животных. Характеристиками, существенными для применения в питании животных, в частности, являются рН и температура, при которых тот или иной фермент активен. В действительности, рН в пищеварительной системе животных является кислым, и, следовательно, важно, чтобы фермент оставался активным при таком рН, для сохранения его активности в отношении гидролиза по остаткам L-арабинозы. Кроме того, применение в кормовой добавке или в корме для животных подразумевает обработку добавки или корма в процессе приготовления, в частности, при температуре выше температуры окружающей среды. Активность используемых при этом ферментов должна быть устойчива к условиям обработки, в частности, к соответствующим температурным условиям.
В соответствии с одним из воплощений настоящего изобретения полипептид проявляет  -L-арабинофуранозидазную активность по типу В при кислом рН, например меньше 5, предпочтительно меньше 4. Кроме того, в соответствии с одним из воплощений настоящего изобретения, оптимум -L-арабинофуранозидазную активность по типу В при кислом рН, например меньше 5, предпочтительно меньше 4. Кроме того, в соответствии с одним из воплощений настоящего изобретения, оптимум  -L-арабинофуранозидазной активности типа В у рассматриваемого полипептида лежит в области рН от 2 до 3,5. -L-арабинофуранозидазной активности типа В у рассматриваемого полипептида лежит в области рН от 2 до 3,5.
В соответствии с предпочтительным воплощением настоящего изобретения, рассматриваемый полипептид проявляет  -L-арабинофуранозидазную активность по типу В при температурах, превышающих температуру окружающей среды. Предпочтительно температурный оптимум -L-арабинофуранозидазную активность по типу В при температурах, превышающих температуру окружающей среды. Предпочтительно температурный оптимум  -L-арабинофуранозидазной активности типа В для полипептида по настоящему изобретению лежит в области от 40°С до 70°С, более предпочтительно от 50 до 65°С. -L-арабинофуранозидазной активности типа В для полипептида по настоящему изобретению лежит в области от 40°С до 70°С, более предпочтительно от 50 до 65°С.
В соответствии с предпочтительным воплощением настоящего изобретения полипептиды по настоящему изобретению являются гликозилированными. Полипептид, соответствующий SEQ ID No. 2, в частности, несет участки N-гликозилирования по аминокислотному остатку 92 и аминокислотному остатку 376. В соответствии с предпочтительным воплощением, остатки аспарагина в положениях 92 и 376 в составе полипептида, соответствующего SEQ ID No. 2, являются гикозилированными.
 -L-арабинофуранозидаза В Penicillium funiculosum представляет собой фермент, секретируемый грибком во внеклеточную среду. Поэтому полипептид SEQ ID No. 2 содержит сигнальный полипептид из 27 аминокислотных остатков. Предметом настоящего изобретения является и зрелый полипептид, образующийся после отщепления сигнального полипептида. В частности, настоящее изобретение относится к полипептиду, аминокислотная последовательность которого находиться между положением 28 и положением 507 SEQ ID No. 2. -L-арабинофуранозидаза В Penicillium funiculosum представляет собой фермент, секретируемый грибком во внеклеточную среду. Поэтому полипептид SEQ ID No. 2 содержит сигнальный полипептид из 27 аминокислотных остатков. Предметом настоящего изобретения является и зрелый полипептид, образующийся после отщепления сигнального полипептида. В частности, настоящее изобретение относится к полипептиду, аминокислотная последовательность которого находиться между положением 28 и положением 507 SEQ ID No. 2.
В соответствии с другим воплощением, сигнальный пептид полипептида SEQ ID No. 2 может быть заменен гетерологичным сигнальным пептидом для экспрессии и секреции полипептида SEQ ID No. 2 чужеродным организмом-хозяином.
Настоящее изобретение также относится к фрагментам полипептида SEQ ID No. 2, имеющим  -L-арабинофуранозидазную активность типа В. -L-арабинофуранозидазную активность типа В.
Термин “фрагмент” полипептида обозначает полипептид, включающий в себя часть полипептида, производным которого является, но не весь последний целиком. Настоящее изобретение, таким образом, относится к полипептиду, содержащему фрагмент полипептида SEQ ID No. 2 длиной 100, 200, 300, 400 или 500 аминокислотных остатков.
Такой фрагмент полипептида SEQ ID No. 2 сохраняет его  -L-арабинофуранозидазную активность типа В. Таким образом, настоящее изобретение относится к биологически активным фрагментам полипептида SEQ ID No. 2. Термин “биологически активный фрагмент” обозначает фрагмент полипептида, сохраняющий функцию полипептида, от которого он происходит. Биологически активные фрагменты полипептида SEQ ID No. 2, таким образом, сохраняют функцию полипептида ABFB-1 Penicillium funiculosum. Эти биологически активные фрагменты обладают -L-арабинофуранозидазную активность типа В. Таким образом, настоящее изобретение относится к биологически активным фрагментам полипептида SEQ ID No. 2. Термин “биологически активный фрагмент” обозначает фрагмент полипептида, сохраняющий функцию полипептида, от которого он происходит. Биологически активные фрагменты полипептида SEQ ID No. 2, таким образом, сохраняют функцию полипептида ABFB-1 Penicillium funiculosum. Эти биологически активные фрагменты обладают  -L-арабинофуранозидазной активностью типа В. -L-арабинофуранозидазной активностью типа В.
Способы получения фрагментов полипептида, а также методики измерения  -L-арабинофуранозидазной активности типа В хорошо известны специалистам. -L-арабинофуранозидазной активности типа В хорошо известны специалистам.
Объектом настоящего изобретения также являются полипептиды, проявляющие  -L-арабинофуранозидазную активность типа В и обладающие, по меньшей мере, 90%-ной идентичностью полипептиду SEQ ID No. 2. Предпочтительно эти полипептиды обладают теми же свойствами и, в частности, теми же каталитическими свойствами, что и полипептиды SEQ ID No. 2. Предпочтительно такие полипептиды выделяются из других штаммов Penicillium funiculosum или других нитчатых грибов. В другом случае такие полипептиды могут быть получены, например, способами направленного мутагенеза. -L-арабинофуранозидазную активность типа В и обладающие, по меньшей мере, 90%-ной идентичностью полипептиду SEQ ID No. 2. Предпочтительно эти полипептиды обладают теми же свойствами и, в частности, теми же каталитическими свойствами, что и полипептиды SEQ ID No. 2. Предпочтительно такие полипептиды выделяются из других штаммов Penicillium funiculosum или других нитчатых грибов. В другом случае такие полипептиды могут быть получены, например, способами направленного мутагенеза.
Объектом настоящего изобретения являются полипептиды, имеющие, по меньшей мере, 90%, 95%, 98%, предпочтительно, по меньшей мере, 99% аминокислотных остатков, идентичных соответствующим аминокислотным остаткам полипептида SEQ ID No. 2.
Под идентичными аминокислотными остатками понимаются аминокислотные остатки, неизменные в двух последовательностях. Эти полипептиды могут иметь делецию, вставку или замену, по меньшей мере, одного аминокислотного остатка по сравнению с полипептидом SEQ ID No. 2.
Объектом настоящего изобретения являются также полипептиды, обнаруживающие, по меньшей мере, 90%, 95%, 98%, предпочтительно, no меньшей мере, 99% сходства с полипептидом SEQ ID No. 2.
Под сходством понимается мера схожести между полипептидными или полинуклеотидными последовательностями. Эти полипептиды могут иметь делецию, вставку или замену, по меньшей мере, одного аминокислотного остатка по сравнению с полипептидом SEQ ID No. 2. Уровень идентичности двух последовательностей, рассчитываемый по результатам подсчета, основывается на доле совпадений и/или консервативных замен в сравниваемых последовательностях.
Полипептиды по настоящему изобретению выделяют или очищают из естественной для них среды. Способы получения полипептидов могут быть различны. Такими способами, в частности, являются очистка из природных источников, таких как клетки, естественно экспрессирующие упомянутые полипептиды; выработка рекомбинантных полипептидов подходящими клетками-хозяевами с последующей очисткой; производство при помощи химического синтеза или, наконец, сочетание этих различных подходов. Указанные различные способы получения хорошо знакомы специалистам. Так, полипептиды ABFB по настоящему изобретению могут быть выделены из Penicillium funiculosum. В другом воплощении полипептиды ABFB по настоящему изобретению выделяют из рекомбинантных организмов-хозяев, экспрессирующих полипептид АВFВ по настоящему изобретению.
Объектом настоящего изобретения являются также слитые белки, рекомбинантные белки или химерные белки, включающие в себя полипептиды по настоящему изобретению. Термин “полипептид” обозначает как белки, так и модифицированные полипептиды.
Полипептиды по настоящему изобретению обладают активностью ABFB и предпочтительно сохраняют каталитические свойства фермента ABFB-1 Penicillium funiculosum. В частности, оптимум активности таких полипептидов имеет место при 60°С и рН 3,4.
Полинуклеотиды
Настоящее изобретение относится также к полинуклеотидам, кодирующим  -L-арабинофуранозидазную активность типа В. Предпочтительно эти полинуклеотиды кодируют -L-арабинофуранозидазную активность типа В. Предпочтительно эти полинуклеотиды кодируют  -L-арабинофуранозидазу В Penicillium funiculosum. -L-арабинофуранозидазу В Penicillium funiculosum.
В соответствии с настоящим изобретением под “полинуклеотидом” понимается однонитевая нуклеотидная цепь или комплементарная ей цепь, которые могут представлять собою ДНК или РНК, либо двунитевая нуклеотидная цепь, которая может представлять собою комплементарную или геномную ДНК. Предпочтительно полинуклеотиды по настоящему изобретению представляют собою ДНК, в особенности двунитевую ДНК. Термин “полинуклеотид” обозначает также модифицированные полинуклеотиды.
Полинуклеотиды по настоящему изобретению выделяют или очищают из естественной для них среды. Предпочтительно полинуклеотиды по настоящему изобретению могут быть получены обычными для молекулярной биологии способами, такими как описано в книге Sambrook et al. Molecular Cloning: A Labratory Manual, 1989, или при помощи химического синтеза.
В соответствии с первым воплощением настоящее изобретение относится к полинуклеотиду, последовательность которого находиться между положением 845 и положением 2368 SEQ ID No.1. Этот полинуклеотид кодирует фермент ABFB-1 Penlcillium funiculosum (SEQ ID No. 2).
В соответствии с другим воплощением настоящее изобретение относится к полинуклеотиду, последовательность которого находится между положением 927 и положением 2368 SEQ ID No.1. Этот полинуклеотид кодирует зрелый полипептид ABFB Penicillium funiculosum после отщепления сигнального пептида.
Настоящее изобретение относится также к полинуклеотидам, обнаруживающим, по меньшей мере, 70%, 75%, 80%, 85%, 90%, 95%, 98%, предпочтительно, по меньшей мере, 99% идентичности с полинуклеотидом, последовательность которого находиться между положением 845 и положением 2368 SEQ ID No.1, и/или с полинуклеотидом, последовательность которого находиться между положением 927 и положением 2368 SEQ ID No. 1. Эти полинуклеотиды кодируют полипептиды с  -L-арабинофуранозидазной активностью типа В. Предпочтительно эти полинуклеотиды кодируют -L-арабинофуранозидазной активностью типа В. Предпочтительно эти полинуклеотиды кодируют  -L-арабинофуранозидазу В Penicillium funiculosum. -L-арабинофуранозидазу В Penicillium funiculosum.
Под идентичными нуклеотидами понимаются нуклеотиды, неизменные в двух последовательностях. Эти полинуклеотиды могут иметь делецию, вставку или замену, по меньшей мере, одного нуклеотида по сравнению с исходным полинуклеотидом.
Объектом настоящего изобретения являются также полипептиды, обнаруживающие, по меньшей мере, 70%, 75%, 80%, 85%, 90%, 95%, 98% предпочтительно, по меньшей мере, 99% сходства с полинуклеотидом, последовательность которого находиться между положением 845 и положением 2368 SEQ ID No.1, и/или с полинуклеотидом, последовательность которого находиться между положением 927 и положением 2368 SEQ ID No.1. Эти полинуклеотиды кодируют полипептиды с  -L-арабинофуранозидазной активностью типа В. Предпочтительно, эти полинуклеотиды кодируют -L-арабинофуранозидазной активностью типа В. Предпочтительно, эти полинуклеотиды кодируют  -L-арабинофуранозидазу В Penicillium funiculosum. -L-арабинофуранозидазу В Penicillium funiculosum.
Под сходством понимается мера схожести между полипептидными или полинуклеотидными последовательностями. Эти полинуклеотиды могут иметь делецию, вставку или замену, по меньшей мере, одного аминокислотного остатка по сравнении с исходным полинуклеотидом. Уровень сходства двух последовательностей, рассчитываемый по результатам подсчета, основывается на доле совпадений и/или консервативных замен в выравниваемых последовательностях.
Предпочтительно полинуклеотиды, обнаруживающие сходство с исходным полинуклеотидом, сохраняют функцию исходной последовательности. В данном случае полинуклеотиды кодируют полипептиды с  -L-арабинофуранозидазной активностью типа В. -L-арабинофуранозидазной активностью типа В.
Настоящее изобретение относится и к полинуклеотидам, способным гибридизоваться избирательным образом с полинуклеотидом, последовательность которого находится между положением 845 и положением 2368 SEQ ID No.1, и/или с полинуклеотидом, последовательность которого находится между положением 927 и положением 2368 SEQ ID No.1. Предпочтительно избирательная гибридизация осуществляется в условиях средней жесткости, более предпочтительно в очень жестких условиях. Эти полинуклеотиды кодируют полипептиды с  -L-арабинофуранозидазной активностью типа В. Предпочтительно эти полинуклеотиды кодируют -L-арабинофуранозидазной активностью типа В. Предпочтительно эти полинуклеотиды кодируют  -L-арабинофуранозидазу В Penicillium funiculosum. -L-арабинофуранозидазу В Penicillium funiculosum.
Под “последовательностями, способными гибридизоваться избирательным образом” в соответствии с настоящим изобретением понимаются последовательности, которые гибридизуются с исходной последовательностью с уровнем гибридизации, значительно превышающим фоновый. Уровень сигнала от взаимодействия последовательности, способной гибридизоваться избирательным образом, с исходными последовательностями, обычно в 10 раз, предпочтительно в 100 раз, более интенсивен, нежели сигнал от взаимодействия других последовательностей ДНК, обуславливающего фоновый шум. Жесткие условия гибридизации, способствующие избирательной гибридизации, хорошо известны специалистам. Обычно температура гибридизации и отмывки, по меньшей мере, на 5°С ниже, чем точка плавления исходной последовательности при данной величине рН и для данной ионной силы. В типичном случае температура гибридизации составляет, по меньшей мере, 30°С для полинуклеотида длиной от 15 до 50 оснований и, по меньшей мере, 60°С для полинуклеотида длиннее 50-ти оснований. Гибридизация осуществляется, например, в буфере следующего состава: 6Х SSC, 50 мМ Трис-НСl (рН 7.5), 1 мМ ЭДТА, 0,02% поливинилпирролидона, 0,02% Ficoll, 0,02% БСА, 500 мкг/мл денатурированной ДНК из молок лосося. Отмывка осуществляется, например, последовательно в мягких условиях (в буфере 2Х SSC, 0,1% SDS), в условиях средней жесткости (в буфере 0,5Х SSC, 0,1% SDS) и в жестких условиях (в буфере 0,1Х SSC, 0,1% SDS). Разумеется, гибридизация может осуществляться и другими обычными способами, хорошо известными специалистам (см., напр., Sambrook et al., Molecular Cloning: A Labratory Manual, 1989). Предпочтительно полинуклеотиды, гибридизующиеся избирательным образом с исходной полинуклеотидной последовательностью, сохраняют функцию исходной последовательности. В данном случае полинуклеотиды, гибридизующиеся избирательным образом с полинуклеотидом, последовательность которого находится между положением 845 и положением 2368 SEQ ID No.1, и/или с полинуклеотидом, последовательность которого находится между положением 927 и положением 2368 SEQ ID No.1, кодируют полипептиды с  -L-арабинофуранозидазной активностью типа В. -L-арабинофуранозидазной активностью типа В.
В целом, настоящее изобретение относится к полинуклеотидам, кодирующим полипептиды по изобретению. Ввиду вырожденности генетического кода различные полинуклеотиды могут кодировать один и тот же полипептид.
Другим объектом настоящего изобретения является полинуклеотнид, последовательность которого соответствует SEQ ID No.1. Полинуклеотид SEQ ID No.1 включает в себя последовательности, фланкирующие открытую рамку считывания гена abfB-1 Penicillium funiculosum. Речь, в частности, идет о промоторных и терминирующих последовательностях гена abfB-1. Ген abfB можно экспрессировать при помощи этих гомологичных регуляторных последовательностей, вызывающих сверхэкспрессию, в частности, у Penicillium funiculosum или у других нитчатых грибов.
В соответствии с другим воплощением настоящего изобретения ген abfB может быть экспрессирован в различных организмах-хозяевах, таких, например, как бактерии, дрожжи и грибы. Ген abfB может быть экспрессирован в организме-хозяине под контролем промотора из SEQ ID No.1 настоящего изобретения либо под контролем гетерологичного промотора.
Экспрессионные кассеты
В одном из воплощений настоящего изобретения полинуклеотид, кодирующий полипептид по настоящему изобретению, вводится в состав экспрессионной кассеты при помощи способов клонирования, хорошо знакомых специалистам. Эта экспрессионная кассета включает в себя элементы, необходимые для транскрипции и трансляции последовательностей, кодирующих полипептиды по настоящему изобретению.
Такая экспрессионная кассета выгодно отличается тем, что одновременно включает в себя элементы, способствующие выработке полипептида клеткой-хозяином, и элементы, необходимые для регуляции этой экспрессии.
Такие экспрессионные кассеты включают в себя в направлении транскрипции:
– промотор, способный функционировать в организме хозяина;
– полинуклеотид по настоящему изобретению;
– терминирующую последовательность, способную функционировать в организме хозяина.
В экспрессионных кассетах по настоящему изобретению могут использоваться промоторные последовательности любого типа. Выбор промотора будет зависеть, в частности, от организма-хозяина, выбранного для экспрессии гена, представляющего интерес. Одни промоторы обеспечивают конститутивную экспрессию, тогда как другие промоторы, наоборот, индуцибельны. Среди промоторов, способных функционировать в грибах, отметим, в частности, промотор глицеральдегид-3-фосфатдегидрогеназы Aspergillus nidulans (Roberts et al., Current. Genet. 15:177-180, 1989). Среди промоторов, способных функционировать в бактериях, отметим, в частности, промотор РНК-полимеразы бактериофага Т7 (Studier et al., Methods in enzymology 185:60-89, 1990). Среди промоторов, способных функционировать в дрожах, отметим, в частности, промотор гена GAL1 (Elledge et al., Proc Natl Acad Sciences, USA. 88:1731-1735, 1991) или промоторы GAL4 и ADH S.cerevisiae. Все эти промоторы описаны в литературе и хорошо известны специалистам.
Для экспрессии в Penicillium funiculosum можно выбрать, например, экспрессионные кассеты, содержащие промотор гена гистона Н4 В, промотор кислой аспартилпротеазы или промотор csl13 (WO 00/68401).
В соответствии с настоящим изобретением экспрессионные кассеты могут дополнительно включать в себя любую другую последовательность, необходимую для экспрессии полипептидов или полинуклеотидов, такую, например, как регулирующие последовательности или сигнальные последовательности, позволяющие полипептидам, выработанным в организме-хозяине, секретироваться. В частности, можно использовать любую регулирующую последовательность, позволяющую повысить уровень экспрессии кодирующей последовательности, включенную в состав экспрессионной кассеты. В соответствии с настоящим изобретением можно, в частности, использовать в сочетании с промоторной последовательностью и другие регулирующие последовательности, располагающиеся между промотором и кодирующей последовательностью, такие как активаторы транскрипции (“энхансеры”).
В экспрессионных кассеты по настоящему изобретению может найти применение большое разнообразие терминирующих последовательностей, обеспечивающих завершение транскрипции и полиаденилирование мРНК. При этом может использоваться любая терминирующая последовательность, способная функционировать в выбранном организме-хозяине.
Для экспрессии в Penicillium funiculosum можно выбрать, например, экспрессионные кассеты, включающие в себя терминатор гистона Н4 В, терминатор кислой аспартилпротеазы или терминатор csl13 (WO 00/68401).
Преметом настоящего изобретения является также полинуклеотид, включающий в себя экспрессионную кассету по настоящему изобретению. Предпочтительно экспрессионные кассеты по настоящему изобретению включают в состав какого-либо вектора.
Векторы
Таким образом, настоящее изобретение касается и векторов репликации или экспрессии для трансформации организма-хозяина. Такой вектор содержит, по меньшей мере, один полинуклеотид или одну экспрессионную кассету по настоящему изобретению. Такой вектор, в частности, может соответствовать плазмиде, космиде, бактериофагу или вирусу, в состав которых введен полинуклеотид или экспрессионая кассета по настоящему изобретению. Способы создания таких векторов и введения в них полинуклеотидов хорошо известны специалистам. Говоря в общем, можно использовать любой вектор, способный к самоподдержанию, саморепликации или самораспространению в клетке-хозяине для обеспечения, в частности, экспрессии полинуклеотида или полипептида. Специалист сможет выбрать подходящие векторы в зависимости от организма-хозяина, подлежащего трансформации и в зависимости от применяемой техники трансформации.
Векторы по настоящему изобретению используются, в частности, для трансформации организма-хозяина с целью репликации вектора и/или экспрессии полипептида по настоящему изобретению в организме-хозяине.
Настоящее изобретение касается также способа получения полипептида по настоящему изобретению, включающего в себя следующие этапы:
– трансформация организма-хозяина экспрессионным вектором, содержащим экспрессионную кассету по настоящему изобретению, и/или полинуклеотидом по настоящему изобретению;
– выделение полипептидов, выработанных организмом-хозяином.
Организмы-хозяева
Объектом настоящего изобретения также является способ трансформации организма-хозяина посредством введения в названный организм-хозяин, по меньшей мере, одного полинуклеотида или одной экспрессионной кассеты или одного вектора по настоящему изобретению. Полинуклеотид может быть встроен в геном организма-хозяина или реплицироваться устойчивым образом в организме-хозяине. Способы трансформации организмов-хозяев хорошо известны специалистам и широко описаны в литературе.
Настоящее изобретение касается также организма-хозяина, трансформированного полинуклеотидом, экспрессионной кассетой или вектором по настоящему изобретению. В частном случае настоящего изобретения под организмом-хозяином понимается любой одно- или многоклеточный организм, низший или высший, в частности, выбираемый среди бактерий, дрожжей и грибов. Под организмом-хозяином понимается организм, отличный от человеческого. Дрожжи предпочтительно выбираются из числа Pichia pastoris, Saccharomyces cerevisae, Yarrow/a lipolytica и Schwanniomyces occidentalis. Грибы выбираются среди Aspergillus и Penicillium, предпочтительно среди Penicilliuin funiculosum, Trichoderma reesei, Aspergillus niger, Aspergillus awamori, Aspergillus kawachii и Trichoderma koningii. В предпочтительном воплощении организмом-хозяином является штамм Penicillium funiculosum, в котором экспрессируется или сверхэкспрессируется полипептид ABFB по настоящему изобретению.
Способы создания векторов, трансформации организмов-хозяев и экспрессии чужеродных белков в этих организмах широко описаны в литературе (Ausubel F.M. et al., Current Protocols in Molecular Biology Vol.1 и 2, Greene Publishing Associates et Wiley – Interscience, 1989; T.Maniatis, E.F.Fritsch, J.Sambrook, Molecular Cloning A laboratory Handbook, 1982).
Кормовые добавки и корма для животных
Настоящее изобретение касается также кормовых добавок, привносящих  -L-арабинофуранозидазную активность типа В. Привнесение ферментативной активности такого типа позволяет улучшить перевариваемость корма и повысить его питательную ценность. -L-арабинофуранозидазную активность типа В. Привнесение ферментативной активности такого типа позволяет улучшить перевариваемость корма и повысить его питательную ценность.
Под кормовой добавкой понимается вещество, намеренно добавляемое к корму, обычно в незначительных количествах, для улучшения питательных свойств или перевариваемости корма. Кормовые добавки для животных могут, в частности, содержать витамины, минеральные соли, аминокислоты и ферменты.
В типичном случае в соответствии с настоящим изобретением кормовые добавки для животных содержат полипептид по настоящему изобретению, организм-хозяин по настоящему изобретению или ферментационное сусло из организма-хозяина по настоящему изобретению. Так, полипептиды, обладающие  -L-арабинофуранозидазной активностью типа В, по настоящему изобретению могут быть очищены или выделены из штамма Penicillium funiculosum или из рекомбинантного организма-хозяина для производства кормовой добавки для животных. В другом варианте штамм Penicillium funiculosum или организм-хозяин, вырабатывающий полипептиды AbfB, могут быть использованы напрямую для производства кормовой добавки для животных. В соответствии с предпочтительным воплощением настоящего изобретения для производства кормовых добавок для животных применяются культуральная среда или ферментационное сусло из Penicillium funiculosum или организма-хозяина по настоящему изобретению. Это воплощение особенно предпочтительно, когда полипептиды ABFB секретируются штаммом Penicillium funiculosum или организмом-хозяином. Обычно культуральная надосадочная жидкость для производства кормовой добавки выпаривается или лиофилизуется. -L-арабинофуранозидазной активностью типа В, по настоящему изобретению могут быть очищены или выделены из штамма Penicillium funiculosum или из рекомбинантного организма-хозяина для производства кормовой добавки для животных. В другом варианте штамм Penicillium funiculosum или организм-хозяин, вырабатывающий полипептиды AbfB, могут быть использованы напрямую для производства кормовой добавки для животных. В соответствии с предпочтительным воплощением настоящего изобретения для производства кормовых добавок для животных применяются культуральная среда или ферментационное сусло из Penicillium funiculosum или организма-хозяина по настоящему изобретению. Это воплощение особенно предпочтительно, когда полипептиды ABFB секретируются штаммом Penicillium funiculosum или организмом-хозяином. Обычно культуральная надосадочная жидкость для производства кормовой добавки выпаривается или лиофилизуется.
Таким образом, настоящее изобретение касается способа получения фермента ABFB, включающего следующие этапы:
а) культивирование штамма Penicillium funiculosum или организма-хозяина, трансформированного в соответствии с настоящим изобретением, в условиях индукции экспрессии ABFB,
б) отделение культуральной среды, содержащей фермент ABFB.
Такая культуральная среда или ферментационное сусло могут затем повергнуться выпариванию или лиофилизации для приготовления кормовой добавки или корма для животных.
Если организм-хозяин не секретирует фермент ABFB в культуральную среду, может оказаться необходимым дополнительный этап разрушения клеток и очистки клеточного экстракта.
Кормовые добавки по настоящему изобретению содержат  -L-арабинофуранозидазную активность типа В, но могут содержать и другие питательные вещества, такие как витамины, аминокислоты или минеральные соли. -L-арабинофуранозидазную активность типа В, но могут содержать и другие питательные вещества, такие как витамины, аминокислоты или минеральные соли.
Добавки по настоящему изобретению повышают перевариваемость кормов, внося, таким образом, свой вклад в повышение питательной ценности диет, в частности, на основе злаков (пшеница, ячмень, кукуруза, овес, рожь и т.п.) и масличных жмыхов (соя, подсолнечник, рапс и т.п.).
Настоящее изобретение также касается кормов для животных, содержащих питательную основу и кормовую добавку по настоящему изобретению. Эти корма обычно представлены в виде муки или гранул, в состав которых включены добавки по настоящему изобретению.
Под кормом понимается все то, что может служить для питания животных.
Корма для животных включают в себя полипептид по настоящему изобретению, организм-хозяин по настоящему изобретению или ферментационное сусло из организма-хозяина по настоящему изобретению.
Для интенсивного выращивания животных эти корма содержат обычно питательную основу и кормовые добавки.
Под питательной основой понимается то, что составляет сущность питательного рациона животного и состоит, например, из смеси злаков, белков и жиров растительного и/или животного происхождения.
Питательные основы для животных приспособлены для этих животных и хорошо знакомы специалистам. Обычно такие питательные основы включают в себя, например, кукурузу, пшеницу, горох и сою. Такие питательные основы приспособлены к потребностям различных видов животных, для которых они предназначаются. Эти питательные основы могут уже содержать кормовые добавки, такие как витамины, минеральные соли и аминокислоты.
В соответствии с предпочтительным воплощением настоящее изобретение касается кормов для животных с однокамерным желудком, в частности для домашней птицы и свиней. Домашняя птица, в частности, включает в себя кур-несушек, мясных цыплят, индеек и уток. Свиньи включают в себя, в частности, свиней на откорм, а также поросят.
Описание графических материалов
Фиг.1. Определение оптимального рН для фермента ABFB-1 в серии буферов Мак-Илвейна (рН от 2,2 до 8) при 40°С в присутствии 5 мМ PNPAF.
Фиг.2. Определение оптимальной температуры для фермента ABFB-1 при оптимальном рН в присутствии 5 мМ PNPAF.
Фиг.3. Определение кинетических постоянных Km и Vm (1/Vi=f(1/S)) ABFB-1 для спектра концентраций PNPAF от 0,5 мМ до 5 мМ при рН 3,4 и температуре 60°С
Фиг.4. Относительные количественные величины дифференциальной экспрессии генов abfBA и abfB-1 в зависимости от условий роста Р. funiculosum.
Примеры
Количественное определение активности L-арабинофуранозидазы В
L-арабинофуранозидазная активность измерялась в культуре Р. funiculosum в среде М2 с добавлением смеси, состоящей из 0,15% Provasoy и 0,3% целлюлозы, через 40 часов. Отбор проб осуществлялся через 48 и 72 часа культивирования. Культивирование осуществляли в колбе Эрлена на 200 мл в полезном объеме 50 мл. Активность определялась посредством гидролиза 5 мМ пара-нитрофенил- -L-арабинофуранозида (PNPAF) в буфере 50 мМ ацетата натрия рН 5. Для этого 50 мкл культуральной надосадочной жидкости выдерживали с 250 мкл субстрата, предварительно нагретого до 50°С в течение 15 мин. Реакцию останавливали добавлением 500 мкл 0,5 М NaOH. Высвобождение п-нитрофенила (PNP) измеряли при 405 нм с коэффициентом молярного поглощения 17000 М-1·см-1. Единица ферментативной активности определялась как количество фермента, гидролизующее 1 мкмоль PNPAF в минуту в вышеописанных условиях. Для культуры Р. funiculosum мы получили величины 20 мЕд·мл-1 через 48 часов культивирования и 112 мЕд·мл-1 через 72 часа культивирования. Полученные результаты согласуются с литературой. Так, для Aspergillus niger были получены величины порядка от 100 до 500 мЕд·мл-1 при добавлении в культуру индуктора. -L-арабинофуранозида (PNPAF) в буфере 50 мМ ацетата натрия рН 5. Для этого 50 мкл культуральной надосадочной жидкости выдерживали с 250 мкл субстрата, предварительно нагретого до 50°С в течение 15 мин. Реакцию останавливали добавлением 500 мкл 0,5 М NaOH. Высвобождение п-нитрофенила (PNP) измеряли при 405 нм с коэффициентом молярного поглощения 17000 М-1·см-1. Единица ферментативной активности определялась как количество фермента, гидролизующее 1 мкмоль PNPAF в минуту в вышеописанных условиях. Для культуры Р. funiculosum мы получили величины 20 мЕд·мл-1 через 48 часов культивирования и 112 мЕд·мл-1 через 72 часа культивирования. Полученные результаты согласуются с литературой. Так, для Aspergillus niger были получены величины порядка от 100 до 500 мЕд·мл-1 при добавлении в культуру индуктора.
Клонирование открытой рамки считывания abfB P. funiculosum в Saccharomyces cerevisiae
Исходя из геномной ДНК Р. funiculosum, посредством ПЦР был амплифицирован ген abfB с использованием пары праймеров (Hind III-abfB/Xba I-abfB) в следующих условиях (94°С 30 с; 62°С 30 с.; 1 мин 30 с при 72°С), 30 циклов. Продукт ПЦР был клонирован в коммерческом векторе pGEM-T(tm) easy.
Последовательность пары праймеров для ПЦР:
Xba I-abfB-1:>5′-ТЦТАГААТГТТТЦЦААГААТААААЦЦАГ-3′<
Hind III-abfB-1:>5′-ААГЦТТТЦАТГЦАААГГЦАГТЦТ-3′<
Фрагмент Hind III/Xba I в 1534 п.н. был вырезан из вектора pGEM-T и субклонирован в участках Hind III/Xba I в векторе-челноке pJL 52 (pladSS-PGK/CYCI). Для гетерологичной экспрессии ген abfB находится, таким образом, под контролем конститутивного промотора гена фосфоглицераткиназы (S. cerevisiae) и терминатора CYC1 (S. cerevisiae) гена цитохром С-оксидазы. Полученная экспрессионная кассета получила название рОТ-01.
Штамм S.cerevisiae JF #1194 (CEN.PK113-5D) – клон, происходящий от штамма CEN.PK 122 с ауксотрофией ura3-52, был трансформирован (способ с ацетатом лития/температурным шоком) экспрессионным вектором рОТ-01. Трансформированные штаммы были отобраны посредством фенотипического дополнения на селективных чашках без урацила (маркер URA3).
Для испытания на присутствие арабинофуранозидазной активности типа B в культуральной жидкости было отобрано шесть трансформированных штаммов. Трансформированные штаммы культивировали в течение суток в 50 мл среды YNB без урацила (кроме контрольного штамма дикого типа). Арабинофуранозидазную активность определяли в культуральной надосадочной жидкости способом, описанным в предыдущем параграфе.
Определение рН-оптимума
Ген abfB-1, кодирующий арабинофуранозидазную активность типа В из Р. funiculosum, был клонирован в S. cerevisiae. После проверки присутствия арабинофуранозидазной активности типа В нескольких трансформированных штаммах был выбран один из этих штаммов, и после суточного роста в культуральной среде была определена активность ABFB. Культивирование осуществляли в колбе Эрлена на 200 мл (полезный объем 50 мл). Активность определяли в присутствии 5 мМ п-нитрофенил- -L-арабинофуранозида (PNPAF) в серии буферов Мак-Илвейна (рН от 2,2 до 8,0). 80 мкл культуральной среды выдерживали 10 мин с 320 мкл субстрата, предварительно нагретого до 40°С. Реакцию останавливали добавлением 1 мл 1М Na2CO3. Уровень высвобождения п-нитрофенила измеряли при 405 нм. Единицу ферментативной активности определяли как количество фермента, способное гидролизовать 1 мкмоль PNPAF в минуту в условиях, определенных выше. Кривая активности приведена на Фиг.1. Для ABFB-1 максимум активности достигается при рН 3,4, а при рН 5 фермент сохраняет 65% своей активности. -L-арабинофуранозида (PNPAF) в серии буферов Мак-Илвейна (рН от 2,2 до 8,0). 80 мкл культуральной среды выдерживали 10 мин с 320 мкл субстрата, предварительно нагретого до 40°С. Реакцию останавливали добавлением 1 мл 1М Na2CO3. Уровень высвобождения п-нитрофенила измеряли при 405 нм. Единицу ферментативной активности определяли как количество фермента, способное гидролизовать 1 мкмоль PNPAF в минуту в условиях, определенных выше. Кривая активности приведена на Фиг.1. Для ABFB-1 максимум активности достигается при рН 3,4, а при рН 5 фермент сохраняет 65% своей активности.
Определение оптимальной температуры
В соответствии с тем же протоколом определяли температуру, оптимальную для активности ABFB-1. Фермент выдерживали 10 мин при каждом значении температуры в буфере Мак-Илвейна с рН 3,4. Кривая активности представлена на Фиг.2. ABFB-1 Р. funiculosum проявляет максимум активности при 60°С. Таким образом, ABFB-1 имеет температурный оптимум, превышающий температурные оптимумы ABFB, описанных прежде. При помещении ABFB-1 в оптимальные условия (рН 3,4, 60°С) отмечается в 4 раза более высокая активность ABFB-1, чем в ацетатном буфере с рН 5 при 40°С (424 мЕд по сравнению 102 мЕд).
Определение Km и Vm
Кинетические постоянные (Km и Vm) для ABFB-1 определяли по гидролизу PNPAF во времени в оптимальных условиях, определенных ранее.
Субстрат (PNPAF) использовали в различных фиксированных концентрациях от 0,5 до 5 мМ в буфере рН 3,4. Кинетику гидролиза отслеживали в течение 10 мин при 60°С. Результаты, обработанные способом двойных обратных величин (по Лайнвиверу-Берку), представлены на Фиг.3.
Величина Km для I’ABFB-1 составляет 1 мМ. По литературным данным, значения Km для ферментов этого типа варьируются от 0,05 до 1,2 мМ, в зависимости от рода и вида изучаемого грибка. Максимальная скорость гидролиза (Vm) для ABFB-1 составляет 521 моль PNPAF/моль фермента/мин в описанных выше условиях.
Определение молекулярной массы фермента ABFB-1
Для определения молекулярной массы фермента ABFB-1 культуральную среду после роста в ней, по меньшей мере, одного мутанта (S.cerevisiae) концентрировали в 200 раз, денатурировали кипячением при 100°С в течение 5 мин и наносили на полиакриламидный гель с ДДС-Na.
Было обнаружено, что в случае штамма дикого типа количество внеклеточных белков весьма незначительно. В случае же мутантов в культуральную среду секретируется фермент ABFB-1. Этот полипептид является мажорным по отношению к исходному уровню внеклеточных белков S.cerevisiae.
Определение молекулярной массы осуществлялось с помощью маркеров молекулярной массы SeeBlue (Invitrogen). Результаты приведены в таблице 1
| Таблица 1. |
| Молекулярная масса ABFB-1 в кДа |
 |
Предсказанная мол. масса |
Мол. масса, определенная в геле |
| ABFB-1 |
53 |
65 |
Мы сравнили молекулярную массу, предсказанную на основании алгоритма Vector Nti, и молекулярную массу, определенную по электрофоретической миграции в денатурирующем полиакриламидном геле с ДДС-Na. Обнаружение на геле размытой электрофоретической зоны (О- и N-гликозилирование) говорит о том, что фермент сильно гликозилирован. Такое гликозилирование происходит в ходе созревания белков в экспрессирующем их организме.
Анализ профиля экспрессии гена abfB-1 в Penicillium funiculosum
Penicillium funiculosum обладает двумя генами, кодирующими a-L-арабинофуранозидазу В: гены abfB-1 и abfB-2. Мы сравнили профили экспрессии этих генов в различных условиях культивирования Р. funiculosum.
Р. funiculosum культивировали в условиях и индукции целлюлолитических и гемицеллюлолитических ферментов (промышленная культуральная среда типа М2) и в условиях отсутствия такой индукции (минимальная глюкозная среда М0). По истечении 40 часов роста культивирование прекращали, мицелий отбирали и экстрагировали из него тотальную РНК. Количество и качество РНК оценивали измерением оптического поглощения при 260 и 280 нм (отношение 260/280>1,8). Уровень транскриптов, кодирующих арабинофуранозидазу В, количественно определяли для обоих условий выращивания (М0 и М2) посредством количественной ПЦР в реальном времени.
Ген, кодирующий тубулин (tub-1) P. funiculosum, использовали в качестве контроля для обоих условий выращивания. Этот ген кодирует структурный белок, необходимый для целостности клетки. Этот ген широко используется как эталонный, поскольку уровень его экспрессии постоянен вне зависимости от условий культивирования.
Для каждого из генов (abfB-1, abfB-2 и tub-1) были сконструированы специфические праймеры для количественной ПЦР. Для обоих условий (М2 и М0) по 2 мкг тотальной РНК подвергали процедуре обратной транскрипции. Осуществляли серию разведений комплементарных ДНК, полученных в результате обратной транскрипции, с целью определить оптимальные условия амплификации генов-мишеней (критичные для метода количественной ПЦР и для эффективности пар праймеров).
Нормализованные результаты представлены в Таблице 2 и Фиг.4.
| Таблица 2. |
| Значения дифференциальной экспрессии генов abfB-1 и abfB-2 в зависимости от условий роста Р. funiculosum |
 |
МО |
М2 |
| abfb1 |
1 |
107 |
| abfb2 |
1 |
1,27 |
Регуляция транскрипции генов, кодирующих целлюлолитические и гемицеллюлолитические активности, описана в литературе. Экспрессия этих генов сильно зависит от природы и химического состава источника углерода и азота, на котором культивируют микроорганизм. Было отмечено значительное подавление транскрипции этих генов в присутствии глюкозы. Такая регуляция осуществляется через посредство катаболического белка-репрессора CreА, который специфически закрепляется на промоторе этих генов и блокирует их транскрипцию. И в нашем случае количественного определения матричных РНК abfB-1 и abfB-2 посредством ПЦР уровень экспрессии этих двух генов в присутствии глюкозы (М0) весьма низок. Это соответствует литературным данным, поскольку, как было показано, вышеупомянутые гены экспрессируются на определенном базовом уровне даже в неблагоприятствующих им условиях (отсутствие целлюлоидных и/или гемицеллюлоидных субстратов). Результаты, полученные для М0, соответствуют литературе. В том, что касается экспрессии гена abfB-1, мы отмечаем факт 107-кратной его индукции по сравнению с базовым уровнем, имеющим место в случае М0, тогда как гену abfB-2 сверхэкспрессия не свойственна.
     
Формула изобретения
1. Полипептид, обладающий  -L-арабинофуранозидазной активностью, отличающийся тем, что представляет собой полипептид, выбранный из следующих полипептидов: -L-арабинофуранозидазной активностью, отличающийся тем, что представляет собой полипептид, выбранный из следующих полипептидов:
полипептид SEQ ID No.2,
полипептид, аминокислотная последовательность которого находится между положениями 28 и 507 SEQ ID No.2,
фрагмент полипептида SEQ ID No.2, обладающий  -L-арабинофуранозидазной активностью типа В, -L-арабинофуранозидазной активностью типа В,
полипептид, обладающий  -L-арабинофуранозидазной активностью типа В и идентичный, по меньшей мере, на 90% полипептиду SEQ ID No.2. -L-арабинофуранозидазной активностью типа В и идентичный, по меньшей мере, на 90% полипептиду SEQ ID No.2.
2. Полинуклеотид, кодирующий  -L-арабинофуранозидазу В, отличающийся тем, что выбран из числа следующих полинуклеотидов: -L-арабинофуранозидазу В, отличающийся тем, что выбран из числа следующих полинуклеотидов:
полинуклеотид, последовательность которого находится между положениями 845 и 2368 SEQ ID No.1,
полинуклеотид, последовательность которого находится между положениями 927 и 2368 SEQ ID No.1,
полинуклеотид, кодирующий полипептид по п.1.
3. Полинуклеотид, кодирующий  -L-арабинофуранозидазу, отличающийся тем, что имеет последовательность SEQ ID No.1 или последовательность, комплементарную SEQ ID No.1. -L-арабинофуранозидазу, отличающийся тем, что имеет последовательность SEQ ID No.1 или последовательность, комплементарную SEQ ID No.1.
4. Экспрессионная кассета, отличающаяся тем, что включает в себя в направлении транскрипции:
промотор, способный функционировать в организме-хозяине, которым являются дрожжи или грибы;
полинуклеотид по п.2 и
последовательность, терминирующую транскрипцию, способную функционировать в том же организме-хозяине.
5. Вектор экспрессии, содержащий полинуклеотид по п.2 или 3 и/или экспрессионную кассету по п.4.
6. Организм-хозяин, представляющий собой дрожжи или грибы, трансформированный полинуклеотидом по п.2 или 3, экспрессионной кассетой по п.4 и/или вектором по п.5.
7. Организм-хозяин по п.6, отличающийся тем, что выбран из дрожжей и нитчатых грибов.
8. Организм-хозяин по п.7, отличающийся тем, что он является штаммом Penicillium funiculosum.
9. Применение полипептида по п.1 или организма-хозяина по любому из пп.6-8 для гидролиза  -L-арабинофуранозильных связей в арабинофуранозилолигосахаридах. -L-арабинофуранозильных связей в арабинофуранозилолигосахаридах.
РИСУНКИ
|
|