Патент на изобретение №2388813
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОРОВЫЙ ПРОБИОТИК КОМПЛЕКСНОГО ДЕЙСТВИЯ
(57) Реферат:
Изобретение относится к области медицинской биотехнологии, в частности к получению нового лекарственного средства, предназначенного для ингибирования патогенных и условно-патогенных бактерий и вирусов. Споровый препарат включает, в мас.%: биомассу штамма Bacillus subtilis
Предлагаемое изобретение относится к области медицинской биотехнологии, в частности к получению нового пробиотика из бактерий рода Bacillus, предназначенного для ингибирования развития патогенных бактерий и вирусов. Традиционная терапия бактериальных заболеваний включает широкое использование антибиотических препаратов. Они часто являются токсическими и обладают неспецифическим бактерицидным действием, в том числе подавляют эндогенную микрофлору, что приводит к развитию различных осложнений, например дисбактериозам. В настоящее время предложены новые антибактериальные препараты, обладающие выраженной активностью против патогенных и условно-патогенных бактерий и не нарушающие микробиоценозов. К таким препаратам, обладающим хорошим лечебным эффектом, относятся препараты на основе бактерий рода Bacillus для лечения желудочно-кишечных, гнойно-воспалительных, урогенитальных заболеваний и не дающих осложнений в виде аллергий и дисбактериозов. Известен профилактический биопрепарат субалин, который содержит биомассу Bacillus subtilis ВКПМ В-4759 при следующем соотношении компонентов, об.%:
Известен также лекарственный препарат из бактерий рода Bacillus subtilis 11 В (ВКМ В-2218Д и ИБФМ РАН) при следующем соотношении компонентов, мас.%:
Терапевтическое действие препарата заключается в эффективном устранении условно-патогенной микрофлоры и восстановлении нормофлоры. Доказаны его абсолютная безвредность и хорошая переносимость (2). В задачу исследований входило – создание пробиотика комплексного действия, который характеризовался более выраженной антагонистической и бактерицидной активностью в отношении болезнетворных микроорганизмов за счет амилолитической активности. Поставленную задачу удалось достичь благодаря тому, что в состав предложенного пробиотика ввели культуру B.subtilis 3А ( Технический результат изобретения заключается в расширении спектра антагонистической активности по отношению к болезнетворным микроорганизмам и устойчивости к ряду антибиотиков, повышении бактерицидной активности в отношении различных патогенных и условно-патогенных микроорганизмов. Предлагаемый штамм B.subtilis 3А ( Морфологические признаки: грамположительные аэробные спорообразующие палочки, размером 2-3×0,6 мкм, расположенные одиночно, попарно или цепочкой. Клетки подвижны, образуют аэробно споры овальной формы, которые располагаются в центре клетки. При спорообразовании клетки не раздуваются. Культурально-морфологические свойства. Штамм B.subtilis 3А ( На мясопептонном бульоне (МПБ) растет в виде беловатой пленки и придонного осадка, вызывая помутнения среды. Оптимальная температура роста микроба (37±1)°С. Ферментативные свойства. Штамм ферментирует с образованием кислоты без газа глюкозу, сахарозу, мальтозу, манит. Не разлагает лактозу. Не образует индол, сероводород. Дает положительную реакцию Фогес-Проскауэра. Продуцирует каталазу, протеазу, желатиназу, амилазу. Не образует лецитиназу, липазу, уреазу. Изучаемая культура характеризуется отсутствием гемолитической активности (табл.1).
Как свидетельствуют данные, секционированный штамм Bacillus subtilis 3А характеризуется типичными для этого вида физиолого-биохимическими признаками, которые могут обусловить широкий диапазон положительного действия при применении. Антибиотикочувствительность. Исследования антибиотикоустойчивости штамма В.subtilis 3А в отношении антибиотиков и антибиотических веществ, широко применяемых в практике здравоохранения, показали, что штамм обладает устойчивостью к ампициллину, бензилпенициллину, азтреонаму, цефтазидиму, цефтизоксиму и полимиксину Е (табл.2).
Антагонистическая активность. Штамм Bacillus subtilis 3A наибольшую антагонистическую активность проявляет к тест-штаммам S.aureus (от 19,9 до 24,9 мм) и Candida albicans (до 36,5 мм), несколько ниже к – S.sonnei, S.flexneri (табл.3). Следует отметить, что штамм не проявляет антагонистическую активность в отношении представителей нормальной микрофлоры – бифидо-, лактобактерий и кишечной палочки.
Как видно из данных, представленных в таблице 3, штамм В.subtilis 3А характеризуется широким спектром высокой антагонистической активности в отношении патогенных и условно патогенных микроорганизмов и, в то же время, не влияет на бактерии – представителей нормальной микрофлоры. Продукцию биологически активных веществ (БАВ) штаммом В.subtilis 3А изучали методом диффузии в агар. О продукции БАВ судили по зонам задержки роста тест-культур.
Тест-культуры в концентрации 108 КОЕ/мл засевали на поверхность агаризованной среды (100 мкл суспензии/чашку). Сверлом (диаметр 6 мм) в агаре делали лунки, в которые вносили по 100 мкл лизата культуры В.subtilis 3A. Чашки культивировали при 37°С в течение 24-48 часов. Активность препарата определяли по зонам угнетения роста штаммов. Данные таблицы 4 свидетельствуют о том, что пробиотический штамм В.subtilis 3А продуцирует биологически активные вещества широкого спектра специфического действия. Безопасность пробиотического штамма Изучали острую и хроническую токсичность штамма В.subtilis 3А. Опыты проводили на белых мышах массой 10-12 г. При изучении острой токсичности животным вводили культуру В.subtilis 3А внутривенно, внутрибрюшинно и перорально в различных концентрациях. При изучении хронической токсичности животным вводили культуру перорально по 106 микробных клеток ежедневно в течение 10 дней. Контрольным животным вводили физиологический раствор. В таблице 5 представлены данные о действии максимальных доз, вводимых мышам при изучении острой токсичности. Результаты изучения хронической токсичности культуры представлены в таблице 6.
Наблюдение за животными проводили в течение 7 дней. Через 1 и 7 суток по 5 животных из каждой группы умерщвляли глубоким эфирным наркозом и проводили макроскопическое исследование внутренних органов, а также отбирали различные органы для гистологического изучения: печень, почки, легкие, селезенку, кишечник, мезентериальные лимфатические узлы, головной мозг, тимус, мягкие ткани в области глотки (последние только при оральном введении). Материал фиксировали в растворе формалина, парафиновые срезы окрашивали гематоксилином и эозином. Проводили в таком же объеме гистологические исследования органов контрольных животных. В течение всего периода наблюдения животные были здоровы, хорошо поедали пищевые рационы, поведенческие реакции не нарушены, шерстный покров не изменен. Макроскопическое и гистологическое изучение внутренних органов животных не выявило никаких патологических изменений даже в группах животных, получавших максимальное количество бактериальных клеток. Таким образом, штамм В.subtilis 3А характеризуется высокой степенью безопасности для животных. Пример 1 Штамм В.subtilis 3А на среде Громыко (МПА+сусло-агар 1:1) при 37°С в течение 48 часов. Бактерии смывали с поверхности агара 7%-ным раствором NaCl и прогревали при 121°С в течение 15 мин. Полученный лизат разводили физиологическим раствором до получения вариантов с различной концентрацией клеток (по оптическому стандарту мутности). В другом варианте бактерии смывали с поверхности агара 7%-ным раствором NaCl и разводили физиологическим раствором до получения вариантов с различной концентрацией клеток (по оптическому стандарту мутности). Вариант 1 Лизат биомассы штамма В.subtilis 3А – 1×109 КОЕ/мл Вариант 2 Лизат биомассы штамма В.subtilis 3A – 1×1010 КОЕ/мл Вариант 3 Лизат биомассы штамма В.subtilis 3A – 1×1011 КОЕ/мл Вариант 4 Биомасса штамма В.subtilis 3A – 1×109 КОЕ/мл Вариант 5 Биомасса штамма В.subtilis 3A – 1×1010 КОЕ/мл Вариант 6 Биомасса штамма В. subtilis 3A – 1×10 КОЕ/мл Изучали антагонистическую активность полученных вариантов препарата в отношении тест-культур (Таблица 7).
Как видно из данных, приведенных в таблице 7, оптимальным количеством микробных клеток в 1 мл препарата является – В.subtilis 3A – 1×109-1×1010 КОЕ/мл, как живых клеток, так и их лизатов. Дальнейшее увеличение количества бактериальных клеток не изменяет существенным образом специфическую активность препарата в отношении тест-культур микроорганизмов. Предложенный штамм В.subtilis 3A депонирован в коллекции микроорганизмов Государственного НИИ стандартизации и контроля медицинских биологических препаратов им. Л.А.Тарасевича под номером В.subtilis I. Получение живого препарата Пример 2. Получение жидкого препарата При стационарной технологии культивирование штамма ведется на плотных агаризованных средах в матрацах, либо в стеклянных бутылях на термостатируемой качалке при температуре от 22 до 38°С в течение от 12-16 ч до 7 сут. По окончании инкубации смывают биомассу, выросшую на поверхности питательной среды, осуществляют стабилизатором, разливают во флаконы. При промышленной технологии культивирование штамма ведется в реакторе/ферментере с питательной средой для культивирования при температуре 35-38°С в течение от 10-18 ч. Процесс считается законченным, если концентрация клеток составляет 4-5 млрд/мл и соотношение спор и вегетативных клеток 1:1. По окончании инкубации в выращенную культуру добавляют стабилизатор, разливают во флаконы. Пример 3. Получение препарата в форме лиофилизата При стационарной технологии культивирование штамма ведется на плотных агаризованных средах в матрацах, либо в стеклянных бутылях на термостатируемой качалке при температуре от 22 до 38°С в течение от 12-16 ч до 7 сут. По окончании инкубации смывают биомассу, выросшую на поверхности питательной среды, осуществляют защитной средой, разливают в ампулы (флаконы) или в кассеты из нержавеющей стали, после чего подвергают замораживанию и обезвоживанию на вакуум-сушильной установке или высушивают распылительным способом. При промышленной технологии культивирование штамма ведется в реакторе/ферментере с питательной средой для культивирования при температуре 35-38°С в течение от 10-18 ч. Процесс считается законченным, если концентрация клеток составляет 4-5 млрд/мл и соотношение спор и вегетативных клеток 1:1. По окончании инкубации в выращенную культуру добавляют стабилизатор, разливают в ампулы (флаконы) или в кассеты из нержавеющей стали, после чего подвергают замораживанию и обезвоживанию на вакуум-сушильной установке или высушивают распылительным способом. В качестве защитной среды может содержать, например, сахарозо-желатиновую среду, молоко, желатозу, сахарозу, лактозу. Пример 4. Получение препарата в таблетированной форме Выращенную культуру штамма В.subtilis 3A после добавления компонентов среды суспендирования обезвоживают на вакуум-сушильной или на распылительной сушильной установке, соединяют с сахарным гранулятом, скользящими веществами и прессуют на ротационных прессах. При формировании таблеток может содержать, например, декстраны, полиглюкин, крахмал, поливинилпирролидон, лактозу, сахарозу, стеарат кальция, гидрокарбонат натрия, гидроокись алюминия, метилцеллюлозу, тальк и т.п. На стабильность изучено 10 экспериментальных серий таблетированного препарата. Как показывают полученные результаты, непосредственно после прессования содержание живых В.subtilis 3A в таблетках составляет не менее 109-7 КОЕ/дозе (соответственно). После хранения таблеток на протяжении 12 мес содержание живых микробных клеток ни в одной партии не оказалось ниже 109-7 КОЕ/дозе. Пример 5. Получение препарата в форме суппозиториев Выращенные культуры штаммов В.subtilis 3A после добавления компонентов среды суспендирования обезвоживают на вакуум-сушильной или на распылительной сушильной установке, соединяют с наполнителями и отливают на свечных машинах. При получении суппозитории или свечи в качестве наполнителя содержат, например, кондитерский жир, парафин, ланолин, масло какао, гель гидроокиси алюминия и т.п. На стабильность изучено 10 экспериментально-производственных серий препарата. Как показывают полученные результаты, непосредственно после прессования содержание живых В.subtilis 3A в суппозиториях составляет не менее 109-7 КОЕ/ суппозиторий (соответственно). После хранения суппозиториев на протяжении 12 мес содержание живых микробных клеток ни в одной партии не оказалось ниже 109-7 КОЕ/суппозиторий. Пробиотик может быть инкапсулирован или иммобилизирован на различных типах носителей или сорбентах, например, на аэросиле, целлюлозе, активированном угле, карбоксиметилцеллюлозе, гидроксиэтилцеллюлозе, хитоне и т.п. Проверяли все полученные варианты и формы препарата на безвредность на лабораторных животных, специфическую антагонистическую активность в отношении тест-культур – представителей различных групп патогенных и условно-патогенных микроорганизмов и устойчивость к антибиотикам. Препарат характеризуется безвредностью. Для определения безвредности содержимое флакона разводили в 0,5 мл физиологического раствора и вводили эту дозу перорально мышам. Для каждого варианта опыта использовали не меньше 10 мышей массой 15-16 г. Препарат считали безвредным, если все мыши оставались живыми в течение 5 суток наблюдения и ни у одной из них не выявлено заболевания. Препарат характеризуется широким спектром антагонистической активности в отношении тест-штаммов культур патогенных микроорганизмов. Для определения специфической активности исследовали антагонистическую активность вариантов препарата в отношении тест-культур. Исследование осуществляли методом отсроченного антагонизма. Для этого содержимое флакона растворяли в 1 мл физиологического раствора. Полученную взвесь высевали штрихом по диаметру чашки Петри с агаризованной средой Гаузе Контролем роста тест-культур служило параллельное выращивание их на чашках с агаризованной средой Гаузе Из полученных данных следует, что оптимальным количеством живых клеток в одной дозе препарата является 1-5×109. Дальнейшее увеличение количества микробных клеток не изменяет существенным образом антагонистическую активность препарата в отношении тест-культур микроорганизмов. II. Получение инактивированного препарата Для получения лизатов клеток суспензию (полученную стационарной (А) или промышленной (Б) технологии) автоклавируют при температуре (110±1)°С 1 атм 10-30 мин. Пример 6. Полученную суспензию лизатов контролируют на подлинность и микробиологическую чистоту. Затем суспензию разливают дозатором в стерильные флаконы по 2, 5, 10 мл, герметично закрывают стерильной пластмассовой пробкой с резьбой и фасуют в потребительскую упаковку.
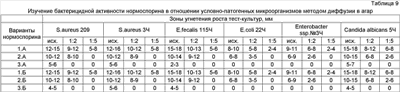
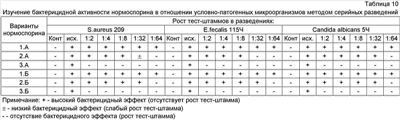
Пример 7. Получение препарата в форме лиофилизата В полученные лизаты клеток добавляют защитную среду, разливают в ампулы (флаконы) или в кассеты из нержавеющей стали, после чего подвергают замораживанию и обезвоживанию на вакуум-сушильной установке или высушивают распылительным способом. В качестве защитной среды может содержать, например, сахарозо-желатиновую среду, молоко, желатозу, сахарозу, лактозу. Пример 8. Получение препарата в таблетированной форме Полученные лизаты клеток штамма В.subtilis 3A после добавления компонентов среды суспендирования обезвоживают на вакуум-сушильной или на распылительной сушильной установке, соединяют с сахарным гранулятом, скользящими веществами и прессуют на ротационных прессах. При формировании таблетка может содержать, например, декстраны, полиглюкин, крахмал, поливинилпирролидон, лактозу, сахарозу, стеарат кальция, гидрокарбонат натрия, гидроокись алюминия, метилцеллюлозу, тальк и т.п. На стабильность изучено 10 экспериментальных серий таблетированного препарата. Пример 9. Получение препарата в форме суппозиториев Полученные лизаты клеток штамма В.subtilis 3A после добавления компонентов среды суспендирования обезвоживают на вакуум-сушильной или на распылительной сушильной установке, соединяют с наполнителями и отливают на свечных машинах. При получении суппозитории или свечи в качестве наполнителя содержат, например, кондитерский жир, парафин, ланолин, масло какао, гель гидроокиси алюминия и т.п. На стабильность изучено 10 экспериментально-производственных серий препарата. Пробиотик может быть инкапсулирован или иммобилизирован на различных типах носителей или сорбентах, например, на аэросиле, целлюлозе, активированном угле, карбоксиметилцеллюлозе, гидроксиэтилцеллюлозе, хитоне и т.п. Пример 10. Бактерицидную активность в отношении тест-штаммов на плотных средах определяли с помощью стандартных дисков, пропитанных изучаемым препаратом, измеряя зоны задержки роста вокруг дисков, включая диаметр самого диска. Исследование показало, что наибольшие показатели бактерицидной активности были у вариантов 1А и 1Б, средние – 2А и 2Б, низкие – 3A и 3Б. При изучении бактерицидной эффективности нормоспорина вариантов 1А, 1Б, 2А и 2Б выявлено, что самые высокие показатели активности препарат проявляет в отношении грибов рода Кандида, стафилококков, энтерококков (табл.9). Воздействие разных вариантов нормоспорина на условно-патогенные бактерии определяли методом серийных разведений в жидкой среде Гаузе На основании экспериментов по изучению бактерицидной активности в последующих исследованиях был использован нормоспорин в вариантах 1А и 1Б. Изучали бактерицидную активность Нормоспорина 1А к клиническим изолятам Н.pylori. Исследования проводили методом диффузии в агар на среде Мюллер-Хинтон. Нормоспорин характеризовался высокой бактерицидной активностью в отношении исследованных тест-штаммов Н.pylori (табл.11).
Предложенный штамм Bacillus subtilis 3A депонирован в коллекции микроорганизмов Государственного НИИ стандартизации и контроля медицинских биологических препаратов им. Л.А.Тарасевича под номером В.subtilis Предложенный штамм Bacillus subtilis 3A характеризуется высокой амилолитической активностью и обладает по сравнению с исходным штаммом более широким спектром антагонистической активности по отношению к болезнетворным микроорганизмам и устойчивостью к ампициллину, бензилпенициллину, азтреонаму, цефтазидиму, цефтизоксиму и полимиксину Е. Лизаты штамма Bacillus subtilis 3A обладают бактерицидной активностью в отношении различных патогенных и условно-патогенных микроорганизмов (стафилококков, энтерококков, грибов рода Кандида, хеликобактерий). Предложенный пробиотик апробирован с положительным результатом в Московском НИИ педиатрии и детской хирургии в апреле 2007 г. Пробиотик найдет применение при лечении больных детей и взрослых при заболеваниях желудочно-кишечного тракта и дисбиозов различной этиологии в лечебно-диагностических учреждениях амбулаторной и стационарной сети. Убедительно просим экспертизу назвать предложенный пробиотик «НОРМОСПОРИН», согласно утвержденной документации. Источники информации 1. Патент РФ 2. Патент РФ
Формула изобретения
Споровый препарат – пробиотик комплексного действия, включающий, мас.%:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 282 ГИСК им. Л.А.Тарасевича (1-5)×108-1010 КОЕ в 1 мл растворителя или лизаты биомассы штамма Bacillus subtilis
282 ГИСК им. Л.А.Тарасевича (1-5)×108-1010 КОЕ в 1 мл растворителя или лизаты биомассы штамма Bacillus subtilis 
 -оксимасляной кислоты на глюкозном агаре
-оксимасляной кислоты на глюкозном агаре