Патент на изобретение №2387651
|
||||||||||||||||||||||||||
(54) ЭТИЛ 1′-БЕНЗИЛ-3,3-ДИМЕТИЛ-1,2′-ДИОКСО-5′-ФЕНИЛ-1′,2,2′,3,4,10-ГЕКСАГИДРО-1Н-СПИРО[АКРИДИН-9,3′-ПИРРОЛ]-4′-КАРБОКСИЛАТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ
(57) Реферат:
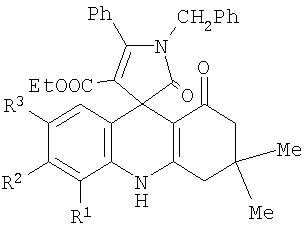
Изобретение относится к области органической химии, а именно к новым этил 5-R1-7-R2-1′-бензил-3,3-диметил-1,2′-диоксо-5′-фенил-1′,2,2′,3,4,10-гексагидро-1Н-спиро[акридин-9,3′-пиррол]-4′-карбоксилатам формулы
где R1=H, Me; R2=H, OMe; R3=H, Me, OMe, Br, и к способу их получения. Технический результат – получение новых соединений, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии как обладающие анальгетической активностью. 3 н. и 2 з.п. ф-лы, 1 табл.
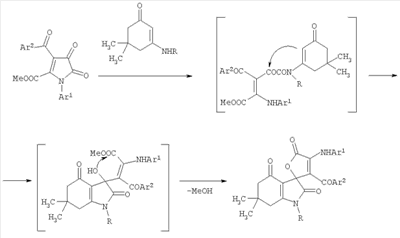
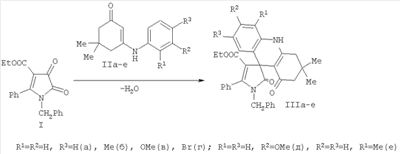
Изобретение относится к области органической химии, а именно к новым индивидуальным соединениям класса спиро[акридин-9,3′-пирролов] и к способу их получения, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем. К недостаткам данного способа относится невозможность получения этил 1′-бензил-3,3-диметил-1,2′-диоксо-5′-фенил-1′,2,2′,3,4,10-гексагидро-1H-спиро[акридин-9,3′-пиррол]-4′-карбоксилатов. Задачей изобретения является разработка простого способа синтеза не описанных в литературе этил 1′-бензил-3,3-диметил-1,2′-диоксо-5′-фенил-1′,2,2′,3,4,10-гексагидро-1H-спиро[акридин-9,3′-пиррол]-4′-карбоксилатов. Поставленная задача осуществляется путем кипячения раствора этил 1-бензил-4,5-диоксо-2-фенил-4,5-дигидро-1H-пиррол-3-карбоксилата (I) и 3-(ариламино)-5,5-диметилциклогекс-2-енонами (IIа, б) в соотношении 1:1 по следующей схеме: Процесс ведут при температуре 139-140°С, а в качестве растворителей используют абсолютный м– или п-ксилол. Из патентной и технической литературы не были выявлены способы получения замещенных этил 1′-бензил-3,3-диметил-1,2′-диоксо-5′-фенил-1′,2,2′,3,4,10-гексагидро-1H-спиро[акридин-9,3′-пиррол]-4′-карбоксилатов, имеющие сходные признаки с заявляемым способом, а именно не использовались исходные продукты, растворители, в которых проходит реакция, и интервал температур, на основании чего можно сделать вывод о соответствии заявленного технического решения критерию «новизна» и «изобретательский уровень». Изобретение иллюстрируется следующими примерами. Пример 1. Этил 1′-бензил-3,3,7-триметил-1,2′-диоксо-5′-фенил-1′,2,2′,3,4,10-гексагидро-1H-спиро[акридин-9,3′-пиррол]-4′-карбоксилат (IIIб). Раствор 1.0 ммоль соединения (I) и 1.0 ммоль енамина (IIб) в 15 мл абсолютного м-ксилола кипятили в течение 5 ч, охлаждали, выпавший осадок отфильтровывали. Выход 73%. Т.пл. 263-264°С (из толуола). Соединение (IIIб) C35H34N2O4. Найдено, %: С 76.75; Н 6.39; N 5.03. Вычислено, %: С 76.90; Н 6.27; N 5.12. Соединение (IIIб) – бесцветное кристаллическое вещество, легкорастворимое в ДМСО и ДМФА, трудно растворимое в обычных органических растворителях, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях. В ИК спектре соединения (IIIб), снятого в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний NH группы при 3264 см-1, лактамной и сложноэфирной карбонильных группы при 1687 см-1 и кетонной группы при 1624 см-1. В спектре ПМР соединения (IIIб), записанном в растворе в ДМСО-d6, кроме сигналов протонов ароматических колец и связанных с ними групп, присутствуют два синглета протонов двух метильных групп при 0.99 и 1.08 м.д., дублетные сигналы четырех неэквивалентных протонов метиленовых групп С2Н2 и С4Н2 в области 2.06-2.55 м.д. с характерными константами спин-спинового взаимодействия (J 16.0 и 16.4 Гц), уширенный синглет протона группы NH при 9.62 м.д., а также триплетный и мультиплетный сигналы протонов этильной группы этоксикарбонильного заместителя при 0.74 и 3.59 м.д. соответственно. Пример 2. Этил 1′-бензил-3,3-диметил-7-метокси-1,2′-диоксо-5′-фенил-1′,2,2′,3,4,10-гексагидро-1H-спиро[акридин-9,3′-пиррол]-4′-карбоксилат (IIIв). Раствор 1.0 ммоль соединения (I) и 1.0 ммоль енамина (IIв) в 15 мл абсолютного м-ксилола кипятили в течение 6 ч, охлаждали, выпавший осадок отфильтровывали. Выход 78%. Т.пл. 268-269°С (из толуола). Соединение (IIIв) C35H34N2O5. Найдено, %: С 74.80; Н 6.03; N 5.00. Вычислено, %: С 74.71; Н 6.09; N 4.98. Соединение (IIIв) – бесцветное кристаллическое вещество, легкорастворимое в ДМСО и ДМФА, трудно растворимое в обычных органических растворителях, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях. В ИК спектре соединения (IIIв), снятого в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний NH группы при 3256 см-1, лактамной и сложноэфирной карбонильных группы при 1687 см-1 и кетонной группы при 1626 см-1. В спектре ПМР соединения (IIIв), записанном в растворе в ДМСО-d6, кроме сигналов протонов ароматических колец и связанных с ними групп, присутствуют два синглета протонов двух метильных групп при 0.99 и 1.08 м.д., дублетные сигналы четырех неэквивалентных протонов метиленовых групп С2Н2 и С4Н2 в области 2.06-2.55 м.д. с характерными константами спин-спинового взаимодействия (J 16.4 и 16.6 Гц), уширенный синглет протона группы NH при 9.63 м.д., а также триплетный и мультиплетный сигналы протонов этильной группы этоксикарбонильного заместителя при 0.74 и 3.60 м.д. соответственно. Предлагаемый способ прост в осуществлении, одностадиен и позволяет получить не описанные в литературе этил 5-R1-7-R2-1′-бензил-3,3-диметил-1,2′-диоксо-5′-фенил-1′,2,2′,3,4,10-гексагидро-1H-спиро[акридин-9,3′-пиррол]-4-карбоксилаты (IIIа-е) с хорошими выходами, которые найдут применение в качестве исходных продуктов для синтеза гетероциклических систем и в фармакологии в качестве потенциальных лекарственных средств. Пример 3. Фармакологическое исследование этил 1′-бензил-3,3,7-триметил-1,2′-диоксо-5′-фенил-1′,2,2′,3,4,10-гексагидро-1H-спиро[акридин-9,3′-пиррол]-4′-карбоксилата (IIIб) и этил 1′-бензил-7-бром-3,3-диметил-1,2′-диоксо-5′-фенил-1′,2,2′,3,4,10-гексагидро-1H-спиро[акридин-9,3′-пиррол]-4′-карбоксилата (IIIг) и на наличие анальгетической активности. Оценку анальгетических свойств соединений (IIIб, г) изучали на беспородных мышах массой 18-22 грамм методом термического раздражения «горячая пластинка» по Эдди и Леймбах (Eddy N.B., Leimbarh D.J. Pharmacol and Exper. Gher. 1953., 385-393). В качестве препарата сравнения использовали анальгин. Проведенные исследования показали (см. таблицу), что соединения (IIIб, г) обладают достаточно сильной анальгетической активностью. Данные о фармакологической активности аналогов заявляемых соединений в доступной литературе отсутствуют.
Формула изобретения
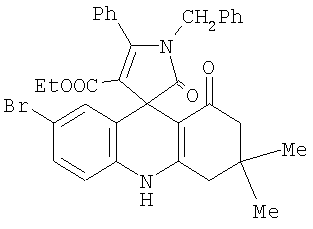
1. Этил 5-R1-7-R2-1′-бензил-3,3-диметил-1,2′-диоксо-5′-фенил-1‘,2,2′,3,4,10-гексагидро-1Н-спиро[акридин-9,3‘-пиррол]-4‘-карбоксилаты формулы 2. Этил 1′-бензил-7-бром-3,3-диметил-1,2′-диоксо-5′-фенил-1′,2,2′,3,4,10-гексагидро-1Н-спиро[акридин-9,3′-пиррол]-4′-карбоксилат формулы 3. Способ получения этил 5-R1-7-R2-1′-бензил-3,3-диметил-1,2′-диоксо-5′-фенил-1′,2,2′,3,4,10-гексагидро-1Н-спиро[акридин-9,3′-пиррол]-4′-карбоксилатов общей формулы 4. Способ по п.3, отличающийся тем, что процесс ведут при температуре 139-140°С. 5. Способ по п.3 или 4, отличающийся тем, что в качестве растворителя используют абсолютный м- или п-ксилол.
|
||||||||||||||||||||||||||

 126
126