|
|
(21), (22) Заявка: 2007134927/13, 19.09.2007
(24) Дата начала отсчета срока действия патента:
19.09.2007
(43) Дата публикации заявки: 27.03.2009
(46) Опубликовано: 20.04.2010
(56) Список документов, цитированных в отчете о
поиске:
RU 2283369 C1, 10.09.2006. RU 2030571 C1, 10.03.1995. RU 2064976 C1, 10.08.1996. КОЛЛА В.Э. и др. Фармакология и химия производных гидразина. – Йошкар-Ола: Марийское книжное издательство, 1976, л. 166-177. КИТАЕВ Ю.П. и др. Гидразоны. – М.: Наука, 1974, 388-401. ГЕРАСИМЕНКО А.А. Микромицетная коррозия металлов. I. Идентификация, культивированиемикромицетов, коррозионные гравиметрические исследования, Защита металлов, 1998, т.34,  2, с.192-207. 2, с.192-207.
Адрес для переписки:
236041, г.Калининград (обл.), ул. А. Невского, 14, ФГУ ВПО Российский государственный университет имени Иммануила Канта (РГУ им. И. Канта), УНИР, патентоведу
|
(72) Автор(ы):
Белоглазов Сергей Михайлович (RU),
Маляревский Дмитрий Сергеевич (RU)
(73) Патентообладатель(и):
ФГОУ ВПО Российский государственный университет им. И. Канта (RU)
|
(54) СПОСОБ ЗАЩИТЫ СТАЛИ ОТ МИКРОБИОЛОГИЧЕСКОЙ КОРРОЗИИ И НАВОДОРОЖИВАНИЯ В ВОДНОЙ СРЕДЕ, СОДЕРЖАЩЕЙ Aspergillus niger
(57) Реферат:
Изобретение относится к биотехнологии, в частности к защите стали от микробиологической коррозии и наводороживания в водной среде, содержащей мицеллы плесневого гриба Aspergillus niger, и предназначено для продления жизни строительных конструкций нефтяного и другого оборудования из углеродистой и легированной стали. Способ включает внесение в среду производного ряда гидразидов или ряда гидразонов в количестве 0,25 1 ммоль/л. Изобретение позволяет предотвратить микробиологичесую коррозию и наводороживание стали. 8 ил, 1 табл. 1 ммоль/л. Изобретение позволяет предотвратить микробиологичесую коррозию и наводороживание стали. 8 ил, 1 табл.
Предлагаемое изобретение относится к способу защиты стали от микробиологической коррозии и наводороживания в водной среде, содержащей мицеллы плесневого гриба Aspergillus niger, и предназначено для продления жизни строительных конструкций нефтяного и другого оборудования из углеродистой и легированной стали.
Известно [1] влияние микромицетов на стационарные потенциалы металлов, на анодное растворение металлов и сталей. Известно также о наибольшем коррозиионном разрушении металлов и сплавов в природных средах в присутствии микромицета Aspergillus niger.
Однако в публикации [1] нет сведений о ингибировании металлов, коррелирующих под действием Aspergillus niger, которое защищало бы их от водородного охрупчивания.
Известна также другая работа А.А.Герасименко [2], в которой были систематизированы микромицеты, инициирующие и интенсифицирующие коррозию металлов, описаны способы их культивирования, особенности их развития и влияния на металлы, сплавы, покрытия, используемые в технике. Проведены коррозионно-весовые испытания, измерения pH и Eh коррозионной среды, исследованы продукты метаболизма микромицетов. Показана целесообразность применения Aspergillus niger в качестве тест-культуры при исследовании коррозионных процессов в условиях эксплуатации изделий при контакте с нефтепродуктами и подтоварными водами.
Данное исследование является наиболее близким к заявляемому.
Его недостатком является то, что оно не содержит сведений об ингибировании коррозии, вызванной штаммом Aspergillus niger.
К задачам, которые поставили перед собой авторы предлагаемого способа, относятся, во-первых, разработка высокоэффективных и экономичных ингибиторов коррозии, сочетающих в себе свойства фунгицидов и ингибиторов наводороживания стали одновременно, а во-вторых, расширение ассортимента ингибиторов для сред, содержащих двухосновные карбоновые кислоты как продукты метаболизма микромицетов.
Поставленные задачи достигаются за счет того, что в качестве ингибиторов микробиологической коррозии и наводороживания стали в водной среде, содержащей Aspergillus niger, вводят в среду производное ряда гидрозидов в количестве 0,25-1 ммоль/л, проявляющее фунгицидные свойства, выбранное из группы:
OC1-фенилгидразидмоноэтилового эфира щавелевой кислоты; ОС7-п-толуилгидразидмоноэтилового эфира щавелевой кислоты:
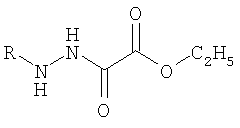
где R=С6Н5; п-С6Н4СН3
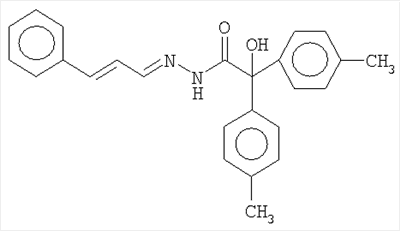
ОС3-п-толуилгидразид-бис(3,5-дихлорфенил)гликолевой кислоты; ОС4-o-толуилгидразид-бис(3,5-дихлорфенил)гликолевой кислоты; ОС9-п-толуилгидразиддибутилгидроксиуксусной кислоты:
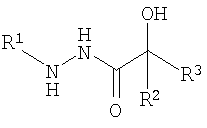
где R1=п-C6H4CH3; о-C6H4CH3
R2=R3=C6H3Cl2; С4Н9
И вводят в среду производное ряда гидразонов, проявляющее также токсичное и фунгицидное действие на Aspergillus niger, в количестве 0,25-1 ммоль/л, выбранное из группы [3, 4]:
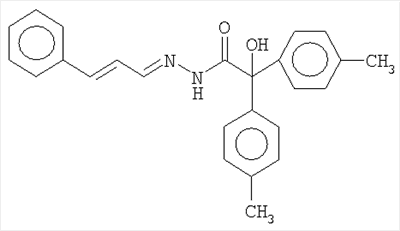
ОС5-дифенилгликолеилгидразон-2-гидрокси-5-бромбензальдегида;
ОС6-бис(м-толуил)-гликолеилгидразон-2-гидрокси-3-метоксибензальдегида:
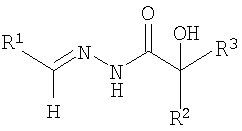
где R1=C6H3OHBr; C6H3CH3OOH
R2=R3=C6H5; м-C6H4CH3
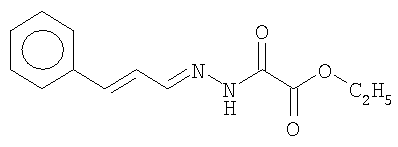
ОС2-этилоксалилгидразонкоричного альдегида; ОС8-бис-(п-толуил)-гликолеилгидразонбензальдегида:
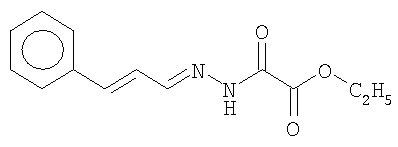
Электрохимические исследования показали, что причиной повышения скорости коррозии стали микромицетом Aspergeillus niger является значительное облегчение процесса активирования поверхности металла в присутствии грибов, особенно пассивируемых в обычных условиях металлов.
Также стимулирующим коррозию фактором является изменение pH среды в кислую сторону.
В подтверждение нашей идеи нами были проведены испытания.
Для испытаний в качестве объектов исследования использовались образцы из листовой стали Ст.3 50×20×1 мм.
Выбор коррозионной среды производили в соответствии со следующими требованиями:
1. Обеспечение преимущественного развития мицелл Aspergillus niger.
2. Близость по составу к природной среде.
3. Высокая коррозионная активность.
Образцы экспонировали 340 ч при 20°С в среде, созданной специально для мицелл Aspergillus niger, выделенных многократным пересевом на элективной питательной среде Чапека. За это время происходит полное развитие жизненного цикла и тела мицеллы до спор.
В качестве среды для роста мицеллы использовали 3-4% сусло, приготовленное по классической технологии пивоварения. Приготовление среды осуществляли следующим способом: 250 г размолотого солода заливали 1 л водопроводной воды, нагревали до 48-50°С и поддерживали эту температуру при постоянном перемешивании в течение 30 минут. В следующие 30 минут температуру доводили до 56-58°С и поддерживали до тех пор, пока реакция остывшей смеси с йодом будет отрицательной. Полученный экстракт фильтровали через бумажный фильтр и вату. В фильтрате определяли содержание сахара, используя сахарометр. До нужной крепости раствор доводили водопроводной водой. Полученное сусло подвергали автоклавированию под давлением 1,5-2 атм в течение получаса.
Образцы шлифовали тонкой шкуркой, обезжиривали венской известью и облучали ртутно-кварцевой лампой. Пробирки обрабатывали микроволновым излучением и ртутно-кварцевой лампой. Время экспозиции в коррозионной среде составляло 14 суток при дневном освещении и комнатной температуре.
Всё время экспозиции определяли следующие физико-химические параметры среды: pH, Eh. Непосредственно по окончании коррозионных испытаний анализировали потерю массы, количество водорода, абсорбированного образцами – по методу анодно-фотометрическому Ю.А.Клячко – С.М.Белоглазова [5, 6], выполняли гравиметрическое определение биомассы микромицета. Количественно анализировали состав среды для определения концентрации карбоновых кислот и других продуктов метаболизма, осуществляли с помощью ИК спектрометра Shimadzu.
Aspergillus niger относится к классу кислотообразующих и является одним из наиболее ярких его представителей. Продуктами его метаболизма являются около 10 двухосновных карбоновых кислот, но в наибольших концентрациях возникают только 5: щавелевая, лимонная, молочная, фумаровая и яблочная. К концу вторых суток наблюдается заметное покрытие поверхности стальных образцов гифами микромицета, при этом pH среды уменьшается на 0,5-0,7 единиц, a Eh потенциал возрастает на 50%. Максимальные изменения значений наблюдаются на 6-8 день.
В сериях с заявляемыми ОС менее сильно, чем в контрольной серии, происходят изменения pH, Eh, и они тем больше, чем выше концентрация исследуемых ОС в коррозионной среде. Уже весьма малая их концентрация 0,25 ммоль/л, введенная в коррозионную среду, приводит к существенному изменению pH, Eh и концентрации продуктов метаболизма. Но соединения данных классов имеют ограниченную растворимость, и, по нашему мнению, наиболее целесообразна для использования концентрация ОС 0,5 ммоль/л. Вывод сделан на том основании, что при повышении концентрации в 2 раза наблюдается несущественное улучшение результатов.
Результаты исследования представлены ниже.
Из фиг.1 видно, что концентрация ОС 0,5 ммоль/л является наиболее рациональной для веществ данного гомологического ряда при их практическом использовании как ингибиторов коррозии, так как дальнейшее повышение концентрации ОС в 2 раза, т.е. до 1 ммоль/л, ведет лишь к незначительному дополнительному эффекту снижения коррозионных потерь. Из гистограмм следует, что эффективность данных соединений значительна и наибольший эффект проявляется при использовании добавок ОС8, ОС5, ОС3, ОС4.
Фунгицидное действие исследованных соединений показано на фиг.2. Из анализа гистограмм следует, что данная группа веществ обладает выраженными фунгицидными свойствами. При концентрации 0,5 ммоль/л в коррозионной среде биомасса микромицетов во всех случаях снижается приблизительно на 40-50%, кроме сред, ингибированных ОС2 и ОС6. Дальнейшее повышение концентрации ОС в среде в 2 раза ведет к лишь незначительному улучшению показателя фунгицидности по сравнению с концентрацией 0,5 ммоль /л.
Измерения pH среды позволили установить уменьшение всеми исследованными ОС ее закисления в среднем на 1 ед. pH, причем происходит предотвращение резкого спада pH уже в первые трое суток (фиг.3 и 4). Это является следствием существенного уменьшения концентрации ряда двухосновных карбоновых кислот, причем происходит особенно сильное подавление продукции щавелевой и фумаровой кислот. В меньшей степени подавляется продукция яблочной, молочной и лимонной кислот, однако ОС3 оказывается наиболее эффективным в подавлении продуцирования яблочной кислоты.
Следует заметить, что увеличение концентрации ОС в 2 раза дает незначительное дополнительное предотвращение снижения pH.
Заявляемые соединения предотвращают сильный сдвиг редокспотенциала в сторону положительных значений (фиг.5 и 6).
Концентрационные профили водорода в стали Ст.3, корродировавшей в исследуемой среде в условиях воздействия микромицетов (на примере Aspergillus niger), имеют такой же характер, как и наблюдавшиеся ранее в средах с сульфатредуцирующими бактериями. Анализ количества поглощаемого водорода металлом показал что, введение исследованных ОС в концентрациях 0,25-1,0 ммоль/л приводит к уменьшению содержания водорода в приповерхностном слое (фиг.7 и 8).
Использование более высоких концентраций не приведет, на наш взгляд, к значительному эффекту из-за недостаточной растворимости данных веществ в полярных растворителях. Наиболее эффективное уменьшение наводороживания проявило ОС5, несколько слабее действуют ОС3 и ОС8.
При рассмотрении результатов качественно-количественного анализа коррозионной среды на продукты метаболизма микромицетов (Табл.1) до и после экспозиции видно, что заявляемые соединения значительно подавляют некоторые физиологические процессы, происходящие в клетках микромицета, что приводит к уменьшению продукции таких двухосновных кислот, как яблочная, молочная, лимонная, фумаровая и щавелевая. Указанная последовательность соответствует уменьшению продукции кислот как в неингибированной среде, так и в присутствии исследованных ОС, хотя она может быть иной в случае иных коррозионных сред.
| Таблица 1 |
| Содержание некоторых продуктов метаболизма в коррозионной среде (г/л) после экспозиции |
 доставки доставки |
Концентрация ОС, ммоль/л |
Щавелевая кислота |
Лимонная кислота |
Молочная кислота |
Фумаровая кислота |
Яблочная кислота |
| контроль |
2,1 |
1 |
25 |
0,3 |
35 |
| 1 |
0,25 |
0,03 |
0,5 |
11 |
0,1 |
33,5 |
| 0,5 |
0,01 |
0,4 |
8 |
0,01 |
33 |
| 1 |
0,01 |
0,8 |
1,9 |
нет |
30 |
| 2 |
0,25 |
0,01 |
0,6 |
13 |
0,25 |
33 |
| 0,5 |
нет |
0,8 |
16,7 |
нет |
31,5 |
| 1 |
0,01 |
0,7 |
16 |
0,2 |
30 |
| 3 |
0,25 |
0,01 |
0,7 |
18 |
0,2 |
18 |
| 0,5 |
нет |
0,7 |
14,8 |
0,1 |
5,2 |
| 1 |
0,01 |
0,6 |
15 |
нет |
15 |
| 4 |
0,25 |
0,01 |
0,7 |
20 |
0,1 |
34,5 |
| 0,5 |
0,01 |
0,6 |
22 |
нет |
34 |
| 1 |
0,01 |
0,6 |
15 |
нет |
33 |
| 5 |
0,25 |
0,01 |
0,8 |
19 |
0,2 |
35 |
| 0,5 |
нет |
0,7 |
18,6 |
нет |
34,6 |
| 1 |
нет |
нет |
16,6 |
0,3 |
32,8 |
| 6 |
0,25 |
0,01 |
0,8 |
22 |
0,15 |
34 |
 |
0,5 |
нет |
0,8 |
21,2 |
0,1 |
32,9 |
| 1 |
нет |
0,7 |
13,5 |
нет |
24 |
| 7 |
0,25 |
0,01 |
0,6 |
15 |
0,1 |
30 |
| 0,5 |
нет |
0,5 |
12,9 |
нет |
22,4 |
| 1 |
нет |
0,5 |
12,5 |
нет |
28 |
| 8 |
0,25 |
0,01 |
0,7 |
19 |
0,15 |
33,5 |
| 0,5 |
нет |
0,6 |
18,5 |
нет |
31 |
| 1 |
0,01 |
0,6 |
15,4 |
0,1 |
22,5 |
| 9 |
0,25 |
0,02 |
0,8 |
18 |
0,15 |
30 |
| 0,5 |
0,01 |
0,7 |
16,7 |
0,1 |
28 |
| 1 |
0,01 |
0,7 |
15,5 |
0,1 |
25,8 |
Учитывая все вышеизложенное, можно сделать следующие выводы:
1. Заявляемые ОС ряда гидрозидов и ряда гидразонов, вводимые в коррозионную среду по отдельности, обладают выраженными фунгицидными свойствами, что приводит к уменьшению биомассы микромицета более чем на 40% и существенному понижению содержания карбоновых кислот как основных коррозионно-опасных продуктов метаболизма Aspergillus niger в коррозионной среде.
2. Ингибирующие коррозию стали действия проявляют все заявляемые ОС ряда гидрозидов и ряда гидразонов по отдельности. Она изменяется в зависимости от строения органических молекул. Наиболее эффективно тормозят коррозию ОС3, ОС4, ОС5, ОС7, ОС8.
3. Все заявляемые ОС ряда гидрозидов и ряда гидразонов по отдельности уменьшают закисление коррозионной среды, вызываемое деятельностью микромицетов.
4. Органические соединения ОС5, ОС3, ОС8 проявляют хорошую эффективность как ингибиторы наводороживания стали Ст.3 в коррозионной среде в присутствии Aspergillus niger.
Список использованных источников
 4. – С.350-359. 4. – С.350-359.
 2. – С.192-207. 2. – С.192-207.
3. Китаев Ю.П., Бузыкин Б.И. Гидразоны. – М.: Наука, 1974. – 415 с.
4. Колла В.Э., Берлинский И.О. Фармокология и химия производных гидразина. – Йошкар-Ола, 1976. – 264 с.
Формула изобретения
Способ защиты стали от микробиологической коррозии и наводороживания стали в водной среде, содержащей Aspergillus niger, включающий внесение в среду производного ряда гидразидов или ряда гидразонов в количестве 0,25 – 1 ммоль/л, где производное представляет собой соединение, выбранное из группы:
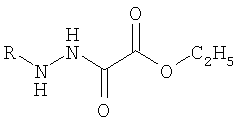
где R=C6H5; п-C6H4CH3,
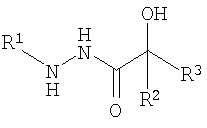
где R1=п-C6H4CH3; o-C6H4CH3,
R2=R3=C6H3Cl2; C4H9,
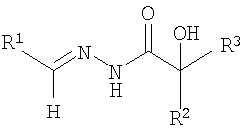
где R1=C6H3OHBr; C6H3CH3OOH,
R2=R3=C6H5; м-C6H4CH3,
РИСУНКИ
|
|