|
|
(21), (22) Заявка: 2008145161/13, 18.11.2008
(24) Дата начала отсчета срока действия патента:
18.11.2008
(46) Опубликовано: 20.04.2010
(56) Список документов, цитированных в отчете о
поиске:
RINCON G., MEDRANO J.F. Single nucleotide polymorphism genotyping of bovine milk protein genes using the tetra-primer ARMS-PCR. J. Anim. Breed. Genet, 2003, 120:331-337. RU 2337141 C2, 27.10.08. SU 1659488 A1, 30.06.1991.
Адрес для переписки:
119991, Москва, ул.Губкина,3, Институт общей генетики им. Н.И. Вавилова РАН, лаборатория сравнительной генетики животных, к.б.н. И.В. Лазебной
|
(72) Автор(ы):
Шайхаев Гаджирамазан Омарович (RU),
Лазебная Ирина Викторовна (RU),
Климов Евгений Александрович (RU),
Сулимова Галина Ефимовна (RU)
(73) Патентообладатель(и):
ООО “Лаборатория Изоген” (RU),
Учреждение Российской академии наук Институт общей генетики им. Н.И. Вавилова РАН (RU)
|
(54) СПОСОБ ОПРЕДЕЛЕНИЯ А- И В-АЛЛЕЛЕЙ ГЕНА КАППА-КАЗЕИНА КРУПНОГО РОГАТОГО СКОТА МЕТОДОМ ТЕТРАПРАЙМЕРНОЙ ПЦР
(57) Реферат:
Изобретение относится к области молекулярной генетики и селекции крупного рогатого скота. Способ включает подготовку пробы нуклеиновой кислоты, проведение полимеразной цепной реакции с использованием двух внутренних аллельспецифичных праймеров и двух внешних праймеров. При этом внутренние праймеры характеризуются отсутствием в 3-й позиции с 3′-конца нуклеотида, негомологичного последовательностям соответствующих цепей ДНК гена каппа-казеина, кроме того, обратный внешний праймер casR обладает большей специфичностью за счет отжига его в экзоне 4 гена CSN3, а в качестве ДНК полимеразы используют KlenTaq ДНК-полимеразу, что обеспечивает амплификацию А- и В-аллельных фрагментов, размеры которых составляют соответственно 122 п.н. и 174 п.н., а также амплификацию фрагмента гена каппа-казеина размером 250 п.н., который позволяет контролировать эффективность проводимой реакции. Способ позволяет повысить специфичность ПЦР. 1 табл., 1 ил.
Изобретение относится к области молекулярной генетики и селекции крупного рогатого скота, а именно к типированию животных по A- и B-аллелям гена каппа-казеина (CSN3) методом тетрапраймерной ПЦР с целью выявления перспективных животных в отношении качества молока для производства сыра. Определение аллельного состояния экзона 4 гена CSN3 имеет важное практическое значение, поскольку известно об ассоциации частоты B-аллеля этого гена с высоким качеством казеиновой мицеллы, образующейся при створаживании молока (Schaar et al., 1984, 1985; Robitaille 1995, Zadworny and Kuchnlein, 1990), что важно для получения сыров высокого качества. Поэтому тестирование КРС на наличие B-аллеля гена CSN3 входит в перечень генетических исследований, проводимых по MAS (marker assistant selection)-селекции и является необходимым при оценке молочного потенциала животных.
Существует ряд способов выявления А- и B-аллельного состояния гена CSN3. Все они основаны на применении полимеразной цепной реакции. В ПЦР-ПДРФ методе (1) ПЦР сочетается с рестрикционным анализом амплифицированного фрагмента соответствующими эндонуклеазами рестрикции (способ 1, Шайхаев и др., 1991; Сулимова и др., 2006, 2007; Ялуга В.Л. и др., 2008). В методе аллель-специфичной ПЦР, описанном Renaville, Robert и др. (Renaville, Robert et al., 2005) А- и B-аллели идентифицируют с помощью аллель-специфичных ДНК-зондов, меченных флюорофорами (способ 2). Оба способа являются адекватными и надежными для определения А- и B-аллельного состояния гена CSN3, но не лишены недостатков, связанных, прежде всего, с высокой стоимостью используемых реактивов и оборудования в способе 2, а в случае применения метода ПЦР-ПДРФ (1) – многостадийностью и трудоемкостью процесса анализа, токсичностью реагентов, используемых на отдельных этапах. Последнее касается применения акриламида при приготовлении полиакриламидного геля для электрофоретического разделения фрагментов, полученных в реакции амплификации соответствующего района гена каппа-казеина (экзон 4).
Существует способ (3) проведения стандартной аллельспецифичной ПЦР для выявления А и B-аллелей гена CSN3 (Вафин P.P., 2006). Типирование аллелей осуществляется путем использования двух пар специфичных праймеров: “B-F-hs” и “B-R-hs” (SEQ ID NO 1 – 5′-cccccGTGAGCCTACAAGTACACCTACCAT-3′ и SEQ ID NO 2 – 5′-сСсссGАТGТСТССТТАGАGТАТТТАGАСС-3′), а также “A-F-hs” и “А-R-hs” (SEQ ID NO 3 – 5′-gggggCTGTTCACACACAAAAACAGTAAAG-3′ и SEQ ID NO 4 – 5′-gggGGGTGCCTAACCTTATACAGCCTTTCG-3′ (приложение 1). Все используемые аллель-специфичные праймеры имеют 5′-некомплементарные участки длиной 3-5 нуклеотидов, отмеченные в перечисленных выше последовательностях строчными буквами. Каждая пара праймеров инициирует амплификацию соответственно В- и А-аллелей гена CSN3, которым соответствуют фрагменты размером 156 п.н. и 242 п.н. Недостатком данного способа может являться не совсем удачный выбор места отжига праймеров для определения A-аллеля гена CSN3. Они гомологичны последовательности интрона 5 с 798 п.н. по 822 п.н. и с 1005 п.н. по 1034 п.н., соответственно “A-F-hs” и “A-R-hs”. Учитывая более высокую скорость эволюции интронов по сравнению с экзонами, можно говорить о меньшей надежности системы анализа A-аллеля гена CSN3 по сравнению с B-аллелем. К тому же из описания изобретения не ясно, на выборке какого объема была проведена апробация предложенной системы и ДНК животных какой породы тестировали, также непонятно, осуществлялся ли параллельный контроль другими методами.
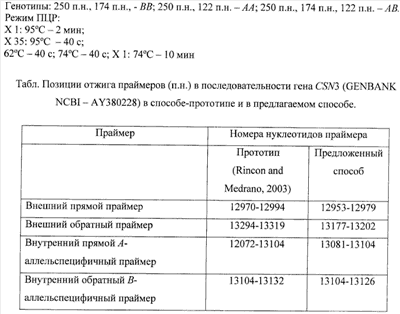
Способ (4), предложенный авторами Rincon и Medrano (Rincon G. and Medrano J.F., 2003) и рассматриваемый в качестве прототипа нашего способа, основан на проведении “tetra-primer ARMS-PCR”. Его особенностью является использование четырех праймеров, двух внутренних аллель-специфичных: SEQ ID NO 5 – 5′-AGTAAGAGAGCACTGTAGCTACTCTAGAGGA-3′ (для A-аллеля) и: SEQ ID NO 6 – 5′-AGGTGGGCTCTCAATAACTTCTGGAGGAG-3′ (для B-аллеля), и двух внешних праймеров: прямого – SEQ ID NO 7 – 5′-ATCATTTATGGCCATTCCACCAAAG-3′ и обратного – SEQ ID NO 8 – GCCCATTTCGCCTTCTCTGTAACAGA-3′ (приложение 1), причем внутренние праймеры содержат в -2 позиции (3-й позиции) с 3′-конца “mismatch”-нуклеотиды, что повышает специфичность отжига праймеров. Результатом “tetra-primer ARMS-PCR” является амплификация двух аллельспецифичных фрагментов (соответственно, А- и B-аллели: 245 п.н. и 164 п.н.) и одного генспецифичного, размером 350 п.н.. Предложенная система является удобной, современной и не трудоемкой, однако и она имеет некоторые недостатки. Одним из них является последовательность обратного внешнего праймера (SEQ ID NO 8 (приложение 1)), гомологичного последовательности интрона 5 гена каппа-казеина, которая эволюционирует с большей скоростью по сравнению с последовательностью экзона 4, что может отразиться на специфичности данного праймера. К тому же метод “tetra-primer ARMS-PCR” (4) не прошел апробацию на российских породах. Учитывая отмеченное, нельзя быть полностью уверенными в универсальности и возможности его использования для тестирования российских пород.
Таким образом, задачу создания универсальной, надежной, экономически выгодной и безопасной для исследователя методики выявления А- и B-аллелей гена CSN3 нельзя считать до конца решенной.
Задача нашего изобретения – создание эффективного и универсального способа определения А- и B-аллелей гена каппа-казеина (CSN3) крупного рогатого скота для использования в животноводстве и селекции.
Сущность изобретения – определение А- и B-аллелей гена каппа-казеина (CSN3) крупного рогатого скота методом тетрапраймерной ПЦР с использованием строго гомологичных последовательностей экзона 4 гена CSN3: двух внутренних аллель-специфичных праймеров
(casFA: SEQ ID NO 9 – 5′-GAGCACTGTAGCTACTCTAGAAGA-3′-A-allele – 24 п.н.,
casRB: SEQ ID NO 10 – 5′-GCTCTCAGTAACTTCTGGAGAAG-3′-B-allele – 23 п.н.) и двух внешних праймеров
(casF: SEQ ID NO 11 – 5′-CACCCACACCCACATTTATCATTTATG-3′ – 27 п.н.,
casR: SEQ ID NO 12 – 5′-CGTTGTCTTCTTTGATGTCTCCTTAG-3′ – 26 п.н.) (приложение 1). Каждый внешний праймер в сочетании с соответствующим ему внутренним праймером (casFA-casR и casF-casRB) инициирует амплификацию аллельспецифичных фрагментов (А- и B-аллели соответственно, 122 п.н. и 174 п.н.). Дополнительно к этому, внешние праймеры (casF-casR) инициируют амплификацию фрагмента (250 п.н.), являющегося внутренним контролем ингибирования ПЦР, поскольку фрагмент гена CSN3 амплифицируется независимо от аллельного состояния гена. Последовательности всех праймеров являются полностью гомологичными последовательности экзона 4 гена CSN3, что определяет их высокую специфичность. Праймеры сконструированы таким образом, что фланкируемые ими фрагменты имеют достаточные размеры и могут быть легко разделены методом электрофореза в 2% агарозном геле, что исключает использование полиакриламидного геля, при приготовлении которого применяют токсическое вещество – акриламид (способ 1). Исключение из анализа стадии рестрикции значительно ускоряет типирование аллелей и удешевляет его. Наша система анализа аллельного состояния гена CSN3, как и способ 4, основана на детекции значимой нуклеотидной замены А-С в положении 13104 гена, соответствующей 416-й нуклеотидной позиции в экзоне 4 (A/N: AY380228), которая приводит к замене в белковом продукте аминокислоты Thr на Ile в 136 положении полипептидной цепи, в то время как в способе 3 A-аллель тестируют по нуклеотидной замене в положении 13510 последовательности гена (822 позиция интрона 5 гена), что может привести к неточности при выявлении A-аллеля.
От прототипа (способ 4) предложенный способ отличается: более коротким размером аллельспецифичных праймеров, отсутствием в -2 позиции (3-ей позиции) с 3′-конца “mismatch”-нуклеотида в последовательности аллельспецифичных праймеров, гомологией обратного внешнего праймера casR последовательности экзона 4 гена CSN3, а не интрона. К тому же в предложенном способе используются иные параметры ПЦР: в противоположность “touchdown”-режиму со снижением через каждые два цикла температуры отжига на 1°C с 64°C до 60°C проводится стандартная смена циклов ПЦР с фиксированной температурой отжига праймеров в течение всех циклов, равной 62°C.
Использование всех четырех праймеров, гомологичных экзону 4, повышает специфичность предложенной системы и делает ее более универсальной. Кроме того, применение в противоположность Taq-ДНК-полимеразе, Klentaq ДНК-полимеразы, не имеющей 3′-5′-экзонуклеазной активности (proofreeding), также повышает специфичность ПЦР.
Способ осуществляют с использованием программируемого термоциклера “Терцик” (фирма “ДНК-Технология”, Россия) при соблюдении оптимального режима амплификации: х1: 95°C – 2 мин; х35: 95°C – 40 с; 62°C – 40 с; 74°C – 40 с; x1: 74°C – 10 мин и состава ПЦР-смеси: в объеме 20 мкл содержится 60 mM Tris-HCL (pH 8,8), 2,5 mM MgCl2, 20 mM KCL, 15 mM (NH4)2SO4, 10 mM меркаптоэтанола, 0,1% тритона Х-100; 0,2 mM дНТФ, 10 ед. Klentaq ДНК-полимеразы (или используют набор реагентов “GenPakR PCR Core” (IsoGene lab., Москва, Россия)), 40 нг ДНК, выделенной из лейкоцитов или цельной крови КРС (набор реагентов DIAtom DNA Prep (IsoGene lab., Москва, Россия); два внутренних аллельспецифичных и два внешних праймера. Концентрация внутренних и внешних праймеров составляет соответственно: 0,5 mkM. Внутренние праймеры имеют следующий состав: casFA: SEQ ID NO 9 – 5′-GAGCACTGTAGCTACTCTAGAAGA-3′ – 24 п.н. (A-аллель специфичный) и casRB: SEQ ID NO 10 – 5′-GCTCTCAGTAACTTCTGGAGAAG-3′ – 23 п.н. (B-аллель специфичный). Последовательность внешних праймеров следующая: casF: SEQ ID NO 11 – 5′-CACCCACACCCACATTTATCATTTATG-3′ – 27 п.н. и casR: SEQ ID NO 12 – 5′-CGTTGTCTTCTTTGATGTCTCCTTAG-3′ – 26 п.н. DNA Prep (IsoGene lab., Москва, Россия); два внутренних аллельспецифичных и два внешних праймера. Концентрация внутренних и внешних праймеров составляет соответственно: 0,5 mkM. Внутренние праймеры имеют следующий состав: casFA: SEQ ID NO 9 – 5′-GAGCACTGTAGCTACTCTAGAAGA-3′ – 24 п.н. (A-аллель специфичный) и casRB: SEQ ID NO 10 – 5′-GCTCTCAGTAACTTCTGGAGAAG-3′ – 23 п.н. (B-аллель специфичный). Последовательность внешних праймеров следующая: casF: SEQ ID NO 11 – 5′-CACCCACACCCACATTTATCATTTATG-3′ – 27 п.н. и casR: SEQ ID NO 12 – 5′-CGTTGTCTTCTTTGATGTCTCCTTAG-3′ – 26 п.н.
Детекцию полученных продуктов амплификации осуществляют методом гельэлектрофореза в 2% агарозном геле, приготовленном на 1-кратном ТАЕ-буфере следующего состава: 0,04 М трис-ацетета, 0,02 М ЭДТА, pH 8,0, 0,5 мкг/мл бромистого этидия. Используют буфер для нанесения – водный раствор, содержащий 0,25% бромфенолового синего и 40% (вес или объем) сахарозы, разведенный при нанесении с ПЦР-продуктом в 6 раз. Горизонтальный электрофорез проводят при напряжении электрического тока 10 В/см в течение 40 мин в камере “SE-1” (“Helicon” Россия) с применением источника постоянного тока “PowerPack Basic” (Bio-Rad, США). Фоторегистрацию результата электрофореза проводят на УФ-трансиллюминаторе “УВТ-1” (312 нм), с помощью фотодокументирующей системы “ViTran-1” (Biokom, Россия).
При обработке результатов необходимо руководствоваться следующим: наличие трех полос размером 250 п.н. (внутренний контроль), 174 п.н. (аллель В) и 122 п.н. (аллель А) указывает на гетерозиготный генотип; наличие двух полос размером 250 п.н. (внутренний контроль) и 174 п.н. (аллель В) указывает на гомозиготный генотип ВВ; наличие двух полос размером 250 п.н. (внутренний контроль) и 122 п.н. (аллель А) – на гомозиготный генотип АА.
Пример 1
Предложенный способ был апробирован на выборках коров российских пород: калмыцкой и бестужевской, ранее генотипированных на наличие В- и А-аллелей гена CSN3 ПЦР-ПДРФ методом (Шайхаев и др., 1991; Сулимова и др., 2006,2007).
Ниже приведены технические результаты применения предложенного способа в виде фотографий электрофоретического разделения продуктов амплификации в 2%-ном агарозном геле на рисунке (приложение 2). Они позволяют точно и однозначно определять генотипы животных, что может найти применение в селекции и животноводстве.
Заключение
В результате апробации предложенного способа определения А- и B-аллелей гена каппа-казеина крупного рогатого скота, проведенной на образцах крови коров калмыцкой и бестужевской пород КРС, получен обеспечиваемый заявленным способом технический результат, а именно, продемонстрирована возможность генотипирования КРС по А- и В-аллелям гена CSN3 методом тетрапраймерной ПЦР с использованием разработанных праймеров в оптимизированных условиях полимеразной цепной реакции.
Таким образом, убедительно продемонстрировано, что для проведения массовой диагностики КРС на присутствие А- и В-аллелей гена CSN3 наиболее доступным, эффективным и универсальным является предложенный способ определения А- и В-аллелей гена каппа-казеина крупного рогатого скота методом тетрапраймерной ПЦР.
Формула изобретения
Способ определения А- и В-аллелей гена каппа-казеина у крупного рогатого скота методом тетрапраймерной ПЦР, включающий подготовку пробы нуклеиновой кислоты, проведение полимеразной цепной реакции с использованием двух внутренних аллель-специфичных праймеров и двух внешних праймеров, отличающийся тем, что используемые в ПЦР праймеры имеют следующие нуклеотидные последовательности: внешние – casF 5′-CACCCACACCCACATTTATCATTTATG-3′ и casR 5′-CGTTGTCTTCTTTGATGTCTCCTTAG-3′, внутренний А-аллель-специфичный – casRA 5′-GAGCACTGTAGCTACTCTAGAAGA-3′ и внутренний В-аллель-специфичный casRB: 5′-GCTCTCAGTAACTTCTGGAGAAG-3′, причем внутренние праймеры характеризуются отсутствием в 3-ей позиции с 3′-конца нуклеотида негомологичного последовательностям соответствующих цепей ДНК гена каппа-казеина, кроме того большей специфичностью обратного внешнего праймера casR, за счет отжига его в экзоне 4 гена CSN3, а также использованием в качестве ДНК-полимеразы KlenTaq ДНК-полимеразы и следующими параметрами режима ПЦР: х1: 95°С – 2 мин; х35: 95°С – 40 с; 62°С – 40 с; 74°С – 40 с; х1: 74°С – 10 мин, что обеспечивает амплификацию А-аллель-специфичного фрагмента, размером 122 п.н., В-аллель-специфического фрагмента, размером 174 п.н. и фрагмента внутреннего контроля специфичности реакции, размером 250 п.н., при этом гетерозиготному генотипу АВ соответствуют ПЦР-продукты, размером 250 п.н., 174 п.н. и 122 п.н., гомозиготному генотипу ВВ – размером 250 п.н. и 174 п.н., гомозиготному генотипу АА – размером 250 п.н. и 122 п.н.
РИСУНКИ
|
|