|
|
(21), (22) Заявка: 2006146946/04, 27.05.2005
(24) Дата начала отсчета срока действия патента:
27.05.2005
(30) Конвенционный приоритет:
28.05.2004 EP 04076585.1
(43) Дата публикации заявки: 10.07.2008
(46) Опубликовано: 20.04.2010
(56) Список документов, цитированных в отчете о
поиске:
WO 03068220 A1, 21.08.2003. EP 0229391 A1, 24.12.1986. RU 2184112 C2, 03.12.1997.
(85) Дата перевода заявки PCT на национальную фазу:
28.12.2006
(86) Заявка PCT:
EP 2005/005816 20050527
(87) Публикация PCT:
WO 2005/118570 20051215
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
МАРТИНЕС ХИЛЬ Ана (ES),
РУБИО АРРЬЕТА Лаура (ES),
МУНЬОС РУИС Пилар (ES),
ДОРРОНСОРО ДИАС Исабель (ES),
ГАРСИА ПАЛОМЕРО Эстер (ES),
ДЕЛЬ МОНТЕ МИЛЬЯН Мария (ES),
МЕДИНА ПАДИЛЛА Мигель (ES)
(73) Патентообладатель(и):
НОСКИРА С.А. (ES)
|
(54) СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ БУТИРИЛХОЛИНЭСТЕРАЗЫ
(57) Реферат:
Изобретение относится к соединениям общей формулы (I)
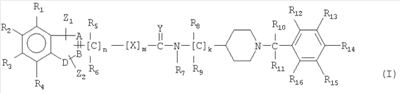
где А, В представляют собой С; D выбирают из N; Х выбирают из -CRaRb-, -O-; Y выбирают из О; Z1 и Z2 независимо выбирают из водорода, замещенного или незамещенного алкила, имеющего от 1 до 8 атомов, R1-R4 независимо выбирают из водорода или галогена; R5-R16 независимо представляют собой водород; где Ra и Rb независимо представляют собой водород; n равен 1-3; m равен 0 или 1; к равен 2; или к его фармацевтически приемлемым солям или сольватам. Изобретение также относится к фармацевтической композиции, ингибирующей бутирилхолинэстеразу (BuChE), на основе указанных соединений. Технический результат – получение новых соединений и фармацевтической композиции на их основе, которые могут применяться для лечения или профилактики когнитивных расстройств и/или нейродегенеративных расстройств. 5 н. и 5 з.п. ф-лы, 1 табл.
Настоящее изобретение относится к соединениям индолилпиперидина, обладающим селективной фармакологической активностью по отношению к ферменту – бутирилхолинэстеразе (BuChE), способам получения таких соединений, фармацевтическим композициям, их содержащим, а также к применению их в терапии, в частности, для лечения и/или профилактики заболеваний, в которых принимает участие BuChE, таких как когнитивное расстройство и нейродегенеративные расстройства.
Болезнь Альцгеймера (AD) представляет собой общее прогрессирующее слабоумие, включающее потерю памяти и высшей когнитивной функции. Эта болезнь характеризуется наличием амилоидных отложений в головном мозге страдающих этим заболеванием. Эти отложения проявляются как в виде экстрацеллюлярных отложений (амилоидных бляшек), так и в виде интрацеллюлярных отложений (нейрофибриллярных клубков). Основным компонентом амилоидных бляшек является амилоидный белок (A ), который образуется в результате протеолитического расщепления белка-предшественника амилоидного белка (APP). Основной составной частью нейрофибриллярных клубков является цитоскелетный tau-белок. ), который образуется в результате протеолитического расщепления белка-предшественника амилоидного белка (APP). Основной составной частью нейрофибриллярных клубков является цитоскелетный tau-белок.
Ацетилхолинэстераза (EC 3.1.1.7; AChE) и бутирилхолинэстераза (EC 3.1.1.8; BuChE) представляют собой два гомологически близких белка. Оба белка присутствуют у всех позвоночных, и оба способны к гидролизу нейромедиатора, ацетилхолина (ACh). У человека присутствуют две функционально различные холинэстеразы, AChE и BuChE, обладающие значительной степенью (>50%) гомологии аминокислотной последовательности, которые кодируются двумя отдельными генами, AChE и BChE соответственно. Два гена имеют аналогичную организацию экзонов и интронов, но радикально различающийся нуклеотидный состав, AchE обогащен G и C, тогда как BChE обогащен A и T. Наличие двух различных генов ChE у всех позвоночных, изученных к настоящему времени, указывает на то, что оба белковых продукта являются биологически необходимыми для этих видов и предположительно имеют разные функции.
Было сделано предположение, что антихолинергические лекарственные средства ухудшают память здоровых людей, подобно тому, как это наблюдают на ранней стадии развития AD. Поэтому основным современным и в краткосрочной перспективе самым многообещающим методом терапии AD является стимуляция холинергической системы. С тех пор как была создана «холинергическая гипотеза» болезни Альцгеймера (AD), понимание холинергических механизмов, свойственных данному расстройству, эволюционировало. Применение ингибиторов холинэстераз (ChE) в настоящее время является основным фармакологическим методом лечения, предлагающим рациональный, основанный на доказательной базе, подход к устранению симптомов заболевания (Giacobini E., Neurochem Res. 2003, Apr; 28(3-4): 515-22.  Cholinesterases: new roles in brain function and in Alzheimer’s Disease Cholinesterases: new roles in brain function and in Alzheimer’s Disease ). Однако, как было показано, анти-ChE агент, физостигмин, обладает краткосрочным незначительным положительным воздействием на когнитивные функции. Загрузка предшественника с холином или фосфатидилхолином является неэффективной. ). Однако, как было показано, анти-ChE агент, физостигмин, обладает краткосрочным незначительным положительным воздействием на когнитивные функции. Загрузка предшественника с холином или фосфатидилхолином является неэффективной.
Первоначально исследование, кроме того, было сосредоточено на селективных ингибиторах ацетилхолинэстеразы (AChE). Хотя многие годы это не было замечено, бутирилхолинэстераза (BuChE) также способна к гидролизу ацетилхолина (ACh) и может играть важную роль в патофизиологии и симптоматологии AD (Greig NH, Lahiri DK, Sambamurti K, Int. Psychogeriatr. 2002, 14:77-91  Butyrylcholinesterase: an important new target in Alzheimer’s Disease therapy Butyrylcholinesterase: an important new target in Alzheimer’s Disease therapy ). ).
Наблюдение, что BuChE оказывается связанной с бляшками в тот момент, когда они из диффузной доброкачественной формы созревают в плотную нейротоксичную форму, обусловленную патологией заболевания, привело к предположению, что BuChE может играть активную роль в этом процессе (Saez-Valero J, et al., J Neurosci Res. 2003 72(4):520-6  Glycosylation of acetylcholinesterase and butyrylcholinesterase changes as a function of the duration of Alzheimer’s Disease Glycosylation of acetylcholinesterase and butyrylcholinesterase changes as a function of the duration of Alzheimer’s Disease ). ).
Содержание BuChE в мозге увеличивается с возрастом, тогда как для AChE обнаруживают противоположную тенденцию. Каталитическая активность BuChE может, поэтому, играть более существенную роль при гидролизе ACh в стареющем мозге, полагая, что ингибирование BuChE может оказывать большее влияние на холинергическую нейротрансмиссию у людей пожилого возраста. Присутствие BuChE в амилоидных бляшках и нейрофибриллярных клубках при AD было подтверждено многочисленными исследователями. Кажется разумным допустить, что этот фермент является глиальным продуктом и что его местоположение в бляшках и клубках может явиться результатом общего воспалительного процесса, связанного с AD. Противодействие активности этого фермента (каталитической или некаталитической) представляет собой многообещающую терапевтическую стратегию воздействия на течение нейропатологического процесса при AD (Greig NH, Utsuki T, Yu Q, Zhu X, Holloway HW, Perry T, Lee B, Ingram DK, Lahiri DK. Curr Med Res Opin. 2001; 17(3): 159-65,  A new therapeutic target in Alzheimer’s Disease treatment: attention to butyrylcholinesterase A new therapeutic target in Alzheimer’s Disease treatment: attention to butyrylcholinesterase ; Giacobini E. Drug’s Aging., 2001, 18(12): 891-8, ; Giacobini E. Drug’s Aging., 2001, 18(12): 891-8,  Selective inhibitors of butyrylcholinesterase: a valid alternative for therapy of Alzheimer’s Disease? Selective inhibitors of butyrylcholinesterase: a valid alternative for therapy of Alzheimer’s Disease? ). ).
Производные пиперидина являются соединениями, представляющими интерес в фармацевтической промышленности. Многие семейства этого класса соединений обнаруживали разнообразную биологическую активность, связанную с ЦНС, такую как ингибирование AChE или гидрокситриптаминовых (HT) рецепторов.
В EP 229391 описаны производные пиперидина, обладающие селективной анти-AChE активностью. Среди прочих описанных, они представляют собой ароматическую часть индола. В EP 1300395 описаны соединения 4-замещенного пиперидина, обладающего ингибирующим воздействием на AChE.
В CN 1345724 описывают индолилпиперидины, применяемые для лечения болезни Альцгеймера; описанные соединения обладают ингибирующей активностью по отношению к AchE, но они не селективны по отношению к BuChE (см. CN 1345724, таблица 1).
Несмотря на возможное терапевтическое применение анатагонистов BuChE, до настоящего времени сообщалось об очень незначительном количестве соединений, обладающих селективной ингибирующей активностью по отношению к BuChE, таких как, например, этопропазин (гидрохлорид 10-(2-диэтиламинопропил)фенотиазина), дансиларгинин-N-(3-этил-1,5-пентандиил)амид (DAPA), фенетилнорсимсерин и соединения, описанные в WO 9902154 или EP 1251131. Очевидно, что существует потребность в обнаружении соединений, которые обладают фармакологической активностью по отношению к BuChE, которые высокоэффективны и селективны и способны дифференцировать BuChE и AChE.
В настоящее время авторы обнаружили семейство структурно различающегося класса соединений, которые являются ингибиторами BuChE, обладающими очень высокой селективностью, некоторые из них проявляют активность даже ниже наномолярного диапазона. Кроме того, соединения по изобретению обладают низкой токсичностью.
Значимыми структурными особенностями этих соединений является наличие гетероциклической части, пиперидиновой части с аралкильным заместителем на атоме N и связующего звена между этими двумя частями; связующее звено содержит амидоподобные функциональные группы. Авторы обнаружили, что селективность и активность могут меняться вместе с природой и длиной связующего звена, а также природой и заместителями указанных выше частей. То, что гетероцикл не соединен со связующим звеном через карбонил или гетероатом, является существенным для уровня селективности.
В одном аспекте изобретение относится к соединению формулы I
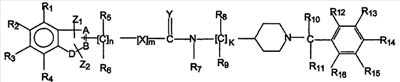
формула 1
где A, B независимо выбирают из С или N;
D выбирают из C, O, S, N;
при условии, что, по крайней мере, один из А, В и D является гетероатомом;
X выбирают из -CRaRb-, -O-, -S-, -NRa-;
Y выбирают из O, S, NRa;
Z1 и Z2 независимо выбирают из водорода, замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного алкенила, замещенного или незамещенного арила, замещенного или незамещенного гетероциклила, -CORa, -C(O)ORa, -C(O)NRaRb, -C=NRa, -CN, -ORa, -OC(O)Ra, -S(O)tRa, -NRaRb, -NRaC(O)Rb, -NO2, -N=CRaRb или галогена,
где Z1 и Z2 вместе с A и В или В и D могут образовывать конденсированную кольцевую систему, или вместе с R1 или R4 могут образовывать конденсированную кольцевую систему;
R1-R16 независимо выбирают из водорода, замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного алкенила, замещенного или незамещенного арила, замещенного или незамещенного гетероциклила, -CORa, -C(O)ORa, -C(O)NRaRb, -C=NRa, -CN, -ORa, -OC(O)Ra, -S(O)tRa, -NRaRb, -NRaC(O)Rb, -NO2, -N=CRaRb или галогена;
где Ra и Rb, каждый независимо, выбирают из водорода, замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного алкенила, замещенного или незамещенного арила, замещенного или незамещенного гетероциклила, замещенного или незамещенного алкокси, замещенного или незамещенного арилокси или галогена;
n равен 1-6;
m равен 0 или 1;
к равен 1-8;
или их фармацевтически приемлемая соль, пролекарство или сольват;
при условии, что соединение не является (aR) 1H-индол-3-пропанамидом, N-[[1-[(4-хлорфенил)метил]-4-пиперидинил]метил]-a-[(3-этоксибензоил)амино].
Соединение (aR) 1H-индол-3-пропанамид, N-[[1-[(4-хлорфенил)метил]-4-пиперидинил]метил]-a-[(3-этоксибензоил)амино] описано в WO 9925686.
В другом аспекте изобретение относится к фармацевтическим композициям, которые содержат соединение формулы (I) или его фармацевтически приемлемую соль, пролекарство или сольват и фармацевтически приемлемые носитель, адъювант или наполнитель. В предпочтительном варианте осуществления композиция является пероральной.
Настоящее изобретение также относится к применению определенных выше соединений при изготовлении лекарственного препарата предпочтительно для лечения когнитивных расстройств, таких как старческое слабоумие, цереброваскулярное слабоумие, легкое расстройство восприятия, расстройство, связанное с дефицитом внимания, и/или нейродегенеративное слабоумие с отклоняющимися от нормы агрегациями белка, особенно болезнь или состояние Альцгеймера, или прионовое нейродегенеративное заболевание, такое как болезнь Крейтцфельдта-Якоба или болезнь Герстманна-Штраусслера-Шейнкера.
Еще в одном аспекте изобретение относится к применению определенных выше соединений в качестве реактивов для биологических анализов.
Еще в одном аспекте изобретение относится к способу получения соединения формулы I, приведенной выше, посредством амидирования реагента, содержащего гетероциклическую часть, при помощи части аминсодержащего 4-замещенного пиперидина.
Типичные соединения по изобретению селективно ингибируют бутирилхолинэстеразу с очевидным отличием на несколько порядков величины от ингибирования AChE, как показано в примерах.
В приведенном выше определении соединений формулы (I) нижеследующие термины имеют следующие значения.
Термин  алкил алкил относится к радикалу с прямой или разветвленной углеводородной цепью, состоящей из атомов углерода и водорода, при отсутствии насыщенности, имеющему один-восемь атомов углерода, который присоединен к остальной части молекулы одинарной связью, например метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил и т.д. Алкильные радикалы могут быть необязательно замещены одним или несколькими заместителями, такими как галоген, гидрокси, алкокси, карбокси, циано, карбонил, ацил, алкоксикарбонил, амино, нитро, меркапто и алкилтио. относится к радикалу с прямой или разветвленной углеводородной цепью, состоящей из атомов углерода и водорода, при отсутствии насыщенности, имеющему один-восемь атомов углерода, который присоединен к остальной части молекулы одинарной связью, например метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил и т.д. Алкильные радикалы могут быть необязательно замещены одним или несколькими заместителями, такими как галоген, гидрокси, алкокси, карбокси, циано, карбонил, ацил, алкоксикарбонил, амино, нитро, меркапто и алкилтио.
Термин  амино амино относится к радикалу формулы -NH2, -NHRa или -NRaRb, где Ra и Rb определены выше. относится к радикалу формулы -NH2, -NHRa или -NRaRb, где Ra и Rb определены выше.
Термин  арил арил относится к фенильному, нафтильному, инденильному, фенантрильному или антрацильному радикалу предпочтительно фенильному или нафтильному радикалу. Арильный радикал может быть необязательно замещен одним или несколькими заместителями, такими как гидрокси, меркапто, галоген, алкил, фенил, алкокси, галогеналкил, нитро, циано, диалкиламино, аминоалкил, ацил и алкоксикарбонил, как определено в настоящем описании. относится к фенильному, нафтильному, инденильному, фенантрильному или антрацильному радикалу предпочтительно фенильному или нафтильному радикалу. Арильный радикал может быть необязательно замещен одним или несколькими заместителями, такими как гидрокси, меркапто, галоген, алкил, фенил, алкокси, галогеналкил, нитро, циано, диалкиламино, аминоалкил, ацил и алкоксикарбонил, как определено в настоящем описании.
Термин  аралкил аралкил относится к арильной группе, соединенной с алкильной группой. Предпочтительные примеры включают бензил и фенетил. относится к арильной группе, соединенной с алкильной группой. Предпочтительные примеры включают бензил и фенетил.
Термин  ацил ацил относится к радикалу формулы -C(O)-Rc и -CO)-Rd, где Rc представляет собой алкильный радикал, определенный выше, и Rd представляет собой арильный радикал, определенный выше, например ацетил, пропионил, бензоил и тому подобное. относится к радикалу формулы -C(O)-Rc и -CO)-Rd, где Rc представляет собой алкильный радикал, определенный выше, и Rd представляет собой арильный радикал, определенный выше, например ацетил, пропионил, бензоил и тому подобное.
Термин  циклоалкил циклоалкил относится к стабильному 3-10-членному моноциклическому или бициклическому радикалу, который является насыщенным или частично насыщенным и который состоит исключительно из атомов углерода и водорода. Если в описании особо не оговорено иное, термин относится к стабильному 3-10-членному моноциклическому или бициклическому радикалу, который является насыщенным или частично насыщенным и который состоит исключительно из атомов углерода и водорода. Если в описании особо не оговорено иное, термин  циклоалкил циклоалкил подразумевает включение циклоалкильных радикалов, которые необязательно замещены одним или несколькими заместителями, такими как алкил, галоген, гидрокси, амино, циано, нитро, алкокси, карбокси и алкоксикарбонил. подразумевает включение циклоалкильных радикалов, которые необязательно замещены одним или несколькими заместителями, такими как алкил, галоген, гидрокси, амино, циано, нитро, алкокси, карбокси и алкоксикарбонил.
Термин  конденсированный арил конденсированный арил относится к арильной группе, главным образом фенильной или гетероарильной группе, конденсированной с еще одним кольцом. относится к арильной группе, главным образом фенильной или гетероарильной группе, конденсированной с еще одним кольцом.
Термин  алкокси алкокси относится к радикалу формулы -ORa, где Ra представляет собой алкильный радикал, определенный выше, например метокси, этокси, пропокси и т.д. относится к радикалу формулы -ORa, где Ra представляет собой алкильный радикал, определенный выше, например метокси, этокси, пропокси и т.д.
Термин  галоген галоген относится к брому, хлору, иоду или фтору. относится к брому, хлору, иоду или фтору.
Термин  гетероциклил гетероциклил относится к стабильному 3-15-членному циклическому радикалу, который состоит из атомов углерода и от одного до пяти гетероатомов, выбранных из группы состоящей из азота, кислорода и серы, предпочтительно 4-8-членному кольцу с одним или несколькими гетероатомами, более предпочтительно 5- или 6-членному кольцу с одним или несколькими гетероатомами. Учитывая цели данного изобретения, гетероцикл может быть моноциклической, бициклической или трициклической кольцевой системой, которая может включать конденсированные кольцевые системы; и атомы азота, углерода или серы в гетероциклильном радикале необязательно могут быть окисленными; атом азота необязательно может быть кватернизирован; и гетероциклильный радикал может быть частично или полностью насыщенным или ароматическим. Примеры таких гетероциклов включают, но без ограничения, азепины, бензимидазол, бензотиазол, фуран, изотиазол, имидазол, индол, пиперидин, пиперазин, пурин, хинолин, тиадиазол, тетрагидрофуран. относится к стабильному 3-15-членному циклическому радикалу, который состоит из атомов углерода и от одного до пяти гетероатомов, выбранных из группы состоящей из азота, кислорода и серы, предпочтительно 4-8-членному кольцу с одним или несколькими гетероатомами, более предпочтительно 5- или 6-членному кольцу с одним или несколькими гетероатомами. Учитывая цели данного изобретения, гетероцикл может быть моноциклической, бициклической или трициклической кольцевой системой, которая может включать конденсированные кольцевые системы; и атомы азота, углерода или серы в гетероциклильном радикале необязательно могут быть окисленными; атом азота необязательно может быть кватернизирован; и гетероциклильный радикал может быть частично или полностью насыщенным или ароматическим. Примеры таких гетероциклов включают, но без ограничения, азепины, бензимидазол, бензотиазол, фуран, изотиазол, имидазол, индол, пиперидин, пиперазин, пурин, хинолин, тиадиазол, тетрагидрофуран.
Ссылки в настоящем описании на замещенные группы в соединениях по настоящему изобретению относятся к обозначенной части, которая может быть замещена в одном или нескольких подходящих положениях одной или несколькими подходящими группами, например галогеном, таким как фтор, хлор, бром и иод; циано; гидроксилом; нитро; азидо; алканоилом, таким как Cl-6алканоильная группа, например ацил и тому подобное; карбоксамидо; алкильными группами, включающими такие группы, которые имеют от 1 до приблизительно 12 атомов углерода или от 1 до, приблизительно, 6 атомов углерода и более предпочтительно, 1-3 атома углерода; алкенильными и алкинильными группами, включающими группы, имеющие одну или несколько ненасыщенных связей и от 2 до, приблизительно, 12 атомов углерода или от 2 до, приблизительно, 6 атомов углерода; алкоксигруппами, имеющими одну или несколько кислородных связей и от 1 до, приблизительно, 12 атомов углерода, или от 1 до, приблизительно, 6 атомов углерода; арилокси, такими как фенокси; алкилтиогруппами, включающими части, имеющие одну или несколько тиоэфирных связей и от 1 до, приблизительно, 12 атомов углерода или от 1 до, приблизительно, 6 атомов углерода; алкилсульфинильными группами, включающими части, имеющие одну или несколько сульфинильных связей и от 1 до, приблизительно, 12 атомов углерода или от 1 до, приблизительно, 6 атомов углерода; алкилсульфонильными группами, включающими части, имеющие одну или несколько сульфонильных связей и от 1 до, приблизительно, 12 атомов углерода или от 1 до, приблизительно, 6 атомов углерода; аминоалкильными группами, такими как группы, имеющие один или несколько атомов N и от 1 до, приблизительно, 12 атомов углерода или от 1 до, приблизительно, 6 атомов углерода; карбоциклическим арилом, имеющим 6 или более атомов углерода, в частности фенилом или нафтилом, и аралкилом, таким как бензил. Если не оговорено иное, необязательно замещенная группа может иметь заместитель в каждом замещаемом положении группы, и каждое замещение является независимым от других замещений.
Предпочтительно, когда в соединениях формулы I связующее звено содержит алкиленовые единицы между частями, как в соединениях следующей формулы II
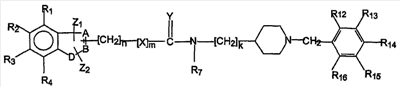
формула II
где A, B, D, Z1, Z2, X, Y, n, m, k и R1-R16 являются такими, как определено выше.
В еще одном варианте осуществления предпочтительно, когда в соединениях формулы I связующее звено содержит амидные функциональные группы.
В следующем варианте осуществления гетероциклическая часть представляет собой индолоподобный гетероцикл, такой как в соединениях формулы III
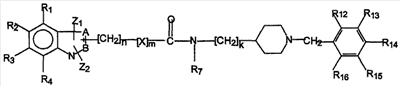
формула III
где A, B, Z1, Z2, X, Y, n, m, k и R1-R16 определены выше. Атом N гетероцикла может быть дополнительно замещен, например, алкилом, аралкилом и т.д.
В еще одном варианте осуществления атом N в пиперидине замещен бензильной группой. В этом случае соединения, предпочтительно, представлены формулой IV
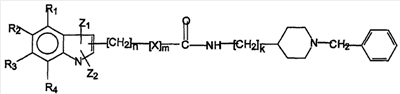
формула IV
где Z1, Z2, X, n, m, k и R1-R4 определены выше.
В этом случае индольный гетероцикл, предпочтительно, соединен со связывающим звеном через положение 3. В предпочтительном варианте, который, в частности, демонстрирует хорошую селективность и активность, m равен 0 и n равен 2.
В следующем варианте осуществления X, предпочтительно, является -CH2– или -O-.
В еще одном варианте осуществления к, предпочтительно, равен 2.
Некоторые соединения по изобретению, из которых соединение 5 является предпочтительным вследствие его хорошей активности и селективности, приведены в примерах.
Если не оговорено иное, то полагают, что соединения по изобретению, кроме того, включают соединения, которые отличаются только наличием одного или нескольких атомов, обогащенных изотопами. Например, соединения, отвечающие настоящим структурам, за исключением того, что водород заменен дейтерием или тритием, или углерод заменен углеродом 13C- или 14C-, или соединения, обогащенные азотом 15N-, включены в объем настоящего изобретения.
Термин  фармацевтически приемлемые соли, производные, сольваты, пролекарства фармацевтически приемлемые соли, производные, сольваты, пролекарства относится к любой фармацевтически приемлемой соли, сложному эфиру, сольвату или любому другому соединению, которое при введении реципиенту способно (прямо или косвенно) обеспечить поступление соединения, описанного в данном описании. Однако будет понятно, что фармацевтически неприемлемые соли также включены в объем изобретения, так как они могут оказаться полезными при получении фармацевтически приемлемых солей. Получение солей, пролекарств и производных может быть осуществлено способами, известными в данной области. относится к любой фармацевтически приемлемой соли, сложному эфиру, сольвату или любому другому соединению, которое при введении реципиенту способно (прямо или косвенно) обеспечить поступление соединения, описанного в данном описании. Однако будет понятно, что фармацевтически неприемлемые соли также включены в объем изобретения, так как они могут оказаться полезными при получении фармацевтически приемлемых солей. Получение солей, пролекарств и производных может быть осуществлено способами, известными в данной области.
Например, фармацевтически приемлемые соли соединений, предлагаемые в настоящем изобретении, синтезируют из исходного химического соединения, содержащего основную или кислотную часть, с помощью общепринятых химических способов. Обычно такие соли, например, получают взаимодействием свободных кислотных или основных форм указанных соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или органическом растворителе или в их смеси. Обычно неводная среда, такая как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил являются предпочтительными. Примеры аддитивных солей кислоты включают аддитивные соли минеральных кислот, такие как, например, гидрохлорид, гидробромид, гидроиодид, сульфат, нитрат, фосфат, и аддитивные соли органических кислот, такие как, например, ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метансульфонат и п-толуолсульфонат. Примеры аддитивных солей оснований включают неорганические соли, такие как, например, соли натрия, калия, кальция, аммония, магния, алюминия и лития, и соли органических оснований, такие как, например, этилендиамин, этаноламин, N,N-диалкиленэтаноламин, триэтаноламин, глюкамин, и соли основных аминокислот.
Особенно предпочтительными производными или пролекарствами являются такие, которые улучшают биодоступность соединений по изобретению при введении таких соединений пациенту (например, кровь более легко абсорбирует соединение при его пероральном введении) или которые ускоряют доставку исходного соединения к биологическому компартменту (например, мозговая или лимфатическая система), по сравнению с доставкой самого исходного соединения.
Любое соединение, которое является пролекарством соединения формулы (I), включено в объем изобретения. Термин  пролекарство пролекарство использован в его наиболее широком значении и охватывает производные, которые in vivo превращаются в соединения по изобретению. Такие производные очевидны для специалистов в данной области и включают, в зависимости от функциональных групп, присутствующих в молекуле, но без ограничения, следующие производные настоящих соединений: сложные эфиры, сложные эфиры аминокислот, сложные эфиры ортофосфорной кислоты, металлические соли сложных эфиров бензосульфокислоты, карбоматы и амиды. использован в его наиболее широком значении и охватывает производные, которые in vivo превращаются в соединения по изобретению. Такие производные очевидны для специалистов в данной области и включают, в зависимости от функциональных групп, присутствующих в молекуле, но без ограничения, следующие производные настоящих соединений: сложные эфиры, сложные эфиры аминокислот, сложные эфиры ортофосфорной кислоты, металлические соли сложных эфиров бензосульфокислоты, карбоматы и амиды.
Соединения по изобретению могут находиться в кристаллической форме или в виде свободных соединений, или в виде сольватов, и обе формы включены в объем настоящего изобретения. Способы сольватации, вообще говоря, известны в данной области. Подходящими сольватами являются фармацевтически приемлемые сольваты. В конкретном варианте осуществления сольват представляет собой гидрат.
Соединения формулы (I) или их соли, или сольваты, предпочтительно, находятся в фармацевтически приемлемой или, по существу, чистой форме. Под фармацевтически приемлемой формой подразумевают форму, inter alia, имеющую фармацевтически приемлемый уровень чистоты, исключая обычные фармацевтические добавки, такие как разбавители и носители, и не содержащую веществ, которые считают токсичными при обычном уровне дозирования. Уровни чистоты веществ лекарственных средств, предпочтительно, превышают 50%, более предпочтительно, превышают 70%, наиболее предпочтительно, превышают 90%. В предпочтительном варианте осуществления уровень чистоты соединения формулы (I) или его солей, сольватов или пролекарств составляют 95%.
Соединения по настоящему изобретению, представляемые описанной выше формулой (I), в зависимости от присутствия хирального центра, могут включать энантиомеры или, в зависимости от наличия кратных связей, изомеры (например, Z, E). Отдельные изомеры, энантиомеры или диастереоизомеры и их смеси включены в объем настоящего изобретения.
Соединения формулы (I), определенные выше, могут быть получены с помощью подходящих методик синтеза из фрагментов, содержащих гетероциклические и пиперидиновые части, соединяя их с образованием необходимого связующего звена между ними, такого как
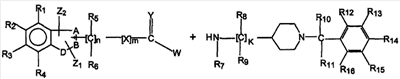
где заместители являются такими, как определено выше, и W представляет собой уходящую группу.
Например, они могут быть получены амидированием производных индолкарбоновой кислоты соединениями аминопиперидина, такими как описано Padwa. A. et al., в Synthesis, 9, 1994, 993-1004. Общий метод синтеза карбоматов описан, например, Bruce, A.; Spangle, L.A.; Kaldor, S.W.; в Tetrahedron Letters, 1996, 7, 937-940.
При необходимости продукты реакции могут быть очищены общепринятыми методами, такими как кристаллизация или хроматография. Там, где описанные выше способы получения соединений по изобретению приводят к получению смесей стереоизомеров, эти изомеры могут быть разделены с помощью общепринятых методов, таких как препаративная хроматография. При наличии хирального центра соединения могут быть получены в рацемической форме, или индивидуальные энантиомеры могут быть получены с помощью энантиоспецифичного синтеза или посредством повторного растворения.
Одной предпочтительной фармацевтически приемлемой формой является кристаллическая форма, включая такую форму в фармацевтической композиции. В случае солей и сольватов, дополнительные части, ионные и растворителя, также должны быть нетоксичны. Соединения по изобретению могут представлять собой различные полиморфные формы; имеется в виду, что изобретение охватывает все такие формы.
Соединения, представляемые приведенной выше формулой (I) по настоящему изобретению, их соли, их сольваты или пролекарства обнаруживают высшую ингибирующую активность по отношению к бутирилхолинэстеразе. Поэтому еще один аспект изобретения относится к способу лечения, улучшающему или предотвращающему заболевание или состояние, связанное с BuChE; включающему введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) или его фармацевтической композиции. Среди заболеваний, которые могут быть подвергнуты лечению, находятся такие когнитивные расстройства, как старческое слабоумие, цереброваскулярное слабоумие, легкое расстройство восприятия, расстройство, связанное с дефицитом внимания, и/или нейродегенеративное слабоумие с отклоняющимися от нормы агрегациями белка, особенно болезнь или состояние Альцгеймера, или прионовое нейродегенеративное заболевание, такое как болезнь Крейтцфельдта-Якоба или болезнь Герстманна-Штраусслера-Шейнкера.
Настоящее изобретение, кроме того, предлагает фармацевтические композиции, содержащие соединение по изобретению или его фармацевтически приемлемую соль, производное, пролекарство или его стереоизомеры вместе с фармацевтически приемлемым носителем, адъювантом или наполнителем, предназначенные для введения пациенту.
Примеры фармацевтических композиций включают любые твердые (таблетки, пилюли, капсулы, гранулы и т.д.) или жидкие (растворы, суспензии или эмульсии) композиции для перорального, местного или парентерального введения.
В предпочтительном варианте осуществления фармацевтические композиции находятся в пероральной форме, твердой или жидкой. Пригодные дозированные формы для перорального введения могут быть таблетками, капсулами, сиропами или растворами и могут содержать общепринятые эксципиенты, известные в данной области, такие как связующие агенты, например сироп, аравийская камедь, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактоза, сахар, маисовый крахмал, фосфат кальция, сорбит или глицин; таблетированные лубриканты, например стеарат магния; дезинтегранты, например крахмал, поливинилпирролидон, натрийкрахмалгликолят или микрокристаллическая целлюлоза; или фармацевтически приемлемые увлажняющие агенты, такие как лаурилсульфат натрия.
Твердые пероральные композиции могут быть получены обычными способами составления смесей, наполнения или таблетирования. Повторные операции смешивания могут быть использованы для распределения активного агента по всем таким композициям, используя большие количества наполнителей. Такие операции являются общепринятыми в данной области. Таблетки, например, могут быть получены посредством влажного или сухого гранулирования и необязательно покрыты оболочкой, способами, хорошо известными в обычной фармацевтической практике, в частности энтеросолюбильной оболочкой.
Фармацевтические композиции также могут быть приспособлены для парентерального введения, такие как стерильные растворы, суспензии или лиофилизованные продукты в соответствующей единичной дозированной форме. Могут быть использованы адекватные эксципиенты, такие как агенты, увеличивающие объем, буферирующие агенты или поверхностно-активные вещества.
Указанные препараты будут получать, используя стандартные методы, которые описывают или на которые ссылаются в Spanish and US Pharmacopoeias и аналогичных справочных текстах.
Введение соединений или композиций по настоящему изобретению может быть осуществлено любым пригодным способом, таким как внутривенное вливание, использование пероральных препаратов и интраперитониальным и внутривенным введением. Пероральное введение является предпочтительным из-за удобства для пациента и хронического характера заболеваний, подлежащих лечению.
Обычно эффективное количество вводимого соединения по изобретению будет зависеть от относительной эффективности выбранного соединения, тяжести расстройства, подлежащего лечению, и массы пациента. Однако активные соединения обычно вводят один или несколько раз в день, например 1, 2, 3 или 4 раза, ежедневно, в обычной общей дневной дозе, находящейся в интервале от 0,1 до 1000 мг/кг/день.
Для осуществления комбинированной терапии соединения и композиции по данному изобретению могут быть использованы вместе с другими лекарственными средствами. Другие лекарственные средства могут составлять часть той же самой композиции или могут быть предусмотрены как отдельная композиция для одновременного введения или введения в разное время.
Следующие примеры являются дополнительной иллюстрацией изобретения, их не следует рассматривать как ограничивающие настоящее изобретение.
ПРИМЕРЫ
Пример 1. Получение соединений
Соединения 1-6 получали, как показано на схеме 1
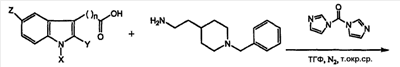 
К раствору производных индолкарбоновой кислоты в ТГФ добавляли 1,1‘-карбонилдиимидазол в атмосфере N2, смесь перемешивали в течение 4 часов при комнатной температуре; затем добавляли амин, полученный раствор перемешивали в течение 20 часов; затем растворитель выпаривали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь растворителей в соотношении, указанном для каждого отдельного случая.
(l) N-[2-(l-Бензилпиперидин-4-ил)этил]-2-(1H-индол-3-ил)-ацетамид
Реагенты: индол-3-уксусная кислота (152,4 мг, 0,87 ммоль), 3 мл ТГФ, 1,1′-карбонилдиимидазол (149,2 мг, 0,92 ммоль), и 2-(1-бензилпиперидин-4-ил)этиламин (200 мг, 0,92 ммоль). Условия: комнатная температура, в течение ночи. Очистка: колоночная хроматография на силикагеле, используя AcOEt/MeOH (2:1). Выход: 110 мг (35%).
1H-ЯМР (CDCl3, 400 МГц, (м.д.): (8,53, ушир., 1H), (7,50, д, 1H, J=7,6 Гц), (7,35, д, 1H, J=7,6), (7,26-7,17, м, 6H), (7,11-7,08, м, 2H), (5,65, м, 1H, NHCO), (3,70, с, 2H), (3,43, с, 2H), (3,16, c, 2H, J=6,8), (2,77-2,74, м, 2H), (1,81-1,75, м, 2H), (1,48-1,45, м, 2H), (1,25-1,20, м, 2H), (1,31-1,06, м, 3H). 13C-ЯМР (CDCl3): 171,4, 138,0, 136,4, 129,3, 128,1, 127,0, 126,39, 123,7, 122,6, 120,0, 118,7, 111,4, 109,0, 63,3, 53,5, 37,2, 36,0, 33,4, 33,2, 32,0.
Электрораспылительная ионизация (ESI)-МС [M+H+]+ 375,23.
(2) N-[2-(1-Бензилпиперидин-4-ил)этил]-2-(1-метил-1H-индол-3-ил)ацетамид
Реагенты: 1-метилиндол-3-карбоновая кислота (165 мг, 0,87 ммоль), 3 мл ТГФ, 1,1′-карбонилдиимидазол (149,2 мг, 0,92 ммоль) и 2-(1-бензилпиперидин-4-ил)этиламин (200 мг, 0,92 ммоль).
Условия: комнатная температура, в течение ночи. Очистка: колоночная хроматография на силикагеле, используя AcOEt/MeOH (3:1). Выход: 40 мг (12%).
1H-ЯМР (CDCl3, 400 МГц, (м.д.): (7,42, д, 1H, J=7,6 Гц), (7,25-7,13, м, 7H), (7,11-7,08, м, 1H), (6,70, с, 1H), (5,48, м, 1H, NHCO), (3,70, с, 3H), (3,60, с, 2H), (3,37, с, 2H), (3,16, м, 2H), (2,75-2,68, м, 2H), (1,70-1,80, м, 2H), (1,40-1,48, м, 2H), (1,43-1,10, м, 2H), (1,10-1,01, м, 3H). 13C-ЯМР (CDCl3): 171,4, 137,0, 129,3, 129,2, 128,3, 128,1, 127,35, 126,9, 122,1, 119,5, 118,8, 109,4, 107,4, 63,3, 53,5, 37,1, 36,0, 33,2, 32,3, 32,0.
ESI-МС [M+H+]+ 389,25.
(3) N-[2-(1-Бензилпиперидин-4-ил)этил]-2-(2-метил-1H-индол-3-ил)ацетамид
Реагенты: 2-метилиндол-3-карбоновая кислота (165 мг, 0,87 мг), 3 мл ТГФ, 1,1′-карбонилдиимидазол (149,2 мг, 0,92 мг) и 2-(1-бензилпиперидин-4-ил)этиламин (200 мг, 0,92 мг).
Условия: комнатная температура, в течение ночи. Очистка: колоночная хроматография на силикагеле, используя AcOEt/MeOH (5:0.02). Выход: 153 мг (46%).
1H-ЯМР (CDCl3, 400 МГц, (м.д.): (8,53, ушир., 1H), (7,42, д, 1H, J=7,6 Гц), (7,25-7,20, м, 5H), (7,18-7,01, м, 3H), (5,62, м, 1H, NHCO), (3,62, с, 2H), (3,42, с, 2H), (3,20-3,10, м, 2H), (2,80-2,72, м, 2H), (2,32, с, 3H), (1,82-1,75, м, 2H), (1,5-1,44, м, 2H), (1,15-1,10, м, 2H) (1,20-1,05, м, 3H). 13C-ЯМР (CDCl3): 171,5, 137,2, 129,2, 128,0, 126,9, 122,4, 119,7, 117,6, 110,5, 104,3, 63,3, 53,5, 37,0, 35,8, 33,2, 32,1, 31,9, 11,4.
ESI-МС [M+H+]+389,25.
(4) N-[2-(1-Бензилпиперидин-4-ил)этил]-2-(5-бром-1H-индол-3-ил)ацетамид
Реагенты: 5-броминдол-3-уксусная кислота (221 мг, 0,87 ммоль), 3 мл ТГФ, 1,1′-карбонилдиимидазол (149,2 мг, 0,92 ммоль) и 2-(1-бензилпиперидин-4-ил)этиламин (200 мг, 0,92 ммоль).
Условия: комнатная температура, в течение ночи. Очистка: колоночная хроматография на силикагеле, используя AcOEt/MeOH (5:0,1). Выход: 60 мг (15%).
1H-ЯМР (CDCl3, 400 МГц, (м.д.): (9,3, ушир.с, 1H), (7,65, с, 1H), (7,29-7,20, м, 7H), (7,10, с, 1H), (5,71, м, 1H, NHCO), (3,65, с, 2H), (3,46, с, 2H), (3,25-3,17, м, 2H), (2,85-2,76, м, 2H), (1,88-1,80, м, 2H), (1,56-1,48, м, 2H), (1,32-1,48, м, 2H), (1,10-1,01, м, 3H). 13C-ЯМР (CDCl3): 170,6, 137,8, 134,7, 129,0, 128,4, 127,8, 126,6, 125,1, 124,6, 121,0, 112,9, 112,6, 108,3, 63,1, 53,2, 37,0, 35,6, 33,0, 32,9, 32,6.
ESI-МС [M+H+]+453,14.
(5) N-[2-(1-Бензилпиперидин-4-ил)этил]-3-(1H-индол-3-ил)пропионамид
Реагенты: 3-индолпропионовая кислота (156 мг, 0,82 ммоль), 3 мл ТГФ, 1,1′-карбонилдиимидазол (141 мг, 0,87 ммоль) и 2-(1-бензилпиперидин-4-ил)этиламин (188 мг, 0,87 ммоль).
Условия: комнатная температура, в течение ночи. Очистка: колоночная хроматография на силикагеле, используя AcOEt/MeOH (1:0,1). Выход: 134,4 мг (42%).
1H-ЯМР (CDCl3, 400 МГц, (м.д.): (8,85, с, 1H), (7,52, д, 1H, J=8 Гц), (7,25-7,20, м, 6H), (7,13-7,10, м, 1H), (7,06-7,02, с, 1H), (6,84, с, 1H), (5,67, м, 1H, NHCO), (3,45, с, 2H), (3,14-3,04, м, 4H), (2,81-2,78, м, 2H), (2,51-2,47, м, 2H), (1,87-1,81, м, 2H), (1,50-1,47, м, 2H), (1,25-1,09, м, 5H). 13C-ЯМР (CDCl3): 172,3, 137,9, 136,4, 129,4, 128,2, 127,0, 121,9, 121,8, 119,0, 118,6, 114,5, 111,4, 63,4, 53,6, 37,5, 37,3, 36,2, 33,4, 32,0, 21,7.
ESI-МС [M+H+]+389,25.
(6) N-[2-(1-Бензилпиперидин-4-ил)этил]-4-(1H-индол-3-ил)бутирамид
Реагенты: 3-индолмасляная кислота (175,1 мг, 0,86 ммоль), 3 мл ТГФ, 1,1′-карбонилдиимидазол (146,0 мг, 0,90 ммоль) и 2-(1-бензилпиперидин-4-ил)этиламин (200 мг, 0,92 ммоль).
Условия: комнатная температура, в течение ночи. Очистка: колоночная хроматография на силикагеле, используя AcOEt/MeOH (1:1). Выход: 95 мг (30%).
1H-ЯМР (CDCl3, 400 МГц, (м.д.): (8,65, с, 1H), (7,53, д, 1H, J=7,6 Гц), (7,28-7,21, м, 6H), (7,14-7,10, м, 1H), (7,06-7,10, м, 1H), (6,70, м, 1H), (5,58, м, 1H, NHCO), (3,44, с, 3H), (3,18-3,13, м, 2H), (2,84-2,81, с, 2H), (2,76-2,72, м, 2H), (2,16-2,13, м, 2H), (2,01-1,97, м, 2H), (1,90-1,85, м, 2H), (1,59-1,56, м, 2H), (1,34-1,18, м, 4H). 13C-ЯМР (CDCl3): 173,1, 137,8, 136,3, 129,2, 129,1, 128,0, 127,33, 126,9, 121,6, 118,8, 118,6, 115,1, 111,2, 63,2, 53,5, 37,1, 36,1, 33,2, 32,0, 26,0, 24,4.
ESI-МС [M+H+]+ 403,26.
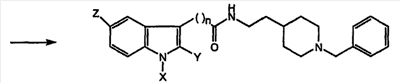
Соединение (7) получают, как показано на схеме 2
Схема 2
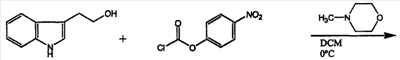 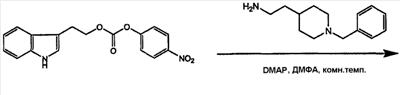 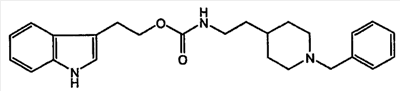
(7) 2-(1H-индол-3-ил)этиловый эфир [2-(1-бензилпиперидин-4-ил)этил]карбаминовой кислоты
К раствору 2-(1H-индол-3-ил)этанола (500 мг, 3,10 ммоль) в N-метилморфолине (627 мг, 62 ммоль) добавляли п-нитрофенилхлорформиат (1250 нмг, 6,2 ммоль), смесь перемешивали в течение 24 часов при комнатной температуре, затем осадок промывали водой, экстрагировали дихлорметаном, и осадок очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь ДХМ/гексан (3:1). 2-(1-Бензилпиперидин-4-ил)этиламин (700 мг, 3,21 ммоль) растворяли в ДМФА и затем сочетали с активированным карбонатом (522 мг, 1,60 ммоль) в присутствии DMAP (диметиламинофенол), (40 мг, 3,21 ммоль). Смесь перемешивали в течение 24 часов при комнатной температуре, затем растворитель выпаривали при пониженном давлении. Затем остаток промывали водой и экстрагировали дихлорметаном. Затем остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь ДХМ/MeOH (4:0,5), с получением соединения 7. Выход составлял 286 мг (44%).
1H-ЯМР (CDCl3, 400 МГц, (м.д.): (8,26, ушир.с, 1H), (7,59, м, 1H), (7,31-7,21, м, 5H), (7,18-7,10, м, 1H), (7,09-7,02, м, 1H), (6,80, м, 1H), (4,46, м, 1H, NHCO), (3,48, с, 2H), (3,12-3,10, м, 2H), (3,08-3,0, м, 2H), (2,90-2,84, м, 4H), (1,99-1,80, м, 2H), (1,52-1,5, м, 2H), (1,49-1,20, м, 5H). 13C-ЯМР (CDCl3): 157,0, 136,5, 129,6, 128,4, 127,2, 122,3, 122,2, 119,5, 119,0, 112,4, 111,4, 65,1, 63,5, 53,8, 38,9, 36,8, 33,4, 32,2, 25,5.
ESI-МС [M+H+]+ 405,24.
Пример 2. Биологические анализы
Ингибирование бутирилхолинэстеразы (BuChE) (из сыворотки крови человека)
Ингибирующую активность по отношению к BuChE оценивали при 30°C с помощью колориметрического метода, описанного Ellman [Ellman G.L.; Courtney K.D.; Andres В.; Featherstone, R.M. Biochem. Pharmacol. 1961, 7, 88-95]. Анализируемый раствор состоял из 0,1 единиц/мл BuChE из сыворотки крови человека, 0,1M натрийфосфатного буфера с pH 8, 0,3 мМ 5,5′-дитиобис(2-нитробензойной кислоты) (DTNB, реагент Эллмана) и 0,5 мМ бутирилтиохолиниодида, в качестве субстрата ферментативной реакции. Ферментативную активность определяли, измеряя в течение 5 минут спектральную поглощательную способность при 405 нм с помощью микропланшет-ридера Digiscan 340T. Тестируемые соединения предварительно в течение 10 минут инкубировали с ферментом при 30°C. Скорость реакции вычисляли, по крайней мере, по трехкратным измерениям. «IC50» обозначает концентрацию каждого соединения, при которой ферментативная активность снижается на 50% по сравнению с ферментативной активностью, наблюдаемой при отсутствии ингибиторов. Результаты показаны в таблице 1.
Ингибирование ацетилхолинэстеразы (AChE) (из телячьих эритроцитов)
Ингибирующую активность по отношению к AChE оценивали при 30°C с помощью колориметрического метода, описанного Ellman [Ellman G.L.; Courtney K.D.; Andres В.; Featherstone, R.M.Biochem. Pharmacol. 1961, 7, 88-95]. Анализируемый раствор состоял из 0,1 M фосфатного буфера с pH 8, 0,3 мМ 5,5′-дитиобис(2-нитробензойной кислоты) (DTNB, реагент Эллмана), 0,2 единиц/мл AChE (из телячьих эритроцитов, от компании Sigma Chemical Co.) и 0,5 мМ ацетилтиохолиниодида, в качестве субстрата ферментативной реакции. Тестируемые соединения добавляли к анализируемому раствору и предварительно инкубировали с ферментом при 30°C в течение 5 мин. По завершении этого периода добавляли субстрат. Изменение спектральной поглощательной способности при 405 нм регистрировали в течение 5 мин с помощью микропланшет-ридера Digiscan 340T. Скорости реакций сравнивали и вычисляли процент ингибирования, обусловленного присутствием тестируемых соединений. Скорость реакции вычисляли, по крайней мере, по трехкратным измерениям, и процент ингибирования, обусловленный присутствием тестируемого соединения, вычисляли относительно контрольного соединения, не содержащего тестируемого соединения. Определяли концентрацию соединения, вызывающую 50% ингибирование AChE (IC50). Результаты приведены в таблице 1.
Измерение токсичности
Цитотоксичное действие молекул тестировали, используя клетки линии SH-SY5Y нейробластомы человека. Указанные клетки культивировали в 96-лунковых планшетах в 1:1 смеси Ham’s F12 нутриентов и поддерживающей среды (MEM) с добавлением 10% фетальной телячьей сыворотки и 1% смеси пенициллин/стрептомицин и выращивали при 37°C в СО2-инкубаторе (5%) с увлажнением.
Клетки высевали, по крайней мере, за 48 часов до измерения токсичности, помещая 104 клеток в каждую лунку. Клетки подвергали действию различных концентраций соединений (от 10-5 до 10-9) в течение 24 часов. Количественную оценку гибели клеток получали, измеряя внутриклеточный фермент лактатдегидрогеназу (LDH) (набор Roche для определения цитотоксичности). Количество LDH измеряли и вычисляли при 492 и 620 нм на микропланшет-ридере Anthos 2010. За контроль была принята 100% жизнеспособность. Результаты показаны в таблице 1.
Определение конкурентного связывания по пропидию
Обнаруживают возрастание флуоресценции пропидия при связывании его с периферическим сайтом AChE, что делает его полезным в качестве зонда при определении конкурентного связывания лигандов с ферментом.
Флуоресценцию измеряли на планшет-ридере Fluostar optima (BMG). Измерения осуществляли в растворе объемом 100 мкл, в 96-лунковых планшетах. Используемый буфер представлял собой 1 мМ Tris/HCl с pH 8,0. 5 мкМ AchE инкубировали с молекулами при разных концентрациях, по крайней мере, в течение 6 часов. 20 мкМ пропидийиодида добавляли в течение 10 мин перед измерением флуоресценции. Длина волны возбуждающего света составляла 485 нм, и длина волны излучения составляла 620 нм. Результаты показаны в таблице 1.
Как можно понять из таблицы, была достигнута очень высокая степень ингибирующей активности по отношению к BChE. Селективность по отношению к AChE составляет, по крайней мере, два порядка величины, в случае соединения 5, она составляет 5 порядков.
Формула изобретения
1. Соединение формулы I
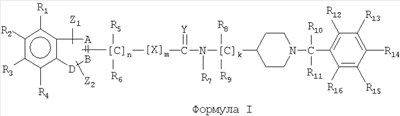
где А, В представляют собой С;
D выбирают из N;
Х выбирают из -CRaRb-, -O-;
Y выбирают из О;
Z1 и Z2 независимо выбирают из водорода, замещенного или незамещенного алкила, имеющего от 1 до 8 атомов,
R1-R4 независимо выбирают из водорода или галогена;
R5-R16 независимо представляют собой водород;
где Ra и Rb независимо представляют собой водород;
n равен 1-3;
m равен 0 или 1;
k равен 2;
или его фармацевтически приемлемая соль или сольват;
при условии, что соединение не является (aR) 1H-индол-3-пропанамидом, N-[[1-[(4-хлорфенил)метил]-4-пиперидинил]метил]-а-[(3-этоксибензоил)амино].
2. Соединение по п.1, где m равен 1, Х является -СН2– или -О-, или его фармацевтически приемлемая соль или сольват.
3. Соединение по п.1, где m равен 0 и n равен 2, или его фармацевтически приемлемая соль или сольват.
4. Фармацевтическая композиция, ингибирующая бутирилхолинэстеразу (BuChE), содержащая соединение формулы (I) или его фармацевтически приемлемую соль или сольват по любому из пп.1-3 и фармацевтически приемлемые носитель, адъювант или наполнитель.
5. Фармацевтическая композиция по п.4 для перорального введения.
6. Применение соединения по любому из пп.1-3 при изготовлении лекарственного средства для лечения заболевания и состояния, опосредованного бутирилхолинэстеразой.
7. Применение по п.6, где лекарственное средство предназначено для лечения когнитивных расстройств, таких как старческое слабоумие, цереброваскулярное слабоумие, легкое расстройство восприятия, расстройство, связанное с дефицитом внимания, и/или нейродегенеративное слабоумие с отклоняющимися от нормы агрегациями белка, особенно болезнь или состояние Альцгеймера, или прионовое нейродегенеративное заболевание, такое как болезнь Крейтцфельдта-Якоба или болезнь Герстманна-Штраусслера-Шейнкера.
8. Применение по п.6, где лекарственное средство предназначено для лечения болезни или состояния Альцгеймера.
9. Применение соединений, по любому из пп.1-3, в качестве реактивов для биологических анализов для ингибирования бутирилхолинэстеразы.
10. Способ получения соединения по любому из пп.1-3, включающий взаимодействие двух соединений:
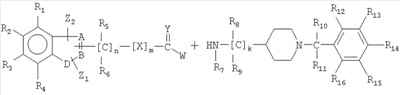
где А, В, D, Z1, Z2, X, Y, n, m, k и R1-R16 имеют значения, определенные в п.1, и W является уходящей группой.
|
|