Патент на изобретение №2386625
|
||||||||||||||||||||||||||
(54) АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ КАК ПРОТИВОВОСПАЛИТЕЛЬНЫЕ, ИММУНОМОДУЛИРУЮЩИЕ И АНТИПРОЛИФЕРАТИВНЫЕ СРЕДСТВА
(57) Реферат:
Изобретение относится к соединениям общей формулы (II), и его фармацевтически приемлемым солям, к их применению и фармацевтической композиции на их основе. В соединениях общей формулы (II)
А представляет собой гетероароматическую 5-членную циклическую систему, содержащую одну группу X, выбранную из группы, состоящей из S и О; Z1 и Z2, независимо один от другого, представляют собой О; R2 представляет собой OR6; R6 представляет собой Н; R8 представляет собой водород или (С1-С6)алкил; Е представляет собой фенил, необязательно замещенный 1-4 заместителями, представляющими собой галоген; Y представляет собой фенил, необязательно замещенный 1-2 заместителями, выбранными из галогена, (С1-С6)алкокси или галоген((С1-С6))алкилокси; m равен 0; n равен 0; q равен 0; t равен 0; или его фармацевтически приемлемые соли. Технический результат – ароматические соединения формулы (II) для ингибирования дигидрооротат-дегидрогеназы. 4 н. и 2 з.п. ф-лы.
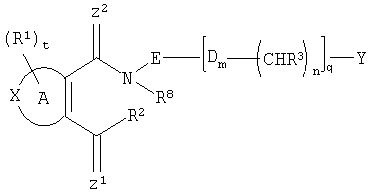
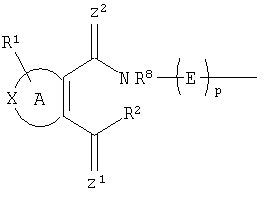
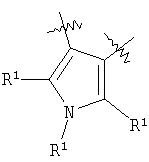
Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениям, которые можно использовать в качестве противовоспалительных, иммуномодулирующих и антипролиферативных средств. В частности, изобретение относится к новым соединениям, которые ингибируют дигидрооротат-дегидрогеназу (DHODH), способу их получения, содержащим их фармацевтическим композициям и их применению для лечения и предупреждения заболеваний, в частности к их применению при заболеваниях, при которых благоприятно ингибирование дигидрооротат-дегидрогеназы (DHODH). Уровень техники Ревматоидный артрит (RA) является болезнью, которая вполне обычна, особенно среди населения старшего возраста. Его лечение обычными лечебными средствами, такими как, например, нестероидные противовоспалительные средства, не является удовлетворительным. Ввиду повышения возраста населения, особенно в развитых странах Запада или в Японии, разработка новых лечебных средств для лечения RA крайне необходима. В WO 99/38846 и ЕР 0646578 раскрываются соединения, о которых сообщается, что они пригодны для лечения RA. Лекарственное средство против ревматоидного артрита с новым механизмом действия лефлуномид (leflunomide) недавно выпущено на рынок компанией Aventis под торговым названием ARAVA [ЕР 780128, WO 97/34600]. Лефлуномид обладает иммуномодулирующими, а также противовоспалительными свойствами [ЕР 217206, DE 2524929]. Механизм действия основан на ингибировании дигидрооротат-дегидрогеназы (DHODH) – фермента биосинтеза пиримидинов. В организме DHODH катализирует синтез пиримидинов, которые необходимы для роста клеток. Ингибирование DHODH подавляет рост (паталогически) быстро пролиферирующих клеток, в то время как клетки, которые растут с нормальной скоростью, могут получать необходимые им пиримидиновые основания из нормального метаболического цикла. Наиболее важные типы клеток для иммунного ответа – лимфоциты используют исключительно синтез пиримидинов для своего роста и реагируют особенно чувствительно на ингибирование DHODH. Вещества, ингибирующие рост лимфоцитов, являются важными лекарственными средствами для лечения аутоиммунных болезней. Лефлуномид (ARAVA), ингибирующий DHODH, является первым лекарственным средством такого класса соединений (лефлуномидов) для лечения ревматоидного артрита. WO 99/45926 также является ссылкой, в которой раскрываются соединения, действующие как ингибиторы DHODH. В ЕР 463444, WO 98/57937, ЕР 150034, Nucleosides & Nucleotides, 1997, 16 (10 & 11), 2025-2033; Egyptian Journal of Pharmaceutical Sciences, 1991, 32 (1-2), 331-339; Journal für Praktische Chemie. 1991, 333 (4), 619-624, Archievs of Pharmacal Research, 1990, 13 (4), 338-341, Sulfur Letters. 1988, 7 (4), 127-136, Synthesis, 1988, 6, 449-452, Sulfur Letters, 1987, 7(19). 19-24, Archiev der Pharmazie, 1987, 320 (12), 1281-1283, Natl. Def. Med. Cent, 1983, 35 (1), 57-64, и Sch. Pharm. Sei, 1977, 97 (4), 410-415 описывается ряд пятичленных ароматических циклических систем, конденсированных с замещенным малеимидом. Целью настоящего изобретения являются альтернативные эффективные средства, которые можно применять для лечения болезней, при которых требуется ингибирование DHODH. Соответственно, найден новый класс соединений с ингибирующим действием на DHODH, в частности на DHODH человека. Настоящее изобретение также относится к соединениям общей формулы (II)
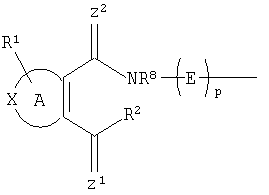
где А представляет собой гетероароматическую 5-членную циклическую систему, содержащую одну или несколько групп X, выбранных из группы, состоящей из S, О, N, NR4, SO2 и SO; D представляет собой О, S, SO2, NR4 или СН2; Z1 и Z2, независимо один от другого, представляют собой О, S или NR5; R1 представляет, независимо, Н, галоген, галогеналкил, галогеналкилокси, -CO2R”, -SO3H, -ОН, -CONR*R”, -CR”O, -SO2-NR*R”, -NO2, -SO2R”, -SO-R*, -CN, алкокси, алкилтио, арил, -NR”-CO2-R’, -NR”-CO-R*, -NR”-SO2-R’, -O-CO-R*, -O-CO2-R*, -O-CO-NR*R”; циклоалкил, алкиламино, гидроксиалкиламино, -SH, гетероарил или алкил; R* представляет, независимо, Н, алкил, циклоалкил, аминоалкил, алкокси, -ОН, -SH, алкилтио, гидроксиалкил, галогеналкил, галогеналкилокси, арил или гетероарил; R’ представляет, независимо, Н, -CO2R” -CONHR”, -CR”O, -SO2-NR”, -NR”-CO-галогеналкил, -NO2. -NR”-SO2-галогеналкил, -NR”-SO2-алкил, -SO2-алкил, -NR”-СО-алкил, -CN, алкил, циклоалкил, аминоалкил, алкиламино, алкокси, -ОН, -SH, алкилтио, гидроксиалкил, гидроксиалкиламино, галоген, галогеналкил, галогеналкилокси, арил, арилалкил или гетероарил; R” представляет, независимо, водород, галогеналкил, гидроксиалкил, алкил, циклоалкил, арил, гетероарил или аминоалкил; R2 представляет собой Н или OR6, NHR7, NR7OR7, или R2 вместе с атомом азота, который присоединяется к R8, образует 5- или 6-членное гетероциклическое кольцо, при условии, что R2 представляет собой -[CH2]s, и R8 отсутствует; R3 представляет собой Н, алкил, циклоалкил, арил, алкокси, O-арил, O-циклоалкил, галоген, аминоалкил, алкиламино, гидроксиламино, гидроксилалкил, галогеналкилокси, гетероарил, алкилтио, S-арил, S-циклоалкил, арилалкил или галогеналкил; R4 представляет собой Н, алкил, циклоалкил, арил или гетероарил; R5 представляет собой Н, ОН, алкокси, O-арил, алкил или арил; R6 представляет собой Н, алкил, циклоалкил, арил, арилалкил, гетероарил, алкиларил, алкоксиалкил, ацилметил, (ацилокси)алкил, несимметричный (ацилокси)алкилдиэфир или диалкилфосфат; R7 представляет собой Н, ОН, алкил, арил, алкокси, O-арил, циклоалкил или O-циклоалкил; R8 представляет собой водород или алкил; Е представляет собой алкильную или циклоалкильную группу или одноядерную или многоядерную замещенную или незамещенную циклическую систему, которая может содержать одну или несколько групп X и которая содержит, по меньшей мере, один ароматический цикл; Y представляет собой водород, галоген, галогеналкил, галогеналкилокси, алкил, циклоалкил, одноядерную или многоядерную замещенную или незамещенную циклическую систему, которая может содержать одну или несколько групп X и которая содержит, по меньшей мере, один ароматический цикл или
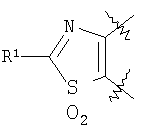
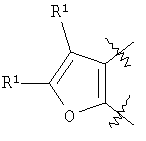
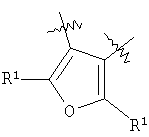
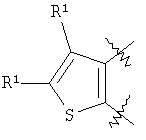
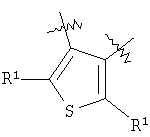
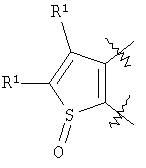
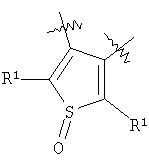
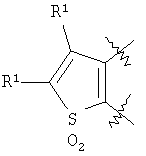
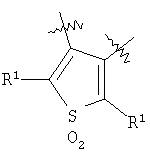
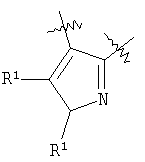
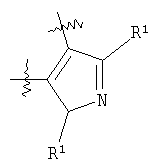
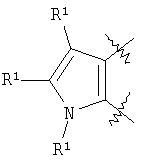
m равен 0 или 1; n равен 0 или 1; p равен 0 или 1; q равен 0 или 1; s равен 0-2; и t равен 0-3, при условии, что исключаются следующие соединения: соединения, где цикл А содержит пять атомов, Z1=Z2=О, и R2 вместе с атомом азота, который присоединяется к R8, образует 5-членное гетероциклическое кольцо, при условии, что R2 представляет собой -[CH2]s, и R8 отсутствует, и s равен 0; соединения, где цикл А содержит три атома углерода и два атома азота, Z1=Z2=О, и R2 вместе с атомом азота, который присоединяется к R8, образует 5-членное гетероциклическое кольцо, при условии, что R2 представляет собой -[СН2]s, и R8 отсутствует, и s равен 0; 4-[4-(нафталин-2-ил)тиазол-2-иламинокарбонил]фуран-3-карбоновая кислота и 5-[4-(нафталин-2-ил)тиазол-2-иламинокарбонил]-2Н-[1,2,3]триазол-4-карбоновая кислота. Алкильная группа, если не оговорено иное, обозначает линейный или разветвленный (С1-С6)-алкил, предпочтительно, линейную или разветвленную цепь с одним-пятью атомами углерода, линейную или разветвленную (С1-С6)-алкенильную или линейную или разветвленную (С1-С6)-алкинильную группу, которая, необязательно, может быть замещена одним или несколькими заместителями R’, предпочтительно, галогеном. (С1-С6)-Алкильный, (С1-С6)-алкенильный и (С1-С6)-алкинильный остаток можно выбрать из группы, состоящей из -СН3, -С2Н5, -СН=СН2, -С -CH2-C -СН(СН3)-С4Н9, -СН2-СН(СН3)-С3Н7, -СН(СН3)-СН2-СН(СН3)2, -СН(СН3)-СН(СН3)-С2Н5, -СН2-СН(СН3)-СН(СН3)2, -СН2-С(СН3)2-С2Н5, -С(СН3)2-С3Н7, -С(СН3)2-СН(СН3)2, -С2Н4-С(СН3)3, -СН(СН3)-С(СН3)3, -С4Н8-СН=СН2, -СН=СН-С4Н9, -С3Н6-СН=СН-СН3, -СН2-СН=СН-С3Н7, -С2Н4-СН=СН-С2Н5, -СН2-С(СН3)=С(СН3)2, -С2Н4-СН=С(СН3)2, -С4Н8-С R’ представляет, независимо, Н, -CO2R”, -CONHR”, -CR”O, -SO2NR”, -NR”-CO-галогеналкил, -NO2, -NR”-SO2-галогеналкил, -NR”-SO2-алкил, -SO2-алкил, -NR”CO-алкил, -CN, алкил, циклоалкил, аминоалкил, алкиламино, алкокси, -ОН, -SH, алкилтио, гидроксиалкил, гидроксиалкиламино, галоген, галогеналкил, галогеналкилокси, арил, арилалкил или гетероарил. R” представляет, независимо, водород, галогеналкил, гидроксиалкил, алкил, циклоалкил, арил, гетероарил или аминоалкил. Циклоалкильная группа обозначает неароматическую циклическую систему, содержащую три-восемь атомов углерода, предпочтительно – четыре-восемь атомов углерода, где один или несколько атомов углерода в цикле могут быть замещены группой X, причем Х имеет значения, указанные выше; (С3-С8)-циклоалкильный остаток можно выбрать из группы, состоящей из -цикло-С3Н5, -цикло-С4Н7, -цикло-С5Н9, -цикло-С6Н11, -цикло-С7Н13, -цикло-С8Н15. Алкоксигруппа обозначает О-алкильную группу, причем алкильная группа имеет значения, указанные выше; алкоксигруппа представляет собой, предпочтительно, метокси-, этокси-, изопропокси-, трет-бутокси- или пентоксигруппу. Алкилтиогруппа обозначает S-алкильную группу, причем алкильная группа имеет значения, указанные выше. Галогеналкильная группа обозначает алкильную группу, замещенную одним-пятью атомами галогена, причем алкильная группа имеет значения, указанные выше; галогеналкильная группа представляет собой, предпочтительно, -С(R10)3, -CR10(R10′)2, -CR10(R10′)R10”, -C2(R10)5, -CH2-C(R10)3, -CH2-CR10(R10′)2, -CH2-CR10(R10′)R10”, -С3(R10)7 или -C2H4-C(R10)3, где R10, R10′, R10 Гидроксиалкильная группа обозначает НО-алкильную группу, причем алкильная группа имеет значения, указанные выше. Галогеналкилоксигруппа обозначает алкоксигруппу, замещенную одним-пятью атомами галогена, причем алкильная группа имеет значения, указанные выше; галогеналкилоксигруппа представляет собой, предпочтительно, -ОС(R10)3, -OCR10(R10′)2, -OCR10(R10′)R10”, -OC2(R10)5, -OCH2-C(R10)3, -OCH2-CR10(R10′)2, -OCH2-CR10(R10′)R10″, -ОС3(R10)7 или -OC2H4-C(R10)3, где R10, R10′, R10” представляют F, Cl, Br или I, предпочтительно, F. Гидроксиалкиламиногруппа обозначает группу (НО-алкил)2-N- или НО-алкил-NH-, причем алкильная группа имеет значения, указанные выше. Алкиламиногруппа обозначает HN-алкильную или N-диалкильную группу, причем алкильная группа имеет значения, указанные выше. Галогеногруппа представляет собой хлор, бром, фтор или йод, причем предпочтительным является фтор. Арильная группа, предпочтительно, обозначает ароматическую группу с пятью-пятнадцатью атомами углерода, которая, необязательно, может быть замещена одним или несколькими заместителями R’, где R’ имеет значения, указанные выше. Арильная группа, предпочтительно, представляет собой фенильную группу, -CH2-Ph, -C2H4Ph, -CH=CH-Ph, -C Гетероарильная группа обозначает 5- или 6-членную гетероциклическую группу, содержащую, по меньшей мере, один гетероатом, подобный О, N, S. Такая гетероциклическая группа может быть конденсирована с другим циклом. Например, такую группу можно выбрать из числа тиазол-2-ила, тиазол-4-ила, тиазол-5-ила, изотиазол-3-ила, изотиазол-4-ила, изотиазол-5-ила, 1,2,4-оксадиазол-3-ила, 1,2,4-оксадиазол-5-ила, 1,2,4-тиадиазол-3-ила, 1,2,4-тиадиазол-5-ила, 1,2,5-оксадиазол-3-ила, 1,2,5-оксадиазол-4-ила, 1,2,5-тиадиазол-3-ила, 1-имидазолила, 2-имидазолила, 1,2,5-тиадиазол-4-ила, 4-имидазолила, 1-пирролила, 2-пирролила, 3-пирролила, 2-фуранила, 3-фуранила, 2-тиенила, 3-тиенила, 2-пиридила, 3-пиридила, 4-пиридила, 2-пиримидинила, 4-пиримидинила, 5-пиримидинила, 3-пиридазинила, 4-пиридазинила, 2-пиразинила, 1-пиразолила, 3-пиразолила, 4-пиразолила, 1Н-тетразол-2-ила, 1H-тетразол-3-ила, тетразолила, индолила, индолинила, бензо[b]фуранила, бензо[b]тиофенила, бензимидазолила, бензотиазолила, хиназолинила, хиноксазолинила или, предпочтительно, хинолинильной, тетрагидрохинолинильной, изохинолинильной, тетрагидроизохинолинильной группы. Такая гетероциклическая группа, необязательно, может быть замещена одним или несколькими заместителями R’, где R’ имеет значения, указанные выше. Значение Е включает необязательно замещенные одним или несколькими заместителями R’ алкильные группы, где алкил имеет значения, указанные выше, или циклоалкильную группу, необязательно замещенную одним или несколькими заместителями R’, такую как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, или карбоциклические ароматические группы, такие как фенил, 1-нафтил, 2-нафтил, антраценил, в частности, 1-антраценил и 2-антраценил, и гетероциклические ароматические группы, такие как N-имидазолил, 2-имидазолил, 2-тиенил, 3-тиенил, 2-фуранил, 3-фуранил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 2-пиранил, 3-пиранил, 4-пиранил, 3-пиразолил, 4-пиразолил, 5-пиразолил, 2-пиразинил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-оксазолил, 4-оксазолил и 5-оксазолил. Е также включает конденсированные ароматические многоядерные циклические системы, такие как 9Н-тиоксантен-10,10-диоксид, в которых карбоциклическое ароматическое ядро или гетероарильный цикл конденсированы с одним или несколькими другими гетероарильными циклами. Изобретение также относится к фармацевтической композиции, содержащей соединение формулы (II), включая соединения, ранее исключенные, в свободной форме или в форме фармацевтически приемлемых солей и физиологически функциональных производных, вместе с их фармацевтически приемлемыми разбавителями или носителями. Термин “физиологически функциональное производное”, используемый в данном описании, относится к соединениям, которые сами не являются фармацевтически активными, но которые превращаются в их фармацевтически активную форму in vivo, т.е. в организме субъекта, которому вводят соединение. Примерами физиологически функциональных производных являются пролекарства, такие как описанные ниже в настоящей заявке. В другом аспекте настоящее изобретение также относится к способу лечения или профилактики состояния, при котором выгодно ингибирование дигидроорогат-дегидрогеназы (DHODH), включающему введение эффективного количества соединения формулы (II) и его физиологически приемлемых солей или физиологически функциональных производных. Изобретение также относится к применению соединений формулы (II) и их фармакологически переносимых солей или физиологически функциональных производных для получения лекарственного средства для предупреждения и лечения болезней, при которых благоприятно ингибирование биосинтеза пиримидинов. Кроме того, настоящее изобретение относится к способам получения соединений изобретения, таких как соединения формулы (II). Соединения формулы (II) можно получить различными способами. В предпочтительных воплощениях изобретения используют способ синтеза производных формулы (II), приведенный далее. Способ 1 Синтез диметиловых эфиров дикарбоновых кислот, описанный в WO 02/07655. Данный диметиловый эфир дикарбоновой кислоты может быть замещен по циклической системе так, как описано в Т.Harrison et al., Tetrahedron, Vol.45, No.16, 1989, 5247-5262. Такой диметиловый эфир дикарбоновой кислоты затем можно превратить в соответствующий ангидрид. Затем полученные ангидриды можно ввести во взаимодействие с соответствующими аминами и получить нужные амиды формулы (II). Такие реакционные стадии аналогичны реакционным стадиям, описанным в WO 02/07655. Соединения формулы (II), в каждом случае [г=0], можно синтезировать аналогично четырем способам, описанным в WO 02/07655. Кроме того, настоящее изобретение относится к способам получения нужных гидроксамовых кислот формулы (II). Способ синтеза соединений формулы (II) включает превращение кислоты в соответствующий хлорангидрид и взаимодействие хлорангидрида с гидроксиламином (Watanabe et al., 1989, J. Org. Chem., 54, 17, 4088-4097; Shishido et al., 1992, J. Org. Chem., 57, 10, 2876-2883). Другие способы получения соединений формулы (II) описываются в Woo et al., 2002, J. Med. Chem., 45, 2877-2885; Knorr et al., 1989, Tetrahedron Lett., 30, 1927-1930; Carpino, 1993, J. Am. Chem. Soc., 115, 4397-4398, и Albericio et al., J. Org. Chem., 63, 9678-9683. Еще одним способом получения соединений формулы (II) является взаимодействие соответствующего сложного эфира с гидроксиламином, описанное в Stowell et al., 1995, J. Med. Chem., 38, 8, 1411-1413. Синтез амидов формулы (II) описывается J, Zabicky в “The Chemistry of Amides”, в цикле работ S.Patai (ed.), “The Chemistry of Functional Groups”, John Wiley & Sons, p.74-131. Способы получения тиоамидов описываются в Houben-Weyl, J.Falbe (ed.), G.Thieme Verlag, vol.E5, p.1219-59. Способы получения сульфамидов описываются в Caldwell et al., J. Am. Chem. Soc. 1944, 66, 1479-82, или в Flynn et al., Med. Chem. Res., 1998, 8, 219-43, и в Dziadulewicz et al., Bioorg. Med. Chem. Lett., 2001, 11, 5, 705-10. Кроме того, настоящее изобретение относится к способам получения соединений формулы (II), где А представляет собой гетероциклическую систему. Например, 3,4-дикарбоновые кислоты тиофена, фурана и пиррола превращают в соответствующие ангидриды и вводят во взаимодействие с аминами по аналогии с DE 3933573 и D.P.Arnold, Aust. J. Chem., 44, 1991, 323-330. 3-Карбоксамид-2-карбоновые кислоты или 2-карбоксамид-2-карбоновые кислоты тиофена, фурана и пиррола синтезируют из 3-карбоновых кислот или 2-карбоновых кислот соответственно путем амидирования ацильной группы и последующего направленного орто-металлирования в положении 2 или 3 соответственно, с последующим добавлением диоксида углерода как электрофильного соединения согласно DE 3933573. Различным образом 4,5-замещенные 2,3-пирролдикарбоновые кислоты и их эфиры получают согласно процедурам, описанным в литературе: a) 1-гидрокси-4,5-диметилзамещенные: из диалкилацетилендикарбоксилатов и монооксимов бутан-2.3-дионов, I.Yavari et al., Synth. Commun., 26, 1996, 4495-4499; b) 3-гидрокси-4-алкил или -арилзамещенные: из диалкилацетилендикарбоксилатов и эфиров аминокислот, Р.Kolar et al., Synth. Commun., 24, 1994, 1887-1893; c) смешанные 4,5-алкил/арилзамещенные: из диалкилацетилендикарбоксилатов и арил- или бензилгидразонов, J.Barluenga et al., Synthesis, 1975, 642-643; d) 4-метилзамещенные: из N-ацетонилфталимида и диэтилоксалацетата, R.E.Lancaster et al., J. Org. Chem., 23, 1958, 1208-1209. Пирролдиэфиры можно превратить в соответствующие кислоты и ангидриды дополнительными реакциями амидирования или превратить непосредственно в соответствующие моногидразинокарбонилы (М.Т.Garcia-Lopez et al., J. Chem. Soc. Perkin Trans., 1978, 483-487). Диэтил-2-алкил-, -арил- или -аминотиазол-4,5-карбоксилаты синтезируют из диэтил- Все диэфиры превращают в моноамиды так, как описано выше. Смеси региоизомеров, получающиеся при реакции амидирования, следует разделить. Ароматические системы, содержащие атом серы в ароматическом скелете, можно превратить в соответствующие S-монооксиды или -диоксиды окислением вышеуказанных гетероциклов м-хлорбензойной кислотой, причем или с добавлением или без добавления эфирата трифторбората (N.Furukawa et al., Heterocycles, 44, 1997, 61-66). Изобретение также относится к способам получения соединений формулы (II), где R2 вместе с атомом азота, который присоединяется к R8, образует 6-членную гетероциклическую систему. Например, диэтил-3-ацетил-2-метилфуран-4,5-дикарбоксилат получают из ацетилированных метилидов сульфония и диэтилацетилендикарбоксилата согласно Tetrahedron, 26, 1970, 4353-4360. Диэфир превращают в соответствующий ангидрид, который затем вводят во взаимодействие с амином, как описано выше, и получают смесь региоизомеров для продуктов моноамидирования. После этерификации карбоновой кислоты с использованием дициклогексилкарбодиимида, 4-диметиламинопиридина- и этанола в метиленхлориде два региоизомера разделяют и осуществляют а-бромирование по ацетилфункциональной группе этил-3-ацетил-2-метил-4-карбоксамидфуран-5-карбоксилата или бромом в метиленхлориде или дибромидом меди в этилацетате аналогично процедурам, описанным в литературе: S.Laufer et al., Arch. Pharm., 330, 1997, 307-312; S.K.C.Devi et al., Synth. Commun., 32, 2002, 1523-1528. Конечного замыкания цикла достигают с использованием гидрида натрия в тетрагидрофуране, и эфир омыляют в нейтральной среде с использованием фенилтиола и фторида калия в 1-метил-2-пирролидиноне (М.К.Nayak et al., Chem. Lett., 1998, 297-298). В соединениях формулы (II) ароматическая циклическая система А содержит 5 атомов углерода. В предпочтительном воплощении соединения настоящего изобретения содержат две сопряженные двойные связи. Один или несколько атомов углерода в циклической системе А могут быть заменены группой X, где Х выбирают из группы, состоящей из S, О, N, NR4, SO, CO или SO2. В предпочтительном воплощении в соединениях формулы (II) ароматическую циклическую систему А выбирают из группы, состоящей из
В соединениях формулы (II) R1, предпочтительно, представляет собой Н, ОН, СО2Н или SO3H или тетразол. В соединениях формулы (II) R2 представляет собой, предпочтительно, ОН, NH2, NHOH, NHR7, NR7OR7 или OR6. В предпочтительном воплощении в соединениях формулы (II) R6 представляет собой бензоилоксиметил, изобутирилоксиметил, 4-аминобутирилоксиметил, бутирилоксиметил, 1-(бутирилокси)этил, 1-(бутирилокси)-2,2-диметилпропил, 1-диэтилфосфонооксиэтил, 2-(2-метоксиэтокси)ацетилоксиметил, п-аминобензоилметил, никотинилоксиметил, пивалилоксиметил, глутарилоксиметил, [2-(2-метоксиэтокси)этокси]ацетилоксиметил, 2-(морфолин-4-ил)этил, 1-диэтилфосфонооксиметил. В соединениях формулы (II) R3 представляет собой Н, алкил, циклоалкил, арил, алкокси, O-арил, O-циклоалкил, галоген, аминоалкил, алкиламино, гидроксиламино, галогеналкил, гидроксилалкил, галогеналкилокси, гетероарил, алкилтио, S-арил, S-циклоалкил, арилалкил, предпочтительно, Н. В соединениях формулы (II) R4 представляет собой Н, алкил, циклоалкил, арил или гетероарил, предпочтительно – Н. В формуле (II) R8 представляет собой Н или алкил, предпочтительно, Н или метил. В формуле (II) Z1 и Z2, независимо друг от друга, представляют собой О, S или NR5, предпочтительно, они оба представляют собой О. В формуле (II) Y представляет собой водород, галоген, алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный Е, замещенный или незамещенный O-Е, замещенный или незамещенный O-алкиларил, замещенный или незамещенный O-арилалкил; в случае указанного замещения предпочтительно замещение одного или нескольких атомов водорода алкильных, циклоалкильных или арильных групп атомами галогенов. Y также может представлять собой
где А, X, R1, R2. R8, Z1, Z2 и р имеют значения, указанные выше. Предпочтительно, Y представляет собой Е, и предпочтительнее, Y представляет собой необязательно замещенный фенил. В формуле (II) Е представляет собой алкильную или циклоалкильную группу, необязательно замещенную одним или несколькими заместителями R’, или Е представляет собой одноядерную или многоядерную замещенную или незамещенную циклическую систему, содержащую, по меньшей мере, один ароматический цикл, и которая может также содержать одну или несколько групп X, выбранных из числа S, О, N, NR4, SO или SO2. В предпочтительном воплощении Е представляет собой одноядерный ароматический цикл или ароматическую двухъядерную или трехъядерную циклическую систему или циклоалкил. В случае замещений атомов углерода в циклической системе, предпочтительно, один, два или три атома углерода заменяют на группу X, имеющую указанные выше значения. В формуле (II) Е, предпочтительно, представляет собой необязательно замещенный одним или несколькими заместителями R’ фенил, 1-нафтил, 2-нафтил, 1-антрацил или 2-антрацил. В предпочтительном воплощении настоящего изобретения в соединениях формулы (II) Е представляет собой необязательно замещенный одним или несколькими заместителями R’ фенил или необязательно замещенный одним или несколькими заместителями R’ циклоалкил. В формуле (II) предпочтительными заместителями R’ являются нитро, галоген, алкокси, галогеналкил, галогеналкилокси, гетероарил, алкил или арил, предпочтительнее, R’ представляет собой Br, F, Cl, CF3, OCF3, этокси или метокси. В формуле (II) предпочтительными гетероарильными группами являются имидазолил, тиенил, фуранил, пиридил, пиримидил, пиранил, пиразолил, пиразинил, тиазолил, 1Н-тетразол-2-ил, 1H-тетразол-3-ил или оксазолил. В формуле (II) t, предпочтительно, равен 0, 1 или 2. В формуле (II) s, предпочтительно, равен 0 или 1. В соединениях формулы (II) D представляет собой О, S, SO2, NR4 или CH2, D, предпочтительно, представляет собой S, или предпочтительнее, О, когда m=1. В другом предпочтительном воплощении в соединениях формулы (II) m и q равны нулю, и Y представляет собой водород, галоген, галогеналкил, галогеналкилокси, алкил, цилокалкил или Е, предпочтительно, F, CF3, OCF3, фенил, необязательно замещенный одним или несколькими заместителями R’, или предпочтительнее, фенил, необязательно замещенный одним или несколькими F, Cl, метокси. CF3 или OCF3. В формуле (II) q равен 0-10, предпочтительно, q равен 0, 1 или 2. Если q равен 1, и n равен 0 или 1, D, предпочтительно, представляет собой О (таким образом, m=1). В особенно предпочтительном воплощении изобретения в соединениях формулы (II) q=0, t=1, Z1=О, Z2=О, и А представляет собой моноамид тиофен-2,3-дикарбоновой кислоты, Y представляет собой Н или F, или Е представляет собой фенил, который является или незамещенным, или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3. В другом особенно предпочтительном воплощении изобретения в соединениях формулы (II) q=0, t=1, Z1=О, Z2=О, А представляет собой моноамид тиофен-2,3-дикарбоновой кислоты, и Е и Y представляют собой замещенный или незамещенный фенилен и фенил соответственно. В еще одном особенно предпочтительном воплощении в соединениях формулы (II) D=О (таким образом, m=1), R3 представляет собой Н (таким образом, n=1), q=1, t=1, Z1=О, Z2=О, и Е представляет собой фенилен, который является или незамещенным или замещен Cl, F и/или CF3 или OCF3, Y представляет собой фенил, который также является или незамещенным или замещен Cl, F и/или CF3, ОСН3, OCH2CH3 или OCF3, и А представляет собой моноамид тиофен-2,3-дикарбоновой кислоты. В еще одном особенно предпочтительном воплощении в соединениях формулы (II) D=О (таким образом, m=1), n=0, q=1, t=1, Z1=О, Z2=О, и Е представляет собой фенилен, который является или незамещенным или замещен Cl, F и/или CF3, или OCF3, Y представляет собой фенил, который также является или незамещенным или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3, и А представляет собой моноамид тиофен-2,3-дикарбоновой кислоты. В еще одном особенно предпочтительном воплощении в соединениях формулы (II) D=S (таким образом, m=1), n=0, q=1, t=1, Z1=О, Z2=О (таким образом, г=1), и Е представляет собой фенилен, который является или незамещенным или замещен Cl, F и/или CF3 или OCF3, Y представляет собой фенил, который также является или незамещенным или замещен Cl, F и/или CF3, ОСН3, OCH2CH3 или OCF3, и А представляет собой моноамид тиофен-2,3-дикарбоновой кислоты. В особенно предпочтительном воплощении изобретения в соединениях формулы (II) q=0, t=1, Z1=О, Z2=О, и А представляет собой моноамид фуран-3,4-дикарбоновой кислоты, Y представляет собой Н или F, или Е представляет собой фенил, который является или незамещенным или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3. В другом особенно предпочтительном воплощении изобретения в соединениях формулы (II) q=0, t=1, Z1=О, Z2=О, и А представляет собой моноамид фуран-3,4-дикарбоновой кислоты, и Е и Y представляют собой замещенный или незамещенный фенилен и фенил соответственно. В еще одном особенно предпочтительном воплощении в соединениях формулы (II) D=О (таким образом, m=1), R3 представляет собой Н (таким образом, n=1), q=1, t=1, Z1=О, Z2=О, и Е представляет собой фенилен, который является или незамещенным или замещен Cl, F и/или CF3 или OCF3, Y представляет собой фенил, который также является или незамещенным или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3, и А представляет собой моноамид фуран-3,4-дикарбоновой кислоты. В еще одном особенно предпочтительном воплощении в соединениях (II) D=О (таким образом, m=1), n=0, q=1, t=1, Z1=O, Z2=O, и E представляет собой фенилен, который является или незамещенным или замещен Cl, F и/или CF3 или OCF3, Y представляет собой фенил, который также является или незамещенным или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3, и А представляет собой моноамид фуран-3,4-дикарбоновой кислоты. В еще одном особенно предпочтительном воплощении в соединениях формулы (II) D=S (таким образом, m=1), n=0, q=1, t=1, Z1=O, Z2=О (таким образом, г=1), и Е представляет собой фенилен, который является или незамещенным или замещен Cl, F и/или CF3 или OCF3, Y представляет собой фенил, который также является или незамещенным или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3, и А представляет собой моноамид фуран-3,4-дикарбоновой кислоты. В особенно предпочтительном воплощении изобретения в соединениях формулы (II) q=0, t=1, Z1=О, Z2=О, и А представляет собой пятичленную ароматическую циклическую систему, где один атом углерода заменен О, или Y представляет собой Н или F, и Е представляет собой фенил, который является или незамещенным или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3, В другом особенно предпочтительном воплощении изобретения в соединениях формулы (II) q=0, t=1, Z1=О, Z2=О, и А представляет собой пятичленную ароматическую циклическую систему, где один атом углерода заменен О, или Е и Y представляют собой замещенный или незамещенный фенилен и фенил соответственно. В еще одном особенно предпочтительном воплощении в соединениях формулы (II) D=О (таким образом, m=1), R3 представляет собой Н (таким образом, n=1), q=1, t=1, Z1=О, Z2=О, и Е представляет собой фенилен, который является или незамещенным, или замещен Cl, F и/или CF3 или OCF3, Y представляет собой фенил, который также является или незамещенным, или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3, или OCF3, и А представляет собой пятичленную ароматическую циклическую систему, где один атом углерода заменен О. В еще одном особенно предпочтительном воплощении в соединениях формулы (II) D=О (таким образом, m=1), n=0, q=1, t=1, Z1=О, Z2=О, и Е представляет собой фенилен, который является или незамещенным или замещен Cl, F и/или СН3 или OCF3, Y представляет собой фенил, который также является или незамещенным, или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3, или OCF3, и А представляет собой пятичленную ароматическую циклическую систему, где один атом углерода заменен О. В еще одном особенно предпочтительном воплощении в соединениях формулы (II) D=S (таким образом, m=1), n=0, q=1, t=1, Z1=O, Z2=О, и Е представляет собой фенилен, который является или незамещенным или замещен Cl, F и/или CF3 или OCF3, Y представляет собой фенил, который также является или незамещенным, или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3, и А представляет собой пятичленную ароматическую циклическую систему, где один атом углерода заменен О. В особенно предпочтительном воплощении изобретения в соединениях формулы (II) q=0, t=1, Z1=О, Z2=О, и А представляет собой пятичленную ароматическую циклическую систему, где один атом углерода заменен S, или Y представляет собой Н или F, и Е представляет собой фенил, который является или незамещенным, или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3. В другом особенно предпочтительном воплощении изобретения в соединениях формулы (II) q=0, t=1, Z1=О, Z2=О, и А представляет собой пятичленную ароматическую циклическую систему, где один атом углерода заменен S, или Е и Y представляют собой замещенный или незамещенный фенилен и фенил соответственно. В еще одном особенно предпочтительном воплощении в соединениях формулы (II) D=О (таким образом, m=1), R3 представляет собой Н (таким образом, n=1). q=1, t=1, Z1=О, Z2=О, и Е представляет собой фенилен, который является или незамещенным, или замещен Cl, F и/или CF3 или OCF3, Y представляет собой фенил, который также является или незамещенным, или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3, и А представляет собой пятичленную ароматическую циклическую систему, где один атом углерода заменен S. В еще одном особенно предпочтительном воплощении в соединениях формулы (II) D=О (таким образом, m=1), n=0, q=1, t=1, Z1=О, Z2=О, и Е представляет собой фенилен, который является или незамещенным, или замещен Cl, F и/или CF3 или OCF3, Y представляет собой фенил, который также является или незамещенным, или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3, и А представляет собой пятичленную ароматическую циклическую систему, где один атом углерода заменен S. В еще одном особенно предпочтительном воплощении в соединениях формулы (II) D=S (таким образом, m=1), n=0, q=1, t=1, Z1=О, Z2=О, и Е представляет собой фенилен, который является или незамещенным, или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3, Y представляет собой фенил, который также является или незамещенным, или замещен Cl, F и/или CF3 или OCF3, и А представляет собой пятичленную ароматическую циклическую систему, где один атом углерода заменен S. В другом предпочтительном воплощении изобретения в соединениях формулы (II) Z1=О (таким образом, r=1), Z2=О, q=0, t=1, R2-ОН, R8=Н, Е представляет собой фенилен, который является или незамещенным, или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3, Y представляет собой фенил, который также является или незамещенным, или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3, и А представляет собой пятичленную ароматическую циклическую систему, где один атом углерода заменен S. В другом особенно предпочтительном воплощении изобретения в соединениях формулы (II) Z1=О, Z2=О, q=0 или 1, t=2, Е представляет собой фенилен, который является или незамещенным, или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3, Y представляет собой фенил, который также является или незамещенным, или замещен Cl, F и/или CF3, или OCF3, и R2 вместе с атомом азота, который соединяется с R8, образует 6-членный гетероцикл, при условии, что R2 представляет собой -[CH2]s, и R8 отсутствует; и А представляет собой фуран. В другом особенно предпочтительном воплощении изобретения в соединениях формулы (II) Z1=О, Z2=О, q=0 или 1, t=2, Е представляет собой фенилен, который является или незамещенным, или замещен Cl, F и/или CF3, ОСН3, ОСН2СН3 или OCF3, Y представляет собой Н или F и R2 вместе с атомом азота, который соединяется с R8, образует 6-членный гетероцикл, при условии, что R2 представляет собой -[CH2]s, и R8 отсутствует; и А представляет собой фуран. Соединения формулы (II), используемые по изобретению, могут образовывать соли с неорганическими или органическими кислотами или основаниями. Примерами таких солей являются, например, соли щелочных металлов, в частности натриевые и калиевые соли, или соли аммония. Соединения настоящего изобретения можно применять при разных заболеваниях человека и животных, предпочтительно болезнях человека, где благоприятно ингибирование метаболизма пиримидинов. Такими заболеваниями являются: – фиброз, увеит, риниты, астма или артропатия, в частности артроз; – все формы ревматизма; – острые иммунные события и расстройства, такие как сепсис, септический шок, эндотоксиновый шок, сепсис, вызванный грамотрицательными бактериями, токсический шок, острый респираторный дистресс-синдром, удар, реперфузное повреждение, повреждение ЦНС, тяжелые формы аллергии, реакции “трансплантат против хозяина” и “хозяин против трансплантата”, болезнь Альцгеймера или pyresis, рестеноз, хроническое воспаление легких, силикоз, саркоз легких, резорбция костей; к указанным иммунным событиям также относится желательная модуляция и супрессия иммунной системы; – все типы аутоиммунных болезней, в частности ревматоидный артрит, ревматоидный спондилит, остеоартрит, подагрический артрит, рассеянный склероз, инсулинозависимый и инсулиннезависимый сахарный диабет, и красная волчанка, неспецифический язвенный колит, болезнь Крона, воспалительное заболевание кишечника, а также другие хронические воспаления, хроническая диарея; – дерматологические расстройства, такие как псориаз; – прогрессирующая атрофия сетчатки; – все виды инфекционных заболеваний, включая вызванные условно-патогенными микроорганизмами. Соединения по изобретению и лекарственные средства, полученные на их основе, как правило, применяют для лечения расстройств пролиферации клеток и для лечения или профилактики иммунных заболеваний и состояний (как например, воспалительных заболеваний, нейроиммунологических болезней, аутоиммунных болезней или других). Соединения настоящего изобретения также пригодны для разработки иммуномодулирующих и противовоспалительных лекарственных средств или, в более общем смысле, для лечения болезней, при которых благоприятно ингибирование биосинтеза пиримидинов. Соединения настоящего изобретения также пригодны для лечения болезней, вызванных злокачественной пролиферацией клеток, таких как формы гематологического и солидного рака. Поэтому соединения по изобретению и лекарственные средства, полученные на их основе, как правило, пригодны для регуляции клеточной активации, пролиферации клеток, выживаемости клеток, клеточной дифференцировки, клеточного цикла, созревания клеток и гибели клеток, или для индукции системных изменений метаболизма, таких как изменения в метаболизме сахаров, жиров или белков. Их также можно применять для поддержания генерации клеток, в том числе роста клеток крови и генерации (прогемопоэтический эффект) после уменьшения числа или разрушения клеток, вызванных, например, токсичными веществами, излучением, иммунотерапией, дефектами роста, нарушением питания, малабсорбцией, иммунной дисрегуляцией, анемией и т.п., или для обеспечения лечебного регулирования образования и разрушения тканей и лечебной модификации клеток и сохранения тканей и гомеостаза клеток крови. Такие заболевания и состояния включают, но не ограничиваются перечисленным, рак, например гематологический (например, лейкоз, лимфому, миелому), или солидные опухоли (например, рак молочной железы, предстательной железы, печени, мочевого пузыря, легких, пищевода, желудка, колоректальный рак, рак мочеполовых путей, желудочно-кишечного тракта, кожи, поджелудочной железы, головного мозга, матки, толстой кишки, головы и шеи, и рак яичников, меланому, астроцитому, мелкоклеточный рак легких, глиому, базально-клеточный и плоскоклеточный рак, саркомы, такие как саркома Капоши и осетосаркома), расстройства с участием Т-клеток, такие как гипопластическая анемия и синдром DiGeorge, и болезнь Грейвса. Ранее обнаружено, что лефлуномид ингибирует репликацию HCMV в клеточной культуре. Герпес глаз является наиболее обычным случаем инфекционной слепоты в развитых странах. Происходит примерно 50000 случаев в год только в США, из которых 90% являются рецидивами начальных инфекций. Рецидивы лечат противовирусными и кортикостероидными средствами. Другой герпесный вирус – цитомегаловирус является обычным случаем повреждения сетчатки и слепоты у пациентов со СПИДом (aids). Соединения настоящего изобретения можно использовать одни или в сочетании с другими противовирусными соединениями для лечения таких заболеваний, такими как ганцикловир и фоскарнет. Соединения настоящего изобретения также можно применять в случае заболеваний, которые вызываются у людей и животных инвазиями простейших. Такими патогенными микроорганизмами для людей и животных являются, предпочтительно, внутриклеточные активные паразиты типа апикомплексов или саркомастигофор, в особенности, трипаносомы, плазмодии, лейшмании, бабезии и тейлерии, криптоспоридии, саркоцистиды, амебы, кокцидии и трихомонады. Указанные активные вещества или соответствующие лекарственные средства особенно подходят для лечения тропической малярии, вызываемой Plasmodium falciparum, трехдневной малярии, вызываемой Plasmodium vivax или Plasmodium ovale, и для лечения четырехдневной малярии, вызываемой Plasmodium malariae. Они также подходят для лечения токсоплазмоза, вызываемого Toxoplasma gondit, кокцидиоза, вызываемого, например, Isospora belli, интестинального саркоспоридиоза, вызываемого Sarcocystis suihominis, дизентерии, вызываемой Entamoeba histolytica, криптоспоридиоза, вызываемого Cryptosporidium parvum, болезни Шагаса, вызываемой Trypanosoma cruzi, сонной болезни, вызываемой Trypanosoma brucei rhodesiense или gambiense, кожных и висцеральных, а также других форм лейшманиоза. Они также подходят для лечения животных, инфицированных микроорганизмами, патогенными для животных, подобными Theileria parva, патогенными микроорганизмами, вызывающими коровью восточно-береговую лихорадку, Trypanosoma congolense congolense или Trypanosoma vivax vivax, Trypanosoma brucei brucei, патогенными микроорганизмами, вызывающими болезнь Нагана крупного рогатого скота в Африке, Trypanosoma brucei evansi, вызывающими трипаносомоз, Babesia bigemina, патогенными микроорганизмами, вызывающими техасскую лихорадку у крупного рогатого скота и буйволов, Babesia bovis, патогенными микроорганизмами, вызывающими европейский бабезиоз крупного рогатого скота, а также бабезиоз у собак, кошек и овец, Sarcocystis ovicanis и ovifilis, патогенными микроорганизмами, вызывающими саркоцистиоз у овец, крупного рогатого скота и свиней, кристопоридиями – патогенными микроорганизмами, вызывающими кристоспоридиоз у крупного рогатого скота и птицы, видами Eimeria и изоспора – патогенными микроорганизмами, вызывающими кокцидиоз у кроликов, крупного рогатого скота, овец, коз, свиней и птицы, особенно у кур и индеек. Применение соединений настоящего изобретения предпочтительно, в частности, для лечения кокцидиоза или малярийных инфекций, или для получения лекарственного средства или корма для лечения указанных заболеваний. Такое лечение может быть профилактическим или лечебным. При лечении малярии соединения настоящего изобретения можно сочетать с другими противомалярийными средствами. Соединения настоящего изобретения также можно применять в случае вирусных инфекций или других инфекционных заболеваний, вызываемых, например, Pneumocystis carinii. Соединения формулы (II) и их фармакологически приемлемые соли можно вводить животным, предпочтительно, млекопитающим и, в частности, людям, собакам и курам, как лечебные средства сами по себе, в виде смесей с другим средством или в форме фармацевтических препаратов, допускающих энтеральное или парентеральное применение, и которые в качестве активной составляющей части содержат эффективную дозу, по меньшей мере, одного соединения формулы (II) или его соли, вместе с обычными фармацевтически безвредными эксципиентами и добавками. Соединения формулы (II) также можно вводить в форме их солей, которые можно получить взаимодействием соответствующих соединений с физиологически приемлемыми кислотами и основаниями. Лечебные средства можно вводить перорально, например в форме пилюль, таблеток, таблеток с покрытием, таблеток с покрытием из сахара, твердых и мягких желатиновых капсул, растворов, сиропов, эмульсий или суспензий или в виде аэрозольных смесей. Однако введение также можно осуществлять ректально, например в форме суппозиториев, или парентерально, например в форме инъекций или инфузий, или чрескожно, например в форме мазей, кремов или настоек. Кроме активных соединений формулы (II), фармацевтическая композиция может содержать другие обычные, как правило, инертные носители или эксципиенты. Так, фармацевтические препараты также могут содержать добавки, такие как, например, наполнители, сухие разбавители, вещества, способствующие рассыпанию, связующие вещества, глиданты, смачивающие вещества, стабилизаторы, эмульгаторы, консерванты, подслащивающие вещества, красители, корригенты или ароматизаторы, буферные вещества и, кроме того, растворители или солюбилизаторы, или вещества, способствующие достижению эффекта депо, а также соли для изменения осмотического давления, вещества покрытия или антиоксиданты. Они также могут содержать два или большее число соединений формулы (II) или их фармакологически приемлемых солей, а также другие терапевтически активные вещества. Таким образом, соединения настоящего изобретения можно применять в форме только одного вещества или в сочетании с другими активными соединениями, например с уже известными лечебными средствами для лечения вышеуказанных заболеваний, за счет чего в последнем случае отмечается благоприятный аддитивный амплифицирующий эффект. Подходящие количества для введения людям колеблются от 5 до 500 мг. Для того чтобы получить фармацевтические препараты, можно использовать фармацевтически инертные неорганические или органические эксципиенты. Для того чтобы получить пилюли, таблетки, таблетки с покрытием и твердые желатиновые капсулы, можно использовать, например, лактозу, кукурузный крахмал или их производные, тальк, стеариновую кислоту или ее соли и т.п. Эксципиентами для мягких желатиновых капсул и суппозиториев являются, например, жиры, воски, полутвердые и жидкие полиолы, натуральные или отвержденные масла, и т.д. Подходящими эксципиентами для получения растворов и сиропов являются, например, вода, сахароза, инвертный сахар, глюкоза, полиолы и т.п. Подходящими эксципиентами для получения растворов для инъекций являются, например, вода, спирты, глицерин, полиолы или растительные масла. Доза может изменяться в широких пределах и должна быть подходящей для отдельного состояния в каждом отдельном случае. Для применений, указанных выше, подходящая дозировка будет зависеть от способа введения, определенного состояния, от которого лечат, и желаемого эффекта. Вообще, однако, удовлетворительные результаты достигаются при дозировках от примерно 1 до 100 мг на кг массы тела животного, предпочтительно – 1-50 мг/кг. Подходящими уровнями дозировки для более крупных млекопитающих, например людей, являются количества порядка от примерно 10 мг до 3 г в сутки, вводимые обычно однократно, в разделенных дозах 2-4 раза в сутки или в форме с отсроченным высвобождением. Вообще, суточная доза в приблизительно 10-5000 мг, предпочтительно 50-500 мг, на индивидуума-человека является подходящей в случае перорального введения, которое является предпочтительной формой по изобретению. В случае других форм введения суточная доза также находится в подобных пределах. Соединения (II) также можно использовать в форме предшественника (пролекарства) или подходящим образом модифицированной форме, которая высвобождает активное соединение in vivo. Такие предшественники, например предпочтительные воплощения R6 или R1, можно получить, например, изолируя свободную кислотную группу эфирной группой, которая затем, в свою очередь, превращается в свободную кислотную группу in vivo [F.W.Sum et al., Bioorg. & Med. Chem. Lett., 9 (1999), 1921-1926; Ada Rephaeli et al., Drug Development Research, 50 (2000), 379-391; H.Ishikawa, Current Med. Chem., 6 (1999), 575-597]. Другими предшественниками для предпочтительных воплощений R6 или R1 являются тетразол, другие препятствующие метаболизму изостерические заместители для карбоксильной группы, описанные в J.Herr, Bioorg. & Med. Chem. Lett., 10 (2002), 3379-3393. Других предшественников для предпочтительных воплощений R5 можно получить, например, изолируя амидин гидроксигруппой, которая затем, в свою очередь, превращается в свободный амидин in vivo [R.M.Scarborough, J. Med. Chem., 43, 19 (2000), 3454-3473]. Примеры Способ А. Общий способ синтеза производного моноамида 5-членной гетероароматической 2,3-дикарбоновой кислоты Бифенильное производное в инертной атмосфере растворяют в сухом дихлорметане. Добавляют в один прием триэтиламин (1,2 экв.). Добавляют по каплям свежеполученный тиофен-3-карбонилхлорид (1,2 экв.) или фуран-3-карбонилхлорид (1,2 экв.) или соответствующий гетероароматический 2′-карбонилхлорид, растворенный в дихлорметане. После добавления смесь греют при 45°С в течение 4 час. Растворитель удаляют в вакууме. Амид растворяют в тетрагидрофуране и раствор охлаждают до -78°С. Добавляют бутиллитий (2 экв.) в течение 15 минут и смесь перемешивают при -78°С в течение 30 минут. Добавляют в один прием твердый диоксид углерода и смесь оставляют нагреваться до комнатной температуры на 4 часа. Реакцию гасят 2 N HCl, смесь 3 раза экстрагируют этилацетатом, объединенные органические слои промывают раствором бикарбоната натрия и рассолом, сушат над MgSO4 и фильтруют. Растворитель удаляют в вакууме. Вещество очищают ВЭЖХ (с использованием градиента вода/ацетонитрил) и получают чистый продукт реакции. Способ С. Общий способ синтеза производных моноамидов 5-членных гетероароматических 3,4-дикарбоновых кислот Тиофен-3,4-дикарбоновую кислоту или фуран-3,4-дикарбоновую кислоту суспендируют в уксусном ангидриде и греют при 100°С в течение 3 час. Реакционный раствор охлаждают до комнатной температуры. Растворитель удаляют в вакууме. Его (остаток) сушат в течение 6 час и получают ангидрид с количественным выходом. Полученный ангидрид растворяют в дихлорметане (0,36 ммоль/мл). К полученному раствору добавляют производное бифениламина (1 экв.), и реакционную смесь греют при 45°С в течение 12 час. Растворитель удаляют в вакууме. Продукт реакции очищают ВЭЖХ. Выход составляет 30-70%. Пример 1 Синтезируют способом А 3-(бифенил-4-илкарбамоил)тиофен-2-карбоновую кислоту. 1Н ЯМР: Пример 2 Синтезируют способом А 3-(2′-этокси-3,5-дифторбифенил-4-илкарбамоил)тиофен-2-карбоновую кислоту. 1Н ЯМР: Пример 3 Синтезируют способом А 3-{3′-этокси-3,5-дифторбифенил-4-илкарбамоил)тиофен-2-карбоновую кислоту. 1Н ЯМР: Пример 4 Синтезируют способом А 3-(3,5-дифтор-2′,4′-диметоксибифенил-4-илкарбамоил)тиофен-2-карбоновую кислоту. 1Н ЯМР: Пример 5 Синтезируют способом А 3-(2,3,5,6-тетрафтор-2′-метоксибифенил-4-илкарбамоил)тиофен-2-карбоновую кислоту. 1Н ЯМР: Пример 6 Синтезируют способом А 3-(2′-хлор-3,5-дифторбифенил-4-илкарбамоил)тиофен-2-карбоновую кислоту. 1Н ЯМР: Пример 7 Синтезируют способом А 3-(3,5,2′-трифторбифенил-4-илкарбамоил)тиофен-2-карбоновую кислоту. 1Н ЯМР: 7,58 (мс, 1Н, СН), 14,74 (с, 1Н, NH). ЖХ/(+)-ESI-MS: m/z=378 [М+Н]+. Пример 8 Синтезируют способом А 3-(2-хлор-2′-метоксибифенил-4-илкарбамоил)тиофен-2-карбоновую кислоту, 1Н ЯМР: 7,61 (мс, 1H. СН), 15,1 (с, 1Н, NH). ЖХ/(+)-ESI-MS: m/z=388 [М+Н]+. Пример 9 Синтезируют способом А 3-(2,3,5,6-тетрафтор-3′-трифторметоксибифенил-4-илкарбамоил)тиофен-2-карбоновую кислоту. ЖХ/(+)-ESI-MS: m/z=480 [М+Н]+. Пример 10 Синтезируют способом А 3-(3-фтор-3′-метоксибифенил-4-илкарбамоил)тиофен-2-карбоновую кислоту. 1Н ЯМР: Пример 11 Синтезируют способом А 3-(3,5-дифтор-3′-трифторметоксибифенил-4-илкарбамоил)тиофен-2-карбоновую кислоту. 1Н ЯМР: Пример 12 Синтезируют способом А 3-(бифенил-4-илкарбамоил)фуран-2-карбоновую кислоту. ЖХ/(+)-ESI-MS: m/z=308 [М+Н]+. Пример 13 Синтезируют способом С 4-(бифенил-4-илкарбамоил)тиофен-3-карбоновую кислоту. 1Н ЯМР: Пример 14 Синтезируют способом С 4-(2-хлор-2′-метоксибифенил-4-илкарбамоил)тиофен-3-карбоновую кислоту, 1Н ЯМР: Пример 15 Синтезируют способом С 4-(3,5,2′-трифторбифенил-4-илкарбамоил)тиофен-3-карбоновую кислоту. 1Н ЯМР: Пример 16 Синтезируют способом С 4-(3′-этокси-3,5-дифторбифенил-4-илкарбамоил)тиофен-3-карбоновую кислоту, 1Н ЯМР: Пример 17 Синтезируют способом С 4-(2′-этокси-3,5-дифторбифенил-4-илкарбамоил)тиофен-3-карбоновую кислоту. 1Н ЯМР: Пример 18 Синтезируют способом С 4-(3,5-дифтор-3′-трифторметоксибифенил-4-илкарбамоил)тиофен-3-карбоновую кислоту. 1Н ЯМР: Пример 19 Синтезируют способом С 4-(3-фтор-3′-метоксибифенил-4-илкарбамоил)тиофен-3-карбоновую кислоту. ЖХ/(+)-ESI-MS: m/z=372 [М+Н]+. Пример 20 Синтезируют способом С 4-(бифенил-4-илкарбамоил)фуран-3-карбоновую кислоту. ЖХ/(+)-ESI-MS: m/z=308 [М+Н]+. Пример 21 Синтезируют способом А 2-(бифенил-4-илкарбамоил)тиофен-3-карбоновую кислоту. ЖХ/(+)-ESI-MS: m/z=324 [М+Н]+. Пример 22 Синтезируют способом А 2-(бифенил-4-илкарбамоил)фуран-3-карбоновую кислоту. ЖX/(+)-ESI-MS: m/z=308 [M+H]+. 3. Анализ на ингибирование активности DHODH Стандартная смесь для анализа содержит 50 мкМ дециклоубихинона, 100 мкМ дигидрооротата, 60 мкМ 2,6-дихлориндофенола, а также 20 мЕ DHODH. Объемная активность используемого рекомбинантного фермента составляет 30 Е/мл. Измерения проводят в 50-мМ трисНСl (150 мМ KCl, 0,1% тритона Х-100, рН 8,0) при 30°С в конечном объеме 1 мл. Компоненты смешивают и реакцию начинают, добавляя дигидрооротат. Ход реакции контролируют спектрофотометрически, измеряя уменьшение поглощения при 600 нм в течение 2 мин. Исследования ингибирования проводят в стандартном анализе с добавлением разных количеств ингибитора. Для определения величин IC50 (концентрация ингибитора, необходимая для 50% ингибирования) используют, по меньшей мере, пять разных концентраций ингибитора. Данные исследования осуществляют с рекомбинантной человеческой, а также с рекомбинантной мышиной DHODH, полученной проф. М.Löffler, Marburg, Germany [M.Löffler, Chem. Biol. Interact., 124 (2000), 61-76]. В качестве стандарта используют активный метаболит лефлуномида А77-1726 [J.Jöckel et al., Biochemical Pharmacology, 56 (1998), 1053-1060]. Соединения примеров 1, 2, 3, 4, 5, 6, 7, 8, 10, 11, 14, 15, 16, 17, 18, 19, 21, 13, 12, 22, 20 показывают ингибирование человеческой DHODH <1 мкМ. Соединения примеров 9 и 21 показывают ингибирование человеческой DHODH от 1 до 5 мкМ.
Формула изобретения
1. Соединение общей формулы (II) 2. Соединение по п.1, выбираемое из 3-(бифенил-4-илкарбамоил)тиофен-2-карбоновой кислоты; 3-(2`-этокси-3,5-дифторбифенил-4-илкарбамоил)тиофен-2-карбоновой кислоты; 3-(3`-этокси-3,5-дифторбифенил-4-илкарбамоил)тиофен-2-карбоновой кислоты; 3-(3,5-дифтор-2`,4`-диметоксибифенил-4-илкарбамоил)тиофен-2-карбоновой кислоты; 3-(2,3,5,6-тетрафтор-2`-метоксибифенил-4-илкарбамоил)тиофен-2-карбоновой кислоты; 3-(2`-хлор-3,5-дифторбифенил-4-илкарбамоил)тиофен-2-карбоновой кислоты; 3-(3,5,2`-трифторбифенил-4-илкарбамоил)тиофен-2-карбоновой кислоты; 3-(2-хлор-2`-метоксибифенил-4-илкарбамоил)тиофен)-2-карбоновой кислоты; 3-(2,3,5,6-тетрафтор-3`-трифторметоксибифенил-4-илкарбамоил)тиофен-2-карбоновой кислоты; 3-(3-фтор-3`-метоксибифенил-4-илкарбамоил)тиофен-2-карбоновой кислоты; 3-(3,5-дифтор-3`-трифторметоксибифенил-4-илкарбамоил)тиофен-2-карбоновой кислоты; 3-(бифенил-4-илкарбамоил)фуран-2-карбоновой кислоты; 4-(бифенил-4-илкарбамоил)тиофен-3-карбоновой кислоты; 4-(2-хлор-2`-метоксибифенил-4-илкарбамоил)тиофен-3-карбоновой кислоты; 4-(3,5,2`-трифторбифенил-4-илкарбамоил)тиофен-3-карбоновой кислоты; 4-(3`-этокси-3,5-дифторбифенил-4-илкарбамоил)тиофен-3-карбоновой кислоты; 4-(3`-этокси-3,5-дифторбифенил-4-илкарбамоил)тиофен-3-карбоновой кислоты; 4-(2`-этокси-3,5-дифторбифенил-4-илкарбамоил)тиофен-3-карбоновой кислоты; 4-(3,5-дифтор-3`-трифторметоксибифенил-4-илкарбамоил)тиофен-3-карбоновой кислоты; 4-(3-фтор-3`-метоксибифенил-4-илкарбамоил)тиофен-3-карбоновой кислоты; 4-(бифенил-4-илкарбамоил)фуран-3-карбоновой кислоты; 2-(бифенил-4-илкарбамоил)фуран-3-карбоновой кислоты. 3. Фармацевтическая композиция, ингибирующая дигидрооротат-дегидрогеназу, содержащая эффективное количество соединения по п.1 в свободной форме или в форме фармацевтически приемлемой соли и фармацевтически приемлемый разбавитель или носитель. 4. Применение соединения по п.1 или фармацевтически приемлемой соли для получения лекарственного средства для применения при лечении болезни или показания к лечению, при которых благоприятно ингибирование дигидрооротатдегидрогеназы. 5. Применение по п.4, где болезнь или показание выбирают из группы, состоящей из ревматизма, острых иммунных расстройств, аутоиммунных болезней, болезней, вызываемых злокачественной пролиферацией клеток, воспалительных болезней, болезней, вызываемых у людей и животных инвазиями простейших, болезней, вызываемых вирусными инфекциями и Pneumocystis carinii, фиброза, увеита, ринита, астмы и атропатии. 6. Применение соединения по п.1 для ингибирования DHODH.
|
||||||||||||||||||||||||||

 СН, -С3Н7, -СН(СН3)2, -СН2-СН=СН2, -С(CH3)=CH2, -СН=СН-СН3, -C
СН, -С3Н7, -СН(СН3)2, -СН2-СН=СН2, -С(CH3)=CH2, -СН=СН-СН3, -C представляют F, Cl, Br или I, предпочтительно, F.
представляют F, Cl, Br или I, предпочтительно, F. -галоген-
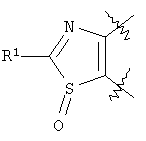
-галоген- -оксосукцината и соответствующих тиоамидов или тиомочевин по аналогии с W.Anderson et al., J. Med. Chem., 27, 1984, 1559-1565; Е.Н.Huntress et al., J. Am. Chem. Soc., 65, 1943, 2167-2169; L.H.Conover et al., J. Am. Chem. Soc., 72, 1950, 5221-5225; M. Robba et al., Bull. Soc. Chim. Fr., 1969, 1762-1768.
-оксосукцината и соответствующих тиоамидов или тиомочевин по аналогии с W.Anderson et al., J. Med. Chem., 27, 1984, 1559-1565; Е.Н.Huntress et al., J. Am. Chem. Soc., 65, 1943, 2167-2169; L.H.Conover et al., J. Am. Chem. Soc., 72, 1950, 5221-5225; M. Robba et al., Bull. Soc. Chim. Fr., 1969, 1762-1768.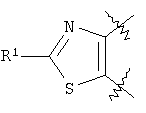
 =1,25 (мс, 9Н, СН3). 3,17 (мс, 6H. СН2), 7,12-7,83 (м, 9Н, CHAr), 7,26 (мс, 1Н, СН), 7,62 (мс, 1H, CH), 14,88 (с, 1Н, NH). ЖХ/(+)-ESI-MS: m/z=324 [M+H]+]+.
=1,25 (мс, 9Н, СН3). 3,17 (мс, 6H. СН2), 7,12-7,83 (м, 9Н, CHAr), 7,26 (мс, 1Н, СН), 7,62 (мс, 1H, CH), 14,88 (с, 1Н, NH). ЖХ/(+)-ESI-MS: m/z=324 [M+H]+]+.