|
|
(21), (22) Заявка: 2008101555/13, 22.01.2008
(24) Дата начала отсчета срока действия патента:
22.01.2008
(43) Дата публикации заявки: 27.07.2009
(46) Опубликовано: 20.04.2010
(56) Список документов, цитированных в отчете о
поиске:
US 6890720 А, 10.05.2005. US 6858438 A, 22.02.2005. RU 2313096 C1, 20.12.2007. RU 2002130492 A, 10.05.2004.
Адрес для переписки:
123182, Москва, пл. Акад. Курчатова, 2, ООО “Филагр”
|
(72) Автор(ы):
Дёмкин Владимир Витальевич (RU),
Кобылянский Андрей Георгиевич (RU)
(73) Патентообладатель(и):
Общество с ограниченной ответственностью “Филагр” (RU)
|
(54) ИММУНОРЕАКТИВНЫЙ ПЕПТИД И СПОСОБ ДИАГНОСТИКИ РЕВМАТОИДНОГО АРТРИТА С ЕГО ИСПОЛЬЗОВАНИЕМ
(57) Реферат:
Изобретение относится к пептидам, происходящим из антигена, узнаваемого аутоантителами, используемым для диагностики ревматоидного артрита. Пептиды представляют собой фрагменты молекулы филаггрина, содержащие модифицированные остатки аргинина и имеющие аминокислотные последовательности, представленные в формуле изобретения. Изобретение раскрывает способ диагностики ревматоидного артрита путем выявления аутоиммунных антител с использованием указанного пептида(ов) путем взаимодействия последнего(их) с сывороткой крови пациентов, страдающих ревматоидным артритом. Присутствие аутоиммунных антител в исследуемом образце диагносцируют по наличию сформированных комплексов пептида с антителом. Пептид по изобретению обладает высокой специфичностью и чувствительностью. 2 н. и 2 з.п. ф-лы, 1 ил., 3 табл.
Изобретение относится к пептидам, происходящим из антигена, узнаваемого аутоантителами. Пептиды представляют собой фрагменты молекулы филаггрина, содержащие модифицированные остатки аргинина. Изобретение относится также к способу детекции аутоиммунных антител при ревматоидном артрите путем взаимодействия с аутоиммунными антителами от пациентов, страдающих ревматоидным артритом. Ревматоидный артрит (РА) является одним из наиболее распространенных заболеваний человека. Этим заболеванием по данным ВОЗ страдает 1-2% населения Земли. В России официально зарегистрировано более 1 млн больных РА. РА характеризуется хроническим воспалением суставов. Это приводит к страданиям, ухудшению качества жизни, снижению и потере трудоспособности.
Развитие РА характеризуется чрезвычайным многообразием клинических проявлений и биохимических нарушений. Это существенно затрудняет раннюю диагностику, а следовательно, проведение адекватной терапии, которая особенно эффективна в дебюте болезни. Современная диагностика РА основана на клинических проявлениях заболевания в сочетании с лабораторным определением в крови пациента так называемого ревматоидного фактора (РФ). Однако РФ не является достаточно специфичным маркером. Двумя другими серологическими маркерами РА являются антиперинуклеарный фактор (АПФ) и антикератиновые антитела (АКА), распознающие антигенные детерминанты цитруллинсодержащего белка филаггрина. Несмотря на высокую специфичность АПФ и АКА для диагностики РА эти аутоантитела не нашли широкого применения в клинической лабораторной практике из-за технических трудностей. В последние годы был разработан иммуноферментный (ИФА) метод определения антител к филаггрину (АФ), который обладает высокой специфичностью. АФ обнаруживаются в крови еще до появления клинических признаков РА, что демонстрирует важную роль этих антител в патогенезе этого заболевания и возможность проводить раннюю диагностику по этому показателю. Основой этой методики является антигенный комплекс в виде полипептидов (участков молекулы филаггрина) или сам белок (рекомбинантный).
Из предшествующего уровня техники известны пептиды, которые используются в способе диагностики ревматоидного артрита и описаны US 2004241767, US 2004253644, US 6890720, US 7288634, US 6858438.
Изобретение посвящено созданию нового антигенного комплекса, обладающего большей специфичностью и чувствительностью.
Исходя из теории гетерогенности популяции АФ, отражающей природную вариабельность антигенов, на которые они вырабатываются (наличие АПФ, АКА, АФ), и полиморфизма молекулы филаггрина можно предположить, что существует несколько цитрулинизированных структурных участков этой молекулы, обладающих антигенными свойствами. Компьютерный анализ молекулы подтвердил это.
На основе предсказательного анализа антигенных эпитопов твердофазным методом с использованием f-moc техники было синтезировано четыре пептида, воспроизводящих фрагменты молекулы белка филаггрина: Ф-1, Ф-2, Ф-3, Ф-4.
ASSHEQAXSSAGEXHGSHHQ – Ф-1,
CSSHEQAXSSAGEXHGCHHQ – Ф-2,
QSHQESAXGXSGETSGHSGS – Ф-3,
CSHQESAXGXSGETSCHSGS – Ф-4,
где Х – Cit,
которые иммунологически реактивны в иммунологическом исследовании, направленном на выявление РА, и могут применяться в способе диагностики РА, включающей в себя детекцию аутоиммунных антител в сыворотке пациента, путем взаимодействия, по крайней мере, одного из вышеуказанных пептидов с сывороткой пациента и детекции наличия сформированных комплексов между упомянутым пептидом и антителом.
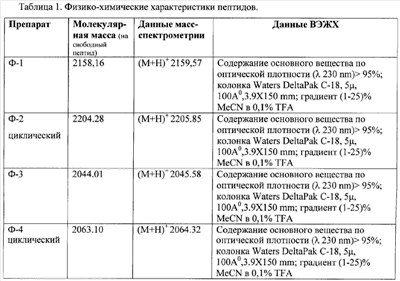
Все препараты пептидов соответствовали 95% чистоте по данным ВЭЖХ и масс-спектроскопии и содержали 20 амикислот с заменой двух остатков Arg на Cit.
ИФА-методика измерения антигенной активности пептидов по отношению к АФ.
1. Иммобилизация ИФА-планшет.
На полистироловые планшеты (Costar США) наносили растворы пептидов в 0,01 М карбонатно-фосфатном буфере рН 7,4 в концентрации 1 мкг/100 мкл. В каждую лунку планшета вносили 100 мкл раствора. Сорбцию пептида проводили при 2-4°С в течение 16 часов.
По окончании сорбции раствор пептида стряхивали и в каждую лунку вносили 2% раствор бычьего сывороточного альбумина (БСА) (Sigma, США). Инкубацию проводили в течение 2 часов при 37°С.
2. Проведение анализа и детекция иммунных комплексов (антиген-антитело).
Исследуемые пробы разводили в 100 раз раствором 2% БСА и полученный раствор вносили в лунки по 100 мкл. Инкубировали 1,5 часа при 37°С. По окончании инкубации планшет промывали трехкратно фосфатно-солевым раствором с 0,05% твин-20 (ФСР) по 250 мкл в лунку. Затем для образования специфических иммунных комплексов в каждую лунку вносили по 100 мкл раствора (1:1000) конъюгата IgG антител кролика к IgG человека с пероксидазой хрена или конъюгат белка А с пероксидазой хрена в 2% БСА и инкубировали 1 час при 37°С. После инкубации раствор стряхивали и планшет промывали трижды раствором ФСР. Для осуществления детекции иммунных комплексов в каждую лунку вносили 100 мкл раствора ТМБ с гидроперитом и инкубировали в темноте при комнатной температуре 5-15 мин до развития окраски. Реакцию останавливали добавлением в каждую лунку 50 мкл 50% соляной кислоты. Интенсивность окраски измеряли на фотометре вертикального сканирования при 450 нм. Положительными считали сыворотки, у которых величина оптической плотности (ОП) превышала значение 0,2.
При испытании иммунохимических свойств пептидов Ф-3 и Ф-4 выявили их высокую чувствительность по отношению АФ (таблицы 2, 3).
| Таблица 2 |
| Выявление антител к филаггрину (пептид Ф-3, Ф-4) в сыворотках больных РА |
 |
Общее количество |
Выявлено больных с AT к Ф-3 |
Выявлено больных с AT к Ф-4 |
| Больные РА |
78 |
66 |
73 |
| Чувствительность |
 |
85% |
93,6% |
При сравнении иммунохимических свойств Ф-3 и Ф-4 между собой и со свойствами уже известного активного циклического пептида ЦЦП (HQCHQESTXGRSRCGRSGS, где X-Cit) оказалось, что есть пациенты, у которых АФ определяются одним из этих пептидов, а другим нет. Наибольшей чувствительностью обладает Ф-4 (Таблица 3, чертеж). На основе этих данных создается антигенный комплекс для выявления АФ из смеси пептидов (Ф-3; Ф-4).
| Таблица 3 |
| Данные измерения оптической плотности образцов сыворотки доноров и больных РА |
| Пациенты |
ЦЦП(ОП450 нм) |
Ф-3(ОП450 нм) |
Ф-4 (ОП450) |
| 1 |
0,147 |
0,239 |
0,329 |
0,333 |
0,791 |
| 2 |
2,136 |
0,241 |
0,525 |
0,309 |
0,329 |
| 3 |
0,222 |
0,258 |
0,61 |
0,349 |
0,525 |
| 4 |
0,28 |
0,242 |
0,276 |
0,271 |
0,61 |
| 5 |
0,463 |
0,197 |
0,295 |
0,264 |
0,276 |
| 6 |
0,401 |
0,217 |
0,588 |
0,187 |
0,295 |
| 7 |
0,743 |
0,339 |
0,56 |
0,283 |
0,588 |
| 8 |
0,224 |
0,27 |
0,342 |
0,411 |
0,56 |
| 9 |
0,206 |
0,251 |
0,393 |
0,32 |
0,342 |
| 10 |
0,972 |
0,223 |
0,469 |
0,274 |
0,393 |
| 11 |
0,209 |
0,21 |
0,861 |
0,193 |
0,469 |
| 12 |
0,263 |
0,229 |
0,641 |
0,249 |
0,861 |
| 13 |
0,364 |
0,232 |
0,291 |
0,233 |
0,641 |
| 14 |
0,395 |
0,215 |
0,101 |
0,243 |
0,291 |
| 15 |
0,476 |
0,245 |
0,279 |
0,209 |
0,101 |
| 16 |
0,331 |
0,3 |
0,243 |
0,403 |
0,279 |
| 17 |
0,16 |
0,263 |
0,31 |
0,259 |
0,243 |
| 18 |
0,304 |
0,21 |
0,347 |
0,243 |
0,31 |
| 19 |
0,195 |
0,215 |
0,437 |
0,266 |
0,347 |
| 20 |
0,192 |
0,191 |
0,711 |
0,188 |
0,437 |
| 21 |
0,274 |
0,203 |
0,172 |
0,175 |
0,711 |
| 22 |
0,626 |
0,255 |
0,273 |
0,202 |
0,172 |
| 23 |
0,294 |
0,184 |
0,323 |
0,198 |
0,273 |
| 24 |
0,184 |
0,221 |
0,276 |
0,218 |
0,323 |
| 25 |
0,272 |
0,31 |
0,465 |
0,184 |
0,276 |
| 26 |
0,2 |
0,234 |
0,472 |
0,334 |
0,465 |
| 27 |
0,166 |
0,217 |
0,421 |
0,212 |
0,472 |
| 28 |
0,158 |
0,18 |
0,516 |
0,316 |
0,421 |
| 29 |
0,223 |
0,236 |
0,255 |
0,249 |
0,516 |
| 30 |
0,253 |
0,161 |
0,213 |
0,197 |
0,255 |
| 31 |
0,357 |
0,229 |
0,306 |
0,23 |
0,213 |
| 32 |
0,154 |
1,548 |
0,251 |
0,204 |
0,306 |
| 33 |
1,024 |
1,334 |
0,441 |
0,177 |
0,251 |
| 34 |
0,17 |
0,221 |
0,849 |
0,366 |
0,441 |
| Д1 |
0,117 |
0,168 |
0,123 |
0,135 |
0,08 |
| Д2 |
0,122 |
0,135 |
0,118 |
0,165 |
0,216 |
| Д3 |
0,084 |
0,139 |
0,174 |
0,173 |
0,219 |
| Д4 |
0,105 |
0,093 |
0,105 |
0,131 |
– |
| Д5 |
0,145 |
0,114 |
0,115 |
0,083 |
– |
| Д6 |
0,115 |
0,099 |
0,102 |
0,114 |
– |
| Д7 |
0,103 |
0,117 |
0,109 |
0,091 |
– |
| Д8 |
0,104 |
0,112 |
0,116 |
0,119 |
– |
| Примечание: в графе «пациенты» индексом «Д» помечены сыворотки доноров. |
Формула изобретения
1. Пептид, имеющий аминокислотную последовательность и структуру, выбранную из:
ASSHEQAXSSAGEXHGSHHQ,
CSSHEQAXSSAGEXHGCHHQ,
QSHQESAXGXSGETSGHSGS,
CSHQESAXGXSGETSCHSGS,
где Х – Cit, предназначенный для диагностики ревматоидного артрита.
2. Пептид по п.1, иммунологически реактивный в иммунологическом исследовании, направленном на выявление ревматоидного артрита.
3. Способ диагностики ревматоидного артрита, включающий взаимодействие по меньшей мере одного из пептидов по п.1 или смеси пептидов, представленных в п.1, с сывороткой (плазмой) крови больного и диагностирование ревматоидного артрита по наличию сформированных комплексов между пептидом и антителом.
4. Способ по п.3, в котором детектирование включает использование иммуноферментного анализа (ИФА).
РИСУНКИ
|
|