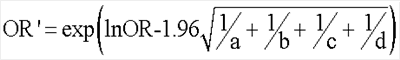Патент на изобретение №2386133
|
||||||||||||||||||||||||||
(54) СПОСОБ ПРОГНОЗИРОВАНИЯ БЕСПЛОДИЯ У ЖЕНЩИН – РАБОТНИЦ НЕФТЕХИМИЧЕСКИХ ПРОИЗВОДСТВ
(57) Реферат:
Изобретение относится к медицине, а именно к области молекулярной биологии и генетики. Для определения риска развития нарушений репродуктивной функции у работниц нефтехимического производства, подвергшихся комбинированному комплексному воздействию химических веществ, выделяют ДНК из лимфоцитов периферической венозной крови, проводят генотипирование полиморфизма A2455G и Т3801С гена CYP1A1 и -163С/А и -2467delT гена CYP1A2. При обнаружении гаплотипа CYP1A1*2A, генотипа *1А*1А полиморфных локусов -163С/А и -2467delT гена CYP1A2, гаплотипа CYP1A2*ID прогнозируют развитие бесплодия. При определении гаплотипа CYP1A2*1L прогнозируют устойчивость к формированию бесплодия у работниц. Использование изобретения позволяет получить прогностические критерии развития бесплодия или устойчивости к нему на основе молекулярно-генетических маркеров у женщин-работниц нефтехимических производств. 3 табл.
Изобретение относится к медицине, а именно к области молекулярной биологии и генетики, и может быть использовано, в частности, в акушерстве и гинекологии при определении риска развития нарушений репродуктивной функции у работниц нефтехимического производства, подвергшихся комбинированному комплексному воздействию химических веществ (предельные, непредельные, ароматические, хлорированные углеводороды и др.). Изучение генов ферментов метаболизма ксенобиотиков на молекулярном уровне позволяет установить причинную связь действующего производственного химического фактора с возникающими патологическими изменениями в организме работниц. В этом случае варианты генетического полиморфизма ферментов метаболизма ксенобиотиков, ассоциированных с предрасположенностью к развитию бесплодия, изменением менструального цикла за время работы женщин, а также наличием у женщин детей с врожденными пороками развития (ВПР), являются основанием для выделения в группе работниц лиц, обладающих повышенной чувствительностью к воздействию производственных химических факторов. Репродуктивная система уязвима в отношении воздействия ксенобиотиков, а изменения, затрагивающие генетический материал генеративных клеток, приводят к серьезным патологиям плода, проявляющимся в виде мертворождений, врожденных пороков развития или отдаленных эффектов. Изучение генов, контролирующих активность ферментов микросомальной монооксигеназной системы, может выявить предрасположенность к заболеваниям репродуктивной системы, вызванным действием токсичных производственных факторов.
Ген CYP1A2 включает 7 экзонов в локусе 15q22 и имеет более 40 однонуклеотидных полиморфизмов (SNPS). Содержит 7.8 kb и состоит из 7 экзонов. Кодирующий регион начинается с 10 нуклеотида 2 экзона. Известно, что 2-6 экзоны являются высоко консервативными для человека, мыши и крысы. Высококонсервативные регионы были обнаружены и в 1 интроне, что прогнозирует его регуляторную роль. Ферменты CYP1A2 и CYP1A1 имеют 71% схожесть последовательности аминокислот и соответственно перекрывающуюся субстратную специфичность.
Известен способ прогнозирования преждевременной недостаточности яичников у женщин репродуктивного возраста с олигоменореей, включающий эхографическое определение объема яичников и числа антральных яичников. При выявлении наличия одного из аллелей DRB1*01, DRB*04, DRB1*03, DQB1*302, DQB1*501 HLA II класса, флюктуирующего уровня фолликулостимулирующего гормона на фоне еще сохраненного ритма менструации или первых задержек менструации и объема яичников менее 5 см3, числа антральных фолликулов менее 10, повышения пульсационного индекса более 1,1 и индекса резистентности 0,71 в воротах и паренхиме более 0,9 и 0,55 соответственно сосудистого кровотока яичников прогнозируют преждевременную недостаточность яичников [патент RU 2326386, 2008]. Известен способ оценки предрасположенности к развитию привычного невынашивания беременности, предусматривающий одновременное тестирование ДНК на наличие полиморфизма R353Q гена фактора VII свертывания крови и полиморфизма С677Т гена метилентетрагидрофолатредуктазы (MTHFR), определение генотипа пациентки с учетом данных по двум исследуемым генам и составление заключения, где генотип RRTT квалифицируется как крайне неблагоприятный, генотипы RRCC, RRCC и RQTT – как неблагоприятные, генотипы RQCC и RQCT – как благоприятные прогностические признаки [патент RU 2330071, 2008].
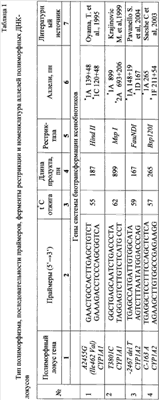
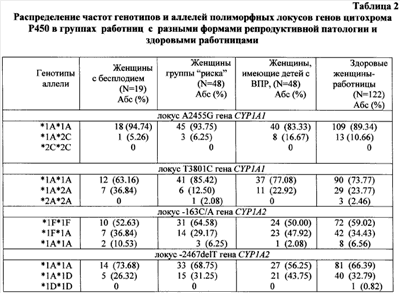
В доступной научно-медицинской и патентной литературе не обнаружено сведений об известности способа прогнозирования бесплодия. В литературе представлены данные, свидетельствующие, что свободнорадикальное окисление играет ключевую роль в патогенезе многих заболеваний. Окислительный стресс – устойчивое смещение существующего в организме про- и антиоксидантного равновесия в пользу окислительных процессов. Окислительный стресс сопровождается образованием многочисленных высокореакционных продуктов, так называемых активных форм кислорода, и затем – продуктов перекисного окисления липидов, которые способны повреждать макромолекулярные и клеточные структуры. Попытка реализовать указанный принцип была положена в основу настоящего изобретения. Задачей изобретения является разработка способа прогнозирования развития бесплодия, основанного на анализе микросомальной монооксигеназной системы организма женщин-работниц в условиях воздействия комплекса химических веществ. Технический результат – получение прогностических критериев развития бесплодия или устойчивости к нему на основе молекулярно-генетических маркеров у женщин-работниц нефтехимических производств. Предлагаемый способ осуществляется следующим образом. Производят забор венозной крови натощак. Выделяют ДНК методом фенол-хлороформной экстракции. Анализ полиморфизма A2455G и Т3801С гена CYP1A1 и -163С/А и -2467delT гена CYP1A2 проводят методом ПЦР/ПДРФ (полиморфизма длин рестрикционных фрагментов). При обнаружении гаплотипа CYP1A1*2A, генотипа *1А*1А полиморфных локусов -163C/A и -2467delT гена CYP1A2, гаплотипа CYP1A2*1D прогнозируют развитие бесплодия. При определении гаплотипа CYP1A2*1L прогнозируют устойчивость к формированию бесплодия у работниц. Осуществление изобретения. I. Материалы и методы. 1. Критерии отбора пациенток с ПН для проведения анализа. В исследуемую группу отбирались женщины российской популяции, работающие лаборантами и контролерами в условиях воздействия комплекса химических веществ (предельные, непредельные, хлорированные и ароматические углеводороды и др.) При этом в анализируемую группу не включали пациенток с наличием хромосомной патологии, воспалительных заболеваний половой сферы, анатомических аномалий репродуктивных органов. Контрольная группа формировалась из здоровых женщин российской популяции. 2. Отбор образцов крови и выделение ДНК. Венозная кровь в объеме 10 мл забиралась в пробирки, содержащие ЭДТА в качестве антикоагулянта (1 объем раствора 0,5 М Na2-ЭДТА, pH 8,0+9 объемов крови). После тщательного перемешивания образцы помещались в морозильную камеру и хранились при -20°С. Выделение геномной ДНК проводили с помощью модифицированного метода с протеиназой К и экстракцией фенол-хлороформом. Для этого в 1,5 мл пробирку (Eppendorf) вносили 700 мкл анализируемого образца крови и 700 мкл ТЕ-буфера (10 мМ Трис-HCl, pH 8,0, 1 мМ ЭДТА) для гемолиза эритроцитов. Процедуру повторяли 2 раза, а затем к клеточному осадку добавляли 400 мкл буфера для протеиназы К, содержащего 200 мкг/мл протеиназы К, после чего инкубировали 4 часа при 60°С на термошейкере с постоянным перемешиванием (850 об/мин). Далее проводили фенол-хлороформную экстракцию ДНК с последующим осаждением 96% этанолом и центрифугированием в течение 10 мин при 10000 об/мин. После серии промывок ДНК элюировали ТЕ буфером (200 мкл). Концентрация выделенной ДНК составляла от 30 до 50 нг/мкл. 3. ПЦР-амплификация и анализ ПЦР-продуктов. Для определения полиморфизмов в исследуемых генах применялся метод ПДРФ. ПЦР проводили в термоциклере Master Cycler Gradient фирмы Eppendorf. При этом для каждого из генов использовали специфические праймеры и условия реакции. ПЦР проводили в объеме 25 мкл в растворе следующего состава: по 6 пмоль каждого праймера, четыре дезоксинуклеозидтрифосфата (каждый в концентрации 0,2 мМ), 1 мкл геномной ДНК, ПЦР-смесь фирмы Amplisense, содержащая Taq-полимеразу, буфер для Taq-полимеразы и MgCl2. Для рестрикционного анализа продукты ПЦР подвергали обработке соответствующей рестриктазой в течение 6 часов. На реакцию рестрикции брали 9 мкл ампликона, 0,5 мкл рестриктазы (3-4 ЕД) и 1 мкл 10 × буфера для рестриктазы. Продукты рестрикции/амплификации анализировали посредством электрофореза в 2% агарозном геле, содержащем 1 мкг/мл бромистого этидия. Размер фрагментов определяли с помощью стандарта массы 500 п.о. – Ladder фирмы «Fermentas». 4. Статистическая обработка результатов. Обработку результатов, полученных при ДНК-тестировании, проводили с помощью программы «Статистика 6.0» методом Проведенный анализ полиморфизма генов монооксигеназной системы CYP1A1, CYP1A2 показал наличие различий в распределении генотипов сравниваемых группах работниц и женщин контрольной группы. У работниц ОАО «Салаватнефтеоргсинтез» установлены генетические маркеры предрасположенности к развитию репродуктивной патологии по вариантам: *1А*2А гена CYP1A1 (A2455G), *1А*1А гена CYP1A1 (Т3801С), *1А*1А гена CYP1A2 (-163С/А), *1А*1А гена CYP1A2 (-2467delT), гаплотипа CYP1A1*2A и гаплотипа CYP1A2*1D. Осуществление изобретения включало следующие этапы: а) изучение полиморфных маркеров гена ферментов микросомальной монооксигеназной системы CYP1A1, CYP1A2 у женщин-работниц с нарушением репродукции; б) анализ ассоциации полиморфных вариантов генов ферментов микросомальной монооксигеназной системы (CYP1A1, CYP1A2) с развитием репродуктивной патологии при воздействии токсических веществ. Проведён анализ полиморфных вариантов генов CYP1A1 (2455A/G, 3801Т/С), CYP1A2 (-2464T/delT, -163С/А) в группах работниц с нарушением репродукции. Проведение ДНК-диагностики пациенток с целью определения аллельных вариантов проводилось, главным образом, с помощью метода полиморфизма длин рестрикционных фрагментов, однако следует иметь в виду, что при осуществлении предлагаемого способа может быть применен любой из известных ныне методов, обеспечивающий надежное детектирование точечных замен в последовательности ДНК, в частности аллель-специфичная ПЦР, масс-спектрометрия, метод гибридизации, ПЦР в реальном времени и т.д. Проведенный анализ ДНК у 238 женщин-работниц выявил следующие результаты: при наличии гаплотипа CYP1A1*2А, генотипа *1А*1А полиморфных локусов -163С/А и -2467delT гена CYP1A2, а также гаплотипа CYP1A2*1D прогнозируется развитие бесплодия. При определении гаплотипа CYP1A2*1L прогнозируется устойчивость к формированию бесплодия у работниц. Примеры реализации и результаты. 1. В работе исследованы образцы ДНК 238 женщин, работающих на предприятии ОАО «Салаватнефтеоргсинтез» в возрасте от 20 до 55 лет (средний возраст 32,7±1,2). Анализ исследуемой выборки показал, что 93.3% обследуемых имели стаж работы в условиях вредных производств свыше 5 лет. По профессиональному составу основную массу составили лаборанты (16.4%) и контролеры (66%). Контрольную группу составили 300 практически здоровых неродственных фертильных женщин, проживающих в Республике Башкортостан и не имеющих профессионального контакта с токсичными веществами. Средний возраст женщин контрольной группы составил 41±14.8 лет. Контрольная группа подобрана с учетом возраста и этнической принадлежности. Выявлено, что осложнения, связанные с беременностью, встречаются у 50% работниц. Ведущими осложнениями беременности у женщин являются токсикоз первой половины беременности (34.8%), токсикоз второй половины беременности (25.3%), анемия (25.0%), угроза прерывания беременности (34.8%). По клиническим признакам исследуемая выборка была разделена следующим образом: а) первую группу составили женщины с бесплодием (n=19); б) вторую группу (группу “риска” по развитию бесплодия) (n=48); в) третью группу составили женщины, имеющие детей с врожденными пороками развития (ВПР) и мертворожденных детей (n=48); в) четвертая группа была представлена здоровыми женщинами-работницами (n=122). Пример 2. Проведение полимеразной цепной реакции синтеза ДНК и рестрикционного анализа. Анализ полиморфных локусов генов цитохромов Р450: CYP1A1 (Т3801С, A2455G), (С-164А, T-2464delT) (номенклатура аллелей приведена согласно www.imm.ki.se/CYPalleles/ Human Cytochrome P-450 (CYP) genes: a web page for the nomenclature of alleles) проводили методом полимеразной цепной реакции синтеза ДНК (ПЦР) на термоциклере в автоматическом режиме с использованием локусспецифических олигонуклеотидных праймеров. Перечень исследованных локусов, последовательности специфических олигонуклеотидных праймеров, а также номенклатура аллелей представлены в табл.1. Во всех случаях реакционная ПЦР – смесь содержала следующие обязательные компоненты: 1,25 мкл 1 × ПЦР-буфера (60 мМ Tris-HCl pH 8.5), 1,5 mM MgC12, 25 mМ KCl, 10 mM 2-меркаптоэтанол, 0.1% тритон Х-100), 200 мМ каждого dNTP, по 1 мкл соответствующих праймеров, примерно 100 нг геномной ДНК, 1 ед. Taq-полимеразы («Сибэнзим») и необходимое количество деионизированной воды до объема 12.5 мл. В случае необходимости для некоторых локусов для локусов генов CYP1A1 (Msp I) добавляли бычий сывороточный альбумин (10Х) с целью оптимизации ПЦР. Пример 3. Проведение статистического анализа ДНК. Математическую обработку результатов исследования проводили с использованием пакетов статистических программ: STATISTICA v.6.0, Microsoft Access, BIOSTAT (Primer of Biostatistics version 4.03), а также программы “The EH software program” (Rockefeller University; New York, NY). Частоты аллелей и генотипов изученных локусов, соответствие распределения частот генотипов равновесию Харди-Вайнберга ( Частоты гаплотипов сцепленных локусов генов (CYP1A1, CYP1A2) рассчитывали в программе “The EH software program” с использованием ЕМ алгоритма (Expectation-Maximization algorithm) и метода максимального подобия [Xie X., Ott J. 1993. Testing linkage disequilibrium between a disease gene and marker loci. Am. J. Hum. Genet. 53, 1107]. Для сравнения распределения частот аллелей в различных группах использовали критерий
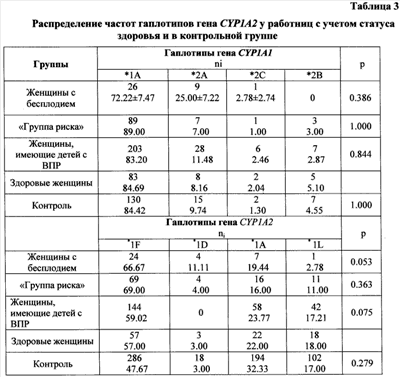
здесь pcp=(p1N1+p2N2)/N – средневзвешенная частота фенотипа. Уровень значимости определяется по Ассоциацию генотипов, аллелей и гаплотипов с развитием заболевания выявляли, сравнивая выборки больных и здоровых индивидов по частоте одного признака с использованием критерия Относительный риск заболевания по конкретному признаку вычисляли как соотношение шансов (OR -odds ratio): OR = (a x d)/(b x c), где a – частота аллеля (генотипа) в выборке больных, b – частота аллеля (генотипа) в контрольной выборке, с – сумма частот остальных аллелей (генотипов) в выборке больных, d – сумма частот остальных аллелей (генотипов) в контрольной выборке. Доверительный интервал для относительного риска рассчитывали по следующей формуле: Значение OR=1 показывало отсутствие ассоциации, значение OR>1 рассматривали как положительную ассоциацию заболевания с признаком («фактор риска»), OR<1 – как отрицательную ассоциацию («фактор устойчивости»). С целью выявления генотипов, определяющих чувствительность организма женщин к действию токсичных производственных факторов, группу женщин-работниц сравнивали с контрольной группой женщин, не имеющих профессиональной токсической нагрузки. Для идентификации генотипов, ассоциированных с предрасположенностью к бесплодию, проводили сравнение между женщинами с бесплодием и здоровыми женщинами-работницами. Для выявления генотипов, ассоциированных с развитием гинекологической патологии, сравнивали группу “риска”со здоровыми женщинами-работницами. Для определения генотипов, ассоциированных с риском формирования врожденных пороков развития (ВПР) у детей, сравнивали женщин, имеющих детей с ВПР или мертворожденных детей, со здоровыми женщинами, имеющими здоровых детей. Проведение анализа ДНК на носительство полиморфных вариантов A2455G и Т3801С гена CYP1A1 и его результаты. Отбор образцов крови, выделение ДНК, ПЦР-амплификацию и анализ ПЦР-продуктов проводили в соответствии с методиками, описанными в разделе «Материалы и методы». ПЦР проводили при следующих условиях: денатурация (94°С, 5 мин) – 1 цикл, денатурация (94°С, 60 с), отжиг (55, 62°С, 60 с) и элонгация (72°С, 60 с) – 30 циклов, конечная элонгация (72°С, 5 мин) – 1 цикл. Для получения специфических рестрикционных фрагментов применяли рестриктазу Hind II (А2455) и Msp I (T3801C). О наличии в образце определенных аллельных вариантов гена CYP1A1 судили по появлению в геле фрагментов с размерами, указанными в табл.1. При проведении ДНК-тестирования на носительство полиморфизма A2455G были получены следующие результаты. а) Определение частоты встречаемости аллелей в группе доноров показало соответствие этого показателя равновесию Харди-Вайнберга, что свидетельствовало о репрезентативности выборки. Распределение частот генотипов и аллелей по полиморфному маркеру A2455G гена CYP1A1 в группе женщин-работниц и в контрольной группе было сходным ( Анализ распределения частот аллелей и генотипов полиморфного маркера T3801C гена CYP1A1 установил сходные частоты в группе работниц и в контроле (табл.2) ( На основании результатов тестирования ДНК на носительство полиморфных вариантов A2455G и T3801C гена CYP1A1 был сделан вывод, что носительство гаплотипа CYP1A1*2A является при прогнозировании бесплодия выраженным неблагоприятным признаком OR=, а гаплотипы *1А, *2С и *2В гена CYP1A1 с точки зрения предрасположенности к заболеванию представляются нейтральными. Пример 3. Проведение анализа ДНК на носительство полиморфных вариантов -163 С/А и -2467delT гена CYP1A2 и его результаты. Отбор образцов крови, выделение ДНК, ПЦР-амплификацию и анализ ПЦР-продуктов проводили в соответствии с методиками, описанными в разделе «Материалы и методы». При этом для амплификации использовали праймеры, представленные в таблице 1. ПЦР проводили при следующих условиях: денатурация (94°С, 5 мин) – 1 цикл, денатурация (94°С, 30 с), отжиг (59, 57°С, 30 с) и элонгация (72°С, 30 с) – 30 циклов, конечная элонгация (72°С, 5 мин) – 1 цикл. О наличии в образце определенных аллельных вариантов -163С/А и -2467delT гена CYP1A2 судили по появлению в гене фрагментов с размерами, указанными в табл. 1. При проведении ДНК-тестирования на носительство аллельных вариантов -163С/А и -2467delT гена CYP1A2 были получены следующие результаты. а) Определение частоты встречаемости аллелей и генотипов полиморфных вариантов -163С/А и -2467delT гена CYP1A2 в группе контроля показало соответствие этого показателя равновесию Харди-Вайнберга, что свидетельствовало о репрезентативности выборки. Изучение частот аллелей и генотипов полиморфных маркеров гена CYP1A2 -163С/А и -2467delT установило достоверное повышение частоты генотипа *1F*1F (-163C/A) до 59.02% по сравнению с 41.67% в контрольной группе женщин ( б) Анализ частот генотипов полиморфного локуса -163С/А CYP1A2 установил тенденцию к повышению частоты гомозиготного генотипа *1А*1А у работниц с бесплодием до 10.53% против 6.56% в группе здоровых женщин. Изучение полиморфного локуса -2467delT CYP1A2 показало увеличение частоты генотипа *1А*1А среди женщин с бесплодием (73,68%) и снижение частоты этого варианта до 56.25% среди женщин, имеющих детей с ВПР, по сравнению со здоровыми работницами (табл.2). Анализ гаплотипического распределения гена CYP1A2 установил повышение частоты гаплотипа CYP1A2*1D у женщин с бесплодием до 11.11% по сравнению с 3.00% среди здоровых работниц. Выявлено, что гаплотип CYP1A2*1L достоверно чаще встречался у здоровых работниц и его частота составила 18.00%, тогда как у женщин с бесплодием на его долю приходилось 2.78% ( На основании полученных данных был сделан вывод, что гомозиготное носительство аллеля *1А полиморфизмов -163С/А и -2467delT гена CYP1A2, а также носительство гаплотипа CYP1A2*1D при прогнозировании бесплодия должно рассматриваться как предрасполагающий к бесплодию признак. Гаплотип CYP1A2*1L может быть определен как протективный (препятствующий развитию патологии) признак.
Формула изобретения
Способ оценки предрасположенности к развитию бесплодия у женщин, подвергшихся комбинированному комплексному воздействию химических веществ, характеризующийся тем, что из лимфоцитов периферической венозной крови выделяют ДНК, проводят генотипирование полиморфизма A2455G и Т3801С гена CYPlA1 и -163С/А и -2467delT гена CYPlA2 и при обнаружении гаплотипа CYPlA1 *2А, генотипа *1А*1А полиморфных локусов -163С/А и -2467delT гена CYPlA2, гаплотипа CYPlA2* ID прогнозируют развитие бесплодия, а при определении гаплотипа CYPlA2* 1L прогнозируют устойчивость к формированию бесплодия у женщин.
|
||||||||||||||||||||||||||

 3, с.49-50. КОЧЕТОВА О.В. и др. Применение новых технологий ДНК-диагностики в медицине труда. Гигиена и санитария, 2008,
3, с.49-50. КОЧЕТОВА О.В. и др. Применение новых технологий ДНК-диагностики в медицине труда. Гигиена и санитария, 2008,  -эстрадиола.
-эстрадиола. 2.
2.