|
|
(21), (22) Заявка: 2007129118/13, 31.07.2007
(24) Дата начала отсчета срока действия патента:
31.07.2007
(43) Дата публикации заявки: 10.02.2009
(46) Опубликовано: 10.04.2010
(56) Список документов, цитированных в отчете о
поиске:
RU 2198394 С2, 10.02.2003. De Ferrari G.V., Mallender W.D., Inestrosa N.C., Rosenberry T.L., J.Biol. Chem., 2001, June, 29, v.276, p.23282-23287. Зарубежная наука и техника, вып. 23, 30.01.2006, Молекулярные технологии. Новости науки и техники. Rogers K.R., Cao C.J., Valdes J.J., Eldefrawi А.Т., Eldefrawi М.Е., Fundam Appl Toxicol, 1991, v.16, p.810-820.
Адрес для переписки:
119192, Москва, Мичуринский пр-кт, 54, корп.2, кв.114, Э.Т.Гайнуллиной
|
(72) Автор(ы):
Антохин Андрей Михайлович (RU),
Андреев Олег Иванович (RU),
Гайнуллина Эра Тазетдиновна (RU),
Рыжиков Сергей Борисович (RU),
Таранченко Виктор Федорович (RU),
Кауров Николай Евгеньевич (RU)
(73) Патентообладатель(и):
Антохин Андрей Михайлович (RU),
Андреев Олег Иванович (RU),
Гайнуллина Эра Тазетдиновна (RU),
Кауров Николай Евгеньевич (RU),
Рыжиков Сергей Борисович (RU),
Таранченко Виктор Федорович (RU)
|
(54) ОПТИЧЕСКИЙ БИОСЕНСОР НЕОБРАТИМЫХ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗЫ В ВОЗДУХЕ
(57) Реферат:
Изобретение относится к области контроля загрязнений окружающей среды, в частности, фосфорорганическими инсектицидами и карбаматами. Оптический биосенсор необратимых ингибиторов холинэстеразы в воздухе включает оптический детектор и активный компонент, состоящий из иммобилизованного на нейтральной подложке комплекса, включающего холинэстеразу и флуорогенный индикатор типа «молекулярный ротор» (MR), который интенсивно флуоресцирует с этим ферментом в составе комплекса ацетилхолинэстераза-молекулярный ротор. В качестве флуорогенного индикатора используют тиофлавин Т, интенсивность флуоресценции которого в присутствии ацетилхолинэстеразы увеличивается более чем в 1000 раз. Кроме того, ускоряется необратимое ингибирование ацетилхолинэстеразы, вследствие чего биосенсор по изобретению является более чувствительным к необратимым ингибиторам, в том числе и к ингибиторам холинэстеразы. 2 з.п. ф-лы, 1 ил., 2 табл.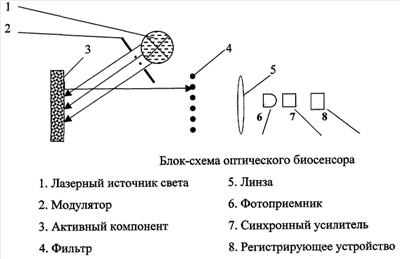
Настоящее изобретение относится к области контроля загрязнений окружающей среды, в частности, фосфорорганическими инсектицидами и карбаматами.
Высокая токсичность и кумулятивное действие многих фосфорорганических ингибиторов (ФОИ) холинэстеразы (ChE) обусловливают актуальность создания чувствительных технических средств, предназначенных для мониторинга окружающей воздушной среды на наличие ингибиторов ChE.
В полевых условиях целесообразно использование для определения ингибиторов ChE наиболее простых по устройству и удобных в эксплуатации аналитических технических средств типа биосенсор – устройства, состоящего из активного компонента и преобразователя аналитического эффекта в регистрируемый сигнал (световой, звуковой и т.п.). Активный компонент биосенсора (БС) играет, в основном, роль «узнающего» агента, который специфически взаимодействует с определяемым веществом, например фермент – субстрат, фермент – ингибитор и др. Этой роли хорошо соответствует ChE, отличающаяся высокой чувствительностью и специфичностью по отношению к ее ингибиторам. Для преобразования аналитического эффекта в информационный сигнал используют, как правило, оптические схемы.
Из оптических БС наибольшей чувствительностью к ФОИ отличаются БС, основанные на регистрации в качестве аналитического отклика флуоресценции. Известны оптические БС определения ингибиторов ChE, основанные на использовании флуоресцентной метки, являющейся обратимым ингибитором ChE [1, 2]. Например, для анализа проб воды в качестве активного компонента оптического БС используется комплекс ацетилхолинэстеразы (AChE) и флуоресцеинизоцианата (FITC), иммобилизованный на волокнах кварца [1]. Активность AChE контролируют по рН-зависимости флуоресцентного сигнала комплекса FITC-AChE, иммобилизованого на поверхности волокна. В результате ферментативного гидролиза субстрата (ацетилхолина) ацетилхолинэстеразой образуются протоны, которые ингибируют AChE, меченную FITC, и это вызывает тушение флуоресценции реакционного раствора. Обратимые ингибиторы эдрофониум и карбамат неостигмин в концентрации 0.1 мМ ингибируют AChE, меченную FITC, что ведет к уменьшению степени тушения флуоресценции. Степень снижения интенсивности флуоресценции обратно пропорциональна концентрации этих ингибиторов. Такой БС определяет концентрации ФОИ (эхотиофат и параоксон) в интервале нМ-мкМ.
Недостатком данного БС является его низкая специфичность, высокая чувствительность к кислым реагентам, которые могут присутствовать в анализируемом воздухе и, таким образом, вносить определенную погрешность в результаты анализа. Перечисленные недостатки такого БС не дают возможность использовать его для определения ингибиторов ChE в воздушной среде и проведения мониторинга.
Наиболее близким к предлагаемому аналитическому устройству является оптический БС для определения ингибиторов ChE в воздухе, активный компонент которого выполнен из комплекса этого фермента с обратимым ингибитором-люмогеном If, иммобилизованного на нейтральной подложке [2]. Интенсивность флуоресценции If, например N-метилакридина, снижается при воздействии ChE, что обусловлено образованием нефлуоресцирующего фермент-ингибиторного комплекса [ChE-If]. В свою очередь, при воздействии нефлуоресцирующего необратимого ингибитора In, например O,O-диизопропилфторфосфата, наблюдается увеличение интенсивности флуоресценции. Наблюдаемый эффект обусловлен фосфорилированием ChE с высокой скоростью, что ведет к смещению равновесия в сторону диссоциации комплекса [ChE-If], увеличению концентрации свободного обратимого флуорофора-ингибитора If и, как следствие, к увеличению интенсивности флуоресценции реакционного раствора. Преимуществом данного БС является несущественное влияние повышенной кислотности атмосферного воздуха благодаря использованию в активном компоненте буфера с высокой буферной емкостью.
Однако этот БС не отвечает современным требованиям по чувствительности. Данный БС принят в качестве прототипа.
Предлагаемое решение направлено на увеличение чувствительности БС к ингибиторам ChE.
Технический результат достигается тем, что в предлагаемом БС активный компонент представляет собой иммобилизированный на подложке интенсивно флуоресцирующий комплекс, образованный AChE и флуорогеном из группы индикаторов типа “молекулярный ротор” (MR). Известен ряд таких флуорогенов MR, например пропидиум, галламин, тиофлавин Т (ТФ) и др. [3], интенсивность флуоресценции которых, например ТФ, увеличивается в присутствии AChE на два-три порядка [3]. При воздействии ФОИ на активный компонент происходит снижение интенсивности флуоресценции комплекса [AChE-ТФ] пропорционально концентрации необратимого ингибитора. В то же время установлено увеличение скорости ингибирования AChE фосфорорганическими ингибиторами в присутствии некоторых MR, например пропидиума или ТФ. Эти свойства MR позволили предложить в качестве активного компонента БС использовать комплекс [AChE-MR], отличающийся более высокой чувствительностью и меньшим временем отклика аналитического эффекта к необратимым ингибиторам ChE по сравнению с активным компонентом БС прототипа.
Кроме того, в оптическую часть БС предлагается внести лазерный источник света для возбуждения активного компонента, модулятор и синхронный усилитель, что позволит увеличить чувствительность БС в целом.
Конструкция оптической части БС представлена на чертеже в виде блок-схемы.
Пример. Изготовление активного компонента
Использовались следующие реактивы фирмы “Sigma”: ацетилхолинэстераза угря, тиофлавин Т, Na2HPO4, KH2PO4, параоксон, N-изопропилакриламид, N,N’-метилен-бисакриламид.
Иммобилизацию комплекса АХЭ с тиофлавином проводили в 0.03 М трис-HCI буфере (рН 7) при 4°С.
В 1 мл 0.03 М трис-HCI буфера (рН 7), содержащего 200 мг N-изопропилакриламида, АХЭ (20 Е/мл) и 1 мМ тиофлавина, добавляли при 4°С и перемешивании 0.02 мл раствора N,N’-метилен-бисакриламида (18 мг/мл), наносили на поверхность нейтральной полимерной пленки и проводили полимеризацию в течение 20 мин при УФ-облучении.
Анализ результатов определения необратимого ингибитора параоксона биосенсором-прототипом и предлагаемым биосенсором приведен таблице 1.
| Таблица 1 |
| Результаты определения параоксона активным компонентом биосенсора-прототипа и предлагаемого биосенсора |
| Эталонный раствор |
БС-прототип |
предлагаемый БС |
| Количество параоксона, нМ |
Количество параоксона, нМ |
Количество параоксона, нМ |
| 1,00 |
Не обнаружен |
1,14±0,10 |
| 10,00 |
Не обнаружен |
9,20±1,05 |
| 100,00 |
95,05±10,25 |
102,0±9,05 |
Из представленных в таблице 1 данных следует, что чувствительность к параоксону предложенного активного компонента существенно выше, чем прототипа.
Таким образом, активный компонент биосенсора на основе иммобилизированного на подложке интенсивно флуоресцирующего комплекса, образованного AChE и флуорогеном из группы индикаторов типа “молекулярный ротор” (MR), позволяет повысить интенсивность флуоресценции на два-три порядка и обладает способностью ускорять необратимое ингибирование AChE, что позволило сконструировать БС, более чувствительный к необратимым ингибиторам, в том числе и фосфорорганическим ингибиторам, по сравнению с БС прототипом.
В таблице 2 сопоставлены существенные признаки БС прототипа и предлагаемого БС.
| Таблица 2. |
| Существенные признаки биосенсора прототипа и предлагаемого биосенсора |
 п/п п/п |
Существенные признаки |
Биосенсор-прототип |
Предлагаемый биосенсор |
| 1 |
Активный компонент |
Комплекс холинэстеразы с люмогеном-ингибитором, иммобилизованный на нейтральной подложке |
Комплекс холинэстеразы с индикатором типа “молекулярный ротор”, иммобилизованный на нейтральной подложке, вызывает увеличение интенсивности флуоресценции на два-три порядка |
| 2 |
Время отклика |
Состав активного компонента не позволяет дополнительно сократить время отклика биосенсора |
Состав активного компонента позволяет сократить время отклика биосенсора за счет увеличения скорости необратимого ингибирования |
| 3 |
Оптический датчик |
Классическая оптическая схема определения флуоресценции |
Предлагается использовать лазерный источник света для возбуждения активного компонента, модулятор и синхронный усилитель для повышения стабильности и чувствительности детектирования флуоресценции |
Использованные литературные источники
1. Rogers K.R, Сао С.J, Valdes J.J, Eldefrawi A.T, Eldefrawi M. E. Fundam Appl Toxicol 1991. v.16, p.810-20.
2. Патент РФ  2198394, 18.12.2003. МПК7 C12Q 1/46, G01N 21/76. 2198394, 18.12.2003. МПК7 C12Q 1/46, G01N 21/76.
3. De Ferrari G.V., Mallender W.D., Inestrosa N.C., Rosenberry T.L. J.Biol. Chem. 2001. v.276, p.23282-23287.
Формула изобретения
1. Оптический биосенсор необратимых ингибиторов холинэстеразы в воздухе, включающий оптический детектор и активный компонент, состоящий из иммобилизованного на нейтральной подложке комплекса, отличающийся тем, что указанный комплекс представляет собой интенсивно флуоресцирующий комплекс, включающий холинэстеразу и флуорогенный индикатор типа «молекулярный ротор».
2. Оптический биосенсор по п.1, отличающийся тем, что флуорогенный индикатор типа «молекулярный ротор» представляет собой тиофлавин Т.
3. Оптический биосенсор по любому из пп.1 и 2, отличающийся тем, что он включает лазерный источник света для возбуждения активного компонента, модулятор и синхронный усилитель.
РИСУНКИ
|
|