Патент на изобретение №2385870
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ N-ЗАМЕЩЕННЫХ (2-ДИАЛКОКСИФОСФОРИЛ-4-ЦИАНО)БУТАНАМИДИНОВ
(57) Реферат:
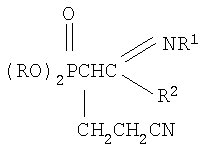
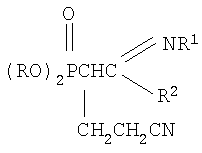
Настоящее изобретение относится к способу получения новых N-замещенных (2-диалкоксифосфорил-4-циано)бутанамидинов формулы
где R=С3-С4-алкил или изоалкил; R1=С(O)СН3, С(O)С6Н5; R2=N(C2H5)2, N(C3H7)2, которые могут служить исходными соединениями для получения биологически активных веществ. Предложенный способ заключается во взаимодействии соответствующих С-фосфорилированных ацетамидинов с акрилонитрилом в присутствии катализатора этилата натрия в среде диоксана при мольном соотношении С-фосфорилированный ацетамидин: акрилонитрил: этилат натрия (1:1.05÷1.15:0.10÷0.20) соответственно и температуре 50÷60°С в течение 2 часов. Техническим результатом является расширение арсенала химических соединений, получение новых N-замещенных (2-диалкоксифосфорил-4-циано)бутанамидинов с высоким выходом (более 73%).
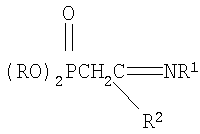
Изобретение относится к химии фосфорорганических соединений, а именно к новому способу получения С-фосфорилированных амидинов, имеющих в структуре цианэтильную группу, общей формулы
где R=C3-C4-алкил или изоалкил; R1=C(O)CH3, C(O)C6H5; R2=N(C2H5)2, N(C3H7)2, которые являются новыми по структуре фосфорорганическими соединениями и могут служить исходными для получения потенциально биологически активных соединений для нужд медицины и сельского хозяйства. Имеется большое число публикаций, подтверждающих различные виды биологической активности у соединений, содержащих в своей структуре амидиновый фрагмент. Например, в обзоре Patai S. «The chemistry of Amidines and Imidates», изданном в Лондоне в 1975 году, стр.262-269, перечислены различные структуры замещенных и незамещенных амидинов, проявивших высокую антивирусную, антибактериальную, противораковую и другие виды активностей. Заявленные в изобретении N-замещенные (2-диалкоксифосфорил-4-циано)бутанамидины, также содержат амидиновый фрагмент, как в вышеприведенной ссылке [Patai S. The chemistry of Amidines and Imidates. – Intrscience: London, 1975, – p.262-269] и можно ожидать, что синтезированные нами соединения обладают этими видами активностей. Кроме того, введение фосфорильной группы добавляет антихолинэстеразные свойства соединениям [Кабачник М.И. Фосфорорганические вещества. – М.: Знание, 1967, – с.14-17]. Имеются также данные, что соединения, содержащие фосфорильный фрагмент, обладают инсектицидной, гербицидной и фунгицидной активностью, полезной для сельского хозяйства [Пурдела Д., Вылчану Р. Химия органических соединений фосфора. – М.: Химия, 1972, – с.557-565]. Известно присоединение нитрила диалкоксифосфорилуксусной кислоты к эфирам непредельных карбоновых кислот с получением бифункциональных соединений сложной структуры, содержащих нитрильную и сложноэфирную группировки. Реакции проводились в присутствии алкоголятов щелочных металлов в безводных спиртах при нагревании реакционных смесей до 4 часов на кипящей водяной бане [А.Н.Пудовик, Н.М.Лебедева. ЖОХ, 1955, т.25, с.1920-1924. А.Н.Пудовик, Н.М.Лебедева. ЖОХ, 1955, т.25, с.2235-2240]. Недостатками данного метода являются невысокие выходы (менее 17-71%) продуктов присоединения. А также в результате получают соединения иной структуры, чем в предлагаемом изобретении. Известен метод присоединения эфира диалкоксифосфорилуксусной кислоты к акрилонитрилу в присутствии в качестве катализатора этилата натрия с получением С-цианэтилированных эфиров диалкоксифосфорилуксусной кислоты. Процессы проводились в растворе этилового спирта, общий выход нитрилов составил 50% от теоретического. [Присоединение фосфонуксусного эфира и его гомологов к непредельным электрофильным реагентам. А.Н.Пудовик, Н.М.Лебедева. ЖОХ, т.22, Вышеописанными методами получают соединения совершенно иной структуры по сравнению с предлагаемым изобретением. Задачей предлагаемого изобретения является разработка нового технологичного малостадийного метода синтеза N-замещенных (2-диалкокси-фосфорил-4-циано)бутанамидинов. Техническим результатом является расширение арсенала химических соединений, получение новых N-замещенных (2-диалкоксифосфорил-4-циано)бутанамидинов с высоким выходом (более 73%). Указанный технический результат достигается разработкой нового способа получения N-замещенных (2-диалкоксифосфорил-4-циано)бутанамидинов формулы
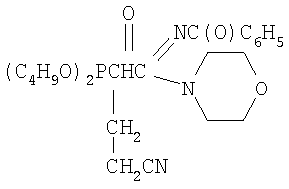
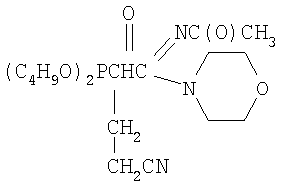
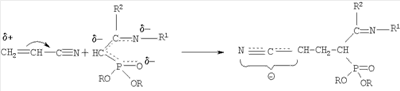
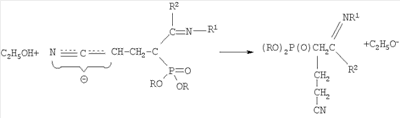
заключающийся во взаимодействии С-фосфорилированных ацетамидинов формулы
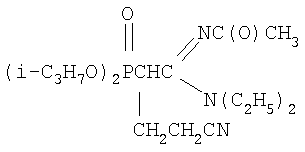
где R=С3-С4-алкил или изоалкил; R1=С(О)СН3, С(O)С6Н5; R2=N(C2H5)2, N(C3H7)2, с акрилонитрилом в присутствии катализатора этилата натрия в среде диоксана при мольном соотношении С-фосфорилированный ацетамидин: акрилонитрил: этилат натрия (1:1.05÷1.15:0.10÷0.20) соответственно и температуре 50÷60°С в течение 2 часов. Химическая схема предложенного способа получения N-замещенных (2-диалкоксифосфорил-4-циано)бутанамидинов: где R=С3-С4-алкил или изоалкил; R1=С(O)СН3, С(O)С6Н5; R2=N(C2H5)2, N(C3H7)2, Нуклеофильное присоединение С-фосфорилированных ацетамидинов к акрилонитрилу происходит по Затем образовавшийся анион нуклеофильно атакует молекулу акрилонитрила с образованием мезомерного аниона: Этот мезомерный анион является сильным основанием и способен отрывать протон от молекулы этилового спирта: Не исключено, что в качестве донора протона выступает метиленовая группа С-фосфорилированного ацетамидина. При выборе растворителя для проведения реакций присоединения к акрилонитрилу нами были учтены следующие требования к растворителю: создание гомогенной реакционной массы, поддержание необходимого температурного режима и инертность по отношению к реагирующим компонентам. Всем этим требованиям отвечает диоксан, в нем растворяется этилат натрия и другие реагенты, есть возможность повышения температуры до 60°С и более, а также он абсолютно инертен по отношению к реагентам. Последнее требование исключает возможность использования этилового спирта, так как он вступает во взаимодействие с акрилонитрилом, понижая выход целевого соединения. В начальный момент взаимодействия нет необходимости в дополнительном нагреве, так как реакция начинается самопроизвольно даже при комнатной температуре. Затем для повышения степени превращения исходных реагентов и ускорения реакции проводили дополнительное нагревание реакционной массы до 50÷60°С в течение 2 часов, так как за это время достигается полная конверсия исходного С-фосфорилированного ацетимидата. Использование в данном процессе 5-15% избытка акрилонитрила по сравнению со стехиометрическим количеством необходимо из-за взаимодействия его со следами этилового спирта, вносимого в реакционную массу с катализатором. Предложенный метод получения N-замещенных (2-диалкоксифосфорил-4-циано)бутанамидинов характеризуется простотой эксперимента, осуществляется в достаточно мягких условиях и обеспечивает высокий (более 73%) выход целевых соединений. Способ осуществляется следующим образом. Для синтеза N-замещенных (2-диалкоксифосфорил-4-циано)бутанамидинов к смеси, состоящей из С-фосфорилированного ацетамидина и акрилонитрила, взятых в мольных количествах 1:1.05÷1.15 соответственно и растворенных в осушенном диоксане, при комнатной температуре и перемешивании прибавляли небольшими порциями катализатор – этилат натрия. Количество катализатора составляло 10÷20% (мольн.) от количества С-фосфорилированного ацетамидина. Процесс протекает с небольшим разогревом реакционной массы и для завершения его рекомендуется нагревание реакционной смеси при 50÷60°С в течение 2 часов. После чего реакционную смесь охлаждали до комнатной температуры, отфильтровывали катализатор, а из фильтрата в вакууме водоструйного насоса отгоняли растворитель. Остатки растворителя удаляли путем вакуумирования (Рост 1÷2 гПа) в течение 1 часа при 50÷60°С. Выход N-замещенных (2-диалкоксифосфорил-4-циано)бутанамидинов составляет более 73%. Для получения химически чистых соединений осуществляли дополнительную очистку полученных соединений методом колоночной адсорбционной хроматографии на силикагеле марки µLC 5/40. Идентификация синтезированных соединений проводилась по данным элементного анализа, молекулярной рефракции, ПМР- и ИК- спектроскопии. Для лучшего понимания сущности предложенного технического решения приводятся конкретные примеры синтезов. Пример 1. N1,N1-диэтил-N2-ацетил(2-диизопропоксифосфорил-4-циано)бутанамидин,
К смеси 2 г (0.0063 моль) N1,N1-диэтил-N2-ацетил-(диизопропокси-фосфорил)ацетамидина, 0.35 г (0.0066 моль, 5% изб. мольн.) акрилонитрила и 10 мл сухого диоксана при температуре 20÷25°С и интенсивном перемешивании небольшими порциями прибавляли катализатор – этилат натрия в количестве 0.07 г (0.0010 моль, 15% от количества исходного амидина). Затем реакционную массу нагревали до 60°С и перемешивали в течение 2 часов, после чего охлаждали, отфильтровывали катализатор, а из фильтрата в вакууме водоструйного насоса отгоняли растворитель. Остаток вакуумировали в течение 1 часа при температуре 50-60°С и 2 гПа. Получили 1.92 г N1,N1-диэтил-N2-ацетил-(2-диизопропоксифосфорил-4-циано)бутанамидина. Выход 82%. nD Спектр ЯМР 1Н (CCl4), м.д.: 1.15 т (6Н, СН3); 1.24 д (12Н, СН3); 1.89 с (3Н, СН3С(О)); 1.97 с (3Н, СН3С(O)); 2.02 м (2Н, СН2СР); 2.48 т (2Н, CH2CN); 3.21 м (1Н, СНР); 3.53 к (4Н, NCH2); 4.57 м (2Н, CHOP); ИК-спектр, Пример 2. N1,N1-дипропил-N2-ацетил(2-дибутоксифосфорил-4-циано)бутанамидин,
К смеси 2.5 г (0.0066 моль) N1,N1-дипропил-N2-ацетил-(дибутоксифосфорил)ацетамидина, 0.39 г (0.0073 моль, 10% изб. мольн.) акрилонитрила и 12 мл сухого диоксана при температуре 20÷25°С и интенсивном перемешивании небольшими порциями прибавляли катализатор – этилат натрия в количестве 0.07 г (0.0010 моль, 15% от количества исходного амидина). Затем реакционную массу нагревали до 60°С и перемешивали в течение 2 часов, после чего охлаждали, отфильтровывали катализатор, а из фильтрата в вакууме водоструйного насоса отгоняли растворитель. Остаток вакуумировали в течение 1 часа при температуре 50÷60°С и 2 гПа. Получили 2.06 г N1,N1-дипропил-N2-ацетил(2-дибутоксифосфорил-4-циано)бутанамидина. Выход 73%. nD Спектр ЯМР 1Н (CCl4), м.д.: 0.89 т (12Н, СН3); 1.37 м (8Н, СН2); 1.95 с (3Н, СН3С(О)); 2.07 м (2Н, СН2СР); 2.47 т (2Н, CH2CN); 3.03 м (1Н, СНР); 3.42 т (4Н, NCH2); 3.91 м (4Н, СН2ОР). ИК-спектр, Пример 3. N1,N1-дипропил-N2-бензоил(2-дибутоксифосфорил-4-циано)бутанамидин,
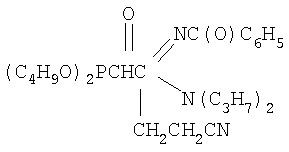
К смеси 2.8 г (0.0064 моль) N1,N1-дипропил-N2-бензоил-(дибутоксифосфорил)ацетамидина, 0.39 г (0.0074 моль, 15% изб. мольн.) акрилонитрила и 16 мл сухого диоксана при температуре 20÷25°С и интенсивном перемешивании небольшими порциями прибавляли катализатор – этилат натрия в количестве 0.09 г (0.0013 моль, 20% от количества исходного амидина). Затем реакционную массу нагревали до 50°С и перемешивали в течение 2 часов, после чего охлаждали, отфильтровывали катализатор, а из фильтрата в вакууме водоструйного насоса отгоняли растворитель. Остаток вакуумировали в течение 1 часа при температуре 50÷60°С и 2 гПа. Получили 2.5 г N1,N1-дипропил-N2-бензоил(2-дибутоксифосфорил-4-циано)бутанамидина. Выход 80%. nD Спектр ЯМР 1Н (CCl4), м.д.: 0.76 т (12Н, СН3); 1.30 м (8Н, СН2); 1.95 м (2Н, СН2СР); 2.42 т (2Н, CH2CN); 2.91 м (lH, СНР); 3.42 т (4Н, NCH2); 3.72 м (4Н, СН2ОР); 7.27 м (6Н, С6Н5). ИК-спектр, Пример 4. N1-морфолино-N2-бензоил(2-дибутоксифосфорил-4-циано)бутанамидин,
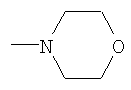
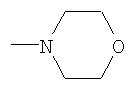
К смеси 2.6 г (0.0061 моль) N1-морфолино-N2-бензоил(ди-бутоксифосфорил)ацетамидина, 0.35 г (0.0067 моль, 10% изб. мольн.) акрилонитрила и 20 мл сухого диоксана при температуре 20÷25°С и интенсивном перемешивании небольшими порциями прибавляли катализатор – этилат натрия в количестве 0.08 г (0.0012 моль, 20% от количества исходного амидина). Затем реакционную массу нагревали до 50°С и перемешивали в течение 2 часов, после чего охлаждали, отфильтровывали катализатор, а из фильтрата в вакууме водоструйного насоса отгоняли растворитель. Остаток вакуумировали в течение 1 часа при температуре 50÷60°С и 2 гПа. Получили 2.15 г N1-морфолино-N2-бензоил(2-дибутоксифосфорил-4-циано)бутанамидина. Выход 74%. nD Спектр ЯМР 1Н (СС14), м.д.: 0.89 т (6Н, СН3); 1.38 м (8Н, СН2); 1.93 м (2Н, СН2СР); 2.45 т (2Н, CH2CN); 3.24 м (1Н, СНР); 3.45 т (4Н, NCH2); 3.67 т (4Н, CH2O); 3.93 м (4Н, СН2ОР); 7.35 м (5Н, С6Н5С(O)) ИК-спектр, Пример 5. N1-морфолино-N2-ацетил(2-дибутоксифосфорил-4-циано)бутанамидин,
К смеси 2.5 г (0.0069 моль) N1-морфолино-N2-ацетил(ди-бутокси-фосфорил)ацетамидина, 0.38 г (0.0072 моль, 5% изб. мольн.) акрилонитрила и 15 мл сухого диоксана при температуре 20÷25°С и интенсивном перемешивании небольшими порциями прибавляли катализатор – этилат натрия в количестве 0.048 г (0.0007 моль, 10% от количества исходного амидина). Затем реакционную массу нагревали до 50°С и перемешивали в течение 2 часов, после чего охлаждали, отфильтровывали катализатор, а из фильтрата в вакууме водоструйного насоса отгоняли растворитель. Остаток вакуумировали в течение 1 часа при температуре 50÷60°С и 2 гПа. Получили 2.43 г N1-морфолино-N2ацетил(2-дибутоксифосфорил-4-циано)бутанамидина. Выход 85%. nD Спектр ЯМР 1Н (CCl4), м.д.: 0.90 т (6Н, СН3); 1.32 м (8Н, СН2); 1.64 м (2Н, СН2СР); 1.94 с (3Н, СН3С(O)); 2.43 т (2Н, CH2CN); 3.08 м (1Н, СНР); 3.51 т (4Н, NCH2); 3.67 т (4Н, CH2O); 3.98 м (4Н, СН2ОР). ИК-спектр, Предложенный метод позволяет осуществлять синтез N-замещенных (2-диалкоксифосфорил-4-циано)бутанамидинов из соответствующих С-фосфорилированных ацетамидинов, что оказалось возможным вследствие высоких С-Н-кислотных свойств активированной метиленовой группы последних. Метод заключается во взаимодействии С-фосфорилированных ацетамидинов с акрилонитрилом в присутствии этилата натрия в качестве катализатора с образованием N-замещенных (2-диалкоксифосфорил-4-циано)бутанамидинов. Достоинством разработанного метода является простота технологии и универсальность, так как он позволяет из соответствующих исходных С-фосфорилированных ацетамидинов получать С-цианэтилированные их гомологи.
Формула изобретения
Способ получения N-замещенных (2-диалкоксифосфорил-4-циано)бутанамидинов формулы
|
||||||||||||||||||||||||||

 ;
;
 ;
; 12, 1952, с.2128-2132]. Недостатком данного метода является невысокий выход нитрилов.
12, 1952, с.2128-2132]. Недостатком данного метода является невысокий выход нитрилов.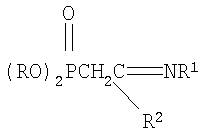
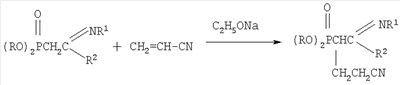
 -углеродному атому. На основании изучения литературных данных механизм взаимодействия С-фосфорилированного ацетамидина с акрилонитрилом можно представить следующим образом: вначале реакции образуется амбидентный анион из ацетамидина под действием алкокси-аниона:
-углеродному атому. На основании изучения литературных данных механизм взаимодействия С-фосфорилированного ацетамидина с акрилонитрилом можно представить следующим образом: вначале реакции образуется амбидентный анион из ацетамидина под действием алкокси-аниона: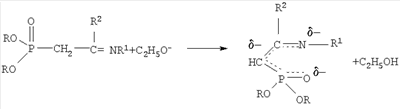
 20 1.4668, d4
20 1.4668, d4 , см-1: 976-1070 (РОС); 1258 (Р=O); 1678 (C=N); 1726 (С=O); 2248 (C
, см-1: 976-1070 (РОС); 1258 (Р=O); 1678 (C=N); 1726 (С=O); 2248 (C N).
N).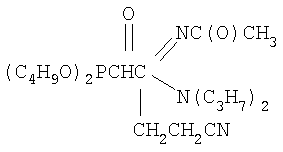
 Car); 1678 (C=N); 1756 (NC=O); 2248 (C
Car); 1678 (C=N); 1756 (NC=O); 2248 (C