Патент на изобретение №2384846
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ОПРЕДЕЛЕНИЯ ПРИЕМА КОРТИКОТРОПИНОВ ПРИ ДОПИНГОВОМ КОНТРОЛЕ СПОРТСМЕНОВ
(57) Реферат:
Изобретение относится к аналитической химии. Предложен способ определения приема кортикотропинов при допинговом контроле спортсменов путем анализа пробы биологической жидкости и выявления глюкокортикостероидов. Способ заключается в том, что пробу мочи подвергают высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией и определяют содержание косвенных биохимических маркеров приема кортикотропинов – кортизола, кортизона и 6
Изобретение относится к области исследования или анализа материалов, в том числе ксенобиотиков, путем разделения образцов материалов на составные части с использованием хроматографии и масс-спектрометрии, а точнее к способам идентификации и определения кортикотропинов, и может быть использовано в допинговом контроле. Наиболее близким к заявляемому объекту по своей технической сущности и достигаемому техническому результату является способ допингконтроля приема кортикотропинов прямым определением содержания глюкокортикотропинов – синактена в пробе крови. По указанному способу пробу подвергают «иммунологической очистке» – электрофоретической разгонке по белкам и их фракциям, аффинной очистке и последующему анализу методом высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией (ВЭЖХ-МС/МС) [1, 2]. Указанный способ является весьма длительным (двое суток), сложным, предполагает травматический отбор пробы (забор крови), что безусловно сказывается на производительности процесса при массовом обследовании спортсменов и стоимости такового обследования. Техническим результатом, на достижение которого направлено создание данного изобретения, является повышение достоверности допингового контроля употребления кортикотропинов за счет определения уровня и соотношения содержания косвенных биохимических маркеров – кортизола, кортизона и 6 Поставленный технический результат достигается тем, что пробы мочи спортсменов подвергают высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией и определяют содержание косвенных биохимических маркеров приема кортикотропинов – кортизола, кортизона и 6 Авторами найдено неожиданное решение. Кинетика протекающих в организме консекутивных биохимических реакций, особенно гормонального обмена, естественным образом определяется концентрацией веществ, участвующих в данном процессе. Так как между выделением глюкокортикостероидов из передней доли гипофиза и концентрацией гормонов коры надпочечников в крови существует тесная связь, то можно утверждать, что при введении в организм синтетических кортикотропинов (например, синактена) должно резко изменяться содержание и соотношение продуктов метаболизма кортикостероидов в организме и его выделениях. Таковыми продуктами являются кортизол, кортизон и 6 В качестве усредненной нормы содержания кортизола, кортизона и 6 В качестве стандартных определяемых веществ используют кортизол, кортизон и 6 В качестве внутренних стандартов (ISTD) используют флюоксиместерон с содержанием основного компонента 99% (Sigma-Aldrich, ФРГ). В качестве экзогенного кортикотропина используют синактен (Синактен ДЕПО Novartis Pharma AG, Австрия). Стандартные растворы аналитов (1 мг/мл) готовят растворением точных навесок в точном объеме метанола. Рабочие растворы получают разбавлением. Хранят рабочие растворы при -20°С. Элюент готовят с использованием метанола «для хроматографии» (Chromasolv®, Merck, Германия), ацетата аммония и муравьиной кислоты (Fluka, Швейцария). Подвижную фазу готовят на основе воды деионизированной, полученной на установке Milli-Q plus (Millipore, Франция). В качестве аппаратуры для проведения высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектроскопией (ВЭЖХ-МС/МС) используют хромато-масс-спектрометр с тройным квадрупольным анализатором TSQ Quantum (фирма Thermo Finnigan, США), соединенным с высокоэффективным жидкостным хроматографом модели Surveyor, оснащенным автосамплером, насосом высокого давления и дегазатором (фирма Thermo Finnigan, США). Для хроматографического разделения используют колонку Eclipse XDB-C18, 150×2,1 мм, с размером частиц 5 мкм, при размере пор 100 В качестве подвижной фазы используют 0.05% раствор муравьиной кислоты с 20 мМ раствором ацетата аммония (рН 3.0) (А) и метанол (В). Скорость потока подвижной фазы поддерживают постоянной. Ионизацию при атмосферном давлении осуществляют электрораспылением в режиме регистрации отрицательных ионов. Детектирование определяемых веществ проводят в режиме регистрации селективных реакций (SRM). Обработку данных проводят с применением программного обеспечения Xcalibur версии 1.3 (фирма Thermo Finnigan, США). Для определения усредненного значения содержания кортизола, кортизона и 6
Изобретение может быть осуществлено следующим образом. Готовят растворы веществ-эталонов в органических растворителях и раствор внутреннего стандарта. Снимают и регистрируют хроматографические и масс-спектрометрические характеристики веществ-эталонов (детектируют не менее трех характеристических ионов каждого эталонного вещества, определяют время удержания, молекулярную массу, прекурсор-ионы, характеристичные ионы, нижний предел обнаружения) и полученные результаты вводят в программное обеспечение, например Xcalibur версии 1.3 фирмы Thermo Finnigan, США. Далее проводят пробоподготовку, при которой в образец исследуемой мочи вводят раствор внутреннего стандарта, доводят рН образца до 9,0 твердым буфером, проводят жидкостно-жидкостную экстракцию диэтиловым эфиром, органический слой упаривают досуха в токе азота и перерастворяют в мобильной фазе. Перерастворенный осадок далее вводят в систему ВЭЖХ-МС/МС с электрораспылительной ионизацией при атмосферном давлении в режиме регистрации отрицательных ионов. Снимают и регистрируют хроматографические и масс-спектрометрические характеристики определяемых веществ в пробе (детектируют не менее трех характеристических ионов каждого определяемого вещества, определяют время удержания, молекулярную массу, прекурсор-ионы, характеристичные ионы, нижний предел обнаружения) и полученные результаты вводят в программное обеспечение, например Xcalibur версии 1.3 фирмы Thermo Finnigan, США. Следует отметить, что заявляемый способ определения приема кортикостероидов позволяет сократить продолжительность допингконтроля группы спортсменов и существенно сократить затраты на проведение допингконтроля. Для лучшего понимания изобретение может быть проиллюстрировано, но не исчерпано следующими примерами его конкретного осуществления. Пример 1. А. Получение масс-спектров, определение характеристических ионов, времени удержания и пределов детектирования кортизола, кортизона и 6 Готовят стандартные растворы аналитов (1 мг/мл): в метаноле, далее получают рабочие растворы разбавлением стандартных растворов до содержания 1,0 мкг/мл. Приготовленные таким образом рабочие растворы вводят в систему ВЭЖХ-МС/МС (хромато-масс-спектрометр с тройным квадрупольным анализатором TSQ Quantum фирмы Thermo Finnigan (США), соединенным с высокоэффективным жидкостным хроматографом модели Surveyor, оснащенным автосамплером, насосом высокого давления и дегазатором фирмы Thermo Finnigan (США). Анализ ведут при скорости потока подвижной фазы 0.2 мл/мин. Определяемые вещества разделяют градиентным элюированием при условиях: 0 мин 15% В; 10 мин 60% В; 15 мин 75% В, 25 мин 85%, общее время анализа с учетом стабилизации системы перед вводом следующего образца составляет 35 мин. Ионизацию при атмосферном давлении осуществляют электрораспылением в режиме регистрации отрицательных ионов. Напряжение на капилляре 3.8 кВ; температура капилляра 245°С; скорость потока осушающего газа (азот) 0.45 л/мин; скорость потока газа (аргон) в камере соударения 0.075 л/мин; температура в камере ионизации 200°С; давление на распылителе 2 атм. Детектирование определяемых веществ проводят в режиме регистрации селективных реакций (SRM). Ширина пика для прекурсор-ионов и соответствующих характерных ионов на первом квадруполе (Q1) и третьем квадруполе (Q3) составляет 0.5 а.е.м. (на половине высоты), время задержки 5 мс. Обработку полученных данных (масс-спектры, характеристические ионы, время удержания и пределы детектирования исследуемых ксенобиотиков) проводят с применением программного обеспечения Xcalibur версии 1.3 фирмы Thermo Finnigan, США (см. табл.2).
Б. Подготовка пробы и анализ исследуемой мочи К образцу мочи (5 мл) добавляют 5 мкл раствора внутренннего стандарта, содержащего флюоксмиестерон (100 мкг/мл), 0,1 г твердого буфера, 5,0 г сульфата аммония и 5 мл диэтилового эфира, перемешивают в течение 2 минут, далее центрифугируют при 1000 об/мин в течение 5 мин, органический слой отделяют, упаривают досуха в токе азота при 40°С и перерастворяют сухой остаток в 50 мкл мобильной фазы, отбирают 5 мкл раствора и вводят в систему ВЭЖХ-МС/МС с электрораспылительной ионизацией при атмосферном давлении в режиме регистрации положительных ионов. Анализ ведут, как в части «А» и при тех же параметрах процесса. Примеры 2-4 Анализ исследуемых образцов мочи ведут, как в Примере 1, часть «Б», за исключением того, что исследуют образцы, полученные от разных индивидуумов. Результаты анализов приведены в табл.3.
Из примера 3 видно, что содержание определяемых веществ в пробе для кортизола, кортизона и 6 Как видно из описания и примеров конкретного осуществления, заявляемый способ определения приема кортикотропинов позволяет существенно сократить продолжительность допингконтроля группы спортсменов и существенно сократить затраты на его проведение. Источники информации 2. Rapid Comm. In Mass Spectroscopy. V.20, Issue 23, 2006 – прототип.
Формула изобретения
Способ определения приема кортикотропинов при допинговом контроле спортсменов путем анализа пробы биологической жидкости и выявления глюкокортикостероидов, отличающийся тем, что в качестве биологической жидкости используют мочу, при этом пробу мочи спортсмена подвергают высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией и определяют содержание косвенных биохимических маркеров приема кортикотропинов – кортизола, кортизона и 6
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


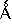 (фирма Agilent, США).
(фирма Agilent, США).
