Патент на изобретение №2384561
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ 1-АЛКОКСИ- ИЛИ 1-ЦИКЛОАЛКОКСИ-1,2-ДИГИДРО[60]ФУЛЛЕРЕНА
(57) Реферат:
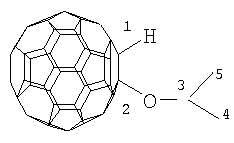
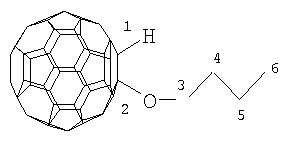
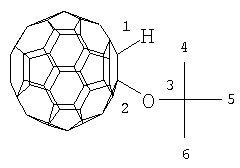
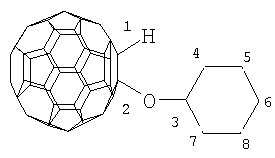
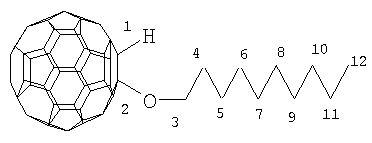
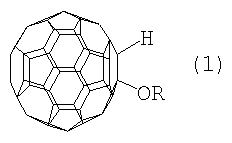
Настоящее изобретение относится к способу получения 1-алкокси- или 1-циклоалкокси-1,2-дигидро[60]фуллеренов общей формулы (1), которые могут найти применение в качестве комплексообразователей, сорбентов, биологически активных соединений, а также при создании новых материалов с заданными свойствами. Способ заключается во взаимодействии фуллерена С60 со спиртами в присутствии катализатора цирконацендихлорида в мольном соотношении С60: ROH: Cp2ZrCl2, равном 0.01:(10-20):(0.0015-0.0025), в среде толуола, в качестве растворителя, при комнатной температуре (~20°С) в течение 20-28 ч. Предлагаемый способ позволяет селективно получать целевые продукты с выходом 59-73%. 1 табл.
R=i-Pr, Bu, t-Bu, cyclo-Hex, Dec
Предлагаемое изобретение относится к органической химии, конкретно к способу получения 1-алкокси- или 1-циклоалкокси-1,2-дигидро[60]фуллеренов общей формулы (1): Полученные оксипроизводные фуллерена являются функционально замещенными производными С60, а разработанный метод их получения позволяет присоединять к фуллерену различные соединения, содержащие в своей структуре гидроксильные группы. Функционально замещенные фуллерены могут найти применение в качестве комплексообразователей, сорбентов, биологически активных соединений, а также при создании новых материалов с заданными свойствами ([1], Л.Н.Сидоров, М.А.Юровская, А.Я.Борщевский, И.В.Трушков, И.Н.Иоффе. Фуллерены: Учебное пособие. М.: Издательство «Экзамен», 2005. – 688 с, [2], Э.Г.Раков. Нанотрубки и фуллерены: Учебное пособие. М.: Университетская книга, Логос, 2006. – 376 с.). Известен способ ([3], L.Gan, S.Huang, X.Zhang, B.Cheng, X.Li, G.Shang. J. Am. Chem. Soc., 2002, 124, 13384) получения смешанного пероксида формулы (2) с выходом 30% реакцией С60 с трет-бутилгидропероксидом в присутствии катализатора Ru(PPh3)3Cl2 по схеме: Известным способом не могут быть получены 1-алкокси- или 1-циклоалкокси-1,2-дигидро[60]фуллерены (1). Известен способ ([4], P.J.Krusic, E.Wasserman, B.A.Parkinson, B.Malone, E.R.Holler, P.N.Keizer, J.R.Morton, K.F.Preston. J. Am. Chem. Soc., 1991, 113, 6274) получения алкокси-радикалов фуллерена формулы (3) введением в молекулу С60 алкокси-радикалов, генерируемых из диалкилпероксидов: Известным способом не могут быть получены 1-алкокси- или 1-циклоалкокси-1,2-дигидро[60]фуллерены (1). Таким образом, в литературе отсутствуют сведения по селективному синтезу 1-алкокси- или 1-циклоалкокси-1,2-дигидро[60]фуллеренов (1). Предлагается новый способ селективного получения 1-алкокси- или 1-циклоалкокси-1,2-дигидро[60]фуллеренов (1). Сущность способа заключается во взаимодействии фуллерена С60 с спиртами ROH (R=i-Pr, Bu, t-Bu, cyclo-Rex, Dec) в присутствии катализатора цирконацендихлорида (Cp2ZrCl2), взятыми в мольном соотношении соответственно 0.01:(10-20):(0.0015-0.0025), предпочтительно 0.01:15:0.0020, при комнатной температуре (~20°С) в течение 20-28 ч, предпочтительно 24 ч, в растворе толуола. Выход 1-алкокси- или 1-циклоалкокси-1,2-дигидро[60]фуллеренов (1) составляет (по данным ВЭЖХ) 59-73%. Реакция протекает по схеме: Спирт берут с большим избытком по отношению к фуллерену С60 с целью повышения выхода целевого продукта (1). Снижение количества спирта по отношению к С60 нецелесообразно, так как приводит к уменьшению выхода целевого продукта. 1-Алкокси- или 1-циклоалкокси-1,2-дигидро[60]фуллерены (1) образуются только с участием фуллерена[60] и спирта под действием катализатора Cp2ZrCl2. Проведение указанной реакции в присутствии циркониевого катализатора Cp2ZrCl2 больше 0.0025 мольных долей по отношению к С60 не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора Cp2ZrCl2 менее 0.0015 мольных долей по отношению к С60 снижает выход продукта (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Изменение соотношения исходных реагентов в сторону значительного увеличения содержания спирта по отношению к фуллерену[60] не приводит к существенному увеличению выхода 1-алкокси- или 1-циклоалкокси-1,2-дигидро[60]фуллеренов (1). Существенные отличия предлагаемого способа: 1. Предлагаемый способ базируется на использовании спирта в качестве исходного реагента и катализатора Cp2ZrCl2. В известном способе используются диалкилпероксиды. Предлагаемый способ, в отличие от известного, позволяет селективно вводить в молекулу фуллерена один алкоксильный или циклоалкоксильный фрагменты с селективным получением 1-алкокси- или 1-циклоалкокси-1,2-дигидро[60]фуллеренов (1). Способ поясняется следующими примерами. ПРИМЕР 1. В стеклянную колбу помещают 0.01 ммоль фуллерена С60, 10 мл толуола, 15 ммоль изопропилового спирта и 0.0020 ммоль катализатора Cp2ZrCl2, перемешивают 24 часа при комнатной температуре (~20°С), получают 1-(изо-пропокси)-1,2-дигидро[60]фуллерен с выходом 68% (по данным ВЭЖХ).
Другие примеры, подтверждающие способ, приведены в таблице.
В качестве растворителя использовали толуол, т.к. в нем наибольшая растворимость фуллерена С60.
Формула изобретения
Способ получения 1-алкокси- или 1-циклоалкокси-1,2-дигидро[60]фуллеренов общей формулы (1),
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 5, с.121-129. RU 2240302 C1, 20.11.2004. US 5416243 A, 16.05.1995. CA 2082593 A1, 28.05.1993.
5, с.121-129. RU 2240302 C1, 20.11.2004. US 5416243 A, 16.05.1995. CA 2082593 A1, 28.05.1993.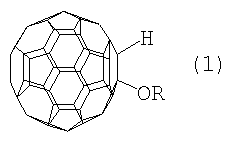

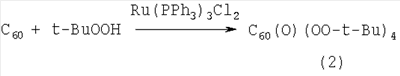

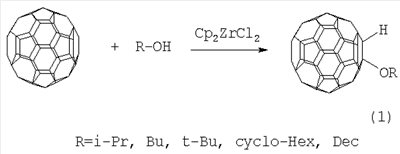
 , м.д.) 1-(изо-пропокси)-1,2-дигидро[60]фуллерена.
, м.д.) 1-(изо-пропокси)-1,2-дигидро[60]фуллерена.