|
|
(21), (22) Заявка: 2008139718/15, 06.10.2008
(24) Дата начала отсчета срока действия патента:
06.10.2008
(46) Опубликовано: 27.02.2010
(56) Список документов, цитированных в отчете о
поиске:
Прикладная иммунология. /Под ред. А.А.Сохина, Е.Ф.Чернушенко. – Киев: Здоровья, 1984. с.50, 51. RU 2251112 C1, 27.04.2005. RU 2157537 C2, 10.10.2000. SU 14421188 A2, 07.12.1988.
Адрес для переписки:
355017, г.Ставрополь, пер. Зоотехнический, 12, ФГОУ ВПО СтГАУ, ОИС (патентный отдел)
|
(72) Автор(ы):
Дмитриев Анатолий Федорович (RU),
Краснощекова Юлия Викторовна (RU),
Морозов Виталий Юрьевич (RU)
(73) Патентообладатель(и):
Федеральное государственное образовательное учреждение высшего профессионального образования “Ставропольский государственный аграрный университет” (RU)
|
(54) СПОСОБ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ ЛОШАДЕЙ К АНТИГЕНАМ МИКРООРГАНИЗМОВ РАЗЛИЧНОЙ ТАКСОНОМИЧЕСКОЙ ПРИНАДЛЕЖНОСТИ
(57) Реферат:
Способ определения чувствительности лошадей к антигенам микроорганизмов различной таксономической принадлежности, включающий проведение реакции лейкоцитолиза с лейкоцитами крови с использованием антигена, подсчет количества лейкоцитов в камере Горяева до и после инкубации и последующим определением чувствительности организма по показателю лейкоцитолиза, отличающийся тем, что при постановке реакции вначале в пробы вносят раствор ацидин-пепсина, подсчет количества лейкоцитов до инкубации проводят только в контрольной пробе, а показатель лейкоцитолиза (ПЛЦ) определяют после инкубации опытной и контрольной проб с последующим вычетом процента спонтанного лейкоцитолиза (СЛЦ) в контрольной пробе и при итоговом значении ПЛЦ(3) до 20% чувствительность организма считают низкой, 20-40% – средней, 40% и более – высокой. 5 табл.
Область техники, к которой относится изобретение
Изобретение относится к ветеринарии, а именно к способу определения чувствительности лошадей к антигенам микроорганизмов различной таксономической принадлежности, и может быть использовано в клинической практике для диагностики гиперчувствительности к микробным антигенам.
Уровень техники
Известен способ определения чувствительности организма животного к туберкулину (in vivo). Способ основан на взаимодействии аллергена с сенсибилизированными Т-лимфоцитами и антиген-презентирующими клетками (макрофагами и клетками Лангерганса), что вызывает высвобождение медиаторов аллергии и развитие местной реакции у сенсибилизированных особей. Постановка кожных проб является диагностическим методом выявления специфической сенсибилизации организма путем введения под кожу аллергена и оценки величины и характера развившейся при этом воспалительной реакции (пат. RU  2280872, кл. G01N 33/68). 2280872, кл. G01N 33/68).
Недостатки кожного тестирования как способа определения чувствительности организма следующие: способ небезопасен для обследуемого, так как не исключается возникновение не только локальных (местных), но и общих реакций организма на введение аллергена, а в случае высокой чувствительности – развития тяжелых аллергических осложнений. Снижается достоверность способа из-за положительных результатов после профилактического или лечебного введения вакцин. Для постановки проб требуется опытный, специально подготовленный персонал, безупречно владеющий методикой их постановки, а также наличие постоянного запаса противошоковых препаратов, что обусловливает необходимость проведения реакции в специально оборудованном помещении. Недостаточна экспрессность, поскольку результаты пробы учитываются через 24-48 часов и ограничено количество анализируемых антигенов.
Известен способ определения содержания общего и аллергоспецифического IgE путем постановки иммуноферментного анализа (ИФА). Способ является достаточно чувствительным, специфичным и экспрессным (Фрадкин В.А. Диагностические и лечебные аллергены. / В.А.Фрадкин. – М.: Медицина, 1990. – 255 с.).
Недостатком иммуноферментного анализа является необходимость наличия специальных тест-систем с конкретным аллергеном, однако набор доступных систем в настоящее время ограничен. Кроме того, способ предъявляет высокие требования к стандартности постановки теста и к качеству антигенных компонентов, то есть воспроизводимость способа существенно зависит от качества и производителя тест-системы.
Недостатком данного способа является сложность его воспроизведения, высокая субъективность полученных результатов, низкая экспрессность, наличие лабораторных животных при постановке непрямого теста.
Известен способ оценки наличия повышенной чувствительности in vitro путем регистрации активности сенсибилизированных клеток крови по специфическому повреждению (разрушению) нейтрофилов (Фрадкин В.А. Диагностика аллергии реакциями нейтрофилов крови. / В.А.Фрадкин. – М.: Медицина, 1985. – 175 с.).
Наиболее близким к заявляемому способу (прототип) является способ постановки реакции с лейкоцитами крови (лейкоцитолиз), заключающийся в следующем: в пробирку с 0,02 мл 5%-ного раствора цитрата натрия добавляют 0,08 мл крови и 0,01 мл специфического антигена (в контроле вместо антигена добавляют такое же количество изотонического раствора поваренной соли). После осторожного перемешивания подсчитывают в камере Горяева количество лейкоцитов в каждой пробирке, содержимое инкубируют в течение 2-х часов при 37°С и вновь подсчитывают количество лейкоцитов. По разнице количества лейкоцитов до и после инкубации в опыте и контроле определяют интенсивность и степень сенсибилизации к специфическому антигену (наличие аллергии). Наличие сенсибилизации организма выявляют при индексе лейкоцитолиза 0,1 и выше (Прикладная иммунология. / Под ред. А.А.Сохина, Е.Ф.Чернушенко. – К.: Здоров’я, 1984. – 320 с.).
Недостатком данного способа являются большие затраты времени на подсчет количества лейкоцитов до инкубации в опытных пробах, он не обладает высокой достоверностью анализа, индекс лейкоцитолиза, установленный расчетным путем, не является информативным показателем, ограниченно количество анализируемых антигенов.
Раскрытие изобретения
Задачей настоящего изобретения является разработка способа определения чувствительности организма лошади к антигенам микроорганизмов различной таксономической принадлежности.
Технический результат, который может быть достигнут с помощью предлагаемого способа, сводится к повышению достоверности определения чувствительности животных и увеличению количества анализируемых антигенов микроорганизмов различной таксономической принадлежности.
Технический результат достигается с помощью способа определения чувствительности лошадей к антигенам микроорганизмов различной таксономической принадлежности, включающего проведение реакции лейкоцитолиза с лейкоцитами крови, с использованием антигена, подсчет количества лейкоцитов в камере Горяева до и после инкубации и последующим определением чувствительности организма по показателю лейкоцитолиза, при этом при постановке реакции вначале в пробы вносят раствор ацидин-пепсина, подсчет количества лейкоцитов до инкубации проводят только в контрольной пробе, а показатель лейкоцитолиза (ПЛЦ) определяют после инкубации опытной и контрольной проб по формуле: 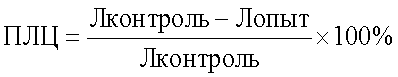 с последующим вычетом процента спонтанного лейкоцитолиза (СЛЦ) в контрольной пробе с последующим вычетом процента спонтанного лейкоцитолиза (СЛЦ) в контрольной пробе 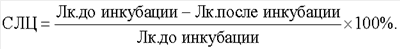 при значении ПЛЦ до 20% чувствительность организма считают низкой, 20-40% – средней, 40% и более – высокой. при значении ПЛЦ до 20% чувствительность организма считают низкой, 20-40% – средней, 40% и более – высокой.
Сущность способа заключается в следующем.
Осуществляют взятие крови у животного с добавлением антикоагулянта.
Реакция ставится в двух пробирках (их количество можно увеличить, если используется большее количество антигенов), куда вносят по 0,3 мл слабоподкрашенного метиленовой синью раствора ацидин-пепсина. Затем в каждую пробирку добавляют по 0,02 мл крови исследуемого животного. В первую пробирку (опытную) добавляют 0,1 мл антигена Staphylococcus aureus, а во вторую (контрольную) – 0,1 мл стерильного физиологического раствора. Пробы тщательно перемешивают, подсчитывают количество лейкоцитов в камере Горяева в контрольной пробирке и помещают опытную и контрольную пробы в термостат на 2 часа при температуре 37-37,5°С.
Антиген, содержащийся в опытной пробе, вызывает специфические повреждения сенсибилизированных лейкоцитов крови и не действует на лейкоциты, которые по отношению к нему не проявляют повышенной чувствительности. Выявить повреждения лейкоцитов путем подсчета возможно лишь в том случае, если они будут полностью разрушены. Разрушение поврежденных лейкоцитов осуществляется ферментом пепсином, который в кислой среде действует только на поврежденные клетки и не действует на неповрежденные. Такое избирательное действие пепсина на поврежденные лейкоциты обеспечивает разницу при их подсчете.
В опытной и контрольной пробах до инкубации содержится разное количество лейкоцитов, при добавлении антигена в опытную пробу в некоторых случаях реакция наблюдается незамедлительно, что подтверждается усиленным цитолизом лейкоцитов. Подсчет количества лейкоцитов до инкубации в опытной пробе приводит к значительной трате времени при анализе чувствительности к нескольким антигенам и не представляет информационной значимости для суждения о состоянии организма.
После инкубирования подчитывают количество лейкоцитов в камере Горяева в опытной и контрольной пробирках.
Определяют показатель лейкоцитолиза для каждого антигена по формуле:

где ПЛЦ – показатель лейкоцитолиза после инкубации;
Л контроль – количество лейкоцитов в контроле после инкубации;
Л опыт – количество лейкоцитов в опыте после инкубации.
Одновременно вычисляют процент спонтанного лейкоцитолиза (СЛЦ) в контрольной пробе:
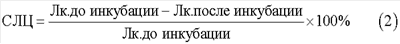
где Л к. до инкубации – количество лейкоцитов в контроле до инкубации;
Л к. после инкубации – количество лейкоцитов в контроле после инкубации.
Итоговое значение показателя лейкоцитолиза для каждого антигена вычисляют по формуле:
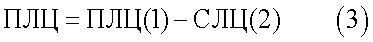
Таким образом, определение показателя лейкоцитолиза к антигену после инкубирования опытной и контрольной проб в растворе ацидин-пепсина с последующим вычетом процента спонтанного лизиса лейкоцитов в контрольной пробе повышает достоверность определения чувствительности животных и, сокращая время исследования, увеличивает количество анализируемых антигенов.
Спонтанный лейкоцитолиз в контрольных пробах исследуемых животных наблюдался от 3 до 13% (табл.1-3), поэтому градация чувствительности определена следующим образом: при значении ПЛЦ (3) до 20% делают вывод о низкой чувствительности организма, 20-40% – средней, 40% и более – высокой.
Осуществление изобретения
Примеры конкретного выполнения способа определения чувствительности лошадей к антигенам микроорганизмов различной таксономической принадлежности
Пример 1. Жеребец Джаган, 8 лет, ахалтекинская порода. По предлагаемому способу определена чувствительность к антигенам Streptococcus faecalis, Staphylococcus aureus, Candida albicans. Для этого берут 4 пробирки (их количество можно увеличить, если используется большее количество антигенов), куда вносят по 0,3 мл слабоподкрашенного метиленовой синью раствора ацидин-пепсина. Затем в каждую пробирку добавляют по 0,02 мл крови исследуемого животного с добавлением антикоагулянта. Далее в первые три пробирки (опытные) добавляют по 0,1 мл антигена Streptococcus faecalis, Staphylococcus aureus, Candida albicans соответственно, а в четвертую (контрольную) – 0,1 мл стерильного физиологического раствора. Пробы тщательно перемешивают, подсчитывают количество лейкоцитов в камере Горяева в контрольной пробирке и помещают опытные и контрольную пробирки в термостат на 2 часа при температуре 37-37,5°С. После инкубирования подчитывают количество лейкоцитов в камере Горяева в опытных и контрольной пробирках.
Количество лейкоцитов крови после инкубации с антигенами Streptococcus faecalis, Staphylococcus aureus, Candida albicans в опытных пробах составило соответственно 3200, 3200 и 3650 тыс./мкл, в контроле до инкубации – 4950 тыс./мкл и после инкубации – 4300 тыс./мкл.
Показатель лейкоцитолиза для антигенов Streptococcus faecalis и Staphylococcus aureus (ПЛЦ1,2) составил 25,6%. Показатель лейкоцитолиза для антигена Candida albicans (ПЛЦ3) составил 15,1%.
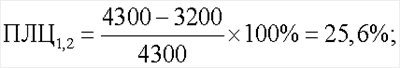
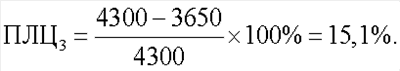
Спонтанный лейкоцитолиз составил 13%:
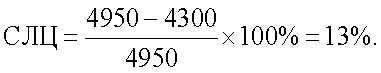
Итоговое значение ПЛЦ для антигенов Streptococcus faecalis и Staphylococcus aureus составило 12,6%:
ПЛЦ1,2=25,6%-13%=12,6%.
Итоговое значение ПЛЦ для антигена Candida albicans составило 2,1%:
ПЛЦ3=15,1%-13%=2,1%.
Делают вывод о наличии низкой чувствительности организма к антигенам Streptococcus faecalis, Staphylococcus aureus, Candida albicans.
Пример 2. Жеребец Триумф, 8 лет, кабардинская порода. По предлагаемому способу определена чувствительность к аналогичным антигенам. Количество лейкоцитов крови после инкубации в опытных пробах с антигенами Streptococcus faecalis, Staphylococcus aureus и Candida albicans составило 7000, 3800 и 2900 тыс./мкл соответственно, в контрольной пробе до инкубации – 7600 тыс./мкл и после инкубации – 7000 тыс./мкл.
Показатель лейкоцитолиза для антигена Streptococcus faecalis составил 0% (ПЛЦ1), для антигена Staphylococcus aureus – 45,7% (ПЛЦ2) и для антигена Candida albicans – 58,6% (ПЛЦ3):
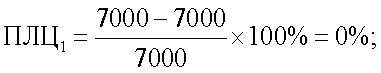
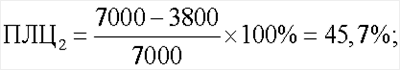
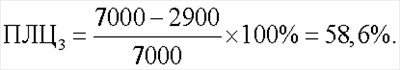
Спонтанный лейкоцитолиз составил 7,8%:
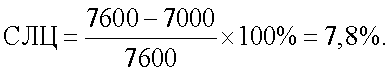
Итоговое значение ПЛЦ для антигена Streptococcus faecalis составило 0%, для антигена Staphylococcus aureus – 37,9% и для антигена Candida albicans – 50,8%:
ПЛЦ2=45,7%-7,8%=37,9%;
ПЛЦ3=58,6%-7,8%=50,8%.
Делают вывод о наличии низкой чувствительности организма к антигену Streptococcus faecalis, средней чувствительности к антигену Staphylococcus aureus и высокой чувствительности к антигену Candida albicans.
Пример 3. Жеребец Грифель, 14 лет, англобуденновская порода. По предлагаемому способу определена чувствительность к антигенам Streptococcus faecalis, Staphylococcus aureus, Candida albicans. Количество лейкоцитов в опытных пробах после инкубирования составило 4300, 3200, 3400 тыс./мкл соответственно, в контрольной пробе до инкубации – 7000 тыс./мкл и после инкубации – 6400 тыс./мкл. Показатель лейкоцитолиза составил 32,8%, 50,0% и 46,8% соответственно. Спонтанный лейкоцитолиз составил 8,5%. Итоговое значение ПЛЦ для антигена Streptococcus faecalis составило 24,3%, для антигена Staphylococcus aureus – 41,5% и для антигена Candida albicans – 38,3%. Делают вывод о наличии средней чувствительности к антигенам Streptococcus faecalis, Candida albicans и высокой чувствительности к антигену Staphylococcus aureus.
Пример 4. Жеребец Хрупкий, 10 лет, тракеннинская порода. По предлагаемому способу определена чувствительность к аналогичным антигенам. Количество лейкоцитов в опытных пробах после инкубирования с антигеном Streptococcus faecalis – 2350 тыс./мкл, с антигеном Staphylococcus aureus – 2400 тыс./мкл, Candida albicans – 3000 тыс./мкл, в контрольной пробе до инкубации – 5000 тыс./мкл и после инкубации – 4750 тыс./мкл. Показатель лейкоцитолиза составил 50,5%, 49,5% и 36,8% соответственно. Спонтанный лейкоцитолиз составил 5,0%. Итоговое значение ПЛЦ для антигена Streptococcus faecalis составило 45,5%, для антигена Staphylococcus aureus – 44,5% и для антигена Candida albicans – 31,8% соответственно. Делают вывод о высокой чувствительности организма к антигенам Streptococcus faecalis, Staphylococcus aureus и средней чувствительности к антигену Candida albicans.
Пример 5. По предлагаемому способу определена чувствительность лошадей конноспортивной школы СтавропольскогоГАУ к антигенам Staphylococcus aureus, Streptococcus faecalis, Candida albicans (табл.1, 2, 3) и другим антигенам микроорганизмов различной таксономической принадлежности (табл.4).
Наибольшее количество животных, проявляющих высокую чувствительность (см. табл.4), отмечалось к антигену Staphylococcus aureus, показатель лейкоцитолиза которых составил 46,0±1,3%, а наименьшее количество животных – к антигенам Escherichia coli и Serratia marcescens, значение показателя лейкоцитолиза которых составило 41,3±0,0% и 40,4±0,0% соответственно. Наибольшее количество животных с низкой чувствительностью наблюдалось к антигену Micrococcus luteus, показатель лейкоцитолиза которых составил 9,0±2,5%.
Установлены достоверные различия показателя лейкоцитолиза у высокочувствительных (44,6±1,3%) и низкочувствительных (11,4±1,4%) животных (p 0,001). 0,001).
Количество животных, проявляющих высокую и низкую чувствительность, имело между собой различие. Критерий расхождения распределений лямбда ( ) составил 8,3 (p ) составил 8,3 (p 0,001). 0,001).
Величина нормированного отклонения у гиперчувствительных животных от средней величины по группе со знаком плюс составила 1,3±0,1, а у низкочувствительных животных со знаком минус – 1,2±0,2.
Особенности реагирования животных на антигены микроорганизмов различной таксономической принадлежности и концентрация общего Ig E представлены в табл.5.
Высокую чувствительность к одному антигену (Staphylococcus aureus., см. табл.5) проявляли 3 животных (21%), к двум антигенам одновременно (Staphylococcus aureus, Candida albicans) – 1 (7%), к трем и более из испытанных антигенов (Streptococcus faecium. Streptococcus faecalis, Staphylococcus aureus, Escherichia coli, Serratia marcescens) – 4 (29%). Низкую чувствительность ко всем антигенам проявляли 6 животных (43%).
Результаты определения чувствительности лошадей к антигенам микроорганизмов различной таксономической принадлежности с использованием реакции лейкоцитолиза совпадают с данными по содержанию в сыворотке крови иммуноглобулина E, который является маркером сенсибилизации. Так, концентрация IgE у животных гиперчувствительных к трем и более антигенам составила 507,8±32,2 МЕ/мл, а у низкочувствительных животных – 294,7±41,1 МЕ/мл (р 0,01), в то время показатель лейкоцитолиза у животных гиперчувствительных к трем и более антигенам составил 46,2±0,9%, а у низкочувствительных животных – 13,8±1,1% (р 0,01), в то время показатель лейкоцитолиза у животных гиперчувствительных к трем и более антигенам составил 46,2±0,9%, а у низкочувствительных животных – 13,8±1,1% (р 0,001). Высокий уровень общего IgE в сыворотке крови животного указывает на состояние гиперчувствительности, а постановка реакции лейкоцитолиза определяет гиперчувствительность к конкретному антигену(ам) или ее отсутствие. 0,001). Высокий уровень общего IgE в сыворотке крови животного указывает на состояние гиперчувствительности, а постановка реакции лейкоцитолиза определяет гиперчувствительность к конкретному антигену(ам) или ее отсутствие.
Установлена положительная корреляционная связь показателя лейкоцитолиза с концентрацией IgE (r=+0,8, p 0,01), абсолютным содержанием лимфоцитов (r=+0,7, p 0,01), абсолютным содержанием лимфоцитов (r=+0,7, p 0,05), включая популяцию Т-лимфоцитов (r=+0,8, p 0,05), включая популяцию Т-лимфоцитов (r=+0,8, p 0,05), Т-хелперами (r=0,6, p 0,05), Т-хелперами (r=0,6, p 0,05) базофилов (r=+0,7, р 0,05) базофилов (r=+0,7, р 0,05) и эозинофилов (r=+0,8, p 0,05) и эозинофилов (r=+0,8, p 0,01) крови, общим белком сыворотки крови (r=+0,7, p 0,01) крови, общим белком сыворотки крови (r=+0,7, p 0,01), 0,01),  -глобулинами (r=+0,7, p -глобулинами (r=+0,7, p 0,01). Отрицательная корреляционная связь показателя лейкоцитолиза установлена с фагоцитарной активностью нейтрофилов (r=-0,8, p 0,01). Отрицательная корреляционная связь показателя лейкоцитолиза установлена с фагоцитарной активностью нейтрофилов (r=-0,8, p 0,01), фагоцитарным индексом (r=-0,7, p 0,01), фагоцитарным индексом (r=-0,7, p 0,05), лизоцимной активностью сыворотки крови (r=-0,7; p 0,05), лизоцимной активностью сыворотки крови (r=-0,7; p 0,05). 0,05).
| Таблица 1 |
| Показатель лейкоцитолиза и чувствительность лошадей к антигену Staphylococcus aureus |
 п/п п/п |
Кличка животного |
Возраст, лет |
Количество лейкоцитов в контроле до инкубации, тыс./мкл |
Количество лейкоцитов после инкубации, тыс./мкл |
Спонтанный лейкоцитолиз, % |
Показатель лейкоцитолиза (итоговый), % |
Чувствитель-ность |
| в контроле |
в опыте |
| 1 |
Джаган |
8 |
4950 |
4300 |
3200 |
13,0 |
12,6 |
низкая |
| 2 |
Бекет |
8 |
6000 |
5800 |
3800 |
3,0 |
31,5 |
средняя |
| 3 |
Мелеогус |
9 |
5600 |
5000 |
2200 |
10,7 |
45,3 |
высокая |
| 4 |
Хрупкий |
10 |
5000 |
4750 |
2400 |
5,0 |
44,5 |
высокая |
| 5 |
Бриз |
3 |
11200 |
10800 |
4500 |
3,5 |
54,8 |
высокая |
| 6 |
Триумф |
8 |
7600 |
7000 |
3800 |
7,8 |
37,9 |
средняя |
| 7 |
Дракон |
15 |
7100 |
6600 |
3500 |
7,0 |
39,9 |
средняя |
| 8 |
Дунай |
17 |
5500 |
4900 |
3600 |
10,9 |
15,6 |
низкая |
| 9 |
Азимут |
1 |
7000 |
6500 |
3000 |
7,1 |
46,7 |
высокая |
| 10 |
Грифель |
14 |
7000 |
6400 |
3200 |
8,5 |
41,5 |
высокая |
| Таблица 2 |
| Показатель лейкоцитолиза и чувствительность лошадей к антигену Streptococcus faecalis |
 п/п п/п |
Кличка животного |
Возраст, лет |
Количество лейкоцитов в контроле до инкубации, тыс./мкл |
Количество лейкоцитов после инкубации, тыс./мкл |
Спонтанный лейкоцитолиз, % |
Показатель лейкоцитолиза (итоговый), % |
Чувствительность |
| в контроле |
в опыте |
| 1 |
Джаган |
8 |
4950 |
4300 |
3200 |
13,0 |
12,6 |
низкая |
| 2 |
Бекет |
8 |
6000 |
5800 |
4150 |
3,0 |
25,4 |
средняя |
| 3 |
Мелеогус |
9 |
5600 |
5000 |
2950 |
10,7 |
30,3 |
средняя |
| 4 |
Хрупкий |
10 |
5000 |
4750 |
2350 |
5,0 |
45,5 |
высокая |
| 5 |
Бриз |
3 |
11200 |
10800 |
5300 |
3,5 |
47,4 |
высокая |
| 6 |
Триумф |
8 |
7600 |
7000 |
7000 |
7,8 |
0 |
низкая |
| 7 |
Дракон |
15 |
7100 |
6600 |
3400 |
7,0 |
41,5 |
высокая |
| 8 |
Дунай |
17 |
5500 |
4900 |
2600 |
10,9 |
36,0 |
средняя |
| 9 |
Азимут |
1 |
7000 |
6500 |
4500 |
7,1 |
23,6 |
средняя |
| 10 |
Грифель |
14 |
7000 |
6400 |
4300 |
8,5 |
24,3 |
средняя |
| Таблица 3 |
| Показатель лейкоцитолиза и чувствительность лошадей к антигену Candida albicans |
 п/п п/п |
Кличка животного |
Возраст, лет |
Количество лейкоцитов в контроле до инкубации, тыс./мкл |
Количество лейкоцитов после инкубации, тыс./мкл |
Спонтанный лейкоцитолиз, % |
Показатель лейкоцитолиза (итоговый), % |
Чувствительность |
| в контроле |
в опыте |
| 1 |
Джаган |
8 |
4950 |
4300 |
3650 |
13,0 |
2,1 |
низкая |
| 2 |
Бекет |
8 |
6000 |
5800 |
5100 |
3,0 |
9,0 |
низкая |
| 3 |
Мелеогус |
9 |
5600 |
5000 |
3100 |
10,7 |
27,3 |
средняя |
| 4 |
Хрупкий |
10 |
5000 |
4750 |
3000 |
5,0 |
31,8 |
средняя |
| 5 |
Бриз |
3 |
11200 |
10800 |
7300 |
3,5 |
28,9 |
средняя |
| 6 |
Триумф |
8 |
7600 |
7000 |
2900 |
7,8 |
50,8 |
высокая |
| 7 |
Дракон |
15 |
7100 |
6600 |
3900 |
7,0 |
33,9 |
средняя |
| 8 |
Дунай |
17 |
5500 |
4900 |
2500 |
10,9 |
38,0 |
средняя |
| 9 |
Азимут |
1 |
7000 |
6500 |
3100 |
7,1 |
45,2 |
высокая |
| 10 |
Грифель |
14 |
7000 |
6400 |
3400 |
8,5 |
38,4 |
средняя |
| Таблица 4 |
| Показатель лейкоцитолиза и чувствительность лошадей к микробным антигенам (п=14) |
Животные
Антиген |
Высокочувствительные, % (M±m) |
Количество животных |
Низкочувствительные, % (M±m) |
Количество животных |
| Streptococcus faecium |
44,5±2,4 |
3 |
14,6±1,6 |
4 |
| Streptococcus faecalis |
47,7±1,5 |
3 |
13,1±2,8 |
2 |
| Staphylococcus aureus |
46,0±1,3 |
7 |
15,4±1,6 |
2 |
| Micrococcus luteus |
– |
0 |
9,0±2,5 |
7 |
| Escherichia coli |
41,3±0,0 |
1 |
13,8±1,8 |
4 |
| Serratia marcescens |
40,4±0,0 |
1 |
9,0±3,3 |
4 |
| Candida albicans |
48,0±2,8 |
2 |
5,4±3,7 |
2 |
| Таблица 5 |
| Специфика реагирования животных на антигены микроорганизмов различной таксономической принадлежности и концентрация общего Ig E |
| Группы животных |
Распределение животных по характеру реагирования на антигены (количество) |
Показатель лейкоцитолиза по группе, % (M±m) |
| один |
Ig E, МЕ/мл (M±m) |
два |
Ig E, МЕ/мл (M±m) |
три |
Ig E, МЕ/мл (M±m) |
| Гиперчувствительные |
3 |
378,8±64,4 |
1 |
586,5±0,0 |
4 |
507,8±32,2* |
45,9±0.8** |
| Низкочувствительные |
6 |
294,7±41,1 |
6 |
294,7±41,1 |
6 |
294,7±41,1 |
13,5±0,9 |
Примечание: *р<0,01, **р 0,001 по сравнению с низкочувствительными животными 0,001 по сравнению с низкочувствительными животными |
Предлагаемый способ по сравнению с прототипом и другими известными способами имеет следующие преимущества:
1. Повышена достоверность анализа за счет внесения в инкубационную среду раствора ацидин-пепсина, избирательное действие которого на поврежденные лейкоциты обеспечивает разницу при их подсчете, и учета процента спонтанного лизиса лейкоцитов в контрольной пробе индивидуально у каждого животного.
2. Позволяет повторно проводить определение чувствительности организма через различные интервалы времени.
3. Позволяет проводить дифференцированное определение чувствительности организма к микробным антигенам различной таксономической принадлежности, что невозможно при постановке внутрикожной пробы.
4. Прост в исполнении, нетрудоемок, позволяет сократить время анализа по сравнению с известными.
5. Безвреден для животных и исполнителей.
6. Экономит дорогостоящие реактивы и препараты.
Формула изобретения
Способ определения чувствительности лошадей к антигенам микроорганизмов различной таксономической принадлежности, включающий проведение реакции лейкоцитолиза с лейкоцитами крови с использованием антигена, подсчет количества лейкоцитов в камере Горяева до и после инкубации и последующим определением чувствительности организма по показателю лейкоцитолиза, отличающийся тем, что при постановке реакции вначале в пробы вносят раствор ацидин-пепсина, подсчет количества лейкоцитов до инкубации проводят только в контрольной пробе, а показатель лейкоцитолиза (ПЛЦ) определяют после инкубации опытной и контрольной проб по формуле:
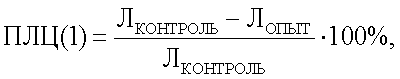
с последующим вычетом процента спонтанного лейкоцитолиза (СЛЦ) в контрольной пробе
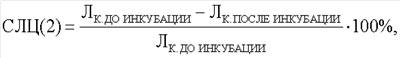
при итоговом значении ПЛЦ(3) до 20% чувствительность организма считают низкой, 20-40% – средней, 40% и более – высокой.
|
|