Патент на изобретение №2383019
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ БРОНХИАЛЬНОЙ АСТМЫ
(57) Реферат:
Изобретение относится к области медицины, а именно к пульмонологии и аллергологии. Предложен способ прогнозирования риска развития бронхиальной астмы с помощью прогностической модели, основанной на данных генотипирования с учетом описторхозной инвазии в регионах, эндемичных по гельминтной инвазии. В крови человека определяют полиморфные варианты генов SOCS7 (rs3890580), PIASX (rs9304337), дополнительно учитывают факт наличия/отсутствия описторхоза и рассчитывают вероятность отнесения индивида к группе с низким риском развития бронхиальной астмы и высоким риском развития бронхиальной астмы. Точность предсказания на основе предложенного способа составляет 64-75%. 4 табл.
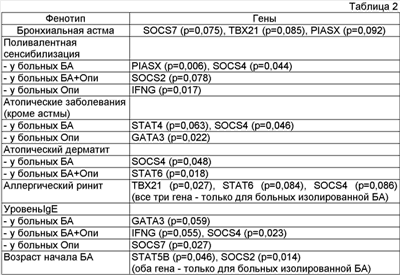
Изобретение относится к области медицины, пульмонологии и аллергологии и может быть использовано для прогнозирования риска развития аллергических заболеваний в регионах, эндемичных по гельминтной инвазии. Несмотря на огромное количество исследований, посвященных изучению аллергических заболеваний, в частности бронхиальной астмы (БА), проблема прогнозирований риска развития аллергопатологии остается практически нерешенной. Необходимость создания нового способа прогнозирования риска развития бронхиальной астмы и оценки риска проявления ее клинических симптомов связана с широкой распространенностью бронхиальной астмы (10% в популяции), частой манифестацией заболевания в раннем возрасте [1] и появлением новых резистентных терапии типов течения заболевания [2]. Для прогнозирования аллергических заболеваний очень важно выявление факторов, способных модифицировать иммунный ответ. К таким факторам относятся гельминтные агенты [3]. Эта проблема особенно актуальна для регионов с высокой распространенностью паразитарных инвазий. Гельминтные и аллергические болезни имеют в своей основе общие механизмы, ассоциированные с функционированием иммунной системы, в частности, посредством регуляции внутриклеточной цепи передачи сигнала. Поэтому прогнозирование риска развития бронхиальной астмы в регионах, эндемичных по определенным видам гельминтных инвазий, должно проводиться с учетом этих факторов, модифицирующих иммунный ответ. Известен способ прогнозирования аллергопатологии, включающий забор крови, стимуляцию цельной крови, инкубацию, центрифугирование, отбор супернатанта, иммуноферментный анализ цитокинов с последующим расчетом показателя активности цитокиновой регуляции, определяемого отношением индуцированной выработки цитокинов иммунокомпетентными клетками (стимулированной) к спонтанной (нестимулированной). Известный способ касается прогнозирования аллергопатологии и является неспецифичным в отношении риска развития бронхиальной астмы [4]. Известен способ прогнозирования риска возникновения бронхиальной астмы, заключающийся в проведении пробы на пыльцевую, пылевую и пищевую аллергии, с учетом непереносимости антибиотиков, анальгетиков и аспирина, выявляют наличие родственников, страдающих астмой, оценивают наличие атопического дерматита, экземы, крапивницы, профессиональных вредностей [5]. В известном способе разработана прогностическая функция, которая рассчитывается с учетом перечисленных показателей. Недостатком известного способа является неспецифичность кожных аллергопроб. Известные способы прогнозирования риска развития аллергопатологии не учитывают факта наличия гельминтной инвазии, что ограничивает их область применения. Наиболее близким к предлагаемому является способ прогнозирования риска развития бронхиальной астмы, основанный на определении генотипов и аллелей полиморфных вариантов генов ИЛ-4 и ИЛ-4Ра. Для прогнозирования риска развития бронхиальной астмы исследуют ДНК из лимфоцитов периферической венозной крови. Определяют генотипы и аллели полиморфных вариантов генов интерлейкина 4 методом полимеразной цепной реакции синтеза ДНК с последующим рестрикционным анализом у индивидов. При выявлении аллеля IL4T промоторного полиморфизма – 590 ОТ гена IL4 у татар, генотипа *11е50/*11е50 полиморфизма He50Val гена IL4Ra у русских прогнозируют риск развития бронхиальной астмы у обследуемого. Недостатками способа являются недостаточная точность и информативность, ограниченная область применения, поскольку количество оцениваемых генов крайне ограничено, а бронхиальная астма является мультифакториальным заболеванием, вклад в развитие которого могут вносить многие гены [6]. В известном способе ограничены методические подходы к определению генотипов и аллелей полиморфных вариантов генов интерлейкина 4, основанные на определении генотипов и аллелей полиморфных вариантов генов ИЛ-4 и ИЛ-4Ра. Новая техническая задача – разработка способа прогнозирования риска развития бронхиальной астмы с помощью прогностической модели, основанной на данных генотипирования с учетом описторхозной инвазии в регионах, эндемичных по гельминтной инвазии. Для решения поставленной задачи в способе прогнозирования риска развития бронхиальной астмы, заключающемся в исследовании ДНК, выделенной из лимфоцитов периферической венозной крови пациента, определение генотипов и аллелей полиморфных вариантов генов интерлейкина 4 методом полимеразной цепной реакции синтеза ДНК с последующим рестрикционным анализом у индивидов, определяют полиморфные варианты генов SOCS7 (rs3890580), PIASX (rs9304337), также дополнительно учитывают факт наличия/отсутствия описторхоза и рассчитывают вероятность отнесения индивида к группе с низким риском развития бронхиальной астмы и высоким риском развития бронхиальной астмы R1 и R2, при этом R1 для индивидов с низким риском развития БА рассчитывают по формуле: R1=-2,91+1,25*Opi+2,44*PIASX+l,25*SOCS7, где Opi – описторхоз: причем, при наличии значение равно 1, при отсутствии – 0; PIASX – генотипы, PIASX (rs9304337): A/A – 2, A/G – 1, G/G – 0; SOCS7- генотип SOCS7 (rs3890580): Т/Т – 1, А/Т – 1, А/А – 0; 1,25; 2,44; 1,25 – численные значения являются коэффициентами, (-2,91) – константа для индивидов с низким риском развития бронхиальной астмы, a R2 для индивидов с высоким риском развития бронхиальной астмы рассчитывают по формуле: R2=-2,12+l,56*Opi+2,26*PIASX+1,60*SOCS7, где Opi – описторхоз: значение при его наличии – 1, при отсутствии – 0; PIASX – генотипы PASX (rs9304337): А/А – 2, A/G – 1, G/G – 0; SOCS7 – генотип SOCS7 (rs3890580): Т/Т – 1, А/Т – 1, А/А – 0; 1,56; 2,26; 1,60 – численные значения являются коэффициентами, (-2,12) – константа для индивидов с высоким риском развития бронхиальной астмы, и при R1>R2 прогнозируют низкий риск развития бронхиальной астмы, а при R1 Новым в изобретении является то, что определяют полиморфные варианты генов SOCS7 (rs3890580), PIASX (rs9304337), также дополнительно учитывают факт наличия/отсутствия описторхоза и рассчитывают вероятность отнесения индивида к группе с низким риском развития бронхиальной астмы и высоким риском развития бронхиальной астмы R1 и R2, при этом R1 для индивидов с низким риском развития БА рассчитывают по формуле: R1=-2,91+1,25*Opi+2,44*PIASX+1,25*SOCS7, где Opi – описторхоз; причем при наличии значение равно 1, при отсутствии – 0; PIASX – генотипы, PIASX (rs9304337): A/A – 2, A/G – 1, G/G – 0; SOCS7 – генотип, SOCS7 (rs3890580): Т/Т – 1, А/Т – 1, A/A – 0; 1,25; 2,44; 1,25 – численные значения являются коэффициентами, (-2,91) – константа для индивидов с низким риском развития бронхиальной астмы, а R2 для индивидов с высоким риском развития бронхиальной астмы рассчитывают по формуле: R2=-2,12+1,56*Opi+2,26*PIASX+1,60*SOCS7, где Opi – описторхоз: значение при его наличии – 1, при отсутствии – 0; PIASX – генотипы PIASX (rs9304337): А/А – 2, A/G – 1, G/G – 0; SOCS7 – генотип SOCS7 (rs3890580): Т/Т – 1, А/Т – 1, А/А – 0; 1,56; 2,26; 1,60 – численные значения являются коэффициентами, (-2,12) – константа для индивидов с высоким риском развития бронхиальной астмы, и при R1>R2 прогнозируют низкий риск развития бронхиальной астмы, а при R1 Способ осуществляют следующим образом Гены, предложенные для генотипирования, кодируют внутриклеточные сигнальные молекулы, включенные в негативную регуляцию цитокиновой сети [7]. Продукты указанных генов вовлечены в функциональные взаимоотношения, являясь важными звеньями цитокиновой сети, фенотипический результат работы которой зависит как от степени экспрессии генов, определяемой, в частности, их полиморфизмом, так и от средового контекста, в котором эта экспрессия осуществляется. Из уровня техники не известно критериев прогнозирования риска развития бронхиальной астмы с учетом генов молекул внутриклеточной цепи передачи сигнала с учетом факта описторхозной инвазии, таким образом, изобретение соответствует критерию «новизна»: построена прогностическая модель; оценка риска развития БА производится с учетом фактора, модифицирующего иммунный ответ, – описторхоза; не существует ограничений в методах определения аллельных вариантов однонуклеотидных замен в крови человека. Точность предсказания на основе предложенного способа составляет 64-75% (применение рассчитанных диагностических функций должно давать корректное предсказание в более чем половине случаев (до двух третей выборки)). Способ осуществляют следующим образом: У индивида, для которого производится оценка риска развития БА: 1. Проводят определение наличия/отсутствия описторхоза. 2. Проводят определение в крови человека аллельных вариантов однонуклеотидных замен в генах SOCS7 (rs3890580), PIASX (rs9304337). 3. Определяют вероятность отнесения индивида к группе с низким риском развития бронхиальной астмы и высоким риском развития бронхиальной астмы R1 и R2, причем R1 для индивидов с низким риском развития БА рассчитывают по формуле: R1=-2,12+1,56*Opi+2,26*PIASX+1,60*SOCS7, где Opi – описторхоз: при наличии – 1, при отсутствии – 0; PIASX – генотипы PIASX (rs9304337): A/A – 2, A/G – 1, G/G – 0; SOCS7 – генотип SOCS7 (rs3890580): Т/Т – 1, А/Т – 1, А/А – 0; 1,56; 2,26; 1,60 – численные значения являются коэффициентами, (-2,12) – константа для индивидов с низким риском развития бронхиальной астмы, и R2 для индивидов с высоким риском развития бронхиальной астмы рассчитывают по формуле: R2=-2,91+1,25*Opi+2,44*PIASX+1,25*SOCS7, где Opi – описторхоз: при наличии – 1, при отсутствии – 0; PIASX-генотипы PIASX (rs9304337): А/А – 2, A/G – 1, G/G – 0; SOCS7 – генотип SOCS7 (rs3890580): Т/Т – 1, А/Т – 1, А/А – 0; 1,25; 2,44; 1,25 – численные значения являются коэффициентами, численное значение (-2,91) – константа для индивидов с высоким риском развития бронхиальной астмы, и при R1>R2 прогнозируют высокий риск развития бронхиальной астмы, а при R1 Критерии предлагаемого способа оценки риска развития бронхиальной астмы подобраны на основании анализа данных клинических исследований пациентов с помощью прогностической модели, основанной на выявлении наличия/отсутствия описторхоза и определении в крови человека аллельных вариантов однонуклеотидных замен в генах SOCS7 (rs3890580), РIАSX (rs9304337), для чего проведено углубленное клинико-функциональное, аллергологическое и паразитологическое обследование 549 добровольцев, соответствующих критериям включения. Критерии включения для больных бронхиальной астмой: – Возраст от 18 до 60 лет. – Европеоидная раса. – Положительные аллергопробы с 1 и более аэроаллергенами. – Пациенты, имеющие ранее подтвержденный диагноз бронхиальной астмы. – Документированные сведения об обратимости обструкции при проведении пробы с b2-агонистом >15%. – Наличие подтвержденного ранее синдрома атопии (отягощенный семейный атопический анамнез, уровень IgE сыворотки >100 МЕ/мл, положительные результаты скарификационного аллерготестирования). – Наличие данных исследования функции внешнего дыхания по результатам спирографии и провокационного теста с метахолином (при отсутствии противопоказаний). Пациенты с БА были разделены по тяжести следующим образом: 1. Легкое персистирующее течение (симптомы 1-3 раза в месяц; ночные симптомы 0-1 раз в месяц; ОФВ1 (ПСВ)>70-80%; суточная лабильность бронхов 0-20%); 2. Среднетяжелое персистирующее течение (симптомы>1 раза в неделю, но не ежедневно; ночные симптомы 1-2 раза в неделю: ОФВ1 (ПСВ) 60-80%; суточная лабильность бронхов 20-30%); 3. Тяжелое персистирующее течение (симптомы несколько раз в неделю; ночные симптомы ежедневно; ОФВ1 (ПСВ)<60%; суточная лабильность бронхов > 30%). Критерии включения для больных хроническим описторхозом: – Возраст от 18 до 60 лет. – Европеоидная раса. – Пациенты, имеющие ранее подтвержденный или впервые выявленный диагноз хронического описторхоза. – Положительные результаты анализов на описторхоз (обнаружение яиц описторхисов в фекалиях и/или дуоденальном содержимом). – Пациенты, не получавшие антигельминтную терапию в отношении описторхоза в течение 5 лет до включения в исследование. Критерии включения для больных бронхиальной астмой в сочетании с хроническим описторхозом: – Возраст от 18 до 60 лет. – Европеоидная раса. – Положительные аллергопробы с 1 и более аэроаллергенами. – Пациенты, имеющие ранее подтвержденный диагноз бронхиальной астмы. – Документированные сведения об обратимости обструкции при проведении пробы с b2-агонистом > 15%. – Наличие подтвержденного ранее синдрома атопии (отягощенный семейный атопический анамнез, уровень IgE сыворотки >100 МЕ/мл, положительные результаты скарификационного аллерготестирования). – Наличие данных исследования функции внешнего дыхания по результатам спирографии и провокационного теста с метахолином (при отсутствии противопоказаний). – Пациенты, имеющие ранее подтвержденный или впервые выявленный диагноз хронического описторхоза. – Положительные результаты анализов на описторхоз (обнаружение яиц описторхисов в фекалиях и/или дуоденальном содержимом). – Пациенты, не получавшие антигельминтную терапию в отношении описторхоза в течение 5 лет до включения в исследование. Критерии включения для здоровых индивидов: – Возраст от 18 до 60 лет. – Европеоидная раса. – IgE < 100 ME/мл. – Отсутствие клинических проявлений аллергических заболеваний на момент обследования и в анамнезе. – Отрицательные результаты анализов на описторхоз (обнаружение яиц описторхисов в фекалиях и/или дуоденальном содержимом). – Критериями исключения были: – Нежелание пациента принимать участие в исследовании. – Несоблюдение требований исследования. – Наличие др. (кроме описторхоза) видов гельминтной инвазии. – Невозможность выполнить исследование FEV1, PEF, форсированной жизненной емкости легких (FVC) и бронхиальной гиперреактивности на любом этапе – данные таких пациентов не анализируются. – Наличие у пациента психических расстройств, прием пациентом психотропных препаратов. – Наличие у пациента декомпенсированных сопутствующих заболеваний. После применения критериев исключения в сформированные конечные клинические группы вошли 368 чел (92 больных бронхиальной астмой, 104 больных описторхозом, 52 больных с сочетанием астмы и описторхоза и 120 здоровых добровольцев). Для этих групп пациентов определили аллельные варианты однонуклеотидных замен в генах IL12A (rs1042155), IL12B (rs3212227), IL18 (rsl7417193), IL12RB1 (rs11575934), TBET (rs11652969), GATA3 (rs570613), STAT1 (rs11549696), STAT2 (rs2066807), STAT3 (rs1064116), STAT4 (rs7572482), STAT5A (rs2230123), STAT5B (rs16967593), STAT6 (rs 167769), SOCS1 (rs11549428), SOCS2 (rs1316740), SOCS3 (rs17849241), SOCS4(rs 1187876), SOCS5(rs6737848), SOCS6(rs2231559), SOCS7 (rs3890580), CISH (rs419202), PIAS1 (rs1802433), PIAS3 (rs12756687), PIASX (rs9304337), PIASY (rs3760903), ICOS (rs55035145), IFNG (rs2069705). Проведен анализ ассоциаций полиморфизмов указанной панели генов с атопическими заболеваниями (БА, атопический дерматит, аллергический ринит), уровнем общего IgE, наличием специфической и поливалентной сенсибилизации по данным скарификационных аллергопроб, тяжестью течения БА и возрастом ее начала, а также с параметрами легочной функции, имеющими диагностическую ценность для БА (PEF, FEV1, FVC, FEV1/FVC, FEV25, FEV50, FEV75: во всех случаях проанализирован уровень признаков, выраженный как процент от должных значений). Выборки данных проверяли на нормальность распределения (критерий Колмогорова-Смирнова). При соответствии нормальному закону распределения признака в исследуемых выборках проверку гипотезы о равенстве средних выборочных величин проводили с использованием t-критерия Стьюдента. Для оценки статистической значимости различий показателей выборок, не подчиняющихся закону нормального распределения, использовали непараметрический критерий Манна-Уитни (U-тест) и Краскела-Уоллиса. Для сравнения частот аллелей и генотипов в различных группах использовали анализ таблиц сопряженности, включая расчет статистики Статистически значимыми различия принимали при p<0,100. Это было сделано с учетом относительно невысокой численности анализируемых групп, а также принимая во внимание, что данный этап исследования предварял построение прогностической генотип-специфической модели. Поэтому важно было определить не столько контрастные различия между сравниваемыми группами, сколько наиболее информативные для построения предиктивной модели гены. Данные о связи полиморфизма исследуемых генов с количественными признаками (уровень IgE, возраст начала БА, показатели легочной функции) суммированы в таблице 1, в которой приведены случаи выявленных статистически значимых (p<0,100)* различий уровней метрических признаков у носителей разных генотипов в группах больных астмой (БА), описторхозом (Опи) и астмой в сочетании с описторхозом (БА+Опи). Таким образом, проведенный анализ позволил выявить ряд генов, полиморфизм которых может быть информативным для предсказания развития заболевания и особенностей его проявления. Таблица 2, в которой представлены группы генов с вероятной высокой информативностью для прогнозирования развития и формирования особенностей клинических фенотипов атопических заболеваний. Для построения модели генотип-специфического подхода диагностики риска БА и A3 в регионе, эндемичном по описторхозу, использовали лог-регрессионный анализ (для качественных зависимых признаков), ковариационный анализ (для количественных зависимых признаков) и дискриминантный анализ. С помощью лог-регрессионного и ковариационного анализа сделана попытка уточнить предиктивный потенциал наиболее информативных генов с учетом факта описторхозной инвазии. Исходя из возможностей доступного пакета статистических программ (STATISTICA 6.0) моделировали взаимодействие описторхоза с одним или двумя генами. Результаты лог-регрессионного анализа для риска развития БА и атопических признаков на фоне описторхоза с учетом генетического полиморфизма представлены в таблице 3. Выбор наиболее информативного сочетания осуществляли на основании величины значения функции потери: наименьшее значение соответствует «лучшей» модели. С помощью этого подхода для риска БА выбрана модель описторхоз + PIASX+SOCS7; для риска поливалентной сенсибилизации – описторхоз + IFNG+SOCS2; для риска атопических заболеваний (кроме БА) – описторхоз + GATA3+SOCS4; для риска аллергического ринита – описторхоз + STAT6+SOCS4. Для риска атопического дерматита ни одна из протестированных моделей не оказалась статистически значимой. Следует отметить, что практически во всех моделях фактор описторхозной инвазии имеет самое высокое предиктивное значение (судя по величине отношения шансов). Исключение составила модель для предсказания риска поливалентной сенсибилизации. По результатам дискриминантного анализа предложены классифицирующие функции для риска БА, развития поливалентной сенсибилизации у больных БА, развития АР, развития других A3, риска среднетяжелой или тяжелой БА (таблица 4, где представлены классифицирующие функции риска патологических состояний. Примечание. Представлены только статистически значимые модели. * – в скобках приведено значение относительного риска ** – в скобках приведена величина критерия хи -квадрат). Примеры на осуществление способа Пример 1. Больной К., 48 лет. Больного К., 48 лет, с мая 2003 года беспокоили приступы удушья, с эпизодами свистящего дыхания и одышки. С момента появления первых симптомов пациент наблюдался у участкового терапевта с диагнозом Хронический обструктивный бронхит. По поводу данного заболевания пациент получал на регулярной основе Эуфиллин 100 мг по 1 таблетке один раз в сутки утром. На фоне данной терапии клинической динамики не зафиксировано. К пульмонологу пациент впервые обратился 21.11.2007 года. Параллельно с описываемыми далее обследованиями был оценен риск развития бронхиальной астмы согласно предлагаемому способу. Для пациента была проведена диагностика описторхоза и определены генотипы с использованием метода оценки полиморфизма длин рестрикционных фрагментов [8] аллельных вариантов генов SOCS7 (rs3890580), PIASX (rs9304337). В результате обследования у пациента не было обнаружено описторхоза. По результатам молекулярно-генетического анализа выявлены следующие генотипы: генотип А/А по гену PIASX и генотип А/Т по гену SOCS7. С низким риском развития БА классификационная функция имеет вид R1=-2,91+1,25*0+2,44*2+1,25*1=-3,22. С высоким риском развития БА классификационная функция имеет вид R2=-2,12+1,56*0+2,26*2+1,60*1=4. R1 Дальнейшее обследование позволило выявить у пациента БА. Атопический статус Уровень общего IgE в сыворотке крови (от 22.11.2007 г.) составил 102,9 МЕ/мл. Пациент не имеет других клинических проявлений атопии. Результаты клинического осмотра Общее состояние ближе к удовлетворительному, положение активное, сознание ясное. Кожные покровы обычной окраски, влажные. Носовое дыхание не затруднено. Периферические лимфоузлы не увеличены. Костно-мышечная система без видимых деформаций, движения в суставах в полном объеме. При осмотре грудная клетка цилиндрическая. Частота дыхания составляет 19 в минуту, фаза выдоха удлинена. При пальпации грудной клетки болевые точки отсутствуют. При перкуссии перкуторный звук легочный, одинаковый над симметричными участками. При аускультации определяется жесткое дыхание с удлиненным выдохом, сухие высокие хрипы по задней поверхности легких. При осмотре области сердца видимых патологических изменений нет. Число сердечных сокращений 72 в минуту, соответствует пульсу. Тоны сердца приглушены, ритмичные. Артериальное давление 125/70 мм рт. ст., одинаковое на обеих руках. При пальпации живот мягкий, безболезненный. Печень и селезенка не увеличены. Пузырные симптомы отрицательные. Симптом поколачивания отрицательный с обеих сторон. Дизурических явлений и периферических отеков нет. Спирография (от 21.11.2008) ФВД: ОФВ1 – 22,3%, ПСВ – 21,5% от должных значений. Обратимость бронхиальной обструкции в тесте с сальбутамолом составила 24,6%. Тест на гиперреактивность бронхов с гистамином не был выполнен в связи с наличием противопоказаний. Клинический диагноз Основной Бронхиальная астма, неатопическая, тяжелое персистирующее течение Сопутствующий нет По поводу бронхиальной астмы пациенту назначена базисная противовоспалительная терапия – Серетид 25/250 мкг по 2 ингаляции 2 раза в сутки (1000 мкг/сут по ФП). Вентолин в режиме «по требованию». Пациент проинструктирован о правильной технике ингаляции с помощью ДАИ. Повторный визит назначен через 3 месяца. Через 3 месяца от начала использования базисной терапии На фоне проводимой терапии отмечена положительная динамика. Жалобы: на момент осмотра нет. В течение данного периода единичные симптомы после физической нагрузки, купировал приемом вентолина; обострений за время периода наблюдения не зарегистрировано; потребность в бронхолитиках короткого действия в течение последнего месяца отсутствует. Лечение получает в полном объеме. Результаты клинического осмотра: состояние удовлетворительное, самочувствие не страдает. Кожные покровы чистые, умеренной влажности; слизистые чистые. Аускультативно дыхание везикулярное, хрипов нет; тоны сердца ясные, ритмичные, патологических шумов нет. Живот мягкий, безболезненный, физиологические оправления не нарушены. С целью исключения влияния сопутствующей патологии на течение бронхиальной астмы проведено обследование на наличие описторхозной инвазии (трехкратная копроовоскопия). Результат отрицательный. Спирометрия: ОФВ1 – 114,1%, ПСВ – 116,3% от должных величин. Таким образом, на фоне текущей терапии астмы достигнуты критерии контроля заболевания. В соответствии с рекомендациями GINA, 2006 проведен пересмотр текущей терапии в сторону уменьшения суточной дозы ИКС. Пациенту назначена базисная противовоспалительная терапия – Серетид 25/250 мкг по 1 ингаляции 2 раза в сутки (500 мкг/сут по ФП). Вентолин в режиме «по требованию». Повторный визит назначен через 3 месяца. Таким образом, предлагаемый способ позволяет с достаточной точностью прогнозировать риск возникновения бронхиальной астмы. Построена прогностическая модель, с помощью которой производят оценку риска развития БА с учетом фактора, модифицирующего иммунный ответ, – описторхоза. При этом не существует ограничений в методах определения аллельных вариантов однонуклеотидных замен в крови человека. Анализ данных клинического материала подтвердил высокую точность предсказания на основе предложенного способа, которая составляет 64-75%, применение рассчитанных диагностических функций должно давать корректное предсказание в более чем половине случаев, до двух третей выборки.
Источники информации
4. Заявка RU 5. Патент RU 6. Патент RU 8. Патологическая анатомия генома человека / Пузырев В.П., Степанов В.А. – Новосибирск: Наука. Сиб. Предприятие РАН, 1997. – 224 с.
Формула изобретения
Способ прогнозирования риска развития бронхиальной астмы, заключающийся в определении в крови человека генотипов и аллельных вариантов однонуклеотидных замен, отличающийся тем, что определяют полиморфные варианты генов SOCS7 (rs 3890580), PIASX (rs 9304337), дополнительно учитывают факт наличия/отсутствия описторхоза и рассчитывают вероятность отнесения индивида к группе с низким R1 и высоким R2 риском развития бронхиальной астмы, при этом R1 рассчитывают по формуле: ,> |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 2 Пирсона с поправкой Йетса на непрерывность и соответствующего ей уровня значимости, а также точного уровня значимости по алгоритму Фишера-Ирвина. Для оценки статистической значимости расхождений между клиническими данными о наличии описторхоза и данными генотипирования использовали критерий
2 Пирсона с поправкой Йетса на непрерывность и соответствующего ей уровня значимости, а также точного уровня значимости по алгоритму Фишера-Ирвина. Для оценки статистической значимости расхождений между клиническими данными о наличии описторхоза и данными генотипирования использовали критерий 
 1. – С.42-46.
1. – С.42-46.