Патент на изобретение №2167161
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ ТЕТРАФУРАЗАНО[3,4-b:3′,4′-f:3″,4″-j:3′”,4′”-N][1,4,5,8,9,12,13,16]ОКТААЗАБ ИЦИКЛО[14.2.2]ЭЙКОЗА-4,8,12-ТРИЕНА И СПОСОБ ИХ ПОЛУЧЕНИЯ
(57) Реферат: Изобретение относится к новому классу химических соединений, а именно к производным новой гетероциклической системы – тетрафуразано[3,4-b:3′,4′-f: 3”, 4”-j: 3”’, 4”’-n-[1,4,5,8,9,12,13,16]-октаазабицикло[14.2.2]эйкоза-4,8,12-триена общей формулы (I), где R1 – R4 = Н, низший алкил или низший алкил, содержащий функциональные группы, такие, как ОR5, SR5, NR5R6, СОNR5R6 или СООR7, где R5, R6, R7 = Н, низший алкил, или R2 + R3 и/или R1 + R4 вместе с соседними атомами углерода пиперазинового цикла образуют алициклический, бензольный, или гетероциклический аннелированный цикл. Описан также способ их получения, заключающийся в том, что производные бис-1,4-(3-аминофуразанил-4,4′-азофуразан-3-ил)-пиперазина обрабатывают дибромизоциануратом в среде трифторуксусной кислоты или ее смеси с инертными органическими растворителями, такими, как СН2Сl2, СН2Сl3, СН3СN. Соединения могут найти применение в биохимии при изучении регуляторных эффектов оксида азота и механизма действия растворимой формы гуанилатциклазы (рГЦ). 2 с.п.ф-лы. 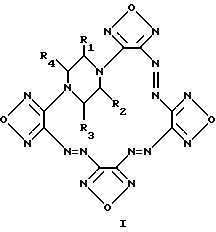
Изобретение относится к новому классу химических соединений, а именно к производным новой гетероциклической системы – тетрафуразано[3,4-b:3′,4′-f: 3”, 4”-j: 3”’,4”’- n][1,4,5,8,9,12,13,16]-октаазабицикло[14.2.2]эйкоза-4,8,12-триена общей формулы (I): 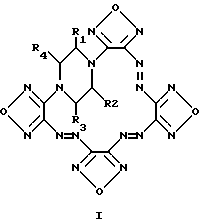 где R1, R2, R3, R4 = H, низший алкил, или низший алкил содержащий функциональные группы, такие как OR5, SR5, NR5R6, CONR5R6 или COOR7, где R5, R6, R7 = H, низший алкил, или R2 + R3 и/или R1 + R4 вместе с соседними атомами углерода пиперазинового цикла образуют алициклический, бензольный, или гетероциклический аннелированный цикл и способу их получения. Предлагаемые соединения могут найти применение в биохимии, в частности, при изучении регуляторных эффектов оксида азота и механизма действия растворимой формы гуанилатциклазы (рГЦ). Тетрафуразано[3,4-b: 3′,4′-f:3”,4”-j:3”’,4”’- n][1,4,5,8,9,12,13,16] -октаазабицикло[14.2.2] эйкоза-4,8,12-триен является представителем соединений, молекула которых содержит до сих пор не встречавшуюся одновременно последовательность атомов и связей в аннелированной гексациклической системе, включающей четыре фуразановых (1,2,5-оксадиазольных), пиперазиновый и [1,4,5,8,9,12,13,16] oктaaзaбицикло[14.2.2] эйкoзa-4,8,12-триеновый циклы, и представляет по сути новый криптант. Известны макроциклы, в которых четыре фуразановых цикла и три азогруппы (-N= N-) непосредственно участвуют в построении молекулы криптанта, образуя пентациклическую систему. Так, макроцикл (II) получается при обработке 4,4′-динитропроизводного (III) солями основного характера в среде ацетонитрила [Sheremetev А. В. , Kulagina V. О. and Ivanova Е.A. “Zero-Hydrogen Furazan Macrocycles with Oxy and Azo Bridges”. J.Org.Chem., 1996, 61, (4) 1510-1511]. 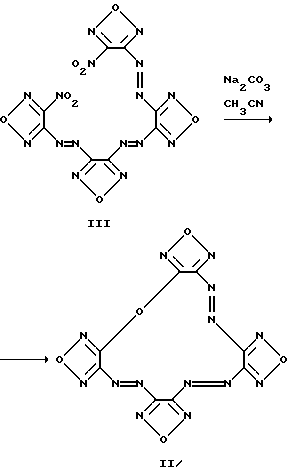 Необходимо отметить, что соединение (II), во-первых, содержит вместо пиперазинового цикла простой эфирный мостик, и, во-вторых, не имеет и не может иметь, никаких заместителей, являясь единственно возможным представителем данного класса макроциклов. Получить указанным способом соединение (I) не представляется возможным, так как процесс макроциклизации заключается в образовании простой эфирной связи между фуразановыми циклами (C-O-C) фрагмента, отсутствующего в структуре предлагаемого класса соединений. Известен также макроцикл (IV), образующийся в качестве одного из продуктов при окислительной макроциклизации диаминов (V), (VI) или (VIII) при действии дибромизоцианурата (ДБИ) в среде ацетонитрила при  20oC [Батог Л. В. , Рожнов В.Ю., Константинова Л.С., Эман В.Е., Декаприлевич М.О., Стручков Ю. Т. , Семенов С.Е., Лебедев О.В., Хмельницкий Л.И. “Окислительная макроциклизация 3,4-диаминофуразана и 4,4′-диаминоазофуразана под действием дибромизоцианурата. Кристаллические структуры гекса и октадиазенофуразановых макроциклов” Изв. АН, сер. хим. , 1996, (5), 1250-1254]. Однако макроцикл (IV), так же как и макроцикл (II), не включает фрагмент пиперазина и не может содержать заместителей, позволяющих корректировать его свойства. 20oC [Батог Л. В. , Рожнов В.Ю., Константинова Л.С., Эман В.Е., Декаприлевич М.О., Стручков Ю. Т. , Семенов С.Е., Лебедев О.В., Хмельницкий Л.И. “Окислительная макроциклизация 3,4-диаминофуразана и 4,4′-диаминоазофуразана под действием дибромизоцианурата. Кристаллические структуры гекса и октадиазенофуразановых макроциклов” Изв. АН, сер. хим. , 1996, (5), 1250-1254]. Однако макроцикл (IV), так же как и макроцикл (II), не включает фрагмент пиперазина и не может содержать заместителей, позволяющих корректировать его свойства.
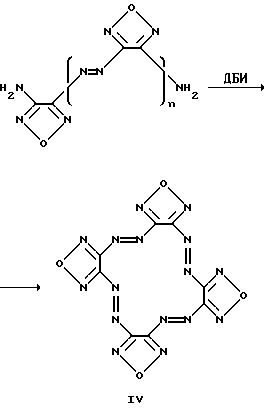 V(n-0), VI(n=1), VII(n=3) 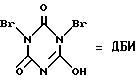 Способ, использованный для синтеза соединения (IV), не может быть использован для получения макроциклов формулы (I), так как введение пиперазинового фрагмента в исходное соединение делает непригодным применение ДБИ в среде указанного растворителя. Задачей настоящего изобретения являются создание производных новой полигетероциклической системы, содержащей в своем составе как фуразановые и [1,4,5,8,9,12,13,16]октаазабицикло[14.2.2]эйкоза-4,8,12-триеновые циклы, так и фармакофорный (не)замещенный пиперазиновый фрагмент и разработка способа их получения. Поставленная задача достигается новыми соединениями – производными тетрафуразано[3,4-b: 3′, 4′-f:3”,4”-j:3”’,4”’-n] [1,4,5,8,9,12,13,16]-октаазабицикло[14.2.2] эйкоза-4,8,12-триена вышеуказанной общей формулы (I), где R1, R2, R3, R4 = H, низший алкил, или низший алкил содержащий функциональные группы, такие как OR5, SR5, NR5R6, CONR5R6 или COOR7, где R5, R6, R7 = H низший алкил, или R2 + R3 и/или R1 + R4 вместе с соседними атомами углерода пиперазинового цикла образуют алициклический, бензольный, или гетероциклический аннелированный цикл и способом их получения, заключающимся в том, что производные бис-1,4-(3-аминофуразанил-4,4′-азофуразан-3-ил)-пиперазина (VIII) обрабатывают дибромизоциануратом (ДБИ) в среде трифторуксусной кислоты или ее смеси с инертными органическими растворителями, такими как CH2CL2, CHCl3, CH3CN и др. 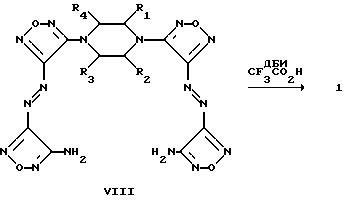 Выход целевых соединений составляет 50-85%. Строение полученных соединений доказано данными элементного анализа, масс-, ИК-, ЯМР-спектров. Таким образом, заявляемые соединения представляют собой производные неизвестной ранее конденсированной гексациклической системы, содержащей в своем составе как фуразановые и [1,4,5,8,9,12,13,16]октаазабицикло[14.2.2]эйкоза-4.8,12-триеновый циклы, так и (не)замещенный пиперазиновый цикл и являются представителями нового класса соединений и новой гетероциклической системы. Наличие в структуре заявляемых соединений пиперазинового фрагмента, несущего заместители, позволяет синтезировать большой ряд аналогов, что дает возможность корректировать свойства целевых соединений. Необходимо отметить, что производные пиперазина широко используются при конструировании физиологически-активных соединений, однако ранее не использовались для создания веществ ингибирующих рГЦ. Предложенный способ основан на внутримолекулярной окислительной конденсации соединения, включающего два аминофуразанильных фрагмента, под действием ДБИ в среде трифторуксусной кислоты или ее смеси с инертными органическими растворителями (CH2Cl2, CHCl2, CH3CN и др.) с образованием азо-связи и замыканием цикла. Известен способ получения макроциклов, включающих эндоциклический азофуразановый фрагмент, обработкой соответствующих бис(аминофуразанильных) соединений ДБИ в среде инертных органических растворителей (CH3CN, CH2Cl2, CHCl3, CCl4, бензол и толуол) при 20-40oC [Sheremetev A.B., Kharitonova О.V. , “Construction of Crown Ethers possessing an Azofurazan Subunit”. Mendeleev Commun., 1992, 157-158; Шереметев А.Б., Харитонова О.В., Новикова Т.С., Хмельницкий Л. И. “Способ получения 2,3,6,7-дифуразано-4,5-диаза-1,8,11-триоксациклотридекатриена-2,4,6” Авт. св. СССР 1803407, кл. C 07 D 498/14, 1993.] . Этот способ, в частности, положен в основу схемы синтеза макроцикла (IV). Ни в одном из известных ранее способов формирования двойной N=N связи в синтезе макроциклов, включающих азофуразановый фрагмент, не использовалось сочетание ДБИ с трифторуксусной кислотой или ее смесей с инертными органическими растворителями. Необходимо отметить, что использование в качестве среды для реакции инертных органических растворителей в отсутствие трифторуксусной кислоты не приводит к получению целевых продуктов; исходные соединения количественно выделяются из реакционной среды. Лишь совокупность взятых для синтеза соединений общей формулы (I) условий и выбранные исходные соединения дали возможность добиться одной из указанных целей – получить новую гетероциклическую систему. Производные вышеуказанной общей формулы (I) могут быть использованы в биохимии, в частности, при изучении регуляторных эффектов оксида азота и механизма действия рГЦ. Гуанилатциклаза [КФ 4.6.1.2. ; гуанозин-5′-трифосфат-пирофосфат-лиаза (циклизующая); ГЦ] является ферментом, катализирующим биосинтез гуанозин-3′, 5′-циклофосфата (цГМФ) – универсального регулятора внутриклеточного метаболизма [Hobbs, A. J. “Soluble guanylate cyclase: the forgotten sibling” Trends in Pharm. Sci., 1997, 18, (12), 487-491]. ГЦ существует в двух формах – мембранной и растворимой (рГЦ) и играет ключевую роль в регуляции таких физиологических процессов, как сокращение и расслабление гладких мышц кровеносных сосудов и агрегация тромбоцитов. Основным эндогенным активатором рГЦ является оксид азота, который в результате взаимодействия с атомом железа гема, входящего в состав фермента, образует комплекс нитрозил-гем В настоящее время для изучения возможного участия рГЦ в различных физиологических процессах, применяют различные ингибиторы данного фермента. Одним из таких ингибиторов, близким к соединениям общей формулы (I) по действию и структуре, является бис(N,N-диметиламид) азодикарбоновой кислоты (диамид): 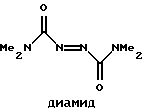 оказывающий ингибирующее действие на базальную и NO-зависимую активность рГЦ [Craven, P.A., DeRubertis, F.R. “Effects of thiol inhibition on hepatic guanylate cyclase activity. Evidence for the involvement of vicinal dithiols in the supression of basal and agonist-stimulated activity”, Biochim Biophys. Acta. 1978, 524, 231-244]. Основным недостатком данного соединения является низкая эффективность ингибирующего действия на рГЦ (IC50 = 0,5-20 мМ). Настоящее изобретение иллюстрируется следующими примерами. Пример 1. Тетрафуразано[3,4-b:3′,4′-f:3”,4”-j:3”’,4”’-n]- [1,4,5,8,9,12,13,16] октаазабицикло[14.2.2]эйкоза-4,8,12-триен (Ia, R1 = R2= R3 = R4 = H). а) Бис-1,4-[4-(4-аминофуразанилазо-3)фуразан-3-ил] пиперазин (VIIIa). К раствору 2,26 г (10 ммол) 4-амино-4′-нитроазофуразана в 50 мл CH2Cl2 при энергичном перемешивании и охлаждении (0-5oC) прибавляют раствор 0,43 г (5 ммол) пиперазина и 2,02 г триэтиламина (20 ммол) в минимальном количестве диметоксиэтана. После перемешивания реакционной массы при комнатной температуре в течение 4 ч, упаривают растворитель, остаток промывают водой и перекристаллизовывают из водного ДМСО. Получают 60% выход соединения VIIIa (R1 = R2 = R3 = R5 = Н) в виде желто-оранжевого порошка, т.пл. 256-258o. Масс-спектр, m/z: 444 ЯМР 13C (ДМСО-d6,  , м.д.): 156.9, 156.3, 155.2, 149.7, 47.1.
ИКС, (в KBr, , м.д.): 156.9, 156.3, 155.2, 149.7, 47.1.
ИКС, (в KBr,  , см-1): 3470, 3380, 2880, 1610, 1480, 1420, 1390, 1100.
Найдено, %: C 32.57 N 50.38 H 2.75 , см-1): 3470, 3380, 2880, 1610, 1480, 1420, 1390, 1100.
Найдено, %: C 32.57 N 50.38 H 2.75C12H12N16O4 (444.33) Вычислено, %: C 32.44 N 50.44 H 2.72 б) Тетрафуразано[3,4-b:3′,4′-f:3”,4”-j:3”’,4”’-n]-[1,4,5,8,9,12,13, 16]октаазабицикло[14.2.2]эйкоза-4,8,12-триен (Ia). К суспензии 0.44 г (1 ммоль) диамина (VIIIa) в 20 мл трифторуксусной кислоты добавляют 1.15 г (4 ммоля) ДБИ и перемешивают при комнатной температуре 1 час. Реакционную массу разбавляют 3 объемами хлористого метилена и фильтруют через небольшой слой силикагеля. Фильтрат упаривают, остаток перекристаллизовывают из хлороформа. Получают 0.36 г (85%) соединения (Iа), малиново-коричневые кристаллы, т. пл. 287-296oC (разл.). Масс-спектр, m/z: 440 ИКС, (в KBr,  , см-1): 2865, 1620, 1470, 1380, 1100, 980.
Найдено, %: C 32.75 N 50.87 H 1.88 , см-1): 2865, 1620, 1470, 1380, 1100, 980.
Найдено, %: C 32.75 N 50.87 H 1.88C12H8N16O4 (440.30) Вычислено, %: C 32.73 N 50.90 H 1.83 Пример 2. 17,20-Диметилтетрафуразано [3,4-b: 3′, 4′-f:3”,4”-j:3”’, 4”’-n] -[1,4,5,8,9,12,13, 16]октаазабицикло[14.2.2]эйкоза-4,8,12-триен (Ib, R1 = R2 = H, R3 = R4 = CH3) 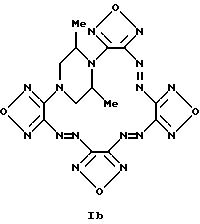 Соединение (Ib) получено аналогично соединению (Ia) из бис-1,4-[4-(4-аминофуразанилазо-3)фуразан-3-ил] -2,6-диметилпиперазина (VIIIb). Выход 81%. Фиолетово-коричневые кристаллы Т.пл. 271-286oC (разл.). Масс-спектр, m/z: 468 Найдено, %: C 35.93 N 47.80 H 2.61 C14H12N16O4 (468.35) Вычислено, %: C 35.90 N 47.85 H 2.58 Пример 3. Диметиламид тетрафуразано [3,4-b: 3′, 4′-f:3”,4”-j:3”’, 4”’-n] -[1,4,5,8,9,12,13,16] октаазабицикло[14.2.2]эйкоза-4,8,12-триен-17-уксусной кислоты (Ic, R1 = CH2CONMe2; R2 = R3 = R4 = H). 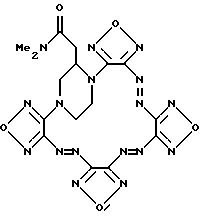 Ic Соединение (Ic) получено аналогично соединению (Ia) из диметиламида бис-1,4-[4-(4-аминофуразанилазо-3)фуразан-3- ил]пиперазин-2-уксусной кислоты (VIIIc). Выход 56%. Фиолетово-коричневые кристаллы Т.пл. 252-266oC (разл.). Масс-спектр, m/z: 524 Найдено, %: C 36.61 N 45.25 H 2.89 C14H12N16O4 (524.41) Вычислено, %: C 36.58 N 45.32 H 2.88 Пример 4. Гесафуразано [3,4-b: 3′, 4′-f: 3”,4”-j:3”’,4”’-n:3””, 4””-q: 3””’, 4””’-t] – [1,4,5,8,9,12,13,16]октаазабицикло[14.2.2]эйкоза-4,8,12-триен (Id). 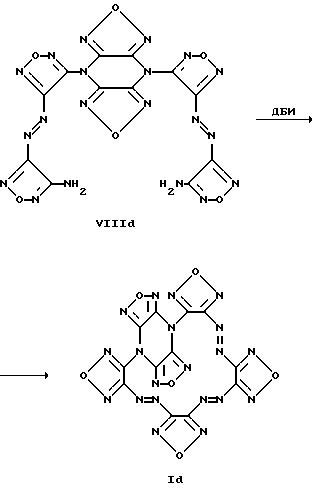 a) 4,8-Бис-[3-(4-аминофуразанилазо-3)фуразан-4- ил)дифуразано[3,4-b:3′, 4′-e]пиперазин (VIIId). К суспензии 0.95 г (5 ммолей) динатриевой соли дифуразано[3,4-b:3′,4′-e] пиперазина в 30 мл абс. CH3CN добавляли 0.1 г тетрабутиламмония фтористого и раствор 1,99 г (10 ммол) 4-амино-4′-фторазофуразана в 10 мл CH3CN и перемешивали при 70-80oC три часа. Реакционную массу охлаждали и разбавляли равным объемом воды, отфильтровывали осадок, промывали водой и хлороформом. После перекристаллизации из CH3CN/CCl4 получают 1.15 г соединения VIIId в виде оранжево-желтого порошка, т.пл. 325-329oC (разл). Масс-спектр, m/z: 524 ЯМР 136C (ДМСО-d6,  , м.д.): 145.1, 145.9, 149.3, 156.2, 157.5.
ИКС, (в KBr, , м.д.): 145.1, 145.9, 149.3, 156.2, 157.5.
ИКС, (в KBr,  , cм-1): 3475, 3380, 1605, 1510, 1423, 1110.
Найдено, %: С 27.53 N 53.40 H 0.80 , cм-1): 3475, 3380, 1605, 1510, 1423, 1110.
Найдено, %: С 27.53 N 53.40 H 0.80C12H4N20O6 (524.29) Вычислено, %: C 27.49 N 53.43 H 0.77 б) Гесафуразано [3,4-b: 3′, 4′-f: 3”,4”-j:3”’,4”’-n:3””,4””-q: 3””’, 4””’-t]- [1,4,5,8,9,12,13,16]октаазабицикло[14.2.2]эйкоза-4,8,12-триен (Id). Окислительную конденсацию соединения (VIIId) проводят аналогично примеру 1б. Выход соединения Id составляет 52%. Коричневый порошок, т.пл. 295-298oC (разл.). Масс-спектр, m/z: 520 ЯМР 13C (ДМСО-d6,  , м.д.): 144.3, 145.2, 149.8, 156.1, 157.9.
ИКС, (в KBr, , м.д.): 144.3, 145.2, 149.8, 156.1, 157.9.
ИКС, (в KBr,  , см-1): 1625, 1615, 1530, 1423, 1110, 1100, 990.
Найдено, %: C 27.74 N 53.80 , см-1): 1625, 1615, 1530, 1423, 1110, 1100, 990.
Найдено, %: C 27.74 N 53.80C12N20O6 (520.26) Вычислено, %: C 27.70 N 53.84 Структура соединения Id также однозначно подтверждена рентгено-структурным исследованием монокристалла. Пример 5. Ингибирующее действие макроциклов общей формулы (I) на базальную активность препарата очищенной рГЦ из легких крысы. Препарат очищенной рГЦ из легких крысы был получен известным способом с модификациями. Легкие крысы (100 г) гомогенизировали с помощью блендера Уорринга в 300 мл 50 мМ Трис-HCl буфера (pH 7,8) содержащего 5 мМ дитиотреитол (буфер A) три раза по 15 с. Центрифугировали полученный гомогенат при 10000 g (4oC, 20 мин). После центрифугирования супернатант отбирали и фильтровали через стекловату. Фильтрат центрифугировали при 100000 g (4oС, 60 мин). Супернатант наносили на колонку с ионообменной смолой ДЭАЭ-Тойоперл 650М производства фирмы Toyo Soda (Япония) диаметром 1,5 см, высотой 40 см, уравновешенную буфером A, со скоростью тока жидкости 80 мл/ч. После промывки колонки с помощью буфера A до полного удаления не связавшегося с носителем белка, проводили элюцию рГЦ линейным градиентом NaCl (0-0.5 М) общим объемом 250 мл. Фракции, содержащие активность рГЦ, объединяли и концентрировали на мембране РМ-10 производства фирмы Amicon (Нидерланды) под давлением азота. Сконцентрированный препарат наносили на колонку со смолой Сефакрил S-300 производства фирмы Pharmacia (Швеция) диаметром 1,2 см, высотой 100 см предварительно уравновешенную буфером A, со скоростью тока жидкости 10 мл/ч. Фракции, содержащие активность рГЦ, объединяли и наносили на колонку с голубой сефарозой CL-4B производства фирмы Pharmacia (Швеция) диаметром 1,2 см, высотой 10 см, предварительно уравновешенную буфером A со скоростью тока жидкости 60 мл/ч. После промывки колонки с помощью буфера A до полного удаления не связавшегося с носителем белка. Проводили элюцию рГЦ буфером A, содержащим 0,5 М NaCl, со скоростью тока жидкости 60 мл/ч. Фракции, содержащие активность рГЦ объединяли и концентрировали на мембране РМ-10 производства фирмы Amicon (Нидерланды) под давлением азота. Сконцентрированный препарат хранили в присутствии 35% глицерина, 1,33 М NaCl при -70oC. Активность фермента определяли по количеству образовавшегося цГМФ известным радиоизотопным способом с использованием [  – 32P]ГТФ в качестве субстрата рГЦ.
Инкубационная смесь для определения активности (общий объем пробы 100 мкл) содержала 50 мМ Трис-HCl (pH 7,6), 0,2 мМ ГТФ (200000 имп/мин – 32P]ГТФ в качестве субстрата рГЦ.
Инкубационная смесь для определения активности (общий объем пробы 100 мкл) содержала 50 мМ Трис-HCl (pH 7,6), 0,2 мМ ГТФ (200000 имп/мин  – 32P] ГТФ на пробу), 5 мМ MgCl2, 5 мМ креатинфосфат, 0,4 мг/мл креатинфосфокиназы, 1 мМ 3-изобутил-1-метилксантин, 2 мМ цГМФ, ферментный препарат. Концентрация соединения в пробе составляла 1 – 32P] ГТФ на пробу), 5 мМ MgCl2, 5 мМ креатинфосфат, 0,4 мг/мл креатинфосфокиназы, 1 мМ 3-изобутил-1-метилксантин, 2 мМ цГМФ, ферментный препарат. Концентрация соединения в пробе составляла 1 10-4 М, ДМСО-0,2% об. В пробы вносили последовательно белок, инкубационную смесь и производные общей формулы (I), инкубировали 10 мин и затем начинали реакцию. Контрольная проба показала отсутствие влияния ДМСО в указанной концентрации на базальную активность рГЦ. Пробы инкубировали в термостате при 37oC в течение 15 минут. Реакцию останавливали перенесением проб на 2 минуты в кипящую водяную баню. После соосаждения непрореагировавшего ГТФ под действием карбоната цинка и центрифугирования в полученном супернатанте определяли количество образовавшегося [32P] цГМФ вышеуказанным способом с использованием хроматографии на колонках с кислой окисью алюминия. Определение белка проводили по способу Лоури, в качестве стандарта использовали человеческий сывороточный альбумин.
Предлагаемые производные фуразана общей формулы (I) оказывали ингибирующее действие на базальную активность рГЦ. Так, эффективность ингибирующего действия соединения (Ia) в концентрации 0,1 мМ при инкубации в присутствии 0,2 мМ дитиотреитола составляла 46%, в присутствии 10 мМ дитиотреитола – 40%.
Пример 6. Ингибирующее действие макроциклов общей формулы (I) на активацию препарата очищенной рГЦ из легких крысы под действием протопорфирина IX. Активность рГЦ измеряли так же, как описано в примере 5, но инкубационная смесь содержала 1 мкМ протопорфирин IX, который добавляли через 10 мин инкубации в присутствии испытуемых соединений (I). Эффективность ингибирующего действия соединения (Iа) в концентрации 0,1 мМ при инкубации в присутствии 0,2 мМ дитиотреитола составляла 50%, а в присутствии 10 мМ дитиотреитола – 37%.
Пример 7. Ингибирующее действие макроциклов общей формулы (I) на активацию препарата очищенной рГЦ из легких крысы под действием хлорида марганца. Активность рГЦ измеряли так же, как описано в примере 5, но инкубационная смесь содержала 5 мМ MnCl2, который добавляли через 10 мин инкубации проб в присутствии соединений общей формулы (I). Эффективность ингибирующего действия соединения (Iа) в концентрации 0,1 мМ при инкубации в присутствии 10 мМ дитиотреитола составляла 35,4%.
Пример 8. Ингибирующее действие макроциклов общей формулы (I) на активацию препарата очищенной рГЦ из легких крысы под действием нитропруссида натрия. Препарат рГЦ из легких крысы получали известным способом. Активность рГЦ измеряли так же, как описано в примере 5, но инкубационная смесь содержала 5 мМ цистеин и 0,1 мМ нитропруссид натрия, который добавляли через 10 мин инкубации проб в присутствии азофуразанов общей формулы (I). Испытуемые соединения общей формулы (I) не оказывали выраженного ингибирующего действия на активацию препарата рГЦ из легких крысы под действием нитропруссида натрия. Так, не наблюдалось ингибирующего действия соединения (Iа) в концентрации 0,1 мМ.
Как следует из представленных данных, предлагаемые в настоящем изобретении соединения общей формулы (I) являются более эффективными ингибиторами базальной активности рГЦ, чем их близкий структурный аналог – диамид. Так, соединение (Iа) в концентрации 0,1 мМ ингибирует рГЦ на 46%, тогда как диамид ингибирует базальную активность фермента на 50% в концентрации 0,48 мМ в отсутствие дитиотреитола. В присутствии дитиотреитола диамид ингибирует базальную активность рГЦ на 54% в концентрации 20 мМ, а соединение (Iа) в концентрации 0,1 мМ ингибирует рГЦ на 40% (Подробнее см. примеры 5). То есть, ингибирующее действие предлагаемых соединений общей формулы (I) является высокоспецифичным – оно практически не зависит от содержания тиолов в среде инкубации. Кроме этого, предлагаемые макроциклы формулы (I) оказывают выраженное ингибирующее действие на гем-независимую стимуляцию рГЦ под действием протопорфирина IX и ионов Mn2+, и практически не влияют на гем-зависимую NO-опосредованную стимуляцию под действием нитропруссида натрия (см. примеры 6-8).
Таким образом, получены производные неизвестной ранее конденсированной гексациклической системы, содержащей в своем составе как фуразановые и [1,4,5,8,9,12,13,16] -октаазабицикло [14.2.2]эйкоза-4,8,12-триеновый циклы, так и (не)замещенный пиперазиновый цикл, являющиеся представителями нового класса соединений и новой гетероциклической системы, а также разработан способ их получения. 10-4 М, ДМСО-0,2% об. В пробы вносили последовательно белок, инкубационную смесь и производные общей формулы (I), инкубировали 10 мин и затем начинали реакцию. Контрольная проба показала отсутствие влияния ДМСО в указанной концентрации на базальную активность рГЦ. Пробы инкубировали в термостате при 37oC в течение 15 минут. Реакцию останавливали перенесением проб на 2 минуты в кипящую водяную баню. После соосаждения непрореагировавшего ГТФ под действием карбоната цинка и центрифугирования в полученном супернатанте определяли количество образовавшегося [32P] цГМФ вышеуказанным способом с использованием хроматографии на колонках с кислой окисью алюминия. Определение белка проводили по способу Лоури, в качестве стандарта использовали человеческий сывороточный альбумин.
Предлагаемые производные фуразана общей формулы (I) оказывали ингибирующее действие на базальную активность рГЦ. Так, эффективность ингибирующего действия соединения (Ia) в концентрации 0,1 мМ при инкубации в присутствии 0,2 мМ дитиотреитола составляла 46%, в присутствии 10 мМ дитиотреитола – 40%.
Пример 6. Ингибирующее действие макроциклов общей формулы (I) на активацию препарата очищенной рГЦ из легких крысы под действием протопорфирина IX. Активность рГЦ измеряли так же, как описано в примере 5, но инкубационная смесь содержала 1 мкМ протопорфирин IX, который добавляли через 10 мин инкубации в присутствии испытуемых соединений (I). Эффективность ингибирующего действия соединения (Iа) в концентрации 0,1 мМ при инкубации в присутствии 0,2 мМ дитиотреитола составляла 50%, а в присутствии 10 мМ дитиотреитола – 37%.
Пример 7. Ингибирующее действие макроциклов общей формулы (I) на активацию препарата очищенной рГЦ из легких крысы под действием хлорида марганца. Активность рГЦ измеряли так же, как описано в примере 5, но инкубационная смесь содержала 5 мМ MnCl2, который добавляли через 10 мин инкубации проб в присутствии соединений общей формулы (I). Эффективность ингибирующего действия соединения (Iа) в концентрации 0,1 мМ при инкубации в присутствии 10 мМ дитиотреитола составляла 35,4%.
Пример 8. Ингибирующее действие макроциклов общей формулы (I) на активацию препарата очищенной рГЦ из легких крысы под действием нитропруссида натрия. Препарат рГЦ из легких крысы получали известным способом. Активность рГЦ измеряли так же, как описано в примере 5, но инкубационная смесь содержала 5 мМ цистеин и 0,1 мМ нитропруссид натрия, который добавляли через 10 мин инкубации проб в присутствии азофуразанов общей формулы (I). Испытуемые соединения общей формулы (I) не оказывали выраженного ингибирующего действия на активацию препарата рГЦ из легких крысы под действием нитропруссида натрия. Так, не наблюдалось ингибирующего действия соединения (Iа) в концентрации 0,1 мМ.
Как следует из представленных данных, предлагаемые в настоящем изобретении соединения общей формулы (I) являются более эффективными ингибиторами базальной активности рГЦ, чем их близкий структурный аналог – диамид. Так, соединение (Iа) в концентрации 0,1 мМ ингибирует рГЦ на 46%, тогда как диамид ингибирует базальную активность фермента на 50% в концентрации 0,48 мМ в отсутствие дитиотреитола. В присутствии дитиотреитола диамид ингибирует базальную активность рГЦ на 54% в концентрации 20 мМ, а соединение (Iа) в концентрации 0,1 мМ ингибирует рГЦ на 40% (Подробнее см. примеры 5). То есть, ингибирующее действие предлагаемых соединений общей формулы (I) является высокоспецифичным – оно практически не зависит от содержания тиолов в среде инкубации. Кроме этого, предлагаемые макроциклы формулы (I) оказывают выраженное ингибирующее действие на гем-независимую стимуляцию рГЦ под действием протопорфирина IX и ионов Mn2+, и практически не влияют на гем-зависимую NO-опосредованную стимуляцию под действием нитропруссида натрия (см. примеры 6-8).
Таким образом, получены производные неизвестной ранее конденсированной гексациклической системы, содержащей в своем составе как фуразановые и [1,4,5,8,9,12,13,16] -октаазабицикло [14.2.2]эйкоза-4,8,12-триеновый циклы, так и (не)замещенный пиперазиновый цикл, являющиеся представителями нового класса соединений и новой гетероциклической системы, а также разработан способ их получения.
Формула изобретения
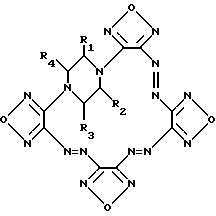 где R1 – R4 = H, низший алкил или низший алкил, содержащий функциональные группы, такие, как OR5, SR5, NR5R6, CONR5R6 или COOR7, где R5, R6, R7, = H, низший алкил, или R2 + R3 и/или R1 + R4 вместе с соседними атомами углерода пиперазинового цикла образуют алициклический, бензольный или гетероциклический аннелированный цикл. 2. Способ получения производных тетрафуразано [3,4-b:3′,4′-f:3”,4”-j: 3′”, 4”’-n] [1,4,5,8,9,12,13,16] октаазабицикло[14.2.2]эйкоза-4,8,12-триена общей формулы I 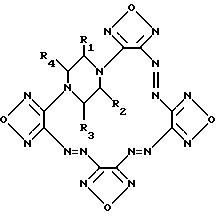 где R1 – R4 = H, низший алкил или низший алкил, содержащий функциональные группы, такие, как OR5, SR5, CONR5R6 или COOR7, где R5, R6, R7, = H, низший алкил, или R2 + R3 и/или R1 + R4 вместе с соседними атомами углерода пиперазинового цикла образуют алициклический, бензольный или гетероциклический аннелированный цикл, отличающийся тем, что производные бис-N,N’-(3-аминофуразанил-4,4′-азофуразан-3-ил)-пиперазина обрабатывают дибромизоциануратом в среде трифторуксусной кислоты или ее смеси с инертными органическими растворителями. MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 17.06.2004
Извещение опубликовано: 20.03.2005 БИ: 08/2005
|
||||||||||||||||||||||||||
