|
|
(21), (22) Заявка: 2008132524/13, 06.08.2008
(24) Дата начала отсчета срока действия патента:
06.08.2008
(46) Опубликовано: 10.02.2010
(56) Список документов, цитированных в отчете о
поиске:
US 2007/0105184 A1, 10.05.2007. RU 2125261 C1, 20.01.1999. RU 2215291 C1, 27.10.2003. RU 2234082 C2, 20.03.2004. RU 2293983 C1, 20.02.2007.
Адрес для переписки:
344006, г.Ростов-на-Дону, ул. Большая Садовая, 105, Южный федеральный университет, патентная служба, Н.Г. Сороке
|
(72) Автор(ы):
Чистяков Владимир Анатольевич (RU)
(73) Патентообладатель(и):
Федеральное государственное образовательное учреждение высшего профессионального образования “Южный федеральный университет” (RU)
|
(54) БИОСЕНСОР ТОКСИЧНОСТИ ВОЗДУХА
(57) Реферат:
Изобретение предназначено для экспресс оценки загрязнения атмосферного воздуха токсичными веществами, например сероводородом, ароматическими углеводородами, окислами азота, металлорганическими соединениями. В состав биосенсора входит переносная металлическая кювета, выполненная в форме уголка, вертикальная часть которого выполняет функцию ручки для переноса кюветы, рабочая горизонтальная поверхность уголка снабжена посадочным местом, на котором размещен фрагмент твердой питательной среды с иммобилизованной культурой генно-модифицированной светящейся бактерии Escherichia coli B-5356 (H 101/pUC7 lux 37). Кювету помещают в прямоугольное кюветное отделение люминометра. Перемещение тест-объекта отдельно от люминометра позволяет проводить измерения токсичности в удаленных зонах и использовать стандартные меры безопасности при работе с генномодифицированными бактериями. Изобретение упрощает конструкцию биосенсора. 1 з.п. ф-лы, 4 ил., 4 табл.
Изобретение относится к микробиологии, в частности к способам измерения, использующим жизнеспособные микроорганизмы, содержащие люциферазу, и может быть использовано для экспрессной оценки загрязнения атмосферного воздуха токсичными веществами, например сероводородом, ароматическими углеводородами, окислами азота, металлорганическими соединениями.
Для мониторинга окружающей среды используют методы химического анализа и биотестирования, при котором широко применяются биосенсоры. С их помощью можно регистрировать токсичность воздушных смесей, содержащих малые концентрации множества ядовитых соединений (Sorensen S.J., Burmolle M., Hansen L.H. Making bio-sense of toxicity: new developments in whole-cell biosensors. Curr Opin Biotechnol. 2006 V.17. N.1. P.11-16) /1/.
Известен способ совместного определения токсичности анилина и нитробензола в воздухе (RU 2234082, МПК G01N 33/02, 2002.07.05) /2/, при котором отобранные пробы воздуха пропускают через два параллельных поглотительных прибора с впаянной стеклянной пористой пластинкой, содержащих по 50,00 см3 пентадекана, переносят поглотительную жидкость в приемник распыляющего устройства, соединенного с началом хроматографической колонки, подают пневматическим распылителем жидкокапельный аэрозоль с размером частиц не более 5 мкм в хроматографическую колонку, размещенную в термостате хроматографа, воздействуют на хроматографическую систему модельной смесью бензола и гексана с воздухом при температуре, соответствующей параметрам микроклимата, определяют разность хроматографических параметров удерживания бензола относительно гексана и воздуха в пробах, которые содержат различные дозы вредных веществ с учетом холостого опыта. Затем определяют индивидуальные дозы анилина и нитробензола в воздухе, поступающие в организм ингаляционным путем, и оценивают токсичность по соотношению между суммарной дозой анилина и нитробензола в воздухе и гигиеническим нормативом. Недостатком известного способа и устройства является сложность и длительность оценки токсичности проб воздуха.
Известен также способ контроля токсичности водной среды, в котором в качестве тест-объекта используют генно-модифицированные бактерии «Эколюм-5» (RU 2215291, МПК G01N 33/18, 2002.08.06) /3/. Для оценки токсичности тестируемой пробы в ее водный раствор помещают суспензию бактерий «Эколюм-5» и измеряют интенсивность биолюминесценции бактерий люминометром. По подавлению свечения судят об угнетении обмена веществ тест-объекта. При этом для контроля токсичности воздуха переводят токсические примеси из воздуха в воду, что не позволяет проводить экспрессную оценку токсичности воздуха, например, при утечке ядовитых газов и образовании ядовитых аэрозолей.
Известен биосенсор для мониторинга экологических систем и объектов (RU 2125261, МПК G01N 33/00, 1999.01.20) /4/, с помощью которого проводят тестирование различных объектов, в том числе и газообразных. Для тестирования газообразных объектов их компоненты предварительно растворяют в воде. Для этого через барботер, который представляет собой емкость с дистиллированной водой, снабженную приспособлением для пропускания газа через воду, барботируют не менее 10 литров газообразного проверяемого объекта, в результате получают исходный материал для размещения в нем тест-объектов. В качестве тест-объектов используют инфузории Paramecium caudatum, которые помещают в исследуемые и контрольные образцы, в качестве которых используют пробирки с дистиллированной водой. Выживаемость инфузорий определяют путем подсчета соотношения живых и мертвых клеток под микроскопом. По полученным данным проводят оценку токсичности исследуемой газовой среды. Использование инфузорий в качестве тест-объекта требует длительного времени для оценки токсичности воздушной среды. Кроме того, наличие промежуточного этапа анализа, состоящего в переводе газообразной среды в жидкую, увеличивает время измерения и требует дополнительного оборудования.
Применение генно-модифицированных светящихся бактерий позволяет значительно повысить чувствительность биосенсоров и сократить время получения результата вплоть до контроля токсичности в режиме реального времени за счет использования интенсивности биолюминесценции в качестве показателя, характеризующего физиологическое состояние тест-объекта.
Наиболее близким по технической сущности к заявляемому изобретению является биосенсор для определения токсичности воды и воздуха (Biosensor method and system based on feature vector extraction US 2007/0105184 A1, МПК C12Q 1/02, 10.05.2007) /5/, принимаемый за прототип, в котором в качестве тест-объекта использована взвесь одноклеточных фотосинтезирующих организмов, либо светящихся генно-модифицированных бактерий, в том числе содержащих комплекс генов Lux оперона, включающий люциферазу. Биосенсор содержит флуориметр, измерительную ячейку с входным и выходным отверстиями, входной фильтр, насос и электронный блок. Свечение водорослей возбуждается источником света, установленным в корпусе флуориметра. При использовании в качестве тест-объекта светящихся бактерий возбуждение флуоресценции не требуется, и флуориметр работает в режиме люминометра. Токсичный воздух подается насосом в ячейку, где расположен фильтр с иммобилизованными на нем клетками тест-объекта, а затем выбрасывается в окружающую среду. Токсичность воздуха определяют после статистической обработки первичных данных о флуоресценции (в случае водорослей), либо о свечении (в случае бактерий). В описании заявки отсутствуют конкретные примеры тестирования токсичности воздуха.
Однако при измерении токсичности воздуха требуется поместить стационарное устройство, содержащее флуориметр, измерительную ячейку с входным и выходным отверстиями, входной фильтр, насос и электронный блок в тестируемую среду, что снижает мобильность устройства. Кроме того, при работе данного биосенсора неизбежно попадание части используемых в качестве тест-объектов микроорганизмов в воздух, т.к. суспензии микроорганизмов при высыхании образуют легкие взвеси и аэрозоли (Герхард Ф. Методы общей бактериологии. М.: Мир. 1983. 536 с) /6/. Следовательно, использование в качестве тест-объекта генно-модифицированных бактерий приводит к попаданию их ДНК в окружающую воздушную среду. Будучи сами по себе безвредными для человека, генно-модифицированные светящиеся бактерии несут ДНК, способную трансформировать природные патогенные бактерии, передавая им устойчивость к антибиотикам, что повышает опасность заболеваний.
Техническим результатом настоящего изобретения является упрощение устройства и исключение попадания ДНК тест-объекта в окружающую среду.
Указанный технический результат достигается тем, что биосенсор токсичности воздуха содержит средство для размещения тест-объекта с иммобилизованной культурой генно-модифицированной светящейся бактерии, несущей комплекс генов Lux оперона, включающий ген люциферазы, и люминометр для измерения изменения свечения иммобилизованной культуры генно-модифицированной светящейся бактерии под действием токсичной среды.
Согласно изобретению средство для размещения тест-объекта выполнено в виде переносной металлической кюветы, имеющей форму уголка, вертикальная часть которого выполняет функцию ручки для переноса кюветы, а рабочая горизонтальная поверхность уголка снабжена посадочным местом, на котором размещен фрагмент твердой питательной среды с иммобилизованной культурой генно-модифицированной светящейся бактерии, а люминометр имеет кюветное отделение, форма которого соответствует переносной кювете.
В качестве генно-модифицированных бактерий, несущих комплекс генов Lux оперона, включающих ген люциферазы, использован штамм Escherichia coli B-5356 (HB 101/pUC7 lux 37).
Выполнение средства для размещения тест-объекта в виде переносной кюветы, выполненной в форме металлического уголка упрощает введение тест-объекта в кюветное отделение люминометра и позволяет перемещать тест-объект отдельно от люминометра, а следовательно, проводить измерения токсичности в зонах, удаленных от люминометра и использовать стандартные меры безопасности при работе с генно-модифицированными бактериями. Исключение прокачки пробы воздуха через измерительную ячейку упрощает конструкцию биосенсора.
Изобретение поясняется схематическим чертежом, графиками и таблицами.
На фиг.1 приведен схематический чертеж биосенсора токсичности воздуха, в аксонометрии.
На фиг.2 приведен общий вид корпуса люминометра ЛТ-01 с прямоугольным кюветным отделением, в аксонометрии.
На фиг.3. приведена зависимость токсичности аэрозоля бензола, в % от его концентрации в воздухе, мг/м3.
На фиг.4 приведена зависимость токсичности сероводорода, в % от его концентрации в воздухе, в мг/м3.
В таблице 1. приведена классификация проб по уровню токсичности.
В таблице 2. приведена зависимость токсичности аэрозоля бензола, в %, от его концентрации в воздухе, в мг/м3.
В таблице 3 приведена зависимость токсичности сероводорода, в %, от его концентрации в воздухе, в мг/м3.
В таблице 4 приведена зависимость токсичности сероводорода в концентрации 20 мг/м3 от времени экспозиции тест-объекта, в мин.
Биосенсор токсичности воздуха (фиг.1) содержит средство для размещения тест-объекта с иммобилизованной культурой генно-модифицированной бактерии, несущей комплекс генов Lux оперона, включающий ген люциферазы, выполненное в виде переносной металлической кюветы, имеющей форму уголка 1, вертикальная часть которого выполняет функцию ручки для переноса кюветы. Рабочая горизонтальная поверхность уголка 1 снабжена посадочным местом 2, ограниченным бортиком 3 для размещения фрагмента твердой питательной среды 4, на поверхности которой иммобилизована культура генно-модифицированной светящейся бактерии 5. Форма уголка 1 соответствует форме кюветного отделения 6 люминометра 7.
В частном случае выполнения в качестве культуры генно-модифицированной светящейся бактерии использована культура Е. coli В-5356 (НВ 101/pUC7 lux 37). Этот штамм является генно-модифицированным и несет комплекс генов Lux оперона, включающий ген люциферазы.
Тест-объект изготавливают следующим образом. В стерильные чашки Петри заливают стерильную расплавленную среду – мясо-пептонный агар (МПА) слоем в 2-4 мм. После застывания среды на поверхность высевают 10-1000 КОЕ культуры Е.coli В-5356 (НВ 101/pUC7 lux 37). Инкубацию бактерий осуществляют в течение 10-20 часов. Затем на внешней стороне чашки Петри маркером отмечают прямоугольный контур площадью 10×20 мм, окружающий отдельную колонию, затем стерильным скальпелем вырезают фрагмент твердой питательной среды вместе с колонией и переносят его на
| Таблица 1. |
| Классификация проб по уровню токсичности. |
| Группы |
Величина Т, % |
Степень токсичности |
| 1 |
от -10 до 15 |
Допустимая степень токсичности. |
| 2 |
от 15 до 49 |
Образец токсичен. |
| 3 |
больше 50 |
Образец сильно токсичен. |
| 4 |
меньше -10 |
Образец токсичен. |
| Таблица 2. |
| Зависимость токсичности аэрозоля бензола от концентрации. |
| Концентрация бензола мг/м3 |
Интенсивность люминесценции УЕС |
Токсичность Т% |
| 0 |
2,12±0,12 |
0 |
| 15* |
2,01±0,15 |
5 |
| 25 |
1,78±0,06 |
16 |
| 35 |
1,02±0,05 |
52 |
| 300 |
0,42±0,07 |
80 |
| 600 |
0,15±0,03 |
93 |
| Таблица 3. |
| Зависимость токсичности сероводорода в воздухе от концентрации. |
| Концентрация сероводорода в воздухе мг/м3 |
Интенсивность люминесценции УЕС |
Токсичность Т% |
| 0 |
3,56±0,22 |
0 |
| 20 |
2,65±0,35 |
20 |
| 26 |
2,31±0,15 |
35 |
| 87 |
0,92±0,12 |
74 |
| Таблица 4. |
| Зависимость токсичности сероводорода в концентрации 20 мг/м3 от времени экспозиции тест-объекта, где * достоверное падение люминесценции (образец токсичен) |
| Экспозиция, мин |
Интенсивность люминесценции в контроле УЕС |
Интенсивность люминесценции в опыте УЕС |
Токсичность Т% |
| 10 |
3,14±0,31 |
3,1±±0,29 |
0 |
| 20 |
3,09±0,30 |
2,81±0,25 |
10 |
| 30 |
3,26±0,32 |
2,60±0,26 |
20* |
| 60 |
3,34±0,30 |
2,75±0,35 |
18* |
рабочую поверхность кюветы. Скальпель смачивают 96% этанолом и обжигают в пламени спиртовки. Таким образом, получают тест-объект, представляющий собой фрагмент твердой питательной среды, на поверхности которого расположены клетки культуры светящихся бактерий в количестве 104-108 КОЕ. Переносную кювету с тест-объектом помещают в кюветное отделение 6 люминометра 7 (фиг.2) и проводят замер фоновой биолюминесценции Iо в условных единицах свечения УЕС. Для измерения люминесценции светящихся бактерий использован люминометр ЛТ-01, применяемый также при измерении токсичности полиароматических углеводородов в водной среде (RU 2198929, МКИ G01N 33/18, 2003.02.20) /7/. При этом для измерения свечения известным способом образцы помещали в стеклянную кювету, имеющую форму параллелепипеда с внешними размерами 35×22×12 мм. Свечение образца регистрируется фотоэлектронным умножителем (ФЭУ). Сигнал от ФЭУ подается в электронный блок, соединенный с дисплеем, показывающим уровень люминесценции в условных единицах свечения (УЕС).
В примере конкретного выполнения образец помещали на 30-60 мин в тестируемый объем воздушной среды. Переноску кюветы осуществляли в стандартном микробиологическом боксе, предохраняющем от попадания бактерий в окружающую среду при случайном падении и других нештатных ситуациях. Затем проводят замер биолюминесценции после контакта с исследуемой воздушной средой (I) в условных единицах свечения (УЕС).
Люминометр устанавливают в микробиологическом боксе, оборудованном средствами стерилизации согласно (Лабинская А.С.Микробиология с техникой микробиологических исследований. Изд. 4-е, перераб. и доп.М., Медицина, 1978. с.394) /8/, что обеспечивает изоляцию ДНК генно-модифицированных бактерий от окружающей среды.
После измерения гель с бактериями сбрасывают в стандартный дезинфицирующий раствор, содержащий окислители: 3-6% перекись водорода, соединения хлора в 0,3-1% концентрации по активному хлору, либо в сосуд с крышкой, выдерживающий прогревание перегретым паром с температурой 134°С для последующего обеззараживания автоклавированием. Затем для дезинфекции кювету обжигают в пламени спиртовки, либо погружают в дезинфицирующий раствор, либо прогревают в сушильном шкафу или автоклавируют. Все операции по дезактивации осуществляют согласно МУ 1.3. 1794-03 (Организация работы при исследованиях методом ПЦР материала, инфицированного микроорганизмами I-II групп патогенности. Методические указания МУ 1.3. 1794-03. Издание официальное. Минздрав России. М., 2003.) /9/
Токсичность рассчитывали по формуле:
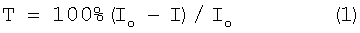
где Т – индекс токсичности, %;
Iо – интенсивность фоновой биолюминесценции, УЕС;
I – интенсивность биолюминесценции после контакта с воздушной средой, УЕС.
Измерение токсичности каждого объекта повторяли три раза для определения погрешности измерения. Токсический эффект считается достоверным при статистически значимом превышении интенсивности I биолюминесценции после контакта с воздушной средой над интенсивностью фоновой биолюминесценции Iо, определяемом при помощи критерия Стьюдента при доверительном интервале 99%. По величине индекса токсичности анализируемые пробы классифицируются на четыре группы, приведенные в изобретении автора, таблица 1 (RU 2198929, МПК G01N 33/18, 2003.02.20) /7/.
Пример 1. Определение токсичности воздушной среды, содержащей бензол.
Кювету с тест-объектом 5 вводили в кюветное отделение 6 люминометра 7. После измерения фоновой люминесценции светящихся бактерий кювету 1 извлекали из кюветного отделения 6 и помещали на дно емкости объемом 10 л, внутри которой ультразвуковым распылителем распыляли 100 мкл водной суспензии бензола в заданной концентрации. После выдерживания в течение 30 мин в воздушной среде, содержащей известную концентрацию бензола, измерение повторяли. Токсичность определяли по падению свечения образца тест-объекта после выдерживания в тестируемом объекте по формуле (1). Полученные результаты по определению токсичности воздушной среды, содержащей бензол, представлены в табл.2 и на фиг.3. Как видно из таблицы 2, предлагаемый способ позволяет регистрировать токсичность воздушной среды, содержащей бензол в концентрации 25 мг/м3 и выше. Концентрация 15 мг/м3, равная предельно допустимой концентрации (ПДК) для воздуха рабочей зоны, согласно таблице 4 из СН 245-71 “Предельно допустимые концентрации вредных веществ в воздухе рабочей зоны” (СН 245-71 – санитарные нормы проектирования промышленных предприятий. М.: Стройиздат, 1972. – 96 с.) /10/ является подпороговой. Увеличение концентрации бензола свыше 25 мг/м3 ведет к усилению токсичности.
Пример 2. Определение токсичности сероводорода.
Аналогично примеру 1 готовили тест-объект и измеряли фоновую люминесценцию. Затем кювету 1 с тест-объектом 5 извлекали из кюветного отделения 6 и помещали в бокс с воздухом, содержащим сероводород. Сероводород генерировали предварительно, помещая расчетное количество сульфида железа в химический стакан объемом 500 мл, содержащий 100 мл 20% серной кислоты. Реакцию проводили в герметически закрытом боксе, помещенном в вытяжной шкаф. По завершении реакции, концентрацию сероводорода в воздухе внутри бокса определяли при помощи электрохимического малогабаритного газоанализатора сероводорода МГЛ – 19.2А (ЗАО «ОПТЭК» Россия). Затем в бокс вводили тест-объект 5. Через 30 минут обработки в тестируемой среде кювету 1 с тест-объектом 5 извлекали из бокса, помещали в кюветное отделение 6 люменометра 7 и вновь измеряли интенсивность люминесценции тест-объекта 5. Токсичность определяли по падению свечения образца тест-объекта после выдерживания в тестируемом объекте по формуле (1). Эксперименты проводили при различных концентрациях сероводорода в воздушной среде. Как видно из таблицы 3, при концентрации сероводорода в воздухе 26 мг/м3 воздушная среда токсична. При концентрации сероводорода в воздухе 87 мг/м3 воздушная среда сильно токсична и увеличение концентрации сопровождается усилением токсичности (фиг.4). Таким образом, заявляемый способ позволяет регистрировать токсичность сероводорода в воздухе в концентрациях, сопоставимых с ПДК (10 мг/м3).
Пример 3. Определение оптимального времени экспозиции тест-объекта в тестируемой газовой среде.
Эксперименты проводили аналогично примеру 2 с воздушной средой, содержащей сероводород в концентрации 20 мг/м3. Как видно из таблицы 4, экспозиции меньшие 30 минут не позволяют зарегистрировать токсичность исследованной концентрации. Увеличение экспозиции от 30 до 60 минут приводит к подавлению свечения пробы, следовательно, позволяет тестировать токсичность воздушной среды при концентрации в ней сероводорода 20 мг/м3. При этом величины индекса токсичности Т для указанного времени экспозиции статистически значимо не отличаются.
Источники информации
1. Sorensen SJ, Burmolle M, Hansen LH. Making bio-sense of toxicity: new developments in whole-cell biosensors. Curr Opin Biotechnol. 2006 V.17. N.1. P11-6.
2. RU 2234082, МПК G01N 33/02, 2002.07.05.
3. RU 2215291, МПК G01N 33/18, 2002.08.06.
4. RU 2125261, МПК G01N 33/00, 1999.01.20.
5. US 2007/0105184 A1, МПК C12Q 1/02, 10.05.2007 – прототип.
6. Ф.Герхард. Методы общей бактериологии. M.: Мир. 1983. 536 с.
7. Лабинская А.С.Микробиология с техникой микробиологических исследований. Изд. 4-е, перераб. и доп. M.: Медицина, 1978. с.394.
8. Организация работы при исследованиях методом ПЦР материала, инфицированного микроорганизмами I-II групп патогенности. Методические указания МУ 1.3. 1794-03. Издание официальное. Минздрав России. Москва 2003.
9. RU 2198929, МПК G01N 33/18, 2003.02.20.
10. СН 245-71 – санитарные нормы проектирования промышленных предприятий. M.: Стройиздат, 1972. 96 с.
Формула изобретения
1. Биосенсор токсичности воздуха, содержащий средство для размещения тест-объекта с иммобилизованной культурой генномодифицированной бактерии, несущей комплекс генов Lux оперона, включающий ген люциферазы, и люминометр для измерения изменения свечения иммобилизованной культуры под действием токсичной среды, отличающийся тем, что средство для размещения тест-объекта выполнено в виде переносной металлической кюветы, выполненной в форме уголка, вертикальная часть которого выполняет функцию ручки для переноса кюветы, а рабочая горизонтальная поверхность уголка снабжена посадочным местом, на котором размещен фрагмент твердой питательной среды с иммобилизованной культурой генномодифицированной светящейся бактерии, а люминометр имеет кюветное отделение, форма которого соответствует переносной кювете.
2. Биосенсор токсичности воздуха по п.1, отличающийся тем, что в качестве генномодифицированных светящихся бактерий использован штамм Escherichia coli B-5356 (H 101/pUC7 lux 37).
РИСУНКИ
|
|