|
|
(21), (22) Заявка: 2006127572/04, 17.02.2005
(24) Дата начала отсчета срока действия патента:
17.02.2005
(30) Конвенционный приоритет:
18.02.2004 US 60/545,292
(43) Дата публикации заявки: 27.03.2008
(46) Опубликовано: 10.02.2010
(56) Список документов, цитированных в отчете о
поиске:
RU 2002107201 A, 27.12.2003. WO 03029210 A2, 10.04.2003.
(85) Дата перевода заявки PCT на национальную фазу:
18.09.2006
(86) Заявка PCT:
US 2005/005216 20050217
(87) Публикация PCT:
WO 2005/080386 20050901
Адрес для переписки:
191036, Санкт-Петербург, а/я 24, “НЕВИНПАТ”, пат.пов. А.В.Поликарпову
|
(72) Автор(ы):
АРОРА Джалай (CA),
ЭДВАРДС Луиза (CA),
АЙЗЕК Метвин (CA),
КЕРС Анника (SE),
СТААФ Карин (SE),
СЛАССИ Абдельмалик (CA),
СТЕФАНАК Томислав (CA),
ВЕНСБО Давид (SE),
КСИН Тао (CA),
ХОЛЬМ Бьёрн (SE)
(73) Патентообладатель(и):
АстраЗенека АБ (SE)
|
(54) ПОЛИГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ МЕТАБОТРОПНОГО РЕЦЕПТОРА ГЛУТАМАТА
(57) Реферат:
Настоящее изобретение относится к соединениям формулы I и их фармацевтически приемлемым солям, которые обладают свойствами ингибитора mGluR5. В формуле I
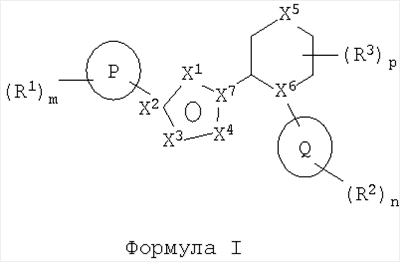
где Р представляет собой фенил; R1 присоединен к Р через атом углерода на кольце Р и выбран из группы, состоящей из галогено, C1-6алкилгалогено, OC1-6алкилгалогено, C1-6алкила, ОС1-6алкила и С0-6алкилциано; X1 выбран из группы, состоящей из N, NR4 и CR4; X2 выбран из группы, состоящей из С и N; X3 выбран из группы, состоящей из N и О; X4 выбран из группы, состоящей из N и О; X5 выбран из группы, состоящей из связи, CR4R4‘, NR4, О, S, SO, SO2; X6 представляет собой N; X7 выбран из группы, состоящей из С и N; Q представляет собой триазолил. Изобретение также относится к фармацевтической композиции, содержащей в качестве активного ингредиента терапевтически эффективное количество соединения изобретения, применению соединения в изготовлении лекарственного средства для лечения расстройств, опосредованных mGluR5 и к способу ингибирования активации рецепторов mGluR5. 4 н. и 21 з.п. ф-лы.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому классу соединений, к фармацевтическим композициям, содержащим указанные соединения, и к применению указанных соединений в терапии. Настоящее изобретение, кроме того, относится к способам получения указанных соединений и к новым промежуточным соединениям, используемым при их получении.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Глутамат является основным возбуждающим нейромедиатором в центральной нервной системе млекопитающих (ЦНС). Глутамат оказывает свое воздействие на центральные нейроны путем связывания с рецепторами клеточной поверхности и посредством этого их активации. Эти рецепторы делят на два основных класса, ионотропные и метаботропные рецепторы глутамата, на основании структурных признаков рецепторных белков, посредством которых эти рецепторы передают сигналы в клетку, а также фармакологических профилей.
Метаботропные рецепторы глутамата (mGluR) представляют собой рецепторы, сопряженные с G-белком, которые активируют ряд внутриклеточных систем вторичных мессенджеров после связывания глутамата. Активация mGluR в интактных нейронах млекопитающих вызывает один или более чем один из следующих ответов: активацию фосфолипазы С; повышение гидролиза фосфоинозитида (Р1); высвобождение внутриклеточного кальция; активацию фосфолипазы D; активацию или ингибирование аденилциклазы; увеличение или уменьшение образования циклического аденозинмонофосфата (цАМФ); активацию гуанилилциклазы; увеличение образования циклического гуанозинмонофосфата (цГМФ); активацию фосфолипазы А2; увеличение высвобождения арахидоновой кислоты и повышение или снижение активности потенциал-зависимых и лиганд-зависимых ионных каналов. Schoepp et al., Trends Pharmacol. Sci. 14-13 (1993), Schoepp, Neurochem. Int. 24:439 (1994), Pin et al., Neuropharmacology 34:1 (1995), Bordi and Ugolini, Prog. Neurobiol. 59:55 (1999).
Восемь отдельных подтипов mGluR, обозначаемых от mGluRI до mGluR8, идентифицированы путем молекулярного клонирования. Nakanishi, Neuron 13:1031 (1994), Pin etal., Neuropharmacology 34:1 (1995), Knopfel etal., J. Med Chem. 38:1417 (1995). Дополнительное разнообразие рецепторов существует благодаря экспрессии альтернативно сплайсированных форм некоторых подтипов mGluR. Pin et al., PNAS 89:10331 (1992), Minakami et al., BBRC 199:1136 (1994), Joly et al., J. Neurosci. 15:3970 (1995).
Подтипы метаботропных рецепторов глутамата можно подразделить на три группы, mGluR группы I, группы II и группы III, на основании гомологии аминокислотной последовательности, систем вторичных мессенджеров, используемых этими рецепторами, а также на основании их фармакологических характеристик. mGluR группы I включают mGluR1, mGluR5 и их варианты альтернативного сплайсинга. Связывание агонистов с этими рецепторами приводит в результате к активации фосфолипазы С и последующей мобилизации внутриклеточного кальция.
Неврологические, психиатрические и болевые расстройства
Попытки оценить физиологическую роль mGluR группы 1 позволили предположить, что активация этих рецепторов вызывает возбуждение нейронов. В различных исследованиях продемонстрировано, что агонисты mGluR группы 1 могут вызывать постсинаптическое возбуждение при нанесении на нейроны в гиппокампе, коре головного мозга, мозжечке и таламусе, а также в других областях ЦНС. Данные указывают на то, что это возбуждение является следствием прямой активации постсинаптических mGluR, но также предположили, что происходит активация пресинаптических mGluR, что приводит в результате к усиленному высвобождению нейромедиаторов. Baskys, Trends Pharmacol. Sci. 15:92 (1992), Schoepp, Neurochem. Int. 24:439 (1994), Pin et al., Neuropharmacology 34:1 (1995), Watkins et al., Trends Pharmacol. Sci. 15:33 (1994).
Метаботропные рецепторы глутамата вовлечены в ряд нормальных процессов в ЦНС млекопитающих. Показано, что активация mGluR необходима для индукции длительной потенциации гиппокапма и длительного подавления деятельности мозжечка. Bashir et al., Nature 363:347 (1993), Bortolotto et al., Nature 368:740 (1994), Aiba et al., Cell 79:365 (1994), Aiba et al., Cell 79:377 (1994). Также продемонстрирована роль активации mGluR в ноцицепции и аналгезии. Meller et al., Neuroreport 4:879 (1993), Bordi and Ugolini, Brain Res. 871:223 (1999). Кроме того, предположили, что активация mGluR играет модуляторную роль в ряде других нормальных процессов, включая синаптическую передачу, развитие нейронов, апоптотическую гибель нейронов, синаптическую пластичность, пространственное обучение, обонятельную память, центральную регуляцию сердечной деятельности, пробуждение, регуляцию моторики и регуляцию вестибулоокулярного рефлекса. Nakanishi, Neuron 13: 1031 (1994), Pin et al., Neuropharmacology 34:1, Knopfel et al., J. Med. Chem. 38:1417 (1995).
Кроме того, предположили, что метаботропные рецепторы глутамата группы I играют роль в ряде острых и хронических патофизиологических процессов и расстройств, поражающих ЦНС. Они включают удар, травму головы, повреждения в результате гипоксии и ишемические повреждения, гипогликемию, эпилепсию, нейродегенеративные расстройства, такие как болезнь Альцгеймера, психиатрические расстройства и боль. Schoepp et al.., Trends Pharmacol. Sci. 14:13 (1993), Cunningham et al., Life Sci. 54:135 (1994), Hollman et al., Ann. Rev. Neurosci. 17:31 (1994), Pin etal., Neuropharmacology 34:1 (1995), Knopfel et al., J. Med Chem. 36:1417 (1995), Spooren et al., Trends Pharmacol. Sci. 22:331 (2001), Gasparini et al. Curr. Opin. Pharmacol. 2:43 (2002), Neugebauer Pain 98:1 (2002). Считают, что многое в патологии этих состояний является следствием избыточного возбуждения нейронов ЦНС, индуцированного глутаматом. Поскольку оказывается, что mGluR группы I повышают опосредованное глутаматом возбуждение нейронов посредством постсинаптических механизмов и усиленного пресинаптического высвобождения глутамата, их активация, возможно, вносит вклад в патологию. Соответственно, избирательные антагонисты рецепторов mGluR группы I могут быть терапевтически полезны при всех состояниях, в основе которых лежит избыточное возбуждение нейронов ЦНС, индуцированное глутаматом, конкретно в качестве нейропротективных агентов, анальгетиков или противосудорожных агентов.
Недавние достижения в объяснении нейрофизиологической роли метаботропных рецепторов глутамата в целом и группы 1 в частности позволили установить, что эти рецепторы являются перспективными мишенями лекарств при терапии острых и хронических неврологических и психиатрических расстройств, а также хронических и острых болевых расстройств.
Желудочно-кишечные расстройства
Нижний пищеводный сфинктер (НПС) подвержен прерывистому расслаблению. Вследствие этого жидкость из желудка может проходить в пищевод, поскольку механический барьер в такие моменты временно нарушен, и это событие здесь далее называют “желудочно-кишечный (ЖК) рефлюкс”.
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) является наиболее распространенным заболеванием верхних отделов желудочно-кишечного тракта. Задачами современных фармакотерапий являются уменьшение секреции желудочной кислоты или нейтрализация кислоты в пищеводе. Считают, что главный механизм, лежащий в основе ЖК-рефлюкса, зависит от гипотоничного нижнего пищеводного сфинктера. Однако, например, в Holloway & Dent (1990) Gastroenterol. Clin. N. Amer. 19, pp.517-535 показано, что большинство эпизодов рефлюкса происходит в момент временных расслаблений нижнего пищеводного сфинктера (ВРНПС), то есть расслаблений, которые не запускаются актами глотания. Также показано, что у пациентов с ГЭРБ секреция желудочной кислоты обычно нормальная.
Предполагают, что новые соединения по настоящему изобретению полезны для ингибирования временных расслаблений нижнего пищеводного сфинктера (ВРНПС) и, следовательно, для лечения гастроэзофагеальной рефлюксной болезни (ГЭРБ).
Формулировка “ВРНПС”, временные расслабления нижнего пищеводного сфинктера, здесь определена в соответствии с Mittal, R.K., Holloway, R.H., Penagini, R., Blackshaw, L.A., Dent, J., 1995; Transient lower esophageal sphincter relaxation. Gastroenterology 109, pp.601-610.
Формулировка “ЖК-рефлюкс” определена здесь как способность жидкости проходить из желудка в пищевод, поскольку в такой момент механический барьер временно утерян.
Формулировка “ГЭРБ”, гастроэзофагеальная рефлюксная болезнь, определена здесь в соответствии с van Heerwarden, M.A., Smout AJ.P.M., 2000; Diagnosis of reflux disease. Bailliere’s Clin. Gastroenterol. 14, pp.759-774.
Ввиду их физиологической и патофизиологической значимости существует необходимость в новых эффективных агонистах и антагонистах mGluR, которые проявляют высокую избирательность к подтипам mGluR, в частности к подтипу рецепторов группы I.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном аспекте изобретения предложено соединение формулы I

где
R1 выбран из арила и гетероарила;
R1 присоединен к Р через атом углерода на кольце Р и выбран из группы, состоящей из: гидрокси, галогено, нитро, C1-6алкилгалогено, OC1-6алкилгалогено, C1-6алкила,
ОС1-6алкила, С2-6алкенила, ОС2-6алкенила, C2-6алкинила, ОС2-6алкинила, С0-6алкилС3-6циклоалкила, ОС0-6алкилС3-6циклоалкила, С0-6алкиларила, ОС0-6алкиларила, СНО, (CO)R5, O(CO)R5, O(CO)OR5, O(CNR5)OR5, С1-6алкилОR5, С1-6алкилОR5, С1-6алкил(СО)R5, OC1-6алкил(СО)R5, С0-6алкилСO2R5, ОС1-6алкилСO2R5, С0-6алкилциано, ОС2-6алкилциано, C0-6алкилNR5R6,
OC2-6алкилNR5R6, C1-6aлкил(CO)NR5R6, OC1-6алкил(СО)NR5R6, С0-6алкилNR5(СО)R6,
OC2-6aлкилNR5(CO)R6, С0-6aлкилNR5(CO)NR5R6, С0-6алкилSR5, ОС2-6алкилSR5, С0-6алкил(SO)R5,
ОС2-6алкил(SO)R5, С0-6алкилSО2R5, ОС2-6алкилSO2R5, C0-6aлкил(SO2)NR5R6, ОС2-6aлкил(SO2)NR5R6, C0-6aлкилNR5(SO2)R6, OC2-6aлкилNR5(SO2)R6, С0-6aлкилNR5(SO2)NR5R6, OC2-6aлкилNR5(SO2)NR5R6, (CO)NR5R6, O(CO)NR5R6, NR5OR6, C0-6aлкилNR5(CO)OR6, OC2-6aлкилNR5(CO)OR6, SO3R5 и 5- или 6-членного кольца, содержащего атомы, независимо выбранные из группы, состоящей из С, N, О и S;
X1 выбран из группы, состоящей из: N, NR4 и CR4;
X2 выбран из группы, состоящей из: С и N;
X3 выбран из группы, состоящей из: CR4, N и О;
X4 выбран из группы, состоящей из: CR4, N, NR4 и О;
X5 выбран из группы, состоящей из: связи, CR4R4‘, NR4, О, S, SO и SO2;
X6 выбран из группы, состоящей из: CR4 и N;
X7 выбран из группы, состоящей из: С и N;
R4 независимо выбран из группы, состоящей из водорода, гидрокси, C1-6алкила,
С0-6алкилциано, оксо, =NR5, =NOR5, С1-4алкилгалогено, галогено, С3-7циклоалкила, O(СО)С1-4алкила, С1-4алкил(SO)С0-4алкила, С1-4алкил(SO2)С0-4алкила, (SO)С0-4алкила, (SO2)С0-4алкила, ОС1-4алкила, С1-4алкилОR5 и С0-4aлкилNR5R6;
Q выбран из группы, состоящей из гетероциклоалкила и гетероарила;
R2 и R3 независимо выбраны из группы, состоящей из: гидрокси, С0-6алкилциано, оксо, =NR5, =NOR5, С1-4алкилгалогено, галогено, С1-6алкила, С3-7циклоалкила, С0-6алкиларила, С0-6алкилгетероарила, C1-6алкилциклоалкила, С0-6алкилгетероциклоалкила, ОС1-4алкила, ОС0-6алкиларила, O(СО)С1-4алкила, (СО)ОС1-4алкила, С0-4алкил(S)С0-4алкила, С1-4алкил(SO)С0-4алкила,
C1-4алкил(SO2)С0-4алкила, (SO)С0-4алкила, (SO2)С0-4алкила, С1-4алкилОR5, С0-4aлкилNR5R6 и 5- или 6-членного кольца, содержащего атомы, независимо выбранные из С, N, О и S, которое может быть возможно конденсировано с 5- или 6-членным кольцом, содержащим атомы, независимо выбранные из группы, состоящей из С, N и О, и где указанное кольцо и указанное конденсированное кольцо может быть замещено одним или более чем одним А;
где любой C1-6алкил, арил или гетероарил, определенный под R1, R2 и R3, может быть замещен одним или более чем одним А;
А выбран из группы, состоящей из: водорода, гидрокси, галогено, нитро, оксо, С0-6алкилциано, С0-4алкилС3-6циклоалкила, C1-6алкила, -ОС1-6алкила, C1-6алкилгалогено, OC1-6алкилгалогено, С2-6алкенила, С0-6алкиларила, С0-6алкилОR5, ОС2-6алкилОR5, С0-6алкилSR5, ОС2-6алкилSR5, (CO)R5, O(CO)R5, ОС2-6алкилциано, ОС1-6алкилСO2R5, O(CO)OR5, ОС1-6алкил(СО)R5, C1-6алкил(СО)R5, NR5OR6, C0-6NR5R6, OC2-6алкилNR5R6, C0-6aлкил(CO)NR5R6, OC1-6aлкил(CO)NR5R6, OC2-6aлкилNR5(CO)R6, C0-6aлкилNR5(CO)R6, C0-6алкилNR5(СО)NR5R6, O(CO)NR5R6, C0-6aлкил(SO2)NR5R6, OC2-6aлкил(SO2)NR5R6, C0-6aлкилNR5(SO2)R6, OC2-6aлкилNR5(SO2)R6, SO3R5, C1-6aлкилNR5(SO2)NR5R6, ОС2-6алкил(SO2)R5, С0-6алкил(SO2)R5, С0-6алкил(SO)R5, ОС2-6алкил(SO)R5 и 5- или 6-членного кольца, содержащего атомы, независимо выбранные из группы, состоящей из С, N, О и S;
R5 и R6 независимо выбраны из Н, C1-6алкила, С3-7циклоалкила и арила;
m выбран из 0, 1, 2, 3 или 4;
n выбран из 0, 1, 2, 3 или 4;
р выбран из 0, 1, 2, 3 или 4,
и его соль или гидрат.
В дополнительном аспекте изобретения предложены фармацевтические композиции, содержащие терапевтически эффективное количество соединения формулы I и фармацевтически приемлемый разбавитель, эксципиенты и/или инертный носитель.
В еще одном дополнительном аспекте изобретения предложена фармацевтическая композиция, содержащая соединение формулы I для применения в лечении расстройств, опосредованных рецептором mGluR5, и для применения в лечении неврологических расстройств, психиатрических расстройств, желудочно-кишечных расстройств и болевых расстройств.
В еще одном дополнительном аспекте изобретения предложено соединение формулы I для применения в терапии, в частности для лечения расстройств, опосредованных рецептором mGluR5, и для лечения неврологических расстройств, психиатрических расстройств, желудочно-кишечных расстройств и болевых расстройств.
Следующий аспект изобретения составляет применение соединения формулы Х для изготовления лекарства для лечения или предупреждения ожирения и состояний, связанных с ожирением, а также для лечения расстройств приема пищи путем подавления избыточного потребления пищи и ожирения, являющегося его результатом, а также осложнений, связанных с этим.
В другом аспекте изобретения предложены способы получения соединений формулы I и промежуточные соединения, используемые при их получении.
Эти и другие аспекты настоящего изобретения более подробно описаны ниже.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Задача настоящего изобретения заключается в том, чтобы предложить соединения, проявляющие активность при метаботропных рецепторах глутамата (mGluR), в частности при рецепторах mGluR5.
Ниже перечислены определения различных терминов, используемых в описании и формуле изобретения, для описания настоящего изобретения.
Во избежание сомнений следует понимать, что, когда в данном описании группу называют как ‘определенную здесь выше’, ‘определенную в данном описании выше’ или ‘определенную выше’, указанная группа охватывает первое встречаемое и наиболее широкое определение, а также все и каждое из других определений для данной группы.
Во избежание сомнений следует понимать, что в данном описании ‘C1-6‘ означает углеродную группу, имеющую 1, 2, 3, 4, 5 или 6 атомов углерода. Подобным образом ‘C1-3‘ означает углеродную группу, имеющую 1, 2 или 3 атома углерода.
В том случае, когда нижний индекс представляет собой целое число 0 (ноль), группа, к которой относится этот нижний индекс, указывает на то, что эта группа отсутствует.
В данном описании, если не указано иное, термин “алкил” включает как неразветвленные, так и разветвленные алкильные группы и может представлять собой, но не ограничен ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, трет-пентил, неопентил, н-гексил или изогексил, трет-гексил. Термин С1-3алкил имеет 1-3 атома углерода и может представлять собой метил, этил, м-пропил или изопропил.
В данном описании, если не указано иное, термин “циклоалкил” относится к возможно замещенной насыщенной циклической углеводородной кольцевой системе. Термин “С3-7циклоалкил” может представлять собой циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
В данном описании, если не указано иное, термин “алкокси” включает как неразветвленные, так и разветвленные алкоксигруппы. C1-3алкокси может представлять собой, но не ограничен ими, метокси, этокси, н-пропокси или изопропокси.
В данном описании, если не указано иное, термин “связь” может представлять собой насыщенную или ненасыщенную связь.
В данном описании, если не указано иное, термин “галогено” и “галоген” может представлять собой фтор, хлор, бром или йод.
В данном описании, если не указано иное, термин “алкилгалогено” означает алкильную группу, как определено выше, которая замещена галогено, как описано выше. Термин “C1-6алкилгалогено” может включать, но не ограничен ими, фторметил, дифторметил, трифторметил, фторэтил, дифторэтил или бромпропил. Термин “ОС1-6алкилгалогено” может включать, но не ограничен ими, фторметокси, дифторметокси, трифторметокси, фторэтокси или дифторэтокси.
В данном описании, если не указано иное, термин “алкенил” включает как неразветвленные, так и разветвленные алкенильные группы. Термин “С2-6алкенил” относится к алкенильной группе, имеющей от 2 до 6 атомов углерода и одну или две двойных связи, и может представлять собой, но не ограничен ими, винил, аллил, пропенил, изопропенил, бутенил, изобутенил, кротил, пентенил, изопентенил и гексенил.
В данном описании, если не указано иное, термин “алкинил” включает как неразветвленные, так и разветвленные алкинильные группы. Термин С2-6алкинил относится к алкинильной группе, имеющей от 2 до 6 атомов углерода и одну или две тройных связи, и может представлять собой, но не ограничен ими, этинил, пропаргил, бутинил, изобутинил, пентинил, изопентинил и гексинил.
В данном описании, если не указано иное, термин “арил” относится к возможно замещенной моноциклической или бициклической углеводородной кольцевой системе, содержащей по меньшей мере одно ненасыщенное ароматическое кольцо. Примерами и подходящими значениями термина “арил” являются фенил, нафтил, 1,2,3,4-тетрагидронафтил, индил и инденил.
В данном описании, если не указано иное, термин “гетероарил” относится к возможно замещенной моноциклической или бициклической ненасыщенной кольцевой системе, содержащей по меньшей мере один гетероатом, независимо выбранный из N, О или S. Примеры “гетероарила” могут представлять собой, но не ограничены ими, тиофен, тиенил, пиридил, тиазолил, фурил, пирролил, триазолил, имидазолил, оксадиазолил, оксазолил, изоксазолил, пиразолил, имидазолонил, оксазолонил, тиазолонил, тетразолил и тиадиазолил, бензоимидазолил, бензооксазолил, тетрагидротриазолопиридил, тетрагидротриазолопиримидинил, бензофурил, индолил, изоиндолил, пиридонил, пиридазинил, пиримидинил, имидазопиридил, оксазолопиридил, тиазолопиридил, пиридил, имидазопиридазинил, оксазолопиридазинил, тиазолопиридазинил и пуринил.
В данном описании, если не указано иное, термин “алкиларил”, “алкилгетероарил” и “алкилциклоалкил” относится к заместителю, который присоединен через алкильную группу к арильной, гетероарильной и циклоалкильной группе.
В данном описании, если не указано иное, термин “гетероциклоалкил” относится к возможно замещенной, насыщенной циклической углеводородной кольцевой системе, где один или более чем один атом углерода заменен гетероатомом. Термин “гетероциклоалкил” включает, но не ограничен ими, пирролидин, тетрагидрофуран, тетрагидротиофен, пиперидин, пиперазин, морфолин, тиоморфолин, тетрагидропиран, тетрагидротиопиран.
В данном описании, если не указано иное, термин “5- или 6-членное кольцо, содержащее атомы, независимо выбранные из С, N, О или S”, включает ароматические и гетероароматические кольца, а также карбоциклические и гетероциклические кольца, которые могут быть насыщенными, частично насыщенными или ненасыщенными. Примеры таких колец могут представлять собой, но не ограничены ими, фурил, изоксазолил, изотиазолил, оксазолил, пиразинил, пиразолил, пиридазинил, пиридил, пиримидил, пирролил, тиазолил, тиенил, имидазолил, имидазолидинил, имидазолинил, триазолил, морфолинил, пиперазинил, пиперидил, пиперидонил, пиразолидинил, пиразолинил, пирролидинил, пирролинил, тетрагидропиранил, тиоморфолинил, фенил, циклогексил, циклопентил и циклогексенил.
В данном описании, если не указано иное, термин “=NR5” и “=NOR5” включает имино- и оксимо-группы, несущие заместитель R5, или может представлять собой группы или часть групп, включая, но не ограничиваясь ими, иминоалкил, иминогидрокси, иминоалкокси, амидин, гидроксиамидин и алкоксиамидин.
В том случае, когда нижний индекс представляет собой целое число 0 (ноль), группа, к которой относится этот нижний индекс, указывает на то, что эта группа отсутствует, то есть имеется прямая связь между группами.
В данном описании, если не указано иное, термин “конденсированные кольца” относится к двум кольцам, которые совместно используют два общих атома.
В данном описании, если не указано иное, термин “мостик” означает молекулярный фрагмент, содержащий один или более чем один атом, или связь, которые соединяют два расположенных на расстоянии друг от друга атома в кольце, образуя, таким образом, либо би-, либо трициклические системы.
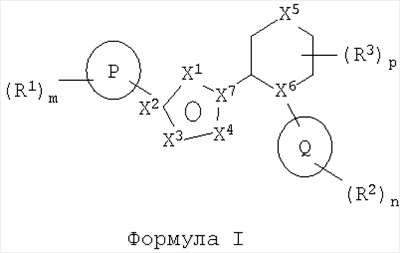
Одно воплощение изобретения относится к соединениям формулы I
где
R1 выбран из арила и гетероарила;
R1 присоединен к Р через атом углерода на кольце Р и выбран из группы, состоящей из: гидрокси, галогено, нитро, С1-6алкилгалогено, OC1-6алкилгалогено, C1-6алкила,
OC1-6алкила, С2-6алкенила, ОС2-6алкенила, С2-6алкинила, ОС2-6алкинила, С0-6алкилС3-6циклоалкила, ОС0-6алкилС3-6циклоалкила, С0-6алкиларила, ОС0-6алкиларила, СНО, (CO)R5, O(CO)R5, O(CO)OR5, C(CNR5)OR5, С1-6алкилОR5,
ОС2-6алкилOR5, С1-6алкил(СО)R5, OC1-6алкил(СО)R5, С0-6алкилСO2R5, ОС1-6алкилСO2R5, С0-6алкилциано, ОС2-6алкилциано, С0-6алкилNR5R6, ОС2-6алкилNR5R6, C1-6aлкил(CO)NR5R6, OC1-6алкил(СО)NR5R6, C0-6алкилNR5(CO)R6, OC2-6aлкилNR5(CO)R6, С0-6aлкилNR5(CO)NR5R6, С0-6алкилSR5, OC2-6алкилSR5, С0-6алкил(SO)R5, ОС2-6алкил(SO)R5, С0-6алкилSO2R5, ОС2-6алкилSO2R5,
C0-6aлкил(SO2)NR5R6, ОС2-6aлкил(SO2)NR5R6, C0-6алкилNR5(SO2)R6, OC2-6aлкилNR5(SO2)R6, С0-6aлкилNR5(SO2)NR5R6, OC2-6aлкилNR5(SO2)NR5R6, (CO)NR5R6, O(CO)NR5R6, NR5OR6, C0-6aлкилNR5(CO)OR6, OC2-6aлкилNR5(CO)OR6, SO3R5 и 5- или 6-членного кольца, содержащего атомы, независимо выбранные из группы, состоящей из С, N, О и S;
X1 выбран из группы, состоящей из N, NR4 и CR4;
X2 выбран из группы, состоящей из С и N;
X3 выбран из группы, состоящей из CR4, N и О;
X4 выбран из группы, состоящей из CR4, N, NR4 и О;
X5 выбран из группы, состоящей из связи, CR4R4‘, NR4, О, S, SO и SO2;
X6 выбран из группы, состоящей из CR4 и N;
X7 выбран из группы, состоящей из С и N;
R4 независимо выбран из группы, состоящей из водорода, гидрокси, C1-6алкила,
С0-6алкилциано, оксо, =NR5, =NOR5, С1-4алкилгалогено, галогено, С3-7циклоалкила, O(СО)С1-4алкила, С1-4алкил(SO)С0-4алкила, С1-4алкил(SO2)С0-4алкила, (SO)С0-4алкила, (SO2)С0-4алкила, ОС1-4алкила, С1-4алкилОR5 и С0-4алкилNR5R6;
Q выбран из группы, состоящей из гетероциклоалкила и гетероарила;
R2 и R3 независимо выбраны из группы, состоящей из: гидрокси, С0-6алкилциано, оксо, =NR5, =NOR5, С1-4алкилгалогено, галогено, С1-6алкила, С3-7циклоалкила, С0-6алкиларила, С0-6алкилгетероарила, C1-6алкилциклоалкила, С0-6алкилгетероциклоалкила, ОС1-4алкила, ОС0-6алкиларила, O(СО)С1-4алкила, (СО)ОС1-4алкила, С0-4алкил(S)С0-4алкила, С1-4алкил(SO)С0-4алкила,
C1-4алкил(SO2)С0-4алкила, (SO)С0-4алкила, (SO2)С0-4алкила, С1-4алкилОR5, С0-4aлкилNR5R6 и 5- или 6-членного кольца, содержащего атомы, независимо выбранные из С, N, О и S, которое может быть возможно конденсировано с 5- или 6-членным кольцом, содержащим атомы, независимо выбранные из группы, состоящей из С, N и О, и где указанное кольцо и указанное конденсированное кольцо может быть замещено одним или более чем одним А;
где любой C1-6алкил, арил или гетероарил, определенный под R1, R2 и R3, может быть замещен одним или более чем одним А;
А выбран из группы, состоящей из: водорода, гидрокси, галогено, нитро, оксо, С0-6алкилциано, С0-4алкилС3-6циклоалкила, C1-6алкила, -OC1-6алкила, С1-6алкилгалогено, OC1-6алкилгалогено, С2-6алкенила, С0-3алкиларила, С0-6алкилОR5, ОС2-6алкилОR5, С0-6алкилSR5, OC2-6алкилSR5, (CO)R5, O(CO)R5, ОС2-6алкилциано, ОС1-6алкилCO2R5, O(CO)OR5, ОС1-6алкил(СО)R5, C1-6алкил(СО)R5, NR5OR6, C0-6NR5R6, OC2-6алкилNR5R6, C0-6aлкил(CO)NR5R6, OC1-6aлкил(CO)NR5R6, OC2-6aлкилNR5(CO)R6, С0-6алкилNR5(СО)R6, С0-6aлкилNR5(CO)NR5R6, O(CO)NR5R6, C0-6aлкил(SO2)NR5R6, ОС2-6aлкил(SO2)NR5R6, C0-6aлкилNR5(SO2)R6, OC2-6aлкилNR5(SO2)R6, SO3R5, C1-6aлкилNR5(SO2)NR5R6, ОС2-6алкил(SO2)R5, С0-6алкил(SO2)R5, С0-6алкил(SO)R5, ОС2-6алкил(SO)R5 и 5- или 6-членного кольца, содержащего атомы, независимо выбранные из группы, состоящей из С, N, О и S;
R5 и R6 независимо выбраны из Н, C1-6алкила, С3-7циклоалкила и арила;
m выбран из 0, 1, 2, 3 или 4;
n выбран из 0, 1, 2, 3 или 4;
р выбран из 0, 1, 2, 3 или 4, и
их соли или гидрату.
Другое воплощение изобретения относится к соединениям:
4-(5-{2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пиперидин-1-ил}-4-метил-4Н[1,2,4]триазол-3-ил)-пиридин;
3-[5-(3-хлор-фенил)-изоксазол-3-ил]-4-(4-метил-5-пиридин-4-ил-4Н[1,2,4]триазол-3-ил)-морфолин;
3-[5-(3-хлор-фенил)-изоксазол-3-ил]-4-[5-(4-дифторметокси-фенил)-4-метил-4Н[1,2,4]триазол-3-ил]-морфолин;
3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н[1,2,4]триазол-3-ил)-морфолин;
3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-[5-(4-дифторметокси-фенил)-4-метил-4Н[1,2,4]триазол-3-ил]-морфолин;
трет-бутиловый эфир 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-пиперазин-1-карбоновой кислоты;
2-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-1-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-пиперазин;
2-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-метил-1-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-пиперазин;
трет-бутиловый эфир 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-[5-(4-дифторметокси-фенил)-4-метил-4Н-[1,2,4]триазол-3-ил]-пиперазин-1-карбоновой кислоты;
2-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-1-[5-(4-дифторметокси-фенил)-4-метил-4Н-[1,2,4]триазол-3-ил]-пиперазин;
2-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-1-[5-(4-дифторметокси-фенил)-4-метил-4Н-[1,2,4]триазол-3-ил]-4-метил-пиперазин;
2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-1-{5-[4-(дифторметокси)фенил]-4-метил-4Н-[1,2,4]триазол-3-ил}пиперидин;
4-(5-{2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]пиперидин-1-ил}-4-метил-4Н[1,2,4]триазол-3-ил)пиридин;
2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-1-[5-(4-метоксифенил)-4-метил-4Н-[1,2,4]триазол-3-ил]пиперидин;
[4-(5-{2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]пиперидин-1-ил}-4-метил-4Н[1,2,4]триазол-3-ил)фенил]диметил-амин;
[4-(5-{2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]пиперидин-1-ил}-4-метил-4Н[1,2,4]триазол-3-ил)-бензил]-диметил-амин;
{2-[4-(5-{2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]пиперидин-1-ил}-4-метил-4Н[1,2,4]триазол-3-ил)-фенокси]-этил}-диметил-амин;
(R)-3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н[1,2,4]триазол-3-ил)-морфолин;
(S)-3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н[1,2,4]триазол-3-ил)-морфолин;
(R)-2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-1-{5-[4-(дифторметокси)-фенил]-4-метил-4Н[1,2,4]триазол-3-ил}пиперидин;
(S)-2-[2-(3-хлорфенил)-2Н-тетразол-5-ил]-1-{5-[4-(дифторметокси)фенил]-4-метил-4Н[1,2,4]триазол-3-ил}пиперидин;
(R)-4-(5-{2-[2-(3-хлорфенил)-2Н-тетразол-5-ил]пиперидин-1-ил}-4-метил-4Н[1,2,4]триазол-3-ил)пиридин;
(S)-4-(5-{2-[2-(3-хлорфенил)-2Н-тетразол-5-ил]пиперидин-1-ил}-4-метил-4Н[1,2,4]триазол-3-ил)пиридин;
4-[5-(5-{2-[5-(3-хлорфенил)-изоксазол-3-ил]пирролидин-1-ил}-4-циклопропил-4Н[1,2,4]триазол-3-ил)пиридин-2-ил]-морфолин;
4-[5-(542-[5-(3-хлорфенил)-изоксазол-3-ил]пирролидин-1-ил}-4-метил-4Н-[1,2,4]триазол-3-ил)пиридин-2-ил]-морфолин;
3-(5-{2-[5-(3-хлорфенил)-изоксазол-3-ил]пирролидин-1-ил}-4-метил-4Н-[1,2,4]триазол-3-ил)-пиридин;
4-(5-{2-[5-(3-хлорфенил)-изоксазол-3-ил]пирролидин-1-ил}-4-циклопропил-4Н[1,2,4]триазол-3-ил)-пиридин;
3-[5-(3-хлорфенил)-[1,2,4]оксадиазол-3-ил]-4-(5-пиридин-4-ил-4Н[1,2,4]триазол-3-ил)-морфолин;
3-[5-(3-хлорфенил)-изоксазол-3-ил]-4-(4-циклопропил-5-пиридин-3-ил-4Н[1,2,4]триазол-3-ил)-морфолин;
3-[5-(3-хлорфенил)-изоксазол-3-ил]-4-(4-циклопропил-5-пиридин-4-ил-4Н[1,2,4]триазол-3-ил)-морфолин;
3-[5-(3-хлорфенил)-изоксазол-3-ил]-4-(4-метил-5-пиридин-3-ил-4Н[1,2,4]триазол-3-ил)-морфолин;
3-[5-(3-хлорфенил)-изоксазол-3-ил]-4-[5-(6-метокси-пиридин-3-ил)-4-метил-4Н[1,2,4]триазол-3-ил]-морфолин;
3-[3-(3-хлорфенил)-1,2,4-оксадиазол-5-ил]-4-[5-(2-метоксипиридин-4-ил)-4-метил-4Н[1,2,4]триазол-3-ил]-морфолин;
3-[3-(3-хлорфенил)-1,2,4-оксадиазол-5-ил]-4-[5-(2-метилпиридин-4-ил)-4-метил-4Н[1,2,4]триазол-3-ил]-морфолин;
3-[3-(3-хлорфенил)-1,2,4-оксадиазол-5-ил]-4-[5-(5-фторпиридин-3-ил)-4-метил-4Н[1,2,4]триазол-3-ил]-морфолин;
3-[5-(3-хлорфенил)-изоксазол-3-ил]-4-[5-(5-фторпиридин-3-ил)-4-метил-4Н[1,2,4]триазол-3-ил]-морфолин;
3-[3-(3-хлорфенил)-1,2,4-оксадиазол-5-ил]-4-(4-метил-5-пиридин-2-ил-4Н[1,2,4]триазол-3-ил)-морфолин;
4-[5-(5-фторпиридин-3-ил)-4-метил-4Н[1,2,4]триазол-3-ил]-3-[3-(3-йодфенил)-1,2,4-оксадиазол-5-ил]морфолин;
3-[3-(3-йодфенил)-1,2,4-оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н[1,2,4]триазол-3-ил)-морфолин;
3-[5-(3-хлорфенил)-изоксазол-3-ил]-4-[5-(2-метилпиридин-4-ил)-4-метил-4Н[1,2,4]триазол-3-ил]-морфолин;
3-[2-(3-хлорфенил)-2Н-тетразол-5-ил]-4-(4-метил-5-пиридин-3-ил-4Н[1,2,4]триазол-3-ил)-морфолин и
3-[2-(3-хлорфенил)-2Н-тетразол-5-ил]-4-[5-(3,5-дифторфенил)-4-метил-4Н[1,2,4]триазол-3-ил]-морфолин.
Данное изобретение относится к полициклическим соединениям формулы I, имеющим переменную Р. В воплощениях изобретения Р представляет собой арил. В конкретных воплощениях изобретения Р представляет собой фенил.
В воплощениях изобретения m равно 1 или 2.
В конкретных воплощениях изобретения Р представляет собой фенил, имеющий один или два заместителя R1. В более конкретных воплощениях изобретения, когда имеется один заместитель R1, этот заместитель расположен в положении 3 фенила относительно X2. В других конкретных воплощениях изобретения, когда имеется два заместителя R1, эти заместители расположены в положениях 2 и 5 фенила относительно X2.
В другом воплощении изобретения R1 выбран из группы, состоящей из: водорода, галогено, C1-6алкилгалогено, OC1-6алкилгалогено, C1-6алкила, OC1-6алкила, С1-6алкилОR5, С0-6алкилциано, С0-6алкилNR5R6. В еще одном воплощении изобретения R1 выбран из группы, состоящей из Cl, F, Me, OMe, CF3, OCF3 и CN. В еще одном воплощении изобретения R1 представляет собой Cl.
В воплощениях изобретения X7 представляет собой С. В других воплощениях изобретения X2 представляет собой С. В предпочтительных воплощениях изобретения по меньшей мере один из X2 и X7 представляет собой С.
В другом воплощении изобретения X3 выбран из N и О.
Изобретение дополнительно относится к соединениям формулы I, где X2 представляет собой С. Воплощения изобретения включают те, в которых X1 представляет собой N или CR4. В дополнительном воплощении изобретения, когда X3 представляет собой О, то X4 представляет собой N, и когда X3 представляет собой N, то X4 представляет собой О.
В другом воплощении изобретения X2 представляет собой N. В дополнительном воплощении изобретения X1 представляет собой N. В еще одном дополнительном воплощении изобретения X3 представляет собой N и X4 представляет собой N или CR4.
В другом воплощении изобретения X5 выбран из группы, состоящей из CR4R4′, NR4, О, S, SO и SO2. В дополнительном воплощении изобретения X5 выбран из группы, состоящей из CR4R4′, NR4 и О. В еще одном дополнительном воплощении изобретения X5 выбран из группы, состоящей из О и NR4.
Конкретные воплощения изобретения включают те, в которых кольцо, содержащее X1, X2, X3 и X4, выбрано таким образом, что образованное кольцо представляет собой тетразольное, триазольное, оксадиазольное, оксазольное, изоксазольное или имидазольное кольцо. Предпочтительно это кольцо представляет собой тетразол, оксадиазол или изоксазол.
В воплощениях изобретения X6 представляет собой N. В дополнительных воплощениях изобретения X5 выбран из О и NR4. В дальнейших воплощениях изобретения X5 выбран из CR4R4′.
В конкретных воплощениях изобретения, когда кольцо, содержащее X1, X2, X3 и X4, представляет собой тетразол, X6 представляет собой N и X5 представляет собой CR4R4′. В другом конкретном воплощении изобретения, когда кольцо, содержащее X1, X2, X3 и X4, выбрано из оксадиазола и изоксазола, X6 представляет собой N и X5 выбран из О и NR4.
В другом воплощении изобретения R4 и R4 независимо выбраны из группы, состоящей из: водорода, C1-6алкила, С1-6алкилгалогено и галогено.
Настоящее изобретение относится к соединениям формулы I, имеющим кольцо Q. Воплощения изобретения включают те, в которых Q представляет собой гетероарил. В предпочтительных воплощениях Q выбран из группы, состоящей из:
a) 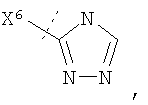 б) б) 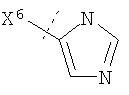 и в) и в) 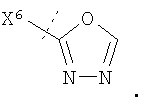
В более предпочтительном воплощении изобретения кольцо Q представляет собой
a) 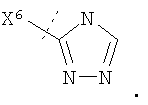
Воплощения изобретения включают те, в которых R1 и R2 выбраны из группы, состоящей из: водорода, С1-4алкилгалогено, С1-6алкила, С3-6циклоалкила, С0-6алкиларила и С0-6алкилгетероарила.
В еще одном другом воплощении изобретения любая переменная C1-6алкил, арил или гетероарил, определенная под R1, R2 и R3, может быть замещена одним или более чем одним заместителем А. Конкретные воплощения изобретения включают те, в которых А выбран из группы, состоящей из: водорода, гидроксила, галогено, С0-6алкилциано, C1-6алкила, -OC1-6алкила, C1-6алкилгалогено, ОС1-6алкилгалогено.
Воплощения изобретения включают соли, образованные соединениями формулы I. Соли для применения в фармацевтических композициях будут представлять собой фармацевтически приемлемые соли, но другие соли могут быть полезны при получении соединений формулы I.
Подходящей фармацевтически приемлемой солью соединений по изобретению является, например, соль присоединения кислоты, например, неорганической или органической кислоты. Кроме того, подходящей фармацевтически приемлемой солью соединений по изобретению является соль щелочного металла, соль щелочноземельного металла или соль с органическим основанием.
Другие фармацевтически приемлемые соли и способы получения этих солей можно найти, например, в Remington’s Pharmaceutical Sciences (18th Edition, Mack Publishing Co.) 1990.
Некоторые соединения формулы I могут иметь хиральные центры и/или центры геометрической изомерии (Е- и Z-изомеры), и следует понимать, что изобретение охватывает все такие оптические, диастереоизомерные и геометрические изомеры.
Изобретение также относится к любой и ко всем таутомерным формам соединений формулы I.
Изобретение также относится к гидратным и сольватным формам соединений формулы I.
Фармацевтическая композиция
Согласно одному аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая в качестве активного ингредиента терапевтически эффективное количество соединения формулы I либо его солей, сольватов или сольватированных солей в сочетании с одним или более чем одним фармацевтически приемлемым разбавителем, эксципиентом и/или инертным носителем.
Композиция может находиться в форме, подходящей для перорального введения, например, в виде таблетки, пилюли, сиропа, порошка, гранулы или капсулы, для парентеральной инъекции (включая внутривенную, подкожную, внутримышечную, внутрисосудистую или инфузию) в виде стерильного раствора, суспензии или эмульсии, для местного введения, например, в виде мази, пластыря или крема, либо для ректального введения, например, в виде суппозитория.
В целом вышеуказанные композиции могут быть изготовлены общепринятым способом, используя один или более чем один из общепринятых эксципиентов, фармацевтически приемлемых разбавителей и/или инертных носителей.
Подходящие суточные дозы соединений формулы I при лечении млекопитающего, включая человека, составляют примерно от 0,01 до 250 мг/кг массы тела при пероральном введении и примерно от 0,001 до 250 мг/кг массы тела при парентеральном введении.
Типичная суточная доза активных ингредиентов варьирует в пределах широкого диапазона и будет зависеть от различных факторов, таких как релевантное показание, тяжесть заболевания, подлежащего лечению, путь введения, возраст, масса и пол пациента и конкретное применяемое соединение, и может быть определена лечащим врачом.
Медицинское применение
Обнаружено, что соединения по настоящему изобретению проявляют высокую степень эффективности и избирательности в отношении индивидуальных подтипов метаботропных рецепторов глутамата (mGluR). Соответственно, ожидают, что соединения по настоящему изобретению полезны в лечении состояний, ассоциированных с возбуждающей активацией mGluR5, и для ингибирования повреждения нейронов, вызванного возбуждающей активацией mGluR5. Эти соединения можно применять для того, чтобы вызвать ингибиторный эффект в отношении mGluR5 у млекопитающих, включая человека.
Рецепторы mGluR группы I, включая mGluR5, обладают высокой экспрессией в центральной и периферической нервной системе и в других тканях. Следовательно, ожидают, что соединения по изобретению хорошо подходят для лечения mGluR5-опосредованных расстройств, таких как острые и хронические неврологические и психиатрические расстройства, желудочно-кишечные расстройства, а также хронические и острые болевые расстройства.
Изобретение относится к соединениям формулы I, как определено здесь выше, для применения в терапии.
Изобретение относится к соединениям формулы I, как определено здесь выше, для применения в лечении mGluR5-опосредованных расстройств.
Изобретение относится к соединениям формулы I, как определено здесь выше, для применения в лечении болезни Альцгеймера, старческой деменции, деменции, вызванной СПИДом, болезни Паркинсона, бокового амиотрофического склероза, хореи Гентингтона, мигрени, эпилепсии, шизофрении, депрессии, тревоги, острой тревоги, офтальмологических расстройств, таких как ретинопатии, диабетические ретинопатии, глаукома, слуховых невропатических расстройств, таких как шум в ушах, невропатий, индуцированных химиотерапией, постгерпетической невралгии и невралгии тройничного нерва, толерантности, зависимости, синдрома хрупкой X-хромосомы, аутизма, умственной отсталости, шизофрении и синдрома Дауна.
Изобретение относится к соединениям формулы I, как определено здесь выше, для применения в лечении боли, связанной с мигренью, воспалительной боли, невропатологических болевых расстройств, таких как диабетические невропатии, артрит и ревматоидные заболевания, боли в нижней части спины, послеоперационной боли и боли, ассоциированной с различными состояниями, включая стенокардию, почечную или желчную колику, менструацию, мигрень и подагру.
Изобретение относится к соединениям формулы I, как определено здесь выше, для применения в лечении удара, травмы головы, повреждений в результате гипоксии и ишемических повреждений, гипогликемии, сердечно-сосудистых заболеваний и эпилепсии.
Настоящее изобретение также относится к применению соединения формулы I, как определено здесь выше, в изготовлении лекарства для лечения заболеваний, опосредованных рецепторами mGluR группы I, и любого расстройства из перечисленных выше.
Одно из воплощений изобретения относится к применению соединения формулы I в лечении желудочно-кишечных расстройств.
Другое воплощение изобретения относится к применению соединения формулы I для изготовления лекарства для ингибирования временных расслаблений нижнего пищеводного сфинктера, для лечения ГЭРБ, для предупреждения ЖК-рефлюкса, для лечения регургитации, лечения астмы, лечения ларингита, лечения заболевания легких и для контроля плохого прибавления в весе.
Дополнительное воплощение изобретения представляет собой применение соединения формулы I для изготовления лекарства для лечения или предупреждения функциональных желудочно-кишечных расстройств, таких как функциональная диспепсия (ФД). Еще один следующий аспект изобретения представляет собой применение соединения формулы I для изготовления лекарства для лечения или предупреждения синдрома раздраженной толстой кишки (СРК), такого как СРК с преобладанием запора, СРК с преобладанием диареи или СРК с преобладанием чередующейся перистальтики кишечника.
В дополнительном аспекте изобретения предложены фармацевтические композиции, содержащие терапевтически эффективное количество соединения формулы I и фармацевтически приемлемый разбавитель, эксципиенты и/или инертный носитель.
В еще одном дополнительном аспекте изобретения предложена фармацевтическая композиция, содержащая соединение формулы I, для применения в лечении расстройств, опосредованных рецепторами mGluR5, и для применения в лечении неврологических расстройств, психиатрических расстройств, желудочно-кишечных расстройств и болевых расстройств.
В еще одном дополнительном аспекте изобретения предложено соединение формулы I для применения в терапии, в частности для лечения расстройств, опосредованных рецепторами mGluR5, и для лечения неврологических расстройств, психиатрических расстройств, желудочно-кишечных расстройств и болевых расстройств.
Дополнительный аспект изобретения представляет собой применение соединения формулы I для изготовления лекарства для лечения или предупреждения ожирения и состояний, связанных с ожирением, а также для лечения расстройств приема пищи путем подавления избыточного поглощения пищи и ожирения, являющегося его результатом, а также осложнений, связанных с этим.
В другом аспекте изобретения предложены способы получения соединений формулы I и промежуточные соединения, используемые при их получении.
Эти и другие аспекты настоящего изобретения более подробно описаны здесь ниже.
В изобретении также предложен способ лечения mGluR5-опосредованных расстройств и любого расстройства из перечисленных выше у пациента, страдающего указанным состоянием или имеющего риск возникновения такого расстройства, включающий введение пациенту эффективного количества соединения формулы I, как определено здесь выше.
Доза, необходимая для терапевтического или профилактического лечения конкретного расстройства, будет обязательно варьировать в зависимости от организма хозяина, которого лечат, от пути введения и от тяжести заболевания, подлежащего лечению.
В контексте настоящего описания термины «терапия» и «лечение» включают предупреждение или профилактику, если нет конкретных указаний на противоположное. Термины «терапевтический» и «терапевтически» следует понимать соответственно.
В данном описании, если не указано иное, термином «антагонист» и «ингибитор» следует обозначать соединение, которое любыми путями, частично или полностью блокирует биохимический путь преобразования сигнала, приводя к получению ответа посредством лиганда.
Термин «расстройство», если не указано иное, означает любое состояние и заболевание, ассоциированное с активностью метаботропных рецепторов глутамата.
Немедицинское применение
Кроме их применения в терапевтической медицине соединения формулы I, их соли или гидраты также полезны в качестве фармакологических инструментов при разработке и стандартизации тест-систем in vitro и in vivo для оценки эффектов ингибиторов активности, связанной с mGluR, на лабораторных животных, таких как кошки, собаки, кролики, обезьяны, крысы и мыши, как части исследований новых терапевтических агентов.
Способы получения
В другом аспекте настоящего изобретения предложены способы получения соединений формулы I, или их солей, или гидратов. Здесь описаны способы получения соединений в настоящем изобретении.
На протяжении всего описания таких способов должно быть понятно, что в различные реагенты и промежуточные соединения вводят, где целесообразно, защитные группы с их последующим удалением способом, который будет легко понятен специалистам в области органического синтеза. Общепринятые методики использования таких защитных групп, а также примеры подходящих защитных групп описаны, например, в «Protective Groups in Organic Synthesis», T.W. Green, P.G.M. Wuts, Wiley-lnterscience, New York (1999). Также следует понимать, что превращение группы или заместителя в другую группу или заместитель путем химических манипуляций может быть осуществлено на любом промежуточном соединении или конечном продукте на синтетическом пути до конечного продукта, в котором возможный тип превращения ограничен только собственной несовместимостью других функциональных групп, которые несет молекула на этой стадии, с условиями или реагентами, используемыми в превращении. Такие собственные несовместимости и пути их преодоления путем проведения соответствующих превращений и стадий синтеза в подходящем порядке будут легко понятны специалистам в области органического синтеза. Примеры превращений приведены ниже, и должно быть понятно, что описанные превращения не ограничены только обычными группами или заместителями, для которых приведены примеры превращений. Ссылки и описания к другим подходящим превращениям даны в «Comprehensive Organic Transformations – A Guide to Functional Group Preparations» R.C.Larock, VHC Publishers, Inc. (1989). Ссылки и описания к другим подходящим реакциям описаны в учебниках органической химии, например, «Advanced Organic Chemistry», March, 4th Ed. McGraw Hill (1992) или «Organic Synthesis», Smith, McGraw Hill (1994). Методики очистки промежуточных соединений и конечных продуктов включают, например, хроматографию с нормальной и обращенной фазой на колонке или вращающейся пластине, перекристаллизацию, дистилляцию и экстракцию жидкость-жидкость или твердо-жидкостную экстракцию, которые будут легко понятны специалистам в данной области техники. Определения заместителей и групп являются такими, как в формуле I, за исключением тех случаев, где они определены иначе. Термином «комнатная температура» и «температура окружающей среды» следует обозначать, если не указано иное, температуру от 16 до 25°С.
Термином «флегмообразование», если не указано иное, следует обозначать, со ссылкой на используемый растворитель, температуру при точке кипения указанного растворителя или выше.
Сокращения
| водн. |
водный |
| атм. |
атмосфера |
| BINAP |
2,2’бис(дифенилфосфино)-1,1′-бинафтил |
| Boc, ВОС |
трет-бутоксикарбонил |
| CDI |
N,N’-карбонилдиимидазол |
| dba |
дибензилиденацетон |
| DCC |
N,N-дициклогексилкарбодиимид |
| ДХМ |
дихлорметан |
| DEA |
N,N-диизопропилэтиламин |
| DIBAL-H |
диизобутилалюмогидрид |
| DIC |
N,N’-диизопропилкарбодиимид |
| DMAP |
N,N-диметил-4-аминопиридин |
| ДМФ |
диметилформамид |
| ДМСО |
диметилсульфоксид |
| DPPF |
1,1′-бис(дифенилфосфино)ферроцен |
| EA или EtOAc |
этилацетат |
| EDC, EDCI |
гидрохлорид N-[3-(диметиламино)пропил]-N’- |
 |
этилкарбодиимида |
| Et |
этил |
| Et2O |
диэтиловый эфир |
| Etl |
йодэтан |
| EtOH |
этанол |
| Et3N |
триэтиламин |
| Fmoc, FMOC |
9-флуоренилметоксикарбонил |
| ч |
час(ы) |
| HBTU |
O-(бензотриазол-1-ил)-N,N,N’,N’-тетраметилурония гексафторфосфат |
| HetAr |
гетероарил |
| HOBt |
N-гидроксибензотриазол |
| ВЭЖХ |
высокоэффективная жидкостная хроматография |
| LCMS |
ВЭЖХ масс-спектр |
| MCPBA |
мета-хлорбензойная кислота |
| Me |
метил |
| MeCN |
ацетонитрил |
| Mel |
йодметан |
| MeMgCl |
метилмагния хлорид |
| MeOH |
метанол |
| мин |
минуты |
| NaOAc |
ацетат натрия |
| nBu |
нормальный бутил |
| nBuLi, n-BuLi |
1-бутиллитий |
| NCS |
N-хлорсукцинимид |
| ЯМР |
ядерный магнитный резонанс |
| в т.н. |
в течение ночи |
| ОАс |
ацетат |
| OMs |
сложный эфир мезилат или метансульфонат |
| OTs |
сложный эфир тозилат, толуолсульфонат или 4-метилбензолсульфонат |
| PPTS |
пиридиния пара-толуолсульфонат |
| pTsOH |
пара-толуолсульфоновая кислота |
| КТ, кт, к.т. |
комнатная температура |
| нас. |
насыщенный |
| ТФЭ |
твердофазная экстракция (обычно содержащая силикагель) |
| TBAF |
тетрабутиламмония фторид |
| tBu, t-Bu |
трет-бутил |
| tBuOH, t-BuOH |
трет-бутанол |
| TEA |
триэтиламин |
| ТГФ |
тетрагидрофуран |
Получение промежуточных соединений
Промежуточные соединения, полученные приведенными ниже путями синтеза, полезны для дальнейшего получения соединений формулы I. Другие исходные вещества либо имеются в продаже, либо могут быть получены способами, описанными в литературе. Описанные ниже пути синтеза являются неограничивающими примерами получения, которые можно использовать. Специалистам в данной области техники будет понятно, что можно использовать другие пути.
Синтез изоксазолов
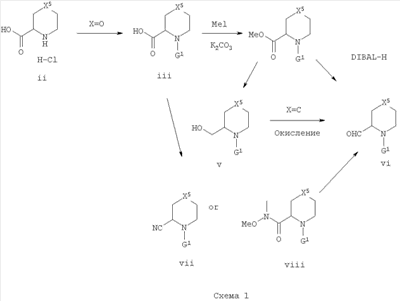
Альдегиды формулы vi, где X5 является таким, как определено в формуле I, могут быть использованы при получении изоксазолов. Имеющиеся в продаже производные кислоты формулы ii, где X5 представляет собой О, S, С, N-R2 и N-G2 (G2 представляет собой защитную группу, ортогональную к G1), могут быть подвергнуты N-защите с получением соединений формулы iii, где G1 представляет собой защитную группу, такую как Вос или Fmoc, с использованием способов, хорошо известных в данной области техники. Кислотная группировка в соединениях формулы iii может быть преобразована в алкиловый эфир формулы iv, такой как, например, метиловый или этиловый эфир, который можно превратить в альдегиды формулы vi, используя мягкий восстанавливающий агент, такой как DIBAL-H, в растворителе, таком как толуол, при низкой температуре, например, -78°С. Более высокие температуры или более сильные восстанавливающие агенты могут привести к образованию первичных спиртов формулы v, либо исключительно, либо в виде смеси с альдегидами формулы vi. Другие функциональные группы, такие как первичный спирт в соединениях формулы v, нитрил в соединениях формулы vii и амидная группировка Вайнреба (Weinreb) в соединениях формулы viii, можно превратить в альдегиды формулы vi, используя методики, разработанные в данной области техники. Кроме того, кислоты формулы ii можно превратить в нитрилы формулы vii способами, известными в данной области техники, например, путем превращения кислоты в первичный амид с последующей дегидратацией до нитрила.
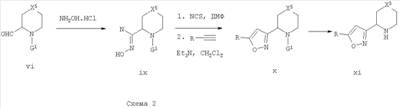
Альдегиды формулы vi можно превратить в оксимы формулы ix путем обработки гидроксиламином в растворителе, таком как пиридин, при температуре от 0°С до комнатной температуры. Изоксазолы формулы х могут быть получены путем хлорирования оксимов формулы ix, используя реагент, такой как N-хлорсукцинимид (NCS), с последующим 1,3-диполярным циклоприсоединением с подходящими R-замещенными ацетиленами, где R может представлять собой (R1)m-P или маскирующую группу, которую можно впоследствии превратить в (R1)m-P (Steven, R. V. et al. J. Am. Chem. Soc. 1986, 108, 1039). Промежуточный изоксазол х можно затем подвергнуть удалению защиты с получением xi стандартными способами.
Изоксазолы формулы х, где R представляет собой маскирующую группу, могут быть получены таким способом, и маскирующую группу можно превратить в (R1)m-P после образования изоксазольного кольца. Например, в результате использования триалкилстаннилацетиленов образуется триалкилстаннилизоксазол, который может быть подвергнут реакциям, таким как, например, перекрестное сочетание типа Штиля, для введения арильных заместителей путем сочетания с соответствующим арилгалогенидом.
Синтез [1,2,4]-оксадиазолов
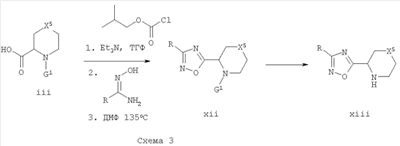
Карбоновые кислоты формулы iii могут быть использованы при получении соответствующих 3-R-замещенных [1,2,4]оксадиазолов формулы xii путем активации кислотной группировки, присоединения подходящего R-замещенного гидроксиамидина с образованием сложного эфира с последующей циклизацией до оксадиазола. [См. Tetrahedron Lett., 2001, 42, 1495-98, Tetrahedron Lett., 2001, 42, 1441-43, и Bioorg. Med. Chem. Lett. 1999, 9, 1869-74]. Кислота может быть активирована в виде смешанного ангидрида, используя алкилхлорформиат, такой как изобутилхлорформиат, в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как ТГФ. Альтернативно можно использовать другие хорошо известные методики активации кислоты, включая активацию кислоты in situ с использованием реагента, такого как EDCI, DCC, DIC или HBTU, в присутствии или в отсутствие сореагентов, таких как HOBt или DMAP, в подходящих растворителях, таких как ДМФ, ДХМ, ТГФ или MeCN, при температуре от -20 до 100°С. Циклизацию можно осуществить путем нагревания в растворителе, таком как пиридин или ДМФ, при микроволновом излучении или путем использования катализаторов, таких как TBAF. R-замещенные гидроксиамидины могут быть получены из нитрилов путем добавления гидрохлорида гидроксиламина в присутствии основания, такого как NaOH, NaHCO3 или Na2CO3, с образованием свободного гидроксиламина, в растворителе, таком как этанол или метанол или подобный им, при температурах от комнатной температуры до 100°С.
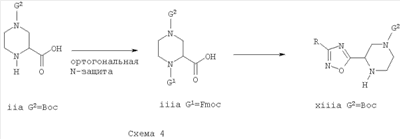
Для соединений формулы ii, где Х представляет собой N-G2, предложен удобный способ получения свободного NH соединения формулы I. Например, имеющееся в продаже производное кислоты формулы iia, где Х представляет собой N-Boc, можно подвергнуть ортогональной N-защите защитной группой G, такой как, например, Fmoc. Полученное в результате промежуточное соединение iiia можно превратить в соответствующие [1,2,4]-оксадиазолы, используя вышеописанные способы. Когда Fmoc используют в качестве одной из защитных групп, способы образования [1,2,4]-оксадиазольного кольца, включающие основание, такие как активация хлорформиатом в присутствии триэтиламина, или замыкание кольца в пиридине, могут обеспечить удаление защитной группы с получением xiiia непосредственно без выделения промежуточного 2-(3-R-[1,2,4]оксадиазол-5-ил)-пиперазина.
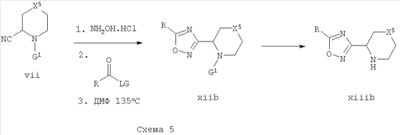
5-R-замещенные [1,2,4]оксадиазолы формулы xiib могут быть получены из нитрилов формулы vii путем эффективной перестановки заместителей, присоединенных к [1,2,4]-оксадиазолу. Нитрилы формулы vii взаимодействуют с гидроксиламином, как описано выше, с получением промежуточного гидроксиамидина и могут быть превращены в [1,2,4]оксадиазолы формулы xiib с использованием ацилирующего агента, содержащего группу R, используя способ, описанный выше для превращения соединений формулы iii в соединения формулы xii.
Синтез тетразолов
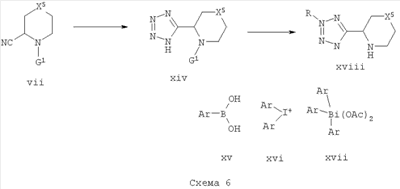
Нитрилы формулы vii могут быть использованы в получении соответствующих тетразолов формулы xviii путем обработки азидом, таким как NaN3, LiN3, азид триалкилилолова или триметилсилилазид, предпочтительно с катализатором, таким как оксид дибутилолова или ZnBr2, в растворителях, таких как ДМФ, вода или толуол, при температуре от 80 до 200°С путем обычного нагревания или микроволнового излучения [см. J. Org. Chem. 2001, 7945-7950; J. Org. Chem. 2000, 7984-7989 или J. Org. Chem. 1993, 4139-4141].
N2-арилирование 5-замещенных тетразолов описано в литературе с использованием ряда партнеров сочетания. Соединения формулы xviii, где R представляет собой арильную группу, могут быть получены с использованием, например, бороновых кислот формулы xv [с группировкой В(ОН)2], либо соответствующих йодониевых солей формулы xvii [с группировкой I+-Ar], либо соответствующих диацетатов триарилвисмута [с группировкой Bi(OAc)2Ar2] в качестве арилирующих агентов, опосредованных переходными металлами [см. Tetrahedron Lett. 2002, 6221-6223; Tetrahedron Lett. 1998, 2941-2944; Tetrahedron Lett. 1999, 2747-2748]. С бороновыми кислотами используют стехиометрические количества Cu(II)-ацетата и пиридина в растворителях, таких как дихлорметан, ДМФ, диоксан или ТГФ, при температуре от комнатной температуры до 100°С. С йодониевыми солями используют каталитические количества Pd(II)-соединений, таких как Pd(dba)2 или Pd(OAc)2, вместе с каталитическими количествами Cu(II)-карбоксилатов, таких как Cu(II)-фенилциклопропилкарбоксилат, и бидентатных лигандов, таких как BINAP или DPPF, в растворителях, таких как t-BuOH, при температуре от 50 до 100°С. С диацетатами триарилвисмута могут быть использованы каталитические количества ацетата меди в присутствии N,N,N’,N’-тетраметилгуанидина в подходящем растворителе, таком как ТГФ, при нагревании при температуре 40-60°С. Йодониевые соли формулы xvi могут быть получены, например, из соответствующих бороновых кислот путем обработки ароматическими соединениями, замещенными гипервалентным йодом, такими как гидроксил(тозилокси)йодбензол или Phl(OAc)2×2TfOH, в дихлорметане или тому подобное [см. Tetrahedron Lett. 2000, 5393-5396]. Диацетаты триарилвисмута могут быть получены из арилмагния бромидов с трихлоридом висмута в подходящем растворителе, таком как ТГФ, кипящий с обратным холодильником, с получением триарилвисмутана, который затем окисляют до диацетата, используя окисляющий агент, такой как перборат натрия, в уксусной кислоте [Synth. Commun. 1996, 4569-75].
Синтез [1,2,3]триазолов
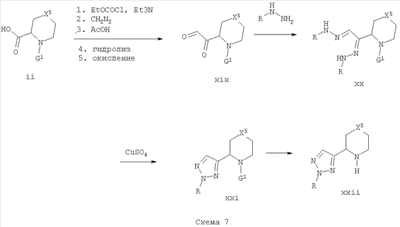
Кетоальдегиды формулы xix могут быть получены из соединений формулы ii посредством активации кислотной группировки, взаимодействия с диазометаном с образованием промежуточного альфа-диазокетона и улавливания кислотой, такой как уксусная кислота, с образованием промежуточного альфа-ацетилированного кетона, который можно превратить в соединения формулы xix путем гидролиза и окисления [См. Bioorg. Med. Chem. 2002, 10, 2199-2206]. Кетоальдегиды формулы xix будут взаимодействовать с арилгидразинами с уксусной кислотой и водой при температуре от -20 до 120°С с образованием бис-гидразонов формулы хх, которые могут претерпевать циклизацию в присутствии сульфата меди (II) в водных смесях, например, диоксана или ТГФ при температуре от -20 до 120°С с образованием [1,2,3]триазолов формулы xxi [См. J. Med. Chem. 1978, 21, 1254-60 и J. Org Chem. 1948, 13, 807-14]. Защиту соединений формулы xxi можно удалить, как указано выше, с получением вторичных аминов формулы xxii.
Синтез кольца Q: амино-триазолы
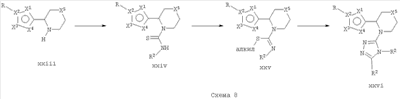
Амины формулы xi, xiii, xviii и xxii с удаленной защитой можно подвергать последовательному образованию тиомочевины, метилированию и образованию триазола с получением соединений формулы I, где кольцо Q представляет собой триазол, присоединенный к вновь защищенному вторичному амину. Тиомочевины формулы xxiv могут быть получены хорошо разработанными способами с использованием, например, изотиоцианата, R2SCN или 1,1-тиокарбонил-диимидазола в присутствии R2NH2, в растворителе, таком как метанол, этанол и тому подобное, при температуре от комнатной температуры до 100°С и обычно осуществляемыми при 60°С. Алкилирование промежуточных тиомочевин можно проводить с использованием алкилирующих агентов, таких как йодметан или йодэтан, в растворителе, таком как ДМФ, ацетон, CH2Cl2, при комнатной температуре или при повышенных температурах с получением изотиомочевины формулы xxv. Когда используют йодалкан, продукт можно выделить в виде соли гидроиодида [см. Synth. Commun. 1998, 28, 741-746]. Соединения формулы xxv могут взаимодействовать с ацилгидразином или с гидразином, а затем с ацилирующим агентом с образованием промежуточного соединения, которое может быть циклизовано до 3-аминотриазолов формулы xxvi путем нагревания при 50-200°С в подходящем растворителе, таком как пиридин или ДМФ.
Превращения других функциональных групп
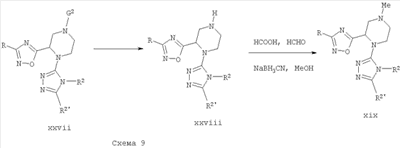
Должно быть понятно, что, когда дополнительные функциональные группы присутствуют в соединениях формулы I или любом предшественнике, эти функциональные группы можно использовать для введения других заместителей или функциональных групп способами, разработанными в данной области техники, когда нет других несовместимых реакционноспособных мест. Например, в соединениях формулы xxvii, которые могут быть получены из ортогонально замещенного бис-амина xiiia, описанного выше, вторичный амин, полученный путем удаления защиты G2, может претерпевать алкилирование или восстановительное аминирование с образованием третичного амина формулы xix. Кроме того, другие заместители, не изображенные подробно на схемах, могут присутствовать, как описано в формуле I, при условии, что указанные заместители не оказывают влияния на описанные выше реакции.
Изобретение дополнительно относится к приведенным ниже соединениям, которые могут быть использованы в качестве промежуточных соединений при получении соединений формулы I:
метил-4-диметиламинометил-бензоат
этил-4-(2-диметиламино-этокси)-бензоат
гидразид 4-диметиламинометил-бензойной кислоты
гидразид 4-(2-диметиламино-этокси)-бензойной кислоты
гидразид 4-дифторметокси-бензойной кислоты
трис-(3-хлор-фенил)-висмутан
диацетат трис-(3-хлор-фенил)-висмутана
трет-бутиловый эфир 2-гидроксиметил-пиперидин-1-карбоновой кислоты
4-трет-бутиловый эфир морфолин-3,4-дикарбоновой кислоты
4-трет-бутиловый эфир 1-(9Н-флуорен-9-илметил)эфир пиперазин-1,2,4-трикарбоновой кислоты
трет-бутиловый эфир 2-формил-пиперидин-1-карбоновой кислоты
4-трет-бутиловый эфир 3-метиловый эфир морфолин-3,4-дикарбоновой кислоты
трет-бутиловый эфир 3-формил-морфолин-4-карбоновой кислоты
трет-бутиловый эфир 2-циано-пиперидин-1-карбоновой кислоты
трет-бутиловый эфир 2-(1Н-тетразол-5-ил)-пиперидин-1-карбоновой кислоты
трет-бутиловый эфир 2-(гидроксиимино-метил)-пиперидин-1-карбоновой кислоты
трет-бутиловый эфир 3-(гидроксиимино-метил)-морфолин-4-карбоновой кислоты
трет-бутиловый эфир 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пиперидин-1-карбоновой кислоты
трет-бутиловый эфир 3-[5-(3-хлор-фенил)-изоксазол-3-ил]-морфолин-4-карбоновой кислоты
трет-бутиловый эфир 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-морфолин-4-карбоновой кислоты
трет-бутиловый эфир 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-пиперазин-1-карбоновой кислоты
трет-бутиловый эфир 2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-пиперидин-1-карбоновой кислоты
2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пиперидин
3-[5-(3-хлор-фенил)-изоксазол-3-ил]-морфолин
3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-морфолин
2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-пиперидин
метиламид 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пиперидин-1-карботиокислоты
метиламид 3-[5-(3-хлор-фенил)-изоксазол-3-ил]-морфолин-4-карботиокислоты
метиламид 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-морфолин-4-карботиокислоты
трет-бутиловый эфир 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-метилтиокарбамоил-пиперазин-1-карбоновой кислоты
метиламид 2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-пиперидин-1-карботиокислоты
метиловый эфир 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-N-метил-пиперидин-1-карбоксимидотиокислоты
метиловый эфир 3-[5-(3-хлор-фенил)-изоксазол-3-ил]-М-метил-морфолин-4-карбоксимидотиокислоты
метиловый эфир 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-метилморфолин-4-карбоксимидотиокислоты
трет-бутиловый эфир 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(метилимино-метилсульфанил-метил)-пиперазин-1-карбоновой кислоты
метиловый эфир 2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-N-метил-пиперидин-1-карбоксимидотиокислоты
Примеры
Далее изобретение будет проиллюстрировано приведенными ниже неограничивающими примерами.
Общие способы
Все исходные вещества имеются в продаже или ранее описаны в литературе.
Спектры 1H ЯМР и 13С ЯМР записывали на спектрометрах либо Bruker 300, либо Bruker DPX400, либо Varian +400, оперируя при 300, 400 и 400 МГц для 1Н ЯМР, соответственно, используя ТМС или остаточный сигнал растворителя в качестве сравнения, в дейтерированном хлороформе в качестве растворителя, если не указано иное. Все химические сдвиги указаны в миллионных долях на дельта-шкале, и тонкое расщепление сигналов указано, как видно из записи (s: синглет, br s: широкий синглет; d: дублет; t: триплет; q: квартет; m: мультиплет).
Разделения с помощью аналитической поточной жидкостной хроматографии с последующими определениями масс-спектра проводили на установке Waters LCMS, состоящей из Alliance 2795 (LC) и одноквадрупольного масс-спектрометра ZQ. Масс-спектрометр был оборудован источником электрораспыления ионов, оперирующим в режиме положительного и/или отрицательного иона. Напряжение распыления ионов составляло ±3 кВ, и масс-спектрометр сканировали от m/z 100-700 при времени сканирования 0,8 с. На колонку, X-Terra MS, Waters, C8, 2,1×50 мм, 3,5 мм, наносили линейный градиент от 5% до 100% ацетонитрила в 10 мМ ацетате аммония (водн.) или в 0,1% ТФУ (водн.). Препаративную хроматографию с обращенной фазой проводили на автоматизированной препаративной ВЭЖХ Gilson с диодным цифровым детектором, используя XTerra MS C8, 19×300 мм, 7 мм, в качестве колонки.
Очистку с помощью хроматотрона проводили на стеклянных пластинах, покрытых силикагелем/гипсом (Merck, 60 PF-254 с сульфатом кальция) со слоем покрытия 1, 2 или 4 мм, используя хроматотрон ТС Research 7924T. Очистку продуктов также проводили с помощью флэш-хроматографии на стеклянных колонках, заполненных силикагелем, или в пластмассовых трубках SPE, предварительно заполненных силикагелем.
Микроволновое нагревание проводили в микроволновом резонаторе Smith Synthesizer Single-mode, дающем непрерывное излучение при 2450 МГц (Personal Chemistry AB, Uppsala, Sweden).
Пример 1
Метил-4-диметиламинометил-бензоат
Метил-4-(бромметил)бензоат (4,58 г, 20 ммоль) смешивали с 45% диметиламином (5,57 мл, 2,5 ммоль) в ТГФ (50 мл) при комнатной температуре в течение 30 мин. Эту смесь концентрировали в вакууме и остаток разбавляли водой и экстрагировали эфиром. Органический слой сушили MgSO4 и концентрировали в вакууме с получением соединения, указанного в заголовке (4,0 г), в виде бледно-желтого масла. 1Н ЯМР (CDCl3)  (млн-1): 8.01 (d, 2H), 7.40 (d, 2H), 3.92 (s, 3H), 3.48 (s, 2H) и 2.26 (s, 6H). (млн-1): 8.01 (d, 2H), 7.40 (d, 2H), 3.92 (s, 3H), 3.48 (s, 2H) и 2.26 (s, 6H).
Пример 2
Этил-4-(2-диметиламино-этокси)-бензоат
Этил-4-гидрокси-бензоат (16,6 г, 0,1 моль) смешивали с гидрохлоридом (2-хлор-этил)-диметил-амина (40 г, 0,28 моль) и K2CO3 (100 г, 0,724 моль) в ДМФ. Эту смесь нагревали до 150°С в течение 4 ч, а затем вливали в ледяную воду и продукт экстрагировали в этилацетат. Этилацетатный слой промывали рассолом, продукт подкисляли 1 н. HCl (130 мл) и этилацетатный слой отбрасывали. Подкисленный водный слой промывали этилацетатом, затем подщелачивали 2М карбонатом натрия (100 мл) и продукт снова экстрагировали в этилацетат. Органический слой промывали рассолом, сушили MgSO4, фильтровали и концентрировали с получением соединения, указанного в заголовке (12,6 г, 53%) в виде липкого светлого желто-коричневого масла. 1H ЯМР (CDCl3),  (млн-1): 8.01 (d, 2H), 6.95 (d, 2H), 4.36 (q, 2H), 4.13 (t, 2H), 2.76 (t, 2H), 2.36 (s, 6H) и 1.39 (t, 3H). (млн-1): 8.01 (d, 2H), 6.95 (d, 2H), 4.36 (q, 2H), 4.13 (t, 2H), 2.76 (t, 2H), 2.36 (s, 6H) и 1.39 (t, 3H).
Пример 3
Гидразид 4-диметиламинометил-бензойной кислоты
Метил-4-диметиламинометил-бензоат (4,0 г, 20 ммоль) смешивали с гидратом гидразина (9,7 мл, 200 ммоль) в метаноле при 80°С в течение ночи. Эту смесь концентрировали в вакууме и остаток растирали с эфиром с получением соединения, указанного в заголовке (3,37 г, 84,2%) в виде белого твердого вещества. 1H ЯМР (DMSO-d6),  (млн-1): 9.75 (w, 1H), 7.76 (d, 2H), 7.35 (d, 2H), 4.50 (w, 2H), 3.41 (s, 2H) и 2.13 (s, 6H). (млн-1): 9.75 (w, 1H), 7.76 (d, 2H), 7.35 (d, 2H), 4.50 (w, 2H), 3.41 (s, 2H) и 2.13 (s, 6H).
Пример 4
Гидразид 4-(2-диметиламино-этокси)-бензойной кислоты
Этил-4-(2-диметиламино-этокси)-бензоат (12,6 г, 53 ммоль) смешивали с гидридом гидразина (26,5 г, 0,5 моль) в этаноле при 100°С в герметично закрытой колбе в течение ночи. Эту смесь концентрировали и растирали с эфиром с получением соединения, указанного в заголовке (9,83 г, 82,9%) в виде бледно-желтого твердого вещества. 1H ЯМР (DMSO-d6),  (млн-1): 9.62 (s, 1H), 7.77 (d, 2H), 6.97 (d, 2H), 4.45 (b, 2H), 4.08 (t, 2H), 2.61 (t, 2H) и 2.20 (s, 6H). (млн-1): 9.62 (s, 1H), 7.77 (d, 2H), 6.97 (d, 2H), 4.45 (b, 2H), 4.08 (t, 2H), 2.61 (t, 2H) и 2.20 (s, 6H).
Пример 5
Гидразид 4-дифторметокси-бензойной кислоты
HOBt (2,2 г, 15,9 ммоль) и EDCl (3,1 г, 15,9 ммоль) добавляли к 4-дифторметокси-бензойной кислоте (2,5 г, 13,3 ммоль) в ацетонитриле (25 мл) при комнатной температуре. Через два часа добавляли по каплям раствор моногидрата гидразина (0,493 мл, 10,2 ммоль) и циклогексана (0,33 мл) в ацетонитриле (5,0 мл) при 0°С. После перемешивания при комнатной температуре в течение 2 часов растворитель удаляли в вакууме и остаток разбавляли этилацетатом, промывали насыщенным бикарбонатом натрия (4 раза), сушили над сульфатом натрия, фильтровали и концентрировали с получением соединения, указанного в заголовке (2,12 г, 79%, белое твердое вещество). 1H ЯМР (DMSO-d6),  (млн-1): 9.80 (bs, 1H), 7.88 (m, 2H), 7.34 (t, 1H), 7.23 (m, 2H), 4.50 (bs, 2H). (млн-1): 9.80 (bs, 1H), 7.88 (m, 2H), 7.34 (t, 1H), 7.23 (m, 2H), 4.50 (bs, 2H).
Пример 6
Бис-(3-хлор-фенил)-йодония тетрафторборат
Бис(ацетилокси)(3-хлорфенил)- -3-йодан получили, как описано в литературе [Kazmierczak, P.; Skulski, L, Synthesis 1998, 12, 1721-1723]. К перемешиваемой смеси 3-хлорфенилбороновой кислоты 0,821 г (5,25 ммоль) и BF3·Et2O (0,78 г, 5,5 ммоль) в дихлорметане (50 мл) при 0°С добавляли раствор бис(ацетилокси)(3-хлорфенил)- -3-йодан получили, как описано в литературе [Kazmierczak, P.; Skulski, L, Synthesis 1998, 12, 1721-1723]. К перемешиваемой смеси 3-хлорфенилбороновой кислоты 0,821 г (5,25 ммоль) и BF3·Et2O (0,78 г, 5,5 ммоль) в дихлорметане (50 мл) при 0°С добавляли раствор бис(ацетилокси)(3-хлорфенил)- -3-йодана (1,78 г, 5 ммоль) в дихлорметане (50 мл) в атмосфере аргона и эту реакционную смесь перемешивали в течение 1,5 часов при 0°С. Добавляли насыщенный водный NH4BF4 (10,5 г, 100 моль) и реакционную смесь перемешивали в течение часа, вливали в воду и экстрагировали дихлорметаном. Органический слой концентрировали с получением твердого остатка, который растирали с диэтиловым эфиром с получением соединения, указанного в заголовке (беловатое твердое вещество, 1,70 г, 78%). 1H ЯМР (CDCl3), -3-йодана (1,78 г, 5 ммоль) в дихлорметане (50 мл) в атмосфере аргона и эту реакционную смесь перемешивали в течение 1,5 часов при 0°С. Добавляли насыщенный водный NH4BF4 (10,5 г, 100 моль) и реакционную смесь перемешивали в течение часа, вливали в воду и экстрагировали дихлорметаном. Органический слой концентрировали с получением твердого остатка, который растирали с диэтиловым эфиром с получением соединения, указанного в заголовке (беловатое твердое вещество, 1,70 г, 78%). 1H ЯМР (CDCl3),  (млн-1): 8.02 (m, 4H), 7.58 (dm, 2H), 7.4 (t, 2H). (млн-1): 8.02 (m, 4H), 7.58 (dm, 2H), 7.4 (t, 2H).
Пример 7
2-Фенилциклопропанкарбоксилат меди(II)
Гидроксид натрия (0,81 г, 20,25 ммоль) в воде (10 мл) добавляли к 2-фенилциклопропанкарбоксилату (32,4 г, 20 ммоль) и смесь перемешивали до тех пор, пока твердое вещество полностью не растворилось. Добавляли по каплям сульфат меди(II) (2,44 г, 10 ммоль) в воде. Смесь перемешивали в течение 2 ч и голубой осадок собирали фильтрованием, сушили в вакууме и использовали без дальнейшей очистки.
Пример 8
трет-Бутиловый эфир 2-гидроксиметил-пиперидин-1-карбоновой кислоты
Ди-трет-бутилдикарбонат (8,3 г, 38,2 ммоль) добавляли к перемешиваемому раствору пиперидинметанола (4,0 г, 37,4 ммоль) в CH2Cl2 (50 мл) и добавляли 1 н. NaOH (50 мл, 50 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли CH2Cl2 и водную фазу отделяли. Водную фазу экстрагировали дихлорметаном (3×30 мл). Объединенную органическую фазу промывали водой (30 мл) и рассолом (30 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме с получением неочищенного продукта, который растирали с гексаном с получением соединения, указанного в заголовке, в виде белого твердого вещества (4,8 г, 64%).
Пример 9
4-трет-Бутиловый эфир морфолин-3,4-дикарбоновой кислоты
Ди-трет-бутилдикарбонат (3,33 г, 15,3 ммоль) добавляли к раствору морфолин-3-карбоновой кислоты (1,7 г, 10,2 ммоль), карбоната калия (7,04 г, 51 ммоль) в ацетоне (5 мл) и воде (10 мл) при 0°С. Полученную в результате смесь перемешивали при комнатной температуре в течение 24 ч, разбавляли водой (50 мл) и экстрагировали диэтиловым эфиром (2×50 мл). Водную фазу обрабатывали соляной кислотой (2М водная, 100 мл), экстрагировали дихлорметаном (2×50 мл). Объединенную органическую фазу промывали водой (50 мл), рассолом (50 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме с выделением желаемого продукта в виде белого твердого вещества (1,98 г, 84%). 1H ЯМР (CDCl3),  (млн-1): 4.46 (m, 2H), 3.80 (m, 3Н), 3.53 (m, 1H), 3.31 (m, 1H), 1.48 (d, 9H). (млн-1): 4.46 (m, 2H), 3.80 (m, 3Н), 3.53 (m, 1H), 3.31 (m, 1H), 1.48 (d, 9H).
Пример 10
4-трет-Бутиловый эфир 1-(9Н-флуорен-9-илметиловый)эфир пиперазин-1,2,4-трикарбоновой кислоты
Раствор 9-флуоренилметилхлорформиата (2,72 г, 10,5 ммоль) в 1,4-диоксане (19 мл) добавляли по каплям к раствору 1-трет-бутилового эфира пиперазин-1,3-дикарбоновой кислоты (2,20 г, 9,6 ммоль) и N,N-диизопропилэтиламина (4,2 мл, 23,9 ммоль) в воде (9,5 мл) в ледяной бане. После перемешивания в течение ночи при комнатной температуре реакционную смесь разбавляли водой и экстрагировали хлороформом (4 раза). Органический слой промывали насыщенным бикарбонатом натрия и водой, а затем 1 н. HCl и водой, сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением 4-трет-бутилового эфира 1-(9Н-флуорен-9-илметилового) эфира пиперазин-1,2,4-трикарбоновой кислоты (4,3 г).
Пример 11
трет-Бутиловый эфир 2-формил-пиперидин-1-карбоновой кислоты
ДМСО (7,14 мл, 98 ммоль) добавляли по каплям к перемешиваемому раствору оксалилхлорида (30 мл, 2М в CH2Cl2, 60 ммоль) в CH2Cl2 (60 мл) при -78°С. Через 5 минут добавляли раствор трет-бутилового эфира 2-гидроксиметил-пиперидин-1-карбоновой кислоты в CH2Cl2 (25 мл) и реакционную смесь перемешивали при -78°С в течение 0,5 часа, после чего добавляли Et3N (25 мл, 181 ммоль) и смесь оставляли медленно нагреваться до комнатной температуры при перемешивании. Затем смесь вливали в воду (100 мл) и органический слой отделяли. Затем органический экстракт промывали NaHCO3 (насыщенный). Водную фазу экстрагировали дихлорметаном (3×30 мл). Объединенную органическую фазу промывали водой (30 мл) и рассолом (30 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме. В результате хроматографии получили продукт, указанный в заголовке, в виде желтого масла (3,27 г, 73%).
Пример 12
4-трет-Бутиловый эфир 3-метиловый эфир морфолин-3,4-дикарбоновой кислоты
Йодметан (0,32 мл, 5,19 ммоль) добавляли к раствору 4-трет-бутилового эфира морфолин-3,4-дикарбоновой кислоты (1 г, 4,32 ммоль) и карбоната калия в ДМФ (15 мл). Полученную в результате смесь перемешивали при комнатной температуре в течение 4 ч, разбавляли диэтиловым эфиром (100 мл) и последовательно промывали водой (3×100 мл) и рассолом (100 мл). Органическую фазу сушили (сульфат натрия), фильтровали и концентрировали в вакууме с выделением желаемого соединения в виде прозрачного масла (0,99 г, 94%). 1H ЯМР (CDCl3),  (млн-1): 4.40 (m, 2Н), 3.75 (m, 6H), 3.39 (m, 2H), 1.46 (d, 9H). (млн-1): 4.40 (m, 2Н), 3.75 (m, 6H), 3.39 (m, 2H), 1.46 (d, 9H).
Пример 13
трет-Бутиловый эфир 3-формил-морфолин-4-карбоновой кислоты
Диизобутилалюмогидрид (1М в толуоле) добавляли по каплям к раствору 4-трет-бутилового эфира 3-метилового эфира морфолин-3,4-дикарбоновой кислоты (992 мг, 4,05 ммоль) в толуоле (10 мл) при -78°С и оставляли перемешиваться при -78°С в течение 1 ч. Реакционную смесь гасили медленным добавлением декагидрата сульфата натрия (0,6 г) при перемешивании при 80°С в течение 40 минут. Смесь фильтровали горячей через набивку целита, используя этилацетат. Фильтрат концентрировали в вакууме и в результате хроматографии (силикагель, 8% ацетон в гексанах) получили продукт, указанный в заголовке, в виде белого твердого вещества (539 мг, 62%). 1H ЯМР (CDCl3),  (млн-1): 9.68 (s, 1Н), 4.45 (m, 2H), 3.86 (m, 2H), 3.70 (dd, 1Н), 3.51 (m, 1Н), 3.23 (m, 1Н), 1.48 (m, 9H). (млн-1): 9.68 (s, 1Н), 4.45 (m, 2H), 3.86 (m, 2H), 3.70 (dd, 1Н), 3.51 (m, 1Н), 3.23 (m, 1Н), 1.48 (m, 9H).
Пример 14
а) трет-Бутиловый эфир 2-циано-пиперидин-1-карбоновой кислоты
1-трет-Бутиловый эфир пиперидин-1,2-дикарбоновой кислоты (12,8 г, 55,6 ммоль) и ТГФ (170 мл) добавляли в 500-мл круглодонную колбу, оборудованную магнитной мешалкой. Раствор охлаждали до -20°С и добавляли триэтиламин (10,1 мл, 72,3 ммоль), а затем этилхлорформиат (5,32 мл, 55,6 ммоль). Полученный в результате белый осадок оставляли перемешиваться при -10°С в течение 1 ч. В вышеуказанную реакционную смесь добавляли водный аммиак (22,6 мл, 1168 ммоль) и прозрачную реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали в вакууме и выделенный остаток растворяли в этилацетате (300 мл). Органическую фазу последовательно промывали водой (300 мл) и рассолом (200 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме с выделением прозрачной смолы. Эту смолу растирали с гексанами с выделением карбамата (9,4 г, 74%) в виде белого твердого вещества. 1Н ЯМР (CDCl3),  (млн-1): 6.03 (bs, 1Н), 5.55 (bs, 1Н), 4.77 (bs, 1H), 4.05 (bs, 1H), 2.81 (t, 1H), 2.27 (bs, 1H), 1.47 (m, 14H). (млн-1): 6.03 (bs, 1Н), 5.55 (bs, 1Н), 4.77 (bs, 1H), 4.05 (bs, 1H), 2.81 (t, 1H), 2.27 (bs, 1H), 1.47 (m, 14H).
Ацетонитрил (220 мл) и ДМФ (3,82 мл, 49,4 ммоль) добавляли в 500-мл круглодонную колбу, оборудованную магнитной мешалкой. Смесь охлаждали до -5°С и добавляли к ней оксалилхлорид (24,7 мл, 49,4 ммоль, 2 М дихлорметан). Полученную в результате смесь перемешивали в течение 15 мин. После этого добавляли раствор трет-бутилового эфира 2-карбамоил-пиперидин-1-карбоновой кислоты (9,4 г, 41,2 ммоль) в ацетонитриле (50 мл) и пиридине (8,3 мл, 103 ммоль). Реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи. Реакционную смесь концентрировали в вакууме и остаток растворяли в этилацетате (300 мл). Органическую фазу последовательно промывали водой (300 мл) и рассолом (200 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме с выделением соединения, указанного в заголовке (8,44 г, 97%) в виде желтого твердого вещества. 1H ЯМР (CDCl3),  (млн-1): 5.23 (bs, 1H), 4.03 (bs, 1H), 2.93 (t, 1H), 1.75 (m, 5H), 1.46 (m, 10Н). (млн-1): 5.23 (bs, 1H), 4.03 (bs, 1H), 2.93 (t, 1H), 1.75 (m, 5H), 1.46 (m, 10Н).
б) трет-Бутил-3-цианоморфолин-4-карбоксилат
Триэтиламин (1,808 мл, 12,97 ммоль) и этилхлорформиат (0,909 мл, 9,514 ммоль) добавляли к охлажденному (0°С) раствору 4-трет-бутилового эфира морфолин-3,4-дикарбоновой кислоты (2,00 г, 8,65 ммоль) в ТГФ (25 мл). Эту реакционную смесь нагревали до комнатной температуры и оставляли перемешиваться в течение 2 ч, затем охлаждали до 0°С и добавляли гидроксид аммония (4 мл). Полученную в результате смесь нагревали до комнатной температуры и перемешивали в течение еще 1 ч. Растворитель удаляли в вакууме и продукт экстрагировали из водной фазы дихлорметаном. Объединенные органические вещества сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением трет-бутилового эфира 3-карбамоил-морфолин-4-карбоновой кислоты (беловатое твердое вещество, 1,37 г, 69%). 1H ЯМР (300 МГц, CDCl3)  =1.51 (s, 9H); 3.19 (m, 1H); 3.52 (m, 2H); 3.88 (m, 2H); 4.50 (d, J=11.4, 1H); 5.81 (s широкий, 1H); 6.05 (s широкий, 1H). =1.51 (s, 9H); 3.19 (m, 1H); 3.52 (m, 2H); 3.88 (m, 2H); 4.50 (d, J=11.4, 1H); 5.81 (s широкий, 1H); 6.05 (s широкий, 1H).
Оксалилхлорид (3,87 мл 2М в ДХМ, 7,73 ммоль) добавляли к охлажденному (0°С) раствору диметилформамида (0,598 мл, 7,73 ммоль) в ацетонитриле (15 мл). Этот раствор перемешивали в течение 20 мин при 0°С. Раствор трет-бутилового эфира 3-карбамоил-морфолин-4-карбоновой кислоты (1,37 г, 5,95 ммоль) в ацетонитриле (6 мл) и пиридине (0,481 мл, 5,95 ммоль) добавляли к первому раствору. Эту смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 30 мин. Растворитель удаляли в вакууме и полученный в результате остаток растворяли в дихлорметане и промывали водой. Водную фазу повторно экстрагировали дихлорметаном. Объединенные органические вещества сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением соединения, указанного в заголовке (беловатые кристаллы, 1,24 г, 98%). 1H ЯМР (300 МГц, CDCl3)  =1.51 (s, 9H); 3.26 (m, 1H); 3.55 (td, J=11.8 Гц, 2.7 Гц, 1H); 3.41 (dd, J=11.8 Гц, 3.3 Гц, 1H); 3.83 (m, 1H), 3.98 (d, J=11.4 Гц, 1H); 4.08 (d, J=12 Гц, 1H); 5.32 (m, 1H). =1.51 (s, 9H); 3.26 (m, 1H); 3.55 (td, J=11.8 Гц, 2.7 Гц, 1H); 3.41 (dd, J=11.8 Гц, 3.3 Гц, 1H); 3.83 (m, 1H), 3.98 (d, J=11.4 Гц, 1H); 4.08 (d, J=12 Гц, 1H); 5.32 (m, 1H).
Пример 15
а) трет-Бутил-2-(2Н-тетразол-5-ил)пиперидин-1-карбоксилат
трет-Бутил-2-цианопиперидин-1-карбоксилат (2,10 г, 10 ммоль) смешивали с азидом натрия (0,715 г, 11 ммоль) и хлоридом аммония (0,588 г, 11 ммоль) в ДМФ (7,5 мл) и нагревали при 100°С в течение ночи. Реакционную смесь гасили водой и экстрагировали этилацетатом. Органический слой промывали водой три раза, а затем рассолом, сушили и концентрировали с получением соединения, указанного в заголовке (белое твердое вещество, 2,34 г, 92,5%). 1H ЯМР (CDCl3),  (млн-1): 5.7 (m, 1H), 4.02 (m, 1H), 2.93 (m, 1H), 2.35 (m, 1H), 2.07 (m, 1H), 1.74 (m, 3H), 1.49 (m+s, 11H). (млн-1): 5.7 (m, 1H), 4.02 (m, 1H), 2.93 (m, 1H), 2.35 (m, 1H), 2.07 (m, 1H), 1.74 (m, 3H), 1.49 (m+s, 11H).
Приведенное ниже соединение получили таким же способом:
б) трет-Бутил-3-(2Н-тетразол-5-ил)морфолин-4-карбоксилат
трет-Бутил-3-цианоморфолин-4-карбоксилат (2,74 г, 12,9 ммоль) смешивали с азидом натрия (0,923 г, 14,2 ммоль) и хлоридом аммония (0,759 г, 14,2 ммоль) в ДМФ (8 мл) и нагревали при 100°С в течение 6 ч и оставляли перемешиваться при комнатной температуре в течение ночи. Реакционную смесь гасили водой, подкисляли до рН 3 и экстрагировали этилацетатом. Органический слой промывали водой три раза, а затем рассолом, сушили и концентрировали с получением соединения, указанного в заголовке (белое твердое вещество, 2,64 г, 80,7%). 1Н ЯМР (CDCl3),  (млн-1): 5.5 (br s, 1H), 4.45 (d, 1H), 3.8-3.98 (m, 3Н), 3.62 (t, 1H), 3.3 (brs, 1H), 1.46 (s, 9H). (млн-1): 5.5 (br s, 1H), 4.45 (d, 1H), 3.8-3.98 (m, 3Н), 3.62 (t, 1H), 3.3 (brs, 1H), 1.46 (s, 9H).
Пример 16
трет-Бутиловый эфир 2-(гидроксиимино-метил)-пиперидин-1-карбоновой кислоты
трет-Бутиловый эфир 2-формил-пиперидин-1-карбоновой кислоты (1,0 г, 4,7 ммоль) в пиридине (1,3 мл) добавляли к раствору гидрохлорида гидроксиламина (407 мг, 5,9 ммоль) в пиридине (5,0 мл) при 0°С и смесь перемешивали при комнатной температуре в течение 12 ч. Смесь разбавляли водой (50 мл), экстрагировали дихлорметаном (3×25 мл). Объединенную органическую фазу промывали рассолом (50 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме с выделением желаемого соединения в виде светло-желтого масла (1,0 г).
Пример 17
трет-Бутиловый эфир 3-(гидроксиимино-метил)-морфолин-4-карбоновой кислоты
Раствор трет-бутилового эфира 3-формил-морфолин-4-карбоновой кислоты (539 мг, 2,50 ммоль) в пиридине (1,3 мл) добавляли к раствору гидрохлорида гидроксиламина (217 мг, 3,13 ммоль) в пиридине (2,5 мл) при 0°С. Смесь нагревали до комнатной температуры и перемешивали в течение 12 ч, разбавляли водой (50 мл) и экстрагировали дихлорметаном (3×25 мл). Объединенную органическую фазу промывали рассолом (50 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме с выделением желаемого соединения в виде светло-желтого масла (578 мг).
Пример 18
трет-Бутиловый эфир 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пиперидин-1-карбоновой кислоты
N-Хлорсукцинимид (643 мг, 4,82) в ДМФ (6 мл) добавляли к трет-бутиловому эфиру 2-(гидроксиимино-метил)-пиперидин-1-карбоновой кислоты (1,0 г, 4,38 ммоль) в диметилформамиде (10 мл) при 40°С. Эту смесь перемешивали при 40°С в течение 1,5 ч, охлаждали до комнатной температуры, разбавляли диэтиловым эфиром (75 мл) и последовательно промывали водой (3×100 мл) и рассолом (100 мл). Органическую фазу сушили (сульфат натрия), фильтровали и концентрировали в вакууме с получением промежуточного соединения в виде желтого масла.
Это промежуточное соединение в дихлорметане (5 мл) добавляли к 3-хлор-1-этинилбензолу (1,24 мл, 10 ммоль), триэтиламину (1,05 мл, 7,54 ммоль) и дихлорметану (5 мл) при 0°С и смесь перемешивали при комнатной температуре в течение 12 ч и концентрировали в вакууме. Остаток растворяли в этилацетате (75 мл) и последовательно промывали водой (3×50 мл) и рассолом (50 мл). Органическую фазу сушили (сульфат натрия), фильтровали и концентрировали в вакууме. В результате хроматографии (силикагель, 2% этилацетат в дихлорметане) получили соединение, указанное в заголовке, в виде желтого твердого вещества (236 мг). 1Н ЯМР (CDCl3),  (млн-1): 7.75 (dd, 1 Н), 7.64 (m, 1Н), 7.40 (m, 2Н), 6.37 (s, 1H), 5.48 (br, 1H), 4.08 (m, 1H), 2.83 (m, 1H), 2.35 (m, 1H), 2.00-1.53 (m, 5H), 1.52 (s, 9H). (млн-1): 7.75 (dd, 1 Н), 7.64 (m, 1Н), 7.40 (m, 2Н), 6.37 (s, 1H), 5.48 (br, 1H), 4.08 (m, 1H), 2.83 (m, 1H), 2.35 (m, 1H), 2.00-1.53 (m, 5H), 1.52 (s, 9H).
Пример 19
трет-Бутиловый эфир 3-[5-(3-хлор-фенил)-изоксазол-3-ил]-морфолин-4-карбоновой кислоты
Раствор N-хлорсукцинимида в диметилформамиде (6 мл) добавляли к раствору трет-бутилового эфира 3-(гидроксиимино-метил)-морфолин-4-карбоновой кислоты (578 мг, 2,51 ммоль) в диметилформамиде (10 мл) при 40°С и смесь перемешивали при 40°С в течение 1,5 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли диэтиловым эфиром (75 мл), последовательно промывали водой (3×100 мл) и рассолом (100 мл). Органическую фазу сушили (сульфат натрия), фильтровали и концентрировали в вакууме с выделением промежуточного соединения в виде прозрачного масла.
Это промежуточное соединение в дихлорметане (5 мл) добавляли к раствору 3-хлор-1-этинилбензола (1,24 мл, 10 ммоль), триэтиламина (1,05 мл, 7,54 ммоль) в дихлорметане (5 мл) при 0°С и смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь концентрировали в вакууме, растворяли в этилацетате (75 мл) и последовательно промывали водой (3×50 мл) и рассолом (50 мл). Органическую фазу сушили (сульфат натрия), фильтровали и концентрировали в вакууме. В результате хроматографии (силикагель, 2% этилацетат в дихлорметане) получили соединение, указанное в заголовке, в виде желтого твердого вещества (236 мг). 1H ЯМР (CDCl3),  (млн-1): 7.76 (bs, 1Н), 7.67 (m, 1H), 7.43 (m, 2H), 6.51 (s, 1H), 5.24 (m, 1H), 4.39 (d, 1H), 3.88 (m, 3Н), 3.60 (dt, 1H), 3.24 (m, 1H), 1.52 (s, 9H). (млн-1): 7.76 (bs, 1Н), 7.67 (m, 1H), 7.43 (m, 2H), 6.51 (s, 1H), 5.24 (m, 1H), 4.39 (d, 1H), 3.88 (m, 3Н), 3.60 (dt, 1H), 3.24 (m, 1H), 1.52 (s, 9H).
Пример 20
трет-Бутиловый эфир 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-морфолин-4-карбоновой кислоты
Изобутилхлорформиат (0,42 мл, 3,24 ммоль) добавляли к раствору 4-трет-бутилового эфира морфолин-3,4-дикарбоновой кислоты (500 мг, 2,16 ммоль) и триэтиламина (0,805 мл, 5,79 ммоль) в ТГФ (15 мл) при 0°С. Эту смесь нагревали до комнатной температуры в течение 2 часов. Добавляли 3-хлор-N-гидрокси-бензамидин (368 мг, 2,16 ммоль) и смесь перемешивали в течение ночи при комнатной температуре, затем охлаждали и разбавляли этилацетатом (350 мл). Органический слой промывали водой (2×30 мл) и рассолом (30 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. В результате хроматографии (силикагель, 30-40% этилацетат в гексанах) получили эфир (755 мг, 91%). 1H ЯМР (CDCl3),  (млн-1): 7.73 (s, 1H), 7.60 (d, 1H), 7.47 (d, 1H), 7.38 (dd, 1H), 5.25 (d, 2H), 4.4-4.8 (m, 2H), 4.1-3.2 (m, 5H), 1.50 (s, 9H). (млн-1): 7.73 (s, 1H), 7.60 (d, 1H), 7.47 (d, 1H), 7.38 (dd, 1H), 5.25 (d, 2H), 4.4-4.8 (m, 2H), 4.1-3.2 (m, 5H), 1.50 (s, 9H).
Раствор этого эфира в ДМФ нагревали при 127°С в течение 2 часов. Продукт экстрагировали в этилацетат (100 мл) и органический слой промывали водой (3×20 мл) и рассолом (20 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Соединение, указанное в заголовке (783 мг), получили с количественным выходом. 1H ЯМР (CDCl3),  (млн-1): 8.09 (s, 1H), 7.98 (d, 1H), 7.46 (m, 2H), 4.50 (s, 1H), 4.2-3.2 (m, 6H), 1.49 (s, 9H). (млн-1): 8.09 (s, 1H), 7.98 (d, 1H), 7.46 (m, 2H), 4.50 (s, 1H), 4.2-3.2 (m, 6H), 1.49 (s, 9H).
Пример 21
трет-Бутиловый эфир 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-пиперазин-1-карбоновой кислоты
4-трет-Бутиловый эфир 1-(9Н-флуорен-9-илметиловый) эфир пиперазин-1,2,4-трикарбоновой кислоты (4,3 г, 9,6 ммоль), 3-хлор-N-гидрокси-бензамидин (1,8 г, 10,5 ммоль), HOBt (1,4 г, 10,5 ммоль) и EDCl (2,0 г, 10,5 ммоль) в ДМФ (25 мл) перемешивали при комнатной температуре в течение ночи. Эту реакционную смесь разбавляли этилацетатом, промывали водой (3 раза), насыщенным бикарбонатом натрия и рассолом, сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток растворяли в ДМФ (20 мл), а затем нагревали при 135°С в течение 2 часов. После охлаждения реакционную смесь разбавляли этилацетатом, промывали водой (3 раза) и рассолом, сушили над безводным сульфатом натрия, фильтровали и концентрировали. В результате хроматографии (силикагель, гексаны – 1:1 гексаны: дихлорметан – 1:3:4 этилацетат: гексаны: дихлорметан – 3:1:4 этилацетат: гексаны: дихлорметан) получили соединение, указанное в заголовке (1,35 г, 39%). 1H ЯМР (CDCl3),  (млн-1): 8.12 (m, 1H), 8.00 (m, 1H), 7.47 (m, 2H), 4.21 (m. 2H), 3.81 (m, 1H), 3.25 (m, 2H), 2.81 (m, 2H), 2.38 (bs, 1H), 1.50 (bs, 9H). (млн-1): 8.12 (m, 1H), 8.00 (m, 1H), 7.47 (m, 2H), 4.21 (m. 2H), 3.81 (m, 1H), 3.25 (m, 2H), 2.81 (m, 2H), 2.38 (bs, 1H), 1.50 (bs, 9H).
Пример 22
а) трет-Бутил-2-[2-(3-хлорфенил)-2Н-тетразол-5-ил]пиперидин-1-карбоксилат
Смесь трет-бутил-2-(2Н-тетразол-5-ил)пиперидин-1-карбоксилата (253 мг, 1 ммоль), трет-бутилата натрия (96 мг, 1 ммоль), рацемического BINAP (24,9 мг, 0,04 ммоль), Pd2(dba)3 (10,4 мг, 0,01 ммоль), 2-фенилциклопропанкарбоксилата меди(II) (7,72 мг, 0,02 ммоль) и бис-(3-хлор-фенил)-йодония тетрафторбората (436,8 мг, 1 ммоль) кипятили с обратным холодильником в трет-бутаноле (20 мл) в атмосфере аргона в течение 2 часов. После удаления растворителя в вакууме в результате хроматографии (5% этилацетат в гексанах) получили соединение, указанное в заголовке (бледно-желтое липкое масло, 237,8 мг, 65,3%). 1H ЯМР (CDCl3),  (млн-1): 8.14 (d, 1H), 8.03 (dm, 1H), 7.46 (m, 2H), 5.75 (brs, 1H), 4.1 (m, 1H), 3.05 (m, 1H), 2.43 (d, 1 H), 1.99 (tm, 1 H), 1.7 (t, 2H), 1.53 (m+s, 11 H). (млн-1): 8.14 (d, 1H), 8.03 (dm, 1H), 7.46 (m, 2H), 5.75 (brs, 1H), 4.1 (m, 1H), 3.05 (m, 1H), 2.43 (d, 1 H), 1.99 (tm, 1 H), 1.7 (t, 2H), 1.53 (m+s, 11 H).
Приведенное ниже соединение получили таким же способом:
б) трет-Бутил-3-[2-(3-хлорфенил)-2Н-тетразол-5-ил]морфолин-4-карбоксилат
Смесь трет-бутил-3-(2Н-тетразол-5-ил)морфолин-4-карбоксилата (701 мг, 2,74 ммоль), трет-бутилата натрия (264 мг, 2,74 ммоль), рацемического BINAP (68,5 мг, 0,11 ммоль), Pd2(dba)3 (28,4 мг, 0,0274 ммоль), (1R,2R)-2-фенилциклопропанкарбоксилата меди(II) (21,2 мг, 0,059 ммоль) и бис-(3-хлор-фенил)-йодония тетрафторбората (1200 мг, 2,74 ммоль) кипятили с обратным холодильником в трет-бутаноле (40 мл) в атмосфере аргона в течение двух часов. После удаления растворителя в вакууме в результате хроматографии (5-20% этилацетат в гексанах) получили соединение, указанное в заголовке (бесцветное липкое масло, 840 мг, 83,7%). 1Н ЯМР (CDCl3),  (млн-1): 8.14 (s, 1H), 8.03 (dm, 1H), 7.48 (m, 2H), 5.40 (br s, 1H), 4.56 (d, 1H), 3.94 (dd, 1H), 3.90 (m, 2H), 3.62 (td, 1H), 3.47 (brs, 1H). (млн-1): 8.14 (s, 1H), 8.03 (dm, 1H), 7.48 (m, 2H), 5.40 (br s, 1H), 4.56 (d, 1H), 3.94 (dd, 1H), 3.90 (m, 2H), 3.62 (td, 1H), 3.47 (brs, 1H).
Пример 23
2-[5-(3-Хлор-фенил)-изоксазол-3-ил]-пиперидин
Трифторуксусную кислоту (5 мл) добавляли к трет-бутиловому эфиру 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пиперидин-1-карбоновой кислоты (500 мг, 1,38 ммоль) в дихлорметане (5 мл) и смесь перемешивали при комнатной температуре в течение 1 ч, концентрировали до сухого состояния и остаток растворяли в гидроксиде натрия (1 н. водный, 30 мл). Водную фазу экстрагировали дихлорметаном (3×30 мл). Объединенную органическую фазу промывали водой (30 мл) и рассолом (30 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме с получением соединения, указанного в заголовке, в виде светло-желтого масла (292 мг, 81%). 1Н ЯМР (CDCl3),  (млн-1): 7.75 (dd, 1H), 7.65 (m, 1H), 7.41 (m, 2H), 6.60 (s, 1H), 3.94 (dd, 1H), 3.17 (m, 1H), 2.83 (m, 1H), 2.35 (m, 1H), 2.00-1.53 (m, 6H). (млн-1): 7.75 (dd, 1H), 7.65 (m, 1H), 7.41 (m, 2H), 6.60 (s, 1H), 3.94 (dd, 1H), 3.17 (m, 1H), 2.83 (m, 1H), 2.35 (m, 1H), 2.00-1.53 (m, 6H).
Пример 24
3-[5-(3-Хлор-фенил)-изоксазол-3-ил]-морфолин
Трифторуксусную кислоту (2 мл) добавляли к трет-бутиловому эфиру 3-[5-(3-хлор-фенил)-изоксазол-3-ил]-морфолин-4-карбоновой кислоты (236 мг, 0,65 ммоль) в дихлорметане (2 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, концентрировали до сухого состояния и остаток растворяли в гидроксиде натрия (1 н. водный, 30 мл). Водную фазу экстрагировали дихлорметаном (3×30 мл). Объединенную органическую фазу промывали водой (30 мл) и рассолом (30 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме с получением соединения, указанного в заголовке, в виде светло-желтого масла (171 мг, 99%). 1H ЯМР (CDCl3),  (млн-1): 7.72 (s, 1Н), 7.62 (m, 1H), 7.37 (m, 2H), 6.59 (s, 1H), 4.18 (dd, 1H), 4.00 (dd, 1H), 3.87 (dt, 1H), 3.62 (m, 2H), 3.03 (m, 2H), 2.10 (bs, 1H). (млн-1): 7.72 (s, 1Н), 7.62 (m, 1H), 7.37 (m, 2H), 6.59 (s, 1H), 4.18 (dd, 1H), 4.00 (dd, 1H), 3.87 (dt, 1H), 3.62 (m, 2H), 3.03 (m, 2H), 2.10 (bs, 1H).
Пример 25
3-[3-(3-Хлор-фенил)-[1,2,4]оксадиазол-5-ил]-морфолин
Раствор трет-бутилового эфира 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-морфолин-4-карбоновой кислоты (783 мг, 2,19 ммоль) растворяли в минимальном количестве дихлорметана, а затем охлаждали до 0°С в ледяной бане. Добавляли раствор 1:1 трифторуксусная кислота: дихлорметан (10 мл), смесь перемешивали при 0°С в течение 15 минут и нагревали эту смесь до КТ в течение 45 минут. Добавляли холодную ледяную воду (20 мл) и смесь нейтрализовали насыщенным бикарбонатом натрия. Продукт экстрагировали в дихлорметан (2×25 мл) и промывали рассолом (2×25 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. В результате хроматографии (силикагель) получили соединение, указанное в заголовке (429 мг, 74%). 1H ЯМР (CDCl3),  (млн-1): 8.11 (s, 1H), 8.00 (d, 1H), 7.47 (m, 2H), 3.6-4.4 (m, 6H), 3.0-3.3 (m, 2H). (млн-1): 8.11 (s, 1H), 8.00 (d, 1H), 7.47 (m, 2H), 3.6-4.4 (m, 6H), 3.0-3.3 (m, 2H).
Пример 26
а) 2-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]-пиперидин
трет-Бутил-2-[2-(3-хлорфенил)-2Н-тетразол-5-ил]пиперидин-1-карбоксилат (237 мг, 0,651 ммоль) смешивали с трифторуксусной кислотой (0,85 мл) и дихлорметаном (0,85 мл) при 0°С 0,5 часа. Эту смесь вливали в насыщенный карбонат натрия и экстрагировали дихлорметаном. В результате хроматографии (20-100% этилацетат в гексанах) получили 2-[2-(3-хлорфенил)-2Н-тетразол-5-ил]-пиперидин (белое твердое вещество, 113 мг, 65,8%). 1H ЯМР (CDCl3),  (млн-1): 8.16 (s, 1H), 8.03 (dm, 1H), 7.46 (m, 2H), 4.17 (dm, 1H), 3.21 (dm, 1H), 2.84 (to, 1H), 2.18 (dm, 1H), 2.15 (m, 1H), 1.94 (m, 1H), 1.8 (m, 1H), 1.68 (m, 1H), 1.59 (m, 2H). (млн-1): 8.16 (s, 1H), 8.03 (dm, 1H), 7.46 (m, 2H), 4.17 (dm, 1H), 3.21 (dm, 1H), 2.84 (to, 1H), 2.18 (dm, 1H), 2.15 (m, 1H), 1.94 (m, 1H), 1.8 (m, 1H), 1.68 (m, 1H), 1.59 (m, 2H).
Приведенное ниже соединение получили таким же способом:
б) 3-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]-морфолин
трет-Бутил-3-[2-(3-хлорфенил)-2Н-тетразол-5-ил]морфолин-4-карбоксилат (840 мг, 2,296 ммоль) смешивали с трифторуксусной кислотой (6 мл) и дихлорметаном (6 мл) при 0°С 1,5 часа. Эту смесь вливали в насыщенный карбонат натрия и экстрагировали дихлорметаном, сушили и концентрировали с получением соединения, указанного в заголовке (бледно-желтое липкое масло, 550 мг, 90%). 1Н ЯМР (CDCl3),  (млн-1): 8.18 (s, 1H), 8.06 (dm, 1H), 7.52 (m, 2H), 4.45 (dd, 1H), 4.24 (dd, 1H), 3.92 (dt, 1H), 3.87 (dd, 1H), 3.72 (ddd, 1H), 3.14 (m,2H), 2.11 (brs, 1H). (млн-1): 8.18 (s, 1H), 8.06 (dm, 1H), 7.52 (m, 2H), 4.45 (dd, 1H), 4.24 (dd, 1H), 3.92 (dt, 1H), 3.87 (dd, 1H), 3.72 (ddd, 1H), 3.14 (m,2H), 2.11 (brs, 1H).
Пример 27
Метиламид 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пиперидин-1-карботиокислоты
Метилизотиоцианат (63 мг, 0,86 ммоль) добавляли к 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пиперидину (150 мг, 0,57 ммоль) в CH2Cl2 (4 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 12 ч. Эту смесь концентрировали в вакууме и выделенный остаток растирали с 50% диэтиловым эфиром в гексанах с выделением желаемого соединения в виде беловатого твердого вещества (количественно).
Пример 28
Метиламид 3-[5-(3-хлор-фенил)-изоксазол-3-ил]-морфолин-4-карботиокислоты
Метилизотиоцианат (46,2 мг, 0,63 ммоль) добавляли к 3-[5-(3-хлор-фенил)-изоксазол-3-ил]-морфолину (145 мг, 0,55 ммоль) в CHCl3 (4 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 12 ч. Эту смесь концентрировали в вакууме и выделенный остаток растирали с 50% диэтиловым эфиром в гексанах с выделением желаемого соединения в виде беловатого твердого вещества (181 мг, 97%). 1H ЯМР (CDCl3),  (млн-1): 7.78 (m, 1H), 7.67 (m, 1H), 7.45 (m, 2H), 6.75 (s, 1H), 6.28 (m, 1H), 5.80 (m, 1H), 4.57 (d, 1H), 4.29 (d, 1H), 4.09 (dd, 1H), 3.99 (dd, 1H), 3.75 (dt, 1H), 3.45 (dt, 1H), 3.23 (d, 3H). (млн-1): 7.78 (m, 1H), 7.67 (m, 1H), 7.45 (m, 2H), 6.75 (s, 1H), 6.28 (m, 1H), 5.80 (m, 1H), 4.57 (d, 1H), 4.29 (d, 1H), 4.09 (dd, 1H), 3.99 (dd, 1H), 3.75 (dt, 1H), 3.45 (dt, 1H), 3.23 (d, 3H).
Пример 29
Метиламид 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-морфолин-4-карботиокислоты
Метилизотиоцианат (161 мг, 2,2 ммоль) и Et3N (0,61 мг, 4,4 ммоль) добавляли к раствору 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-морфолину (294 мг, 1,1 ммоль) в CH2Cl2 (4 мл) и смесь перемешивали при комнатной температуре в течение 12 ч и концентрировали в вакууме. В результате хроматографии получили соединение, указанное в заголовке, в виде липкого масла (313 мг, 84%). 1H ЯМР (CDCl3), 6 (млн-1): 8.06 (d, 1H), 7.96 (dd, 1H), 7.48 (dd, 1H), 7.45 (t, 1H), 6.88 (dd, 1H), 6.01 (br, m, 1H), 4.57 (d, 1H), 3.99 (m, 2H), 3.80 (m, 2H), 3.67 (ddd, 1H), 3.26 (d, 3H).
Пример 30
трет-Бутиловый эфир 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-метилтиокарбамоил-пиперазин-1-карбоновой кислоты
Метилизотиоцианат (256 мг, 3,50 ммоль) добавляли к раствору трет-бутилового эфира 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-пиперазин-1-карбоновой кислоты (1,11 г, 3,04 ммоль) в хлороформе (17 мл) при комнатной температуре. После перемешивания в течение ночи смесь концентрировали и в результате хроматографии (силикагель, 1:3:4 этилацетат: гексаны: дихлорметан – 1,5:2,5:4 этилацетат: гексаны: дихлорметан) получили соединение, указанное в заголовке (796 мг, 60%). 1H ЯМР (CDCl3),  (млн-1): 8.05 (m, 1H), 7.95 (m, 1H), 7.45 (m, 2H), 6.01 (m, 1H), 4.68 (m, 1H), 4.22 (m, 1H), 3.80 (m, 2H), 3.51 (m, 1H), 3.25 (m, 3H), 3.07 (m, 1H), 1.30 (bs, 9H). (млн-1): 8.05 (m, 1H), 7.95 (m, 1H), 7.45 (m, 2H), 6.01 (m, 1H), 4.68 (m, 1H), 4.22 (m, 1H), 3.80 (m, 2H), 3.51 (m, 1H), 3.25 (m, 3H), 3.07 (m, 1H), 1.30 (bs, 9H).
Пример 31
Метиламид 2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-пиперидин-1-карботиокислоты
2-({2-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]пиперидин-1-ил}метил)пиридин (600 мг, 2,38 ммоль) смешивали с метилизотиоцианатом (250 мг, 3,41 ммоль) в хлороформе (10 мл) при комнатной температуре в течение ночи. Реакционную смесь концентрировали и растирали с эфиром с получением соединения, указанного в заголовке, в виде белого твердого вещества (676 мг, 88%). 1H ЯМР (CDCl3),  (млн-1): 8.13 (s, 1H), 8.03 (m, 1H), 7,51 (m, 2H), 6.93 (w, 1H), 6.06 (w, 1Н), 4.24 (m, 1H), 3.34 (m, 1H), 3.23 (d, 3H), 2.46 (m, 1H), 2.11 (m, 1H), 1.60-1.95 (m, 4H). (млн-1): 8.13 (s, 1H), 8.03 (m, 1H), 7,51 (m, 2H), 6.93 (w, 1H), 6.06 (w, 1Н), 4.24 (m, 1H), 3.34 (m, 1H), 3.23 (d, 3H), 2.46 (m, 1H), 2.11 (m, 1H), 1.60-1.95 (m, 4H).
Пример 32
Метиловый эфир 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-И-метил-пиперидин-1-карбоксиимидотиокислоты
Йодметан (50 мкл, 0,80 ммоль) добавляли к метиламиду 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пиперидин-1-карботиокислоты (181 мг, 0,54 ммоль) в метаноле (4 мл) и полученную в результате смесь перемешивали при 75°С в течение 3 ч. Смесь охлаждали до комнатной температуры, разбавляли насыщенным бикарбонатом натрия (водный, 30 мл), экстрагировали дихлорметаном (3×20 мл). Объединенную органическую фазу промывали рассолом (30 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме с получением соединения, указанного в заголовке, в виде желтого масла (0,19 г, 100%). 1H ЯМР (CDCl3),  (млн-1): 7.73 (dd, 1H), 7.64 (m, 1H), 7.38 (m, 2H), 6.60 (s, 1H), 5.37 (m, 1H), 4.25 (m, 1H), 3.95 (m, 2H), 3.67 (m, 2H), 3.32 (m, 1H), 3.25 (s, 3H), 2.36 (s, 3H). (млн-1): 7.73 (dd, 1H), 7.64 (m, 1H), 7.38 (m, 2H), 6.60 (s, 1H), 5.37 (m, 1H), 4.25 (m, 1H), 3.95 (m, 2H), 3.67 (m, 2H), 3.32 (m, 1H), 3.25 (s, 3H), 2.36 (s, 3H).
Пример 33
Метиловый эфир 3-[5-(3-хлор-фенил)-изоксазол-3-ил]-М-метил-морфолин-4-карбоксиимидотиокислоты
Йодметан (50 мкл, 0,80 ммоль) добавляли к метиламиду 3-[5-(3-хлор-фенил)-изоксазол-3-ил]-морфолин-4-карботиокислоты (181 мг, 0,54 ммоль) в метаноле (4 мл) и полученную в результате смесь перемешивали при 75°С в течение 3 ч. Смесь охлаждали до комнатной температуры, разбавляли насыщенным бикарбонатом натрия (водный, 30 мл), экстрагировали дихлорметаном (3×20 мл). Объединенную органическую фазу промывали рассолом (30 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме с получением соединения, указанного в заголовке, в виде желтого масла (0,19 г, 100%). 1H ЯМР (CDCl3),  (млн-1): 7.73 (dd, 1H), 7.64 (m, 1H), 7.38 (m, 2H), 6.60 (s, 1H), 5.37 (m, 1H), 4.25 (m, 1H), 3.95 (m, 2H), 3.67 (m, 2H), 3.32 (m, 1H), 3.25 (s, 3H), 2.36 (s, 3H). (млн-1): 7.73 (dd, 1H), 7.64 (m, 1H), 7.38 (m, 2H), 6.60 (s, 1H), 5.37 (m, 1H), 4.25 (m, 1H), 3.95 (m, 2H), 3.67 (m, 2H), 3.32 (m, 1H), 3.25 (s, 3H), 2.36 (s, 3H).
Пример 34
Метиловый эфир 3-[3-(3-хлор-фенил)-(1,2,4]оксадиазол-5-ил]-метилморфолин-4-карбоксиимидотиокислоты
Йодметан (212 мг, 1,5 ммоль) добавляли к раствору метиламида 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-морфолин-4-карботиокислоты (313 мг, 0,92 ммоль) в метаноле (10 мл) и эту смесь перемешивали при 75°С в течение 3 ч. Смесь охлаждали до комнатной температуры, разбавляли насыщенным бикарбонатом натрия (водный, 30 мл), экстрагировали дихлорметаном (3×20 мл). Объединенную органическую фазу промывали рассолом (30 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме с получением соединения, указанного в заголовке, в виде белого твердого вещества (248 мг, 76%). 1H ЯМР (CDCl3),  (млн-1): 8.08 (d, 1Н), 7.95 (dd, 1H), 7.47 (dd, 1H), 7.43 (t, 1H), 5.47 (dd, 1H), 4.36 (d, 1H), 3.40-4.00 (m, 5H), 3.21 (s, 3H), 2.36 (s, 3H). (млн-1): 8.08 (d, 1Н), 7.95 (dd, 1H), 7.47 (dd, 1H), 7.43 (t, 1H), 5.47 (dd, 1H), 4.36 (d, 1H), 3.40-4.00 (m, 5H), 3.21 (s, 3H), 2.36 (s, 3H).
Пример 35
трет-Бутиловый эфир 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(метилимино-метилсульфанил-метил)-пиперазин-1-карбоновой кислоты
трет-Бутиловый эфир 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-метилтиокарбамоил-пиперазин-1-карбоновой кислоты (796 мг, 1,82 ммоль) и йодметан (0,170 мл, 2,73 ммоль) в метаноле (11 мл) нагревали при 75°С в герметично закрытом флаконе в течение 2 часов. После охлаждения смесь концентрировали, а затем остаток растворяли в дихлорметане. Органический слой промывали насыщенным бикарбонатом натрия, сушили над безводным сульфатом натрия, фильтровали и концентрировали. В результате хроматографии (силикагель, 25% этилацетат в гексанах) получили соединение, указанное в заголовке (632 мг, 77%). 1Н ЯМР (CDCl3),  (млн-1): 8.08 (m, 1H), 7.97 (m, 1H), 7.44 (m, 2H), 5.51 (m, 1H), 4.49 (m, 1H), 4.01 (m, 2H), 3.49 (m, 2H), 3.20 (s, 3H), 3.15 (m, 1H), 2.37 (s, 3H), 1.38 (bs, 9H). (млн-1): 8.08 (m, 1H), 7.97 (m, 1H), 7.44 (m, 2H), 5.51 (m, 1H), 4.49 (m, 1H), 4.01 (m, 2H), 3.49 (m, 2H), 3.20 (s, 3H), 3.15 (m, 1H), 2.37 (s, 3H), 1.38 (bs, 9H).
Пример 36
Метиловый эфир 2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-N-метил-пиперидин-1-карбоксиимидотиокислоты
Метиламид 2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-пиперидин-1-карботиокислоты (676 мг, 2,0 ммоль) смешивали с йодметаном (0,4 мл) в метаноле (15 мл) в герметично закрытом флаконе при 80°С в течение 2 часов. Эту реакционную смесь концентрировали с помощью роторного испарителя. Остаток подщелачивали насыщенным бикарбонатом натрия и экстрагировали дихлорметаном. Органический слой сушили MgSO4 с получением соединения, указанного в заголовке, в виде липкого бледно-желтого масла (700 мг, 100%). 1H ЯМР (CDCl3),  (млн-1): 8.15 (s, 1Н), 8.04 (d, 1H), 7.48 (m, 2H), 5.75 (m, 1H), 3.22 (m, 1H), 3.22 (m, s, 4H), 2.04 (s, m, 4H), 2.10 (m, 1H), 1.69 (m, 4H). (млн-1): 8.15 (s, 1Н), 8.04 (d, 1H), 7.48 (m, 2H), 5.75 (m, 1H), 3.22 (m, 1H), 3.22 (m, s, 4H), 2.04 (s, m, 4H), 2.10 (m, 1H), 1.69 (m, 4H).
Пример 37
а) 4-(5-{2-[5-(3-Хлор-фенил)-изоксазол-3-ил]-пиперидин-1-ил}-4-метил-4Н-[1,2,4]триазол-3-ил)-пиридин
Гидразид изоникотиновой кислоты (42,3 мг, 0,31 ммоль) добавляли к метиловому эфиру 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-N-метил-1-пиперидин-1-карбоксиимидотиокислоты (90 мг, 0,26 ммоль) в этаноле (1,5 мл). Эту смесь перемешивали при 75°С в течение 12 ч, а затем разбавляли дихлорметаном (8 мл). Органическую фазу последовательно промывали водой (4×10 мл) и рассолом (10 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме. В результате хроматографии (силикагель, 10% метанол в этилацетате) получили желтое масло, которое растирали с 30% гексанами в диэтиловом эфире с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (50 мг). 1H ЯМР (CDCl3),  (млн-1): 8.72 (d, 2H), 7.69 (s, 1H), 7.59 (m, 3H), 7.36 (m, 2H), 6.54 (s, 1H), 4.79 (dd, 1H), 3.64 (s, 3Н), 3.28 (m, 2H), 2.20 (m, 2H), 1.90-1.73 (m, 4H). (млн-1): 8.72 (d, 2H), 7.69 (s, 1H), 7.59 (m, 3H), 7.36 (m, 2H), 6.54 (s, 1H), 4.79 (dd, 1H), 3.64 (s, 3Н), 3.28 (m, 2H), 2.20 (m, 2H), 1.90-1.73 (m, 4H).
Приведенные ниже соединения получили подобным способом:
б) 3-[5-(3-Хлор-фенил)-[1,2,4]оксадиазол-3-ил]-4-(5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-морфолин; выход 40,2 мг, 24%, желтый порошок; 1H ЯМР CDCl3 (300 МГц): 3.37 (m, 1H); 3.59 (m, 1H); 3.75 (s, 3Н); 3.97 (m, 1H); 4.08 (m, 2H); 4.32 (dd, J=11.7 Гц, 3.3 Гц, 1H); 5.00 (m, 1H); 7.45 (t, J=8 Гц), 7.56 (d, J=8 Гц, 1H); 7.62 (d, J=4.8 Гц, 2H); 7.94 (d, J=7.8 Гц, 1H); 8.04 (m, 1H); 8.75 (br. s, 2H).
Энантиомеры разделяли, используя колонку Chiralpak AD 4,6×250 мм, элюируя iPrOH/0,05% Et2NH при скорости потока 1 мл/мин с получением 12,5 мг энантиомера 1, Rt (время удерживания) 7,39 мин, и 12,7 мг энантиомера 2, Rt 12,57 мин.
в) 3-[5-(3-Хлор-фенил)изоксазол-3-ил]-4-(4-циклопропил-5-пиридин-3-ил-4Н-1,2,4-триазол-3-ил)-морфолин; выход 63,5 мг, 27%, беловатое твердое вещество; 1H ЯМР CDCl3 (300 МГц): 9.07 (s, 1H), 8.71 (d из t, 1H), 8.16 (d из t, 1H), 7.75 (d, 1H), 7.64 (m, 1H), 7.41 (m, 3Н), 6.83 (s, 1H), 5.18 (t, 1H), 4.25 (d, 2H), 4.12 (m, 1H), 3.99 (m, 1H), 3.72 (m, 1H), 3.49 (m, 1H), 3.38 (m, 1H), 1.30 (m, 1H), 1.14 (m, 2H), 0.60 (m, 1H).
Энантиомеры разделяли, используя колонку Chiralpak AD 4,6×250 мм, элюируя IPrOH при скорости потока 1 мл/мин, с получением энантиомера 1 в виде беловатого твердого вещества, 14,4 мг, Rt 5,9 мин, и энантиомера 2 в виде беловатого твердого вещества, 16,7 мг, Rt 23,7 мин.
г) 3-[5-(3-Хлор-фенил)изоксазол-3-ил]-4-(4-циклопропил-5-пиридин-4-ил-4Н-1,2,4-триазол-3-ил)морфолин; выход 103,4 мг, 43%, белое твердое вещество; 1H ЯМР CDCl3 (300 МГц): 8.75 (d, 2Н), 7.76 (m, 3H), 7.64 (m, 1H), 7.41 (m, 2Н), 6.83 (s, 1H), 5.19 (t, 1H), 4.25 (d, 2Н), 4.13 (m, 1H), 3.99 (t из d, 1H), 3.73 (t из d, 1H), 3.50 (m, 1H), 3.41 (m, 1H), 1.28 (m, 1H), 1.15 (m, 2Н), 0.62 (m, 1H).
д) 3-[5-(3-Хлор-фенил)изоксазол-3-ил]-4-(4-метил-5-пиридин-3-ил-4Н-1,2,4-триазол-3-ил)морфолин; выход 85,0 мг, 35%, белое твердое вещество;
1H ЯМР CDCl3 (300 МГц): 8.90 (d, 1H), 8.72 (m, 1H), 8.05 (d из t, 1H), 7.73 (m, 1H), 7.61 (m, 1H), 7.41 (m, 3H), 6.67 (s, 1H), 4.82 (m, 1H), 4.25 (d из d, 1H), 4.08 (m, 3H), 3.67 (s, 3H), 3.48 (m, 1H), 3.40 (m, 1H).
е) 3-[5-(3-Хлор-фенил)-изоксазол-3-ил]-4-[5-(6-метокси-пиридин-3-ил)-4-метил-4Н-[1,2,4]триазол-3-ил]морфолин; выход 73,2 мг, 29%, беловатое твердое вещество; 1H ЯМР CDCl3 (300 МГц): 8.40 (d, 1H), 7.88 (d из d, 1H), 7.69 (s, 1H), 7.59 (m, 1H), 7.38 (m, 2Н), 6.84 (d, 1H), 6.65 (s, 1H), 4.79 (m, 1H), 4.20 (d из d, 1H), 4.04 (m, 3H), 3.98 (s, 3H), 3.61 (s, 3H), 3.44 (m, 1H), 3.36 (m, 1H).
ж) 3-[3-(3-Хлор-фенил)-1,2,4-оксадиазол-5-ил]-4-[5-(2-метоксипиридин-4-ил)-4-метил-4Н-1,2,4-триазол-3-ил]морфолин; выход 26,6 мг, 5,8%, желтое масло; 1H ЯМР CDCl3 (300 МГц): 8.31 (d, 1H), 8.04 (t, 1H), 7.95 (dt, 1H), 7.44 (m, 2Н), 7.24 (d, 1H), 7.02 (s, 1H), 5.14 (dd, 1H), 4.38 (dd, 1H), 4.19 (dd, 1H), 4.05 (m, 2Н), 4.02 (s, 3H), 3.73 (s, 3H), 3.7 (m, 1H), 3.34 (m, 1H).
з) 3-[3-(3-Хлор-фенил)-1,2,4-оксадиазол-5-ил]-4-[5-(2-метилпиридин-4-ил)-4-метил-4Н-1,2,4-триазол-3-ил]морфолин; выход 42,3 мг, 9,6%, желтое масло; 1H ЯМР CDCl3 (300 МГц): 8.64 (br, 1H), 8.02 (t, 1H), 7.94 (dt, 1H), 7.44 (m, 4H), 5.14 (dd, 1H), 4.38 (dd, 1H), 4.19 (dd, 1H), 4.03 (m, 2Н), 3.74 (s, 3H), 3.7 (m, 1H), 3.38 (m, 1H), 2.66 (s, 3H).
и) 3-[3-(3-Хлор-фенил)-1,2,4-оксадиазол-5-ил]-4-[5-(5-фторпиридин-3-ил)-4-метил-4Н-1,2,4-триазол-3-ил]морфолин; выход 285 мг, 63,9%, желтое масло; 1H ЯМР CDCl3 (300 МГц): 8.72 (s, 1Н), 8.59 (d, 1H), 8.03 (t, 1H), 7.94 (dt, 1H), 7.82 (dq, 1H), 7.45 (m, 2H), 5.14 (dd, 1H), 4.38 (dd, 1H), 4.19 (dd, 1H), 4.05 (m, 2H), 3.75 (s, 3Н), 3.7 (m, 1H), 3.38 (m, 1H).
к) 3-[5-(3-Хлор-фенил)изоксазол-3-ил]-4-[5-(5-фторпиридин-3-ил)-4-метил-4Н-1,2,4-триазол-3-ил]морфолин; выход 40 мг, 38%, беловатое твердое вещество; 1H ЯМР CDCl3 (300 МГц): 8.73 (s, 1H), 8.59 (d, 1H), 7.83 (m, 1H), 7.73 (m, 1H), 7.62 (m, 1H), 7.41 (m, 2H), 6.68 (s, 1H), 4.83 (m, 1H), 4.25 (m, 1H), 4.08 (m, 3Н), 3.71 (s, 3Н), 3.45 (m, 2H).
л) 3-[3-(3-Хлор-фенил)-1,2,4-оксадиазол-5-ил]-4-(4-метил-5-пиридин-2-ил-4Н-1,2,4-триазол-3-ил)морфолин; выход 68 мг, 14,3%, желтое масло; 90% чистоты по ЯМР; 1H ЯМР CDCl3 (300 МГц): 8.64 (d, 1H), 8.22 (d, 1H), 8.01 (s, 1H), 7.93 (d, 1H), 7.78 (td, 1H), 7.28 (m, 3Н), 5.14 (dd, 1H), 4.38 (dd, 1H), 4.19 (dd, 1H), 4.03 (m, 2H), 4.02 (s, 3Н), 3.66 (m, 1H), 3.34 (m, 1H).
м) 4-[5-(5-Фторпиридин-3-ил)-4-метил-4Н-1,2,4-триазол-3-ил]-3-[3-(3-йодфенил)-1,2,4-оксадиазол-5-ил]морфолин; выход 103 мг, 36,2%, прозрачное масло; 1H ЯМР CDCl3 (300 МГц): 8.74 (s, 1H), 8.61 (d, 1H), 8.38 (t, 1H), 8.02 (dt, 1H), 7.84 (dq, 2H), 7.21 (t, 1H), 5.14 (dd, 1H), 4.38 (dd, 1H), 4.19 (dd, 1H), 4.03 (m, 2H), 3.75 (s, 3Н), 3.70 (m, 1H), 3.38 (m, 1H)
н) 3-[3-(3-Йодфенил)-1,2,4-оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н-1,2,4-триазол-3-ил)морфолин; выход 99,6 мг, 37,3%, прозрачное масло;
1H ЯМР CDCl3 (300 МГц): 8.78 (dd, 2H), 8.38 (t, 1H), 8.02 (dt, 1H), 7.84 (dt, 1H), 7.63 (dd, 2H), 7.21 (t, 1H), 5.14 (dd, 1H), 4.38 (dd, 1H), 4.18 (m, 1H), 4.03 (m, 2H), 3.76 (s, 3Н), 3.71 (m, 1H), 3.37 (m, 1H).
о) 3-[5-(3-Хлор-фенил)изоксазол-3-ил]-4-[5-(2-метилпиридин-4-ил)-4-метил-4Н-1,2,4-триазол-3-ил]морфолин; выход 5,6 мг, 5%, желтое масло; 1H ЯМР CDCl3 (300 МГц): 8.64 (d, 1H), 7.72 (m, 1H), 7.5 (m, 1H), 7.41 (m, 1H), 7.38 (m, 3Н), 6.66 (s, 1H), 4.81 (m, 1H), 4.24 (m, 1H), 4.09 (m, 3Н), 3.68 (s, 3Н), 3.52 (m, 2H), 2.63 (s, 3Н).
Пример 38
3-[5-(3-Хлор-фенил)-изоксазол-3-ил]-4-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)морфолин
Гидразид изоникотиновой кислоты (56,1 мг, 0,41 ммоль) добавляли к метиловому эфиру 3-[5-(3-хлор-фенил)-изоксазол-3-ил]-N-метил-морфолин-4-карбоксиимидотиокислоты (96 мг, 0,27 ммоль) в этаноле. Полученную в результате смесь оставляли перемешиваться при 75°С на 12 ч, а затем разбавляли дихлорметаном (8 мл). Органическую фазу последовательно промывали водой (4×10 мл) и рассолом (10 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме. В результате хроматографии (силикагель, 10% метанол в этилацетате) получили желтое масло, которое растирали с 30% гексанами в диэтиловом эфире с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (46 мг). 1H ЯМР (CDCl3),  (млн-1): 8.76 (d, 2H), 7.72 (dd, 1H), 7.62 (m, 3H), 7.42 (m, 2H), 6.67 (s, 1H), 4.82 (dd, 1H), 4.25 (dd, 1H), 4.07 (m, 3H), 3.71 (s, 3H), 3.45 (m, 2H). (млн-1): 8.76 (d, 2H), 7.72 (dd, 1H), 7.62 (m, 3H), 7.42 (m, 2H), 6.67 (s, 1H), 4.82 (dd, 1H), 4.25 (dd, 1H), 4.07 (m, 3H), 3.71 (s, 3H), 3.45 (m, 2H).
Энантиомеры разделяли, используя колонку Chiralpak AD 4,6×250 мм, элюируя IPrOH при скорости потока 1 мл/мин, с получением энантиомера 1 в виде белого твердого вещества, 9 мг, Rt 5,6 мин, и энантиомера 2 в виде белого твердого вещества, 9 мг, Rt 9,9 мин.
Пример 39
3-[5-(3-Хлор-фенил)-изоксазол-3-ил]-4-[5-(4-дифторметокси-фенил)-4-метил-4Н-[1,2,4]триазол-3-ил]-морфолин
Пиридин (30 мкл) и гидразид 4-дифторметокси-бензойной кислоты (57,9 мг, 0,29 ммоль) добавляли к раствору метилового эфира 3-[5-(3-хлор-фенил)-изоксазол-3-ил]-N-метил-морфолин-4-карбоксиимидотиокислоты (960 мг, 0,27 ммоль) в этаноле. Эту смесь перемешивали при 75°С в течение 48 ч, а затем разбавляли дихлорметаном (8 мл). Органическую фазу последовательно промывали водой (4×10 мл) и рассолом (10 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме. В результате хроматографии (силикагель, 10% дихлорметан в этилацетате) получили соединение, указанное в заголовке, в виде прозрачного масла (18 мг). 1H ЯМР (CDCl3),  (млн-1): 7.67 (m, 4Н), 7.39 (m, 2H), 7.23 (d, 2H), 6.66 (s, 1H), 6.58 (t, 1H), 4.80 (dd, 1H), 4.25 (dd, 1H), 4.07 (m, 3H), 3.61 (s, 3H), 3.40 (m, 2H). (млн-1): 7.67 (m, 4Н), 7.39 (m, 2H), 7.23 (d, 2H), 6.66 (s, 1H), 6.58 (t, 1H), 4.80 (dd, 1H), 4.25 (dd, 1H), 4.07 (m, 3H), 3.61 (s, 3H), 3.40 (m, 2H).
Пример 40
3-[3-(3-Хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-морфолин
Пиридин (30 мкл) и гидразид изоникотиновой кислоты (60 мг, 0,29 ммоль) добавляли к метиловому эфиру 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-метилморфолин-4-карбоксиимидотиокислоты (101 мг, 0,44 ммоль) в этаноле и эту смесь перемешивали при 75°С в течение 48 ч и смесь разбавляли дихлорметаном (8 мл). Органическую фазу последовательно промывали водой (4×10 мл) и рассолом (10 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме. В результате хроматографии (силикагель, 10% дихлорметан в этилацетате) получили соединение, указанное в заголовке, в виде прозрачного масла (40 мг, 33%). 1Н ЯМР (CDCl3) 6 (млн-1): 8.78 (d, 2H), 8.03 (d, 1Н), 7.92 (dd, 1H), 7.63 (d, 2H), 7.46 (dd, 1H), 7.40 (t, 1H), 5.14 (dd, 1H), 4.35 (d, 1H), 4.14 (m, 3H), 3.75 (s, 3H), 3.73 (m, 1H), 3.39 (m, 1H).
Пример 41
3-[3-(3-Хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-[5-(4-дифторметокси-фенил)-4-метил-4Н-[1,2,4]триазол-3-ил]-морфолин
Метиловый эфир 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-N-метил-морфолин-4-карбоксиимидотиокислоты (100 мг, 0,28 ммоль), гидразид 4-дифторметокси-бензойной кислоты (60,2 мг, 0,30 ммоль) и пиридин (4 капли) в этаноле (10 мл) нагревали при 75°С в течение 24 часов. После охлаждения реакционную смесь разбавляли этилацетатом, а затем промывали водой (5 раз) и рассолом, сушили над безводным сульфатом натрия, фильтровали и концентрировали. В результате хроматографии (силикагель, 1-2% метанол в дихлорметане) получили соединение, указанное в заголовке (99,5 мг, 73%). 1H ЯМР (CDCl3)  (млн-1): 8.03 (m, 1H), 7.93 (m, 1H), 7.67 (m, 2H), 7.46 (m, 1H), 7.42 (m, 1H), 7.25 (m, 2H), 6.59 (t, 1H), 5.13 (m, 1H), 4.37 (m, 1H), 4.16 (m, 1H), 4.01 (m, 2H), 3.66 (m, 1H), 3.67 (s, 3H), 3.36 (m, 1H). (млн-1): 8.03 (m, 1H), 7.93 (m, 1H), 7.67 (m, 2H), 7.46 (m, 1H), 7.42 (m, 1H), 7.25 (m, 2H), 6.59 (t, 1H), 5.13 (m, 1H), 4.37 (m, 1H), 4.16 (m, 1H), 4.01 (m, 2H), 3.66 (m, 1H), 3.67 (s, 3H), 3.36 (m, 1H).
Пример 42
трет-Бутиловый эфир 3-[3-(3-Хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-пиперазин-1-карбоновой кислоты
трет-Бутиловый эфир 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(метилимино-метилсульфанил-метил)-пиперазин-1-карбоновой кислоты (211,6 мг, 0,47 ммоль) и изоникотиновый гидразид (96,5 мг, 0,70 ммоль) в этаноле (6 мл) нагревали при 80°С в течение 24 часов. После охлаждения смесь разбавляли этилацетатом и промывали водой (5 раз) и рассолом, сушили над безводным сульфатом натрия, фильтровали и концентрировали. В результате хроматографии (силикагель, 0-5% 2 М метанольный аммиак в смеси 1:1 этилацетат:дихлорметан) получили соединение, указанное в заголовке (168,5 мг, 69%, бесцветное масло). 1H ЯМР (CDCl3)  (млн-1): 8.77 (m, 2H), 8.04 (s, 1H), 7.94 (m, 1H), 7.62 (m, 2H), 7.44 (m, 2H), 5.08 (m, 1H), 4.15 (m, 1H) 4.06 (m, 1H), 3.75 (m, 3Н), 3.73 (s, 3Н), 3.32 (m, 1H), 1.43 (bs, 9H). (млн-1): 8.77 (m, 2H), 8.04 (s, 1H), 7.94 (m, 1H), 7.62 (m, 2H), 7.44 (m, 2H), 5.08 (m, 1H), 4.15 (m, 1H) 4.06 (m, 1H), 3.75 (m, 3Н), 3.73 (s, 3Н), 3.32 (m, 1H), 1.43 (bs, 9H).
Пример 43
2-[3-(3-Хлор-фенил)-[1,2,4]оксадиазол-5-ил]-1-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-пиперазин
Трифторуксусную кислоту (1,5 мл) добавляли к раствору трет-бутилового эфира 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-пиперазин-1-карбоновой кислоты (164 мг, 0,31 ммоль) в дихлорметане (3 мл) при 0°С и перемешивали в течение 2,5 часов. После концентрирования смеси остаток разбавляли дихлорметаном, а затем промывали насыщенным бикарбонатом натрия, сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением соединения, указанного в заголовке (109 мг, 83%, белое пенообразное твердое вещество). 1H ЯМР (CDCl3)  (млн-1): 8.75 (m, 2H), 8.02 (m, 1H), 7.93 (m, 1H), 7.62 (m, 2H), 7.43 (m, 2H), 5.01 (m, 1H), 3.73 (s, 3Н), 3.62 (m, 2H), 3.40 (m, 1H), 3.22 (m, 3Н). (млн-1): 8.75 (m, 2H), 8.02 (m, 1H), 7.93 (m, 1H), 7.62 (m, 2H), 7.43 (m, 2H), 5.01 (m, 1H), 3.73 (s, 3Н), 3.62 (m, 2H), 3.40 (m, 1H), 3.22 (m, 3Н).
Пример 44
2-[3-(3-Хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-метил-1-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-пиперазин
Муравьиную кислоту (0,1 мл), формальдегид (37% масс/масс раствор в воде, 0,1 мл) и цианоборгидрид натрия (1,0 М в ТГФ, 0,1 мл) добавляли к раствору 2-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-1-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-пиперазина (50,3 мг, 0,12 ммоль) в метаноле (0,8 мл) при комнатной температуре. После перемешивания в течение 30 минут смесь разбавляли водой и экстрагировали хлороформом (4 раза), сушили над безводным сульфатом натрия, фильтровали и концентрировали. В результате хроматографии (силикагель, 1-5% 2 М метанольный аммиак в дихлорметане) получили соединение, указанное в заголовке (90%). 1H ЯМР (CDCl3)  (млн-1): 8.77 (m, 2H), 8.03 (m, 1H), 7.93 (m, 1H), 7.63 (m, 2H), 7.42 (m, 2H), 5.21 (m, 1H), 3.74 (s, 3Н), 3.70 (m, 1H), 3.43 (m, 1H), 3.09 (m, 2H), 2.70 (m, 2H), 2.41 (s, 3Н). (млн-1): 8.77 (m, 2H), 8.03 (m, 1H), 7.93 (m, 1H), 7.63 (m, 2H), 7.42 (m, 2H), 5.21 (m, 1H), 3.74 (s, 3Н), 3.70 (m, 1H), 3.43 (m, 1H), 3.09 (m, 2H), 2.70 (m, 2H), 2.41 (s, 3Н).
Пример 45
трет-Бутиловый эфир 3-[3-(3-Хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-[5-(4-дифторметокси-фенил)-4-метил-4Н-[1,2,4]триазол-3-ил]-пиперазин-1-карбоновой кислоты
трет-Бутиловый эфир 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(метилимино-метилсульфанил-метил)-пиперазин-1-карбоновой кислоты (211,3 мг, 0,47 ммоль), гидразид 4-дифторметокси-бензойной кислоты (99,2 мг, 0,49 ммоль) и пиридин (8 капель) в этаноле нагревали при 75°С в течение трех суток. После охлаждения реакционную смесь разбавляли этилацетатом, а затем промывали водой (5 раз) и рассолом, сушили над безводным сульфатом натрия, фильтровали и концентрировали. В результате хроматографии (силикагель, этилацетат:гексаны:дихлорметан 3:1:4 до 100% этилацетата) получили соединение, указанное в заголовке.
Пример 46
2-[3-(3-Хлор-фенил)-[1,2,4]оксадиазол-5-ил]-1-[5-(4-дифторметокси-фенил)-4-метил-4Н-[1,2,4]триазол-3-ил]-пиперазин
Трифторуксусную кислоту (1,5 мл) добавляли к раствору трет-бутилового эфира 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-[5-(4-дифторметокси-фенил)-4-метил-4Н-[1,2,4]триазол-3-ил]пиперазин-1-карбоновой кислоты при 0°С и перемешивали в течение 2,5 часов. После концентрирования смеси остаток разбавляли дихлорметаном, а затем промывали насыщенным бикарбонатом натрия, сушили над безводным сульфатом натрия, фильтровали и концентрировали. В результате хроматографии (силикагель, 3-4% 2 М метанольный аммиак в дихлорметане) получили соединение, указанное в заголовке (белое твердое вещество, выход 31% за две стадии). 1H ЯМР (CDCl3)  (млн-1); 8.05 (m, 1Н), 7.95 (m, 1H), 7.69 (m, 2H), 7.47 (m, 1H), 7.42 (m, 1H), 7.26 (m, 2H), 6.59 (t, 1H), 5.01 (m, 1H), 3.63 (m, 5H), 3.39 (m, 1H), 3.20 (m, 3H). (млн-1); 8.05 (m, 1Н), 7.95 (m, 1H), 7.69 (m, 2H), 7.47 (m, 1H), 7.42 (m, 1H), 7.26 (m, 2H), 6.59 (t, 1H), 5.01 (m, 1H), 3.63 (m, 5H), 3.39 (m, 1H), 3.20 (m, 3H).
Пример 47
2-[3-(3-Хлор-фенил)-[1,2,4]оксадиазол-5-ил]-1-[5-(4-дифторметокси-фенил)-4-метил-4Н-[1,2,4]триазол-3-ил]-4-метил-пиперазин
Муравьиную кислоту (0,1 мл), формальдегид (37% мас./мас. в воде, 0,1 мл) и цианоборгидрид натрия (1,0 М в ТГФ, 0,1 мл) добавляли к раствору 2-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-1-[5-(4-дифторметокси-фенил)-4-метил-4Н-[1,2,4]триазол-3-ил]-пиперазина (27,3 мг, 0,056 ммоль) в метаноле (0,8 мл) при комнатной температуре. После перемешивания в течение 30 минут смесь разбавляли водой и экстрагировали хлороформом (3 раза), сушили над безводным сульфатом натрия, фильтровали и концентрировали. В результате хроматографии (силикагель, 1-3% метанол в дихлорметане) получили соединение, указанное в заголовке (57%). 1H ЯМР (CDCl3)  (млн-1): 8.03 (m, 1Н), 7.93 (m, 1H), 7.68 (m, 2H), 7.46 (m, 1H), 7.42 (m, 1H), 7.25 (m, 2H), 6.59 (t, 1H), 5.20 (m, 1H), 3.68 (m, 1H), 3.66 (s, 3Н), 3.40 (m, 1H), 3.12 (m, 1H), 3.02 (m, 1H), 2.69 (m, 2H), 2.40 (s, 3H). (млн-1): 8.03 (m, 1Н), 7.93 (m, 1H), 7.68 (m, 2H), 7.46 (m, 1H), 7.42 (m, 1H), 7.25 (m, 2H), 6.59 (t, 1H), 5.20 (m, 1H), 3.68 (m, 1H), 3.66 (s, 3Н), 3.40 (m, 1H), 3.12 (m, 1H), 3.02 (m, 1H), 2.69 (m, 2H), 2.40 (s, 3H).
Пример 48
2-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]-1-{5-[4-(дифторметокси)фенил]-4-метил-4Н-1,2,4-триазол-3-ил}пиперидин
Метиловый эфир 2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-N-метил-пиперидин-1-карбоксиимидотиокислоты (70 мг, 0,2 ммоль) смешивали с гидразидом 4-дифторметокси-бензойной кислоты (40,4 мг, 0,2 ммоль) в этаноле при 80°С в течение ночи. Эту реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Дихлорметановый слой сушили и очищали хроматографией (этилацетат) с получением соединения, указанного в заголовке (37 мг, 38%). 1H ЯМР (CDCl3)  (млн-1): 8.09 (s, 1H), 7.99 (m, 1H), 7.66 (d, 2H), 7.46 (m, 2H), 7.24 (d, 2H), 6.58 (t, 1H), 5.10 (m, 1H), 3.66 (s, 3Н), 3.48 (m, 1H), 3.30 (m, 1H), 1.70-2.30 (m, 6H). (млн-1): 8.09 (s, 1H), 7.99 (m, 1H), 7.66 (d, 2H), 7.46 (m, 2H), 7.24 (d, 2H), 6.58 (t, 1H), 5.10 (m, 1H), 3.66 (s, 3Н), 3.48 (m, 1H), 3.30 (m, 1H), 1.70-2.30 (m, 6H).
Пример 49
4-(5-{2-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]пиперидин-1-ил}-4-метил-4Н-1,2,4-триазол-3-ил)пиридин
Метиловый эфир 2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-N-метил-пиперидин-1-карбоксиимидотиокислоты (70 мг, 0,2 ммоль) смешивали с гидразидом изоникотиновой кислоты (33,2 мг, 0,2 ммоль) в этаноле при 80°С в течение ночи. Эту реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Дихлорметановый слой сушили и очищали хроматографией (этилацетат) с получением соединения, указанного в заголовке (34 мг, 40,3%). 1H ЯМР (CDCl3)  (млн-1): 8.74 (d, 2H), 8.07 (s, 1H), 7.96 (m, 1H), 7.61 (d, 2H), 7.45 (m, 2H), 5.11 (m, 1H), 3.73 (s, 3Н), 3.48 (m, 1H), 3.30 (m, 1H), 1.70-2.30 (m, 6H). (млн-1): 8.74 (d, 2H), 8.07 (s, 1H), 7.96 (m, 1H), 7.61 (d, 2H), 7.45 (m, 2H), 5.11 (m, 1H), 3.73 (s, 3Н), 3.48 (m, 1H), 3.30 (m, 1H), 1.70-2.30 (m, 6H).
Пример 50
2-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]-1-[5-(4-метоксифенил)-4-метил-4Н-1,2,4-триазол-3-ил]пиперидин
Метиловый эфир 2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-N-метил-пиперидин-1-карбоксиимидотиокислоты (70 мг, 0,2 ммоль) смешивали с гидразидом 4-метокси-бензойной кислоты (33,2 мг, 0,2 ммоль) в этаноле при 80°С в течение ночи. Эту реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Дихлорметановый слой сушили и очищали хроматографией (этилацетат) с получением соединения, указанного в заголовке (20,2 мг, 22,4%). 1H ЯМР (CDCl3)  (млн-1): 8.09 (s, 1H), 7.98 (m, 1H), 7.57 (d, 2H), 7.45 (m, 2H), 7.99 (d, 2H), 5.10 (m, 1H), 3.86 (s, 3Н), 3.63 (s, 3Н), 3.48 (m, 1H), 3.29 (m, 1H), 1.70-2.30 (m, 6H). (млн-1): 8.09 (s, 1H), 7.98 (m, 1H), 7.57 (d, 2H), 7.45 (m, 2H), 7.99 (d, 2H), 5.10 (m, 1H), 3.86 (s, 3Н), 3.63 (s, 3Н), 3.48 (m, 1H), 3.29 (m, 1H), 1.70-2.30 (m, 6H).
Пример 51
[4-(5-{2-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]пиперидин-1-ил}-4-метил-4Н-1,2,4-триазол-3-ил)фенил]диметиламин
Метиловый эфир 2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-N-метил-пиперидин-1-карбоксиимидотиокислоты (70 мг, 0,2 ммоль) смешивали с гидразидом 4-метокси-бензойной кислоты (27,4 мг, 0,2 ммоль) в этаноле при 80°С в течение ночи. Эту реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Дихлорметановый слой сушили и очищали хроматографией (этилацетат) с получением соединения, указанного в заголовке (20,2 мг, 21,6%). 1H ЯМР (CDCl3)  (млн-1): 8.10 (s, 1H), 7.97 (m, 1H), 7.48 (m, 4H), 6.75 (d, 2H), 5.09 (m, 1H), 3.63 (s, 3Н), 3.48 (m, 1H), 3.29 (m, 1H), 3.02 (s, 3H), 1.70-2.30 (m, 6H). (млн-1): 8.10 (s, 1H), 7.97 (m, 1H), 7.48 (m, 4H), 6.75 (d, 2H), 5.09 (m, 1H), 3.63 (s, 3Н), 3.48 (m, 1H), 3.29 (m, 1H), 3.02 (s, 3H), 1.70-2.30 (m, 6H).
Энантиомеры разделяли, используя колонку Chiralpak AD 4,6×250 мм, элюируя iPrOH при скорости потока 2 мл/мин, с получением энантиомера 1 в виде белой пены, 2,6 мг, Rt 6,3 мин, и энантиомера 2 в виде белой пены, 2,6 мг, Rt7,1 мин.
Пример 52
[4-(5-{2-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]-пиперидин-1-ил}-4-метил-4Н-[1,2,4]триазол-3-ил)бензил]диметиламин
Метиловый эфир 2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-N-метил-пиперидин-1-карбоксиимидотиокислоты (49,9 мг, 0,1422 ммоль) смешивали с гидразидом 4-диметиламинометил-бензойной кислоты (30 мг, 0,156 ммоль) в этаноле (1,2 мл) при 100°С в течение ночи. Эту реакционную смесь разбавляли этилацетатом, промывали водой 3 раза, очищали хроматографией (2~3% 2 М метанольный аммиак в хлороформе) с получением соединения, указанного в заголовке (9,2 мг, 13,5%). 1H ЯМР (CDCl3)  (млн-1): 8.09 (s, 1Н), 7.98 (m, 1H), 7.60 (d, 2H), 7.45 (m, 4H), 5.11 (m, 1H), 3.66 (s, 3Н), 3.48 (s плюс m, 3Н), 3.30 (m, 1H), 2.28 (s, 6H), 1.60-2.20 (m, 6H). (млн-1): 8.09 (s, 1Н), 7.98 (m, 1H), 7.60 (d, 2H), 7.45 (m, 4H), 5.11 (m, 1H), 3.66 (s, 3Н), 3.48 (s плюс m, 3Н), 3.30 (m, 1H), 2.28 (s, 6H), 1.60-2.20 (m, 6H).
Пример 53
(2-[4-(5-{2-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]-пиперидин-1-ил}-4-метил-4Н-[1,2,4]триазол-3-ил)-фенокси]-этил}-диметиламин
Метиловый эфир 2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-N-метил-пиперидин-1-карбоксиимидотиокислоты (85 мг, 0,242 ммоль) смешивали с гидразидом 4-(2-диметиламино-этокси)-бензойной кислоты (75,7 мг, 0,339 ммоль) в этаноле (1,2 мл) при 100°С в течение ночи. Эту реакционную смесь разбавляли дихлорметаном, промывали водой (х3), очищали хроматографией (2~3% 2 М метанольный аммиак в хлороформе) с получением соединения, указанного в заголовке (32 мг, 26%). 1H ЯМР (CDCl3)  (млн-1): 8.09 (s, 1H), 7.97 (m, 1H), 7.56 (d, 2H), 7.44 (m, 2H), 7.01 (d, 2H), 5.09 (m, 1H), 4.11 (t, 2H), 3.62 (s, 3Н), 3.65 (m, 1H), 3.44 (m, 1H), 2.76 (t, 2H), 2.36 (s, 6H), 1.60-2.30 (m, 6H). (млн-1): 8.09 (s, 1H), 7.97 (m, 1H), 7.56 (d, 2H), 7.44 (m, 2H), 7.01 (d, 2H), 5.09 (m, 1H), 4.11 (t, 2H), 3.62 (s, 3Н), 3.65 (m, 1H), 3.44 (m, 1H), 2.76 (t, 2H), 2.36 (s, 6H), 1.60-2.30 (m, 6H).
Примеры 54а и 54б
(R)-3-[3-(3-Хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-морфолин и
(S)-3-[3-(3-Хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-морфолин
Два энантиомера выделили из рацемического 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-морфолина, используя хиральную колонку ВЭЖХ (Chiralpak AD) с гексаном/изопропанолом (20: 80); энантиомер 1 показал время удерживания 7,5 минут, тогда как энантиомер 2 показал время удерживания 8,7 минуты.
Примеры 55а и 55б
(R)-2-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]-1-{5-[4-(дифторметокси)фенил]-4-метил-4Н-[1,2,4]триазол-3-ил}пиперидин и
(S)-2-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]-1-{5-[4-(дифторметокси)фенил]-4-метил-4Н-[1,2,4]триазол-3-ил}пиперидин
2-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]-1-{5-[4-(дифторметокси)фенил]-4-метил-4Н-[1,2,4]триазол-3-ил}пиперидин разделяли с помощью Chiralpak AD (4,6×250), используя этанол:изопропанол (1:1) при скорости потока 1,0 мл/мин с получением двух энантиомеров 13,3 мг (Rt=14,2 мин) и 11,9 мг (Rt=18,7 мин).
Примеры 56а и 56б
(R)-4-(542-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]пиперидин-1-ил}-4-метил-4Н-[1,2,4]триазол-3-ил}пиридин и
(S)-4-(5-{2-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]пиперидин-1-ил}-4-метил-4Н-[1,2,4]триазол-3-ил}пиридин
Продукт разделяли с помощью Chiralpak AD (4,6×250), используя этанол: изопропанол (1:1) при скорости потока 1,0 мл/мин с получением двух энантиомеров 9,5 мг (Rt=11,6 мин) и 10,8 мг (Rt=16,8 мин).
Пример 57
5-Фторникотингидразид
Моногидрат гидразина 98% (4,9 мл, 101,1 ммоль) добавляли к раствору этил-5-фторникотината (1,71 г, 10,1 ммоль) в EtOH (35 мл) в атмосфере аргона. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение пяти часов. Реакционную смесь концентрировали и растирали с гексаном с получением соединения, указанного в заголовке (светло-желтое твердое вещество, 1,462 г, 93%). 1Н ЯМР CD3OD  (млн-1): 8.82 (s, 1H), 8.65 (m, 1Н), 8.01 (dm, 1H). (млн-1): 8.82 (s, 1H), 8.65 (m, 1Н), 8.01 (dm, 1H).
Пример 58
2-Метилизоникотингидразид
HOBt (950 мг, 6,99 ммоль) и EDCl (1,34 г, 6,99 ммоль) добавляли к суспензии 2-хлор-6-метилизоникотиновой кислоты (1 г, 5,83 ммоль) в ацетонитриле (15 мл) при комнатной температуре. Через 1 ч добавляли раствор моногидрата гидразина (0,56 мл, 11,66 ммоль) и циклогексена (0,15 мл, 1,5 ммоль) в ацетонитриле (5 мл) по каплям при 0°С. Эту смесь перемешивали в течение ночи и оставляли нагреваться до комнатной температуры. Растворитель удаляли в вакууме и остаток разбавляли этилацетатом, промывали насыщенным бикарбонатом натрия и рассолом, сушили над сульфатом натрия, фильтровали и концентрировали с получением 2-хлор-6-метилизоникотингидразида (желтое твердое вещество, 1,1 г, использовали без дальнейшей очистки). Баллон, заполненный водородом, присоединяли к колбе, содержащей 2-хлор-6-метилпиридин-4-карбоновую кислоту (1,12 г, 6,03 ммоль), палладий 10% мас./мас. на активированном углероде (0,56 г), триэтиламин (3,4 мл) и этанол (20 мл), а затем перемешивали в течение ночи при комнатной температуре. Реакционную смесь фильтровали через целит, промывали метанолом и концентрировали. Остаток растирали с дихлорметаном, а затем фильтровали с получением 2-метилизоникотингидразида (светло-желтое твердое вещество, сырой продукт использовали без дальнейшей очистки).
Пример 59
2-Метоксиизоникотингидразид
HOBt (1,73 г, 12,79 ммоль) и EDCl (2,45 г, 12,79 ммоль) добавляли к суспензии 2-хлор-6-метоксиизоникотиновой кислоты (2 г, 10,66 ммоль) в ацетонитриле (25 мл) при комнатной температуре. Через 1 ч добавляли раствор моногидрата гидразина (1,03 мл, 21,32 ммоль) и циклогексена (0,2 мл, 2,0 ммоль) в ацетонитриле (5 мл) по каплям при 0°С. Эту смесь перемешивали в течение ночи и оставляли нагреваться до комнатной температуры. Растворитель удаляли в вакууме и остаток разбавляли этилацетатом, промывали насыщенным бикарбонатом натрия и рассолом, сушили над сульфатом натрия, фильтровали и концентрировали с получением 2-хлор-6-метоксиизоникотингидразида (светло-желтое твердое вещество, 2,03 г, 95%). Баллон, заполненный водородом, присоединяли к колбе, содержащей 2-хлор-6-метилпиридин-4-карбоновую кислоту (1,83 г, 9,07 ммоль), палладий 10% мас./мас. на активированном углероде (0,91 г), триэтиламин (5,5 мл) и этанол (30 мл), а затем перемешивали в течение ночи при комнатной температуре. Реакционную смесь фильтровали через целит, промывали метанолом и концентрировали. Остаток растирали с дихлорметаном, а затем фильтровали с получением 2-метоксиизоникотингидразида (светло-желтое твердое вещество, сырой продукт использовали без дальнейшей очистки).
Пример 60
3-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]-N-метилморфолин-4-карботиоамид
К перемешиваемому раствору 3-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]морфолина (550 мг, 2,07 моль) в хлороформе (8 мл) добавляли метилизотиоцианат (227 мг, 3,1 ммоль). Этот раствор перемешивали при комнатной температуре в течение ночи, концентрировали и растирали с диэтиловым эфиром с получением соединения, указанного в заголовке, в виде белого твердого вещества (608 мг, 86,7%). 1H ЯМР (CDCl3)  (млн-1): 8.13 (s, 1Н), 8.03 (dm, 1H), 7.5 (m, 2H), 6.69 (m, 1H), 6.04 (m, 1H), 4.58 (d, 1H), 4.02 (m, 3Н), 3.74 (m, 2H), 3.24 (d, 3Н). (млн-1): 8.13 (s, 1Н), 8.03 (dm, 1H), 7.5 (m, 2H), 6.69 (m, 1H), 6.04 (m, 1H), 4.58 (d, 1H), 4.02 (m, 3Н), 3.74 (m, 2H), 3.24 (d, 3Н).
Пример 61
Метил-3-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-N-метилморфолин-4-карбимидотиоат
К раствору 3-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-N-метилморфолин-4-карботиоамида (608 мг, 1,79 ммоль) в метаноле (12 мл) добавляли CH3l (224 мкл, 3,59 ммоль). Этот раствор нагревали до флегмообразования в течение 1,5 ч, затем охлаждали до комнатной температуры и разбавляли дихлорметаном и промывали NaHCO3 (водн.). Водную фазу повторно экстрагировали дихлорметаном и объединенные органические вещества сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением соединения, указанного в заголовке, с количественным выходом. 1H ЯМР (300 МГц, CDCl3)  (млн-1): 8.15 (s, 1H), 8.04 (dm, 1H), 7.48 (m, 2H), 5.65 (t, 1H), 4.45 (dd, 1H), 4.03 (dd, 1H), 3.93 (dt, 1H), 3.79 (dm, 1H), 3.72 (td, 1H), 3.59 (tm, 1H), 3.25 (s, 3Н), 2.38 (s, 3Н). (млн-1): 8.15 (s, 1H), 8.04 (dm, 1H), 7.48 (m, 2H), 5.65 (t, 1H), 4.45 (dd, 1H), 4.03 (dd, 1H), 3.93 (dt, 1H), 3.79 (dm, 1H), 3.72 (td, 1H), 3.59 (tm, 1H), 3.25 (s, 3Н), 2.38 (s, 3Н).
Пример 62
трет-Бутиловый эфир 3-(N-гидроксикарбамимидоил)-морфолин-4-карбоновой кислоты
трет-Бутиловый эфир 3-циано-морфолин-4-карбоновой кислоты (600 мг, 2,83 ммоль) в метаноле (20 мл) добавляли к раствору гидрохлорида гидроксиламина (982 мг, 14,13 ммоль) и карбоната натрия (1,498 г, 14,19 ммоль) в деионизованной воде (20 мл). Полученный в результате раствор нагревали до флегмообразования в течение ночи, затем охлаждали до комнатной температуры и метанол удаляли в вакууме. Продукт экстрагировали два раза этилацетатом, затем третий раз после добавления хлорида натрия до насыщения водной фазы. Растворитель удаляли в вакууме с получением соединения, указанного в заголовке (липкого беловатого твердого вещества, 466,8 мг, 67%). 1H ЯМР (300 МГц, CDCl3)  (млн-1): 1.50 (s, 9H); 3.23 (td, J=11 Гц, 3 Гц, 1Н); 3.55 (m, 2H); 3.81 (m, 2H); 4.58 (s, широкий, 1Н); 4.92 (s, широкий, 1H). (млн-1): 1.50 (s, 9H); 3.23 (td, J=11 Гц, 3 Гц, 1Н); 3.55 (m, 2H); 3.81 (m, 2H); 4.58 (s, широкий, 1Н); 4.92 (s, широкий, 1H).
Пример 63
трет-Бутиловый эфир 3-[5-(3-хлор-фенил)-[1,2,4]оксадиазол-3-ил]-морфолин-4-карбоновой кислоты
К перемешиваемому раствору трет-бутилового эфира 3-(N-гидроксикарбамимидоил)-морфолин-4-карбоновой кислоты (300 мг, 1,22 ммоль), 3-хлор-бензойной кислоты (193,4 мг, 1,24 ммоль) и HOBt (181,8 мг, 1,35 ммоль) в диметилформамиде (4 мл) добавляли EDCl (236,8 мг, 1,24 ммоль). Этот раствор перемешивали в течение ночи при комнатной температуре, затем разбавляли дихлорметаном и промывали водой. Водную фазу повторно экстрагировали дихлорметаном и объединенные органические фазы сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Неочищенное промежуточное соединение фильтровали через силикагель, используя 10% метанол в дихлорметане, для удаления следов HOBt. Элюент концентрировали при пониженном давлении, затем растворяли в диметилформамиде (3 мл) и нагревали до 130°С в течение 90 мин. В результате удаления растворителя в вакууме получили соединение, указанное в заголовке (300 мг, 67%). 1H ЯМР (300 МГц, CDCl3)  (млн-1): 1.51 (s, 9H); 3.54 (m, 3H); 3.89 (m, 2H); 4.51 (m, 2H); 7.47 (m, 1Н); 7.58 (m, 1Н); 8.02 (m, 2H). (млн-1): 1.51 (s, 9H); 3.54 (m, 3H); 3.89 (m, 2H); 4.51 (m, 2H); 7.47 (m, 1Н); 7.58 (m, 1Н); 8.02 (m, 2H).
Пример 64
3-[5-(3-Хлор-фенил)-[1,2,4]оксадиазол-3-ил]-морфолин
Раствор трифторуксусной кислоты (4 мл) в дихлорметане (2 мл) добавляли к раствору трет-бутилового эфира 3-[5-(3-хлор-фенил)-[1,2,4]оксадиазол-3-ил]-морфолин-4-карбоновой кислоты (примерно 200 мг) в дихлорметане (2 мл). Полученный в результате раствор перемешивали при комнатной температуре в течение 30 мин, затем разбавляли дихлорметаном и небольшим объемом воды. Водную фазу нейтрализовали твердым бикарбонатом натрия, затем добавляли деионизованную воду и органическую фазу отделяли. Водную фазу повторно экстрагировали дихлорметаном и объединенные органические фазы сушили, фильтровали и концентрировали при пониженном давлении с получением соединения, указанного в заголовке (144,9 мг, количественно). 1Н ЯМР (300 МГц, CDCl3)  (млн-1): 3.10 (m, 2H); 3.72 (m, 1H); 3.85 (m, 2H); 4.18 (dd, J=11 Гц, 3 Гц, 1Н); 4.27 (dd, J=8 Гц, 3 Гц, 1Н); 7.49 (t, J=8 Гц, 1Н); 7.60 (m, 1Н); 8.04 (m, 2H). (млн-1): 3.10 (m, 2H); 3.72 (m, 1H); 3.85 (m, 2H); 4.18 (dd, J=11 Гц, 3 Гц, 1Н); 4.27 (dd, J=8 Гц, 3 Гц, 1Н); 7.49 (t, J=8 Гц, 1Н); 7.60 (m, 1Н); 8.04 (m, 2H).
Пример 65
Метиламид 3-[5-(3-хлор-фенил)-[1,2,4]оксадиазол-3-ил]-морфолин-4-карботиокислоты
К перемешиваемому раствору 3-[5-(3-хлор-фенил)-[1,2,4]оксадиазол-3-ил]-морфолина (184,8 мг, 0,696 моль) в хлороформе (5 мл) добавляли метилизотиоцианат (54,7 мкл, 0,800 ммоль). Этот раствор перемешивали при комнатной температуре в течение ночи, разбавляли дихлорметаном и промывали водой. Водную фазу повторно экстрагировали дихлорметаном и объединенные органические фазы сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт подвергали хроматографии в 60% этилацетате в гексанах с получением соединения, указанного в заголовке, в виде беловатых кристаллов. 1H ЯМР (300 МГц, CDCl3)  (млн-1): 3.06 (d, J=4.2 Гц, 3Н); 3.61 (квинтет из d, J=12 Гц, 3 Гц, 2H); 3.92 (m, 3Н); 4.51 (d, J=12 Гц, 1Н); 6.51 (s, широкий, 2H); 7.42 (t, J=7.5 Гц, 1Н); 7.51 (m, 1H); 7.92 (m, 1H); 8.01 (m, 1Н). (млн-1): 3.06 (d, J=4.2 Гц, 3Н); 3.61 (квинтет из d, J=12 Гц, 3 Гц, 2H); 3.92 (m, 3Н); 4.51 (d, J=12 Гц, 1Н); 6.51 (s, широкий, 2H); 7.42 (t, J=7.5 Гц, 1Н); 7.51 (m, 1H); 7.92 (m, 1H); 8.01 (m, 1Н).
Пример 66
Метиловый эфир 3-[5-(3-хлор-фенил)-[1,2,4]оксадиазол-3-ил]-N-метил-морфолин-4-карбоксиимидотиокислоты
К раствору метиламида 3-[5-(3-хлор-фенил)-[1,2,4]оксадиазол-3-ил]-морфолин-4-карботиокислоты (137,6 мг, 0,41 ммоль) в метаноле (3 мл) добавляли CH3l (50,6 мкл, 0,82 ммоль). Этот раствор нагревали до флегмообразования в течение 1,5 ч, затем охлаждали до комнатной температуры и разбавляли дихлорметаном и промывали NaHCO3 (водн.). Водную фазу повторно экстрагировали дихлорметаном и объединенные органические фазы сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением соединения, указанного в заголовке, с количественным выходом. 1H ЯМР (300 МГц, CDCl3)  (млн-1): 2.34 (s, 3Н); 3.24 (s, 3Н); 3.61 (квинтуплет из d, J=12 Гц, 3.3 Гц, 2H); 3.80 (d, J=12 Гц, 1Н); 3.91 (m, 2H); 4,40 (dd, J=12 Гц, 2 Гц, 1Н); 5.46 (s, широкий, 1Н); 7.43 (t, J=8.1 Гц, 1Н); 7.52 (m, 1Н); 7.96 (d, J=7.5 Гц, 1Н); 8.07 (m, 1Н). (млн-1): 2.34 (s, 3Н); 3.24 (s, 3Н); 3.61 (квинтуплет из d, J=12 Гц, 3.3 Гц, 2H); 3.80 (d, J=12 Гц, 1Н); 3.91 (m, 2H); 4,40 (dd, J=12 Гц, 2 Гц, 1Н); 5.46 (s, широкий, 1Н); 7.43 (t, J=8.1 Гц, 1Н); 7.52 (m, 1Н); 7.96 (d, J=7.5 Гц, 1Н); 8.07 (m, 1Н).
Пример 67
трет-Бутил-3-[3-(3-йодфенил)-1,2,4-оксадиазол-5-ил]морфолин-4-карбоксилат
Изобутилхлорформиат (1,56 мл, 12,0 ммоль) добавляли к раствору 4-трет-бутилового эфира морфолин-3,4-дикарбоновой кислоты (2,528 г, 10,9 ммоль) и триэтиламин (3,8 мл, 27,3 ммоль) в ТГФ (35 мл) при 0°С и эту смесь перемешивали в течение 2 часов. Добавляли 3-йод-N-гидрокси-бензамидин (2,86 г, 10,9 ммоль), смесь перемешивали в течение 1 ч при комнатной температуре и растворитель удаляли в вакууме. Ациклическое эфирное промежуточное соединение использовали без дальнейшей очистки. Добавляли ДМФ (25 мл) и смесь нагревали при 120°С в течение ночи. Продукт экстрагировали в этилацетат и органический слой промывали водой и рассолом, сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. В результате хроматографии (силикагель, 10-20% этилацетат в гексане) получили соединение, указанное в заголовке (легкое желтое масло, 3,0403 г, 61%), в виде смеси ротамеров по ЯМР. 1H ЯМР (CDCl3)  (млн-1): 8.44 (s, 1Н), 8.06 (d, 1Н), 7.85 (d, 1Н), 7.23 (t, 1Н), 5.41 (br s, 0.5H), 5.24 (brs, 0.5H), 4.52 (brs, 1Н), 3.9 (m, 3Н), 3.6 (t, 1Н), 3.49 (m, 1Н), 1.53 (s, 4.5H), 1.46 (s, 4.5H). (млн-1): 8.44 (s, 1Н), 8.06 (d, 1Н), 7.85 (d, 1Н), 7.23 (t, 1Н), 5.41 (br s, 0.5H), 5.24 (brs, 0.5H), 4.52 (brs, 1Н), 3.9 (m, 3Н), 3.6 (t, 1Н), 3.49 (m, 1Н), 1.53 (s, 4.5H), 1.46 (s, 4.5H).
Пример 68
3-[3-(3-Йодфенил)-1,2,4-оксадиазол-5-ил]морфолин
Раствор трифторуксусной кислоты (9,6 мл) в дихлорметане (25 мл) добавляли к раствору трет-бутил-3-[3-(3-йод-фенил)-1,2,4-оксадиазол-5-ил]морфолин-4-карбоксилата (3,04 г, 6,05 ммоль) в дихлорметане (30 мл) и эту смесь перемешивали при комнатной температуре в течение ночи и концентрировали до сухого состояния. Остаток растворяли в этилацетате и промывали гидроксидом натрия (1 н. водный, 15 мл). Органическую фазу промывали рассолом, сушили (сульфат натрия), фильтровали и концентрировали в вакууме. В результате хроматографии (силикагель, 5% 2 M метанольный аммиак в дихлорметане) получили соединение, указанное в заголовке (желтое масло, 2,1599 г, 91%). 1H ЯМР (CDCl3)  (млн-1): 8.48 (s, 1Н), 8.08 (d, 1H), 7.86 (d, 1H), 7.24 (t, 1H), 4.34 (m, 1H), 4.2 (d, 1H), 3.86-3.99 (m, 2H), 3.74 (t, 1H), 3.18 (d, 1H), 3.05 (t, 1H). (млн-1): 8.48 (s, 1Н), 8.08 (d, 1H), 7.86 (d, 1H), 7.24 (t, 1H), 4.34 (m, 1H), 4.2 (d, 1H), 3.86-3.99 (m, 2H), 3.74 (t, 1H), 3.18 (d, 1H), 3.05 (t, 1H).
Пример 69
3-[3-(3-Йодфенил)-1,2,4-оксадиазол-5-ил]-М-метилморфолин-4-карботиоамид
Метилизотиоцианат (575 мг, 7,86 ммоль) добавляли к 3-[3-(3-йодфенил)-1,2,4-оксадиазол-5-ил]морфолину (2,16 г, 6,05 ммоль) в CHCl3 (50 мл) и полученную в результате смесь перемешивали при 60°С в течение 7 ч и оставляли при комнатной температуре на выходные. Смесь концентрировали в вакууме и выделенный остаток растирали с диэтиловым эфиром в гексанах с выделением соединения, указанного в заголовке (желтое масло, 2,6 г, 100%). 1H ЯМР (CDCl3)  (млн-1): 8.38 (s, 1H), 8.02 (d, 1H), 7.83 (d, 1H), 7.2 (t, 1H), 6.86 (m, 1H), 6.18 (m, 1H), 4.56 (d, 1H), 3.99 (m, 2H), 3.78 (t, 2H), 3.63 (m, 1H), 3.03 (d, 3Н). (млн-1): 8.38 (s, 1H), 8.02 (d, 1H), 7.83 (d, 1H), 7.2 (t, 1H), 6.86 (m, 1H), 6.18 (m, 1H), 4.56 (d, 1H), 3.99 (m, 2H), 3.78 (t, 2H), 3.63 (m, 1H), 3.03 (d, 3Н).
Пример 70
Метил-3-[3-(3-йодфенил)-1,2,4-оксадиазол-5-ил]-N-метилморфолин-4-карбимидотиоат
Йодметан (0,11 мл, 1,74 ммоль) добавляли к 3-[3-(3-йодфенил)-1,2,4-оксадиазол-5-ил]-N-метилморфолин-4-карботиоамиду (465 мг, 1,08 ммоль) в метаноле (5 мл) и полученную в результате смесь перемешивали при 75°С в течение 4 ч. Смесь охлаждали до комнатной температуры, концентрировали в вакууме, разбавляли насыщенным бикарбонатом натрия (водным), экстрагировали дихлорметаном. Объединенную органическую фазу сушили (сульфат натрия), фильтровали и концентрировали в вакууме с получением соединения, указанного в заголовке, в виде желтого масла (460 мг, 96%). 1H ЯМР (CDCl3)  (млн-1): 7.44 (s, 1H), 8.05 (d, 1H), 7.84 (d, 1H), 7.22 (t, 1H), 5.46 (m, 1H), 4.36 (dm, 1H), 3.96 (m, 2H), 3.65-3.86 (m, 3Н), 3.22 (s, 3Н), 2.37 (s, 3Н). (млн-1): 7.44 (s, 1H), 8.05 (d, 1H), 7.84 (d, 1H), 7.22 (t, 1H), 5.46 (m, 1H), 4.36 (dm, 1H), 3.96 (m, 2H), 3.65-3.86 (m, 3Н), 3.22 (s, 3Н), 2.37 (s, 3Н).
Пример 71
трет-Бутиловый эфир 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пирролидин-1-карбоновой кислоты
Раствор трет-бутилового эфира 2-формил-пирролидин-1-карбоновой кислоты (4,2 г, 21,1 ммоль) (имеется в продаже от PharmaCore, Inc., 4180 Mendenhall Oaks Parkway, Suite 160. High Point, NC 27265, USA, или его синтезируют согласно методике Beak et. al. J. Org. Chem. 1993, 58, 1109) в безводном пиридине (8 мл) добавляли к охлажденному на льду раствору гидрохлорида гидроксиламина (1,90 г, 27,4 ммоль) в безводном пиридине (25 мл). Этот раствор перемешивали при комнатной температуре в течение ночи. Добавляли воду (500 мл) и раствор экстрагировали дихлорметаном (3×200 мл). Объединенные органические слои промывали рассолом, сушили (сульфат натрия), фильтровали и концентрировали в вакууме. Остаток растворяли в безводном ДМФ (50 мл) и нагревали до 40°С. Добавляли раствор N-хлорсукцинимида (3,10 г, 23,2 ммоль) в безводном ДМФ (30 мл) и реакционную смесь перемешивали при 40°С в течение 1,5 ч, а затем при комнатной температуре в течение ночи. Добавляли дополнительно 844 мг (6,3 ммоль) N-хлорсукцинимида и реакционную смесь перемешивали при 40°С в течение 1,5 ч. Реакционную смесь оставляли охлаждаться, разбавляли диэтиловым эфиром (500 мл) и промывали водой (3×300 мл), а затем рассолом (100 мл). Органический слой сушили (сульфат натрия), фильтровали и концентрировали в вакууме. Остаток растворяли в безводном дихлорметане (30 мл) и добавляли к охлажденному на льду раствору 1-хлор-3-этинил-бензола и триэтиламина в безводном дихлорметане (25 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре и растворитель удаляли в вакууме. Остаток растворяли в этилацетате (300 мл) и промывали водой (3×100 мл) и рассолом (100 мл). Органический слой сушили (сульфат натрия), фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией (гептан:этилацетат 8:1-4:1) с получением соединения, указанного в заголовке (3,48 г, 48%), в виде масла, которое затвердевало при стоянии. 1H ЯМР (400 МГц, CDCl3, ротамеры)  (млн-1): 1.10-1.69 (m, 9H); 1.71-2.44 (m, 4H); 3.34-3.68 (m, 2H); 4.90-5.10 (m, 1H); 6.40-6.55 (m, 1H); 7.37 (bs, 2H); 7.67 (m, 1H); 7.72 (bs, 1H). (млн-1): 1.10-1.69 (m, 9H); 1.71-2.44 (m, 4H); 3.34-3.68 (m, 2H); 4.90-5.10 (m, 1H); 6.40-6.55 (m, 1H); 7.37 (bs, 2H); 7.67 (m, 1H); 7.72 (bs, 1H).
Пример 72
5-(3-Хлор-фенил)-3-пирролидин-2-ил-изоксазол
трет-Бутиловый эфир 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пирролидин-1-карбоновой кислоты (3,45 г, 9,9 ммоль) растворяли в дихлорметане (15 мл) и добавляли трифторуксусную кислоту (15 мл). Этот раствор перемешивали при комнатной температуре в течение 1 ч, а затем концентрировали в вакууме.
Остаток растворяли в дихлорметане (200 мл) и промывали 1 М водным NaOH (200 мл). Водный слой экстрагировали дихлорметаном (2×100 мл) и объединенные органические слои промывали водой (100 мл) и рассолом (100 мл), сушили (сульфат натрия), фильтровали и концентрировали в вакууме с получением соединения, указанного в заголовке (2,12 г, 86%). 1Н ЯМР (400 МГц, CDCl3)  (млн-1): 1.88 (m, 3Н); 2.1 (s, 1Н); 3.62 (m, 1H); 3.12 (m, 1H); 4.32 (dd, 1H); 6.51 (s, 1H); 7.35 (m, 1H); 7.61 (m, 1H); 7.72 (s, 1H). (млн-1): 1.88 (m, 3Н); 2.1 (s, 1Н); 3.62 (m, 1H); 3.12 (m, 1H); 4.32 (dd, 1H); 6.51 (s, 1H); 7.35 (m, 1H); 7.61 (m, 1H); 7.72 (s, 1H).
Пример 73
Метиламид 2-[5-(3-хлор-фенил)изоксазол-3-ил]-пирролидин-1-карботиокислоты
Метилизотиоцианат (329 мг, 4,5 ммоль) добавляли к 5-(3-хлор-фенил)-3-пирролидин-2-ил-изоксазолу (746 мг, 3,0 ммоль) в безводном дихлорметане (20 мл) при комнатной температуре. Реакционную смесь перемешивали в течение ночи и концентрировали в вакууме. Остаток очищали флэш-хроматографией, используя градиент 20-80% этилацетата в гептане, с получением соединения, указанного в заголовке (580 мг, 60%). 1H ЯМР
(400 МГц, CDCl3)  (млн-1): 2.21 (m, 3Н); 2.37 (m, 1H); 3.11 (d, 3Н); 3.79 (m, 2H); 5.53 (bs, 1H); 6.57 (s, 1H); 7.39 (m, 1H), 7.68 (m, 1H); 7.73 (m, 1H). (млн-1): 2.21 (m, 3Н); 2.37 (m, 1H); 3.11 (d, 3Н); 3.79 (m, 2H); 5.53 (bs, 1H); 6.57 (s, 1H); 7.39 (m, 1H), 7.68 (m, 1H); 7.73 (m, 1H).
Пример 74
Циклопропиламид 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пирролидин-1-карботиокислоты
Циклопропилизотиоцианат (446 мг, 4,5 ммоль) добавляли к 5-(3-хлор-фенил)-3-пирролидин-2-ил-изоксазолу (746 мг, 3,0 ммоль) в безводном дихлорметане (20 мл) при комнатной температуре. Реакционную смесь перемешивали в течение ночи и концентрировали в вакууме. Остаток очищали флэш-хроматографией, используя градиент 20-80% этилацетата в гептане, с получением соединения, указанного в заголовке (585 мг, 56%). 1H ЯМР
(400 МГц, CDCl3)  (млн-1): 0.55 (m, 2H); 0.83 (m, 2H); 2.20 (m, 3Н); 2.39 (m, 1H); 3.03 (m, 1H); 3.80 (m, 2H); 5.45 (bs, 1H); 5.87 (bs, 1H); 6.65 (bs, 1H); 7.40 (m, 2H); 7.64 (m, 1H); 7.75 (bs, 1H). (млн-1): 0.55 (m, 2H); 0.83 (m, 2H); 2.20 (m, 3Н); 2.39 (m, 1H); 3.03 (m, 1H); 3.80 (m, 2H); 5.45 (bs, 1H); 5.87 (bs, 1H); 6.65 (bs, 1H); 7.40 (m, 2H); 7.64 (m, 1H); 7.75 (bs, 1H).
Пример 75
Метиловый эфир 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-N-метил-пирролидин-1-карбоксиимидотиокислоты
Суспензию метиламида 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пирролидин-1-карботиокислоты (520 мг, 1,61 ммоль) и метилиодида (344 мг, 2,42 ммоль) в безводном метаноле (10 мл) нагревали с помощью одноузлового микроволнового облучения в герметично закрытом сосуде при 110°С в течение 15 мин. После охлаждения полученный в результате раствор разбавляли насыщенным водным бикарбонатом натрия (50 мл) и экстрагировали дихлорметаном (3×70 мл). Объединенные органические слои промывали рассолом, сушили (сульфат натрия), фильтровали и концентрировали в вакууме с получением соединения, указанного в заголовке, в виде масла (533 мг, 98%). 1H ЯМР (400 МГц, CDCl3)  (млн-1): 2.00 (m, 3H); 2.12 (m, 1H); 2.26 (s, 3Н); 3.23 (s, 3H); 3.63 (m, 1H); 3.71 (m, 1H); 5.39 (m, 1H); 6.39 (s, 1H); 7.37 (m, 2H); 7.63 (m, 1H); 7.72 (bs, 1H). (млн-1): 2.00 (m, 3H); 2.12 (m, 1H); 2.26 (s, 3Н); 3.23 (s, 3H); 3.63 (m, 1H); 3.71 (m, 1H); 5.39 (m, 1H); 6.39 (s, 1H); 7.37 (m, 2H); 7.63 (m, 1H); 7.72 (bs, 1H).
Пример 76
а) Метиловый эфир 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-N-циклопропил-пирролидин-1-карбоксиимидотиокислоты
Суспензию циклопропиламида 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пирролидин-1-карботиокислоты (546 мг, 1,57 ммоль) и метилиодида (335 мг, 2,36 ммоль) в безводном метаноле (10 мл) нагревали с помощью одноузлового микроволнового облучения в герметично закрытом сосуде при 75°С в течение 2 ч. После охлаждения полученный в результате раствор разбавляли насыщенным водным бикарбонатом натрия (40 мл) и экстрагировали дихлорметаном (3×50 мл). Объединенные органические слои промывали рассолом, сушили (сульфат натрия), фильтровали и концентрировали в вакууме с получением соединения, указанного в заголовке, в виде масла (563 мг, 99%). 1H ЯМР (400 МГц, CDCl3)  (млн-1): 0.51 (m, 1H); 0.60 (m, 1H); 0.69 (m, 2H); 1.96 (m, 2H); 2.12 (m, 1H); 2.29 (m, 1H); 2.33 (m, 3Н); 3.10 (m, 1H); 3.59 (m, 1H); 3.66 (m, 1H); 5.28 (m, 1H); 6.37 (s, 1H); 7.35 (m, 2H); 7.61 (m, 1H); 7.70 (bs, 1H). (млн-1): 0.51 (m, 1H); 0.60 (m, 1H); 0.69 (m, 2H); 1.96 (m, 2H); 2.12 (m, 1H); 2.29 (m, 1H); 2.33 (m, 3Н); 3.10 (m, 1H); 3.59 (m, 1H); 3.66 (m, 1H); 5.28 (m, 1H); 6.37 (s, 1H); 7.35 (m, 2H); 7.61 (m, 1H); 7.70 (bs, 1H).
Приведенные ниже соединения были получены подобным способом:
б) 4-[5-(5-{2-[5-(3-Хлор-фенил)-изоксазол-3-ил]-пирролидин-1-ил}-4-циклопропил-4Н-[1,2,4]триазол-3-ил)-пиридин-2-ил]-морфолин; выход 24 мг, 23%, беловатое твердое вещество; 1H ЯМР CDCl3 (500 МГц): 8.54 (d, 1H), 7.92 (dd, 1H), 7.70 (s, 1H). 7.59 (m, 1H), 7.38 (m, 2H), 6.67 (d, 1H), 6.50 (s, 1H), 5.54 (dd, 1H), 4.06 (ddd, 1H), 3.83 (m, 4H), 3.61 (m, 1H), 3.58 (m, 4H), 3.21 (m, 1H), 2.54 (m, 1H), 2.29 (m, 1H), 2.21 (m, 1H), 2.14 (m, 1H), 1.11 (m, 2H), 0.99 (m, 1H), 0.52 (m, 1H).
в) 4-[5-(5-{2-[5-(3-Хлор-фенил)-изоксазол-3-ил]-пирролидин-1-ил}-4-метил-4Н-[1,2,4]триазол-3-ил)-пиридин-2-ил]-морфолин; выход 41 мг, 34%, светло-желтое твердое вещество; 1H ЯМР CDCl3 (500 МГц): 8.38 (d, 1H), 7.81 (dd, 1H), 7.72 (s, 1H), 7.61 (m, 1H), 7.37 (m, 2H), 6.70 (d, 1H), 6.59 (s, 1H), 5.41 (t, 1H), 3.87 (m, 1H), 3.83 (m, 4H), 3.59 (m, 4H), 3.52 (m, 4H), 2.55 (m, 1H), 2.30 (m, 1H), 2.19 (m, 2H).
г) 3-(5-{2-[5-(3-Хлор-фенил)-изоксазол-3-ил]-пирролидин-1-ил}-4-метил-4Н-[1,2,4]триазол-3-ил)-пиридин; выход 72 мг, 64%, беловатое твердое вещество; 1H ЯМР CDCl3 (500 МГц): 8.84 (d, 1H), 8.68 (dd, 1H), 8.01 (dt, 1H), 7.71 (m, 1H), 7.61 (m, 1H), 7.42 (dd, 1H), 7.37 (m, 2H), 6.54 (s, 1H), 5.42 (dd, 1H), 3.90 (dt, 1H), 3.57 (s, 3H), 3.54 (ddd, 1H), 2.56 (dddd, 1H), 2.24 (m, 3Н).
д) 4-(5-{2-[5-(3-Хлор-фенил)-изоксазол-3-ил]-пирролидин-1-ил}-4-циклопропил-4Н-[1,2,4]триазол-3-ил)-пиридин; выход 75 мг, 68%, беловатое твердое вещество; 1H ЯМР CDCl3 (500 МГц): 8.69 (dd, 2H), 7.70 (m, 3H), 7.59 (m, 1H), 7.36 (m, 2H), 6.52 (s, 1H), 5.58 (dd, 1H), 4.11 (dt, 1H), 3.66 (m, 1H), 3.32 (m, 1H), 2.57 (m, 1H), 2.26 (m, 3Н), 2.16 (m, 1H), 1.15 (m, 2H), 1.00 (m, 1H), 0.47 (m, 1H).
Пример 77
4-(5-{2-[5-(3-Хлор-фенил)-изоксазол-3-ил]-пирролидин-1-ил}-4-метил-4Н-1,2,4-триазол-3-ил)-пиридин
Суспензию метилового эфира 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-N-метил-пирролидин-1-карбоксиимидотиокислоты (61 мг, 0,18 ммоль), гидразида изоникотиновой кислоты (43,2 мг, 0,32 ммоль) и пиридина (18 мг, 0,23 ммоль) в этаноле (3 мл) нагревали с помощью одноузлового микроволнового облучения в герметично закрытом сосуде при 130°С. После охлаждения растворитель выпаривали и остаток очищали препаративной ВЭЖХ с обращенной фазой, используя линейный градиент ацетонитрила в 0,15% водной трифторуксусной кислоте. В результате второй очистки препаративной ВЭЖХ с обращенной фазой, используя линейный градиент ацетонитрила в 0,1 М водном ацетате аммония, получили соединение, указанное в заголовке (18,5 мг, 25%), в виде белого твердого вещества после лиофилизации. 1H ЯМР CDCl3 (500 МГц)  (млн-1): 8.71 (d, 2H), 7.69 (s, 1H), 7.58 (m, 3H), 7.36 (m, 2H), 6.53 (s, 1H), 5.42 (dd, 1H), 3.91 (dt, 1H), 3.60 (s, 3H), 3.54 (ddd, 1H), 2.56 (m, 1H), 2.23 (m, 3H). (млн-1): 8.71 (d, 2H), 7.69 (s, 1H), 7.58 (m, 3H), 7.36 (m, 2H), 6.53 (s, 1H), 5.42 (dd, 1H), 3.91 (dt, 1H), 3.60 (s, 3H), 3.54 (ddd, 1H), 2.56 (m, 1H), 2.23 (m, 3H).
Пример 78
3-(5-{2-[5-(3-Хлор-фенил)изоксазол-3-ил]пирролидин-1-ил}-4-циклопропил-4Н-1,2,4-триазол-3-ил)пиридин
Суспензию метилового эфира 2-[5-(3-хлор-фенил)-изоксазол-3-ил]-N-циклопропил-пирролидин-1-карбоксиимидотиокислоты (76 мг, 0,21 ммоль), гидразида никотиновой кислоты (43,2 мг, 0,32 ммоль) и пиридина (18 мг, 0,23 ммоль) в 2,5 мл 2-пропанола нагревали с помощью одноузлового микроволнового облучения в герметично закрытом сосуде при 150°С. После охлаждения растворитель выпаривали и остаток очищали препаративной ВЭЖХ с обращенной фазой, используя линейный градиент ацетонитрила в 0,1 М водном ацетате аммония, с получением соединения, указанного в заголовке (50,3 мг, 55%), в виде беловатого твердого вещества после лиофилизации. 1H ЯМР CDCl3 (500 МГц)  (млн-1): 9.00 (d, 1H), 8.65 (dd, 1H), 8.13 (dt, 1H), 7.71 (m, 1H), 7.60 (m, 1H), 7.38 (m, 3H), 6.53 (s, 1H), 5.58 (dd, 1H), 4.11 (dt, 1H), 3.65 (ddd, 1H), 3.31 (m, 1H), 2.56 (m, 1H), 2.26 (m, 2H), 2.16 (m, 1H), 1.14 (m, 2H), 0.98 (m, 1H), 0.44 (m, 1H). (млн-1): 9.00 (d, 1H), 8.65 (dd, 1H), 8.13 (dt, 1H), 7.71 (m, 1H), 7.60 (m, 1H), 7.38 (m, 3H), 6.53 (s, 1H), 5.58 (dd, 1H), 4.11 (dt, 1H), 3.65 (ddd, 1H), 3.31 (m, 1H), 2.56 (m, 1H), 2.26 (m, 2H), 2.16 (m, 1H), 1.14 (m, 2H), 0.98 (m, 1H), 0.44 (m, 1H).
Пример 79
а) 3-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н-1,2,4-триазол-3-ил)морфолин
Гидразид изоникотиновой кислоты (155,5 мг, 1,13 ммоль) добавляли к метил-3-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-N-метилморфолин-4-карбимидотиоату (200 мг, 0,567 ммоль) в изопропаноле (4 мл). Эту смесь перемешивали при 85-95°С в течение ночи, а затем разбавляли дихлорметаном (8 мл). Органическую фазу последовательно промывали водой и рассолом, сушили, фильтровали и концентрировали в вакууме. В результате растирания с диэтиловым эфиром получили соединение, указанное в заголовке (белое твердое вещество, 212 мг, 88%). 1H ЯМР (CDCl3)  (млн-1): 8.76 (d, 2H), 8.1 (s, 1H), 7.99 (m, 1H), 7.62 (m, 2H), 7.48 (m, 2H), 5.2 (dd, 1H), 4.32 (dd, 1H), 4.12 (m, 2H), 4.03 (m, 1H), 3.77 (s, 3H), 3.6 (m, 1H), 3.42 (m, 1H). (млн-1): 8.76 (d, 2H), 8.1 (s, 1H), 7.99 (m, 1H), 7.62 (m, 2H), 7.48 (m, 2H), 5.2 (dd, 1H), 4.32 (dd, 1H), 4.12 (m, 2H), 4.03 (m, 1H), 3.77 (s, 3H), 3.6 (m, 1H), 3.42 (m, 1H).
Приведенные ниже соединения были получены подобным способом:
б) 3-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]-4-(4-метил-5-пиридин-3-ил-4Н-1,2,4-триазол-3-ил)морфолин; выход 89,3 мг, 87,4%, белое твердое вещество; 1H ЯМР (CDCl3)  (млн-1): 8.89 (s, 1Н), 8.73 (d, 1H), 8.11 (m, 1H), 8.03 (m, 2H), 7.47 (m, 3Н), 5.2 (dd, 1H), 4.33 (dd, 1H), 4.12 (m, 2H), 4.04 (m, 1H), 3.74 (s, 3H), 3.59 (m, 1H), 3.46 (m, 1H). (млн-1): 8.89 (s, 1Н), 8.73 (d, 1H), 8.11 (m, 1H), 8.03 (m, 2H), 7.47 (m, 3Н), 5.2 (dd, 1H), 4.33 (dd, 1H), 4.12 (m, 2H), 4.04 (m, 1H), 3.74 (s, 3H), 3.59 (m, 1H), 3.46 (m, 1H).
в) 3-[2-(3-Хлор-фенил)-2Н-тетразол-5-ил]-4-[5-(3,5-дифторфенил)-4-метил-4Н-1,2,4-триазол-3-ил]морфолин; выход 78,9 мг, 71,4%, белое твердое вещество; 1H ЯМР (CDCl3)  (млн-1): 8.1 (s, 1H), 7.99 (m, 1H), 7.48 (m, 2H), 7.23 (m, 2H), 6.94 (tm, 1H), 5.18 (dd, 1H), 4.32 (dd, 1H), 4.11 (m, 2H), 4.02 (m, 1H), 3.73 (s, 3Н), 3.57 (dm, 1H), 3.41 (m, 1H). (млн-1): 8.1 (s, 1H), 7.99 (m, 1H), 7.48 (m, 2H), 7.23 (m, 2H), 6.94 (tm, 1H), 5.18 (dd, 1H), 4.32 (dd, 1H), 4.11 (m, 2H), 4.02 (m, 1H), 3.73 (s, 3Н), 3.57 (dm, 1H), 3.41 (m, 1H).
Фармакология
Фармакологические свойства соединений по изобретению могут быть протестированы с использованием стандартных анализов на функциональную активность. Примеры анализов рецепторов глутамата хорошо известны в данной области техники, как описано, например, в Aramori et al., Neuron 8:757 (1992), Tanabe et al., Neuron 8:169 (1992), Miller et al., J. Neuroscience 15: 6103 (1995), Balazs et al., J. Neurochemistry 69:151 (1997). Методология, описанная в этих публикациях, включена в данное описание путем ссылки. Для удобства соединения по изобретению можно исследовать посредством анализа, который измеряет мобилизацию внутриклеточного кальция [Са2+]i в клетках, экспрессирующих mGluR5.
Для FLIPR-анализа клетки, экспрессирующие человеческий mGluR5d, как описано в WO 97/05252, высевали на покрытые коллагеном 96-луночные планшеты с прозрачным дном с черными стенками и анализ мобилизации [Са2+]i проводили через 24 ч после высева.
FLIPR-эксперименты проводили, используя лазерную установку 0,800 Вт и скорость прерывателя пучка камеры CCD 0,4 секунды. Каждый FLIPR-эксперимент инициировали 160 мкл буфера, присутствующего в каждой лунке планшета для клеточных культур. После каждого добавления соединения брали образец сигнала флуоресценции 50 раз через 1-секундные интервалы, а затем 3 образца через 5-секундные интервалы. Ответы измеряли в виде высоты пика ответа за период взятия образца. Определения EC50 и IC50 проводили на основании данных, полученных из 8-точечных кривых концентрация-ответ (CRC, concentration response curve), полученных в двух повторах. Агонистические CRC строили путем сопоставления всех ответов с максимальным ответом, наблюдаемым для планшета. Антагонистическую блокаду стимуляции агонистом нормализовали по среднему ответу стимуляции агонистом в 14 контрольных лунках на том же планшете.
Авторы изобретения подтвердили достоверность вторичного функционального анализа для mGluR5d, как описано в WO 97/05252, на основе обмена инозитфосфата
(IP3). Аккумуляцию IP3 измеряют в виде индекса опосредованного рецептором обмена фосфолипазы С. Клетки GHEK, стабильно экспрессирующие человеческие рецепторы mGluR5d, инкубировали с [3H]-мио-инозитом в течение ночи, промывали три раза в физиологическом растворе, забуференном HEPES, и предварительно инкубировали в течение 10 мин с 10 мМ LiCl. Добавляли соединения (агонисты) и инкубировали в течение 30 мин при 37°С. Антагонистическую активность определяли путем предварительной инкубации тестируемых соединений в течение 15 мин, затем инкубации в присутствии глутамата (80 мкМ) или DHPG (30 мкМ) в течение 30 мин. Реакции останавливали добавлением хлорной кислоты (5%). Образцы собирали и нейтрализовали и инозитфосфаты выделяли, используя ионообменные колонки, работающие самотеком.
Подробный протокол тестирования соединений по изобретению представлен в приведенном ниже анализе.
Анализ антагонистической активности в отношении рецепторов группы 1
Для FLIPR-анализа клетки, экспрессирующие человеческий mGluR5d, как описано в WO 97/05252, высевали на покрытые коллагеном 96-луночные планшеты с прозрачным дном и черными стенками и проводили анализ мобилизации [Са2+]i через 24 ч после высева. В эти 96-луночные планшеты с клеточными культурами вносили 4 мкМ раствор флуоресцентного индикатора кальция fluo-3 (Molecular Probes, Eugene, Oregon) в форме ацетоксиметилового эфира в 0,01% Pluronic. Все анализы проводили в буфере, содержащем 127 мМ NaCl, 5 мМ KCl, 2 мМ MgCl2,
0,7 мМ NaH2PO4, 2 мМ CaCl2, 0,422 мг/мл NaHCO3, 2,4 мг/мл HEPES, 1,8 мг/мл глюкозы и 1 мг/мл БСА фракции IV (рН 7,4).
FLIPR-эксперименты проводили, используя лазерную установку 0,800 Вт и скорость прерывателя пучка камеры CCD 0,4 секунды. Каждый FLIPR-эксперимент инициировали 160 мкл буфера, присутствующего в каждой лунке планшета для клеточных культур. После добавления 40 мкл из антагонистического планшета добавляли 50 мкл из агонистического планшета. После каждого добавления брали образец сигнала флуоресценции 50 раз через 1-секундные интервалы, а затем 3 образца через 5-секундные интервалы. Ответы измеряли в виде высоты пика ответа за период взятия образца. Определения EC50 и IC50 проводили на основании данных, полученных из 8-точечных кривых концентрация-ответ (CRC), полученных в двух повторах. Агонистические CRC строили путем сопоставления всех ответов с максимальным ответом, наблюдаемым для планшета. Антагонистическую блокаду стимуляции агонистом нормализовали по среднему ответу стимуляции агонистом в 14 контрольных лунках на том же планшете.
Измерение обмена инозитфосфата в интактных целых клетках
GHEK, стабильно экспрессирующие человеческий рецептор mGluR5d, высевали на 24-луночные планшеты, покрытые поли-L-лизином, в концентрации 40×104 клеток/лунка в среде, содержащей 1 мКи/лунка [3Н]-миоинозита. Клетки инкубировали в течение ночи (16 ч), затем промывали три раза и инкубировали в течение 1 ч при 37°С в физиологическом растворе, забуференном HEPES (146 мМ NaCl, 4,2 мМ KCl, 0,5 мМ MgCl2, 0,1% глюкоза, 20 мМ HEPES, pH 7,4), с добавлением глутаматпируваттрансаминазы в концентрации 1 единица/мл и 2 мМ пирувата. Клетки промывали один раз в физиологическом растворе, забуференном HEPES, и предварительно инкубировали в течение 10 мин в физиологическом растворе, забуференном HEPES, содержащем 10 мМ LiCl. Добавляли соединения (агонисты) и инкубировали при 37°С в течение 30 мин. Антагонистическую активность определяли путем предварительной инкубации тестируемых соединений в течение 15 мин, затем инкубации в присутствии глутамата (80 мкМ) или DHPG (30 мкМ) в течение 30 мин. Реакции останавливали добавлением 0,5 мл хлорной кислоты (5%) на льду с инкубацией при 4°С в течение по меньшей мере 30 мин. Образцы собирали в 15-мл пробирки Falcon и инозитфосфаты выделяли, используя колонки Dowex, как описано ниже.
Анализ на инозитфосфаты с использованием ионообменных колонок, работающих самотеком
Приготовление ионообменных колонок
Ионообменную смолу (Dowex AG1-X8 формиатная форма, 200-400 меш, BIORAD) промывали три раза дистиллированной водой и хранили при 4°С. 1,6 мл смолы добавляли в каждую колонку и промывали 3 мл 2,5 мМ HEPES, 0,5 мМ ЭДТА, рН 7,4.
а) Обработка образца
Образцы собирали в 15-мл пробирки Falcon и нейтрализовали 0,375 М HEPES, 0,75 М КОН. Добавляли 4 мл HEPES/ЭДТА (2,5/0,5 мМ, рН 7,4) для осаждения перхлората калия. Надосадочную жидкость добавляли в подготовленные колонки Dowex.
б) Выделение инозитфосфата
Элюция глицерофосфатидилинозитов 8 мл 30 мМ формиата аммония.
Элюция суммарных инозитфосфатов 8 мл 700 мМ формиата аммония/100 мМ муравьиной кислоты и сбор элюата в сцинтилляционные флаконы. Считывание элюата, смешанного с 8 мл сцинтиллятора.
Один аспект изобретения относится к способу ингибирования активации mGluR5, при котором клетку, содержащую указанный рецептор, обрабатывают эффективным количеством соединения формулы I.
Скрининг соединений, активных против ВРНПС
Используют взрослых лабрадоров ретриверов, дрессированных на стояние в станке Павлова. Образуют эзофагостомы слизистая-кожа, и собакам дают возможность полностью выздороветь перед проведением каких-либо экспериментов.
Измерение сократительной способности
Кратко, после голодания в течение около 17 ч при свободном доступе к воде через эзофагостомы вводят многополостное устройство рукав/боковые отверстия (Dentsleeve, Adelaide, South Australia) для измерения желудочного, нижнего пищеводного сфинктера (НПС) и пищеводного давления. Это устройство перфузируют водой, используя манометрический перфузионный насос с низкой упругой деформацией (Dentsleeve, Adelaide, South Australia). Трубку, продуваемую воздухом, помещают в направлении ротовой полости для измерения глотательных движений и сурьмяный электрод для мониторинга рН помещают на 3 см выше НПС. Все сигналы усиливают и собирают на персональном компьютере при 10 Гц.
Когда получено измерение базового уровня двигательной активности фазы III желудка/НПС на фоне голодания, плацебо (0,9% NaCl) или тестируемое соединение вводят внутривенно (i.v., 0,5 мл/кг) в вену передней лапы. Через десять мин после i.v. введения питательную смесь (10% пептон, 5% D-глюкоза, 5% интралипид, рН 3,0) инфузируют в желудок через центральный просвет устройства со скоростью 100 мл/мин до конечного объема 30 мл/кг. После инфузии питательной смеси проводят инфузию воздуха со скоростью 500 мл/мин до получения внутрижелудочного давления 10±1 мм Hg. Затем давление поддерживают на этом уровне на протяжении всего эксперимента, используя инфузионный насос для дополнительной инфузии воздуха или для выхода воздуха из желудка. Время эксперимента от начала инфузии питательной смеси до окончания вдувания воздуха составляет 45 мин. Эта методика утверждена в качестве достоверного измерения инициирования ВРНПС.
ВРНПС определяют как снижение давления в нижнем пищеводном сфинктере (по сравнению с внутрижелудочным давлением) со скоростью >1 мм Hg/с. Расслаблению не должен предшествовать фарингеальный сигнал <2 с до его начала, и в этом случае расслабление квалифицируют как вызванное глотанием. Разность давления между НПС и желудком должна быть меньше, чем 2 мм Hg, а продолжительность полного расслабления дольше, чем 1 с.
Сокращения
| БСА |
Бычий сывороточный альбумин |
| CCD |
Устройство со связанным зарядом (Charge Coupled Device) |
| CRC |
Кривая концентрация-ответ |
| DHPG |
3,5-Дигидроксифенилглицин |
| ЭДТА |
Этилендиаминтетрауксусная кислота |
| FLIPR |
Планшет-ридер для флуорометрической визуализации (Fluorometric Imaging Plate reader) |
| GHEK |
GLAST-содержащие эмбриональные почки человека |
| GLAST |
Переносчик глутамат/аспартат |
| HEPES |
4-(2-Гидроксиэтил)-1-пиперазинэтансульфоновая кислота (буфер) |
| IP3 |
Инозиттрифосфат |
Результаты
Типичные значения IC50, измеренные в вышеописанных анализах, составляют 10 мкМ или менее. В одном аспекте изобретения IC50 ниже 2 мкМ. В другом аспекте изобретения IC50 ниже 0,2 мкМ. В еще одном аспекте изобретения IC50 ниже 0,05 мкМ.
| Соединение |
FLIPP IC50 |
| 3-[3-(3-хлор-фенил)-1,2,4-оксадиазол-5-ил]-4-{5-[4-(дифторметокси)фенил]-4-метил-4Н-1,2,4-триазол-3-ил}морфолин |
199 нМ |
| 4-(5-{2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]пиперидин-1-ил}-4-метил-4Н-1,2,4-триазол-3-ил)пиридин |
40 нМ |
Формула изобретения
1. Соединение формулы I
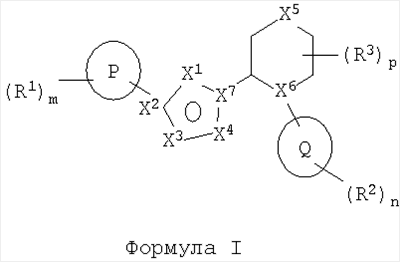
где Р представляет собой фенил;
R1 присоединен к Р через атом углерода на кольце Р и выбран из группы, состоящей из галогено, C1-6алкилгалогено, OC1-6алкилгалогено, C1-6алкила, OC1-6алкила и С0-6алкилциано;
X1 выбран из группы, состоящей из N, NR4 и CR4;
Х2 выбран из группы, состоящей из С и N;
X3 выбран из группы, состоящей из N и О;
X4 выбран из группы, состоящей из N и О;
X5 выбран из группы, состоящей из связи, CR4R4′, NR4, О, S, SO, SO2;
X6 представляет собой N;
X7 выбран из группы, состоящей из С и N;
R4 и R4 независимо выбран из группы, состоящей из водорода, C1-6алкила, С1-4алкилгалогено и галогено; независимо выбран из группы, состоящей из водорода, C1-6алкила, С1-4алкилгалогено и галогено;
Q представляет собой триазолил;
R2 и R3 независимо выбраны из группы, состоящей из С1-4алкилгалогено, C1-6алкила, С3-6циклоалкила, С0-6алкилфенила, ОС0-6алкилфенила, (СО)ОС1-4алкила, O(СО)С1-4алкила и 6-членного кольца, содержащего атомы, независимо выбранные из С, N, О и S, и где указанное кольцо может быть замещено одним или более чем одним А;
А выбран из группы, состоящей из водорода, гидрокси, галогено, оксо, С0-6алкилциано, C1-6алкила, -OC1-6алкила, C1-6алкилгалогено, OC1-6алкилгалогено, С0-6алкилNR5R6, OC2-6aлкилNR5R6 и 6-членного кольца, содержащего атомы, независимо выбранные из группы, состоящей из С, N, О и S;
R5 и R6 независимо выбраны из Н и C1-6алкила;
m равно 1;
n выбран из 1 и 2;
р выбран из 0 и 1; и
его фармацевтически приемлемая соль.
2. Соединение по п.1, где X7 представляет собой С.
3. Соединение по п.1, где X5 выбран из группы, состоящей из CR4R4′, NR4, О, S, SO и SO2.
4. Соединение по п.1, где R1 выбран из группы, состоящей из Cl, F, Me, OMe, CF3, OCF3 и CN.
5. Соединение по п.1, где X2 представляет собой С.
6. Соединение по п.5, где X1 представляет собой N или CR4.
7. Соединение по п.6, где, когда X3 представляет собой О, X4 представляет собой N, а когда X3 представляет собой N, X4 представляет собой О.
8. Соединение по п.1, где X2 представляет собой N.
9. Соединение по п.8, где X1 представляет собой N.
10. Соединение по п.9, где X3 представляет собой N, и X4 представляет собой N.
11. Соединение по п.6, где X5 выбран из группы, состоящей из связи, CR4R4′, NR4 и О.
12. Соединение по п.7, где X5 выбран из группы, состоящей из связи, О и NR4.
13. Соединение по п.10, где X5 выбран из группы, состоящей из О и CR4R4′.
14. Соединение по п.1, где R2 и R3 независимо выбраны из группы, состоящей из C1-4алкилгалогено, C1-6алкила и С3-6циклоалкила.
15. Соединение по п.1, где А выбран из группы, состоящей из водорода, гидроксила, галогено, С0-6алкилциано, C1-6алкила, -OC1-6алкила, C1-6алкилгалогено, OC1-6алкилгалогено.
16. Соединение по п.1, выбранное из:
4-(5-{2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пиперидин-1-ил}-4-метил-4Н-[1,2,4]триазол-3-ил)-пиридина;
3-[5-(3-хлор-фенил)-изоксазол-3-ил]-4-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-морфолина;
3-[5-(3-хлор-фенил)-изоксазол-3-ил]-4-[5-(4-дифторметокси-фенил)-4-метил-4Н-[1,2,4]триазол-3-ил]-морфолина;
3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-морфолина;
3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-[5-(4-дифторметокси-фенил)-4-метил-4Н-[1,2,4]триазол-3-ил]-морфолина;
трет-бутилового эфира 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-пиперазин-1-карбоновой кислоты;
2-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-1-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-пиперазина;
2-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-метил-1-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-пиперазина;
трет-бутилового эфира 3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-[5-(4-дифторметокси-фенил)-4-метил-4Н-[1,2,4]триазол-3-ил]-пиперазин-1-карбоновой кислоты;
2-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-1-[5-(4-дифторметокси-фенил)-4-метил-4Н-[1,2,4]триазол-3-ил]-пиперазина;
2-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-1-[5-(4-дифторметокси-фенил)-4-метил-4Н-[1,2,4]триазол-3-ил]-4-метил-пиперазина;
2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-1-{5-[4-(дифторметокси)фенил]-4-метил-4Н-1,2,4-триазол-3-ил}-пиперидина;
4-(5-{2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]пиперидин-1-ил}-4-метил-4Н-1,2,4-триазол-3-ил)пиридина;
2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-1-[5-(4-метоксифенил)-4-метил-4Н-1,2,4-триазол-3-ил]пиперидина;
[4-(5-{2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]пиперидин-1-ил}-4-метил-4Н-1,2,4-триазол-3-ил)фенил]диметиламина;
[4-(5-{2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-пиперидин-1-ил}-4-метил-4Н-[1,2,4]триазол-3-ил)-бензил]-диметил-амина;
{2-[4-(5-{2-[2-(3-хлор-фенил)-2Н-тетразол-5-ил]-пиперидин-1-ил}-4-метил-4Н-[1,2,4]триазол-3-ил)-фенокси]-этил}-диметил-амина;
(R)-3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-морфолина;
(S)-3-[3-(3-хлор-фенил)-[1,2,4]оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-морфолина;
(R)-2-[2-(3-хлорфенил)-2Н-тетразол-5-ил]-1-{5-[4-(дифторметокси)фенил]-4-метил-4Н-1,2,4-триазол-3-ил}пиперидина;
(S)-2-[2-(3-хлорфенил)-2Н-тетразол-5-ил]-1-{5-[4-(дифторметокси)фенил]-4-метил-4Н-1,2,4-триазол-3-ил}пиперидина;
(R)-4-(5-{2-[2-(3-хлорфенил)-2Н-тетразол-5-ил]пиперидин-1-ил}-4-метил-4Н-1,2,4-триазол-3-ил)пиридина;
(S)-4-(5-{2-[2-(3-хлорфенил)-2Н-тетразол-5-ил]пиперидин-1-ил}-4-метил-4Н-1,2,4-триазол-3-ил)пиридина;
4-[5-(5-{2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пирролидин-1-ил}-4-циклопропил-4Н-[1,2,4]триазол-3-ил)-пиридин-2-ил]-морфолина;
4-[5-(5-{2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пирролидин-1-ил}-4-метил-4Н-[1,2,4]триазол-3-ил)-пиридин-2-ил]-морфолина;
3-(5-{2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пирролидин-1-ил}-4-метил-4Н-[1,2,4]триазол-3-ил)-пиридина;
4-(5-{2-[5-(3-хлор-фенил)-изоксазол-3-ил]-пирролидин-1-ил}-4-циклопропил-4Н-[1,2,4]триазол-3-ил)-пиридина;
3-[5-(3-хлор-фенил)-[1,2,4]оксадиазол-3-ил]-4-(5-пиридин-4-ил-4Н-[1,2,4]триазол-3-ил)-морфолина;
3-[5-(3-хлорфенил)изоксазол-3-ил]-4-(4-циклопропил-5-пиридин-3-ил-4Н-1,2,4-триазол-3-ил)морфолина;
3-[5-(3-хлорфенил)изоксазол-3-ил]-4-(4-циклопропил-5-пиридин-4-ил-4Н-1,2,4-триазол-3-ил)морфолина;
3-[5-(3-хлорфенил)изоксазол-3-ил]-4-(4-метил-5-пиридин-3-ил-4Н-1,2,4-триазол-3-ил)морфолина;
3-[5-(3-хлор-фенил)-изоксазол-3-ил]-4-[5-(6-метокси-пиридин-3-ил)-4-метил-4Н-[1,2,4]триазол-3-ил]-морфолина;
3-[3-(3-хлорфенил)-1,2,4-оксадиазол-5-ил]-4-[5-(2-метоксипиридин-4-ил)-4-метил-4Н-1,2,4-триазол-3-ил]морфолина;
3-[3-(3-хлорфенил)-1,2,4-оксадиазол-5-ил]-4-[5-(2-метилпиридин-4-ил)-4-метил-4Н-1,2,4-триазол-3-ил]морфолина;
3-[3-(3-хлорфенил)-1,2,4-оксадиазол-5-ил]-4-[5-(5-фторпиридин-3-ил)-4-метил-4Н-1,2,4-триазол-3-ил]морфолина;
3-[5-(3-хлорфенил)изоксазол-3-ил]-4-[5-(5-фторпиридин-3-ил)-4-метил-4Н-1,2,4-триазол-3-ил]морфолина;
3-[3-(3-хлорфенил)-1,2,4-оксадиазол-5-ил]-4-(4-метил-5-пиридин-2-ил-4Н-1,2,4-триазол-3-ил)морфолина;
4-[5-(5-фторпиридин-3-ил)-4-метил-4Н-1,2,4-триазол-3-ил]-3-[3-(3-йодфенил)-1,2,4-оксадиазол-5-ил]морфолина;
3-[3-(3-йодфенил)-1,2,4-оксадиазол-5-ил]-4-(4-метил-5-пиридин-4-ил-4Н-1,2,4-триазол-3-ил)морфолина;
3-[5-(3-хлорфенил)изоксазол-3-ил]-4-[5-(2-метилпиридин-4-ил)-4-метил-4Н-1,2,4-триазол-3-ил]морфолина;
3-[2-(3-хлорфенил)-2Н-тетразол-5-ил]-4-(4-метил-5-пиридин-3-ил-4Н-1,2,4-триазол-3-ил)морфолина;
3-[2-(3-хлорфенил)-2Н-тетразол-5-ил]-4-[5-(3,5-дифторфенил)-4-метил-4Н-1,2,4-триазол-3-ил]морфолина;
3-(5-{2-[5-(3-хлорфенил)изоксазол-3-ил]пирролидин-1-ил}-4-циклопропил-4Н-1,2,4-триазол-3-ил)пиридина и
4-(5-{2-[5-(3-хлорфенил)изоксазол-3-ил]пирролидин-1-ил}-4-метил-4Н-1,2,4-триазол-3-ил)пиридина.
17. Фармацевтическая композиция, обладающая свойствами ингибитора mGluR5, содержащая в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-16 в сочетании с одним или более чем одним фармацевтически приемлемым разбавителем, эксципиентом и/или инертным носителем.
18. Соединение по любому из пп.1-16, обладающее свойствами ингибитора mGluR5.
19. Соединение по любому из пп.1-16 в качестве активного агента для получения лекарственного средства, обладающего свойствами ингибитора mGluR5.
20. Применение соединения по любому из пп.1-16 в изготовлении лекарственного средства для лечения расстройств, опосредованных mGluR5.
21. Применение по п.20, где расстройство, опосредованное mGluR5, представляет собой неврологическое расстройство.
22. Применение по п.20, где расстройство, опосредованное mGluR5, представляет собой психиатрическое расстройство.
23. Применение по п.20, где расстройство, опосредованное mGluR5, представляет собой хроническое или острое болевое расстройство.
24. Применение по п.20, где расстройство, опосредованное mGluR5, представляет собой желудочно-кишечное расстройство.
25. Способ ингибирования активации рецепторов mGluR5, включающий обработку клетки, содержащей указанный рецептор, эффективным количеством соединения по п.1.
|
|